Возраст рак легких: Кто больше всего подвержен раку легких — Российская газета
Рак легкого у больных молодого возраста
БАГИРОВ РАХМАТ РАГИМ ОГЛЫ
РАК ЛЕГКОГО У БОЛЬНЫХ МОЛОДОГО ВОЗРАСТА
14.01.12- онкология
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
□□3492528
Москва-2010
003492528
Работа выполнена в Учреждении Российской Академии Медицинских Наук Российском онкологическом научном центре им. Н.Н.Блохина (директор — академик РАН и РАМН, профессор М.И. Давыдов).
Научный руководитель:
доктор медицинских наук, профессор Б.Е.ПОЛОЦКИЙ
Официальные оппоненты:
доктор медицинских наук, профессор К.П.ЛАКТИОНОВ доктор медицинских наук, профессор В.С.МАЗУРИН Ведущее учреждение:
ФГУ Российский научный центр рентгенорадиологии МЗ и СР РФ
Защита диссертации состоится «11» марта 2010 года в_часов
на заседании диссертационного совета (Д. 001.017.01) РОНЦ им. Н.Н.Блохина РАМН (Москва 115478, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке РОНЦ им. Н.Н.Блохина РАМН.
Автореферат разослан «10» февраля 2010 г.
Ученый секретарь Диссертационного совета, Доктор медицинских наук, профессор Ю.В.ШШ
Общая характеристика диссертации
Актуальность проблемы. Рак легкого является наиболее распространенной формой злокачественных опухолей и представляет собой одну из актуальных проблем клинической онкологии. В 35 развитых странах мира и в Российской Федерации этого заболевания остается главной причиной смертности онкологических больных, преимущественно мужчин. Годовой прирост заболеваемости раком легкого в России составляет в настоящее время 3,4%, ежегодно заболевают около 60 тыс. человек (Аксель Е.М. 2006).
Рак легкого в основном развивается в возрасте 50-80 лет. Относительная редкость его у лиц молодого возраста зачастую приводит к его позднему распознаванию и диагностическим ошибкам. Одной из причин этого предположительно могут быть биологические различия опухоли у больных молодого и пожилого возраста, а также клинические морфологические и другие особенности рака легкого у молодых (Зайцев В. Ф., 1989; Трахтенберг А.Х., 1987; Харченко В.П., с соавт., 1994,1999; De Саго L., et al., 1983).
Ф., 1989; Трахтенберг А.Х., 1987; Харченко В.П., с соавт., 1994,1999; De Саго L., et al., 1983).
Вопрос о хирургическом лечении рака легкого у больных молодого возраста освещен недостаточно полно, противоречиво. Во многих публикациях имеются данные (Воронцов А.Ю., с соавт., 2000; Green LS., et al., 1993; Neuman HW., et al., 1956; Tsai СМ., et al., 1988) о неутешительных результатах хирургического лечения у молодых в сравнении с больными старших возрастных групп. В то же время другие данные литературы показывают одинаковую и даже лучшую общую выживаемость молодых пациентов (Давыдов М.И., с соавт., 2005; Capewell S., et al., 1992; Da-li Tian, et al., 2003; Kuo CW., et al., 2000; Kreuzer M., et al., 1998; Minami H., et al., 2001; Nugent WC., et al., 1997; Ramalin-gam S., et al., 1998). Также остаются весьма спорными такие вопросы, как возможность применения не только лобэктомии, но и пневмонэктомии, так как функциональные возможности организма этих больных позволяют это делать.
Практически в литературе не освещены особенности внутригрудного лимфогенного метастазирования, возможности комбинированных методов ле-
чения немелкоклеточного рака легкого у больных молодого возраста, поэтому изучение этих вопросов заслуживает внимания.
Несмотря на многочисленность публикаций, нет единого представления о клиническом течении заболевания и результатах лечения в различных возрастных группах. Поэтому представляет интерес сравнительная оценка результатов хирургического лечения немелкоклеточного рака легкого у больных молодого, среднего и пожилого возраста с целью уточнения современных подходов и результатов лечения в различных возрастных группах пациентов.
Цель исследования — Улучшение результатов хирургического и комбинированного лечения больных немелкоклеточным раком легкого молодого возраста.
Для достижения поставленной цели решены следующие задачи:
1. Оценка частоты различных гистологических форм рака легкого и степени дифференцировки в возрастных группах больных.
2. Изучение особенностей лимфогенного внутригрудного метастазирова-ния у больных молодого возраста относительно больных старших возрастных групп.
3. Сравнение отдаленных результатов радикального хирургического лечения больных немелкоклеточным раком легкого молодого возраста и больных старших возрастных групп в зависимости от распространенности опухоли и объема выполненного оперативного вмешательства.
4. Сравнительная оценка результатов хирургического и комбинированного лечения рака легкого в возрастных группах больных.
Научная новизна
На большом клиническом материале изучены особенности лимфогенного метастазирования и отдаленные результаты хирургического лечения больных раком легкого молодого возраста относительно пациентов старших возрастных групп в зависимости от распространенности, размера первичной опухоли, ее гистологической структуры, проксимальной границы поражения бронха. Оценены прогностически важные клинико-морфологические факторы, влияющие
на результаты радикального хирургического лечения. Изучены результаты хирургического лечения в зависимости от объема операции при сравнимой распространенности заболевания в возрастных группах пациентов. Показано, что объем хирургического лечения при сравнимой распространенности опухолевого процесса не влияет на показатели выживаемости в сравниваемых возрастных группах. Изучены результаты хирургического и комбинированного лечения в зависимости от распространенности опухолевого процесса. Показано, что во всех возрастных группах пациентов результаты хирургического лечения при I и II стадиях рака легкого достоверно превосходили результаты комбинированного лечения, в то же время при III стадии существенных различий не получено.
Показано, что во всех возрастных группах пациентов результаты хирургического лечения при I и II стадиях рака легкого достоверно превосходили результаты комбинированного лечения, в то же время при III стадии существенных различий не получено.
Практическая значимость исследования
Частота рака легкого у молодых в нашем исследовании составила 9,9%, что говорит о необходимости онкологической настороженности врачей при лечении больных этой группы. Внедрение результатов исследования в практику хирургического лечения больных немелкоклеточным раком легкого у больных молодого возраста позволяет повысить радикальность операций и улучшает результаты хирургического вмешательства. Объем операции должен определяться распространенностью опухоли. Расширение объема операции до пневмонэк-томии у молодых больных при онкологической возможности выполнения резекции легкого не оправдано, так как результаты лечения не отличаются от таковых у пациентов более старших возрастных групп, после лобэктомии.
Апробация диссертации состоялась 30 июня 2009 года на совместной научной конференции с участием хирургического торакального отделения тора-ко-абдоминального отдела, отделения диагностики опухолей, отделения абдоминальной онкологии, патологоанатомического отделения, поликлинического отделения РОНЦ им. Н.Н.Блохина РАМН, кафедры онкологии лечебного факультета ММА им. И.М.Сеченова.
Публикации
По теме диссертации опубликовано 3 работы в центральных медицинских журналах.
Объем и структура диссертации
Диссертация построена по традиционному стилю и состоит из введения, четырех глав, включающих литературный обзор, материалы и методы, две главы по результатам исследования, а также заключение, выводы и список литературы, содержащий 164 источника, из которых 66 — отечественных и 98 — зарубежных авторов. Работа представлена на 148 страницах машинописного текста, иллюстрирована 63 таблицами и 42 рисунками. СОДЕРЖАНИЕ РАБОТЫ Материалы исследования
В исследование включены 1727 больных, получивших хирургическое лечение в торакальном отделении РОНЦ им. Н.Н.Блохина РАМН с 1 января 1985 по 31 декабря 2007.
Н.Н.Блохина РАМН с 1 января 1985 по 31 декабря 2007.
В исследование включены пациенты, получившие хирургическое или комбинированное лечение по поводу немелкоклеточного рака легкого.
Больные были распределены по возрастным группам в соответствии с классификацией ВОЗ (1978) следующим образом: до 45 лет — больные молодого возраста; от 46 до 59 лет — больные среднего возраста; от 60 до 74 лет — больные пожилого возраста.
Из 1727 больные молодого возраста составили 171 (9,9%), среднего возраста 888 (51,4%) и пожилого возраста 668 (38,7%) пациентов. В нашем исследовании возраст самого молодого больного составил 23 года, а самого старого — 74 года. Соотношение мужчин (1488 — 86,2%) и женщин (239 — 13,8%) составило 6,2:1 с преобладанием мужчин во всех возрастных группах. В группе больных молодого возраста, соотношение «мужчины : женщины» составило 3,6:1, в группе больных среднего и пожилого возраста это соотношение составило 8,3:1 и 5,2:1 соответственно, разница статистически достоверна. Из общего числа (1727) наблюдений, 1464 (84,8%) пациента были оперированы радикально, 131 (7,5%) — паллиативно и 132 (7,7%) больным выполнена пробная торакотомия (табл. 1).
Из общего числа (1727) наблюдений, 1464 (84,8%) пациента были оперированы радикально, 131 (7,5%) — паллиативно и 132 (7,7%) больным выполнена пробная торакотомия (табл. 1).
Распределение больных по характеру операций
Характер операций Возраст
молодой средний ПОЖИЛОЙ
Радикальные 142 (83,1%) 742 (83,6%) 580 (86,8%)
Паллиативные 12(7,0%) 64 (7,2%) 55 (8,3%)
Эксплоративные 17(9,9%) 82 (9,2%) 33 (4,9%)
Всего(%) 171 (100%) 888 (100%) 668(100%)
Резектабельность (%) 90% 90,7% 95%
Из представленной таблицы видно, что радикальные и паллиативные операции во всех возрастных группах производились с одинаковой частотой (90,1%, 90,8% и 95,1%), однако в пожилом возрасте реже выполнялись оперативные вмешательства, завершившиеся пробной торакотомией (4,9% против 9,9% и 9,2%, 1=2,3 р<0,05) что, скорее всего, связано с отбором больных этой группы для лечения. Резектабельность в возрастных группах больных оказалась идентичной — 90,0; 90,7 и 95,0%, соответственно.
Морфологические формы опухолей установлены по «Международной классификации онкологических болезней; МКБ-О» (ВОЗ, 1995 г.). В структуре опухолей преобладал плоскоклеточный рак (всего 69,6%). Аденокарцинома по частоте занимала второе место, составляя 24,6%. В исследование также были включены редкие формы рака легкого. Из них бронхиолоальвеолярный рак составлял 2,3%, крупноклеточный 1,3%, диморфный 2,1% (табл. 2).
У молодых пациентов отмечена более высокая частота аденокарциномы по сравнению со старшими возрастными группами. Так соотношение аденокарциномы и плоскоклеточного рака у больных молодого возраста составило 31,6% (54) : 62,6% (107) (1:1,98), в то же время, у больных среднего возраста составило 21,6% : 72,3%, (1:3,3), у больных пожилого возраста 26,8% : 67,8% (1:2,5) (относительно больных среднего возраста разница статистически достоверна 1=2,43 р<0,01; относительно больных пожилого возраста 1=1,27 р<0,5).
Редкие формы рака легкого во всех возрастных группах встречаются одинаково часто.
Таблица 2
Типы гистологических форм рака в возрастных группах _
Структура опухоли Возраст Всего %
молодой средний пожилой
Плоскоклеточный рак 107 (62,6%) 642 (72,3%) 453 (67,8%) 69,6
Аденокарцинома 54 (31,6%) 192 (21,6%) 179 (26,8%) 24,6
БАР 5 (2,9%) 22 (2,5%) 13 (1,9%) 2,3
Крупноклеточный рак 2(1,2%) 10(1,1%) 11 (1,7%) 1,3
Диморфный рак 3 (.1,7%) 22 (2,5%) 12(1,8%) 2,1
Всего 171 (100%) 888 (100%) 668(100%) 1727 (100%)
Распределение больных по степени дифференцировки плоскоклеточного рака в сравниваемых возрастных группах одинаково. Однако при аденокарци-номе легкого выявлено статистически значимое преобладание низкодифферен-цированной формы в группе больных молодого возраста относительно контрольных групп (22,2% против 7,8% и 8,4% (t=2,41 р<0,02)).
Стадирование заболевания проводилось в соответствии с TNM классификацией (ВОЗ, 1997). Радикальные операции выполнены у 142 (из 171) больных молодого, 742 (из 888) среднего и 580 (из 668) больных пожилого возраста.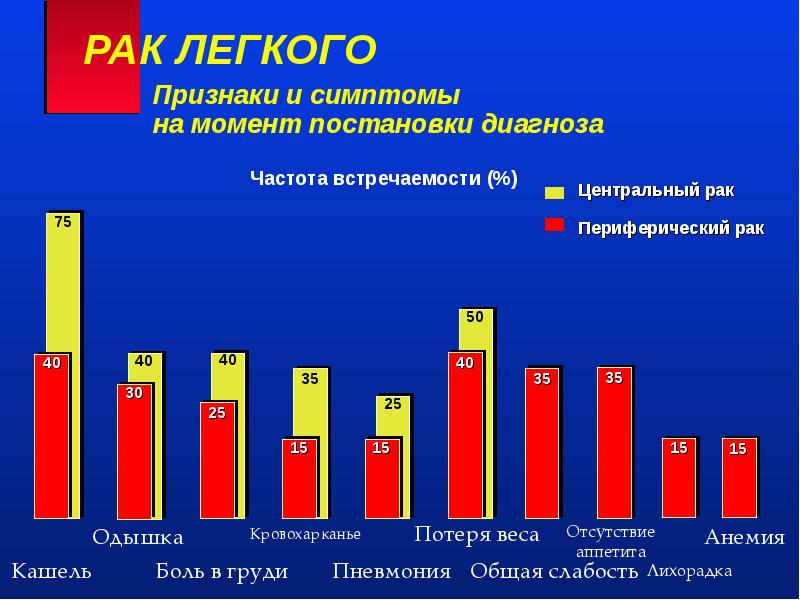
I стадия заболевания достоверно чаще диагностирована у больных среднего и пожилого возраста 42,2% и 54,3%, соответственно, против 29,6% — у молодых пациентов. В то же время у молодых пациентов чаще выявлялась IIIA стадия рака легкого — 33,1% против 22,6% и 21,2% (р<0,02) (табл. 3).
Распределение больных по объему выполненного радикального оперативного вмешательства представлено в таблице 4.
Стадия TNM в возрастных группах у радикально оперированных больных
pTNM Возраст
молодой средний пожилой
абс. % абс. % абс. %
Стадия I 42 29,6 313 42,2 315 54,3
T,NoMo 17 12,0 78 10,5 80 13,8
T2N0M0 25 17,6 235 31,7 235 40,5
Стадия II 35 24,6 198 26,7 109 18,8
T,N,M0 3 2,1 15 2,0 15 2,6
T2N,M0 20 14,1 ИЗ 15,2 58 10,0
t3n0m0 12 8,4 70 9,5 36 6,2
Стадия III 63 44,3 227 30,6 145 25,0
Стадия IIIA 47 33,1 168 22,6 123 21,2
T,N2M0 6 4,2 19 2,5 22 3,8
T2N2M0 22 15,5 80 10,8 64 11,0
T3N1M0 8 5,7 35 4,7 17 2,9
T3N2M0 11 7,7 34 4,6 20 3,5
Стадия HIB 16 11,2 59 8,0 22 3,8
T1N3M0 0 0 0 0 0 0
t2n3m0 3 2Д 3 0,4 2 0,3
t3n3m0 1 0,7 0 0 0 0
t4n0m0 5 3,4 20 2,8 9 1,6
t4n1m0 2 1,5 7 0,9 4 0,7
T4N2M0 5 3,5 27 3,6 5 0,9
t4n3m0 0 0 2 0,3 2 0,3
Стадия IV 2 1,5 4 0,5 11 1,9
TMNOM, 2 1,5 0 0 4 0,7
T1. 4N1M1 0 0 2 0,3 2 0,3
4N1M1 0 0 2 0,3 2 0,3
TmN2M, 0 0 1 0,1 5 0,9
TmN3M, 0 0 1 ОД 0 0
Всего (n=1464) 142 100% 742 100% 580 100%
Таблица 4
Распределение больных по объему радикальных оперативных вмешательств
Объем операций — Молодой возраст Средний возраст Пожилой возраст
Атипичные резекции 3 (2,1%) 9(1,2%) 13 (2,2%)
Сегментэктомии 1 (0,7%) 4 (0,5%) 5 (0,9%)
Лоб/билобэктомии 53 (37,3%) 296 (39,9%) 337(58,1%)
Пневмонэктомии 85 (59,9%) 433 (58,4%) 225 (38,8%)
Всего 142 (100%) 742(100%) 580 (100%)
Обращает на себя внимание более частое выполнение пневмонэктомии у радикально оперированных пациентов молодого и среднего возраста (59,9% (85 из 142) и 58,4% (433 из 742) соответственно). В пожилом же возрасте преобладали закономерно более щадящие вмешательства.
Чисто хирургическое лечение получили 110 (64,3%) пациентов молодого возраста, а комбинированное — 61 (35,7%) (табл. 5).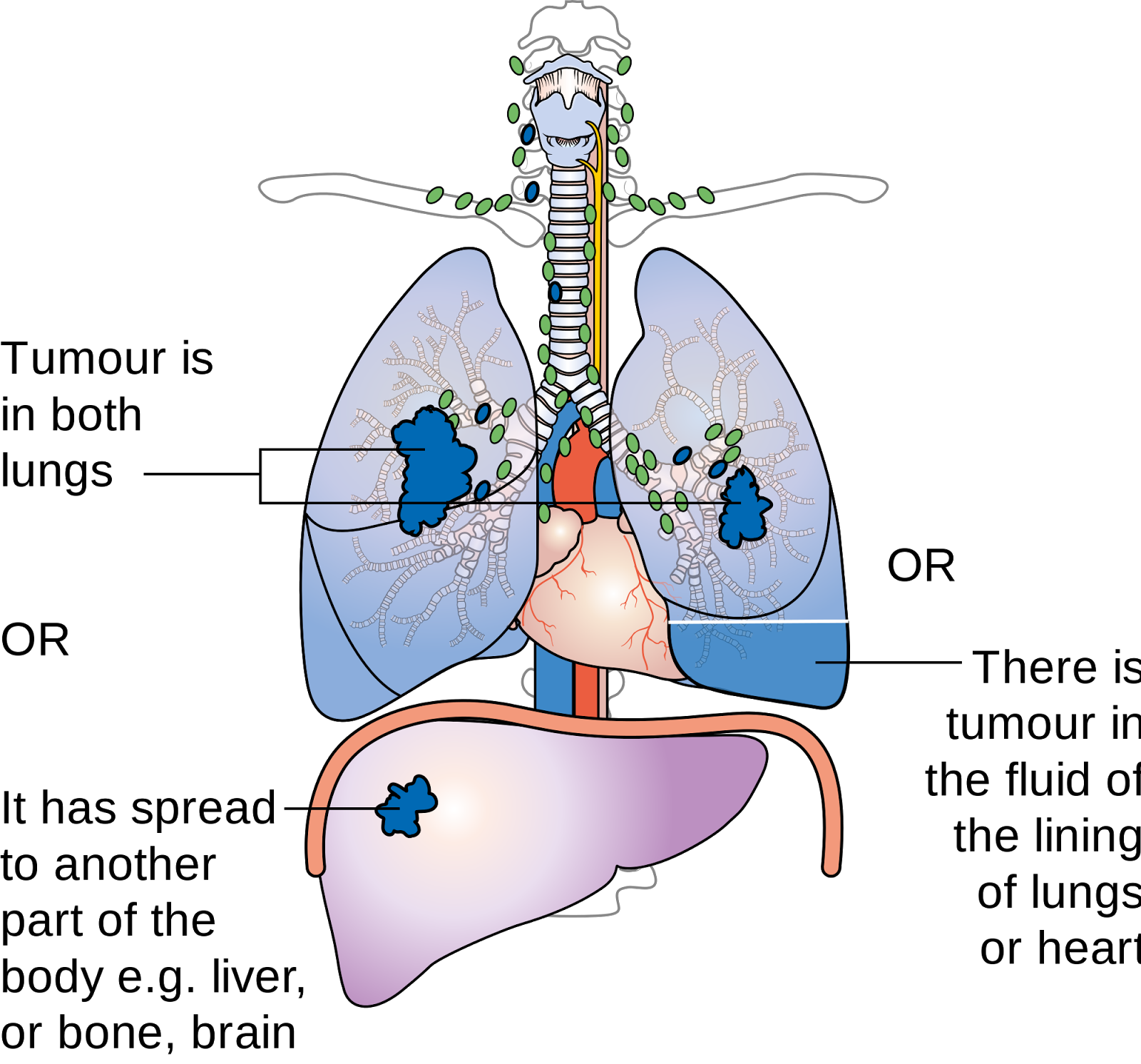
Таблица 5
Вид лечения Возраст
■молодой средний пожилой
Хирургическое 110(64,3%) 673 (75,8%) 554 (82,9%)
Комбинированное 61 (35,7%) 215 (24,2%) 114(17,1%)
Всего 171 (100%) 888 (100%) 668 (100%)
Обращает на себя внимание относительно большая частота комбинированного лечения у молодых больных. Так, соотношение хирургического и комбинированного лечения у молодых составило 64,3% : 35,7%, больных среднего возраста 75,8% : 24,2%, больных пожилого возраста 82,9% : 17,1%. Различия оказались статистически достоверными за счет пожилых пациентов, которые чаще получали чисто хирургическое лечение (1=2,9 р<0,005).
Варианты комбинированного лечения больных раком легкого представлены в таблице 6.
Таблица б
Варианты проведенного комбинированного лечения в возрастных группах
Варианты комбинированного лечения Возраст
молодой средний пожилой
абс. % абс. % абс. Г %
% абс. Г %
ХТ + Операция 8 13,1 27 12,5 12 10,6
ЛТ + Операция 7 11,5 55 25,6 13 11,4
Операция +ХТ 8 13,1 19 8,8 20 17,5
Операция + ЛТ 20 32,8 69 32,1 55 48,2
ХТ + Операция + ЛТ 3 4,9 23 10,8 6 5,3
ХТ+ЛТ+операция 3 4,9 4 1,9 4 3,5
Комбинированная лимфохимиотерапия 12 19,7 18 8,3 4 3,5
Всего 61 100% 215 100% 114 100%
Лучевая терапия проводилась преимущественно в режиме среднего фракционирования, в суммарной дозе 30-40Гр. Химиотерапия проводилась преимущественно с применением препаратов платины. Приведенные данные показывают многообразие комбинаций химиотерапии и лучевой терапии с операцией. Помимо этого, необходимо отметить, что комбинированное лечение проводилось в разных режимах и дозировках. В связи с вышесказанным, в нашем исследовании изучены только непосредственные и отдаленные результаты комбинированного лечения в целом.
Статистический анализ полученных результатов Достоверность различий количественных показателей в трех возрастных группах оценивалась по t-критерию Стьюдента.
Для оценки критерия «выживаемости» использовался моментный метод построения таблиц дожития (Kaplan E.L. и Meier Р., 1958) с использованием компьютерной программы Statistic 6.0. Для сравнения кривых общей выживаемости, рассчитанных по методу Kaplan-Meier, использовались Log-rank тест, а также критерий (%2) — метод Пирсона. Уровень достоверности, необходимый для утвердительного ответа, составлял 95% и более (р<0,05). Результаты собственных исследований Лимфогенное метастазирование у больных молодого возраста Анализ лимфогенного метастазирования в возрастных группах проведен по клинико-анатомическим формам рака легкого с их последующим сравнением в зависимости от различных клинических факторов. В связи с небольшим числом больных в исследуемой группе (171 человек), сравнительный анализ лимфогенного метастазирования проведен по уровню поражения лимфоколлек-торов, а не по группам лимфоузлов.
Наиболее прогностически важным фактором, определяющим высокий метастатический потенциал был размер опухоли, как при центральном, так и при периферическом раке легкого.
Характеристика метастазирования в регионарные лимфоколлекторы в зависимости от размера первичной опухоли при центральном раке представлена в таблице 7.
Таблица 7
Характеристика метастазирования в регионарные лимфоколлекторы в зависимости от размера первичной опухоли при центральном раке_
«р>1» Размер опухоли
0-3 см 3,1-5 см >5 см
Возраст больных
ДО 45 46-59 60-74 до 45 46-59 60-74 до 45 46-59 60-74
рЫ+ 7 (46,7%) 36 (40,0%) 32 (48,5%) . 26 (52,0%) 77 (35,2%) 40 (29,8%) 42 (95,4%) 219 (82,3%) 91 (74,6%)
рМ0 8 (53,3%) 54 (60,0%) 34 (51,5%) 24 (48,0%) 142 (64,8%) 94 (70,2%) 2 (4,6%) 47 (17,7%) 31 (25,4%)
3 (20,0%) 20 (22,2%) 14 (21,2%) 9 (18,0%) 50 (22,9%) 22. ! (16,4%) 9 (20,4%) 64 (24,1%) 20 (16,4%)
рК2 4 (26,7%) 15 (16,7%) 18 (27,3%) 16 (32,0%) 25 (11,4%) 16 (11,9%) 29 (65,9%) 145 (54,5%) 68 (55,7%)
рМ3 0 1 (1,1%) 0 1 (2,0%) 2 (0,9%) (1,5%) 4 (9,1%) 10 (3,7%) 3 (2,5%)
Всего 15 (100%) 90 (100%) 66 (100%) 50 (100%) 219 (100%) 134 (100%) 44 (100%) 266 (100%) 122 (100%)
Опухоли более 5,0 см характеризовались стабильно высоким метастатическим потенциалом у больных молодого возраста, метастазы выявлялись почти у всех (95,4%) пациентов. В контрольных возрастных группах этот показатель оказался также высоким и составил 82,3% и 74,6%, соответственно (разница между возрастными группами статистически достоверна, р<0,001). Помимо этого, во всех возрастных группах метастазы достоверно чаще реализовались в медиастинальные лимфатические узлы, так, соотношение «Ы2 к N1», у молодых составило 65,9 к 20,4%, у больных среднего возраста 54,5 к 24,1%, а у пожилого возраста 55,7 к 16,4%. Различия в пределах каждой возрастной группы статистически достоверны (р<0,001) (табл. 7).
В контрольных возрастных группах этот показатель оказался также высоким и составил 82,3% и 74,6%, соответственно (разница между возрастными группами статистически достоверна, р<0,001). Помимо этого, во всех возрастных группах метастазы достоверно чаще реализовались в медиастинальные лимфатические узлы, так, соотношение «Ы2 к N1», у молодых составило 65,9 к 20,4%, у больных среднего возраста 54,5 к 24,1%, а у пожилого возраста 55,7 к 16,4%. Различия в пределах каждой возрастной группы статистически достоверны (р<0,001) (табл. 7).
В наблюдениях с размером первичной опухоли до 3,0 см обращает на себя внимание приблизительно одинаковое распределение метастатического поражения, как первого, так и второго уровня лимфоколлекторов. Так, у молодых
больных поражение только лимфоузлов первого уровня выявлено в 20,0%, а второго уровня в 26,7% случаев. Аналогичные показатели мы получили в наблюдениях у больных среднего и пожилого возраста, так соотношение «N1 к Ы2» составило 22,2 к 16,7% и 21,2 к 27,3% соответственно. Поражение лимфо-коллекторов уровня n3 при размере первичного опухолевого очага до 3,0 см нами выявлено лишь в одном наблюдении у больных среднего возраста. Одинаковое число наблюдений без лимфогенных метастазов во всех возрастных группах больных опухолью размером менее 3,0 см — 53,3; 60,0 и 51,5%, соответственно (р>0,5). Таким образом, в возрастных группах больных, опухоли размером до 3,0 см характеризовались одинаково низким и сопоставимым метастатическим потенциалом (р<0,5).
Поражение лимфо-коллекторов уровня n3 при размере первичного опухолевого очага до 3,0 см нами выявлено лишь в одном наблюдении у больных среднего возраста. Одинаковое число наблюдений без лимфогенных метастазов во всех возрастных группах больных опухолью размером менее 3,0 см — 53,3; 60,0 и 51,5%, соответственно (р>0,5). Таким образом, в возрастных группах больных, опухоли размером до 3,0 см характеризовались одинаково низким и сопоставимым метастатическим потенциалом (р<0,5).
Опухоли от 3,0 до 5,0 см, у больных молодого возраста характеризовались достоверно более высоким, чем в контрольных группах метастатическим потенциалом (52,0%; 35,2%; 29,8%). Поражение лимфоколлекторов уровня N1 в возрастных группах больных оказалось почти идентичным: — 18,0%; 22,9% и 16,4% соответственно. Однако поражение уровня N2 у молодых больных составило 32,0%, у больных среднего и пожилого возраста — 11,4 и 11,9%, соответственно (разница статистически достоверна 1=2,97 р<0,005 и 1=2,81 р<0,005).
Таким образом, у молодых больных наличие опухоли, превышающей 3,0 см, может оказаться прогностически значимым фактором, определяющим повышенный риск внутригрудного метастазирования.
Характеристика метастазирования в регионарные лимфоколлекторы в зависимости от размера первичной опухоли при периферическом раке представлена в таблице 8.
В нашем исследовании частота метастазирование во внутригрудные лимфатические узлы при опухолях до 3,0 см во всех возрастных группах не превышала 36,4% случаев. Показатели метастатического поражения каждого определенного уровня лимфоколлекторов, во всех возрастных группах статистически не различались.
Таблица 8
Регионарное метастазирование периферического рака в зависимости от ___размера первичного опухолевого очага_
«р№> Размер опухоли
0-3 см 3,1-5 см >5 см
Возраст больных
до 45 46-59 60-74 до 45 46-59 60-74 до 45 46-59 60-74
рК+ 9 (34,6%) 36 (36,4%) 39 (31,9%) 12 (66,7%) 32 (30,5%) 38 (29,6%) 12 (66,7%) 71 (65,1%) 53 (55,2%)
рИ0 17 (65,4%) 63 (63,6%) 83 (68,0%) 6 (33,3%) 73 (69,5%) 90 (70,4%) 6 (33,3%) 38 (34,9%) 43 (44,8%)
рИ, 3 (11,6%) 16 (16,2%) 19 (15,5%) ‘8 (44,4%) 13 (12,4%) 19 (14,8%) 3 (16,7%) 26 (23,8%) 12 (12,5%)
6 (23,0%) 20 (20,2%) 20 (16,4%) 4 (22,3%) 19 (18,1%) 19 (14,8%) 8 (44,4%) 41 (37,6%) 40 (41,7%)
рИ3 0 0 0 0 0 0 ‘ 1 (5,6%) 4 (3,7%) 1 (1,0%)
Всего 26 (100%) 99 (100%) 122 (100%) 18 (100%) 105 (100%) 128 (100%) 18 (100%) 109 (100%) 96 (100%)
Опухоли размером от 3,0 до 5,0 см у молодых больных при периферическом раке легкого характеризовались более высоким показателем внутригруд-ного метастазирования. Так, частота метастазирования в лимфатические узлы уровня N1 составила 44,4%, что в три раза больше, чем у больных среднего и пожилого возраста — 12,4% и 14,8%, соответственно. Разница статистически достоверна (1=2,57 р<0,01 и 1=2,38 р<0,02). В то же время, поражение лимфо-коллекторов уровня N2 существенно не различалось.
Так, частота метастазирования в лимфатические узлы уровня N1 составила 44,4%, что в три раза больше, чем у больных среднего и пожилого возраста — 12,4% и 14,8%, соответственно. Разница статистически достоверна (1=2,57 р<0,01 и 1=2,38 р<0,02). В то же время, поражение лимфо-коллекторов уровня N2 существенно не различалось.
Частота лимфогенного метастазирования опухолей размером более 5,0 см в исследуемой и контрольных группах оказалась одинаково высокой — 66,7%, 65,1%, 55,2% соответственно.
Таким образом, во всех возрастных группах больных, как при центральном, так и при периферическом раке легкого с увеличением размера первичного опухолевого очага отмечено возрастание лимфогенного метастазирования в целом. Опухоли размером от 3,0 до 5,0 см у молодых больных характеризовались более агрессивным течением лимфогенного метастазирования относительно больных контрольных возрастных групп.
У больных центральным раком легкого молодого возраста в случае поражения сегментарного бронха метастазы определялись в 62,5%, а у больных среднего и пожилого возраста в 42,2% и 36,4% наблюдений соответственно (разница между возрастными группами статистически не достоверна 1=1,09 р<0,5 и 1=1,40 р<0,1) (табл.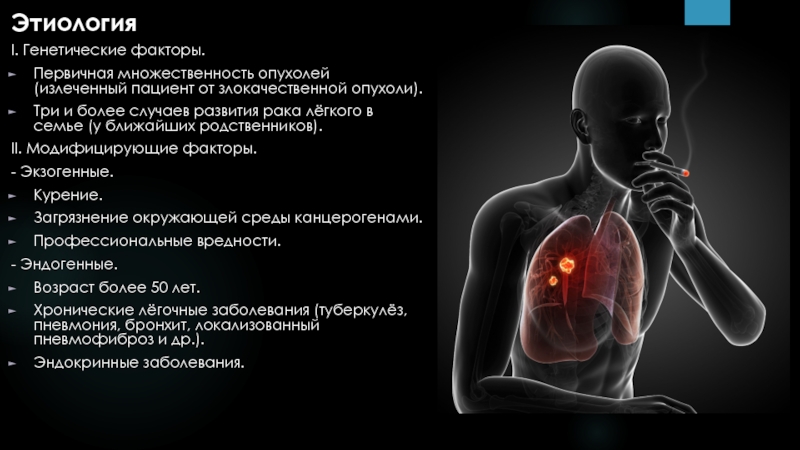 9).
9).
Таблица 9
Характеристика регионарного метастазирования в возрастных группах при центральном раке легкого в зависимости от проксимальной границы
поражения бронхиального дерева
«р№> Проксимальная граница поражения бронха
Сегментарный бронх Долевой бронх Главный бронх
Воз эаст больных
до 45 46-59 60-74 до 45 46-59 60-74 до 45 46-59 60-74
5 (62,5%) 19 (42,2%) 16 (36,4%) 55 (67,9%) 229 (55,6%) 111 (49,3%) 15 (75,0%) 84 (71,2%) 36 (67,9%)
3 (37,5%) 26 (57,8%) 28 (63,6%) 26 (32,1%) 183 (44,4%) 114 (50,7%) 5 (25,0%) 34 (28,8%) 17 (32,1%)
Р>Г, 1 (12,5%) 11 (24,4%) 6 (13,6%) 18 (22,2%) 102 (24,8%) 41 (18,2%) 2 (10,0%) 21 (17,8%) 9 (17,0%)
рИ2 3 (37,5%) 8 (17,8%) 9 (20,5%) 33 (40,8%) 120 (29,1%) 68 (30,2%) 13 (65,0%) 57 (48,3%) 25 (47,1%)
рМ3 1 (12,5%) 0 1 (2,3%) 4 (4,9%) 7 (1,7%) 2 (0,9%) 0 6 (5,1%) 2 (3,8%)
Всего 8 (100%) 45 (100%) 44 (100%) 81 (100%) 412 (100%) 225 (100%) 20 (100%) 118 (100%) 53 (100%)
Поражение долевого бронха у молодых больных определило более высокий процент метастазирования — метастазы в регионарные лимфатические узлы реализовались в 67,9% наблюдений. В то же время у больных среднего и пожилого возраста при поражении долевого бронха общая частота метастазирования составила 55,6% и 49,3%, соответственно (разница между основной и контрольными группами статистически достоверна 1=2,14 р<0,02 и 1=3,02 р<0,002). Отмеченная разница в частоте метастазирования достигается за счет N2, так как частота метастазирования в первый уровень лимфоколлекторов в сравниваемых группах сопоставима (22,2; 24,8 и 18,2%), а для второго уровня лимфоколлекторов — 40,8% у молодых больных достоверно больше, чем 29,1%
В то же время у больных среднего и пожилого возраста при поражении долевого бронха общая частота метастазирования составила 55,6% и 49,3%, соответственно (разница между основной и контрольными группами статистически достоверна 1=2,14 р<0,02 и 1=3,02 р<0,002). Отмеченная разница в частоте метастазирования достигается за счет N2, так как частота метастазирования в первый уровень лимфоколлекторов в сравниваемых группах сопоставима (22,2; 24,8 и 18,2%), а для второго уровня лимфоколлекторов — 40,8% у молодых больных достоверно больше, чем 29,1%
и 30,2% у пациентов среднего и пожилого возраста соответственно (1=1,98 р<0,05 и 1=1,89 р<0,05).
При поражении главного бронха у молодых больных метастазы во внут-ригрудные лимфатические узлы реализовывались в 75,0% наблюдений, а поражение лимфоколлекторов второго уровня составило 65,0%. Аналогичные данные нами получены в наблюдениях у больных среднего и пожилого возраста — № 71,2%; N2 48,3% и 67,9%; N2 47,1%, соответственно.
Таким образом, уровень поражения бронха при центральном раке легкого может являться значимым фактором в прогнозировании внутригрудного мета-стазирования. Так, у больных молодого возраста, и в контрольных возрастных группах с приближением проксимальной границы опухоли от сегментарного бронха к главному возрастает показатель общей частоты метастазирования в основном за счет поражения второго уровня лимфоколлекторов.
При аденокарциноме как центральной, так и периферической локализации каких-либо существенных различий структуры лимфогенного метастазирования в возрастных группах нами не обнаружено. Однако при плоскоклеточном раке легкого у молодых больных отмечено более агрессивное поведение опухоли (табл. 10).
Таблица 10
Характеристика регионарного метастазирования в возрастных группах при
центральном плоскоклеточном раке
«рЫ» Возраст
молодой средний пожилой
абс. % абс. % абс. %
60 67,4 280 56,1 133 47,3
N0 29 32,6 219 43,9 148 52,7
N. 20 22,5 119 23,8 50 17,8
20 22,5 119 23,8 50 17,8
N2 36 40,4 151. 30,3 79 28,1
N3 4 4,5- 10 2,0 4 1,4
Всего 89 100% 499 100% 281 100%
При центральном плоскоклеточном раке легкого отмечена высокая частота лимфогенного метастазирования у больных молодого возраста в основном за счет поражения лимфоколлекторов уровня N2, которое составило 40,4%. Ана-
логичные данные у больных среднего и пожилого возраст составили 30,3% и 28,1%, соответственно. Разница оказалась статистически достоверной относительно больных пожилого возраста (1=2,10 р<0,05), а относительно больных среднего возраста она приближалась к достоверности (1=1,82 р<0,1). Также общая частота лимфогенного метастазирования у больных молодого возраста достоверно выше, чем у больных среднего и пожилого возраста (67,4% против 56,1% и 47,3%, 1=2,08 р<0,02 и 1=3,47 р<0,001).
Характеристика внутригрудного метастазирования при периферическом плоскоклеточном раке легкого представлена в таблице 11.
Таблица 11
Характеристика внутригрудного метастазирования при периферическом
плоскоклеточном раке легкого
«рИ» Возраст
молодой средний пожилой
абс. % абс. % абс. %
N0 7 38,9 84 58,7 109 63,4
N1 3 16,7 26 18,2 26 15,1
N2 8 44,4 33 23,1 37 21,5
N3 0 0 0 0 0 0
Всего 18 100% 143 100% 172 100%
Отсутствие поражения лимфатических узлов (N0) у молодых встречается достоверно реже, чем у больных среднего и пожилого возраста — 38,9% против 58,7% и 63,4%. Целесообразно отметить, что у молодых пациентов относительно больных контрольных возрастных групп при одинаковой частоте поражения лимфоколлекторов уровня N1 (16,6; 18,2 и 15,1%, соответственно), число поражения лимфоколлекторов уровня N2 оказалось достоверно выше (44,4% против 23,1% и 21,5%; р<0,05).
Результаты радикального хирургического лечения При расчетах выживаемости больных из общего числа наблюдений исключены случаи послеоперационной летальности, смерти от сопутствующих заболеваний, а также пациенты с отдаленными метастазами (М|) на момент операции.
Показатели 5-летней выживаемости у радикально оперированных молодых больных (рис. 1) оказались низкими. Так, 5-летний период пережили 34,2% (43 из 127) больных молодого возраста, 40,1% (257 из 645) больных среднего возраста и 43,3% (210 из 486) больных пожилого возраста. Разница статистически оказалась достоверной относительно больных пожилого возраста (р<0,05, Х2=1,69, k=l Log-rank test), а относительно больных среднего возраста мы лишь получили тенденцию к достоверности (р<0,2).
Рис. 1. Общая выживаемость после радикальных операций в зависимости от
возраста
Данные общей выживаемости у радикально оперированных больных в за-
висимости от стадии болезни представлены в таблице 12.
Таблица 12
_ Выживаемость в зависимости от стадии рака легкого_
Стадии Молодой возраст Средний возраст Пожилой возраст «р»
Выживаемость (%)
3 года 5 лет (п) 3 года 5 лет (п) 3 года 5 лет (п)
IA 62,5% 50,0% 15 80,3% 59,7% 72 72,6% 68,5% 63 p=Q,5
IB 62,6% 56,5% 22 66,6% 54,4% 203 68,3% 52,4% 204 Р=0,5
IIA — — 3 29,9% 29,7% 13 55,5% 36,9% 13 -
IIB 50,2% 39,6% 31 42,9% 33,1% 156 46,9% 37,3% 84 р=0,5
IIIA 44,4% 15,0% 44 34,6% 28,8% 149 30,4% 22,1% 105 р=0,05
IIIB 20,0% 20,0% 12 27,3% 16,7% 52 37,5% 29,0% 17 Р=0,5
п — число наблюдений
При IA стадии рака легкого максимальная 5-летняя выживаемость отмечена у больных пожилого возраста — 68,5% (42 из 63), в то же время, у больных молодого и среднего возраста — 50,0% (8 из 15) и 59,7% (41 из 72), соответственно. Однако, различия в сравниваемых возрастных группах статистически не достоверны (р<0,5, %2=2,20, k=l Log-rank test). При IB стадии общая выживаемость молодых больных также оказалась идентичной выживаемости больных старших возрастных групп: 56,5% (12 из 22), 54,4% (109 из 203) и 52,4% (106 из 205), соответственно (р>0,05, х2=0,63, k=l Log-rank test). При IIB стадии общая 5-летняя выживаемость молодых составила 39,6% (12 из 31), больных среднего и пожилого возрастаЗЗ,1% (51 из 156) и 37,3% (31 из 84), соответственно. Разница статистически недостоверна (р<0,5, %2=0,37, k=l Logrank test).
Однако, различия в сравниваемых возрастных группах статистически не достоверны (р<0,5, %2=2,20, k=l Log-rank test). При IB стадии общая выживаемость молодых больных также оказалась идентичной выживаемости больных старших возрастных групп: 56,5% (12 из 22), 54,4% (109 из 203) и 52,4% (106 из 205), соответственно (р>0,05, х2=0,63, k=l Log-rank test). При IIB стадии общая 5-летняя выживаемость молодых составила 39,6% (12 из 31), больных среднего и пожилого возрастаЗЗ,1% (51 из 156) и 37,3% (31 из 84), соответственно. Разница статистически недостоверна (р<0,5, %2=0,37, k=l Logrank test).
При IIIA стадии общая выживаемость молодых больных оказалась достоверно ниже выживаемости больных среднего и пожилого возраст — 15,0% (7 из 44) против 28,8% (43 из 149) и 22,1% (23 из 105). (р<0,05, г =6,22 k=l Log-rank test) (рис. 2).
Рис. 2. Общая выживаемость больных раком легкого IIIA стадии в зависимости от возраста При IIIB стадии различий выживаемости молодых относительно больных
старших возрастных групп нами не выявлено (р<0,5, х2=1,29 k=l Log-rank test).
Сравнительный анализ выживаемости больных в возрастных группах в зависимости от объема операции и стадии болезни показал, что 5-летняя выживаемость больных раком легкого I стадии, оперированных в объеме лоб/билобэктомии статистически не различалась: 44,2% (9 из 21) — молодые больные; 58,4% (89 из 153) — средний возраст; 55,7% (104 из 186) — пожилые пациенты (р<0,2 и р<0,5, %2=0,65 k=l Log-rank test) (рис. 3).
Рис. 3. Общая выживаемость больных раком легкого I стадии, оперированных в объеме лоб/билобэктомии
Аналогичные результаты получены и для больных раком легкого, оперированных в объеме пневмонэктомии. 5-летняя выживаемость молодых — 66,7% (9 из 14) против 54,4% (60 из 110) и 51,7% (35 из 67) для групп среднего и пожилого возраста соответственно (р<0,5 и р<0,5, %2=1,07 k=l Log-rank test) (рис.
4).
100
молодой возраст средний возраст пожилой возраст
2 годы з
Рис. 4. Общая выживаемость больных раком легкого I стадии, оперированных
в объеме пневмонэктомии 5-летняя выживаемость молодых больных раком легкого II стадии, оперированных в объеме лоб/билобэктомии статистически не отличалась от выживаемости пациентов контрольных возрастных групп — 49,8; 35,0 и 29,5% (р<0,5, х2=2,55 k=l Log-rank test) (рис. 5).
5).
Рис. 5. Общая выживаемость больных раком легкого II стадии, оперированных
в объеме лоб/билобэктомии Аналогичная картина имеет место и для больных раком легкого II стадии,
оперированных в объеме пневмонэктомий — 49,2; 41,0 и 31,9%, соответственно
(р<0,5 и р<0,5, %2=1,75 k=l Log-rank test) (рис. 6).
Рис. 6. Общая выживаемость больных раком легкого II стадии, оперированных
в объеме тевмонэктомии -Показатели 5-летней выживаемости больных раком легкого III стадии,
оперированных в объеме лоб/билобэктомии, у больных молодого, среднего и пожилого возраста оказались идентичными и составили 25,8; 35,6 и 23,0%, соответственно. Различия статистически недостоверны (р<0,5 и р<0,5, %2=3,19 к=1 Log-rank test) (рис. 7).
Рис. 7. Общая выживаемость больных раком легкого III стадии, оперированных в объеме лоб/билобэктомии
Для больных раком легкого III стадии, оперированных в объеме пневмо-нэктомии 5-летняя выживаемость в сравниваемых группах больных также ста-
тистически не различалась — 14,2; 23,0 и 23,2%, соответственно (р<0,5 и р<0,5, Х2=2,70 k=l Log-rank test) (рис. 8).
8).
Рис. 8. Общая выживаемость больных раком легкого III стадии, оперированных в объеме пневмонэктомии Влияние гистологического варианта опухоли на результаты радикального
хирургического лечения характеризовалось некоторыми особенностями. Так, при I и II стадиях заболевания 5-летняя выживаемость во всех возрастных группах больных плоскоклеточным раком легкого фактически оказалась идентичной — 58,2; 57,6 и 57,8%, соответственно. А при III стадии выживаемость молодых пациентов оказалась достоверно хуже выживаемости больных контрольных возрастных групп — 10,8% (4 из 39) против 30,0% (43 из 143) и 30,3% (24 из 79), соответственно (р<0,002 и р<0,01, соответственно) (табл. 13).
Напротив, при всех стадиях аденокарциномы легкого показатели общей 5-летней выживаемости у молодых пациентов оказались лучше, так, при I, II и III стадиях заболевания общая выживаемость молодых больных составила 55,6% (9 из 16), 40,0% (4 из 10) и 41,0% (6 из 14), соответственно; выживаемость больных среднего возраста составила 46,5% (27 из 58), 22,3% (8 из 35) и 8,3% (4 из 47), а пожилых пациентов — 44,0% (33 из 75), 21,5% (4 из 21) и 11,7% (4 из 38), соответственно. Однако разница оказалась статистически достоверной только при III стадии рака легкого (р<0,02 и р<0,05, соответственно) (табл. 13).
Однако разница оказалась статистически достоверной только при III стадии рака легкого (р<0,02 и р<0,05, соответственно) (табл. 13).
Таблица 13
Общая выживаемость в зависимости от стадии заболевания _при плоскоклеточном раке и аденокарциноме__
Структура опухоли Стадии 5-летняя выживаемость (%) «р»
молодой возраст средний возраст пожилой возраст
Плоскоклеточный рак 1 58,2% 57,6% 57,8% р<0,5
II 41,4% 35,6% 45,2% Р<0,5
III 10,8% 30,0% 30,3% р<0,002 р<0,01
Число наблюдений (п) 17/23/39 195/125/143 180/69/79
Аденокарцинома I — 55,6% 46,5% 44,0% р<0,5
II • 40,0% 22,3% 21,5% Р<0,5
III 41,0% 8,3% 11,7% р<0,02 р<0,05
Число наблюдений (п) 16/10/14 58/35/47 75/21/38
Наиболее прогностически значимым клиническим фактором, влияющим
на результаты радикального хирургического лечения у молодых пациентов, оказался размер опухоли менее 3,0 см. Так, общай 5-летняя выживаемость оказалась одинаково выше в возрастных группах и составила 57,0% (20 из 35), 47,2% (80 из 169) и 47,3% (71 из 151), соответственно (р<0,5 и р<0,5, х2=0,84 k=l Log-rank test) (табл. 14).
Так, общай 5-летняя выживаемость оказалась одинаково выше в возрастных группах и составила 57,0% (20 из 35), 47,2% (80 из 169) и 47,3% (71 из 151), соответственно (р<0,5 и р<0,5, х2=0,84 k=l Log-rank test) (табл. 14).
Таблица 14
Выживаемость радикально оперированных больных в зависимости от _ размера первичного опухолевого очага _
Размер опухоли Выживаемость (%) «р»
годы молодой возраст средний возраст пожилой возраст
До 3 см 3 года 66,6% 60,9% 56,8% Р<0,5 р<0,5
5 лет 57,0% 47,2% 47,3%
Медиана выжив, (мес.) 61 мес. 54 мес. 49 мес.
Число наблюдений (п) 35 169 151
От 3 до 5 см 3 года 49,5% 57,5% 64,4% р<0,05 р<0,05
5 лет 33,1% 47,9% 48,5%
Медиана выжив, (мес.) 29 мес. 50 мес. 51 мес.
Число наблюдений (п) 56 261 212
Более 5 см 3 года 33,6% 36,0% 37,6% р<0,2 р<0,1
5 лет 16,8% 26,5% 30,4%
Медиана выжив, (мес.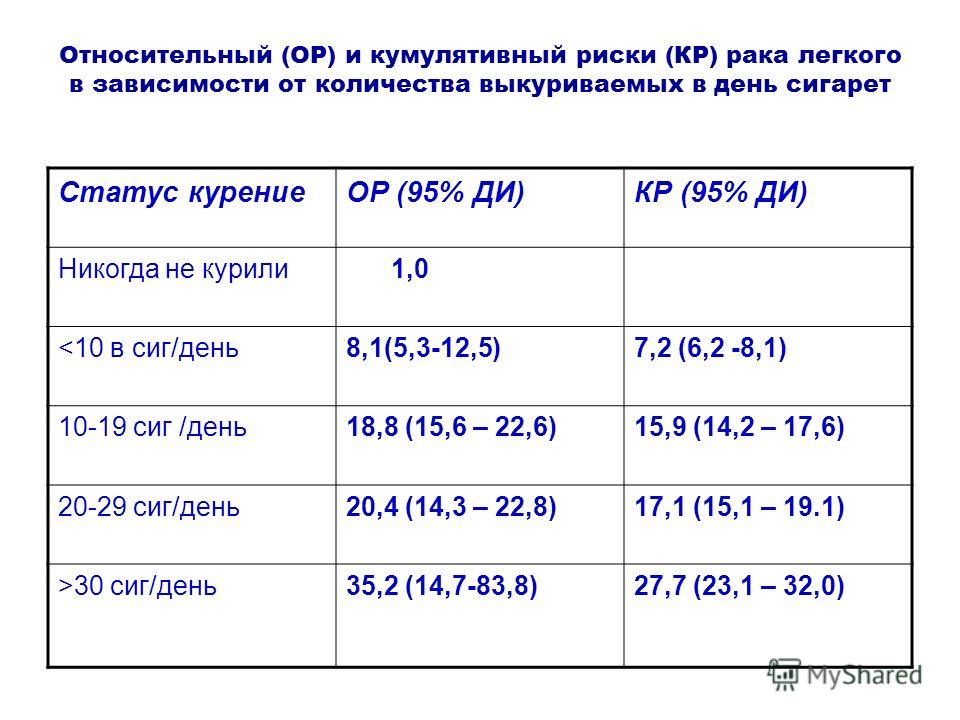 ) 19 мес. 23 мес. 21 мес.
) 19 мес. 23 мес. 21 мес.
Число наблюдений (п) 36 215 123
При размере первичного опухолевого очага от 3,0 до 5,0 см результаты 5-летней выживаемости у молодых оказались достоверно хуже, составляя 33,1% (18 из 56) против 47,9% (125 из 261) и 48,5% (102 из 212), соответственно (р<0,05 и р<0,05, х2=3,86 k=l Log-rank test).
При опухолях размером более 5,0 см в возрастных группах больных установлены одинаково низкие показатели 5-летней выживаемости — 16,8% (6 из 36) против 26,5% (57 из 215) и 30,4% (37 из 123), соответственно (р<0,2 и р<0,1, X2=l,30 k=l Log-rank test).
Более низкие показатели 5-летней выживаемости молодых пациентов по сравнению с другими возрастными группами получены и при опухолях, соответствующих значению символа «Т3». Так, 5-летняя выживаемость молодых пациентов составила 14,3% (5 из 31) против 30,4% (36 из 120) и 31,6% (19 из 60) (р<0,01, /2= 10,50 k=l Log-rank test).
Общая выживаемость больных в зависимости от стадии болезни при хирургическом и комбинированном лечении представлена в таблице 15.
Таблица 15
Общая выживаемость в зависимости от стадии болезни при хирургическом и _ комбинированном лечении___
Вид лечения Стадия Молодой возраст Средний возраст Пожилой возраст
5-летняя выживаемость (%)
Хирургический I 60,0% 58,7% 55,7% р<0,5
II 45,8% 37,3% 39,8% р<0,5
III 18,0% 27,9% 23,7% р<0,5 Р<0,5
Число наблюдений (п) 33/21/20 246/131/111 241/79/83
Комбинированный I — 22,2% 48,5% -
II 39,8% 18,8% 26,2% р<0,5
III 17,9% 23,2% 21,4% р<0,5 р<0,5
Число наблюдений (п) 4/13/36 29/38/90 26/18/39
Сравнительный анализ переведен между «первой и второй» и «первой и третей» возрастнъши группами
Достоверных различий в выживаемости молодых больных по сравнению с другими возрастными группами, как после хирургического, так и комбинированного лечения при одинаковых стадиях заболевания не выявлено.
Сравнительный анализ результатов хирургического и комбинированного лечения рака легкого в пределах каждой возрастной группы позволил выявить следующее:
• у молодых пациентов результаты хирургического и комбинированного лечения при всех стадиях за исключением I стадии оказались идентичными.
• у больных среднего возраста при I и II стадиях рака легкого результаты хирургического лечения с большой достоверностью превосходили
1
результаты комбинированного лечения (р<0,0001). Однако при III стадии рака легкого результаты хирургического и комбинированного лечения фактически оказались идентичными (р<0,5).
• у пожилых больных результаты хирургического лечения оказались достоверно лучше только при I стадии заболевания (р<0,01), при II и III стадиях рака легкого результаты хирургического и комбинированного лечения оказались сопоставимы.
Выводы
1. Среди оперированных по поводу немелкоклеточного рака легкого молодые пациенты составляют всего 9,9% (171 из 1727). Во всех возрастных группах преобладающим гистологическим типом является плоскоклеточный рак. Однако среди пациентов молодого возраста относительно преобладают женщины и больные аденокарциномой низкой степени дифференцировки по сравнению с больными среднего и пожилого возраста.
2. Характеристики опухолей — «Т2.з», размер от 3,0 до 5,0 см, проксимальная граница на уровне долевого бронха, плоскоклеточный рак — являются отрицательными прогностическими клиническими факторами, определяющими повышенную частоту лимфогенного метастазирования у больных молодого возраста относительно пациентов среднего и пожилого возраста.
3. В целом 5-летняя выживаемость молодых больных после радикального хирургического лечения ниже относительно пожилых — 34,2% против 43,3% (р<0,05). Однако при I и II стадиях заболевания у молодых пациентов и в стар-
ших возрастных группах выживаемость одинакова; она ухудшается только при IIIA стадии — 15,0; 28,8 и 22,1% (р<0,05, yj=6,22 k=l Log-rank test), соответственно. При опухолях, соответствующих значению «Тз», с размером от 3,0 до 5,0 см без учета лимфогенного метастазирования (N), выживаемость молодых пациентов также ниже, чем в группе среднего и пожилого возраста (р<0,01, Х2=10,5 k=l Log-rank test).
4. При центральном раке выживаемость пациентов пожилого возраста достоверно выше относительно пациентов молодого и среднего возраста — 47,2; 33,2 и 37,6%, соответственно (р<0,05). Поражение регионарных лимфатических узлов при верхнедолевой локализации опухоли прогностически более неблагоприятно у больных молодого возраста: так 5-летняя выживаемость оказалась достоверно ниже — 14,3; 27,9 и 29,1%, соответственно (р<0,05).
При центральном раке выживаемость пациентов пожилого возраста достоверно выше относительно пациентов молодого и среднего возраста — 47,2; 33,2 и 37,6%, соответственно (р<0,05). Поражение регионарных лимфатических узлов при верхнедолевой локализации опухоли прогностически более неблагоприятно у больных молодого возраста: так 5-летняя выживаемость оказалась достоверно ниже — 14,3; 27,9 и 29,1%, соответственно (р<0,05).
5. Как при плоско клеточном раке, так и при аденокарциноме выживаемость в возрастных группах больных при 1 и II стадиях оказалась идентичной. Однако при III стадии заболевания 5-летняя выживаемость молодых больных аденокарциномой оказалась выше, а плоскоклеточным раком ниже. Так, при аденокарциноме она составила 41,0; 8,3 и 11,7%, соответственно (р<0,02 и р<0,05), а при плоскоклеточном раке — 10,8; 30,0 и 30,3%, соответственно (р<0,002 и р<0,01).
6. Объем хирургического вмешательства при сравнимой распространенности опухоли не оказал влияния на показатели выживаемости в сравниваемых возрастных группах.
7. У молодых пациентов результаты хирургического и комбинированного лечения при всех стадиях заболевания существенно не различались. А в старших возрастных группах при I и II стадиях рака легкого результаты хирургического лечения превосходили результаты комбинированного лечения (р<0,05). Однако при III стадии в контрольных возрастных группах больных результаты хирургического и комбинированного лечения существенно не различались.
8. Несмотря на некоторые клинические различия, большая частота про-грессирования процесса у больных молодого возраста лишь соответствует
большей распространенности первичных опухолей, а не отражает «более злокачественное» течение заболевания в молодом возрасте.
Список научных трудов, опубликованных по теме диссертации
1. Багиров P.P., Полоцкий Б.Е./Рак легкого у больных молодого возрас-та//Российский Биотерапевтический Журнал. — 2009. — Т.8. — №4. — С. 89-94.
2. Багиров P.P.. Лактионов К.К., Аллахвердиев А. К., Никуличев Л.А., Бахтадзе Л.А., Полоцкий Б.Е., Давыдов М.И./Хирургическое лечение рака легкого у больных молодого возраста//Вестник РОНЦ им. Н.Н.Блохина РАМН.’- 2009. — Т.20. — №4. — С. 48-56.
К., Никуличев Л.А., Бахтадзе Л.А., Полоцкий Б.Е., Давыдов М.И./Хирургическое лечение рака легкого у больных молодого возраста//Вестник РОНЦ им. Н.Н.Блохина РАМН.’- 2009. — Т.20. — №4. — С. 48-56.
3. Davydov Mikhail, Allakhverdiyev Arif, Polotsky Boris, Laktionov Konstantin, Davydov Mikhail M., Nikulichev Lev, Bagirov Rahmat. Gotsadze Ilya/Systematic lymph node dissection (SLND) — the mainstay of surgical management of stage II and IIIA lung cancer//Scientific Abstracts of the 13th World Conference on Lung Cancer. — San Francisco, USA. -2009. — July 31-August 4. — PD11.1.5.
/
I
Подписано в печать 08.02.1Q Формат 60X84/16 Бумага офисная «8уек>Сору». Тираж 100 экз. Заказ № 114 Отпечатано на УМТ РОНЦ им. Н.Н.Блохина РАМН 115478, Москва, Каширское ш., 24
Рак лёгких — диагностика и лечение в центре онкологии ЕМС в Москве
Рак легкого, или бронхогенная карцинома, – злокачественное новообразование, происходящее из ткани бронхов или легочной паренхимы.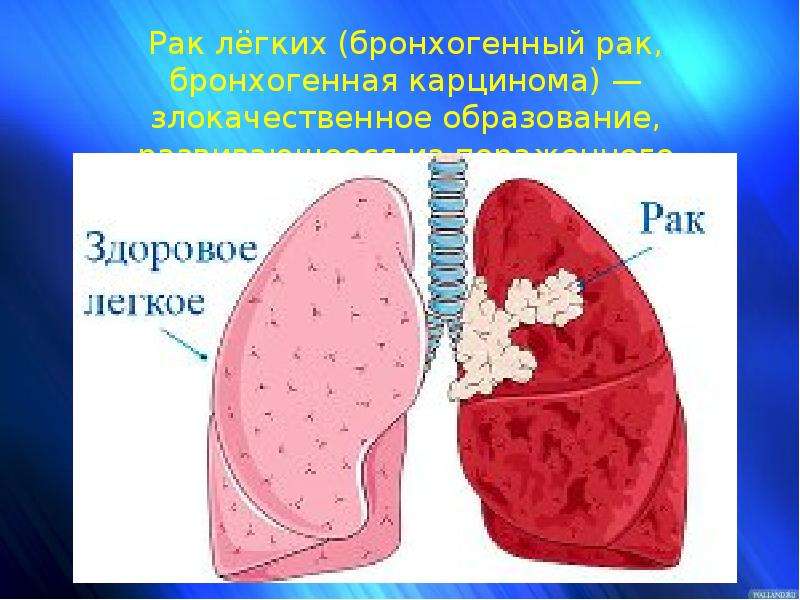 Рак легких – одно из наиболее распространенных онкологических заболеваний у мужчин и женщин во всем мире.
Рак легких – одно из наиболее распространенных онкологических заболеваний у мужчин и женщин во всем мире.
Виды рака легкого
-
Мелкоклеточный рак легкого (МКРЛ) диагностируется у 10-15% пациентов. Имеет тенденцию к более агрессивному течению, быстрому распространению, рецидивам.
-
Немелкоклеточный рак легкого (НМКРЛ) включает в себя все остальные виды рака легкого и диагностируется у 85-90% пациентов. НМКРЛ имеет подкатегории, наиболее распространенными среди которых являются аденокарцинома и плоскоклеточный рак. Этот вид рака легких нередко является показанием к хирургическому лечению, особенно на ранних стадиях заболевания.
Мелкоклеточный и немелкоклеточный рак лёгкого предполагают разные подходы к хирургическому лечению, лучевой и химиотерапии. До недавнего времени простое гистологическое разделение НМКРЛ и МКРЛ наряду со стадией было адекватным для принятия решения о лечении при впервые установленном диагнозе рака легкого.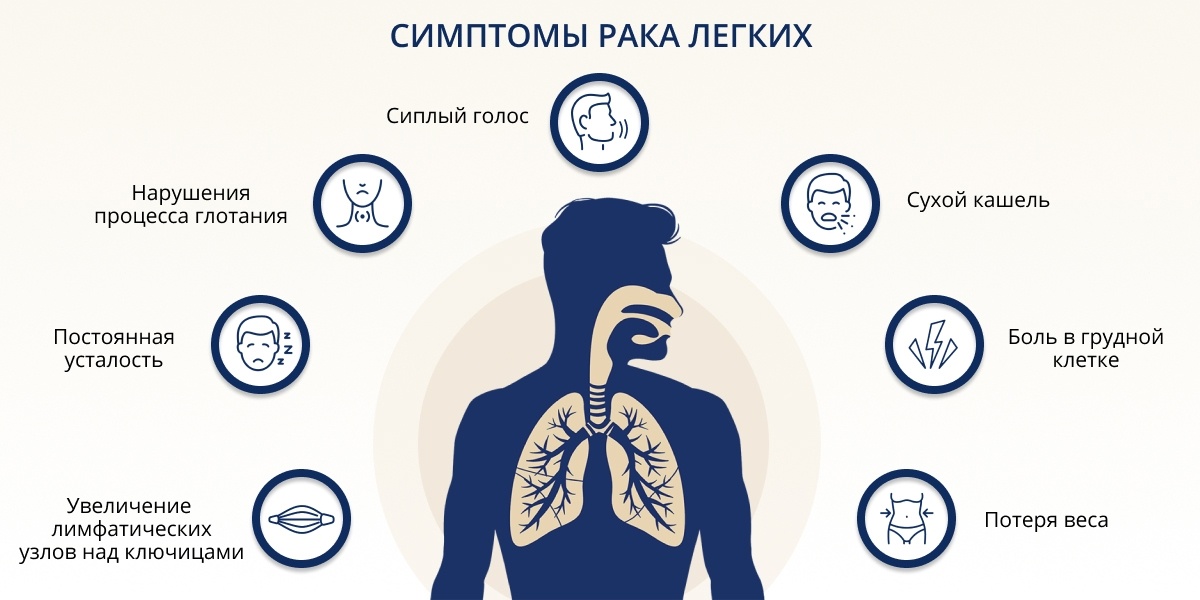
Симптомы рака легкого
На ранних стадиях заболевания, при которых лечение будет наиболее эффективным, симптомы незначительны и отсутствуют, что подчеркивает актуальность скрининговых исследований у пациентов, имеющих высокий онкологический риск.
Наиболее частыми клиническими проявлениями рака легкого являются:
-
Кашель – у 50-75 % пациентов
-
Кровохарканье – у 25-50 % пациентов
-
Одышка – у 25 % пациентов
-
Боль в груди – у 20 % пациентов
Появление симптомов, как правило, свидетельствует о далеко зашедшем процессе.
Реже рак легкого может проявляться отклонениями в лабораторных показателях вследствие метастазирования в другие органы (чаще всего в печень, кости, головной мозг) или паранеопластическим синдромом – это комплекс проявлений, не связанных непосредственно с опухолью, но вызванных воздействием раковых клеток на организм.
Паранеопластический синдром включает:
-
гиперкальциемию (повышение концентрации кальция в плазме крови),
-
синдром Кушинга (повышенное выделение гормона кортизола корой надпочечников),
-
гиперкоагуляционные нарушения (усиление свертываемости крови),
-
различные неврологические синдромы (нарушения координации, проблемы с равновесием, трудности при ходьбе, затрудненная речь, глотание и т.д.).
Мелкоклеточный и немелкоклеточный рак легкого могут проявляться одинаковыми симптомами. Но для мелкоклеточного рака характерны:
-
быстрое прогрессирование симптомов,
-
паранеопластический синдром,
-
объемные множественные метастазы в медиастинальные лимфоузлы,
-
синдром верхней полой вены,
-
костные метастазы и метастазы в головной мозг.

Тогда как синдром Панкоста (слабость и боль в руке, вызванная прорастанием опухоли верхней доли легкого в плечевое сплетение) и гиперкальциемия чаще обнаруживаются у пациентов с немелкоклеточным раком легкого.
Диагностика рака легкого
Пациенту с подозрением на рак лёгкого назначается компьютерная топография (КТ) грудной полости и верхних отделов брюшной полости (обычно с контрастированием) для оценки степени распространенности первичной опухоли и возможного распространения в средостение, печень и надпочечники.
Окончательный диагноз рака устанавливается только на основании цитологического исследования (например, плевральной жидкости) или гистологического исследования (биопсии ткани).
Биопсия может быть выполнена одним из следующих способов:
-
Бронхоскопия
-
Эндобронхиальная ультразвуковая бронхоскопия, или EBUS, — техника, которая сочетает в себе применение гибкого бронхоскопа с ультразвуком
-
Тонкоигольная биопсия под контролем КТ
-
Игольная аспирация
-
Торакоцентез
- В том случае, если другие процедуры биопсии не позволили определить диагноз, может потребоваться операция.
 Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.
Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.
Радиолог, специалист по диагностике онкологических заболеваний Института онкологии EMC профессор Евгений Либсон (Израиль) имеет многолетний опыт проведения тонкоигольных биопсий под контролем КТ, что позволяет многим пациентам избежать открытой операции, выполняемой с диагностической целью.
После биопсии материал отправляется в Гистологическую лабораторию EMC для установки точного диагноза и получения важных характеристик опухоли, которые помогают в дальнейшем выборе лечения.
При необходимости или по желанию пациента проводится верификация диагноза в ведущих клиниках США, Великобритании, Израиля, Германии, Франции, Швейцарии (методом телепатологии). Получение «второго мнения» зарубежного специалиста входит в стандартную стоимость исследования.
Получение «второго мнения» зарубежного специалиста входит в стандартную стоимость исследования.
Молекулярный анализ опухоли
В Институте онкологии EMC проводится также молекулярный анализ опухоли для определения специфических биомаркеров опухоли или генных мутаций. Это позволяет составить так называемый «молекулярный портрет» опухоли и проводить терапию таргетными препаратами, которая даёт лучший эффект, чем стандартная химиотерапия. Наиболее распространенными биомаркерами рака лёгкого являются мутации EGFR, транслокации ALK и транслокации c-ROS онкогена 1 (онкогена ROS1).
Стадирование
После установления диагноза необходимо провести дообследование для правильного стадирования заболевания. С этой целью могут быть назначены:
-
Ультразвуковые исследования плевральных и брюшной полости, сосудов, лимфатических узлов (для диагностики распространения и вызванных опухолью осложнений)
-
МРТ головного мозга (при наличии неврологической симптоматики)
-
Рентген тазовой области (при боли в области таза)
-
Эхокардиография для оценки злокачественного плеврального выпота (при наличии гипотензии с синусовой тахикардией).

Лабораторные исследования
При подозрении на рак легкого по данным КТ выполняются следующие исследования:
-
Общий анализ крови
-
Электролиты
-
Кальций
-
Щелочная фосфатаза
-
АЛТ, АСТ, билирубин общий
-
Креатинин
-
Общий белок, альбумин и лактатдегидрогеназы (не обязательно)
-
Коагулограмма
Клинический осмотр и лабораторные исследования проводятся для выявления возможных метастазов. Отклонения лабораторных показателей от нормы являются основанием для назначения дополнительных инструментальных исследований.
В EMC применяется современный высокоточный метод стадирования рака легкого — ПЭТ/КТ всего тела. ПЭТ/КТ проводится пациентам с I, II и III стадией заболевания, обязательно проведение исследования перед операцией. ПЭТ/КТ может обнаружить очаги опухоли в лимфатических узлах, не детектируемые с помощью КТ, а также отдаленные метастазы в других органах. Зачастую по результатам ПЭТ/КТ пересматривается первоначальная стадия и тактика лечения.
ПЭТ/КТ может обнаружить очаги опухоли в лимфатических узлах, не детектируемые с помощью КТ, а также отдаленные метастазы в других органах. Зачастую по результатам ПЭТ/КТ пересматривается первоначальная стадия и тактика лечения.
Стадии немелкоклеточного рака легкого определяются исходя из следующих факторов:
-
размера и расположения опухоли
-
распространения опухоли в лимфатические узлы и ткани внутри грудной полости
-
распространения опухоли за пределы грудной полости (например, рак лёгкого может метастазировать в кости, печень, надпочечники или другие органы).
Стадии немелкоклеточного рака легкого варьируются от I до IV:
-
Стадия I – диаметр опухоли меньше или равен 3 см, опухоль не распространилась ни в какие другие ткани или лимфоузлы.
-
Стадия II – Стадия II означает, что опухоль имеет размер от 3 до 7 см или распространилась в лимфоузлы, или проникла в ткани, окружающие лёгкое, или начала прорастать в просвет бронхов.

-
Стадия IIIA – Стадия IIIA заболевания означает, что опухоль может быть больше 7 см или распространяться в лимфатические узлы в центре грудной полости (средостения), или проросла в ребра, сердце, пищевод или трахею.
-
Стадия IIIB – Стадия IIIB заболевания означает, что опухоль распространилась на лимфатические узлы за пределами средостения или в лимфатические узлы выше или ниже ключицы. К стадии IIIB также относят опухоли, которые распространились на ребра, сердце, пищевод или трахею без вовлечения лимфоузлов средостения.
-
Стадия IV – Стадия IV означает, что рак распространился за пределы грудной полости или на противоположную сторону средостения. На IV стадии рак может привести к скоплению жидкости вокруг легкого или сердца (злокачественный выпот).
Стадии мелкоклеточного рака лёгкого. Техническое разделение мелкоклеточного рака на стадии происходит точно так же, как и для немелкоклеточного рака. Однако варианты лечения обычно определяются по более простой схеме. Обычно мелкоклеточный рак лёгкого характеризуют как «ограниченный» или «распространенный» процесс.
Однако варианты лечения обычно определяются по более простой схеме. Обычно мелкоклеточный рак лёгкого характеризуют как «ограниченный» или «распространенный» процесс.
-
ограниченный процесс – это мелкоклеточный рак лёгкого, который ограничен одной стороной грудной полости и поражением регионарных лимфоузлов.
-
распространенный процесс – это мелкоклеточный рак лёгкого, который распространился на противоположную сторону грудной клетки и другие органы за пределами грудной клетки.
Лечение рака легкого
В Институте онкологии EMC реализованы все возможности для оказания помощи пациентам с раком легкого по международным стандартам.
Лечение рака легкого в EMC:
-
Международная команда врачей: специалисты с опытом работы в США, Израиле, Западной Европе.
-
Каждый клинический случай обсуждается на мультидисциплинарном консилиуме.
 Команда специалистов, включающая в себя онкологов, хирургов, радиологов, морфологов, лучевых терапевтов, определяет тактику лечения индивидуально для каждого пациента.
Команда специалистов, включающая в себя онкологов, хирургов, радиологов, морфологов, лучевых терапевтов, определяет тактику лечения индивидуально для каждого пациента. -
Комплексная диагностика (КТ, МРТ, ПЭТ/КТ)
-
Химиотерапия по современным европейским и американским протоколам, препараты последнего поколения ведущих мировых производителей.
-
Таргетная терапия, основанная на молекулярном анализе опухоли
-
Иммунотерапия
-
Новейшие системы для проведения лучевой терапии и стереотактической лучевой терапии Varian EDGE, Truebeam, США.
-
Психотерапевтическая поддержка пациента и его семьи.
Ранние стадии рака лёгкого обычно поддаются хирургическому лечению с удалением опухоли и окружающей ткани лёгкого. На III стадии рака лёгкого часто показано комбинированное лечение — сочетание химиолучевой терапии и хирургической операции на различных этапах терапии. Если рак распространился за пределы грудной полости (стадия IV), химиотерапия и лучевая терапия применяются для контроля заболевания и его симптомов.
Если рак распространился за пределы грудной полости (стадия IV), химиотерапия и лучевая терапия применяются для контроля заболевания и его симптомов.
Для пациентов с МКРЛ системная химиотерапия является одним из наиболее важных компонентов лечения, поскольку практически у всех пациентов на момент обращения уже имеет место распространенный МКРЛ. Для пациентов с ограниченной стадией применяется лучевая терапия грудной полости в сочетании с химиотерапией. Часто проводится профилактическая лучевая терапия на головной мозг, чтобы снизить частоту развития метастазов в головном мозге и увеличить выживаемость. Профилактическая лучевая терапия в области головы и грудной клетки также может иметь положительное воздействие у пациентов с полным или частичным ответом на первичную системную химиотерапию.
Хирургическое лечение рака легкого
Хирургическая резекция обеспечивает наилучшую длительную выживаемость и нередко полное излечение у пациентов с немелкоклеточным раком легкого. Однако даже при наличии опухоли, поддающейся удалению, пациент может быть «неоперабельным» ввиду недостаточности функции лёгких или из-за сопутствующих заболеваний, поэтому всестороннее обследование имеет большое значение при подготовке к операции.
Однако даже при наличии опухоли, поддающейся удалению, пациент может быть «неоперабельным» ввиду недостаточности функции лёгких или из-за сопутствующих заболеваний, поэтому всестороннее обследование имеет большое значение при подготовке к операции.
Хирургические вмешательства у пациентов с подозрением или установленным диагнозом рака легкого могут быть различными по объему и целям, которые необходимо достичь в результате операции. Прогнозирование объема операции проводится по результатам обследования и совместным решением междисциплинарного консилиума EMC.
При подозрении на рак легкого и невозможности взятия материала для гистологического исследования может понадобиться диагностическая операция:
- Биопсия лимфатических узлов средостения.
Выполняется с использованием современных малоинвазивных технологий – видеомедиастиноскопии или видеоторакоскопии с малыми хирургическими разрезами (1-2 см) и минимальной травмой мышц и других тканей. Операция, как правило, хорошо переносится, длительность госпитализации редко превышает 2-3 дней.
- Биопсия легкого.
Также может быть выполнена видеоторакоскопическим доступом.
Существуют хирургические вмешательства, направленные на удаление плевры или индукцию плевродеза (спаечного процесса в плевральной полости). Проведение таких операций помогает купировать осложнения, связанные с поражением плевры метастазами и развитием рецидивирующего плеврита. Такие осложнения могут не только препятствовать проведению химиотерапии, но и угрожать жизни.
Выбор метода радикального хирургического лечения рака легкого зависит от локализации опухоли, ее размеров, признаков прорастания соседних структур и поражения лимфатических узлов. По объему можно выделить следующие операции:
-
Лобэктомия
-
Пневмонэктомия
-
Билобэктомия и лобэктомия с бронхопластикой или ангиопластикой
-
Сегментэктомия
При выявлении рака легкого на ранней стадии, когда нет прорастания соседних органов и размеры опухоли менее 5-6 см, возможно выполнение операции малоинвазивным доступом – с использованием видеоторакоскопии и малых разрезов.
Лучевая терапия рака легкого в EMC
Стереотаксическая радиохирургия SBRT (Stereotactic Body Radiation Therapy), известная также как SABR (Stereotactic Ablative Body Radiotherapy) является эффективным и безопасным неинвазивным методом лечения немелкоклеточного рака легкого 1 стадии, то есть опухолей размером до 5 см и с интактными лимфатическими узлами). Исследования показали равноценную общую выживаемость и локальный контроль над опухолью при сравнении хирургии (лобэктомии, стандарта лечения на сегодняшний день) и SBRT у пожилых или неоперабельных по сопутствующей патологии пациентов.
Используется от 3 до 5 сеансов (фракций) SBRT.
Центр лучевой терапии EMC под руководством главного радиотерапевта г. Москвы д-ра Нидаля Салима является одним из немногих отделений радиотерапии в мире, где метод стереотаксической радиохирургии используется при лечении первичных и метастатических опухолей легкого, печени, предстательной и поджелудочной железы, головного и спинного мозга и костей. В Центре установлены новейшие системы лучевой терапии EDGE и Truebeam, США, которые позволяют применять самые современные методы лучевого лечения.
В Центре установлены новейшие системы лучевой терапии EDGE и Truebeam, США, которые позволяют применять самые современные методы лучевого лечения.
Современные технологии в лучевой терапии, такие как IMRT, VMAT/RapidArc, IGRT, позволяют повысить точность облучения и сохранить окружающие опухоль здоровые ткани.
При облучении опухолей легкого, особенно локализующихся в нижних долях, наблюдается высокая подвижность очага на разных фазах дыхания. Применение технологии Gated RapidArc дает возможность облучать опухоль с учетом ее реального отклонения на всех фазах дыхания либо временно останавливать облучение при вдохе/выдохе за пределами заданного интервала.
Опухоль Панкоста лечение
Опухоль Панкоста (опухоль верхней борозды лёгкого) относится к немелкоклеточному раку легкого, который расположен в верхней части легкого. Опухоль затрагивает нервы, вызывая характерные симптомы, такие как:
-
Боль в плече или в руке
-
Мышечная слабость в руке
-
Гиперемия и чрезмерное потоотделение на одной стороне лица
По мере прогрессирования опухоли происходит опущение века (птоз), и полностью прекращается потоотделение на стороне поражения. При отсутствии отделенных метастазов, лечение опухоли Панкоста состоит из химиолучевой терапии и последующей операции.
При отсутствии отделенных метастазов, лечение опухоли Панкоста состоит из химиолучевой терапии и последующей операции.
Лечение рака легких IV стадии
Пациенты с IV стадией заболевания обычно получают лечение системными средствами или симптоматическую паллиативную терапию. У должным образом отобранных пациентов химиотерапия, молекулярная таргетная терапия и/или иммунотерапия могут увеличивать выживаемость без ущерба качеству жизни. Некоторым пациентам целесообразно проведение лучевой терапии и операции в качестве симптоматического паллиативного лечения.
У пациентов с IV стадией заболевания с отдаленными метастазами (например, в головном мозге, надпочечниках), благоприятное влияние может оказать резекция метастазов, а также агрессивное лечение первичной опухоли.
В Институте онкологии EMC созданы все возможности для оказания помощи пациентам с метастатическим раком легкого, в том числе применение новейших препаратов для иммунотерапии (Ниволумаб, Пемброзилумаб), которые продемонстрировали эффективность в повышении выживаемости у пациентов с IV стадией заболевания.
Для улучшения качества жизни пациентов с IV стадией заболевания применяется паллиативная терапия. Мы оказываем всю необходимую помощь тяжелобольным пациентам, включая адекватное обезболивание, проведение паллиативных операций и лучевой терапии, в том числе в экстренном режиме. Одышка в результате полного вовлечения центральных дыхательных путей может поддаваться паллиативному лечению путём удаления опухоли с помощью жёсткого или гибкого бронхоскопа и лазерной коагуляции или криотерапии. Стентирование может потребоваться для поддержания проходимости дыхательных путей, и чтобы создать условия для наружной дистанционной лучевой терапии.
Прогноз при раке легкого
Для пациентов с немелкоклеточным раком легкого фактором, который оказывает наибольшее влияние на прогноз, является стадия по TNM на момент обращения. Выживаемость прогрессивно снижается при более высокой степени заболевания, составляя, в среднем, от 59 месяцев для пациентов с IA стадией заболевания до четырёх месяцев для пациентов с IV стадией.
Клинические признаки на момент установления диагноза также позволяют прогнозировать выживаемость, независимо от стадии болезни. Большинство таких факторов было выявлено в исследованиях, которые преимущественно включали в себя пациентов с прогрессирующими или неоперабельными формами НМКРЛ. Было установлено, что низкая работоспособность и потеря веса связаны со сниженной выживаемостью. Сниженный аппетит, фактор, предшествующий потере веса, также имеет негативное прогностическое значение.
Наиболее важным прогностическим фактором у пациентов с МКРЛ служит степень распространенности заболевания на момент обращения. Для пациентов с ограниченными стадиями болезни средняя продолжительность жизни составляет от 15 до 20 месяцев, пятилетняя выживаемость составляет 10-13%. Для пациентов с прогрессирующими стадиями заболевания средняя продолжительность жизни составляет 8-13 месяцев, а пятилетняя выживаемость — 1-2%. Необходимо учитывать, что это среднестатистические показатели, прогноз в каждом отдельном случае индивидуален.
Факторы риска
Среди всех факторов риска развития рака легкого лидирующая роль принадлежит курению, которое «отвечает» за 90 % случаев развития рака легкого. Риск заболеть раком легкого у человека, выкуривающего пачку сигарет в день на протяжении 40 лет, в 20 раз выше, чем у некурящего. Наличие других канцерогенных факторов, как например, воздействие асбеста, дополнительно увеличивает риск заболевания.
Отказ от курения снижает вероятность развития заболевания, особенно у тех, кто бросил курить в возрасте до 30 лет. Но у бывших курильщиков риск заболеть раком легкого с возрастом выше, чем у тех, кто не курил никогда.
Среди других доказанных факторов риска:
-
Лучевая терапия на область легких. Риск развития рака легких выше у пациентов, которые ранее проходили лучевую терапию по поводу другого онкологического заболевания (в частности, у пациентов, которым проводилась лучевая терапия при раке молочной железы и лимфоме Ходжкина)
-
Экзогенные токсины (асбест, радон, мышьяк, хром, никель, ионизирующее излучение, полициклические ароматические углеводороды, а также пассивное курение).

-
Пневмосклероз (фиброз легких) – по результатам нескольких исследований, риск заболеть раком легких примерно в семь раз выше у пациентов, страдающих легочным фиброзом.
-
ВИЧ-инфекция
-
Генетическая предрасположенность
Роль алкоголя в развитии рака легких требует дальнейшего изучения. Попытки снизить заболеваемость у групп высокого риска с помощью диеты (антиоксидантов, фитоэстрогенов) пока не увенчались успехом. Напротив, в ходе одного из исследований было доказано, что прием курильщиками бета-каротина в составе витаминных препаратов привел к увеличению заболеваемости.
Скрининг рака легкого
Скрининг — исследование, позволяющее выявить заболевания до появления симптомов. До недавнего времени скрининг рака легкого не был широко распространен, так как по результатам нескольких исследований рентгенография грудной клетки и цитологическое исследование мокроты не приводили к снижению смертности от рака легкого.
За последние несколько лет появились более точные методы исследования, такие как низкодозовая компьютерная томография легких. Лучевая нагрузка при проведении данного исследования в 5-10 раз меньше по сравнению со стандартной КТ, что позволяет использовать метод в качестве скрининга.
В результате крупного исследования, проведенного Национальным институтом рака США было установлено, что низкодозовая КТ, проводившаяся курильщикам со стажем, позволила снизить смертность от рака легких на 20% по сравнению с курильщиками, которым в аналогичном режиме выполнялась рентгенография грудной клетки.
На сегодняшний день этот метод рекомендован специальной комиссией США по профилактике заболеваний (United States Preventive Service Task Force — USPSTF) для скрининга рака легкого людям в возрастной группе от 55 до 80 лет и которые при этом имеют 30-летнюю историю курения или бросили курить не более чем 15 назад.
EMC одним из первых центров в России внедрил в практику низкодозовую КТ легких для ранней диагностики рака легкого.
Какая продолжительность жизни при раке легких на разных стадиях?
Доктор Вадим БережнойОснователь платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Время чтения – 15 минут
ВОЗ сообщает, что каждый год рак легких диагностируется у более 2 миллионов человек. Это заболевание опасно, так как на первых стадиях проходит бессимптомно, а на последних степенях быстро прогрессирует и тяжело поддается лечению. Несмотря на это, болезнь возможно победить, даже при наличии метастазов. Специалисты MediGlobus собрали статистику выживаемости при раке легких из надежных источников – Американского общества онкологов, Национального института рака, Международной ассоциации изучения рака легких, Американской ассоциации легких. В этой статье вы узнаете сколько живут с раком легких на разных стадиях и какого образа жизни нужно придерживаться, чтобы не допустить рецидива.
 Читайте статью до конца и при необходимости – обращайтесь за лечением!
Читайте статью до конца и при необходимости – обращайтесь за лечением!
Слушать статью:
ПРОГНОЗ ЖИЗНИ НА 0 СТАДИИ РАКА ЛЕГКИХ
На стадии “in situ” раковые клетки присутствуют только в базальной мембране легких. По классификации TNM рак легких на 0 стадии обозначается как Tis, N0, M0.
Онкология легких 0 степени излечима. Пациентам показана малоинвазивная хирургическая операция – клиновидная резекция. Она значит, что врач удалит небольшой участок пораженной ткани органа.
Выживаемость пациентов с раком легких на 0 стадии составляет 100%. Риск рецидива – низкий, при условии регулярных осмотров и соблюдений рекомендаций врача.
Самая большая сложность для пациентов с этим диагнозом – вовремя обнаружить наличие раковых клеток. На 0 стадии болезнь не проявляет никаких симптомов. Менее 5% людей начинают лечение онкологии на этом этапе.
Как обнаружить рак легких на 0 стадии? Онкологический чекап или генетическое тестирование помогут выявить опухоль на стадии “in situ”. Люди в высокой группе риска должны проходить обследования каждый год. В группу с высоким риском развития рака легких входят активные и пассивные курильщики, работники шахт или текстильных фабрик, жители городов с загрязненным воздухом, а также люди, подвергшиеся радиации.
Люди в высокой группе риска должны проходить обследования каждый год. В группу с высоким риском развития рака легких входят активные и пассивные курильщики, работники шахт или текстильных фабрик, жители городов с загрязненным воздухом, а также люди, подвергшиеся радиации.
ЗАПИСАТЬСЯ НА ГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ
Во время генетического тестирования специалисты проанализируют более 300 генов, мутации которых могут привести к раку легких. Если у вас есть склонность к развитию онкологии, вы сможете начать лечение через 2 месяца и спасти свою жизнь.
Оставить заявку
ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ ПРИ РАКЕ ЛЕГКИХ 1 СТЕПЕНИ
На 1 стадии у человека обнаруживают раковые клетки только в легких; опухоль не распространяется на лимфоузлы. Существует несколько подтипов рака легких первой стадии: 1a и 1b. По классификации TNM они записываются как T1N0M0 или T2N0M0. Они отличаются размером опухоли.
Пятилетняя выживаемость при раке легких 1 стадии составляет:
Что значит 5-летняя выживаемость?
Этот показатель говорит сколько людей прожили 5 лет. Например, если 5-летняя выживаемость пациентов с раком легких 1 стадии составляет 92%, это значит, что 92% людей с этим диагнозом прожили как минимум 5 лет.
На показатель выживаемости влияют разные факторы: возраст, наличие других заболеваний, предыдущее лечение, образ жизни. Чем более молод пациент, тем лучше его прогнозы. Общая 5-летняя выживаемость пациентов с раком легких 1 степени в зависимости от возраста составляет:
Срок жизни с раком легких у людей, которые никогда не курили больший, чем у курильщиков. Около 70% некурильщиков проживают больше 5 лет без рецидивов после лечения онкологии.
ЗАПИСАТЬСЯ НА ЛЕЧЕНИЕ РАКА ЛЕГКИХ 1 СТЕПЕНИ
На 1 стадии рак легких излечим. Для этого врачи совмещают хирургию с лучевой терапией или химиотерапией. В клиниках за рубежом вы сможете пройти лечение по безопасным протоколам. Оставляйте заявку для записи к онкологу.
Записаться к онкологу
СКОЛЬКО ЖИВУТ ПРИ РАКЕ ЛЕГКИХ 2 СТАДИИ?
На 2 стадии опухоль достигает крупных размеров и может распространиться на дыхательные пути или лимфоузлы. Врачи выделяют две подстадии болезни – 2а и 2b. По классификации TMN вторая стадия рака легких отмечается как T2bN0M0 или T1aN1M0. На 2 стадии опухоль не метастазирует.
Опухоль в легких на 2 стадии хорошо поддается лечению. 5-летняя выживаемость при раке легкого 2 стадии составляет:
- подтип 2а – опухоль от 4 до 5 см, лимфоузлы не затронуты – 60%; подтип 2b – опухоль от 3 до 4 см, раковые клетки есть в лимфоузлах – 50%.
Продолжительность жизни больных раком легких зависит от пола. Прогнозы для женщин обычно лучше, чем для мужчин. Так, 60% женщин проживают 5 лет со второй стадией рака легких. Среди мужчин, пятилетний порог выживаемости преодолевают только 50% пациентов.
ЗАПИСАТЬСЯ НА ЛЕЧЕНИЕ РАКА ЛЕГКИХ 2 СТЕПЕНИ
Полное излечение опухоли в легких на 2 стадии возможно, однако это требует значительного опыта от доктора. В клиниках Турции, Германии, Израиля, Испании практикуют известные доктора Моше Инбар, Бартоломе Оливер, Фатих Агалар. С нашей помощью вы можете записаться к настоящему знатоку своего дела.
Записаться к онкологу
ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ ПРИ РАКЕ ЛЕГКИХ 3 СТАДИИ
На 3 стадии опухоль распространяется на лимфоузлы. Иногда она может поражать второе легкое или соседние доли. Раковые клетки обнаруживаются в бронхе, плевре, диафрагме.
Онкология легких третьей стадии делится на 3 подтипа: 3а, 3b и 3c. Выживаемость при раке легких 3 стадии составляет:
Показатели выживаемости тесно связаны с возможностью хирургического удаления опухоли – на стадиях 3b и 3c это практические невозможно. При неоперабельном раке легких только 13-26% живут больше 5 лет. Опытные врачи при наличии современного оборудования могут провести резекцию в таком сложном случае и это увеличит продолжительность жизни.
ЗАПИСАТЬСЯ НА ЛЕЧЕНИЕ РАКА ЛЕГКИХ 3 СТЕПЕНИ
Операция может увеличить продолжительность жизни при раке легких на 3 стадии. Зарубежные клиники принимают пациентов на лечение и могут вам помочь. В их распоряжении – роботизированная хирургия Да Винчи и продвинутые методы медикаментозной терапии.
Оставить заявку на операцию
СКОЛЬКО ЖИВУТ С РАКОМ ЛЕГКИХ НА 4 СТАДИИ?
Четвертая стадия рака легких означает, что опухоль метастазировала в мозг, печень, кости и другие органы. Она также делится на два подтипа: 4a и 4b.
Рак легких на последней стадии неизлечим. Врачи могут улучшить самочувствие человека. Однолетняя продолжительность жизни при раке легких 4 стадии составляет:
- стадия 4а – метастазы затронули один орган – 15%; стадия 4b – метастазы в нескольких органах – 1-5%.
Несмотря на неутешительные прогнозы, некоторым пациентам удается прожить несколько лет с этим диагнозом. Этот результат достигается за счет применения продвинутых методов лечения, которые доступны лишь в некоторых клиниках мира. В их число входит иммунотерапия, CAR-T терапия, протонная терапия.
ПОЛУЧИТЬ ПОМОЩЬ В ЛЕЧЕНИИ РАКА ЛЕГКИХ 4 СТАДИИ
Многие клиники отказываются брать на лечение пациентов с метастатическим раком легких. Мы поможем вам найти госпиталь, где врачи предоставят необходимое лечение. С MediGlobus вы можете записаться на таргетную и протонную терапию. С нашей поддержкой вы запишитесь в клинику как можно быстрее. Оставьте свои контакты и мы перезвоним вам в течение 30 минут.
Записаться на лечение
СТАТИСТИКА ВЫЖИВАЕМОСТИ ПРИ РАЗНЫХ ВИДАХ РАКА ЛЕГКИХ
Рак легких делится на 2 вида: мелкоклеточный и немелкоклеточный. Немелкоклеточный рак легких встречается у 85% пациентов. Общая пятилетняя выживаемость людей с диагнозом немелкоклеточного рака легких составляет:
Немелколеточный рак легких делится на 3 типа: аденокарциному, плоскоклеточную карциному и крупноклеточную нейроэндокринную карциному.
ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ ПРИ АДЕНОКАРЦИНОМЕ
В 50% случаев у людей диагностируют аденокарциному. 5-летняя продолжительность жизни людей с аденокарциномой легких составляет:
ВЫЖИВАЕМОСТЬ ПРИ ПЛОСКОКЛЕТОЧНОМ РАКЕ
Плоскоклеточный рак легких составляет 25% от всей случаев онкологий этого органа. Общая продолжительность жизни пациентов с плоскоклеточным раком легких составляет 24%. Пятилетняя выживаемость по степени распространенности:
ВЫЖИВАЕМОСТЬ ПРИ КРУПНОКЛЕТОЧНОЙ ОПУХОЛИ
Крупноклеточная нейроэндокринная опухоль встречается у 10% пациентов с раком легких. Она агрессивная и требует незамедлительного лечения. Пятилетняя выживаемость пациентов с нейроэндокринным раком легких:
ВЫЖИВАЕМОСТЬ ПРИ МЕЛКОКЛЕТОЧНОМ РАКЕ
Мелкоклеточный рак относительно редкий и встречается у 15% пациентов. Он тяжелее поддается лечению. Пятилетняя выживаемость при мелкоклеточном раке легких составляет:
ПРОЙТИ ЛЕЧЕНИЕ РАКА ЛЕГКОГО
В иностранных клиниках предлагают лечение всех видов опухоли в легких. Наши врачи-координаторы могут связаться с клиникой и запросить индивидуальную программу лечения вместе с прайсом. Оставляйте свой номер телефона и наш координатор вам перезвонит.
Связаться с координатором
КАКОЙ МЕТОД ЛЕЧЕНИЯ ЛУЧШЕ ВСЕГО ПРОДЛЕВАЕТ ЖИЗНЬ ПАЦИЕНТОВ С РАКОМ ЛЕГКИХ?
Хирургическое удаление опухоли является самым надежным и безопасным методом лечения рака легких. Существует четыре типа операции при этом диагнозе:
На всех стадиях онкологии выживаемость связана с количеством удаленной легочной ткани. Чем большая часть легких сохраняется, тем дольше ожидаемая продолжительность жизни пациента. Количество удаленной ткани зависит от степени распространения опухоли. В зависимости от степени запущенности заболевания, пациенту назначают химиотерапию, радиотерапию или более серьезное лечение.
Тактика лечения рака легких с наилучшей выживаемостью на 0 стадии
При 0 стадии патологии проводят клиновидную резекцию, без химиотерапии или радиотерапии. Этого достаточно, вылечить пациента и вывести его в 10-летнюю ремиссию или дольше.
Тактика лечения рака легких с наилучшей выживаемостью на 1 стадии
На 1 стадии рака легких рекомендуется лобэктомия для молодых пациентов и пневмонэктомия для людей старше 70 лет. Более 80% пациентов проживают 5 лет и больше после хирургического вмешательства, совмещенного с химиотерапией. Показатель 5-летней выживаемости при клиновидной резекции опухоли в легком на 1 стадии составляет 74%.
Тактика лечения рака легких с наилучшей выживаемостью на 2 стадии
Процент выживаемости после лобэктомии при раке легких составляет 31%, а после пневмонэктомии – 15%. Прием химиотерапии после операции увеличивает продолжительность жизни. 78% пациентов, которые прошли лобэктомию и химиотерапию проживают больше 5 лет. Пятилетняя выживаемость пациентов, которым полностью удалили легкое и провели химиотерапию составляет 62%.
Тактика лечения рака легких с наилучшей выживаемостью на 3 стадии
Сочетание предоперационной химиотерапии и лобэктомии является предпочтительной тактикой лечения. Около 33% пациентов проживают больше 5 лет после лечения рака легких на стадии 3a. При сочетании неоадъювантной химиотерапии и пневмонкэтомии процент выживаемости составляет 20,7%.
Тактика лечения рака легких с наилучшей выживаемостью на 4 стадии
Проведение операции при 4 степени рака легких бывает невозможно. Традиционное лечение – это сочетание химиотерапии и радиотерапии. Однако в этом случае пятилетняя выживаемость пациентов очень низкая.
Современная зарубежная медицина предлагает альтернативные тактики лечения при помощи таргетной терапии, иммунотерапии и протонной терапии. Они позволяют продлить жизнь людей с метастатическими опухолями в легких.
Выживаемость пациентов после курсов протонной терапии
Протонная терапия – лечение путем облучения опухоли протонами. По сравнению с лучевой терапией она не вызывает сухости во рту и проблем с ЖКТ. 3-летняя выживаемость пациентов с неоперабельным раком легких после протонной терапии составляет 58%. Этот метод лечения достаточно безопасен для пациентов старше 65 лет.
Выживаемость пациентов после курса таргетной терапии
Препараты таргетной терапии используют вещества, которые способны распознавать раковые клетки и уничтожать их. Успех лечения достигается за счет распознавания генетических мутаций, которые свойственны опухоли. В число наиболее эффективных таргетных препаратов для лечения рака легких входят Тарцева, Ксалкори, Зикадия. Журнал Journal of Thoracic Oncology опубликовал исследование, которое показало, что после курса лечение препаратом Ксалкори, 50% пациентов с опухолью легких 4 стадии прожили больше 5 лет.
Выживаемость пациентов после курса лечения Кейтрудой
Иммунотерапий Кейтрудой считается революционным методом помощи пациентам. Пембролизумаб вдвое увеличивает продолжительность жизни людей с метастатическим немелкоклеточным раком легких. Так, около 32% пациентов прожили больше после курса Кейтруды. В это время только 16% пациентов преодолели 5-летний порог выживаемости после химиотерапии. Терапия Кейтрудой подходит пациентам с высокой активностью белка PD-L1. Для определения показаний нужно пройти специальное генетическое тестирование.
ПРОЙТИ ЛЕЧЕНИЕ РАКА ЛЕГКИХ
Врачи-координаторы MediGlobus помогут вам записаться на операцию, химиотерапию, радиотерапию, иммунотерапию, протонную терапию или таргетную терапию. Оставьте заявку, чтобы получить помощь специалиста.
Записаться на лечение
КАК ЖИТЬ С РАКОМ ЛЕГКИХ?
Продолжительность жизни после успешного лечения рака легких зависит от образа жизни пациента. Доктор Линн Элдридж предлагает соблюдать такие правила, чтобы продлить жизнь при раке легких:
Резюме
На 0 стадии выживаемость пациентов с немелкоклеточным раком легких составляет 100%. На 1 стадии от 68% до 92% пациентов проживают 5 лет. На 2 стадии этот показатель снижается до 50-60%. При раке легких 3 степени выживаемость пациентов составляет 12-36%. На 4 стадии от 2% до 15% пациентов преодолевают пятилетний порог выживаемости. Общая выживаемость людей с аденокарциномой составляет 40%; при плоскоклеточном раке – 24%; при крупноклеточных нейроэндокринных опухолях – 36%. При мелкоклеточном раке легких 40% людей проживают 5 лет на 1 стадии, 27% пациентов – при 2 стадии, 16% людей – на 3 степени и только 3% пациентов – на последней стадии. Лобкэтомия является самым предпочтительным методом хирургии при раке легких. В сочетании с химиотерапией она повышает выживаемость пациентов на 47%. Некоторые факторы могут повысить шансы на долгую жизнь. Так, люди, которые никогда не курили, имеют большую выживаемость, а женщины с раком легких живут на 10-20% дольше, чем мужчины. Возраст также важен: пациенты до 50 лет имеют большую продолжительность жизни после лечения, чем люди после 65 лет. Чтобы продлить жизнь после успешной терапии рака легких, нужно бросить курить, посещать врача каждые 3 месяца и сдавать анализы, соблюдать диету, снизить употребление добавок с бета-каротином и сохранять оптимистичный настрой.Если у вас остались вопросы – свяжитесь с нашими координаторами. Мы проконсультируем вас о методах лечения и посоветуем клинику, подходящую по расположению и бюджету. Мы понимаем, что вам нужна помощь как можно скорее, поэтому отвечаем оперативно. .
Получить бесплатную консультацию
Источники:
- 1. Stages of Lung cancer
- 2. ASCO – Stages of non-small lung cancer
- 3. Lung cancer on zero stage
- 4. Lung cancer on 1 stage
- 5.Lung cancer on 2 stage
- 6. Lung cancer on 3 stage
- 7. Lung cancer on 4 stage
- 8. Life with lung cancer
- 9. Adenocarcinoma survival rate
- 10. Squamous cell carcinoma survival rate
- 11. Large-Cell Neuroendocrine Lung Cancer survival rate
- 12.Small-cell lung cancer survival rate
- 13. Keytruda and lung cancer survival rate
- 14.Proton therapy and lung cancer
Доктор Вадим Бережной
Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Альбина ГоловинаРаботает в сфере медицинского копирайтинга 2 года. Учится на аспирантуре факультета психологии. Автор нескольких научных публикаций в области клинической психологии. Дополнительно изучает физиологию ЦНС, нейропсихологию и психиатрию. В свободное время изучает практики mindfulness и проводит психологические консультации.
Похожие посты
Как работает вирусная терапия — прорыв в лечении рака кожи
Читать дальшеПри коронавирусе стали чаще выявлять рак легкого COVID-19 у пациентов могли не найти, но замечали онкологию
— Константин Константинович, какое место в структуре онкозаболеваний занимает сегодня рак легкого?
— Он уверенно стоит на втором месте по распространенности среди злокачественных новообразований, уступая только раку молочной железы. Однако у мужчин он стоит на первом месте, у женщин — на шестом. В год в нашей стране раком легкого заболевает примерно 55–60 тысяч человек.
— С чем связана столь высокая распространенность этого вида патологии?
— С активным курением. Ведь курение остается ведущим предрасполагающим фактором развития рака легкого. Первая в мире монография, посвященная этому заболеванию, вышла в 1912 году, и ученые долго размышляли над вопросом, имеет ли смысл выпускать научный труд, посвященный такому редкому заболеванию? Но буквально за век мода на курение перевела опухоль из одной из самых редких патологий в одну из самых частых.
— Неужели раньше так много не курили? Ведь табак на Руси появился еще при Петре Первом…
— На самом деле вред табакокурения был доказан только в середине 60-х годов прошлого века. Все его варианты, включая и махорку, и никотин, вредны. Но вариант потребления табака может вызывать разные виды злокачественного образования: легкого, ротоглотки, губы и пр. Вообще, влияние табакокурения в развитии опухолей доказано при 12 различных локализациях (это и рак желудка, и кишки, и мочевого пузыря).
— Какова статистика смертности при раке легкого сегодня?
— Она остается очень печальной. Каждый второй пациент, которому установлен такой диагноз, умрет в течение года с момента постановки диагноза.
— Столь высокая смертность объясняется выявлением заболевания на запущенных стадиях?
— Да, конечно. На ранних стадиях выявляется лишь около четверти пациентов. А на 3–4-й стадии — уже 75%.
— Какую роль в повышении раннего выявления заболевания могут играть регулярные профосмотры?
— Рак легкого — достаточно коварное заболевание, которое долго может протекать без симптомов. И первые клинические проявления возникают либо в связи с образованием отдаленных метастазов, либо уже с распространением опухоли на окружающие структуры — средостение, сердце, крупные сосуды, грудную стенку, что уже классифицируется как распространенный процесс. Поэтому у нас такой маленький процент выявления рака легкого на ранних стадиях. Есть такое понятие «опухоль не визуальной локализации». То есть это не такая опухоль, как, например, рак кожи или молочной железы, где шансы обнаружить злокачественный процесс на ранней стадии намного выше.
— И все-таки — какие нужно проходить исследования, чтобы поймать болезнь как можно раньше?
— Скрининговых программ на уровне государства у нас нет. Да и в мире особо нет. Ежегодные осмотры, диспансеризация — хороший стандарт. Единственное — для выявления ранних симптомов рака легкого нужно проходить регулярные рентгенографические исследования, флюорографии маловато. А если есть подозрения на рентгене, надо назначать пациенту компьютерную томографию (КТ).
— Насколько доступна сегодня низкодозная КТ?
— Низкодозная КТ — это элемент скрининговых программ, ее надо проходить раз в год. Но на уровне государства этих программ нет. Есть только региональные пилотные проекты.
— Каков на сегодня портрет среднестатистического пациента — возраст, пол, сопутствующие заболевания, факторы риска?
— Средний возраст пациента — 65 лет. Это мужчина, курильщик со стажем курения не менее 15 лет. Сопутствующие патологии, как правило, легочные и сердечные (ХОБЛ, ишемическая болезнь сердца).
— Факторы риска, кроме курения, существуют?
— Да, работа на вредных производствах, в загрязненных помещениях, например, работа с асбестом. Эти профвредности давно известные, таких сотрудников хорошо наблюдают. Генетических факторов предрасположенности к раку легкого не существует. Сказать, что можно посмотреть такой-то маркер и выявить высокую вероятность заболевания, нельзя — таких маркеров нет. Иными словами, болезнь не наследуется.
— Как повлияла на выявляемость заболевания пандемия?
— В цифровом значении не могу сказать. Но на уровне ощущений — действительно, сегодня появилось больше пациентов с ранними бессимптомными опухолями легких, которые стали случайными находками во время поисков ковида. Ковид не обнаруживали, а вот немые изменения в легких выявляли. И хотя не все изменения оказались раком легкого, был повод к тому, чтобы разобраться в ситуации. Ведь изменения могут быть и не опухолевой природы.
— Рак легкого бывает мелкоклеточным и немелкоклеточным. В чем разница?
— Да, есть две большие подгруппы. На долю немелкоклеточного приходится 85% всех случаев. Они различаются агрессивностью. Так, мелкоклеточный более агрессивен, зато лучше поддается лечению лучевой и химиотерапией. За счет более агрессивного течения мелкоклеточный рак более активно метастазирует, что выливается в более разнообразную симптоматику и более агрессивное распространение. Этот вид рака практически никогда не оперирует, ибо даже на ранних стадиях это не имеет смысла. Если говорить о немелкоклеточном, то тут основные надежды связаны с возможностью проведения радикального хирургического вмешательства, после которого пациенты могут надеться на выздоровление, однако это удел в первую очередь тех, у кого болезнь обнаружена на первой и второй стадии.
— Какое современное лечение существует?
— Сегодня в лечении таких заболеваний применяется системный метод воздействия (химиотерапия) и локальный (лучевая терапия, хирургия). Основные изменения сегодня произошли в возможностях системного воздействия. До последних лет химиотерапия позволяла надеться на краткосрочный контроль над болезнью. Но в начале века появилась таргетная терапия, которая реализовала концепцию перевода смертельно опасного заболевания в хроническое. Оказалось, что каждая возникающая опухоль индивидуальна и несет в себе ряд характерных только для нее генетических поломок. Поэтому начали разрабатываться лекарства, действующие избирательно на клетки, несущие именно эти поломки. Например, немелкоклеточный рак легкого может быть обусловлен мутацией в гене EGFR (рецептор эпидермального фактора роста), с такой мутацией у нас выявляется около 3 тысяч пациентов в год — и под эту мишень разработаны препараты. У пациентов с такой мутацией химиотерапевтические препараты будут менее эффективны, им нужны таргетные. Сегодня при раке легкого известно уже 4 мишени, и под каждую есть набор препаратов. В разработке еще 3–4 мишени.
— Доступны ли новые лекарства?
— Могу сказать, что в последние годы их доступность стала значительно выше. Ситуация изменилась кардинально, даже в регионах. Главное — чтобы их умели правильно назначать. Ведь долгое время их не было, а назначение таких средств требует квалификации, знаний и опыта применения. Но опыт, конечно, придет вместе с применением. Так что сегодня региональное здравоохранение привыкает к тому счастью, которое на них свалилось. И есть все шансы, что в ближайшие годы мишеней появится еще больше, и мы научимся лечить пациентов и сможем переломить ту печальную статистику по смертности, которая есть сегодня. Ну а пока могу посоветовать одно: не курите.
Источник: https://www.mk.ru/social/health/2020/10/20/pri-koronaviruse-stali-chashhe-vyyavlyat-rak-legkogo.html?fbclid=IwAR2UAJwxxawyyLzjvGqc831qQuGhY6B7t0oBjeI7MLb2AMBW8TAOSSBghS4
Рак легкого — диагностика и лечение рака легких | Клиника «Оберіг»
Рак легкого – это заболевание, при котором злокачественная опухоль образуется из клеток, выстилающих внутреннюю поверхность легкого и бронхов. Несмотря на достижения современной медицины, рак легкого остается смертельно опасным заболеванием. Онкологи утверждают, что рак легких – один из наиболее коварных «убийц» среди злокачественных опухолей. Преимущественно, его жертвами становятся мужчины.
Но в последние годы все больше женщин заболевают раком легких. Это связано с распространением курения среди представительниц прекрасного пола. Женщины начали массово курить в 1970-х и 1980-х годах. Десятилетия вредной привычки повышают вероятность повреждения ДНК в клетках, которые дают начало опухоли легких. Поэтому в наше время женщины постепенно начинают догонять мужчин в заболеваемости раком легких.
Опухоль на ранней стадии в большинстве случаев не вызывает никаких симптомов. Это ещё одна причина высокой смертности. Зачастую пациенты обращаются к врачу слишком поздно, когда им уже невозможно помочь. Поэтому важную роль в борьбе с заболеванием играют профилактические осмотры, которые позволяют своевременно выявить опухоль, спасти жизнь и здоровье человека.
ПРИЧИНЫ ОПУХОЛИ ЛЕГКОГО
Причина любого рака – повреждение ДНК клеток под воздействием канцерогенов. В случае рака легкого – это, прежде всего, табачный дым. Около 80% пациентов являются курильщиками. Чем дольше стаж курения – тем больше риск заболевания. При этом отказаться от вредной привычки никогда не поздно! Риск рака легкого начинает стремительно снижаться после того, как вы навсегда попрощаетесь с сигаретами.
Ещё одна важная причина рака легких и бронхов – работа на вредных производствах, где человек вдыхает пыль и различные токсические вещества. Микроскопические частицы способны проникать в глубокие слои легкого, повреждая клетки. Повышенный риск имеют шахтеры, рабочие деревообрабатывающего, металлургического, фосфатного и асбестоцементного производства.
ФОРМЫ И СТАДИИ РАКА ЛЕГКОГО
Если вспомнить учебник анатомии, то можно понять, что бронхи и легкие являются тесно связанными органами. Бронхи входят в легкие и разветвляются в них, как крона дерева. Рак бронхов и легкого обычно объединяют под названием «бронхопульмональный рак». В зависимости от расположения опухоли выделяют разные формы рака легких. Центральный рак зарождается в слизистой оболочке крупного бронха, а периферический – в ткани легкого.
Как и многие другие онкологические заболевания, рак легкого может давать метастазы. В первую очередь поражаются расположенные рядом с первичной опухолью лимфатические узлы. В дальнейшем метастазы могут возникнуть в печени, почках, костях, головном мозге и надпочечниках. Степени распространения раковых клеток легкого определяют стадию заболевания.
Опухоль при I стадии рака находится в пределах бронхов или легкого. II стадия характеризуется появлением единичных метастазов в ближайших лимфатических узлах. При III стадии опухоль захватывает несколько долей легкого или прорастает в соседние бронхи, а метастазы поражают отдаленные лимфатические узлы. IV стадия определяется, когда опухоль выходит за пределы легкого и распространяется на другие органы.
СИМПТОМЫ И ПРИЗНАКИ РАКА ЛЕГКИХ
Опухоль легкого вызывает симптомы, которые являются неспецифичными. Это означает, что они характерны для многих заболеваний органов дыхания. Поэтому сложно выделить какие-либо однозначные признаки рака легких. В результате больные часто не обращаются к врачу своевременно. А при ранней стадии рака легкого у 15% из них симптомы вообще отсутствуют.
Как же распознать рак легких? Немедленно обращайтесь к врачу, если наблюдаются первые симптомы рака легкого и бронхов:
- Появление постоянного кашля
- Изменения в характере хронического «кашля курильщика»
- Кровохарканье (даже малое количество крови в мокроте)
- Одышка
- Боли в груди
Ранние признаки рака легкого существенно зависят от расположения опухоли. Центральный рак (рак бронхов) вызывает симптомы вскоре после начала заболевания. Рост опухоли сопровождается болью, кашлем, мокротой и другими проявлениями нарушения работы дыхательной системы.
Признаки рака бронхов пропустить сложно. Периферическая форма более коварна. Поскольку в легочной ткани отсутствуют болевые окончания, ранние симптомы рака легких человек не способен ощутить. Первые признаки рака легких возникают тогда, когда опухоль прорастает в бронхи, плевру и соседние органы.
РАННЯЯ ДИАГНОСТИКА РАКА ЛЕГКИХ
Первый шаг в диагностике рака легкого – это рентгенограмма или знакомая всем флюорография. Не игнорируйте ежегодный осмотр у врачей. Не думайте, что флюорографию вам навязывают. Это важный метод профилактики и диагностики рака легкого и других опасных заболеваний. Если на снимке обнаруживается новообразование, то диагноз «рак легкого» не снимается, пока не будет доказано, что это не так.
Не затягивайте посещение врача. При подозрении на диагноз «опухоль легкого» нужно срочно обратиться к профильным специалистам — торакальному хирургу и онкологу. Современные методы диагностики рака легких позволяют быстро подтвердить или опровергнуть наличие заболевания.
При помощи компьютерной томографии (КТ) распознаются небольшие опухоли, которые не видны на рентгенограмме. В диагностике рака бронхов и легких на ранних стадиях большое значение имеет биопсия – анализ образца легочной ткани. Получить его можно несколькими способами.
Биопсия может быть выполнена во время бронхоскопии. В этом случае врач вводит в легкие бронхоскоп через гортань. В Универсальной клинике «Оберіг» используется видеофибробронхоскопия с максимальной четкостью изображения и забором образца для гистологического исследования.
Прогрессивный и малотравматичный метод диагностики опухоли легкого – видеомедиастиноскопия. Торакальный хирург делает небольшой разрез в основании шеи, через который вводит хирургические инструменты и забирает на анализ ткани лимфатических узлов в области легких. Также биопсия может быть проведена методом трансторакальной пункции. При этом образцы извлекаются через иглу, которой прокалывают грудную клетку под контролем рентгена, УЗИ или КТ.
МЕТОДЫ ЛЕЧЕНИЯ РАКА ЛЕГКИХ
Врач выбирает программу лечения опухоли легкого в зависимости от формы и стадии заболевания. Три основных способа борьбы с раком – это хирургическая операция, лучевая терапия и химиотерапия. Хирургическое лечение рака бронхов и легких традиционным способом предполагает разрез грудной клетки.
Универсальная клиника «Оберіг» оснащена оборудованием для проведения малоинвазивных операций, которые существенно легче переносятся пациентом и дают меньше осложнений. Современная технология VATS (Video-Assisted Thoracic Surgery) позволяет проводить хирургическое вмешательство, сделав лишь небольшие «проколы». Через них вводятся инструменты и видеокамеры для удаления опухоли и окружающих ее тканей легкого.
Масштаб оперативного вмешательства зависит от распространенности злокачественного процесса. При раке на ранних стадиях проводится удаление только небольшой части легкого. В более сложных случаях необходимо хирургическое удаление доли легкого или целиком всего органа. Химиотерапия и радиотерапия могут назначаться как самостоятельно, так и в сочетании с другими методами. Если рак легких обнаружен своевременно, шансы на излечение высоки!
ПРОФИЛАКТИКА РАКА ЛЕГКИХ
Основное правило профилактики – отказ от курения! Также избегайте пассивного курения. Вдыхание табачного дыма, даже если вы сами не курите, повышает риск заболевания. Но сигареты – не единственный фактор риска.
Толчком к развитию рака может быть работа на вредном производстве, загрязненный воздух. Постарайтесь максимально защитить себя от этого. Профилактика рака легкого также включает правильное питание с большим количеством фруктов и овощей. Содержащиеся в них антиоксиданты противостоят повреждению клеток легкого.
Ежегодно проходите рентгенологическое обследование органов грудной клетки! Берегите свое здоровье! Стандартная крупноформатная рентгенографиясущественно информативнее флюорографии, а лучевая нагрузка ниже. В большинстве развитых стран используют компьютерную томографию (КТ) для ежегодного скрининга. В Универсальной клинике «Оберіг» можно пройти как крупноформатную рентгенографию, так и КТ.
Даже при таком грозном заболевании ранняя диагностика и лечение позволяют добиться выздоровления. Если у вас заподозрен рак легкого, запишитесь на прием к торакальному хирургу или пульмонологу Торакопульмононологического центра Универсальной клиники «Оберіг», позвонив по номеру:
(044) 521 30 03
Лабораторные маркеры рака легких
Комплексное лабораторное исследование, направленное на определение наличия злокачественного новообразования легких, степени его распространенности, оценки эффективности лечения и возможности развития рецидивов.
Синонимы русские
Рак легкого; злокачественные опухоли легкого; комплексное лабораторное обследование.
Синонимы английские
Lung cancer; comprehensive laboratory examination.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 24 часов до исследования.
Общая информация об исследовании
К лабораторным маркерам рака легких относятся некоторые специфические вещества, определение которых позволяет предположить наличие злокачественного новообразования, степень его распространенности и оценить проводимое лечение. Это опухолевые маркеры, которые чаще всего являются сложными белками или пептидами, гликопротеинами. Они синтезируются опухолевыми клетками или окружающими опухоль нормальными клетками в повышенных концентрациях.
Раковый эмбриональный антиген (РЭА) является гликопротеином и относится к классу онкоэмбриональных маркеров. Преимущественно синтезируется в органах желудочно-кишечного тракта плода, а после рождения его уровень резко снижается. Он также обнаруживается в тканях органов пищеварения и у взрослых людей, но в значительно меньшем количестве. Определение уровня РЭА используется для диагностики ряда злокачественных опухолей. К ним относятся рак толстой и прямой кишки, поджелудочной железы, легкого, молочной железы. В большинстве случаев РЭА является показателем аденогенных опухолей, в частности аденокарциномы и крупноклеточного рака легкого. Его определение используется в составе комплексной диагностики для определения стадии заболевания, оценки эффективности лечения у больных с раком легкого с исходно повышенным уровнем РЭА, для мониторинга возможности развития рецидивов рака. Следует отметить, что концентрация РЭА увеличивается у 20-50 % больных с доброкачественными заболеваниями кишечника, поджелудочной железы, печени и легких, при пневмонии, бронхитах, туберкулезе, эмфиземе, муковисцидозе, а также при некоторых аутоиммунных заболеваниях. Показатель повышается при обострении болезни, но в случае улучшения самочувствия возвращается к норме. При злокачественном же процессе уровень РЭА неуклонно растет на протяжении всего периода заболевания.
Антиген плоскоклеточной карциномы (SCCA) является гликопротеином с молекулярной массой 48 кДа и маркером плоскоклеточного рака. В норме небольшое количество антигена вырабатывается внутри клеток эпителия кожи, шейки матки, анального канала и не высвобождается во внеклеточное пространство. При плоскоклеточном раке отмечается увеличение секреции антигена опухолевыми клетками, что, возможно, играет роль в процессах инвазии и метастазирования карциномы. Повышение концентрации антигена может отмечаться при плоскоклеточном раке шейки матки, пищевода, легкого, влагалища. У больных плоскоклеточным раком легкого чувствительность показателя составляет 50-60 %, а специфичность около 80 %. Определение данного маркера может быть использовано для оценки эффективности лечения у больных с раком легкого с исходно повышенным уровнем SCCA и для мониторинга больных плоскоклеточным раком для доклинического выявления рецидивов заболевания. Показатель может быть повышен при некоторых доброкачественных заболеваниях кожи, при туберкулезе.
Нейронспецифическая энолаза (НСЕ/NSE) – это одна из структурных разновидностей фермента энолазы, участвующего в процессах гликолиза. У плода он обнаруживается в клетках нервной и легочной ткани, у взрослых людей – преимущественно в нейроэндокринных образованиях. Повышение NSE часто наблюдается при мелкоклеточном раке легкого, а также при медуллярном раке щитовидной железы, феохромоцитоме, нейроэндокринных опухолях кишечника и поджелудочной железы и нейробластоме. Мелкоклеточный рак легкого (МКРЛ) по сути является анапластическим процессом и обладает нейроэндокринными свойствами. Например, для этого вида рака характерна секреция адренокортикотропного гормона (АКТГ), антидиуретического гормона (АДГ), а также нейронспецифической энолазы. Другие виды рака легкого объединяются под общим названием немелкоклеточный рак легкого (НМРЛ). Эта группа заболеваний, в отличие от МКРЛ, не обладает нейроэндокринными свойствами, и для нее не характерна продукция избыточного количества NSE. Данный маркер обладает высокими показателями чувствительности (44-87 % в зависимости от стадии заболевания) и специфичностью для мелкоклеточного рака легкого. Его определение рекомендуется для дифференциальной диагностики опухолей легкого и для оценки эффективности лечения. Данный лабораторный показатель оказывается особенно полезным, когда рутинные методы диагностики не могут быть выполнены из-за тяжести заболевания или сопутствующей патологии.
Раковый антиген СА 19-9 является высокомолекулярным гликопротеином, который в норме вырабатывается клетками эпителия желудочно-кишечного тракта. Его уровень повышается практически у всех пациентов с опухолями желудочно-кишечного тракта и особенно поджелудочной железы.
Раковый антиген СА 72-4 – это высокомолекулярный муциноподобный гликопротеин, который вырабатывается во многих тканях плода и в норме практически не обнаруживается у взрослого человека. Производство СА 72-4 увеличивается практически у всех пациентов со злокачественными опухолями железистого генеза, особенно при раке желудка, муцинозном раке яичников. Уровень представленных маркеров может быть повышен при опухолях иной локализации: колоректальном раке, раке легких, а также заболеваниях печени (гепатитах и циррозе), доброкачественных опухолях яичников, воспалительных заболеваниях желудочно-кишечного тракта. Они являются неспецифичными показателями и могут использоваться в качестве дополнительных маркеров злокачественных процессов в комплексной диагностике рака легких.
Для чего используется исследование?
- Для комплексной диагностики рака легкого;
- для дифференциальной диагностики форм рака легкого: плоскоклеточная карцинома, мелкоклеточный, немелкоклеточный рак легкого;
- для оценки стадии онкологического процесса;
- для оценки эффективности лечения (оперативного и консервативной терапии) у больных с раком легкого;
- для мониторинга возможности развития рецидивов рака легкого в процессе длительного наблюдения после завершения лечения.
Когда назначается исследование?
- При подозрении на злокачественное новообразование легких или иных локализаций и мониторинге состояния в процессе диагностированного заболевания.
Что означают результаты?
Референсные значения
Отдельно для каждого показателя, входящего в комплекс:
Причины повышения:
- рак легкого;
- рак другой локализации: рак толстой и прямой кишки, поджелудочной железы, молочной железы, рак шейки матки, влагалища, пищевода, нейробластома, феохромацитома;
- заболевания легких: пневмония, бронхит, туберкулез, эмфизем, муковисцидоз;
- заболевания печени: гепатит, цирроз, печеночная недостаточность;
- хроническая почечная недостаточность;
- панкреатит;
- аутоиммунные заболевания.
Причины понижения:
- хирургическое удаление злокачественной опухоли;
- успешная терапия онкологического заболевания;
- ремиссия доброкачественной опухоли.
Что может влиять на результат?
- Пол;
- возраст;
- наличие сопутствующей патологии;
- терапевтическое и хирургическое лечение.
Важные замечания
- Отрицательный результат анализа не исключает наличия онкологического заболевания легких.
- Диагностика рака легкого является комплексной и основана на клинических проявлениях заболевания, результатах лабораторных и инструментальных исследований.
Кто назначает исследование?
Онколог, пульмонолог, терапевт, врач общей практики, хирург.
Литература
- Долгов В.В., Меньшиков В.В. Клиническая лабораторная диагностика: национальное руководство. – Т. I., Т. II – М. : ГЭОТАР-Медиа, 2012.
- Fauci, Braunwald, Kasper, Hauser, Longo, Jameson, Loscalzo Harrison’s principles of internal medicine, 17th edition, 2009.
- Jaume Trape et al. Increased plasma concentrations of tumour markers in the absence of neoplasia. Clin Chem Lab Med 2011;49(10):1605–1620.
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. – Saunder Elsevier, 2008.
- Hayat, M.A. Methods of Cancer Diagnosis, Therapy, and Prognosis. Springer Dewey, 2010.
Причины рака легкого. Booking Health
Рак легкого – смертельно опасное заболевание, которое даже сегодня, в условиях стремительного развития медицины, крайне тяжело поддается лечению. Встречается эта онкопатология очень часто, занимая одно из первых мест по распространенности в большинстве стран мира. Все мы знаем главную причину, из-за чего образуется рак легких – это курение. Но есть масса других факторов риска, влияющих на вероятность этой болезни.
Эта статья о том, откуда берется рак легких, как на его риск влияет курение, почему рак легких появляется не у всех курильщиков. Мы расскажем вам, какие причины рака легких нужно устранить в первую очередь, чтобы минимизировать вероятность развития этого заболевания.
Курение – причина рака легких
По причине курения рак легких развивается чаще всего. Курящий человек имеет риск заболеть в 20 раз выше, чем некурящий. Патология развивается вследствие постоянного воздействия на слизистую оболочку бронхов канцерогенных веществ. Всего таковых в табачном дыме содержится около 60. Самые опасные из них: радон, бензпирен, нитрозамин. Кроме того, сигареты угнетают иммунитет, а потому организму становится сложнее противостоять онкологическим процессам.
Взаимосвязь курения и рака легких подтверждает статистика. В настоящее время это заболевание является первой в мире причиной смерти мужчин от онкологических патологий.
Вероятность заболеть на протяжении жизни:
- Для некурящего мужчины – 1,3%
- Для курящего мужчины – 17,2%
- Для некурящей женщины – 1,4%
- Для курящей женщины – 11,6%
На то, как быстро развивается рак легких при курении, не влияет, насколько крепкие сигареты курит человек. Если он предпочитает легкие сигареты с пониженным содержанием никотина и смол, вероятность онкозаболевания не снижается. Это связано с тем, что рак легких во время курения вызывает не никотин, а бензпирен и другие канцерогены.
На то, как быстро развивается рак легких от курения, не влияет:
- Курите вы сигареты, сигары, кальян или трубку
- С фильтром ваши сигареты или без
- Какие торговые марки предпочитаете
Однако исследователи предполагают, что ментол, который иногда включают в состав табака, является дополнительной причиной, почему курение вызывает рак легких. У людей, которые курят ментоловые сигареты, вероятность развития заболевания ещё выше. Хотя само по себе это вещество канцерогеном не является. Ученые связывают это с тем, что человек, который курит ментоловые сигареты, затягивается глубже.
Сколько надо курить, чтобы появился рак легких? Установлено, что чем дольше человек имеет эту вредную привычку, тем выше у него вероятность возникновения онкологической патологии. Хотя и нельзя точно сказать, после скольки лет курения рак легких может развиться. Нет такой закономерности, что 29 лет можно курить без рисков для здоровья, а на 30 год появится опухоль. Все процессы в легких происходят постепенно.
Вкратце объясним, почему возникает рак легких при курении. Под действием табачного дыма и канцерогенов наступает атрофия эпителия бронхов, в них уменьшается количество бокаловидных клеток. Происходит замещение железистых компонентов слизистой оболочки фиброзной тканью. Цилиндрический эпителий превращается в многослойный плоский. Появляются очаги дисплазии – вначале слабой, потом средней, потом тяжелой степени. В конце концов, в одном из выраженных очагов метаплазии может развиться рак на месте (преинвазивный). Через несколько лет он переходит в инвазивный рак и начинает быстро увеличиваться в размерах.
Но отказ от сигарет ведет к постепенному снижению вероятности заболевания. Слизистая оболочка бронхов восстанавливается. Через 10-15 лет после прекращения курения риск онкопатологии становится таким же, как у человека, никогда не курившего в прошлом. Тем не менее, если у бросившего курить человека все же развивается рак легких, заболевание протекает тяжелее, чем у того, кто никогда не курил. Такие пациенты имеют гораздо меньшую выживаемость.
Немаловажно и количество выкуренных сигарет в сутки. Отмечается наибольшая вероятность рака легких при курении от 2 пачек сигарет в день. Частота возникновения злокачественной опухоли составляет 217 случаев на 100 тысяч населения.
Если человек курит одну пачку в день, вероятность развития рака у него на 25-30% меньше. Встречаемость заболевания у таких категорий людей – 144 случая на 100 тысяч населения. Еще меньше риск у тех, кто курит в среднем 10 сигарет в день. Частотность рака легких среди таких людей – 51 случай на 100 тысяч населения. То есть, риск в 4 раза меньше по сравнению с теми, кто курит 2 пачки в день, и в 3 раза меньше — в сравнении с выкуривающими 1 пачку сигарет ежедневно.
Со скольки лет может быть рак легких?
Часто курильщики интересуются, со скольки лет можно заболеть раком легких. Они считают, что если вовремя бросить курить, можно оградить себя от всех рисков. Такой подход не лишен оснований. Чем старше человек, тем выше риск заболевания. Рак легких в 20 лет не встречается. Рак легких в 30 лет бывает очень редко. А вот после 40 вероятность этого заболевания возрастает. Наиболее подвержена патологии возрастная группа после 60 лет. У мужчин в 60-69 лет риск заболевания выше в 60 раз по сравнению с возрастом 30-39 лет.
С учетом того, когда возникает рак легких, можно спланировать максимальный возраст, в котором следует бросить курить. Лучше всего, если вы бросите не позже 30 лет. На восстановление лёгких потребуется 10-15 лет. Зная, в каком возрасте может быть рак легких, нетрудно понять, что в этом случае вероятность заболевания значительно уменьшится. Ведь до 40-45 лет лёгкие курильщика очистятся от последствий курения, и вероятность возникновения заболевания у него будет такой же, как у никогда не курившего.
Но если вы не успели бросить до 30 лет, лучше сделать это поздно, чем никогда. Вы уже знаете, со сколько лет может появиться рак легких с наибольшей вероятностью. Это возраст 60 лет. Следовательно, чтобы не попасть в эту возрастную категорию курильщиков, ожидающих развития опухоли в бронхах, бросить нужно максимум до 45 лет. Это значительно уменьшит риск онкозаболевания, но не устранит его полностью.
Когда появляется рак легких, вопрос индивидуальный. У разных людей разное состояние иммунитета. На то, когда начинает развиваться рак легких, влияет и генетика, и пол, и национальность, и масса факторов внешней среды. Невозможно точно предсказать, когда наступает момент развития рака легких. С годами риск увеличивается. Поэтому бросать курить нужно как можно раньше. Если вы желаете предотвратить рак легких, возраст, в котором следует отказаться от сигарет – от 30 до 45 лет.
Часто пациенты спрашивают, может ли быть рак легких в 20 лет. От курения в таком возрасте он не развивается. В целом рак легких у детей – большая редкость. Он развивается лишь в случае грубых генетических дефектов, выраженного первичного иммунодефицита, а также на фоне других онкологических патологий детского возраста. Это может быть метастатический рак. Изредка онкологическая опухоль развивается вследствие высокодозного облучения по поводу другого ракового заболевания.
Из-за чего появляется рак легких у некурящих
Существует множество причин, от чего может быть рак легких. Ведь на вероятность его развития влияют и другие факторы, помимо табачного дыма. Рассмотрим основные причины, почему рак легких у некурящих тоже возникает.
Радон
Отравление радоном – это вторая по значимости после курения причина, из-за чего может быть рак легких. Радон — это газ без цвета и запаха, который появляется при разложении радиоактивного радия. Радий, в свою очередь, образуется из урана, сформировавшегося в земной коре. Радон называют главной причиной, откуда появляется рак легких, если человек не курил. При увеличении его количества во вдыхаемом воздухе возрастает риск развития онкологии. Концентрация его в атмосфере зависит от состава почвы и камней. Однако на улице газ рассеивается. Он представляет опасность только при накоплении в замкнутых помещениях.
Причина, почему появляется рак легких при высокой концентрации радона, заключается в том, что он распадается на твёрдые радиоактивные элементы, обладающие канцерогенным действием. Это полоний-214, свинец-214 и полоний-218. Они прикрепляются к частицам пыли и попадают в лёгкие. Оседая на стенках легких, эти элементы дают излучение, повреждающее генетический материал клеток, вызывающее мутации и злокачественные процессы.
Теперь вы знаете, почему развивается рак легких под действием радона. Но где накапливается это вещество? Где именно человек контактирует с ним?
Вариантов несколько:
- В собственном доме. В зависимости от почвы в некоторых географических регионах уровень радона может быть существенно повышенным. Увеличение его концентрации в воздухе на каждые 100 Бк/м3 ведет к возрастанию риска рака лёгкого на 10%. Выделяемый почвой радон проникает в трещины в стенах и попадает в дом, где и накапливается. Больше всего его содержится в подвале.
- На работе. Еще одним местом контакта с радоном, от чего развивается рак легких, может стать рабочее место. Чаще дышат радоном люди, которые работают в подвалах: например, ремонтируют трубы. Этот газ может содержаться и в строительных материалах. Работники заводов по переработке урана очень часто контактируют с радоном. В группе риска также работники шахт с высоким уровнем радона в почве и воздухе.
Хотя радон является одной из основных причин, от чего может появиться рак легких, на вероятность других видов онкозаболеваний он не влияет. Это связано с тем, что радиоактивные частицы оседают в лёгких и не разносятся с кровью по организму. Излучение они дают на короткое расстояние. Поэтому повреждают ДНК только в тех клетках, которые расположены рядом. Сильнее всего радон, как причина рака легких, увеличивает вероятность этого заболевания в сочетании с курением. Однако и как самостоятельный фактор риска он имеет достаточно большое значение.
Асбест
Еще одной причиной, от чего может возникнуть рак легких, является контакт с асбестом. Он содержится во многих строительных материалах. После установления вредного воздействия асбеста на организм в 70-х годах прошлого века его производство в развитых странах начало существенно сокращаться. В 2005 году он был запрещен в Европе. Тем не менее материал, по-прежнему широко используется в некоторых странах, а многие европейские дома были построены раньше 2005 года. Чаще всего причиной, почему бывает рак легких от асбеста, становятся профессиональные вредности.
Это происходит, когда:
- Человек работает на предприятии, которое производит стройматериалы из асбеста
- Человек занимается стройкой из этих материалов
- Он живет в доме, построенном из асбеста (но в воздух он попадает не всегда, а только при строительстве, ремонте, разрушении стройматериалов, содержащих асбест)
Причиной рака легких может стать только постоянное и длительное вдыхание асбеста. В группе риска – строители домов, а также работники судостроительных предприятий. Риску также подвержены их родственники. Ведь работники приносят домой асбестовую пыль на своей одежде. Причиной рака легких не может быть кратковременное вдыхание асбеста. Обычно болеют те, кто подвергался его постоянному воздействию не менее 15 лет.
Другие канцерогены
Помимо радия и асбеста, существуют и другие факторы, от чего бывает рак легких. К веществам, увеличивающим вероятность возникновения этого заболевания, относятся:
- Радиоактивные руды, включая уран
- Дизельный выхлоп
- Кремния диоксид
- Винилхлорид
- Никель
- Кадмий
- Мышьяк
- Бериллий
- Уголь
- Соединения хрома
Большинство веществ, из-за чего бывает рак легких, опасны только при вдыхании. Однако некоторые химические соединения увеличивают риск возникновения заболевания и при употреблении внутрь. Так, в некоторых регионах Южной Америки и Юго-Восточной Азии отмечается повышенная заболеваемость раком легкого из-за повышенного содержания мышьяка в питьевой воде.
Экологический фактор
Загрязнение атмосферы является еще одной причиной, от чего образуется раковая опухоль легких. По приблизительным оценкам около 5% всех случаев этого заболевания связаны с промышленными загрязнениями.
Статистика рака легких показывает, что жители городов более подвержены этому заболеванию, по сравнению с деревенскими жителями. Это связано с автомобильными выхлопами. Причем, чаще болеют те, кто живет возле дороги с большим потоком машин.
Лучевая терапия
Сильное воздействие радиации – это способ, как быстро заработать рак легких, а также опухоли любой другой локализации. Радиоактивное излучение является мутагенным фактором и повреждает генетический материал клеток, провоцируя их неконтролируемое интенсивное деление.
Большинство людей не подвергаются сильному радиационному воздействию даже в случае занятости в атомных отраслях промышленности. Но большую дозу излучения можно получить во время сеанса лучевой терапии по поводу опухолевых новообразований другой локализации. Лёгкие чаще всего получают свою дозу радиации при облучении молочной железы, реже – при других новообразованиях с локализацией в грудной клетке.
Так как получить рак легких в дополнение к новообразованию груди не хочет ни один здравомыслящий человек, лучше использовать качественные виды лучевой терапии. Они позволяют более точно сфокусировать лучи, избежав губительного воздействия радиации на здоровые ткани.
Большинство современных онкологических клиник на сегодняшний день используют более качественные и щадящие методики лучевой терапии. Хотя в развивающихся странах, где используются технологии 70-80-х годов, по-прежнему можно заработать рак лёгких, получая курс облучения по поводу рака груди.
Семейный анамнез
Среди причин возникновения рака легких следует упомянуть семейный анамнез. Доказано, что у человека значительно повышается риск этого заболевания, если им страдал родственник первой линии. Однако пока что не ясно, от чего появляется рак легких: вследствие наследственной предрасположенности или по причине воздействия внешних факторов.
От родителей к детям передаются не только гены, и особенности образа жизни. К тому же, ребенок может в детском возрасте подвергаться воздействию табачного дыма, что делает его предрасположенным к онкопатологии легких. Родители и их дети живут в одном доме, где могут быть кровельные материалы из асбеста или высокая концентрация радона в воздухе, от чего можно получить рак легких.
Витамины
Курильщикам лучше не принимать витаминные добавки и не увлекаться потреблением моркови, так как можно получить рак легких с большей вероятностью, если в организм ежедневно поступает большое количество бета-каротина. Это желтый пигмент, который преобразуется в витамин А. Однако это не касается людей без вредных привычек. Только в сочетании с курением бета-каротин увеличивает риск развития онкологической патологии.
Пассивное курение
Иногда рак легких у некурящих людей возникает по причине пассивного вдыхания табачного дыма. Предполагается, что с этим фактором связано около 7 тысяч случаев онкозаболевания ежегодно. То есть в 25% случаев, причиной почему рак легких бывает у некурящих, является пассивное курение.
Недоказанные факторы, от чего рак легких может возникнуть
Предполагаются и другие причины, от чего возникает рак легких. Но доказательства у них ограниченные, либо недостоверные.
Возможно, вероятность онкозаболевания увеличивают:
Как не заболеть раком легких?
Зная, откуда появляется рак легких, вероятность этого заболевания можно значительно уменьшить. Большинство факторов риска установлены и поддаются контролю. Поэтому каждый человек имеет возможности для профилактики рака легкого. Для этого достаточно устранить все факторы риска. Как результат, вероятность заболевания уменьшится в десятки раз.
Вот как спастись от рака легких:
- Отказаться от курения. Это самый весомый фактор риска, так как заболеть раком легких при наличии этой вредной привычки можно с вероятностью 17%. То есть, у одного из шести курящих при жизни будет диагностирован рак легкого. Вероятность просто огромная. Курение столь же опасно, как русская рулетка – если вы поместите один патрон в револьвер и выстрелите себе в висок, шансы погибнуть будут аналогичными – один к шести. А ведь сигареты влияют и на вероятность многих других заболеваний. Поэтому лучше никогда не начинать курить, а если уже начали – срочно отказаться от этой привычки. Это лучшая профилактика рака легких.
- Ограничить профессиональные вредности. Учитывая, какой шанс заболеть раком легких имеют люди, постоянно вдыхающие вредные вещества, от таких профессий лучше отказаться. Не стоит работать в шахтах и подвалах, чтобы не дышать радоном. Не стоит заниматься стройкой или кровлей крыш, если используются асбестосодержащие материалы. Стоит также избегать контакта с мышьяком, никелем, фосфорорганическими удобрениям и другими веществами, вдыхание которых вредит организму и провоцирует рак легкого.
- Исключить экологический фактор. Вряд ли житель города захочет перебраться в деревню только для того, чтобы снизить риск рака легких. Однако есть множество других вещей, которые можно сделать для уменьшения вероятности заболевания путем устранения экологического фактора.
Чтобы предотвратить рак легких, профилактика может заключаться в том, чтобы:
- Переехать подальше от оживленной дороги. Можно выбрать себе квартиру в тихом спальном районе, желательно подальше от центра города. Там вы будете меньше дышать выхлопными газами.
- Переехать в город с низким уровнем производства. Промышленные центры часто имеют загрязненную атмосферу. Люди в таких городах чаще болеют раком легкого.
Чем раньше будут приняты меры профилактики, тем лучше вы будете защищены от рака легкого. Если же предотвратить патологию не удалось, нужно вовремя начинать лечение. И лечиться лучше в клиниках развитых стран, таких как Германия.
Организация лечения в Германии
Рак легких трудно поддается лечению. Начинать его следует как можно раньше. И для увеличения продолжительности жизни необходимо использовать все достижения современной медицины. Самые новые терапевтические методики доступны в крупных онкологических центрах Германии.
Чтобы получить лечение в одной из авторитетных клиник, вы можете воспользоваться услугами компании Booking Health. Мы уже много лет занимаемся организацией лечения за границей.
У нас заключены прямые договора со всеми клиниками Германии, поэтому наши клиенты получают:
- Качественное лечение в лучших немецких медицинских центрах
- Уменьшение времени ожидания начала лечения, что важно в случае онкологических заболеваний, ведь рак легкого быстро распространяется и дает метастазы
- Экономию до 70% в связи с оптимизацией расходов на лечение, отсутствием необходимости оплаты страховки для иностранных пациентов
Мы решаем все организационные вопросы и предоставляем полный пакет сервисных услуг: помогаем с оформлением документов, предоставляем переводчика, сопровождаем пациента в Германии на протяжении всего курса лечения. Оставьте заявку на нашем сайте, чтобы мы подобрали для вас клинику и рассчитали стоимость лечения рака легкого в Германии.
Выбирайте лечение за рубежом и Вы, несомненно, получите отличный результат!
Авторы: Доктор Надежда Иванисова, Доктор Сергей Пащенко
Читайте:
Почему Booking Health – Вопросы и ответы
Как не ошибиться в выборе клиники и специалиста
7 причин доверять рейтингу клиник на сайте Booking Health
Booking Health – Стандарты качества
Отправить запрос на лечение
Статистика заболеваемости раком легких | Cancer Research UK
Стандартизованные по возрасту показатели заболеваемости раком легких среди мужчин и женщин в Великобритании вместе снизились на 8% в период с 1993–1995 по 2015–2017 гг. [1–4].
В период с 1993–1995 по 2015–2017 годы у женщин уровень заболеваемости раком легких в Великобритании увеличился на 31%. Для мужчин заболеваемость раком легких в Великобритании снизилась на 33% в период с 1993–1995 по 2015–2017 годы.
За последнее десятилетие в Великобритании (между 2005–2007 и 2015–2017 гг.) Заболеваемость раком легкого АС у женщин и мужчин в совокупности увеличилась на 1%.[1-4] У женщин заболеваемость АС увеличилась на 15%, а у мужчин снизилась на 11%.
Рак легкого (МКБ-10 C33-C34), Европейские стандарты заболеваемости по возрасту, Великобритания, 1993-2017 гг.
Показатели заболеваемости раком легких в целом увеличились в большинстве широких возрастных групп взрослых женщин в Великобритании с начала 1990-х годов, но снизились в некоторых [1-4]. Показатели в возрастной группе 25-49 лет снизились на 16%, в возрасте 50-59 лет — на 16%. увеличилось на 9%, в 60-69 годах увеличилось на 14%, в 70-79 годах увеличилось на 34%, а в 80+ годах увеличилось на 80%.
Рак легкого (МКБ-10 C33-C34), Европейские стандартизированные по возрасту коэффициенты заболеваемости, по возрасту, женщины, Великобритания, 1993-2017 гг.
Показатели заболеваемости раком легких снизились в целом во всех широких возрастных группах взрослых мужчин в Великобритании с начала 1990-х годов, но остались стабильными в некоторых. [1-4] Показатели в возрастных группах 25-49 лет снизились на 38%, в 50- 59% уменьшились на 44%, в 60-69 годах уменьшились на 39%, в 70-79 годах уменьшились на 32%, а в 80+ годах уменьшились на 23%.
Рак легкого (МКБ-10 C33-C34), Европейские стандартизированные по возрасту коэффициенты заболеваемости, по возрасту, мужчины, Великобритания, 1993-2017 гг.
Для рака легких, как и для большинства видов рака, тенденции заболеваемости в значительной степени отражают изменение распространенности факторов риска и улучшения в диагностике и регистрации данных.Последние тенденции заболеваемости зависят от распространенности факторов риска в прошлые годы, а тенденции по возрастным группам отражают подверженность факторам риска в когортах новорожденных.
Рак легкого (C33-C34) Европейские стандартизированные по возрасту показатели заболеваемости и распространенности курения, Великобритания, 1948-2017 гг.
Рекомендация: Рак легкого: скрининг | Целевая группа профилактических услуг США
Объем проверки
Чтобы обновить свою рекомендацию 2013 г., USPSTF заказала систематический обзор 24,25 точности скрининга рака легких с помощью НДКТ, а также преимуществ и вреда скрининга на рак легких.В обзоре также оценивалось, различаются ли преимущества скрининга в зависимости от подгруппы (например, от расы или пола) или от количества или частоты сканирований LDCT, и отличается ли вред, связанный со скринингом и оценкой легочных узелков, при использовании Lung-RADS. , Международная программа действий по борьбе с раком легких (I-ELCAP) или аналогичные подходы (например, для уменьшения количества ложноположительных результатов). Кроме того, в обзоре оценивалось, улучшает ли использование моделей прогнозирования риска для выявления взрослых с повышенным риском смертности от рака легких баланс преимуществ и вреда от скрининга по сравнению с использованием критериев приемлемости для исследования или вариантов критериев предыдущих рекомендаций USPSTF.
В дополнение к систематическому обзору фактических данных USPSTF заказала совместные исследования по моделированию из CISNET 14,15 , чтобы предоставить информацию об оптимальном возрасте для начала и окончания скрининга, оптимальном интервале скрининга, а также относительной пользе и вреде различных стратегии скрининга, в том числе стратегии, основанные на факторах риска, с использованием возраста, годовой истории курения и количества лет с момента отказа от курения для бывших курильщиков, по сравнению с модифицированными версиями многомерных моделей прогнозирования риска.Исследования по моделированию дополняют доказательства, которые предоставляет систематический обзор.
Точность отборочных тестов
USPSTF проанализировал несколько РКИ и когортных исследований, в которых сообщалось о чувствительности, специфичности или прогностической ценности НДКТ, используя возможную диагностику рака легких в качестве эталонного стандарта. 24,25 Не во всех рассмотренных исследованиях представлены все данные о точности тестов. В исследованиях, в которых сообщалось, чувствительность варьировалась от 59% до 100%, специфичность — от 26.От 4% до 99,7%, прогностическая ценность положительного результата варьировалась от 3,3% до 43,5%, а прогностическая ценность отрицательного результата — от 97,7% до 100%.
В испытаниях NLST 26 и NELSON 11 заявленная чувствительность составила 93,1% и 59% соответственно, а заявленная специфичность — 76,5% и 95,8% соответственно. Хотя отрицательные прогностические значения были схожими для испытаний NLST и NELSON (99,9% и 97,7% соответственно), прогностические значения положительных результатов сильно различались (3,3% и 43.5% соответственно). Это несоответствие в значительной степени объясняется разными определениями клинических испытаний положительного результата и протоколов скрининга — в испытании NELSON использовался объемный подход и добавлена категория неопределенных результатов узелков (т. Е. Неопределенный результат не считался положительным результатом, даже если он приводил к до дополнительного тестирования). NLST использовал подход максимального диаметра без неопределенной категории (т.е. любой узелок, отвечающий критериям диаметра, считался положительным результатом).
В трех ретроспективных исследованиях сравнивалось, как различные подходы к классификации конкреций могут повлиять на точность НДКТ. 21,27,28 Первое исследование продемонстрировало, что использование Lung-RADS в NLST повысит специфичность при одновременном снижении чувствительности. 21 Два других исследования показали, что использование критериев I-ELCAP (увеличение порогового значения размера узелков до среднего диаметра 5 мм, 6 мм или более) может повысить положительную прогностическую ценность. 27,28
Преимущества раннего выявления и лечения
USPSTF рассмотрел 7 РКИ, в которых оценивали скрининг рака легких с помощью НДКТ. 24,25 NLST 9 и исследование NELSON 11 были единственными испытаниями, обладающими достаточной мощностью для выявления преимущества в отношении смертности от рака легких.
В NLST, самом крупном на сегодняшний день РКИ (n = 53 454), приняли участие участники в возрасте от 55 до 74 лет на момент рандомизации, которые употребляли табак не менее 30 пач-лет и курили в настоящее время или бросили курить в прошлом. 15 лет. Средняя продолжительность курения в пачках у участников NLST составила 56 пачко-лет. 9 В испытание NELSON (n = 15 792) приняли участие участники в возрасте от 50 до 74 лет, которые употребляли табак не менее 15 сигарет в день (три четверти пачки в день) в течение более 25 лет или 10 сигарет в день. день (половина пачки в день) более 30 лет и курили в настоящее время или бросили курить в течение последних 10 лет.Средняя продолжительность курения в течение пачкового года у участников испытания NELSON составляла 38 пачко-лет. 11
NLST сообщил об относительном снижении риска смертности от рака легких на 20% (95% ДИ, 6,8–26,7%) 9; последующий анализ данных NLST с дополнительным наблюдением и проверкой конечных точек показал снижение относительного риска на 16% (95% ДИ, 5-25%). 10 Через 10 лет наблюдения в исследовании NELSON было зарегистрировано 181 смертельный исход от рака легких среди участников в группе скрининга и 242 случая в контрольной группе (коэффициент заболеваемости [IRR], 0.75 [95% ДИ, 0,61-0,90]). 11,24 NLST также обнаружил снижение смертности от всех причин при скрининге LDCT по сравнению с рентгенографией грудной клетки (IRR, 0,93 [95% ДИ, 0,88–0,99]). Результаты других испытаний были неточными, без каких-либо статистически значимых различий между скринингом с помощью НДКТ и рентгенографией грудной клетки или без скрининга. 24
Доказательства интервала между скринингами получены из испытаний NLST и NELSON, а также исследований моделирования CISNET. NLST проводится ежегодно в течение 3 лет. 9 Исследование NELSON проводилось с интервалом в 1 год, затем 2 года, затем 2,5 года. 11 Исследования моделирования CISNET показывают, что ежегодный скрининг с помощью LDCT дает больше преимуществ в снижении смертности от рака легких и увеличения продолжительности жизни по сравнению с двухгодичным скринингом. 14
Несколько линий доказательств предполагают, что скрининг на рак легких у лиц с меньшим количеством пачко-лет курения (т. Е. Критерием приемлемости менее 30 пачко-лет по рекомендации USPSTF 2013 г.) и в более раннем возрасте может повысить эффективность скрининга.Как уже отмечалось, в испытании NELSON участвовали люди в возрасте от 50 до 74 лет (около четверти участников были моложе 55 лет), у которых накопилось меньше пачко-лет курения (половина пачки в день в течение более 30 лет или трех лет). четверти пачки в день более 25 лет). 11 Это исследование предоставляет эмпирические данные в пользу скрининга рака легких с помощью НДКТ у лиц в возрасте от 50 до 55 лет и с более легким стажем курения в течение года.
Исследования моделирования CISNET также предоставили данные, которые помогли определить критерий годности для проведения скрининга на рак легких и возраст, в котором следует начинать и прекращать скрининг.USPSTF сосредоточился на программах скрининга в когорте рожденных 1960 г. (более представительных для нынешних моделей курения по сравнению с более ранними когортами), которые привели к снижению смертности от рака легких, по крайней мере, столь же значительному, как скрининговая программа USPSTF 2013 г. (A-55-80-30-15) . Для программ скрининга, которые обеспечивают такой уровень снижения смертности, а также максимизируют или близки к максимальному, как предотвращенные смерти от рака легких, так и увеличенные годы жизни для любого заданного уровня скрининга LDCT, по крайней мере, в 3 из 4 моделей CISNET (т. Е. «Консенсус-эффективных» программ), большинство (52%) имеют минимальный критерий права на получение пакета в год, равный 20 годам пакета.Почти у всех есть начальный возраст 50 или 55 лет, и у всех конечный возраст 80 лет. 14,15
По сравнению с программой скрининга USPSTF 2013 года (A-55-80-30-15), анализ моделирования CISNET предполагает, что ежегодный скрининг людей в возрасте от 50 до 80 лет, которые курят не менее 20 лет и в настоящее время курят или бросили курить. за последние 15 лет (A-50-80-20-15) будет связано со снижением смертности от рака легких на 13,0% по сравнению с 9,8%, с предотвращением 503 случаев смерти от рака легких по сравнению с 381 и увеличения количества лет жизни на 6918 лет по сравнению с 4882 жизнями. -летний выигрыш на 100 000 человек населения в возрасте от 45 до 90 лет за все время проведения скрининга. 14 Таким образом, эта программа скрининга будет связана с существенным сокращением смертности от рака легких и увеличением продолжительности жизни по сравнению с предыдущей рекомендацией и поддерживается новыми данными испытаний и исследованиями моделирования CISNET.
Скрининг на рак легких у лиц в более раннем возрасте и с меньшим количеством пачко-лет курения (т. Е. 20 пачко-лет) также может помочь частично уменьшить расовые различия в критериях отбора. Данные показывают, что курящие чернокожие имеют более высокий риск рака легких, чем белые, и эта разница в рисках более очевидна при более низких уровнях интенсивности курения. 7 Один недавний анализ участников когортного исследования южного сообщества показал, что 17% курящих чернокожих имели право на скрининг на рак легких на основе критериев отбора USPSTF 2013 года по сравнению с 31% курящих белых. В том же исследовании среди лиц с диагнозом рака легких значительно меньший процент курящих чернокожих (32%) соответствовал критериям отбора, чем белые (56%). 29 Данные также предполагают, что курящие латиноамериканцы / латиноамериканцы накапливают меньше ста лет, чем курящие белые. 30,31 Стратегия ежегодного скрининга людей в возрасте от 50 до 80 лет, которые курят не менее 20 пачок в год и в настоящее время курят или бросили курить в течение последних 15 лет (A-50-80-20-15) увеличить относительный процент лиц, имеющих право на скрининг, на 87% в целом — 78% среди взрослых белых неиспаноязычных, 107% среди взрослых чернокожих неиспаноязычных и 112% среди взрослых латиноамериканцев по сравнению с критериями USPSTF 2013 года (A-55-80- 30-15). 14 Аналогичным образом, расширится стратегия скрининга лиц в возрасте от 50 до 80 лет, которые курят не менее 20 пачок лет и в настоящее время курят или бросили курить в течение последних 15 лет (A-50-80-20-15). относительный процент людей, имеющих право на скрининг, на 80% у мужчин и на 96% у женщин, 14 , потому что они накапливают меньше пачко-лет, чем мужчины. 32
Имитационные исследования показывают, что модели прогнозирования риска для определения права на скрининг рака легких могут быть связаны с уменьшением смертности от рака легких и количеством участников, необходимых для скрининга, чтобы предотвратить 1 смерть от рака легких. Таким образом, в исследованиях моделирования CISNET, заказанных USPSTF, сравнивались преимущества и вред программ скрининга, основанных на моделях прогнозирования риска, и скрининга на основе факторов риска (т. Е. С использованием возраста и истории курения). Используемые модели прогнозирования риска были модифицированными версиями модели PLCOm2012, 33 , модели инструмента оценки риска смерти от рака легких (LCDRAT), 34 и модели Баха, 35 с ограничениями по возрасту, полу (для тех моделей, которые включают пол как переменная, такая как модели LCDRAT и Баха), интенсивность курения и продолжительность курения (и установка других потенциальных переменных, таких как раса, образование, индекс массы тела, личный анамнез рака или семейный анамнез рака легких, для их ссылки значение).Поскольку возраст является важным фактором риска рака легких, эти модели прогнозирования риска перенесли скрининг на людей старшего возраста и увеличили число предотвращенных смертей от рака легких, но скрининг проводится в более старшем возрасте, когда остается меньше лет. Таким образом, некоторые программы скрининга, основанные на модели прогнозирования риска, были связаны с небольшим увеличением продолжительности жизни, в то время как некоторые не были связаны или были связаны даже с небольшим сокращением продолжительности жизни. Модели прогнозирования рисков также были связаны с увеличением числа чрезмерно диагностированных случаев рака легких, которые чаще встречаются у пожилых людей. 14
Возможно, что использование более сложной модели прогнозирования риска для определения права на участие может создать препятствие для более широкого внедрения и использования скрининга на рак легких, услуги, которая в настоящее время не пользуется большой популярностью. В настоящее время нет исследований, которые проспективно сравнивали бы использование критериев USPSTF с учетом возраста, годовой истории курения и количества лет с момента отказа от курения с моделями прогнозирования риска в качестве критериев для скрининга рака легких, поэтому неясно, следует ли использовать прогнозирование риска. модель улучшит обнаружение рака легких и клинические результаты.Международное исследование легких (ILST), проспективное когортное исследование, в котором сравнивается точность модели PLCOm2012 с критериями USPSTF 2013 года для выявления рака легких, может предоставить некоторые доказательства по этому поводу. 36 Таким образом, определение права на скрининг рака легких с использованием более сложных моделей прогнозирования риска может представлять собой препятствие для реализации, и в настоящее время недостаточно данных для оценки того, улучшит ли скрининг на основе модели прогнозирования риска результаты по сравнению с простым использованием факторов риска возраст и история курения.
Вред скрининга и лечения
Вред скрининга может включать ложноположительные результаты, ведущие к ненужным тестам и инвазивным процедурам, гипердиагностику, радиационно-индуцированный рак, случайные находки и усиление стресса или беспокойства.
По данным NLST, частота ложноположительных результатов составила 26,3% для исходного уровня, 27,2% для 1 года и 15,9% для 2-го года. В исследовании NELSON сообщалось о частоте ложноположительных результатов 19,8% на исходном уровне, 7,1% в 1 год, 9,0% для мужчин. в год 3 и 3.9% для мужчин на 5,5 году скрининга. 11,37 Исследование внедрения, проведенное Управлением здравоохранения ветеранов, показало, что на исходном уровне уровень ложноположительных результатов составил 28,9% ветеранов, имеющих право на скрининг (58% от тех, кто действительно прошел скрининг). 38 Оба этих исследования были проведены до использования протокола Lung-RADS для классификации узлов, использование которого может уменьшить количество ложноположительных результатов, хотя и за счет некоторых ложноотрицательных результатов. В одном ретроспективном исследовании оценивалось, как использование Lung-RADS могло бы изменить частоту ложноположительных результатов в NLST, и было обнаружено, что среди исходных результатов для Lung-RADS, равных 12, частота ложноположительных результатов.8% (95% ДИ, 12,4–13,2%) против 26,6% (95% ДИ, 26,1–27,1%) для подхода NLST. 21
Дальнейшая обработка ложноположительных результатов может привести к значительному ущербу, например, при дополнительной визуализации, биопсии или хирургических вмешательствах. В четырнадцати исследованиях сообщалось об оценке ложноположительных результатов. Среди всех пациентов, прошедших скрининг, процент ложноположительных результатов пункционной биопсии колебался от 0,09% до 0,56%. Частота осложнений при пункционной биопсии для ложноположительных результатов варьировалась от 0.От 03% до 0,07% всех обследованных пациентов. О хирургических процедурах из-за ложноположительных результатов сообщили от 0,5% до 1,3% всех прошедших скрининг участников. 24
В NLST ложноположительные результаты привели к инвазивным процедурам (пункционная биопсия, торакотомия, торакоскопия, медиастиноскопия и бронхоскопия) у 1,7% обследованных пациентов. Осложнения возникли у 0,1% обследованных пациентов, а смерть в течение 60 дней после наиболее инвазивной процедуры, выполненной для оценки ложноположительного результата, наступила у 0.007% опрошенных. 9 Одно исследование показало, что использование критерия Lung-RADS предотвратило бы 23,4% инвазивных процедур из-за ложноположительных результатов. 21
В исследованиях моделирования CISNET частота ложных срабатываний варьировалась в зависимости от критериев отбора. По сравнению с критериями USPSTF 2013 года (A-55-80-30-15), критерии USPSTF 2021 года (A-50-80-20-15) приведут к 2,2 ложноположительным результатам против 1,9 на человека в течение всей жизни скрининга. . 14 Обратите внимание на то, что программы скрининга, которые начинаются в более молодом возрасте или используют более низкий годовой пакет отбора, большее общее количество людей.
Определение степени гипердиагностики в скрининговых испытаниях является сложной задачей, поскольку продолжительность последующего наблюдения влияет на расчет избыточного, потенциально избыточно диагностированного рака в группах скрининга по сравнению с контрольными группами. Первоначально NLST сообщил о 119 дополнительных случаях рака легких (1060 общих случаев рака с LDCT против 941 с рентгенографией грудной клетки) после 3 раундов скрининга и 6,5 лет наблюдения (IRR, 1,12 [95% ДИ, 1,02–1,22]). 9,24 При расширенном наблюдении NLST не обнаружил статистически значимых различий между группами по общей заболеваемости раком легких; тем не менее, это исследование имело некоторые методологические ограничения, в том числе использование другого метода установления диагноза во время последующего наблюдения после исследования, отсутствие информации о любом последующем скрининге, который мог иметь место в группе НДКТ или рентгенографии грудной клетки, а также отсутствующие данные. 39 В исследовании NELSON было зарегистрировано 40 случаев избыточного рака легких (344 рака в группе LDCT по сравнению с 304 в контрольной группе) после априори запланированных 10 лет наблюдения; после 11 лет наблюдения было зарегистрировано 14 случаев рака с НДКТ. 11
В исследованиях моделирования CISNET, которые учитывают последующее наблюдение в течение всей жизни, программа скрининга USPSTF 2013 года (A-55-80-30-15) привела бы к тому, что 6,3% выявленных скрининговых случаев рака легких были сверх диагностированы по сравнению с 6.0% случаев рака легких гипердиагностируются программой скрининга 2021 года (A-50-80-20-15). 14
В 9 публикациях, в которых сообщается о радиационном воздействии, связанном с НДКТ, 24 облучение, связанное с 1 сканированием НДКТ, варьировалось от 0,65 до 2,36 мЗв. Для контекста, среднее годовое радиационное облучение в США составляет 2,4 мЗв. В двух исследованиях оценивалась кумулятивная лучевая нагрузка на участников, проходящих скрининг с помощью НДКТ. Используя оценочную дозу облучения, полученную в результате скрининга и последующих оценок, а также оценки риска смерти от рака, вызванного радиацией, Итальянское испытание по скринингу рака легких (ITALUNG) оценило пожизненный риск смертельного рака равным 0.11 случаев на 1000 человек для LDCT после 4 раундов скрининга, 40 и исследование продолжающегося наблюдения за курящими субъектами оценили пожизненный риск серьезных раковых заболеваний от 2,6 до 8,1 на 10 000 человек, прошедших скрининг после 10 раундов ежегодного скрининга. 41
Моделирование CISNET показало, что оценки смертности от рака легких в течение жизни варьировались в зависимости от критериев отбора для прохождения скрининга. По сравнению с рекомендацией USPSTF 2013 года (A-55-80-30-15) рекомендация USPSTF 2021 года (A-50-80-20-15) будет связана примерно с 38.6 против 20,6 смертей от рака легких, связанных с радиацией, на 100 000 человек в общей численности населения в возрасте от 45 до 90 лет, или 1 смерть на каждые 13,0 против 18,5 случаев смерти от рака легких, которых удалось избежать с помощью скрининга. 14
При сравнении групп LDCT с контрольными группами по результатам прекращения курения или воздержания, данные не указывают на то, что скрининг приводит к более низким показателям отказа от курения или продолжающемуся воздержанию или к более высоким показателям рецидивов. Несколько исследований показывают, что по сравнению с отсутствием скрининга люди, прошедшие скрининг НДКТ, не имеют более низкого качества жизни, связанного со здоровьем, беспокойства или дистресса в течение 2 лет наблюдения.Однако участники скрининга, получившие истинно положительные или неопределенные результаты, могут в краткосрочной перспективе испытывать ухудшение качества жизни, связанное со здоровьем, беспокойство или дистресс. 24
В исследованияхсообщалось о широком диапазоне случайных результатов, связанных со скринингом, которые были признаны значимыми или требовали дальнейшей оценки (от 4,4% до 40,7%), отчасти из-за непоследовательных определений того, что является случайным обнаружением и какие результаты были клинически значимыми. 24 Старший возраст ассоциировался с большей вероятностью случайных находок.Общие случайные находки включали кальцификацию коронарной артерии, аневризмы аорты, эмфизему, а также инфекционные и воспалительные процессы. Другими частыми находками были образования, узелки или кисты почек, груди, надпочечников, печени, щитовидной железы, поджелудочной железы, позвоночника и лимфатических узлов. Рак почек, щитовидной железы или печени в конечном итоге был диагностирован у 0,39% участников NLST в группе LDCT во время скрининга. 42
Случайные находки привели к последующей оценке, включая консультации, дополнительную визуализацию и инвазивные процедуры с соответствующими затратами и трудностями.Польза случайного выявления онкологических состояний, не связанных с легкими, и баланс пользы и вреда случайных результатов скрининга НДКТ, остаются неопределенными.
Ответ на общественное обсуждение
Предварительная версия этого заявления о рекомендации была размещена для общественного обсуждения на веб-сайте USPSTF с 7 июля 2020 г. по 3 августа 2020 г. Большинство комментариев в целом согласились с проектом рекомендации, хотя некоторые просили расширить критерии приемлемости для скрининга рака легких и другие отметили, что существуют дополнительные факторы риска рака легких, помимо курения, или что рак легких может возникнуть у людей, которые никогда не курили.В ответ USPSTF признает, что помимо курения существуют факторы риска рака легких; однако имеющиеся данные не подтверждают включение этих факторов риска в качестве детерминант права на скрининг рака легких. USPSTF также признает, что рак легких может возникать у людей, которые никогда не курили, или у лиц, которые в настоящее время курят или курили ранее, но не соответствуют критериям отбора. Тем не менее, курение является основным фактором риска рака легких, все испытания скрининга на рак легких проводились среди лиц, которые курили или были бывшими курильщиками, а данные испытаний и моделирования подтверждают текущую рекомендацию USPSTF как предлагающую разумный баланс преимуществ и вреда .
В некоторых комментариях предлагалось использовать более сложные модели прогнозирования риска для определения права на скрининг рака легких. В ответ USPSTF разъяснил, что использование этих моделей прогнозирования рисков может затруднить реализацию, и что в настоящее время не существует испытаний по скринингу рака легких, в которых можно было бы проспективно сравнивать критерии соответствия USPSTF с моделями прогнозирования риска. USPSTF также добавила ссылку на ILST, проспективное когортное исследование, посвященное этой проблеме.
В ответ на комментарии USPSTF также добавила информацию о низкой в настоящее время распространенности скрининга на рак легких и данные о влиянии текущей рекомендации на соответствие критериям отбора для лиц латиноамериканского / латиноамериканского происхождения. Наконец, USPSTF добавила и обновила ресурсы и ссылки на веб-сайты в разделе «Дополнительные инструменты и ресурсы».
Как доказательства согласуются с биологическим пониманием?
Рак легкого — это распространение злокачественных клеток, происходящих из ткани легких.Курение — самый сильный фактор риска рака легких. Пожилой возраст также связан с увеличением заболеваемости раком легких. Рак легкого подразделяется на 2 основные категории в зависимости от типа клеток, иммуногистохимических и молекулярных характеристик: НМРЛ, который в совокупности включает аденокарциному, плоскоклеточный рак и крупноклеточный рак, и мелкоклеточный рак легкого. Скрининг направлен на раннее выявление НМРЛ, а не на мелкоклеточный рак легкого, поскольку последний встречается гораздо реже и обычно распространяется слишком быстро, чтобы его можно было надежно обнаружить на ранней потенциально излечимой стадии путем скрининга.
В настоящее время 79% пациентов обращаются с раком легких, который распространился на региональные лимфатические узлы или метастазировал в отдаленные места. Только 17% пациентов имеют локализованное заболевание. Пациенты с локализованным заболеванием имеют 5-летнюю выживаемость 59% по сравнению с 32% для пациентов с региональным распространением и 6% для пациентов с отдаленными метастазами. 1 Скрининг на рак легких, ведущий к более раннему выявлению и лечению, может дать пациентам больше шансов на излечение.
Типы, симптомы, диагностика, методы лечения и перспективы
Рак легких I стадии — это вторая по ранней стадии заболевания.Это означает, что аномальные клетки в ваших дыхательных путях превратились в рак. Но опухоль находится только в вашем легком и не распространилась на ваши лимфатические узлы.
Стадия I также называется раком легких на ранней стадии. Его часто можно вылечить, и большинство людей могут рассчитывать прожить 5 лет или дольше.
Типы и стадии
Почти 9 из 10 человек с раком легкого имеют немелкоклеточный рак легкого (НМРЛ). Более редкий и агрессивный тип называется мелкоклеточным раком легкого. Пронумерованные стадии чаще используются при НМРЛ.
Ваш врач определит стадию вашего рака, используя три ключевых критерия, называемых TNM:
Опухоль (T) . Насколько велика и где находится опухоль?
Узлы (N) . Рак находится в близлежащих лимфатических узлах?
Метастаз (M) . Насколько далеко рак распространился от своего первоначального места?
Врачи делят немелкоклеточный рак легкого I стадии на два основных подтипа. Это помогает им понять, насколько серьезен ваш рак, и выбрать лучшее лечение.
Продолжение
Этап IA. Ваша опухоль находится только внутри легкого и не превышает 3 сантиметров. Это примерно размером с грецкий орех. Эта стадия еще больше разбивается в зависимости от размера опухоли:
- Стадия IA1: 1 сантиметр или меньше или не очень инвазивная
- Стадия IA2: больше 1 сантиметра, но не больше 2 сантиметров
- Стадия IA3: Более 2 сантиметров, но не более 3 сантиметров
Stage IB. Ваш рак не распространился на ваши лимфатические узлы. Стадия IB измеряется одним из двух способов. Первый — если ваша опухоль больше 3 сантиметров, но не больше 4 сантиметров.
Или ваша основная опухоль может быть любого размера до 4 сантиметров, и верно хотя бы одно из следующего:
- Ваша опухоль находится в основных дыхательных путях (бронхе), но не в том месте, где ваше дыхательное горло разделяется влево и вправо (киль).
- Ваш рак распространился на мембрану, покрывающую поверхность вашего легкого.
- Ваше легкое разрушено или воспалено (пневмонит).
Симптомы
У вас может быть рак легких на ранней стадии и вы не подозреваете об этом. Или вы можете заметить некоторые общие признаки, в том числе:
. Обращайтесь к врачу по поводу любых симптомов. Ваши шансы победить рак легких напрямую зависят от того, насколько рано вы его заразите.
Диагноз
Иногда рак легких I стадии обнаруживают с помощью обычных тестов. Или у вашего врача могут быть причины думать, что это у вас есть.В таком случае вы можете получить такие тесты, как:
Рентген и сканирование изображений. Рентген может выявить подозрительное образование в легком. Компьютерная томография (КТ) позволяет обнаружить опухоли меньшего размера.
Ваш врач может назначить другие тесты, чтобы проверить степень вашего рака. Они могут включать:
Биопсия. Врач исследует образец вашей ткани под микроскопом, чтобы убедиться, что это рак.
Лечение
При раннем вмешательстве рак легких I стадии может быть излечим.Обычно ваш врач хочет удалить рак хирургическим путем. Вам также может потребоваться химиотерапия или лучевая терапия, если следы рака остаются или могут остаться.
Лучевая терапия — это вариант, если вы не можете или не хотите делать операцию.
Outlook
В США от рака легких умирает больше мужчин и женщин, чем от любого другого вида рака. Но ваши шансы выжить при раке легких I стадии хорошие. И ваши шансы, как правило, тем выше, чем ниже ваша стадия на момент постановки диагноза.
Например, около 92% людей со стадией IA1 живут не менее 5 лет. Это по сравнению с 83% для тех, кто находится на стадии IA2. 5-летняя выживаемость при стадии IB — дальнем конце стадии I — составляет 68%.
Жизнь с раком
Узнав, что у вас рак даже на ранней стадии, вы можете почувствовать себя потрясенным. Сохранение силы морально и физически поможет вам в лечении. Попробуйте и:
Продолжение
Самообразование. Задайте своему врачу вопросы о своем заболевании.Узнайте, какие методы лечения вы выберете и чего от них ожидать. Знания придадут вам уверенности в том, что вы получаете лучшее лечение своего рака.
Обратитесь за поддержкой. Обратитесь к друзьям и семье за эмоциональной, практической и другой помощью. Или поговорите с психотерапевтом, медицинским социальным работником, представителем вашего религиозного учреждения или другими квалифицированными специалистами.
Связаться с другими . Люди, больные раком, могут понять, через что вы проходите, сложнее для других.Присоединяйтесь к группе поддержки рака лично или онлайн. Американское онкологическое общество имеет доступный для поиска каталог групп и программ в вашем районе. Вы можете найти бесплатную или льготную транспортировку, парики и другую поддержку.
Почему здоровые некурящие заболевают раком легких?
Никто не был подготовлен к результатам биопсии, которые показали, что шишка на самом деле была симптомом рака легких, распространившегося на ее живот, печень, легкие и таз.
«Я подумал:« Подождите, но я никогда не курил », — сказал Нуньес.»Это так случайно».
Хотя диагнозы рака легких у молодых встречаются редко, а данные по этой возрастной группе ограничены, «кажется, что он превращается в отдельный подтип рака легких — тот, от которого необходимы новые эффективные методы лечения, чтобы сделать его пригодным для жизни заболеванием. — сказал доктор Джефф Окснард, специалист по раку легких из онкологического института Дана-Фарбер в Бостоне.
В 2013 году 159 480 мужчин и женщин в США умрут от этой болезни — больше, чем те, кто умирает от рака груди, толстой кишки и простаты вместе взятых.
Хотя курение, безусловно, является самым большим фактором риска развития рака легких, по оценкам, от 10 до 15 процентов пациентов с раком легких в США никогда не курили. Большинство этих пациентов — женщины, и, как и Тейлор и Нуньес, им поставлен диагноз в более молодом возрасте, чем у типичного пациента с раком легких.
«Молодые пациенты с раком легких, которых мы наблюдаем, также с большей вероятностью будут иметь IV стадию при постановке диагноза. К тому времени, когда их болезнь обнаружена, они уже довольно больны », — сказал Окснард.
Семьдесят пять процентов пациентов с раком легких имеют запущенное заболевание, а пятилетняя выживаемость составляет всего 5 процентов.
«У пожилых пациентов болезнь часто диагностируется случайно с помощью сканирования или рентгеновского снимка, выполненного по какой-либо другой причине», — объясняет Окснард. «Но у молодых, которые в остальном здоровы и не так интегрированы в медицинскую систему, симптомы, если таковые имеются, часто игнорируются или принимаются за что-то еще».
Традиционно рак легких подразделяется на два основных типа: мелкоклеточный и немелкоклеточный. Однако сегодня считается, что рак легких состоит из нескольких различных подтипов, каждый из которых характеризуется мутированными генами и аномальными белками, которые можно все чаще контролировать с помощью таргетной терапии.
Таргетная терапия — это лечение, специально разработанное для лечения конкретной мутации или другой аномалии. Помимо того, что они более эффективны, чем традиционные химиотерапевтические препараты и лучевая терапия в замедлении роста и распространения рака, таргетные методы лечения часто имеют меньше побочных эффектов и минимизируют повреждение нормальных, здоровых клеток.
Например, молодые люди и некурящие люди с раком легких обычно имеют мутации в гене, называемом EGFR. Пациенты с положительным результатом теста на эту мутацию лучше реагируют на таргетную терапию Тарцева, чем на стандартную химиотерапию.Молодые люди и некурящие с раком легких также часто имеют мутации в генах ALK и ROS1, которые хорошо реагируют на новый целевой препарат под названием Xalkori.
Окснард говорит, что более половины всех молодых пациентов с раком легких имеют мутацию в опухолях, для которой существует лекарство, блокирующее действие мутации. Этого не произошло ни с Тейлором, ни с Нуньесом, оба из которых были успешно вылечены — на данный момент — стандартным курсом химиотерапии, чтобы остановить болезнь.
Начать скрининг на рак легких в возрасте 50 лет, 20 пачек-лет курения
9 марта 2021 г.
Читать 6 мин.
Источник / Раскрытие информацииОпубликовано:
Раскрытий: Вонг сообщает об авторстве множества публикаций, связанных с раком легких, и о финансировании NIH для разработки имитационной модели политики для оценки здоровья и экономических результатов скрининга на рак легких.Пожалуйста, ознакомьтесь с заявлением о рекомендации, модельным исследованием и обзором доказательств для раскрытия финансовой информации всех других авторов. Фольк сообщает о грантах от NCI и Техасского научно-исследовательского института по профилактике рака, а также является членом рабочей группы по совместному принятию решений Национального круглого стола по раку легких, для которой он получил путевые расходы для участия в ежегодном собрании. Пожалуйста, ознакомьтесь с точкой зрения всех других авторов, раскрывающих соответствующую финансовую информацию.
ДОБАВИТЬ ТЕМУ В СООБЩЕНИЯ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Целевая группа профилактических услуг США выпустила свое окончательное руководство по скринингу на рак легких, снизив возраст для начала скрининга до 50 лет, а требуемый стаж курения — до 20 пачко-лет.
В качестве обновления своего руководства от 2013 г., в котором содержится призыв к скринингу начиная с 55 лет для тех, кто курил не менее 30 упаковок лет, USPSTF теперь рекомендует ежегодный скрининг с применением КТ с низкой дозой для лиц в возрасте от 50 до 80 лет и 20 пачок курения в прошлом, которые курят в настоящее время или бросили курить в течение последних 15 лет, в соответствии с проектом руководства, выпущенным в июле. Целевая группа также рекомендует проверить отказ от курения после того, как человек не курил в течение 15 лет или у него появилось заболевание, ограничивающее его продолжительность жизни или не позволяющее ему перенести операцию на легких.
Данные были получены из Jonas DE, at al. JAMA . 2021; DOI: 10.1001 / jama.2021.0377.Целевая группа присвоила этой рекомендации B, что указывает на высокую степень уверенности в умеренной чистой прибыли или умеренную уверенность в средней или значительной чистой прибыли.
Целевая группа процитировала исследование, показывающее, что эти расширенные критерии увеличат относительный процент лиц, имеющих право на скрининг, на 87% по сравнению с критериями 2013 года, с большим увеличением среди чернокожих (107%) и латиноамериканских (112%) взрослых, чем среди взрослых белых (78 %), а среди женщин (96%), чем среди мужчин (80%).
Джон Б. Вонг
«Рак легких — причина № 1 смертности от рака среди мужчин и женщин в США», Джон Б. Вонг, доктор медицины, член USPSTF, а также главный научный сотрудник, заместитель председателя по клиническим вопросам, руководитель отдела принятия клинических решений и врач первичной медико-санитарной помощи в медицинском центре Тафтс сказал Healio. «Мы знаем, что ежегодный скрининг с компьютерной томографией для людей с высоким риском курения может спасти жизни.Снижая стартовый возраст и количество стай-лет, мы получаем относительное увеличение числа чернокожих и женщин, которые получают право на спасительный скрининг на рак легких. В конечном итоге мы надеемся, что с помощью скрининга на рак легких мы сможем сократить число американцев, которые в конечном итоге умирают от этой разрушительной болезни ».
Подтверждающие доказательства
В качестве основы для обновления Йонас и его коллеги провели обзор литературы по MEDLINE, Кокрановской библиотеке и реестрам испытаний — результаты которого были опубликованы в JAMA — для выявления 223 публикаций, связанных со скринингом с использованием КТ малых доз, моделями прогнозирования риска и лечение рака легких на ранней стадии.Они выявили семь рандомизированных клинических испытаний КТ с низкой дозой для скрининга рака легких, крупнейшими из которых были Национальное испытание по скринингу легких (NLST, n = 53 454) и Nederlands-Leuvens Longkanker Screenings Onderzoek (NELSON, n = 15 792).
NLST оценил три цикла ежегодной КТ с низкой дозой по сравнению с рентгенологическим исследованием грудной клетки для нынешних и бывших курильщиков высокого риска в возрасте от 55 до 74 лет. После 6,5 лет наблюдения результаты показали, что КТ в низких дозах приводила к снижению смертности от рака легких (коэффициент заболеваемости [IRR] = 0.85; 95% ДИ, 0,75–0,96), с числом, необходимым для скрининга, чтобы предотвратить одну смерть от рака легкого — 323.
NELSON, который сравнивал четыре курса КТ с низкой дозой с увеличивающимися интервалами без скрининга среди нынешних и бывших курильщиков высокого риска в возрасте от 50 до 74 лет, также показал снижение смертности от рака легких в течение среднего периода наблюдения в 10 лет (IRR = 0,75; 95% ДИ, 0,61-0,9), с числом, необходимым для скрининга на предотвращение одной смерти от рака легкого, равным 130.
«В критериях включения NELSON был более молодой возраст, сниженный до 50 лет, и меньшее количество стай-лет», — сказал Вонг Healio.«Эти данные … в сочетании с компьютерным моделированием, позволили нам с уверенностью снизить возраст начала до 50 [лет] и учесть более легкое курение».
USPSTF также основывает свое руководство на результатах исследования моделирования, проведенного Мезой и его коллегами, также опубликованного в JAMA , для которого исследователи создали четыре модели истории рака легких для лиц, родившихся в 1950-х и 1960-х годах, за которыми наблюдали в возрасте от 45 до 90 лет. годы. Исследователи оценивали скрининг с разным возрастом и частотой начала и окончания, а также с различными критериями отбора, основанными на возрасте, стажировке, годах после отказа от курения и оценках индивидуального риска.
Результаты показали, что стратегии скрининга на основе факторов риска, которые оказались наиболее эффективными, начали скрининг в возрасте 50 или 55 лет и продолжали его до 80 лет. Критерии, использованные в рекомендациях USPSTF 2013 года, не оказались эффективной стратегией для когорты рожденных в 1960 году.
Meza и его коллеги также обнаружили, что сокращение требований к курению для ежегодного скрининга до 20 пачек-лет увеличит долю населения, когда-либо имеющего право на курение, до 20.6% до 23,6%, с 14,1% по критериям 2013 года. Когда исследователи сравнили соответствие критериям отбора по полу и расе / этническому происхождению, они обнаружили, что увеличение правоспособности было больше для женщин, чем для мужчин, а также для чернокожих, испаноязычных и американских индейцев / коренных жителей Аляски по сравнению с белыми и азиатскими людьми.
Кроме того, такой подход увеличит продолжительность жизни (6 018–7 596 на 100 000 против 4 882 на 100 000).
Возможный вред
Скрининг также был связан с потенциальным вредом, включая радиационно-индуцированный рак, ложноположительные результаты и страдания пациента.
Например, ложноположительные результаты в NLST привели к 17 инвазивным процедурам на 1000 человек, прошедших скрининг (число необходимых для нанесения вреда, 59), при этом 0,1% обследованных имели серьезные осложнения. Кроме того, по оценкам исследователей, от 0% до 67% случаев рака легких были диагностированы с гипердиагностикой, а оценка случайных результатов варьировалась от 4,4% до 40,7%.
В модельном исследовании исследователи обнаружили, что ежегодный скрининг лиц с 20-летним стажем курения приведет к большему количеству ложноположительных результатов (1.9–2,5 на человека, прошедшего скрининг, против 1,9 на человека, прошедшего скрининг), случаев гипердиагностики (83–94 на 100 000 против 69 на 100 000) и случаев смерти от рака легких, связанного с радиацией (29–42,5 на 100 000 против 20,6 на 100 000) по сравнению с 2013 годом. критерии.
Большая часть потенциального вреда возникает из-за того, что КТ с низкой дозой дает изображение, из-за которого, по словам Вонга, трудно различить доброкачественные и злокачественные образования.
«Это может привести к дополнительным тестам для уточнения, а иногда к биопсии, а иногда даже к хирургическому вмешательству», — сказал он.«Однако это по большей части краткосрочные неудобства. Для меня краткосрочный дискомфорт более чем перевешивается потенциальным обнаружением рака легких на ранней стадии, когда он поддается лечению и потенциально излечим, в отличие от того, чтобы не замечать его с помощью скрининга и не обнаруживать его после появления симптомов, после чего он обычно распространяется и шансы на выживание резко падают.
«Мы сопоставляем эти краткосрочные неудобства с долгосрочными выгодами, когда вы действительно можете спасти чью-то жизнь и улучшить его качество, не борясь с распространившимся раком легких», — добавил он.
Совместное принятие решений
Расширение USPSTF критериев приемлемости для скрининга рака легких будет уделять больше внимания совместному принятию решений, процессу, предусмотренному CMS в его записке о решении для охвата скрининга, согласно точке зрения, которая сопровождает публикации JAMA Robert J. Volk , Доктор философии, профессор исследований в области здравоохранения в Онкологическом центре им. М. Д. Андерсона Техасского университета и его коллеги.
Роберт Дж. Волк
«Новые критерии отбора расширят возможности скрининга для включения групп населения с более низким абсолютным риском рака легких», — сказал Волк Healio.«Совместные обсуждения принятия решений для всех подходящих групп должны подчеркивать важность ежегодного скрининга; потенциальные преимущества раннего выявления рака легких, когда шансы на излечение больше; и вред, включая ложные срабатывания, приводящие к ненужным тестам, гипердиагностике и лучевому облучению, особенно от диагностических тестов ».
Поскольку расширенное право на участие делает скрининг доступным для большего числа женщин и женщин из исторически недопредставленных групп, совместное принятие решений также может улучшить справедливость в отношении здоровья за счет взаимодействия с этими уязвимыми группами населения, добавили Волк и его коллеги.
«Для пациентов с более низкой санитарной грамотностью могут быть разработаны вспомогательные средства для принятия решения по скринингу рака легких, которые могут представлять информацию о риске и пользе таким образом, чтобы пациенты могли лучше ее понять, и быть на других языках, кроме английского», — сказал Волк Healio. «Эти стратегии могут сделать информацию более доступной, способствовать вовлечению и исследовать ценности пациентов, связанные с решением о скрининге».
Однако совместное принятие решений иногда рассматривалось как еще одно препятствие для проверки, учитывая временные ограничения.
«Хорошо известно, что у врачей есть ограниченное время для профилактических бесед с пациентами, включая разговоры о скрининге на рак легких, — сказал Волк. — Одним из решений является привлечение нефизиков из клинической группы с определенной ролью и временем для проведения совместное принятие решений, например, медсестры или социальные работники ».
Такие разговоры также являются решающим моментом для обсуждения отказа от курения.
«Прежде всего, я хотел бы пригласить любого, кто курит, поговорить со своим врачом о том, что курение делает и как бросить курить, что включает как консультации, так и лекарства», — сказал Вонг.«Для тех, кто давно курил или продолжает курить, я бы посоветовал им поговорить со своим врачом о скрининге на рак легких, который, основываясь на научных данных и доказательствах, снижает смертность от легких. рака и помочь людям жить более здоровой и долгой жизнью ».
Артикул:
Hoffman RM, et al. ДЖАМА. 2021; DOI: 10.1001 / jama.2021.1817.
Jonas DE, at al. JAMA . 2021; DOI: 10.1001 / jama.2021.0377.
Meza R и др. JAMA . 2021; DOI: 10.1001 / jama.2021.1077.
USPSTF. JAMA . 2021; DOI: 10.1001 / jama.2021.1117.
Для доп. Информации:
Роберт Дж. Волк, доктор философии , можно связаться в онкологическом центре им. Доктора медицины Андерсона Техасского университета, 1515 Holcombe Blvd., Houston, TX 77030; электронная почта: [email protected].
John B. Wong, MD , , с ним можно связаться в Институте клинических и трансляционных исследований Тафтса в Медицинском центре Тафтса, 35 Kneeland St., 8-й этаж, Бостон, Массачусетс 02111; электронная почта: [email protected].
Перспектива
Вернуться к началуМайкл Б. Стейнберг, MD, MPH, FACP
Изменения USPSTF к своим руководящим принципам по скринингу с использованием КТ с низкой дозой (НДКТ) для раннего выявления рака легких — еще один шаг вперед в ускорении достижений в снижении смертности от рака в США. Нет лучшего места для начала, чем с основной причины. смертности от рака как среди мужчин, так и среди женщин — от рака легких.
Первоначальные руководящие принципы были основаны на критериях отбора из основополагающих исследований, продемонстрировавших значительное улучшение показателей смертности. Однако с момента появления этих оригинальных руководств мы стали лучше понимать факторы риска, способствующие развитию рака легких.
Снижение возраста для начала проверки и годовой экспозиции упаковки особенно важны для некоторых цветных сообществ. Например, заболеваемость раком легких среди афроамериканцев / чернокожих мужчин выше, чем среди белых мужчин.Кроме того, темнокожие курильщики — и в некоторой степени курильщики латиноамериканцев / латиноамериканцев — курят ментоловые сигареты чаще, и в целом курильщики ментола, как правило, выкуривают меньше сигарет в день. Появляется все больше свидетельств того, что из-за «охлаждающего» анестезирующего действия ментола курильщики этих ароматизированных сигарет могут вдыхать более глубоко и, следовательно, иметь повышенное воздействие токсинов, даже если они выкуривают меньше сигарет. Таким образом, пороговое значение годовой пачки для курильщиков ментола, включая значительную долю афроамериканцев / чернокожих курильщиков, возможно, не было достигнуто в соответствии со старыми руководящими принципами, несмотря на то, что эти курильщики могут иметь значительно повышенный риск рака легких.Теперь это будет улучшено.
Как и в случае со всеми скрининговыми тестами, при расширении критериев приемлемости риск ложноположительных тестов может возрасти. Тем не менее, в целом, правильно используемый эффективный скрининговый тест на рак может быть очень ценным инструментом для снижения смертности от рака.
Как подчеркивает USPSTF, в связи с огромной пользой отказа от курения в предотвращении заболеваний, вызванных табаком, таких как рак легких, необходимо увязать скрининг рака легких с эффективным лечением табака, основанным на фактических данных.Контактное лицо для НДКТ — критически важный момент, по которому можно научиться принимать меры против табака. И наоборот, те, кто проводит такие вмешательства, должны рассмотреть возможность оценки соответствия критериям НДКТ и рекомендовать курильщикам, которые имеют на это право, поговорить со своим медицинским работником для возможного направления на скрининг рака легких, как указано.
Скрининг рака легких с помощью НДКТ используется крайне недостаточно, и его проходят менее 15% подходящих людей. С расширением критериев приемлемости фактический коэффициент использования снизится еще больше.Несмотря на понимание преимущества LDCT в отношении смертности уже более 10 лет, знакомство с LDCT все еще довольно низкое, даже среди врачей. Таким образом, отчаянно необходимы согласованные усилия для повышения осведомленности и пользы НДКТ как среди населения в целом, так и среди специалистов здравоохранения.
Хотя доступ к скринингу на рак по-прежнему может быть серьезным препятствием, это важное обновление руководящих принципов по скринингу рака легких будет иметь важное значение для обеспечения того, чтобы люди с повышенным риском развития рака легких могли пройти скрининговые тесты, основанные на фактических данных, которые, как мы надеемся, дадут результат. в более раннем выявлении этих видов рака и улучшении результатов лечения.
Артикул:
Zahnd WE и Eberth JM. Am J Prev Med . 2019; DOI: 10.1016 / j.amepre.2019.03.015.
Майкл Б. Стейнберг, MD, MPH, FACP
HemOnc Today Член редколлегии
Медицинская школа Рутгерса Роберта Вуда Джонсона
Раскрытие информации: Steinberg не сообщает о раскрытии соответствующей финансовой информации.
Перспектива
Вернуться к началуРохит Кумар, Мэриленд
С момента публикации NLST было проведено множество исследований, в которых оценивалась полезность и применение КТ-изображений грудной клетки с низкой дозой для скрининга рака легких.В центре внимания большинства этих исследований была попытка обогатить скрининговую популяцию, чтобы увеличить количество спасенных жизней при одновременном снижении вреда, и определить подходящий временной интервал скрининга. Недавнее положительное испытание NELSON в Европе значительно дополнило эту информацию. Используя данные этих испытаний вместе с исследованиями моделирования, проведенными через Сеть моделирования вмешательства и наблюдения за раком или CISNET, USPSTF смогла значительно изменить свои рекомендации по критериям отбора для скрининга рака легких.
В этой хорошо написанной и подробной публикации JAMA целевая группа и исследователи сопутствующих исследований показали умеренную чистую выгоду от предотвращения значительно большего числа смертей от рака легких при максимальном увеличении количества лет жизни за счет снижения возрастных критериев до 50 лет и воздействие табака на 20 пачек-лет для нынешних курильщиков или тех, кто бросил курить в течение 15 лет. Согласно исследованиям моделирования, ежегодный скрининг по сравнению с раз в два года также кажется более подходящей стратегией.Это также, вероятно, поможет уменьшить неравенство в скрининге рака легких за счет возможности включать больше чернокожих, латиноамериканцев и женщин.
Скрининг на основе факторов риска также оказался более подходящим, чем скрининг на основе прогнозирования на основе модели риска; однако это, вероятно, связано с тем, что в моделях CISNET вряд ли будет достаточно данных для прямого сравнения этих двух стратегий. Авторы признают, что в ходе проводимых исследований будет больше данных, чтобы ответить на этот вопрос, однако они считают, что внедрение скрининга на основе модели прогнозирования риска практически сложнее и, вероятно, будет ограниченным.
Эти рекомендации, вероятно, повлияют на значительные изменения в программах скрининга по всей стране и, мы надеемся, приведут к увеличению использования скрининга рака легких среди более разнообразного населения.
Рохит Кумар, Мэриленд
Онкологический центр Fox Chase
Раскрытие информации: Кумар не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В СООБЩЕНИЯ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Выживаемость, прогноз и др.
Существует два основных типа рака легких: немелкоклеточный рак легкого и мелкоклеточный рак легкого. У каждого есть отдельная система стадий, которую врачи используют для определения степени распространенности рака.
Стадия помогает врачам предсказать вероятный прогноз для человека, страдающего раком легких. Это также может помочь им разработать наилучший план лечения.
В этой статье мы рассмотрим различные системы стадий для основных типов рака легких, их влияние на прогноз, а также обзор симптомов и диагнозов.
Оба основных типа рака легких имеют разные системы стадий.
Немелкоклеточный рак легкого
По данным Американского онкологического общества (ACS), немелкоклеточный рак легкого (NSCLC) составляет 80–85% случаев рака легкого.Три основных подтипа:
- Аденокарцинома : Около 40% людей с раком легкого страдают аденокарциномой. Обычно он развивается во внешних частях легкого и имеет тенденцию расти медленнее, чем два других подтипа. Это означает, что у вас больше шансов найти и вылечить опухоль до того, как она распространилась.
- Плоскоклеточный рак : На его долю приходится около 25–30% случаев рака легких. Он растет из клеток, выстилающих внутреннюю часть дыхательных путей. Плоскоклеточный рак обычно развивается в центре легкого.
- Крупноклеточная карцинома : Около 10–15% случаев рака легких относятся к этому типу. Он может расти в любой части легкого и имеет тенденцию расти быстрее, чем другие подтипы.
Врачи обычно используют следующие критерии для определения стадии НМРЛ:
- размер и расположение опухоли
- количество ближайших лимфатических узлов, на которые распространился рак
- распространился ли рак на отдаленные органы (метастазировал)
Используя эти критерии, они вычисляют, какая из следующих стадий лучше всего описывает НМРЛ:
Стадия 1Опухоль находится в одном легком и не распространилась на лимфатические узлы или отдаленные органы.
Стадия 2Рак больше 3 сантиметров (см) в поперечнике. Возможно, он распространился на лимфатические узлы внутри легких, но не на какие-либо отдаленные органы.
3 стадияРак имеет диаметр более 7 см. Возможно, он распространился на лимфатические узлы в центре грудной клетки, но не на какие-либо отдаленные органы. Стадия 3 имеет два подтипа:
- 3a: Рак не распространился на противоположную сторону грудной клетки.
- 3b: Рак распространился на лимфатические узлы противоположного легкого или около ключицы.
НМРЛ распространился на другое легкое, на жидкость вокруг легкого или сердца, или на отдаленные лимфатические узлы или органы.
Мелкоклеточный рак легкого
На мелкоклеточный рак легкого (МРЛ) приходится около 15% всех случаев рака легкого.
Наиболее распространенная система стадирования SCLC разбивает заболевание на две категории:
Ограниченная стадияРак развился только на одной стороне грудной клетки и затрагивает одну область легкого, лимфатические узлы или и то, и другое. .
Обширная стадияРак распространился на противоположную сторону грудной клетки или за ее пределы.
Эксперты говорят о 5-летней выживаемости. Это относится к шансам человека выжить в течение 5 лет после постановки диагноза по сравнению с тем, у кого нет рака.
ACS использует следующие стадии для оценки шансов выжить в течение 5 лет или дольше после диагностики мелкоклеточного или немелкоклеточного рака легкого:
- Локализованный: На момент постановки диагноза рак ограничен к одной части тела.
- Региональный: Распространение на близлежащие ткани.
- Отдаленный: Распространяется по всему телу и поражает другие органы.
Согласно ACS, 5-летняя выживаемость при немелкоклеточном раке легкого составляет:
Для мелкоклеточного рака легкого ожидаемая продолжительность жизни составляет:
Перспективы для человека с раком легкого зависит от типа и стадии.
Другие факторы, которые могут повлиять на прогноз, могут включать:
- возраст
- пол
- уровни воспалительной реакции
- статус работоспособности
статус работоспособности означает способность человека позаботиться о себе до того, как разовьется рак.Те, кто по какой-либо причине нуждается в большей поддержке в повседневной жизни, могут иметь худшее мировоззрение. Воспалительная реакция — это то, как иммунная система человека реагирует на любой вид атаки.
В исследовании 2015 года отмечается, что воспалительная реакция человека и его работоспособность могут играть важную роль в прогнозе для людей с раком легких как SC, так и NSC. Авторы предполагают, что они могут быть более значимыми, чем возраст или пол.
Некоторые исследования показали, что это может быть правдой, особенно для людей с SCLC.
Другие болезни, например пневмония, могут повлиять на внешний вид человека с раком легких. В исследовании, опубликованном в 2020 году, сделан вывод, что люди с раком легких представляют собой уязвимую группу населения перед лицом COVID-19. Они с большей вероятностью будут проводить время в больнице и имеют более высокий риск развития острого респираторного дистресс-синдрома.
Прогноз для немелкоклеточного рака легкого обычно лучше, чем для мелкоклеточного рака легкого. Однако рак поражает всех по-разному, и невозможно точно предсказать индивидуальный результат.
Каковы перспективы человека с раком легких 4 стадии?
Симптомы рака легких могут напоминать симптомы бронхита или пневмонии. Это одна из причин, по которым более 70% случаев рака легких уже находятся на поздних стадиях, прежде чем врачи обнаруживают их, согласно обзору 2015 года.
ACS рекомендует обратиться за консультацией при появлении следующих симптомов:
- постоянный кашель с регулярным выделением крови или темной мокроты
- хриплый голос
- боль в груди
- одышка
- хрипы
- частые респираторные инфекции
- усталость или слабость
- снижение аппетита
- потеря веса
По мере прогрессирования рака легких могут развиваться новые симптомы.К ним относятся:
- головные боли, головокружение или судороги, которые могут указывать на то, что рак распространился на нервную систему
- желтуха из-за распространения рака на печень
- комков под кожей, если рак достиг лимфатических узлов
- боль в спине
- боль в бедре
- общая боль в костях
Скрининг может принести пользу не каждому человеку, подверженному риску рака легких.
Однако люди из группы высокого риска могут увеличить свои шансы на выявление и лечение рака легких до того, как он перейдет в более позднюю, более опасную стадию.
Врачи рекомендуют проведение компьютерной томографии с низкой дозой облучения для выявления рака легких.
ACS определяет людей, подходящих для обследования на рак легких по следующим критериям:
- в возрасте 55–74 лет
- в настоящее время курят или бросили курить в течение последних 15 лет
- имеют историю курения, эквивалентную одному упаковка в день в течение 30 лет, две упаковки в день в течение 15 лет и т. д.
Люди из этих категорий могут поговорить со своим врачом о том, подходит ли им скрининг.
Каковы ранние признаки рака легких?
Если симптомы указывают на наличие рака легких, врач сначала проведет рентген грудной клетки.
Если рентген обнаруживает признаки опухоли или не определяет причину симптомов грудной клетки, врач запросит компьютерную томографию. КТ дает более детальное изображение и может выявить размер, форму и положение опухоли в легком.
Следующим шагом является определение того, является ли узелок, масса или другая важная особенность на компьютерной томографии раком легких, и если да, то какого типа.
Для этого врач назначит биопсию легочной ткани с помощью иглы или хирургического вмешательства. В качестве альтернативы врач может исследовать образцы клеток мокроты или жидкости, окружающей легкие.
Врачи используют разные системы стадирования в зависимости от типа рака легких. Этапы зависят от размера опухоли, от того, распространилась ли она и где она распространилась.
Иногда симптомы рака легких напоминают другие заболевания, такие как бронхит или пневмония, что означает, что врачи не всегда ставят диагноз, пока он не достигнет более поздней стадии.
Однако в некоторых случаях скрининг может помочь, а ранняя диагностика позволяет выявить рак легких на более излечимой стадии.
Любому, у кого наблюдаются симптомы, которые могут указывать на рак легких, следует как можно скорее поговорить с врачом.
Рак легкого у молодых пациентов: характеристики опухоли и лечение в ирландском населении — Калливан
Введение
Рак легких — одна из ведущих причин смертности от рака во всем мире. Хотя большинство случаев рака легких возникает у пациентов пожилого возраста, существует важная подгруппа более молодых пациентов, которые страдают этим заболеванием.Исследования показывают, что рак легких у более молодых пациентов имеет различные характеристики, особенно в отношении пола пациента, статуса курения и морфологии опухоли (1-4).
Национальные и международные данные демонстрируют рост заболеваемости раком легких у женщин, в то время как заболеваемость у мужчин продолжает снижаться. Есть данные, позволяющие предположить, что эта тенденция повторяется и у более молодых пациентов (5,6). Точный механизм этого неизвестен, однако это высвечивает важные вопросы, касающиеся факторов риска рака легких, специфичных для пола, которые могут иметь важные последствия для стратификации риска и потенциального скрининга.Более того, более высокая частота аденокарциномы была продемонстрирована у более молодых пациентов, независимо от пола, что имеет важные последствия для лечения (1-4). Все больше пациентов получают целенаправленное лечение рака легких, и терапевтические возможности расширяются в свете последних достижений в молекулярной диагностике и лечении рака легких. Это дает захватывающие возможности изучить такие методы лечения в более молодой когорте. Это ретроспективное одноцентровое исследование было разработано для определения характеристик рака легких у пациентов в возрасте 55 лет и младше в ирландском населении.
Методы
Это ретроспективное одноцентровое исследование пациентов в возрасте 55 лет и младше с подтвержденным диагнозом рака легких. С разрешения учреждения с января 2010 года по декабрь 2016 года из местных медицинских карт и электронной базы данных больницы были собраны данные о возрасте пациента на момент постановки диагноза рака легкого, его поле, истории курения, методах диагностики, стадии, гистологическом подтипе опухоли и локализации, а также о первоначальном выборе лечения. .Пациенты с диагнозом, отличным от рака легких, или в возрасте старше 55 лет были исключены из исследования. Отобранные пациенты были разделены на три категории в зависимости от возраста; <35 лет, 35–44 года и 45–55 лет. Диагноз рака легких был основан на клинических, радиологических и гистологических данных, а также на обсуждениях многопрофильной группы (MDT) на региональной встрече MDT по раку легких в больнице Коркского университета, Ирландия.
Гистология опухоли была разделена на подгруппы немелкоклеточного рака легкого (НМРЛ) не плоскоклеточного, НМРЛ плоскоклеточного, НМРЛ, не уточненного иначе (БДУ), мелкоклеточного рака легкого и карциноида (типичного и атипичного).Международная система TNM (опухоль-узел-метастаз), седьмое издание, использовалась для определения стадии опухоли, и при оценке учитывались результаты молекулярных тестов.
Статистический анализ был выполнен в комбинированных возрастных группах с использованием таблиц сопряженности 2 × 2 в программном обеспечении GraphPad для сравнения клинико-патологических характеристик. Во всех анализах значение P менее 0,05 считалось статистически значимым.
Результаты
Демография
С января 2010 года по декабрь 2016 года в больнице Коркского университета в общей сложности 1635 пациентов были диагностированы с раком легких.В общей сложности 130 пациентов соответствовали критериям включения и были отобраны для дальнейшего анализа. Характеристики пациентов отражены в Таблице 1 . Не было существенной разницы между показателями курения по гендерному признаку, поскольку 87% (n = 47) мужчин и 89% (n = 68) женщин были нынешними или бывшими курильщиками (P = 0,7289).
Метод диагностики
Всем пациентам (n = 130) в рамках диагностического обследования была выполнена компьютерная томография грудной клетки.Цитопатологические и гистопатологические образцы были получены с использованием различных методов, включая бронхоскопическую эндобронхиальную и трансбронхиальную биопсию (27%), эндобронхиальную трансбронхиальную игольчатую аспирацию под контролем УЗИ (20%), биопсию легкого под контролем КТ (15%), хирургическую биопсию (15%) и биопсию отдаленные метастазы (16%). Альтернативный метод использовался у 7% (n = 9) (, таблица 2, ).
Таблица 2 Описание диагностических методов, локализации опухоли, гистологии и стадии опухолиПолная таблица
Расположение опухоли
Что касается локализации опухоли, то большинство опухолей были расположены в верхних долях, так как 23% (n = 30) располагались в правой верхней доле и 19% (n = 24) в левой верхней доле.Остальные опухоли были расположены в прикорневой области (22%), нижних долях (19%) и других легочных участках у 17% (, таблица 2, ).
Гистология и стадия опухоли
НМРЛ без плоскоклеточного рака был диагностирован в 53% (n = 69) онкологических заболеваний, плоскоклеточный НМРЛ — в 15% (n = 19) и NSCLC NOS — еще в 7% (n = 9). Мелкоклеточный рак легкого был диагностирован у 14% (n = 18), а карциноид — у 11% (n = 15) (, таблица 2, ). Что касается стадии опухоли, 41% (n = 53) пациентов имели стадию заболевания IV, а 12% (n = 15) имели обширную мелкоклеточную карциному на момент постановки диагноза (, таблица 2, ).Все гистологические подтипы увеличивались с увеличением возраста пациента (P = 0,0536) ( Рисунок 1A ). Рисунок 1B изображает гистологию опухоли в соответствии с полом пациента и демонстрирует большее количество НМРЛ и мелкоклеточного рака легкого у молодых пациентов женского пола по сравнению с их коллегами-мужчинами, что не соответствовало статистической значимости (P = 0,6077).
Рисунок 1 Показывает характеристики рака легких у молодых пациентов в зависимости от возраста и пола пациента.(A) Демонстрирует гистологию опухоли в соответствии с возрастом пациента. Все гистологические подтипы увеличивались с увеличением возраста пациента. Это не соответствовало статистической значимости (P = 0,0536). (B) Показывает гистологию опухоли в зависимости от пола пациента. Более высокое количество НМРЛ и мелкоклеточного рака легкого было продемонстрировано у молодых пациентов женского пола по сравнению с их коллегами-мужчинами, что не соответствовало статистической значимости (P = 0,6077). НМРЛ, немелкоклеточный рак легкого.
Кроме того, мутации рецептора эпидермального фактора роста (EGFR), киназы анапластической лимфомы (ALK), онкогена саркомы крыс Кирстен (KRAS) и онкогена c-ros 1 (ROS1) оценивали в отдельных случаях в соответствии с рекомендациями MDT по лечению рака легких.Молекулярный анализ был проведен в 47 случаях (36%), и все положительные случаи были взаимоисключающими. Мутации EGFR были выявлены в 4 (9%) из 47 случаев, а транслокация ALK — в 1 (3%) из 30 образцов. В Ирландии оценка мутаций KRAS и экспрессии лиганда запрограммированной смерти 1 (PD-L1) рекомендуется только в случаях распространенного НМРЛ, при отсутствии доказательств наличия мутаций EGFR или ALK Мутации KRAS в 4 (80%) из 5 проанализированных образцов ( Таблица 90). 3 ). Экспрессия PD-L1 оценивалась в 6 случаях.Высокая экспрессия PD-L1 (> 50%) присутствовала в 1 случае (16,7%) и низкая экспрессия (1–50%) в следующем случае (16,7%). Остальные 4 случая, проверенные на экспрессию PD-L1, были отрицательными (66,7%) (, таблица 4, ).
Лечение
Наиболее распространенным начальным лечением I – II стадии заболевания было хирургическое вмешательство (n = 33, 25%), а для стадии III (n = 7, 5%) и IV (n = 31, 24%) химиотерапия.Пациенты с мелкоклеточным раком легкого обычно сначала получали комбинированную химиотерапию и лучевую терапию или только химиотерапию (n = 17, 13%) (, таблица 5, ).
Таблица 5 Первичное лечение в зависимости от стадии пациентаПолная таблица
Обсуждение
Рак легких является одной из основных причин смертности от рака во всем мире, а рак легких у молодых может быть разрушительным и ограничивающим жизнь заболеванием.Исследования в этой когорте в настоящее время ограничены определенными факторами, включая двусмысленность в отношении точного определения термина «молодые» и небольшой и часто ретроспективный характер этих исследований. Тем не менее, это многоцентровое ретроспективное исследование выявляет некоторые интересные характеристики в этой популяции, и, насколько нам известно, это первое исследование в ирландской популяции, описывающее рак легких у пациентов в возрасте 55 лет и младше.
В настоящее время существует заметная неоднородность в отношении определения «молодых» пациентов с раком легкого в литературе; например Rocha et al. [1994] выбрал порог 40-летнего возраста, Kreuzer et al. [1998] выбрал 45 лет, а Franceschini et al. [2017] принял пороговое значение в 55 лет для определения «молодых» (1-3). Причины такого выбора часто неясны. Арнольд и др. [2016] выбрал возрастной порог в своем исследовании, рассчитав возраст на два стандартных отклонения ниже среднего возраста диагноза рака легких в их популяции (4), что может быть подходящим подходом, ориентированным на популяцию.Уточнение этого определения необходимо для руководства при планировании будущих исследований и облегчения последующих сравнений. В отчете Национального онкологического реестра Ирландии (NCRI) за 2011 год отмечается, что 9% пациентов с диагнозом рака легких в период с 1994 по 2008 годы были моложе 55 лет, и поэтому в нашем исследовании в ирландском университете был выбран порог 55 лет. население (7).
Это исследование описывает интересные характеристики, касающиеся пола, локализации опухоли и гистологии.Во-первых, это исследование предполагает преобладание женщин (59%, n = 76). Это согласуется с ирландскими и международными данными, демонстрирующими рост заболеваемости раком легких у женщин. В частности, Национальный регистр рака Ирландии (NCRI) сообщил о снижении заболеваемости раком легких у мужчин (-0,8% в год) и росте показателей у женщин (+ 2,0% в год) с 1994 по 2013 год (5). Аналогичная тенденция была отмечена Jemal et al. среди американского населения, что свидетельствует о более высокой заболеваемости раком легких среди женщин (6).Увеличение количества курящих среди женщин частично объясняет эту тенденцию, и наше исследование подчеркивает постоянную значимость этого фактора риска, поскольку 88% (n = 115) молодых пациентов с раком легких были нынешними или бывшими курильщиками. Такие авторы, как Campling et al. [2019] продемонстрировали значительную разницу в возрасте между нынешними и бывшими курильщиками (8), предполагая, что продолжающееся воздействие табака может повысить склонность к развитию рака легких у продолжающих курить. Этот результат не был воспроизведен в нашем исследовании, поскольку средний возраст при постановке диагноза рака легких составлял 52 и 53 года для нынешних и бывших курильщиков соответственно (P = 0.5617). Хотя эти результаты подтверждают ценность постоянных антитабачных мер, эта разница в частоте случаев рака легких не полностью объясняется половыми различиями в курении. Для установления точных механизмов необходимо продолжить исследования факторов риска рака легких, специфичных для пола, включая восприимчивость к канцерогенам табака (6,9).
Кроме того, расположение опухоли является важным фактором, который следует учитывать при оценке случаев подозрения на рак легкого.42% (n = 54) случаев рака легких в этом исследовании были выявлены в верхних долях. Американский колледж грудных врачей и Британское торакальное общество определили расположение верхней доли как независимый прогностический фактор злокачественности одиночных легочных узелков (10,11). Некоторые исследования предполагают, что эта связь потенциально более выражена у молодых пациентов (12,13), однако этот вывод противоречив (14).
Гистология и стадия опухоли имеют важное лечебное и прогностическое значение.К сожалению, у более молодых пациентов диагноз рака легких иногда откладывается, поскольку клиническое подозрение на рак легких часто ниже. Это было подчеркнуто Bryant et al. [2008] и Dell’Amore et al. [2015], поскольку более молодые пациенты часто направлялись к торакальным хирургам позже, чем пациенты старшего возраста (15,16). В нашем исследовании диагноз рака легких во всех случаях ставился на основании патологических образцов. Предположительно, это отражает благоприятный статус у более молодых пациентов из-за меньшего количества сопутствующих заболеваний и возможную тенденцию к более агрессивному обследованию этих пациентов из-за их возраста.Это контрастирует с практикой в отношении всей популяции раком легкого в нашем центре, поскольку в 2016 году 15% (n = 53) всех пациентов с раком легкого не прошли инвазивные тесты из-за плохой успеваемости или предпочтений пациентов и, следовательно, получили клинический диагноз: только рак легких (17).
Многочисленные исследования продемонстрировали преобладание аденокарциномы у молодых пациентов с раком легкого и тенденцию к постановке диагноза на поздней стадии (18-21). Эти результаты повторяются в нашем исследовании, поскольку аденокарцинома была доминирующим подтипом (46%, n = 64), а 53% (n = 68) имели диагноз НМРЛ IV стадии или обширный мелкоклеточный рак легкого при поступлении.Это ставит интересные вопросы относительно скрининга на рак легких у более молодых пациентов. Текущие данные, а именно Национальное исследование рака легких и исследование NELSON, предполагают роль скрининга рака легких в группах высокого риска, которые часто определяются как «пожилые», с соответствующим многолетним анамнезом (22,23). Эта модель может не учитывать более молодых пациентов из группы «высокого риска».
В данном исследовании молекулярный анализ был выполнен в 36% (n = 47) случаев.Эти показатели сопоставимы с недавними данными, опубликованными Bigay-Gamé et al. [2018] во французской когорте молодых пациентов с раком легкого, поскольку только одна треть их популяции прошла молекулярное профилирование (18), что отражает необязательный характер биологического профилирования в обеих странах в этот период и ограниченные терапевтические возможности. Например, в Ирландии оценка мутаций KRAS и экспрессии PD-L1 рекомендуется только в случаях распространенного НМРЛ, при отсутствии доказательств мутаций EGFR или ALK.Интересно, что недавнее многоцентровое исследование, изучающее частоту молекулярных мутаций в ирландской популяции, отметило, что частота мутаций гена KRAS составляет 41,6% во всей их когорте с раком легких (24). Поэтому дополнительные данные, касающиеся молекулярной диагностики, экспрессии PD-L1 и бремени опухолевых мутаций у молодых пациентов с раком легкого, не только желательны, но и необходимы, и могут иметь значимые клинические последствия (25).
Учитывая ретроспективный характер этого исследования, документация о конкретных факторах риска пациентов, таких как семейный анамнез и употребление запрещенных наркотиков, была неполной и поэтому не была включена.Это возможное ограничение, поскольку предыдущие исследования подчеркнули потенциальную важность этих факторов риска в этой когорте (18,26). Еще одним ограничением является отсутствие контрольной группы пожилых пациентов, чтобы облегчить прямое сравнение в наших популяциях. Наконец, примерно в одной трети случаев был проведен молекулярный анализ, и дальнейшая информация о биологическом профилировании должна быть в центре внимания будущих исследований этой растущей когорты молодых пациентов
.Выводы
Это исследование подкрепляет существующие данные, которые демонстрируют отличительные характеристики у молодых пациентов с раком легких, включая преобладание женщин, высокие показатели аденокарциномы и частые поздние стадии при постановке диагноза.Требуются дальнейшие крупномасштабные многоцентровые исследования для проверки этих результатов и определения ответственных механизмов. Из этих данных ясно, что мы должны продолжать активно бороться с курением, одновременно исследуя эти результаты.
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Этическое заявление: Авторы несут ответственность за все аспекты работы, обеспечивая надлежащее расследование и решение вопросов, связанных с точностью или целостностью любой части работы. Исследование было одобрено Комитетом по этике исследований Корка [No. ECM 6 (q) 01.03.16].
Список литературы
- Rocha MP, Fraire AE, Guntupalli KK, et al. Рак легких у молодых.Cancer Detect Prev 1994; 18: 349-55. [PubMed]
- Kreuzer M, Kreienbrock L, Gerken M и др. Факторы риска рака легких у молодых людей. Am J Epidemiol 1998; 147: 1028-37. [Crossref] [PubMed]
- Franceschini JP, Jamnik S, Lopes Santoro I. Выживание в когорте пациентов с раком легких: роль возраста и пола в прогнозе. J Bras Pneumol 2017; 43: 431-6. [Crossref] [PubMed]
- Арнольд Б.Н., Томас Д.К., Розен Дж. Э. и др.Рак легких в очень молодом возрасте: лечение и выживание в национальной базе данных по раку. Дж. Торак Онкол 2016; 11: 1121-31. [Crossref] [PubMed]
- Национальный регистр рака. Рак в Ирландии 1994-2013: Годовой отчет Национального реестра рака. Корк, Ирландия: NCR, 2015. .
- Джемал А., Миллер К.Д., Ма Дж. И др. Более высокая заболеваемость раком легких у молодых женщин, чем у молодых мужчин в Соединенных Штатах. N Engl J Med 2018; 378: 1999-2009. [Crossref] [PubMed]
- Национальный регистр рака.Рак в Ирландии 1994-2008: Годовой отчет Национального реестра рака. Корк, Ирландия: NCR, 2011. .
- Campling BG, Ye Z, Lai Y, et al. Разница в возрасте при постановке диагноза рака легких между нынешними и бывшими курильщиками. J Cancer Res Clin Oncol 2019; 145: 1243-51. [Crossref] [PubMed]
- Табак и неравенство: Руководство по устранению неравенства в отношении вреда, связанного с табаком. Всемирная организация здравоохранения, 2014 г. Доступно в Интернете: http://www.euro.who.int/__data/assets/pdf_file/0005/247640/tobacco-0.pdf. Сентябрь 2018.
- Каллистер М.Э., Болдуин Д.Р., Акрам А.Р. и др. Рекомендации Британского торакального общества по исследованию и лечению легочных узелков. 2015; 70 Приложение 2: II1-54.
- Гулд М.К., Донингтон Дж., Линч В.Р. и др. Обследование людей с легочными узлами: когда это рак легких? Диагностика и лечение рака легких, 3-е изд: Руководство по клинической практике Американского колледжа грудных врачей, основанное на фактических данных. Сундук 2013; 143: e93S-e120S.
- Byers TE, Vena JE, Rzepka TF. Предрасположенность к раку легких для верхних долей: эпидемиологическое исследование J Natl Cancer Inst 1984; 72: 1271-5. [PubMed]
- Канеда Х., Уэмура Й., Накано Т. и др. Поражения у пациентов с мультифокальной аденокарциномой чаще встречаются в правых верхних долях. Interact Cardiovasc Thorac Surg 2012; 15: 627-32. [Crossref] [PubMed]
- Thomas A, Chen Y, Yu T, et al. Тенденции и характеристики молодых пациентов с немелкоклеточным раком легких в США.Фронт Онкол 2015; 5: 113. [Crossref] [PubMed]
- Брайант А.С., Cerfolio RJ. Различия в исходах между более молодыми и пожилыми пациентами с немелкоклеточным раком легкого. Энн Торак Сург 2008; 85: 1735-9. [Crossref] [PubMed]
- Dell’Amore A, Monteverde M, Martucci N, et al. Хирургия немелкоклеточного рака легкого у молодых пациентов: в чем различия? Heart Lung Circ 2015; 24: 62-8. [Crossref] [PubMed]
- Годовой отчет о ключевых показателях деятельности службы лечения рака легких за 2016 г., Южный региональный онкологический центр, Университет Корка.2016.
- Bigay-Gamé L, Bota S, Greillier L, et al. Характеристики рака легких у пациентов моложе 40 лет: проспективный многоцентровый анализ во Франции. Онкология 2018; 95: 337-43. [Crossref] [PubMed]
- Маруяма Р., Йошино И., Йохена Т. и др. Рак легких у пациентов моложе 40 лет. J Surg Oncol 2001; 77: 208-12. [Crossref] [PubMed]
- Скарин А.Т., Хербст Р.С., Леонг Т.Л. и др. Рак легких у пациентов младше 40 лет.Рак легких 2001; 32: 255-64. [Crossref] [PubMed]
- Рамалингам С., Павлиш К., Гаджил С. и др. Рак легких у молодых пациентов: анализ базы данных эпиднадзора, эпидемиологии и конечных результатов. Дж. Клин Онкол 1998; 16: 651-7. [Crossref] [PubMed]
- Национальная исследовательская группа по скринингу легких, Aberle DR, Adams AM, et al. Снижение смертности от рака легких с помощью низкодозовой компьютерной томографии. N Engl J Med 2011; 365: 395-409. [Crossref] [PubMed]
- Вилле М.М., Дирксен А., Ашраф Х. и др.Результаты рандомизированного датского скринингового исследования рака легких с упором на профилирование высокого риска. Am J Respir Crit Care Med 2016; 193: 542-51. [Crossref] [PubMed]
- Маллалли В.


 Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.
Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.

 Команда специалистов, включающая в себя онкологов, хирургов, радиологов, морфологов, лучевых терапевтов, определяет тактику лечения индивидуально для каждого пациента.
Команда специалистов, включающая в себя онкологов, хирургов, радиологов, морфологов, лучевых терапевтов, определяет тактику лечения индивидуально для каждого пациента.