Уменьшение мышечной массы причины: современные подходы к диагностике и лечению uMEDp
современные подходы к диагностике и лечению uMEDp
Потеря мышечной ткани с возрастом и вследствие некоторых серьезных заболеваний значительно снижает функциональные возможности человека, повышает риск падений и, как следствие, травм и переломов, определяет необходимость постороннего ухода. В статье представлены современные рекомендации по диагностике саркопении, определению степени тяжести потери мышечной ткани, подходы к терапии саркопении и перспективные разработки, рассмотрены препараты витамина D: химическая структура колекальциферола, альфакальцидола и кальцитриола, их биологические возможности, эффективность для повышения функциональных возможностей пожилых людей и снижения риска падений.
Таблица. Этиологическая классификация саркопении [11]
Саркопения – дегенеративная потеря мускулатуры (в среднем 0,5–1% каждый год после 25–30 лет), ухудшение качества мышечных волокон и снижение силы сокращения мышц.

Патогенетические аспекты целого ряда заболеваний, связанных с возрастом (атеросклероз, сахарный диабет 2 типа, остеопороз, деменция), изучаются давно, в то время как причины потери мышечной массы стали исследовать совсем недавно.
В связи с этим нами проанализированы причины и ключевые механизмы развития саркопении, подходы к диагностике этого состояния и способы немедикаментозной и медикаментозной коррекции.
Этиология саркопении
В подавляющем большинстве случаев саркопения связана со старением организма, поэтому чаще выявляется у пожилых людей. Однако это состояние встречается и у молодых пациентов.
Классификация потери мышечной ткани предполагает выделение первичной и вторичной саркопении, последняя подразделяется на формы в зависимости от первопричины заболевания [11]. Этиологическая классификация саркопении представлена в таблице.
Первичная саркопения обусловлена рядом факторов [11–13]:
- гормональной перестройкой.
 Она связана со снижением содержания половых гормонов, уровня соматотропного гормона, относительным увеличением содержания свободного кортизола, нарушением нормального циркадного ритма кортизола, снижением содержания витамина D и D-гормона и уменьшением количества/ухудшением чувствительности рецепторов к D-гормону;
Она связана со снижением содержания половых гормонов, уровня соматотропного гормона, относительным увеличением содержания свободного кортизола, нарушением нормального циркадного ритма кортизола, снижением содержания витамина D и D-гормона и уменьшением количества/ухудшением чувствительности рецепторов к D-гормону; - активизацией процессов апоптоза, митохондриальной дисфункцией, определяющей процессы старения клетки, дифференцировкой мезенхимальной стволовой клетки в адипоцит. В ряде случаев уменьшение мышечной массы происходит без уменьшения массы тела вследствие замещения мышечной ткани жировой;
- дегенерацией нервной системы, ухудшением иннервации мышечных волокон и денервацией.
В случае первичной саркопении процесс носит необратимый, прогрессирующий характер. Поэтому именно данная когорта пациентов нуждается в грамотной диагностике и разработке способов лечения.
При вторичных формах саркопении, как правило, отмечается один значимый этиологический фактор (таблица). Так, у пациентов, страдавших эндогенным гиперкортицизмом в 25–30-летнем возрасте, наблюдается значимое снижение функциональных возможностей и повышение риска переломов [14, 15]. Необходимо отметить, что в большинстве случаев эти процессы имеют полное или частичное обратное развитие после достижения ремиссии заболевания [16].
Так, у пациентов, страдавших эндогенным гиперкортицизмом в 25–30-летнем возрасте, наблюдается значимое снижение функциональных возможностей и повышение риска переломов [14, 15]. Необходимо отметить, что в большинстве случаев эти процессы имеют полное или частичное обратное развитие после достижения ремиссии заболевания [16].
Диагностическая концепция саркопении
Термин «саркопения» для обозначения феномена потери мышечной массы с возрастом впервые был предложен в 1997 г. [17], диагностическая концепция заболевания – в 1998-м [18]. Саркопенией считалось снижение тощей массы на два стандартных отклонения, измеренных при двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorptiometry – DXA), по отношению к молодому здоровому взрослому человеку соответствующего пола. Такой подход имел целый ряд преимуществ. Определение было понятно большинству врачей, демонстрировало высокие прогностические возможности для негативного исхода, а диагностика могла проводиться в ходе обследования на исключение остеопороза.
В 2010 г. концепция саркопении была пересмотрена. Европейская ассоциация клинического питания и метаболизма предложила определять саркопению при снижении мышечной массы более двух стандартных отклонений по сравнению с молодыми здоровыми лицами того же пола и этнической принадлежности. Кроме того, снижение мышечной массы должно было сочетаться со снижением скорости ходьбы человека (менее 0,8 м/с при четырехметровом тесте) [19].
Расширяя это понятие, Европейская рабочая группа по изучению саркопении у пожилых людей предложила выделять стадии саркопении [11]:
- первую (прекахексия) – снижение мышечной массы;
- вторую – снижение мышечной массы и мышечной силы или функциональных возможностей;
- третью (тяжелая форма) – снижение всех трех параметров.
Силу мышц сегодня оценивают при выполнении теста на силу сжатия динамометра, подъема со стула или из положения приседания и определении пикового респираторного объема (межреберные мышцы).
Тесты для оценки функциональных возможностей (короткий набор тестов функциональных возможностей, тест для определения скорости ходьбы, шестиминутный тест ходьбы и тест ходьбы по лестнице) ввиду сложности проведения и интерпретации используются только в клинических исследованиях [22].
В Европейском консенсусе по диагностике саркопении предложен алгоритм выявления пациентов с таким заболеванием. Отмечено, что исследование должны проходить пациенты старше 65 лет (или с факторами риска развития саркопении). Сначала оценивается скорость ходьбы (время прохождения 4 м). При скорости ходьбы более 0,8 м/с предлагается измерить силу сжатия динамометра. В случае нормальных показателей проводить исследование мышечной массы не надо. При скорости ходьбы менее 0,8 м/с или неадекватной силе сжатия динамометра необходимо исследовать мышечную массу (применяется DXA). Только после этого ставится диагноз.
Саркопения в составе других синдромов
Потеря мышечной массы наблюдается при кахексии. Кахексия – это комплексный метаболический синдром, который ассоциирован с основным заболеванием пациента и при котором происходит утрата мышечной массы с потерей жировой ткани или без таковой [23]. Кахексия часто сочетается с воспалительными процессами, инсулинорезистентностью, анорексией и ускоренным разрушением белков мышечной ткани [24].
Кахексия часто сочетается с воспалительными процессами, инсулинорезистентностью, анорексией и ускоренным разрушением белков мышечной ткани [24].
Другой гериатрический симптомокомлекс, включающий в себя саркопению, – немощность. Данное состояние обусловлено прогрессирующим снижением функций всех органов и систем с ухудшением резервных возможностей гомеостаза, снижением устойчивости к стрессовым факторам. При нем повышается риск падений, частота госпитализаций и летальных исходов [25]. Помимо физических проявлений (спонтанная потеря массы тела, переутомление, выраженная слабость, медленная походка, низкая физическая активность) [26] немощность проявляется в снижении когнитивных функций, социальной активности и др. [25].
Лечение саркопении
Немедикаментозная терапия. Традиционно считается, что дефицит физической активности является наиболее значимым фактором развития саркопении [27]. Однако даже у спортсменов, в том числе тех, кто продолжает активные тренировки, мышечная масса, мышечная сила и выносливость начинают снижаться после 30 лет [28, 29]. Тем не менее физические нагрузки – существенная составляющая терапии саркопении, поскольку было доказано, что непродолжительные силовые нагрузки повышают способность мышечной ткани синтезировать белок [29].
Тем не менее физические нагрузки – существенная составляющая терапии саркопении, поскольку было доказано, что непродолжительные силовые нагрузки повышают способность мышечной ткани синтезировать белок [29].
Медикаментозная терапия. Препарата с зарегистрированными показаниями для лечения саркопении пока не существует. Дегидроэпиандростерон и гормон роста человека показали минимальную эффективность или ее отсутствие в терапии саркопении. Гормон роста человека увеличивал синтез белков мышцей и, как следствие, мышечную массу, но это не повышало силу мышц и функциональные возможности [30]. Малоэффективным оказался и рекомбинантный инсулиноподобный фактор роста 1. Возможно, причиной стали сопутствующие воспалительные процессы и другие факторы, связанные с возрастом.
Тестостерон продемонстрировал определенное положительное влияние на мышечную силу и мышечную массу, но его применение у пациентов пожилого возраста было связано с рядом нежелательных явлений. Существует опасение в отношении развития рака предстательной железы, повышения сердечно-сосудистых рисков [31–33]. Кроме того, у женщин тестостерон вызывает вирилизацию.
Кроме того, у женщин тестостерон вызывает вирилизацию.
Для коррекции или замедления развития саркопении сегодня рассматриваются потенциальные возможности грелина, ингибиторов ангиотензинпревращающего фермента и эйкозапентаеновой кислоты (ЭПК) [34]. ЭПК – полиненасыщенная жирная кислота класса омега-3, которая входит в состав липидов большинства тканей животных. В рацион человека ЭПК попадает в составе таких продуктов питания, как сельдь, скумбрия, лосось, сардины или печень трески. Восполнить ее содержание можно также при приеме добавок омега-3 жирных кислот, эффективность которых до сих пор обсуждается.
Наиболее благоприятный профиль (соотношение эффективности и безопасности) для лечения саркопении у пожилых пациентов имеют препараты витамина D.
Важность D-гормона для развития мышц и их функциональных возможностей была продемонстрирована во многих работах. Еще в середине 70-х гг. прошлого века было показано, что 25-гидроксивитамин D3 (25(ОН)D3) оказывает влияние на фосфатный метаболизм в мышцах диафрагмы животных с дефицитом витамина D [35]. В результате дальнейших исследований рецептор активной формы витамина D (1,25 дигидрохолекальциферола), или D-гормона, был обнаружен на клетках скелетной мускулатуры [36]. Следующие работы показали, что D-гормон влияет на скелетную мускулатуру на генетическом (изменение траскрипции генов) и тканевом уровне через регуляцию метаболизма кальция и контроль мышечных сокращений и расслаблений [37–40]. Важность D-гормона для удержания равновесия была дополнительно подтверждена в двух проспективных генетических исследованиях. Полиморфизм рецептора витамина D сопровождается увеличением частоты падений и снижением мышечной силы [41].
В результате дальнейших исследований рецептор активной формы витамина D (1,25 дигидрохолекальциферола), или D-гормона, был обнаружен на клетках скелетной мускулатуры [36]. Следующие работы показали, что D-гормон влияет на скелетную мускулатуру на генетическом (изменение траскрипции генов) и тканевом уровне через регуляцию метаболизма кальция и контроль мышечных сокращений и расслаблений [37–40]. Важность D-гормона для удержания равновесия была дополнительно подтверждена в двух проспективных генетических исследованиях. Полиморфизм рецептора витамина D сопровождается увеличением частоты падений и снижением мышечной силы [41].
В ходе исследований было выявлено, что снижение содержания витамина D в сыворотке крови (25(ОН)D менее 40 нг/мл, по некоторым данным менее 20 нг/мл) повышает риск падений [42, 43].
Надо отметить, что в отдельных когортах пациентов дефицит D-гормона может наблюдаться даже при нормальном поступлении витамина D. Это больные с тяжелыми заболеваниями печени, снижением скорости клубочковой фильтрации (СКФ) – менее 65 мл/мин, больные ожирением, а также люди преклонного возраста.
У пациентов с ожирением нативный витамин D как жирорастворимый витамин преимущественно находится в жировом депо, поэтому и создается относительный дефицит циркулирующего D-гормона. При первичной патологии печени и почек нарушается превращение нативного витамина D в D-гормон. В исследовании с участием 1781 больного остеопорозом возрастное снижение функции почек было признано независимым фактором риска падений и снижения функциональных возможностей пациентов [44]. У людей пожилого возраста наблюдается снижение экспрессии рецептора к D-гормону по сравнению с молодыми [45]. Во всех этих когортах пациентов функциональные возможности хуже, а риск падений выше по сравнению со здоровыми лицами из группы контроля [46].
Назначение колекальциферола – нативного витамина D – оказывает положительное влияние на снижение риска падений и, как следствие, переломов, особенно у пациентов с дефицитом D-гормона [47].
Вместе с тем важно понимать разницу между профилактическим назначением нативного витамина D пожилым пациентам с дефицитом витамина D и фармакотерапией препаратами D-гормона или его аналогов [48]. Активная форма витамина D (альфакальцидол) нуждается в одном гидроксилировании в печени (25-гидроксилаза) для превращения в D-гормон. Этим определяется преимущество альфакальцидола перед кальцитриолом: большая продолжительность действия и меньшая частота гиперкальциемии. Альфакальцидол эффективен и при снижении СКФ. Описана способность альфакальцидола преодолевать резистентность рецепторов к D-гормону и увеличивать их экспрессию [45]. Сравнительный метаанализ (14 исследований, 21 268 пациентов) показал, что активные метаболиты витамина D (альфакальцидол и кальцитриол) статистически значимо (р = 0,049) уменьшают риск падений по сравнению с нативным витамином D (отношение рисков 0,79 (95%-ный доверительный интервал (ДИ) 0,64–0,96) против 0,94 (95% ДИ 0,87–1,01)) [49]. Лечение пациентов с остеопорозом альфакальцидолом в дозе 1 мкг в течение трех – шести месяцев приводило к относительному увеличению доли мышечных волокон типа А и некоторому уменьшению доли волокон типа B, что сочеталось с увеличением поперечного сечения волокон типа А.
Активная форма витамина D (альфакальцидол) нуждается в одном гидроксилировании в печени (25-гидроксилаза) для превращения в D-гормон. Этим определяется преимущество альфакальцидола перед кальцитриолом: большая продолжительность действия и меньшая частота гиперкальциемии. Альфакальцидол эффективен и при снижении СКФ. Описана способность альфакальцидола преодолевать резистентность рецепторов к D-гормону и увеличивать их экспрессию [45]. Сравнительный метаанализ (14 исследований, 21 268 пациентов) показал, что активные метаболиты витамина D (альфакальцидол и кальцитриол) статистически значимо (р = 0,049) уменьшают риск падений по сравнению с нативным витамином D (отношение рисков 0,79 (95%-ный доверительный интервал (ДИ) 0,64–0,96) против 0,94 (95% ДИ 0,87–1,01)) [49]. Лечение пациентов с остеопорозом альфакальцидолом в дозе 1 мкг в течение трех – шести месяцев приводило к относительному увеличению доли мышечных волокон типа А и некоторому уменьшению доли волокон типа B, что сочеталось с увеличением поперечного сечения волокон типа А. Время, которое требовалось пациентам, чтобы одеться, статистически значимо уменьшалось [50].
Время, которое требовалось пациентам, чтобы одеться, статистически значимо уменьшалось [50].
Кроме того, терапия альфакальцидолом в течение шести месяцев у пациенток пожилого возраста с дефицитом витамина D приводила к статистически значимому улучшению мышечной силы (изометрической силы разгибания колена) и функциональных возможностей (расстояние, которое они могли пройти за две минуты) [51].
У пациентов с остеопенией на фоне ревматоидного артрита и нормальным уровнем витамина D (49–59 нмоль/л), которые ежедневно получали 1 мкг альфакальцидола, статистически значимо повысилась мышечная сила по сравнению с больными, получавшими ежедневно нативный витамин D в дозе 1000 МЕ (60 против 18%) [52].
После успешных пилотных исследований были проведены рандомизированные плацебоконтролируемые исследования, доказавшие способность альфакальцидола предотвращать падения и переломы у пациентов старше 65 лет [53–55]. Особенно эффективным оказалось применение альфакальцидола (Альфа Д3-Тева®) в дозе 1 мкг у пациентов с возрастным снижением СКФ (менее 65 мл/мин): риск падений снизился на 71% [56].
Работа японских исследователей продемонстрировала эффективность приема альфакальцидола в дозе 1 мкг в течение года в отношении увеличения мышечной массы у пациентов с ее дефицитом (мышечная масса измерялась с помощью DXA) и поддержания мышечной массы при исходно нормальных показателях (согласно критериям, применяемым в Японии) [57].
Очевидно, что на фоне лечения альфакальцидолом улучшается мышечная функция, снижается риск падений и повышается минерализация костной ткани, следовательно, снижается риск переломов. Именно поэтому длительное время препарат использовался для лечения остеопороза [58]. Когда появились более эффективные препараты для лечения остеопороза, альфакальцидол стали применять в профилактических целях или в дополнение к антирезорбтивной терапии [58–64]. В ряде исследований альфакальцидол продемонстрировал преимущество перед нативным витамином D и возможность использования в тех случаях, когда комбинация антирезорбтивной терапии и нативных форм витамина D недостаточно эффективна [65, 66].
Наиболее широко применяемым альфакальцидолом является лекарственный препарат Альфа Д3-Тева®, имеющий широкий международный и российский опыт применения и большую доказательную базу.
На сегодняшний день поиск препаратов для лечения саркопении продолжается. Проводятся доклинические и клинические исследования эффективности миостатина, селективных модуляторов андрогенных рецепторов [67], а также принципиально нового класса анаболик-катаболик-трансформирующих агентов – MT-102, показавших хорошие результаты у животных [68].
Заключение
Саркопения, обусловленная возрастными изменениями мышечной ткани, вносит существенный вклад в повышение риска падений, снижение функциональных возможностей и способности к самообслуживанию. Увеличение продолжительности жизни населения ставит перед медициной задачи по сохранению активной и независимой жизни пожилых людей. Разрабатываются методы лечения остеопороза, атеросклероза и онкологических заболеваний, все больше внимания уделяется саркопении. Среди существующих медикаментозных методов лечения эффективность продемонстрировали препараты тестостерона и витамина D. При этом активные метаболиты витамина D (альфакальцидол) представляются более эффективными по сравнению с нативным витамином D и безопасными по сравнению с тестостероном. Учитывая важность проблемы, в настоящее время ведется поиск новых методов медикаментозного лечения саркопении.
Среди существующих медикаментозных методов лечения эффективность продемонстрировали препараты тестостерона и витамина D. При этом активные метаболиты витамина D (альфакальцидол) представляются более эффективными по сравнению с нативным витамином D и безопасными по сравнению с тестостероном. Учитывая важность проблемы, в настоящее время ведется поиск новых методов медикаментозного лечения саркопении.
Статья создана при поддержке ООО «Тева».
За дополнительной информацией обращаться:
OOO «Тева», Россия, 119049, Москва, ул. Шаболовка, д. 10, корп. 2.
Тел. +7 (495) 644-22-34, факс +7 (495) 644-22-35, www.teva.ru
FIRE-ALD3-AEL-190914-A4-674-180915
Саркопения глазами эндокринолога | Мокрышева
Одним из синдромов, существенно влияющих на здоровье и жизнь пациента, является саркопения. Саркопения (от греч. sarx – тело, плоть + penia – снижение) – состояние, характеризующееся прогрессирующей и генерализованной утратой мышечной массы и силы с повышением риска неблагоприятных событий, таких как ухудшение качества жизни, инвалидизация и смерть (Европейский консенсус по саркопении 2010 г. ) [1]. Снижение мышечной силы описывал еще Гиппократ, однако термин «саркопения» впервые предложил в 1989 г. американский профессор I. Rosenberg [2]. Диагностические, профилактические и лечебные мероприятия при саркопении должны разрабатываться с учетом повышения коморбидности с возрастом. Это особенно актуально в практике эндокринолога, так как множество эндокринопатий может приводить к формированию данного синдрома.
) [1]. Снижение мышечной силы описывал еще Гиппократ, однако термин «саркопения» впервые предложил в 1989 г. американский профессор I. Rosenberg [2]. Диагностические, профилактические и лечебные мероприятия при саркопении должны разрабатываться с учетом повышения коморбидности с возрастом. Это особенно актуально в практике эндокринолога, так как множество эндокринопатий может приводить к формированию данного синдрома.
ЭПИДЕМИОЛОГИЯ
Распространенность саркопении в популяции по разным источникам варьирует от 4,3% до 73,3% и зависит от возрастных критериев включения и особенностей исследуемых групп (пациенты, получающие амбулаторную помощь, и жители домов престарелых имеют значимые отличия). Чаще встречаются данные о распространенности в диапазоне 5–13% среди лиц 60–70 лет и на уровне 50% – в группе старше 80 лет [3, 4]. В российской популяции частота составила 13% у пациентов старше 85 лет [5].
ЭТИОЛОГИЯ
Этиологически саркопению разделяют на первичную и вторичную. Первичную саркопению рассматривают в рамках возрастных изменений мышечной ткани, вторичную – как следствие других заболеваний и патологических состояний (онкологической патологии, сахарного диабета (СД) 2 типа, хронической сердечной недостаточности, гиподинамии и прочего, а также вследствие приема некоторых лекарственных препаратов).
Первичную саркопению рассматривают в рамках возрастных изменений мышечной ткани, вторичную – как следствие других заболеваний и патологических состояний (онкологической патологии, сахарного диабета (СД) 2 типа, хронической сердечной недостаточности, гиподинамии и прочего, а также вследствие приема некоторых лекарственных препаратов).
Также обсуждается и генетическая предрасположенность к саркопении. Например, доказана связь генов ACE (кодирует ангиотензинпревращающий фермент), ACTN3 (кодирует альфаактинин 3), MSTN (кодирует миостатин), CNTF (кодирует цилиарный нейротрофический фактор), IGF1 (кодирует ИФР-1), IL-6 (кодирует интерлейкин 6) и VDR (кодирует рецептор витамина D) с силой и/или массой мышечной ткани. Особый интерес для изучения представляют такие гены-кандидаты, как GREM1 (кодирует Gremlin1), TRHR (кодирует рецептор тиреотропин-рилизинг-гормона), ACVR1B (кодирует рецептор активина 1B). В ряде двойных слепых исследований продемонстрировано, что наследуемость некоторых показателей мышечной массы и силы достигает 80% [6, 7].
В ряде двойных слепых исследований продемонстрировано, что наследуемость некоторых показателей мышечной массы и силы достигает 80% [6, 7].
ПАТОГЕНЕЗ
Саркопения – это мультиэтиологичный синдром со сложным патогенезом, в котором эндокринные факторы играют одну из ведущих ролей. Патогенез данного состояния изучен недостаточно, однако уже известно, что на развитие саркопении значимое влияние оказывает снижение уровня гормона роста (ГР), инсулиноподобного фактора роста-1 (ИФР-1), половых гормонов, витамина D, инсулинорезистентность. В то же время активно изучаются такие факторы, способствующие развитию саркопении, как особенности образа жизни (качество питания, физическая активность, иммобилизация) и пищевой статус. Снижение последнего приводит к недостаточному синтезу белка, развитию дегенеративных процессов, митохондриальной дисфункции и атрофии мышечных волокон, вследствие чего происходит потеря мышечной массы и силы [8]. На развитие саркопении также может влиять течение гестационного периода матери, окружающая среда в раннем детском возрасте, вес тела при рождении и в младенчестве, который прямо связан с мышечной массой и ее функциональными возможностями в старшем возрасте [6].
В основе патогенеза саркопении лежит утрата мышечной массы. Зрелые мышечные волокна состоят из многоядерных клеток, неспособных к делению, поэтому рост и регенерация мышц происходят за счет пролиферации клеток-сателлитов. При саркопении в первую очередь снижается количество клеток-сателлитов и волокон II типа, приводя к невозможности совершения пациентом быстрых движений [9]. Будучи ключевым звеном большинства клеточных процессов (обеспечение энергией, регуляция внутриклеточного гомеостаза кальция, активация клеточной пролиферации), митохондриальная дисфункция и дальнейшая потеря целостности митохондрий в миоцитах приводят к снижению окислительной способности, нарастанию уровня оксидативного стресса, повреждению клеток и развитию атрофии мышечных волокон (рис. 1).
Рис. 1. Этиология и патогенез саркопении.
Значительную роль играют системное воспаление, трансформация митохондрий и их взаимное усиление дегенеративного влияния на мышцы. В скелетных мышцах происходит повреждение транспортной цепи электронов, которое может определяться фокально в миоцитах или в дискретных областях отдельной клетки, и приводит к снижению активности цитохрома С-оксидазы и повышению активности сукцинатдегидрогеназы (СДГ) [10].
Доказательства, подтверждающие ключевую роль мутаций митохондриальной ДНК (мтДНК) в патогенезе старения, были получены в эксперименте на животных моделях, у которых имела место ошибка считывания в мтДНК-полимеразе γ (PolG), что проявлялось преждевременным старением, характеризующимся алопецией, кифозом, потерей слуха, остеопорозом, саркопенией и сокращением продолжительности жизни. У этих мышей накапливались соматические мутации мтДНК и демонстрировали системную дисфункцию митохондрий, включая снижение функции дыхательной цепи, ускоренный апоптоз в постмитотических тканях, при этом повышенного уровня окислительного стресса у них не наблюдалось. Интересно, что делеции мтДНК локализуются совместно с мутациями транспортной цепи электронов и при повышении определенного порога значений приводят к нарушению ее активности. В целом эти данные подтверждают гипотезу о том, что делеции мтДНК, накапливаясь в мышечных волокнах, компрометируют митохондриальную биоэнергетику и способствуют развитию атрофии мышц [10].
Другой путь, регулирующий метаболизм митохондрий во время старения, включает ИФР-1. Этот путь осуществляется путем фосфорилирования АТФ-цитрат-лиазы, фермента, катализирующего митохондриальное производное цитрат в оксалоацетат и ацетил-КоА. Предполагается, что возрастное снижение уровня ИФР-1 может нарушать митохондриальную активность посредством снижения АТФ-цитрат-лиазы, способствуя развитию саркопении [10].
Наличие воспалительной реакции также тесно связано с риском развития саркопении. Повышение фактора некроза опухоли-α способствует развитию воспаления через активацию ядерного фактора k-B, что приводит к потере мышечной массы (см. рис. 1) [11].
Таким образом, ИФР-1, механизмы контроля качества митохондрий и воспалительный путь являются основными звеньями, контролирующими мышечную массу.
Повреждения на любом уровне контроля состояния митохондрий сохраняются на протяжении их жизни, таким образом накапливаются поврежденные органеллы. Как следствие, увеличение отношения AMФ/ATФ и оксидативный стресс активируют катаболический путь, который приводит к атрофии мышц. Этот путь включает в себя как посредников, связанных с аутофагами, так и индукторов мышечного катаболизма (MuRF-1, атрогин), приводящих к деградации митохондрий и белка для обеспечения альтернативных источников энергии [11].
Этот путь включает в себя как посредников, связанных с аутофагами, так и индукторов мышечного катаболизма (MuRF-1, атрогин), приводящих к деградации митохондрий и белка для обеспечения альтернативных источников энергии [11].
В исследовании, изучавшем взаимосвязь скелетной мышечной массы с сохранностью капиллярной сети при старении, сравнивались данные гистологического исследования мышечной ткани между группами молодых здоровых лиц (средний возраст – 22 года, мужчины (n=14), женщины (n=5)) и пожилых лиц (средний возраст – 74 года, мужчины (n=22), женщины (n=6)). Степень мышечной капилляризации и распределения капилляров определяли методом капиллярных доменов. Окислительную способность мышечных волокон оценивали с помощью количественной гистохимии. Обеспечение капиллярами волокон определялось главным образом размером волокна и лишь в малой степени окислительной способностью. Несмотря на атрофию волокон II типа на 18% (p=0,019) и снижение количества капилляров на одну клетку на 23% (р<0,002) у пожилых людей, существенных различий в распределении капилляров между молодыми и пожилыми людьми выявлено не было. При исследовании активности СДГ максимальное потребление кислорода, поддерживаемое капилляром, не сильно различалось между молодыми и пожилыми людьми, но волокна I типа имели, как и ожидалось, более высокую активность СДГ по сравнению с волокнами II типа [12].
При исследовании активности СДГ максимальное потребление кислорода, поддерживаемое капилляром, не сильно различалось между молодыми и пожилыми людьми, но волокна I типа имели, как и ожидалось, более высокую активность СДГ по сравнению с волокнами II типа [12].
КЛИНИЧЕСКАЯ КАРТИНА САРКОПЕНИИ
Клиническая картина характеризуется снижением объема мышц, их силы и общей активности пациента. Больные отмечают трудности в выполнении привычных действий, выраженную мышечную и общую слабость, боли в мышцах, невозможность самостоятельного передвижения и самообслуживания, что постепенно приводит к инвалидизации и снижению продолжительности жизни. С целью предотвращения таких тяжелых последствий необходимо выявлять данный синдром на самом раннем этапе его развития.
ДИАГНОСТИЧЕСКИЕ МЕТОДЫ
Заподозрить саркопению возможно с помощью опросников. Наиболее часто используются опросники SarQol (Sarcopenia and Quality of Life – качество жизни при саркопении) и SARC-F (Strength, Assistance with walking, Rise from a chair, Climb stairs and Falls – сила, помощь при ходьбе, подъем со стула, подъем по лестнице и падения). Опросник SarQol разработан в 2015 г. французской научной группой для пациентов старше 65 лет в целях оценки мышечной функции и качества жизни. Он состоит из 22 вопросов, разделенных на модули: физическое и психическое здоровье, активность, состав тела, функциональность, деятельность в повседневной жизни и во время досуга [3]. Опросник SARC-F состоит из 5 вопросов и является скрининговым методом обследования, позволяющим быстро оценить мышечную функцию (чувствительность 4–10%, специфичность 94–99%).
Опросник SarQol разработан в 2015 г. французской научной группой для пациентов старше 65 лет в целях оценки мышечной функции и качества жизни. Он состоит из 22 вопросов, разделенных на модули: физическое и психическое здоровье, активность, состав тела, функциональность, деятельность в повседневной жизни и во время досуга [3]. Опросник SARC-F состоит из 5 вопросов и является скрининговым методом обследования, позволяющим быстро оценить мышечную функцию (чувствительность 4–10%, специфичность 94–99%).
Европейская рабочая группа по изучению саркопении у пожилых людей (EWGSOP) рекомендует в качестве стандартного метода оценки физического состояния пациента определять скорость ходьбы на короткое расстояние (4 м). Отрезной точкой является скорость 0,8 м/с, ниже которой необходимо заподозрить саркопению. Вторым этапом следует анализ мышечной силы и массы. Сила мышц оценивается с помощью динамометрии, а масса – с помощью денситометрии (двухэнергетической рентгеновской абсорбциометрии, DXA) и биоимпедансного анализа [13]. Для оценки мышечной силы определяют силу сжатия кисти с помощью кистевых динамометров. Наиболее часто используется в зарубежных исследованиях динамометр Jamar. У пациентов с заболеваниями суставов более предпочтителен Martin Vigorimeter, который измеряет давление обхватывающей руки и не зависит от размера кисти. Для более достоверной оценки мышечной силы требуется выполнение двух методик. При проведении проспективного когортного исследования «Хрусталь» в Северо-Западном регионе России был произведен расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет. Средняя скорость снижения силы сжатия кисти в российской популяции у мужчин была выше, чем у женщин, и составила примерно 1 кг/год в возрасте от 65 до 76 лет и 0,5 кг/год в возрасте старше 76 лет. Средняя скорость снижения силы сжатия у женщин была 2 кг за 5 лет. Представленные результаты согласуются с результатами других исследований: например, средняя скорость снижения силы сжатия в исследовании H. Frederiksen и соавт.
Для оценки мышечной силы определяют силу сжатия кисти с помощью кистевых динамометров. Наиболее часто используется в зарубежных исследованиях динамометр Jamar. У пациентов с заболеваниями суставов более предпочтителен Martin Vigorimeter, который измеряет давление обхватывающей руки и не зависит от размера кисти. Для более достоверной оценки мышечной силы требуется выполнение двух методик. При проведении проспективного когортного исследования «Хрусталь» в Северо-Западном регионе России был произведен расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет. Средняя скорость снижения силы сжатия кисти в российской популяции у мужчин была выше, чем у женщин, и составила примерно 1 кг/год в возрасте от 65 до 76 лет и 0,5 кг/год в возрасте старше 76 лет. Средняя скорость снижения силы сжатия у женщин была 2 кг за 5 лет. Представленные результаты согласуются с результатами других исследований: например, средняя скорость снижения силы сжатия в исследовании H. Frederiksen и соавт. , основанном на анализе трех крупных популяционных исследований, была также выше у мужчин по сравнению с женщинами и составила 0,65±0,02 кг/год, в то время как у женщин – 0,34±0,01 кг/год. В исследовании «Возраст и здоровье женщин II» (The Women’s Health and Aging Study II) скорость снижения силы сжатия у женщин была в среднем 1,10–1,31 кг в возрасте от 70 до 75 и 0,50–0,39 кг в возрасте старше 75 лет [14].
, основанном на анализе трех крупных популяционных исследований, была также выше у мужчин по сравнению с женщинами и составила 0,65±0,02 кг/год, в то время как у женщин – 0,34±0,01 кг/год. В исследовании «Возраст и здоровье женщин II» (The Women’s Health and Aging Study II) скорость снижения силы сжатия у женщин была в среднем 1,10–1,31 кг в возрасте от 70 до 75 и 0,50–0,39 кг в возрасте старше 75 лет [14].
Однако кистевые динамометры не могут достоверно отобразить силу мышц верхних и нижних конечностей. В настоящее время ни один из инструментальных методов не может быть рекомендован для оценки мышечной силы в рутинной клинической практике. Функциональные тесты более информативны, однако также имеют ряд ограничений, например, у пациентов с заболеваниями суставов, неврологическими расстройствами, нарушением координации, головокружением и других. Тест SPPB (Short Physical Performance Battery – характеристика короткой физической активности) позволяет оценить кратковременную физическую активность и включает определение скорости ходьбы на короткое расстояние (4 м), а также 5-кратное вставание со стула и возможность удержания равновесия в положении стоя в течение 10 с [15].
При оценке индекса тощей массы (ИТМ) скелетных мышц с помощью двухэнергетической рентгеновской абсорбциометрии (денситометрии, DXA) рассчитывается частное аппендикулярной мышечной массы (АММ), полученной как сумма тощей массы рук и ног, и роста человека в квадратных метрах, то есть АММ/рост², и измеряется в кг/м². Саркопения диагностируется при снижении ИТМ более чем на 2 стандартных отклонения, что, по разным источникам, соответствует ИТМ у мужчин менее 7,26–8,5 кг/м², а у женщин – менее 5,5–5,75 кг/м² [16, 17].
Биоэлектрический импедансный анализ является альтернативой денситометрии, будучи более дешевым, легко воспроизводимым и мобильным методом диагностики. В таблице 1 представлены референсные значения ИТМ для диагностики саркопении.
Таблица 1. Критерии саркопении по данным биоимпедансного анализа.
ИТМ | Муж. | Жен. |
Норма | > 10,75 кг/м² | > 6,75 кг/м² |
Обратимая саркопения | 8,51–10,75 кг/м² | 5,76–6,75 кг/м² |
Выраженная саркопения | 8,5 кг/м² | 5,75 кг/м2 |
Вместе с тем биоимпедансный метод исследования недостаточно точен, особенно у пациентов с заболеваниями, проявляющимися отечным синдромом (хроническая сердечная недостаточность, почечная недостаточность и лимфедема). Антропометрические измерения, такие как окружность икроножной мышцы или толщина кожной складки, неточны главным образом потому, что ожирение, отеки, а также изменения в жировой ткани и потеря эластичности кожи, связанные с возрастом, снижают специфичность метода в оценке мышечной массы. Они не рекомендуются для использования в целях диагностики саркопении, но могут быть альтернативными в случае отсутствия других методов [16, 18]. Антропометрический метод недостаточно информативен и при саркопеническом ожирении, включающем критерии саркопении и увеличение объема подкожной жировой клетчатки у мужчин ≥25%, у женщин ≥35%. При данном состоянии наблюдается жировое перерождение клеток-сателлитов, жировая инфильтрация мышц, которые способствуют снижению силы нижних конечностей и гиподинамии – возникает порочный круг. Однако на данный момент невозможно оценить, что развивается первично: саркопения или ожирение, так как при ожирении наблюдается хроническое воспаление, которое, в свою очередь, приводит к снижению мышечной массы и силы [16].
Антропометрические измерения, такие как окружность икроножной мышцы или толщина кожной складки, неточны главным образом потому, что ожирение, отеки, а также изменения в жировой ткани и потеря эластичности кожи, связанные с возрастом, снижают специфичность метода в оценке мышечной массы. Они не рекомендуются для использования в целях диагностики саркопении, но могут быть альтернативными в случае отсутствия других методов [16, 18]. Антропометрический метод недостаточно информативен и при саркопеническом ожирении, включающем критерии саркопении и увеличение объема подкожной жировой клетчатки у мужчин ≥25%, у женщин ≥35%. При данном состоянии наблюдается жировое перерождение клеток-сателлитов, жировая инфильтрация мышц, которые способствуют снижению силы нижних конечностей и гиподинамии – возникает порочный круг. Однако на данный момент невозможно оценить, что развивается первично: саркопения или ожирение, так как при ожирении наблюдается хроническое воспаление, которое, в свою очередь, приводит к снижению мышечной массы и силы [16].
ОСТЕОСАРКОПЕНИЯ
Остеосаркопения – это относительно новое понятие, включающее в себя сочетание низкой мышечной массы и сниженной минеральной плотности костной ткани (МПК), связанное со старением и общим патогенезом [19]. Учитывая повышение риска развития как саркопении, так и остеопороза у пожилых лиц, требуется оценка состояния мышечной ткани у таких пациентов [20].
Состав тела пациентов с остеосаркопенией характеризуется снижением мышечной массы, МПК, ИМТ и индекса общего жира по сравнению с пациентами с изолированным остеопорозом или саркопенией. Клинические проявления остеосаркопении характеризуются слабостью, низкой скоростью ходьбы, потерей подвижности. В настоящее время отсутствуют специфические маркеры остеосаркопении, однако отмечено, что у пациентов с данной патологией уровень тестостерона, витамина D и гемоглобина ниже, чем у пациентов с изолированным остеопорозом или саркопенией.
Помимо возраста, существует ряд других факторов, которые способствуют развитию остеосаркопении. Генетические полиморфизмы GLYAT, METTL21C, MSTN, ACTN3 PGC-1α и MEF-2C связаны с потерей костной и мышечной ткани. Эндокринные заболевания (в основном СД, нарушение функции щитовидной железы и низкий уровень витамина D, половых гормонов, ГР, ИФР-1), алиментарная недостаточность, ожирение и прием кортикостероидов также влияют на развитие остеосаркопении [19]. Отмечено, что саркопения и мышечная слабость, так же как и частота переломов, встречаются чаще у пациентов с СД 2 типа, чем у здоровых людей [21].
Генетические полиморфизмы GLYAT, METTL21C, MSTN, ACTN3 PGC-1α и MEF-2C связаны с потерей костной и мышечной ткани. Эндокринные заболевания (в основном СД, нарушение функции щитовидной железы и низкий уровень витамина D, половых гормонов, ГР, ИФР-1), алиментарная недостаточность, ожирение и прием кортикостероидов также влияют на развитие остеосаркопении [19]. Отмечено, что саркопения и мышечная слабость, так же как и частота переломов, встречаются чаще у пациентов с СД 2 типа, чем у здоровых людей [21].
Жировая инфильтрация мышц у пожилых вносит свой вклад в развитие остеосаркопении, что, возможно, связано с отрицательным воздействием продукции воспалительных цитокинов костным мозгом и жировой тканью. Установлено, что пациенты с саркопенией и остеопенией имеют высокие концентрации воспалительных цитокинов, преобладание интерлейкина-6 (IL-6) и фактора некроза опухолей альфа (ФНО-α), которые связаны как с системной, так и с локальной липотоксичностью. Кроме того, изменения в костном мозге тесно ассоциированы с изменениями мышечной массы. Скелетная и мышечная ткань взаимодействуют механически, физически, а также биохимически посредством паракринных и эндокринных факторов. В этом процессе существует много возможных путей, которые могут объяснить развитие и прогрессирование остеосаркопении. Один из них включает остеокальцин, который стимулирует пролиферацию β-клеток, секрецию инсулина и действует непосредственно на скелетную мышцу, коррелируя с мышечной силой. Другим внутренним механизмом, связывающим мышцы и кость, является секреция сосудистого эндотелиального фактора роста (VEGF) с помощью мезенхимальных стромальных клеток костного мозга, что стимулирует пролиферацию миобластов. Мышцы также секретируют несколько гормонов и активных веществ, влияющих на кость, таких как ИФР-1, остеоглицин, ирисин, остеонектин, фактор роста фибробластов-2, IL-6, IL-15 и миостатин. Миостатин является членом надсемейства бета-трансформирующего фактора роста, экспрессируемого в основном в скелетных мышцах.
Кроме того, изменения в костном мозге тесно ассоциированы с изменениями мышечной массы. Скелетная и мышечная ткань взаимодействуют механически, физически, а также биохимически посредством паракринных и эндокринных факторов. В этом процессе существует много возможных путей, которые могут объяснить развитие и прогрессирование остеосаркопении. Один из них включает остеокальцин, который стимулирует пролиферацию β-клеток, секрецию инсулина и действует непосредственно на скелетную мышцу, коррелируя с мышечной силой. Другим внутренним механизмом, связывающим мышцы и кость, является секреция сосудистого эндотелиального фактора роста (VEGF) с помощью мезенхимальных стромальных клеток костного мозга, что стимулирует пролиферацию миобластов. Мышцы также секретируют несколько гормонов и активных веществ, влияющих на кость, таких как ИФР-1, остеоглицин, ирисин, остеонектин, фактор роста фибробластов-2, IL-6, IL-15 и миостатин. Миостатин является членом надсемейства бета-трансформирующего фактора роста, экспрессируемого в основном в скелетных мышцах. Изучен его эффект на рост мышц и влияние на кость. Дефицит гена MSTN и системное введение ACVR2B-Fc (inhibitor of the Activin Receptor 2B – блокатора рецептора активина 2B) приводят к гипертрофии мышечной ткани и увеличению костной массы [18]. Мышечная ткань также секретирует декорин, который, связывая миостатин, способствует росту мышечной ткани. Обнаружен и его противоопухолевый эффект. При изучении генетически модифицированных животных с выключенным геном DCN, кодирующим декорин, зафиксирован спонтанный рост опухолей. Однако влияние этого белка на физиологию человека изучено недостаточно.
Изучен его эффект на рост мышц и влияние на кость. Дефицит гена MSTN и системное введение ACVR2B-Fc (inhibitor of the Activin Receptor 2B – блокатора рецептора активина 2B) приводят к гипертрофии мышечной ткани и увеличению костной массы [18]. Мышечная ткань также секретирует декорин, который, связывая миостатин, способствует росту мышечной ткани. Обнаружен и его противоопухолевый эффект. При изучении генетически модифицированных животных с выключенным геном DCN, кодирующим декорин, зафиксирован спонтанный рост опухолей. Однако влияние этого белка на физиологию человека изучено недостаточно.
Постменопаузальная остеосаркопения, развитие которой обусловлено генетическими факторами, изменением состава тела, низкой физической активностью, дефицитом эстрогенов и витамина D, приводит к снижению мышечной массы, силы, функциональных возможностей, а также к снижению МПК, что в сочетании с коморбидностью пожилых пациентов реализуется в увеличении частоты переломов, инвалидизации и смертности [20].
Также существует такое понятие как остеосаркопеническое ожирение, критериями которого являются снижение МПК по Т-критерию ≤-1,0 SD по данным DXA, снижение ИТМ <5,5 кг/м2 для женщин и <7,23 кг/м2 для мужчин, повышение массы жира ≥38% для женщин и ≥28% для мужчин, а также соотношение висцерального/подкожного жирового соотношения >1 (для андроидного типа ожирения) или <1 (для гиноидного типа ожирения). Распространенность остеосаркопенического ожирения, по данным перекрестного исследования в Италии, составила 6,86%, из которых частота гиноидного и андроидного ожирения составила соответственно 2,1% и 4,7%.
В группе пациентов с остеосаркопеническим висцеральным ожирением (по сравнению с другими когортами) отмечен более высокий уровень С-реактивного белка (>2,34 мг/дл), гликемии (>112 мг/дл), а также более высокий риск переломов (FRAX>15%, r=0,316; p<0,05) [22].
САРКОПЕНИЯ И ВИТАМИН D
Установлено, что витамин D играет важную роль в метаболических процессах в мышечной и костной ткани. Так, снижение его уровня на 10 нг/мл приводит к увеличению частоты развития саркопении в 1,5 раза в течение последующих 5 лет. Однако результаты рандомизированных контролируемых исследований не смогли установить патогенетическую роль витамина D в развитии заболеваний мышечной системы [23].
Так, снижение его уровня на 10 нг/мл приводит к увеличению частоты развития саркопении в 1,5 раза в течение последующих 5 лет. Однако результаты рандомизированных контролируемых исследований не смогли установить патогенетическую роль витамина D в развитии заболеваний мышечной системы [23].
Было показано, что прием витамина D в дозе от 700 до 800 МЕ/день повышает прочность мышц и костей, снижает риск падений, переломов бедренной кости и смертности, однако оптимальная доза приема витамина D все еще остается неопределенной. Европейское общество по клиническим и экономическим аспектам остеопороза, остеоартрита и скелетно-мышечных заболеваний (ESCEO) также оценивает адекватное потребление витамина D в 800 МЕ/день для поддержания сывороточного уровня 25-гидроксивитамина D>30 нг/мл (50 нмоль/л) [18]. Баланс между витамином D и паратиреоидным гормоном (ПТГ) является ключевым регулятором мышечной силы: ПТГ способен модулировать работу мышечной ткани через увеличение внутриклеточного кальция.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА САРКОПЕНИИ
В настоящее время отсутствует специфическое лечение саркопении, первичной является профилактика. Физические упражнения, особенно постепенно увеличивающиеся силовые нагрузки, являются стимулом для синтеза мышечного белка. Выполнение физических упражнений в течение минимум 20 минут в неделю значительно повышает мышечную и костную массу, силу, снижает функциональные ограничения, предотвращает падения и переломы у пожилых людей. Однако у пациентов с тяжелыми сопутствующими заболеваниями (такими как нейрокогнитивные и сердечные-сосудистые патологии) могут возникнуть сложности в достижении рекомендуемого уровня физической активности [18].
В ходе метаанализа, включившего 37 исследований, 34 рандомизированных клинических исследования, оценивали влияние физических упражнений на мышечную массу у пожилых людей (почти в 80% случаев мышечная масса увеличилась с помощью физических упражнений). Влияние дополнительного питания на мышечную массу было зафиксировано только в 23,5% случаев. Мышечная сила увеличилась в 82,8% исследований после повышения физической активности, а пищевые добавки показали дополнительные преимущества только в небольшом количестве исследований (22,8%). Таким образом, физические упражнения оказывают положительное влияние на мышечную массу и силу или физическую работоспособность у здоровых лиц в возрасте от 60 лет и старше [24].
Мышечная сила увеличилась в 82,8% исследований после повышения физической активности, а пищевые добавки показали дополнительные преимущества только в небольшом количестве исследований (22,8%). Таким образом, физические упражнения оказывают положительное влияние на мышечную массу и силу или физическую работоспособность у здоровых лиц в возрасте от 60 лет и старше [24].
Белок пищи оказывает косвенное влияние на ключевые регуляторные белки и факторы роста, связанные со здоровьем мышц и костей, за счет увеличения абсорбции кальция, подавления ПТГ и увеличения секреции ИФР-I (костного и мышечного анаболического стимулятора). Потребление белка более 0,8 мг/кг массы тела в день, в основном животного происхождения, усиливает анаболизм мышечного белка наряду с защитой от возрастной потери мышц и костной ткани. У пациентов в возрасте 70–79 лет содержание белка в пище в количестве 1,1 г/кг массы тела в день приводит к отсутствию мышечной потери при 3-летнем наблюдении.
ESCEO рекомендует потребление белка с пищей от 1,0 до 1,2 г/кг массы тела в день, минимум 20–25 г чистого белка в каждой порции. Европейское общество клинического питания и обмена веществ (ESPEN) и Исследовательская группа PROT-AGE рекомендуют такое же потребление белка для здоровых людей старшего возраста, от 1,2 до 1,5 г/кг массы тела в день, а для пациентов с тяжелыми заболеваниями и недостаточным питанием – свыше 2 г/кг в сутки [18]. Пациенты с хронической болезнью почек (ХБП) додиализных стадий для профилактики саркопении должны снизить потребление белка до 0,2–0,5 г/кг в сутки (при СКФ <20 мл/мин/1,73 м²) вследствие возможного развития метаболического ацидоза [25]. Кроме того, потребление белка совместно с физическими упражнениями улучшает синтез мышечного белка и положительно влияет на состав тела, способствуя снижению жировой массы, увеличению или поддержанию мышечной ткани и сохранению кости [18] (табл. 2).
Европейское общество клинического питания и обмена веществ (ESPEN) и Исследовательская группа PROT-AGE рекомендуют такое же потребление белка для здоровых людей старшего возраста, от 1,2 до 1,5 г/кг массы тела в день, а для пациентов с тяжелыми заболеваниями и недостаточным питанием – свыше 2 г/кг в сутки [18]. Пациенты с хронической болезнью почек (ХБП) додиализных стадий для профилактики саркопении должны снизить потребление белка до 0,2–0,5 г/кг в сутки (при СКФ <20 мл/мин/1,73 м²) вследствие возможного развития метаболического ацидоза [25]. Кроме того, потребление белка совместно с физическими упражнениями улучшает синтез мышечного белка и положительно влияет на состав тела, способствуя снижению жировой массы, увеличению или поддержанию мышечной ткани и сохранению кости [18] (табл. 2).
Таблица 2. Рекомендуемое количество потребления белка в сутки различным группам людей.
Критерий | Количество потребляемого белка в сутки, г/кг массы тела |
Здоровые люди старшего возраста | 1,0–1,2 |
Пациенты с острыми и хроническими заболеваниями | 1,2–1,5 |
Саркопения первичная (пожилые пациенты с недостаточным питанием) | свыше 2 |
Пациенты с ХБП С5 (до начала гемодиализа) | 0,2–0,5 |
ХБП С1–3 А2 | не более 1,0 |
ХБП С1–3 А3 | 0,6–0,8 |
ХБП С4 | 0,6–0,8 |
ХБП С5 | 0,2–0,5 |
ХБП С5Д (гемодиализ) | не более 1,2 |
ХБП С5Д (перитонеальный диализ) | не более 1,4 |
ХБП (после трансплантации почки) | 0,8–1,0 |
Таким образом для профилактики развития саркопении следует придерживаться рекомендаций ESCEO об оптимальном потреблении белка c пищей 1,0–1,2 г/кг тела в день с содержанием по меньшей мере 20–25 г белка на каждый основной прием пищи, об адекватном потреблении витамина D 800 МЕ/сут, а также потреблении кальция в дозе 1000 мг/сут в сочетании с регулярными физическими упражнениями 3–5 раз в неделю [26].
Активно изучаются возможности патогенетического лечения саркопении. Рандомизированное клиническое исследование 2 фазы показало, что введение антител к миостатину приводит к увеличению аппендикулярной мышечной массы по сравнению с плацебо. Однако остаются нерешенными вопросы о клинической эффективности и безопасности этого метода лечения, поскольку миостатин также присутствует в сердечной мышечной ткани, его ингибирование потенциально может привести к развитию кардиомиопатии. Исследование антител к миостатину все еще находится в экспериментальной фазе испытаний для оценки эффективности и безопасности данного лечения.
В экспериментальных условиях показано, что ACVR2B/Fc, блокатор рецептора активина 2B, сохраняет мышечную массу и увеличивает костную в животных моделях с несовершенным остеогенезом и мышечной дистрофией [27]. Применение цитруллина (непротеиногенная аминокислота), как показали исследования на крысах и молодых взрослых людях, увеличивает мышечную массу, синтез белка, а также липолиз в адипоцитах [28].
В результате экспериментального введения ГР мышам после длительной иммобилизации конечности наблюдалось увеличение мышечной массы, а введение ПТГ привело к улучшению микроархитектоники костей, повышению МПК. Комбинированная терапия ГР и ПТГ оказала более выраженное влияние на параметры костной ткани, не улучшив при этом показатели мышечной массы по сравнению с монотерапией ГР. Однако клинические исследования, проведенные на людях, не дали ожидаемого результата и по применению ГР: мышечная масса увеличилась незначительно [29].
Различные другие фармакологические препараты, такие как тестостерон, ИФР-1, витамин D, ПТГ и т.д., оцениваются как потенциальные средства для лечения саркопении, однако необходимый эффект не был достигнут [18]. Таким образом, в настоящее время можно говорить только о профилактике данного состояния, в которую входят адекватные физические нагрузки и питание с достаточным потреблением белка.
ЗАКЛЮЧЕНИЕ
Наиболее изученным последствием саркопении является повышение смертности: метаанализ 17 исследований показал, что риск смерти в 4 раза выше у пациентов с саркопенией, риск снижения функциональных возможностей мышц или инвалидности в 3 раза выше, чем у лиц того же возраста без данного синдрома [3]. Это подчеркивает клиническую и социальную значимость саркопении, необходимость тщательного изучения данного состояния, поиск ее предикторов и эффективного лечения.
Это подчеркивает клиническую и социальную значимость саркопении, необходимость тщательного изучения данного состояния, поиск ее предикторов и эффективного лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Данная статья является репринтом:
Мокрышева Н.Г., Крупинова Ю.А., Володичева В.Л., Мирная С.С., Мельниченко Г.А. Саркопения глазами эндокринолога // Ожирение и метаболизм. — 2018. — Т. 15. — №.3 — С. 21-27. doi: 10.14341/OMET9792
1. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412-423. doi: 10.1093/ageing/afq034.
2. Rosenberg I.H. Epidemiologic and methodologic problems in determining nutritional status of older persons. Proceedings of a conference. Albuquerque, New Mexico, October 19-21, 1988. Am. J. Clin. Nutr. 1989;50(5 Suppl):1121-1235.
Rosenberg I.H. Epidemiologic and methodologic problems in determining nutritional status of older persons. Proceedings of a conference. Albuquerque, New Mexico, October 19-21, 1988. Am. J. Clin. Nutr. 1989;50(5 Suppl):1121-1235.
3. Wright JM, Beaudart C, Zaaria M, et al. Health Outcomes of Sarcopenia: A Systematic Review and Meta-Analysis. PLoS One. 2017;12(1):e0169548. doi: 10.1371/journal.pone.0169548.
4. Morley JE, Anker SD, von Haehling S. Prevalence, incidence, and clinical impact of sarcopenia: facts, numbers, and epidemiology-update 2014. Journal of Cachexia, Sarcopenia and Muscle. 2014;5(4):253-259. doi: 10.1007/s13539-014-0161-y.
5. Safonova Y, Zotkin E, Lila A. Prevalence of sarcopenia in elderly northwestern region of the Russian Federation. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 238. doi: 10.13140/RG.2.2.22677.01768
WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 238. doi: 10.13140/RG.2.2.22677.01768
6. Scott D. Reducing the burden of sarcopenia: a healthy lifestyle throughout the lifetime D. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 99.
7. Tan L-J, Liu S-L, Lei S-F, et al. Molecular genetic studies of gene identification for sarcopenia. Hum. Genet. 2011;131(1):1-31. doi: 10.1007/s00439-011-1040-7.
8. Ali S, Garcia JM. Sarcopenia, Cachexia and Aging: Diagnosis, Mechanisms and Therapeutic Options — A Mini-Review. Gerontology. 2014;60(4):294-305. doi: 10.1159/000356760.
doi: 10.1159/000356760.
9. Sayer AA, Robinson SM, Patel HP, et al. New horizons in the pathogenesis, diagnosis and management of sarcopenia. Age Ageing. 2013;42(2):145-150. doi: 10.1093/ageing/afs191.
10. Picca A, Calvani R, Bossola M, et al. Update on mitochondria and muscle aging: all wrong roads lead to sarcopenia. Biol. Chem. 2018;399(5):421-436. doi: 10.1515/hsz-2017-0331.
11. Radic M. Autoimmune sarcopenia – current knowledge and perspective. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 135
12. Barnouin Y, McPhee JS, Butler-Browne G, et al. Coupling between skeletal muscle fiber size and capillarization is maintained during healthy aging. Journal of Cachexia, Sarcopenia and Muscle. 2017;8(4):647-659. doi: 10.1002/jcsm.12194.
Coupling between skeletal muscle fiber size and capillarization is maintained during healthy aging. Journal of Cachexia, Sarcopenia and Muscle. 2017;8(4):647-659. doi: 10.1002/jcsm.12194.
13. Ji H-M, Han J, Won Y-Y. Sarcopenia and Osteoporosis. Hip & Pelvis. 2015;27(2):72. doi: 10.5371/hp.2015.27.2.72.
14. Турушева А.В., Фролова Е.В., Дегриз Я.-М. Расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет в Северо-Западном регионе России: результаты проспективного когортного исследования «Хрусталь» // Российский семейный врач. – 2017. – Т. 21. – №4. – С. 29-35. [Turusheva AV, Frolova EV, Degryse J-M. Development of reference ranges of handgrip strength among healthy adults 65+ in Northwest Russia: a prospective population-based cohort Crystal study. Russian Family Doctor. 2017;21(4):29-35. (In Russ.)] doi: 10.17816/rfd2017429-35.
(In Russ.)] doi: 10.17816/rfd2017429-35.
15. Bauer J. M. Principles for the standardization of the assessment of muscle strength and power. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 75.
16. Rolland Y, Czerwinski S, van Kan GA, et al. Sarcopenia: Its assessment, etiology, pathogenesis, consequences and future perspectives. The Journal of Nutrition Health and Aging. 2008;12(7):433-450. doi: 10.1007/bf02982704.
17. Carnevale V, Castriotta V, Piscitelli PA, et al. Assessment of Skeletal Muscle Mass in Older People: Comparison Between 2 Anthropometry-Based Methods and Dual-Energy X-ray Absorptiometry. J. Am. Med. Dir. Assoc. 2018;19(9):793-796. doi: 10.1016/j.jamda.2018.05.016.
2018;19(9):793-796. doi: 10.1016/j.jamda.2018.05.016.
18. Hirschfeld HP, Kinsella R, Duque G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos. Int. 2017;28(10):2781-2790. doi: 10.1007/s00198-017-4151-8.
19. Frisoli A. Clinical and biochemical phenotype of osteosarcopenia. WCO-IOF-ESCEO World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2017 March 23-26, Florence, Italy. Springer; 2017. р.106.
20. Sirola J, Kröger H. Similarities in Acquired Factors Related to Postmenopausal Osteoporosis and Sarcopenia. Journal of Osteoporosis. 2011;2011:1-14. doi: 10.4061/2011/536735.
21. Trierweiler H, Kisielewicz G, Hoffmann Jonasson T, et al. Sarcopenia: a chronic complication of type 2 diabetes mellitus. Diabetol. Metab. Syndr. 2018;10(1). doi: 10.1186/s13098-018-0326-5.
Sarcopenia: a chronic complication of type 2 diabetes mellitus. Diabetol. Metab. Syndr. 2018;10(1). doi: 10.1186/s13098-018-0326-5.
22. Perna S, Spadaccini D, Nichetti M, et al. Osteosarcopenic Visceral Obesity and Osteosarcopenic Subcutaneous Obesity, Two New Phenotypes of Sarcopenia: Prevalence, Metabolic Profile, and Risk Factors. Journal of Aging Research. 2018;2018:1-8. doi: 10.1155/2018/6147426.
23. Bruyère O. Vitamin D and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
24. Beaudart C. Outcomes of the IOF-ESCEO sarcopenia working groups. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.77-78.
Springer; 2018. р.77-78.
25. National Kidney F. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am. J. Kidney Dis. 2003;42(4 Suppl 3):S1-201.
26. Reginster J.-Y. Dairy products in the prevention and treatment of sarcopenia: outcomes of the ESCEO Working Groups. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 78.
27. Barreto R, Kitase Y, Matsumoto T, et al. ACVR2B/Fc counteracts chemotherapy-induced loss of muscle and bone mass. Sci. Rep. 2017;7(1). doi: 10.1038/s41598-017-15040-1.
28. Aubertin-Leheudre M. Citruline and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
Citruline and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
29. Brent MB, Brüel A, Thomsen JS. PTH (1–34) and growth hormone in prevention of disuse osteopenia and sarcopenia in rats. Bone. 2018;110:244-253. doi: 10.1016/j.bone.2018.02.017.
Возрастная потеря мышечной массы: как избежать
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
К сожалению, современная наука пока не может повернуть время вспять и отменить старение, но при помощи некоторых хитростей его можно заметно отсрочить. Один из главных признаков старения — саркопения. Этим термином называют возрастную потерю мышечной массы, которая начинается уже к 30 годам. По данным исследований мы теряем от 0,5 до 1% мышц в год. Эти качественные изменения тела приводят не только к мышечной слабости, но и к внешним изменениям, в первую очередь лица — впалые щеки, ярко выраженные морщины (как справиться с видимыми признаками старения при помощи лицевой йоги, читайте здесь). С саркопенией можно бороться путем внесения корректив в режим питания и тренировок. Каких именно, рассказываем в нашем материале.
По данным исследований мы теряем от 0,5 до 1% мышц в год. Эти качественные изменения тела приводят не только к мышечной слабости, но и к внешним изменениям, в первую очередь лица — впалые щеки, ярко выраженные морщины (как справиться с видимыми признаками старения при помощи лицевой йоги, читайте здесь). С саркопенией можно бороться путем внесения корректив в режим питания и тренировок. Каких именно, рассказываем в нашем материале.
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Больше белкаСвязь потребления белка и процента мышечной массы, наверное, очевидна, но повторение лишним не будет. Аминокислоты, из которых состоит белок, играют роль «строительных блоков» в нашем организме. Из них выстраиваются не только непосредственно мышцы, но и все ткани в теле. Особенно важна незаменимая аминокислота — лейцин, она катализирует рост мышечной массы, даже если в силу возраста он уже изрядно замедлился. Отличный источник лейцина — белое мясо, рыба, соевые бобы и греческий йогурт. Однако не стоит есть больше 30 г белка за один прием пищи: наш организм не умеет запасать аминокислотные соединения, поэтому все, что сразу не усваивается, откладывается в жир.
Отличный источник лейцина — белое мясо, рыба, соевые бобы и греческий йогурт. Однако не стоит есть больше 30 г белка за один прием пищи: наш организм не умеет запасать аминокислотные соединения, поэтому все, что сразу не усваивается, откладывается в жир.
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Омега-3 кислотыКак известно, омега-3 жирные кислоты улучшают все: от работы сердца до настроения. С возрастной потерей мышечной массы они тоже прекрасно справляются. Одна из причин разрушения мышц является воспаление, с которым отлично борется омега. Кроме того, регулярное употребление омега-3 значительно улучшает метаболизм белка, помогает ему легче усвоиться, а значит — укрепить мышцы. Лосось, орехи, семена льна и яйца — это те продукты, которые должны стать неотъемлемой частью вашего рациона, чтобы омега-3 кислоты всегда в достатке были в организме.
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Регулряная проверка уровня витамина DМногими научными исследованиями была установлена связь между уровнем витамина D и активностью синтеза мышечного белка. «Солнечный» витамин не только стимулирует рост мышечной массы, но и отлично борется с воспалительными процессами, что не позволяет мышцам разрушаться. С возрастом способность тела синтезировать витамин D самостоятельно снижается, поэтому необходимо позаботиться об определенных продуктах в рационе или о приеме БАДов (только после консультации врача).
«Солнечный» витамин не только стимулирует рост мышечной массы, но и отлично борется с воспалительными процессами, что не позволяет мышцам разрушаться. С возрастом способность тела синтезировать витамин D самостоятельно снижается, поэтому необходимо позаботиться об определенных продуктах в рационе или о приеме БАДов (только после консультации врача).
Фото: @thora_valdimars
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Силовые тренировкиЖенщины часто избегают силовых упражнений из страха набрать слишком много мышц и выглядеть массивно. На самом деле, заметное увеличение мышечного объема — результат упорного многолетнего труда и особого питания. А вот обычные силовые тренировки, доступные практически всем, помогут исключительно укрепить и подтянуть тело, создать мышечный корсет и предотвратить возрастную потерю мышц.
Кардио тренировкиПро аэробные нагрузки тоже забывать не следует. Кардио улучшает реакцию организма на инсулин, что способствует правильному восстановлению мышц после любых физических нагрузок. Не обязательно изводить себя бегом на дорожке, выбирайте тип упражнений, который вам по душе. Это может быть быстрая ходьба, езда на велосипеде или плавание. Главное в этом деле — регулярность.
Кардио улучшает реакцию организма на инсулин, что способствует правильному восстановлению мышц после любых физических нагрузок. Не обязательно изводить себя бегом на дорожке, выбирайте тип упражнений, который вам по душе. Это может быть быстрая ходьба, езда на велосипеде или плавание. Главное в этом деле — регулярность.
От нейронов до гормонов. Современные научные знания о геронтологии
Издательство «Эксмо» представляет книгу Валерия Михайловича Новосёлова «От нейронов до гормонов. Современные научные знания о геронтологии и советы, как защитить свое тело и мозг от преждевременного старения».
Старение неизбежно, но есть целый ряд процессов, на которые может повлиять человек, чтобы прожить здоровым и активным как можно дольше. К таким относятся режим сна, гомеостаз, гормональный фон, метаболизм, стресс, питание и физическая активность. Валерий Новосёлов, врач-гериатр с 30-летним опытом работы, невролог, в своей новой книге рассказывает, какие процессы в организме меняются с возрастом, как правильно заботиться о себе, чтобы не допустить проблем в будущем, и что делать, если уже беспокоят возрастзависимые заболевания.
Предлагаем прочитать фрагмент книги, посвященный саркопении.
Всё больше внимания мир уделяет проблеме саркопении. Данный термин в 1989 году предложил I. Rosenberg, а диагностическая концепция синдрома сформирована позднее, в 1998 году. В последние годы мы наблюдаем буквально взрыв интереса к данной теме, и странно даже, что эту гигантскую, а не частную и мелкую проблему не замечали так долго в нашем катастрофически стареющем мире.
Вы часто видите таких людей: они потихоньку, поддерживая друг друга, идут рядом с вами по улице. Или в супермаркетах, где они двигаются, как бы уложив верхнюю часть своего тела на тележку для опоры и толкая ее перед собой. Просто вы не думаете о них именно как о пациентах, считая, что это нормально. Ведь они часть нашего мира.
Так что же такое саркопения? Это снижение объема и силы скелетной мускулатуры. Сам процесс тесно связан именно с возрастом, с процессами инволюции нашей мышечной ткани. Проявляется он снижением физической активности, мышечной слабостью, повышенной утомляемостью. Приводит к снижению, а затем и утрате способности выполнять повседневную работу, сначала интенсивную, затем и менее интенсивную, а в итоге и к гипомобильности. По мере своего развития он серьезно снижает качество жизни пожилого и старого человека.
Приводит к снижению, а затем и утрате способности выполнять повседневную работу, сначала интенсивную, затем и менее интенсивную, а в итоге и к гипомобильности. По мере своего развития он серьезно снижает качество жизни пожилого и старого человека.
Таким образом, саркопения — атрофическое дегенеративное изменение скелетной мускулатуры, ассоциированное с возрастом и приводящее к постепенной потере мышечной массы и ее силы. Саркопения — это синдром, который характеризуется прогрессивным и генерализированным снижением скелетной мышечной массы, ее силы и риском развития таких осложнений, как нарушение подвижности, снижение качества жизни и смерть (EWGSOP, 2009).
Люди с этим синдромом ощущают мышечную слабость, снижение скорости своих движений, им сложнее выполнять именно быстрые движения, требующие мышечной силы и выносливости (бег, длительная ходьба в быстром темпе). На продвинутых стадиях постепенно нарастает зависимость от посторонней помощи.
Саркопения часто ассоциируется с различными патологическими состояниями, например, с повышенной инсулинорезистентностью, деменцией, падениями, переломами, и в итоге приводит к обвалу жизнеспособности, госпитализации и смерти пациента. Ранее саркопенией считалось снижение тощей массы на два стандартных отклонения, измеренных при двухэнергетической рентгеновской абсорбциометрии по отношению к молодому здоровому взрослому человеку того же пола. Такой подход имел целый ряд преимуществ: он был понятен, а диагностика могла проводиться в ходе обследования по остеопорозу.
Ранее саркопенией считалось снижение тощей массы на два стандартных отклонения, измеренных при двухэнергетической рентгеновской абсорбциометрии по отношению к молодому здоровому взрослому человеку того же пола. Такой подход имел целый ряд преимуществ: он был понятен, а диагностика могла проводиться в ходе обследования по остеопорозу.
В 2010 году концепция саркопении была пересмотрена. Европейская ассоциация клинического питания и метаболизма предложила определять ее при снижении мышечной массы более двух стандартных отклонений, и, что важно, это должно обязательно сочетаться со снижением скорости ходьбы человека ниже 0,8 м/с.
Вопросы классификации саркопении окончательно не решены, а многие из них спорны. Однако мы выделяем пресаркопению (или динопению) — снижение мышечной силы без нарушения функции передвижения, и собственно саркопению, когда и происходит снижение мышечной силы, и наступает гипомобильность. Европейская рабочая группа по изучению саркопении у пожилых людей предложила выделять три стадии синдрома: снижение мышечной массы, снижение мышечной массы и силы, и третья — снижение всех параметров.
Точной статистики по представленности саркопении, даже если кто-то говорит, что она есть, не существует по многим причинам. Это и разные методы оценки, разные подходы, отсутствие единых критериев в разных популяциях. Например, когда говорят, что среди лиц пожилого возраста 60–74 лет синдром саркопении есть у 22 % людей, встает вопрос: а разве можно такие разные возрастные группы, как 60 и старше 70, вообще включать в одну фокус-группу?
Напомню, что максимальное развитие мышц у человека приходится на возраст около 25–30 лет, к 50 годам мышечная масса уменьшается. В большинстве случаев средняя потеря мышечной массы у человека составляет около 1 % в год в возрасте после 35–40 лет. После 50 лет мышечная масса снижается на 1–2 %, мышечная сила — на 1,5–3 % в год, у мужчин это более выражено, чем у женщин.
В молодом и среднем возрасте под влиянием физической нагрузки происходит формирование микротравмы в ткани скелетной мускулатуры. В область микротравмы мигрируют стволовые клетки, которые приходят в активное состояние и начинают продуцировать разнообразные миогенные факторы, что приводит к слиянию имеющихся мышечных волокон и стволовых клеток с формированием нового, увеличенного в объеме и обладающего большей силой мышечного волокна (гиперплазия). Эти процессы в старости нарушаются.
Эти процессы в старости нарушаются.
В качестве эталона силы мышц используется определение силы четырехглавой мышцы бедра, которая снижается в возрасте 80 лет на 20–40 % по сравнению с лицами 25-летнего возраста. Двуглавая мышца плеча (всем хорошо известный бицепс) в 30 лет весит 174 грамма, к 60 годам теряет 20 граммов, к 70 — еще 35 граммов.
Мышцы в старости на секции выглядят бледными, суховатыми и тугими, как бы натянутыми, падает их васкуляризация. Важно, что эти изменения мы видим во всей скелетной мускулатуре. Патофизиологические изменения мускулатуры характеризуются тотальным снижением числа мышечных волокон, а также выраженной инфильтрацией скелетных мышц фиброзной и жировой тканью. На уровне мышечного волокна происходит дегенерационная атрофия миоцитов, снижается количество нейромускулярных единиц, снижается количество мышечных волокон второго типа, которые являются волокнами быстрого сокращения и обеспечивают, прежде всего, быстрые действия человека (например, бег).
В развитии саркопении играет роль:
– системное воспаление;
– циркуляционная и тканевая гипоксия;
– уменьшение синтеза белка;
– алиментарные факторы: плохое питание, нарушения моторики желудочно-кишечного тракта;
– гормональные изменения: возрастное снижение уровней СТГ, тестостерона, эстрогена и инсулиноподобного фактора роста;
– снижение содержания иммуноглобулина А, G, противоспалительных цитокинов;
– усиление оксидативных процессов;
– возрастное снижение активности альфа-мотонейрона спинного мозга;
– снижение способности мышечной ткани к регенерации;
– возрастзависимая патология, включающая в себя на всех этапах и уровнях развития саркопению (остеопороз, диабет 2-го типа, болезнь Альцгеймера, сердечно-сосудистые заболевания), она как бы дает дополнительное ускорение синдрому.
Профилактика синдрома саркопении
1. Адекватная физическая нагрузка с обязательными силовыми упражнениями.
2. Увеличение потребления белка при отсутствии противопоказаний со стороны почек. Суммарное потребление белка должно составлять 1,2 г/кг веса/сутки, дополнительное назначение пациентам с саркопенией белка в дозе 0,25 г/кг/cутки вызывает достоверное повышение «тощей» массы.
Суммарное потребление белка должно составлять 1,2 г/кг веса/сутки, дополнительное назначение пациентам с саркопенией белка в дозе 0,25 г/кг/cутки вызывает достоверное повышение «тощей» массы.
3. Использование протеиновых смесей и аминокислот (лейцин, изолейцин, валин).
4. Выделю еще четыре вещества: L-карнитин, карнозин, L-аргинин, креатинин.
5. Терапия препаратами тестостерона для мужчин (если нет противопоказаний).
6. Терапия эстрогенами (для женщин, доказательств почти нет).
7. Низкодозный СТГ (это назначение только off-label, кроме того, непонятно, надо ли его использовать, если его показания в рамках референтных значений), данные о пользе данного гормона крайне противоречивы.
8. Витамин D3, полиненасыщенные жирные кислоты.
9. Терапия основной патологии старости (диабет 2-го типа, макроангиопатии, нейродегенеративные и прочие).
Эффективность физических нагрузок превышает результаты других видов лечения саркопении, применявшихся без сочетания с физической нагрузкой (различные варианты заместительной гормональной терапии, коррекция питания). Идеальный вид физических нагрузок для пожилых людей — скандинавская ходьба, в которой используется техника ходьбы с палками. Скандинавская ходьба имеет ряд преимуществ для лиц в возрасте, так как проста в технике и не имеет возрастных ограничений, а при занятиях ею задействованы более 90 % мышц.
Идеальный вид физических нагрузок для пожилых людей — скандинавская ходьба, в которой используется техника ходьбы с палками. Скандинавская ходьба имеет ряд преимуществ для лиц в возрасте, так как проста в технике и не имеет возрастных ограничений, а при занятиях ею задействованы более 90 % мышц.
Мы можем попытаться вмешаться в цепочку «физическая нагрузка — умеренная тканевая гипоксия — активация гипоксических факторов — экспрессия генов — адаптация» с помощью специальных интервальных гипоксических упражнений, воздействуя на синтез гипоксия-индуцируемым фактором (HIF), гетеродимерами, которые влияют на 2 % всех генов человека и запускают каскад сложных адаптационных биохимических реакций. В этом случае мы даем нагрузку на механизмы биохимической и эпигенетической адаптации, а человек при этом лежит или сидит в кресле. Но на вопрос, как и насколько гипоксические интервальные тренировки могут нам помочь в борьбе с саркопенией, ответит только будущее.
Недавно 90-летний бегун-любитель Earl Fee пробежал 400 метров за 1:30. 76 (прежний рекорд составил 1:46.78) и дистанцию 800 метров за 3:42.50. Нам уже в ближайшем будущем следует ожидать просто дождя рекордов в группах ветеранов старших возрастных групп.
76 (прежний рекорд составил 1:46.78) и дистанцию 800 метров за 3:42.50. Нам уже в ближайшем будущем следует ожидать просто дождя рекордов в группах ветеранов старших возрастных групп.
В саркопении важны три характеристики этого синдрома: он прогрессирует, повышает вероятность смерти и — самое важное для нас — мы можем на него повлиять.
Легче проводить профилактику саркопении, чем с ней бороться.
Сохранение объемов скелетной мускулатуры — это одна из основ активного и здорового долголетия.
Занимайтесь физическими нагрузками на постоянной основе как можно дольше.
Силовые нагрузки — обязательный компонент борьбы с саркопенией.
Новые научные данные: найдена доступная альтернатива старению
Результаты исследований, о которых мало кто знает. Совершенно незаметно прошла мимо широкого внимания сенсация, случившаяся на конференции по долголетию в начале октября 2014 года в Базеле, Швейцария
А ведь новые научные данные, обнародованные там, касаются каждого! Ученые из команды Эндрю Маркса из Колумбийского университета (Нью-Йорк) объявили, что одной из главных причин старения (а отнюдь не следствием) является возрастная потеря мышечной массы. Их данные подтверждают и специалисты Калифорнийского университета США, которые обнаружили, что вероятность умереть от сердечно-сосудистых заболеваний возрастает прямо пропорционально уменьшению мышечной массы в организме.
Их данные подтверждают и специалисты Калифорнийского университета США, которые обнаружили, что вероятность умереть от сердечно-сосудистых заболеваний возрастает прямо пропорционально уменьшению мышечной массы в организме.
Согласно последней возрастной классификации Всемирной организации здравоохранения, молодой возраст заканчивается в 44 года, однако возрастная потеря мышечной массы начинается уже с 25 лет. Каждый мужчина в возрасте от 25 до 45 лет теряет мышечную массу и силу в среднем чуть менее 1% в год. Это число кажется небольшим, но в дальнейшем скорость потери растет.
Таким образом, если ничего специально не предпринимать, то к пожилому возрасту из-за этих процессов теряется до 60% изначальной мышечной массы, и любая болезнь способна заметно ускорить этот процесс.
Мышцы являются единственным местом, где тело может хранить существенные запасы своего главного строительного материала — аминокислот, из которых синтезируются различные белки. Таким образом, когда нам плохо, организм может оперативно взять в мышцах требуемые аминокислоты для восстановления органов. Если же мышечной массы мало, то шансы выздороветь и восстановиться могут снижаться. И каждый эпизод болезни может забирать вашу мышечную массу и уменьшать ваш ресурс сопротивления болезням с возрастом. Мышечное депо играет важную роль и в других важнейших процессах обмена. Сокращение доступного запаса аминокислот с возрастом приводит и к дефициту коллагена — белка, определяющего упругость кожи.
Если же мышечной массы мало, то шансы выздороветь и восстановиться могут снижаться. И каждый эпизод болезни может забирать вашу мышечную массу и уменьшать ваш ресурс сопротивления болезням с возрастом. Мышечное депо играет важную роль и в других важнейших процессах обмена. Сокращение доступного запаса аминокислот с возрастом приводит и к дефициту коллагена — белка, определяющего упругость кожи.
Сокращение объема мышц с возрастом, особенно объема важных скелетных мышц, приводит к уменьшению скорости основного обмена, и это создает заметную склонность к накоплению жира и лишнего веса. В масштабном исследовании 2010 г.* было протестировано более 8 тысяч людей разного возраста. Выяснилось, что у взрослых после 40 лет тело в состоянии покоя сжигает на 50–60 килокалорий в день меньше. Кажется, что это не слишком много, но, если не изменить уровень физической активности и пищевые привычки, вы набираете три килограмма за год!
Замещение с возрастом мышечной ткани на жировую является важной особенностью, маскирующей остроту проблемы потери мышц. С возрастом внешний вид и вес человека может почти не меняться, но при этом объем мышечной массы может заметно сократиться. Происходит увеличение объема внутреннего (висцерального) жира и снижение подкожно-жирового слоя. Происходящая жировая инфильтрация мышц сопровождается снижением объема и силы мышц. Чем меньше в организме мышц и больше жира, тем тяжелее двигаться и тем меньше стремление к физической активности. Чем дольше откладываются занятия спортом, тем сложнее решиться на них в дальнейшем. И это замкнутый круг, приковывающий нас к любимому дивану. Слабые мышцы приводят к потере чувства удовольствия от движения и со временем вызывают все более доминирующее ощущение усталости и раскоординированности — как тут найти силы для активных физических нагрузок?
С возрастом внешний вид и вес человека может почти не меняться, но при этом объем мышечной массы может заметно сократиться. Происходит увеличение объема внутреннего (висцерального) жира и снижение подкожно-жирового слоя. Происходящая жировая инфильтрация мышц сопровождается снижением объема и силы мышц. Чем меньше в организме мышц и больше жира, тем тяжелее двигаться и тем меньше стремление к физической активности. Чем дольше откладываются занятия спортом, тем сложнее решиться на них в дальнейшем. И это замкнутый круг, приковывающий нас к любимому дивану. Слабые мышцы приводят к потере чувства удовольствия от движения и со временем вызывают все более доминирующее ощущение усталости и раскоординированности — как тут найти силы для активных физических нагрузок?
Совсем недавно считалось, что регулярные легкие и умеренные физические нагрузки, такие как пешие прогулки, бег трусцой, спокойная ходьба на лыжах, медленное плавание, тренировки на беговых дорожках, способны оптимально поддерживать тренированность и являются некоторой профилактикой старости. Однако оказалось, что уменьшение объема мышц с возрастом обусловлено в основном уменьшением количества «быстрых» мышечных волокон — эти волокна отвечают за высокоинтенсивную физическую активность. Таким образом, обернуть процесс мышечной деградации вспять могут в основном относительно высокоинтенсивные тренировки, ориентированные на «быстрые» мышечные волокна, например, быстрый и рваный бег в игровых видах спорта, функциональный тренинг и грамотная работа всех групп мышц в тренажерном зале. А тренировки, направленные на «медленные» волокна, для борьбы с возрастными изменениями почти бесполезны.
Однако оказалось, что уменьшение объема мышц с возрастом обусловлено в основном уменьшением количества «быстрых» мышечных волокон — эти волокна отвечают за высокоинтенсивную физическую активность. Таким образом, обернуть процесс мышечной деградации вспять могут в основном относительно высокоинтенсивные тренировки, ориентированные на «быстрые» мышечные волокна, например, быстрый и рваный бег в игровых видах спорта, функциональный тренинг и грамотная работа всех групп мышц в тренажерном зале. А тренировки, направленные на «медленные» волокна, для борьбы с возрастными изменениями почти бесполезны.
Более того, бег или длительные кардиотренировки на беговой дорожке, например, способны легко привести к заметной потере мышечной массы! В этой связи повальное увлечение бегом трусцой и многочасовые забеги, бездумное увлечение кардиотренажерами кратковременно повышают уровень тренированности мышц ног и сердца, но не будут эффективными в плане борьбы с возрастной потерей мышечной массы и замещением ее жиром, не отложат старение. Для эффективной борьбы с возрастом и весом нужен тренажерный зал.
Для эффективной борьбы с возрастом и весом нужен тренажерный зал.
С возрастом следует тщательно подходить к выбору тренажерного зала — хорошо оснащенного и располагающего грамотными профессионалами, с которыми можно путем разносторонних упражнений построить заново красивое тело и после 50 лет. В возрасте на этот процесс может потребоваться целый год и немало денег, но это позволяет снизить непоправимый вред, который можно нанести организму, выполняя упражнения неумело, без знания всех необходимых тонкостей, не понимая состояния сердца, позвоночника и суставов, не владея техникой упражнений и необходимыми знаниями в области биохимии и эндокринологии, физиологии и реабилитации.
На сегодняшний день только один фитнес-центр в Новосибирске следует концепции «научного фитнеса», отвечает всем требованиям по работе с возрастными клиентами и располагает соответствующими тренерами и оборудованием — это новый фитнес-клуб EDGE, открывшийся в 2018 г. * Это единственный фитнес-клуб города, в котором работает команда сертифицированных реабилитологов*. Только в этом клубе в Новосибирске установлена система кардиомониторинга MyZone для непрерывного отслеживания оптимальной зоны кардионагрузок на тренировках**.
* Это единственный фитнес-клуб города, в котором работает команда сертифицированных реабилитологов*. Только в этом клубе в Новосибирске установлена система кардиомониторинга MyZone для непрерывного отслеживания оптимальной зоны кардионагрузок на тренировках**.
В EDGE также установлен единственный в Новосибирске аппарат InBody770 для измерения 75 показателей мышечной массы, висцерального и подкожного жира, состояния клеток, позволяющий четко и точно диагностировать любые изменения, включая возрастные, и отслеживать эффективность занятий***.
Генеральный директор EDGE Premium Fitness Club Максим Частковский:«В клубе собраны наиболее квалифицированные специалисты города в области фитнеса, тренеры с медицинским образованием, нутрициологи, реабилитологи — рассказывает управляющий клуба EDGE Premium Fitness Максим Частковский. — Здесь способны разработать для клиента индивидуальную программу питания и занятий для эффективного набора мышечной массы и потери жира без вреда для здоровья. Полгода занятий в клубе EDGE под руководством опытного тренера гарантированно дадут вам больше, чем несколько лет в обычном фитнес-клубе»
— Здесь способны разработать для клиента индивидуальную программу питания и занятий для эффективного набора мышечной массы и потери жира без вреда для здоровья. Полгода занятий в клубе EDGE под руководством опытного тренера гарантированно дадут вам больше, чем несколько лет в обычном фитнес-клубе»
«В хорошем клубе можно построить заново красивое тело и после 50 лет, — уверен Александр — На это может потребоваться целый год и это стоит денег, но это позволяет избежать непоправимого вреда, который можно нанести организму, выполняя упражнения некорректно, без знания тонкостей, не понимая состояния сердца, позвоночника и суставов, не владея техникой упражнений и необходимыми знаниями в области биохимии и эндокринологии, физиологии и реабилитации»
«Чем больше научно обоснованных методов в фитнесе, тем он эффективнее и безопаснее, — комментирует Александр Филимонов. — Изучение физиологии, спортивной медицины, прикладных программ тренировок позволит сделать тренировки намного более результативными и полезными для здоровья». По мнению Александра, особенно важен «научный» подход к тренировкам для зрелых людей.
— Изучение физиологии, спортивной медицины, прикладных программ тренировок позволит сделать тренировки намного более результативными и полезными для здоровья». По мнению Александра, особенно важен «научный» подход к тренировкам для зрелых людей.
Узнайте подробнее об эксклюзивных условиях членства с гарантией результата по тел. 8-800-234-00-57
Фитнес-клуб EDGE:
пр. Карла Маркса, 57
тел. 8-800-234-00-57
Instagram: @edgepremiumfitness
edgepremiumfitness.ru
Справка: Фитнес-клуб EDGE оснащен премиальными линейками самых современных на сегодняшний день тренажеров компании Life Fitness (США). Life Fitness внес клуб в список лучших проектов компании. Также клубу присвоен международный почетный статус официального тренировочного центра Hammer Strength. Это новый полноценный фитнес-клуб с бассейном, один из самых больших в Новосибирске. Он способен предложить необыкновенно высокий уровень оснащенности, гигиеничности, комфорта, сервиса, качества и профессионализма. Клуб признан самым стильным клубом Урала, Сибири и Дальнего Востока и входит в топ-5 фитнес-клубов России по данным авторитетного международного журнала AD.
Это новый полноценный фитнес-клуб с бассейном, один из самых больших в Новосибирске. Он способен предложить необыкновенно высокий уровень оснащенности, гигиеничности, комфорта, сервиса, качества и профессионализма. Клуб признан самым стильным клубом Урала, Сибири и Дальнего Востока и входит в топ-5 фитнес-клубов России по данным авторитетного международного журнала AD.
Только факты:
1. Более 4000 кв. м, 10 фитнес-залов, бассейн, хамам, сауна и более 50 видов групповых программ.
2. Наивысшие стандарты гигиеничности и безопасности: каучуковые спортивные полы без запаха, противоскользящая плитка, сверхскоростная очистка воды в бассейне. Только сенсорная сантехника. Мощные системы кондиционирования.
3. Самое передовое оборудование в отрасли и новейшие инструменты фитнес-тестирования.
4. Сильный тренерский состав. EDGE — единственный в Новосибирске фитнес-клуб с командой сертифицированных реабилитологов.
5. Две большие бесплатные парковки, удобная транспортная развязка для жителей всех районов
6. Spa концепция. Ультрасовременный 18-метровый бассейн из нержавеющей стали с цветомузыкальной подсветкой, римской лестницей, гейзерами, водопадами и аэромассажем. Инновационный мраморный хаммам KLAFS длиной более 7 метров, с 4 системами парового удара. Роскошная дизайнерская сауна из канадского кедра площадью почти 16 кв.м.
7. Люксовые детали: полотенца и халаты в свободном доступе, охлажденные мини-полотенца, кнопочные души с термостатами, отсутствие турникетов, интерактивные тренажеры с самыми большими FHD экранами в отрасли.
8. Ультрасовременный дизайнерский интерьер. Открытое многоуровневое пространство с атриумом и панорамными окнами. Передовые решения и технологии, эксклюзивные материалы.
9. Клубная атмосфера: лобби, удобные общие зоны. Бар с DJ-сессиями и концертами только для членов клуба.
*По данным Новосибирской региональной общественной организации «Федерация фитнес-аэробики».
**По данным LifeFitness
***По данным InBody
Саркопения у больных: возможности диагностики и перспективы лечения | #08/17
Многие заболевания, как острые, так и хронические, сопровождаются непреднамеренной потерей массы тела. Результатом этого может быть развитие недостаточного питания или истощения. Согласно определению, недавно предложенному Европейским обществом по клиническому питанию (European Society for Clinical Nutrition and Metabolism, ESPEN, 2015), недостаточным питанием называется состояние, при котором в результате недостаточного поступления в организм или усвоения в нем питательных веществ отмечаются изменения в компонентном составе организма, в частности снижение тощей массы тела, приводящие к нарушению физических и психических функций организма, ухудшающие клинический исход заболевания [1]. Ранее нами было предложено похожее определение недостаточности питания как «патологического состояния, обусловленного несоответствием поступления и расходов питательных веществ, приводящим к снижению массы тела и изменению компонентного состава организма» [2].
Ранее нами было предложено похожее определение недостаточности питания как «патологического состояния, обусловленного несоответствием поступления и расходов питательных веществ, приводящим к снижению массы тела и изменению компонентного состава организма» [2].
Компонентный состав организма в упрощенном виде состоит из двух частей — жировой массы и так называемой «тощей» или безжировой массы. При углубленном рассмотрении состав тощей массы неоднороден, в нее входят вода, мышечная масса, кости, кожа, внутренние органы [3].
Возможности детального анализа компонентного состава тела раньше были весьма ограничены. В настоящее время диагностические возможности существенно расширились. Для анализа многокомпонентного состава организма используются такие инструментальные и высокотехнологичные методы, как биоимпедансометрия, компьютерная и магнитно-резонансная томографии, рентгеновская абсорбциометрия, денситометрия и др. Они позволяют как качественно, так и количественно оценить точное содержание жира, мышечной массы, костей, воды в различных частях организма. Недавно был разработан метод периферической количественной компьютерной томографии [4, 5].
Недавно был разработан метод периферической количественной компьютерной томографии [4, 5].
Благодаря новым техническим возможностям сегодня стало возможно оценить влияние изменений отдельных компонентов состава организма на течение и исход заболеваний. Было установлено, что снижение мышечной массы тела имеет большее прогностическое значение, чем изменения в количестве жировой ткани. Также было показано, что изменения в тощей и мышечной массе тела у больных часто опережают снижение общей массы тела.
В настоящее время определяющее значение в оценке тяжести, динамике течения и прогнозе заболевания имеет наличие и степень выраженности мышечного истощения (саркопении) у больных. Термин «саркопения» (от греческих слов sarx — мясо, плоть и penia — недостаток) был предложен профессором из США Ирвином Розенбергом (Irwin Rosenberg) в 1988 г. [6]. Предлагались и другие термины, обозначающие дефицит мышечной массы: миопения, кратопения, динапения и др. [7, 8].
Согласно Европейскому консенсусу по саркопении (2010), под этим термином понимают уменьшение мышечной массы тела и снижение функции мышц (силы и производительности), обусловленные возрастными нейрогуморальными сдвигами, нарушениями питания или мышечным катаболизмом [9, 10].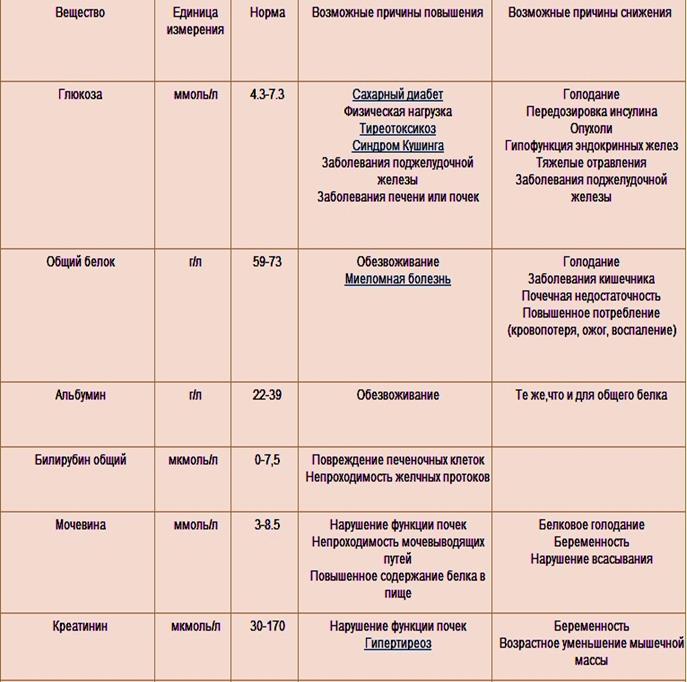
В сентябре 2016 г. диагноз «саркопения» был официально включен в дополненную 10-ю международную классификацию болезней (МКБ-10) под кодом М 62.84 [11].
Причины развития саркопении разнообразны. Она может возникнуть вследствие естественных инволютивных (старческих) изменений в организме, длительного голодания, нарушений питания, мальабсорбции и т. п. Саркопения часто наблюдается при хронических сердечно-сосудистых заболеваниях, сопровождающихся недостаточностью кровообращения, хронических болезнях легких с дыхательной недостаточностью, тяжелых поражениях печени и почек (циррозы, нефриты и т. п.), нейродегенеративных заболеваниях (болезнях Альцгеймера, Паркинсона, рассеянном склерозе и др.), различных видах рака, а также при кахексии любого происхождения. Кроме того, саркопения развивается при длительном постельном режиме, малоподвижности, в невесомости (у космонавтов), а также при дефиците стероидных половых гормонов, в частности тестостерона, а также гормона роста.
Саркопения часто встречается в клинической практике [12]. Так, при хронических сердечно-сосудистых и бронхолегочных заболеваниях распространенность саркопении в 2 раза выше, а при циррозах печени — в 18–50 раз выше, чем недостаточности питания (табл. 1).
Так, при хронических сердечно-сосудистых и бронхолегочных заболеваниях распространенность саркопении в 2 раза выше, а при циррозах печени — в 18–50 раз выше, чем недостаточности питания (табл. 1).
По оценкам международных экспертов, саркопения станет к 2045 г. общемировой проблемой [13]. Это связано со старением населения нашей планеты, увеличением продолжительности жизни, а следовательно, числа лиц пожилого и старческого возраста. По оценкам международных экспертов, число пожилых людей в мире с 2000 по 2050 гг. возрастет с 600 млн до 2 млрд человек. Распространенность саркопении в мире при этом вырастет на 70% — с 19 млн (в 2016 г.) до 32 млн человек (в 2045 г.).
В патогенезе развития саркопении у больных, находящихся как в стационарах, так и на дому, имеет место так называемый «порочный круг», когда заболевание и постельный режим сопровождаются потерей аппетита и развитием нарушений питания, в частности саркопении, а она, в свою очередь, приводит к снижению двигательной активности, постельному режиму и потере аппетита (рис. 1).
1).
Рис. 1. Порочный круг саркопении
В последнее время установлено, что саркопения имеет определенное значение для прогноза течения и исхода заболевания, особенно у тяжелобольных. Показано, что за 10 суток нахождения больного в отделении реанимации он теряет около 17% массы мышц бедра. При этом величина снижения мышечной массы прямо коррелирует с тяжестью полиорганных нарушений. При потере от 5% до 10% массы мышц отмечается нарушение функции одного органа, от 10% до 20% — двух или трех органов, свыше 20% мышечной массы — четырех органов [14].
Таким образом, саркопения является независимым фактором риска развития осложнений, в том числе и жизнеугрожающих, таких как сепсис или полиорганная недостаточность. Установлено, что саркопения является независимым прогностическим фактором развития осложнений после радикальных операций при раке желудка и раке легких. В последнее время отмечается, что именно саркопения является основной причиной госпитализации, инвалидизации и смертности больных [15–17].
Если саркопения сопровождается критической потерей не только мышечной, но и жировой массы, она неизбежно переходит в форму кахексии (рис. 2) [18]. Под кахексией в настоящее время понимают тяжелое истощение, вызванное катаболизмом на фоне системной воспалительной реакции в организме [19]. Она наблюдается у многих пациентов с тяжелыми заболеваниями (сердечная, почечная, печеночная, раковая кахексии). Тяжелая кахексия характерна и для развернутой клинической картины СПИДа в 4-й и 5-й стадиях болезни [20].
При сочетании саркопении (потери мышц) с увеличением жировой массы развивается так называемое «саркопеническое ожирение». Такая форма саркопении наблюдается часто у лиц с резко выраженным ожирением, у пожилых и у больных, длительно находящихся на постельном режиме. Так, в проведенном во Франции исследовании EPIDOS показано, что у лиц до 70 лет саркопеническое ожирение наблюдалось в 10–12% случаев, в то время как у лиц старше 80 лет — уже у 15–27% [21].
В настоящее время для диагностики саркопении используются скрининговые и инструментальные методы. При этом оценивают как размеры (объем) мышечной ткани в организме, так и функцию мышц (мышечную силу и работоспособность). Для первичной скрининговой оценки наличия или отсутствия саркопении у больных сегодня используют достаточно простую шкалу оценки SARC-F [22]. В ней оцениваются такие показатели, как подъем груза, ходьба по комнате, вставание с кровати, подъем по лестнице, непроизвольные падения (табл. 2). Саркопения предполагается при наличии четырех и более баллов.
При этом оценивают как размеры (объем) мышечной ткани в организме, так и функцию мышц (мышечную силу и работоспособность). Для первичной скрининговой оценки наличия или отсутствия саркопении у больных сегодня используют достаточно простую шкалу оценки SARC-F [22]. В ней оцениваются такие показатели, как подъем груза, ходьба по комнате, вставание с кровати, подъем по лестнице, непроизвольные падения (табл. 2). Саркопения предполагается при наличии четырех и более баллов.
Для более точной диагностики наличия саркопении у пациентов используют такие инструментальные методы, как биоимпедансный анализ компонентного состава организма, компьютерную и магнитно-резонансную томографии, рентгеновскую абсорбциометрию, а в последнее время — и ультразвуковое исследование [18, 23].
Наиболее простым способом оценить состояние мышц является измерение окружности плеча и толщины кожно-жировых складок с последующим расчетом окружности мышц плеча. Затем по специальным формулам можно вычислить площадь мышц плеча и общую мышечную массу тела. При всей доступности антропометрического метода он является наименее точным и достаточно субъективным, так как зависит от навыка и мастерства исследователя. Кроме того, состояние мышц плеча не всегда отражает общую мышечную массу, в частности, объем мышц нижних конечностей.
При всей доступности антропометрического метода он является наименее точным и достаточно субъективным, так как зависит от навыка и мастерства исследователя. Кроме того, состояние мышц плеча не всегда отражает общую мышечную массу, в частности, объем мышц нижних конечностей.
В настоящее время для оценки компонентного состава организма достаточно широко используют метод биоимпедансометрии. Он основан на измерении сопротивления при прохождении слабого электрического тока через ткани организма. С помощью современных аппаратов для биоимпедансометрии можно достаточно точно определить содержание тощей и мышечной массы тела, активной клеточной массы и общее содержание белка в организме. Наличие саркопении устанавливается с помощью индекса тощей массы тела (табл. 3).
Вторым по частоте использования в клинической практике инструментальным методом является двухэнергетическая рентгеновская абсорбциометрия (DXA). Этот метод является относительно недорогим и отличается небольшой лучевой нагрузкой на пациента. С его помощью можно определить так называемый скелетно-мышечный индекс, основанный на суммарном измерении мышечной массы двух верхних и двух нижних конечностей.
С его помощью можно определить так называемый скелетно-мышечный индекс, основанный на суммарном измерении мышечной массы двух верхних и двух нижних конечностей.
Компьютерная и магнитно-резонансная томографии позволяют определить скелетно-мышечную массу на уровне третьего поясничного позвонка (L3) и оценить наличие или отсутствие саркопении, рассчитав так называемый поясничный скелетно-мышечный индекс (табл. 3). Кроме того, этими методами можно точно определить общую тощую массу тела [24].
Существенно снизить лучевую нагрузку на пациента позволяет метод периферической количественной компьютерной томографии (pQCT), при котором измеряется мышечный массив в одной конкретной конечности [25].
Ультразвуковым методом можно неинвазивно и без лучевой нагрузки для пациента точно измерить объем конкретной мышцы. Метод относительно недорог и может использоваться у лежачих больных [26].
Для оценки наличия или, наоборот, отсутствия саркопении необходимо оценить не только размеры, но и функцию мышц. Для этого используют динамометрию кистей рук, а в самое последнее время — и измерение силы мышц ног (квадрицепсов). Критерием снижения мышечной силы является выжимание ручным динамометром менее 30 кг для мужчин и менее 20 кг для женщин [23]. Важным показателем физической выносливости является скорость ходьбы. Для этого проводят 4-метровый тест. Критерием саркопении как у мужчин, так и у женщин является скорость ходьбы менее 0,8 м в секунду.
Для этого используют динамометрию кистей рук, а в самое последнее время — и измерение силы мышц ног (квадрицепсов). Критерием снижения мышечной силы является выжимание ручным динамометром менее 30 кг для мужчин и менее 20 кг для женщин [23]. Важным показателем физической выносливости является скорость ходьбы. Для этого проводят 4-метровый тест. Критерием саркопении как у мужчин, так и у женщин является скорость ходьбы менее 0,8 м в секунду.
При наличии таких критериев, как снижение веса, саркопения, мышечная слабость (по динамометрии) и замедленная походка, устанавливается наличие синдрома «разбитости» (frailty syndrome) [27]. За рубежом для комплексной диагностики функционального состояния пациента и наличия или отсутствия саркопении проводят многоуровневый тест SARFRAIL [28].
До определенной стадии саркопения вполне обратима, за исключением возрастных инволютивных изменений. Для лечения саркопении используют усиленное белковое питание, стероидные и нестероидные анаболические средства, а также движение и физические упражнения.
Для профилактики и лечения саркопении необходимо увеличить синтез (анаболизм) и замедлить распад (катаболизм) белков в организме. С пищей в наш организм ежедневно поступает около 50–100 г белка, в то время как синтезируется и распадается у взрослого человека около 300 г белка в сутки. Поскольку белково-энергетическая недостаточность и нарушение синтеза белка всегда имеют место при саркопении, необходимо увеличить потребление белка до 1,2–1,5 г на кг массы тела в сутки. Для этого в последнее время используется дополнительное энтеральное питание, назначаемое перорально в виде жидких питательных смесей, выпиваемых медленно, со скоростью 100–200 мл в течение часа, так называемый пероральный сипинг [29].
В качестве дополнительного энтерального питания применяются сбалансированные питательные смеси, обогащенные как растительным, так и животным (молочным) белком. Жировой их компонент представлен комбинацией нескольких видов растительных масел (рапсового, подсолнечного, соевого, кокосового) и рыбьего жира, а углеводы — мальтодекстрином с высоким содержанием полисахаридов в виде крахмала. Также они содержат все необходимые витамины, макро- и микроэлементы (кальций, цинк, медь, железо, йод, фтор, хром, марганец, молибден, селен). Примером таких смесей может быть энтеральное питание Нутрикомп.
Также они содержат все необходимые витамины, макро- и микроэлементы (кальций, цинк, медь, железо, йод, фтор, хром, марганец, молибден, селен). Примером таких смесей может быть энтеральное питание Нутрикомп.
Для преодоления анаболической резистентности используются возможности таргетной фармакотерапии. Используются нестероидные и стероидные анаболические средства. Поскольку мужской половой гормон тестостерон влияет на пролиферацию и дифференцировку мышечных клеток, увеличивая синтез и уменьшая распад белка, таким образом увеличивая мышечную массу, силу и производительность, применяются синтетические аналоги тестостерона — стероидные анаболические средства, например, нандролон (Ретаболил). Эти препараты строго запрещены у спортсменов, так как относятся к допинговым средствам. Этой категории лиц, а также остальным пациентам могут быть беспрепятственно назначены нестероидные анаболические и энерготропные средства, в первую очередь левокарнитин (L-карнитин).
Карнитин в организме содержится в основном в мышечной ткани (95%). При его дефиците отмечается выраженная мышечная слабость, катаболизм белков мышц [30]. Показано, что прием L-карнитина приводит, в том числе, к увеличению содержания в крови анаболических гормонов, в частности, тестостерона и инсулиноподобного фактора роста [31]. При этом он не относится к запрещенным, допинговым средствам и может использоваться у спортсменов [32]. В нашей стране уже более 10 лет широко используется фармакологический препарат L-карнитина Элькар, назначаемый как перорально, так и парентерально. У больных с раковой саркопенией и кахексией карнитин снижает оксидативный стресс, подавляет выработку провоспалительных цитокинов, уменьшает атрофию мышц и мышечную слабость [33].
При его дефиците отмечается выраженная мышечная слабость, катаболизм белков мышц [30]. Показано, что прием L-карнитина приводит, в том числе, к увеличению содержания в крови анаболических гормонов, в частности, тестостерона и инсулиноподобного фактора роста [31]. При этом он не относится к запрещенным, допинговым средствам и может использоваться у спортсменов [32]. В нашей стране уже более 10 лет широко используется фармакологический препарат L-карнитина Элькар, назначаемый как перорально, так и парентерально. У больных с раковой саркопенией и кахексией карнитин снижает оксидативный стресс, подавляет выработку провоспалительных цитокинов, уменьшает атрофию мышц и мышечную слабость [33].
При переходе саркопении в стадию кахексии по показаниям назначают противовоспалительные (прогестины, глюкокортикоиды, каннабиноиды), антицитокиновые препараты (бимагрумаб, этанерцепт, талидомид и др.), а также гормон роста. В перспективе рассматривают возможность применения ингибиторов протеасом, антагонистов миостатина, аналога грелина — анаморелина [34, 35].
Большое значение при лечении саркопении имеет достаточная двигательная и физическая активность. Она способствует активизации анаболических процессов в организме, росту массы мышц и увеличению их силы и производительности. Показано, что физические упражнения увеличивают выработку инсулиноподобного фактора роста в организме в 4 раза [36, 37].
Результатом лечения саркопении должен быть не просто рост тощей (мышечной) массы тела, но и увеличение функции мышц, т. е. их силы и производительности, а также улучшение качества жизни больных.
Выводы
Саркопения достаточно часто встречается в клинической практике среди различных категорий терапевтических и хирургических пациентов.
Саркопения является независимым фактором риска развития осложнений, в том числе жизнеугрожающих, таких как сепсис и полиорганная недостаточность.
Диагноз «саркопения» с сентября 2016 г. официально включен в Международную классификацию болезней 10-го пересмотра (МКБ-10) под кодом М 62. 84.
84.
Для диагностики саркопении у пациентов используют скрининговые опросники, а также такие инструментальные методы, как биоимпедансный анализ компонентного состава организма, компьютерную и магнитно-резонансную томографии, двойную рентгеновскую абсорбциометрию, ультразвуковое исследование.
Для профилактики и лечения саркопении используют как усиленное по белку и энергии питание с включением сбалансированных энтеральных питательных смесей, так и стероидные или нестероидные анаболические средства, в том числе L-карнитин, а также физические упражнения.
Результатом лечения должно быть не просто увеличение массы мышц, но и повышение их функции, т. е. силы и производительности, а в итоге — улучшение качества жизни больных.
Предупреждение саркопении и перехода ее в кахексию является основной задачей лечения у различных категорий больных, поскольку кахексию проще предупредить, а в необратимой стадии кахексия практически неизлечима.
Литература
- Cederholm T.
 , Bosaeus I., Barazzoni R. et al. Diagnostic criteria for malnutrition — an ESPEN Consensus Statement // Clin. Nutr. 2015. Vol. 34, № 3. P. 335–340.
, Bosaeus I., Barazzoni R. et al. Diagnostic criteria for malnutrition — an ESPEN Consensus Statement // Clin. Nutr. 2015. Vol. 34, № 3. P. 335–340. - Хорошилов И. Е. Недостаточное питание у пациента: диагностика и лечение // Лечащий Врач. 2003. № 6. С. 62–64.
- Николаев Д. В., Смирнов А. В., Бобринская И. Г., Руднев С. Г. Биоимпедансный анализ состава тела человека. М.: Наука, 2009. 392 с.
- Frank A. W., Lorbergs A. L., Chilibeck P. D. et al. Muscle cross sectional area and grip torque contraction types are similarly related to pQCT derived bone strength indices in the radii of older healthy adults // J. Musculoskelet. Neuronal. Interact. 2010. Vol. 10, № 2. P. 136–141.
- Blew R. M., Lee V. R., Farr J. N. et al. Standardizing evaluation of pQCT image quality in the presence of subject movement: qualitative versus quantitative assessment // Calcif. Tissue Int. 2014. Vol. 94, № 2. P. 202–211.
- Rosenberg I. Summary comments // Am.
 J. Clin. Nutr. 1989. Vol. 50. P. 1231–1233.
J. Clin. Nutr. 1989. Vol. 50. P. 1231–1233. - Fearon K., Evans W., Anker S. Myopenia — new universal term for muscle wasting // J. Cachexia Sarcopenia Muscle. 2011. Vol. 2. № 1. P. 1–3.
- Morley J. E. Sarcopenia epidemiology / Materials of 9 th International Conference on Cachexia, Sarcopenia and Muscle Wasting, Berlin, Germany, 10–11 December 2016. P. 13.
- Cruz-Jentoft A. J., Baeyens J. P., Bauer J. M. et al. Sarcopenia: European consensus on definition and diagnosis: report of the European working group on sarcopenia in older people // Age Ageing. 2010. Vol. 39, № 4. P. 412–423.
- Muscaritoli M., Anker S. D., Argiles J. et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special Interest Groups (SIG) «cachexia-anorexia in chronic wasting diseases» and «nutrition in geriatrics» // Clin. Nutr. 2010. Vol. 29, № 2. P. 154–159.
- Anker S. D., Morley J. E., von Haehling S. Welcome to the ICD-10 code for sarcopenia // J.
 Cachexia, Sarcopenia and Muscle. 2016. Vol. 7, № 5. P. 512–514.
Cachexia, Sarcopenia and Muscle. 2016. Vol. 7, № 5. P. 512–514. - Von Haehling S., Morley J. E., Anker S. D. An overview of sarcopenia: facts and numbers on prevalence and clinical impact // J. Cachexia, Sarcopenia and Muscle. 2010. Vol. 1, № 2. P. 129–133.
- The future prevalence of sarcopenia in Europe. World Congress on osteoporosis, osteoarthritis and musculoskeletal diseases, 2016 // Osteoporosis Intern. 2016. Vol. 27, Suppl. 1.
- Puthucheary Z. A., Rawal J., McPhail M. et al. Acute skeletal muscle wasting in critical illness // JAMA. 2013. Vol. 310, № 15. P. 1591–1600.
- Morley J. E., Anker S. D., von Haehling S. Prevalence, incidence and clinical impact of sarcopenia: facts, numbers and epidemiology — Update 2014 // J. Cachexia, Sarcopenia and Muscle. 2014, № 5. Vol. 5. P. 253–259.
- Morley J. E. Sarcopenia epidemiology/ 9 th International conference on cachexia, sarcopenia and muscle wasting. Berlin, 10–11 December 2016.
 P. 13.
P. 13. - Liccini A., Malmstrom T. K. Frailty and sarcopenia as predictor of adverse health outcomes in persons with diabetes mellitus // J. Am. Med. Dir. Assoc. 2016. Vol. 17. P. 846–851.
- Biolo G., Cederholm T., Muscaritoli M. Muscle contractile and metabolic dysfunction is a common feature of sarcopenia of aging and chronic diseases: from sarcopenic obesity to cachexia // Clin. Nutr. 2014. Vol. 33, № 5. P. 737–748.
- Хорошилов И. Е. Недостаточность питания и её распространенность в клинической практике. В кн.: Парентеральное и энтеральное питание: национальное руководство / Под ред. М. Ш. Хубутия, Т. С. Поповой, А. И. Салтанова. М.: ГЭОТАР-Медицина, 2014. С. 161–169.
- Белозеров Е. С., Горбунов В. И., Мурыванова Н. Н. ВИЧ-инфекция: медико-социальные аспекты. Ульяновск: УлГУ, 2014. С. 70–71.
- Dupuy C., Lauwers-Cances V., Guyonnet S. Searching for a relevant definition of sarcopenia: results from the cross-sectional EPIDOS study // J.
 Cachexia, Sarcopenia and Muscle. 2015. Vol. 6, № 2. P. 144–154.
Cachexia, Sarcopenia and Muscle. 2015. Vol. 6, № 2. P. 144–154. - Malmstrom T. K., Morley J. E. SARC-F: a simple questionnaire to rapidly diagnose sarcopenia // J. Am. Med. Dir. Assoc. 2013. Vol. 14, № 8. P. 531-53-22.
- Sousa A., Guerra R. S., Fonseca I. Sarcopenia among hospitalized patients — a cross-sectional study // Clin. Nutr. 2015. Vol. 34, № 6. P. 1239–1244.
- Rollins K. E., Tewari N., Ackner A. The impact of sarcopenia and myosteatosis on outcomes of unresectable pancreatic cancer or distal cholangiocarcinoma // Clin. Nutr. 2016. Vol. 35, № 5. P. 1103–1109.
- Sergi G., Trevisan C., Veronese N. Imaging of sarcopenia // Eur. J. Radiol. 2016. Vol. 85, № 8. P. 1519–1524.
- Harris-Love M. O., Seamon B. A., Teixeira C., Ismail C. Ultrasound estimates of muscle quality in older adults: reliability and comparison of Photoshop and Image J for the grayscale analysis of muscle echogenicity // Peer J. 2016. Vol. 22, № 4.
 P. e1721.
P. e1721. - Morley J. E., Vellas B., van Kan G. A. Frailty consensus: a call to action // J. Am. Med. Dir. Assoc. 2013. Vol. 14, № 6. P. 392–397.
- Maggio M. Functional tests: gait speed, SPPB test / Materials of 9 th International Conference on Cachexia, Sarcopenia and Muscle Wasting, Berlin, Germany, 10–11 December 2016. P. 18.
- Хорошилов И. Е. Сипинговое энтеральное питание: клинико-фармакологический анализ и возможности использования в интенсивной терапии // Вестник анестезиологии и реаниматологии. 2015. Т. 12, № 5. С. 58–64.
- Хорошилов И. Е. Карнитин: роль в организме и возможности терапевтического применения при разных заболеваниях // Врач. 2017. № 3. С. 2–6.
- Kraemer W. J., Volek J. C., French D. N. et al. The effects of L-carnitine L-tartrate supplementation on hormonal responses resistence exercise and recovery // J. Strength Cond. Res. 2003. Vol. 17. P. 455–462.
- Парастаев С. А., Топольский А.
 В., Хван Д. Е. и др. О результатах применения L-карнитина (препарат Элькар) у спортсменов высокой квалификации // Спортивная медицина: наука и практика. 2012. № 2. С. 21–28.
В., Хван Д. Е. и др. О результатах применения L-карнитина (препарат Элькар) у спортсменов высокой квалификации // Спортивная медицина: наука и практика. 2012. № 2. С. 21–28. - Silverio R., Laviano A., Fanelli F. R., Seelaender M. L-carnitine and cancer cachexia: clinical and experimental aspects // J. Cachexia, Sarcopenia and Muscle. 2011. Vol. 2, № 1. P. 37–44.
- White T. A., Le Brasseur N. K. Myostatin and sarcopenia: opportunities and challenges — a mini-review // Gerontology. 2014. Vol. 60. P. 289–293.
- Zhang H., Garcia J. M. Anamorelin hydrochloride for the treatment cancer-anorexia-cachexia in NSCLC // Expert. Opin. Pharmacother. 2015. Vol. 16. P. 1245–1253.
- Bowen T. S., Schuler G., Adams F. Skeletal muscle wasting in cachexia and sarcopenia: molecular pathophysiology and impact of exercise training // J. Cachexia, Sarcopenia and Muscle. 2015. Vol. 6, № 3. P. 197–207.
- Gomes M. J., Martinez P. F., Pagan L. U.
 Skeletal muscle aging: influence of oxidative stress and physical exercise // Oncotarget. 2017. Vol. 15. P. 1–13. DOI: 10.18632/oncotarget.14670.
Skeletal muscle aging: influence of oxidative stress and physical exercise // Oncotarget. 2017. Vol. 15. P. 1–13. DOI: 10.18632/oncotarget.14670.
И. Е. Хорошилов, доктор медицинских наук
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
Контактная информация: [email protected]
Как бороться с потерей мышечной массы с возрастом
Саркопения — это потеря скелетной мышечной массы — в том числе из-за старения.
Саркопения сокращает продолжительность жизни. Силовые тренировки — самый эффективный вид физической тренировки для терапии саркопении. Однако масштабная реализация профилактики потери мышечной массы в процессе старения физическими упражнениями невыполнима для многих людей. Для преодоления этого барьера важна разработка альтернативных методов профилактики и лечения саркопении.
Лечить саркопению помогает ряд лекарств и добавок.
Саркопения буквально означает “отсутствие плоти”.
Саркопения — это потеря скелетной мышечной массы, в том числе из-за старения. Обычно человек начинает терять около 1-3% мышц в год после 50 лет. Иногда уже и с 35 лет. При саркопении наблюдаются не только снижение мышечной массы, но и падение мышечной силы, плохая физическая работоспособность в общем. Если человек в обычной жизни ходит со скоростью менее 1 метра в секунду, то это вероятно уже может означать развитие саркопении. Итог саркопении — смерть. Саркопения может прогрессировать до такой степени, что пожилой человек потеряет свою способность передвигаться самостоятельно.
Ссылки на исследования:
- www.sciencedirect.com/science/article/pii/S1568163716302719
- www.ncbi.nlm.nih.gov/pubmed/27370407
- www.ncbi.nlm.nih.gov/pubmed/27376823
К сожалению, саркопения также сильно сокращает продолжительность жизни.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/25365952
- www.ncbi.nlm.nih.gov/pubmed/26844538
Американский ученый Дорес Вагнер, проводя исследования в больнице Джона Хопкинса (США), показал, что саркопения связана с увеличением смертности в следующие 3 года наблюдения после постановки диагноза (см. график слева)
график слева)
Отсутствие физических упражнений считается значительным фактором риска саркопении. Даже высококвалифицированные спортсмены, которые продолжают тренироваться и соревноваться на протяжении всей своей взрослой жизни, все равно испытывают прогрессирующую потерю мышечной массы и силы, хоть и намного меньше, чем люди, ведущие малоактивный образ жизни.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/18299960
- www.ncbi.nlm.nih.gov/pubmed/17117147
- www.ncbi.nlm.nih.gov/pubmed/17880359
- www.ncbi.nlm.nih.gov/pmc/articles/PMC4724585
Факторы образа жизни, которые ускоряют наступление саркопении:
- Малоподвижный образ жизни.
- Постельный режим.
- Злоупотребление алкоголем
- Курение
- Периоды снижения активности могут создавать порочный круг. Мышечная сила снижается, что приводит к еще большей усталости и затрудняет возвращение к нормальной активности. Поэтому не нужно упражнения откладывать на потом.

Чрезмерно оптимально-калорийное питание (когда индекс массы тела опускается ниже 22,5) с низким содержанием белка становится обычным в пожилом возрасте из-за проблем с зубами, деснами, а также из-за сложности самостоятельного приготовления пищи с возрастом.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/26073423
- www.ncbi.nlm.nih.gov/pubmed/26980367
- www.ncbi.nlm.nih.gov/pubmed/26566405
Перечислим некоторые причины саркопении:
- Угасание функции митохондрий (энерегетических станций клеток организма). Это часто связано с уменьшением выносливости человека и в частности с уровнем максимального потребления кислорода
- Потеря моторных нейронов (нервных клеток) с возрастом.
- Снижение синтеза некоторых гормонов из-за старения: ИФР-1; тестостерон, гормон роста, инсулина и др.
- Системное старческое воспаление и любое другое хроническое воспаление (например, ХОБЛ, ревматоидный артрит, воспалительные заболевания кишечника, такие как болезнь Крона или язвенный колит, системная красная волчанка, хронические инфекции и др.
 ) провоцируют синтез воспалительных цитокинов: Интерлейкин-6; Фактор некроза опухоли альфа и др. Рост уровня стареющих клеток в процессе старения, вызывает воспаление, не связанное с каким-то органом организма — воспаление всего организма. Исследование 11 249 пожилых пациентов обнаружило, что высокий уровень воспалительного маркера C-реактивный белок хорошо предсказывает будущую саркопению.
) провоцируют синтез воспалительных цитокинов: Интерлейкин-6; Фактор некроза опухоли альфа и др. Рост уровня стареющих клеток в процессе старения, вызывает воспаление, не связанное с каким-то органом организма — воспаление всего организма. Исследование 11 249 пожилых пациентов обнаружило, что высокий уровень воспалительного маркера C-реактивный белок хорошо предсказывает будущую саркопению. - Жировое перерождение клеток спутников из-за жировой инфильтрации мышц (межмышечный жир). Жировое перерождение также происходит из-за воспаления, а также из-за нарушения чувствительности к инсулину (сахарный диабет 1-го типа). Очень часто жир накапливается в мышцах, заменяя их. И получается, что вроде как вес тела человека не меняется, а процент мышц может уменьшаться в пользу жировой ткани. Важно, что и наоборот — снижение мышечной массы в пользу жировой массы вызывает сахарный диабет 2-го типа, даже если общая масса тела не меняется. Человек как бы толстеет за счет жира изнутри (незаметно).

- Малоподвижный образ жизни
- Содержание в рационе питания большого количества углеводов.
- Увеличение с возрастом Фактора роста фибробластов 2-го типа.
- Хронический стресс и связанные с этим заболевания: хроническая сердечная недостаточность, хроническая болезнь почек, раковые опухоли.
Ссылки на исследования:
- http://thorax.bmj.com/content/68/7/625
- www.ncbi.nlm.nih.gov/pubmed/28041587
- www.ncbi.nlm.nih.gov/pubmed/26264581
- www.ncbi.nlm.nih.gov/pubmed/27372291
- www.ncbi.nlm.nih.gov/pubmed/27570755
- www.ncbi.nlm.nih.gov/pubmed/26743210
Эффективность физических нагрузок для противодействия саркопении превышает результаты других изученных наукой лекарств, питания и добавок. Существенно, что увеличение силы и мышечной массы путем тренировок достигалось даже очень пожилыми людьми (старше 90 лет). Однако масштабная реализация профилактики потери мышечной массы в процессе старения невыполнима для многих людей из-за ряда причин:
- отсутствие мотивации к тренировках
- заболевания суставов, не позволяющие полноценно двигаться
- нестабильные сердечно-сосудистые заболевания, которые препятствуют занятиям физическими упражнениями
Для преодоления таких барьеров очень важна разработка альтернативных методов профилактики и лечения саркопении.
Физические упражнения на развитие физической силы и выносливости замедляют и частично обращают вспять потерю мышечной массы в процессе старения.
2009 году Кокрановский обзор, сделаный в британском Университете Квинса в Белфасте (рисунок слева) Джоном Кристи (Christie J) доказал, что в физические упражнения в пожилом возрасте могут улучшить физическую работоспособность (скорость походки), мышечную силу.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/21884490
До сих пор физические тренировки — самый эффективный способ профилактики и борьбы с саркопенией.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/28251287
Особенно эффективно для предупреждения и обращения вспять саркопении — сочетать в рамках 2-4 занятий еженедельно тренировки на развитие мышечной силы, аэробной выносливости (бег трусцой, плавание и др.) и гибкости.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/23748185
Силовые тренировки — самый эффективный вид физической тренировки для терапии саркопении.

Когда вы выполняете упражнения для тренировки мышечной силы, то напряжение в наших мышечных волокнах приводит к росту сигналов к росту и повышению гормона роста. Только это не инъекции гормона роста, чреватые онкологией. Здесь организм сам решает сколько синтезировать гормона. Эти изменения заставляют мышечные клетки расти, создавать новые белки, ремонтировать поврежденные клетки. В результате активизируется деятельность стволовых клеток (клеток спутников) предшественников мышечной ткани.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/25249278
- www.ncbi.nlm.nih.gov/pubmed/20847704
Ученые из Университета Тафтса, США (см. рисунок слева) исследовали 57 взрослых в возрасте 65-94 лет. В результате было выявлено, что выполнение упражнений на развитие силы три раза в неделю увеличивает силу мышц за 12 недель даже в очень глубокой старости.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/18852547
Научный центр здоровья при Техасском университете в Сан — Антонио опубликовал в 2014 году исследование в котором было показано, что особенно полезны упражнения не с тяжелыми отягощениями, а с умеренными. То есть с такими, которые можно поднять не 10 раз, а минимум раз 20. Такими упражнениями полезно заниматься в возрасте после 40 лет. Они приводят к снижению циркулирующего ИФР-1 (инсулин подобного фактора роста 1) в плазме крови, направляя ИФР-1 в мышцы и в гиппокамп. Тем самым значительно (на 30-40%) снижается риск рака, а также риски когнитивных нарушений и саркопении.
То есть с такими, которые можно поднять не 10 раз, а минимум раз 20. Такими упражнениями полезно заниматься в возрасте после 40 лет. Они приводят к снижению циркулирующего ИФР-1 (инсулин подобного фактора роста 1) в плазме крови, направляя ИФР-1 в мышцы и в гиппокамп. Тем самым значительно (на 30-40%) снижается риск рака, а также риски когнитивных нарушений и саркопении.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC3854211
Езда на велосипеде, либо бег трусцой или пешие прогулки до 30-45 минут в день 5 дней в неделю в течение года увеличивают мышечную массу, хоть и нет так эффективно, как тренировка силы
Большинство исследований изучающих воздействие аэробных упражнений для лечения или профилактики саркопении также включают упражнения на развитие мышечной силы. И долго было не ясно смогут ли отдельно только бег трусцой или иные аэробные нагрузки на выносливость увеличивать объем мышечной массы без использования непосредственной тренировки мышечной силы. И вот в 2013 году Центр Исследования Рака Фреда Хатчинсона (США) занялся этим вопросом и показал результат. В этом исследовании 439 женщин в возрасте старше 50 лет выполняли аэробные упражнения (бег трусцой, плавание и др.) 5 дней в неделю в течение года. Сначала они тренировались по 15 минут в день, но постепенно время было увеличено и доведено до 45 минут в день. Это позволило им увеличивать мышечную массу.
И вот в 2013 году Центр Исследования Рака Фреда Хатчинсона (США) занялся этим вопросом и показал результат. В этом исследовании 439 женщин в возрасте старше 50 лет выполняли аэробные упражнения (бег трусцой, плавание и др.) 5 дней в неделю в течение года. Сначала они тренировались по 15 минут в день, но постепенно время было увеличено и доведено до 45 минут в день. Это позволило им увеличивать мышечную массу.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/28181204
- www.ncbi.nlm.nih.gov/pubmed/23190588
Ходьба в сочетании с витамином Д3 также может предотвратить и даже обратить вспять саркопению.
Кто бы не сказал и какие бы исследования не делали вывод, что нет разницы в продолжительности жизни между лежащими на диване и людьми ведущими умеренный активный образ жизни — я лично не верю. И внимательно читаю дизайн таких исследований. В таких исследованиях всегда есть много нюансов, которые не позволяют делать такие выводы. Не можете бегать — хотя бы ходите много. Ходьба также может предотвратить и даже обратить вспять саркопению.
Ходьба также может предотвратить и даже обратить вспять саркопению.
Японские ученые во главе с Ямадой из Университета Цукуба, Токио (Япония) (см. картинку слева) исследовал 227 японских женщин в возрасте 65 лет и старше, которых попросили много ходить в рамках исследования в течение 6 месяцев. Они не просто ходили. Им были предоставлены шагомеры и поставлена задача ежемесячно увеличивать количество шагов в сутки на 10%. Некоторые по желанию использовали утяжелители по 0.5 кг на лодыжки. В итоге было показано увеличение мышечной массы. Думаю плавание будет еще эффективнее, так как задействованы многие мышечные группы. При этом пациенты дополнительно употребляли витамин Д3.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/25858281
Строго не рекомендуется применять для лечения саркопении гормона роста, ИФР-1, а также тестостерона из-за опасных последствий.
Тестостерон повышает смертность от сердечно-сосудистых заболеваний.
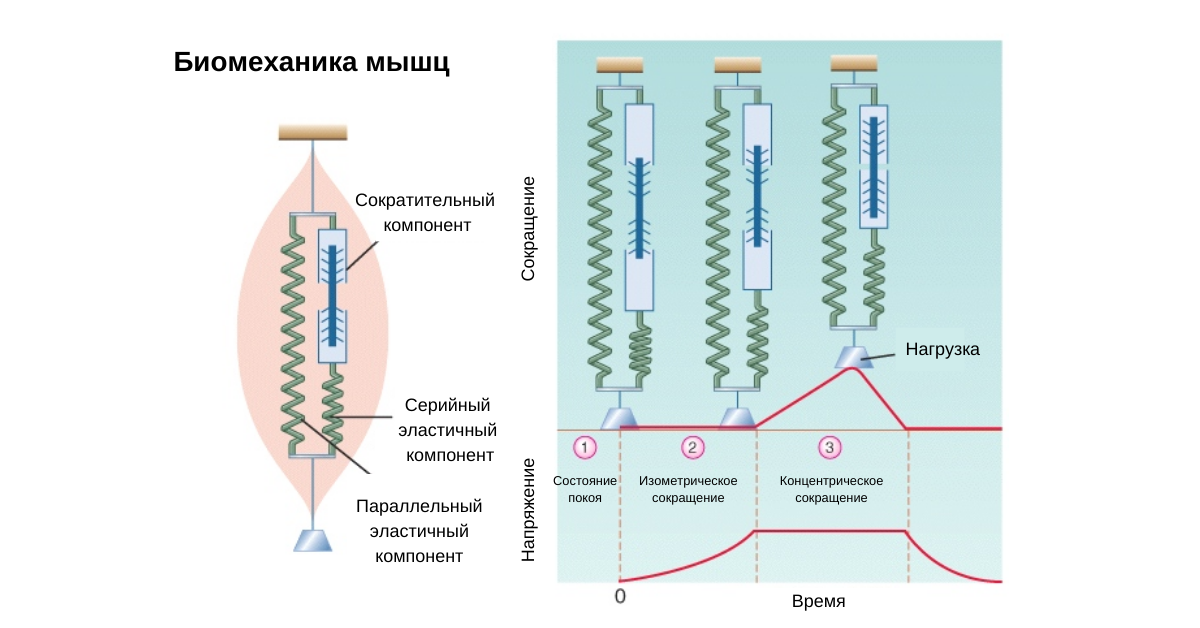
Тестостерон и 5α-дигидротестостерон могут эффективно увеличивать мышечную массу, силу и физическую работоспособность. Что доказано в исследованиях.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/26178029
- www.ncbi.nlm.nih.gov/pubmed/27106402
Однако в настоящее время преимущества лечения саркопении тестостероном без явных показаний не установлено из-за последствий. FDA США рекомендует использовать лечение тестостероном только для мужчин с очень низким уровнем тестостерона с одновременными заболеваниями яичек и гипофиза.
Ссылка на источник:
- http://fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm436280.htm
В результате терапии тестостероном, по данным американских исследователей, значительно повышается риск смертности от инсульта и инфаркта сердца не только у пожилых мужчин, но даже у молодых, если молодые люди уже имеют заболевания сердца и сосудов. У пожилых людей добавки тестостерона повышали смертность на 30%.
Ссылки на источники:
- www.ncbi.nlm.nih.gov/pubmed/24489673
- www.ncbi.nlm.nih.gov/pubmed/24193080
Сейчас идёт разбирательство в пользу того, что заместительная гормональная терапия тестостероном вызывает сердечно-сосудистые повреждения, в том числе тромбоз глубоких вен, легочную эмболию, инсульт и инфаркт.
В 2013 году исследование, опубликованное в журнале американской медицинской Ассоциации JAMA, сообщает «использование терапии тестостероном достоверно связано с повышенным риском неблагоприятных исходов.» Расследования начались после того, как предыдущее клиническое исследование терапии тестостероном у мужчин было остановлено преждевременно «из-за неблагоприятных сердечно-сосудистых событий»
Ссылки на источники:
- http://fda.gov/Drugs/DrugSafety/ucm401746.htm
- www.ncbi.nlm.nih.gov/pubmed/24193080
- http://fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm384225.
 htm
htm
Лечение саркопении у пожилых людей анаболическими стероидами, гормоном роста и инсулин подобным фактором роста (ИФР-1) небезопасны, а эффективность не доказана.
Дегидроэпиандростерон (DHEA, ДГЭА) — полифункциональный стероидный гормон. Исследователи Университета Тойохаши (Япония) показали, что DHEA, гормон роста и ИФР-1 не однозначны в своей эффективности, если применяются в пожилом возрасте. Гормон роста неэффективен из-за того, что он действует через ИФР-1. А у пожилых людей возникает местное сопротивление к ИФР-1 в стареющих мышцах из-за воспаления и других возрастных изменений.
Ссылки на источники:
- www.ncbi.nlm.nih.gov/pubmed/22690213
- www.ncbi.nlm.nih.gov/pubmed/18003794
- www.ncbi.nlm.nih.gov/pubmed/18762207
Применение креатина для лечения саркопении целесообразно только в случае слишком низкого Инсулин Подобного Фактора Роста-1 в анализах крови и только курсами, и не часто
Креатин — азотсодержащая карбоновая кислота. Креатин повышает Инсулин подобный фактор роста 1 типа (ИФР-1) в мышцах, который снижается с возрастом. Но повышение ИФР-1 выше нормы даже в мышцах опасно онкологией мышечной ткани, хотя и риски онкологии намного ниже, чем риски онкологии, когда ИФР-1 повышен в крови. Поэтому креатин целесообразно принимать при низком ИФР-1 в анализах крови и коротким курсом. Креатин синтезируется в организме, но возможен его дефицит — особенно в рационе питания людей, сокращающих мясо. Исследования ученых из Университета Макмастера (Канада — см. рисунок слева) 2014 года исследовало 357 взрослых людей со средним возрастом 64 года. Когда участники исследования принимали креатин, то эффективность их тренировки мышечной массы была выше. Но креатин опасен для людей склонных к повышенному артериальному давлению. У таких людей креатин может еще более повышать давление.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pubmed/24576864
Но сам креатин по себе не тормозит саркопению, вероятно, если используется без упражнений. Его нужно пить по 5 грамма в сутки утром и качаться. Но не более 2-х месяцев подряд. Однако креатин может ускорять рост некоторых видов рака мышечной ткани Например, рак мочевого пузыря.
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC4385953
Также креатин может образовывать гетероциклические амины
- www.ncbi.nlm.nih.gov/pmc/articles/PMC4575580
Креатин играет непосредственную роль в образовании конечных продуктов гликирования (пентозидина). А именно пентозидин, накапливаясь в почках повышает артериальное давление и приводит к старению почек (нефропатия, почечная недостаточность), а также к сахарному диабету и многим другим проблемам. Поэтому использование креатина возможно нечастыми короткими курсами (1-2 месяца), а не систематически.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/12359068
- http://sciencedirect.com/science/article/pii/S0531513102009123
- www.ncbi.nlm.nih.gov/pubmed/12707391
- www.ncbi.nlm.nih.gov/pubmed/15930093
Лечение и профилактика саркопении, подавляя миостатин — белок, который подавляет рост и дифференцировку мышечной ткани
Миостатин принадлежит к семейству трансформирующих факторов роста бета (TGF-beta) и негативно регулирует работу скелетных мышц. Его удаление с помощью генетических вмешательств вызывает избыточный рост мышц, а, наоборот, его избыточная активность приводит к атрофии мышц. Животные с удалением миостатина выглядят, как на картинке слева. Подавление миостатина усиливает регенерацию мышечной ткани при саркопении, увеличивая пролиферацию клеток спутников. Но нужно помнить, что подавители миостатина повышают ИФР-1, и подавление TGF-beta может привести к прогрессии рака, если подавляется чрезмерно.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/15215484
- www.ncbi.nlm.nih.gov/pubmed/9139826
- www.ncbi.nlm.nih.gov/pubmed/17551508
Тестостерон тоже миостатин ингибирует (но у него много опасных побочек)
Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC2817626
Исследование 1993 года, проведенное Национальным Институтом Агрономических Исследований во Франции изучало способность пентоксифиллина предупреждать сокращение мышечной массы у крыс. Как оказалось пентоксифиллин почти полностью подавляет фактор некроза опухоли альфа (ФНО альфа), что важно для лечения саркопении.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/8238342
Исследование 2008 года, проведенное в Университете Торина (Италия) — см. на рисунке слева, показало, что пентоксифиллин способен подавлять миостатин и тем самым лечить саркопению. Больным онкологией крысам вводили пентоксифиллин для подавления миостатина при кахексии. Кахексия — это это крайнее истощение организма, которое характеризуется общей слабостью, резким снижением веса. И их кахексия частично отменялась. Пентоксифиллин используется для лечения нарушений периферического кровообращения у людей не старше 70 лет. Пентоксифиллин в российских аптеках продается под торговым названием Трентал®. Так, что если врач вам назначил Трентал®, то заодно и мышечную массу полечите. Но не занимайтесь самолечением.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/18578694
Исследование 2007 года, проведенное в Копенгагенском Университете (Дания) — см. картинку слева, изучало влияние курения сигарет на синтез белка в мышцах. Оказалось, что курение в возрасте около 60-63 лет увеличивает экспрессию миостатина в мышцах. В итоге курение нарушает процесс синтеза мышечного белка и, вероятно, повышает риск развития саркопении.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/17609255
Исследование 2011 года, проведенное в Университете Джона Хопкинса в США, показало, что лекарства от артериального давления группы сартанов (особенно телмисартан и лозартан) подавляют миостатин у мышей и защищают от саркопении.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/21562229
Гормон Ангиотензин II вызывает саркопению, а ингибирование ангиотензина, либо его рецепторов — перспективный метод лечения саркопении.
Ангиотензин II — это гормон, благодаря которому повышается артериальное давление. С возрастом уровень Ангиотензина II у многих людей растет, и прогрессирует саркопения вместе с повышением артериального давления. Это происходит потому, что Ангиотензин II, как показали исследования, вызывает саркопению, активизируя миостатин — белок, который подавляет рост и дифференцировку мышечной ткани. И напротив, блокада рецепторов ангиотензина II (AT1 рецепторов) или синтез Ангиотензина II, предотвращает потерю мышечной массы и является перспективным методом лечения саркопении.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/21570954
- www.ncbi.nlm.nih.gov/pubmed/21747283
- www.ncbi.nlm.nih.gov/pubmed/23769949
Ангиотензин II снижает уровень ИФР1, что может быть связано как с прямым подавлением экспрессии гена через рецепторы ангиотензина II на клетках печени, так и с косвенными эффектами (через действие на глюкокортикоиды или уровень цитокина Фактора Некроза Опухоли альфа). С другой стороны, под действием ингибиторов ангиотензин-превращающего фермента иАПФ (эналаприл, рамиприл и др.) и блокаторов рецепторов ангиотензина БРА (телмисартан, лозартан и др.) возрастает до нормального уровень ИФР-1 в сыворотке крови. Количество доказательств в пользу применения иАПФ и БРА растет.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/11250929
- www.ncbi.nlm.nih.gov/pubmed/16679098
- www.ncbi.nlm.nih.gov/pubmed/18615230
- www.ncbi.nlm.nih.gov/pubmed/16339331
- www.ncbi.nlm.nih.gov/pubmed/11918911
- www.ncbi.nlm.nih.gov/pubmed/9788828
Агонисты PPARγ предупреждают саркопению через регулирование метаболизма глюкозы
Активация PPARγ-рецепторов (Peroxisome proliferator-activated receptor gamma) позволяет повышать чувствительность к инсулину — гормону, который регулирует уровень глюкозы в крови, что способствует уменьшению межмышечного жира. А межмышечный жир — одна из причин снижения мышечной массы. Агонисты PPARγ-рецепторов являются перспективными средствами для лечения саркопении.
Ссылка на источник:
- https://it.wikipedia.org/wiki/PPAR-γ
Телмисартан — одно из лекарств группы сартанов, которое кроме снижения артериального давления обладает дополнительным свойством — агонизм к PPARγ-рецепторам. Из всех сартанов телмисартан — самый мощный активатор PPAR- γ — сильнее лозартана примерно в 20 раз. У мышей дикого типа, при длительном приеме телмисартана наблюдается повышение выносливости в беге, снижение жировых отложений и увеличение доли мышечных волокон Типа I. Волокна I типа богаты митохондриями и являются устойчивыми к усталости. Именно из-за этих их свойств было предложение с 2016 года внести телмисартан в список допинговых средств для спортсменов. Поэтому людям с повышенным артериальным давлением для защиты от саркопении, телмисартан — это препарат выбора.
Ссылка(и) на исследование(я):
- http://onlinelibrary.wiley.com/doi/10.1111/j.1582-4934.2010.01085.x/full
- it.wikipedia.org/wiki/PPAR-γ
Исследование 2008 года, проведенное в Университете Флориды в США, изучает влияние низкокалорийной диеты на метаболизм глюкозы и связанную с этим защиту от саркопении. Предварительные наблюдения показали, что небольшое (до 8%) снижение потребления пищи может оказать защитный эффект против старческой саркопении. А это значит, что нужно взять за привычку выходить из-за стола с легким чувством голода.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/18191752
- www.ncbi.nlm.nih.gov/pubmed/16677097
Фенофибрат — это лекарство для лечения повышенного холестерина в крови. Фенофибрат активизирует рецепторы, активируемые пероксисомным пролифератором альфа (PPAR альфа). В связи с этим ученые Аньхойского Университета в Китае изучали фенофибрат с точки зрения влияния на старение мышц. Исследование было опубликовано в 2016 году и показало, что фенофибрат уменьшает воспаление в скелетных мышцах и тем самым защищает их от саркопении. Исследование 2016 года, проведенное Норвежским Университетом Науки и Технологии, показало, что фенофибрат защищает мышцы от старения в период менопаузы — при дефиците эстрогенов у самок крыс. Крыс лечили фенофибратом 8 недель. После лечения крысы выше прыгали, чем до лечения. Стоит заметить, что людям для снижения холестерина назначают статины, которые наоборот ухудшают состояние мышечной массы. И если у человека нужно и холестерин снижать и саркопению лечить, то фенофибрат использовать предпочтительнее. Но нельзя сочетать фенофибрат со статинами одновременно — это опасно. Фенофибрат нельзя употреблять людям с повышенным креатинином в анализах крови или со сниженной скорость клубочковой фильтрации. И естественно нельзя применять без назначения врача.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/27297630
- www.ncbi.nlm.nih.gov/pubmed/27526032
Метформин — лекарство для лечения сахарного диабета 2-го типа, также является агонистом PPAR-гамма рецепторов. Исследование на людях 2014 года, проведенное Научным Центром Здоровья при Техасском Университете (см. рисунок слева) в Сан — Антонио (США) показало, что основной эффект снижения смертности метформином объясняется снижением риска наступления старческой немощности из-за сокращения мышечной массы и других причин немощности. Исследователи изучали 2415 пациентов больных сахарным диабетом 2-го типа в возрасте от 65 до 89 лет в период с 1999 по 2006 годы. Рассматривались пациенты, которым для лечения сахарного диабета назначали только метформин (без иных сахароснижающих препаратов) и не менее 180 дней. Также исключались пациенты с болезнями почек, печени, с онкологией. Оказалось, что снижение смертности на 23% у принимающих метформин было связано именно с предупреждением наступления немощности. Так людям, у которых уже была немощность на момент назначения метформина, это лекарство смертность не сокращало. А значит, что продление жизни метформином было связано в основном с профилактикой развития немощности.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/27978584
- www.ncbi.nlm.nih.gov/pubmed/25506599
После таких многообещающих результатов от применения метформина было инициировано клиническое испытания метформина с целью предупреждения сокращения мышечной массы у больных сахарным диабетом. Клиническое испытание проводится Университетом Кентукки в США (см. рисунок слева). Дело в том, что у ряда больных сахарным диабетом в преклонном возрасте тренировки мышечной массы не дают результата, а даже иногда наоборот, размер мышечной массы сокращается. Но была выдвинута гипотеза, что метформин может заблокировать нечувствительность мышц к тренировкам у ряда больных сахарным диабетом. Возрастным пациентам дают 1700 мг метформина в сутки или плацебо. Одновременно пациенты тренируются на тренажерах. По задумке ученых метформин должен повысить эффективность тренировок. Результаты будут готовы в 2017-2018 годах.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/28441958
Исследование 2016 года, проведенное Католическим Университетом Святого Сердца в Италии, изучало влияние кетогенной диеты с добавками аминокислот в клиническом испытании с точки зрения влияния на саркопению. Кетогенная диета с аминокислотами была высокоэффективна для похудения, но без потери мышечной массы.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/27383313
Да. Всем кто применяет кетогенную диету обязательно нужно пить БЦАА аминокислоты, (которые можно купить в спортивном магазине, либо заказать здесь) для того, чтобы на кетогенной диете не было саркопении, а наоборот мышцы лучше были.
Подавление воспаления в мышцах предупреждает саркопению
Исследование 2002 года, проведенное Университетским Медицинским Центром в Нидерландах, изучало витамин Д3 с точки зрения влияния дефицита витамина Д в крови на мышечную массу. При дефиците витамина Д в крови возникает мышечная атрофия (преимущественно в волокнах II типа) из-за воспаления.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/11916748
Исследование 2008 года, проведенное Университетом Саутгемптона (Великобритания) показало, изучая 2983 пациентов в возрасте от 59 до 73 лет, что употребление в пищу жирной рыбы (или рыбного жира) может быть существенным фактором для восстановления силы скелетных мышц за счет модулирования воспаления. Аналогичные результаты были показаны в в 2012 году в рандомизированном контролируемом исследовании, проведенном Федеральным Университетом штата Парана (Бразилия), а также в исследовании 2015 года, проведенном Университетом Макмастера в Канаде.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/9467429
- www.ncbi.nlm.nih.gov/pubmed/18005355
- www.ncbi.nlm.nih.gov/pubmed/21159787
- www.ncbi.nlm.nih.gov/pubmed/21501117
- www.ncbi.nlm.nih.gov/pubmed/22218156
- www.ncbi.nlm.nih.gov/pmc/articles/PMC4496741
Иные способы профилактики саркопении
HMB (β-гидрокси-β-метилбутират)– это метаболит аминокислоты лейцина. В основном это значит, что наш организм производит HMB из лейцина. Помимо воздействия на сигнальные элементы роста мышц, HMB также снижает активность процесса распада белка в мышцах. Исследование 2016 года, проведенное Университетом Монпелье во Франции, изучало β-гидрокси-β-метилбутират (HMB) и его роль для уменьшения межмышечной жировой ткани с целью предупреждения атрофии мышц. Как видно на графике слева, употребление HMB от 1,5 до 3 грамм в сутки на протяжении 4 недель повышает объем мышечной массы. Но после 4 недель этот эффект начинает снижаться — имеет смысл применять HMB не более 4 недель, а потом делать перерыв на 1 месяц. Исследования 2015 года, проведенные Тяньцзиньским Университетом в Китае и Университетом Макмастера в Канаде, также показали эффективность добавок β-гидрокси-β-метилбутирата (HMB) для лечения саркопении у людей в возрасте от 65 лет и старше. Но учитывая, что β-гидрокси-β-метилбутират (HMB) активизирует mTOR и подавляет аутофагию, то применять эту добавку имеет смысл курсами, а не постоянно.
Ссылка(и) на исследование(я):
- www.ncbi.nlm.nih.gov/pubmed/27106402
- www.ncbi.nlm.nih.gov/pubmed/26169182
- www.ncbi.nlm.nih.gov/pubmed/26178029
Гидроксиметилбутират (HMB) можно приобрести в спортивных магазинах, либо заказать в интернете — ссылка Now Foods, Спортивное питание, гидроксиметилбутират в форме порошка, 3,2 унции (90 г).
Выводы:
- Саркопения — это потеря скелетной мышечной массы — в том числе из-за старения.
- Саркопения сокращает продолжительность жизни.
- Силовые тренировки — самый эффективный вид физической тренировки для терапии саркопении.
- Строго не рекомендуется применять для лечения саркопении гормон роста, ИФР-1, а также тестостерон из-за опасных последствий.
- Применение креатина для лечения саркопении целесообразно только в случае слишком низкого Инсулин Подобного Фактора Роста-1 в анализах крови и только короткими нечастыми курсами.
- Лечить саркопению помогает ряд лекарств и добавок: пентоксифиллин, эналаприл, рамиприл, телмисартан, фенофибрат, метформин, витамин Д3, рыбный жир, β-гидрокси-β-метилбутират (HMB)
- Курение увеличивает экспрессию миостатина в мышцах и стимулирует саркопению.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
Уважаемые читатели ресурса www.nestarenie.ru. Если Вы думаете, что статьи настоящего ресурса полезны для Вас, и желаете, чтобы этой информацией могли пользоваться и другие люди многие годы, то имеет возможность помочь в развитии этого сайта, потратив на это около 2-х минут Вашего времени. Для этого кликните по этой ссылке.
Рекомендуем ещё почитать следующие статьи:
- Метформин — самое изученное и надёжное лекарство от старости.
- Подробная программа продления жизни научно доказанными способами.
- Витамин K2 (МК-7) сокращает смертность
- Витамин B6+магний снижают смертность на 34%
- Глюкозамин Сульфат эффективно продлевает жизнь и защищает от многих видов рака
- Фолаты для предупреждения раннего старения
- Как победить метилглиоксаль — вещество, которое нас старит.
Какие состояния могут вызвать мышечное истощение?
Мышечное истощение — это потеря мышечной массы из-за ослабления и сокращения мышц. Существует несколько возможных причин истощения мышц, включая определенные заболевания, такие как боковой амиотрофический склероз.
Симптомы мышечной атрофии зависят от степени потери мышечной массы, но типичные признаки и симптомы включают:
- снижение мышечной силы
- нарушение способности выполнять физические нагрузки
- уменьшение размера мышц
Диагностика обычно возникает после изучения истории болезни и физического осмотра.Причина истощения мышц иногда очевидна. В других случаях врачу может потребоваться провести дополнительные тесты для подтверждения диагноза.
Медицинские состояния, которые могут вызвать мышечное истощение, включают следующие:
Боковой амиотрофический склероз (БАС) — прогрессирующее заболевание, поражающее нервные клетки по всему телу.
Обычно нервные клетки в головном и спинном мозге посылают мышцам сигнал о движении.
У людей с БАС нервные клетки, контролирующие произвольные движения, умирают и перестают посылать сигналы, разрешающие движение.В конце концов, из-за отсутствия использования мышцы атрофируются.
Врачи не знают, что вызывает БАС.
Узнайте больше о ALS здесь.
Рассеянный склероз (РС) — это тип аутоиммунного заболевания, которое поражает миелин, окружающий нервные волокна.
Состояние вызывает повреждение нервов, которое, в свою очередь, влияет на мышцы. Поврежденные нервы теряют способность запускать мышечные движения, что приводит к атрофии.
Степень повреждения влияет на скорость потери мышечной массы.
Узнайте больше о рассеянном склерозе здесь.
Спинальная мышечная атрофия — это состояние, похожее на мышечную дистрофию.
Заболевание является генетическим и возникает из-за потери двигательных нейронов, которые являются клетками, контролирующими мышцы. Мышцы тела постепенно ослабевают.
Хотя спинальная мышечная атрофия ослабляет большинство мышц тела, обычно наиболее сильно поражаются мышцы, расположенные ближе к центру тела.
Узнайте больше о мышечной атрофии позвоночника здесь.
Некоторые другие причины мышечного истощения, которые сами по себе не являются заболеваниями, включают:
Длительное бездействие
Продолжительное бездействие, например постельный режим, может привести к потере мышечной массы. Постельный режим может быть необходим из-за травм или болезней, из-за которых человек не может двигаться.
Согласно исследованиям, мышечное истощение может развиться в течение 10 дней у здоровых пожилых людей, находящихся в постельном режиме. Из-за истощения мышц в течение первой недели может произойти снижение мышечной силы на 40%.
Недоедание
Люди с недоеданием получают значительно неадекватное питание, и это может вызвать потерю мышечной массы, что приведет к истощению мышц.
Недоедание имеет множество возможных причин, включая нервную анорексию, рак и стойкую тошноту.
Старение
Потеря мышечной массы происходит постепенно из-за старения.
Авторы исследования 2013 года отметили, что значительные изменения мышечной массы ног происходят после 50 лет, когда потеря мышечной массы составляет 1-2% в год.
Они также отметили исследования, показывающие, что в возрасте от 20 до 80 лет средний человек теряет 35-40% мышечной массы ног.
Лечение мышечной атрофии жизненно важно для общего благополучия человека.
Мышечная атрофия возникает при многих заболеваниях. Согласно исследованию, проведенному в 2017 году, истощение мышц способствует худшему прогнозу при таких заболеваниях, как сердечная недостаточность, сепсис и рак.
Лечение может частично зависеть от основного состояния, приводящего к потере мышечной массы.В некоторых случаях лечение болезни может предотвратить дальнейшее истощение мышц и помочь изменить состояние.
Дополнительные варианты лечения могут включать:
Упражнения
Упражнения для наращивания силы — один из основных способов предотвращения и лечения мышечной атрофии. Вид деятельности, которую рекомендуют врачи, будет зависеть от причины атрофии. Например, определенные основные условия могут ограничивать выполнение определенных упражнений.
Сфокусированная ультразвуковая терапия
Сфокусированная ультразвуковая терапия — это относительно новый метод лечения мышечной атрофии.Он включает в себя направление лучей высокочастотных звуковых волн на определенные участки тела. Звуковые волны стимулируют сокращение мышц, что может помочь уменьшить их потерю.
Диетотерапия
Правильное питание помогает телу наращивать и сохранять мышцы. Принятие диеты, обеспечивающей достаточное количество калорий, белка и других питательных веществ, способствующих развитию мышц, может помочь в лечении мышечного истощения.
Физиотерапия
Физическая терапия может включать в себя различные методы предотвращения мышечного истощения.Терапевты могут порекомендовать определенные упражнения в зависимости от состояния человека.
Физиотерапия также полезна, если человек находится в постельном режиме. Терапевты могут выполнять пассивные упражнения, если человек не может двигаться. В этом типе упражнений терапевт двигает руками и ногами для тренировки мышц.
Мышечная атрофия включает потерю или атрофию мышц и обычно происходит постепенно. Это может произойти из-за множества состояний, включая БАС, мышечную дистрофию и рассеянный склероз.
Поскольку истощение мышц может повлиять на силу человека и его способность выполнять повседневную деятельность, оно может значительно снизить качество его жизни.
Как можно скорее лечить это заболевание, чтобы предотвратить или замедлить значительную потерю мышечной массы. Любой, кто думает, что у него может быть мышечное истощение, должен обратиться к врачу.
В некоторых случаях можно обратить вспять мышечное истощение, но это может занять время. Когда мышечная атрофия необратима, лечение может, по крайней мере, замедлить ее.Лечение может включать в себя сочетание упражнений, изменений в питании и физиотерапии.
Мышечная атрофия: причины, симптомы и лечение
Термин «мышечная атрофия» относится к потере мышечной ткани. Атрофированные мышцы кажутся меньше нормальных. Отсутствие физической активности из-за травмы или болезни, плохого питания, генетики и определенных заболеваний может способствовать атрофии мышц.
Атрофия мышц может возникнуть после длительного бездействия. Если мышца не получает никакой пользы, тело в конечном итоге разрушает ее, чтобы сохранить энергию.
Атрофия мышц, развивающаяся из-за бездействия, может возникнуть, если человек остается неподвижным, пока он выздоравливает после болезни или травмы. Регулярные упражнения и физиотерапия могут обратить вспять эту форму мышечной атрофии.
Люди могут лечить мышечную атрофию, изменив образ жизни, попробовав физиотерапию или сделав операцию.
В этой статье мы рассмотрим некоторые другие причины, симптомы и методы лечения атрофии мышц.
Многие факторы могут вызвать атрофию мышц, в том числе:
Плохое питание
Плохое питание может вызвать множество заболеваний, включая атрофию мышц.
В частности, Международный фонд остеопороза предупреждает, что диета с низким содержанием постного белка, фруктов и овощей может привести к снижению мышечной массы.
Атрофия мышц, связанная с неправильным питанием, может развиться в результате заболеваний, которые ухудшают способность организма усваивать питательные вещества, например:
Кахексия — это сложное метаболическое состояние, которое вызывает сильную потерю веса и атрофию мышц. Кахексия может развиваться как симптом другого основного заболевания, такого как рак, ВИЧ или рассеянный склероз (РС).
Люди с кахексией могут испытывать значительную потерю аппетита или непреднамеренную потерю веса, несмотря на потребление большого количества калорий.
Возраст
С возрастом в организме человека вырабатывается меньше белков, способствующих росту мышц. Это сокращение доступного белка вызывает сокращение мышечных клеток, что приводит к состоянию, называемому саркопенией.
Согласно отчету Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), саркопения поражает до трети людей в возрасте 60 лет и старше.
Помимо снижения мышечной массы, саркопения может вызывать следующие симптомы:
- слабость или хрупкость
- плохой баланс
- трудности с движением
- снижение выносливости
Потеря мышечной массы может быть неизбежным результатом естественного процесс старения. Однако это может увеличить риск травм и негативно повлиять на общее качество жизни человека.
Генетика
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое вызывает потерю двигательных нервных клеток и мышечную атрофию.
Существует несколько различных типов SMA, которые попадают в следующие категории:
- SMA, связанная с хромосомой 5 : Эти типы SMA возникают из-за мутации в генах SMN1 на хромосоме 5. Мутации приводят к дефицит белка выживания мотонейрона. СМА обычно развивается в детстве, но может развиться в любой момент жизни.
- SMA, не связанная с хромосомой 5
Мышечная дистрофия относится к группе прогрессирующих состояний, которые вызывают потерю мышечной массы и слабость.
Мышечная дистрофия возникает, когда один из генов, участвующих в производстве белка, мутирует. Человек может унаследовать генетические мутации, но многие из них возникают естественным образом по мере развития эмбриона.
Медицинские условия
Поделиться на PinterestАтрофированные мышцы меньше здоровых.Изображение предоставлено: OpenStax, 2016.
Заболевания и хронические состояния, которые могут способствовать атрофии мышц, включают:
- Боковой амиотрофический склероз (БАС) : БАС, также называемый болезнью Лу Герига, включает несколько типов, которые повреждают двигательные нервные клетки, которые повреждают двигательные нервные клетки. контролировать мышцы.
- MS : Это хроническое заболевание возникает, когда иммунная система организма атакует центральную нервную систему, вызывая опасное воспаление нервных волокон.
- Артрит : Артрит относится к воспалению суставов, которое вызывает боль и скованность. Артрит может серьезно ограничить подвижность человека, что может привести к неиспользованию мышц и атрофии.
- Миозит : Термин миозит относится к воспалению мышц. Это состояние вызывает мышечную слабость и боль.У людей может развиться миозит после вирусной инфекции или как побочный эффект аутоиммунного заболевания.
- Полиомиелит : Это инфекционное заболевание поражает нервную систему. Это вызывает симптомы гриппа и может привести к необратимому параличу.
Неврологические проблемы
Травма или состояние могут повредить нервы, контролирующие мышцы, что приведет к состоянию, которое называется нейрогенной мышечной атрофией.
Когда это развивается, мышцы перестают сокращаться, потому что они больше не получают сигналы от нерва.
Симптомы мышечной атрофии сильно различаются в зависимости от причины и степени потери мышечной массы.
Помимо снижения мышечной массы, симптомы мышечной атрофии включают:
- , когда одна рука или нога заметно меньше других
- испытывает слабость в одной конечности или обычно
- испытывает трудности с равновесием
- остается неактивным в течение длительный период
Методы лечения атрофии мышц различаются в зависимости от степени потери мышц и наличия каких-либо сопутствующих заболеваний.
Лечение основного состояния, вызывающего мышечную атрофию, может помочь замедлить прогрессирование потери мышечной массы.
К лечению атрофии мышц относятся:
Физическая терапия
Поделиться на Pinterest Физическая терапия может помочь улучшить подвижность людей с атрофией мышц.Физическая терапия включает выполнение определенных упражнений на растяжку и упражнения с целью предотвращения неподвижности. Физическая терапия предлагает следующие преимущества людям с атрофией мышц:
- предотвращение неподвижности
- увеличение мышечной силы
- улучшение кровообращения
- уменьшение спастичности, которая вызывает непрерывное сокращение мышц
Функциональная электрическая стимуляция
Функциональная электрическая стимуляция (FES ) — еще одно эффективное средство от мышечной атрофии.Он включает использование электрических импульсов для стимуляции сокращения пораженных мышц.
Во время FES обученный техник прикрепляет электроды к атрофированной конечности. Электроды пропускают электрический ток, который вызывает движение конечности.
Сфокусированная ультразвуковая терапия
Этот метод доставляет лучи ультразвуковой энергии к определенным участкам тела. Лучи стимулируют сокращение атрофированной мышечной ткани.
Эта новая технология находится в стадии разработки и еще не вошла в стадию клинических испытаний.
Хирургия
Хирургические процедуры могут улучшить функцию мышц у людей, атрофия которых связана с неврологическими заболеваниями, травмами или недоеданием.
Атрофия мышц, или истощение мышц, характеризуется значительным укорочением мышечных волокон и потерей общей мышечной массы.
Несколько факторов могут способствовать атрофии мышц, например:
- длительное пребывание в неподвижности из-за болезни или травмы
- возраст
- недоедание
- генетика
- неврологические проблемы
- определенные заболевания, такие как артрит, миозит , ALS и MS
Варианты лечения будут зависеть от каждого отдельного случая, но они могут включать физиотерапию, диетическое вмешательство или хирургическое вмешательство.
Мышечная атрофия: причины, симптомы и лечение
Термин «мышечная атрофия» относится к потере мышечной ткани. Атрофированные мышцы кажутся меньше нормальных. Отсутствие физической активности из-за травмы или болезни, плохого питания, генетики и определенных заболеваний может способствовать атрофии мышц.
Атрофия мышц может возникнуть после длительного бездействия. Если мышца не получает никакой пользы, тело в конечном итоге разрушает ее, чтобы сохранить энергию.
Атрофия мышц, развивающаяся из-за бездействия, может возникнуть, если человек остается неподвижным, пока он выздоравливает после болезни или травмы.Регулярные упражнения и физиотерапия могут обратить вспять эту форму мышечной атрофии.
Люди могут лечить мышечную атрофию, изменив образ жизни, попробовав физиотерапию или сделав операцию.
В этой статье мы рассмотрим некоторые другие причины, симптомы и методы лечения атрофии мышц.
Многие факторы могут вызвать атрофию мышц, в том числе:
Плохое питание
Плохое питание может вызвать множество заболеваний, включая атрофию мышц.
В частности, Международный фонд остеопороза предупреждает, что диета с низким содержанием постного белка, фруктов и овощей может привести к снижению мышечной массы.
Атрофия мышц, связанная с неправильным питанием, может развиться в результате заболеваний, которые ухудшают способность организма усваивать питательные вещества, например:
Кахексия — это сложное метаболическое состояние, которое вызывает сильную потерю веса и атрофию мышц. Кахексия может развиваться как симптом другого основного заболевания, такого как рак, ВИЧ или рассеянный склероз (РС).
Люди с кахексией могут испытывать значительную потерю аппетита или непреднамеренную потерю веса, несмотря на потребление большого количества калорий.
Возраст
С возрастом в организме человека вырабатывается меньше белков, способствующих росту мышц. Это сокращение доступного белка вызывает сокращение мышечных клеток, что приводит к состоянию, называемому саркопенией.
Согласно отчету Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), саркопения поражает до трети людей в возрасте 60 лет и старше.
Помимо снижения мышечной массы, саркопения может вызывать следующие симптомы:
- слабость или хрупкость
- плохой баланс
- трудности с движением
- снижение выносливости
Потеря мышечной массы может быть неизбежным результатом естественного процесс старения. Однако это может увеличить риск травм и негативно повлиять на общее качество жизни человека.
Генетика
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое вызывает потерю двигательных нервных клеток и мышечную атрофию.
Существует несколько различных типов SMA, которые попадают в следующие категории:
- SMA, связанная с хромосомой 5 : Эти типы SMA возникают из-за мутации в генах SMN1 на хромосоме 5. Мутации приводят к дефицит белка выживания мотонейрона. СМА обычно развивается в детстве, но может развиться в любой момент жизни.
- SMA, не связанная с хромосомой 5
Мышечная дистрофия относится к группе прогрессирующих состояний, которые вызывают потерю мышечной массы и слабость.
Мышечная дистрофия возникает, когда один из генов, участвующих в производстве белка, мутирует. Человек может унаследовать генетические мутации, но многие из них возникают естественным образом по мере развития эмбриона.
Медицинские условия
Поделиться на PinterestАтрофированные мышцы меньше здоровых.Изображение предоставлено: OpenStax, 2016.
Заболевания и хронические состояния, которые могут способствовать атрофии мышц, включают:
- Боковой амиотрофический склероз (БАС) : БАС, также называемый болезнью Лу Герига, включает несколько типов, которые повреждают двигательные нервные клетки, которые повреждают двигательные нервные клетки. контролировать мышцы.
- MS : Это хроническое заболевание возникает, когда иммунная система организма атакует центральную нервную систему, вызывая опасное воспаление нервных волокон.
- Артрит : Артрит относится к воспалению суставов, которое вызывает боль и скованность. Артрит может серьезно ограничить подвижность человека, что может привести к неиспользованию мышц и атрофии.
- Миозит : Термин миозит относится к воспалению мышц. Это состояние вызывает мышечную слабость и боль.У людей может развиться миозит после вирусной инфекции или как побочный эффект аутоиммунного заболевания.
- Полиомиелит : Это инфекционное заболевание поражает нервную систему. Это вызывает симптомы гриппа и может привести к необратимому параличу.
Неврологические проблемы
Травма или состояние могут повредить нервы, контролирующие мышцы, что приведет к состоянию, которое называется нейрогенной мышечной атрофией.
Когда это развивается, мышцы перестают сокращаться, потому что они больше не получают сигналы от нерва.
Симптомы мышечной атрофии сильно различаются в зависимости от причины и степени потери мышечной массы.
Помимо снижения мышечной массы, симптомы мышечной атрофии включают:
- , когда одна рука или нога заметно меньше других
- испытывает слабость в одной конечности или обычно
- испытывает трудности с равновесием
- остается неактивным в течение длительный период
Методы лечения атрофии мышц различаются в зависимости от степени потери мышц и наличия каких-либо сопутствующих заболеваний.
Лечение основного состояния, вызывающего мышечную атрофию, может помочь замедлить прогрессирование потери мышечной массы.
К лечению атрофии мышц относятся:
Физическая терапия
Поделиться на Pinterest Физическая терапия может помочь улучшить подвижность людей с атрофией мышц.Физическая терапия включает выполнение определенных упражнений на растяжку и упражнения с целью предотвращения неподвижности. Физическая терапия предлагает следующие преимущества людям с атрофией мышц:
- предотвращение неподвижности
- увеличение мышечной силы
- улучшение кровообращения
- уменьшение спастичности, которая вызывает непрерывное сокращение мышц
Функциональная электрическая стимуляция
Функциональная электрическая стимуляция (FES ) — еще одно эффективное средство от мышечной атрофии.Он включает использование электрических импульсов для стимуляции сокращения пораженных мышц.
Во время FES обученный техник прикрепляет электроды к атрофированной конечности. Электроды пропускают электрический ток, который вызывает движение конечности.
Сфокусированная ультразвуковая терапия
Этот метод доставляет лучи ультразвуковой энергии к определенным участкам тела. Лучи стимулируют сокращение атрофированной мышечной ткани.
Эта новая технология находится в стадии разработки и еще не вошла в стадию клинических испытаний.
Хирургия
Хирургические процедуры могут улучшить функцию мышц у людей, атрофия которых связана с неврологическими заболеваниями, травмами или недоеданием.
Атрофия мышц, или истощение мышц, характеризуется значительным укорочением мышечных волокон и потерей общей мышечной массы.
Несколько факторов могут способствовать атрофии мышц, например:
- длительное пребывание в неподвижности из-за болезни или травмы
- возраст
- недоедание
- генетика
- неврологические проблемы
- определенные заболевания, такие как артрит, миозит , ALS и MS
Варианты лечения будут зависеть от каждого отдельного случая, но они могут включать физиотерапию, диетическое вмешательство или хирургическое вмешательство.
Мышечная атрофия: причины, симптомы и лечение
Термин «мышечная атрофия» относится к потере мышечной ткани. Атрофированные мышцы кажутся меньше нормальных. Отсутствие физической активности из-за травмы или болезни, плохого питания, генетики и определенных заболеваний может способствовать атрофии мышц.
Атрофия мышц может возникнуть после длительного бездействия. Если мышца не получает никакой пользы, тело в конечном итоге разрушает ее, чтобы сохранить энергию.
Атрофия мышц, развивающаяся из-за бездействия, может возникнуть, если человек остается неподвижным, пока он выздоравливает после болезни или травмы.Регулярные упражнения и физиотерапия могут обратить вспять эту форму мышечной атрофии.
Люди могут лечить мышечную атрофию, изменив образ жизни, попробовав физиотерапию или сделав операцию.
В этой статье мы рассмотрим некоторые другие причины, симптомы и методы лечения атрофии мышц.
Многие факторы могут вызвать атрофию мышц, в том числе:
Плохое питание
Плохое питание может вызвать множество заболеваний, включая атрофию мышц.
В частности, Международный фонд остеопороза предупреждает, что диета с низким содержанием постного белка, фруктов и овощей может привести к снижению мышечной массы.
Атрофия мышц, связанная с неправильным питанием, может развиться в результате заболеваний, которые ухудшают способность организма усваивать питательные вещества, например:
Кахексия — это сложное метаболическое состояние, которое вызывает сильную потерю веса и атрофию мышц. Кахексия может развиваться как симптом другого основного заболевания, такого как рак, ВИЧ или рассеянный склероз (РС).
Люди с кахексией могут испытывать значительную потерю аппетита или непреднамеренную потерю веса, несмотря на потребление большого количества калорий.
Возраст
С возрастом в организме человека вырабатывается меньше белков, способствующих росту мышц. Это сокращение доступного белка вызывает сокращение мышечных клеток, что приводит к состоянию, называемому саркопенией.
Согласно отчету Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), саркопения поражает до трети людей в возрасте 60 лет и старше.
Помимо снижения мышечной массы, саркопения может вызывать следующие симптомы:
- слабость или хрупкость
- плохой баланс
- трудности с движением
- снижение выносливости
Потеря мышечной массы может быть неизбежным результатом естественного процесс старения. Однако это может увеличить риск травм и негативно повлиять на общее качество жизни человека.
Генетика
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое вызывает потерю двигательных нервных клеток и мышечную атрофию.
Существует несколько различных типов SMA, которые попадают в следующие категории:
- SMA, связанная с хромосомой 5 : Эти типы SMA возникают из-за мутации в генах SMN1 на хромосоме 5. Мутации приводят к дефицит белка выживания мотонейрона. СМА обычно развивается в детстве, но может развиться в любой момент жизни.
- SMA, не связанная с хромосомой 5
Мышечная дистрофия относится к группе прогрессирующих состояний, которые вызывают потерю мышечной массы и слабость.
Мышечная дистрофия возникает, когда один из генов, участвующих в производстве белка, мутирует. Человек может унаследовать генетические мутации, но многие из них возникают естественным образом по мере развития эмбриона.
Медицинские условия
Поделиться на PinterestАтрофированные мышцы меньше здоровых.Изображение предоставлено: OpenStax, 2016.
Заболевания и хронические состояния, которые могут способствовать атрофии мышц, включают:
- Боковой амиотрофический склероз (БАС) : БАС, также называемый болезнью Лу Герига, включает несколько типов, которые повреждают двигательные нервные клетки, которые повреждают двигательные нервные клетки. контролировать мышцы.
- MS : Это хроническое заболевание возникает, когда иммунная система организма атакует центральную нервную систему, вызывая опасное воспаление нервных волокон.
- Артрит : Артрит относится к воспалению суставов, которое вызывает боль и скованность. Артрит может серьезно ограничить подвижность человека, что может привести к неиспользованию мышц и атрофии.
- Миозит : Термин миозит относится к воспалению мышц. Это состояние вызывает мышечную слабость и боль.У людей может развиться миозит после вирусной инфекции или как побочный эффект аутоиммунного заболевания.
- Полиомиелит : Это инфекционное заболевание поражает нервную систему. Это вызывает симптомы гриппа и может привести к необратимому параличу.
Неврологические проблемы
Травма или состояние могут повредить нервы, контролирующие мышцы, что приведет к состоянию, которое называется нейрогенной мышечной атрофией.
Когда это развивается, мышцы перестают сокращаться, потому что они больше не получают сигналы от нерва.
Симптомы мышечной атрофии сильно различаются в зависимости от причины и степени потери мышечной массы.
Помимо снижения мышечной массы, симптомы мышечной атрофии включают:
- , когда одна рука или нога заметно меньше других
- испытывает слабость в одной конечности или обычно
- испытывает трудности с равновесием
- остается неактивным в течение длительный период
Методы лечения атрофии мышц различаются в зависимости от степени потери мышц и наличия каких-либо сопутствующих заболеваний.
Лечение основного состояния, вызывающего мышечную атрофию, может помочь замедлить прогрессирование потери мышечной массы.
К лечению атрофии мышц относятся:
Физическая терапия
Поделиться на Pinterest Физическая терапия может помочь улучшить подвижность людей с атрофией мышц.Физическая терапия включает выполнение определенных упражнений на растяжку и упражнения с целью предотвращения неподвижности. Физическая терапия предлагает следующие преимущества людям с атрофией мышц:
- предотвращение неподвижности
- увеличение мышечной силы
- улучшение кровообращения
- уменьшение спастичности, которая вызывает непрерывное сокращение мышц
Функциональная электрическая стимуляция
Функциональная электрическая стимуляция (FES ) — еще одно эффективное средство от мышечной атрофии.Он включает использование электрических импульсов для стимуляции сокращения пораженных мышц.
Во время FES обученный техник прикрепляет электроды к атрофированной конечности. Электроды пропускают электрический ток, который вызывает движение конечности.
Сфокусированная ультразвуковая терапия
Этот метод доставляет лучи ультразвуковой энергии к определенным участкам тела. Лучи стимулируют сокращение атрофированной мышечной ткани.
Эта новая технология находится в стадии разработки и еще не вошла в стадию клинических испытаний.
Хирургия
Хирургические процедуры могут улучшить функцию мышц у людей, атрофия которых связана с неврологическими заболеваниями, травмами или недоеданием.
Атрофия мышц, или истощение мышц, характеризуется значительным укорочением мышечных волокон и потерей общей мышечной массы.
Несколько факторов могут способствовать атрофии мышц, например:
- длительное пребывание в неподвижности из-за болезни или травмы
- возраст
- недоедание
- генетика
- неврологические проблемы
- определенные заболевания, такие как артрит, миозит , ALS и MS
Варианты лечения будут зависеть от каждого отдельного случая, но они могут включать физиотерапию, диетическое вмешательство или хирургическое вмешательство.
Мышечная атрофия: причины, симптомы и лечение
Термин «мышечная атрофия» относится к потере мышечной ткани. Атрофированные мышцы кажутся меньше нормальных. Отсутствие физической активности из-за травмы или болезни, плохого питания, генетики и определенных заболеваний может способствовать атрофии мышц.
Атрофия мышц может возникнуть после длительного бездействия. Если мышца не получает никакой пользы, тело в конечном итоге разрушает ее, чтобы сохранить энергию.
Атрофия мышц, развивающаяся из-за бездействия, может возникнуть, если человек остается неподвижным, пока он выздоравливает после болезни или травмы.Регулярные упражнения и физиотерапия могут обратить вспять эту форму мышечной атрофии.
Люди могут лечить мышечную атрофию, изменив образ жизни, попробовав физиотерапию или сделав операцию.
В этой статье мы рассмотрим некоторые другие причины, симптомы и методы лечения атрофии мышц.
Многие факторы могут вызвать атрофию мышц, в том числе:
Плохое питание
Плохое питание может вызвать множество заболеваний, включая атрофию мышц.
В частности, Международный фонд остеопороза предупреждает, что диета с низким содержанием постного белка, фруктов и овощей может привести к снижению мышечной массы.
Атрофия мышц, связанная с неправильным питанием, может развиться в результате заболеваний, которые ухудшают способность организма усваивать питательные вещества, например:
Кахексия — это сложное метаболическое состояние, которое вызывает сильную потерю веса и атрофию мышц. Кахексия может развиваться как симптом другого основного заболевания, такого как рак, ВИЧ или рассеянный склероз (РС).
Люди с кахексией могут испытывать значительную потерю аппетита или непреднамеренную потерю веса, несмотря на потребление большого количества калорий.
Возраст
С возрастом в организме человека вырабатывается меньше белков, способствующих росту мышц. Это сокращение доступного белка вызывает сокращение мышечных клеток, что приводит к состоянию, называемому саркопенией.
Согласно отчету Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), саркопения поражает до трети людей в возрасте 60 лет и старше.
Помимо снижения мышечной массы, саркопения может вызывать следующие симптомы:
- слабость или хрупкость
- плохой баланс
- трудности с движением
- снижение выносливости
Потеря мышечной массы может быть неизбежным результатом естественного процесс старения. Однако это может увеличить риск травм и негативно повлиять на общее качество жизни человека.
Генетика
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое вызывает потерю двигательных нервных клеток и мышечную атрофию.
Существует несколько различных типов SMA, которые попадают в следующие категории:
- SMA, связанная с хромосомой 5 : Эти типы SMA возникают из-за мутации в генах SMN1 на хромосоме 5. Мутации приводят к дефицит белка выживания мотонейрона. СМА обычно развивается в детстве, но может развиться в любой момент жизни.
- SMA, не связанная с хромосомой 5
Мышечная дистрофия относится к группе прогрессирующих состояний, которые вызывают потерю мышечной массы и слабость.
Мышечная дистрофия возникает, когда один из генов, участвующих в производстве белка, мутирует. Человек может унаследовать генетические мутации, но многие из них возникают естественным образом по мере развития эмбриона.
Медицинские условия
Поделиться на PinterestАтрофированные мышцы меньше здоровых.Изображение предоставлено: OpenStax, 2016.
Заболевания и хронические состояния, которые могут способствовать атрофии мышц, включают:
- Боковой амиотрофический склероз (БАС) : БАС, также называемый болезнью Лу Герига, включает несколько типов, которые повреждают двигательные нервные клетки, которые повреждают двигательные нервные клетки. контролировать мышцы.
- MS : Это хроническое заболевание возникает, когда иммунная система организма атакует центральную нервную систему, вызывая опасное воспаление нервных волокон.
- Артрит : Артрит относится к воспалению суставов, которое вызывает боль и скованность. Артрит может серьезно ограничить подвижность человека, что может привести к неиспользованию мышц и атрофии.
- Миозит : Термин миозит относится к воспалению мышц. Это состояние вызывает мышечную слабость и боль.У людей может развиться миозит после вирусной инфекции или как побочный эффект аутоиммунного заболевания.
- Полиомиелит : Это инфекционное заболевание поражает нервную систему. Это вызывает симптомы гриппа и может привести к необратимому параличу.
Неврологические проблемы
Травма или состояние могут повредить нервы, контролирующие мышцы, что приведет к состоянию, которое называется нейрогенной мышечной атрофией.
Когда это развивается, мышцы перестают сокращаться, потому что они больше не получают сигналы от нерва.
Симптомы мышечной атрофии сильно различаются в зависимости от причины и степени потери мышечной массы.
Помимо снижения мышечной массы, симптомы мышечной атрофии включают:
- , когда одна рука или нога заметно меньше других
- испытывает слабость в одной конечности или обычно
- испытывает трудности с равновесием
- остается неактивным в течение длительный период
Методы лечения атрофии мышц различаются в зависимости от степени потери мышц и наличия каких-либо сопутствующих заболеваний.
Лечение основного состояния, вызывающего мышечную атрофию, может помочь замедлить прогрессирование потери мышечной массы.
К лечению атрофии мышц относятся:
Физическая терапия
Поделиться на Pinterest Физическая терапия может помочь улучшить подвижность людей с атрофией мышц.Физическая терапия включает выполнение определенных упражнений на растяжку и упражнения с целью предотвращения неподвижности. Физическая терапия предлагает следующие преимущества людям с атрофией мышц:
- предотвращение неподвижности
- увеличение мышечной силы
- улучшение кровообращения
- уменьшение спастичности, которая вызывает непрерывное сокращение мышц
Функциональная электрическая стимуляция
Функциональная электрическая стимуляция (FES ) — еще одно эффективное средство от мышечной атрофии.Он включает использование электрических импульсов для стимуляции сокращения пораженных мышц.
Во время FES обученный техник прикрепляет электроды к атрофированной конечности. Электроды пропускают электрический ток, который вызывает движение конечности.
Сфокусированная ультразвуковая терапия
Этот метод доставляет лучи ультразвуковой энергии к определенным участкам тела. Лучи стимулируют сокращение атрофированной мышечной ткани.
Эта новая технология находится в стадии разработки и еще не вошла в стадию клинических испытаний.
Хирургия
Хирургические процедуры могут улучшить функцию мышц у людей, атрофия которых связана с неврологическими заболеваниями, травмами или недоеданием.
Атрофия мышц, или истощение мышц, характеризуется значительным укорочением мышечных волокон и потерей общей мышечной массы.
Несколько факторов могут способствовать атрофии мышц, например:
- длительное пребывание в неподвижности из-за болезни или травмы
- возраст
- недоедание
- генетика
- неврологические проблемы
- определенные заболевания, такие как артрит, миозит , ALS и MS
Варианты лечения будут зависеть от каждого отдельного случая, но они могут включать физиотерапию, диетическое вмешательство или хирургическое вмешательство.
Сохраните мышечную массу — Harvard Health
Снижение мышечной массы является частью старения, но это не значит, что вы бессильны его остановить.
Как говорится, в жизни две неизбежности: смерть и налоги. Но и мужчинам следует добавить в список потерю мышечной массы.
Возрастная потеря мышечной массы, называемая саркопенией, является естественной частью старения. После 30 лет вы начинаете терять от 3% до 5% за десятилетие. Большинство мужчин теряют около 30% своей мышечной массы в течение жизни.
Меньше мышц означает большую слабость и меньшую подвижность, что может увеличить риск падений и переломов. В отчете Американского общества исследований костей и минералов за 2015 год было обнаружено, что у людей с саркопенией в 2,3 раза выше риск получить малотравматичный перелом в результате падения, например перелома бедра, ключицы, ноги, руки или запястья.
Но то, что вы теряете мышечную массу, не означает, что она исчезла навсегда. «Пожилые мужчины действительно могут увеличить мышечную массу, потерянную в результате старения», — говорит д-р.Томас В. Сторер, директор лаборатории физиологии упражнений и физических функций Гарвардской больницы Бригама и женщин. «Это требует работы, самоотверженности и плана, но никогда не поздно восстановить мышцы и поддерживать их».
Гормональный фактор
Одним из возможных факторов саркопении является естественное снижение уровня тестостерона, гормона, который стимулирует синтез белка и рост мышц. Думайте о тестостероне как о топливе для наращивания мышечной массы.
Некоторые исследования показали, что дополнительный тестостерон может увеличить мышечную массу тела, то есть мышечную массу, у пожилых мужчин, но может иметь побочные эффекты.Кроме того, FDA не одобрило эти добавки специально для увеличения мышечной массы у мужчин.
Следовательно, лучший способ нарастить мышечную массу, независимо от вашего возраста, — это прогрессивные тренировки с отягощениями (PRT), — говорит доктор Сторер. С PRT вы постепенно увеличиваете объем тренировки — вес, количество повторений и подходов — по мере того, как улучшаются ваша сила и выносливость.
Это постоянное упражнение нарастает мышечную массу и удерживает вас от плато, когда вы перестаете набирать вес. (См. «Работа над программой PRT.Фактически, недавний метаанализ, опубликованный в Medicine & Science in Sports & Exercise , рассмотрел 49 исследований мужчин в возрасте от 50 до 83 лет, которые выполняли PRT, и обнаружил, что у испытуемых в среднем увеличилась мышечная масса на 2,4 фунта.
Сила белка
Ваша диета также играет роль в наращивании мышечной массы. Белок — король мышечной пищи. Организм расщепляет его на аминокислоты, которые используются для наращивания мышц. Однако пожилые мужчины часто испытывают явление, называемое анаболической резистентностью, которое снижает способность их организма расщеплять и синтезировать белок.
Следовательно, как и в случае с PRT, если вы старше, вам нужно больше. Недавнее исследование, опубликованное в журнале Nutrients , предполагает ежедневное потребление от 1 до 1,3 грамма (г) белка на килограмм веса тела пожилыми людьми, которые тренируются с отягощениями. Например, мужчине весом 175 фунтов потребуется от 79 до 103 граммов в день. Если возможно, распределите белок поровну между ежедневными приемами пищи, чтобы максимизировать синтез мышечного белка.
Это большое количество по сравнению со средней диетой, но есть много способов получить дополнительный белок, который вам нужен.Источники животного происхождения (мясо, яйца и молоко) считаются лучшими, поскольку они обеспечивают правильное соотношение всех незаменимых аминокислот. Тем не менее, вы хотите держаться подальше от красного мяса и обработанного мяса из-за высокого уровня насыщенных жиров и добавок. Вместо этого выберите более здоровые продукты, например
.3,5 унции нежирной курицы или лосося (31 г и 24 г соответственно)
6 унций простого греческого йогурта (17 г)
1 стакан обезжиренного молока (9 г)
1 стакан вареной фасоли (около 18 г).
Протеиновые порошки содержат около 30 г на мерную ложку, и их можно добавлять во все виды блюд, например, в овсяные хлопья, коктейли и йогурт. «Хотя источники пищи являются лучшими, дополнительный белок может помочь, если вы боретесь с потреблением достаточного количества калорий и белка из своего обычного рациона», — говорит доктор Сторер.
Кроме того, чтобы максимизировать рост мышц и улучшить восстановление, он предлагает употреблять напитки или еду с соотношением углеводов к белкам примерно три к одному или четыре к одному в течение 30 минут после тренировки.Например, хороший выбор — 8 унций шоколадного молока, в котором содержится около 22 г углеводов и 8 г белка.
Мощность — не просто сила«Наращивание мышц — это не только сила», — говорит доктор Сторер. Вам также нужна сила. «Сила мышц, насколько быстро и эффективно вы двигаетесь, больше связана с повседневной деятельностью и физическими функциями, чем с мышечной силой», — говорит он. Хороший способ улучшить общую мышечную силу — ноги, так как они больше всего отвечают за подвижность.«Быстрые движения против сопротивления, например, веса собственного тела, могут быть эффективным средством развития силы», — говорит д-р Сторер. Например, вставая из положения сидя, старайтесь делать это быстро. Поднимаясь по лестнице, держитесь за поручень и отталкивайте ступеньку как можно быстрее. «Необязательно делать каждый шаг — начните с одного-трех шагов, — но это учит ваши мышцы более эффективно использовать силу». |
Работа по программе PRT«Чтобы набрать больше мышечной массы, пожилым мужчинам нужна структурированная и подробная программа PRT», — говорит доктор.Storer. «Он должен быть адаптирован к индивидууму с целями прогрессирования и улучшения», — говорит он. «Он должен быть сосредоточен на отдельных элементах, таких как конкретные упражнения, нагрузка, повторения и периоды отдыха, и должен бросать вызов, но не подавлять». Проконсультируйтесь с врачом перед тем, как приступить к любым видам силовых тренировок. Затем обратитесь к высококвалифицированному личному тренеру, который поможет составить подробную последовательность и контролировать ваши начальные тренировки, чтобы обеспечить их безопасное и наилучшее выполнение.По мере вашего прогресса вы часто можете выполнять их самостоятельно. Типичная программа обучения может включать
После того, как вы установили распорядок, есть несколько способов продвинуться вперед.Самый простой — добавить второй, а затем третий комплекс упражнений. Другой способ — уменьшить количество повторений в подходе и увеличить вес или сопротивление до точки, при которой вы сможете выполнить не менее восьми повторений, но не более 12. По мере улучшения вы можете увеличивать вес методом проб и ошибок. так что вы остаетесь в пределах от восьми до 12 повторений. |
В качестве услуги для наших читателей Harvard Health Publishing предоставляет доступ к нашей библиотеке заархивированного контента.Обратите внимание на дату последнего обзора или обновления всех статей. На этом сайте нет контента, независимо от даты, никогда не следует использовать вместо прямого медицинского совета вашего врача или другого квалифицированного клинициста.
Изменения мышечной ткани с возрастом
Curr Opin Clin Nutr Metab Care. Авторская рукопись; доступно в PMC 2010 12 января.
Опубликован в окончательной редакции как:
PMCID: PMC2804956
NIHMSID: NIHMS131937
Отдел эндокринологии и диабета, Медицинский факультет Университета Южной Калифорнии, Лос-Анджелес, Калифорния, США
Переписка с Еленой Вольпи, доктором медицины, Отделение эндокринологии и диабета, 1333 San Pablo St., BMT-B11, Лос-Анджелес, CA, США, тел .: +1 323 442 2839; факс: +1 323 442 2809; e-mail: ude.csu@iplov См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Цель обзора
В этой обзорной статье рассматриваются изменения, которые происходят в мышцах с возрастом, в частности, непроизвольная потеря мышечной массы, силы и функции, называемая саркопенией. Особое внимание уделяется метаболическим изменениям, которые характерны для саркопении, и потенциально излечимым причинам этого состояния, включая возрастные эндокринные изменения и изменения в питании, а также отсутствие активности.
Недавние открытия
Последние опубликованные данные включают те, которые касаются потенциальной роли инсулинорезистентности в развитии саркопении, потенциальной роли андрогенов и гормона роста в лечении этого состояния, полезности физических упражнений, включая тренировки с отягощениями и аэробные тренировки. улучшение мышечного роста и функции, и, наконец, возможное использование диетических манипуляций для улучшения мышечной массы.
Резюме
Саркопения, вероятно, является многофакторным заболеванием, которое нарушает физические функции и предрасполагает к инвалидности.Это можно предотвратить или вылечить с помощью изменения образа жизни и фармакологического лечения. Однако необходимы дальнейшие долгосрочные исследования, чтобы установить, какой тип и комбинации вмешательств наиболее эффективны для улучшения мышечной массы и функции у пожилых людей.
Ключевые слова: старение, мышцы, саркопения, питание, упражнения, гормоны, метаболизм
Введение
Одним из наиболее поразительных эффектов возраста является непроизвольная потеря мышечной массы, силы и функции, называемая саркопенией [1– 3].Мышечная масса уменьшается примерно на 3–8% за десятилетие после 30 лет, а после 60 лет скорость ее снижения еще выше [4,5]. Эта непроизвольная потеря мышечной массы, силы и функции является основной причиной инвалидности у пожилых людей. Это связано с тем, что саркопения увеличивает риск падений и уязвимости к травмам и, следовательно, может привести к функциональной зависимости и инвалидности [6,7]. Уменьшение мышечной массы также сопровождается прогрессирующим увеличением жировой массы и, следовательно, изменением состава тела, и связано с увеличением случаев инсулинорезистентности у пожилых людей [1,4,5,8].Кроме того, уменьшается плотность костной ткани, увеличивается жесткость суставов и наблюдается небольшое снижение роста (кифоз). Все эти изменения могут иметь последствия для ряда состояний, включая диабет 2 типа, ожирение, сердечные заболевания и остеопороз.
Возможные причины саркопении
Этиология саркопении до конца не выяснена, но было предложено несколько механизмов. На клеточном уровне специфические возрастные изменения включают уменьшение количества мышечных клеток, времени мышечных сокращений и силы сокращений, объема саркоплазматического ретикулума и способности перекачивать кальций [2,9].Расстояние между саркомерами становится дезорганизованным, ядра мышц становятся централизованными вдоль мышечного волокна, плазматическая мембрана мышц становится менее возбудимой, и происходит значительное увеличение накопления жира внутри и вокруг мышечных клеток. Нервно-мышечные изменения включают снижение скорости нервных импульсов в мышцах, количества двигательных нейронов и регенеративных способностей нервной ткани. Размер моторного блока также увеличивается [2]. Кроме того, старение связано с изменениями количества и набора сателлитных клеток, что является показателем и потенциальной причиной снижения мышечного роста [10–12].
С возрастом в мышцах также происходят биохимические и метаболические изменения. Сообщалось о делеционных мутациях митохондриальной ДНК, вызванных окислительным повреждением и снижением синтеза митохондриального белка, которые, вероятно, связаны со снижением активности гликолитических и окислительных ферментов, запасов креатинфосфата и АТФ в мышечной клетке, объема митохондрий и небольшого снижения общего метаболизма. ставка (~ 10%) [13–16]. Эти метаболические изменения в мышцах способствуют общей физической пригодности пожилых людей и являются важным компонентом снижения примерно на 30% способности использовать кислород во время упражнений (т.е. VO 2max ).
Первоначальные исследования небольшого числа пожилых людей также предположили, что старение связано со снижением синтеза базального мышечного белка, что могло быть ответственно за прогрессирующее снижение мышечной массы [17–21]. Однако более поздние данные, полученные в самой большой когорте здоровых пожилых мужчин, не подтвердили более ранние отчеты и пришли к выводу, что различия в обмене базального мышечного белка между пожилыми и молодыми мужчинами не могут объяснить потерю мышечной массы с возрастом, предполагая, что будущие исследования должны быть сосредоточены на ответах. на определенные раздражители, такие как питание, упражнения или болезнь [22].
Помимо описанных выше мышечных изменений, другие возрастные изменения эндокринной функции или реакции на гормональные стимулы, питания или реакции на питательные вещества и физической активности могут быть ответственны за развитие и ухудшение саркопении [23–30]. Скорее всего, саркопения — проблема многофакторная. Однако среди всех возможных причин снижение эндокринной функции, физической активности и правильного питания потенциально можно лечить с помощью поведенческих вмешательств или фармакологических средств, и по этой причине будет обсуждаться в этом обзоре.
Эндокринные изменения, связанные с саркопенией
В процессе старения наблюдаются различные гормональные изменения, которые могут способствовать потере мышечной массы с возрастом. Мы выбрали наиболее важные изменения, связанные с их влиянием на скелетные мышцы.
Основным и наиболее сильнодействующим анаболическим стероидом является тестостерон. Примерно у 60% мужчин старше 65 лет уровень тестостерона снижается до уровня ниже нормального для юношеского возраста, что называется андропаузой [31]. В отличие от быстрого снижения эстрадиола, наблюдаемого при менопаузе, концентрация тестостерона постепенно снижается на протяжении всего процесса старения [31].Поскольку тестостерон увеличивает синтез мышечного белка, мышечную массу и силу [32,33], было высказано предположение, что снижение уровня тестостерона может вызвать снижение синтеза мышечного белка и привести к потере мышечной массы. Имея это в виду, в нескольких исследованиях изучался эффект заместительной терапии тестостероном у мужчин с явным гипогонадизмом или концентрация тестостерона на уровне ниже нормы. Тестостерон вводили путем инъекции, трансдермального пластыря или кожного геля [24,34–38].Из этих исследований было показано, что замена тестостерона до среднего нормального уровня привела к значительному увеличению мышечной массы, мышечной силы, синтеза мышечного белка и плотности костей. Таким образом, эти результаты предполагают, что андропауза может играть роль в развитии саркопении, и подчеркивают, что терапия тестостероном может привести к обращению или ослаблению саркопении. Однако тестостерон в настоящее время не рекомендуется для лечения саркопении, и тщательная оценка потенциальных преимуществ и потенциальных рисков (например,грамм. повышение простатспецифического антигена, гематокрита и сердечно-сосудистого риска), прежде чем давать такую рекомендацию [39].
У женщин уровень эстрадиола резко снижается во время менопаузы [31]. Доступно очень мало информации о роли менопаузы в саркопении. Похоже, что снижение уровня эстрогенов не влияет на мышечную массу. Поперечные исследования, оценивающие влияние возраста на безжировую массу тела и массу аппендикулярных мышц, показали, что скорость снижения мышечной массы у женщин не увеличивается после менопаузы, что предполагает маргинальную роль, если таковая имеется, этого события в развитии саркопения у женщин [5].Однако заместительная гормональная терапия может значительно повысить уровень связывающего стероидные гормоны глобулина в сыворотке крови, что приводит к значительному снижению уровня свободного тестостерона в сыворотке крови у женщин [40]. Низкий уровень свободного тестостерона в сыворотке крови у женщин связан с меньшей мышечной массой. Следовательно, заместительная гормональная терапия может играть роль в дальнейшем уменьшении, а не увеличении мышечной массы у пожилых женщин.
Ось гормона роста / инсулиноподобного фактора роста-I также демонстрирует постепенное снижение при нормальном старении [31].Хотя предоставление заместительной терапии гормоном роста взрослым с дефицитом гормона роста привело к увеличению мышечной массы, некоторые исследования не показали влияния на мышечную силу [41–46]. Заместительная терапия гормоном роста у пожилых людей, по-видимому, полезна для снижения жировой массы, улучшения липидного профиля крови и увеличения безжировой массы тела, но эти изменения могут не привести к увеличению силы и функции мышц. Фактически, мышечная сила увеличивалась только тогда, когда гормон роста давался пожилым мужчинам, проходящим программу силовых тренировок, по сравнению с одной заместительной терапией гормоном роста, или когда заместительная терапия половыми гормонами проводилась в сочетании с гормоном роста [41,46].Также важно подчеркнуть, что на методы, используемые для измерения состава тела, может влиять задержка воды. Таким образом, увеличение мышечной массы с уменьшением жировой массы без изменения силы после терапии гормоном роста следует интерпретировать с осторожностью, поскольку гормон роста, как известно, увеличивает задержку воды, что может быть неверно истолковано как увеличение мышечной массы тела. Что касается тестостерона, заместительная терапия гормоном роста в настоящее время не рекомендуется для лечения саркопении из-за результатов опубликованных исследований и потенциально серьезных побочных эффектов (артралгия, отек, инсулинорезистентность, сердечно-сосудистый риск и т. Д.)) [41].
Концентрации дегидроэпиандростерона в крови также постепенно снижаются при нормальном старении (адренопауза) [31]. Фактически, у очень пожилых мужчин уровень может быть до пяти раз ниже, чем у более молодых мужчин. Пероральный прием дегидроэпиандростерона у пожилых людей действительно восстанавливает его уровень до юношеского значения, повышает уровень инсулиноподобного фактора роста-I у мужчин и женщин, повышает уровень эстрогенов у мужчин и повышает уровень тестостерона у женщин [47–50]. Однако никаких изменений в безжировой массе тела обнаружено не было, а уровень холестерина ЛПВП значительно снизился [47,49].Тем не менее, в одном конкретном исследовании мышечная сила была увеличена у пожилых мужчин (но не у женщин), получавших дегидроэпиандростерон [48]. Недавно проведенное с участием пожилых людей очень крупное исследование показало, что заместительная терапия дегидроэпиандростероном не влияет на размер, силу или функцию мышц [50]. Таким образом, важность адренопаузы в развитии саркопении еще предстоит продемонстрировать.
Способность мышечной ткани реагировать на инсулин — важный аспект общей чувствительности к инсулину.Частота инсулинорезистентности и диабета 2 типа увеличивается с возрастом, и саркопения может играть важную роль. В большинстве исследований сообщается, что распространенность инсулинорезистентности и непереносимости глюкозы выше у пожилых людей, когда данные сообщаются на единицу массы тела, но эти различия исчезают, если данные корректируются на безжировую массу тела [51–55]. Это говорит о том, что изменения в составе тела могут способствовать увеличению инсулинорезистентности с возрастом. Хотя инсулин обычно рассматривается в контексте его способности увеличивать поглощение глюкозы клетками, появляются новые доказательства того, что инсулинорезистентность мышц и метаболизм белков всего тела у пожилых людей может быть важным фактором саркопении [29,56].Например, когда глюкоза попадает в организм с обычным приемом пищи, последующее повышение концентрации инсулина отрицательно сказывается на синтезе мышечного белка только у пожилых людей [29]. Это означает, что при нормальном старении способность мышечных клеток должным образом реагировать на циркулирующий инсулин (за счет увеличения синтеза мышечного белка) нарушается.
Физическая активность и саркопения
Еще одним важным фактором саркопении является бездействие. Хотя трудно причинно определить относительную важность малоподвижного образа жизни в развитии саркопении, хорошо известно, что кратковременное бездействие мышц сильно снижает мышечную массу и силу даже у молодых людей.Типичные примеры — постельный режим и невесомость [57,58]. Также признано, что этим мышечным изменениям можно противодействовать с помощью упражнений, обычно упражнений с отягощениями [59]. Несколько авторов сообщили, что острые упражнения с отягощениями увеличивают синтез миофибриллярного мышечного белка как у молодых, так и у пожилых людей [20,21]. Также было показано, что прогрессивные тренировки с отягощениями вызывают гипертрофию мышц и увеличивают силу у пожилых и физически ослабленных взрослых [12,19,60–66]. Однако, несмотря на очевидную эффективность в увеличении мышечной массы, силы и функции, тренировки с отягощениями могут быть трудным вмешательством для пожилых людей, проживающих в сообществе, из-за необходимости специального оборудования и наблюдения, а также возможности того, что это может не быть показано в определенные состояния, часто встречающиеся у пожилых пациентов (например,грамм. гипертония, инсульт) и тот факт, что поднятие тяжестей может быть неинтересным занятием для сидячих людей пожилого возраста.
В нескольких исследованиях было показано, что аэробные упражнения улучшают VO 2max , плотность и активность митохондрий, чувствительность к инсулину и расход энергии у молодых и пожилых людей [67–69]. Два исследования также показали, что продолжительные и интенсивные аэробные упражнения могут увеличить синтез мышечного белка у молодых активных людей [70–71]. Недавние предварительные данные показывают, что аэробика (40% VO 2max ) также может резко увеличить синтез мышечного белка у здоровых, независимых пожилых людей [72].Хотя аэробные упражнения не вызывают явной гипертрофии мышц, некоторые исследования показали, что интенсивные аэробные упражнения могут вызывать некоторую степень гипертрофии, на что указывают увеличенная окружность икр, площадь мышечных волокон и активация сателлитных клеток [73,74]. Характерное телосложение марафонцев, воплощение аэробных упражнений, может поставить под сомнение анаболическую эффективность аэробных упражнений. Однако важно подчеркнуть, что мышцы этих спортсменов, хотя и не гипертрофированы, не лишены силы и мощности, как мышцы пожилых людей с саркопенией.Фактически, мышечная масса — не единственный фактор, определяющий функцию мышц, и аэробные упражнения могут иметь важные положительные эффекты на нервно-мышечную адаптацию и, следовательно, качество мышц, особенно у людей, которые вели малоподвижный образ жизни и страдали саркопенией до вмешательства. Фактически, было показано, что качество мышц значительно улучшается при тренировках с отягощениями у пожилых людей и у молодых людей с истощением мышц [75,76].
Таким образом, как упражнения с отягощениями, так и аэробные упражнения могут быть очень полезны для противодействия саркопении и связанным с ней метаболическим изменениям в мышцах.
Питание и саркопения
Недоедание приводит к истощению мышц. Было показано, что старение связано с прогрессирующим сокращением потребления пищи, что предрасполагает к белково-энергетической недостаточности [30]. Кроме того, пожилые люди могут добровольно снизить потребление белка, чтобы соблюдать диету с пониженным содержанием жира и холестерина. Недавние исследования [77] показывают, что потребности пожилых людей в белке могут быть выше (~ 1 г / кг / день), чем уровень, рекомендованный в настоящее время Институтом медицины (0.8 г / кг / сут) [78]. Таким образом, диетические вмешательства являются привлекательным потенциальным средством профилактики и лечения саркопении у пожилых людей благодаря простоте применения и безопасности. Аминокислоты из потребляемого белка напрямую стимулируют синтез мышечного белка [79]. Интересно, что здоровые пожилые люди реагируют на аминокислотный стимул увеличением синтеза мышечного белка, что незначительно отличается от эффекта, наблюдаемого у их более молодых коллег [80–82]. Однако попытки увеличить мышечную массу, силу и синтез мышечного белка с помощью коммерческих пищевых добавок или диеты с высоким содержанием белка были в основном безуспешными [83,84].Хотя в более раннем и меньшем исследовании сообщалось об увеличении мышечной массы с помощью пищевых добавок [85], в гораздо большей когорте ослабленных пожилых людей Fiatarone et al . [60] сообщили об увеличении мышечной массы и силы, связанном с упражнениями с отягощениями, но не с пищевыми добавками. Кроме того, пищевые добавки или блюда с высоким содержанием белка, добавленные к упражнениям с отягощениями, не привели к увеличению мышечной массы, силы или синтеза мышечного белка по сравнению с одними упражнениями [60,83,84].Есть по крайней мере два возможных объяснения неспособности пищевых добавок или увеличения потребления белка для увеличения мышечного роста и силы. Во-первых, присутствие углеводов в пищевой добавке для пожилых людей не приносит пользы [29] и может фактически ухудшать анаболический ответ мышечных белков на положительный эффект только аминокислот [80,81]. Эти данные согласуются с данными на старых крысах, указывающими на то, что синтез мышечного белка притупляется при сбалансированном кормлении [28].Поскольку как коммерческие добавки, так и диеты с высоким содержанием белка, ранее проверенные на пожилых людях, содержали углеводы, одно это могло бы дать достаточное объяснение неэффективности этих вмешательств [60,83,84]. Во-вторых, сообщалось о том, что пожилые люди, которым давали добавки в отсутствие увеличения физической активности, уменьшили свое диетическое потребление, так что их общее суточное потребление энергии осталось неизменным [60]. Это указывает на то, что пищевые добавки для пожилых людей лучше рассматривать как диетические заменители.Следовательно, если содержание питательных веществ в добавке мало отличается от нормального рациона, вполне вероятно, что добавка будет неэффективной. Следовательно, пищевая добавка для профилактики или лечения саркопении должна содержать только те питательные вещества, которые абсолютно необходимы для стимуляции анаболизма мышечного белка, чтобы достичь наивысшей анаболической эффективности (анаболический эффект на единицу энергии). Данные молодых людей показывают, что незаменимые аминокислоты в основном ответственны за индуцированную аминокислотами стимуляцию синтеза мышечного белка [86,87], тогда как заменимые аминокислоты, по-видимому, не оказывают какого-либо значительного эффекта даже при введении в очень высоких дозах [87] ].Недавние исследования показывают, что это верно и для пожилых людей. Фактически, незаменимые аминокислоты в первую очередь ответственны за аминокислотную стимуляцию анаболизма мышечных белков у здоровых пожилых людей, тогда как заменимые аминокислоты, по-видимому, не требуются [82]. В частности, потребление 18 г незаменимых аминокислот отдельно или в комбинации с 22 г заменимых аминокислот увеличивало анаболизм чистого мышечного белка. Величина анаболического эффекта обеих добавок была схожей.Однако важно учитывать, что, хотя содержание незаменимых аминокислот и состав обеих добавок были идентичными, сбалансированная аминокислотная добавка обеспечивала более чем в два раза больше энергии и амино-азота, чем незаменимая аминокислотная добавка.
Заменимые аминокислоты составляют значительную часть пищевых белков, включая высококачественные белки (например, сыворотку, яйца), которые обычно используются в качестве дополнения к диетам с низким содержанием белка. Поскольку заменимые аминокислоты, по-видимому, не необходимы для острой стимуляции анаболизма мышечных белков у пожилых людей, высококачественных белков может быть недостаточно для эффективного длительного лечения саркопении, учитывая чрезмерное количество калорий, которые они обеспечивают. форма заменимых аминокислот.Таким образом, устранение любого источника энергии, который не стимулирует анаболизм белков, включая заменимые аминокислоты и углеводы, не должно уменьшать долгосрочный анаболический эффект добавки незаменимых аминокислот для пожилых людей, при этом значительно снижая ее общую калорийность. Однако нет данных об эффективности длительного приема высокоэффективной смеси незаменимых аминокислот на рост мышц у пожилых людей. Следовательно, необходимы долгосрочные рандомизированные клинические испытания, чтобы четко оценить, могут ли высокоэффективные пищевые добавки эффективно улучшать мышечную массу у пожилых людей с саркопенией.
Заключение
Саркопения — многофакторный процесс. Снижение эндокринной функции, физическая активность и неправильное питание — все это играет важную роль в снижении мышечной массы при нормальном старении. Заместительная терапия тестостероном может быть полезным вмешательством у пожилых мужчин с гипогонадизмом для увеличения мышечной массы и силы, хотя в настоящее время она не рекомендуется. Заместительная гормональная терапия в период менопаузы, адренопаузы или соматопаузы, по-видимому, оказывает незначительное или не оказывает положительного воздействия на мышечную массу и силу.Физические упражнения и правильное питание могут иметь огромное влияние на мышечную массу и силу. Оптимальная программа вмешательства может включать график тренировок с отягощениями и аэробными упражнениями с адекватным потреблением общего количества калорий и белка. Это не только улучшит мышечную массу и силу, но и снизит резистентность к инсулину, которая чаще встречается у пожилых людей. Пищевая добавка, состоящая только из аминокислот или белка, также может быть полезной для стимулирования роста мышц за счет стимуляции синтеза мышечного белка и увеличения общего суточного потребления калорий, но необходимы дальнейшие исследования.
К счастью, старые мышцы все еще очень пластичны и могут реагировать на анаболические стимулы увеличением своей массы и силы. Эти знания жизненно важны для разработки вмешательств, направленных на то, чтобы обратить вспять или уменьшить потерю мышечной массы с возрастом и улучшить функциональные способности у пожилых людей.
Благодарности
Эта работа частично финансировалась грантом № AG18311 Национального института старения / NIH.

 Она связана со снижением содержания половых гормонов, уровня соматотропного гормона, относительным увеличением содержания свободного кортизола, нарушением нормального циркадного ритма кортизола, снижением содержания витамина D и D-гормона и уменьшением количества/ухудшением чувствительности рецепторов к D-гормону;
Она связана со снижением содержания половых гормонов, уровня соматотропного гормона, относительным увеличением содержания свободного кортизола, нарушением нормального циркадного ритма кортизола, снижением содержания витамина D и D-гормона и уменьшением количества/ухудшением чувствительности рецепторов к D-гормону; Cachexia, Sarcopenia and Muscle. 2016. Vol. 7, № 5. P. 512–514.
Cachexia, Sarcopenia and Muscle. 2016. Vol. 7, № 5. P. 512–514. P. 13.
P. 13. P. e1721.
P. e1721. В., Хван Д. Е. и др. О результатах применения L-карнитина (препарат Элькар) у спортсменов высокой квалификации // Спортивная медицина: наука и практика. 2012. № 2. С. 21–28.
В., Хван Д. Е. и др. О результатах применения L-карнитина (препарат Элькар) у спортсменов высокой квалификации // Спортивная медицина: наука и практика. 2012. № 2. С. 21–28.
 ) провоцируют синтез воспалительных цитокинов: Интерлейкин-6; Фактор некроза опухоли альфа и др. Рост уровня стареющих клеток в процессе старения, вызывает воспаление, не связанное с каким-то органом организма — воспаление всего организма. Исследование 11 249 пожилых пациентов обнаружило, что высокий уровень воспалительного маркера C-реактивный белок хорошо предсказывает будущую саркопению.
) провоцируют синтез воспалительных цитокинов: Интерлейкин-6; Фактор некроза опухоли альфа и др. Рост уровня стареющих клеток в процессе старения, вызывает воспаление, не связанное с каким-то органом организма — воспаление всего организма. Исследование 11 249 пожилых пациентов обнаружило, что высокий уровень воспалительного маркера C-реактивный белок хорошо предсказывает будущую саркопению.
 htm
htm