Шкала moca: Монреальская шкала оценки когнитивных функций
быстрое исследование когнитивных функций в крупных исследованиях с участием пациентов с инсультом
Монреальская шкала оценки когнитивных функций: быстрое исследование когнитивных функций в крупных исследованиях с участием пациентов с инсультом
Т.Б. Кумминг, Дж. Берхардт, Т. Линден
Предпосылки и цель исследования. В исследованиях, посвященных проблемам инсульта, изучению нарушений когнитивных функций пациентов часто уделяют недостаточно внимания. Краткая Монреальская шкала оценки когнитивных функций (MoCA) может быть чувствительна к выявлению нарушений когнитивных функций при инсульте. Методы. Оценили обоснованность использования MoCA в период через 3 месяца после проведения крупного испытания A Very Early Rehabilitation Trial (AVERT) с участием пациентов с инсультом. Результаты. Данные (с учетом ослепления относительно проводимого вмешательства) представлены для 294 пациентов, средний возраст 70,6 года (стандартное отклонение [СО]=12,8 года), из которых 220 (75%) пациентам провели полную оценку по MoCA, в 54 (18%) случаях данных было недосточно для полной оценки по шкале MoCA, 20 (7%) пациентов скончались.
Ключевые слова: когнитивное нарушение, сосудистая деменция, цереброваскулярное заболевание, нейропсихология
Литература
1. Jin Y.P., Di Legge S., Ostbye T., Feightner J.W., Hachinski V. The reciprocal risks of stroke and cognitive impairment in an elderly population. Alzheimers Dement. 2006;2:171–178.
2. Anderson C.A., Arciniegas D.B., Filley C.M. Treatment of acute ischemic stroke: does it impact neuropsychiatric outcome? J Neuropsychiatry Clin Neurosci.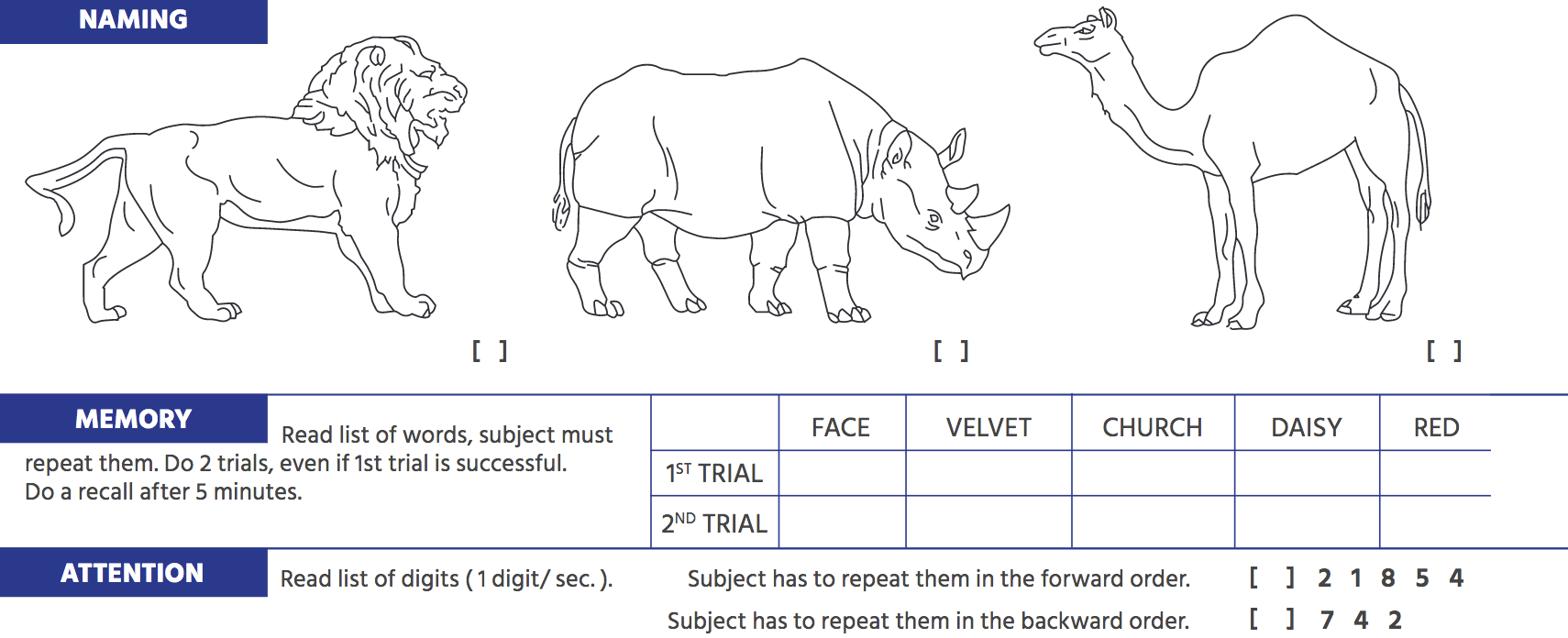 2005;17:486–488.
2005;17:486–488.
3. Folstein M.F., Folstein S.E., McHugh P.R. ‘Mini-Mental State.’ A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975;12:189–198.
4. Nys G.M., van Zandvoort M.J., de Kort P.L., Jansen B.P., Kappelle L.J., de Haan E.H. Restrictions of the mini-mental state examination in acute stroke. Arch Clin Neuropsychol. 2005;20:623–629.
5. Hachinski V., Iadecola C., Petersen R.C., Breteler M.M., Nyenhuis D.L., Black S.E., et al. National Institute of Neurological Disorders and Stroke– Canadian Stroke Network vascular cognitive impairment harmonization standards. Stroke. 2006;37:2220–2241.
7. Pendlebury S.T., Cuthbertson F.C., Welch S.J.V., Mehta Z., Rothwell P.M. Underestimation of cognitive impairment by Mini-Mental State Examination versus the Montreal Cognitive Assessment in patients with transient ischemic attack and stroke: a population-based study. Stroke. 2010;41:1290–1293.
Stroke. 2010;41:1290–1293.
8. Popovic I.M., Seric V., Demarin V. Mild cognitive impairment in symptomatic and asymptomatic cerebrovascular disease. J Neurol Sci. 2007;257:185–193.
9. Bernhardt J., Dewey H., Thrift A., Lindley R., Moodie M., Donnan G. Lancet protocol review: protocol 06PRT/5424: A Very Early Rehabilitation Trial (AVERT): Phase III. Lancet. Available at: www.thelancet.com/protocolreviews/ 06PRT-5424. Accessed March 16, 2011.
Похожие статьи
Содержание и архив номеров — Издательство РАМН
Общая патология и патологическая физиология
Изменения в белом веществе головного мозга и состояние когнитивных функций у асимптомных лиц
А.Б.Бердалин, А.К.Никогосова, И.Л.Губский, Е.А.Ковражкина, Л.В.Губский, В.Г.Лелюк — 559-563
ФГБУ Федеральный центр цереброваскулярной патологии и инсульта Минздрава России, Москва
Проанализирована взаимосвязь между очагами гиперинтенсивности на Т2-взвешенных МР-изображениях в белом веществе головного мозга (по шкале Fazekas) и состоянием когнитивных функций (общий балл по шкале MOCA) у 65 асимптомных лиц. Выявлена зависимость между наличием и количеством очагов в глубоком белом веществе головного мозга и состоянием когнитивного статуса по общему баллу шкалы MOCA. Результаты оценки когнитивных функций также были сопряжены с выраженностью атрофии коры головного мозга, регистрируемой при МРТ. Выраженность очаговых изменений в глубоком белом веществе полушарий мозга по шкале Fazekas также была связана со значениями конечных диастолических скоростей кровотока в средних мозговых, позвоночных и основной артериях.
Выявлена зависимость между наличием и количеством очагов в глубоком белом веществе головного мозга и состоянием когнитивного статуса по общему баллу шкалы MOCA. Результаты оценки когнитивных функций также были сопряжены с выраженностью атрофии коры головного мозга, регистрируемой при МРТ. Выраженность очаговых изменений в глубоком белом веществе полушарий мозга по шкале Fazekas также была связана со значениями конечных диастолических скоростей кровотока в средних мозговых, позвоночных и основной артериях.
Ключевые слова: магнитно-резонансная томография; очаги гиперинтенсивности в белом веществе головного мозга; когнитивная дисфункция; шкала Fazekas, шкала MOCA
Адрес для корреспонденции: [email protected] Бердалин А.Б.
Brain white matter changes and cognitive functions state in asymptomic patients
A. B. Berdalin, A. K. Nikogosova, I. L. Gubskiy, E. A. Kovrazhkina, L. V. Gubskiy, and V. G. Lelyuk
Federal Center for Cerebrovascular Pathology and Stroke, the Ministry of Health of the Russian Federation, Moscow, Russia
We analyzed relationship between white matter hyperintensities on T2-weighted MR-images, evaluated using the Fazekas scale and cognitive functions state (total score by MOCA scale) in 65 asymptomatic individuals..jpg) Relationship between presence/number of lesions in brain deep white matter and cognitive status according to the overall MOCA score was revealed. Results of cognitive functions assessment were also associated with cerebral cortex atrophy severity, according to MRI. Severity of deep white matter lesions according to the Fazekas scale were also associated with end-diastolic blood flow velocities in the middle cerebral, vertebral and basilar arteries.
Relationship between presence/number of lesions in brain deep white matter and cognitive status according to the overall MOCA score was revealed. Results of cognitive functions assessment were also associated with cerebral cortex atrophy severity, according to MRI. Severity of deep white matter lesions according to the Fazekas scale were also associated with end-diastolic blood flow velocities in the middle cerebral, vertebral and basilar arteries.
Key Words: magnetic resonance imaging; white matter lesions; cognitive dysfunction; Fazekas scale; MOCA scale
Клиническая оценка использования опросников симптомов нижних мочевых путей у мужчин | Дударев
Введение
Симптомами нижних мочевых путей (СНМП) принято обозначать комплекс различных нарушений мочеиспускания, отрицательно влияющих на качество жизни людей [1][2]. На сегодняшний день известно, что у каждого четвертого мужчины развивается гиперплазия предстательной железы (ГПЖ) и СНМП [3]. По данным расчетов О. И. Аполихина и соавт. в Российской Федерации, более 13 млн. мужчин могут иметь ГПЖ и СНМП различной степени тяжести [4]. Выраженность СНМП варьируется от минимального уровня до тяжелых расстройств мочеиспускания, существенно влияющих на трудоспособность пациента. По современным представлениям, СНМП разделены на три группы в соответствии с расстройством фазы мочеиспускания — «накопления», «опорожнения» и «пост- миктурические» [5]. На сегодняшний день существует большой спектр методик диагностики ГПЖ и СНМП у мужчин пожилого возраста, по большей части, понятных для интерпретации врачом урологом [6]. Использование международной шкалы симптомов простаты (IPSS — International Prostate Symptom Score) и дополнительно индекса качества жизни, связанного с мочеиспусканием (QoL— Quality of life), позволяют врачу практически оценить выраженность нарушений мочеиспускания у пациентов любого возраста.
И. Аполихина и соавт. в Российской Федерации, более 13 млн. мужчин могут иметь ГПЖ и СНМП различной степени тяжести [4]. Выраженность СНМП варьируется от минимального уровня до тяжелых расстройств мочеиспускания, существенно влияющих на трудоспособность пациента. По современным представлениям, СНМП разделены на три группы в соответствии с расстройством фазы мочеиспускания — «накопления», «опорожнения» и «пост- миктурические» [5]. На сегодняшний день существует большой спектр методик диагностики ГПЖ и СНМП у мужчин пожилого возраста, по большей части, понятных для интерпретации врачом урологом [6]. Использование международной шкалы симптомов простаты (IPSS — International Prostate Symptom Score) и дополнительно индекса качества жизни, связанного с мочеиспусканием (QoL— Quality of life), позволяют врачу практически оценить выраженность нарушений мочеиспускания у пациентов любого возраста.
Однако любой вопросник обладает рядом недостатков, связанных с особенностями субъективных ощущений респондента, которые он может трактовать с учётом времени и места заполнения анкеты, наличия врача (например, в момент врачебного приёма) и опасения огласки его проблем. Результаты исследования N.R. Netto et al. (1995) показали, что для качественного заполнения опросника IPSS от пациента требуется минимальный порог когнитивных способностей, эквивалентный программе незаконченного среднего образования. Как ни странно, авторы продемонстрировали обратную связь уровня образования респондента и восприятия смысла вопросов предлагаемого теста [7].
Результаты исследования N.R. Netto et al. (1995) показали, что для качественного заполнения опросника IPSS от пациента требуется минимальный порог когнитивных способностей, эквивалентный программе незаконченного среднего образования. Как ни странно, авторы продемонстрировали обратную связь уровня образования респондента и восприятия смысла вопросов предлагаемого теста [7].
S.A. MacDiarmid et al. (1998) отметили, что «современный уровень образования людей пожилого возраста в большинстве случаев не соответствует минимальному порогу для правильного понимания вопросов IPSS» [8]. По мнению этих авторов, неправильное формирование ответов на список вопросов с последующей интерпретацией итогов может привести врача к ложным умозаключениям, а в дальнейшем — и к неверному выбору индивидуального лечебного подхода.
В ходе совместной работы C.L. van der Walt и сотрудников кафедры урологии Университета Стелленбош (Западный Кейп, Южная Африка) в 2011 году разработан опросник визуальной оценки симптомов заболеваний простаты (VPSS). Результаты данного опросника в гораздо меньшей степени, чем IPSS, коррелируют с уровнем когнитивных способностей пациента [9]. В опроснике приведены 4 вопроса, соответствующие аналогам IPSS, с отражением информации о частоте мочеиспускания в разные периоды времени (ночь и день), состоянии струи мочи и о качестве жизни респондента (рис. 1).
Результаты данного опросника в гораздо меньшей степени, чем IPSS, коррелируют с уровнем когнитивных способностей пациента [9]. В опроснике приведены 4 вопроса, соответствующие аналогам IPSS, с отражением информации о частоте мочеиспускания в разные периоды времени (ночь и день), состоянии струи мочи и о качестве жизни респондента (рис. 1).
Рисунок 1. Опросник визуальной оценки симптомов заболеваний простаты (VPSS)
Figure 1. Visual Prostate Symptom Assessment questionnaire (VPSS)
Позже Y. Сеуlаn et al. (2015) провели исследование, в котором опросник VPSS экспериментально заполнялся группами мужчин с различными уровнями полученного образования. Установлена значимая корреляция VPSS и IPSS, сформулировано заключение о возможности широкого использования опросника у мужчин с недостаточно высоким уровнем образования [10].
В настоящее время клиницисты отмечают недостаток адекватных опросников, использование которых поможет оценить динамику клинических проявлений СНМП, подобно лабораторному методу исследования.2009/62/12.png) Клиническая практика нуждается в простой диагностике с большей степенью доказательности.
Клиническая практика нуждается в простой диагностике с большей степенью доказательности.
Цель исследования: сравнить эффективность оценки СНМП у мужчин пожилого возраста с использованием двух шкал: международного индекса симптомов простаты (IPSS) и визуальной шкалы оценки симптомов заболеваний простаты (VPSS) с учётом степени когнитивных нарушений. Для реализации поставленной цели сформулированы задачи: 1. Сравнить валидность шкалы опросника VPSS в сравнении с IPSS. 2. Провести анализ объективности заполнения пациентами опросников VPSS и IPSS, в зависимости от когнитивного статуса и его нарушений. 3. Оценить адекватность понимания пациентами вопросов, представленных в опроснике IPSS в связи с когнитивным статусом респондентов.
Материалы и методы
В исследовании приняли участие 56 мужчин жителей Забайкальского края в возрасте 53 — 85 лет (средний возраст — 64,82 года). Критериями отбора в группы исследования были возраст мужчин старше 50 лет, наличие самостоятельного мочеиспускания, отсутствие онкологических заболеваний органов мочевыделительной системы. Предварительно все респонденты тестированы с помощью Монреальской шкалы оценки когнитивных функций (тест МоСа). Обследуемые дважды заполняли анкету IPSS: сначала самостоятельно (IPSSl), затем при участии врача (IPSS2). Также, всех пациентов анкетировали по опроснику визуальной оценки симптомов заболеваний простаты (VPSS). Для анализа качества жизни анкетируемых мужчин использовали шкалу QoL.
Предварительно все респонденты тестированы с помощью Монреальской шкалы оценки когнитивных функций (тест МоСа). Обследуемые дважды заполняли анкету IPSS: сначала самостоятельно (IPSSl), затем при участии врача (IPSS2). Также, всех пациентов анкетировали по опроснику визуальной оценки симптомов заболеваний простаты (VPSS). Для анализа качества жизни анкетируемых мужчин использовали шкалу QoL.
Статистическую обработку полученных данных проводили с помощью программного обеспечения Statistica 8.0. при статистической обработке осуществляли попарное сравнение исследуемых групп с использованием непараметрического критерия Манна-Уитни, критическим уровнем значимости принимали значение р < 0,05.
Результаты
По итогам анкетирования респондентов (тест MoCa) определены 3 группы исследуемых: I — мужчины с 0 — 20 баллами (деменция) по тесту MoCa (n = 17), II — 21 — 25 баллов (когнитивные нарушения) (n = 24), III группа — 26 — 30 баллов (нет когнитивных нарушений) (n = 16). Средний возраст респондентов I, II и III групп составил 68,1; 63,2; 63,0 лет, соответственно.
Средний возраст респондентов I, II и III групп составил 68,1; 63,2; 63,0 лет, соответственно.
У больных I группы после анкетирования по опроснику VPSS выявлено, что в 11,76% (n = 2) случаев наблюдалась лёгкая степень выраженности СНМП, в 76,47% (n = 13) случаев — умеренная и в 11,76% (n = 2) случаев — тяжёлая (рис. 2).
Рисунок 2. Степени выраженности СНМП по опросникам VPSS, IPSS1, IPSS2 в I группе
Figure 2. Severity of LUTS according to VPSS, IPSS1, IPSS2 questionnaires in group I
По результатам самостоятельного заполнения опросника IPSSl выявлено, что в 17,65% (n = 3) случаев диагностировалась лёгкая степень СНМП, умеренная степень — в 29,41% (n = 5) случаев. В остальных 52,94% (n = 9) случаев определена тяжёлая степень выраженности нарушений (рис. 2). После заполнения опросника IPSS2 у 17,65% (n = 3) пациентов определена лёгкая степень выраженности СНМП, в 64,71% (n = 11) — умеренная, в остальных 17,65% (n = 3) — тяжёлая степень выраженности (рис. 3).
3).
Рисунок 3. Сравнение результатов опросников IPSS1 / IPSS2, VPSS / IPSS1, VPSS / IPSS2 в I группе
Figure 3. Comparison of the results of the questionnaires IPSS1 / IPSS2, VPSS / IPSS1, VPSS / IPSS2 in group I
Различия результатов оценки нарушений мочеиспускания, полученных при заполнении опросников IPSSl c IPSS2, составили 76,47% (п = 13) случаев (рис. 3).
При сравнении результатов опросников VPSS / IPSSl в 64,71% (п = 11) случаев степень тяжести СНМП не совпадала (рис. 3). При аналогичной оценке результатов ответов VPSS / IPSS2 различия составили 29,41%.
Анализ результатов опросника IPSS, заполненного самостоятельно и совместно с лечащим врачом, продемонстрировал статистически значимые различия (р < 0,05). Скорее всего, это свидетельствует о неполном понимании сути вопросов больными при самостоятельном заполнении анкеты.
При оценке различий результатов ответов по симптомам накопления с тремя вариантами опросников после использования VPSS (в сравнении с IPSSi1, IPSS2) отмечена статистически значимая разница (р < 0,05). Значимых различий в отношении симптомов опорожнения не было (р > 0,05).
Во II группе (признаки когнитивных нарушений) при анкетировании VPSS лёгкая и умеренная степени СНМП отмечены в 29,17% (n = 7) и в 70,83% (n = 17) случаев соответственно. Тяжёлой степени нарушений среди анкетируемых не было (рис. 4).
Рисунок 4. Степени выраженности СНМП по опроснику VPSS, IPSS1, IPSS2 во II группе
Figure 4. The severity of LUTS according to the VPSS, IPSS1, IPSS2 questionnaires in group II
После самостоятельного заполнения опросника IPSS1 тяжёлая и умеренная степени СНМП отмечены в 29,17% (n = 7) и в 20,83% (n = 5) случаев соответственно. У остальных 50% (n = 12) респондентов констатирована лёгкая степень нарушений (рис. 4). После заполнения опросника с врачом (IPSS2) данные распределились так: лёгкая, средняя и тяжёлая степени СНМП определены в 33,33% (n = 8), 62,50% (n = 15) и 4,17% (n = 1) случаев соответственно.
4). После заполнения опросника с врачом (IPSS2) данные распределились так: лёгкая, средняя и тяжёлая степени СНМП определены в 33,33% (n = 8), 62,50% (n = 15) и 4,17% (n = 1) случаев соответственно.
При сравнении результатов IPSSi1 / IPSS2 выявлено несовпадение по числу баллов в 58,33% (n = 14) случаев (рис. 5).
Рисунок 5. Сравнение результатов опросников IPSS1 / IPSS2, VPSS / IPSS1, VPSS / IPSS2 во II группе
Figure 5. Comparison of the results of the questionnaires IPSS1 / IPSS2, VPSS / IPSS1, VPSS / IPSS2 in group II
Сравнимые результаты (50%) получены по анкетам VPSS / IPSS1, что говорит о сложностях анкетирования пациентов без посторонней помощи; совпадение данных VPSS / IPSS2 — в 79,17% (n = 24) случаях (рис. 5).
При оценке расхождений IPSS1 / IPSS2 во II группе выявлены статистически значимые различия (р < 0,05).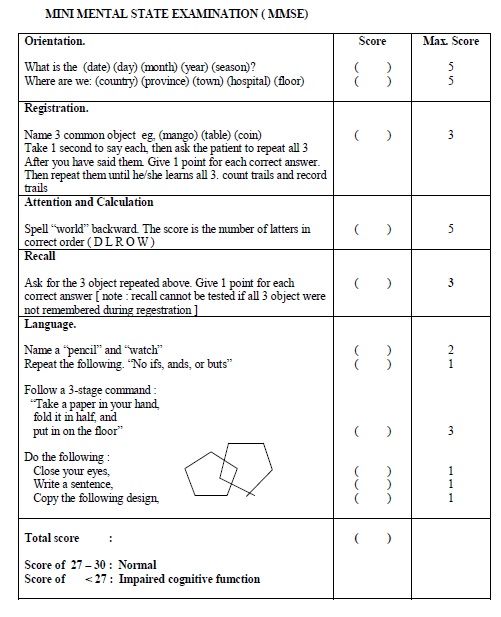 При сравнении итогов опроса по трём шкалам установлены результаты, аналогичные с I группой (р < 0,05). При отдельном сравнении симптомов накопления и опорожнения VPSS, с IPSS1, IPSS2 статистически значимых различий не было (р > 0,05). Симптомы накопления/ опорожнения при заполнении IPSS1 / IPSS2, а также результаты по шкалам качества жизни статистически не различались (р > 0,05).
При сравнении итогов опроса по трём шкалам установлены результаты, аналогичные с I группой (р < 0,05). При отдельном сравнении симптомов накопления и опорожнения VPSS, с IPSS1, IPSS2 статистически значимых различий не было (р > 0,05). Симптомы накопления/ опорожнения при заполнении IPSS1 / IPSS2, а также результаты по шкалам качества жизни статистически не различались (р > 0,05).
В III группе (n = 16) после анкетирования VPSS в 75% (n = 12) случаев преобладала умеренная степень выраженности СНМП, в 25% (п = 4) — лёгкая степень. Тяжёлой степени нарушений мочеиспускания не было (рис. 6).
Рисунок 6. Степени выраженности СНМП по опросникам VPSS, IPSS1, IPSS2 в III группе
Figure 6. The severity of LUTS according to VPSS, IPSS1, IPSS2 questionnaires in III group
При самостоятельном заполнении валидного опросника (IPSS1 в 56,25% (n = 9) случаев преобладала умеренная, в 31,25% (n = 5) — лёгкая, в 12,50% (n = 2) — тяжёлая степень нарушений мочеиспускания (рис. 5). После заполнения анкеты с врачом умеренная и лёгкая степени нарушений отмечены в 68,75% (n = 11) и в 31,25% (n = 5), соответственно. Тяжёлую степень СНМП не отмечали (рис. 6).
5). После заполнения анкеты с врачом умеренная и лёгкая степени нарушений отмечены в 68,75% (n = 11) и в 31,25% (n = 5), соответственно. Тяжёлую степень СНМП не отмечали (рис. 6).
Как представлено на рисунке 7, при сопоставлении IPSS1 / IPSS2 в 12,50% (n = 2) случаев отмечены расхождения результатов оценки степени СНМП. Различия по оценке VPSS / IPSS1 составили 25% (n = 4), по VPSS / IPSS2 — 12,50% (n = 2) (рис. 7).
Рисунок 7. Сравнение результатов опросников IPSS1 / IPSS2, VPSS / IPSS1, VPSS / IPSS2 в III группе
Figure 7. Comparison of the results of questionnaires IPSS1 / IPSS2, VPSS / IPSS1, VPSS / IPSS2 in group III
При сравнении результатов опросника IPSS, заполненного самостоятельно и вместе с помощником, в третьей группе пациентов статистически значимых различий не выявлено. Различия уровней признаков по результатам опросников VPSS c IPSS1 и IPSS2 были статистически недостоверны (р > 0,05). При оценке результатов по шкалам качества жизни, статистически значимых различий во всех группах не выявлено (р > 0,05).
Обсуждение
Симптомы нижних мочевыводящих путей в совокупности представляют собой достаточно частое проявление среди мужчин, особенно в пожилом возрасте. Известно, что проявления СНМП в значительной степени влияют на повседневную жизнь пациентов.
Регламентированы стандартные инструменты для оценки мнения пациентов о степени тяжести нарушений мочеиспускания, в частности наиболее используемая международная шкала симптомов простаты. Несмотря на популярность данного опросника у медицинских специалистов урологического профиля, данные о частоте проявлений отдельных симптомов у пациентов с гиперплазией предстательной железы немногочисленны. Опросник отражает лишь субъективные суждения о выраженности СНМП, что во многом различается с объективной оценкой клинической ситуации и не позволяет специалисту быть объективным [11].
Восприятие пациентами своего патологического состояния во многом определяется их культурными, религиозными и ментальными особенностями. Вопросы влияния ментального статуса пациента на особенности заполнения опросника нарушений мочеиспускания изучены в работах прошлых лет. Так, в 2012 году M. Rom et al. отмечали важность учета ментальных изменений у пациентов с СНМП, для характеристики которых использовали известную шкалу депрессии Бека (Beck Depression Inventory, BDI) [12]. подобная зависимость была отмечена и другими учеными.
В 2015 году доложены итоги популяционного исследования по анкетированию пациентов с СНМП с использованием IPSS и корейской версии шкалы депрессии Центра эпидемиологических исследований (CES-D-K), с пороговой оценкой выраженной депрессии свыше 16 баллов [13]. Выявлена положительная корреляция между депрессивными симптомами, тяжестью СНМП (p < 0,001). В результате было сделано заключение о том, что тяжесть СНМП, как правило, сопутствует риску депрессии, в сравнении со случаями более легких нарушений мочеиспускания. В последующих исследованиях гипотеза о взаимосвязи периодов депрессии с выраженностью нарушений мочеиспускания у мужчин пожилого возраста получила дополнительное подтверждение в работах учёных Южной Кореи [14] и Тайваня [15].
Адекватность восприятия престарелым пациентом клинической симптоматики, обусловленной СНМП, признана важным показателем [16]. Удовлетворённость пациентов проведённым курсом лечения и динамикой клинической симптоматики, признаётся важными составляющими эффективности, выбранной врачом тактики и даже выбранного метода операции. Эти показатели позволяют руководителям медицинских организаций, фармацевтических компаний и разработчикам клинических рекомендаций наиболее адекватно оценивать качество медицинской помощи с учётом ожиданий и предпочтений пациентов.
По мере того, как расширяется спектр вариантов лечения, оценка восприятия валидных шкал пожилым мужчиной с наличием сопутствующей патологии, естественным страхом возрастных заболеваний и наступления смерти представляется актуальным направлением. При этом качественное междисциплинарное взаимодействие врача-уролога и врача-психиатра (или психоаналитика) у мужчин с нарушением мочеиспускания, приобретает особую роль.
В отечественной медицинской литературе подобным вопросам в условиях контроля СНМП у мужчин пожилого возраста внимание уделяется крайне редко. В клинической практике направления уролого-психиатрического (или «психо-урологического») взаимодействия развиты преимущественно в области нарушений мужской сексуальной сферы. Это побудило авторов развить тему клинической оценки результатов анкетирования возрастных мужчин, и подобные исследования стоит продолжать
Выводы
- При заполнении опросника VPSS у мужчин с деменцией выявлено достоверно максимальное числом совпадений степени выраженности СНМП с опросником IPSS, заполненным при участии лечащего врача, что, возможно, является свидетельством сложности понимания вопросов оценки тяжести СНМП данной категорией больных.
- Несовпадение степени тяжести нарушений мочеиспускания у пациентов, включенных в исследование, свидетельствует о недостаточно полном понимании поставленных клиницистом вопросов, что может привести к избыточной оценке выраженности СНМП, что в свою очередь может негативно сказаться на выборе лечебной тактики.
- У мужчин без когнитивных нарушений могут в одинаково равной мере использоваться опросники VPSS и Частота несовпадения степени выраженности СНМП у респондентов этой группы является минимальной, что свидетельствует об адекватном уровне понимания предлагаемых вопросов.
Можно полагать, что применение опросника визуальной оценки симптомов заболеваний простаты (VPSS) наиболее целесообразно у мужчин с когнитивными нарушениями и с клинической картиной деменции. Оценка качества жизни пациентов с нарушенным мочеиспусканием не определяется когнитивным статусом пациента и, вероятно, нуждается в дополнительном междисциплинарном изучении.
1. Гаджиева З.К., Газимиев М.А., Аляев Ю.Г., Киндаров З.Б. Функциональное состояние нижних мочевыводящих путей у мужчин с инфравезикальной обструкцией. Уральский медицинский журнал. 2018;164(9):43-51. eLIBRARY ID: 36369920
2. Magistro G, Chapple CR, Elhilali M, Gilling P, McVary KT, Roehrborn CG, Stief CG, Woo HH, Gratzke C. Emerging Minimally Invasive Treatment Options for Male Lower Urinary Tract Symptoms. Eur Urol. 2017;72(6):986-997. https://doi.org/10.1016/j.eururo.2017.07.0053. Lee SWH, Chan EMC, Lai YK. The global burden of lower urinary tract symptoms suggestive of benign prostatic hyperplasia: A systematic review and meta-analysis. Sci Rep. 2017;7(1):7984. https://doi.org/10.1038/s41598-017-06628-8
4. Аполихин О.И., Комарова В.А., Никушина А.А., Сивков А.В. Болезни предстательной железы в Российской Федерации: статистические данные 2008-2017 гг. Экспериментальная и клиническая урология. 2019;(2):4-13. https://doi.org/10.29188/2222-8543-2019-11-2-4-12
6. Старцев В.Ю., Дударев В.А. Факторы прогноза развития нарушений мочеиспускания при гиперплазии предстательной железы у мужчин пожилого возраста. Урология. 2018;(6):150-154. https://doi.org/10.18565/urology.2018.6.150-154
7. Netto Junior NR, de Lima ML. The influence of patient education level on the International Prostatic Symptom Score. J Urol. 1995;154(1):97-9. https://doi.org/10.1097/00005392-199507000-00034
8. MacDiarmid SA, Goodson TC, Holmes TM, Martin PR, Doyle RB. An assessment of the comprehension of the American Urological Association Symptom Index. J Urol. 1998;159(3):873-4. PMID: 94741729. van der Walt CL, Heyns CF, Groeneveld AE, Edlin RS, van Vuuren SP. Prospective comparison of a new visual prostate symptom score versus the international prostate symptom score in men with lower urinary tract symptoms. Urology. 2011;78(1):17-20. https://doi.org/10.1016/j.urology.2011.01.065
10. Ceylan Y, Gunlusoy B, Degirmenci T, Kozacioglu Z, Bolat D, Minareci S. Is new visual prostate symptom score useful as International Prostate Symptom Score in the evaluation of men with lower urinary tract symptoms? A prospective comparison of 2 symptom scores in Turkish society. Urology. 2015;85(3):653-7. https://doi.org/10.1016/j.urology.2014.10.057
11. Gannon K, Glover L, O’Neill M, Emberton M. Lower urinary tract symptoms in men: self-perceptions and the concept of bother. BJU Int. 2005;96(6):823-7. https://doi.org/10.1111/j.1464-410X.2005.05720.x
12. Rom M, Schatzl G, Swietek N, Rucklinger E, Kratzik C. Lower urinary tract symptoms and depression. BJU Int. 2012;110(11 Pt C):E918-21. https://doi.org/10.1111/j.1464-410X.2012.11552.x
13. 1Jeong WS, Choi HY, Nam JW, Kim SA, Choi BY, Moon HS, Kim KS. Men With Severe Lower Urinary Tract Symptoms Are at Increased Risk of Depression. Int Neurourol J. 2015;19(4):286-92. https://doi.org/10.5213/inj.2015.19.4.286
14. Rhee SJ, Kim EY, Kim SW, Kim SH, Lee HJ, Yoon DH, Ahn YM. Longitudinal study of the relationship between lower urinary tract symptoms and depressive symptoms. J Psychosom Res. 2019;116:100-105. https://doi.org/10.1016/j.jpsychores.2018.11.01515. Huang CL, Wu MP, Ho CH, Wang JJ. The bidirectional relationship between anxiety, depression, and lower urinary track symptoms: A nationwide population-based cohort study. J Psychosom Res. 2017;100:77-82. https://doi.org/10.1016/j.jpsychores.2017.07.008
16. Castellini G, Wu FC, Finn JD, O’Neill TW, Lean ME, Pendleton N, Rastrelli G, Rutter MK, Gacci M, Ricca V, Maggi M; EMAS Study Group. Interactions Between Depression and Lower Urinary Tract Symptoms: The Role of Adverse Life Events and Inflammatory Mechanisms. Results From the European Male Ageing Study. Psychosom Med. 2016;78(6):758-69. https://doi.org/10.1097/PSY.0000000000000328
Когнитивные нарушения и когнитивный резерв, их взаимосвязи с поведенческими особенностями у пациентов с вирусом иммунодефицита человека во время госпитализации | Кольцова
1. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. М.: Практическая медицина; 2018.
2. ВИЧ-инфекция и СПИД: клинические рекомендации. Под ред. В.В.Покровского. М.: ГЭОТАРМедиа. 2019.
3. Кольцова О.В., Сафонова П.В., Рыбников В.Ю. Психологические трудности пациентов, инфицированных вирусом иммунодефицита человека, при подготовке к антиретровирусной терапии. Журнал инфектологии. 2019;11(4):85-91.
4. Леонова О.Н., Степанова Е.В., Беляков Н.А. Тяжелые коморбидные состояния больных с ВИЧ-инфекцией: анализ неблагоприятных исходов. ВИЧ-инфекция и иммуносупрессии. 2017;9(1):55-65. doi: 10.22328/2077-9828-2017-9-1-55-64
5. Мельницкая Т.Б., Рыбников В.Ю., Белых Т.В. Психологическая концепция культуры безопасности жизнедеятельности населения радиоактивно загрязненных территорий. Монография. СПб.: Политехника-Сервис; 2014.
6. Попов В.В., Новикова И.А. Психологические основы здоровья человека: учебное пособие. СПб.: СпецЛит; 2017.
7. Стресс, выгорание, совладание в современном контексте. Под ред. А.Л. Журавлева, Е.А. Сергиенко. М.: Изд-во «Институт психологии РАН»; 2011.
8. Стрижицкая О.Ю. Когнитивный резерв как психологический и психофизиологический ресурс в период старения. Вестник СПбГУ. Сер.16. Психология. Педагогика. 2016;2:79-87. DOI:10.21638/11701/spbu16.2016.209
9. Стрижицкая О.Ю., Харитонова Т.С. Когнитивный резерв и психологическое благополучие: сравнительный анализ жителей Санкт-Петербурга и Нижнего Новгорода. Интернет-журнал «Мир науки», 2018;6(6). https://mir-nauki.com/PDF/133PSMN618.pdf (доступ свободный).
10. Хритинин Д.Ф., Новиков В.В. Психические расстройства при ВИЧ-инфекции в XXI веке. М.: Изд-во БИНОМ; 2016.
11. Nucci M, Mapelli D, Mondini S. The cognitive Reserve Questionnaire (CRIq): a new instrument for measuring the cognitive reserve. Aging clinical and experimental research. 2011;(3):218-226. DOI: 10.3275/7800
12. Remien RH; Stirratt MJ; Nguyen N; Robbins RN; Pala AN; Mellins CA. Mental health and HIV/ AIDS: the need for an integrated response. AIDS 2019;33:1411-1420. doi:10.1097/QAD.0000000000002227
13. Toussaint A, Murray AM, Voigt K, Herzog A, Gierk B, Kroenke K, Rief W, Henningsen P, Löwe B. Development and Validation of the Somatic Symptom Disorder–B Criteria Scale (SSD-12). Psychosomatic Medicine. 2016;78(1):5-12. doi: 10.1097/PSY.0000000000000240
плазма, эритроциты, моча» (КПЭМ) для неинвазивной оценки состояния гомеостаза калия у пациентов
Верифицированная комплексная шкала «Калий: плазма, эритроциты, моча» (КПЭМ) для неинвазивной оценки состояния гомеостаза калия у пациентов
О.А. Громова, Е.Ю. Егорова, И.Ю. Торшин, Н.В. Юдина
1 ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России 2 ФГБУ ФИЦ Информатики и Управления РАН, г. Москва 3 ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», г. Москва
На основе анализа выборки пациентов (n=345, 50% мужчин) получена и верифицирована комплексная балльная шкала «Калий: плазма, эритроциты, моча» (КПЭМ). Шкала КПЭМ позволяет проводить неинвазивную оценку уровней калия в плазме крови, эритроцитах и моче пациентов на основе наблюдаемой симптоматики, данных анамнеза и опроса пациентов. На независимой контрольной выборке (n=175) установлено существование достоверных корреляций между экспериментально определенными уровнями калия и оценками, полученными по шкале КПЭМ. Использование предлагаемой шкалы позволяет оценить состояние калиевого гомеостаза пациента еще до проведения клинико-лабораторных анализов соответствующих биосубстратов.
Литература
Об авторах / Для корреспонденции
Ольга Алексеевна Громова, д.м.н., профессор кафедры фармакологии ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России. Адрес: 153000, г. Иваново, Шереметевский пр., д. 8. Тел.: (4932) 41-65-25. Г.н.с. ФГБУ ФИЦ Информатики и Управления РАН. Адрес: 119333, г. Москва, ул. Вавилова, д. 40. Тел.: (499) 135-24-89. E-mail: [email protected]
Евгения Юрьевна Егорова, к.м.н., доцент кафедры безопасности жизнедеятельности и общемедицинских знаний ФГБОУ ВО «Ивановский государственный университет», докторант кафедры фармакологии ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России. Адрес: 153025, г. Иваново, ул. Ермака, д. 39. Тел.: (4932) 37-01-57. Е-mail: [email protected]
Иван Юрьевич Торшин, к.ф-м.н., с.н.с. ФГБУ ФИЦ Информатики и Управления РАН. Адрес: 119333, г. Москва, ул. Вавилова, д. 40. Тел.: (499) 135-24-89
Наталья Владимировна Юдина, главный врач санатория-профилактория Ивановского государственного университета. Адрес: 153025, г. Иваново, ул. Ермака, д. 39. Тел.: (4932) 32-62-10
Мария Андреевна Сорокина, ординатор кафедры внутренних болезней, факультет фундаментальной медицины, МГУ им. М.В. Ломоносова. Адрес: 119192, г. Москва, Ломоносовский пр., д. 27, корп. 1. Тел.: (495) 932-88-14
Похожие статьи
Монреальская Когнитивная Оценка (тест МоСА) для диагностики болезни Альцгеймера и других видов деменции (слабоумия)
Вопрос обзора
Мы рассмотрели доказательства о точности теста Монреальской Когнитивной Оценки (МоСА) для диагностики деменции и ее подтипов.
Актуальность
Деменция является распространенным состоянием у пожилых людей, которой страдают по меньшей мере 7% людей в возрасте старше 65 лет в Великобритании, и число их растет по всему миру. В этом обзоре, мы хотели выяснить, действительно ли с помощью признанного когнитивного теста MoCA, можно точно определить деменцию по сравнению с золотым стандартом диагностического теста. Тест МоСА использует серии вопросов, чтобы проверить различные аспекты психического функционирования.
Характеристика исследований
Доказательства актуальны по август 2012 года. Мы нашли семь исследований, которые соответствовали нашим критериям. Три исследования были из клиник памяти (специализированные клиники, куда люди направляются при подозрении на деменцию), два — из клиник общего профиля, ни одного — из первичной медицинской помощи, и два исследования были проведены в домашних условиях (среди общего населения). Все исследования, включали пожилых людей, с самым молодым средним возрастом 61 год в одном исследовании. В общей сложности во все 7 исследований было включено 9422 человек, хотя только в одном исследовании было более 350 человек.
Доля людей с деменцией составила от 5% до 10% в двух исследованиях на уровне популяции, и от 22% до 54% — в пяти исследованиях на базе клиник. Был большой разброс в том, как различные исследования проводились: поэтому мы решили представить результаты в описательном виде, потому что в статистической сводке (объединении всех оценок в единый свод по чувствительности и специфичности) не было бы смысла.
Основные результаты
Мы обнаружили, что тест МоСА был хорош в выявлении деменции при использовании признанного уровня отсечения по баллам — менее 26 баллов. В исследованиях, в которых использовали этот уровень отсечения, мы обнаружили, что этот тест правильно выявил более 94% людей с деменцией в любых условиях. С другой стороны, тест также дал высокую долю ложно-позитивных случаев, то есть лиц, которые не имели деменцию, но дали положительный результат при уровне отсечения «ниже, чем 26». В исследованиях, которые мы рассмотрели, более 40% людей, не имеющих деменцию, были бы неправильно диагностированы (поставлен диагноз) как страдающие деменцией при использовании теста МоСА.
Выводы
В целом качество исследований не было достаточно хорошим, чтобы сделать четкие рекомендации по использованию теста MoCA для диагностики деменции в различных медицинских учреждениях. В частности, ни одно из исследований не изучало, насколько полезна МоСА для диагностики деменции в учреждениях первичной медицинской помощи. Вполне вероятно, что порог отсечения по МоСА ниже 26 будет более полезным для оптимальной диагностической точности при деменции, хотя это требует более широкого подтверждения.
Монреальская шкала оценки когнитивных функций при динамическом применении способна выявлять обратимые когнитивные нарушения у пациентов с транзиторной ишемической атакой и малыми инсультами
Рутинная оценка когнитивных функций после транзиторной ишемической атаки или малого инсульта полезна для определения способности восстановления повседневной активности
Когнитивные нарушения, возникающие после ишемического инсульта, как правило, остаются незамеченными. Такие нарушения обычно возникают остро и чаще выявляются у пациентов с транзиторными и слабо выраженными неврологическими нарушениями.
Авторы из Канады провели исследование с целью проверки гипотезы о преходящем характере когнитивных нарушений и восстановлении функций после перенесённых транзиторных ишемических атак (ТИА) или малого инсульта. Результаты исследования были опубликованы в журнале «Stroke».
Для подтверждения этой гипотезы проводилась динамическая оценка когнитивных функций у пациентов с ТИА и малыми инсультами. Для исследования отбирали пациентов с ТИА/малым инсультом без когнитивных нарушений в анамнезе, поступивших с баллом по шкале NIHSS в первые 72 часа не более 3). На 1, 7, 30 и 90 сутки пациенты оценивались с помощью краткой шкалы оценки психического статуса (MMSE — Mini-Mental State Examination) и монреальской шкалы оценки когнитивных функций (MoCA — Montreal Cognitive Assessment). Наличие когнитивных нарушений фиксировалось в случае оценки по MoCA менее 26 и по MMSE не более 26.
В исследование включили 100 пациентов с медианой (интерквартильный интервал) балла по шкале NIHSS 1 (2) и медианой возраста 68 (20) лет. При поступлении медиана балла по шкале MoCA (26 [4]) был ниже, чем по шкале MMSE (29 [2]; p<0,0001). Когнитивные нарушения выявлялись у 54 из 100 пациентов (54%) при оценке шкалой MoCA и у 16 из 100 (16%, p=0,001) шкалой MMSE. Показатели по MoCA улучшились на 7 день (27 [5]), 30 (28 [2]) и 90 (28 [2]; p<0,0001) день. Регресс когнитивных нарушений был обусловлен регрессом нарушений памяти.
Таким образом, при ТИА/малых инсультах острое временное нарушение когнитивных функций является частым явлением. Чувствительной шкалой для оценки этих изменений является MoCA, но не MMSE. Рутинная оценка когнитивных функций после ТИА/малого инсульта может быть полезной для определения способности восстановления повседневной активности при отсутствии другой неврологической симптоматики.
MoCA Montreal — Когнитивная оценка
Когда пациент начинает испытывать потерю памяти и другие формы когнитивного снижения, это может быть стрессовым, неопределенным и тяжелым временем для всех участников, от пациента до его семьи, друзей, опекунов и даже медицинских работников. Независимо от того, какова причина когнитивных нарушений, важно быстро выяснить, как это влияет на когнитивные функции человека, чтобы можно было разработать соответствующий план лечения.Здесь на помощь приходит MoCA — наш простой инструмент для диагностики пациентов и определения соответствующего плана последующего наблюдения и лечения. Благодаря способности оценивать несколько когнитивных областей, тест MoCA является проверенным и полезным инструментом когнитивного скрининга многих заболеваний, в том числе:
Болезнь Альцгеймера
Болезнь Паркинсона
Болезнь Хантингтона
Тело Леви
VCI / ход
Лобно-височная деменция
Метастазы в мозг
ALS
Расстройство сна
Опухоли головного мозга
Рассеянный склероз
Травма головы
Депрессия
Шизофрения
Сердечная недостаточность
Злоупотребление психоактивными веществами
ВИЧ
И более
Монреальский когнитивный тест (MoCA) на деменцию
Монреальская когнитивная оценка (MoCA) — это краткий тест из 30 вопросов, который занимает от 10 до 12 минут и помогает оценить людей на предмет деменции.Он был опубликован в 2005 году группой из Университета Макгилла, которая несколько лет работала в клиниках памяти в Монреале.
Вот посмотрите, что включает в себя MoCA, как он оценивается и интерпретируется и как он может помочь в выявлении деменции.
Веривелл / Брианна ГилмартинОценка
MoCA оценивает различные типы когнитивных способностей. К ним относятся:
- Ориентация : Администратор тестирования просит вас указать дату, месяц, год, день, место и город.
- Кратковременная память / отложенный вызов : Читается пять слов, тестируемого просят повторить их, их снова читают и просят повторить еще раз. После выполнения других задач человека просят повторить каждое из пяти слов еще раз и дают подсказку категории, к которой принадлежит слово, если он не может вспомнить их без подсказки.
- Исполнительная функция / зрительно-пространственные способности : Эти две способности оцениваются с помощью теста Trails B, который требует, чтобы вы нарисовали линию для правильного упорядочивания чередующихся цифр и чисел (1-A, 2-B и т. Д.) и с помощью задачи, которая требует от вас нарисовать копию формы куба.
- Знание языков: Это задание состоит из правильного повторения двух предложений и последующего перечисления всех слов, которые можно вспомнить и начинающихся с буквы «F».
- Абстракция : Вас просят объяснить, чем похожи два предмета, например поезд и велосипед. Это измеряет ваше абстрактное мышление, которое часто нарушается при деменции. Тест интерпретации пословиц — еще один способ проверить навыки абстрактного мышления.
- Присвоение имен животным: Показаны три изображения животных, и человека просят назвать каждое из них. В основном это используется для проверки беглости.
- Внимание: Тестируемого просят повторить ряд чисел вперед, а затем другой ряд назад, чтобы оценить внимание.
- Тест на рисование часов : В отличие от мини-экзамена на умственное состояние (MMSE), который не включает тест рисования часов, MoCA просит человека, которого оценивают, нарисовать часы, которые показывают десять минут одиннадцатого.
Для точности важно, чтобы этот тест проводился на родном языке пациента.
Подсчет очков
Оценки по шкале MoCA варьируются от нуля до 30, при этом 26 и выше обычно считаются нормальными.
В первоначальных данных исследования, устанавливающих MoCA, нормальный контроль имел средний балл 27,4 по сравнению с 22,1 у людей с легкими когнитивными нарушениями (MCI) и 16,2 у людей с болезнью Альцгеймера.
Распределение оценок выглядит следующим образом:
- Визуально-пространственное и исполнительное функционирование: 5 баллов
- Наименование животных: 3 балла
- Внимание: 6 баллов
- Язык: 3 балла
- Абстракция: 2 балла
- Отложенный отзыв (кратковременная память): 5 баллов
- Ориентация: 6 баллов
- Уровень образования: к результату экзаменуемого добавляется 1 балл, если у него 12 или менее лет формального образования.
Полезность
MoCA — это относительно простой краткий тест, который помогает медицинским работникам быстро определить, есть ли у человека аномальные когнитивные функции, и может потребоваться более тщательное диагностическое обследование болезни Альцгеймера.
Он может помочь предсказать деменцию у людей с легкими когнитивными нарушениями (MCI), и, поскольку он проверяет управляющую функцию, он более чувствителен в этом отношении, чем MMSE. Наконец, было показано, что он лучше выявляет когнитивные проблемы у людей с болезнью Паркинсона. болезнь.
Преимущества против недостатков
Преимущества MoCA включают его краткость, простоту и надежность в качестве скринингового теста на болезнь Альцгеймера. Кроме того, он измеряет важный компонент деменции, который не измеряется с помощью MMSE, а именно исполнительную функцию.Кажется, он хорошо работает при деменции, вызванной болезнью Паркинсона, и, в отличие от MMSE, он бесплатен для некоммерческого использования.
Следует отметить, что MoCA доступен более чем на 35 языках, а также существует слепой тест MoCA Test Blind, который позволяет проводить когнитивное тестирование для людей с нарушениями зрения.
Недостатком MoCA является то, что для его проведения требуется немного больше времени, чем MMSE, и, как и многие другие скрининги, его следует сочетать с множеством других скринингов и тестов для точного выявления и диагностики деменции.
Слово Verywell
Знание того, что включает в себя MoCA и как он оценивается, может помочь вам лучше понять его результаты для вас или вашего любимого человека. Помните также, что MoCA, хотя и полезен для выявления когнитивных проблем, должен сочетаться с несколькими другими оценками, проводимыми врачом, чтобы полностью оценить умственное функционирование и определить возможные причины потери памяти.
Монреальский когнитивный тест | База данных RehabMeasures
Библиография
Bezdicek, O., Майерова, В., Новак, М., Николай, Т., Ружичка, Э., и Рот, Дж. (2013). Достоверность Монреальского когнитивного теста для выявления когнитивной дисфункции при болезни Хантингтона. Применяется
Нейропсихология: Взрослый, 20, 33-40. DOI: 10.1080 / 09084282.2012.670158
Брюйнен, К. Дж. У. Х., Янсен, М., Дейкстра, Б. А. Г., Вальвоорт, С. Дж. В., Лугтмейер, С., Маркус, В., Йонг, К. А. Дж. Д., и Кесселс, Р. П. С. (2019). Монреальская когнитивная оценка (MoCA) как когнитивный экран в лечении наркозависимости: валидационное исследование для клинической практики. Журнал использования веществ , 24 (1), 47–54. https://doi.org/10.1080/14659891.2018.1497102
Карсон, Н., Лич, Л., и Мерфи, К. Дж. (2017). Пересмотр пороговых значений Монреальской когнитивной оценки (MoCA). Международный журнал гериатрической психиатрии , 33 (2), 379–388. DOI: 10.1002 / gps.4756
Чоу, К. Л., Амик, М. М. и др. (2010). «Рекомендуемая шкала когнитивного скрининга в клинических испытаниях болезни Паркинсона.»Двигательные расстройства 25 (15): 2501-2507.
Камминг, Т. Б., Лоу, Д., Линден, Т., и Бернхард, Дж. (2018). Данные AVERT MoCA: оценка надежности в большом многоцентровом исследовании. Оценка , 1073191118771516. https://doi.org/10.1177/1073191118771516
Dalrymple-Alford, J., MacAskill, M., et al. (2010). «MoCA Хорошо подходящий скрининг когнитивных нарушений при болезни Паркинсона». Неврология 75 (19): 1717-1725.
Эверт, В., Пеллетье, С., Аларкон, Р., Налпас, Б., Доннадье-Риголе, Х., Труйе, Р., и Перни, П. (2017). Определение показателя отсечения MoCA у пациентов с расстройствами, связанными с употреблением алкоголя. Алкоголизм: клинические и экспериментальные исследования, 42 (2), 403–412. DOI: 10.1111 / acer.13547
Фазели П. Л., Казалетто К. Б., Паолилло Э., Мур Р. К., Мур Д. Дж. И группа HNRP. (2017). Скрининг нейрокогнитивных нарушений у ВИЧ-инфицированных взрослых в возрасте 50 лет и старше: Монреальская когнитивная оценка связана с ежедневным функционированием, о котором сообщают сами пациенты, и оценивается клиницистами. Журнал клинической и экспериментальной нейропсихологии , 39 (9), 842–853. https://doi.org/10.1080/13803395.2016.1273319
Фини, Дж., Савва, Г. М., О’Реган, К., Кинг-Каллиманис, Б., Кронин, Х. и Кенни, Р. А. (2016). Ошибка измерения, надежность и минимальное обнаруживаемое изменение в Кратком экзамене по психическому состоянию, Монреальском когнитивном тесте и тесте по цветовым следам среди людей среднего и пожилого возраста. Журнал болезни Альцгеймера , 53 (3), 1107-1114.
Гилл Д. Дж., Фрешман А. и др. (2008). «Монреальская когнитивная оценка как инструмент скрининга когнитивных нарушений при болезни Паркинсона». Mov Disord 23 (7): 1043-1046.
Гольдштейн, Ф. К., Эшли, А. В., Миллер, Э., Алексеева, О., Зандерс, Л., и Кинг, В. (2014). Валидность Монреальского когнитивного теста как скрининга легких когнитивных нарушений и деменции у афроамериканцев. Журнал гериатрической психиатрии и неврологии , 27 (3), 199–203.https://doi.org/10.1177/0891988714524630
Hoops, S., Nazem, S., et al. (2009). «Валидность MoCA и MMSE в выявлении MCI и деменции при болезни Паркинсона». Неврология 73 (21): 1738-1745.
Клетцель, С. Л., Эрнандес, Дж. М., Мискель, Э. Ф., Маллинсон, Т., и Папе, Т. Л.-Б. (2017). «Оценка эффективности Монреальской когнитивной оценки на ранней стадии болезни Паркинсона». Паркинсонизм и связанные с ним расстройства , 37 , 58–64.DOI: 10.1016 / j.parkreldis.2017.01.012
Коски, Л. (2013). Валидность и применение Монреальской когнитивной оценки для оценки сосудистых когнитивных нарушений. Цереброваскулярное заболевание , 36, 6-13. DOI: 10.1159 / 000352051
Лам Б., Миддлтон Л. Э., Мазеллис М., Стасс Д. Т., Гарри Р. Д., Кисс А. и Блэк С. Е. (2013). Критерий и конвергентная валидность Монреальской когнитивной оценки со скринингом и стандартизированным нейропсихологическим тестированием. Журнал Американского гериатрического общества , 61 (12), 2181–2185. https://doi.org/10.1111/jgs.12541
Малек-Ахмади, М., Пауэлл, Дж. Дж., Белден, К. М., О’Коннор, К., Эванс, Л., Кун, Д. В., и Ниери, В. (2015). Нормативные данные с поправкой на возраст и уровень образования для Монреальской когнитивной оценки (MoCA) для пожилых людей в возрасте 70–99 лет. Старение, нейропсихология и познание , 22 (6), 755–761. https://doi.org/10.1080/13825585.2015.1041449
МакЛеннан, С.Н., Матиас, Дж. Л., Бреннан, Л. С., и Стюарт, С. (2011). Валидность Монреальской оценки (MoCA) в качестве скринингового теста на легкое когнитивное нарушение (MCI) у сердечно-сосудистой популяции. Журнал гериатрической психиатрии и неврологии, 24 (1), 33-38 . DOI: 10.1177 / 08919887103
MoCA Montreal Cognitive Assessment (2019). ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ. Получено с https://www.mocatest.org/
.Насреддин З. С., Филлипс Н. А. и др. (2005). «Монреальская когнитивная оценка, MoCA: краткий инструмент для выявления умеренных когнитивных нарушений.»Журнал Американского гериатрического общества 53 (4): 695-699.
Назем С., Сидеровф А. Д. и др. (2009). «Показатели когнитивной оценки в Монреале у пациентов с болезнью Паркинсона с« нормальным »глобальным познанием в соответствии с краткой оценкой оценки психического состояния». Журнал Американского гериатрического общества 57 (2): 304-308.
Роальф, Д. Р., Моберг, П. Дж., Се, С. X., Волк, Д. А., Мёльтер, С. Т., и Арнольд, С. Е. (2013). Сравнительная точность двух стандартных инструментов скрининга для классификации болезни Альцгеймера, легких когнитивных нарушений и здорового старения. Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association , 9 (5), 529–537. https://doi.org/10.1016/j.jalz.2012.10.001
Роббен, С. Х., Слегерс, М. Дж. И др. (2010). «Пилотное исследование трехэтапного метода диагностики для молодых и старых пациентов с деменцией при болезни Паркинсона: скрининг, тест и затем диагностика». Международный журнал гериатрической психиатрии 25 (3): 258-265.
Россетти, Х. К., Лакриц, Л. Х. и др. (2011). «Нормативные данные для Монреальской когнитивной оценки (MoCA) в выборке на основе населения.»Неврология 77 (13): 1272-1275.
Smith, T., Gildeh, N., et al. (2007). «Монреальский когнитивный тест: достоверность и полезность в условиях клиники памяти». Канадский журнал психиатрии. Revue Canadienne de Psychiatrie 52 (5): 329-332.
Тиффин-Ричардс, ИП, Коста, А.С., Хольшбах, Б., Франк, Р.Д., Вассилиаду, А., Крюгер, Т., Куцк, К., Гросс, Т., Эйтнер, Ф., Флёге, Дж., Шульц, Дж. Б., и Ритц, К. (2014). Монреальский когнитивный тест (MoCA) — чувствительный инструмент скрининга для выявления когнитивных нарушений у пациентов, находящихся на хроническом гемодиализе. PLOS ONE , 9 (10), 1-9. https://doi.org/10.1371/journal.pone.0106700
Толья Дж., Фитцджеральд К. А. и др. (2011). «Краткое обследование психического состояния и Монреальская когнитивная оценка у лиц с легким подострым инсультом: взаимосвязь с функциональным результатом». Архивы физической медицины и реабилитации 92 (5): 792-798.
Янг, З., Абдул Рашид, Н.А., Фенг Квек, Ю., Лам, М., Мей Си, Ю., Маниам, Ю., Дауэлс, Дж., Лит Тан, Б., и Ли, Дж. ( 2018).«Монреальская когнитивная оценка как инструмент скрининга когнитивных нарушений при шизофрении». Schizophrenia Research, 199 . https://doi.org/10.1016/j.schres.2018.03.008
Zadikoff, C., Fox, S.H., et al. (2008). «Сравнение мини-экзамена на психическое состояние с когнитивной оценкой в Монреале для выявления когнитивных нарушений при болезни Паркинсона». Mov Disord 23 (2): 297-299.
Монреальский тест для оценки когнитивных функций (MoCA) на деменцию
Последнее обновление: 29 мая 2020 г.
Что такое MoCA?
Монреальский когнитивный тест — это тест из 30 вопросов, который определяет, есть ли у человека признаки деменции.Он не предназначен для постановки диагноза, но исследования показали, что он чрезвычайно надежен для прогнозирования того, будет ли у кого-то диагностирована болезнь Альцгеймера или другое слабоумие. Тест предназначен для проведения и оценки медицинским работником, который затем решит, нужны ли дополнительные тесты. Опять же, MoCA — это не диагностический инструмент, а скорее индикатор того, что требуются дополнительные тесты.
Ищете на дому тест на деменцию ? Некоторые из них доступны для скачивания здесь. 30 вопросов оценивают различные аспекты мышления, на которые влияет деменция:
— Ориентация: знание дня, даты и вашего текущего местоположения
— Кратковременная память: способность слышать слово и повторять его через короткое время
— Фокусировка и пространственное восприятие: последовательно соединяйте пронумерованные точки и рисуйте трехмерные фигуры
— Язык: способность говорить и понимать целые предложения и запоминать имена известных животных или предметов
— Концентрация: повторение простых последовательностей вперед и назад
— Тест рисования часов: известен для оценки предупреждающих знаков о деменции
Тест был создан в 2005 году исследователями из Университета Макгилла, работающими в Монреале с людьми, имеющими серьезные проблемы с памятью.Он не такой простой, как Mini-Cog, который состоит из одного упражнения на запоминание и теста рисования часов. Другой популярный тест, Краткий экзамен на психическое состояние, чаще используется исследователями, изучающими деменцию, но MoCA лучше определяет легкую (раннюю стадию) деменции, чем MMSE.
По сравнению с MMSE
Краткий экзамен на психическое состояние — это также тест из 30 вопросов для определения наличия у кого-либо признаков деменции. MMSE был изобретен в середине 1970-х, примерно на 30 лет раньше, чем MoCA, и используется чаще, чем MoCA в клинических кругах людьми, изучающими деменцию.Несмотря на то, что он хорошо справляется с проверкой тех же навыков мышления, что и MoCA, исследования показали, что MoCA лучше помогает выявлять легкую (раннюю) деменцию, чем MMSE.
По сравнению с SAGE
Самостоятельный герокогнитивный экзамен, как следует из названия, проводится самостоятельно. Это означает, что его можно принимать дома без помощи медицинского работника, хотя рекомендуется, чтобы тест оценивал врач. Это проще, чем MoCA, с меньшим количеством вопросов и меньше времени на заполнение.Если вы хотите решить дома, стоит ли спросить врача о признаках деменции, сесть и пройти тест SAGE — хороший способ начать. Получите МУДРЕЦ
По сравнению с Mini-Cog
Mini-Cog — это очень быстрый и базовый тест на признаки деменции, состоящий только из теста воспоминаний и теста рисования часов. Испытуемым говорят три несвязанных между собой слова, затем просят нарисовать часы, после чего они должны запомнить эти три слова. Mini-Cog прост и эффективен, но не настолько глубок.Кроме того, он не предоставляет столько информации врачам, которые делают следующие шаги к постановке диагноза.
Тестирование опекунаНекоторые тесты на деменцию должны сдавать лицо, осуществляющее уход, или член семьи, а не лицо, у которого есть подозрение на деменцию. Один из этих тестов, Modified CDR, быстрый, бесплатный и доступен в Интернете. Пройдите модифицированный тест CDR здесь.
Насколько точен MoCA?
Исследования показали, что MoCA примерно на 94 процента точно определяет, есть у человека деменция или нет.Это означает, что 94 процента людей с деменцией набрали менее 26 из 30 баллов по шкале MoCA (25 лет и младше считаются группой риска). Таким образом, MoCA является полезным и наиболее точным инструментом для выявления деменции.
Что особенно важно для людей, которые проходят тест, потому что они обеспокоены тем, что они могут находиться на самых ранних стадиях болезни Альцгеймера (или связанной с ней деменции), MoCA гораздо более эффективен для выявления легкого когнитивного нарушения (MCI), которое часто считается самой ранней стадией. деменции.Некоторые вопросы MoCA предназначены для проверки «исполнительной функции», то есть способности сосредотачиваться и рассуждать с помощью последовательной задачи. В одном разделе это означает переход от цифр к буквам и назад и вперед по порядку (1, A, 2, B и т. Д.). Если вам интересно, является ли повышенная забывчивость результатом болезни Альцгеймера или просто нормального старения, это означает, что лучший тест для прохождения теста на MoCA.
Помните, однако, что тест предназначен для проведения и оценки врачом. Если вы хотите пройти тест дома, SAGE точен и предназначен для проведения любимым человеком, а не медицинским работником.
Как взять MoCA
MoCA имеет официальный веб-сайт, где он продвигается как инструмент для медицинских работников, например врачей, который помогает диагностировать своих пациентов, у которых может быть деменция. Чтобы зарегистрироваться и пройти тест, вы должны быть квалифицированы. Таким образом, этот тест не предназначен для людей, которые могут проходить его дома, если они не живут с медсестрой, терапевтом, неврологом или другим медицинским работником, который был обучен проводить тест и оценивать его. Официальная версия теста фактически не будет доступна после сентября 2020 года для тех, кто не получил надлежащую сертификацию, согласно организации MoCA.
Несмотря на это, настоящий тест можно найти в Интернете сегодня. Хорошая (неофициальная) ссылка здесь. Хотя не рекомендуется проводить тест дома, прямо на тесте есть инструкции. Проблема для любого, кто хочет пройти MoCA дома без сертифицированного надзора, заключается в том, что некоторые его части должны быть заполнены голосом, в то время как другие разделы требуют письменных принадлежностей. Тестируемому придется писать или рисовать в одних разделах, не видя других, несмотря на то, что весь тест занимает одну страницу.
Домашние альтернативы MoCAЛюбой, кто хочет пройти тест на дому, должен пройти тест SAGE или Mini-Cog с помощью друга или любимого человека. Даже MMSE можно проводить дома, хотя это не рекомендуется. Чтобы пройти MoCA, позвоните своему лечащему врачу. Может потребоваться направление к неврологу или другому квалифицированному специалисту по заболеваниям головного мозга.
Плюсы и минусы
Плюсы:
1. Высокая точность. Исследования показали, что MoCA правильно определяет деменцию примерно в 94 процентах случаев.
2. Лучше для ранних стадий. Люди, которые находятся на ранних или легких стадиях деменции, могут иметь достаточно высокие баллы по другим тестам (включая краткий экзамен по психическому состоянию), чтобы они указывали на отсутствие деменции. Доказана эффективность MoCA для выявления деменции на ранней стадии или умеренного когнитивного нарушения (MCI).
3. Лучше при деменции Паркинсона. MoCA также лучше, чем MMSE, в том, что касается выявления у людей с болезнью Паркинсона признаков деменции, связанной с болезнью Паркинсона.
4. Относительно быстро, занимает от 10 до 15 минут.
Против
1. Должен назначаться и оцениваться медицинским работником, поэтому требуется прием медсестры, врача или терапевта — в отличие от SAGE и других тестов, которые можно сдать дома.
2. Не дает диагноза, поэтому перед постановкой диагноза его необходимо провести в паре с другими тестами, включая сканирование мозга и неврологическое обследование.
Улучшенная прогностическая способность Монреальской когнитивной оценки для диагностики деменции в исследовании на уровне сообщества | Исследование и терапия болезни Альцгеймера
Организация Объединенных Наций, Департамент по экономическим и социальным вопросам, Отдел народонаселения. Перспективы народонаселения мира: обзор 2010 г. Том I: подробные таблицы. Нью-Йорк: Организация Объединенных Наций; 2011. http://www.un.org/en/development/desa/population/publications/pdf/trends/WPP2010/WPP2010_Volume-I_Comprehensive-Tables.pdf. По состоянию на 20 октября 2015 г.
Hilal S, Ikram MK, Saini M, Tan CS, Catindig JA, Dong YH, et al. Распространенность когнитивных нарушений в Китае: эпидемиология деменции в исследовании Сингапура.J Neurol Neurosurg Psychiatry. 2013; 84: 686–92.
Артикул PubMed Google Scholar
Рокка В.А., Петерсен Р.С., Кнопман Д.С., Хеберт Л.Е., Эванс Д.А., Холл К.С. и др. Тенденции заболеваемости и распространенности болезни Альцгеймера, деменции и когнитивных нарушений в США. Демент Альцгеймера. 2011; 7: 80–93.
PubMed Central Статья PubMed Google Scholar
Prince M, Bryce R, Albanese E, Wimo A, Ribeiro W, Ferri CP. Глобальная распространенность деменции: систематический обзор и метаанализ. Демент Альцгеймера. 2013; 9: 63–75.e2.
Артикул PubMed Google Scholar
Jia J, Wang F, Wei C, Zhou A, Jia X, Li F и др. Распространенность деменции в городских и сельских районах Китая. Демент Альцгеймера. 2014; 10: 1–9.
Артикул PubMed Google Scholar
Hurd MD, Martorell P, Delavande A, Mullen KJ, Langa KM. Денежные издержки деменции в США. N Engl J Med. 2013; 368: 1326–34.
PubMed Central CAS Статья PubMed Google Scholar
Чжу К.В., Скармеас Н., Орнштейн К., Альберт М., Брандт Дж., Блэкер Д. и др. Использование и стоимость медицинских услуг для лиц, ухаживающих за деменцией: продольные результаты исследования Predictors Caregiver Study. Демент Альцгеймера. 2015; 11: 444–54.
Артикул PubMed Google Scholar
Кавамура Т., Умемура Т., Хотта Н. Когнитивные нарушения у пациентов с диабетом: может ли контроль диабета предотвратить снижение когнитивных функций? J. Исследование диабета. 2012; 3: 413–23.
PubMed Central Статья PubMed Google Scholar
Hughes CP, Berg L, Danziger WL, Coben LA, Martin RL. Новая клиническая шкала для определения стадии деменции.Br J Psychiatry. 1982; 140: 566–72.
CAS Статья PubMed Google Scholar
Morris JC. Рейтинг клинической деменции (CDR): текущая версия и правила оценки. Неврология. 1993; 43: 2412–4.
CAS Статья PubMed Google Scholar
Рейсберг Б., Феррис Ш., де Леон М. Дж., Крук Т. Глобальная шкала ухудшения состояния для оценки первичной дегенеративной деменции.Am J Psychiatry. 1982; 139: 1136–9.
CAS Статья PubMed Google Scholar
Folstein MF, Folstein SE, McHugh PR. «Мини-психическое состояние»: практический метод оценки когнитивного состояния пациентов для клинициста. J Psychiatr Res. 1975; 12: 189–98.
CAS Статья PubMed Google Scholar
Зеки Аль Хаззури А., Виттингхофф Э., Байерс А., Ковински К., Блейзер Д., Дием С. и др.Долгосрочное кумулятивное бремя депрессивных симптомов и риск снижения когнитивных функций и деменции у очень старых женщин. J Gerontol A Biol Sci Med Sci. 2014; 69: 595–601.
PubMed Central Статья PubMed Google Scholar
Мацумото А., Сато М., Кикуя М., Окубо Т., Хирано М., Иноуэ Р. и др. Повседневная изменчивость домашнего артериального давления связана со снижением когнитивных функций: исследование Охасамы. Гипертония. 2014; 63: 1333–8.
CAS Статья PubMed Google Scholar
Бэтти Г.Д., Ли К., Хаксли Р., Зунгас С., Тейлор Б.А., Нил Б. и др. Заболевания полости рта в связи с будущим риском деменции и снижения когнитивных функций: проспективное когортное исследование, основанное на исследовании Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified-Release Controlled Evaluation (ADVANCE). Eur Psychiatry. 2013; 28: 49–52.
PubMed Central Статья PubMed Google Scholar
Bos D, Vernooij MW, de Bruijn RF, Koudstaal PJ, Hofman A, Franco OH, et al. Атеросклеротический кальциноз связан с более высоким риском деменции и когнитивного снижения. Демент Альцгеймера. 2015; 11: 639–47.e1.
Артикул PubMed Google Scholar
Кеммерер Т. Влияние возраста и образования на результативность MMSE среди пожилых амбулаторных пациентов с задокументированным нарушением памяти [аннотация A-30]. Arch Clin Neuropsychol.2014; 29: 514.
Артикул Google Scholar
Насреддин З.С., Филлипс Н.А., Бедириан В., Шарбонно С., Уайтхед В., Коллин И. и др. Монреальская когнитивная оценка, MoCA: краткий инструмент для выявления умеренных когнитивных нарушений. J Am Geriatr Soc. 2005; 53: 695–9.
Артикул PubMed Google Scholar
Гил Л., Руис де Санчес К., Гиль Ф, Ромеро С. Дж., Претельт Бургос Ф.Подтверждение Монреальской когнитивной оценки (MoCA) на испанском языке в качестве инструмента скрининга легких когнитивных нарушений и легкой деменции у пациентов старше 65 лет в Боготе, Колумбия. Int J Geriatr Psychiatry. 2015; 30: 655–62.
Артикул PubMed Google Scholar
Йунг П.Й., Вонг Л.Л., Чан С.Ч., Леунг Дж.Л., Юнг С.Ю. Проверочное исследование гонконгской версии Монреальской когнитивной оценки (HK-MoCA) у китайских пожилых людей в Гонконге.Hong Kong Med J. 2014; 20: 504–10.
CAS PubMed Google Scholar
Фрейтас С., Симоес М.Р., Алвес Л., Сантана И. Монреальская когнитивная оценка: валидационное исследование для легких когнитивных нарушений и болезни Альцгеймера. Alzheimer Dis Assoc Disord. 2013; 27: 37–43.
Артикул PubMed Google Scholar
Цай К.Ф., Ли В.Дж., Ван С.Дж., Шиитская Британская Колумбия, Насреддин З., Фу Дж.Л.Психометрия Монреальской когнитивной оценки (MoCA) и ее подшкал: проверка тайваньской версии MoCA и анализ теории ответов на вопросы. Int Psychogeriatr. 2012; 24: 651–8.
Артикул PubMed Google Scholar
Fujiwara Y, Suzuki H, Yasunaga M, Sugiyama M, Ijuin M, Sakuma N, et al. Краткий инструмент для скрининга легких когнитивных нарушений у пожилых японцев: проверка японской версии Монреальской когнитивной оценки.Гериатр Геронтол Инт. 2010; 10: 225–32.
Артикул PubMed Google Scholar
Луис Калифорния, Киган А.П., Маллан М. Перекрестная проверка Монреальской когнитивной оценки в сообществе пожилых людей, проживающих на юго-востоке США. Int J Geriatr Psychiatry. 2009; 24: 197–201.
Артикул PubMed Google Scholar
Zhou S, Zhu J, Zhang N, Wang B, Li T, Lv X, et al.Влияние образования на китайскую версию Монреальской когнитивной оценки при обнаружении амнестических легких когнитивных нарушений у пожилых людей в сельской местности Пекина. Научный мир J. 2014; 2014: 689456.
Google Scholar
Kasai M, Meguro K, Nakamura K, Nakatsuka M, Ouchi Y, Tanaka N. Скрининг пациентов с очень легкой подкорковой сосудистой деменцией в возрасте 75 лет и старше с использованием Монреальской когнитивной оценки и мини-исследования психического состояния в сообществе : проект Курихара.Dement Geriatr Cogn Dis Extra. 2012; 2: 503–15.
PubMed Central Статья PubMed Google Scholar
Hsieh YC, Hung CT, Lien LM, Bai CH, Chen WH, Yeh CY, et al. Значительное снижение артериального давления благодаря программе семейного просвещения по вопросам питания среди жителей Тайваня. Public Health Nutr. 2009; 12: 570–7.
Артикул PubMed Google Scholar
Chou CC, Lien LM, Chen WH, Wu MS, Lin SM, Chiu HC, et al. Взрослые с хронической болезнью почек на поздней стадии 3 подвержены высокому риску распространенного тихого инфаркта мозга: популяционное исследование. Инсульт. 2011; 42: 2120–5.
Артикул PubMed Google Scholar
Rahman TT, El Gaafary MM. Монреальский когнитивный тест. Арабская версия: надежность и достоверность распространенности умеренных когнитивных нарушений среди пожилых людей, посещающих гериатрические клубы в Каире.Гериатр Геронтол Инт. 2009; 9: 54–61.
Артикул PubMed Google Scholar
Conti S, Bonazzi S, Laiacona M, Masina M, Coralli MV. Монреальский когнитивный тест (MoCA) — итальянская версия: нормы на основе регрессии и эквивалентные баллы. Neurol Sci. 2015; 36: 209–14.
Артикул PubMed Google Scholar
Zheng L, Teng EL, Varma R, Mack WJ, Mungas D, Lu PH и др.Монреальский когнитивный тест на китайском языке для говорящих на кантонском или мандаринском диалекте: возраст, образование и гендерные аспекты. Int J Alzheimers Dis. 2012; 2012: 2046 23.
PubMed Central PubMed Google Scholar
Santangelo G, Siciliano M, Pedone R, Vitale C, Falco F, Bisogno R, et al. Нормативные данные для Монреальской когнитивной оценки в выборке итальянского населения. Neurol Sci. 2015; 36: 585–91.
Артикул PubMed Google Scholar
Чанг Ю.Т., Чанг С.К., Линь Х.С., Хуанг С.В., Чанг В.Н., Луи С.К. и др. Монреальская когнитивная оценка для оценки клинической тяжести и гиперинтенсивности белого вещества при болезни Альцгеймера с нормальным контролем. Acta Neurol Тайвань. 2012; 21: 64–73.
PubMed Google Scholar
Wu YT, Lee HY, Norton S, Chen C, Chen H, He C и др. Исследования распространенности деменции в материковом Китае, Гонконге и Тайване: систематический обзор и метаанализ.PLoS One. 2013; 8: e66252.
PubMed Central CAS Статья PubMed Google Scholar
Sun Y, Lee HJ, Yang SC, Chen TF, Lin KN, Lin CC, et al. Общенациональное исследование умеренных когнитивных нарушений и деменции, включая очень легкую деменцию, на Тайване. PLoS One. 2014; 9: e100303.
PubMed Central Статья PubMed Google Scholar
Альберт М.С., ДеКоски С.Т., Диксон Д., Дюбуа Б., Фельдман Х.Х., Фокс Н.С. и др.Диагноз легкого когнитивного нарушения, вызванного болезнью Альцгеймера: рекомендации рабочих групп Национального института старения и ассоциации Альцгеймера по диагностическим руководствам по болезни Альцгеймера. Демент Альцгеймера. 2011; 7: 270–9.
PubMed Central Статья PubMed Google Scholar
Достоверность Монреальской когнитивной оценки (MoCA) для скрининга сосудистых когнитивных нарушений после ишемического инсульта
Овчар Штанте К., Поточник Дж., Ракуша М. (2017) Сосудистые когнитивные нарушения и сосудистая деменция. Здр Вестн 86: 331–345
Google Scholar
Эдвардс Дж. Д., Якова С., Сепери А. А. и др. (2013) Количественный систематический обзор доменно-специфических когнитивных нарушений при лакунарном инсульте. Неврология 80: 315–322. https://doi.org/10.1212/WNL.0b013e31827deb85
Артикул PubMed PubMed Central Google Scholar
Ридерер П., Корчин А.Д., Али С.С. и др. (2017) Диабетический мозг и познание. J Neural Transm 124: 1431–1454. https://doi.org/10.1007/s00702-017-1763-2
Артикул PubMed Google Scholar
McKhann GM, Knopman DS, Chertkow H et al (2011) Диагностика деменции, вызванной болезнью Альцгеймера: Рекомендации рабочих групп Национального института старения — Ассоциации Альцгеймера по диагностическим руководствам по болезни Альцгеймера.Демент Альцгеймера 7: 263–269. https://doi.org/10.1016/j.jalz.2011.03.005
Артикул Google Scholar
Pendlebury ST, Mariz J, Bull L et al (2012) MoCA, ACE-R и MMSE в сравнении с национальным институтом неврологических расстройств и инсульта — канадской сетью инсульта, согласованной со стандартами гармонизации когнитивных нарушений сосудов, нейропсихологической батареей после ТИА и Инсульт. Ход 43: 464–469. https://doi.org/10.1161/STROKEAHA.111.633586
Артикул PubMed Google Scholar
Hachinski V, Oveisgharan S, Romney A, Shankle WR (2012) Оптимизация шкалы ишемии Хачинского. Arch Neurol 69: 169–175
Статья Google Scholar
Джонсон Л.А., Кушинг Б., Рольфинг Дж. И др. (2014) Шкала ишемии Хачинского и когнитивные способности: влияние этнической принадлежности. Возраст: старение 43: 364–369. https: // doi.org / 10.1093 / старение / aft189
Артикул PubMed Google Scholar
Rakusa M, Jensterle J, Mlakar J (2018) Тест рисования часов: простая система баллов для точного скрининга когнитивных нарушений у пациентов с легкими когнитивными нарушениями и деменцией. Dement Geriatr Cogn Disord 45: 326–334
Статья Google Scholar
Folstein MF, Folstein SE, McHugh PR (1975) Мини-психическое состояние.J Psychiatr Res 12: 189–198. https://doi.org/10.1016/0022-3956(75)
-6
CAS Статья PubMed PubMed Central Google Scholar
Ракуса М., Гранда Г., Когой А. и др. (2006) Краткое обследование психического состояния: стандартизация и валидация для пожилого населения Словении. Eur J Neurol 13: 141–145. https://doi.org/10.1111/j.1468-1331.2006.01185.x
CAS Статья PubMed Google Scholar
Godefroy O, Fickl A, Roussel M et al (2011) Превосходит ли монреальская когнитивная оценка над мини-экспертизой психического состояния для выявления когнитивных нарушений после инсульта ?: Исследование с нейропсихологической оценкой. Инсульт 42: 1712–1716. https://doi.org/10.1161/STROKEAHA.110.606277
Артикул PubMed Google Scholar
Насреддин З., Филлипс Н., Бедириан В. и др. (2005) Монреальская когнитивная оценка, MoCA: краткий инструмент для выявления умеренных когнитивных нарушений.J Am Geriatr Soc 53: 695–699. https://doi.org/10.1111/j.1532-5415.2005.53221.x
Артикул PubMed Google Scholar
Роман Г.К., Татемичи Т.К., Эркинджунтти Т. и др. (1993) Сосудистая деменция: диагностические критерии для научных исследований: отчет международного семинара NINDS-AIREN. Неврология 43: 250–250. https://doi.org/10.1212/WNL.43.2.250
CAS Статья PubMed Google Scholar
Альберт М.С., ДеКоски С.Т., Диксон Д. и др. (2011) Диагностика легкого когнитивного нарушения из-за болезни Альцгеймера: рекомендации рабочих групп Национального института старения-Ассоциации Альцгеймера по диагностическим руководствам по болезни Альцгеймера. Alzheimers Dement 7: 270–279. https://doi.org/10.1016/j.jalz.2011.03.008
Артикул PubMed PubMed Central Google Scholar
van Swieten JC, Koudstaal PJ, Visser MC et al (1988) Соглашение между наблюдателями по оценке инвалидности у пациентов с инсультом.Ход 19: 604–607. https://doi.org/10.1161/01.STR.19.5.604
Артикул PubMed PubMed Central Google Scholar
Бартос А., Файетт Д. (2018) Валидация чешской монреальской когнитивной оценки умеренных когнитивных нарушений из-за болезни Альцгеймера и чешских норм у 1552 пожилых людей. Dement Geriatr Cogn Disord 46: 335–345. https://doi.org/10.1159/000494489
Артикул PubMed Google Scholar
Lees R, Selvarajah J, Fenton C et al (2014) Проверка точности когнитивных скрининговых тестов для диагностики деменции и многодоменных когнитивных нарушений при инсульте. Инсульт 45: 3008–3018. https://doi.org/10.1161/STROKEAHA.114.005842
Артикул PubMed Google Scholar
Swartz RH, Cayley ML, Lanctot KL et al (2016) Проверка прагматического подхода к когнитивному скринингу в клиниках профилактики инсульта с использованием когнитивной оценки montreal.Ход 47: 807–813. https://doi.org/10.1161/STROKEAHA.115.011036
Артикул PubMed Google Scholar
Dong Y, Slavin MJ, Chan BP-L et al (2014) Улучшение скрининга сосудистых когнитивных нарушений через 3–6 месяцев после легкого ишемического инсульта и транзиторной ишемической атаки. Int Psychogeriatr 26: 787–793. https://doi.org/10.1017/S1041610213002457
Артикул PubMed Google Scholar
Tu Q-Y, Jin H, Ding B-R et al (2013) Надежность, валидность и оптимальная граничная оценка когнитивной оценки Монреаля (версия чанша) у пациентов с ишемической цереброваскулярной болезнью в провинции Хунань, Китай. Dement Geriatr Cogn Dis Extra 3: 25–36. https://doi.org/10.1159/000346845
Артикул PubMed PubMed Central Google Scholar
Chiti G, Pantoni L (2014) Использование Монреальской когнитивной оценки у пациентов с инсультом.Инсульт 45: 3135–3140
Артикул Google Scholar
Salvadori E, Pasi M, Poggesi A et al (2013) Прогностическая ценность MoCA в острой фазе инсульта для диагностики среднесрочных когнитивных нарушений. J Neurol 260: 2220–2227. https://doi.org/10.1007/s00415-013-6962-7
CAS Статья PubMed Google Scholar
Koski L (2013) Валидность и применение Монреальской когнитивной оценки для оценки сосудистых когнитивных нарушений.Цереброваск Дис 36: 6–18. https://doi.org/10.1159/000352051
Артикул PubMed Google Scholar
Камминг ТБ, Чурилов Л., Линден Т., Бернхардт Дж. (2013) Монреальская когнитивная оценка и мини-проверка психического состояния являются действенными когнитивными инструментами при инсульте. Acta Neurol Scand 128: 122–129
CAS Статья Google Scholar
https: // www.mocatest.org/. Доступ 18 марта 2020 г.
Лис Р.А., Хендри Ба К., Брумфилд Н. и др. (2016) Когнитивная оценка при инсульте: выполнимость и свойства тестирования с использованием различных подходов к подсчету неполных заданий. Int J Geriatr Psychiatry. https://doi.org/10.1002/gps.4568
Артикул PubMed Google Scholar
Pendlebury ST, Klaus SP, Mather M et al (2015) Регулярный когнитивный скрининг пожилых пациентов, поступивших в отделение неотложной медицины: сокращенная оценка умственных способностей (AMTS) и жалобы на субъективную память по сравнению с Монреальской когнитивной оценкой и IQCODE.Возраст: старение 44: 1000–1005. https://doi.org/10.1093/ageing/afv134
CAS Статья PubMed PubMed Central Google Scholar
Оценка легкой когнитивной дисфункции у пациентов с болезнью Паркинсона в клинической практике в Тайване
Участники
Все участники (n = 168) были отобраны для исследования 21 Регистра болезни Паркинсона (DRPD). Пациентам был поставлен диагноз идиопатической болезни Паркинсона в соответствии с клиническими диагностическими рекомендациями 22 , установленными Британским обществом PD Society Brain Bank.Последовательные пациенты с БП были набраны по направлениям неврологов двенадцати медицинских центров или учебных больниц на Тайване. Критерии включения были следующими: идиопатическая БП (возраст начала> 50 лет), отсутствие депрессивного расстройства, как указано по Гериатрической депрессивной шкале 23 баллов менее 6, и подробный анамнез был собран у лиц, осуществляющих уход. Критериями исключения участников были следующие: неграмотность, деменция, слабоумие с тельцами Леви, синдром паркинсона-плюс, инсульт, перенесенные операции на головном мозге и другие системные или психические заболевания (например,g., большое депрессивное расстройство), которые могут повлиять на когнитивные функции. Мы также исключили пациентов, которым вводили операцию по глубокой стимуляции мозга или лекарства (например, антихолинергические средства, ингибиторы холинэстеразы или ингибиторы N-метил-D-аспартата). Демографические и клинические характеристики были собраны путем интервью, а когнитивные функции были измерены, когда пациенты принимали лекарства «ON». Все участники были проинформированы о содержании исследования и подписали форму согласия перед включением в это исследование, и только те участники, которые предоставили свое информированное согласие, были допущены к участию в исследовании в соответствии с Хельсинкской декларацией этических стандартов 1964 года.Институциональные наблюдательные советы каждой участвующей больницы (например, больница Шунг Хо, больница Чушан Шоу-Чван, больница Университета Чун-Шань, больница общего профиля Tri-Service, Тайбэй, Тайчжун и больница общего профиля для ветеранов Гаосюн, больница E-Da, Тайбэй и Мемориальная больница Гаосюн Чангун, больница Гаосюнского медицинского университета и Муниципальная больница Та-Тунг в Гаосюне подтверждают протоколы настоящего исследования. После процедуры сбора данных пациенты были разделены на две группы (т.е., когнитивно интактные пациенты, CI по сравнению с пациентами MCI) в соответствии с рекомендацией MDS для диагностики PD-MCI 6 . Неврологи оценили функциональную зависимость пациента и повседневную активность.
Клинические, нейрокогнитивные и нейропсихиатрические измерения
Все пациенты прошли неврологическое обследование для подтверждения диагноза идиопатической болезни Паркинсона. Клинические характеристики, такие как история болезни, возраст начала болезни Паркинсона и данные о лекарствах (например, использование леводопы), регистрировались с помощью полуструктурированного интервью.В полуструктурированном интервью невролог спрашивал пациентов и их опекунов об их истории болезни (например, диагноз любого другого системного заболевания и операции на головном мозге) и клинических характеристиках (например, возраст начала, лекарства, тяжесть заболевания и продолжительность). Продолжительность заболевания относится к времени, прошедшему с момента возникновения двигательных симптомов, о котором сообщает пациент или наблюдают лица, осуществляющие уход. Шкала Хоэна и Яра 24 применялась для измерения тяжести заболевания, а двигательные нарушения оценивались неврологами с помощью части III Единой рейтинговой шкалы болезни Паркинсона MDS 25 .Суточная эквивалентная доза леводопы для пациента 26 была рассчитана в соответствии с рекомендациями невролога.
Общая когнитивная способность оценивалась с помощью тайваньской версии MMSE 17 и MoCA 16 . Следуя рекомендациям MDS для диагностики БП с деменцией 10 или PD-MCI 6 , мы подробно оценили пять когнитивных доменов с использованием наиболее распространенных клинических инструментов и критериев. MDS зафиксировал дисфункцию или дефицит, опубликованные критерии или норму, соответствующую возрасту и образованию 10,27,28 .Нейропсихиатрические характеристики были измерены с помощью Нейропсихиатрического инвентаря (NPI) 29 , и он содержит двенадцать пунктов. Наличие или отсутствие каждого симптома оценивалось как «1» или «0» соответственно. Общий балл NPI был получен путем сложения 12 баллов интенсивности.
Статистический анализ
Для проведения статистического анализа применялось программное обеспечение R 3.3.2 (R Foundation for Statistical Computing, Вена, Австрия). Уровень α 0,05 был установлен как статистически значимый уровень.Среднее значение и стандартное отклонение были рассчитаны для описания распределения непрерывных переменных, а частота и процентное соотношение использовались для описания категориальных переменных. Не скорректированный эффект потенциальных прогностических факторов или предикторов MCI по сравнению с когнитивно интактным (CI) в одномерном анализе был протестирован с использованием суммы рангов Вилкоксона и точного критерия Фишера для типа данных у пациентов с БП. Величина эффекта каждого теста измерялась с использованием Cohen d (менее 0.49 для малых, от 0,5 до 0,79 для средних и больших или равных 0,8 для больших размеров эффекта).
Был проведен многомерный анализ, и скорректированные эффекты прогностических факторов или предикторов MCI были определены с помощью модели множественной логистической регрессии. В нашем регрессионном анализе были применены следующие методы подгонки модели, включая выбор переменных, проверку согласия (GOF), а также диагностику и коррекцию регрессии. Мы использовали пакет My.stepwise из R 30 , чтобы выполнить пошаговый выбор переменных для получения окончательной модели.В таблице 1 показаны одномерные релевантные ковариаты (включая пол, возраст, годы образования и т. Д.), И модераторы были выбраны соответствующим образом. Критерии для входа и пребывания были установлены как 0,15, а окончательная модель логистической регрессии была определена путем запуска ковариат, чье значение p было больше 0,05, до тех пор, пока коэффициенты не стали отличаться от нуля. Эффект независимых ковариант в одномерном анализе и эффекты маскировки медиаторов в многомерном анализе могут вызвать несоответствие между результатами одномерного и многомерного анализа.Например, возраст и уровень образования могут повлиять на общий балл MMSE, а последний, в свою очередь, может предсказать вероятность наличия MCI. В текущем исследовании площадь под кривой рабочей характеристики приемника (ROC) и тест GOF Хосмера-Лемешоу, а также скорректированный обобщенный R 2 Нагелькерке были применены для изучения GOF нашей модели. Значение ROC, большее или равное 0,7, означает, что он имеет приемлемую различимость, а значения скорректированного обобщенного R 2 Нагелькерке более значимы или равны 0.30 означает приемлемый уровень физической подготовки для модели. Кроме того, значения p теста Hosmer-Lemeshow GOF указывают на уровень физической подготовки, и чем больше, тем лучше.
Таблица 1 Демографические данные и клинические характеристики БП с когнитивными интактными и умеренными когнитивными нарушениями.Множественные и простые обобщенные аддитивные модели (GAM) использовались для проверки нелинейного влияния непрерывных переменных и определения подходящей точки отсечения в процессе пошагового выбора переменных.Мы использовали функцию vgam пакета VGAM (Yee, 2017), чтобы подобрать GAM для наших бинарных ответов в R. Проблемы модели или данных наблюдались с помощью обнаружения важных случаев, проверки мультиколлинеарности и диагностики регрессии для остаточного анализа.
