Шкала mmse для выявления когнитивных нарушений: Валидность тестовых шкал для нейрокогнитивного и психоэмоционального тестирования у пациентов с хирургической патологией прецеребральных артерий
Валидность тестовых шкал для нейрокогнитивного и психоэмоционального тестирования у пациентов с хирургической патологией прецеребральных артерий
Сосудистые заболевания головного мозга являются одной из ведущих причин инвалидизации и смертности населения во всем мире [1—3]. Наиболее распространенной патологией прецеребральных артерий признано атеросклеротическое стенозирующее поражение внутренних сонных артерий (ВСА), что составляет 90% случаев сосудисто-мозговой недостаточности [4, 5]. В России каждый год фиксируется около 500 тысяч новых случаев ишемического инсульта [6]. И с каждым годом неуклонно увеличивается количество хирургических вмешательств на артериях, кровоснабжающих головной мозг [7—9]. Хирургическая тактика лечения стенозирующего поражения направлена, прежде всего, на сокращение частоты возникновения грубого очагового поражения головного мозга. Однако любой вид вмешательства на брахиоцефальных артериях сопряжен с рисками нейронального повреждения [10—12].
Логично предположить, что устранение преграды в хронически стенозированном сосуде и восстановление нормального притока крови к головному мозгу должны нести благоприятный гемодинамический эффект, а, следовательно, и благотворно влиять на когнитивную сферу.
Термин послеоперационная когнитивная дисфункция (ПОКД) объединяет интеллектуально-мнестические нарушения, развивающиеся в раннем (с первых по шестые сутки после операции) и сохраняющиеся в позднем послеоперационном периоде. При этом дефицит когнитивной сферы должен быть подтвержден данными нейропсихологического тестирования, а именно, снижением показателей в послеоперационном периоде на 10% и более от дооперационного уровня [19]. В современной литературе основное внимание уделяется нейрокогнитивным расстройствам, формирующимся на момент перевода из реанимационного отделения и позднее, в то время как непосредственному послеоперационному периоду (первые 24 ч после хирургического лечения) уделяется недостаточное внимание [20, 21].
В международном проспективном рандомизированном контролированном исследовании ПОКД (International Study of Post-Operative Cognitive Dysfunction — ISPOCD-1−2), которое было проведено в 2 этапа: в 1994—1998 и 1998—2000 гг., проанализированы случаи оперативных вмешательств, выполненных в условиях общей анестезии, исключая кардиохирургические и операции на головном мозге. Исследование ISPOCD-1 (1998) продемонстрировало наличие нейрокогнитивного дефицита у 25,8% больных через неделю после операции и его сохранение у 9,9% пациентов в течение последующих трех месяцев. У пациентов старше 75 лет стойкие когнитивные нарушения выявляли в 14% случаев. В исследовании убедительно доказана ведущая роль общей анестезии в развитии стойкой ПОКД [22]. Исследование ISPOCD-2 (2000) демонстрирует, что частота ранней ПОКД после операций в условиях общей анестезии у пациентов среднего возраста (40—60 лет) составляет 19,2% случаев, стойкой — 6,2% случаев [23].
По данным разных авторов негативное влияние компонентов общей анестезии и продуктов их биотрансформации на центральную нервную систему отмечается при использовании даже среднетерапевтических доз практически всех известных анестетиков и наркотических анальгетиков [24, 25]. В литературе подробно описано действие морфина, лидокаина, α-метилфенилэтиламина, фентанила, галотана (фторотана), оксибутирата натрия, гексенала (гексобарбитала), кетамина, пентобарбитала на высшую нервную деятельность [26—31].
В литературе подробно описано действие морфина, лидокаина, α-метилфенилэтиламина, фентанила, галотана (фторотана), оксибутирата натрия, гексенала (гексобарбитала), кетамина, пентобарбитала на высшую нервную деятельность [26—31].
Интраоперационный период у пациентов с патологией прецеребральных артерий, имеющих хроническую гипоперфузию головного мозга, сопряжен, помимо действия наркоза, с манипуляциями на компрометированных сосудах (как в случае открытой операции, так и при стентировании). В ходе хирургического вмешательства производится временное одностороннее пережатие сонной артерии, удаление атероматозной бляшки, по показаниям — постановка временного внутрипросветного шунта. Каждая из этих техник может сопровождаться нарушением целостности бляшки и эпизодами церебральной микроэмболии. При интервенционном вмешательстве явления общей анестезии нивелированы, но профилактика эмболий становится более актуальной. Разработаны специальные тактики и инструментарий, включающий различные фильтры-ловушки. Однако данные литературы свидетельствуют о наличии у таких пациентов когнитивного дефицита со схожим уровнем выраженности, как и при открытых операциях [32—34]. В этой связи, хирургические вмешательства при патологии прецеребральных артерий с одной стороны предопределяют большие надежды в отношении нейронального повреждения, с другой стороны несут существенную опасность формирования ПОКД. Этот факт заставляет более детально исследовать нейрокогнитивный статус пациентов перед хирургическим вмешательством для прогнозирования и контроля формирования его дефицита.
Однако данные литературы свидетельствуют о наличии у таких пациентов когнитивного дефицита со схожим уровнем выраженности, как и при открытых операциях [32—34]. В этой связи, хирургические вмешательства при патологии прецеребральных артерий с одной стороны предопределяют большие надежды в отношении нейронального повреждения, с другой стороны несут существенную опасность формирования ПОКД. Этот факт заставляет более детально исследовать нейрокогнитивный статус пациентов перед хирургическим вмешательством для прогнозирования и контроля формирования его дефицита.
Говоря о ПОКД, необходимо учитывать тесную патофизиологическую и клиническую взаимосвязь когнитивных и психоэмоциональных нарушений [35, 36]. Так, ПОКД может усугубляться тревожно-депрессивными нарушениями, недооцениваться или протекать под их маской. Поэтому, для полноценной оценки, наряду с исследованием когнитивных функций, тестирование необходимо дополнять выявлением психоэмоциональных расстройств [37—39].
В настоящее время разработано множество стандартных тестов, шкал и опросников, которые используются для объективизации нейрокогнитивных и тревожно-депрессивных расстройств.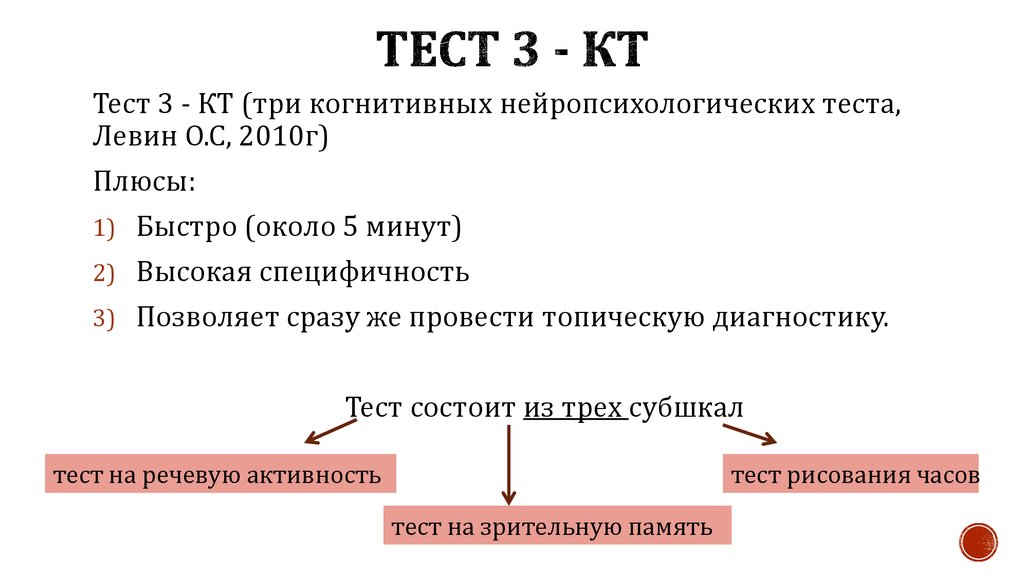

Краткая шкала оценки психического статуса, Mini Mental State Examination (MMSE) используется для скрининга когнитивных расстройств более 40лет [42]. Она не требует специальной подготовки и удобна для быстрого тестирования, в том числе и в условиях реанимационного отделения. Шкала MMSE представляет собой набор из 11 проб, оценивающих ориентировку во времени и месте, повторение слов, счет, слухо-речевую память, называние предметов, повторение фразы, понимание команды, чтение, письмо и рисунок [43]. Она является достаточно надежным инструментом для первичного скрининга когнитивных нарушений [44].
Шкала MMSE широко используется для выявления ПОКД в сердечно-сосудистой хирургии. Так, в проведенном в 2015 году K. Lai и соавторами анализе частоты развития ПОКД у 568 пациентов, оперированных по поводу стеноза аортального клапана, указывается целесообразность ее применения для оценки познавательных функций. Вместе с тем авторы уточняют, что шкала недостаточно высоко чувствительна для оценки более тонких нарушений памяти и для пациентов с исходно высоким интеллектуальным потенциалом [45].
Исследование J. Saczynski и соавт. (2012) на 225 пациентах, перенесших коронарное шунтирование или протезирование клапанов сердца, демонстрирует высокую валидность MMSE для выявления ПОКД [46].
В 2014 г. M. Nagai и соавт. исследовали связь ПОКД с увеличением артериального давления и ремоделированием сосудистой стенки. Нейрокогнитивные функции оценивали у пожилых пациентов (n=201) с различными нехирургическими заболеваниями сердечно-сосудистой системы с помощью двух шкал: MMSE и общего ухудшения состояния (global deterioration scale). При сравнении шкал между собой авторы отметили большую надежность и чувствительность MMSE по сравнению со шкалой общего ухудшения состояния. Худшие оценки по шкале MMSE ( р<0,01) получили пациенты, сочетавшие артериальную гипертонию с увеличением толщины комплекса интима—медиа или с возрастанием жесткости сосудистой стенки [47].
Нейрокогнитивные функции оценивали у пожилых пациентов (n=201) с различными нехирургическими заболеваниями сердечно-сосудистой системы с помощью двух шкал: MMSE и общего ухудшения состояния (global deterioration scale). При сравнении шкал между собой авторы отметили большую надежность и чувствительность MMSE по сравнению со шкалой общего ухудшения состояния. Худшие оценки по шкале MMSE ( р<0,01) получили пациенты, сочетавшие артериальную гипертонию с увеличением толщины комплекса интима—медиа или с возрастанием жесткости сосудистой стенки [47].
В последние годы все большую распространенность приобретает процедура стентирования при стенозах ВСА, поэтому растет и актуальность исследования когнитивных функций у этой группы пациентов [48]. Так в 2013 г. Y. Cheng и соавт. исследовали частоту ПОКД у пациентов после стентирования сонных артерий. В это исследование вошло 240 пациентов, которые проходили подробное нейропсихологические обследование до и через 6 месяцев после лечения, включающее батарею тестов, в том числе — MMSE и Монреальскую шкалу.
Z. Xia и соавт. (2015) обследовали 579 пациентов со стенозами ВСА, подготовленных к стентированию и 552 здоровых людей. Когнитивное тестирование также, включало MMSE и Монреальскую шкалу. Авторы подтвердили высокую валидность и надежность обеих методик оценки. По данным Z. Xia MMSE и Moнреальская шкала сопоставимы у пациентов до и после стентирования, что позволяет использовать MMSE не только для констатации факта ПОКД, но и для оценки эффективности лечения [50].
В 2015 г. группой авторов под руководством Antonopoulos C.N. был проведен мета-анализ исследований, оценивающих когнитивные функции до и после стентирования ВСА при помощи батареи тестов, включающей MMSE. Шестнадцать исследований включали 626 пациентов. Шкала MMSE признана валидной для нейрокогнитивного тестирования пациентов с атеросклеротическим поражением ВСА [51].
I. Zavoreo и соавт. (2013) соотнесли снижение когнитивных функций с церебральной вазореактивностью у 150 пациентов с асимптомными гемодинамически значимыми односторонними стенозами ВСА. Для исследования авторы использовали две шкалы: MMSE и Moнреальскую шкалу. Цереброваскулярную реактивность и внутричерепное коллатеральное кровообращение оценивали с помощью индекса задержки дыхания и транскраниальной цветной доплерографии. Оценки MMSE у больных со стенозом ВСА были в пределах нормального диапазона, тогда как показатели Moнреальской шкалы были ниже группы контроля (n=150). Результаты исследования показали, что измененная реактивность сосудов головного мозга и церебральная гипоперфузия могут снижать специфические нейрокогнитивные функции. Поэтому авторы предлагают применять совместно с MMSE другие, более чувствительные шкалы, а также индекс задержки дыхания, что может помочь в скрининге когнитивных нарушений у бессимптомных пациентов со стенозами ВСА [52].
Тест «Информация—Память—Концентрация внимания», Information—Memory—ConcentrationTest, является методом выявления нейрокогнитивных расстройств аналогичным шкале MMSE, но распространенность его использования в клинической медицине несколько ниже.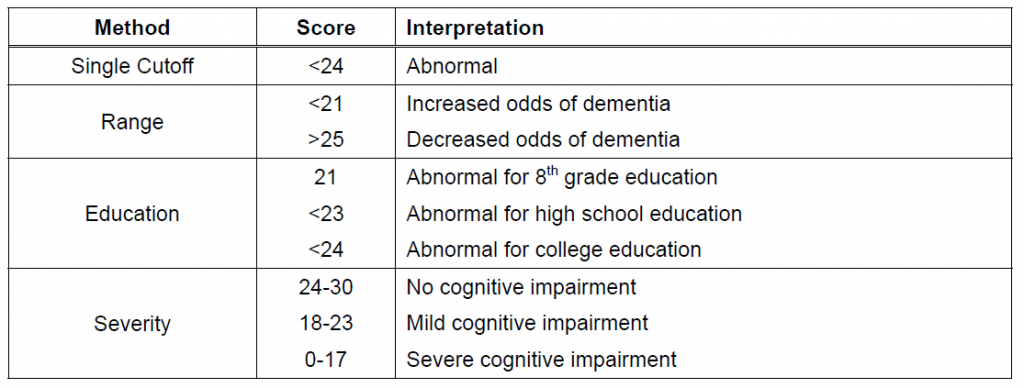 Он прост в использовании, удобен для применения в условиях реанимационного отделения и представляет собой короткую структурированную шкалу с оценкой каждого правильного ответа в один балл, за исключением пунктов, где указана иная система оценки. При этом максимально возможные 42 балла соответствуют норме, а диапазон ниже 42 свидетельствует о снижении уровня интеллекта: чем меньше балл, тем выше нарушения памяти и внимания.
Он прост в использовании, удобен для применения в условиях реанимационного отделения и представляет собой короткую структурированную шкалу с оценкой каждого правильного ответа в один балл, за исключением пунктов, где указана иная система оценки. При этом максимально возможные 42 балла соответствуют норме, а диапазон ниже 42 свидетельствует о снижении уровня интеллекта: чем меньше балл, тем выше нарушения памяти и внимания.
D. Terry и соавт. (2008) исследовали когнитивную сферу долгожителей — от 97 лет и старше, 523 женщин и 216 мужчин. Авторы обследовали всех испытуемых с помощью теста «Информация—Память—Концентрация внимания», подтвердив его высокую валидность и достаточную чувствительность для выявления нейрокогнитивной дисфункции [53].
D. Mungas и B. Reed в исследовании, проведенном в 2000 г., изучили 1207 пациентов с признаками нейрокогнитивных нарушений. Авторы сравнивали адекватность проведения различных видов тестов на данной группе людей. При этом как MMSE, так и тест «Информация—Память—Концентрация внимания» показали хорошие результаты при средних значениях когнитивных функций и значительную нелинейность результатов при низких и высоких уровнях умственного развития. Авторы делают вывод, что данные тесты хороши для скрининга нейрокогнитивных расстройств, а также для выявления ПОКД в составе батареи тестов, однако не подходят в качестве основного инструмента исследований в отдельном виде. Их необходимо дополнять тестами, содержащими задания по скорости психомоторных реакции, времени реакций, вниманию, памяти и зрительно-пространственной ориентации [54].
Авторы делают вывод, что данные тесты хороши для скрининга нейрокогнитивных расстройств, а также для выявления ПОКД в составе батареи тестов, однако не подходят в качестве основного инструмента исследований в отдельном виде. Их необходимо дополнять тестами, содержащими задания по скорости психомоторных реакции, времени реакций, вниманию, памяти и зрительно-пространственной ориентации [54].
В этой связи, для выявленияпреимущественного поражения лобных долей и подкорковых структур может быть использована батарея лобной дисфункции — Frontal assessment battery (FAB). В диагностике интеллектуально-мнестических расстройств, с преимущественным поражением лобных долей, имеет значение сопоставление результатов FAB и MMSE: о лобной деменции говорит крайне низкий результат FAB (менее 11 баллов) при относительно высоком результате MMSE. При деменции альцгеймеровского типа легкой степени снижается MMSE (20—24 балла), тогда как показатель FAB остается максимальным или снижается незначительно (более 11 баллов).
Батарея широко используется сердечно-сосудистыми хирургами, неврологами, психиатрами и нейрохирургами во всем мире. Это более сложная методика, для которой нужно большее количество времени, но она приемлема в условиях реанимационного отделения. Шкала позволяет выявить нарушения мышления, анализа, обобщения, выбора, беглости речи, праксиса, реакции и внимания.
В 2013 г. J. Kim и соавт. сравнили результаты тестирования FAB и MMSE разнородной популяции: 541 здорового человека и 474 лиц с серьезными когнитивными нарушениями (из них 335 человек с болезнью Альцгеймера и 139 — с другими видами нарушений интеллекта). Результаты исследования убедительно подтвердили целесообразность дополнения скрининга MMSE батареей FAB для повышения эффективности диагностики когнитивных расстройств [55].
В 2014 г. группа авторов под руководством K. Shibahashi изучала влияние хирургического лечения аневризм артерий головного мозга на когнитивные функции у 71 пациента. Использовали батарею тестов, включающую MMSE и FAB, доказав высокую чувствительность и валидность шкалы FAB [56].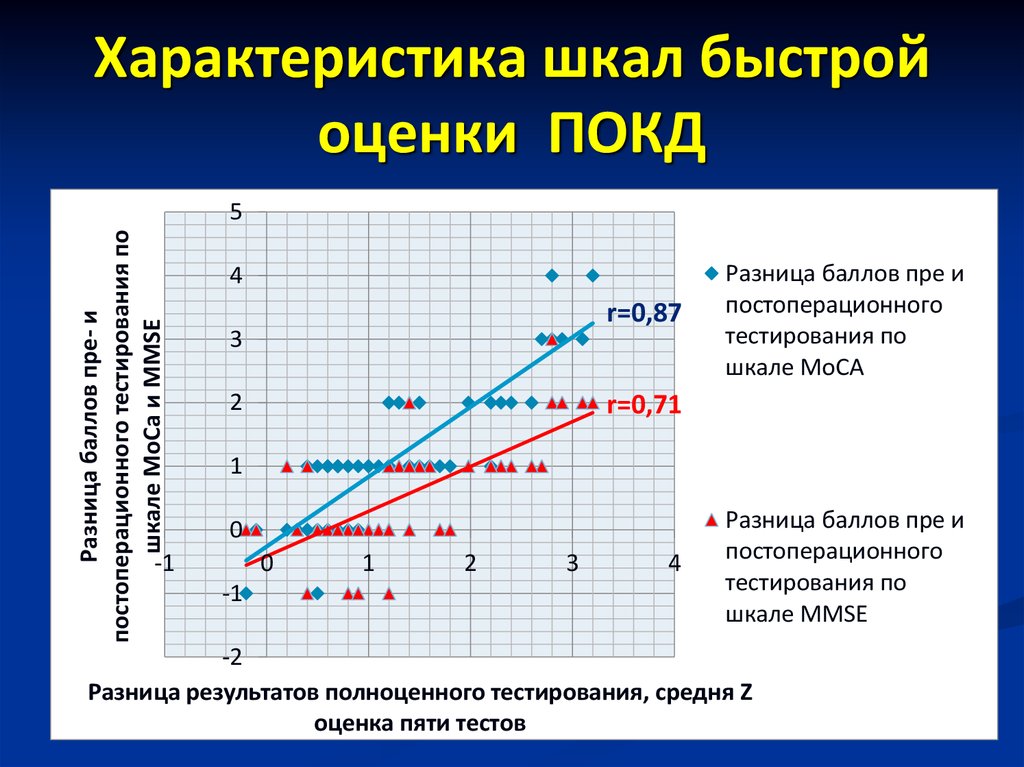
В.В. Шмелев и М.И. Неймарк (2013) наблюдали 238 пациентов после каротидной эндартерэктомии, оценивали нейрокогнитивные расстройства в послеоперационном периоде. Доказана высокая диагностическая эффективность применения FAB для этой группы пациентов [57].
Тест рисования часов — ClockDrawingTest (CDT) используется давно. Простота и высокая информативность делает его одним из наиболее общеупотребительных для выявления когнитивных расстройств и может использоваться в условиях реанимационного отделения. Пациенту дают карандаш и чистый лист бумаги и просят самостоятельно изобразить круглые часы, расставив цифры в нужные позиции циферблата и нарисовав стрелки, показывающие заданное время. Результат менее 10 баллов свидетельствует о наличии нейрокогнитивных расстройств.
H. Brodaty и соавт. (1997) изучили 28 пациентов с болезнью Альцгеймера и 28 волонтеров. Тест продемонстрировал высокую чувствительность, специфичность и межэкспертную надежность (т. е. корреляцию между данными наблюдений разных исследователей). Причем в скрининге когнитивных нарушений тест рисования часов превзошел MMSE [58].
е. корреляцию между данными наблюдений разных исследователей). Причем в скрининге когнитивных нарушений тест рисования часов превзошел MMSE [58].
В 2014 г. P. Wang и соавт. обследовали 121 человека и предложили свою систему учета очков теста рисования часов. Авторы утверждают, что тест рисования часов — одна из самых сбалансированных, чувствительных и специфичных шкал с клинической точки зрения [59].
Методика таблиц Шульте применяется для исследования темпа сенсомоторной координации, характеристик внимания и уровня умственной работоспособности. Разработал методику немецкий профессор психотерапии Вальтер Шульте, который в середине прошлого столетия занимался изучением свойств человеческого внимания. Шкала применяется неврологами и нейрохирургами в России и в странах Восточной Европы. Материалом служат 5 черно-белых таблиц квадратной формы, на которых в случайном порядке размещены числа от 1 до 25. Дается инструкция искать числа по порядку, указывая и называя их вслух. С помощью секундомера фиксируются время, затраченное на каждую таблицу, и допущенные ошибки. С помощью этого теста оцениваются такие показатели, как эффективность работы, степень врабатываемости, психическая устойчивость. Тестирование обладает достаточно высокими показателями валидности и чувствительности, и применимо в непосредственном послеоперационном периоде в условиях реанимационного отделения.
С помощью секундомера фиксируются время, затраченное на каждую таблицу, и допущенные ошибки. С помощью этого теста оцениваются такие показатели, как эффективность работы, степень врабатываемости, психическая устойчивость. Тестирование обладает достаточно высокими показателями валидности и чувствительности, и применимо в непосредственном послеоперационном периоде в условиях реанимационного отделения.
O. Gavrilova и соавт. (2011) обследовали 97 пациентов со стенозирующим поражением брахиоцефальных артерий. Применяли тест запоминания 10 слов Лурии, тест Векслера и таблицы Шульте. Нарушения высших психических функций были обнаружены у 97,9% больных. Дисфункция теменной и височной долей имела односторонний характер и соответствовала стороне поражения. Нарушения нейродинамических параметров психической деятельности коррелировали с возрастом, стороной стеноза и наличием инсульта в анамнезе [60].
Тест Векслера — Wechsler Adult Intelligence Scale (WAIS) является одним из самых валидных и чувствительных тестов исследования интеллекта и позволяет оценить основные показатели: вербальное понимание, память и внимательность. Тест широко используется в Америке, странах Европы и Азии. В России тест широко известен, но популярность его не так велика, из-за сложности адаптации заданий на русский язык и высоких требований к подготовке психодиагноста. Тест включает 11 субтестов, составляющих вербальную и невербальную шкалы. Вербальные субтесты предусматривают логические интеллектуальные действия, невербальные — манипулирование объектами (частями разрезанных фигур, кубиками) или визуальную оценку печатных материалов и картинок. Задания имеют лимит по времени с дополнительными баллами за скорость выполнения. Стандартный вариант обработки заключается в подсчете первичных оценок по каждому из субтестов, переводе их по таблицам в стандартные баллы и определение показателей общего, вербального и невербального коэффициентов интеллекта (IQ). Шкала имеет существенные сложности в использовании, что делает практически невозможным ее использование в непосредственном послеоперационном периоде в отделении реанимации. К минусам этой шкалы также относится необходимость специальной подготовки и высокой квалификации нейропсихолога, проводящего тестирование.
Тест широко используется в Америке, странах Европы и Азии. В России тест широко известен, но популярность его не так велика, из-за сложности адаптации заданий на русский язык и высоких требований к подготовке психодиагноста. Тест включает 11 субтестов, составляющих вербальную и невербальную шкалы. Вербальные субтесты предусматривают логические интеллектуальные действия, невербальные — манипулирование объектами (частями разрезанных фигур, кубиками) или визуальную оценку печатных материалов и картинок. Задания имеют лимит по времени с дополнительными баллами за скорость выполнения. Стандартный вариант обработки заключается в подсчете первичных оценок по каждому из субтестов, переводе их по таблицам в стандартные баллы и определение показателей общего, вербального и невербального коэффициентов интеллекта (IQ). Шкала имеет существенные сложности в использовании, что делает практически невозможным ее использование в непосредственном послеоперационном периоде в отделении реанимации. К минусам этой шкалы также относится необходимость специальной подготовки и высокой квалификации нейропсихолога, проводящего тестирование.
В 2013 г. Y. Cheng и соавт. исследовали влияние стентирования ВСА на нейрокогнитивные функции у пациентов с умеренными нарушениями. В это исследование было включено 240 пациентов, тестирование которых проводили до и через 6 месяцев после процедуры. Использовали MMSE, тест Векслера и Монреальскую шкалу. Тест Векслера продемонстрировал высокую специфичность и надежность результатов. Авторы пришли к выводу, что стентирование ВСА улучшает интеллектуально-мнестических способности больных через 6 месяцев после процедуры. Тестирование в непосредственном послеоперационном периоде не проводилось [61].
T. Inoue и соавт. (2013) изучали положительные эффекты рутинного использования внутрипросветного сосудистого шунта во время каротидной эндартерэктомии у 81 пациента с атеросклеротическим стенозом ВСА. Нейропсихологическое обследование состояло из шкалы Векслера, дополненное более детальным изучением памяти. Авторы указывают на достаточную надежность и чувствительность теста Векслера. Тестирование проводили до и через 6 месяцев после операции. Авторы считают, что основную роль в развитии ПОКД играет интраоперационная церебральная гипоперфузия во время пережатия ВСА и настаивают на обязательном использовании внутрипросветного шунта при каждой каротидной эндартерэктомии [62].
Тестирование проводили до и через 6 месяцев после операции. Авторы считают, что основную роль в развитии ПОКД играет интраоперационная церебральная гипоперфузия во время пережатия ВСА и настаивают на обязательном использовании внутрипросветного шунта при каждой каротидной эндартерэктомии [62].
В 2011 г. B. Lal и соавт. сравнили результаты когнитивного тестирования пациентов после открытых операций и после стентирования ВСА (n=46). Основными причинами снижения нейрокогнитивных функций авторы считают микроэмболию и гипоперфузию во время манипуляций. Использовали батарею из 6 тестов, включающую тест Векслера. В результате реваскуляризации отмечалось улучшение интеллектуальных способностей в обеих группах. ПОКД встречалась также в обеих группах, причем хирургическое лечение чаще приводило к снижению памяти, а стентирование — к снижению скорости психомоторных реакций [63].
A. Takaiwa и соавт. (2013) исследовали влияние каротидной эндартерэктомии на когнитивные функции у 15 больных с бессимптомным стенозом ВСА.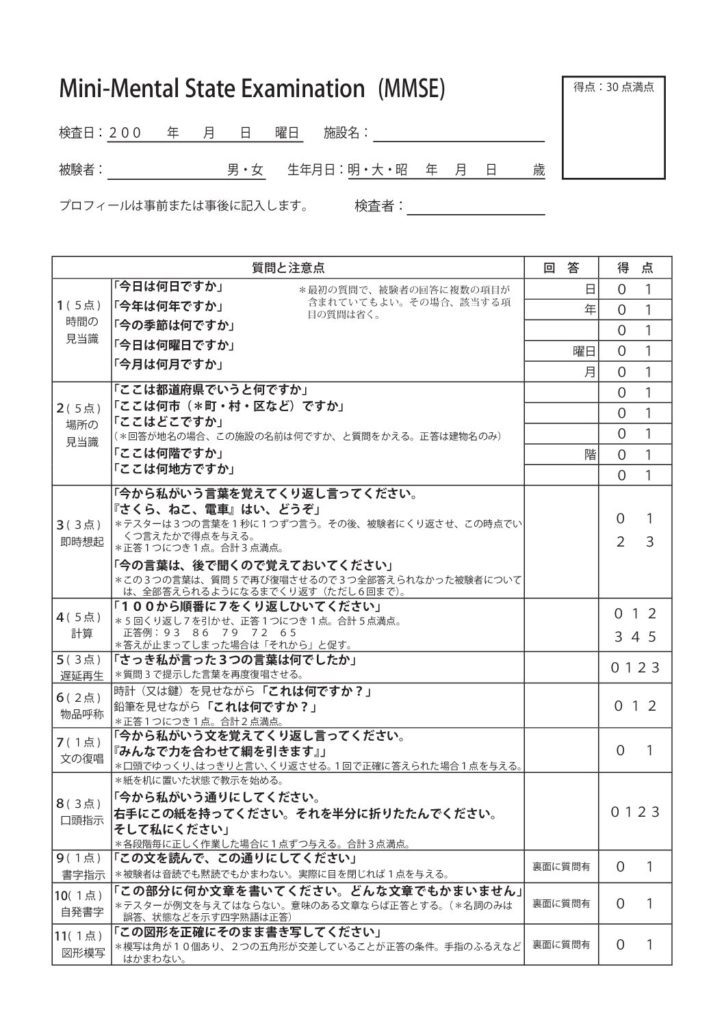 Батарея тестов включала тест Векслера. После хирургического лечения возрастали: общий суммарный показатель теста, краткосрочная память и внимание (26,7% для теста Векслера) [64].
Батарея тестов включала тест Векслера. После хирургического лечения возрастали: общий суммарный показатель теста, краткосрочная память и внимание (26,7% для теста Векслера) [64].
Исследование Q. Sun и соавт. (2014) включало 105 пациентов, которым проводили стентирование ВСА. У всех больных были подтверждены участки лейкоареоза белого вещества головного мозга. Группа контроля состояла из 206 здоровых людей. Всех пациентов тестировали при помощи двух шкал: MMSE и теста Векслера. Обе шкалы получили высокие оценки с точки зрения специфичности, валидности и надежности. Стентирование улучшало нейрокогнитивные функции (р<0,01) [65].
В исследование T. Nanba и соавт. (2012) послеоперационной церебральной гиперперфузии входило 70 пациентов, перенесших каротидную эндартерэктомию. Всем испытуемым измеряли мозговой кровоток с помощью однофотонной эмиссионной компьютерной томографии до, сразу после и на третий день после операции. Нейрокогнитивные функции проверяли с помощью батареи тестов, в том числе шкалы Векслера. Авторы указали на его высокую валидность и чувствительность у данной группы лиц. Гиперперфузию головного мозга наблюдали у 11 пациентов (16%), а ПОКД — у 9 больных (13%). Авторы доказали, что церебральная гиперперфузия реализуется повреждением белого вещества головного мозга, что коррелирует с ПОКД (р=0,0085) [66].
Авторы указали на его высокую валидность и чувствительность у данной группы лиц. Гиперперфузию головного мозга наблюдали у 11 пациентов (16%), а ПОКД — у 9 больных (13%). Авторы доказали, что церебральная гиперперфузия реализуется повреждением белого вещества головного мозга, что коррелирует с ПОКД (р=0,0085) [66].
Методика запоминания 10 слов А.Р. Лурия — the Luria Memory Words Test предназначена для оценки состояния произвольной вербальной памяти. Тест популярен в России, однако и в зарубежных исследованиях он также используется [67]. Стимульный материал — 10 слов, не связанных между собой, по смыслу и эмоционально нейтральных. Слова читаются четко, без эмоциональной окраски, с интервалом времени между словами в 1 с, не более 5 раз. Пациент 5 раз воспроизводит по памяти запомнившиеся слова, отсроченное воспроизведение оценивается через 50—60 мин без предупреждения больного. Оцениваемые параметры: объем непосредственного воспроизведения, объем отсроченного воспроизведения и эффективность запоминания. Также выявляется характер «кривой запоминания»: платообразный, ломаный, возрастающий или др. Но тест не может быть использован в отделении реанимации.
Также выявляется характер «кривой запоминания»: платообразный, ломаный, возрастающий или др. Но тест не может быть использован в отделении реанимации.
Психо-эмоциональное тестирование пациентов необходимо для выявления тревожных и депрессивных расстройств, которые оказывают существенное влияние на снижение показателей интеллекта.
В недавнее исследование (2015) R. Marijnissen и соавт. было включено 1517 пациентов в возрасте 50—70 лет. Изучали взаимосвязь между атеросклерозом и невротизацией, а также гипотезу сосудистой апатии. Выявлено, что при атеросклерозе ВСА и сопутствующем поражении лобных долей головного мозга у больных имеются изменения психоэмоциональных функций в виде когнитивных и соматически-эмоциональных симптомов [68].
M. Alosco и соавт. (2015), обследовав 55 пожилых людей, страдающих различными сердечно-сосудистыми заболеваниями пришли к выводу, что высокий уровень тревоги может усиливать действие церебральной гипоперфузии и вызывать когнитивные нарушения [69].
Госпитальная шкала оценки тревоги и депрессии — HospitalAnxietiandDepressionScale (HADS) предназначена для скрининга и оценки степени тяжести депрессии и тревоги, используется специалистами всего мира в том числе в условиях реанимационного отделения. Опросник состоит из 14 вопросов, имеет две подшкалы — тревоги и депрессии. Каждому утверждению соответствуют 4 варианта ответа, отражающие градации выраженности признака и кодирующиеся от 0 (отсутствие) до 4 баллов (максимальная выраженность). Для спонтанности ответа пациента устанавливаются четкие временные рамки для заполнения теста, около 20—30 мин. При интерпретации данных учитывается суммарный показатель по каждой подшкале, при этом выделяются 3 области значений: 0—7 баллов — норма; 8—10 баллов — субклинически выраженная тревога/депрессия; 11 баллов и выше — клинически выраженная тревога/депрессия.
S. Vasdekis и соавт. (2015) провели исследование психо-эмоциональной реабилитации у пациентов, перенесших каротидную эндартерэктомию. Работа демонстрирует значимость психо-эмоциональных расстройств в патогенезе когнитивных нарушений [70].
Работа демонстрирует значимость психо-эмоциональных расстройств в патогенезе когнитивных нарушений [70].
В исследование 2013 г. S. Stauber и соавт. включали пациентов с диагнозом атеросклероза периферических артерий нижних конечностей (n=69) и ишемической болезнью сердца (n=520). Во время 12-недельной программы реабилитации после хирургического лечения изучали уровни депрессии и тревоги по HADS, а также качество жизни. Положительные результаты операций были тесно связаны с психическим (р<0,001) и физическим качеством жизни (р<0,001). А шкала HADS признана приемлемой в послеоперационном периоде [71].
Шкала Кови — Covi Anxiety Scale предназначена для быстрой оценки выраженности тревоги. Тест основан на восприятии тестирующим врачом тревожности пациента для объективизации его состояния. Совместим с другими шкалами оценки психо-эмоционального статуса пациента. Шкала широко применяется неврологами разных стран [72]. Отраженные в опроснике, симптомы характеризуют различные формы проявления тревожных расстройств — жалобы, поведение, соматические симптомы. Шкала заполняется клиницистом во время расспроса и осмотра больного. Каждый из трех пунктов шкалы оценивается по 5-балльной системе (от 0 до 4 баллов). Общий балл равен сумме всех баллов и может иметь значение от 0 до 12. Суммарный балл от 0 до 2 обычно расценивается как отсутствие тревожного состояния, от 2 до 5 баллов — как наличие симптомов тревоги, 6 баллов и выше — как тревожное состояние.
Шкала заполняется клиницистом во время расспроса и осмотра больного. Каждый из трех пунктов шкалы оценивается по 5-балльной системе (от 0 до 4 баллов). Общий балл равен сумме всех баллов и может иметь значение от 0 до 12. Суммарный балл от 0 до 2 обычно расценивается как отсутствие тревожного состояния, от 2 до 5 баллов — как наличие симптомов тревоги, 6 баллов и выше — как тревожное состояние.
Исследование 2008 г. J. Rejas и соавт. включало 603 пациента после различных медицинских вмешательств. Испытуемые проходили психологическое обследование при помощи батареи тестовых заданий, включающее шкалу Кови. Авторы указывают на высокую чувствительность и надежность шкалы Кови в составе батареи тестов [73].
Современное развитие хирургии брахиоцефальных артерий диктует повышение требований к результатам лечения. Успешным хирургическим вмешательством или стентированием ВСА считается не только приемлемое механическое устранение препятствия току крови в пораженном сосуде, но и максимальное сохранение когнитивного и психо-эмоционального здоровья в послеоперационном периоде. Широкое распространение хронической церебральной ишемии среди хирургических больных с сердечно-сосудистой патологией предусматривает наличие подобных расстройств еще в предоперационном периоде, что усугубляет ситуацию. Адекватное и своевременное выявление нарушений интеллектуально-мнестической сферы и тревожно-депрессивных расстройств и их коррекция способны улучшить результаты лечения и качества жизни пациентов.
Широкое распространение хронической церебральной ишемии среди хирургических больных с сердечно-сосудистой патологией предусматривает наличие подобных расстройств еще в предоперационном периоде, что усугубляет ситуацию. Адекватное и своевременное выявление нарушений интеллектуально-мнестической сферы и тревожно-депрессивных расстройств и их коррекция способны улучшить результаты лечения и качества жизни пациентов.
При выборе метода тестирования необходимо учитывать надежность, валидность, чувствительность выбранных шкал, и возможность выполнения тестирования в отделении реанимации.
Авторы заявляют об отсутствии конфликта интересов.
Краткая шкала оценки психического статуса mmse бланк
Содержание
- Поиск по сайту
- Краткая шкала оценки психического статуса
- История создания
- Теоретические основы
- Внутренняя структура
- Процедура проведения
- Интерпретация
- Клиническая значимость
- Начнем оценку
- Проматывайте вниз для калькуляции балла по MMSE
- Руководство (на английском языке)
- 1.
 0 Introduction
0 Introduction - Typical features:
- 7.2 Vascular Dementia
- 7.3 Lewy Body Dementia
- 7.4 Depression
- 8.0 Care plan for Alzheimer’s disease (and other dementias)
- MMSE 25-20
- MMSE 19-11
- MMSE 10-0
- Что такое шкала MMSE
- Как происходит опрос
- Пример опросника
- Ориентация
- Восприятие
- Внимание и счет
- Память
- Выполнение операций
- Чтение
- Письмо
- Копирование
- Оценка результатов исследования
2. Для каждого вопроса выбирайте один ответ и отметьте его в соответствующем квадратике.
3. Сложите все баллы, соответствующие Вашим ответам на вопросы.
4. Используйте Ваш суммарный балл для определения Вашего риска развития сахарного диабета или предиабета.
5. Передайте заполненный вопросник своему врачу/медсестре и попросите их объяснить Вам результаты вопросника.
Возраст
До 45 лет 0 баллов
45-54 лет 2 балла
55-64 года 3 балла
Старше 65 лет 4 балла
Индекс массы тела
Индекс массы тела позволяет выявить наличие у вас избыточного веса или ожирения.
Вы можете подсчитать свой индекс массы тела сами:
вес___ кг : (рост___м) 2 = ___ кг/м 2
Например: 73 кг: (1,65 м Х 1,65 м) = 26,8 = 27 кг/м 2
Менее 25 кг/м 2 0 баллов
25-30 кг/м 2 1 балл
Более 30 кг/м 2 3 балла
Окружность талии
Окружность талии также указывает на наличие у Вас избыточного веса или ожирения. Измеряется окружность талии на уровне пупка.
Мужчины Женщины
94-102 см 80-88 см 3 балла
> 102 см > 88 см 4 балла
Как часто Вы едите овощи, фрукты или ягоды?
Каждый день 0 баллов
Не каждый день 1 балл
Занимаетесь ли Вы физическими упражнениями регулярно?
Делаете ли Вы физические упражнения по 30 минут каждый день или 3 часа в течение недели?
Принимали ли Вы когда-либо регулярно лекарства для снижения артериального давления
Обнаруживали ли у Вас когда-либо уровень сахара в крови выше нормы
(во время диспансеризации, проф. осмотра, во время болезни или
Беременности)
Был ли у Ваших родственников сахарный диабет 1 или 2 типа?
Да: дедушка/бабушка, тетя/дядя,
двоюродные братья/сестры 3 балла
Да: родители, брат/сестра
или собственный ребенок 5 баллов
Результаты:
Сумма баллов ________
Ваш риск развития сахарного диабета типа 2 в течение 10 лет составит:
Основные этапы развития астрономии. Гипотеза Лапласа: С точки зрения гипотезы Лапласа, это совершенно непонятно.
Гипотеза Лапласа: С точки зрения гипотезы Лапласа, это совершенно непонятно.
Пример оформления методической разработки: Методическая разработка — разновидность учебно-методического издания в помощь.
Отчет по производственной практике по экономической безопасности: К основным функциональным целям на предприятии ООО «ХХХХ» относятся.
Поиск по сайту
©2015-2022 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2019-04-14 Нарушение авторских прав и Нарушение персональных данных
Методика предназначена для оценки степени нарушений когнитивных функций как в качестве скрининга, так и для оценки динамики состояния (прогрессирование деменции, улучшение или стабилизация состояния на фоне лечения).
История создания
Методика была создана в 1975 году Folstein M.F., Folstein S.Е. и McHugh P.R. под названием «Mini-Mental state» как скриниговый инструмент выявления деменции.
В дальнейшем шкала претерпела ряд изменений.
Теоретические основы
Шкала прямо оценивает когнитивные функции респондента: ориентацию в месте и времени, кратковременную память, устный счёт, внимание, речь, воприятие, узнавание, способность к письму, чтению, рисованию, восприятию логических конструкций, выполнению последовательных действий. Теоретической основой для отбора и использования данных параметров являлось общее представление о когнитивной сфере человека в норме и патологии.
Внутренняя структура
Тест состоит из 9 частей, каждая из которых может быть разбита на более мелкие пункты (всего 30 пунктов). За правильное выполнение каждого пункта начисляется 1 балл (максимум 30 баллов).
Процедура проведения
Бланк тестирования используется специалистом для контроля правильности проведения теста. На нём можно отмечать результаты ответов пациента. Вопросы задаются устно, одновременно оценивается реакция на обращённую речь, возможные сложности в усвоении устных инструкций и т. д.
д.
Интерпретация
За каждый ответ, совпадающий с ключом, пациент получает 1 балл:
- Пациент назвал сегодняшее число
- Пациент назвал месяц
- Пациент назвал год
- Пациент назвал день недели
- Пациент назвал время года
- Пациент назвал город
- Пациент назвал регион
- Пациент назвал учреждение
- Пациент назвал этаж
- Пациент назвал страну
- Пациент сказал «мяч»
- Пациент сказал «флаг»
- Пациент сказал «дверь»
- Пациент сказал «93» или «Я»
- Пациент сказал «86» или «Л»
- Пациент сказал «79» или «М»
- Пациент сказал «72» или «Е»
- Пациент сказал «65» или «З»
- Пациент сказал «мяч»
- Пациент сказал «флаг»
- Пациент сказал «дверь»
- Пациент сказал «часы»
- Пациент сказал «карандаш»
- Пациент сказал «Не если, и, или нет»
- Пациент взял лист бумаги в правую руку
- Пациент сложил лист бумаги пополам
- Пациент положил сложенный лист на колено
- Пациент закрыл глаза
- Пациент написал осмысленное предложение
- Пациент нарисовал два пересекающихся пятиугольника:
- 28-30 баллов: норма.
 Нарушения когнитивных функций отсутствуют.
Нарушения когнитивных функций отсутствуют. - 24-27 баллов: когнитивные нарушения.
- 20-23 балла: деменция лёгкой степени.
- 11-19 баллов: деменция средней степени.
- 0-10 баллов: деменция тяжёлой степени.
Клиническая значимость
Шкала предназначена для скринига дементирующих процессов среди предрасположенных к этому групп населения: лица пожилого возраста, больные, у которых может развиться более ранняя деменция (например, при стойкой ГБ или наследственной предрасположенности). Лица, набравшие недостаточно баллов, нуждаются в консультации специалиста (невропатолога и/или психиатра). Клиническая оценка симптомов по данной шкале более специфична, чем чувствительна, и может не выявить лёгкие, начальные проявления дементирующих процессов, особенно подкорковых и лобных дегенераций.
Оценка когнитивных функций при депрессиях разной степени тяжести требует также особого подхода, поскольку у таких пациентов, как правило, имеют место явления обратимого когнитивного снижения, которые редуцируются по мере купирования аффективной симптоматики. Для объективизации истинного уровня когнитивных расстройств у этих больных необходимо проводить их обследование в динамике. Диагностически значимыми являются результаты исследования, проведенного после редукции депрессивной симптоматики, а также сопоставленные с данными обследования на предмет депрессивных расстройств.
Для объективизации истинного уровня когнитивных расстройств у этих больных необходимо проводить их обследование в динамике. Диагностически значимыми являются результаты исследования, проведенного после редукции депрессивной симптоматики, а также сопоставленные с данными обследования на предмет депрессивных расстройств.
Проматывайте вниз для калькуляции балла по MMSE
Руководство (на английском языке)
Authors: Dr. D. William Molloy and Dr. Roger Clarnette
1.0 Introduction
The population is a ging. Elderly frail adults are the most rapidly growing group in developed countries. More and more physicians are coming to recognize the importance of cognitive testing in the assessment of older adults.
About 10% of people aged 70 or more and a third of those aged 85 and over have dementia. Yet this is often missed, particularly in the early stages.
The Mini-Mental State Examination (MMSE) is the most widely used screening test of mental function in this age group. This manual describes a standardized version of this test and shows how physicians and other health care professionals can use and interpret it. This manual describes some uses that they may not be aware of previously.
This manual describes a standardized version of this test and shows how physicians and other health care professionals can use and interpret it. This manual describes some uses that they may not be aware of previously.
Since Dr. Marshall Folstein first developed the Mini-Mental State Examination (MMSE) in 1975, it has become widely used as a screening test for cognitive impairment and it is routinely used as an inclusion/exclusion criterion and outcome measure in clinical trials. The test covers a variety of cognitive domains, including orientation to time and place, short and long term memory, registration, recall, constructional ability, language and the ability to understand and follow commands.
This test should never be used alone. It is used in conjunction with a corroborative history.
The test usually takes about ten minutes to complete and can be used reliably after a short training period by physicians, nurses and other health-care professionals. The original MMSE had few instructions for administration and scoring.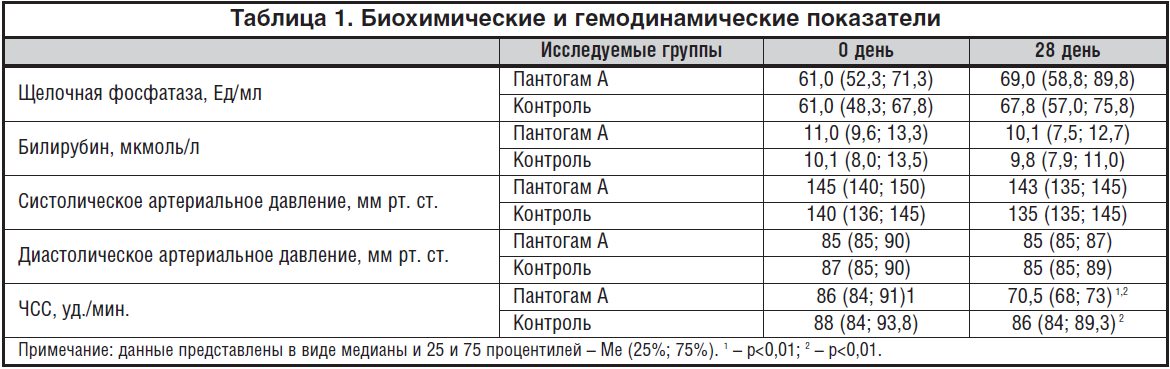 These were left to the discretion of each rater.
These were left to the discretion of each rater.
Different raters developed their own unique styles and techniques of administration and scoring. This led to wide differences and lowered the reliability of the test.
The Standardized Mini-Mental State Examination (SMMSE) was developed to provide clear unequivocal guidelines for administration and scoring. The SMMSE takes less time to administer and has significantly reduced the variability of the MMSE.
The intrarater variability is significantly lower with the SMMSE (86%, P 1. Short-term memory loss; 2. Disorientation to time, date, day, season, month etc.; 3. Can’t spell «WORLD» backwards and are disoriented to place; 4. Problems with language e.g. three-step command (difficulty with five-sided figures appear later).
Typical features:
Gradual, progressive short-term memory loss, then nominal aphasia (difficulty with names, finding the right noun) — person repeats statements and questions over and over again. No changes in tone or problems walking or swallowing. MRI may show atrophy of the medial temporal lobe.
No changes in tone or problems walking or swallowing. MRI may show atrophy of the medial temporal lobe.
The typical pattern of deficits on the MMSE is shown. The numbers represents the order of deficits in each domain.
Figure. Typical sequence of deficits in all domains
Numbers indicate the sequence of deficits in Alzheimer’s Disease, e.g. the first three points are usually lost in short term memory, next in orientation to time etc.
7.2 Vascular Dementia
The relationship between Alzheimer’s and vascular dementia is not fully understood. They share many common risk factors. The thinking in this area is evolving.
The onset and progression of deficits in Vascular Dementia is more variable and less predictable than in Alzheimer’s disease. Many believe that isolated vascular dementia is rare. Vascular dementia frequently coexists with Alzheimer’s (mixed dementia) and may modify the progress of the deficits.
There are no hard and fast rules, but early problems with language and visuo-spatial functions suggest vascular or frontal lobe involvement.
This pattern of deficits raises suspicion of vascular involvement.
Figure. Sequence of deficits in vascular dementia:
Problems drawing the figures or in following the three step command occur early and at the same time as problems with memory and spelling. The deficits tend to be diffuse, affecting many areas of function such as orientation, memory and language. Language deficits are usually seen much later in Alzheimer’s disease.
The clinical clues to vascular dementia are step-like progression, history of transient ischemic attack, stroke, early problems with gait, early incontinence and depression. There may be subtle changes on physical examination such as positive Babinski, unilateral changes in tone, sensation or power. A MRI may show white matter changes or infarcts.
7.3 Lewy Body Dementia
The characteristic feature of Lewy Body Dementia is hallucinations very early in the disease process. Typically, there is spontaneous increased tone.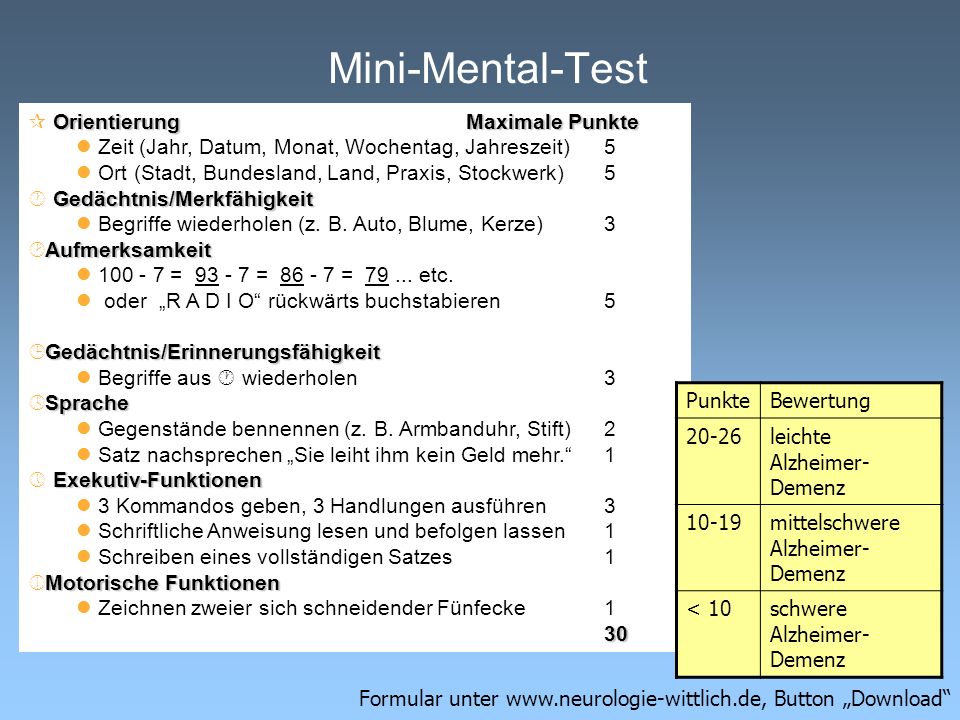 This looks like mild Parkinson’s (mild bradykinesia and rigidity), without the tremor.
This looks like mild Parkinson’s (mild bradykinesia and rigidity), without the tremor.
Hallucinations may be exacerbated when treated with Dopamine, so it should be introduced very carefully, if at all. Patients tend to walk «slumped over» to one side. They are often very paranoid, accusing their spouse of having affairs etc.
They will see bizarre hallucinations, like children playing or people in the house wearing tuxedos etc. They believe these are real and will talk to them or complain about them. Symptoms fluctuate, so that one day the person is alert, oriented and appropriate, and the next confused, hallucinating, drowsy and lethargic.
These patients fall, and are exquisitely sensitive to neuroleptics. If given neuroleptics, they become very rigid, lethargic, sleepy and experience a dramatic deterioration in function. These patients present with a characteristic constellation of symptoms and signs and often have characteristic deficits in the MMSE.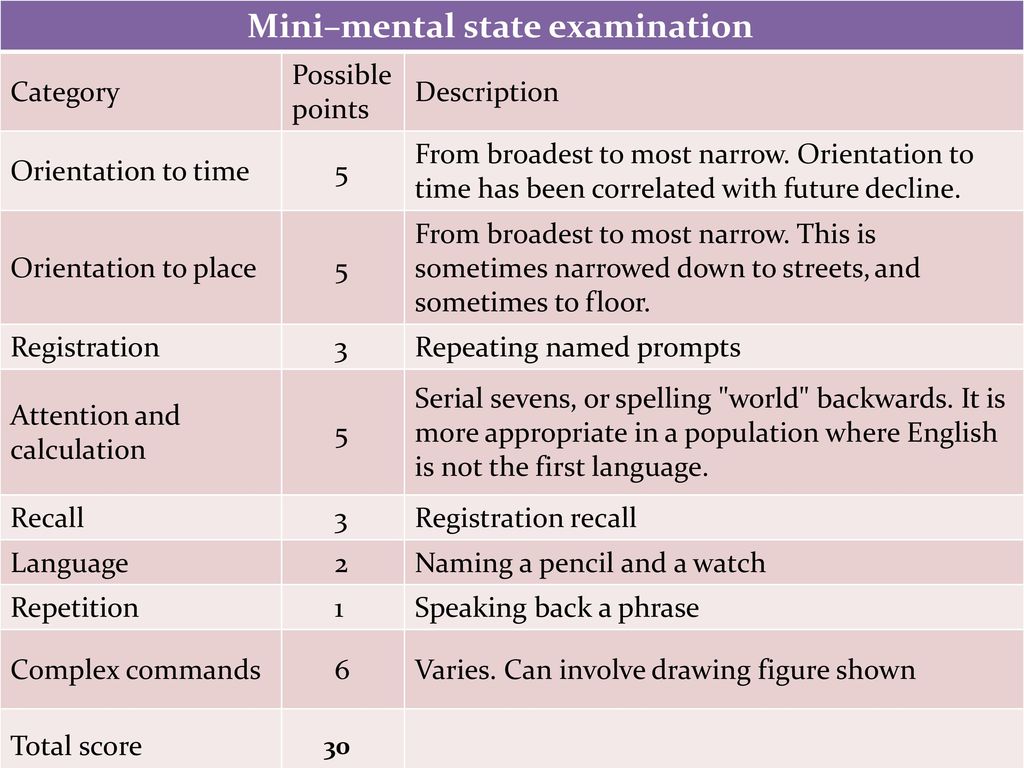
They develop early visuo-spatial problems, so it is not surprising that the first deficit on the MMSE may be difficulty with the five sided figures. Later, disorientation to day and date, short-term memory loss and the inability to spell «WORLD» backwards, occur. Although not absolute, the pattern of cognitive deficit provides valuable clues to the underlying pathology.
The history, physical findings and characteristic changes on the MMSE all help to diagnose their condition.
This pattern of deficits on the SMMSE, with the characteristic history and clinical findings support a diagnosis of Lewy Body dementia:
These patients may improve with anti-cholinesterases like Donepezil, Rivastigmine or Galantamine. For delusions, hallucinations and paranoia, a trial with low doses of Olanzepine may help the hallucinations, paranoia and delusions. They may get worse with Dopamine and this should be introduced carefully, if at all.
They may tolerate low dose SSRIs if they are depressed.
7.4 Depression
Unlike Alzheimer’s disease, these patients often complain of memory loss. When asked questions they will often answer «I don’t know». When you get «don’t knows» or «it doesn’t matter», consider depression. When pressed, they may know the answer, but just couldn’t be bothered.
They will often complain of low energy, anxiety or somatic complaints in the bowel, saying that there is indigestion or a vague uneasy feeling related to the gastrointestinal tract. Somatic complaints seem refractory to treatment (e.g. arthritis).
Some develop somatic delusions and become convinced that they have cancer or something physically wrong, but the doctor won’t tell them. They seem to perform much worse than you would expect from the degree of cognitive impairment. For example, a person with mild cognitive deficits does not wash or dress independently.
This «disability gap» means they function lower than expected. In conversation, they do not have the obvious word-finding difficulties that the Alzheimer patient exhibits.
They will often experience anhedonia, or lack of pleasure in anything. They will have mood change that they will describe as a physical feeling of being unwell that descends like a cloud they can’t shake. This is often worse in the morning and gets better as the day progresses. This diurnal variation is a typical feature of depression.
Other vegetative signs like loss of appetite, loss of energy, sleep disturbance that is characterized by early wakening or difficulty falling asleep. They do not wake feeling refreshed; rather early morning may be their worst time. They lose libido and may even consider suicide.
Older adults with depression are at risk from suicide. In depressed, older adults it is important to ask about suicidal ideation. Ask «Did you ever go to bed at night and wish you weren’t going to wake up in the morning?» If they answer yes, ask «Did you ever think of killing yourself and ending it all?» If they say yes, ask if they have ever thought how they would do it.
If they have thought of a method, such as hanging or overdose, or have suicidal urges e.g. to crash their car into another on the highway, then the suicide risk is significantly increased and they should be referred and monitored closely. If an anti-depressant is prescribed, it is important to advise patients and families that it will take some time to work e.g.
three or four weeks. They should not stop taking the medication if it is not working in a few days or if they feel better after a few weeks. Also, tell them that if they get side effects and stop taking the anti-depressant, they must call you immediately to get a different medication.
Many patients with dementia become depressed. Depression does not exclude dementia. Many people with dementia have depression that may be a feature of dementia and does not respond to treatment.
In the practice of old-age medicine, the MMSE is a very useful test. But one cannot be dogmatic in using this test alone.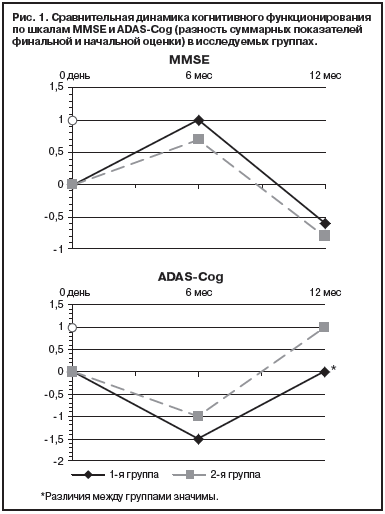 The test must be interpreted in the context of other symptoms and signs.
The test must be interpreted in the context of other symptoms and signs.
Dementia is a heterogeneous disease and these conditions are frequently mixed. For example, Alzheimer’s, Lewy body, vascular dementia and depression frequently co-exist. It is important to be aware that not every patient will fit neatly into a convenient diagnostic box.
Many are not typical and will be «mixed». In these cases, gather information and keep an open mind as you follow their progress. The «typical» patterns with each disease are presented, but do not be too dogmatic applying these «rules» in practice.
Many patients with medical problems have Alzheimer’s Disease and it is important to treat the medical conditions and the dementia.
All of the common dementias are progressive. At present there are no treatments available to stop or arrest these diseases, although there is a growing number of drugs that slow the progress and provide symptomatic relief. It is important to have a tentative diagnosis, stage the disease, start treatment and follow carefully to monitor response and progress.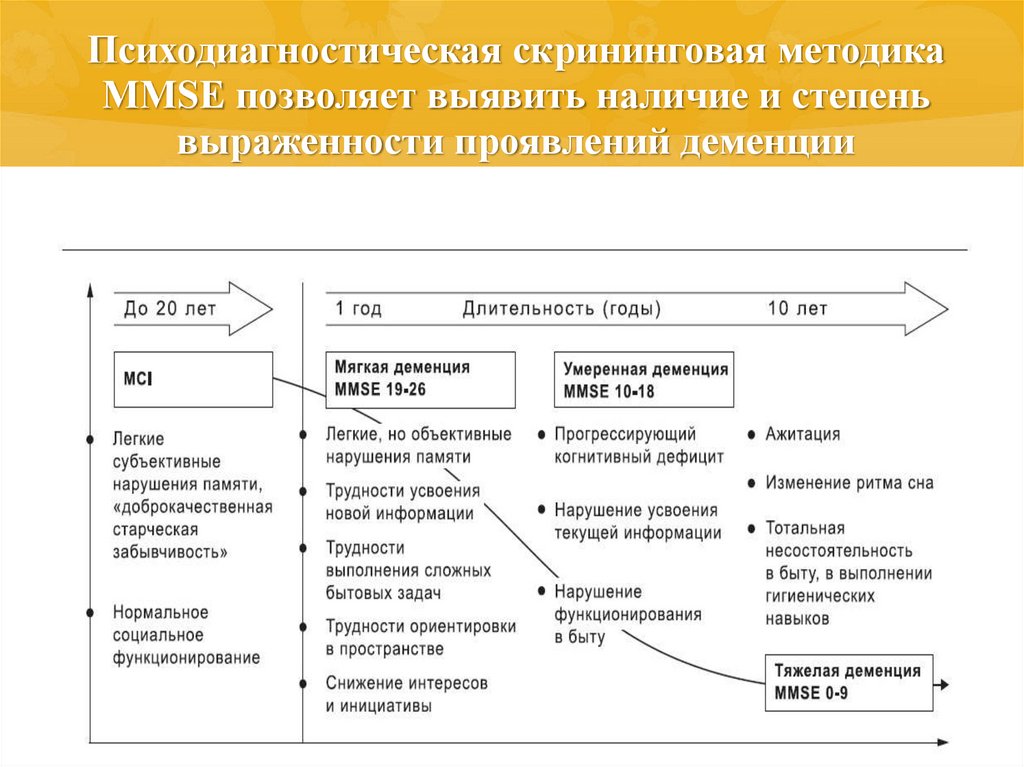
The MMSE is an invaluable tool in this process.
8.0 Care plan for Alzheimer’s disease (and other dementias)
MMSE 25-20
MMSE 19-11
Family should fill dosette and supervise medication-taking. Check, finances, shopping, diet and safety (getting lost etc.). Provide adequate support to family/spouse. Homecare supports. Day Care. Friend ly visitors. Wandering Person Registry
MMSE 10-0
Consider respite care — Day Programs. In-Home respite care. Short Stay Respite Care in a Facility. Nursing Home care. May require a secure unit. Support caregiver in re-starting life on their own. Grief and bereavement counseling for family.
Что такое шкала MMSE
Шкала оценки когнитивных функций MMSE – это опросник, при помощи которого можно выявить признаки деменции (старческое слабоумие) у человека.
Это сборник специальных вопросов, который помогает выявить нарушения мыслительной деятельности людей преклонного возраста или людей с заболеваниями нервной системы.
Это своего рода тестирование, результаты которого определяют тактику лечения больного и эффективность уже проводимой терапии.
Данный вид исследования был впервые применен в 1975 году. С тех пор тестирование несколько раз подвергалось изменениям.
Как происходит опрос
Опрос лучше проводить после редукции депрессивной симптоматики, то есть после периода, когда симптомы депрессии начинают исчезать у потенциального больного.
Проведение опроса от медицинского работника требуется не только большого терпения, но и навыков психологии.
Врач должен сразу сориентироваться настолько быстро необходимо задать вопросы человеку, чтобы не вызвать у него негодование или раздражение.
Тест MMSE для выявления когнитивных нарушений в пожилом возрасте
Тестирование проводит обязательно психиатр. Он обязан найти подход к человеку и предоставить все вопросы таким образом, чтобы больной не подумал, что его подозревают в слабоумии.
Желательно чтобы опрос проводился в комфортных для человека условиях.
Лучше выбрать для этого просторное помещение, которое не будет ассоциироваться у человека с негативом или страхом помещения на лечение в медицинское учреждение.
На исследовании должен присутствовать только психиатр и потенциальный больной.
Пример опросника
Краткая шкала оценки когнитивного состояния MMSE состоит из 30 вопросов.
Тест разделен на части:
- «Ориентация».
- «Восприятие».
- «Внимание и счет».
- «Память».
- «Речь».
- «Выполнение операций».
- «Чтение».
- «Письмо».
- «Копирование».
Ориентация
Первый вопрос, который задает больному врач: «Какое сегодня число?». Последующие два вопроса краткой шкалы MMSE про нынешний месяц и год.
Затем больного спрашивают о дне недели на нынешний момент тестирования. После этого больной должен ответить, в каком городе и области он находится в данное время.
Следующий вопрос касается места его нахождения, то есть учреждения, где проводится тестирование.
Тест на ориентацию — один из этапов шкалы MMSE
Также человеку, который проходит опрос, потребуется ответить на каком этаже проводится исследование.
Последний вопрос из раздела «ориентация» касается страны проживания и нахождения человека в данный момент.
Восприятие
Раздел теста «восприятие» заключается в том, что врач медленно называет пациенту 3 слова «мяч, флаг, дверь», а затем просит больного повторить только что произнесённые слова. За каждое правильно названное слово ставится 1 балл.
Внимание и счет
Данный раздел разделяется на 2 части.
Медработник просит пациента мысленно отнимать от 100 цифру 7 и произносить вслух результат.
Когда число 7 было отнято 5 раз, врач прекращает тестирование и записывает результат. За каждый правильный ответ – 1 балл.
Внимание и счет — этап тестирования MMSE
Вторая часть раздела проводится только в том случае, если человек не смог дать ни одного правильного ответа на предыдущий опрос.
Данное задание заключается в том, чтобы воспроизвести слово «земля» в обратном порядке. За каждую правильно названную букву полагается 1 балл.
Память
В разделе память повторяется задание из раздела «восприятие».
Человека просят назвать ранее произнесенные 3 слова «мяч, флаг, дверь» (врач их не называет).
Медицинский работник по очереди показывает человеку часы и карандаш просит его назвать название данных предметов.
Также в данном разделе больному предстоит повторить полностью фразу «Не если, и, или нет».
Выполнение операций
Суть данного задания заключается в том, что больному дается в правую руку листок, который необходимо сначала положить пополам, а затем положить его на колено.
Результат оценивается по 3 действиям:
- Взял в руку листок – 1 балл.
- Сложил его пополам – 1 балл.
- Положил лист на колено – 1 балл.
Чтение
Суть задания – на листке крупными буквами пишется «Закройте глаза».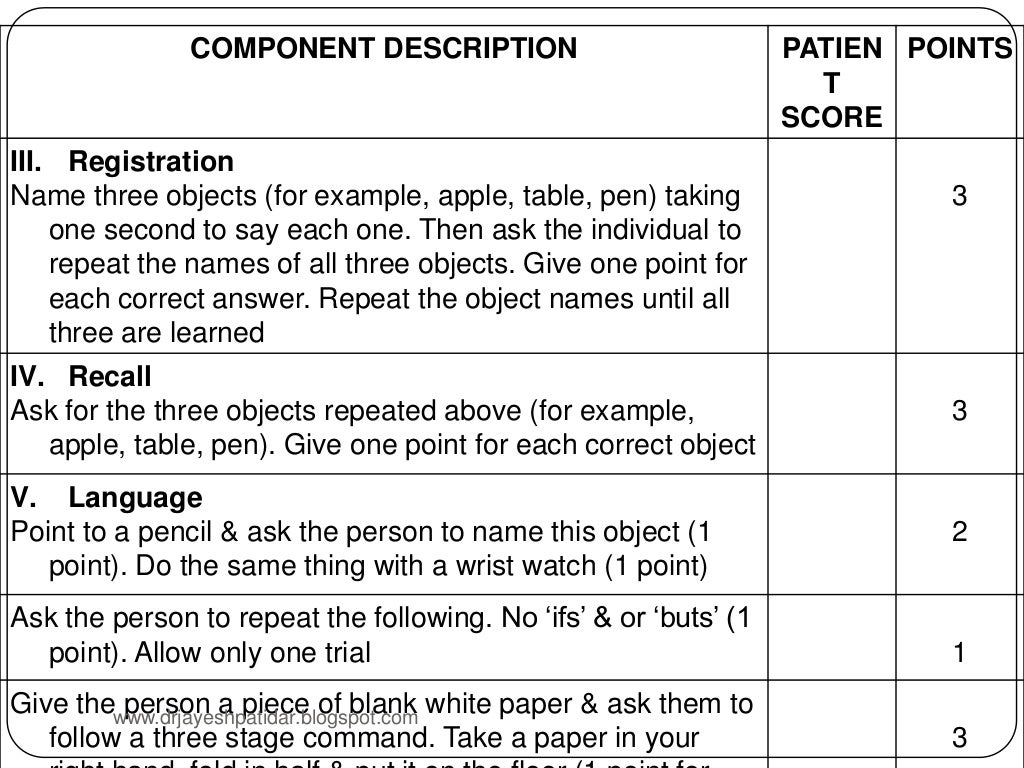 Пациент должен прочитать и выполнить задание, то есть закрыть глаза.
Пациент должен прочитать и выполнить задание, то есть закрыть глаза.
Письмо
Задание – больному требуется написать на листке предложение, которое должно содержать существительное и глагол.
Проверка письменных возможностей по тесту MMSE
Задание считается выполненным, если предложение было написано, оно является осмысленным и не содержит грамматических ошибок.
Копирование
Человеку показывают рисунок, на котором изображено 2 пересекающихся пятиугольника.
Задание – воспроизвести на листке бумаги фигуры в таком же расположении.
Оценка результатов исследования
Оцениванием результатов занимается врач-психиатр. Результаты по нейропсихологическому обследованию по шкале MMSE отображаются в количестве правильных ответов больного.
Всего в тесте 30 вопросов, значит максимальный балл – 30 баллов. Данный показатель указывается на высокие когнитивные способности и показывает, что у человека отсутствуют признаки деменции./10_m2.jpg)
Оценка результатов исследования тестирования MMSE
Нормальным результатом также считается количество баллов от 28 до 30. Если человек ответил правильно на 24 – 27 вопросов, то ему ставится предварительный диагноз «наличие когнитивных нарушений».
Если результат тестирования от 20 до 23 баллов, то это показатель деменции лёгкой степени выраженности.
Если человек отвечает на 11 – 19 вопросов правильно, то на основе тестирования можно сделать вывод, что больной страдает деменцией умеренной степени выраженности.
Если количество правильных ответов не превышает 10, то это свидетельствует о наличии тяжелой деменции у человека.
Выявление деменции с помощью мини-обследования психического состояния у высокообразованных лиц | Деменция и когнитивные нарушения | JAMA Неврология
Абстрактный
Цель Оценить полезность результатов мини-теста психического состояния (MMSE) для выявления когнитивной дисфункции в выборке высокообразованных людей.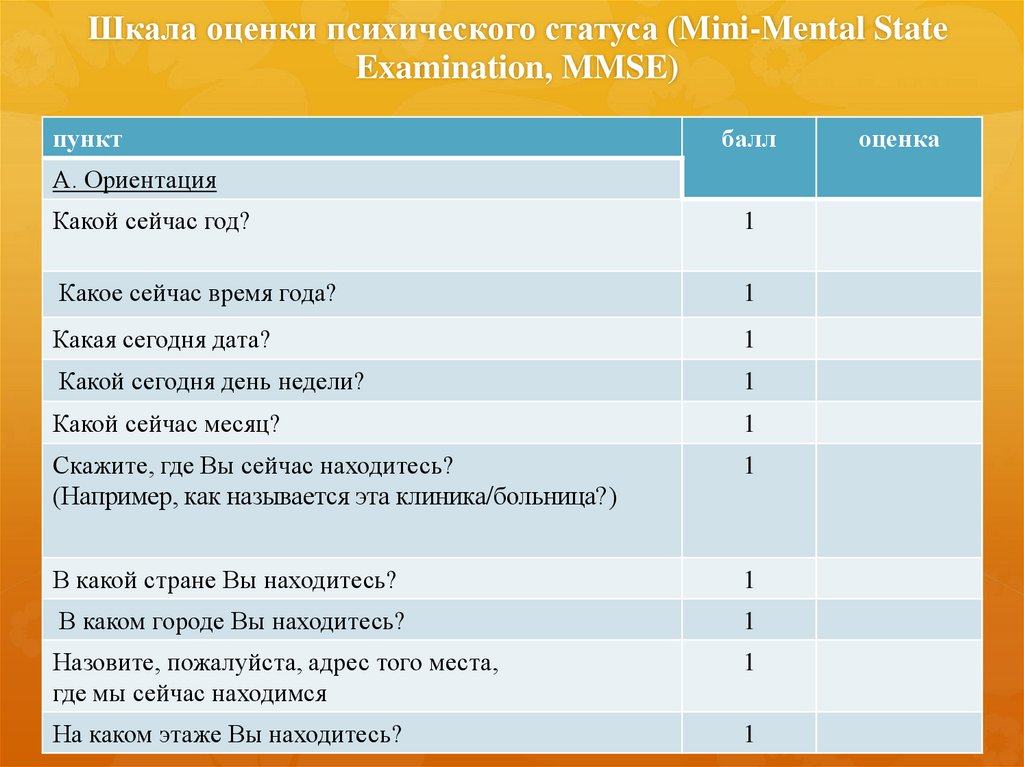
Дизайн Были проанализированы архивные данные о 4248 участниках, зарегистрированных в Центре исследования болезни Альцгеймера клиники Майо и в Реестре пациентов с болезнью Альцгеймера.
Пациенты В общей сложности был выявлен 1141 преимущественно белый (93%) человек с 16 или более годами образования, по самооценке. В их число вошли 307 (164 мужчины и 143 женщины) пациентов с деменцией (любого типа), 176 (106 мужчин и 70 женщин) пациентов с легкими когнитивными нарушениями и 658 (242 мужчины и 416 женщин) участников контрольной группы без деменции.
Настройка Центр исследования болезни Альцгеймера клиники Майо и когорта Регистра пациентов с болезнью Альцгеймера.
Показатели основных результатов Оценки диагностической точности (чувствительность, специфичность и положительная и отрицательная прогностическая сила) MMSE снижают баллы при обнаружении когнитивной дисфункции.
Результаты В этой выборке высокообразованных, в основном белых пожилых людей стандартный балл MMSE, равный 24 (23 или ниже), дал чувствительность 0,66, специфичность 0,99 и общий уровень правильной классификации 89% при выявлении деменции. Сокращенный балл до 27 (26 или ниже) привел к оптимальному балансу чувствительности и специфичности (0,89).и 0,91 соответственно) с общим уровнем правильной классификации 90%. В группе с когнитивными нарушениями (слабоумие и легкие когнитивные нарушения) более подходящим может быть пороговый балл 27 (чувствительность 0,69; специфичность 0,91) или 28 (чувствительность и специфичность 0,78).
Заключение Пожилые пациенты с высшим образованием, которые предъявляют жалобы на ухудшение когнитивных функций (о которых сообщают они сами или другие лица) и набирают менее 27 баллов по шкале MMSE, подвергаются большему риску диагностирования деменции и должны быть направлены на всестороннее обследование на предмет деменции, включая формальное обследование. нейропсихологическое тестирование.
нейропсихологическое тестирование.
Мини-тест психического состояния (MMSE) 1 — это наиболее часто проводимая психометрическая скрининговая оценка когнитивных функций. MMSE используется для скрининга пациентов на предмет когнитивных нарушений, отслеживания изменений когнитивных функций с течением времени и часто для оценки влияния терапевтических средств на когнитивные функции. 2 С момента его разработки было опубликовано множество литературы по MMSE, демонстрирующей, что он является относительно чувствительным маркером явной деменции. 3 -5 Однако его полезность снижается при обследовании пациентов с умеренным снижением когнитивных функций и психическими расстройствами. 6 -8
Показатели MMSE зависят от демографических переменных, при этом баллы снижаются с возрастом и низким уровнем образования. 9 Хотя нормативные данные, стратифицированные по возрасту и уровню образования, были опубликованы, 10 -12 эти исследования были сосредоточены почти исключительно на влиянии более низкого уровня образования, в то время как остается относительно мало доступной информации относительно соответствующих сокращенных баллов или интерпретационных стратегий для высокообразованные личности. Этот пробел особенно проблематичен, учитывая выводы в литературе, касающиеся когнитивного резерва. 13 Эта литература показывает, что после постановки диагноза пациенты с вероятной болезнью Альцгеймера, которые имеют более высокий уровень образования, как правило, демонстрируют более крутой наклон снижения 14 ,15 и более ранние уровни смертности. 15 Выявление когнитивной дисфункции у этих людей желательно как можно раньше, чтобы соответствующие стратегии лечения могли быть реализованы на более ранних стадиях заболевания. Однако на сегодняшний день авторам неизвестны какие-либо опубликованные исследования, в которых специально изучалась полезность MMSE для выявления когнитивной дисфункции у высокообразованных людей. Текущее исследование изучало этот вопрос у лиц с образованием не менее 16 лет. Было высказано предположение, что у высокообразованных пациентов часто применяемая шкала сокращения MMSE составляет 24,9 балла.0033 9 не даст адекватного баланса между чувствительностью и специфичностью, и что для достижения оптимальных оценок диагностической точности потребуется использовать более высокий пороговый балл.
Этот пробел особенно проблематичен, учитывая выводы в литературе, касающиеся когнитивного резерва. 13 Эта литература показывает, что после постановки диагноза пациенты с вероятной болезнью Альцгеймера, которые имеют более высокий уровень образования, как правило, демонстрируют более крутой наклон снижения 14 ,15 и более ранние уровни смертности. 15 Выявление когнитивной дисфункции у этих людей желательно как можно раньше, чтобы соответствующие стратегии лечения могли быть реализованы на более ранних стадиях заболевания. Однако на сегодняшний день авторам неизвестны какие-либо опубликованные исследования, в которых специально изучалась полезность MMSE для выявления когнитивной дисфункции у высокообразованных людей. Текущее исследование изучало этот вопрос у лиц с образованием не менее 16 лет. Было высказано предположение, что у высокообразованных пациентов часто применяемая шкала сокращения MMSE составляет 24,9 балла.0033 9 не даст адекватного баланса между чувствительностью и специфичностью, и что для достижения оптимальных оценок диагностической точности потребуется использовать более высокий пороговый балл.
Методы
Были проанализированы архивные данные о 4248 последовательных участниках, включенных в базу данных Центра исследования болезни Альцгеймера клиники Майо и реестра пациентов с болезнью Альцгеймера. Реестр пациентов с болезнью Альцгеймера в Рочестере-Майо отвечает за набор пациентов с деменцией и контрольных участников без деменции для исследований прогрессирования болезни Альцгеймера через Департамент общественной и внутренней медицины и не работает в Джексонвилле. Центры исследования болезни Альцгеймера в Рочестере и Джексонвилле принимают пациентов с деменцией из отдела поведенческой неврологии отделения неврологии. Центр исследования болезни Альцгеймера в Джексонвилле также набирает участников общественного контроля через церкви и общественные организации. Одни и те же критерии включения/исключения применяются к контрольным участникам на обоих сайтах набора и широко публикуются в результате анализа нормативных исследований пожилых американцев Мэйо 9. 0033 16 -19 и нормативные исследования пожилых афроамериканцев Мэйо 20 -22 . Пациенты с проблемами памяти, о которых сообщил сам пациент, член семьи или врач, проходят всестороннее неврологическое обследование и нейропсихологическое тестирование для подтверждения или исключения деменции и болезни Альцгеймера.
0033 16 -19 и нормативные исследования пожилых афроамериканцев Мэйо 20 -22 . Пациенты с проблемами памяти, о которых сообщил сам пациент, член семьи или врач, проходят всестороннее неврологическое обследование и нейропсихологическое тестирование для подтверждения или исключения деменции и болезни Альцгеймера.
В общей сложности было выявлено 1141 человек с 16 или более годами образования, о которых они сообщили сами. В выборку вошли 1064 (93%) человека, которые идентифицировали себя как белые, и 77 (7%), которые идентифицировали себя как афроамериканцы. Из 1141 участника 658 человек (242 мужчины и 416 женщин) не страдали деменцией и считались когнитивно-нормальными (см. Ivnik et al. 9).0033 19 для полных критериев, используемых для определения нормального познания). У остальных 307 участников (164 мужчины и 143 женщины) диагнозы деменции были установлены консенсусом исследователей Центра исследования болезни Альцгеймера и на основании опубликованных диагностических критериев. Диагнозы включали 202 пациента с вероятной болезнью Альцгеймера (66%), 48 с деменцией с тельцами Леви (16%), 18 с лобно-височной деменцией (6%), 13 с сосудистой деменцией (4%) и 25 с деменцией другой этиологии (8). %). Для целей сравнения также была включена выборка из 176 пациентов (106 мужчин и 70 женщин), у которых были диагностированы легкие когнитивные нарушения.
Диагнозы включали 202 пациента с вероятной болезнью Альцгеймера (66%), 48 с деменцией с тельцами Леви (16%), 18 с лобно-височной деменцией (6%), 13 с сосудистой деменцией (4%) и 25 с деменцией другой этиологии (8). %). Для целей сравнения также была включена выборка из 176 пациентов (106 мужчин и 70 женщин), у которых были диагностированы легкие когнитивные нарушения.
Общая выборка включала 512 мужчин (45%) и 629 женщин (55%) со средним (SD) возрастом 75,9 (7,2) лет и средним (SD), по самооценке, уровнем образования 17,1 (1,5) года. . Существенных различий между группами (с деменцией и без деменции) по возрасту, полу или уровню образования не было.
В то время как MMSE был доступен на диагностических собраниях, диагноз деменции (и особенно подтипа) был установлен на основе консенсуса с учетом данных неврологического осмотра, клинического опроса, результатов лабораторных исследований, визуализации, оценок информаторов ежедневной активности. жизни, данные нейропсихологических тестов. Таким образом, MMSE оказал минимальное влияние на диагностические решения в когорте больных деменцией и вообще не рассматривался как часть определения контрольного статуса.
Таким образом, MMSE оказал минимальное влияние на диагностические решения в когорте больных деменцией и вообще не рассматривался как часть определения контрольного статуса.
Полученные результаты
Оценки чувствительности и специфичности были рассчитаны для сокращенных баллов MMSE от 16 (т.е. 15 и ниже) до 30 (т.е. 29 и ниже). Результаты сравнения участников контрольной группы без деменции с участниками, у которых диагностирована какая-либо форма деменции, представлены в таблице 1 и проиллюстрированы графиком рабочих характеристик приемника на рисунке. Традиционный предельный балл 24 (23 или ниже) дает умеренную оценку чувствительности (0,66) с очень высокой специфичностью (0,9).9) и общий уровень правильной классификации 88,9%. Скромная чувствительность теста отражает неспособность традиционной сокращённой шкалы выявить значительное число пациентов с деменцией в этой высокообразованной выборке. В частности, 104 пациента с деменцией (34%) в этой выборке были ошибочно классифицированы как не страдающие деменцией.
Оптимальный баланс между чувствительностью (0,89) и специфичностью (0,91) был достигнут при сокращении баллов 27 (26 или ниже). Это дало лишь небольшое улучшение общего показателя правильной классификации (90,1%), но идентифицировали 70 из 104 пациентов с деменцией, которые были пропущены при использовании традиционного порогового значения. Сокращенный балл 27 дает отношение правдоподобия 9,6, что указывает на то, что выпускники колледжей с оценкой MMSE 26 и с жалобами на снижение когнитивных функций (о которых сообщают они сами или другие) почти в 10 раз чаще страдают деменцией, чем те, кто получил оценку от 27 и выше.
Как и ожидалось, улучшенная чувствительность, полученная при повышении порогового значения до 27, достигается за счет снижения специфичности. В результате 61 (9%) участников без деменции попадают ниже верхнего порогового значения по сравнению только с 3 (< 1%) участниками с ложноположительной идентификацией при традиционном пороговом показателе 24.
Вышеупомянутые анализы были рассчитаны для группы с когнитивными нарушениями (легкие когнитивные нарушения и деменция) по сравнению с участниками контрольной группы, чтобы определить, можно ли получить соответствующий отсеченный балл. Оценки чувствительности и специфичности представлены в Таблице 2. Традиционный пороговый показатель, равный 24, дает очень низкую чувствительность (0,45), но идеальную специфичность (1,0) (Таблица 2). Повышение показателя сокращения до 27 дает повышенную чувствительность (0,69) с сопутствующим снижением, хотя и все еще впечатляющей, специфичностью (0,91).
Оценки чувствительности и специфичности представлены в Таблице 2. Традиционный пороговый показатель, равный 24, дает очень низкую чувствительность (0,45), но идеальную специфичность (1,0) (Таблица 2). Повышение показателя сокращения до 27 дает повышенную чувствительность (0,69) с сопутствующим снижением, хотя и все еще впечатляющей, специфичностью (0,91).
Хотя показатели чувствительности и специфичности важны для установления диагностической валидности показателей теста, таких как MMSE, диагностическая полезность определенного балла, полученного конкретным пациентом, представлена прогностическими значениями теста. Положительные прогностические значения (PPV) представляют вероятность того, что пациент с оценкой ниже порогового значения действительно имеет интересующее состояние. И наоборот, отрицательные прогностические значения (NPV) представляют вероятность того, что у пациента с оценкой выше отсечки нет интересующего состояния. В отличие от чувствительности и специфичности, на PPV и NPV влияет базовая частота исследуемого состояния в целевой популяции. В текущем исследовании, где базовая частота деменции (группа только с деменцией) составляла 32%, PPV и NPV для традиционного порогового значения 24 составили 0,9.7 и 0,86 соответственно. Использование порогового значения 27 дало более низкую PPV (0,82), но более высокую NPV (0,94). При рассмотрении группы с когнитивными нарушениями (легкие когнитивные нарушения и деменция) стандартный пороговый балл, равный 24, дает очень низкую чувствительность (0,45), но идеальную специфичность (1,0). Оптимальный баланс чувствительности и специфичности был найден при сокращении баллов 27 (PPV, 0,78; NPV, 0,86) или 28 (PPV, 0,63; NPV, 0,88). В таблице 3 представлены расчеты прогностической ценности для обеих групп для клиницистов, которые хотят применить эти данные в условиях, где базовые показатели когнитивных нарушений и/или деменции отличаются от показателей текущего исследования.
В текущем исследовании, где базовая частота деменции (группа только с деменцией) составляла 32%, PPV и NPV для традиционного порогового значения 24 составили 0,9.7 и 0,86 соответственно. Использование порогового значения 27 дало более низкую PPV (0,82), но более высокую NPV (0,94). При рассмотрении группы с когнитивными нарушениями (легкие когнитивные нарушения и деменция) стандартный пороговый балл, равный 24, дает очень низкую чувствительность (0,45), но идеальную специфичность (1,0). Оптимальный баланс чувствительности и специфичности был найден при сокращении баллов 27 (PPV, 0,78; NPV, 0,86) или 28 (PPV, 0,63; NPV, 0,88). В таблице 3 представлены расчеты прогностической ценности для обеих групп для клиницистов, которые хотят применить эти данные в условиях, где базовые показатели когнитивных нарушений и/или деменции отличаются от показателей текущего исследования.
Комментарий
Текущие результаты показывают, что традиционная 24-балльная шкала MMSE не обеспечивает оптимальной точности классификации высокообразованных белых пациентов с деменцией.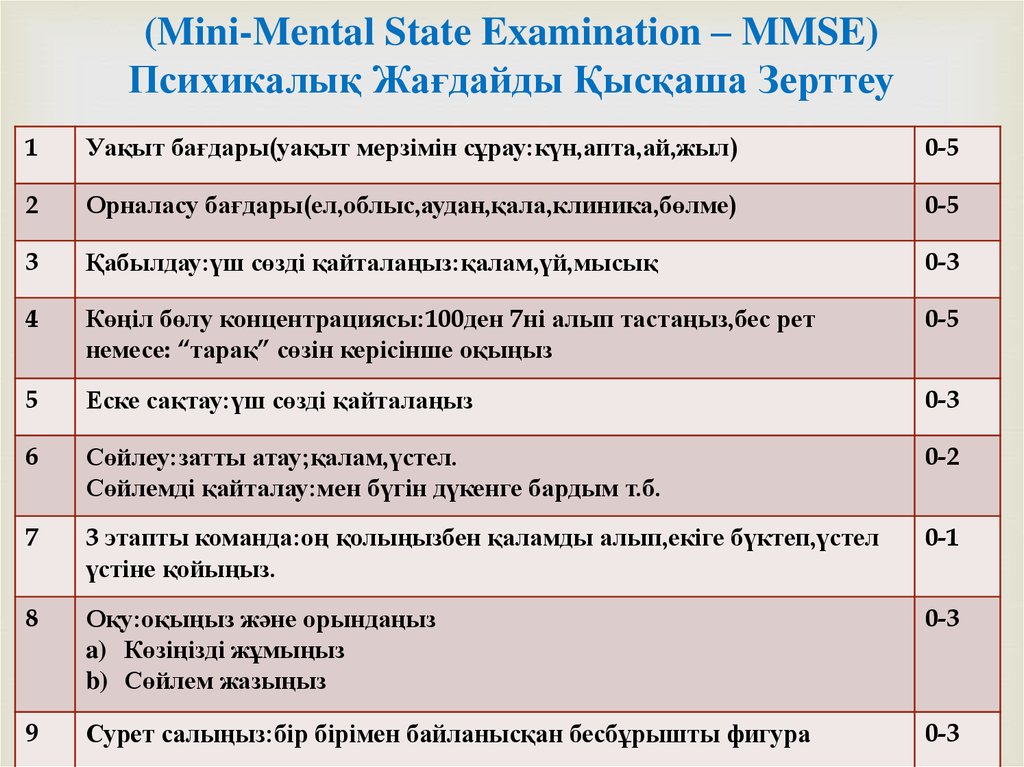 Вместо этого более строгий пороговый балл 27 дает большую клиническую пользу для выявления деменции у высокообразованных людей. Несмотря на ожидаемое сопутствующее увеличение числа ложноположительных идентификаций с использованием более высокого порогового показателя, предпочтительнее жертвовать специфичностью в обмен на значительный выигрыш в чувствительности, когда целью скрининга психического статуса является раннее выявление возможной деменции.
Вместо этого более строгий пороговый балл 27 дает большую клиническую пользу для выявления деменции у высокообразованных людей. Несмотря на ожидаемое сопутствующее увеличение числа ложноположительных идентификаций с использованием более высокого порогового показателя, предпочтительнее жертвовать специфичностью в обмен на значительный выигрыш в чувствительности, когда целью скрининга психического статуса является раннее выявление возможной деменции.
Текущие анализы также показывают, что, когда рассматриваются легкие когнитивные нарушения, очень сложно достичь оптимального баланса между чувствительностью и специфичностью. В таблице 2 показано, что оптимальное соотношение между чувствительностью и специфичностью достигается при пороговых значениях 27 (чувствительность 0,69; специфичность 0,91) или 28 (чувствительность и специфичность 0,78). NPV и PPV для группы с когнитивными нарушениями, использующие традиционный сокращенный балл 24, впечатляют даже при низких базовых показателях; однако это функция совершенной специфичности и низких базовых показателей.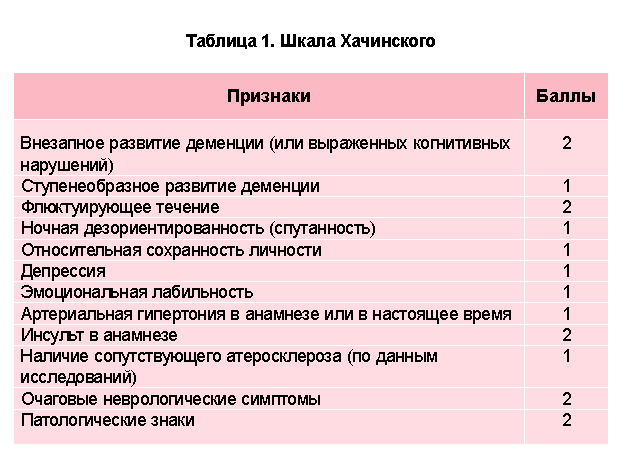 Для практикующих клиницистов это означает очень высокий уровень ложноотрицательных результатов (часто ≥ 50%), что означает, что из-за небольшого числа истинных случаев в условиях низкой базовой частоты большая часть людей, страдающих когнитивной дисфункцией, не будет выявить и направить на всестороннее обследование и/или лечение. Таблица 3 позволяет отдельному врачу определить, какую(ие) шкалу(ы) сокращения он или она желает применить, учитывая характер контингента клиники (например, демографические данные, соответствующий базовый показатель), дополнительную информацию, полученную при медицинском обследовании ( т. е. скрининг на когнитивные нарушения по сравнению с деменцией, если получена информация о функциональных изменениях), а также его или ее предпочтения в отношении потенциальных диагностических ошибок (т. е. частота ложноотрицательных и ложноположительных результатов).
Для практикующих клиницистов это означает очень высокий уровень ложноотрицательных результатов (часто ≥ 50%), что означает, что из-за небольшого числа истинных случаев в условиях низкой базовой частоты большая часть людей, страдающих когнитивной дисфункцией, не будет выявить и направить на всестороннее обследование и/или лечение. Таблица 3 позволяет отдельному врачу определить, какую(ие) шкалу(ы) сокращения он или она желает применить, учитывая характер контингента клиники (например, демографические данные, соответствующий базовый показатель), дополнительную информацию, полученную при медицинском обследовании ( т. е. скрининг на когнитивные нарушения по сравнению с деменцией, если получена информация о функциональных изменениях), а также его или ее предпочтения в отношении потенциальных диагностических ошибок (т. е. частота ложноотрицательных и ложноположительных результатов).
Подавляющее большинство опубликованной литературы, посвященной изучению взаимосвязи между результатами когнитивных тестов и образованием, сосредоточено на группах населения с низким уровнем образования без учета лиц с более высоким уровнем образования./32/32.jpg) Фактически, исследования показывают, что более низкие баллы по шкале MMSE подходят для оценки населения с низким уровнем образования, 11 и формулы коррекции были опубликованы. 5 Уровень образования часто считается проявлением когнитивного резерва, при этом более высокий уровень образования связан с большей резервностью и большей способностью выдерживать невропатологическое бремя до появления обнаруживаемых признаков заболевания. 13 Считается, что люди с большим когнитивным резервом сохраняют более высокий уровень когнитивных функций на ранних стадиях дегенеративной деменции. Считается, что к тому времени, когда когнитивные симптомы впервые выявлены, эти пациенты имеют значительно большее бремя болезни и более быстрое последующее ухудшение. Идентификация таких лиц на более ранней стадии развития и прогрессирования заболевания желательна как для лечения, так и для исследовательских целей.
Фактически, исследования показывают, что более низкие баллы по шкале MMSE подходят для оценки населения с низким уровнем образования, 11 и формулы коррекции были опубликованы. 5 Уровень образования часто считается проявлением когнитивного резерва, при этом более высокий уровень образования связан с большей резервностью и большей способностью выдерживать невропатологическое бремя до появления обнаруживаемых признаков заболевания. 13 Считается, что люди с большим когнитивным резервом сохраняют более высокий уровень когнитивных функций на ранних стадиях дегенеративной деменции. Считается, что к тому времени, когда когнитивные симптомы впервые выявлены, эти пациенты имеют значительно большее бремя болезни и более быстрое последующее ухудшение. Идентификация таких лиц на более ранней стадии развития и прогрессирования заболевания желательна как для лечения, так и для исследовательских целей.
В текущей выборке недостаточно данных, чтобы проверить сравнительную точность индивидуальных сокращенных баллов между высокообразованными людьми из разных этнических групп.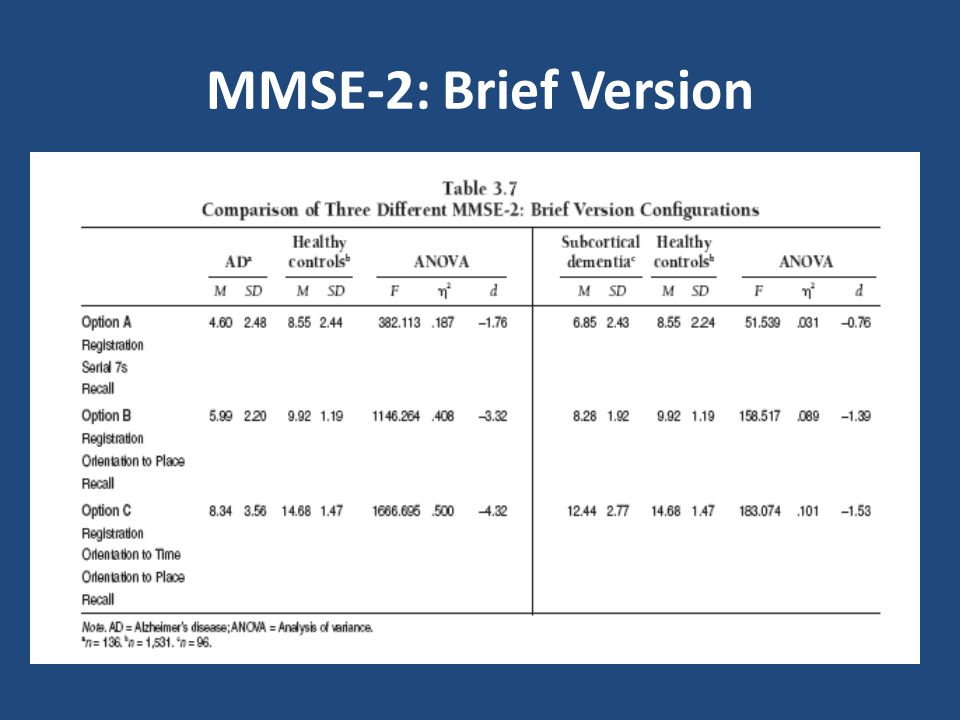 Следовательно, текущие данные о белых людях должны быть проверены среди этнических меньшинств, прежде чем можно будет делать обобщения. Кроме того, выборка является англоязычной, и следует соблюдать осторожность при попытке обобщить неанглоязычных лиц или лиц, для которых английский является вторым языком. Следует также отметить, что MMSE вводился как часть клинического обследования и не использовался как часть критериев включения/исключения из базы данных исследования. Таким образом, MMSE не использовался в качестве скрининга когнитивных функций в этой выборке и мог работать по-разному при использовании в этом контексте (например, в эпидемиологических исследованиях).
Следовательно, текущие данные о белых людях должны быть проверены среди этнических меньшинств, прежде чем можно будет делать обобщения. Кроме того, выборка является англоязычной, и следует соблюдать осторожность при попытке обобщить неанглоязычных лиц или лиц, для которых английский является вторым языком. Следует также отметить, что MMSE вводился как часть клинического обследования и не использовался как часть критериев включения/исключения из базы данных исследования. Таким образом, MMSE не использовался в качестве скрининга когнитивных функций в этой выборке и мог работать по-разному при использовании в этом контексте (например, в эпидемиологических исследованиях).
Текущие результаты не предназначены для поощрения диагностики когнитивных нарушений или деменции на основании только общих баллов MMSE. Вместо этого эти результаты предоставляют практикующим врачам пересмотренные критерии для надлежащего ведения высокообразованных пожилых белых пациентов. В частности, пожилые пациенты с жалобами на память (о которых сообщают они сами или другие), получившие высшее образование или более высокий уровень образования и набравшие менее 27 баллов по шкале MMSE, подвергаются повышенному риску когнитивной дисфункции и деменции и должны быть направлены на обследование.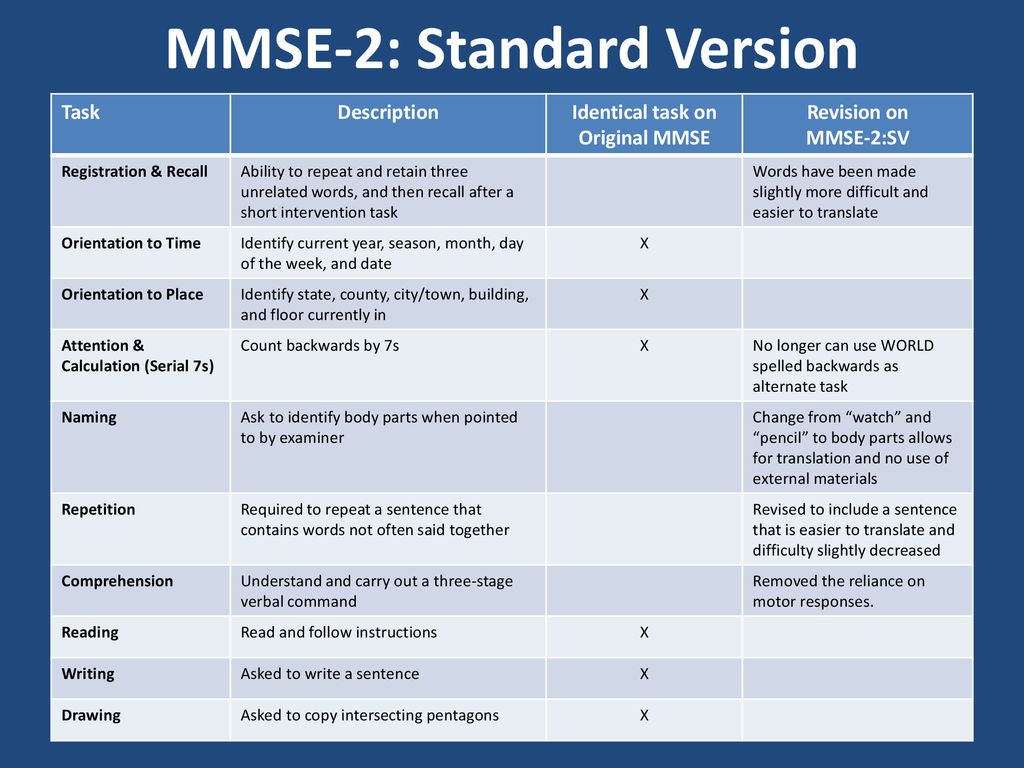 всесторонняя оценка, включая формальные нейропсихологические исследования. Когда раннее выявление является основной целью скрининга, затраты, связанные с дальнейшей оценкой лиц, у которых впоследствии не будет обнаружено деменции, перевешиваются преимуществами выявления значительно большего числа лиц, находящихся на самых ранних стадиях деменции, где раннее вмешательство и/или участие в клинических испытаниях может принести максимальную пользу.
всесторонняя оценка, включая формальные нейропсихологические исследования. Когда раннее выявление является основной целью скрининга, затраты, связанные с дальнейшей оценкой лиц, у которых впоследствии не будет обнаружено деменции, перевешиваются преимуществами выявления значительно большего числа лиц, находящихся на самых ранних стадиях деменции, где раннее вмешательство и/или участие в клинических испытаниях может принести максимальную пользу.
Для переписки: Сид Э. О’Брайант, доктор философии, кафедра нейропсихиатрии и поведенческих наук, Центр медицинских наук Техасского технического университета, 3601 4th St, STOP 8321, Лаббок, Техас 79430 ([email protected]).
Принято к публикации: 24 января 2008 г.
Финансирование/поддержка: Это исследование было поддержано грантами P50 AG16574 и U01 AG06786 Национального института старения, а также Робертом и Кларисой Смит и Эбигейл Ван Бюрен. Программа исследований болезни Альцгеймера.
Вклад авторов: Концепция и дизайн исследования : О’Брайант, Ивник, Петерсен и Лукас. Сбор данных : Смит, Ивник, Графф-Рэдфорд и Лукас. Анализ и интерпретация данных : О’Брайант, Хамфрис, Смит и Лукас. Составление рукописи : О’Брайант и Петерсен. Критический пересмотр рукописи на предмет важного интеллектуального содержания : О’Брайант, Хамфрис, Смит, Ивник, Графф-Рэдфорд и Лукас. Статистический анализ : О’Брайант и Лукас. Получено финансирование : Графф-Рэдфорд и Петерсен. Административная, техническая и материальная поддержка : Хамфрис, Смит, Ивник и Лукас. Учебный надзор : Ивник и Лукас.
Раскрытие финансовой информации: Д-р Петерсен является консультантом компаний Elan и GE Healthcare и спикером компании Servier. Все остальные авторы сообщают об отсутствии конфликта интересов.
использованная литература
1.
Фольштейн М.Ф. Фольштейн SE Макхью PR «Минипсихическое состояние»: практический метод оценки когнитивного состояния пациентов для клинициста. J Psychiatr Res 1975;12 (3) 189- 198PubMedGoogle ScholarCrossref
2.
Штраус ЭШерман ЭМССприн O Сборник нейропсихологических тестов: введение, нормы и комментарии. 3-е изд. Оксфорд, Англия, издательство Оксфордского университета, 2006 г .;
3.
Харван Дж. Р. Коттер V Оценка скрининга деменции в условиях первичной медико-санитарной помощи. J Am Acad Nurse Pract 2006;18 (8) 351- 360PubMedGoogle ScholarCrossref
4.
Грут
М.Фратильони
Л.Виитанен
МВинблад
B Точность мини-обследования психического статуса в качестве скринингового теста на деменцию у пожилого населения Швеции. Acta Neurol Scand 1993;87
(4)
312- 317PubMedGoogle ScholarCrossref
Acta Neurol Scand 1993;87
(4)
312- 317PubMedGoogle ScholarCrossref
5.
Мунгас ДМаршалл SCWeldon Мхаан МРид BR Коррекция возраста и образования в рамках мини-обследования психического состояния для англо- и испаноязычных пожилых людей. Неврология 1996;46 (3) 700- 706PubMedGoogle ScholarCrossref
6.
Бенедикт Р. Х. Брандт J Ограничение мини-обследования психического состояния для выявления амнезии. J Geriatr Psychiatry Neurol 1992;5 (4) 233- 237PubMedGoogle ScholarCrossref
7.
Nys
ГМван Зандвоорт
МЖде Корт
П.Л.Янсен
BPKappelle
LJde Haan
EH Ограничения мини-обследования психического состояния при остром инсульте.2009/62/12.png) Arch Clin Neuropsychol 2005;20
(5)
623- 629PubMedGoogle ScholarCrossref
Arch Clin Neuropsychol 2005;20
(5)
623- 629PubMedGoogle ScholarCrossref
8.
Томбо Т.Н. Макинтайр NJ Мини-обследование психического состояния: всесторонний обзор. J Am Geriatr Soc 1992;40 (9) 922- 935PubMedGoogle Scholar
9.
Лезак МДХовисон DBLoring DW Нейропсихологическая оценка. 4-е изд. Оксфорд, Англия, издательство Оксфордского университета, 2004 г .;
10.
Браво Геберт R Референтные значения для мини-психического и модифицированного мини-психического состояния, зависящие от возраста и образования, полученные для пожилых людей без деменции. Int J Geriatr Psychiatry 1997;12 (10) 1008- 1018PubMedGoogle ScholarCrossref
11.
Крам Р.М.Энтони Джей Си Бассет ССФольштейн MF Популяционные нормы мини-обследования психического состояния по возрасту и уровню образования. JAMA 1993;269 (18) 2386- 2391PubMedGoogle ScholarCrossref
12.
Томбо Т. Макдауэлл Кристьянссон БиХабли Мини-тест психического состояния (MMSE) и модифицированный MMSE (3MS): психометрическое сравнение и нормативные данные. Psychol Assess 1996;848- 59Google ScholarCrossref
13.
Стерн Y Когнитивный резерв и болезнь Альцгеймера. Ассоциированная болезнь Альцгеймера 2006;20 (3) ((3 доп. 2)) S69- S74PubMedGoogle ScholarCrossref
14.
Scarmeas
Н. Альберт
СММэнли
Дж. Дж. Стерн
Y Образование и темпы снижения когнитивных функций при заболевании болезнью Альцгеймера. J Нейрол Нейрохирург Психиатрия 2006;77
(3)
308- 316PubMedGoogle ScholarCrossref
Альберт
СММэнли
Дж. Дж. Стерн
Y Образование и темпы снижения когнитивных функций при заболевании болезнью Альцгеймера. J Нейрол Нейрохирург Психиатрия 2006;77
(3)
308- 316PubMedGoogle ScholarCrossref
15.
Стерн ЯАльберт STang М-ХЦай W-Y Скорость снижения памяти при БА связана с образованием и родом занятий: когнитивный резерв? Неврология 1999;53 (9) 1942– 1947PubMedGoogle ScholarCrossref
16.
Steinberg Б.А.Беляускас ЛАСмит ГЕИвник Нормативные исследования пожилых американцев Р. Дж. Мэйо: нормы с поправкой на возраст и IQ для теста на определение пути, теста Струпа и контролируемого теста устных словесных ассоциаций MAE. Клин нейропсихологии 2005;19 (3-4) 329- 377PubMedGoogle ScholarCrossref
17.
Steinberg Б.А.Беляускас ЛАСмит ГЕИвник Р.Дж.Малек Нормативные исследования пожилых американцев Дж. Ф. Мэйо: нормы с поправкой на возраст и IQ для теста на слуховое вербальное обучение и теста на визуальное пространственное обучение. Clin Neuropsychol 2005;19 (3-4) 464- 523PubMedGoogle ScholarCrossref
18.
Лукас ЯИвник Р.Дж.Смит Дженерал Электрик и другие. Нормативные данные для шкалы оценки деменции Мэттиса. J Clin Exp Neuropsychol 1998;20 (4) 536- 547PubMedGoogle ScholarCrossref
19.
Ивник
Р.Дж.Малек
JFSmith
GETangalos
Э. Г. Петерсен
Нормы нейропсихологических тестов RC для лиц старше 55 лет COWAT, BNT, MAE Token, WRAT-R Reading, AMNART, STROOP, TMT и JLO.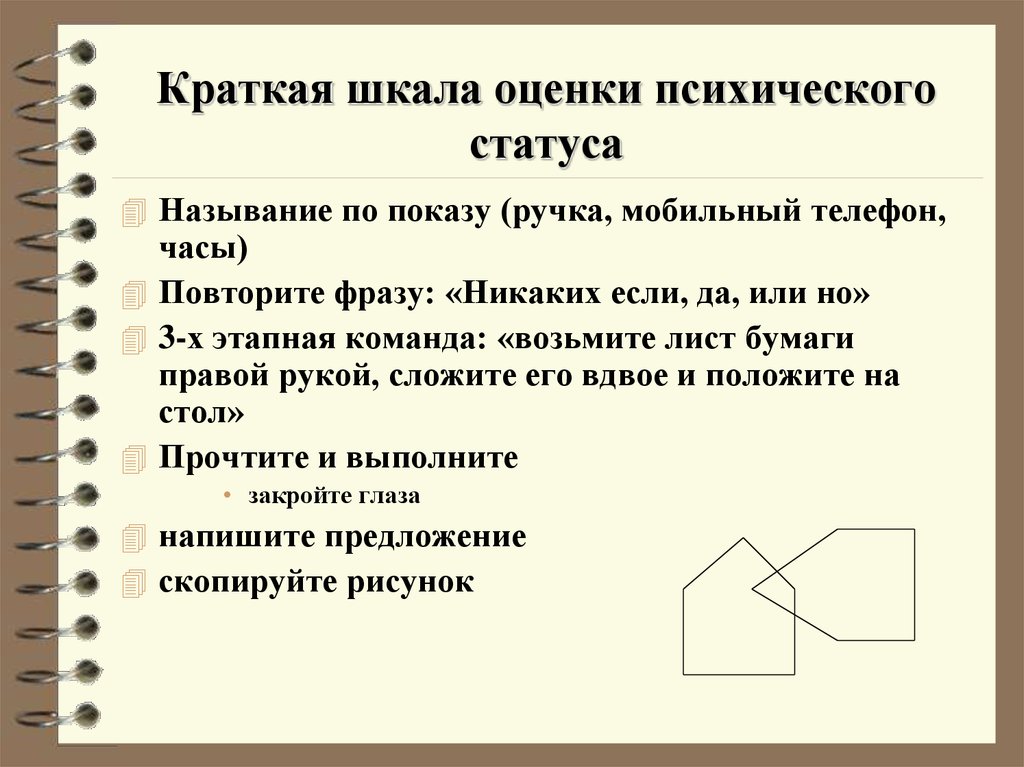 Clin Neuropsychol 1996;10262-278Google ScholarCrossref
Clin Neuropsychol 1996;10262-278Google ScholarCrossref
20.
O’Bryant СЕЛукас Дж.А.Уиллис ФБсмит GEGraff-Radford НРИвник RJ Расхождения между количеством лет образования, о которых сообщают сами, и оценочным уровнем чтения среди пожилых афроамериканцев, проживающих в общине: анализ данных MOAANS. Arch Clin Neuropsychol 2007;22 (3) 327- 332PubMedGoogle ScholarCrossref
21.
Лукас ЯИвник Р.Дж.Смит Дженерал Электрик и другие. Нормативные исследования пожилых афроамериканцев Мэйо: нормы для Бостонского теста на имена, ассоциации контролируемой устной речи, беглости категорий, называния животных, теста на жетоны, чтения Wrat-3, теста на создание следов, теста Струпа и оценки ориентации линии. Clin Neuropsychol 2005;19 (2) 243- 269PubMedGoogle ScholarCrossref
22.
Риллинг Лукас ЯИвник РЖ и другие. Нормативные исследования пожилых афроамериканцев Мэйо: нормы рейтинговой шкалы Мэттиса для деменции. Клин нейропсихологии 2005;19 (2) 229- 242PubMedGoogle ScholarCrossref
[PDF] Мини-обследование психического состояния (MMSE) для выявления болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI).
- .
title={Краткое обследование психического состояния (MMSE) для выявления болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI).},
author={Ingrid Ar{\’e}valo-Rodriguez and Nadja Smailagic and Marta Roqué i Figuls and Agust{\’i}n Ciapponi and Erick Sanchez-Perez and Antri Giannakou and Olga Lucia Pedraza and Xavier Bonfill Косп и Сара Каллум},
journal={Кокрановская база данных систематических обзоров},
год = {2015},
объем = {3},
страницы={
CD010783
}
}
- I.
 Arévalo-Rodriguez, N. Smailagic, S. Cullum
Arévalo-Rodriguez, N. Smailagic, S. Cullum - Опубликовано 5 марта 2015 г.
- Медицина, психология
- Кокрановская база данных систематических обзоров
ПРЕДПОСЫЛКИ Деменция — синдром прогрессирующего глобального когнитивного нарушения. По оценкам, в 2010 году более 35 миллионов человек во всем мире страдали деменцией. У некоторых людей с легкими когнитивными нарушениями (MCI) прогрессирует деменция, но другие остаются стабильными или полностью восстанавливают свои функции. Существует большой интерес к поиску хороших предикторов деменции у людей с ЛКН. Мини-тест психического состояния (MMSE) является наиболее известным и наиболее часто используемым инструментом краткого скрининга для предоставления…
Посмотреть в PubMed
репозиторий.cam.ac.ukМини-тест психического состояния (MMSE) для раннего выявления деменции у людей с легкими когнитивными нарушениями (MCI).
- I. Arévalo-Rodriguez, N. Smailagic, S. Cullum
Медицина, психология
Кокрановская база данных систематических обзоров
- 2021

Краткое обследование психического состояния (MMSE) для выявления болезни Альцгеймера и других видов деменции у людей с легкими когнитивными нарушениями (MCI). , Психология
- I.
- 2018
Мини-оценка психического состояния (MMSE) является наиболее известным и наиболее часто используемым инструментом краткого скрининга для проведения DTA 20 Mini-MSE для выявления болезни Альцгеймера и других деменций у людей. с легкими когнитивными нарушениями.
Мини-обследование психического состояния для выявления болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями.
- P. Skorga, C. Young
Психология, медицина
Клиническая медсестра-специалист по ЦНС
- 2015
Самый известный и часто используемый метод краткого обследования психического состояния (MMSE) для обеспечения общей меры когнитивных нарушений в клинических, общественных и исследовательских условиях.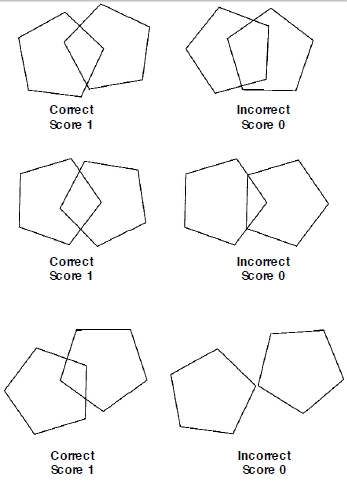
Mini Mental State Examination and Logical Memory scores for entry into Alzheimer’s disease trials
- Kimberly R. Chapman, Hanaan Bing-Canar, R. Stern
Medicine, Psychology
Alzheimer’s Research & Therapy
- 2016
MMSE и LM могут привести к неправильному включению субъектов в крупномасштабные многоцентровые исследования, предназначенные для разработки методов лечения и диагностики БА.
Прогнозирование ухудшения когнитивных функций при болезни Паркинсона с легкими когнитивными нарушениями: годовое обсервационное исследование
- Pei-Hao Chen, Fang-Yu Cheng, Shih-Jung Cheng, Jin-Siang Shaw
Психология, медицина
Болезнь Паркинсона
- 2020
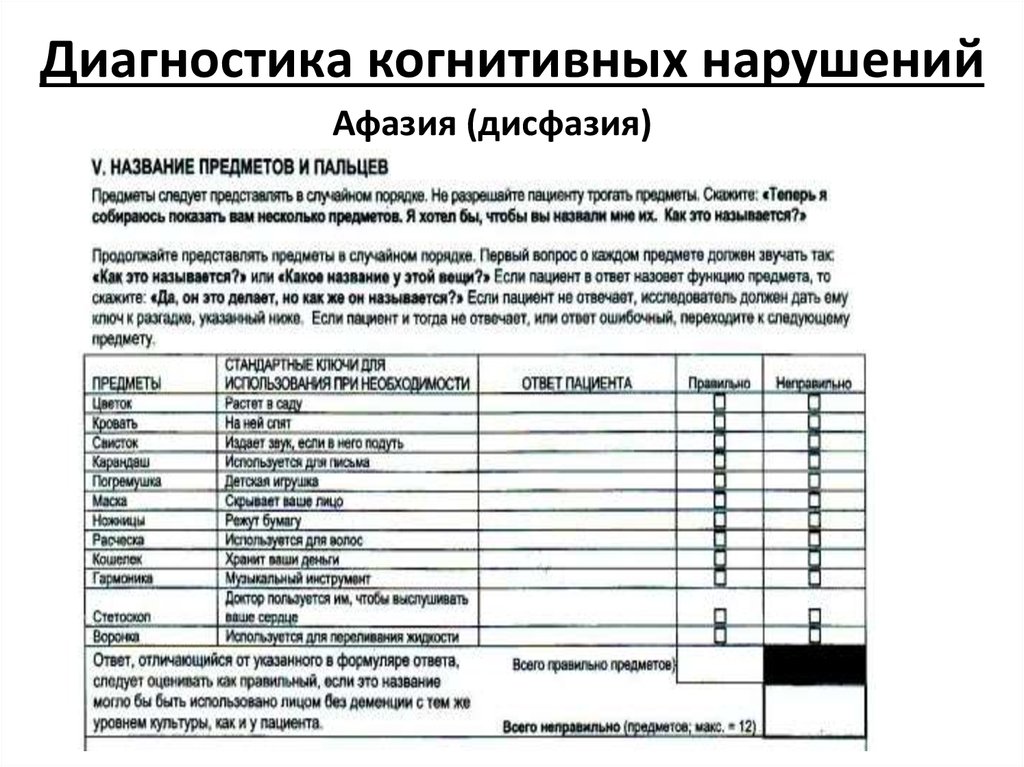
Иерархическая байесовская модель латентного класса для диагностической эффективности мини-обследования психического состояния и Монреальской когнитивной оценки при скрининге легких когнитивных нарушений, вызванных болезнью Альцгеймера
Мини-тест психического состояния (MMSE) и Монреальский когнитивный тест (MoCA) — это недорогие и неинвазивные нейропсихологические тесты для скрининга легких когнитивных нарушений (MCI) из-за… Актуальность
- М. Гётлин
Психология, медицина
- 2019
Большая группа пациентов клиники памяти не имеет значительных когнитивных нарушений и имеет очень низкую вероятность прогрессирования деменции по сравнению с пациентами с другие подтипы и те, кто не соответствовал критериям MCI.
Раннее выявление снижения когнитивных функций при легких когнитивных нарушениях и болезни Альцгеймера с помощью нового теста слежения за глазами
Сердечно-сосудистые факторы риска болезни Альцгеймера и других нейрокогнитивных расстройств в Малайзии.

- B. Ibrahim, S. Suppiah, N. Ibrahim
Медицина, Психология
Медицинский журнал Малайзии
- 2021
Учитывая, что инсульт у больных достоверно предсказал риск развития деменции центральному населению Малайзии рекомендуется изменить образ жизни, чтобы уменьшить эти факторы риска сердечно-сосудистых заболеваний.
Мини-обследование психического состояния (MMSE) для выявления деменции у клинически необследованных людей в возрасте 65 лет и старше в амбулаторных условиях и в группах первичной медико-санитарной помощи.
Для определения диагностической точности краткого обследования психического состояния (MMSE) в различных контрольных точках для выявления деменции у людей в возрасте 65 лет и старше в амбулаторных учреждениях и учреждениях первичной медико-санитарной помощи, которые не проходили предварительное тестирование на деменцию, был проведен метаанализ с использованием метода иерархических сводных кривых приемник-оператор (HSROC) и двумерного метода.
ПОКАЗАНЫ 1-10 ИЗ 135 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантности Наиболее влиятельные документыНедавность
Mini-Cog для диагностики деменции при болезни Альцгеймера и других деменций в условиях сообщества.
- Bruce Fage, C. Chan, D. Seitz
Медицина, психология
Кокрановская база данных систематических обзоров
- 2015
скрининговый тест, который можно рекомендовать для скрининга когнитивных нарушений в условиях сообщества и для выявления потенциальных источников систематической ошибки.
Связь нейропсихиатрических симптомов при ЛКН с деменцией и болезнью Альцгеймера.
- P. Rosenberg, M. Mielke, B. Appleby, E. Oh, Y. Geda, C. Lyketsos
Psychology, Medicine
Американский журнал гериатрической психиатрии: официальный журнал Американской ассоциации гериатрической психиатрии
- 2013
Бета-амилоид плазмы и спинномозговой жидкости для диагностики деменции при болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI).

- C. Ritchie, N. Smailagic, R. McShane
Медицина, психология
Кокрановская база данных систематических обзоров
- 2014
Точность ЦСЖ оценивалась для всех форм деменции42 , и ROC-кривой была проведена формальная систематическая оценка чувствительности, специфичности и других свойств биомаркеров бета-амилоида плазмы и спинномозговой жидкости (Aß).
Выявление ранней болезни Альцгеймера у пациентов с ЛКН с помощью комбинации MMSE и теста эпизодической памяти
- A. Pozueta, E. Rodríguez-Rodríguez, O. Combarros
Психология, медицина
Неврология BMC
- 2011
Комбинацию линии S-SEMC можно отличить от Pr-ADIMM и CVLT-LDTR, которые являются относительно короткими и могут быть легко выполнены в неспециализированных клинических условиях.
Сравнение кратких когнитивных тестов и биомаркеров спинномозговой жидкости в прогнозировании болезни Альцгеймера при легких когнитивных нарушениях: шестилетнее последующее исследование
- S.
 Palmqvist, Joakim Hertze, O. Hansson
Palmqvist, Joakim Hertze, O. Hansson Биология, медицина
PloS one
- 2012
- 2012
Мини-психическое состояние в качестве точных часов для предсказания биомаркеров Экспертиза и исследование психического состояния в будущем развития БА у пациентов с ЛКН, и сочетание обоих инструментов обеспечило значительно большую точность, чем когнитивные тесты или только биомаркеры ЦСЖ в прогнозировании БА.
¹⁸F-FDG ПЭТ для ранней диагностики деменции при болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI).
- N. Smailagic, M. Vacante, C. Hyde, Steven Martin, O. Ukoumunne, C. Sachpekidis
Психология
Кокрейновская база данных систематических обзоров индексный тест ПЭТ с ¹⁸F-ФДГ для выявления людей с ЛКН на исходном уровне, у которых при последующем наблюдении клинически может развиться деменция, вызванная болезнью Альцгеймера, или другие формы деменции, было оценено 14 исследований.

Маркеры повреждения, но не амилоидные маркеры, связаны с быстрым прогрессированием от легких когнитивных нарушений до деменции при болезни Альцгеймера.
Полученные данные указывают на различную роль биомаркеров в диагностике и прогнозировании MCI-AD, в то время как амилоидные маркеры могут использоваться для выявления MCI-AD, а маркеры повреждения могут прогнозировать быстрое прогрессирование деменции.
Легкие когнитивные нарушения как диагностическая единица
- R. Petersen
Психология, медицина
Журнал внутренних болезней
- 2004
Диагноз легких когнитивных нарушений может быть поставлен аналогичны клиническим диагнозам деменции и БА, и представлен алгоритм, помогающий клиницисту в идентификации субъектов и их подклассификации по различным типам MCI.
Когнитивные нарушения при болезни Паркинсона: инструменты для диагностики и оценки
Дальнейшие исследования инструментов, специфичных для БП, кажутся обязательными, чтобы помочь установить точные пороговые значения для диагностики легкой формы БП, выявить когнитивные профили, более склонные к развитию деменции в будущем и позволяют сравнивать различные описательные или интервенционные исследования.


 0 Introduction
0 Introduction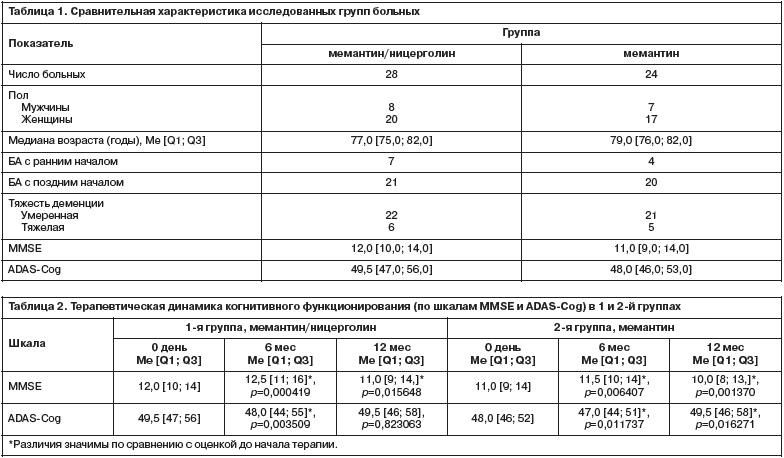 В дальнейшем шкала претерпела ряд изменений.
В дальнейшем шкала претерпела ряд изменений.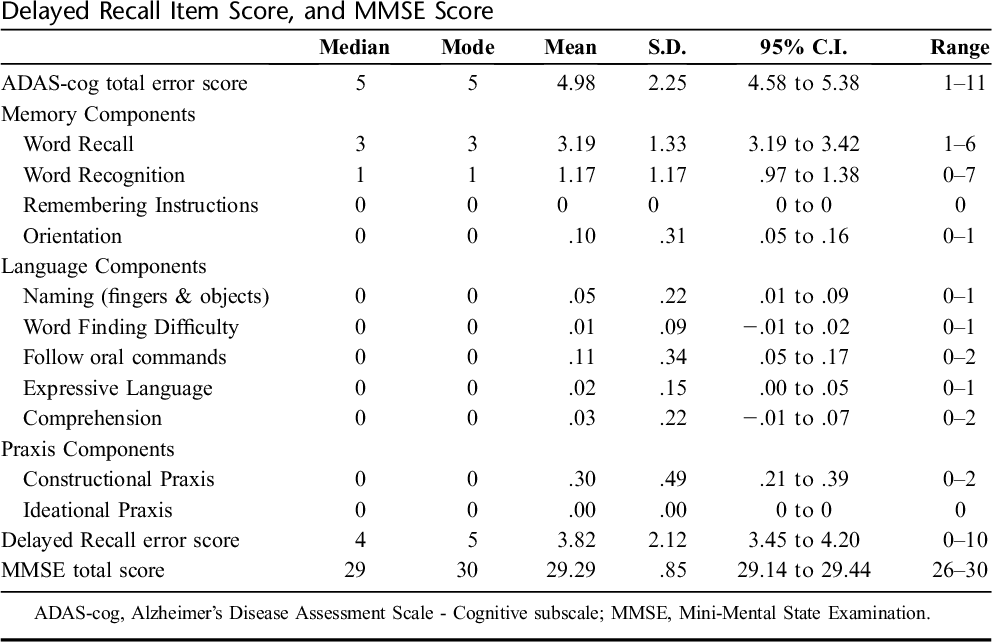 Нарушения когнитивных функций отсутствуют.
Нарушения когнитивных функций отсутствуют. This pattern of deficits raises suspicion of vascular involvement.
This pattern of deficits raises suspicion of vascular involvement.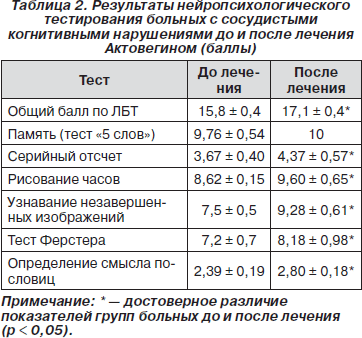

 Arévalo-Rodriguez, N. Smailagic, S. Cullum
Arévalo-Rodriguez, N. Smailagic, S. Cullum
 Palmqvist, Joakim Hertze, O. Hansson
Palmqvist, Joakim Hertze, O. Hansson
