Шкала мейо: Шкала комы Мэйо. Онлайн калькулятор.
Шкала Комы Мэйо » Медвестник
Открывание глазГлаза открыты, слежение и мигание по командеГлаза открыты, но нет слеженияГлаза закрыты, открываются на громкий звук, но слежения нетГлаза закрыты, открываются на боль, но слежения нетГлаза остаются закрытыми в ответ на больДвигательная реакцияВыполняет команды (знак отлично, кулак, знак мира)Локализует больСгибательный ответ на больРазгибательная поза на больНет ответа на боль или генерализованный миоклонический эпистатусСтволовые реакцииЗрачковый и роговичный рефлексы сохраненыОдин зрачок расширен и не реагирует на светЗрачковый ИЛИ роговичный рефлекс отсутствуетЗрачковый И роговичный рефлексы отсутствуютОтсутствуют зрачковый, роговичный и кашлевой рефлексыДыханиеНе интубирован, регулярное дыханиеНе интубирован, дыхание Чейна-СтоксаНе интубирован, нерегулярное дыханиеСопротивляется аппарату ИВЛПолностью синхронен с аппаратом ИВЛ или апноэСбросить показания
Шкала разработана в 2005 году в клинике
Oценка по баллам:
| 16 баллов | сознание ясное |
| 15 баллов | сомноленция |
| 14 баллов | оглушение |
| 9 — 12 баллов | сопор |
| 4 — 8 баллов | кома |
| 3 балла | смерть мозга |
Сайт medvestnik.ru не несет никакой юридической, финансовой, медицинской, гражданской и любой иной ответственности за решения и их последствия (в т.ч. связанные с диагностикой и лечением заболеваний), принятые Посетителем посредством использования калькуляторов, алгоритмов, шкал и иных сервисов и материалов, размещенных на Сайте, в том числе в результате их неверного применения.
Любая размещенная на Сайте информация носит информационный характер и может быть использована только квалифицированными специалистами в области медицины на свой страх и риск, учитывая возможность неточностей, ошибок или заблуждений авторов материалов, и не может стать заменой профессиональной консультации врача.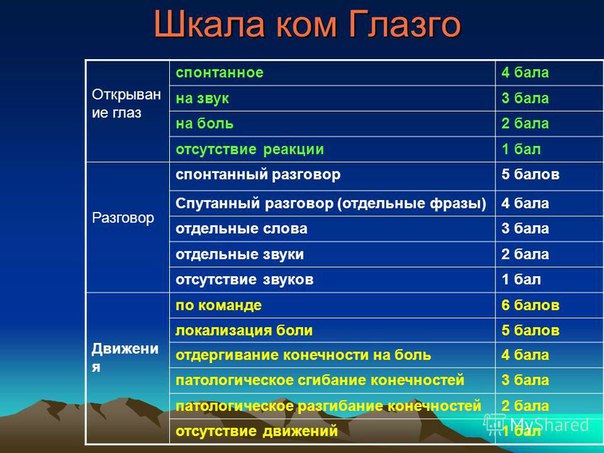
Подробнее: «Условия использования сервисов и отказ от гарантий»
Шкала оценки уровня комы Full Outline of UnResponsiveness (FOUR)
Шкала комы FOUR разработана в Майо Клиник и представлена Э.Ф. Виждиксом и коллегами в 2005 году.
Многочисленные исследования подтвердили валидность этой шкалы в условиях отделения нейрореанимации.
Позволяет оценить рефлексы ствола головного мозга или речевую реакцию у интубированных или больных с афазией (и другими нарушениями речи).
Рекомендуется использовать как дополнение к шкале комы Глазго (ШКГ). Шкала комы Full Outline of UnResponsiveness (FOUR) позволяет:
• точнее детализировать неврологический статус;
• распознать синдром запертого человека;
• оценить рефлексы ствола мозга и дыхательный паттерн;
• выявить различные стадии дислокации (вклинения) мозга.
Шкала имеет простую систему оценок — 4 балла по каждому из 4 параметров, однозначно интерпретирует двигательные реакции, одинаково применима у детей и взрослых.
Предоставляет дополнительную информацию о прогнозе у больных с низким баллом по шкале комы Глазго.
Вероятность летального исхода выше у больных с наименьшим баллом по шкале FOUR, чем у пациентов с наименьшим баллом по шкале комы Глазго.
Шкала комы FOUR включает 4 параметра: глазные реакции (открывание глаз и слежение), двигательные реакции (ответ на боль и выполнение простых команд), стволовые рефлексы (зрачковый, роговичный и кашлевой) и дыхательные паттерны (ритм дыхания и дыхательные попытки у пациентов на аппарате ИВЛ).
Глазные реакции (E)(4) Глаза открыты, слежение и мигание по команде
(3) Глаза открыты, но нет слежения
(2) Глаза закрыты, открываются на громкий звук, но слежения нет
(1) Глаза закрыты, открываются на боль, но слежения нет
(0) Глаза остаются закрытыми в ответ на боль
Двигательные реакции (M)
(4) Выполняет команды (знак отлично, кулак, знак мира)
(3) Локализует боль
(2) Сгибательный ответ на боль
(1) Разгибательная поза на боль
(0) Нет ответа на боль или генерализованный миоклонический эпистатус
Стволовые рефлексы (B )
(4) Зрачковый и роговичный рефлексы сохранены
(3) Один зрачок расширен и не реагирует на свет
(2) Зрачковый ИЛИ роговичный рефлекс отсутствует
(1) Зрачковый И роговичный рефлексы отсутствуют
(0) Отсутствуют зрачковый, роговичный и кашлевой рефлексы
Дыхательный паттерн (R)
(4) Не интубирован, регулярное дыхание
(3) Не интубирован, дыхание Чейна-Стокса
(2) Не интубирован, нерегулярное дыхание
(1) Сопротивляется аппарату ИВЛ
(0) Полностью синхронен с аппаратом ИВЛ или апноэ
Максимальное число баллов по шкале FOUR — 16, минимальное — 0.
Интерпретация:
16 — Ясное сознание
15 — Умеренное оглушение
13-14 — Глубокое оглушение
9-12 — Сопор
7-8 — Кома I
1-6 — Кома II
0 — Кома III, гибель коры
Шкала оценки сознания FOUR | CardioNeurology.ru
На протяжении многих лет шкала комы Глазго являлась золотым стандартом в градации глубины комы. Однако, оценить рефлексы ствола головного мозга или речевую реакцию у интубированных больных с ее помощью не представлялось возможным. Шкала комы FOUR (Full Outline of UnResponsiveness) имеет преимущества перед шкалой комы Глазго, а именно: точнее детализирует неврологический статус, распознает синдром запертого человека, дает оценку рефлексам ствола мозга, дает оценку дыхательному паттерну, выявляет различные стадии дислокации (вклинения) мозга.
Шкала комы FOUR также предоставляет дополнительную информацию о прогнозе у больных с низким баллом по шкале комы Глазго. Вероятность внутрибольничного летального исхода выше у больных с наименьшим баллом по шкале FOUR, чем у пациентов с наименьшим баллом по шкале комы Глазго. Шкала комы FOUR включает 4 параметра с максимальной оценкой «4» по каждому из них: глазные реакции (открывание глаз и слежение), двигательные реакции (ответ на боль и выполнение простых команд), стволовые рефлексы (зрачковый, роговичный и кашлевой) и дыхательные паттерны (ритм дыхания и дыхательные попытки у пациентов на аппарате ИВЛ). Шкала комы FOUR разработана в Майо Клиник и представлена Э.Ф. Виждиксом и коллегами в 2005 году. Многочисленные исследования подтвердили валидность этой шкалы в условиях отделения нейрореанимации. На этой странице Вы сможете рассчитать риск по шкале FOUR, используя калькулятор
Глазные реакции (E)
Оценивается наилучшая из возможных реакций после как минимум 3 попыток вызвать максимальное пробуждение. Оценка E4 выставляется, если как минимум 3 произвольных акта сохранены. Если глаза закрыты, следует их открыть и исследовать слежение за пальцем или объектом. Слежение с поднятием одного века будет достаточным в случаях отека век или травмы лица. Если слежение по горизонтали отсутствует, необходимо проверить слежение по вертикали. Как альтернатива, 2 мигания по команде должны быть зафиксированы. Это поможет распознать синдром запертого человека (пациент в ясном сознании). Оценка E3 указывает на отсутствие произвольного слежения при открытых глазах. Оценку E2 дают больному, который открывает глаза на громкий звук, но не может следить за предметом. Оценка E1 выставляется, если глаза открываются на болевые стимулы, однако слежение при этом отсутствует. Оценка E0 показывает, что глаза не открываются на боль.
Если глаза закрыты, следует их открыть и исследовать слежение за пальцем или объектом. Слежение с поднятием одного века будет достаточным в случаях отека век или травмы лица. Если слежение по горизонтали отсутствует, необходимо проверить слежение по вертикали. Как альтернатива, 2 мигания по команде должны быть зафиксированы. Это поможет распознать синдром запертого человека (пациент в ясном сознании). Оценка E3 указывает на отсутствие произвольного слежения при открытых глазах. Оценку E2 дают больному, который открывает глаза на громкий звук, но не может следить за предметом. Оценка E1 выставляется, если глаза открываются на болевые стимулы, однако слежение при этом отсутствует. Оценка E0 показывает, что глаза не открываются на боль.
Глаза открыты, слежение и мигание по команде
Глаза открыты, но нет слежения
Глаза закрыты, открываются на громкий звук, но слежения нет
Глаза закрыты, открываются на боль, но слежения нет
Глаза остаются закрытыми в ответ на боль
Двигательные реакции (M)
Оценивается наилучший из возможных ответов с рук. Оценка M4 выставляется, если больной демонстрирует любой рукой как минимум 1 из 3 знаков (отлично, кулак, мир). Оценка M3 показывает, что больной коснулся или почти коснулся руки исследователя после болевых стимулов – давление на височно-нижнечелюстной сустав или надбровный нерв (локализация). Оценка M2 выставляется при любом сгибательном движении в верхних конечностях. Это может быть или отдергивание или декортикационная поза. Оценка M1 указывает на разгибательную позу. Оценка M0 присваивается при отсутствии двигательной реакции или миоклоническом эпистатусе.
Выполняет команды (знак отлично, кулак, знак мира)
Локализует боль
Сгибательный ответ на боль
Разгибательная поза на боль
Нет ответа на боль или генерализованный миоклонический эпистатус
Стволовые рефлексы (B)
Оценивается наилучший из возможных ответов. Исследуются зрачковые и роговичные рефлексы. Лучше, если роговичные рефлексы будут проверяться с помощью закапывания нескольких капель физиологического раствора на роговицу с расстояния нескольких дюймов (это предотвращает ее травму при повторных исследованиях). Ватные полоски тоже можно использовать. Кашлевой рефлекс на отсасывание из трахеи проверяется в случае отсутствия этих двух рефлексов. Оценка B4 показывает сохранность зрачкового и роговичного рефлексов. Оценка B3 выставляется, если один зрачок расширен и не реагирует на свет. Оценка B2 указывает на отсутствие либо зрачкового либо роговичного рефлекса, а B1 – обоих рефлексов, но кашлевой рефлекс (используется отсасывание из трахеи) сохранен. Оценка B0 показывает, что зрачковый, роговичный и кашлевой рефлексы отсутствуют.
Лучше, если роговичные рефлексы будут проверяться с помощью закапывания нескольких капель физиологического раствора на роговицу с расстояния нескольких дюймов (это предотвращает ее травму при повторных исследованиях). Ватные полоски тоже можно использовать. Кашлевой рефлекс на отсасывание из трахеи проверяется в случае отсутствия этих двух рефлексов. Оценка B4 показывает сохранность зрачкового и роговичного рефлексов. Оценка B3 выставляется, если один зрачок расширен и не реагирует на свет. Оценка B2 указывает на отсутствие либо зрачкового либо роговичного рефлекса, а B1 – обоих рефлексов, но кашлевой рефлекс (используется отсасывание из трахеи) сохранен. Оценка B0 показывает, что зрачковый, роговичный и кашлевой рефлексы отсутствуют.
Зрачковый и корнеальный рефлексы сохранены
Один зрачок расширен и не реагирует на свет
Зрачковый ИЛИ роговичный рефлекс отсутствует
Зрачковый И роговичный рефлексы отсутствуют
Отсутствуют зрачковый, роговичный и кашлевой рефлексы
Дыхательный паттерн (R)
Оценивается просто: регулярный ритм – R4, дыхание Чейн-Стокса – R3, нерегулярный ритм – R2. У интубированных: больной дышит поверх аппарата ИВЛ – R1, наблюдается только дыхание, генерируемое аппаратом ИВЛ – R0. Для идентификации дыхательных движений больного поверх аппарата ИВЛ используется монитор, отображающий дыхательные паттерны. Во время проведения теста не делается никакой подстройки аппарата ИВЛ, и оценка проводится преимущественно при нормальных границах PaCO2. Возможно потребуется отсоединение от аппарата ИВЛ на 1-2 минуты, оксигенация при этом не должна прекращаться. Если больной дышит на частоте аппарата ИВЛ, возможно проведение стандартного (кислородно-диффузионного) теста на апноэ.
Не интубирован, регулярное дыхание
Не интубирован, дыхание Чейн-Стокса
Не интубирован, нерегулярное дыхание
Сопротивляется аппарату ИВЛ
Полностью синхронен с аппаратом ИВЛ или апноэ
Значение шкалы комы FOUR. |
Вконтакте
Одноклассники
Шкала FOUR как критерий оценки состояния сознания у больных с ишемическим инсультом в острейшем периоде
Ишемический инсульт в острейшем периоде часто сопровождается нарушением сознания. Появление шкал коматозных состояний значительно облегчило для практикующих врачей оценку степени угнетения мозговых функций. В 2005 году в клинике Мейо Wijdicks E F разработал шкалу комы FOUR (Full Outline of Unresponsiveness). Многочисленные исследования в Западной Европе подтвердили валидность этой шкалы в условиях отделения реанимации. Однако в настоящее время в клиниках РФ данная шкала широко не используется.
Цель работы. Оценить диагностическую и прогностическую ценность шкалы комы FOUR у больных с ишемическим инсультом (ИИ) в острейшем периоде.
Материалы и методы. Проведено обследование 33 пациентов в возрасте от 57 до 88 лет, поступивших в отделение реанимации 9 ГКБ г. Саратова с диагнозом острое нарушение мозгового кровообращения по ишемическому типу, которое сопровождалось нарушением сознания. Степень угнетения сознания данных больных оценивалось по шкалам комы Глазго и FOUR при поступлении и далее ежедневно в течение 7 дней.
Результаты. Средний возраст больных составил 63±1,62 года, мужчин — 54,5% и женщин — 45,5%. Средний балл по шкале FOUR составил 12,55 ± 0,56, по шкале Глазго — 11,06 ± 0,53. Разница показателей, вероятно, связана с наличием у больных афатических нарушений, которые уменьшают балл по шкале Глазго. При поступлении в стационар у больных с ИИ регистрировалось угнетение сознание до умеренного оглушения по шкале Глазго (45,5 %) и до сопора (30,3%) по шкале FOUR. Анализируя летальные случаи (76%), было обнаружено, что летальный исход наблюдался в среднем на 3,54± 0,53 сутки от момента госпитализации. Была зафиксирована сильная прямая корреляционная связь между результатами оценки состояния сознания по исследуемым шкалам (0,84), а также заметная обратная корреляция между количеством баллов по шкале FOUR и вероятностью летального исхода (-0,63).
Выводы. Шкала комы FOUR, как и шкала Глазго, имеет простые критерии определения нарушения сознания, при этом дополнительно дает оценку дыхательному паттерну и рефлексам ствола мозга, однозначно трактует двигательные реакции, что ведет к более точной диагностике глубины угнетения сознания, а также является источником объективной информации о прогнозе у пациентов с ИИ.
Москва, Россия, 16 марта 2021 года – Глобальная научно-исследовательская биофармацевтическая компания AbbVie объявила о положительных результатах исследования U-ACCOMPLISH фазы 3, в котором упадацитиниб (45 мг/сут) достиг первичной конечной точки клинической ремиссии (согласно адаптированной шкале Мейо), а также вторичных конечных точек1.
«Мы стремимся улучшить результаты терапии пациентов с язвенным колитом, – сказал Том Хадсон, старший вице-президент по исследованиям и разработкам AbbVie. – Полученные положительные результаты сопоставимы с результатами первого исследования и подчеркивают потенциал упадацитиниба в облегчении симптомов у пациентов, нуждающихся в достижении контроля над заболеванием».
В исследовании U-ACCOMPLISH достигнуты все вторичные конечные точки, включая результаты клинической, эндоскопической и гистологической оценки1. У большего числа пациентов, получавших упадацитиниб, клинический ответ (по адаптированной шкале Мейо) наблюдался на 8 неделе в сравнении с пациентами, получавшими плацебо (74% по сравнению с 25%, p<0,001)1. Более того, 63% пациентов, получавших упадацитиниб, достигли клинического ответа (согласно частичной адаптированной шкале Мейо) на 2 неделе в сравнении с 26% в группе плацебо (p<0,001) «Люди, живущие с язвенным колитом среднетяжелой и тяжелой степени, продолжают страдать от бремени заболевания, – сказал Сильвио Данесе, M.D., ведущий исследователь и руководитель Центра воспалительных заболеваний кишечника в Исследовательской клинике Humanitas, Милан, Италия.
Профиль безопасности упадацитиниба (45 мг) соответствовал результатам, полученным в предшествующем исследовании фазы 3, при этом новых рисков безопасности выявлено не было1-6. В течение 8-недельного периода исследования, наиболее частыми нежелательными явлениями (НЯ), которые наблюдались в группе пациентов, получавших упадацитиниб, были акне, повышение в крови уровня креатинфосфокиназы и анемия1. Повышение уровня креатинфосфокиназы в крови не относилось к серьезным НЯ и не требовало отмены препарата1. Повышение уровня креатинфосфокиназы у пациентов обычно протекало бессимптомно, и о случаях рабдомиолиза не сообщалось1. Серьезные нежелательные явления (СНЯ) наблюдались у 3,2% пациентов в группе упадацтиниба и у 4,5% пациентов в группе плацебо1. В обоих группах серьезные инфекции возникали с одинаковой частотой (0,6%)1. Случаев смерти, перфорации желудочно-кишечного тракта, злокачественных новообразований, серьезных сердечно-сосудистых или тромбоэмболических осложнений в группе упадацитиниба не наблюдалось1. В группе плацебо зарегистрирован один случай венозной тромбоэмболии (тромбоз глубоких вен и тромбоэмболия легочной артерии) и один случай перфорации желудочно-кишечного тракта1. Полные результаты исследования U-ACCOMPLISH будут представлены на предстоящих специализированных конференциях и опубликованы в рецензируемом журнале.
О язвенном колите Язвенный колит – хроническое системное воспалительное заболевание, сопровождающееся воспалением слизистой оболочки толстой кишки, проявляющееся болью в животе, поносом с кровью, болезненными позывами к дефекации, потерей веса и утомляемостью15-17. Тяжесть симптомов и неконтролируемые обострения заболевания у пациентов с язвенным колитом часто приводят к инвалидности 18.
Об исследовании U—ACCOMPLISH1,9 U-ACCOMPLISH– многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3 для оценки эффективности и безопасности упадацитиниба (45 мг/сут) для индукционной терапии у пациентов с язвенным колитом в сравнении с плацебо. U-ACCOMPLISH – второе исследование фазы 3. Первичной конечной точкой исследования стало достижение клинической ремиссии (по адаптированной шкале Мейо) на 8 неделе. Ранжированные вторичные конечные точки включали клинический ответ (снижение по сравнению с исходным уровнем согласно адаптированной шкале Мейо на ≥2 балла и ≥30% от исходного уровня, плюс снижение шкалы кровотечения (RBS) на ≥1 или абсолютное RBS ≤1), эндоскопическое улучшение (≤1 по эндоскопической шкале оценки активности) и улучшение слизистой при гистолого-эндоскопическом исследовании (эндоскопический балл 0 или 1 и оценка Geboes≤3,1) на 8 неделе. Более подробную информацию об исследовании вы можете найти на сайте www.clinicaltrials.gov (NCT03653026).
О программе исследований применения упадацитиниба при язвенном колите9,19,20 В глобальной программе, состоящей из трех основных исследований, применения упадацитиниба при язвенном колите фазы 3 принимает участие более 1 300 пациентов с язвенным колитом среднетяжёлой и тяжелой степени.
О препарате РАНВЭК (упадацитиниб) Разработанный компанией AbbVie, препарат РАНВЭК – это селективный обратимый ингибитор Янус киназ, применение которого исследуется для лечения (перорально, один раз в сутки) ряда иммуноопосредованных воспалительных заболеваний1,7-14. На данный момент препарат РАНВЭК одобрен в России для лечения ревматоидного артрита, анкилозирующего спондилита и псориатического артрита. Утвержденная доза препарата РАНВЭК для лечения этих заболеваний составляет 15 мг один раз в сутки22. Продолжаются исследования фазы 3 по оценке эффективности и безопасности применения препарата РАНВЭК для лечения атопического дерматита, аксиального спондилоартрита, болезни Крона, язвенного колита, гигантоклеточного артериита и болезни Такаясу 8-14. Использование РАНВЭК при язвенном колите не одобрено, а его безопасность и эффективность не оценивались регуляторными агентствами.
О роли компании AbbVie в гастроэнтерологии Благодаря надежной программе клинических исследований, AbbVie стремится проводить передовые исследования, чтобы поддерживать важные достижения в области воспалительных заболеваний кишечника (ВЗК), таких как язвенный колит и болезнь Крона. Благодаря инновациям, обучению и адаптации AbbVie стремится избавиться от бремени ВЗК и оказывать значительное влияние на жизнь пациентов с этими заболеваниями. Для получения дополнительной информации о роли AbbVie в гастроэнтерологии воспользуйтесь ссылкой https://www.
Об AbbVie Миссия компании AbbVie — разработка и вывод на рынок инновационной терапии для лечения некоторых из самых тяжелых заболеваний и решение медицинских проблем завтрашнего дня. Мы стремимся оказывать значительное влияние на жизнь людей в ключевых терапевтических областях: иммунология, онкология, неврология, офтальмология, вирусология, женское здоровье и гастроэнтерология, а также с помощью продуктов и услуг подразделения Allergan — эстетическая медицина. За дополнительной информацией о компании обращайтесь на сайт www.abbvie.com, www.abbvie.ru, а также к аккаунтам в социальных сетях @abbvie в Twitter, Facebook, Instagram, YouTube.
Прогнозные заявления В этом анонсе содержатся или могут содержаться определенные прогнозные заявления для целей закона 1995 года «О реформе судебных разбирательств по частным ценным бумагам». Слова «верить», «ожидать», «предполагать», «планировать» и подобные выражения среди прочего обычно обозначают прогнозные заявления. Эти прогнозные заявления подвержены рискам и неопределенностям, которые могут привести к тому, что фактические результаты будут существенно отличаться от указанных в прогнозных заявлениях. Такие риски и неопределенности включают, но не ограничиваются, неспособность реализовать ожидаемые выгоды от приобретения AbbVie компании Allergan, неспособность быстро и эффективно интегрировать бизнес-процессы Allergan, справиться с конкуренцией со стороны других продуктов, с вопросами, касающимися интеллектуальной собственности, с трудностями в области исследований и разработок, неблагоприятными судебными разбирательствами или действиями с стороны правительства, изменениями в законодательстве и нормативных актах в отношении фармацевтической отрасли, а также влиянием вспышек заболеваний, эпидемий или пандемий в области общественного здравоохранения, таких как COVID-19. Дополнительная информация об экономических, правительственных, технологических и других факторах, которые могут повлиять на AbbVie, изложены в годовом отчете AbbVie по форме 10-K, изложенный в отчетах Комиссии по ценным бумагам и биржам США и обновленный последующими ежеквартальными отчетами по форме 10-Q. AbbVie не принимает на себя никаких обязательств по обновлению каких-либо прогнозных заявлений в результате последующих событий, за исключением случаев, предусмотренных законом. ### За дополнительной информацией, пожалуйста, обращайтесь: Елена Дианова Директор по связям с общественностью AbbVie в России и СНГ Тел.: +7 (919) 767-80-93 ______________________________________
| ||
Сравнительная оценка клинических форм и степени активности воспалительных заболеваний кишечника
Во всем мире, включая Украину, воспалительные заболевания кишечника (ВЗК) остаются одной из наиболее актуальных медико-социальных проблем в связи с тенденцией к агрессивному непрерывно рецидивирующему течению и непреклонному росту данной патологии [2, 7, 18]. По данным эпидемиологических исследований последних лет, распространенность неспецифического язвенного колита (НЯК) в разных странах составляет от 85 до 120 случаев, болезни Крона (БК) — от 58 до 150 случаев на 100 тысяч населения [16]. В Донецком регионе в последние годы также отмечается рост данной патологии, причем все чаще врачи сталкиваются с тяжелыми формами болезни, сопровождающимися большим количеством осложнений, что в результате приводит к потере трудоспособности и быстрой инвалидизации больных [2–4].
По данным эпидемиологических исследований последних лет, распространенность неспецифического язвенного колита (НЯК) в разных странах составляет от 85 до 120 случаев, болезни Крона (БК) — от 58 до 150 случаев на 100 тысяч населения [16]. В Донецком регионе в последние годы также отмечается рост данной патологии, причем все чаще врачи сталкиваются с тяжелыми формами болезни, сопровождающимися большим количеством осложнений, что в результате приводит к потере трудоспособности и быстрой инвалидизации больных [2–4].
Несмотря на многолетнюю историю изучения данных заболеваний, их этиология и патогенез до сих пор остаются неясными, что затрудняет раннюю диагностику, а также значительно снижает эффективность лечения. По мнению многих авторов, существенную роль в возникновении ВЗК играет генетическая предрасположенность, реализующаяся под воздействием некоторых предрасполагающих факторов, среди которых бесконтрольное применение медикаментов, нарушение режима и характера питания, аллергия, курение и т.д. [2, 17]. Большой интерес также вызывает инфекционная теория, согласно которой присутствие в кишечнике определенных видов бактерий и вирусов ведет к нарушению микробиоценоза, дисбактериозу и развитию воспалительного процесса, однако до сих пор не существует экспериментальных данных, подтверждающих данную теорию [13, 14].
Ведущими механизмами в патогенезе НЯК и БК считаются нарушения иммунной системы, дисбаланс цитокиновой регуляции, истощение системы антиоксидантной защиты, на фоне чего развивается хроническая интоксикация с метаболическими нарушениями и, как следствие, прогрессирование микроциркуляторных расстройств и гипоксия тканей [10–12].
ВЗК отличаются многообразием клинической картины. У каждого больного проводится дифференциальная диагностика между неспецифическим язвенным колитом и болезнью Крона, в ряде случаев определить нозологическую форму практически невозможно. Между тем в прогнозе и тактике ведения существуют принципиальные различия, что и обусловливает актуальность изучения особенностей манифестации и течения ВЗК с выделением наиболее типичных их проявлений.
Лечение данной категории больных — чрезвычайно сложная проблема. Для разработки качественной, эффективной схемы лечения необходимо учитывать тяжесть течения и степень активности заболевания, распространенность и локализацию воспалительного процесса, наличие осложнений. Необходимо также принимать во внимание индивидуальные особенности пациента: возраст, пол, сопутствующие заболевания, возможную лекарственную непереносимость. Правильная оценка этих факторов увеличивает вероятность успешного решения врачом-гастроэнтерологом стоящих перед ним задач:
— улучшения качества жизни больных;
— уменьшения выраженности клинических проявлений заболевания;
— предотвращения возникновения рецидивов.
Именно комплексная оценка клинических проявлений заболевания и результатов лабораторно-инструментальных методов исследования позволяет выяснить нозологию, оценить характер течения, текущую активность, длительность воспалительного процесса и наличие осложнений [8].
Однако, на наш взгляд, возникают разногласия между понятиями «тяжесть течения» ВЗК, которое оценивает заболевание в динамике, и «степень активности», которое указывает на характер течения конкретного обострения и определяет состояние больного в данный момент времени.
Целью нашего исследования была оценка особенностей клинических форм болезни у пациентов с воспалительными заболеваниями кишечника с определением индексов клинической активности и степени тяжести, а также эндоскопических индексов активности.
Материалы и методы
Были проанализированы результаты обследования 62 пациентов с подтвержденным диагнозом ВЗК за период с 2006 по 2011 гг. Из них 38 (61,3 %) больных с неспецифическим язвенным колитом и 24 (38,7 %) с болезнью Крона. По половому признаку больные разделены следующим образом: 35 (56,5 %) мужчин и 27 (43,5 %) женщин в возрасте от 23 до 70 лет, из них 53 (85,5 %) пациента трудоспособного возраста. Средний койко-день составил 11,8 дня./76/76.jpg)
Диагностический алгоритм включал динамическое клиническое обследование со сбором жалоб, анамнеза заболевания и жизни, лабораторную диагностику, анализ кала на простейшие, эндоскопическое и морфологическое исследование участков пораженной кишки.
Степень активности НЯК оценивалась с помощью клинического индекса активности по Рахмилевичу, включающего в себя такие критерии, как частота стула за последние 7 дней, примесь крови в кале, общее самочувствие, боли в животе и внекишечные проявления. Индекс активности (шкала Мейо) позволил объединить клинические показатели и данные эндоскопического исследования. Тяжесть течения неспецифического язвенного колита определялась по классификации Truelovе — Witts [5, 15].
Для оценки степени активности БК использовался стандартизированный индекс CDAI (Crohn’s disease activity index), или индекс Беста. Для БК, в отличие от НЯК, по этому индексу определяют не только клиническую активность данного обострения, но и тяжесть течения заболевания, т.к. по индексу CDAI оцениваются не только частота стула, общее самочувствие и интенсивность болевого синдрома за последнюю неделю, но и наличие внекишечных проявлений и осложнений БК, которые формируются и сохраняются длительное время [2, 3, 6, 14]. Степень эндоскопической активности БК определяли с помощью специализированного эндоскопического индекса CDEIS.
Дизайн работы предполагал параллельное изучение превалирующих форм ВЗК, в том числе внекишечных и перианальных осложнений, а также локализацию и распространенность процесса. Так как, по данным литературы, болезнь Крона может поражать любой отдел желудочно-кишечного тракта, в комплекс обследования пациентов с БК кроме фиброколоноскопии (ФКС) входила эзофагогастродуоденоскопия (ЭГДС) [9].
Результаты
В группе больных с неспецифическим язвенным колитом первая атака болезни наблюдалась у 24 (63,2 %) человек, из них у 21 пациента (87,5 %) она протекала с постепенным началом и у 3 больных (12,5 %) выявлена молниеносная форма НЯК. При этом дистальное поражение диагностировано у 7 (29,2 %) больных, левосторонний колит — у 14 (58,3 %) исследуемых и тотальное поражение встречалось в 12,5 % случаев (3 пациента). У данной категории больных легкое течение выявлено у 8 (33,3 %) больных, среднетяжелое — у 12 (50,0 %) и тяжелое течение НЯК диагностировано у 4 (16,7 %) пациентов. При оценке клинической степени активности заболевания были получены следующие данные: в 33,3 % случаев (8 больных) диагностирована минимальная активность, что по Рахмилевичу составило от 4 до 6 баллов, по шкале Мейо — от 3 до 5 баллов, у 12 (50,0 %) пациентов индекс активности по Рахмилевичу соответствовал 8–11 баллам, по шкале Мейо — 6–10 баллам, что расценивается как умеренная степень активности. В свою очередь, у 4 (16,7 %) больных выявлена выраженная активность воспалительного процесса, что соответствовало 12–13 баллам по Рахмилевичу и 12 баллам по шкале Мейо.
При этом дистальное поражение диагностировано у 7 (29,2 %) больных, левосторонний колит — у 14 (58,3 %) исследуемых и тотальное поражение встречалось в 12,5 % случаев (3 пациента). У данной категории больных легкое течение выявлено у 8 (33,3 %) больных, среднетяжелое — у 12 (50,0 %) и тяжелое течение НЯК диагностировано у 4 (16,7 %) пациентов. При оценке клинической степени активности заболевания были получены следующие данные: в 33,3 % случаев (8 больных) диагностирована минимальная активность, что по Рахмилевичу составило от 4 до 6 баллов, по шкале Мейо — от 3 до 5 баллов, у 12 (50,0 %) пациентов индекс активности по Рахмилевичу соответствовал 8–11 баллам, по шкале Мейо — 6–10 баллам, что расценивается как умеренная степень активности. В свою очередь, у 4 (16,7 %) больных выявлена выраженная активность воспалительного процесса, что соответствовало 12–13 баллам по Рахмилевичу и 12 баллам по шкале Мейо.
Следовательно, при первой атаке НЯК тяжесть течения заболевания соответствует степени его активности. Однако необходимо отметить, что после проведенного курса консервативной терапии степень активности воспалительного процесса принципиально отличалась от таковой при поступлении с тенденцией к снижению во всех группах больных с различной длительностью процесса и степенью тяжести НЯК.
У 12 (31,6 %) пациентов наблюдалась рецидивирующая форма заболевания. Частота обострений варьировала от 1 раза в 3–4 года до 2–3 раз в год. Длительность ремиссий, по нашим наблюдениям, колебалась от 3–4 месяцев до 3 и более лет. В данной группе исследуемых у 4 (33,0 %) пациентов выявлено дистальное поражение толстой кишки, у 6 (50,0 %) — левосторонний колит, соответственно, тотальное поражение диагностировано у 2 больных (17,0 %). Исходя из анамнестических данных, легкое течение заболевания выявлено у 7 (58,3 %) пациентов, среднетяжелое — у 2 (16,7 %), а тяжелое течение наблюдалось у 3 (25,0 %) больных. Исследуя клиническую степень активности НЯК у данных пациентов, у 2 (17,0 %) было получено 4 и 5 баллов по Рахмилевичу и 3 балла по шкале Мейо, что соответствовало минимальной активности воспалительного процесса. При эндоскопическом исследовании отмечались отек, эритема, стертость сосудистого рисунка, незначительная разрыхленность слизистой и слабо выраженная контактная кровоточивость. У 9 исследуемых пациентов (75,0 %) установлена умеренная активность, что по Рахмилевичу составило от 8 до 10 баллов, по шкале Мейо — от 6 до 9 баллов. Эндоскопически наблюдались выраженная гиперемия, отсутствие сосудистого рисунка, контактная кровоточивость, а также зернистость и множественные эрозии слизистой оболочки. Лишь у 1 больного (8,0 %), у которого было получено 12 баллов по Рахмилевичу и 11 баллов по шкале Мейо, была диагностирована выраженная активность НЯК. При ФКС слизистая оболочка была зернистая, диффузно кровоточащая, с множественными поверхностными язвами различной формы, а также наблюдались слизь, кровь и гной в просвете кишки.
При эндоскопическом исследовании отмечались отек, эритема, стертость сосудистого рисунка, незначительная разрыхленность слизистой и слабо выраженная контактная кровоточивость. У 9 исследуемых пациентов (75,0 %) установлена умеренная активность, что по Рахмилевичу составило от 8 до 10 баллов, по шкале Мейо — от 6 до 9 баллов. Эндоскопически наблюдались выраженная гиперемия, отсутствие сосудистого рисунка, контактная кровоточивость, а также зернистость и множественные эрозии слизистой оболочки. Лишь у 1 больного (8,0 %), у которого было получено 12 баллов по Рахмилевичу и 11 баллов по шкале Мейо, была диагностирована выраженная активность НЯК. При ФКС слизистая оболочка была зернистая, диффузно кровоточащая, с множественными поверхностными язвами различной формы, а также наблюдались слизь, кровь и гной в просвете кишки.
Все результаты были подтверждены морфологически, причем данные гистологического исследования соответствовали степени активности, установленной клинически и эндоскопически. У 5 (71,4 %) больных с тяжелым течением были выявлены внекишечные проявления, которые обусловили тяжесть НЯК, но не отразились на степени его активности.
Непрерывно рецидивирующая форма НЯК установлена у 2 больных (5,3 %) с дистальным поражением толстой кишки. Анамнестически у обоих пациентов наблюдалось среднетяжелое течение, однако у 1 (50,0 %) зафиксирована минимальная активность заболевания (индекс активности по Рахмилевичу и шкале Мейо составил 4 балла), а у 1 больного (50 %) — умеренная (8 баллов по результатам обоих индексов).
Группу больных с БК составили 24 пациента, причем у 5 (20,8 %) из них диагностирована первая атака заболевания, а у 19 (79,2 %) диагноз установлен ранее. Согласно Монреальской классификации (2005), все пациенты с БК были разделены следующим образом: по возрасту начала заболевания группу А2 (с дебютом заболевания в возрасте от 17 до 40 лет) составили 16 (66,7 %) пациентов, а группу А3 (старше 40 лет) — 8 (33,3 %) больных. По локализации процесса были получены следующие данные: локализация в терминальном отделе тонкого кишечника L1 выявлена у 4 пациентов (16,7 %), колит L2 — у 15 (62,5 %) больных, а сочетанное поражение тонкого и толстого кишечника L3 выявлено у 5 (20,8 %) обследованных пациентов. Поражения типа L2 + L4 c локализацией процесса в желудке и ободочной кишке зафиксировано не было. Превалировала нестенозирующая, нефистулизирующая форма заболевания В1 — 17 (70,8 %) пациентов. Стенозирующая В2-форма БК выявлена у 4 (16,7%), а фистулизирующая В3 — у 3 (12,5 %) больных. Необходимо отметить, что у всех пациентов с В3-формой БК выявлены перианальные проявления, и они классифицировались нами как В3р. У двух больных диагностированы прямокишечные свищи как следствие перенесенного острого парапроктита, а у одной пациентки — хроническая анальная трещина и массивные папилломатозные разрастания на анодерме.
Поражения типа L2 + L4 c локализацией процесса в желудке и ободочной кишке зафиксировано не было. Превалировала нестенозирующая, нефистулизирующая форма заболевания В1 — 17 (70,8 %) пациентов. Стенозирующая В2-форма БК выявлена у 4 (16,7%), а фистулизирующая В3 — у 3 (12,5 %) больных. Необходимо отметить, что у всех пациентов с В3-формой БК выявлены перианальные проявления, и они классифицировались нами как В3р. У двух больных диагностированы прямокишечные свищи как следствие перенесенного острого парапроктита, а у одной пациентки — хроническая анальная трещина и массивные папилломатозные разрастания на анодерме.
Степень тяжести текущего заболевания, которая соответствует его активности, оценивали по индексу Беста, позволяющему определить характер течения заболевания в динамике у каждого конкретного пациента с учетом эффективности проводимых мероприятий, а также наличия или отсутствия внекишечных и перианальных проявлений, сохраняющихся длительное время. У пациентов с формой заболевания В3р дополнительно оценивалась степень активности перианальных осложнений с учетом индекса активности перианальной болезни Крона (PCDAI).
Оценивая изолированно проблему терминологии тяжести и активности проявлений БК, хотелось бы упомянуть о вопросе оценки тяжести основного заболевания и активности перианальных его осложнений. В связи с широким внедрением в клиническую практику биологической терапии в исследованиях последних лет стал использоваться такой критерий активности, как «ответ на терапию». По данным D.H. Present, P. Rutgeerts et al. (1999), клиническим ответом считается уменьшение на 50 % или более количества отделяемого из свищей по крайней мере при двух последовательных визитах пациента, а клинической ремиссией — полное прекращение отделяемого, несмотря на легкое надавливание, также по меньшей мере при двух последовательных визитах.
Полученные результаты распределились следующим образом: легкое течение заболевания и минимальная степень его активности отмечены у 3 (12,5 %) больных, у которых индекс Беста соответствовал 170, 185 и 225 баллам; средняя степень тяжести и умеренная активность воспалительного процесса — у 14 (58,3 %) пациентов (индекс Беста при этом составил 350 ± ± 70 баллов). В группе больных с индексом Беста 530 ± 45 баллов диагностированы тяжелое течение заболевания и высокая степень его активности — у 7 (29,2 %).
Необходимо отметить, что пациенты с ремиссией в группу исследования не включались. Результаты оценки тяжести течения и степени активности у больных с локализацией воспалительного процесса в тонкой кишке (L1) базировались в основном на изучении клинических показателей, так как при данной локализации провести качественное эндоскопическое и морфологическое исследование у неоперированных больных не представилось возможным. В то же время у всех пациентов с колитом Крона или при L3-форме БК клиническая тяжесть течения заболевания подтверждалась при колоноскопии с биопсией.
Эндоскопическая картина при стенозирующей форме заболевания характеризовалась выраженным гранулематозным воспалением, а при фистулизирующей — формированием глубоких язв-трещин.
Выводы
Таким образом, проведенное исследование свидетельствует о целесообразности разделения понятий «тяжесть заболевания» и «активность процесса», причем данный постулат наиболее правомочен у пациентов с неспецифическим язвенным колитом. Такая трактовка клинического течения заболевания позволит оптимизировать тактические подходы при лечении данной категории больных.
Bibliography1. Калинин А.В., Хазанов А.И. Гастроэнтерология и гепатология: диагностика и лечение. — Москва: Миклош, 2009. — 602 с.
2. Дорофеев А.Э., Звягинцева Т.Д., Харченко Н.В. Заболевания кишечника. — ЧП «Видавництво «Ліхтар», 2010. — 532 с.
3. Белоусова Е.А. Язвенный колит и болезнь Крона. — Тверь: ООО «Издательство «Триада», 2002. — 128 с.
4. Дорофеев А.Э. Диагностика и лечение заболеваний пищеварительного тракта. — Донецк: Норд-Пресс, 2009. — 366 с.
5. Григорьева Г.А., Мешалкина Н.Ю. Об алгоритмах диагностики и лечения осложненных форм неспецифического язвенного колита и болезни Крона // Терапевтический архив. — 2005. — № 8. — С. 48-55.
6. Халиф И.Л., Лоранская И.Д. Воспалительные заболевания кишечника (неспецифический язвенный колит и болезнь Крона): клиника, диагностика и лечение. — М.: Миклош, 2004. — 88 с.
7. Парфенов А.И. Основные направления и перспективы лечения воспалительных заболеваний кишечника (передовая) // Тер. арх. —2007. — Т. 8. — С. 5-8.
8. Ливзан М.А., Макейкина М.А. Воспалительные заболевания кишечника: современные аспекты диагностики и лечения // Гастроэнтерология. — 2010. — № 2.
9. Харченко Н.В., Бабак О.Я. Гастроентерологiя. — К., 2007. — 720 с.
10. Ahmad T., Satsangi J., McGovern D. et al. The genetics of inflammatory bowel disease // Aliment. Pharmacol. Ther. — 2001. — 15(6). — 731-748.
11. Dalton H.R., Jewell D.P. The immunology of inflammatory bowel disease // Inflammatory Bowel Disease / Ed. by G. Jamerot. — 1992. — 125-147.
12. Zeitz M. Role of immunological mechanisms in inflammatory bowel disease // Innovative Concepts in Inflammatory Bowel Diseases. Falk Symposium № 105. — 1998. — 33.
13. Dimitroulia E. Frequent detection of cytomegalovirus in the intestine of patients with inflammatory bowel disease // Inflamm. Bowel Dis. — 2006. — 12. — 879-884.
14. Swidsinski A. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease // J. Clin. Microbiol. — 2005. — 43. —3380-3389.
15. Satsangi J., Sutherland L.R. Inflammatory Bowel Disease. — Elsevier, 2003. — 792 p.
16. Norton J. Greenberger, Richard S. Blumberg, Robert Burakoff Current Diagnosis & Treatment: Gastroenterology, Hepatology, & Endoscopy. — McGraw Hill Medical. — 2009. — 547 c.
17. Dignass A., Van Assche G., Lindsay J.O. et al. The second European evidencebased Consensus on the diagnosis and management of Crohn’s disease // J. Crohn’s & Colitis. — 2010. — Vol. 4/1. — P. 29-62.
18. Stephen C. Hauser, Darrell S. Pardi, John J. Poterucha. Mayo Clinic Gastroenterology and Hepatology Board Review. — 3rd ed. — Mayo clinic scientific press and Informa healthcare USA, Inc., 2008. — 503 c.
Упадацитиниб – препарат, разработанный компанией AbbVie
Москва, Россия, 16 февраля 2021 года – Глобальная научно-исследовательская биофармацевтическая компания AbbVie объявила о положительных результатах исследования U-ACHIEVE фазы 3, в котором упадацитиниб (45 мг/сут) достиг первичной конечной точки клинической ремиссии (согласно адаптированной шкале Мейо) на 8 неделе, а также вторичных конечных точек при применении у взрослых пациентов с язвенным колитом среднетяжёлой и тяжелой степени1.
«Несмотря на доступность вариантов лечения с различными механизмами действия, многие пациенты все еще не способны достичь контроля над своим заболеванием, — сказал Майкл Северино (Michael Severino), M.D., вице-председатель и президент компании AbbVie. — Мы воодушевлены полученными результатами исследований, демонстрирующими потенциал упадацитиниба в улучшении клинических исходов и показателей эндоскопической и гистологической оценки у пациентов с язвенным колитом».
Достоверно большее число пациентов, получавших упадацитиниб, достигли эндоскопического улучшения на 8 неделе в сравнении с пациентами, получавшими плацебо (36% против 7%; p <0,001)1. Более того, 30% пациентов, получавших упадацитиниб, достигли улучшения слизистой оболочки, выявленного при гистологическом и эндоскопическом исследовании, на 8 неделе в сравнении с 7% пациентов, получавших плацебо (p<0,001)1. Большая часть пациентов, получавших упадацитиниб, достигла клинического ответа (согласно адаптированной шкале Мейо) на 8 неделе в сравнении с плацебо (73% против 27%; p <0,001), а 60% пациентов, получавших упадацитиниб, достигли клинического ответа (согласно частичной адаптированной шкале Мейо) на 2 неделе в сравнении с 27% в группе плацебо (p <0,001)1.
«Язвенный колит – заболевание, которое тяжело поддается лечению и многим пациентам сложно избавиться от его симптомов, — сказал Сильвио Данесе (Silvio Danese), M.D., ведущий исследователь и руководитель Центра воспалительных заболеваний кишечника в Исследовательской клинике Humanitas, Милан, Италия. – Я обрадован полученными положительными результатами, демонстрирующим потенциал упадацитиниба в облегчении симптомов и контроле воспаления слизистой оболочки у пациентов со среднетяжелым и тяжелым язвенным колитом».
|
Результаты эффективности U—ACHIEVE на 8 неделе*,1 |
||
|
Упадацитиниб 45 мг/сут (n=319) |
Плацебо (n=154) |
|
|
Клиническая ремиссия (адаптированная шкала Мейо)a,† |
26% |
5% |
|
Клинический ответ (адаптированная шкала Мейо)b,† |
73% |
27% |
|
Эндоскопическое улучшение,† |
36% |
7% |
|
Улучшение по данным гистологического и эндоскопического исследования d,† |
30% |
7% |
|
* Первичной конечной точкой была клиническая ремиссия (согласно адаптированной шкале Мейо). Вторичные ранжированные конечные точки включали: клинический ответ (согласно адаптированной шкале Мейо), эндоскопическое улучшение и улучшение слизистой, выявленное при гистологическом и эндоскопическом исследовании. Показаны не все ранжированные вторичные конечные точки. Все первичные и ранжированные вторичные конечные точки достигли значений p <0,001 в сравнении с плацебо. aКлиническая ремиссия по адаптированной шкале Мейо определяется как подшкала частоты стула (SFS) ≤1 и не превышающая исходного уровня, подшкала ректального кровотечения (RBS) 0 и эндоскопическая подшкала ≤1. b Клинический ответ по адаптированной шкале Мейо определяется как уменьшение по сравнению с исходным уровнем по адаптированной шкале Мейо на ≥2 балла и ≥30% от исходного уровня, плюс уменьшение RBS ≥1 или абсолютного RBS ≤1. |
||
|
cЭндоскопическое улучшение определяется как балл ≤1 по эндоскопической подшкале. |
||
|
dУлучшение состояния слизистой оболочки, выявленное при гистолого-эндоскопическом исследовании, определяется как эндоскопический балл 0 или 1 и оценка по шкале Geboes ≤3,1. † Наличие контактного кровотечения во время эндоскопии у пациентов с «легкой» эндоскопической активностью учитывалось как эндоскопический балл 2. |
||
Профиль безопасности упадацитиниба (45 мг) соответствовал результатам, полученным в предшествующих исследованиях, при этом новых рисков безопасности выявлено не было1-5. В течение 8-недельного периода исследования, наиболее частыми нежелательными явлениями (НЯ), которые наблюдались в группе пациентов, получавших упадацитиниб, были акне, повышение в крови уровня креатинфосфокиназы и ринофарингит1. Повышение уровня креатинфосфокиназы в крови не относилось к серьезным НЯ и не требовало отмены препарата1. Повышение уровня креатинфосфокиназы у пациентов обычно протекало бессимптомно, и о случаях рабдомиолиза не сообщалось1. Серьезные нежелательные явления (СНЯ) наблюдались у 2,5% пациентов в группе упадацитиниба и у 5,8% пациентов в группе плацебо1. О серьезных инфекциях сообщалось нечасто (1,6% в группе упадацитиниба и 1,3% в группе плацебо)1. Случаев смерти, перфорации желудочно-кишечного тракта, злокачественных новообразований, серьезных сердечно-сосудистых или тромбоэмболических осложнений не наблюдалось1.
Полные результаты исследования U-ACHIEVE будут представлены на предстоящих специализированных конференциях и опубликованы в рецензируемом журнале. Использование упадацитиниба при язвенном колите не одобрено, а его безопасность и эффективность не оценивались регуляторными ведомствами.
О язвенном колите
Язвенный колит — хроническое системное воспалительное заболевание, сопровождающееся воспалением слизистой оболочки толстой кишки, проявляющееся болью в животе, поносом с кровью, болезненными позывами к дефекации, потерей веса и утомляемостью15-17. Тяжесть симптомов и неконтролируемые обострения заболевания у пациентов с язвенным колитом часто приводят к инвалидности 18.
Об исследовании U—ACHIEVE1,8
U-ACHIEVE – продолжающееся многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2b/3 для оценки эффективности и безопасности упадацитиниба для индукционной и поддерживающей терапии у пациентов с язвенным колитом среднетяжёлой и тяжелой степени. Результаты фазы 2b исследования были объявлены в октябре 2018 года. Целью данного первого из двух индукционных исследований фазы 3 является оценка эффективности и безопасности упадацитиниба в дозе 45 мг/сут в сравнении с плацебо.
Первичной конечной точкой исследования стало достижение клинической ремиссии (согласно адаптированной шкале Мейо) на 8 неделе. Ранжированные вторичные конечные точки включали клинический ответ (снижение по сравнению с исходным уровнем согласно адаптированной шкале Мейо на ≥2 балла и ≥30% от исходного уровня, плюс снижение шкалы кровотечения (RBS) на ≥1 или абсолютное RBS ≤1), эндоскопическое улучшение (≤1 по эндоскопической шкале оценки активности) и улучшение слизистой при гистолого-эндоскопическом исследовании (эндоскопический балл 0 или 1 и оценка Geboes≤3,1) на 8 неделе. Более подробную информацию об исследовании вы можете найти на сайте www.clinicaltrials.gov (NCT02819635).
О программе исследований применения упадацитиниба при язвенном колите фазы 38,19,20
В глобальной программе, состоящей из трех основных исследований, применения упадацитиниба при язвенном колите фазы 3 принимает участие более 1 300 пациентов с язвенным колитом среднетяжёлой и тяжелой степени. Данные исследования включают в себя оценку эффективности, безопасности и переносимости препарата. Ключевые показатели эффективности включают клиническую ремиссию согласно адаптированной шкале Мейо, клинический ответ по адаптированной шкале Мейо, эндоскопическое улучшение и эндоскопический ответ. Более подробную информацию об этих исследованиях можно найти на сайте www.clinicaltrials.gov (NCT02819635, NCT03653026, NCT03006068).
О препарате РАНВЭК (упадацитиниб)
Разработанный компанией AbbVie, препарат РАНВЭК — это селективный обратимый ингибитор Янус киназ, применение которого исследуется для лечения (перорально, один раз в сутки) ряда иммуноопосредованных воспалительных заболеваний1,6-14. На данный момент препарат РАНВЭК одобрен в России для лечения ревматоидного артрита, анкилозирующего спондилита и псориатического артрита. Утвержденная доза препарата РАНВЭК для лечения этих заболеваний составляет 15 мг один раз в сутки22. Продолжаются исследования фазы 3 по оценке эффективности и безопасности применения препарата РАНВЭК для лечения атопического дерматита, аксиального спондилоартрита, болезни Крона, язвенного колита, гигантоклеточного артериита и болезни Такаясу 7-14. Использование РАНВЭК при язвенном колите не одобрено, а его безопасность и эффективность не оценивались регуляторными агентствами.
Важная информация по безопасности РАНВЭК (упадацитиниб)21
РАНВЭК. Применение и важная информация по безопасности
РАНВЭК – рецептурный препарат, который используется для лечения взрослых пациентов с ревматоидным артритом умеренной и высокой активности, активным псориатическим артритом, анкилозирующим спондилитом22.
О роли компании AbbVie в гастроэнтерологии
Благодаря надежной программе клинических исследований, AbbVie стремится проводить передовые исследования, чтобы поддерживать важные достижения в области воспалительных заболеваний кишечника (ВЗК), таких как язвенный колит и болезнь Крона. Благодаря инновациям, обучению и адаптации AbbVie стремится избавиться от бремени ВЗК и оказывать значительное влияние на жизнь пациентов с этими заболеваниями. Для получения дополнительной информации о роли AbbVie в гастроэнтерологии воспользуйтесь ссылкой https://www.abbvie.com/our-science/therapeutic-focus-areas/immunology/immunology-focus-areas/gastroenterology.html
Об AbbVie
Миссия компании AbbVie — разработка и вывод на рынок инновационной терапии для лечения некоторых из самых тяжелых заболеваний и решение медицинских проблем завтрашнего дня. Мы стремимся оказывать значительное влияние на жизнь людей в ключевых терапевтических областях: иммунология, онкология, неврология, офтальмология, вирусология, женское здоровье и гастроэнтерология, а также с помощью продуктов и услуг подразделения Allergan — эстетическая медицина.
______________________________________
- AbbVie. Data on File: ABVRRTI71469.
- Cohen S., et al. Safety profile of upadacitinib in Rheumatoid Arthritis: Integrated analysis from the SELECT Phase 3 Clinical Program. EULAR 2019; THU0167.
- Genovese, M.C., et al. Efficacy and Safety of Upadacitinib in Patients With Active Psoriatic Arthritis and Inadequate Response to Biologic Disease-Modifying Anti-Rheumatic Drugs (SELECT-PsA-2): a Double-Blind, Randomized Controlled Phase 3 Trial. 2020 EULAR E-Congress; OP0223.
- Van der Heijde D., et al. Efficacy and Safety of Upadacitinib in a Randomized, Double-Blind, Placebo-Controlled, Multicenter Phase 2/3 Clinical Study of Patients With Active Ankylosing Spondylitis. 2019 ACR/ARP Annual Meeting; 2728.
- Guttman-Yassky, E., et al. Safety and Efficacy of Upadacitinib Monotherapy in Adolescents and Adults with Moderate-to-severe Atopic Dermatitis: Results From 2 Pivotal, Phase 3, Randomized, Double-blinded, Monotherapy, Placebo-controlled Studies (Measure Up 1 and Measure Up 2). European Academy of Dermatology and Venerology Congress. 2020. D3T03.4B.
- Pipeline – Our Science | AbbVie. AbbVie. 2019. Available at: https://www.abbvie.com/our-science/pipeline.html. Accessed on December 3, 2020.
- Burmester G.R., et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018 Jun 23;391(10139):2503-2512.
- A Study to Evaluate the Safety and Efficacy of ABT-494 for Induction and Maintenance Therapy in Subjects With Moderately to Severely Active Ulcerative Colitis. ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT02819635. Accessed on Accessed on December 3, 2020.
- A Multicenter, Randomized, Double-Blind, Placebo-Controlled Study of ABT-494 for the Induction of Symptomatic and Endoscopic Remission in Subjects With Moderately to Severely Active Crohn’s Disease Who Have Inadequately Responded to or Are Intolerant to Immunomodulators or Anti-TNF Therapy. ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT02365649. Accessed on Accessed on December 3, 2020.
- A Study Comparing Upadacitinib (ABT-494) to Placebo and to Adalimumab in Participants With Psoriatic Arthritis Who Have an Inadequate Response to at Least One Non-Biologic Disease Modifying Anti-Rheumatic Drug (SELECT — PsA 1). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03104400. Accessed on December 3, 2020.
- A Study to Evaluate Efficacy and Safety of Upadacitinib in Adult Participants With Axial Spondyloarthritis (SELECT AXIS 2). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT04169373. Accessed on December 3, 2020.
- A Study to Compare Safety and Efficacy of Upadacitinib to Dupilumab in Adult Participants With Moderate to Severe Atopic Dermatitis (Heads Up). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03738397. Accessed on December 3, 2020.
- A Study to Evaluate the Safety and Efficacy of Upadacitinib in Participants With Giant Cell Arteritis (SELECT-GCA). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03725202. Accessed on December 3, 2020.
- A Study to Evaluate the Efficacy and Safety of Upadacitinib in Subjects With Takayasu Arteritis (SELECT-TAK). ClinicalTrials.gov. 2020. Available at https://clinicaltrials.gov/ct2/show/record/NCT04161898. Accessed on Accessed on December 3, 2020.
- The Economic Costs of Crohn’s Disease and Ulcerative Colitis. Access Economics Pty Limited. 2007. Available at: https://www.crohnsandcolitis.com.au/site/wp-content/uploads/Deloitte-Access-Economics-Report.pdf. Accessed on December 3, 2020
- The Facts about Inflammatory Bowel Diseases. Crohn’s & Colitis Foundation of America. 2014. Available at: https://www.crohnscolitisfoundation.org/sites/default/files/2019-02/Updated%20IBD%20Factbook.pdf. Accessed on December 3, 2020
- Crohn’s disease. Symptoms and Causes. Mayo Clinic. 2020. Available at: https://www.mayoclinic.org/diseases-conditions/crohns-disease/symptoms-causes/syc-20353304. Accessed on December 3, 2020.
- Mehta F. Report: economic implications of inflammatory bowel disease and its management. Am J Manag Care. 2016 Mar;22(3 Suppl):s51-60.
- A Study of the Efficacy and Safety of Upadacitinib (ABT-494) in Participants With Moderately to Severely Active Ulcerative Colitis (U-Accomplish). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03653026. Accessed on December 3, 2020.
- A Study to Evaluate the Long-Term Safety and Efficacy of Upadacitinib (ABT-494) in Participants With Ulcerative Colitis (UC). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03006068. Accessed on December 3, 2020.
- RINVOQ™ (upadacitinib) [Package Insert]. North Chicago, Ill.: AbbVie Inc.
- Инструкция по медицинскому применению препарата Ранвэк. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=ef952958-d7a1-42f5-963f-a3661d7f74c9&t= Доступ 27 января 2021 года.
Система оценки Мэйо для оценки язвенного колита |
| Какой из них выбрать? «Частичная партитура Мэйо была исполнена так же, как и полная партитура Мейо. идентифицировать пациента воспринимаемый клинический ответ. « 1 . Частичную оценку по клинике Мейо можно легко выполнить у постели больного. только начальная оценка, но также и последующие посещения для оценки воздействия клинические вмешательства. |
| Выбор предпочтительной системы подсчета очков Мэйо : Полная оценка Мэйо (включая эндоскопические данные) Частичная оценка Мэйо (исключает эндоскопию) |
| 1. Частота стула (в день) : 1 Нормальное количество стула для этого пациента 1-2 больше нормы 3-4 больше нормы 5 или больше нормы |
| 2. Ректальное кровотечение (укажите наиболее сильное кровотечение из
день) : Крови не наблюдается Полосы крови со стулом менее чем в половине случаев Очевидная кровь в стуле большую часть времени проходит только кровь [ Присвоение 3 баллов требует, чтобы пациенты имели> / = 50% кишечника движение, сопровождающееся видимой кровью и испражнения 1+ с кровью один.] 2 |
| 3. Внешний вид слизистой оболочки при эндоскопии Нормальное или неактивное заболевание Легкое заболевание (эритема, снижение сосудистого рисунка, легкая рыхлость) Умеренная эритема с выраженным заболеванием, отсутствие сосудистого рисунка, хрупкость, эрозии Тяжелое заболевание (спонтанное кровотечение, изъязвление) [ Игнорировать, если вы selected Частичная оценка Мэйо ] |
| 4. Общая оценка врача: * нормальное (промежуточные баллы в основном равны 0) легкое заболевание (промежуточные баллы в основном равны 1) умеренное заболевание (промежуточные баллы в основном составляют от 1 до 2) тяжелое заболевание (промежуточные баллы в основном составляют от 2 до 3) [* Глобальная оценка врачей признает баллов, ежедневная запись дискомфорта в животе и функциональных оценка и другие наблюдения, такие как физические данные, и статус пациента .] 2 |
Справочная информация |
| Оценка: Частота стула Ректальное кровотечение Внешний вид слизистой оболочки при эндоскопии Оценка активности заболевания врачом Оценка на основе баллов : Частичный показатель индекса Мэйо |
Список литературы |
|
Не позволяйте весам утяжелять вас
Не позволяйте весам утяжелять вас
Если вы похожи на многих людей, пытающихся похудеть, число, которое вы видите на весах утром, может повлиять на весь ваш день.Неутешительные новости с весов могут даже отправить вас прямиком к ближайшей домашней еде. Попробуйте практиковать осознанность, чтобы весы стали вам другом.
Джейми Л. ФрендЕсли вы, как и многие люди, пытаетесь похудеть, число, которое вы видите утром на весах, может повлиять на весь ваш день. Для многих весы измеряют самооценку, а также вес.
Если вы весите меньше, чем предполагали, вы чувствуете себя уверенно и успешно. Но если ваш вес выше ожидаемого, вы можете подумать: «Я ничего не могу делать правильно» или «Все те тяжелые усилия, которые я вкладываю в упражнения и попытки правильно питаться, не имеют никакого значения, так почему я беспокоить?» Неутешительные новости о весах могут даже отправить вас прямиком за ближайшей привычной едой.
Что, если бы вы могли без страха стоять перед весами? Это возможно, и ключ к этому — внимательность.
По своей сути, внимательность включает в себя сосредоточение внимания намеренно, без осуждения. Используя этот подход, вы взвешиваете себя без осуждения, понимая, что самообвинения не помогают вам похудеть. Напротив, исследования показывают, что, когда вы строго осуждаете себя, вы с большей вероятностью будете искать утешения, которое может проявляться в виде высококалорийной пищи или бездействия.
Вот три способа начать менять свое отношение к тому, что говорят вам весы.
Прекратить судить. Вместо того, чтобы переключаться между любовью и ненавистью к шкале, подумайте о том, что она вам говорит и как эта информация может вам помочь. Спросите себя: «Что я могу извлечь из этого?» Это поможет вам определить, какие шаги предпринять дальше на пути к снижению веса.
Будьте добры к себе. Ты человек. Критикуя себя, изолируя себя или позволяя своим заботам взять верх над собой, вы не достигнете своих целей.Такое поведение лишь показывает, что вам нужно немного сочувствия к себе. Когда вы начинаете критиковать себя, бросьте вызов своим мыслям, спросив: «Верно ли то, что я говорю себе прямо сейчас? Действительно ли я плохой человек, потому что число на шкале выше, чем я ожидал?»
Измените то, как вы смотрите на масштаб. Конечно, вам не обязательно любить свои весы, но вы можете превратить свои негативные мысли в более позитивные. Вы можете сказать себе: «Это число — показатель, который поможет мне узнать, работают ли на меня изменения в моем поведении.«Или» Это число измеряет лишь небольшую часть меня. Он не включает мою страсть и желание работать, мою любовь к семье и друзьям, мои таланты и сильные стороны ». И еще одно:« Шкала — это только одно измерение. Он не показывает изменений в процентном содержании жира в моем организме или о том, как моя одежда по-разному сидит на моем теле ».
Это может даже помочь вам написать «Чему я могу научиться из этого?» на листе бумаги и повесьте его над весами, чтобы вы могли видеть его каждый раз, когда взвешиваетесь.Затем смело шагайте вперед — держите голову высоко, какое бы число вы ни увидели.
Эксперименты
- Когда вы замечаете, что выносите суждения, запишите их и затем спросите себя: «Чему я могу научиться из этого?»
- Когда вы сталкиваетесь с неудачей из-за веса, подумайте, прежде чем критиковать себя. Что бы вы сказали другу, находящемуся в таком же положении? А теперь попробуйте использовать этот язык для себя.
- Подружитесь с весами. Если чувство страха начинает закрадываться, когда вы собираетесь наступить, остановитесь и подумайте о более широкой картине того, что вы изучаете, когда взвешиваете себя.
- Mantzios M, et al. Изучение внимательности и внимательности с помощью вмешательств, ориентированных на самосострадание, для помощи в похудании: теоретические соображения и предварительные результаты рандомизированного пилотного исследования. Внимательность. Июль 2014.
.
Signant Health поднимает планку испытаний язвенного колита с помощью eCOA
Клиническая шкала Мэйо (MCS) — один из наиболее часто используемых показателей активности заболевания в клинических испытаниях язвенного колита (UC).Спонсоры используют MCS, поскольку это обычная первичная конечная точка в исследованиях UC. Однако реализовать это может быть сложно по разным причинам. Наш эксперт Кэти Гарнер делится с нами своим мнением о состоянии и о том, как использование электронной оценки клинических результатов (eCOA) в клинических испытаниях UC может принести пользу отрасли. В этом разделе вопросов и ответов Кэти рассматривает сложности и проблемы внедрения MCS и дает рекомендации по улучшению соответствия, рабочих процессов на объекте и внедрения eCOA в клинические испытания UC.
Кэти ГарнерQ: Вы можете создать для нас сцену? Что такое язвенный колит?
Язвенный колит (ЯК) — хроническое рецидивирующее воспалительное заболевание кишечника (ВЗК), которое вызывает воспаление пищеварительного тракта. Для него характерны боли в животе и диарея. Как и болезнь Крона, еще одна распространенная ВЗК, ЯК может быть изнурительным и иногда приводить к опасным для жизни осложнениям. Обычно он поражает только самую внутреннюю оболочку толстой кишки (называемую слизистой оболочкой) и прямую кишку.Это происходит только через непрерывные участки толстой кишки, в отличие от болезни Крона, которая возникает очагами в любом месте пищеварительного тракта и часто распространяется глубоко в слои пораженных тканей.
По оценкам, в настоящее время в США от 1–1,3 миллиона человек страдают ВЗК. 1 Точное понимание того, сколько людей страдают болезнью Крона и ЯК, очень сложно, поскольку не существует стандартных критериев для диагностики ВЗК. Выявление случаев ВЗК часто бывает непоследовательным, или заболевание может быть классифицировано как другое состояние.
Q: Что такое оценка MAYO и почему это проблематично?
ЯК не поддается лечению, но существует ряд лекарств для лечения симптомов болезни. Клинические испытания, предназначенные для изучения эффективности терапевтических вмешательств, требуют измерения результатов, которые оценивают активность заболевания. Эти меры часто объединяют результаты инвазивных тестов (ректороманоскопия или колоноскопия) и клинические характеристики, сообщенные пациентом. Клиническая оценка Мэйо (MCS) — один из наиболее часто используемых показателей активности заболевания в клинических испытаниях ЯК, однако его применение может быть проблематичным.Проблемы возникают в связи со сбором данных и подсчетом баллов MAYO, выбором данных для целей оценки, соответствием данных и рабочими процессами клинического центра.
Поскольку заболеваемость ЯК продолжает расти, вероятно, что количество клинических испытаний ЯК будет продолжать расти, и поэтому крайне необходимо более эффективное решение для расчета шкалы MAYO. В Signant Health мы разработали новый способ расчета баллов MAYO с использованием единого решения, которое легко реализовать и которое предлагает преимущества для пациентов, сайтов и спонсоров.Клинические испытания для оценки болезни и поиска новых методов лечения ЯК имеют решающее значение, и с помощью Signant Health эти испытания будут оснащены для сбора соответствующих, полных и качественных данных.
Q: Можете ли вы рассказать нам, как проходит клиническое исследование UC?
Эффекты лечения часто оцениваются по признакам и симптомам, сообщаемым пациентами, а также по эндоскопическим свидетельствам воспаления. В условиях клинических испытаний MCS исторически использовался для оценки активности заболевания, сочетая эндоскопические данные с признаками и симптомами, оцененными врачом, на основе информации, предоставленной пациентом, и суммирования в единую общую оценку.И Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), и Европейское агентство по лекарственным средствам (EMA) выпустили руководящие принципы, относящиеся к клиническим испытаниям ЯК, в которых отмечается важность включения адекватно подтвержденных показателей исходов, сообщаемых пациентами (PROM), для оценки облегчения симптомов в качестве основного показателя результата в основных клинических исследованиях ЯК. 5,6
Индустрия клинических испытаний внедрила технологии для повышения эффективности и качества испытаний, включая электронную оценку клинических результатов (eCOA) и, в частности, электронную оценку результатов, сообщаемую пациентами (ePRO).Прогнозируется, что рынок eCOA будет значительно расти по мере того, как будут реализованы преимущества полноты данных, своевременности, точности и относимости, а регулирующие органы будут усиливать свои рекомендации в отношении электронного сбора данных.
Используя системы электронных устройств, PROM при ВЗК можно регулярно измерять до и между посещениями, чтобы определить реакцию на терапию или ее неэффективность. FDA заявило, что MCS соответствует текущим нормативным требованиям для разработки лекарств в UC.Тем не менее, он признает, что есть ограничения с этой оценкой и другими оценками, потому что они включают Глобальную оценку врача (PGA). FDA не считает, что единственная оценка врача может точно отражать состояние пациента. FDA призвало спонсоров разработать альтернативные критерии результатов на основе результатов, сообщенных пациентами, и тем временем поощряет использование MCS. 7
Вопрос: В чем заключаются особые проблемы MCS?
Есть много способов реализовать MCS.Это составная оценка, что означает, что несколько компонентов объединяются в одну оценку, включая исходы, сообщаемые пациентами, результаты, сообщаемые клиницистами, и обычно значение медицинской визуализации при колоноскопии. Что касается внедрения eCOA, испытания UC аналогичны большинству других клинических испытаний. Однако есть несколько аспектов, которые могут вызвать затруднения, в основном связанные с внедрением MCS. К ним относятся:
- Агрегирование данных из нескольких источников,
- сбор данных и расчет MCS,
- выбор данных для целей оценки,
- соответствие данных и
- рабочий процесс сайта
Q: Какие проблемы возникают при сборе данных?
Перед визитом на место необходимо собрать много данных о пациенте.С точки зрения спонсоров, они хотят получить баллы MAYO по одной системе. Собрать все данные в одном месте для расчетов может быть сложно. Для выполнения расчета Майо в одной и той же программной среде должны присутствовать данные о пациенте, врачи / данные об объекте и часто оценка эндоскопии (в зависимости от того, является ли она полной или частичной оценкой Мэйо). Ручной расчет отнимает больше времени, может привести к ошибкам и обременительным для персонала объекта. Это особенно важно, когда MCS также используется в качестве критерия приемлемости.Удобное решение eCOA, которое позволяет объединять данные пациента и места, а также рассчитывать MCS. Это то, что лежит в основе нашего подхода в Signant Health.
Q: Есть ли проблемы с выбором данных?
Как правило, протокол исследования требует данных за фиксированное количество дней до посещения объекта для расчета оценки MCS. Используется несколько дней, а не один, чтобы информация отражала опыт испытуемого. FDA обычно рекомендует использовать последний трехдневный последовательный период в течение недели перед визитом для расчета промежуточных показателей частоты стула и ректального кровотечения.
Сайт обычно просят ввести дату посещения, чтобы система рассчитала правильное окно сбора данных. Важно выделить дни, в которые проводилась эндоскопия / подготовка кишечника, чтобы эти данные можно было исключить. Эти дни исключены, потому что подготовка кишечника способствует опорожнению кишечника. В эти дни, вероятно, будет больше движений, и это не совсем соответствует состоянию пациента. На сайте следует спросить: «Была ли выполнена подготовка кишечника к этому визиту?» «Дата подготовки кишечника?» так что данные по этим дням можно исключить из оценки Мэйо.
Q: С какими проблемами комплаенса вы сталкиваетесь?
Бремя пациента и вовлеченность могут быть проблемой. Из-за большого количества данных, которые необходимо собрать от пациента, это может привести к увеличению нагрузки на пациента и потере взаимодействия. Таким образом, в конечном итоге может быть нарушено соответствие завершения PROM. Несоблюдение, в свою очередь, может повлиять на расчет MCS. Некоторые исследования UC требуют, чтобы пациенты собирали данные в течение заранее определенного периода перед посещением объекта. Пациенты могут забыть начать вводить данные или не заполнить все необходимые данные, что приведет к низкому соблюдению режима лечения.Запись данных только в некоторые дни может привести к тому, что пациенты забудут завершить ввод данных (даже если им будут отправлены напоминания). Решение eCOA может иметь звуковые сигналы, чтобы напоминать пациентам о необходимости ввода данных и легко проводить их через сбор данных, уменьшая часть нагрузки.
Если решение eCOA извлекает данные за те дни, когда субъект не заполнял свой ежедневный дневник, и отсутствуют данные или данные, то оценка не будет выставлена правильно. Поэтому FDA рекомендует использовать три дня подряд «за неделю до посещения» и не ограничивает свое руководство тремя днями непосредственно перед посещением.Это обеспечивает некоторую гибкость и позволяет получить наиболее полный набор данных (работая по правилам последовательных дней и исключая подготовку кишечника). Решение eCOA может выбрать необходимое количество последовательных дней, в которые вводятся данные субъекта, и избежать несоответствующих дней, когда данные субъекта не были введены.
В. Как это может повлиять на рабочий процесс сайта?
Практические аспекты расчета показателя MCS могут быть сложными, особенно если субъекты и сайты имеют разные устройства, которые они используют для ввода данных.Многие исследования UC также включают другие инструменты, такие как анкета по воспалительному заболеванию кишечника (IBDQ), заполняемая при посещении больницы на планшете. Не всегда практично, чтобы субъект и сайт передавали одно устройство вперед и назад, требуя, чтобы они входили и выходили несколько раз. Таким образом, важно помнить об этом бремени и стараться по возможности уменьшить его.
Вопрос: Не могли бы вы описать решение Signant Health?
Наша клиническая наука и опыт консультирования, в том числе опыт подготовки рейтеров в таких областях, как нейробиология, позволили нам разработать уникальный план для понимания того, как оценивать сложные состояния и конкретные испытания.В конечном итоге мы хотим снять нагрузку с сайтов, спонсоров и пациентов. Мы провели качественное исследование в Signant Health, чтобы оценить, как составные баллы, такие как MCS, были реализованы в различных исследованиях, а также определить текущий опыт и отношения, потенциальные проблемы, возможности и передовые методы использования eCOA в клинических испытаниях UC. После изучения всех требований и реализаций было определено лучшее в своем классе веб-решение UC eCOA, сочетающее компоненты eDiary и Management.
Электронный дневник на:
- Захватите ежедневные реакции пациента на симптомы,
- зафиксируйте «нормальное» количество стула пациента в день во время ремиссии и
- зафиксируйте, если необходимо, принимал ли пациент лекарства от диареи / запора (или что-то еще, определяемое как « день исключения)
Инструмент управления для сайтов на:
- Регистрация дат посещения или разрешение пользователям «активировать» посещение,
- регистрацию значений PGA,
- регистрацию значений оценки эндоскопии,
- регистрацию любой другой соответствующей информации, такой как даты подготовки кишечника и даты процедуры,
- подсчет баллов, после того, как вся необходимая информация была введена для посещения,
- фиксирует, если необходимо, критерии допуска или дополнительных проверок и информирует пользователя, когда эти критерии соблюдены, а
- позволяет пользователям «пересчитать», если значение было настраивается с помощью формы коррекции данных (DCF), или если устройство отправило данные, которые ранее были недоступны. использовать дневник.Записи дневника преобразуются в промежуточные баллы и объединяются с баллами врача и эндоскопии для расчета и отображения баллов MCS в интерфейсах управления исследованием (наша система TrialMAx®).
Спонсоры клинических испытаний и исследователи, проводящие исследование UC, продолжают сталкиваться с множеством проблем, когда дело доходит до реализации стратегии eCOA. Технология клинических испытаний спонсора должна быть больше, чем просто сбор данных. Речь должна идти о расширении прав и возможностей пациентов и их вовлечении. Он должен помочь пациентам на протяжении всего пути клинических испытаний.И это должно помочь спонсорам и сайтам достичь своих целей.
Использование интегрированного электронного решения дает так много преимуществ как с точки зрения эффективности, так и качества данных. Он соответствует тематике и потребностям сайта в сборе данных, позволяет объединять данные, вычислять и управлять рабочими процессами сайта
Субъектам выгодно вести ежедневный дневник, а не только в те дни, которые требуются перед посещением объекта. По нашему опыту, субъекты испытывают меньшую нагрузку при выполнении знакомой им деятельности, вместо того, чтобы думать и запоминать, в какие дни завершать информацию, а в какие — нет.Мы верим, что это правда, даже если им будут напоминать. Общее соответствие и качество данных, вероятно, будут выше при ежедневном ведении дневника.
Ежедневный дневник также снижает вероятность ошибок при открытии, закрытии и изменении расписания окон ввода данных. Окна ввода данных зависят от данных хорошего качества, отправляемых в течение определенного окна ввода данных. Однако подход, основанный на ежедневном дневнике, позволяет системе выбирать дни, соответствующие данным и протоколу.
Вопрос: Как, по вашему мнению, это повлияет на большую индустрию клинических исследований?
Здесь есть один ключевой элемент.Этот элемент проходит через все темы, о которых мы говорили, — это важность простоты. Спонсорам, CRO и исследовательским центрам нужна технология, которая ежедневно органично объединяет их исследовательские программы с потоком пациентов. Чем проще пациентам участвовать в исследовании, а исследовательским группам и исследовательским центрам — проводить исследования, тем проще обеспечить качество, повысить эффективность и предоставить данные и аналитику, которые помогут улучшить будущее здравоохранения для всех. Сочетание решений с фоном упрощает каждый шаг на пути к пациенту и позволяет пациентам предоставить правдивую информацию, необходимую для сегодняшних исследований.В Signant Health мы привержены технологиям и инновациям. Унифицированное решение, поддерживаемое опытными разработчиками, руководителями проектов, аналитиками данных, учеными и клиницистами, может действительно улучшить ключевые аспекты клинических исследований от планирования и запуска до закрытия и за его пределами.
Часто тем, кто проводит испытания объединенных коммуникаций, приходится полагаться на поставщиков технологий, обладающих опытом и знаниями в этой области. У нас есть ответы, поэтому вам не нужно беспокоиться о том, чтобы найти путь вперед. Чтобы опережать потенциальные риски, нужен опыт, и платформы eCOA, которые решают вопросы качества данных на шаг впереди, имеют преимущество.Немногие могут претендовать на глубокий опыт в этой области, поэтому первым шагом будет поиск партнера с опытом в этой области. Если это может быть подкреплено обширным опытом в науке, операциях и регулировании в терапевтических областях и странах, то спонсоры должны быть уверены в использовании глобально доступных технологий, которые обеспечивают цельные, удобные решения для многих различных категорий пациентов.
Список литературы
- Каппельман, доктор медицинских наук, Рифас-Шиман С.Л., Клейнман К., Оллендорф Д., Бусварос А., Гранд Р.Дж., Финкельштейн Д.А.Распространенность и географическое распространение болезни Крона и язвенного колита в США. Клин Гастроэнтерол Гепатол. 2007; 5: 1424-9.
- Организация пациентов с болезнью Крона и колита в Великобритании, https://www.crohnsandcolitis.org.uk/about-inflamasted-bowel-disease/treatments
- Отчет об эпидемиологии Medtrack Язвенный колит, ОКТ / PSM / Терапевтические области / Резюме терапевтических показаний / PDF Отчет об эпидемиологии «Язвенный колит», https://oct.crfhealth.com/kronodoc/P%26S/857166
- Регистрация клинических испытаний, клинические испытания.gov
- Европейское агентство по лекарственным средствам (EMA) (июль 2016 г.). Руководство по разработке новых лекарственных средств для лечения язвенного колита (Проект). Доступно по адресу http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2016/07/WC500211431.pdf. Лондон, Великобритания: Европейское агентство по лекарственным средствам.
- FDA и CDER (август 2016 г.). Язвенный колит: Руководство по конечным точкам клинических испытаний для промышленности. (Проект руководства) Доступно по адресу http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM515143.pdf Сильвер-Спринг, доктор медицины: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), Центр оценки и исследований лекарственных средств (CDER).
- https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm515143.pdf
Недавние сообщения
Использование современных технологий для улучшения клинических исследований
eCOA Бриана Данэм
Просмотреть все недавние сообщенияИспользование неинвазивных компонентов шкалы Майо для оценки клинического ответа при язвенном колите
Z Amaç: Ülseratif kolit (ÜK) influenatuar bağırsak hastalığı alt tipidir.Anemi, ÜK’de en sık görülen ekstraintestinal bulgudur. Bu çalışmada amaç klinik remisyondaki ÜK hastalarında anemi sıklığı, sebepleri ve ilişkili faktörlerin saptanmasıdır. Gereç ve Yöntem: Bu çalışma kesitsel bir çalışmadır. Ocak-Temmuz 2019 arasında Gastroenteroloji kliniğinde ÜK tanısı ile ayaktan takip edilen ve klinik remisyonda 265 ÜK hastası çalışmaya alınmıştır. Klinik remisyon, parsiyel Mayo skoru <2 olarak kabul edilmiştir. Ülseratif kolit tutulumu Montreal'e göre E1, E2 ve E3 olarak gruplanmıştır.Yeni tanı ÜK, <18 лет, klinik aktivite ve gebe olanlar çalışmadan dışlanmıştır. Demografik, klinik ve labratuvar veriler kaydedilmiştir. Анеми танисы, DSÖ'ye göre; гемоглобин, erkeklerde <13 г / дл, kadınlarda <12 г / дл olarak kabul edilmiştir. ECCO kılavuzuna göre, aktif hastalığı olmayanlarda сывороточный ферритин <30 мкг / л demir eksikliği anemisi (DEA), ферритин> 100 мкг / л трансферрин <% 20 kronik hastalık anemisi (KHA), ферритин DEA 30-100 + мкг / л / folat eksikliği ile MCV> 100 мкл megaloblastik anemi olarak tanımlanmıştır.Anemi olmaksızın serum demir, B12 ve folatın normalin alt sınırı altında olması eksiklik olarak tanımlanmıştır. Bulgular: Hastaların ortalama yaşı 48,2 ± 15,2 yıl, 154’ü (% 58) erkek, ortalama hastalık süresi 11,4 ± 7 yıl, 98’inde (% 37) anemi, 76’sında (% 28,7 ) anemisiz demir, B12 veya folat eksikliği vardı. Hastaların 63’ü (% 23,8) DEA, 4’ü (% 1,5) KHA, 19’u (% 7,2) DEA + megaloblastik anemi, 12’si (% 4,5) DEA + KHA, 67’si (% 25,2) demir eksikliği, 7’si (% 2,6) B12, 2’si (% 0,75) folat eksikliğidir. Anemi olan ve olmayan gruplar arasında cinsiyet, hastalık süresi, tutulum, tedavi, CRP ve albümin düzeyleri arasında anlamlı fark saptandı (p <0,05).Sonuç: Bu çalışma aneminin klinik remisyondaki ÜK hastalarında bile sık olduğunu ve kılavuzlara göre taranması gerekliliğini vurgulamıştır. Анахтар Сезчюклер: воспаление бахирсак хасталыğы, ülseratif kolit, remisyon, anemi РЕЗЮМЕ Цель: Язвенный колит (ЯК) является подтипом воспалительного заболевания кишечника. Анемия - наиболее частая внекишечная находка при ЯК. Цель этого исследования - определить частоту, причины и факторы, связанные с анемией у пациентов с ЯК с клинической ремиссией. Материалы и методы: это перекрестное исследование.Всего было включено 265 пациентов с ЯК, находившихся под наблюдением в гастроэнтерологическом отделении с января по июль 2019 г. Клиническая ремиссия была определена как частичная оценка по шкале Мэйо <2. Язвенный колит
Халамка стремится к глобальному масштабированию цифрового здравоохранения для клиники Мэйо
Клиника Мэйо имеет возможность «определить платформу цифрового здравоохранения для планеты», — утверждает Джон Халамка, доктор медицины, который возглавит усилия по расширению возможностей провайдера во всем мире .
Во вторник клиника Майо объявила, что Халамка, который в последнее время занимал должность исполнительного директора Центра исследований медицинских технологий для Beth Israel Lahey Health, перейдет в Рочестер, штат Миннесота.1 января.
«Как президент Mayo Clinic Platform, я возглавляю портфель компаний, занимающихся новыми цифровыми платформами, нацеленных на преобразование здоровья за счет использования искусственного интеллекта, Интернета вещей и экосистемы партнеров Mayo Clinic, — написал Халамка в своем блоге в среду.
Платформа является инициативой Джанрико Фарруджиа, доктора медицины, нового президента и главного исполнительного директора клиники Мэйо, который является соавтором книги «Думай масштабно, начинай с малого, двигайся быстро: план трансформации» от Центра инноваций клиники Майо , который указывает на необходимость изменения в оказании медицинской помощи.
«Фарруджа работал со всеми заинтересованными сторонами в Mayo, чтобы разработать план на 2030 год, чтобы преобразовать всю передовую организацию в цифровую среду», — сказал Халамка в интервью Health Data Management . «Идея платформы Mayo Clinic Platform состоит в том, чтобы ускорить эту трансформацию за счет содействия сотрудничеству и использования приложений и сервисов, которые работают на этой платформе».
Халамка говорит, что его почти 25 лет в Бостоне, в том числе более 20 лет в качестве главного информационного директора в Медицинском центре Beth Israel Deaconess, «очень хорошо подходят» для руководства платформой клиник Mayo с сотрудниками по всему миру.
«Видение Мэйо состоит в том, чтобы упростить осуществление таких вещей, как домашнее здравоохранение, цифровая диагностика и поддержка принятия клинических решений в очень больших масштабах, — говорит Халамка. «Я смотрю на это как на извлеченные уроки из Бостона и теперь делюсь ими с гораздо более широкой аудиторией».
В своем блоге в среду Халамка сказал, что видит в Mayo Clinic Platform «фабрику инноваций» для сотрудничества, использующего технологии, политики и людей, чтобы радикально сократить время на оценку новых компаний.
«Как консультант многих стартапов, инкубаторов и акселераторов по всему миру, я испытал препятствия и факторы, способствующие инновациям», — пишет Халамка. «Запуск пилотного проекта может занять 6 месяцев только на проработку процессов утверждения. Иногда академическим медицинским центрам может потребоваться до 18 месяцев, чтобы формализовать подтверждение концепции проекта ».
По словам Халамки, цель клиники Мэйо — оказывать высококачественную помощь как можно большему количеству людей, не прибегая к дополнительным помещениям и увеличению штата.
«Если цифровая платформа окажется успешной, когда вы спросите, какой адрес клиники Мэйо, ответ будет в вашем телефоне, в ваших руках», — говорит он. «То есть вы можете получить доступ к необходимой помощи, профессионалам и знаниям в цифровом виде. Некоторые визиты, конечно же, будут личными. Но многое из этого будет доступно виртуально. Здравоохранение в ближайшие 10 лет — это не кирпич и строительный раствор. Речь идет о предоставлении цифровых услуг, которые помогают пациентам там, где они находятся.
Хотя Халамка не приступит к своей новой должности в Мэйо до 1 января, в этом месяце он берет личное время, чтобы добровольно работать волонтером в главном кампусе в Рочестере, чтобы встретиться с «заинтересованными сторонами на всех уровнях организации» и «выслушать их надежды». и потребности для проектов Mayo Clinic Platform ».
Несмотря на то, что будет рассмотрено множество потенциальных проектов, Халамка говорит, что платформа Mayo Clinic Platform изначально будет сосредоточена на трех направлениях: домашнее здравоохранение, расширенная цифровая диагностика и анализ клинических данных.
«Будет еще много проектов, но мы должны подойти к этому со смирением, потому что вы не можете вскипятить океан», — отмечает он. «Здесь много неизвестного, и нам придется начать с пары проектов, посмотреть, что работает, развить их и расширять по мере достижения успеха».
Когда дело доходит до разработки цифровой диагностики на основе данных, генерируемых пациентами с помощью носимых устройств, Халамка отмечает, что «проблема в том, что мы все генерируем эту новую телеметрию, но мы не превращаем эти данные в мудрость.Однако он утверждает, что клиника Мэйо, работая со сторонними сотрудниками, может разработать алгоритмы для обнаружения у пациентов аритмии или риска сердечного приступа.
«Было бы намного лучше использовать всю эту телеметрию, чем просто собирать ее в своем смартфоне в качестве хранилища данных», — добавляет он.
Халамка отмечает, что Google Cloud и Mayo Clinic недавно объявили о партнерстве для улучшения результатов лечения пациентов и внедрения инноваций в области цифрового здравоохранения в глобальном масштабе.Помимо создания своей платформы данных в облаке Google, Mayo вместе с Google создает модели машинного обучения для серьезных и сложных заболеваний, которые в конечном итоге будут переданы медицинским работникам по всему миру для улучшения оказания медицинской помощи.
«Идея партнерства (Google-Mayo) состоит в том, чтобы создать платформу данных, которая в некотором смысле независима от поставщиков», — говорит Халамка. «Epic — это транзакционная система (в Mayo), которая очень богата и содержит много данных. Но вам придется объединить эти данные с данными о социальных детерминантах здоровья, носимых устройствах, географическом местоположении и данных о вспышках болезней в сообществах — множестве различных видов данных.
Халамка говорит, что он думает о платформе как о «независимом от производителя механизме для сбора и интеграции данных новыми способами», добавляя, что «Epic будет очень важной ее частью, но всего лишь ее частью».
В следующем месяце Халамка начнет жить в квартире в Рочестере четыре дня в неделю, путешествуя между Массачусетсом и Миннесотой. «Полеты просты (2,5–3 часа, три раза в день на Jet Blue), и даже с еженедельными поездками на работу я могу лететь меньше в 2020 году, чем в 2019 году (400 000 миль в 40 странах).
На вопрос, почему он решил поехать на работу, а не в Миннесоту, Халамка отвечает, что он не может «бросить своих 250 детей» — ссылка на заповедник Юнити-Фарм в Шерборне, штат Массачусетс, основанный в конце 2016 года им и его жена Кэти, где он продолжит обеспечивать уход и обслуживание в выходные дни спасенных сельскохозяйственных животных.
Amazon.com: ОСВОБОЖДЕНИЕ Мэйо Чики !: Фигурка Канаде Сузуцуки из ПВХ (масштаб 1: 8): игрушки и игры
В настоящее время недоступен.
Мы не знаем, когда и появится ли этот товар в наличии.Марка БЕСПЛАТНО Материал Пластиковый Количество штук 1 - Убедитесь, что это подходит введя номер вашей модели.
- Импорт из FREEing
- Из манги и аниме
- Высота фигуры 5,9 дюйма.
GE Ventures и Mayo Clinic запускают компанию по масштабированию и оцифровке клеточной и генной терапии
Vitruvian Networks для борьбы с раком и другими заболеваниями с помощью передовых программных систем и производственных услуг, которые ускорят доступ пациентов к персонализированным методам лечения
MENLO PARK, CA — 11 апреля 2016 г. — сегодня объявили GE Ventures и Mayo Clinic запуск Vitruvian Networks, Inc., независимая компания-разработчик платформ, стремящаяся ускорить доступ к клеточной и генной терапии с помощью передовых, готовых к облачным технологиям программных систем и производственных услуг.
Клеточная и генная терапия требует затрат времени и ресурсов для предоставления пациентам индивидуального лечения. Требуются эффективные и экономичные решения, чтобы ускорить переход перспективных и потенциально лечебных методов лечения от ранних клинических испытаний к портфелю продуктов, способствующих развитию медицины.
Vitruvian Networks будет сотрудничать с производителями терапевтических средств и обслуживать их, предоставляя современное программное обеспечение и производственную платформу для внедрения «Интернета вещей» в клеточную и генную терапию. В масштабе платформа станет сетевым оркестратором для терапевтических компаний с мощными возможностями бизнес-аналитики и анализа данных.
«Объединение операционных достижений GE с новейшими клеточными и генными методами лечения позволит пациентам проводить более быстрое, эффективное и безопасное лечение», — сказала Сью Сигель, генеральный директор GE Ventures and healthymagination.«Клиника Мэйо — ключевой лидер в области оказания помощи пациентам в онкологии и регенеративной медицине, поэтому для нас большая честь инкубировать это решение в рамках совместного партнерства».
Под руководством экспертов в области биологии и разработки программного обеспечения, Vitruvian Networks сначала сосредоточится на производстве аутологичных клеточных терапий, направленных на борьбу с раком крови. Новая компания также разработает поддерживающие стандарты, инфраструктуру и экосистему, которые будут защищать пациентов и ускорять обнаружение, доставку и регулирование в этой области.
«Аутологические методы лечения в области регенеративной и персонализированной медицины показали большие перспективы в лечении опасных для жизни заболеваний», — говорит Андре Терзич, доктор медицинских наук, директор Центра регенеративной медицины Mayo Clinic. «Мы рады, что Vitruvian Networks будет и дальше стимулировать стандартизацию отрасли, увеличивать масштабируемость и способствовать реализации критического терапевтического потенциала для удовлетворения неудовлетворенных потребностей пациентов во всем мире».
Vitruvian Networks будет использовать данные Mayo Clinic, связанные с биомаркерами, процессами клеточной терапии и клиническими результатами, чтобы направлять дальнейшую разработку индивидуализированных методов лечения.Компания также будет использовать инструменты из подразделения клеточной терапии GE Healthcare в дополнение к инструментам других ведущих партнеров. Vitruvian Networks получит доступ к магазину GE Store — глобальному обмену знаниями, технологиями и инструментами со всей компании — для перепрофилирования аналитических возможностей и совершенствования производственных процессов бизнес-подразделений, таких как GE Healthcare, GE Aviation и GE Power.
«Настроенный характер клеточной и генной терапии показывает большие перспективы для лечения пациентов, но также создает логистические проблемы, которые делают массовое производство уникально сложным», — говорит Киран Мерфи, президент и генеральный директор GE Healthcare Life Sciences.«Многосторонний подход GE к внедрению инноваций в этой отрасли поможет быстрее и эффективнее предлагать клеточную и генную терапию пациентам, которые с нетерпением ждут их».
Штаб-квартира компании находится в районе залива, компанию можно найти в Интернете по адресу http://www.vineti.com (@vinetiworks).
+++
О GE Ventures
GE Ventures выявляет, масштабирует и ускоряет идеи, которые помогут сделать мир лучше. GE Ventures, ориентированная на области программного обеспечения, передового производства, энергетики и здравоохранения, сочетает в себе инвестиции в акционерный капитал, создание нового бизнеса, лицензирование и передачу технологий, чтобы предоставить инновационную платформу, предназначенную для стимулирования роста партнеров и GE.

 ..
.. В исследовании 33% пациентов, получавших упадацитиниб, достигли клинической ремиссии (по адаптированной шкале Мейо) на 8 неделе в сравнении с 4% пациентов, получавших плацебо (p<0,001)1. U-ACCOMPLISH — второе исследований фазы 3 для оценки безопасности и эффективности упадацитиниба у взрослых пациентов с язвенным колитом среднетяжёлой и тяжелой степени1.
В исследовании 33% пациентов, получавших упадацитиниб, достигли клинической ремиссии (по адаптированной шкале Мейо) на 8 неделе в сравнении с 4% пациентов, получавших плацебо (p<0,001)1. U-ACCOMPLISH — второе исследований фазы 3 для оценки безопасности и эффективности упадацитиниба у взрослых пациентов с язвенным колитом среднетяжёлой и тяжелой степени1. – Я обрадован положительными результатами двух исследований применения упадацитиниба при язвенном колите. Они подтверждают, что упадацитиниб может стать потенциально новым вариантом лечения для пациентов, страдающих этим заболеванием».
– Я обрадован положительными результатами двух исследований применения упадацитиниба при язвенном колите. Они подтверждают, что упадацитиниб может стать потенциально новым вариантом лечения для пациентов, страдающих этим заболеванием». 
 Основные результаты исследования U-ACHIEVE были объявлены в феврале 2021 года и на данный момент оба исследования продолжаются. Использование упадацитиниба при язвенном колите не зарегистрировано на данный момент, его безопасность и эффективность не оценивались регуляторными ведомствами.
Основные результаты исследования U-ACHIEVE были объявлены в феврале 2021 года и на данный момент оба исследования продолжаются. Использование упадацитиниба при язвенном колите не зарегистрировано на данный момент, его безопасность и эффективность не оценивались регуляторными ведомствами. Данные исследования включают в себя оценку эффективности, безопасности и переносимости препарата. Ключевые показатели эффективности включают клиническую ремиссию согласно адаптированной шкале Мейо, клинический ответ по адаптированной шкале Мейо, эндоскопическое улучшение и эндоскопический ответ. Более подробную информацию об этих исследованиях можно найти на сайте www.clinicaltrials.gov (NCT03653026, NCT02819635, NCT03006068).
Данные исследования включают в себя оценку эффективности, безопасности и переносимости препарата. Ключевые показатели эффективности включают клиническую ремиссию согласно адаптированной шкале Мейо, клинический ответ по адаптированной шкале Мейо, эндоскопическое улучшение и эндоскопический ответ. Более подробную информацию об этих исследованиях можно найти на сайте www.clinicaltrials.gov (NCT03653026, NCT02819635, NCT03006068). abbvie.com/our-science/therapeutic-focus-areas/immunology/immunology-focus-areas/gastroenterology.html
abbvie.com/our-science/therapeutic-focus-areas/immunology/immunology-focus-areas/gastroenterology.html
 R., et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018 Jun 23;391(10139):2503-2512.
R., et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018 Jun 23;391(10139):2503-2512. ClinicalTrials.gov. 2021. Available at: https://clinicaltrials.gov/ct2/show/NCT03725202. Accessed on February 12, 2021.
ClinicalTrials.gov. 2021. Available at: https://clinicaltrials.gov/ct2/show/NCT03725202. Accessed on February 12, 2021.