Постуральная неустойчивость это: Заболевания экстрапирамидной системы (болезнь Паркинсона и другие)
Дифференциальная диагностика атипичного паркинсонизма* — Центр Экстрапирамидных Заболеваний
Дифференциальная диагностика атипичного паркинсонизма*
О.С.Левин, Н.А.Амосова
Что такое атипичный паркинсонизм?
Атипичный паркинсонизм (АП) – условный термин, применяющийся для обозначения паркинсонического синдрома, отличающегося по своим характеристикам от синдрома, наблюдающегося при болезни Паркинсона (БП). Диагностика БП, являющейся причиной более чем 80% случаев паркинсонизма, в большинстве случаев не вызывает затруднений и может быть основана на клинических данных. Основными позитивными критериями диагноза БП могут служить: односторонние или асимметричные симптомы в дебюте заболевания, наличие типичного тремора покоя, хорошая реакция на препараты леводопы, относительно медленно прогрессирующее течение. К негативным критериям, подтверждающим диагноз БП, относится отсутствие пирамидных, мозжечковых знаков, грубого псевдобульбарного синдрома, раннего развития постуральной неустойчивости, тяжелой вегетативной недостаточности, надъядерной офтальмоплегии и некоторых других симптомов. Соответственно, атипичным паркинсонизмом мы можем назвать акинетико-ригидный синдром, при котором препараты леводопы не оказывают эффекта или оказывают минимальный или краткосрочный эффект, отсутствует тремор покоя, отмечается двустороннее относительно симметричное начало, имеются сопутствующие симптомы, не свойственные БП (см. табл. 1).
Причиной АП может быть целый ряд заболеваний, при которых перечисленные симптомы встречаются в той или иной комбинации. Поэтому АП – условный термин, который обычно используют до того момента, когда с помощью клинического и параклинического обследования, а иногда и длительного наблюдения удастся поставить нозологический диагноз.
В Центре экстрапирамидных заболеваний за последние 2 года наблюдалось 98 больных с АП. В результате обследования клинический диагноз удалось установить более чем у 3/4 из них, у 22 больных он остается неясным (табл.
Таблица 1. Основные клинические черты АП
| Основные группы признаков | Признаки |
| Особенности паркинсонического синдрома | Отсутствие значительного и стойкого эффекта препаратов леводопы Отсутствие тремора покоя Симметричные проявления Быстрое прогрессирование Раннее развитие постуральной неустойчивости и падений |
| Сопутствующие неврологические синдромы | Выраженный постурально-кинетический тремор и миоклония Раннее развитие выраженной вегетативной недостаточности Ограничение подвижности глазных яблок Раннее развитие тяжелых псевдобульбарных симптомов (дизартрия, дисфагия) Пирамидные знаки Аксиальная дистония Раннее развитие деменции; наличие очаговых нарушений корковых функций (апраксия, афазия и др.) |
Таблица 2.
| Заболевания | Процент от общего числа больных |
| Деменция с тельцами Леви | 20 |
| Мультисистемная атрофия | 15 |
| Прогрессирующий надъядерный паралич | 12 |
| Сосудистый паркинсонизм | 11 |
| Лекарственный паркинсонизм | 5 |
| Кортикобазальная дегенерация | 3 |
| Токсический паркинсонизм | 3 |
| Гепатолентикулярная дегенерация | 3 |
| Нормотензивная гидроцефалия | 2 |
| Болезнь Фара | 2 |
| Опухоль мозга | 1 |
| Болезнь Крейтцфельдта–Якоба | 1 |
| Нозологический диагноз неясен | 22 |
| Всего | 100 |
Основной причиной АП являются нейродегенеративные заболевания, которые обычно относят к «паркинсонизму-плюс»: мультисистемная атрофия (МСА), прогрессирующий надъядерный паралич (ПНП), кортикобазальная дегенерация (КБД), болезнь диффузных телец Леви (БДТЛ).
Ограниченность объема статьи заставляет нас остановиться лишь на некоторых неврологических, нейропсихологических и нейровизуализационных признаках, имеющих, по нашему опыту, важное значение в дифференциальной диагностике наиболее частых заболеваний, вызывающих АП.
Стойкая высокая эффективность препаратов леводопы – наиболее надежный признак БП, отмечающийся в 95% случаев. Таким образом, назначение леводопы можно рассматривать как своеобразный фармакологический тест, позволяющий оценить состояние как нигростриарных нейронов, так и, главным образом, стриарных нейронов, несущих дофаминовые рецепторы. Практически всем заболеваниям, бывающим причиной АП, свойственна низкая эффективность препаратов леводопы, однако из этого правила есть исключения. Клинико-патоморфологические исследования показывают, что примерно у 15–20% больных, которым при жизни ставился диагноз БП, патоморфологически выявляется иное заболевание. При этом 2/3 этих больных имели хорошую или очень хорошую реакцию на препараты леводопы. Чаще всего БП ошибочно диагностируется у больных с МСА. При МСА умеренная или хорошая реакция выявляется на ранней стадии у трети больных, но, как правило, в течение 1–2 лет она постепенно истощается и при последующем наблюдении выявляется только у 4–13% больных. При деменции с тельцами Леви (ДТЛ) хорошая реакция на препараты леводопы выявляется более чем в половине случаев, но она также имеет тенденцию к истощению, к тому же нередко оказывается, что при этом заболевании не удается достигнуть эффективной дозы леводопы из-за плохой переносимости, часто из-за развития психотических нарушений или усугубления ортостатической гипотензии. Хорошая, но обычно быстро истощающаяся (в течение нескольких месяцев) реакция на препараты леводопы наблюдается также в отдельных случаях сосудистого паркинсонизма (СП), ПНП, КБД.
Важное диагностическое значение имеет и другой фактор. При длительном лечении препаратами леводопы, обычно через 3–5 лет, у пациентов с БП закономерно возникают моторные флуктуации и дискинезии. При заболеваниях, проявляющихся АП, эти феномены отсутствуют или имеют своеобразный характер. Например, при МСА крайне редко развиваются хореодистонические дискинезии в конечностях, возникающие при БП в связи с приемом леводопы, но нередко на фоне приема препаратов леводопы возникают дискинезии краниоцервикальной локализации. Мы неоднократно наблюдали у больных МСА дистоническую камптокормию (выраженное сгибание туловища кпереди) в связи с применением дофаминергических средств. Следует подчеркнуть, что вывод о неэффективности препарата леводопы может быть сделан лишь после того, как доза леводопы (в составе комбинированного препарата, включающего ингибитор ДОФА-декарбоксилазы) будет доведена до 1500 мг/сут. Если в течение 2 нед. и эта доза окажется неэффективной, то ее следует постепенно снизить до средней (500–750 мг/сут.). Полная отмена препаратов леводопы, даже если они казались неэффективными, нежелательна, так как может привести к ухудшению состояния больного. В первую очередь это относится к больным с МСА. У части больных МСА наблюдается раннее (на 1–2-м году заболевания) развитие моторных флуктуаций.
Симметричность паркинсонических симптомов. У большинства пациентов с БП тремор, акинезия или ригидность первоначально вовлекают только одну конечность или сторону тела (гемипаркинсонизм). При последующем прогрессировании симптомы появляются и с другой стороны, но асимметрия часто сохраняется, и конечности, вовлеченные первыми, оказываются более пораженными. Одностороннее начало и выраженная асимметрия акинезии, ригидность, постурально-кинетический тремор характерны и для КБД. Но для большинства заболеваний, проявляющихся синдромом АП, свойственно двустороннее начало и более выраженная симметричность симптомов. Относительная симметричность паркинсонических симптомов особенно характерна для ПНП, в несколько меньшей степени – для СП. Хотя при МСА и БДТЛ симптомы нередко бывают симметричными, у значительной части больных возможно асимметричное вовлечение конечностей.
Одностороннее начало и выраженная асимметрия акинезии, ригидность, постурально-кинетический тремор характерны и для КБД. Но для большинства заболеваний, проявляющихся синдромом АП, свойственно двустороннее начало и более выраженная симметричность симптомов. Относительная симметричность паркинсонических симптомов особенно характерна для ПНП, в несколько меньшей степени – для СП. Хотя при МСА и БДТЛ симптомы нередко бывают симметричными, у значительной части больных возможно асимметричное вовлечение конечностей.
Распределение паркинсонических симптомов. При БП в первую очередь чаще всего вовлекаются дистальные отделы конечностей. При ПНП и СП акинезия и ригидность более выражены в аксиальных отделах (голова, шея, туловище) и проксимальных отделах конечностей, тогда как в дистальных отделах признаки гипокинезии могут отсутствовать, а мышечный тонус бывает нормальным, а иногда и низким. По отношению к этому признаку МСА и ДТЛ занимают промежуточное положение: у некоторых больных доминируют аксиальные симптомы, у других аксиальные и дистальные симптомы бывают выражены в одинаковой степени.
Постуральные нарушения и изменения ходьбы. Для большинства заболеваний, проявляющихся синдромом АП, характерно гораздо более быстрое, чем при БП, развитие постуральной неустойчивости, которая нередко превращается в основной инвалидизирующий фактор, резко затрудняющий ходьбу и часто приводящий к падениям и травмам. Особенно быстро нарастает постуральная неустойчивость при ПНП, СП и нормотензивной гидроцефалии. Для проверки постуральной устойчивости врач становится за спиной больного и быстрым толчком кзади выводит его из равновесия. При неэффективности постуральных рефлексов у больного возникает ретропульсия либо он может упасть как «подпиленное дерево», даже не предпринимая попыток удержаться на ногах.
Важное дифференциально-диагностическое значение имеет и оценка ходьбы. У больных с СП, МСА, БДТЛ, КБД чаще развиваются нарушения ходьбы по типу лобной дисбазии (апраксии ходьбы). Для лобной дисбазии характерны замедленное начало ходьбы, походка мелкими шаркающими шажками, затруднения при поворотах и преодолении даже небольших препятствий, часто с застыванием и топтанием. Но в отличие от БП площадь опоры при ходьбе не уменьшается, менее выражены сгибательная поза и ахейрокинез (следует оговорить, что у некоторых больных с МСА и БДТЛ походка такая же, как и при БП, а у больных с поздней стадией БП нарушение ходьбы может приобретать черты лобной дисбазии).
Для лобной дисбазии характерны замедленное начало ходьбы, походка мелкими шаркающими шажками, затруднения при поворотах и преодолении даже небольших препятствий, часто с застыванием и топтанием. Но в отличие от БП площадь опоры при ходьбе не уменьшается, менее выражены сгибательная поза и ахейрокинез (следует оговорить, что у некоторых больных с МСА и БДТЛ походка такая же, как и при БП, а у больных с поздней стадией БП нарушение ходьбы может приобретать черты лобной дисбазии).
У части больных с ПНП походка также меняется по типу лобной дисбазии, но в целом для этого заболевания более характерны изменения ходьбы по типу подкорковой астазии. На ранней стадии у таких больных не отмечается затруднений инициации ходьбы, уменьшения длины шага и площади опоры, снижения скорости ходьбы, как при БП. Затруднения больного скорее связаны с тем, что он не в состоянии правильно скоординировать движения туловища и нижних конечностей таким образом, чтобы не происходило резких смещений центра тяжести тела относительно площади его опоры. Голова и туловище больных нередко бывают отклонены кзади. Из-за размашистых шагов ноги время от времени опережают «задержавшееся» туловище, и больной может неожиданно упасть на спину, даже не предпринимая попыток удержать равновесие. Падения при ПНП могут происходить в любом направлении, но чаще больной валится на спину (при БП и МСА больные чаще падают вперед). При МСА ноги у некоторых больных бывают широко расставленными, а ходьба имеет более отчетливый атактический характер.
Пирамидные знаки исключают БП, но нередко отмечаются при различных заболеваниях, проявляющихся АП, чаще всего при СП и МСА. Следует, однако, отметить, что интерпретировать оживление сухожильных рефлексов в отсутствие патологических стопных знаков, расширения рефлексогенных зон или клонуса стоп как проявление пирамидной недостаточности следует с осторожностью. Поводом для ошибочной диагностики пирамидной недостаточности у больных с экстрапирамидной патологией нередко является особый вариант дистонии стопы («стриарная стопа»), для которой характерна разгибательная установка большого пальца. В отличие от рефлекса Бабинского, разгибание большого пальца в этом случае представляет собой не фазический, а тонический феномен, часто возникающий спонтанно или провоцирующийся ходьбой и другими движениями. Штриховое раздражение подошвы при «стриарной стопе» вызывает нормальную сгибательную реакцию стопы (обычно ее легче вызвать, если придать ноге положение легкой флексии).
В отличие от рефлекса Бабинского, разгибание большого пальца в этом случае представляет собой не фазический, а тонический феномен, часто возникающий спонтанно или провоцирующийся ходьбой и другими движениями. Штриховое раздражение подошвы при «стриарной стопе» вызывает нормальную сгибательную реакцию стопы (обычно ее легче вызвать, если придать ноге положение легкой флексии).
Глазодвигательные нарушения. Подробное исследование глазодвигательных функций – обязательная часть осмотра у больных с АП, особенно важная для диагностики ПНП. Для этого заболевания характерно ограничение амплитуды содружественных движений глаз (паралич взора) вниз, но в значительной части случаев оно развивается лишь спустя 2–3 года от начала болезни. Но еще до развития паралича взора у большинства больных с ПНП выявляются более легкие глазодвигательные нарушения: замедление и гипометрия вертикальных саккадических движений и нарушение плавности вертикальных следящих движений (особенно направленных вниз), а также нарушение подавления вестибулоокулярного рефлекса и отсутствие или замедление быстрой фазы оптико-кинетического нистагма в вертикальной плоскости.
Для проверки произвольных саккадических движений врач просит больного быстро переводить взгляд с одной точки на другую в пределах поля зрения (например, с одного пальца врача на другой, при этом пальцы обычно разводят на 1 м и помещают на расстоянии 60 см от уровня глаз больного). Уже на ранней стадии ПНП нередко можно отметить, что вертикальные саккады оказываются диспропорционально более медленными, чем горизонтальные, а из-за гипометрии вертикальных саккад для того, чтобы перевести взор с одной точки на другую, глаза совершают одно или несколько дополнительных движений. Неспособность подавить вестибулоокулярный рефлекс можно проверить, приставив ко лбу больного молоток и попросив его фиксировать взгляд на рукоятке молотка: при повороте головы взгляд больного будет время от времени отставать от мишени, а затем догонять ее быстрым скачком. Оптико-кинетический нистагм проверяют, вращая перед глазами больного барабан с чередующимися черными и белыми полосами. У некоторых больных с ПНП, часто уже на ранней стадии, нарушается фиксация взора: если попросить больного остановить взгляд на удаленной точке, то можно заметить внезапные очень быстрые скачкообразные подергивания глазных яблок от точки фиксации и обратно, обычно в пределах 1–5° (дисфиксационные саккады). Для КБД характерен длительный латентный период саккадических движений в горизонтальной плоскости.
Оптико-кинетический нистагм проверяют, вращая перед глазами больного барабан с чередующимися черными и белыми полосами. У некоторых больных с ПНП, часто уже на ранней стадии, нарушается фиксация взора: если попросить больного остановить взгляд на удаленной точке, то можно заметить внезапные очень быстрые скачкообразные подергивания глазных яблок от точки фиксации и обратно, обычно в пределах 1–5° (дисфиксационные саккады). Для КБД характерен длительный латентный период саккадических движений в горизонтальной плоскости.
Умеренные глазодвигательные нарушения, в том числе дисфиксационные саккады, возможны и при других заболеваниях, проявляющихся синдромом паркинсонизма (табл. 3). Важно предостеречь от диагностики ПНП только на основании выявления у больного с паркинсонизмом пареза взора вверх: это неспецифический признак, который может наблюдаться практически при любом варианте АП.
Кроме того, следует отметить, что и парез взора вниз может наблюдаться не только при ПНП, но также при КБД и БДТЛ. Характерной чертой ПНП являются исключительная редкость мигания, нередко парадоксально сочетающаяся с резким оживлением надбровного рефлекса. Иногда больные с ПНП испытывают затруднения при произвольном открывании, реже закрывании глаз (апраксия открывания или закрывания глаз). Изредка аналогичные расстройства наблюдаются при КБД. Хотя блефароспазм чаще встречается при ПНП, его дифференциально-диагностическое значение невелико, так как он возможен при БП и других формах АП.
Псевдобульбарный синдром. Раннее развитие псевдобульбарных проявлений, особенно дизартрии и дисфагии, в большей степени характерно
Таблица 3. Сравнительная частота различных форм глазодвигательных нарушений при заболеваниях, проявляющихся синдромом паркинсонизма
| Тип нарушения | БП | МСА | ПНП | КБД | БДТЛ |
| Парез взора | |||||
| вертикального | |||||
| – вверх | + | + | +++ | ++ | ++ |
| – вниз | – | – | +++ | + | + |
| горизонтального | – | ++ | ++ | ++ | – |
| Нарушение плавности следящих движений | + | ++ | +++ | ++ | + |
| Гипометрия саккад | + | ++ | ++ | ++ | + |
| Замедление саккад | + | ++ | +++ | ++ | + |
| Гиперметрия глазных яблок | – | + | – | – | – |
| Дисфиксационные саккады | – | +++ | +++ | ++ | + |
| Отсутствие феномена Белла | – | – | +++ | ++ | – |
| Нистагм | – | ++ | + | – | – |
| Апраксия открывания/закрывания глаз | – | – | +++ | ++ | – |
для ПНП, СП, МСА. В отличие от БП, при которой дизартрия в основном вызвана гипокинезией и характеризуется монотонной приглушенной речью, при ПНП и СП доминирует спастический компонент дизартрии, проявляющийся охриплостью и огрубением голоса, замедленной, растянутой, смазанной речью, прерываемой частыми паузами. При МСА спастический компонент выражен меньше и в части случаев преобладает атактическая скандированная речь. У части больных с МСА развивается паралич мышц гортани, вызывающий инспираторный стридор и своеобразную дисфонию. Особенности дрожательного гиперкинеза. У 85% пациентов с БП выявляется характерный тремор покоя по типу «скатывания пилюль», который обычно бывает асимметричным и иногда сопровождается умеренным постурально-кинетическим тремором. При СП тремор покоя выявляется только в единичных случаях, связанных с поражением среднего мозга. Тремор покоя не характерен и для ПНП (только у 5% пациентов с этим заболеванием наблюдается минимальный тремор покоя). Чаще тремор покоя встречается при МСА и БДТЛ, но при этом у большинства больных с МСА и половины больных с БДТЛ он отсутствует. При СП, ПНП, БДТЛ нередко встречается умеренный постурально-кинетический тремор. Грубый постурально-кинетический тремор с интенционным компонентом, на который иногда наслаиваются акционные миоклонические подергивания, наблюдается при КБД и иногда при МСА. При МСА этот тремор обычно бывает двусторонним, при КБД – односторонним или резко асимметричным.
В отличие от БП, при которой дизартрия в основном вызвана гипокинезией и характеризуется монотонной приглушенной речью, при ПНП и СП доминирует спастический компонент дизартрии, проявляющийся охриплостью и огрубением голоса, замедленной, растянутой, смазанной речью, прерываемой частыми паузами. При МСА спастический компонент выражен меньше и в части случаев преобладает атактическая скандированная речь. У части больных с МСА развивается паралич мышц гортани, вызывающий инспираторный стридор и своеобразную дисфонию. Особенности дрожательного гиперкинеза. У 85% пациентов с БП выявляется характерный тремор покоя по типу «скатывания пилюль», который обычно бывает асимметричным и иногда сопровождается умеренным постурально-кинетическим тремором. При СП тремор покоя выявляется только в единичных случаях, связанных с поражением среднего мозга. Тремор покоя не характерен и для ПНП (только у 5% пациентов с этим заболеванием наблюдается минимальный тремор покоя). Чаще тремор покоя встречается при МСА и БДТЛ, но при этом у большинства больных с МСА и половины больных с БДТЛ он отсутствует. При СП, ПНП, БДТЛ нередко встречается умеренный постурально-кинетический тремор. Грубый постурально-кинетический тремор с интенционным компонентом, на который иногда наслаиваются акционные миоклонические подергивания, наблюдается при КБД и иногда при МСА. При МСА этот тремор обычно бывает двусторонним, при КБД – односторонним или резко асимметричным.
Другие экстрапирамидные синдромы. При БП возможно развитие дистонии (чаще всего дистонии стопы, усиливающейся при ходьбе), но в большинстве случаев дискинезии бывают связаны с применением леводопы. При АП наблюдается более широкий спектр других экстрапирамидных синдромов. Особенно часто встречается аксиальная дистония: при ПНП – ретроколлис и блефароспазм, при МСА – антероколлис. Дистония конечностей часто наблюдается при КБД, а при ПНП она бывает практически единственным асимметричным проявлением заболевания. У части больных с МСА, КБД, БДТЛ наблюдается акционная миоклония.
У части больных с МСА, КБД, БДТЛ наблюдается акционная миоклония.
Вегетативная дисфункция. Выраженные признаки вегетативной недостаточности: ортостатическая гипотензия с частыми предобморочными состояниями или обмороками, гипертензия в положении лежа, гипотензия после еды, фиксированный пульс, импотенция, учащенное или затрудненное мочеиспускание, нарушение моторики желудочно-кишечного тракта или расстройства потоотделения и т.д. – особенно характерны для МСА, но могут также наблюдаться при БП, БДТЛ, ПНП. Важное диагностическое значение имеет время появления симптомов; например, при МСА клинически явная вегетативная недостаточность часто выявляется в первые 1–3 года болезни, тогда как при БП – спустя 5 лет от момента появления первых симптомов. При КБД признаки вегетативной недостаточности обычно отсутствуют.
Особенности течения заболевания. Для большинства заболеваний, вызывающих АП, характерно более быстрое прогрессирование, чем при БП. Более того, если через 6–8 лет после начала заболевания больной сохраняет способность к самостоятельному передвижению, то это свидетельствует против диагноза ПНП или МСА. Для нейродегенеративных заболеваний (ПНП, МСА, КБД) характерны постепенное начало и неуклонно прогрессирующее течение. Отличительными особенностями СП являются острое или подострое начало, ступенеобразное прогрессирование с периодами частичного регресса и длительной стабилизации.
Особенности нейропсихологических нарушений. Нейропсихологическое обследование является весьма информативным дополнением неврологического осмотра, так как позволяет лучше оценить топику и распространенность патологического процесса. При МСА, как и в большинстве случаев БП, когнитивные нарушения не достигают степени деменции и связаны с дисфункцией подкорково-лобных кругов. Они проявляются замедленностью мышления (брадифренией), нарушением внимания, снижением мотивации, трудностями в инициации, планировании и организации интеллектуальной деятельности с вторичной дефектностью мнестических процессов. При ПНП подкорково-лобный когнитивный дефект гораздо более выражен и достигает степени деменции, сопровождаясь выраженным изменением поведения по лобному типу (апатико-абулическим синдромом, расторможенностью, импульсивностью). Развитие деменции при ПНП может быть связано с массивной деафферентацией лобной коры, а на поздних этапах, возможно, с непосредственным поражением коры. При БДТЛ, как и у части пациентов с БП, развивается деменция смешанного подкорковокоркового типа, для которой характерна комбинация подкорково-лобного нейропсихологического дефекта с признаками вовлечения височно-теменной коры (грубым первичным нарушением памяти, афазией, апраксией, пространственной дезориентацией и т.д.). В отличие от БП с деменцией, при БДТЛ деменция развивается более быстро (в первые 1–2 года заболевания), сопровождается выраженными флуктуациями с развитием эпизодов инактивности или спутанности, продолжающихся от нескольких часов до нескольких суток, и ранним развитием психотических нарушений (зрительных галлюцинаций, параноидного синдрома). Ключевую роль играет нейропсихологическое исследование и в диагностике КБД, при которой оно выявляет, наряду с подкорково-лобным дефектом, признаки поражения лобной и теменной коры (чаще всего апраксию, афазию и игнорирование половины пространства).
При ПНП подкорково-лобный когнитивный дефект гораздо более выражен и достигает степени деменции, сопровождаясь выраженным изменением поведения по лобному типу (апатико-абулическим синдромом, расторможенностью, импульсивностью). Развитие деменции при ПНП может быть связано с массивной деафферентацией лобной коры, а на поздних этапах, возможно, с непосредственным поражением коры. При БДТЛ, как и у части пациентов с БП, развивается деменция смешанного подкорковокоркового типа, для которой характерна комбинация подкорково-лобного нейропсихологического дефекта с признаками вовлечения височно-теменной коры (грубым первичным нарушением памяти, афазией, апраксией, пространственной дезориентацией и т.д.). В отличие от БП с деменцией, при БДТЛ деменция развивается более быстро (в первые 1–2 года заболевания), сопровождается выраженными флуктуациями с развитием эпизодов инактивности или спутанности, продолжающихся от нескольких часов до нескольких суток, и ранним развитием психотических нарушений (зрительных галлюцинаций, параноидного синдрома). Ключевую роль играет нейропсихологическое исследование и в диагностике КБД, при которой оно выявляет, наряду с подкорково-лобным дефектом, признаки поражения лобной и теменной коры (чаще всего апраксию, афазию и игнорирование половины пространства).
Компьютерная томография (КТ) и особенно магнитно-резонансная томография (МРТ) имеют особенно важное значение в диагностике сосудистого и других форм вторичного паркинсонизма. В диагностике нейродегенеративных заболеваний роль нейровизуализации гораздо более ограниченна и сводится прежде всего к исключению структурной патологии мозга (опухоли, гидроцефалии, сосудистых поражений). В то же время МРТ может выявлять и некоторые позитивные признаки нейродегенеративных заболеваний, диагностический вес которых, однако, до настоящего времени мало изучен. Например, у части больных с МСА МРТ выявляет снижение интенсивности сигнала от скорлупы, связанное с накоплением железа (на Т2-взвешенных изображениях). Однако этот же признак может выявляться и у больных с ПНП. Более специфичны для МСА щелевидная гиперинтенсивная (в Т2-режиме) зона по наружному краю скорлупы и атрофия скорлупы. Кроме того, при этом заболевании нередко встречаются также атрофия моста и мозжечка, но этот признак иногда выявляется и при ПНП и КБД. Атрофия среднего мозга особенно характерна для ПНП, но возможна также при МСА и КБД. Важно учитывать, что при ПНП МРТ или КТ нередко выявляют лакунарные очаги в веществе мозга, в том числе и в базальных ганглиях, связанные с артериальной гипертензией, которая может развиваться в результате дегенерации стволовых вегетативных структур. Выявление таких очагов может быть причиной ошибочной диагностики СП у больных с ПНП. Чтобы избежать этой ошибки, нужно оценивать весь комплекс нейровизуализационных изменений и всегда соотносить их с клиническими проявлениями.
Однако этот же признак может выявляться и у больных с ПНП. Более специфичны для МСА щелевидная гиперинтенсивная (в Т2-режиме) зона по наружному краю скорлупы и атрофия скорлупы. Кроме того, при этом заболевании нередко встречаются также атрофия моста и мозжечка, но этот признак иногда выявляется и при ПНП и КБД. Атрофия среднего мозга особенно характерна для ПНП, но возможна также при МСА и КБД. Важно учитывать, что при ПНП МРТ или КТ нередко выявляют лакунарные очаги в веществе мозга, в том числе и в базальных ганглиях, связанные с артериальной гипертензией, которая может развиваться в результате дегенерации стволовых вегетативных структур. Выявление таких очагов может быть причиной ошибочной диагностики СП у больных с ПНП. Чтобы избежать этой ошибки, нужно оценивать весь комплекс нейровизуализационных изменений и всегда соотносить их с клиническими проявлениями.
Некоторое диагностическое значение имеет и региональное распределение наружной атрофии, выражающейся в расширении корковых борозд. Выраженная наружная атрофия мозга, преимущественно в лобных и височных отделах, чаще всего встречается при БДТЛ, но возможна при ПНП и БП. При КБД МРТ может выявлять асимметричную атрофию, преимущественно вовлекающую лобную и теменную кору полушария, контралатерального наиболее пораженной руке. У большинства больных с МСА величина корковых борозд и желудочковой системы соответствует возрастной норме.
Таблица 4. Основные диагностические признаки заболеваний, являющихся причиной АП
| Болезни | Обязательные признаки | Признаки, свидетельствующие в пользу диагноза | Признаки, свидетельствующие против диагноза |
| ПНП | Акинезия и ригидность в аксиальных отделах, выраженная постуральная неустойчивость с частыми падениями, парез вертикального взора | Выраженный псевдобульбарный синдром, ретроколлис, подкорковая астазия, деменция подкорково-лобного типа. Атрофия среднего мозга при Атрофия среднего мозга приМРТ | Высокая эффективность препаратов леводопы, длительное доброкачественное течение (возможность самостоятельного передвижения через 5 лет), асимметрия клинических проявлений, корковые черты деменции, корковые нарушения чувствительности, галлюцинации |
| МСА | Акинезия, ригидность (паркинсоническая) или мозжечковая атаксия с рано развивающейся вегетативной недостаточностью | Резистентность к препаратам леводопы, пирамидные знаки, антероколлис, псевдобульбарные нарушения, парез мышц гортани, лицевая дискинезия при применении леводопы, ранние моторные флуктуации, миоклония. Изменения интенсивности сигнала от скорлупы, атрофия моста и мозжечка при МРТ | Стойкая высокая эффективность препаратов леводопы; длительное доброкачественное течение; деменция, спутанность сознания и галлюцинации, связанные с приемом противопаркинсонических средств |
| БДТЛ | Акинезия, ригидность, деменция | Флуктуации психического статуса, психотические нарушения, вегетативная недостаточность. Атрофия лобных и височных долей при МРТ. Вспышки медленных волн в лобной области при ЭЭГ | Отсутствие деменции в первые 2 года заболевания, отсутствие признаков корковой деменции |
| КБД | Асимметричные акинезия, ригидность, дистония; очаговые нарушения высших корковых функций (апраксия, афазия, игнорирование половины пространства) | Феномен «чужой» руки, астерео гноз, грубые асимметричные постурально-кинетический тремор и миоклония. Асимметричная атрофия лобной и теменной коры при МРТ | Раннее развитие деменции, высокая эффективность леводопы |
| Болезни | Обязательные признаки | Признаки, свидетельствующие в пользу диагноза | Признаки, свидетельствующие против диагноза |
| СП | Акинезия, ригидность, признаки цереброваскулярного заболевания | Подострое начало, ступенеобразное прогрессирование с периодами регресса и длительной стабилизации, низкая эффективность леводопы, паркинсонические признаки преимущественно в аксиальных отделах и нижних конечностях, раннее развитие постуральной неустойчивости и тазовых нарушений, лобная дисбазия, выраженный псевдобульбарный синдром. Обширный лейкоареоз или двусторонние подкорковые инфаркты в скорлупе и бледном шаре при МРТ Обширный лейкоареоз или двусторонние подкорковые инфаркты в скорлупе и бледном шаре при МРТ | Высокая стойкая эффективность препаратов леводопы, отсутствие очаговых или диффузных изменений при МРТ предположительно сосудистого характера |
ПНП – прогрессирующий надъядерный паралич, МСА – мультисистемная атрофия, БДТЛ – болезнь диффузных телец Леви, СП – сосудистый паркинсонизм, КБД – кортикобазальная дегенерация.
В заключение следует отметить, что клинические признаки заболеваний, вызывающих синдром АП, в значительной степени перекрываются в связи с тем, что в патологический процесс при различных процессах вовлекаются одни и те же структуры. В то же время особенности пространственно-временны́ х характеристик того или иного патологического процесса, выражающиеся в относительно специфической констелляции поражаемых структур (систем) или, что, быть может, еще более важно, в определенной последовательности их вовлечения, предопределяют клиническое своеобразие каждого из заболеваний и создают возможность установления у больных с АП нозологического диагноза. Наш опыт показывает, что в большинстве случаев АП диагноз может быть установлен при учете всего комплекса неврологических, нейропсихологических и нейровизуализационных признаков, в котором находит отражение патофизиологическая логика процесса, специфичная у каждого из рассмотренных заболеваний. Основные дифференциально-диагностические признаки заболеваний, вызывающих АП, суммированы в таблице 4. Важно подчеркнуть, что клинический диагноз заболевания, вызывающего АП, нередко носит вероятностный характер и может быть пересмотрен при последующем наблюдении в связи с появлением новых признаков.
* Диагностика и лечение экстрапирамидных расстройств / Под ред. В.Н.Штока. – М., 2000. – С. 71–83.
Болезнь Паркинсона | Для врачей
Определение
Болезнь Паркинсона — хроническое прогрессирующее дегенеративное заболевание центральной нервной системы, клинически проявляющееся нарушением произвольных движений.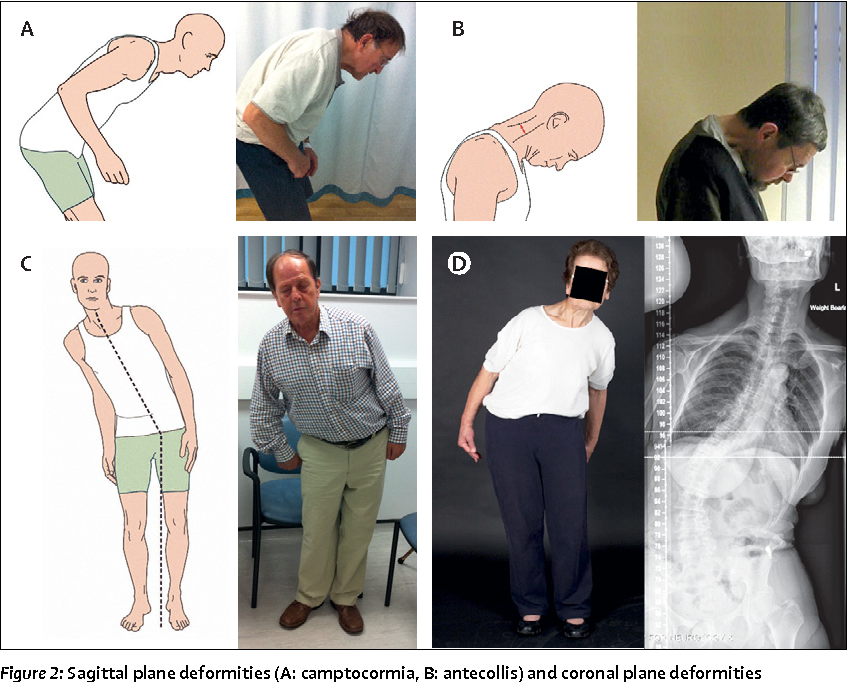
Болезнь Паркинсона относится к первичному, или идиопатическому, паркинсонизму. Различают также вторичный паркинсонизм, который может быть обусловлен различными причинами, например энцефалитом, избыточным приемом лекарственных препаратов, атеросклерозом сосудов головного мозга. Понятие «паркинсонизм» применяется к любому синдрому, при котором наблюдаются характерные для Болезнь Паркинсона неврологические нарушения.
Исторические аспекты
Болезнь Паркинсона впервые описал английский врач Джеймс Паркинсон в 1817 году в своем «Эссе о дрожательном параличе», в котором обобщил результаты наблюдений за шестью пациентами.
Дж. Паркинсон описывал это заболевание как «дрожательный паралич» со следующими характерными проявлениями: «непроизвольные дрожательные движения, ослабление мышечной силы, ограничение активности движений, туловище больного наклонено вперед, ходьба переходит в бег, при этом чувствительность и интеллект больного остаются сохранными.
С тех пор Болезнь Паркинсона была детально изучена, конкретизированы все её симптомы, однако портрет заболевания, составленный Дж. Паркинсоном, остается по-прежнему точным и емким.
Течение заболевания
Как правило, Болезнь Паркинсона имеет медленное течение, так что на ранних стадиях заболевание может не диагностироваться в течение ряда лет. Для характеристики стадий Болезнь Паркинсона используется ряд шкал, в том числе Оценочная Шкала Хёна и Яра (Hoehn and Yahr Rating Scale) и Унифицированная Оценочная Шкала Болезни Паркинсона (Unified Parkinson’s Disease Rating Scale). Некоторые шкалы тестируют уровень дневной активности и адаптации больного (Activity of Daily Living Scale).
Движения
В осознанном контроле за произвольными движениями принимает участие кора лобных долей головного мозга, откуда нервные импульсы передаются в конечности. Роль посредников в передаче импульсов между нейронами и синапсами играют химические нейротранс-миттеры, важнейшим из которых является ацетилхолин.
В акте произвольного движения участвует и ПИРАМИДНАЯ СИСТЕМА
Однако важным для целостного процесса движения является контроль не только за произвольными, но и за непроизвольными движениями. Эту функцию выполняет ЭКСТРАПИРАМИДНАЯ СИСТЕМА, обеспечивающая плавность движений и возможность прервать начатое действие. Эта система объединяет структуры — базальные ганглии, располагающиеся за пределами продолговатого мозга (отсюда термин «экстрапирамидная система». Нейротрансмиттер, обеспечивающий бессознательный контроль за движениями, получил название «дофамин». В основе Болезнь Паркинсона лежит дегенерация дофаминергических нейронов — нейронов, вырабатывающих и накапливающих дофамин.
Нарушение функции дофаминергических нейронов приводит к дисбалансу тормозных (дофаминовых) и возбуждающих (ацетилхолиновых) нейротрансмиттеров, что клинически проявляется симптомами Болезнь Паркинсона.
Лечение Болезнь Паркинсона, целью которого является восстановление нарушенного баланса нейротрансмиттеров, может быть направлено либо на повышение уровня дофамина в мозге, либо на снижение уровня ацетилхолина.
Рис. 1. Базальные ганглии.
Анатомия
Базальные ганглии (рис.1) объединяют следующие структуры: хвостатое ядро, скорлупу (вместе — полосатое тело), бледный шар и черную субстанцию Базальные ганглии получают импульсацию от лобной коры, ответственной за контроль произвольных движений, и опосредуют обратный непроизвольный контроль за движениями через премоторную кору и таламус.
Болезнь Паркинсона возникает вследствие дегенерации дофаминергических нейронов черной субстанции.
Дофамин вырабатывается и накапливается в пузырьках (везикулах) пресинаптического нейрона и затем под воздействием нервного импульса высвобождается в синаптическую щель. В синаптической щели он связывается с дофаминовыми рецепторами, располагающимися в постсинаптической мембране нейрона, в результате чего обеспечивается дальнейшее прохождение нервного импульса через постсинаптический нейрон.
Рис. 2. Схема нейротрансмиттерной передачи
Болезнь Паркинсона
Это хроническое неврологическое заболевание, вызванное прогрессирующим разрушением нейронов черного вещества среднего мозга и других отделов центральной нервной системы, использующих дофамин в качестве медиатора. Как правило этому подвержены люди, старше 50 лет.
Для болезни Паркинсона характерны двигательные нарушения (тремор, мышечная ригидность, гипокинезия, постуральная неустойчивость), вегетативные и психические расстройства.
Тремор (дрожание). Характерно появление тремор в покое, иногда бывает интенционный тремор (дрожание при выполнении движений, которое усиливается при необходимости совершить точное движение), постуральный тремор (возникает при необходимости удержать конечность против силы тяжести). Часто бывает дрожание головы по типу кивательных движений, нижней челюсти, языка, век. Тремор исчезает во время сна и усиливается при волнении, психо-эмоциональном перенапряжении.
Гипокинезия проявляется снижением произвольной двигательной активности. Активные движения замедлены (брадикинезия), возникают после некоторого промедления. Пациент ходит мелкими шагами, лицо маскообразное (амимия), редко моргает, речь монотонна, почерк становится мелким.
Мышечная ригидность — равномерно повышается тонус мышц таким образом, что формируется характерная поза (голова наклонена вперед, больной сутулится, ноги и руки полусогнуты, руки прижаты к туловищу).
Постуральная неустойчивость — пациенту сложно начать движение и сложно остановиться, если движение уже начато. При движениях туловище опережает ноги, в результате этого пациент может потерять устойчивость и упасть.
Вегетативные расстройства — часто страдает обмен веществ, может развиться истощение, или же наоборот ожирение, появляется сальность кожи, потливость, повышенное слюноотделение.
Психические расстройства — развиваются депрессии, расстройства сна, патологическая утомляемость. Пациенты часто бывают безынициативны. В тяжелых случаях возникает психоз — бессонница, чувство страха, психомоторное возбуждение, нарушается ориентировка в пространстве, возможны галлюцинации.
Болезнь Паркинсона занимает около 80% в спектре причин паркинсонизма — комплекса симптомов, описанных выше. К остальным причинам относят вторичный паркинсонизм, когда известна ситуация, вызвавшая данный симптомокомплекс. К таким видам паркинсонизма относят лекарственный, сосудистый, токсический, метаболический, гидроцефалический, паранеопластический, опухолевый и постэнцефалический и другие виды.
Также синдром паркинсонизма является основным при синдроме Шая-Драйжера, синдроме Стила-Ричардсона, стриато-нигральной дегенерации, кортико-базальной дегенерации, и других, в том числе наследственно обусловленных дегенерациях.
Существует достаточно широкий спектр средств и методов для терапии болезни Паркинсона при правильном и своевременном подборе которых удаётся добиться существенного уменьшения симптомов, замедления развития заболевания и повышения качества жизни.
батарея нейропсихологических тестов на болезнь Паркинсона (CAB-PK) онлайн. Когнитивный тест на болезнь Паркинсона.
Когда рекомендуется использовать данный тест на болезнь Паркинсона?
С помощью этой батареи тестов можно с высокой надёжностью обнаружить риск присутствия симптомов и когнитивных нарушений, связанных с болезнью Паркинсона, у молодёжи, взрослых и пожилых людей.
Рекомендуется как можно раньше пройти этот тест, если у пожилого человека есть подозрение на болезнь Паркинсона или связанное с ней когнитивное расстройство. Раннее обнаружение позволит начать лечение и подобрать подходящую программу когнитивной стимуляции, которая поможет поддержать нарушенные болезнью Паркинсона способности на функциональном уровне.
Эта батарея нейропсихологических тестов также позволяет выявить риск раннего паркинсонизма и связанные с ним когнитивные расстройства у более молодых людей. Хотя считается, что ранний паркинсонизм (диагностированный в возрасте до 49 лет) встречается только у 10% страдающих болезнью Паркинсона, необходимо иметь ввиду, что им болеют тысячи молодых людей. Возможно, в этом возрасте когнитивные и функциональные расстройства не столь очевидны, но лучше всего для минимизации нарушений как можно раньше начать стимуляцию когнитивных способностей.
Если заболевание не было обнаружено вовремя и не были приняты необходимые меры, это может привести к трудностям в повседневной жизни, на работе, в социальной, семейной и эмоциональной сферах.
Таким образом, для этого заболевания характерен не только тремор в состоянии покоя, но и различные когнитивные нарушения: проблемы с памятью и вниманием, зрительно-пространственные изменения, замедленная скорость обработки информации, дерегуляторный синдром и нарушения речи. Болезнь Паркинсона также связана с проблемами в рабочей, социальной и функциональной сферах. Главным образом, можно выделить:
Постуральные нарушения при болезни Паркинсона (клинико-стабилометрический анализ)
1. Артемьев Д.В., Обухова В.А. Агонист дофаминовых рецепторов проноран в лечении ранних и развернутых стадий болезни Паркинсона // Неврол. журнал. 2002. — № 5. — С. 43-46.
2. Артемьев Д.В., Яхно Н.Н. Паркинсонизм // В кн.: Нейродегенеративные болезни и старение / под ред. Завалишина И.А., Яхно Н.Н., Гавриловой С.И.-М.: AAA, 2001. -С.80-137.
3. Вейн A.M., Голубев B.JI., Берзиныи Ю.Э. Паркинсонизм: клиника, этиология, патогенез, лечение. Рига: Зинатне, 1981.
4. Голубев B.JI., Левин Я.И., A.M.Вейн. Болезнь Паркинсона и синдром паркинсонизма. М.: Медпресс, 1999.
5. Гурфинкель В. С., Коц Я.М., Шик M.JI. Регуляция позы человека. М.: Наука.- 1965.
6. Дамулин И.В., Жученко Т.Д., Левин О. С. Нарушения равновесия и походки у пожилых // В сб.: Достижения нейрогериатрии. Т.1 / под ред. Яхно Н.Н., Дамулина И.В. М.: ММА. — 1995. — С. 71-97.
С. Нарушения равновесия и походки у пожилых // В сб.: Достижения нейрогериатрии. Т.1 / под ред. Яхно Н.Н., Дамулина И.В. М.: ММА. — 1995. — С. 71-97.
7. Жученко Т.Д. Нарушения равновесия у больных пожилого возраста с хронической сосудистой мозговой недостаточностью (клинико-стабилографический анализ): Дис. канд. мед. наук. М. 1995. С. 35-72.
8. Иванова-Смоленская И.А., Маркова Е.Д., Иллариошкин С.Н. Агонисты дофаминовых рецепторов в лечении больных первичным паркинсонизмом молодого возраста // Неврол. журнал. 2002. — №.2. — С. 38-41.
9. Коновалов Н.В. Патология и патофизиология мозжечка. М.: Медгиз, 1939.
10. Левин О.С. Механизм регуляции движений и патогенез основных экстрапирамидных синдромов // В кн.: Экстрапирамидные расстройства /под ред. Штока В.Н., Ивановой Смоленской И.А., Левина О.С. — М.: МЕДпресс-информ, 2002. — С. 15-55 (а).
11. Левин О.С. Нарушения ходьбы: механизмы, классификация, принципы диагностики и лечения // В кн.: Экстрапирамидные расстройства / под ред. Штока В.Н., Ивановой-Смоленской И.А., Левина О.С. М.: МЕДпресс-информ, 2002. — С.473-494 (б).
12. Левин О.С. Сосудистый паркинсонизм // Неврологический журнал. 1997. -№4.-С. 42-51.
13. Переяслов Г. А, Слива С. С. Особенности программно-методического обеспечения стабилографического комплекса для биохимических исследований// Материалы Российской конференции по биомеханике, 1999. №2. — С. 100-101.
14. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М., МедиаСфера, 2002
15. Скворцов Д.В. Клинический анализ движений. Стабилометрия. М.: Антидор, 2000.
16. Устинова К.И., Черникова Л.А., Матвеев Е.В. Применение билатеральной стабилографической платформы при диагностике и восстановлении двигательных нарушений в клинике нервных болезней // Медицинская техника. 2000. — № 6. — С. 35-40.
17. Федорова Н.В., Смоленцева И.Г., Левин О.С. Применение агонистовдофаминовых рецепторов при болезни Паркинсона // Неврол. журнал. -2002. -№ 1.-С. 41-45.
журнал. -2002. -№ 1.-С. 41-45.
18. Черникова JI.A. Оптимизация восстановительного процесса у больных, перенесших инсульт: клинические и нейропсихологические аспекты функционального биоуправления // Автореф. . доктора мед. наук. М., 1998.
19. Шик M.JI., Северин Ф.В., Орловский Г.Н. Управление ходьбой и бегом посредством электрической стимуляции среднего мозга // Биофизика. 1966. -Т. 11.-Р. 659-666.
20. Шток В.Н., Федорова Н.В. Болезнь Паркинсона. // В кн.: Экстрапирамидные расстройства / под ред. Штока В.Н., Ивановой- Смоленской И.А., Левина О.С. М.: МЕДпресс-информ, 2002. — С. 87-124.
21. Яхпо Н.Н., Нодель М.Р. Современные принципы терапии болезни Паркинсона // Русский мед. журнал. 2000. -№ 10. — С.418-425.
22. Alexander G.E., Crutcher M.D. Functional architecture of basal ganglia circuits: neural substrates of parallel proceceeng// Trends. Neusci. 1990. — Vol. 13. — P. 266-271.
23. Allum J.H.J. Keshner E.A., Honegger F. Disturbance of posture in Parkinson’s disease // In: Posture and Gait: Development, Adaptation and Modulation / eds. Amblard B. et al Amsterdam: Elsevier. — 1988. — P. 245-257.
24. Andersson G., Hagman J., Talianzadeh R. et al. Effect of cognitive load on postural control. Brain Res, Bull. 2002. — Vol. 58. — P. 135-139.
25. Amsten A.F.T., Sleeve J.C., Jetsch D.J. et al. Noradrenergic influence on prefrontal cortical cognitive function: opposing actions of postjunctional alphai versus alpha2-adrenergic receptors. Adv. Pharmacol 1998. — Vol. 42. — P. 764767.
26. Barbeau A. Aging and extrapyramidal system //J. Am. Geriatr. Soc. 1973. — Vol. 21.-P. 145-149.-10434. Basmajian J.V., De Luca C.J. Muscles alive: their functions revealed by electromyography. 5 th ed. // Baltimore: Williams & Wilkins. 1985.
27. Beckley D.J., Bloem B.R., Rentier M.P. Impaired scaling of long latency postural reflexes in patients with Parkinson’s disease // Electroenceph. Clin. Neurophysiol. 1993.-Vol. 89.-P. 22-28.
28. Beckley D.J., Bloem B.R., van Dijk J.G. et al. Electrophysiological correlates of postural instability in Parkinson’s disease// Electroenceph Clin Neurophysiol. -1991.-Vol. 81.-P. 263-268.
29. Beckley D.J., Panzer V.P., Remler M.P., et al. Clinical correlates of motor performance during paced postural tasks in Parkinson’s disease // J. Neurol. Sci. -1995.-Vol. 132.-P. 133-138.
30. Benvenutti F. Physiology of Human Balance // In: Gait Disorders. Advances in Neurology/ eds. Ruzicka E. et al. Philadelphia: Lippincott Wiliams & Wilkins. -2001.-Vol. 87.-P. 41-52.
31. Bertrand E., Lechowicz W., Szpak G.M. et al. Qualitative and quantitative analysis of locus coeruleus neurons in Parkinson’s disease // Folia Neuropathol. 1997. -Vol. 35.-P. 80-86
32. Bizzo G., Guillet M, Patat A. et al. Specifications for building a vertical force platform designed for clinical stabilometry// Med. & Biol. Eng. & Comput. -1985. Vol. 23. — P. 474-476.
33. Bloem B.R., Beckely D.J., Remler M.P. et al. Postural reflexes in Parkinson’s disease during «resist» and «yield» tasks // J. Neurol. Sci. 1995. — Vol.129. — P. 109-119
34. Bloem B.R., Beckley D.J., van Dijk J.K. et al. Influence of dopaminergic medication on automatic postural responses and balance impairment in Parkinson’s disease // Mov. Disord. 1996. — Vol. 11. — P. 509-521
35. Bloem B.R., Grimbergen Y.A.M., GramerM. et al. Prospective assessment of falls in Parkinson’s disease // Mov. Disord. 1998. — Vol. 10. — P. 147(a).
36. Bloem B.R., van Vugt J., Beckley D.J. Habituation of longer leg stretch reflexes in Parkinson’s disease // Electroenceph. Clin. Neurophysiol. 1998. — Vol. 109. — P. 73-77(6).
37. Bloem B.R., van Vugt J., Beckley D.J. Postural instability and falls in Parkinson disease // In: Gait Disorders. Advances in Neurology/ eds. Ruzicka E. et al. -Philadelphia: Lippincott Wiliams & Wilkins. 2001. — Vol. 87. — P. 209-223.
38. Bonnet AM., Loria Y. , Saint-Hilaire M.H. et al. Does long-term aggravation of Parkinson’s disease result from nondopaminergic lesions? // Neurology. 1987. -Vol. 37.-P. 1539-1542.
, Saint-Hilaire M.H. et al. Does long-term aggravation of Parkinson’s disease result from nondopaminergic lesions? // Neurology. 1987. -Vol. 37.-P. 1539-1542.
39. Bouisset S., Sattara M. A sequence of postural movement precedes voluntary movement//Neurosci. Lett. 1981. — Vol. 22. — P.263-270.
40. Brefel-Courbon C. Parkinson’s disease and the noradrenaline system // Presse Med. 2002. — Vol. 31. — P. 1240-1242.
41. Brefel-Courbon C., Thalamas C., Peyro-Saint-Paul H. et al. a2-Adrenoreceptor antagonists: a new approach to Parkinson’s disease? // CNS Drugs. 1998. -Vol. 10.-P. 189-207.
42. Briley M. Noradrenergic mechanisms in Parkinson’s disease // Trends. Pharmacol. Sci. 1993. — Vol. 14. — P. 33-34.
43. Brocklehurst J.C., Robertson D., James-Groom P. Skeletal deformities in the elderly and their effect on postural sway//J. Am. Geriatr. Soc. 1982. — Vol 8. -P. 534-538.
44. Bronstein A.M., Yardley L, Moore A.P. et al. Visually and posturally mediated tilt illusion in Parkinson’s disease and in labyrinthine defective subjects // Neurology. 1996,-Vol. 47.-P. 651-656.
45. Brooks V.B. The neural basis of motor control // N.Y.: Oxford Univ. Press. 1986.
46. Brown P. and Steiger M.J. Basal ganglia and gait disorders // In: Clinical Disorders of Balance, Posture and Gait / eds. Bronstein A.M. et al. London: Arnold. — 1996. — P. 156-167.
47. Charlett A., Weller C., Doobs S.M. et al. What makes a faller in early Parkinson’s disease? // Eur. Neurol. 1997. — Vol. 38. — 312-314.
48. Crenna P., Frigo C., Giovani P. The initiation of gait in Parkinson’s disease // In: Motor disturbances II (eds. Bererdelli A., et al.). London: Academic Press. 1990. P. 161-173.
49. De Rijk M.C., Breteler M.M., Gravelend G.A. et al. Prevalence of Parkinson’s disease in the elderly: the Rotterdam study // Neurology. 1995. — Vol. 45.
50. Dietz V. Neurophysiology of gait disorders: present and future applications //Electroenceph. Clin. Neurophysiol. -1997. -Vol. 103.-P. 333-335.
-1997. -Vol. 103.-P. 333-335.
51. Dietz V. Physiology of Human Gait: Neural Processes // In: Gait Disorders. Advances in Neurology/ eds. Ruzicka E. et al. -Philadelphia: Lippincott Wiliams & Wilkins. 2001. — Vol. 87. — P. 53- 64.
52. Dietz V., Berger W., Horstmann G.A. Posture in Parkinson’s disease: impairment of reflexes and programming // Ann. Neurol. 1988.- Vol. 24. P. 660-669.
53. Elble R.J. Gait disorders: pathophysiology of standing and locomotion // Mov. Disord. 1998. — Vol. 13. — 9-10 (a).
54. Elble R.J. Motor control and Movement Disorders // In: Parkison’s disease and Movement disorders/eds. Jankovic J., Tolosa E. Baltimore: Williams & Wilkins. — 1998. — P. 30-35 (6).
55. Elble R.J., Cousins R., Leffler K., et al. Gait initiation by patients with lower-half parkinsonism // Brain. 1996. — Vol. 119. — P. 101-112.
56. Eventon I., Morreno M, Geller E. et al. Hip fractures in patients with Parkinson’s syndrome // J. Trauma. 1983. — Vol. 23. P. 98-101.
57. Fahn S. Parkinsonism // In: Merrit’s textbook of Neurology /ed. Rowland L.P. 9th ed. Baltimore: Williams & Wilkins. 1995. — P. 713-730.
58. Fisher CM. Hydrocephalus as a cause of disturbance of gait in the elderly//-107
59. Neurology. 1982. — Vol. 32. — P. 1358.
60. Folstein M.F., Folstein S.E., McHugh P.R. Mini-mental state: a practical method for grading the cognitive status of patients for the clinician // J. Psychiatr. Res. -1975.-Vol. 12.-P. 189-198.
61. Forno L.S. Neuropathology of Parkison’s disease // J. Neuropathol. Exp. Neurol. 1996. — Vol. 55. — P. 259-272.
62. German D.C., Manaje K.F., White C.L. et al. Disease specific pattern of locus coeruleus cell loss // Ann. Neurol. 1992. — Vol. 32. — P. 667- 676.
63. Gesi M, Soldani P., Giorgi F.S. et al. The role of the locus coeruleus in the development of Parkinson’s disease // Neurosci. Biobehav. Rev. 2000. — Vol. 24. — P.655-668.
64. Ghika J., Tennis M., Hoffman E. et al. Idazoxan treatment in progressive supranuclear palsy // Neurology. 1991. — Vol. 41. — P. 986-991.
et al. Idazoxan treatment in progressive supranuclear palsy // Neurology. 1991. — Vol. 41. — P. 986-991.
65. Giladi N., Kao R., Fahn S. Freezing phenomenon in patients with parkinsonian syndromes. Mov. Disors. 1997. — Vol. 12. -P.302-305.
66. Gottwald MD. Bainbridge JL, Dowling GA. et al. New pharmacotherapy for Parkinson’s disease. Ann Pharmacother 1997; 31: 1205-17
67. Gray P., Hildebrand K. Fall Risk Factors in Parkinson’s Disease // J. Neurosci. Nurs. 2000. — Vol. 32. — P. 222-228.
68. Hageman P.A. Gait characteristics of healthy elderly: a literature review 11 Issues Aginig. 1995. — Vol. 18. — P.14-17(a).
69. Hageman P.A., Leibowitz J.M., Blanke D. Age and gender effects on postural control measures // Arch. Phys. Med. Rehabil. 1995. — Vol. 10. — P. 961-965(6).
70. Hasegawa Y., Mukai E., Matsusoka Y. et al. Effect of oral L-threo-3,4-dyhydroxyphenylserine on orthostatic hypotension in Parkinson’s disease // Mov. Disord. 1997.-Vol. 12. P. 88.
71. Hawken M.B., Tanyeri S. et al. Influence of sensory manipulation on postural control in Parkinson’s disease // J. Neurol. Neurosurg. Psychiatry. 1993. — Vol. 56.-P. 1276-1281.
72. Horak F.B. and Nashner L.M. Central programming of postural movements: adaptation to altered support surface configurations // J. Neurophysiol. 1986. -Vol. 55.-P. 1369-1381.
73. Horak F.B. Assumptions underlying motor control for neurologisc rehabilitation I I IN: Contemporary management of motor control problems. Proceedings of the II Step Conference/ Alexandria, VA: APTA. 1991. — P. 11-27.
74. Horak F.B., Frank J. S. Three separate postural systems affected in parkinsonism // In: Motor control. Vol. 7 /eds. Stuart D.G., Gurfinkel V.S., Wiesendanger M.). -Tucson: Motor Control Press. 1996: 343-346.
75. Horak F.B., Nutt J.G., Nashner L.M. Postural inflexibility in parkinsonian subjects // J. Neurol. Sci. 1992. — Vol. 111. — P. 46-58.
76. Hornykiewicz O. Brain neurotransmitter changes in Parkinson’s disease I I In: Movement disorders, Neurology / eds.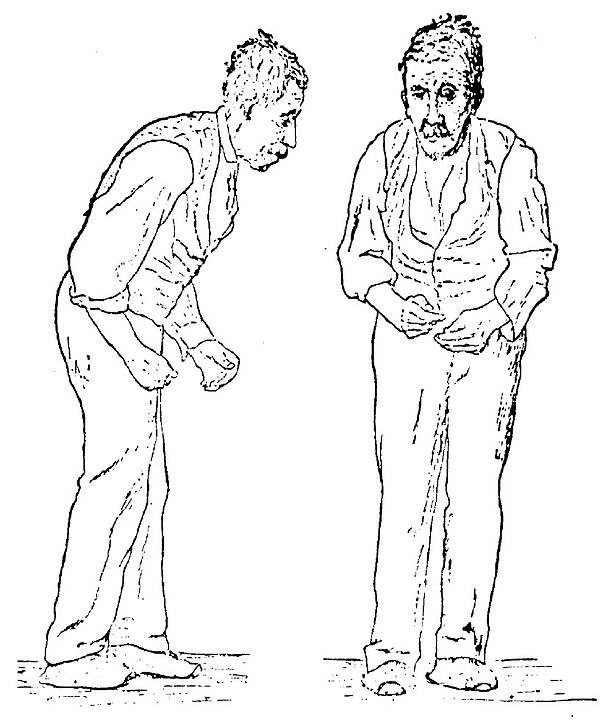 Marsden C.D., Fahn S. London: Butterworth Scientific. — 1982. — Vol. 2. — P. 41-58.
Marsden C.D., Fahn S. London: Butterworth Scientific. — 1982. — Vol. 2. — P. 41-58.
77. Huffschmidt A., Stark K., Lucking C.H. Contractile properties of lower leg muscles are normal in Parkinson’s disease// J. Neurol. Nerosurg. Psychiat. -1991. Vol. 54. — P. 457-460.
78. Hughes A.J., Daniel S.E., Kilford L. et al. Accuracy of clinical diagnosis of PD: a clinicopathological study of 100 cases // J. Neurol. Psychiat. 1992. — Vol. 55. -P. 181 — 184.
79. Inglis W.L., Winn P. The pedunculopontine tegmental nucleus: where the striatum meets the reticular formation // Prog. Neurobiol. 1995. — Vol. 47. — P. 1-29.
80. Ito M. The cerebellum and neural control // N.Y.: Raven Press. 1984.
81. Jenner P. Pharmacology of dopamine agonists in the treatment of Parkinson’s disease // Neurology. 2002. — Vol. 58 (Suppl. 1). — P. S1-S8.
82. Jenner P. The rationale for use of dopamine agonists in Parkinson’s disease // Neurology. 1995. — Vol. 45. — P.S6-S12.
83. Johnels В., Ingvarsson P.E., Steg G. et al. The Posture-Locomotion-Manual Test: A Simple Method for the Characterization of Neurological Movement
84. Disturbances // In: Gait Disorders. Advances in Neurology/ eds. Ruzicka E. et al. -Philadelphia: Lippincott Wiliams & Wilkins. 2001. — Vol. 87. — P. 91-100.
85. Kapteyn T.S., Bles W., Njiokiktjien Ch.J. et al. Standartization in platform stabilometry being a part of posturography // Agressologie. 1983. — Vol.7. — P. 321-326.
86. Kendal F.P., McCreary E.K. Muscles: testing and function. 3rd ed. // Baltimore:Williams & Wilkins. 1983.
87. King M.B., Judge J.O., Wolfson L. Functional base of support decreases with age // J. Gerontol. 1994. — Vol. 6. — P. 258-263.
88. Klawans H.L. Individual manifestations of Parkinson’s disease after ten or more years of levodopa. Mov. Disord. 1986. — Vol. 1. — P. 187-192.
89. Koller W.C., Glatt S., Vetere-Overfield B. et al. Falls and Parkinson’s disease // Clin. Neuropharmacology. 1989. — Vol. 2. — P. 98-105.
1989. — Vol. 2. — P. 98-105.
90. Koller W.C., Glatt S., Wilson R., et al. Cerebellar atrophy: relationship to aging and cerebellar atrophy // Neurology. 1981. — Vol. 23. — P. 405.
91. Lakke J.P.W.F. Axial apraxia in Parkinson’s disease // J. Neurol. Sci. 1985. -Vol. 69. — P.37-46.
92. Lauk M, Chow C.C., Lipsitz L.A. et al. Assesing muscle stiffness from quite stance in Parkinson’s disease // Muscle Nerve. 1999. — Vol. 22. — P. 635-639.
93. Lavoie В., Parent A. Pedunculopontine nucleus in the squirrel monkey: projections to the basal ganglia as revealed by anterograde tract-tracking methods // J. Comparative Neurol. 1994. — Vol. 344. — P. 210-231.
94. Lee R.G., Tonolli I., Viallet F. Preparatory postural adjustment in Parkinsonian patients with postural instability // Can. J. Neurol. Sci. 1995. — Vol. 22. — 126135.
95. Lund C. and Sheafore M.L. Is your patient about to fall? Gerontol. Nurs. 1985. -Vol. 11.-P. 37-41.
96. Lundin-Olsson L., Nyberg L, Gustafson Y. «Stops walking when talking» as a predictor of falls in elderly people // Lancet. 1997. — Vol. 349. — P. 617.
97. MarienM., Briley M, Colpaert F. Noradrenaline depletion exacerbates MPTP-induced striatal dopamine loss in mice //Eur. J. Pharmacol. 1993. — Vol. 236. -P.487-489.
98. Marsden C.D. Parkinson’s disease // J. Neurol. Neurosurg. Psychiatry. 1994. -Vol. 57.-P. 672-681.
99. Martin J.P. The basal ganglia and posture // London: Pitman Medical. 1967.
100. Martinez-Martin P., Urra D.G., Quijano T.D. et al. A new clinical tool for gait evaluation in Parkinson’s disease // Clin. Nuropharmacology. 1997. — Vol. 20. -183-194.
101. Masdeu J.C., Wolfson L., Lantos G. et al. Brain white-matter changes in the elderly prone to falling //Arch. Neur. 1989. — Vol. 46. — P. 1292-1296.
102. Millan M.J., Cussac D., Milligan G. et al. Antiparkinsonian agent Piribedil displays antagonism properties at native, rat, and cloned, human a2-adrenoreceptors: cellular and functional characterization // J. Pharm. Exp. Ther. -2001.-297.-P. 876-887.
Pharm. Exp. Ther. -2001.-297.-P. 876-887.
103. Mink J. W., Thac T. Basal ganglia motor control: III. Pallidal ablation: normal reaction time, muscle contraction, and slow movement // J. Neurophysiol. -1991.-Vol.65.- P. 330-351.
104. Mitchel S.L., Collins J.J., de Luca C.J. et al. Open-loop and closed-loop postural control mechanism in Parkinson’s disease: increased mediolateral activity during quite standing // Neurosci. Lett. 1995. — Vol. 111. — P. 133-136.
105. Montastruc J.L., Rascol O., Senard J.M. New directions in the drug treatment of Parkinson’s disease // Drugs Aging. 1996. — Vol. 9. — p. 169-184.
106. Morris M.E., Iansek R., Matyas T. et.al. The pathogenesis of gait hypokinesia in Parkinson’s disease // Brain. 1994. — Vol. 117. — P. 1169-1181.
107. Mutch W.J. and Lien C. Epidemiology // In: Parkinson’s disease in the older patient /eds. Playfer J., Hindle J. London: Arnold. — 2001. — P. 30-41.
108. Narabayashi #., Kondo Т., Yokochi F. et al. Clinical effects of L-threo-3,4-dyhydroxyphenylserine in cases of parkinsonism and pure akinesia // Adv. Neurol. 1987. — Vol. 45. — P.593-602.
109. Nashner L.M. and McCollum G. The organization of human postural movements: a formal basis and experimental synthesis // Behav. Brain Sci. 1985. — Vol. 8. -P. 135-172.
110. Nashner L.M., Minn A.Y., Rodrigues K., et al. Postural instability in Parkinson’s disease: Opposing effects of treatment on sensory and motor components // In: Control of Posture and Gait / eds. Duysens J., Bouwien C.M. ISPG. — 2001. — P. 737-741.
111. Nicholas A.P., Hokfelt Т., Pieribone V.A. The distribution and significance of CNS adrenoreceptors examined with in situ hybridization //Trends Pharmacol. Sci. -1997.-Vol. 18.-P. 210-211.
112. Nutt J.G., Marsden C.D., Thompson P.D. Human walking and higher-level gait disorders, particulary in the elderly // Neurology. 1993. — Vol. 43. — P.268-279.
113. Olanow C. W. The role of dopamine agonists in the treatment of early Parkinson’s disease. Neurology. 2002. — Vol. 58 (Suppl.l). — P. 33-41.
Neurology. 2002. — Vol. 58 (Suppl.l). — P. 33-41.
114. Overstall P.W., Exton-Smith A.N., Imms F.J. et al. Falls in the elderly related to postural imbalance // Br. Med. J. 1977. — Vol. 1. — P. 261-264.
115. Overstall P. W. Motor problems // In: Parkinson’s disease in the older patient /eds. Playfer J., Hindle J. London: Arnold. — 2001. — P. 184-200.1. P. 2143-2146.
116. Palta E. The neural control of locomotion // Evaluation and management of gait disorders / ed. Spivack B.S. 1999. — P. 45-47.
117. Rascol O., Amulf I., Agid Y. L-dyhydroxyphenilalanine-induced dyskinesias improvement by an alpha2-antagonist, idazoxan in patient with Parkinson’s disease //Mov. Disord. 1997. — Vol. 12. — P.111.
118. Sato Y, Manabe S, Kuno H. et al. Amelioration of osteopenia and hypovitaminosis D by 1 alha-hydroxivitamin D3 in elderly patients with Parkinson’s disease // J. Neurol. Neurosurg. Psychiatry. 1999. — Vol. 66. — P.64-68.
119. Shapira A. Neuroprotection and dopamine agonists // Neurology. 2002. — Vol. 58 (Suppl. 1).- S9-S18.
120. Sheldon J.H. The effect of age on the control of sway. Geront. Clin. — 1963. Vol. 5.-P. 129-138.
121. Shenkman M.A., Butler R.B. «Automatic Postural Tone» in posture, movement, and function. Forum on physical therapy issues related to cerebrovascular accident // Alexandria, VA: APT A. 1992. — P. 16-21.
122. Schiepati M, Hugon M, Grasso M. et al. The limits of equilibrium in young and elderly normal subjects and in parkinsonians // Electroenceph. Clin. Neurophysiol. 1994.-Vol. 93. -P.286-298.
123. Shumway-Cook A., Woollacott M.H. Motor Control. Theory and Practical Applications. 2nd ed. // Baltimore: Lippincott Williams & Wilkins. 2001.
124. Smithson F., Morris M.E., Ianek R. Performance on clinical tests of balance in Parknson’s disease // Phys. Ther. 1998. — Vol.78. — P.577-592.
125. Soames R. W., Atha J. The soectral characteristics of postural sway behaviour // Eur. J. Appl. Physiol. 1982. — Vol. 49. — P. 169-177.
Physiol. 1982. — Vol. 49. — P. 169-177.
126. Sudarski L. and Ronthal M. Gait disorders among elderly patients: A survey study of 50 patients// Arch. Neurol. (Clin.). 1983. — Vol. 40. — P. 740- 743.
127. Thomson P.D., Marsden C.D. Walking disorders // In: Neurology in clinical practice /eds. Breadly et al. Butterworth. — 1996. — P.321-334.
128. Tinetti M.E., Baker D.J., McAvay G. et al. A multifactorial intervention to reduce the risk of falling among elderly people living in the community //New Engl. J. Med. 1994. — Vol. 331. — P. 821-826.
129. Wendell C.M., Hauser R.A., Nagaria M.H. et al. Chief complaints of patient’s with Parkinson’s disease // Neurology. 1999. — Vol. 52. — P. A90-A91.
130. Wenning GK, Litvan I, Jankovic J. et al. Natural history and survival of 14 patients with corticobasal degeneration confirmed at postmortem examination // J. Neurol. Neurosurg. Psychiatry. 1998. — P. 64. — Vol. 184-189.
131. Wood В H, Bilclough J A, Bowron A. Incidence and prediction of falls in Parkinson’s disease: a prospective multidisciplinary study // J. Neurol. Neurosurg. Psychiatry. 2002. — Vol. 72. P. — 721-725.
132. Woollacott M.H., Shumway-Cook A., Nashner L.M. Aging and posture control: changes in sensory organization and muscular coordination // Int. J. Aging Hum. Dev. 1986. -Vol. 22. — P. 332.
133. Yekutiel M.P. Patients’ fall records as an aid in designing and assessing therapy in Parkinsonism // Disability and Rehabilitation. 1993. — Vol. 15. — P. 189-193.
134. ZieglerM., Lacombles L., Rascol O. et al. Efficacy of piribedil in adjunction to L-dopa in a 6-month randomized placebo-controlled study in early Parkinson’s disease / Neurology. 2000. — Vol. 54 (Suppl. 3). — A 280.
135. Ziegler M., Rondot P. Activity of piribedil in Parkinson’s disease: a multicenter study // Press Med. 1999. — Vol. 28. — P. 1414-1418.
Болезнь Паркинсона — Клиника Нейровита
Болезнь Паркинсона (синонимы: идиопатический синдром паркинсонизма, дрожательный паралич) — медленно прогрессирующее хроническое неврологическое заболевание, характерное для лиц старшей возрастной группы. Относится к дегенеративным заболеваниям экстрапирамидной моторной системы. Вызвано прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, — прежде всего в чёрной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведет к активирующему влиянию базальных ганглиев на кору головного мозга.
Относится к дегенеративным заболеваниям экстрапирамидной моторной системы. Вызвано прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, — прежде всего в чёрной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведет к активирующему влиянию базальных ганглиев на кору головного мозга.
Ведущими симптомами (иначе: основные или кардинальные симптомы) являются:
— мышечная ригидность
— гипокинезия
— тремор
— постуральная неустойчивость
Современная медицина пока не может излечить заболевание или замедлить его прогрессирование (этиологическая или патогенетическая терапия), однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных.
Термин «паркинсонизм» является общим понятием для ряда заболеваний и состояний с вышеназванными ведущими симптомами. Однако наиболее значимой из форм паркинсонизма является болезнь Паркинсона — идиопатическое заболевание (что означает болезнь самостоятельную, не вызванную генетическими нарушениями или другими заболеваниями).
Эпидемиология.Болезнь Паркинсона составляет 70—80 % случаев синдрома паркинсонизма. Она является наиболее частым нейродегенеративным заболеванием после болезни Альцгеймера. Заболевание встречается повсеместно. Его частота колеблется от 60 до 140 человек на 100 тысяч населения, число больных значительно увеличивается среди представителей старшей возрастной группы. Удельный вес людей с болезнью Паркинсона в возрастной группе старше 60 лет составляет 1 %, а старше 85 лет — от 2,6 % до 4 %. Чаще всего первые симптомы заболевания появляются в 55—60 лет. Однако в ряде случаев болезнь может развиться и в возрасте до 40 (болезнь Паркинсона с ранним началом) или до 20 лет (ювенильная форма заболевания).
Мужчины болеют несколько чаще, чем женщины. Существенных расовых различий в структуре заболеваемости не выявлено.
Существенных расовых различий в структуре заболеваемости не выявлено.
Этиология болезни Паркинсона на вторую половину 2011 года окончательно не выяснена. Этиологическими факторами риска считаются старение, генетическая предрасположенность, воздействие факторов окружающей среды. Патоморфологически нормальное старение сопровождается уменьшением числа нейронов чёрной субстанции и наличием в них телец Леви. Старению также сопутствуют нейрохимические изменения в стриатуме — снижение содержания дофамина и фермента тирозингидроксилазы, а также уменьшение числа дофаминовых рецепторов. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении.
Около 15 % людей с болезнью Паркинсона имеют семейный анамнез данного заболевания. Однако гены, ответственные за развитие болезни Паркинсона, не идентифицированы.
Причинами паркинсоноподобных проявлений также могут быть воздействие факторов окружающей среды (пестициды, гербициды, соли тяжёлых металлов), хроническая цереброваскулярная недостаточность или употребление лекарств, вызывающих экстрапирамидные побочные эффекты.
Экологические факторы.Установлено, что после инъекции вещества 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) развивается паркинсонизм. МФТП проникает через ГЭБ и под действием МАО-B окисляется до 1-метил-4-фенилпиридина (МФП+). МФП+ проникает в митохондрии и ингибирует комплекс I дыхательной цепи. Сходство химического строения МФТП и некоторых пестицидов (например, ротенон, паракват) и гербицидов (например, Агент Оранж) позволило предположить, что МФТП-подобные токсины окружающей среды способствуют развитию болезни Паркинсона. К факторам риска относят также проживание в сельской местности и близость промышленных предприятий и карьеров.
Риск развития болезни Паркинсона у курильщиков в 3 раза ниже, чем у некурильщиков. Предполагают, что это связано с дофамин-стимулирующим эффектом никотина. Кроме того, это можно объяснить наличием в дыме табака соединений, действие которых подобно ингибиторам МАО. От развития болезни Паркинсона защищает также употребление кофеина.
Предполагают, что это связано с дофамин-стимулирующим эффектом никотина. Кроме того, это можно объяснить наличием в дыме табака соединений, действие которых подобно ингибиторам МАО. От развития болезни Паркинсона защищает также употребление кофеина.
Окислительная гипотеза.
Окислительная гипотеза предполагает, что свободные радикалы, образующиеся при окислительном метаболизме дофамина, играют важную роль в развитии и прогрессировании болезни Паркинсона. Содержание веществ, которые могут служить донором электронов, в чёрном веществе увеличивается, что способствует образованию свободных радикалов[2]. Кроме того, при окислении дофамина под действием МАО образуется пероксид водорода. Если пероксид водорода не связывается с глутатионом, то происходит накопление весьма реактивных гидроксильных радикалов, которые вступают в реакцию с липидами клеточных мембран, вызывая перекисное окисление липидов и гибель клеток.
ПатогенезПатологическая анатомия.
При болезни Паркинсона поражаются структуры экстрапирамидной системы — базальные ядра и чёрное вещество, голубое пятно и другие. Наиболее выраженные изменения отмечают в передних отделах чёрной субстанции. Характерные для болезни Паркинсона симптомы возникают при гибели 60—80 % нейронов данного анатомического образования.
Макроскопические изменения характеризуются депигментацией содержащих меланин областей чёрного вещества и голубого пятна. При микроскопическом исследовании поражённых областей выявляют уменьшение числа нервных клеток. В них определяется наличие телец Леви. Также происходит гибель астроцитов (разновидности глиальных клеток) и активация микроглии. Тельца Леви образуются вследствие скопления в цитоплазме белка ?-синуклеина. Наличие телец Леви — один из признаков болезни Паркинсона.
Тельца Леви обнаруживают также и при других нейродегенеративных заболеваниях. В связи с этим они не считаются специфическим маркером болезни Паркинсона. Кроме того, при данном заболевании в чёрной субстанции и голубом пятне обнаружены «бледные тельца» — внутриклеточные гранулярные включения, которые замещают распадающийся меланин.
Кроме того, при данном заболевании в чёрной субстанции и голубом пятне обнаружены «бледные тельца» — внутриклеточные гранулярные включения, которые замещают распадающийся меланин.
Патологическая физиология.
Тесная взаимосвязь между составляющими экстрапирамидной системы — паллидумом и стриатумом — обеспечивается многочисленными пучками нервных волокон. Благодаря связям между таламусом и стриопаллидарной системой образуются рефлекторные дуги, обеспечивающие выполнение многочисленных стереотипных и автоматизированных движений (например, ходьба, бег, плаванье, езда на велосипеде и др.). Тесная связь стриопаллидарной системы с ядрами гипоталамуса определяет её роль в механизмах эмоциональных реакций. В норме экстрапирамидная система посылает импульсы к периферическим двигательным нейронам. Эти сигналы играют важную роль в обеспечении миостатики путём готовности мышц к произвольным движениям. От деятельности данного отдела центральной нервной системы зависит способность человека принимать оптимальную для намеченного действия позу, достигается необходимое соотношение тонуса мышц-агонистов и мышц-антагонистов, а также плавность и соразмерность произвольных движений во времени и пространстве.
Характер клинических проявлений болезни зависит от того, какая часть стриопаллидарной системы поражена — стриатум или паллидум. Если чрезмерно тормозящее влияние стриатума, возникает гипокинезия — бедность движений, амимия. Гипофункция стриатума приводит к возникновению избыточных непроизвольных движений — гиперкинезов. Паллидум оказывает тормозящее воздействие на структуры стриатума. Для болезни Паркинсона характерно снижение тормозящего влияния паллидума на стриатум. Повреждение паллидума приводит к «торможению торможения» периферических двигательных нейронов.
Открытие роли нейромедиаторов позволило объяснить функции экстрапирамидной системы, а также причины возникновения клинических проявлений болезни Паркинсона и паркинсонизма. В мозге существует несколько дофаминергических систем. Одна из них начинается в нейронах чёрной субстанции, аксоны которых через ножку мозга, внутреннюю капсулу, бледный шар доходят до полосатого тела (лат. corpus striatum). Терминальные отделы этих аксонов содержат большое количество дофамина и его производных. Дегенерация данного нигростриарного дофаминергического пути является основным причинным фактором развития болезни Паркинсона. Вторая восходящая дофаминергическая система — мезолимбический путь. Он начинается от клеток интерпедункулярного ядра среднего мозга и заканчивается в гипоталамусе и лобных долях головного мозга. Этот путь принимает участие в контроле настроения, поведении и контролирует начало двигательного акта и движений аффективной реакции (движений, которые сопровождают эмоции).
Одна из них начинается в нейронах чёрной субстанции, аксоны которых через ножку мозга, внутреннюю капсулу, бледный шар доходят до полосатого тела (лат. corpus striatum). Терминальные отделы этих аксонов содержат большое количество дофамина и его производных. Дегенерация данного нигростриарного дофаминергического пути является основным причинным фактором развития болезни Паркинсона. Вторая восходящая дофаминергическая система — мезолимбический путь. Он начинается от клеток интерпедункулярного ядра среднего мозга и заканчивается в гипоталамусе и лобных долях головного мозга. Этот путь принимает участие в контроле настроения, поведении и контролирует начало двигательного акта и движений аффективной реакции (движений, которые сопровождают эмоции).
Основу всех форм паркинсонизма составляет резкое уменьшение количества дофамина в чёрной субстанции и полосатом теле и соответственно нарушение функционирования дофаминергических проводящих путей головного мозга. Клиническая картина. Для болезни Паркинсона характерны 4 двигательных нарушения (тремор, гипокинезия, мышечная ригидность, постуральная неустойчивость), а также вегетативные и психические расстройства. Тремор (дрожание) — наиболее очевидный и легко выявляемый симптом. Для паркинсонизма характерен тремор, возникающий в покое, хотя редко возможны и другие типы (постуральный, интенционный). Его частота 4—6 Гц (движений в секунду). Он обычно начинается в дистальном отделе одной руки, при прогрессировании заболевания распространяясь на противоположную руку и на ноги. Разнонаправленные движения большого и других пальцев внешне напоминают счёт монет или скатывание пилюль (схожесть с ручной техникой создания пилюль в фармацевтике). Иногда также отмечается дрожание головы по типу «да-да» или «нет-нет», дрожание век, языка, нижней челюсти. В редких случаях оно охватывает всё тело. Тремор усиливается при волнении и стихает во время сна и произвольных движений. В отличие от мозжечкового тремора, который появляется при движении и отсутствует в покое, при болезни Паркинсона типично его наличие в покое и уменьшение или исчезновение при движениях.
Почерк при болезни Паркинсона.
На рисунке видны рваные движения там, где предполагаются плавные линии
Гипокинезия — снижение спонтанной двигательной активности. Больной может застывать, часами сохраняя неподвижность. Характерна общая скованность. Активные движения возникают после некоторого промедления, темп их замедлен — брадикинезия. Больной ходит мелкими шагами, ступни при этом располагаются параллельно друг другу — кукольная походка. Лицо маскообразное (амимия), взгляд застывший, мигания редкие. Улыбка, гримаса плача возникают с запозданием и так же медленно исчезают.
Речь лишена выразительности, монотонна и имеет тенденцию к затуханию. В результате характерного для болезни Паркинсона уменьшения амплитуды движений почерк становится мелким — микрография.
Одним из проявлений олигокинезии (уменьшение количества движений) является отсутствие физиологических синкинезий (содружественных движений). При ходьбе руки не совершают обычных размашистых движений, они остаются прижатыми к туловищу (ахейрокинез). При взгляде вверх не отмечается наморщивания лба. Сжатие пальцев в кулак не сопровождается разгибанием кисти. Больной не может выполнять несколько целенаправленных движений одновременно. Все действия напоминают автоматические.
Мышечная ригидность — равномерное повышение тонуса мышц по пластическому типу. Конечности при их сгибании и разгибании застывают в приданном им положении. Такая форма повышения мышечного тонуса называется «пластической восковой гибкостью». Преобладание ригидности в определённых группах мышц приводит к формированию характерной позы просителя (также называют «поза манекена»): больной сутулится, голова наклонена вперёд, полусогнутые в локтевых суставах руки прижаты к телу, ноги также слегка согнуты в тазобедренных и коленных суставах. При пассивном сгибании-разгибании предплечья, головы, круговых движениях в лучезапястном суставе можно ощутить своеобразную прерывистость, ступенчатость напряжения мышц — «симптом зубчатого колеса».
Изменения мышечного тонуса ведут к нарушению тенденции конечности к возвращению в исходную позицию после совершённого движения. Например, после резкого пассивного тыльного сгибания стопы она некоторое время сохраняет приданную ей позицию — феномен Вестфаля.
Постуральная неустойчивость развивается на поздних стадиях заболевания. У больного отмечаются затрудения преодоления как инерции покоя, так и инерции движения. Больному сложно начать движение, а начав его, трудно остановиться. Возникают явления пропульсии (лат. propulsio — проталкивание вперёд), латеропульсии и ретропульсии. Они выражаются в том, что, начав движение вперёд, в сторону или назад, туловище обычно как бы опережает ноги, в результате чего нарушается положение центра тяжести. Человек теряет устойчивость и падает. Иногда у больных определяют «парадоксальные кинезии», когда вследствие эмоциональных переживаний, после сна либо вследствие других факторов человек начинает свободно передвигаться, пропадают характерные для заболевания симптомы. Через несколько часов симптоматика возвращается.
Вегетативные и психические расстройства.
Кроме нарушений двигательной сферы, при болезни Паркинсона отмечаются вегетативные расстройства, а также нарушения обмена веществ. Следствием может быть либо истощение (кахексия), либо ожирение. Секреторные расстройства проявляются сальностью кожных покровов, особенно лица, повышенным слюноотделением, избыточной потливостью.
Психические расстройства при болезни Паркинсона могут быть обусловлены как самим заболеванием, так и антипаркинсоническими препаратами. Начальные признаки психоза (страх, растерянность, бессонница, галлюцинаторно-параноидное состояние с нарушением ориентировки) отмечают у 20 % амбулаторных и двух третей больных с тяжёлой формой паркинсонизма. Слабоумие выражено слабее, чем при сенильной деменции. У 47 % наблюдают депрессии, у 40 % — расстройства сна и патологическую утомляемость. Больные безынициативны, вялы, а также назойливы, склонны к повторению одних и тех же вопросов.
Различают несколько клинических форм заболевания — ригидно-брадикинетическую, дрожательно-ригидную и дрожательную:
- Ригидно-брадикинетическая форма характеризуется повышением тонуса мышц по пластическому типу, прогрессирующим замедлением активных движений вплоть до обездвиженности. Появляются мышечные контрактуры. Характерна «поза манекена» («поза просителя»).
- Дрожательно-ригидная форма характеризуется тремором конечностей, преимущественно их дистальных отделов, к которому присоединяется скованность произвольных движений.
- Для дрожательной формы характерно наличие постоянного или почти постоянного средне- и крупноамплитудного тремора конечностей, языка, головы, нижней челюсти. Тонус мышц нормальный или несколько повышен. Темп произвольных движений сохранён.
Наиболее часто применяемой в медицине является классификация стадий паркинсонизма по Хён и Яру. Впервые она была опубликована в 1967 году в журнале Neurology Маргарет Хён (англ. Hoehn) и Мелвином Яром (англ. Yahr). Изначально она описывала 5 стадий прогрессирования болезни Паркинсона (1 — 5). Впоследствии шкалу модифицировали, дополнив её стадиями 0, 1,5 и 2,5.
- Стадия 0 — нет признаков заболевания.
- Стадия 1 — симптомы проявляются на одной из конечностей.
- Стадия 1,5 — симптоматика проявляется на одной из конечностей и туловище.
- Стадия 2 — двусторонние проявления без постуральной неустойчивости.
- Стадия 2,5 — двусторонние проявления с постуральной неустойчивостью. Больной способен преодолевать инерцию движения, вызванную толчком.
- Стадия 3 — двусторонние проявления. Постуральная неустойчивость. Больной способен к самообслуживанию.
- Стадия 4 — обездвиженность, потребность в посторонней помощи. При этом больной способен ходить и/или стоять без поддержки.
- Стадия 5 — больной прикован к креслу или кровати.
 Тяжёлая инвалидизация.
Тяжёлая инвалидизация.
Консервативное лечение.
В настоящее время болезнь Паркинсона является неизлечимой, все существующие методы лечения направлены на облегчение её симптомов (симптоматическое лечение).
Основные препараты, устраняющие двигательные нарушения: леводопа (чаще в комбинации с периферическими ингибиторами ДОФА-декарбоксилазы или реже с ингибиторами КОМТ), агонисты дофаминовых рецепторов[en] и ингибиторы МАО-Б.
Дофаминергические препараты.
Диоксифенилаланин (сокращённо допа, или дофа) — биогенное вещество, которое образуется в организме из тирозина и является предшественником дофамина, в свою очередь являющегося предшественником норадреналина. В связи с тем, что при болезни Паркинсона содержание дофамина в головном мозге значительно снижено, для лечения заболевания целесообразно применение веществ, повышающих его содержание в ЦНС. Сам дофамин не может быть использован для этой цели, так как он плохо проникает через гемато-энцефалический барьер.
Леводопа.
В качестве лекарственного препарата широко применяют синтетический левовращающий изомер диоксифенилаланина (сокращённо L-дофа), который значительно активнее правовращающего. Леводопа хорошо всасывается при приёме внутрь. Бо?льшая часть препарата попадает в печень и превращается в дофамин, который не проникает через гемато-энцефалический барьер. Для уменьшения декарбоксилирования препарат рекомендуют применять с ингибиторами дофа-декарбоксилазы (бенсеразидом, карбидопой).
Препарат эффективен при болезни Паркинсона и паркинсонизме. Он уменьшает гипокинезию и ригидность. При треморе, дисфагии и слюнотечении лечебный эффект достигается у 50—60 %.
Препарат можно назначать с центральными холиноблокаторами и не следует применять с необратимыми ингибиторами моноаминоксидазы (МАО).
При применении возможны побочные эффекты: диспепсические явления (тошнота, рвота, потеря аппетита), гипотензия, аритмии, гиперкинезы и др.
У пациентов младше 60—70 лет назначение леводопы из-за развития побочных явлений и снижения эффективности при длительной терапии стараются отложить и применяют другие лекарственные средства. Лечение пациентов старше 70 лет даже в начальных стадиях рекомендуют начинать с леводопы, что объясняют меньшей эффективностью препаратов других групп и более частыми соматическими и психическими побочными эффектами в этом возрасте.
Агонисты дофамина.
В качестве основного лечения также используются агонисты дофаминовых рецепторов (бромокриптин, перголид, прамипексол, ропинирол, каберголин, апоморфин, лизурид). Препараты данной группы являются специфическими центральными агонистами дофаминовых рецепторов. Имитируя действие дофамина, они вызывают те же фармакологические эффекты, что и леводопа.
По сравнению с леводопой они реже вызывают дискинезии и другие двигательные расстройства, но чаще оказывают иные побочные эффекты: отёки, сонливость, запоры, головокружение, галлюцинации, тошноту. Ингибиторы МАО типа Б и катехол-О-метилтрансферазы.
Данная группа препаратов избирательно подавляет активность ферментов, которые расщепляют дофамин: моноаминоксидаза (МАО типа Б) и катехол-О-метилтрансфераза (КОМТ). ингибиторы МАО-Б (например, селегилин, разагилин] и ингибиторы КОМТ (например, энтакапон и толкапон) замедляют неуклонное прогрессирование болезни Паркинсона. Фармакологические эффекты аналогичны леводопе, хотя их выраженность значительно меньше. Они позволяют усилить эффекты леводопы, не повышая и даже снижая её суммарную дозу.
Ингибиторы обратного нейронального захвата дофамина
Непрямые дофаминомиметики (амантадин, глудантан) повышают чувствительность рецепторов к соответствующему медиатору. Данные препараты усиливают выделение дофамина из пресинаптических окончаний и тормозят его обратный нейрональный захват. Лекарственные средства данной группы вызывают те же фармакологические эффекты, что и леводопа, то есть они преимущественно подавляют гипокинезию и мышечную ригидность, значительно меньше влияя на тремор.
Центральные холиноблокаторы
Тригексифенидил — основной препарат группы центральных холиноблокаторов, применяемых для лечения болезни Паркинсона
Для лечения паркинсонизма применяют антихолинергические средства. Знаменитый французский врач Жан Шарко ещё в 1874 году использовал белладонну для уменьшения наблюдаемой при заболевании усиленной саливации. Им также было отмечено уменьшение тремора при её приёме. В дальнейшем для лечения стали использовать не только препараты белладонны, но и другие холиноблокаторы — атропин и скополамин. После появления синтетических холинолинолитиков стали применяться тригексифенидил (циклодол), трипериден, бипериден , тропацин, этпенал, дидепил и динезин. Применение холиноблокаторов патогенетически обосновано. Поражения чёрной субстанции и других нервных образований приводит к существенным сдвигам в холин- и дофаминергических процессах, а именно повышению холинергической активности и снижению дофаминергической. Таким образом, центральные холиноблокаторы «выравнивают» нейромедиаторные взаимодействия.
Применяемые ранее препараты белладонны действуют преимущественно на периферические ацетилхолиновые рецепторы и меньше — на холинорецепторы мозга. В связи с этим терапевтическое действие данных препаратов относительно невелико. Вместе с этим они вызывают ряд побочных явлений: сухость во рту, нарушение аккомодации, задержку мочи, общую слабость, головокружение и др. Современные синтетические противопаркинсонические центральные холиноблокаторы характеризуются более избирательным действием. Они широко применяются при лечении экстрапирамидных заболеваний, а также неврологических осложнений, вызываемых нейролептиками. Отличительным свойством центральных холиноблокаторов является то, что они в большей степени воздействуют на тремор; в меньшей мере влияют на ригидность и брадикинезию. В связи с периферическим действием уменьшается слюнотечение, в меньшей степени потоотделение и сальность кожи.
Хирургические методы лечения можно разделить на два типа: деструктивные операции и стимуляцию глубинных мозговых структур.
Деструктивные операции
К деструктивным операциям, применяемым при болезни Паркинсона, относятся таломо- и паллидотомия.
Таламотомия показана лишь в тех случаях, когда основным симптомом заболевания является тремор. Для получения положительного результата от операции больные должны соответствовать нескольким критериям: болезнь Паркинсона проявляется односторонним тремором, консервативное лечение неэффективно. Показано, что разрушение вентрального промежуточного ядра таламуса (лат. nucleus ventralis intramedius) приводит к снижению тремора у больных паркинсонизмом. Согласно литературным данным, эффективность операции по устранению тремора при болезни Паркинсона достигает 96 %. При этом те же авторы отмечают высокий риск осложнений (до 1/6 — стойких и примерно 1/2 — преходящих).
К осложнениям, возникающим после таламотомии, относят дизартрию, абулию, дисфазию, диспраксию.
Паллидотомия может быть показана больным с преобладанием двигательных расстройств, для которых консервативное лечение неэффективно. Процедура заключается во введении иглы в бледный шар (лат. globus pallidus) с последующим его частичным разрушением.
Паллидотомия является относительно безопасной процедурой. При анализе 85 статей, посвящённых паллидотомии, и соответственно результатов лечения 1510 больных выделены такие осложнения данной операции: Эффективность паллидотомии при болезни Паркинсона достаточно высока. Гипокинезия в противоположных стороне операции конечностях снижается в 82 % случаев.
С развитием радиохирургии появилась новая возможность производить разрушение соответствующих нервных структур без травматизации окружающих структур и тканей.
Для получения информации о записи на прием к специалистам просим обращаться по телефонам:
8 499 324-93-39; 8 499 324-44-97, +7 906 749-98-00
или по электронной почте Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript. / Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Для просмотра адреса в вашем браузере должен быть включен Javascript. / Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Персистирующее постурально-перцептивное головокружение
Р.Г. ЕСИН, И.Х. ХАЙРУЛЛИН, Э.Р. МУХАМЕТОВА, О.Р. ЕСИН
В отечественной практике используются термины «системное головокружение» и «несистемное головокружение». К первому относят симптомы, обусловленные непосредственным поражением вестибулярного анализатора (вращательное головокружение), ко второму — нарушения равновесия, пресинкопальные эпизоды и психогенное головокружение. Для практикующего врача весьма важно при первой встрече с пациентом определить, какие ощущения описывает пациент как «головокружение». Следует предоставить пациенту несколько вариантов дескрипторов, из которых он сможет выбрать наиболее подходящий. Если пациент плохо владеет русским языком, то целесообразно пригласить его прийти на повторный визит с сопровождающим, владеющим как русским, так и родным для пациента языком. По итогам такого визита врачу необходимо отнести ощущения пациента к одной из четырех категорий. Неопределенное ощущение дурноты (англ.: lightheadedness) — часто описывается как состояние легкости и пустоты в голове, трудно вербализуемое недомогание, дезориентация в пространстве. Пациенты часто описывают постуральную неустойчивость или неясное ощущение головокружения (ощущения оцепенения, дурноты, шаткости при ходьбе, чувство утраты равновесия) или, очень редко, — ротаторное головокружение с сопутствующей вегетативной симптоматикой и тошнотой. Трудность описания этого варианта головокружения обусловлена тем, что оно, как правило, вызвано не нарушением работы систем поддержания равновесия, а страхом падения, т.е. тревожным расстройством. Именно трудности вербализации тревоги в общемедицинской практике, подмена описания собственных ощущений жалобами соматического (физикального) характера обусловливают неопределенность предъявляемых жалоб.
 Именно это расстройство рассматривается как постуральное фобическое головокружение (ПФГ).
Именно это расстройство рассматривается как постуральное фобическое головокружение (ПФГ).Скачать документ «Персистирующее поступательно-перцептивное головокружение», PDF 167 KB.
Постуральная нестабильность (нарушение равновесия и падения)
Постуральная нестабильность
Постуральная нестабильность является наименее поддающимся лечению из основных двигательных симптомов БП, но есть вещи, которые вы можете сделать, чтобы снизить риск падений.
Лучше всего начинать тренировку пораньше и делать все возможное, чтобы поддерживать хорошую осанку. Доказано, что упражнения улучшают походку и равновесие, а также уменьшают количество падений.
В дополнение к упражнениям, ранняя физиотерапия — хорошая идея.Вам не нужно ждать, пока у вас возникнут проблемы с перемещением, чтобы начать! Физиотерапевт может помочь вам разработать общий план упражнений и научить конкретным упражнениям для поддержания и улучшения равновесия и осанки.
Советы по предотвращению падений
Вот несколько основных советов, которые сделают ваш дом безопасным и доступным:
- Удалить коврики.
- Держите участки хорошо освещенными; при необходимости используйте ночники.
- Установить поручни в ванной.
- Установить поручни на все лестницы.
- Убрать беспорядок.
- Избегайте стульев на колесиках.
Полезно пройти комнату за комнатой по дому, чтобы внести необходимые коррективы, которые позволят создать более безопасную домашнюю среду.
Для полной проверки безопасности вашего дома попросите своего врача пройти оценку безопасности трудотерапевта на дому или найдите сертифицированного специалиста по старению на месте (CAPS). Вы можете найти CAPS на веб-сайте Национальной ассоциации домостроителей или по телефону 1-800-368-5242.
Советы по предотвращению обратного падения
- Не отступайте назад.
- Шаг в сторону.
- Сделайте безопасный поворот и идите вперед.
- Не стойте прямо перед дверцей духовки, холодильника, микроволновой печи или другого прибора, который вы пытаетесь открыть. Вместо этого встаньте немного в сторону и используйте «силовую стойку», положив одну руку на устойчивую поверхность.
При падении
- Сохраняйте спокойствие.Прежде чем попытаться встать, почувствуйте и поищите любую боль или возможные травмы. Тщательно планируйте свою стратегию.
- Используйте тяжелую мебель, чтобы помочь вам встать. Если вы сомневаетесь в своей способности встать в одиночестве, подползите или подбегите к телефону и обратитесь за помощью.
Если вы часто падаете, рекомендуется записаться в систему домашнего экстренного реагирования. Физиотерапевт также может помочь вам подготовить систему на случай падения.
Партнеры по уходу также должны знать, как помочь человеку встать после падения.Ремень переноса может обеспечить вам надежный захват, чтобы помочь человеку, когда он или она встанет.
Подробные инструкции о том, как встать после падения, а также дополнительную информацию и советы по осанке и равновесию, можно найти в публикации Фонда Паркинсона Fitness Counts. Позвоните на нашу горячую линию по телефону 1-800-4PD-INFO (473-4636), чтобы получить бесплатную копию.
5. Двигательные симптомы, нестабильность осанки и походка
При болезни Паркинсона потеря дофаминергических клеток в черной субстанции влияет на способность базальных ганглиев координировать тормозные и возбуждающие нервно-моторные сигналы (Kwan & Whitehall, 2011).Чистый эффект — общее снижение моторной мощности, называемое гипокинезией . К сожалению, препараты, используемые для лечения БП, могут вводить слишком много дофамина, вызывая чрезмерную активацию двигательной системы и вызывая дискинезий (фрагментированные или резкие движения, спазмы или тики). Двигательные симптомы, связанные с БП, влияют на все аспекты повседневной деятельности, походки, устойчивости позы и подвижности.
Двигательные симптомы, связанные с БП, влияют на все аспекты повседневной деятельности, походки, устойчивости позы и подвижности.
Тремор, ригидность, брадикинезия и дискинезия
Одним из первых видимых двигательных симптомов, которые появляются при БП, является тремор покоя конечности, которая поддерживается и находится в состоянии покоя.Тремор обычно начинается на одной стороне тела (часто в одной руке) с частотой от 3 до 7 циклов в секунду. Тремор обычно менее выражен или даже отсутствует при произвольном движении и может усиливаться во время эмоционального стресса. Тремор считается одним из основных симптомов болезни Паркинсона — в некоторых исследованиях сообщается, что он присутствует у 80% пациентов с БП, подтвержденной аутопсией (Довженок и Рубчинский, 2012).
Ригидность — еще один распространенный видимый моторный симптом, связанный с БП.Это тип повышенного мышечного тонуса, который обычно определяется как повышенное сопротивление пассивному движению сустава. Жесткость, как правило, более выражена в мышцах-сгибателях туловища и конечностей, вызывая характерную сутулость. Есть два типа жесткости: свинцовая труба и зубчатое колесо. Жесткость свинцовой трубы определяется как постоянное сопротивление движению во всем диапазоне движений. Жесткость зубчатого колеса относится к сопротивлению, которое останавливается и начинается, когда конечность перемещается в пределах своего диапазона движения.
Брадикинезия , еще одна кардинальная моторная особенность БП, имеет неизвестную причину и остается предметом споров. Он определяется как замедленное произвольное движение , хотя теперь мы знаем, что жесткость также влияет на автоматические движения, такие как раскачивание рук и ног во время походки.
Одна теория предполагает, что брадикинезия — это компенсаторная реакция, предназначенная для замедления произвольных движений и повышения точности движений. Другая гипотеза предполагает, что это вызвано дефицитом производства силы. Теория производства силы была опровергнута исследованиями, демонстрирующими, что люди с болезнью Паркинсона способны достичь адекватных мышечных сокращений при нейрофизиологическом тестировании. Некоторые исследователи предположили, что брадикинезия, а не просто проявление моторной медлительности (скорости движения и инициации), может отражать специфический нервный дефицит, возникающий в полосатом теле (Shiner et al., 2012).
Теория производства силы была опровергнута исследованиями, демонстрирующими, что люди с болезнью Паркинсона способны достичь адекватных мышечных сокращений при нейрофизиологическом тестировании. Некоторые исследователи предположили, что брадикинезия, а не просто проявление моторной медлительности (скорости движения и инициации), может отражать специфический нервный дефицит, возникающий в полосатом теле (Shiner et al., 2012).
Одной из поразительных клинических характеристик брадикинезии является ее вариабельность, когда один и тот же пациент может достигать ощутимо разной скорости движения в разных контекстах.Крайним проявлением этой изменчивости является парадоксальная кинезия , при которой пациенты внезапно могут двигаться со скоростью, близкой к нормальной, что может происходить в экстремальных, отталкивающих условиях (Shiner et al., 2012).
Среди основных осложнений БП — наличие дискинезии. Дискинезии состоят из ненормальных движений (например, движения головы, шеи, конечностей), которые изнуряют, физически утомляют и вызывают смущение. Несколько отчетов показали, что частота этой проблемы варьируется от 19% до 80% у пациентов с БП (Lokk & Delbar, 2012).
Баланс, ориентация и контроль осанки
Balance — это способность автоматически и точно поддерживать центр масс над базой опоры. Постуральная ориентация — это способность управлять сегментами своего тела относительно друг друга и силы тяжести с учетом окружающей среды и выполняемой задачи. Контроль осанки включает в себя как равновесие, так и осанку.
Контроля осанки имеет как опорно-двигательный аппарат компоненты (диапазон движения, гибкость, мышечную функцию и биомеханические отношения между сегментами тела) и двигательными процессами, которые организуют мышцы в нервно-мышечную синергию.Баланс также включает нейронные компоненты — сенсорные и перцептивные процессы, которые объединяют входные данные соматосенсорной, зрительной и вестибулярной систем, а также процессы более высокого уровня, которые вносят вклад в упреждающие и адаптивные аспекты постурального контроля (Shumway-Cook & Woollacott, 2012).
Плохое равновесие и нестабильная осанка обычно наблюдаются двигательные симптомы у людей с БП. До недавнего времени считалось, что это происходит относительно поздно в ходе болезни. Это отражено шкалой Хоэна и Яра, в которой постуральная нестабильность представлена только на поздних стадиях заболевания (стадии с 3 по 5).Однако есть убедительные доказательства того, что изменения в контроле позы происходят даже на ранних стадиях болезни Паркинсона и, хотя есть колебания, обычно со временем усиливаются (Maetzler et al., 2012).
При ранней стадии болезни Паркинсона функциональные нарушения могут быть минимальными. При выполнении простых движений и походок ходьба может быть замедлена, а длина шага — уменьшена. Тем не менее, изменение контроля позы часто проявляется во время выполнения стоячих задач наряду с трудностями при повороте.Трудность поворота становится чувствительным индикатором более высокой распространенности замерзания и падений у людей с продвинутой стадией болезни Паркинсона (Song et al., 2012).
Нарушение походки
Изменения походки являются отличительной чертой PD, со снижением скорости, уменьшением длины шага, изменением частоты вращения педалей и повышенной вариабельностью походки. Хотя аномалии походки не выражены на ранних стадиях, их распространенность и тяжесть возрастают по мере прогрессирования заболевания. В течение 3 лет после постановки диагноза более чем у 85% людей с клинически вероятной БП развиваются проблемы с походкой.Потенциальные последствия нарушения походки при БП значительны и включают повышенную инвалидность, повышенный риск падений и снижение качества жизни (Kelly et al., 2012).
По мере прогрессирования болезни люди с БП обычно демонстрируют шаркающую походку с наклоненной вперед позой и асимметричным махом рук ( оплодотворяющая походка ). Эти характеристики требуют большого количества энергии, поэтому обычная ходьба позволяет человеку достичь максимальной или почти максимальной метаболической способности (Hass et al. , 2012).Нарушения походки усугубляются наличием брадикинезии, ригидности и постуральной нестабильности (Shumway-Cook & Woollacott, 2012).
, 2012).Нарушения походки усугубляются наличием брадикинезии, ригидности и постуральной нестабильности (Shumway-Cook & Woollacott, 2012).
При кинематических исследованиях людей с болезнью Паркинсона обычно наблюдаются эти изменения походки:
- Отсутствие удара пяткой — ступня сначала приземляется либо на плоскую, либо на переднюю часть стопы
- Неполное разгибание колена во время фазы опоры
- Неспособность разогнуть колено и согнуть голеностоп в конечной стойке
- Наклон ствола передний
- Отсутствие движения в багажнике
- Пониженный или отсутствующий поворот рычага
- Уменьшение зазора между пальцами ног
- Пониженная скорость и амплитуда (Shumway-Cook & Woollacott, 2012)
Дефицит однозадачной ходьбы, при котором не требуется никаких других действий, кроме ходьбы, был связан с множеством двигательных симптомов при БП.Например, повышенная жесткость связана с ухудшением результатов при выполнении однозадачных измерений баланса и функциональной мобильности. Ригидность может способствовать уменьшению смещения суставов нижних конечностей и согнутой позе вперед при ходьбе. Брадикинезия может привести к сокращению длины шага и снижению скорости походки во время ходьбы. Постуральная нестабильность может способствовать нарушениям походки, таким как повышенная вариабельность от шага к шагу и поддержка двойной конечности (Kelly et al., 2012).
Нарушения равновесия и походки могут привести к снижению качества жизни.Фактически, люди с болезнью Паркинсона считают ограничения подвижности и ходьбы одними из худших аспектов болезни (Kelly et al., 2012). Пациенты последовательно определяют улучшение ходьбы как наиболее значимый результат при оценке эффективности лечения болезни Паркинсона (Hass et al., 2012).
Замораживание походки
Заморозка походки (ВОГ) — периодическая неспособность эффективно шагать. Это неизменно рассматривается как один из самых тяжелых и выводящих из строя симптомов болезни Паркинсона.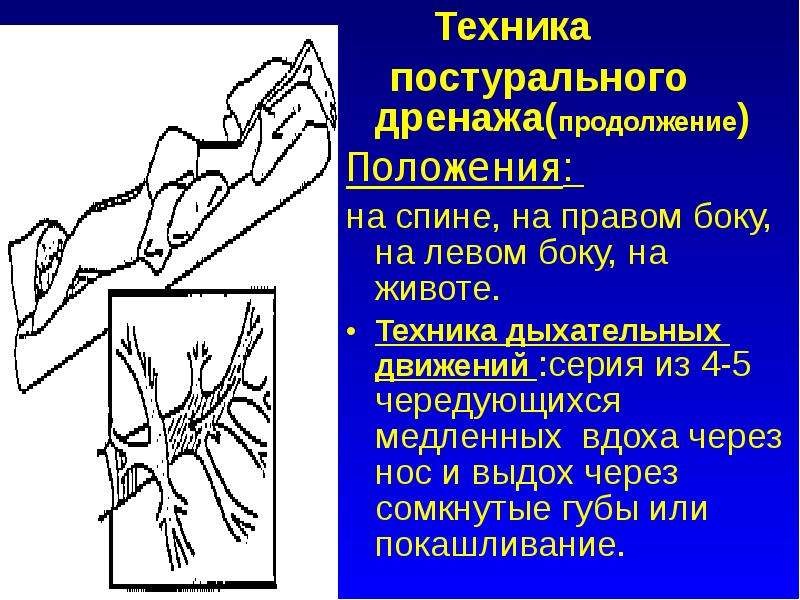 Пациенты часто описывают ВОГ как ощущение, что их ноги «прилипают к полу»; или «приклеены к земле», несмотря на попытки заставить себя ходить.ВОГ увеличивается с продолжительностью заболевания; примерно 30% пациентов с БП испытывают ВОГ в течение 5 лет и почти 60% — через 10 лет (Lo et al., 2010).
Пациенты часто описывают ВОГ как ощущение, что их ноги «прилипают к полу»; или «приклеены к земле», несмотря на попытки заставить себя ходить.ВОГ увеличивается с продолжительностью заболевания; примерно 30% пациентов с БП испытывают ВОГ в течение 5 лет и почти 60% — через 10 лет (Lo et al., 2010).
FOG в основном срабатывает в начале ходьбы и во время поворота, но также при столкновении с узкими пространствами (например, дверными проемами) или при приближении к целям. Его продолжительность обычно составляет менее 10 секунд и редко превышает 30 секунд. Введение L-допы может уменьшить ВОГ, который чаще возникает при прекращении приема лекарств, что указывает на дефицит дофамина в качестве причины (Arias & Cudeiro, 2010).
Клиническое лечение ВОГ в значительной степени ограничено сложностью оценки его тяжести, и в этой области преобладали субъективные критерии. Пункт 14 (часть III) единой шкалы оценки болезни Паркинсона (замирание при ходьбе) оценивает пациентов по шкале от 0 (нет) до 4 (частые падения от замерзания) на основе истории болезни. Это был первичный критерий оценки (UPDRS 14 ≥1), использованный в большом исследовании селегилина * в качестве профилактического лечения FOG на ранних стадиях болезни Паркинсона (Moore et al., 2013).
Ряд исследований по прогнозированию показал, что нарушение постурального контроля и остановка походки (FOG) являются мощными детерминантами повторяющихся падений. Эпизод FOG может проявляться в значительном уменьшении размера шага (шаркающая походка), дрожании в коленях или полной акинезии, что приводит к внезапной остановке ходьбы. Во время замерзания центр тяжести может продолжать двигаться вперед, в то время как ступни перестают двигаться; это приводит к дисбалансу, который нельзя исправить компенсационными мерами, и, следовательно, увеличивает риск падения.В одном исследовании пациенты с болезнью Паркинсона не могли начать компенсаторное шагание и демонстрировали дрожащие движения колен, похожие на ВОГ, когда равновесие было нарушено с помощью внезапного движения платформы вперед. Эти данные свидетельствуют о дефиците постурального контроля и, в частности, о неспособности сочетать баланс и произвольную локомоторную синергию (Vervoort et al., 2013).
Эти данные свидетельствуют о дефиците постурального контроля и, в частности, о неспособности сочетать баланс и произвольную локомоторную синергию (Vervoort et al., 2013).
Дефицит постурального контроля у людей с ВОГ может также возникать во время произвольного изменения веса. Как часть повторяющейся задачи шагания, морозильные камеры показывают быстрый, небольшой и неэффективный перенос веса между ногами, который связан с эпизодами замерзания.Кроме того, как периферическая проприоцептивная обратная связь, так и аномалии центральной сенсорной обработки были приписаны дефициту постурального контроля при БП (Vervoort et al., 2013).
Анкета «Замораживание походки» (FOG-Q) и новый FOG-Q (NFOG-Q) недавно были предложены в качестве чувствительных инструментов для определения поведения FOG и оценки эффективности вмешательств. Однако ни оценка FOG-Q, ни NFOG-Q не коррелировали с тяжестью (частотой или продолжительностью) эпизодов обморожения во время ходьбы в недавнем исследовании пациентов с БП с самооценкой FOG (Moore et al., 2013).
Оценка видеозаписей передвигающихся пациентов использовалась для определения количества событий FOG с использованием одного, двух или трех наблюдателей. Этот метод стал золотым стандартом de facto за последнее десятилетие. Недавнее исследование с участием десяти опытных оценщиков из четырех ведущих центров PD, которые оценивали видео из «морозильных камер», обнаружило лишь умеренное межэкспертное согласие по количеству событий FOG, а внутриэкспертная надежность была чрезвычайно низкой (Moore et al., 2013).
Существующие варианты лечения ВОГ в значительной степени неэффективны. Повышенная распространенность обморожения наблюдается на поздних стадиях заболевания и в клиническом «выключенном» или немедикаментозном состоянии, что подчеркивает ключевую роль истощения дофамина в полосатом теле в его патогенезе. Увеличение дозировки леводопы может снизить частоту замораживания в нерабочем состоянии без изменения основной патофизиологии, вероятно, за счет увеличения порога возникновения ВОГ. Однако FOG обычно показывает только частичную реакцию на леводопу, и преимущества увеличения дозировки леводопы для снижения FOG должны быть сбалансированы с повышенной вероятностью дискинезий, вызванных леводопой, также связанных с большим риском падений (Moore et al., 2013).
Однако FOG обычно показывает только частичную реакцию на леводопу, и преимущества увеличения дозировки леводопы для снижения FOG должны быть сбалансированы с повышенной вероятностью дискинезий, вызванных леводопой, также связанных с большим риском падений (Moore et al., 2013).
Пациентам может быть проведена операция по глубокой стимуляции головного мозга для облегчения симптомов вневременного ВОГ, хотя эти хирургические вмешательства в настоящее время рассматриваются как вариант лечения только на более поздних стадиях БП. Клиническое ведение дофаминергической терапии для минимизации FOG, а также оценка новых целевых вмешательств выиграют от разработки объективных стандартизированных мер FOG, способных контролировать этот изнурительный симптом в условиях сообщества (Moore et al., 2013).
Алан: Жизнь с болезнью Паркинсона
Первоначально Sinemet лечил тремор, но по мере того, как болезнь прогрессировала, я начал испытывать новые проблемы. Мне нужна была помощь, чтобы разрезать еду, и как только она была разрезана, я не знала, смогу ли я держать ее на вилке.
В 2004 году я поехал в Коста-Рику, чтобы навестить друзей, которые там вышли на пенсию. Выйдя из самолета в Сан-Хосе, я впервые испытал «заморозку Паркинсона».
Я не мог пошевелить ногами.Как будто их приклеили к полу.
Ко мне подошел незнакомец и спросил, есть ли у меня болезнь Паркинсона. Я сказал ему да, и он сказал, что позаботится обо мне. Он заказал мне инвалидную коляску и отвез меня к месту выдачи багажа, через таможню и к моим друзьям, которые ждали снаружи терминала.
У меня была тяжелая неделя в Коста-Рике. Мне было очень трудно ходить, и я впервые испугалась этой болезни.
Невероятно, но тот же человек, который помогал мне в аэропорту Сан-Хосе, был пассажиром моего обратного рейса, и он помогал мне в конце поездки, пока мы не нашли мою жену Дайан.Этот человек сказал мне, что у его начальника болезнь Паркинсона, и он распознал симптомы по тому, как я пытался сделать шаг.
Я вернулся к своему невропатологу, который назначил мне Сталево и Реквип.
По совету друга я также посетил специалиста по акупунктуре, который начал вводить мне в руки иглы каждый день. Он посоветовал мне выполнять упражнения на растяжку и внести изменения в мою диету. По сей день не знаю, что помогло больше всего, но лекарства помогали надолго.
Трудности при двойной ходьбе
[Этот раздел взят в основном из Kelly et al., 2012.]
В нескольких исследованиях изучается нарушение походки, когда ходьба выполняется одновременно с другим заданием, называемым ходьбой с двойным заданием . Двойная ходьба требует одновременного выполнения ходьбы и другой физической или когнитивной задачи. Параллельные когнитивные задачи могут включать мысленное отслеживание, арифметические вычисления, разговорные задачи и задачи памяти. Параллельные двигательные задачи могут включать переноску предметов или манипулирование ими во время ходьбы.
Люди с PD сообщают, что ходьба при выполнении другой задачи — одна из самых серьезных проблем повседневной мобильности.Они также описывают необходимость использования концентрации для контроля и коррекции ходьбы, что согласуется с первоначальным наблюдением Джеймса Паркинсона, что «ходьба становится задачей, которую невозможно выполнить без значительного внимания».
Несколько механизмов, специфичных для БП, могут способствовать дефициту ходьбы при выполнении двойных задач. Один из таких механизмов обозначен как с уменьшенным автоматом хода . Автоматичность — это способность выполнять умелое движение без сознательного или исполнительного контроля или внимания, направленного на движение.
Предполагается, что базальные ганглии играют ключевую роль в автоматическом контроле движений. Дисфункция базальных ганглиев может привести к снижению автоматизма движений и необходимости большей зависимости от когнитивных ресурсов для управления движениями. Если снижение автоматизма движений способствует дефициту ходьбы с двумя задачами у людей с БП, стратегии реабилитации, разработанные для улучшения автоматического контроля ходьбы, должны улучшить ходьбу с двумя задачами.
Если снижение автоматизма движений способствует дефициту ходьбы с двумя задачами у людей с БП, стратегии реабилитации, разработанные для улучшения автоматического контроля ходьбы, должны улучшить ходьбу с двумя задачами.
Опосредованная дофамином дисфункция базальных ганглиев также может вносить вклад в дефицит двойной ходьбы при БП.Дегенерация дофаминергических нейронов при БП, по-видимому, влияет как на моторные, так и на когнитивные цепи в базальных ганглиях. Дефицит двойного действия при ходьбе устраняется противопаркинсоническими препаратами, что подтверждает идею о том, что моторные и когнитивные нарушения частично связаны с дофаминергическими путями. Воздействие антипаркинсонических препаратов может быть ограничено теми нарушениями, которые опосредованы дисфункцией дофамина, и многие исследования демонстрируют дефицит двойной ходьбы у людей с болезнью Паркинсона, находящихся «на» лечении.
Наличие недофаминергической патологии, которая может влиять как на походку, так и на познавательные способности, также может способствовать дефициту двойной ходьбы при БП. Все чаще считается, что патология БП не ограничивается дофамином, но включает другие системы нейротрансмиттеров, такие как серотонин, норэпинефрин (норадреналин) или ацетилхолин. Дисфункция нескольких систем нейромедиаторов может способствовать ухудшению походки и когнитивным нарушениям. В соответствии с этой идеей, дефицит двойной ходьбы сохраняется даже при оптимальном лечении пациентов с болезнью Паркинсона.
Прогулка по сообществу
[Этот раздел основан на Lamont et al., 2012.]
Люди, страдающие болезнью Паркинсона, сталкиваются с целым рядом проблем. Самостоятельное функционирование связано с нашей способностью эффективно ходить, а общественная прогулка позволяет нам участвовать в различных общественных, рабочих и развлекательных мероприятиях. Это включает в себя возможность согласовывать общественные и частные места, как внутри, так и на открытом воздухе, которые предъявляют различные экологические требования. Люди с болезнью Паркинсона часто сталкиваются с препятствиями окружающей среды для ходьбы в сообществе, но обычно не сообщают об инвалидности; скорее они изменяют свое поведение.
Люди с болезнью Паркинсона часто сталкиваются с препятствиями окружающей среды для ходьбы в сообществе, но обычно не сообщают об инвалидности; скорее они изменяют свое поведение.
Современные клинические методы оценки мобильности сообщества, в которых основное внимание уделяется скорости походки или расстоянию, могут не предоставить достаточной информации, чтобы точно отразить способность человека ходить в сообществе. Более глубокое понимание доклинической инвалидности при ходьбе может позволить терапевтам проводить более своевременную оценку и терапию, отсрочивая наступление инвалидности, а не пытаясь обратить ее вспять после ее проявления.
В недавнем австралийском исследовании изучались факторы, влияющие на способность человека ходить в обществе. Восемнадцати участникам с PD спросили, какие факторы помогают или препятствуют их мобильности в сообществе. Участники рассмотрели несколько факторов, связанных с успешным передвижением по месту жительства, включая скорость ходьбы, планирование и подготовку, поездку в отпуск, управление приемом лекарств, роль партнера, пешеходные переходы и препятствия для ходьбы в сообществе.
Внимание к скорости ходьбы
Общей стратегией, о которой сообщили участники исследования, была необходимость сознательно обращать внимание на скорость ходьбы, длину шага и расстояние между пальцами ног.Большинство людей сообщили, что они либо сконцентрировались на ходьбе, либо проявляли особую осторожность при ходьбе. Сознательное выполнение длинных ритмичных шагов обычно использовалось для помощи при ходьбе в сообществе, но несколько участников сообщили, что использование этой стратегии в среде сообщества было менее автоматическим, чем дома (Lamont et al., 2012):
«Если вы идете медленнее, поднимаете ноги и концентрируетесь, это помогает».
“. . Вы должны попытаться подумать и не забыть сделать это, например, подумать и убедиться, что вы это делаете.. . попробуй выйти и больше поднять ноги ».
Планирование и подготовка
Участники исследования отметили, что планирование и подготовка сыграли ключевую роль в успехе передвижения по месту жительства. Почти все сообщили, что планирование походов совпало со временем высокой эффективности лекарств (временем «включения»). Подготовка к прогулкам, составление плана и соблюдение этого плана снижает вероятность опоздания, ощущения спешки и совершения таких ошибок, как забывание приема лекарств.Поручения также были тщательно организованы, чтобы обеспечить кратчайшие пешие прогулки. Участники исследования сообщили, что при использовании этих стратегий чувствовали меньше стресса (Lamont et al., 2012).
Почти все сообщили, что планирование походов совпало со временем высокой эффективности лекарств (временем «включения»). Подготовка к прогулкам, составление плана и соблюдение этого плана снижает вероятность опоздания, ощущения спешки и совершения таких ошибок, как забывание приема лекарств.Поручения также были тщательно организованы, чтобы обеспечить кратчайшие пешие прогулки. Участники исследования сообщили, что при использовании этих стратегий чувствовали меньше стресса (Lamont et al., 2012).
Путешествие в отпуск
Прогулка в сообществе, связанная с новой или приятной ситуацией, обсуждалась несколькими участниками исследования и поддерживалась их партнерами. В частности, участники описали уменьшение симптомов и меньшую усталость во время путешествий в отпуске, чем они обычно испытывали дома, и это изменение может длиться несколько недель после их возвращения (Lamont et al., 2012):
«Возвращаясь к трем годам, когда [моя жена], я бы сказал, страдала полной болезнью Паркинсона, ей было очень, очень плохо. Мы совершили заграничную поездку и. . . [моя жена] просто продолжала идти и идти. К тому времени, как мы добрались до Франции, я рассыпался. . . Она все еще продолжала идти. . . Что-то поддерживало ее, потому что, как только мы вернулись домой, бум, она снова заболела Паркинсоном, но пока мы были в отъезде, это, похоже, не повлияло на нее ».
Оптимальное лечение лекарствами
Сообщенные эффекты антипаркинсонических препаратов на ходьбу были разными.Лекарства улучшают некоторые аспекты однозадачной ходьбы, включая скорость походки и длину шага, но могут не влиять на другие аспекты, такие как изменчивость шага к шагу, оплодотворение и застывание походки. Оптимальное лечение было связано с более эффективной походкой и меньшим утомлением, что делало ходьбу на длинные дистанции более возможной. Положительный ответ на хирургическое вмешательство позволил одному участнику исследования освободиться от графика приема лекарств, что позволило проводить общественные прогулки в удобное время по причинам, не связанным с эффективностью лечения (Lamont et al.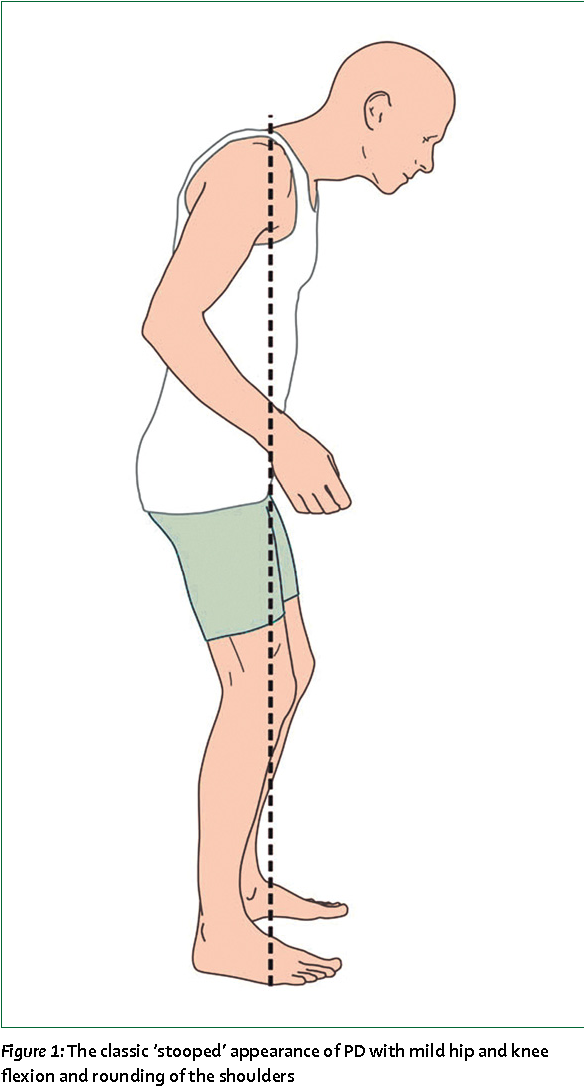 , 2012):
, 2012):
«Мне это нравится, мне нравится независимость, и мне нравится ходить по магазинам, а не лекарства».
Роль партнера
Некоторые участники исследования и их партнеры сообщили, что партнеры сыграли решающую роль в мобильности, побуждая участников выходить на улицу, пропагандируя важность ходьбы, оказывая физическую помощь для преодоления препятствий в окружающей среде и поддерживая использование внимания или стратегии подсказки.Эффективные стратегии подсказок были дискретными, взаимно согласованными и практиковались во избежание использования контрпродуктивных сигналов (Lamont et al., 2012).
Пешеходный переход
Только один аспект физической среды был описан как способствующий пешеходной прогулке в сообществе, но это было подчеркнуто большинством участников исследования: пешеходные переходы с сигналами. Участники сообщили, что сигнальные пешеходные переходы уменьшают внимание, необходимое для отслеживания движения и принятия решения о безопасном переходе, и, следовательно, облегчают пешеходные прогулки в сообществе.Для ряда участников это стало привычкой, теперь делается бескомпромиссно (Lamont et al., 2012):
“. . . ты никогда не пытаешься включить свет, ты всегда ждешь светофора и не переходишь дорогу, если на нем нет светофора ».
Препятствия для общественного хождения
Участники сообщили о ряде внешних препятствий при ходьбе в сообществе. Подавляющее большинство людей не любили переполненную среду. Участники рассказали, что необходимость менять направление и избегать препятствий при ходьбе в загроможденной или густонаселенной среде была спусковым крючком для коротких, шаркающих шагов и более частых эпизодов замерзания (Lamont et al., 2012):
«Мне труднее, когда вокруг много людей, значит, нужно делать более короткие шаги. Мне нравится делать длинные шаги, я могу лучше удерживать равновесие ».
Характеристики поверхности для ходьбы, такие как неровные пешеходные дорожки, холмы, пандусы, движущиеся пешеходные дорожки и скользкие поверхности, были зарегистрированы как причина повышенной утомляемости, страха падения и более частых эпизодов замерзания. Даже изгиб пешеходной дорожки, спроектированный так, чтобы вода могла стекать, обычно затрудняла ходьбу (Lamont et al., 2012):
Даже изгиб пешеходной дорожки, спроектированный так, чтобы вода могла стекать, обычно затрудняла ходьбу (Lamont et al., 2012):
«Моя самая большая трудность, когда я иду, — это спуск с горы. Не могу с этим справиться. Я могу идти ровно в гору, но не могу спуститься с горы. Даже с тележкой мои ноги застревают на пандусе, и я не могу двинуться с места ».
Алан: Жизнь с болезнью Паркинсона
Еще одно состояние, с которым я столкнулся, — это жжение и покалывание в ногах. Это странное ощущение, которое имеет тенденцию ухудшаться, когда я сижу или стою в течение длительного периода времени. Иногда я чувствую, что мои ноги очень тяжелые.
По ощущениям жжения, покалывания и «тяжести» в ногах мой врач заподозрил невропатию или синдром беспокойных ног и прописал мне габапентин.
Из-за симптомов стопы стало неудобно ходить, поэтому около месяца назад я прекратила свои ежедневные прогулки в парке. Это было плохим поступком. Я начал волочить ноги и снова заколебался, когда сделал шаг.
Ну, короче говоря, на прошлой неделе я начал ходить в Target с моим другом Фрэнком.Я уже лучше хожу, и мне не нужны отговорки.
Постуральная нестабильность при идиопатической болезни Паркинсона: роль лекарств и односторонней паллидотомии | Мозг
Абстрактные
Постуральная нестабильность (ИП) часто встречается при идиопатической болезни Паркинсона (ИПБ). Мы измерили сенсорный и моторный вклад в ИП у 50 пациентов с продвинутой стадией ИПИ, которые не принимали и не принимали лекарства, а также в подгруппе до и через 3, 6 и 12 месяцев после односторонней паллидотомии, используя компьютерную динамическую постурографию [в частности, Тест сенсорной организации (SOT ) и подшкалы PIGD Объединенной шкалы оценки болезни Паркинсона (UPDRS) (постуральная нестабильность и нарушение походки)].Без лечения все пациенты имели ненормальные показатели PIGD. Группу можно было разделить на тех, у кого были нормальные баллы равновесия SOT (SOTN), и тех, у большинства из которых наблюдался аномальный постуральный контроль, когда сенсорная обратная связь была ограничена (SOTABN). Медикаменты улучшили показатели PIGD, но ухудшили показатели SOT у большинства пациентов. Увеличение спонтанного колебания у некоторых пациентов способствовало отрицательному влиянию лекарств на показатели SOT. Однако это не могло объяснить пагубное влияние лекарств на показатели SOT по крайней мере у 40% пациентов.С другой стороны, паллидотомия улучшила показатели PIGD и SOT в обеих группах. Предиктором хорошего результата паллидотомии в отношении ИП была степень ухудшения эффекта, оказываемого лекарством на баллы SOT5. ИП в ИПД оказывается многофакторным. Мы предполагаем, что оценка PIGD отражает сенсорные и моторные аспекты постурального контроля с нормальной сенсорной обратной связью, в то время как баллы равновесия SOT измеряют сенсорный организационный процесс постурального контроля в присутствии измененных сенсорных входов.Существует диссоциация между эффектами лекарств и паллидотомии на моторные и сенсорные компоненты постурального контроля, что может отражать лежащий в основе патофизиологический механизм, ответственный за эти различные компоненты ИП. Мы предлагаем пациентам с прогрессирующим IPD и PI, принимающим лекарства, рассмотреть возможность адъювантного хирургического лечения для лучшего контроля осанки.
Медикаменты улучшили показатели PIGD, но ухудшили показатели SOT у большинства пациентов. Увеличение спонтанного колебания у некоторых пациентов способствовало отрицательному влиянию лекарств на показатели SOT. Однако это не могло объяснить пагубное влияние лекарств на показатели SOT по крайней мере у 40% пациентов.С другой стороны, паллидотомия улучшила показатели PIGD и SOT в обеих группах. Предиктором хорошего результата паллидотомии в отношении ИП была степень ухудшения эффекта, оказываемого лекарством на баллы SOT5. ИП в ИПД оказывается многофакторным. Мы предполагаем, что оценка PIGD отражает сенсорные и моторные аспекты постурального контроля с нормальной сенсорной обратной связью, в то время как баллы равновесия SOT измеряют сенсорный организационный процесс постурального контроля в присутствии измененных сенсорных входов.Существует диссоциация между эффектами лекарств и паллидотомии на моторные и сенсорные компоненты постурального контроля, что может отражать лежащий в основе патофизиологический механизм, ответственный за эти различные компоненты ИП. Мы предлагаем пациентам с прогрессирующим IPD и PI, принимающим лекарства, рассмотреть возможность адъювантного хирургического лечения для лучшего контроля осанки.
Введение
Постуральная нестабильность (PI) или нарушение равновесия часто встречается при идиопатической болезни Паркинсона (IPD), особенно по мере того, как болезнь прогрессирует.Механизмы нарушения равновесия могут способствовать травмам, связанным с падением, ограничению походки и снижению подвижности. Эти нарушения приводят к потере функциональной независимости и социальной изоляции.
Термин «баланс» относится к мультисистемной функции, которая стремится удерживать тело в вертикальном положении во время сидения или стоя и при изменении позы. Баланс необходим, чтобы держать тело ориентированного надлежащим образом при выполнении добровольной деятельности, во внешних возмущениях и, когда опорная поверхность или среды изменений.
Хорак и др. . (1992) предположили, что баланс (постуральная стабильность) требует трех различных процессов: (i) сенсорная организация, в которой одно или несколько ориентировочных чувств (соматосенсорное, зрительное и вестибулярное) задействованы и интегрированы в ЦНС; (ii) процесс двигательной адаптации, связанный с выполнением скоординированных и правильно масштабированных нервно-мышечных реакций; и (iii) фоновый тонус мышц, через который происходит изменение баланса.
Организация ориентировочных чувств понимается как адаптивная иерархическая система (Nashner et al ., 1982). Есть две основные системы отсчета для сенсорного представления положения тела по отношению к пространству (Horak and Macpherson, 1996; Massion, 1998; Mergner and Rosemeier, 1998). На более низком уровне взвешенная комбинация ориентационных входов напрямую опосредует активность постуральных мышц и в основном контролирует положение горизонтального центра тяжести (COG) (организация снизу вверх). На более высоком уровне, вестибулярные входы обеспечивают ориентационную ссылку, против которой конфликты в опорной поверхности и визуальной ориентации идентифицируется и сочетание входов, приспособленная к условиям задачи (сверху вниз) организации.Для устойчивости позы информация нижнего уровня должна быть согласована с инерциально-гравитационным эталоном более высокого уровня, и любые конфликтующие входные данные ориентации должны быть быстро подавлены в пользу тех, которые соответствуют внутреннему эталону. Таким образом, у взрослых сенсорный организационный процесс зависит от контекста (Nashner и др. ., 1982; Woollacott и др. ., 1986) из-за быстрого взвешивания и повторного взвешивания сенсорных входов на нижний уровень и обратно с помощью адаптивный процесс более высокого уровня.
Из-за целостного характера равновесия и устойчивости позы, одно объективное измерение невозможно. Функциональные меры, используемые в реабилитационных условиях, такие как функциональный охват и задачи по внешнему возмущению (Smithson et al . , 1998), хорошо служат своей цели, но менее подходят для числовых данных о результатах. Клинические показатели постурального контроля при IPD выводятся из пунктов стандартизированных клинических рейтинговых шкал, таких как Единая рейтинговая шкала болезни Паркинсона (UPDRS) (Fahn et al ., 1987). Общепринятая оценка постуральной нестабильности и нарушения походки (PIGD) включает исторические вопросы, связанные с падением, ходьбой и замерзанием, а также объективные оценки способности пациента изменять позу, ходить и сохранять равновесие во время ретропульсивного или пропульсивного толчка (Lozano et al ., 1995). Тесты, составляющие оценку PIGD, выполняются при нормальных сенсорных условиях и, следовательно, могут более серьезно влиять на моторную регулировку компонента постурального контроля.
, 1998), хорошо служат своей цели, но менее подходят для числовых данных о результатах. Клинические показатели постурального контроля при IPD выводятся из пунктов стандартизированных клинических рейтинговых шкал, таких как Единая рейтинговая шкала болезни Паркинсона (UPDRS) (Fahn et al ., 1987). Общепринятая оценка постуральной нестабильности и нарушения походки (PIGD) включает исторические вопросы, связанные с падением, ходьбой и замерзанием, а также объективные оценки способности пациента изменять позу, ходить и сохранять равновесие во время ретропульсивного или пропульсивного толчка (Lozano et al ., 1995). Тесты, составляющие оценку PIGD, выполняются при нормальных сенсорных условиях и, следовательно, могут более серьезно влиять на моторную регулировку компонента постурального контроля.
В нескольких исследованиях использовалась компьютерная динамическая постурография для изучения сенсорного организационного процесса при ИПИ (Бронштейн и др. ., 1990; Уотерстон и др. ., 1993; Тренквальдер и др. ., 1995; Тул и др. . , 1996; Chong et al ., 1999), но результаты были неоднозначными, возможно, из-за различий в использовании лекарств, испытанных условиях и методах анализа.
Многие пациенты с ИПИ отмечают, что их «баланс» ухудшается при приеме лекарств.Предлагаемая этиология этого явления предполагает, что увеличение подвижности, вызванное приемом лекарств, сочетается с более медленным временем реакции, связанным с заболеванием, что снижает постуральную стабильность. Подразумевается, что в результате пациенты, принимающие лекарства, с большей вероятностью будут отклоняться от предела, необходимого для поддержания вертикального положения, и, следовательно, с большей вероятностью не смогут вовремя поправиться до потери равновесия.
Хирургическое лечение ИПИ в настоящее время широко применяется на поздних стадиях заболевания, когда эффективность лекарств снижается из-за осложнений двигательной реакции, таких как дискинезии и непредсказуемые и колеблющиеся двигательные состояния.Возрождение хирургического лечения болезни Паркинсона в 1990-х годах началось с абляционного лечения, такого как паллидотомия. Хотя технология превратилась в глубокую стимуляцию мозга, было обнаружено, что аккуратно размещенные односторонние паллидные поражения являются успешным адъювантным лечением при запущенной болезни Паркинсона. В большинстве исследований односторонней паллидотомии, в которых оценивались результаты через ≥6 месяцев после операции, сообщалось об устойчивом улучшении на ≥25% баллов моторного контроля, измеренных с помощью моторного подшкала UPDRS-III (Svennilson et al ., 1960; Laitinen и др. , 1992; Dogali et al., , 1995; Lozano и др. , 1995; Baron и др. , 1996; Fazzini и др. , 1997; Кишор и др. , 1997; Lang et al., , 1997; Giller и др. , 1998; Masterman и др. , 1998; Самуэль и др. , 1998; Скотт и др. , 1998; Шеннон и др. , 1998; Baron и др. , 2000; Fine et al ., 2000).
В отличие от моторного контроля, влияние паллидотомии на ИП было трудно оценить.Около половины исследований, сообщающих о долгосрочных клинических результатах паллидотомии, конкретно комментировали постуральный контроль. Измерение постурального контроля варьировалось от качественных комментариев до единственной меры постурального контроля, оценки ретропульсии по шкале UPDRS-III (Fahn и др. , 1987) до суб-оценки PIGD (Lozano и др. . , 1995). Долговременного улучшения постурального контроля обычно не наблюдалось.
Наша общая цель состояла в том, чтобы понять влияние терапевтических вмешательств, таких как лекарства и / или хирургическое вмешательство, на ИП при ИПИ.Мы использовали клинические измерения PI из UPDRS и измерения сенсорного организационного процесса постурального контроля с использованием компьютерной динамической постурографии, чтобы ответить на следующие вопросы: какова природа PI в группе пациентов с умеренным и продвинутым IPD? Является ли ИП следствием аномалий сенсорно-организационного процесса, аномальной функции процесса двигательной адаптации и фонового мышечного тонуса, или это связано с нарушением иерархического процесса и недостатками сенсомоторной интеграции? Существуют ли разные типы ИП в этой группе пациентов с ИПИ? Какую роль играют лекарства и хирургия? Здесь мы сообщаем о влиянии лекарств и односторонней паллидотомии.Наши результаты после двусторонней стимуляции глубокого субталамического мозга являются предметом отдельного исследования.
Объекты и методы
Субъектов
Пятьдесят пациентов с IPD без деменции, клинических признаков вестибулярного заболевания, слабости или периферической потери чувствительности согласились участвовать в исследовании постуральной стабильности с использованием компьютерной динамической постурографии в дополнение к стандартному UPDRS в соответствии с Хельсинкской декларацией.Исследование было одобрено этическим комитетом Медицинского центра Стэнфордского университета. В таблице 1 представлены демографические данные пациентов как группы.
Пациенты были изучены в их наилучшем состоянии при приеме лекарств и в практически определенном состоянии без приема лекарств. Дофаминергические препараты длительного действия [Sinemet-CR (DuPont Pharma Inc.) и агонисты дофамина] были отменены за 24 часа, а препараты короткого действия были отменены, по крайней мере, за 12 часов до тестирования вне штата. Подгруппа из 10 пациентов также была изучена с помощью CAPIT (Core Assessment Program for Intracerebral Transplantation) (Langston et al ., 1992) до и через 3, 6 и 12 месяцев после односторонней паллидотомии. Критерии включения для паллидотомии требовали, чтобы у пациента имелась чувствительность к леводопа, стадия III по Хону и Яру или выше без приема лекарств, не проводилась оптимальная медикаментозная терапия в течение как минимум 4 недель, не было признаков деменции и не было тяжелой атрофии на МРТ.
Клиническая оценка
Все пациенты были обследованы с помощью UPDRS и исследования постурального колебания в измененных сенсорных условиях с использованием компьютерной динамической постурографии.Оценка PIGD была рассчитана путем добавления пунктов 13, 14, 15, 29 и 30 (падение, замирание, ходьба, походка и устойчивость позы) из моторных и повседневных частей UPDRS, чтобы представить клиническую мобильность. Оценка интенсивности дискинезии была 32-м пунктом UPDRS.
Компьютерная динамическая постурография
Компьютеризированная динамическая постурография — это количественный метод оценки функции вертикального равновесия в различных условиях, имитирующих условия повседневной жизни (Nashner, 2001).Испытуемые стоят на подвижных пластинах в свободно сидящей обвязке. Их ноги тщательно выровнены над определенными осями на forceplates, которые ссылаются на четыре силовых преобразователей, установленных на опорной плите центра. Технология Forceplate измеряет вертикальные силы, действующие на человека, стоящего в вертикальном положении (Nashner, 1993). Эти меры, а также рост и вес пациента используются для расчета угла COG. В компьютерной динамической постурографии изменение угла COG измеряется в реальном времени и называется колебанием COG.Четыре условия теста сенсорной организации (SOT) предназначены для оценки способности пациента эффективно использовать и интегрировать соматосенсорные, зрительные и вестибулярные сигналы для поддержания баланса и, следовательно, не чрезмерно раскачиваться. Сенсорная организация оценивается путем выборочного нарушения соматосенсорной и / или визуальной информации о COG тела по отношению к вертикали, а затем измерения способности пациента сохранять равновесие. Производятся непрерывные измерения колебания COG, но оценка равновесия (см. Ниже) отражает максимальный AP (передний – задний) угол COG, измеренный за испытание, как процент от теоретического максимального колебания, которое нормальный субъект может выдержать до потери равновесия.Чем больше угол COG, тем сильнее раскачивается испытуемый и, следовательно, тем ниже балл равновесия. Было показано, что измерения SOT с течением времени согласованы в пределах 5% и не зависят от систематической ошибки обучения (Coogler and Wolf, 1992; Nashner, 1993; Paloski et al ., 1999).
В SOT испытуемые спокойно стояли в течение 20 секунд на подвижных силовых пластинах (Smart EquiTest, NeuroCom, Clackamas, OR, USA). Все пациенты смотрели прямо перед собой, их голова была выровнена вертикально относительно оси туловища; ни у одного пациента не было явных передне-, латеро- или кривошеи.Работоспособность испытуемого регистрировалась во время трех испытаний в каждом из четырех условий, показанных на рис. 1. В SOT1 все сенсорные входы были доступны для ориентации; Субъекты стояли с открытыми глазами, и с фиксированной платформы была доступна соматосенсорная информация. Измерения в этом состоянии отражали спонтанное колебание позы. В SOT2 визуальная информация была удалена, когда испытуемых просили закрыть глаза. В SOT4 соматосенсорная информация была сделана неадекватной для ориентации из-за вращения платформы вокруг оси голеностопного сустава пропорционально спонтанному качанию AP.В SOT5 соматосенсорные и визуальные входы были недоступны из-за вращения платформы с закрытыми глазами субъекта.
Оценка равновесия сравнивает колебания субъекта с теоретическими пределами устойчивости. Предполагается, что теоретическое максимальное смещение, которое нормальный субъект может качнуть без потери равновесия, составляет 12,5 ° (8,25 ° кпереди, 4,25 ° кзади; McCollum, 1989). Балл равновесия = [12,5 — θ (макс – мин) / 12,5] × 100%, где θ — максимальный угол качания AP COG, зарегистрированный за испытание; см. выше.Балл равновесия для каждого условия отражает средний балл по трем испытаниям. Падение регистрируется, когда испытуемые делают шаг или нуждаются в помощи администратора теста. Падению присваивается нулевой балл.
Баллы равновесия у клинически здоровых субъектов
Нормативные данные, использованные в этом исследовании, были опубликованы в другом месте (Nashner, 1993) и включают данные 194 нормальных субъектов в трех возрастных группах; от 20 до 59 лет, от 60 до 69 лет и от 70 до 79 лет.Клиническими отклонениями от нормы в SOT считаются те, которые хуже, чем 95% клинически бессимптомной контрольной выборки.
В ряде других исследований сообщалось о бессимптомных нормативных данных для SOT, которые согласуются с нормативными данными, использованными в этом исследовании (Horak et al ., 1989; Peterka and Black, 1990; Beckley et al ., 1991; Wolfson и др. ., 1992). Нормативные данные пятого процентиля, взвешенные для диапазона возрастных групп наших пациентов, были: SOT1 = 87%, SOT2 = 82%, SOT4 = 73% и SOT5 = 50%.Для каждого показателя SOT он был рассчитан путем умножения установленных значений пятого процентиля для каждой из трех возрастных групп на долю от общего числа пациентов в этой группе и сложения трех значений. В этом исследовании оценка равновесия пациентов для каждого состояния сравнивалась с пятым процентилем возрастных нормативных данных. Оценка ниже взвешенного пятого процентиля считалась ненормальной.
Хирургическая техника
Пациентам выполнена стереотаксическая паллидотомия под контролем микроэлектродов.Перед процедурой прием лекарств был прекращен как минимум за 12 ч. Для идентификации сенсомоторной области в глобусе pallidus internus (GPi) использовалась многопроходная, одиночная нейронная, микроэлектродная запись и отслеживались анатомические сагиттальные срезы из Атласа Шальтенбранда и Бейли (Schaltenbrand and Bailey, 1959) и соматотопическая карта GPi, разработанная Делонгом . и др. . (неопубликованное наблюдение) в Университете Эмори. Радиочастотные поражения были получены путем последовательного нагрева макрозонда (диаметром 1 мм, последние 3 мм которого не были изолированы) (Radionics Inc., Берлингтон, Массачусетс, США). Постоянное обследование речи, зрения и двигательной функции пациента на всем протяжении поражения подтвердило отсутствие поражения капсулы или зрительного тракта. Повреждения наносили за три прохода в двух плоскостях, чтобы соответствовать нанесенному на карту объему сенсомоторной области. Местоположение и размер очага поражения определяли с помощью МРТ-снимков, сделанных в ближайшем послеоперационном периоде менее 3 дней после операции.
Статистический анализ
Тест Стьюдента t показывает величину разницы средних и, следовательно, величину наблюдения.Таким образом, непарный тест t использовался для оценки разницы между оценками SOT пациентов с IPD и нормальными субъектами. Парный тест Стьюдента t использовался для оценки статистической значимости различий в средних значениях SOT при приеме и лечении лекарствами. Парный тест Стьюдента t также использовался для оценки статистической значимости различий в средних значениях баллов SOT1 до и после паллидотомии при приеме лекарств, а также баллов SOT5 до и после паллидотомии при прекращении приема лекарств.Все тесты были двусторонними. Для непараметрических данных (PIGD и все другие баллы по шкале клинической оценки) для определения значимости лечения по соответствующим критериям использовался знаковый ранговый критерий Вилкоксона. Ранговая корреляция Спирмена и / или критерий суммы рангов Манна-Уитни использовались для оценки взаимосвязи между оценкой PIGD при отсутствии и приеме лекарств, оценками PIGD и оценками SOT5, оценками дискинезии и SOT1 и SOT5, взаимосвязью изменения PIGD из-за паллидотомии. или изменение PIGD из-за приема лекарств и предоперационной оценки SOT5 на лекарствах.Ранговая корреляция Спирмена также использовалась для оценки взаимосвязи между группами в отношении их стадии Хоэна и Яра, моторных суббаллов по шкале UPDRS и изменения показателей по шкале UPDRS из-за приема лекарств. Значение P ≤0,05 использовалось в качестве уровня значимости. Поправка Бонферрони не указывалась, поскольку это были тесты множественных одиночных сравнений, а не множественные сравнения единственного результата.
Результаты
Пациенты, не принимавшие лекарства, сохраняли равновесие в пределах нормы в условиях SOT1 и SOT2 (рис.2). Однако средняя оценка SOT4 была немного ниже нижней границы нормы, а оценка SOT5 была значительно ниже нормы. В частности, 52% пациентов демонстрировали большее постуральное колебание, чем 95% нормальных субъектов, в состоянии SOT5 при отсутствии лекарств, состоянии, при котором были нарушены как соматосенсорные, так и зрительные сигналы. Пациенты были разделены на две группы: пациенты с баллами равновесия SOT5 в нормальном диапазоне (группа SOTN) и пациенты с баллами SOT5 ниже пятого процентиля нормальных данных субъектов (группа SOTABN) (см.рис.3А и В). Помимо одного пациента, это разделение разделило группу на тех, у кого были нормальные оценки для всех состояний SOT, и тех, у которых SOT4 и / или SOT5 были ненормальными. Интересно, что эти две группы были очень похожи по возрасту, продолжительности и тяжести заболевания, как показано в таблице 2. Показатели SOT5 не коррелировали с изменениями их показателей UPDRS, вызванными приемом лекарств, что показывает, что более низкие показатели SOT5 не были наводящий на мысль об атипичном паркинсонизме.
На рис. 3A и B сравниваются показатели SOT при приеме и отключении лекарств для групп SOTN и SOTABN, соответственно.Показатели группы SOTN, принимавшей лекарства, снизились по сравнению с их нормальными значениями, не принимавшими лекарства, что свидетельствует о потере постуральной стабильности во всех условиях (рис. 3A). Снижение показателей SOT1, SOT2 и SOT4 составило в среднем от 5,4 до 7,9%, в то время как показатели SOT5 снизились в среднем на 16,3%. Баллы по равновесию были значительно ниже, чем нештатные по SOT1, SOT2 и SOT5.
В группе SOTABN показатели SOT4 и SOT5 без лечения были значительно ниже нормы ( P <0.002, рис. 3Б). В состоянии приема лекарств снижение их оценок SOT1 и SOT2 по сравнению с оценками в состоянии отсутствия лечения было аналогичным таковым в группе SOTN, в среднем 4,4 и 6,0% соответственно. Показатели SOT4 снизились в среднем на 6,4% при приеме лекарств. Изменения SOT5, вызванные приемом лекарств, было труднее оценить, поскольку многие из них неоднократно снижались как при приеме, так и при приеме лекарств, а оценка SOT5 была очень низкой (в среднем по группе = 17%, норма> 50%), что позволяет предположить, что у этих пациентов развился ИП. когда у них не было адекватной соматосенсорной и / или визуальной обратной связи, и они были гораздо более нестабильными без них.Разница в значениях SOT4 и SOT5 частично объясняется наличием падений (балл равновесия = 0) у некоторых пациентов в каждом состоянии. Хотя оценка SOT5 снизилась на фоне приема лекарств в группе SOTN, среднее значение для этой группы все еще было значительно выше, чем у группы SOTABN, получавшей лекарства ( P <0,001).
Влияние лекарств на показатели SOT5 у всех пациентов суммировано на рис. 4, на котором сравниваются показатели приема и прекращения лечения на графике x — y .Семьдесят процентов пациентов имели ненормальные показатели SOT5 при приеме лекарств. Как свидетельствуют точки в нижнем левом квадранте, 40% пациентов имели ненормальные показатели SOT5 как при отсутствии, так и при приеме лекарств, а PI был достаточно серьезным у семи пациентов, чтобы вызывать падения при каждом испытании SOT5, при отсутствии и при приеме лекарств (представлено одной точкой данных ). Тридцать процентов пациентов не принимали лекарства в нормальных пределах, но не принимали лекарства (нижний правый квадрант). Только у 12% пациентов наблюдались отклонения от нормы при приеме лекарств, а затем показатели улучшились до нормального уровня при приеме лекарств (верхний левый квадрант).Наконец, 18% пациентов нормально функционировали как без приема лекарств, так и без них (верхний правый квадрант), при этом большинство этих точек сгруппировались рядом с диагональной линией, что указывает на незначительные изменения, если вообще какие-либо изменения при приеме лекарств.
Общее влияние лекарств на показатели SOT5 можно увидеть, сравнив точки вверху и слева с точками внизу и справа от диагональной линии «без изменений». За исключением точек, находящихся в пределах ± 5% от линии, 66% пациентов были менее стабильны по сравнению с отсутствием лечения.Таким образом, преобладающим эффектом дофаминергических препаратов было снижение баллов равновесия SOT5.
Мы использовали стандартную подшкалу UPDRS, PIGD, чтобы исследовать влияние лекарств на клиническую оценку постурального контроля. По оценке PIGD все, кроме трех пациентов, улучшили прием лекарств. Группа SOTABN, как правило, показывала меньшее улучшение PIGD из-за приема лекарств, чем группа SOTN, и вела себя более однородно в этом отношении ( r = 0,72 для группы SOTABN по сравнению с r = 0.47 для группы СОТН; данные не показаны). Однако эта разница не достигла статистической значимости.
Показатели SOT5 не коррелировали с показателем PIGD или каким-либо компонентом показателя PIGD, без лечения (данные не показаны), что позволяет предположить, что SOT5 и PIGD измеряют различные компоненты постурального контроля. Мы отметили, что все пациенты имели ненормальные показатели PIGD и что некоторые из пациентов с самыми высокими показателями PIGD имели нормальные показатели SOT5. Также не было корреляции между изменением SOT5 и изменением PIGD на фоне приема лекарств.В этом нет ничего удивительного, так как общий эффект от лечения заключался в улучшении оценки PIGD, но в ухудшении оценки SOT5.
Чтобы оценить гипотезу о том, что снижение SOT5 при приеме лекарств является исключительно функцией увеличенного спонтанного влияния (т. Е. Снижения показателей SOT1), мы сравнили изменения показателей SOT5 и SOT1 при приеме и прекращении лечения (рис. 5). Медикаменты ухудшили состояние большинства пациентов как в SOT1, так и в SOT5, поскольку большинство точек данных попали в третий квадрант. По существу, в этом квадранте было две категории ответов: те, у которых наблюдалось значительное снижение оценок SOT1, примерно на 20%, и те, чьи точки данных были близки к вертикальной оси, что указывает на отсутствие изменений в SOT1.Среди пациентов со значительным снижением SOT1 ни у одного не наблюдалось улучшения SOT5, что свидетельствует о том, что влияние увеличенного спонтанного раскачивания на прием лекарств также оказывало вредное воздействие на постуральную стабильность в SOT5. На рис. 3A и B снижение показателей SOT1 и SOT4 при приеме лекарств было схожим по величине, что свидетельствует о том, что в среднем механические эффекты движения платформы при SOT4 не имели тенденции к усилению спонтанного колебания. Если бы мы применили то же предположение к оценкам SOT5 для лекарств, мы могли бы отнести снижение оценок SOT5 к лекарствам спонтанным колебанием только тогда, когда снижение SOT5 было меньше или равно уменьшению SOT1.Исходя из этого предположения, усиление спонтанного колебания объясняет ухудшение показателей SOT5 на фоне приема лекарств у 10% пациентов, в то время как, по-видимому, наблюдались аддитивные ухудшения показателей SOT5 у 40% пациентов, которые не могли быть объяснены исключительно эффектом спонтанного колебания.
Аномальное спонтанное колебание позы, соответствующее низкому баллу равновесия SOT1, наблюдалось только в состоянии приема лекарств и могло быть связано с дискинезиями. Используя оценку интенсивности дискинезии UPDRS, мы исследовали, существует ли какая-либо корреляция между шкалой тяжести дискинезии и изменением SOT1 и / или изменением SOT5 из-за приема лекарств.На рисунках 6A и B показано, что существует более значимая корреляция между дискинезиями и изменением SOT1, чем с изменением SOT5, что позволяет предположить, что дискинезии оказали большее влияние на SOT1, чем баллы равновесия SOT5.
Влияние паллидотомии на постуральную нестабильность
На рис. 7 показан балл равновесия SOT1 до и через 3, 6 и 12 месяцев после паллидотомии, без и после лечения для группы хирургических пациентов. После паллидотомии наблюдалось незначительное улучшение и без того нормальных показателей SOT1 без лечения.Наблюдалось более заметное улучшение показателей SOT1 при приеме лекарств, которое было значимым через 6 месяцев ( P = 0,01) и было близко к значительному через 3 и 12 месяцев после операции ( P = 0,08 и P = 0,07, соответственно). Паллидотомия также улучшила показатели включения в SOT2 и SOT4, приблизив их к оценкам выключения (данные не показаны).
Мы разделили хирургических пациентов на те же две группы на основе баллов SOT5 до операции без лечения: пациентов с нормальными баллами (SOTN; n = 4) и пациентов с ненормальными баллами (SOTABN; n = 6).Затем мы проанализировали влияние односторонней паллидотомии на отдельные группы.
На рисунках 8A и B показано влияние паллидотомии на показатели SOT5 каждой группы. Паллидотомия улучшила и без того нормальные оценки SOT5 для лекарств в группе SOTN (рис. 8A) и привела ненормальные оценки SOT5 для лекарств в нормальный диапазон. Таким образом, односторонняя паллидотомия уменьшила, но не устранила пагубное влияние лекарств на показатели SOT5. На рисунке 8B показано, что у пациентов с оценками SOTABN паллидотомия значительно улучшила показатели SOT5 без лечения, в результате чего средние показатели SOT5, как без лечения, так и после лечения, оказались в пределах нормы.Этот значительный эффект сохранялся через 6 и 12 месяцев.
Обе группы показали улучшение показателя PIGD через 3 и 6 месяцев после паллидотомии. Улучшение для группы SOTABN оказалось более сильным и сохранялось в течение 12 месяцев. До операции средний балл PIGD в двух группах был схожим, без лечения (PIGD = 7,3 для SOTN и 7,8 для SOTABN). Постпаллидотомия в группе SOTABN улучшилась на 57% через 3 месяца, и лишь незначительно снизилась до 42% через 12 месяцев. Напротив, улучшения в группе SOTN были меньше через 3 месяца (37%) и почти полностью исчезли к 12 месяцам (2%).Однако размер выборки был небольшим, и эта разница не достигла значимости. Улучшение показателей PIGD после односторонней паллидотомии коррелировало с улучшением показателей SOT5 без лечения, особенно в группе SOTABN (данные не показаны, r = 0,77, 0,82 и 0,86 через 3, 6 и 12 месяцев, соответственно). Таким образом, выяснилось, что пациенты с оценкой SOTABN после лечения, препаллидотомии, имели тенденцию к большему улучшению после паллидотомии с точки зрения как их оценок SOT5, так и их оценок PIGD, чем в группе SOTN.
На фиг. 9A показано влияние паллидотомии на показатель PIGD для лечения в зависимости от предоперационных показателей SOT5 для лечения через 3, 6 и 12 месяцев после операции. Это показывает обратную корреляцию между улучшением PIGD после паллидотомии и оценкой SOT5 при приеме лекарств, то есть низкий показатель SOT5 при приеме лекарств предсказывает лучшее улучшение клинической подвижности при паллидотомии. Напротив, влияние лекарств на оценку PIGD через 3, 6 и 12 месяцев после паллидотомии было тем больше, чем выше оценка SOT5 до операции при приеме лекарств (рис.9Б).
Обсуждение
Мы обнаружили, что в группе из 50 пациентов с продвинутой стадией IPD есть две отдельные группы, не принимающие лекарства: те, кто поддерживает постуральную стабильность в измененных сенсорных условиях (группа SOTN), и те, большинство из которых нестабильны (группа SOTABN). . По всей видимости, это не зависело от возраста, продолжительности или тяжести заболевания. Аномальный показатель SOT5 также не выбирался для пациентов с менее устойчивым улучшением моторных показателей из-за дофаминергических препаратов, что позволяет предположить, что степень ИП при измененных сенсорных состояниях не была индикатором возможного атипичного паркинсонизма.Это говорит о том, что аномальный сенсорный организационный процесс для постурального контроля может быть неотъемлемым свойством болезни у большинства пациентов с болезнью Паркинсона на поздней стадии.
Этиология аномальных баллов равновесия SOT5 в IPD
Все пациенты демонстрировали постуральную стабильность, когда соматосенсорная информация была доступна в дополнение к вестибулярной сенсорной информации. Это согласуется с другими исследованиями ИП у пациентов с ИПЗ (Horak et al ., 1992). Пациенты с двусторонним вестибулярным заболеванием неоднократно подпадают под SOT5, но обычно не попадают в другие условия SOT (Nashner et al ., 1982). В условиях SOT4 и SOT5 почти отсутствует соматосенсорная обратная связь от проприорецепторов голеностопного сустава, но некоторая соматосенсорная обратная связь от других гравирецепторов, расположенных в почках и крупных сосудах, остается неизменной (Mittelstaedt, 1996; Dietz, 1998). Это говорит о том, что в SOT5 имеется лишь небольшой объем сенсорной информации, доступной для использования для управления позой, кроме вестибулярной сенсорной информации.
На основании приведенных выше аргументов аномальные показатели SOT5 при болезни Паркинсона предполагают, что (i) центры постурального контроля не получают никакой вестибулярной информации из-за периферической дисфункции или дисфункции ствола мозга; (ii) что существует специфический дефицит вестибулярной, сенсомоторной интеграции в центрах постурального контроля; или (iii) что взаимодействия между высшими и низшими иерархическими процессами постурального контроля недостаточны.
Мы не считаем, что дефицит SOT5 можно объяснить периферическими или вестибулярными заболеваниями ствола мозга в нашей группе, поскольку ни у одного из этих пациентов не было клинических признаков вестибулярного заболевания; нистагма не было, а VOR (вестибулярный окулярный рефлекс) был нормальным при клиническом обследовании.Этот вывод согласуется с результатами других углубленных исследований вестибулярной функции при IPD (Pastor et al ., 1993; Bronstein et al ., 1996). Однако в исследовании 36 пациентов с IPD различной степени тяжести Reichert et al . (1982) сообщили, что у 31% отсутствовали калорийные ответы, что соответствовало двусторонней периферической и / или центральной вестибулярной дисфункции. Уотерстон и др. . (1993) обнаружили дефицит SOT5 у пациентов с более поздними стадиями IPD, только двое из которых имели вестибулярную дисфункцию, измеренную по калорийности.Они пришли к выводу, что основная патология связана с двигательной системой.
Если периферические вестибулярные сенсорные входы нормальны при IPD, то другим логическим объяснением распространенности аномальных баллов равновесия SOT5 будет специфический дефицит центральной вестибулярной сенсомоторной интеграции, как было предложено Мартином (1967). Хотя это может быть частичным объяснением, мы не думаем, что у пациентов с SOTABN был только специфический дефицит вестибулярной, сенсомоторной интеграции, потому что они также продемонстрировали снижение постуральной стабильности в состоянии SOT4, когда и зрение, и вестибулярная информация доступны для постурального контроля.
Мы предполагаем, что дефицит сенсорного организационного процесса при ИПД отражает распад центральной иерархии постурального контроля. Мы предполагаем, что у большинства наших пациентов система высших эталонов для контроля позы больше не может «автоматически» обеспечивать желаемую синергию более низкого уровня для поддержания равновесия без совпадающей когерентной сенсорной обратной связи. Это похоже на предположение Хорака о том, что дефицит различных сенсорных состояний отражает негибкость способности пациентов с IPD адаптироваться к измененным условиям поддержки (Horak et al ., 1992). Демирчи и др. . (1997) предположили, что пациенты с болезнью Паркинсона недооценивают соматосенсорную обратную связь («кинестезия») при оценке амплитуды пассивных угловых смещений пальца. Таким образом, в SOT5, хотя, вероятно, все еще присутствует некоторая обратная связь с гравирецепторами, пациенты с IPD могут быть неспособны адекватно использовать ее для поддержания баланса.
Вопреки данным, полученным от нормальных субъектов, мы не идентифицировали конкретную «визуально зависимую» группу пациентов с ИПЗ в отношении их сенсорного организационного контроля осанки (Isableu, 1997).Однако это было невозможно с доступными условиями SOT. Измерение визуальной зависимости может быть достигнуто с помощью SOT путем сравнения равновесия в условиях визуального отсутствия с условиями, когда визуальная обратная связь несовместима. Визуально зависимые субъекты продолжают использовать визуальные подсказки для контроля позы, даже если они неуместны (Nashner, 1993). Дитц и другие предположили, что пациенты с болезнью Паркинсона в значительной степени полагаются на зрение и контроль сгибающих мышц для контроля баланса во время стойки и передвижения (Dietz, 1998; Azulay et al ., 1999). Они предполагают, что рецепторы нагрузки разгибателей действуют как гравицепторы тела и связаны в основном с балансом на основе наземной системы отсчета. Они предполагают, что при болезни Паркинсона эти рецепторы плохо функционируют, в результате чего пациент зависит от зрения. Поскольку не было заметного отклонения вертикальной ориентации головы, наши данные предполагают, что наземная система отсчета все еще играла важную роль в постуральном контроле у всех наших пациентов с болезнью Паркинсона, поскольку их равновесие было нормальным, пока оно не было недоступно (условия SOT4 и SOT5).
Бернштейн (1967) предположил, что нервная система организует движения иерархическим образом. Более высокие уровни активируют синергию более низкого уровня, то есть группы мышц, действующих как единое целое. Тогда более высокие уровни больше озабочены адаптацией «моторных» реакций к изменениям в задаче или условиях окружающей среды. Марсден предположил, что основная роль базальных ганглиев в моторном контроле — «автоматическое выполнение выученных моторных планов», предполагая роль базальных ганглиев на более высоком уровне иерархической структуры (Marsden, 1982).
Анатомические данные свидетельствуют о существовании такой постуральной системы отсчета, опосредованной моторной корой, хвостатым ядром и локомоторными областями ствола мозга, такими как педункулопонтинное ядро (PPN) (Garcia-Rill et al ., 1985). Визуальные и вестибулярные входы в моторную кору и корково-хвостатые проекции направлены преимущественно на моторные представления оси тела, а не дистальные представления конечностей (Boisacq-Schepens and Hanus, 1972; Garcia-Rill and Dubrovsky, 1973).Эта осевая система является частью иерархической гравитационной системы отсчета координат, относительно которой мы оцениваем сенсорные условия окружающей среды и выполняем внеперсонально направленные движения (Bernstein, 1967; Nashner et al ., 1982).
В этом исследовании большинство пациентов не могли поддерживать постуральную стабильность без приема лекарств без согласованной сенсорной обратной связи. Их производительность была наихудшей, когда была недоступна и соматосенсорная, и визуальная информация, и постепенно улучшалась с восстановлением последовательной визуальной, а затем и визуальной, и соматосенсорной обратной связи.Эти данные свидетельствуют о том, что в базальных ганглиях, денервированных дофамином, мозг становится зависимым от когерентной сенсорной обратной связи «онлайн» для поддержания контроля позы. Интересно, что пациенты с сильно отклоненными от нормы оценками SOT5 имели нормальные оценки равновесия в состоянии SOT2, когда устраняется только зрение, но некоторые из них были нестабильными в SOT4, когда недоступна только соматосенсорная информация. Это позволяет предположить, что некоторые пациенты с IPD склонны придавать большее значение соматосенсорной обратной связи, чем визуальной, в иерархическом сенсорном организационном процессе.
Клинический показатель постурального контроля, показатель PIGD, был отклонен от нормы у всех пациентов. Оценка SOT5 не была связана с оценкой PIGD, что позволяет предположить, что эти два инструмента измеряют разные компоненты контроля позы. Мы бы предположили, что оценка PIGD отражает сенсорные и моторные аспекты постурального контроля, когда сенсорный организационный процесс не подвергается сомнению, и что баллы равновесия SOT измеряют сенсорный организационный процесс постурального контроля. Однако оценка PIGD также включает исторические вопросы (например, отчеты об истории падений).Если пациенты падали исключительно ночью, когда свет был тусклым или отсутствующим и / или когда они шли по неровной поверхности, эта оценка также могла отражать некоторые элементы сенсорного организационного процесса. Группа SOTN смогла сохранить равновесие при всех сенсорных состояниях, но многие из них показали заметные отклонения в шкале PIGD. Таким образом, постуральный контроль, нарушения походки и любые сообщения о падениях у пациентов с SOTN, вероятно, ограничивались процессами двигательной адаптации и инициирования движений, тогда как в группе SOTABN наблюдались дополнительные дефициты в сенсорном организационном процессе постурального контроля.
Интересно, что обратное не было правдой, то есть ни у одного пациента не было аномальных сенсорных компонентов постурального контроля, но были нормальные моторные аспекты постурального контроля. Мы не знаем, что такое различие в элементах постурального контроля было зарегистрировано среди пациентов с IPD. Это открытие подтверждает гипотезу Марсдена о том, что ИПИ является заболеванием двигательной системы (Marsden, 1982), но очевидно, что в подгруппах пациентов в их иерархическом контроле сенсомоторной интеграции наблюдаются дополнительные аномалии.
Влияние дофаминергических препаратов на контроль осанки
Дофаминергические препараты улучшили оценку PIGD у всех пациентов, кроме трех. С другой стороны, прием лекарств ухудшил показатели SOT5 у 66% пациентов. По крайней мере, у 40% пациентов снижение баллов равновесия SOT5 при приеме лекарств нельзя было объяснить только на основании снижения, наблюдаемого в SOT1.
Снижение показателя SOT1 отражает усиление спонтанного колебания. Почему это может происходить при IPD? Horak и др. .предположили, что усиление спонтанного колебания в ответ на внешние возмущения у пациентов с ИПД, принимающих лекарства, связано со снижением мышечного тонуса без увеличения амплитуд корректирующих импульсов ЭМГ (Hallett and Khoshbin, 1980; Horak et al ., 1996). Однако в состоянии SOT1 нет внешних возмущений, так как это «базовое» состояние, когда все сенсорные входы доступны для постурального контроля. Еще одним объяснением повышенного спонтанного раскачивания было наличие дискинезий.Снижение SOT1 коррелировало с тяжестью дискинезии. Можно было бы ожидать, что наличие спонтанного колебания повлияет на другие сенсорные состояния. Фактически, снижение SOT1, SOT2 и SOT4 при приеме лекарств было одинаковым. Однако при приеме лекарств наблюдалось относительно большее снижение показателей SOT5. Мы могли объяснить снижение постуральной стабильности в SOT5 только лишь уменьшением SOT1 у 10% пациентов, в то время как, по-видимому, имелся дополнительный пагубный эффект дофаминергических препаратов у 40% группы пациентов, когда и соматосенсорные, и соматосенсорные. визуальная информация была недоступна для контроля равновесия.Мы предлагаем механизм этого эффекта в заключительном разделе статьи.
Влияние паллидотомии на моторные и сенсорные компоненты контроля осанки
В отличие от воздействия лекарств, односторонняя паллидотомия привела к существенному улучшению как баллов равновесия SOT5, так и баллов PIGD. Обе группы SOTN и SOTABN продемонстрировали улучшения в SOT5, но улучшения были особенно значительными у пациентов с аномальными показателями SOT5 до операции, без лечения.У этих пациентов показатели SOT5 были приведены в нормальный диапазон после паллидотомии и оставались таковыми в течение 12 месяцев наблюдения. Улучшения по шкале PIGD также были более значительными и устойчивыми в группе SOTABN после паллидотомии.
Из 24 исследований, сообщающих об исходах паллидотомии, 12 включали постуральный контроль (Iacono et al ., 1995; Lozano et al ., 1995; Baron et al ., 1996; Johansson et al ., 1997) ; Кишор и др. ., 1997; Lang et al., , 1997; Masterman и др. , 1998; Самуэль и др. , 1998; Melnick et al ., 1999; Baron и др. , 2000; Fine et al ., 2000). Среди этих 12 исследований восемь сообщили о клинических измерениях постуральной стабильности с использованием суббаллов UPDRS; трое из того же центра (Lozano и др. ., 1995; Lang и др. ., 1997; Fine и др. ., 2000) использовали оценку PIGD, остальные использовали единственную оценку стабильности осанки из пункта 30 моторная шкала UPDRS (Fahn et al ., 1987). Сообщили о трех измерениях постурального контроля с помощью постурографии. Только в одном из 12 исследований не сообщалось об улучшении контроля позы на раннем этапе (Melnick et al ., 1999). Хотя в других исследованиях сообщалось о ранних улучшениях, ни в одном из них не было выявлено долгосрочной пользы односторонней паллидотомии для контроля позы. Устойчивые улучшения наблюдались у отдельных пациентов в одном долгосрочном исследовании (Vitek et al ., 2000).
Если бы мы объединили две группы в нашем исследовании, мы также могли бы увидеть общее снижение улучшения PIGD к 12 месяцам.Однако, разделив пациентов на основании результатов дооперационного исследования SOT5, мы обнаружили, что улучшение показателей PIGD в группе SOTABN снизилось лишь незначительно с 57% через 3 месяца до 42% через 12 месяцев. Напротив, улучшения в группе SOTN были меньше через 3 месяца (37%) и почти полностью исчезли к 12 месяцам (2%). Наша группа пациентов небольшая, и мы не сообщали здесь о корреляции общего результата с локализацией поражения, что также могло повлиять на эти результаты (Bronte-Stewart et al ., 1998).
Наши выводы о влиянии паллидотомии на сенсорный организационный процесс при IPD согласуются с двумя другими исследованиями, которые также показали улучшение эквивалента всех оценок SOT. Одно из них было выполнено только во время приема лекарств (Masterman et al ., 1998). Другой показал значительное улучшение комбинированного балла SOT4, 5 и 6 в послеоперационном состоянии без лечения, но тестирование проводилось только через 1—3 месяца после операции (Mandybur et al ., 1999). Наши результаты непросто сравнить с третьим исследованием, в котором использовалась постурография. Это исследование не показало значительной эффективности через 3 месяца (Melnick et al ., 1999), но использовался составной балл SOT, а не баллы отдельных сенсорных состояний, и всех пациентов лечили как одну группу.
Существуют ли разные стратегии лечения для двух групп пациентов?
Похоже, что пациенты с ИПД и ИП имеют разные представления ИП.Их можно классифицировать как пациентов с более значительными трудностями с инициированием движения и скоростными характеристиками, а также с дополнительными нарушениями сенсорного организационного компонента постурального контроля. Впервые мы обнаружили, что существует диссоциация между эффектами лекарств и эффектами паллидотомии на моторные и сенсорные аспекты постурального контроля. Лекарства явно улучшили компонент двигательной адаптации контроля позы, но могли пагубно сказаться на сенсорном организационном контроле позы.С другой стороны, паллидотомия может полностью исправить нарушения сенсорного организационного компонента постурального контроля, а также улучшить двигательные компоненты баланса и подвижности. Оказалось, что пациенты, у которых показатели SOT5 были наихудшими на фоне приема лекарств, получили наибольшее улучшение показателей PIGD после паллидотомии. Тем не менее, пациенты с нормальными или выше нормальных показателей SOT5 все же улучшили PIGD от лекарств, постпаллидотомии
Таким образом, пациенты с IPD, PI и аномальными показателями SOT5 могут оказаться хорошими кандидатами на операцию, если PI является инвалидизирующим симптомом. .Для пациентов с IPD, PI и нормальными показателями SOT5 мы предлагаем адекватно лечить PI этих пациентов только с помощью лекарств и что решение о хирургическом вмешательстве следует принимать по другим причинам, таким как двигательные колебания и узкое терапевтическое окно. Наиболее подходящим показателем для прогнозирования стратегии лечения был предоперационный балл равновесия SOT5 при приеме лекарств.
Механизмы различного воздействия лекарств и хирургических вмешательств на моторные и сенсорные компоненты постурального контроля
Базальные ганглии являются частью множества сегрегированных цепей, которые обеспечивают моторные, глазодвигательные, лимбические и ассоциативные функции.Анатомические и физиологические данные свидетельствуют о том, что полосатое тело является местом пространственно-временной, контекстно-зависимой сенсомоторной интеграции, на которую напрямую влияет дофамин (Flaherty and Graybiel, 1991, 1993, 1994; Graybiel et al ., 1994; Mink , 1996). Тормозящие выходные сигналы проходят от GPi к таламусу и оттуда возвращаются в премоторную кору. GPi также напрямую подавляет мишени ствола мозга и, в частности, PPN (Garcia-Rill, 1991; Parent and Hazrati, 1995, a , b ; Winn et al ., 1997; Dormont и др. ., 1998). PPN, по-видимому, является частью параллельного пути базальных ганглиев с плотными реципрокными связями с субталамическим ядром и с обширным выходом в таламус. PPN, по-видимому, является неотъемлемой частью постурального контроля и передвижения (Garcia-Rill, 1986; Conde et al ., 1998), и было высказано предположение, что PPN может играть важную роль в обусловленной сенсомоторной деятельности (Dormont et al. ., 1998).
При IPD аномальная физиология обнаруживается в базальных ганглиях.В нейронах GPi средняя скорость разряда увеличивается, а паттерны возбуждения становятся аномально нерегулярными с увеличением взрывной активности и синхронизации (Filion, 1979; Miller and DeLong, 1987, 1988; Vitek и др. ., 1990, 1994; Nini и др. ., 1995; Feingold et al ., 1996; Raz et al ., 1997). Vitek и Giroux (2000) предположили, что изменения в паттернах возбуждения и степени синхронизации в базальных ганглиях мешают нисходящей передаче сигнала и нарушают нормальные пространственно-временные паттерны подкорковой и корковой нейрональной активности.Повышенные колебательные паттерны возбуждения также наблюдаются при гиперкинетических состояниях (Suarez et al ., 1997), а Vitek и Giroux (2000) предположили, что дискинезии при болезни Паркинсона могут быть частично связаны с нерегулярными паттернами возбуждения в нейронах базальных ганглиев. Было показано, что дофаминергические препараты снижают частоту возбуждения GPi до нормального уровня, но лекарство может вызвать дальнейший взрыв и нерегулярность режима возбуждения (Filion et al ., 1991; Merello et al ., 1999).Лекарства также способствуют возникновению дискинезий.
Паллидотомия снижает угнетающее действие на таламус за счет снижения частоты возбуждения паллидных нейронов. В отличие от воздействия лекарств на паттерны возбуждения, паллидотомия может нормализовать паттерны возбуждения в паллидо-таламокортикальных и паллидо-PPN-таламокортикальных путях (Vitek and Giroux, 2000).
Таким образом, существует по крайней мере два возможных механизма различного воздействия дофаминергических препаратов и паллидотомии на моторные и сенсорные организационные процессы постурального контроля.Во-первых, существуют разные места для пространственно-временной, контекстно-зависимой, сенсомоторной интеграции: полосатое тело для аппендикулярного моторного контроля и PPN для аксиального моторного контроля, то есть постурального контроля и передвижения. Допамин может способствовать сенсомоторной интеграции в полосатом теле, но не влияет на PPN. Паллидотомия в значительной степени повлияет на сенсомоторную интеграцию в PPN. Это оставляет необъяснимым, как дофамин может нарушить сенсорный организационный процесс. Во-вторых, мы предлагаем разные причины различного воздействия лекарств и хирургического вмешательства на различные клинические аспекты заболевания, которые могут быть связаны с патофизиологическими изменениями в базальных ганглиях.Это показано на диаграмме Венна (рис. 10).
Компонент моторной регулировки моторного и постурального контроля может быть опосредован, главным образом, изменениями в скорости тонического возбуждения нейронов GPi, отраженными в последующих мишенях. Сенсорный организационный процесс может больше зависеть от согласованных паттернов увольнения. Медикаментозное лечение и паллидотомия снижают частоту возбуждения, тем самым освобождая расположенные ниже ядра от ингибирования и улучшая двигательную функцию. Это было предложено в качестве механизма улучшения ригидности, брадикинезии, и мы предлагаем для двигательных аспектов постурального контроля с помощью лекарств и постпаллидотомии.Лекарства могут усугубить нерегулярную стрельбу, а паллидотомия может улучшить их. Это может объяснить, почему прием лекарств ухудшается, а паллидотомия улучшает сенсорные аспекты постурального контроля. Таким образом, один и тот же патофизиологический процесс может лежать в основе дискинезий, вызванных приемом лекарств, и их влияния на сенсорный организационный процесс постурального контроля. Ухудшение SOT5 при приеме лекарств может быть частично связано с моторными эффектами дискинезий, дополненными еще большим нарушением обработки сенсомоторной информации.Это могло бы объяснить диссоциацию между эффектами лекарств и паллидотомии на моторные и сенсорные аспекты ИП при болезни Паркинсона. В настоящее время мы изучаем такой же эффект после глубокой стимуляции мозга в субталамическом ядре при болезни Паркинсона.
Благодарности
Мы благодарим Патрисию Смит и Трейси Кортни за техническую помощь, а также Мелани Вансил и Мэри Пиндер за помощь в подготовке рукописи. Эта работа была частично представлена на Ежегодном собрании Американской академии неврологии в 2000 г., Сан-Диего.
Рис. 1 Компьютерная динамическая постурография: СОТ. Символы, показанные на панели SOT1, представляют наличие зрительной, вестибулярной и соматосенсорной обратной связи соответственно (слева направо). Их отсутствие на следующих панелях иллюстрирует отсутствие этого специфического режима сенсорной обратной связи в каждом состоянии SOT. Этот рисунок можно просмотреть в цвете в качестве дополнительного материала на Brain Online.
Рис. 1 Компьютерная динамическая постурография: СОТ.Символы, показанные на панели SOT1, представляют наличие зрительной, вестибулярной и соматосенсорной обратной связи соответственно (слева направо). Их отсутствие на следующих панелях иллюстрирует отсутствие этого специфического режима сенсорной обратной связи в каждом состоянии SOT. Этот рисунок можно просмотреть в цвете в качестве дополнительного материала на Brain Online.
Рис. 2 SOT1, SOT2, SOT4 и SOT5 — средние значения для всех пациентов (черные столбцы).Нижние пределы возрастных нормальных значений (пятый процентиль) обозначены заштрихованным фоном. * P = 0,009.
Рис. 2 SOT1, SOT2, SOT4 и SOT5 — средние значения для всех пациентов (черные полосы). Нижние пределы возрастных нормальных значений (пятый процентиль) обозначены заштрихованным фоном. * P = 0,009.
Рис.3 Средние баллы SOT1, SOT2, SOT4 и SOT5 на фоне приема лекарств для пациентов с нормальными баллами SOT5 в отношении лечения (группа SOTN) ( A ) и для пациентов с аномальными баллами SOT5 в отношении лечения (группа SOTABN) ( Б ).Пунктирные линии представляют нижние пределы нормальных значений. * P <0,001, ** P <0,05 относительно выключенного состояния.
Рис.3 Средние значения SOT1, SOT2, SOT4 и SOT5 для пациентов с нормальными показателями SOT5, не принимающих лекарства (группа SOTN) ( A ), и для пациентов с ненормальными показателями SOT5, не принимающих лекарства (группа SOTABN) ( В ). Пунктирные линии представляют нижние пределы нормальных значений. * P <0,001, ** P <0.05 относительно выключенного состояния.
Рис. 4 Сравнение результатов SOT5 всех пациентов по сравнению с принимаемыми лекарствами. График разделен на квадранты, разделенные сплошными вертикальными и горизонтальными линиями, представляющими нижнюю границу нормальных показателей SOT5 по осям включения и выключения лекарства. Локации, представляющие отсутствие изменений между оценками включения и выключения лекарств, расположены вдоль пунктирной диагональной линии, наклон = 1.
Рис. 4 Сравнение оценок SOT5 всех пациентов с полученными лекарствами.График разделен на квадранты, разделенные сплошными вертикальными и горизонтальными линиями, представляющими нижнюю границу нормальных показателей SOT5 по осям включения и выключения лекарства. Локации, в которых нет изменений между оценками включения и выключения лечения, расположены вдоль пунктирной диагональной линии, наклон = 1.
Рис. 5 Изменение SOT1 по сравнению с изменением SOT5 от лекарств. Пунктирная линия, наклон = 1, представляет одинаковое изменение для SOT1 и SOT5 из-за приема лекарств.
Рис. 5 Изменение SOT1 по сравнению с изменением SOT5 от лекарств. Пунктирная линия, наклон = 1, представляет одинаковое изменение для SOT1 и SOT5 из-за приема лекарств.
Рис. 6 Оценка интенсивности дискинезии как функция изменения SOT1 из-за приема лекарств ( A ) и как функция изменения SOT5 ( B ).
Рис. 6 Оценка интенсивности дискинезии как функция изменения SOT1 из-за приема лекарств ( A ) и как функция изменения SOT5 ( B ).
Рис. 7 Средние баллы SOT1 при приеме и отсутствии лекарств, до паллидотомии и через 3, 6 и 12 месяцев после паллидотомии. Пунктирная линия представляет нижнюю границу нормальных значений. * P ≤ 0,05 (сравнивается оценка SOT1 после операции и до операции при приеме лекарств).
Рис. 7 Средние баллы SOT1 при приеме и отсутствии лекарств, до паллидотомии и через 3, 6 и 12 месяцев после паллидотомии. Пунктирная линия представляет нижнюю границу нормальных значений.* P ≤ 0,05 (сравнивается оценка SOT1 после операции и до операции при приеме лекарств).
Рис. 8 Средние баллы по шкале SOT5 при медикаментозном лечении до и после паллидотомии для группы SOTN ( A ) и для группы SOTABN ( B ). Пунктирная линия представляет нижнюю границу нормальных значений. * P <0,001, ** P <0,02 (сравнивается оценка SOT5 после операции и до операции без лечения).
Фиг.8 Среднее значение SOT5 после и после лечения до и после паллидотомии для группы SOTN ( A ) и для группы SOTABN ( B ). Пунктирная линия представляет нижнюю границу нормальных значений. * P <0,001, ** P <0,02 (сравнивается оценка SOT5 после операции и до операции без лечения).
Рис. 9 ( A ) Изменение показателей PIGD после паллидотомии без лечения через 3, 6 и 12 месяцев после операции по сравнению с дооперационным баллом SOT5 для всех пациентов.( B ) Изменение баллов PIGD от лекарств по сравнению с дооперационными баллами SOT5 от лекарств. Закрашенные символы представляют группу SOTN, а открытые символы представляют группу SOTABN. * P ≤ 0,02.
Рис. 9 ( A ) Изменение баллов PIGD после прекращения приема лекарств через 3, 6 и 12 месяцев после операции по сравнению с дооперационным баллом SOT5 для всех пациентов. ( B ) Изменение баллов PIGD от лекарств по сравнению с дооперационными баллами SOT5 от лекарств.Закрашенные символы представляют группу SOTN, а открытые символы представляют группу SOTABN. * P ≤ 0,02.
Рис. 10 Диаграмма Венна, связывающая различные эффекты лекарств и хирургического вмешательства на клинические и патофизиологические аспекты болезни Паркинсона.
Рис. 10 Диаграмма Венна, связывающая различные эффекты лекарств и хирургического вмешательства на клинические и патофизиологические аспекты болезни Паркинсона.
Таблица 1Демографические данные пациентов, n = 50
| Среднее ± SD (диапазон) или медиана (25-й, 75-й процентиль) | |
| Возраст (лет) | 60.6 ± 9,4 (36–76) |
| Продолжительность болезни (лет) | 11,8 ± 4,8 (4–25) |
| Хоэн и Яхр, оф. | III (III, IV) |
| Хон и Yahr, на | II.5 (II.5, IV) |
| Среднее ± SD (диапазон) или медиана (25-й, 75-й процентиль) | |
| Возраст (лет) | 60,6 ± 9,4 (36–76) |
| Продолжительность болезни (лет) | 11.8 ± 4,8 (4–25) |
| Хоэн и Яр, оф. | III (III, IV) |
| Хон и Яр, на | II.5 (II.5, IV) |
Демографические данные пациентов, n = 50
| Среднее ± SD (диапазон) или медиана (25-й, 75-й процентиль) | |
| Возраст (лет) | 60,6 ± 9,4 (36– 76) |
| Продолжительность болезни (лет) | 11.8 ± 4,8 (4–25) |
| Хоэн и Яр, оф. | III (III, IV) |
| Хон и Яр, на | II.5 (II.5, IV) |
| Среднее ± SD (диапазон) или медиана (25-й, 75-й процентиль) | |
| Возраст (лет) | 60,6 ± 9,4 (36–76) |
| Продолжительность болезни (лет) | 11,8 ± 4,8 (4–25) |
| Хоэн и Яр, оф. | III (III, IV) |
| Хон и Яр, тел. | II.5 (II.5, IV) |
Средние (± SD) или медианные (25, 75 процентили) значения для групп SOTN и SOTABN
| SOTN ( n = 24) | SOTABN ( n = 26) | P значение | |
| Возраст (лет) | 59,5 ± 8,0 | 61,2 ± 10,7 | 0,6 |
| Продолжительность болезни (лет) | 12.1 ± 4,9 | 11,5 ± 4,7 | 0,6 |
| Ступень Хёна и Яра, выкл. | 3 (3, 3) | 3 (3, 4) | 0,4 |
| Оценка двигателя UPDRS, выкл. | 35,5 (30, 40) | 39 (31, 47) | 0,4 |
| Изменение оценки мотора UPDRS, от до | 15 (10, 23,3) | 19 (5,3, 30,5) | 0,9 |
| SOTN ( n = 24) | SOTABN ( n = 26) | P значение | |
| Возраст (лет) | 59.5 ± 8,0 | 61,2 ± 10,7 | 0,6 |
| Продолжительность болезни (лет) | 12,1 ± 4,9 | 11,5 ± 4,7 | 0,6 |
| Стадия Хёна и Яра, выкл. 3) | 3 (3, 4) | 0,4 | |
| Оценка мотора UPDRS, выкл. | 35,5 (30, 40) | 39 (31, 47) | 0,4 |
| Изменение оценки мотора UPDRS , выкл на | 15 (10, 23.3) | 19 (5,3, 30,5) | 0,9 |
Средние (± SD) или медианные (25, 75 процентили) значения для групп SOTN и SOTABN
| ( | SOTN) n = 24) | SOTABN ( n = 26) | P значение |
| Возраст (лет) | 59,5 ± 8,0 | 61,2 ± 10,7 | 0,6 |
| Продолжительность болезни (лет) | 12.1 ± 4,9 | 11,5 ± 4,7 | 0,6 |
| Ступень Хёна и Яра, выкл. | 3 (3, 3) | 3 (3, 4) | 0,4 |
| Оценка двигателя UPDRS, выкл. | 35,5 (30, 40) | 39 (31, 47) | 0,4 |
| Изменение оценки мотора UPDRS, от до | 15 (10, 23,3) | 19 (5,3, 30,5) | 0,9 |
| SOTN ( n = 24) | SOTABN ( n = 26) | P значение | |
| Возраст (лет) | 59.5 ± 8,0 | 61,2 ± 10,7 | 0,6 |
| Продолжительность болезни (лет) | 12,1 ± 4,9 | 11,5 ± 4,7 | 0,6 |
| Стадия Хёна и Яра, выкл. 3) | 3 (3, 4) | 0,4 | |
| Оценка мотора UPDRS, выкл. | 35,5 (30, 40) | 39 (31, 47) | 0,4 |
| Изменение оценки мотора UPDRS , выкл на | 15 (10, 23.3) | 19 (5,3, 30,5) | 0,9 |
Ссылки
Azulay JP, Mesure S, Amblard B, Blin O, Sangla I, Pouget J. Визуальный контроль передвижений при болезни Паркинсона.
Мозг
1999
;122
:111
–20.Барон М.С., Витек Дж.Л., Бакай Р.А., Грин Дж., Канеоке Й., Хашимото Т. и др. Лечение запущенной болезни Паркинсона с помощью задней GPi-паллидотомии: годовые результаты пилотного исследования.
Ann Neurol
1996
;40
:355
–66.Барон М.С., Витек Д.Л., Бакай Р.А., Грин Дж., Макдональд В.М., Коул С.А. и др. Лечение запущенной болезни Паркинсона односторонней задней GPi-паллидотомией: 4-летние результаты пилотного исследования.
Mov Disord
2000
;15
:230
–7.Бекли Диджей, Блум Б.Р., ван Дейк Дж.Г., Роос Р.А., Ремлер МП. Электрофизиологические корреляты постуральной нестабильности при болезни Паркинсона.
Электроэнцефалограмма Clin Neurophysiol
1991
;81
:263
–8.Бернштейн Н.А. Координация и регулировка движений. Оксфорд: Pergamon Press;
1967
.Boisacq-Schepens N, Hanus M. Моторные вестибулярные реакции коры головного мозга у хлоралзированных кошек.
Exp Brain Res
1972
;14
:539
–49.Бронштейн А.М., Худ JD, Грести М.А., Панаги С. Визуальный контроль баланса при мозжечковом и паркинсоническом синдромах.
Мозг
1990
;113
:767
–79.Бронштейн А.М., Ярдли Л., Мур А.П., Кливз Л. Визуально и постурально опосредованная иллюзия наклона при болезни Паркинсона и у субъектов с дефектами лабиринта.
Неврология
1996
;47
:651
–6.Bronte ‐ Stewart HM, Hill BC, Molander MP, Kaufman RL, Pappas C, Fross RD и др. Местоположение поражения позволяет прогнозировать клинический результат паллидотомии [аннотация].
Mov Disord
1998
;13
:300
.Чонг Р.К., Хорак Ф.Б., Фрэнк Дж., Кэй Дж. Сенсорная организация для баланса: специфический дефицит при болезни Альцгеймера, но не при болезни Паркинсона.
J Gerontol A Biol Sci Med Sci
1999
;54
:M122
–8.Конде Х., Дормонт Дж. Ф., Фарин Д. Роль педункулопонтинного тегментального ядра в отношении условных двигательных функций у кошек. II. Эффекты обратимой инактивации внутримозговыми микроинъекциями.
Exp Brain Res
1998
;121
:411
–8.Coogler CE, Вольф С. Последовательность постуральных реакций у пожилых людей. В Woollacott M, Horak F, редакторы. Осанка и походка: механизмы управления, Vol. II. Юджин: Книжный отдел Орегонского университета;
1992
. п.239
–42.Демирчи М., Гриль С., МакШейн Л., Халлетт М. Несоответствие между кинестетическим и визуальным восприятием при болезни Паркинсона.
Ann Neurol
1997
;41
:781
–8.Дитц В. Доказательства вклада рецепторов нагрузки в контроль осанки и передвижения.[Рассмотрение].
Neurosci Biobehav Rev
1998
;22
:495
–9.Догали М., Фаззини Э., Колодный Э., Эйдельберг Д., Стерио Д., Девинский О. и др. Стереотаксическая вентральная паллидотомия при болезни Паркинсона.
Неврология
1995
;45
:753
–61.Дормонт Дж. Ф., Конде Х., Фарин Д. Роль педункулопонтинного тегментального ядра по отношению к условной двигательной активности у кошек. I. Контекстно-зависимая и связанная с подкреплением деятельность отдельных единиц.
Exp Brain Res
1998
;121
:401
–10.Фан С., Элтон Р.Л., члены комитета по развитию UPDRS. Единая шкала оценки болезни Паркинсона. В: Fahn S, Marsden C, Calne D, редакторы. Последние изменения в болезни Паркинсона. Парк Флорхэм (Нью-Джерси): Медицинская информация Macmillan;
1987
. п.153
–63.Fazzini E, Dogali M, Sterio D, Eidelberg D, Beric A. Стереотаксическая паллидотомия при болезни Паркинсона: долгосрочное наблюдение за односторонней паллидотомией.
Неврология
1997
;48
:1273
–7.Фейнгольд А., Нини А., Раз А., Словин Х., Зеленская В., Ваадиа Е. и др. Нейрональные корреляции в базальных ганглиях нормальных обезьян и обезьян, получавших МРТР [аннотация].
Soc Neurosci Abstr
1996
;22
:414
.Филион М. Влияние прерывания нигростриатного пути и допаминергических агентов на спонтанную активность нейронов бледного шара у бодрствующей обезьяны.
Brain Res
1979
;178
:425
–41.Filion M, Tremblay L, Bédard PJ. Влияние агонистов дофамина на спонтанную активность нейронов бледного шара у обезьян с MPTP-индуцированным паркинсонизмом.
Brain Res
1991
;547
:152
–61.Fine J, Duff J, Chen R, Chir B, Hutchison W., Lozano AM, et al. Долгосрочное наблюдение за односторонней паллидотомией при запущенной болезни Паркинсона.
N Engl J Med
2000
;342
:1708
–14.Flaherty AW, Graybiel AM. Кортикостриатальные трансформации в соматосенсорной системе приматов. Проекции физиологически нанесенных изображений частей тела.
J Neurophysiol
1991
;66
:249
–63.Flaherty AW, Graybiel AM. Выходная архитектура скорлупы приматов.
J Neurosci
1993
;13
:3222
–37.Flaherty AW, Graybiel AM. Вход-выходная организация сенсомоторного полосатого тела у беличьей обезьяны.
J Neurosci
1994
;14
:599
–610.Гарсия ‐ Рилл E. Базальные ганглии и локомоторные области. [Рассмотрение].
Brain Res
1986
;396
:47
–63.Гарсиа ‐ Рилл Э. Ядро плодоножки и папоротника. [Рассмотрение].
Prog Neurobiol
1991
;36
:363
–89.Гарсия ‐ Рилл Э., Дубровский Б. Топографическая организация зрительного ввода в предкрупную кору головного мозга кошки.
Brain Res
1973
;56
:151
–63.Гарсия ‐ Рилл Э, Скиннер РД, Фицджеральд Дж. Химическая активация мезэнцефальной локомоторной области.
Brain Res
1985
;330
:43
–54.Giller CA, Dewey RB, Ginsburg MI, Mendelsohn DB, Berk AM. Стереотаксическая паллидотомия и таламотомия с использованием индивидуальных вариаций анатомических ориентиров для локализации.
Нейрохирургия
1998
;42
:56
–62; обсуждение62
–5.Graybiel AM, Aosaki T, Flaherty AW, Kimura M. Базальные ганглии и адаптивный моторный контроль. [Рассмотрение].
Наука
1994
;265
:1826
–31.Халлетт М., Хошбин С. Физиологический механизм брадикинезии.
Мозг
1980
;103
:301
–14.Хорак Ф. Б., Макферсон Дж. М.. Постуральная ориентация и равновесие. В: Роуэлл LB, Shepherd JT, редакторы. Справочник по физиологии, разд. 12: упражнение: регулирование и интеграция нескольких систем.Нью-Йорк: издательство Оксфордского университета;
1996
. п.255
–92Хорак Ф.Б., Шуперт К.Л., Мирка А. Компоненты постурального нарушения контроля у пожилых людей: обзор. [Рассмотрение].
Neurobiol Aging
1989
;10
:727
–38.Хорак Ф. Б., Натт Дж. Г., Нашнер Л. М.. Постуральная негибкость у пациентов с паркинсонизмом.
J Neurol Sci
1992
;111
:46
–58.Хорак Ф. Б., Фрэнк Дж., Натт Дж.Влияние дофамина на контроль осанки у пациентов с паркинсонизмом: масштабирование, установка и тон.
J Neurophysiol
1996
;75
:2380
–2396.Iacono RP, Lonser RR, Ulloth JE, Shima F. Задне-вентральная паллидотомия при болезни Паркинсона.
J Clin Neurosci
1995
;2
:140
–5.Isableu B, Ohlmann T, Crémieux J, Amblard B. Выбор пространственной системы отсчета и вариабельность постурального контроля.
Exp Brain Res
1997
;114
:584
–9.Йоханссон Ф., Мальм Дж., Норд Э., Хариз М. Полезность паллидотомии при запущенной болезни Паркинсона.
J Neurol Neurosurg Psychiatry
1997
;62
:125
–32.Кишор А., Тернбулл И.М., Сноу Б.Дж., де ла Фуэнте ‐ Фернандес Р., Шульцер М., Мак Э. и др. Эффективность, стабильность и предикторы исхода паллидотомии при болезни Паркинсона. Шестимесячное наблюдение с дополнительными наблюдениями в течение 1 года.
Мозг
1997
;120
:729
–37.Laitinen LV, Bergenheim AT, Hariz MI. Задневентральная паллидотомия Лекселла в лечении болезни Паркинсона.
J Neurosurg
1992
;76
:53
–61.Lang AE, Lozano AM, Montgomery E, Duff J, Tasker R, Huchinson W. Постеровентральная медиальная паллидотомия при запущенной болезни Паркинсона.
N Engl J Med
1997
;337
:1036
–42.Лэнгстон Дж. У., Виднер Х., Гетц К. Г., Брукс Д., Фан С., Фриман Т. и др. Основная программа оценки внутримозговых трансплантаций (CAPIT).
Mov Disord
1992
;7
:2
–13.Lozano AM, Lang AE, Galvez ‐ Jimenez N, Miyasaki J, Duff J, Hutchinson WD, et al. Влияние паллидотомии GPi на двигательную функцию при болезни Паркинсона.
Ланцет
1995
;346
:1383
–7.Мандибур G, Кинг WM, Мур К.Стереотаксическая задне-вентральная паллидотомия улучшает контроль баланса по данным компьютерной постурографии.
Стереотактная функция Neurosurg
1999
;72
:233
–40.Marsden CD. Загадочная моторная функция базальных ганглиев: лекция Роберта Вартенберга.
Неврология
1982
;32
:514
–39.Martin JP. Базальные ганглии и осанка. Лондон: Питман Медикал;
1967
.п.49
–51.Массион Дж. Системы контроля осанки в перспективе развития. [Рассмотрение].
Neurosci Biobehav Rev
1998
;22
:465
–72.Мастерман Д., ДеСаллес А., Балох Р.В., Фрайзингер Р., Фоти Д., Бенке Э. и др. Моторные, когнитивные и поведенческие характеристики после односторонней вентроп-задней паллидотомии по поводу болезни Паркинсона.
Arch Neurol
1998
;55
:1201
–8.МакКоллум Дж., Лин Т.Форма и исследование пределов механической устойчивости в вертикальном положении.
J Mot Behav
1989 21:225
–44.Мелник М.Э., Доулинг Г.А., Аминофф М.Дж., Барбаро Н.М. Влияние паллидотомии на контроль осанки и двигательную функцию при болезни Паркинсона.
Arch Neurol
1999
;56
:1361
–5.Мерелло М., Балей Дж., Дельфино М., Каммарота А., Бетти О., Лейгуарда Р. Апоморфин вызывает изменения спонтанного оттока GPi у пациентов с болезнью Паркинсона.
Mov Disord
1999
;14
:45
–9.Мергнер Т., Розмайер Т. Взаимодействие вестибулярных, соматосенсорных и визуальных сигналов для контроля позы и восприятия движения в земных условиях и условиях микрогравитации — концептуальная модель. [Рассмотрение].
Brain Res
Brain Res Rev
1998
;28
:118
–35.Миллер WC, Делонг MR. Измененная тоническая активность нейронов бледного шара и субталамического ядра в модели паркинсонизма приматов MPTP.В: Карпентер МБ, Джаяраман А., редакторы. Базальные ганглии II. Нью-Йорк: Пленум Пресс;
1987
. п.415
–27.Миллер WC, Делонг MR. Симптоматика паркинсонизма. Анатомо-физиологический анализ.
Ann NY Acad Sci
1988
;515
:287
–302.Норка JW. Базальные ганглии: целенаправленный отбор и ингибирование конкурирующих моторных программ. [Рассмотрение].
Прог нейробиол
1996
;50
:381
–425.Миттельштадт Х. Соматическая гравицета.
Биол Психол
1996
;42
:53
–74.Нашнер Л.М. Компьютеризированная динамическая постурография. В: Jacobson G, Newman C, Kartush J, редакторы. Справочник по тестированию функции баланса. Чикаго (Иллинойс): Ежегодник Мосби;
1993
. п.280
–307.Нашнер Л.М. Компьютеризированная динамическая постурография. В: Goebel JA, редактор. Практическое ведение пациента с головокружением. Филадельфия (Пенсильвания): Липпинкотт Уильямс и Уилкинс;
2001
.п.143
–70.Нашнер Л.М., Black FO, Настенный CD. Адаптация к измененным опорным и зрительным условиям в стойке: пациенты с вестибулярным дефицитом.
J Neurosci
1982
;2
:536
–44.Нини А., Фейнгольд А., Словин Х., Бергман Х. Нейроны в бледном шаре не проявляют коррелированной активности у нормальной обезьяны, но синхронизированные по фазе колебания появляются в модели паркинсонизма MPTP.
J Нейрофизиол
1995
;74
:1800
–5.Paloski WH, Reschke MF, черный FO. Восстановление контроля постурального равновесия после космического полета. Заключительный отчет по медицинскому проекту орбитального аппарата увеличенной продолжительности. НАСА;
1999
. 5.4. п.1
–16.Родитель A, Hazrati L-N. Функциональная анатомия базальных ганглиев. I. Кортико-базальные ганглии-таламо-кортикальная петля. [Рассмотрение].
Brain Res
Brain Res Rev
1995
a;20
:91
–127.Родитель A, Hazrati L-N.Функциональная анатомия базальных ганглиев. II. Место субталамического ядра и внешнего паллидума в контуре базальных ганглиев. [Рассмотрение].
Brain Res
Brain Res Rev
1995
b;20
:128
–54.Пастор MA, Day BL, Marsden CD. Вестибулярные постуральные реакции при болезни Паркинсона.
Brain
1993
;116
:1177
–90.Петерка Р.Ж., Черный FO. Возрастные изменения в контроле осанки человека: тесты сенсорной организации.
J Вестибулярный Res
1990
;1
:73
–85.Raz A, Feingold A, Vaadia E, Abeles M, Bergman H. В фазе нейрональных колебаний в базальных ганглиях тремучих обезьян верветок, получавших лечение МРТР [аннотация].
Soc Neurosci Abstr
1997
;23
:466
.Райхерт WH, Дулиттл Дж., Макдауэлл Ф.Х. Вестибулярная дисфункция при болезни Паркинсона.
Неврология
1982
;32
:1133
–8.Сэмюэл М., Капуто Е., Брукс Д. Д., Шраг А., Скаравилли Т., Бранстон Н. М. и др. Исследование медиальной паллидотомии при болезни Паркинсона: клинические результаты, расположение МРТ и осложнения.
Brain
1998
;121
:59
–75.Schaltenbrand G, Bailey P. Einfuhrung in die stereotaktischen Operationen: mit einem Atlas des menschlichen Gehirns (Введение в стереотаксис с атласом человеческого мозга). Штутгарт: Тиме;
1959
.Скотт Р., Грегори Р., Хайнс Н., Кэрролл С., Хайман Н., Папанасстасиу В. и др. Нейропсихологические, неврологические и функциональные результаты после паллидотомии по поводу болезни Паркинсона. Последовательная серия из восьми одновременных двусторонних и двенадцати односторонних процедур.
Brain
1998
;121
:659
–75.Шеннон К.М., Пенн Р.Д., Кроин Дж.С., Адлер С.Х., Янко К.А., Йорк М. и др. Стереотаксическая паллидотомия для лечения болезни Паркинсона. Эффективность и побочные эффекты через 6 месяцев у 26 пациентов.
Неврология
1998
;50
:434
–8.Smithson F, Morris ME, Iansek R. Выполнение клинических тестов равновесия при болезни Паркинсона.
Phys Ther
1998
;78
:577
–92.Суарес Д.И., Метман Л.В., Райх С.Г., Догерти П.М., Халлетт М., Ленц Ф.А. Паллидотомия при гемибаллизме: эффективность и характеристики нейрональной активности.
Ann Neurol
1997
;42
:807
–11.Свеннилсон Э., Торвик А., Лоу Р., Лекселл Л. Лечение паркинсонизма стереотаксическими термоповреждениями в паллидальной области. Клиническая оценка 81 случая.
Acta Psychiatr Neurol Scand
1960
;35
:358
–77.Тул Т., Парк С., Хирш М.А., Леман Д.А., Мейтленд К.Г. Многокомпонентный характер равновесия у людей с паркинсонизмом: регрессионный подход.
J Neural Transm Gen Sect
1996
;103
:561
–80.Trenkwalder C, Paulus W, Krafczyk S, Hawken M, Oertel WH, Brandt T. Постуральная стабильность отличает «нижнюю часть тела» от идиопатического паркинсонизма.
Acta Neurol Scand
1995
;91
:444
–52.Витек Дж. Л., Жиру М. Физиология гипокинетических и гиперкинетических двигательных расстройств: модель дискинезии. [Рассмотрение].
Ann Neurol
2000
; 47 (4 Прил. 1):S131
–40.Витек Дж. Л., Эш Дж., Делонг М. Р., Александр Г. Е..Изменение свойств соматосенсорной реакции нейронов в «моторном» таламусе паркинсонических обезьян, получавших лечение МРТР [аннотация].
Soc Neurosci Abstr
1990
;16
:425
.Vitek JL, Ashe J, Kaneoke Y. Спонтанная нейрональная активность в моторном таламусе: изменение характера и скорости при паркинсонизме.
Soc Neurosci Abstr
1994
;20
:561
.Waterston JA, Hawken MB, Tanyeri S, Jantti P, Kennard C.Влияние сенсорных манипуляций на контроль позы при болезни Паркинсона.
J Neurol Neurosurg Psychiatry
1993
;56
:1276
–81.Winn P, Brown VJ, Inglis WL. О взаимоотношениях полосатого тела и тегментального ядра педункулопонтина. [Рассмотрение].
Crit Rev Neurobiol
1997
;11
:241
–61.Вольфсон Л., Уиппл Р., Дерби Калифорния, Амерман П., Мерфи Т., Тобин Дж. Н. и др. Динамическое постурографическое исследование баланса у здоровых пожилых людей.
Неврология
1992
;42
:2069
–75.Woollacott MH, Шамвей-Кук A, Нашнер LM. Старение и контроль осанки: изменения в сенсорной организации и мышечной координации.
Int J Aging Hum Dev
1986
;23
:97
–114.Заметки автора
1 Кафедра неврологии и неврологических наук, Стэнфордский университет, Стэнфорд, Калифорния, и 2 NeuroCom International, Клакамас, Орегон, США
Биомеханический анализ теста на отрыв
Постуральная нестабильность при болезни Паркинсона (БП) обычно оценивается с помощью теста на отрыв.Этот клинический тест может быть смещен из-за изменчивости прилагаемого тягового усилия. Наша цель состояла в том, чтобы изучить постуральные реакции, вызываемые воспроизводимыми тяговыми силами у здоровых субъектов и пациентов с болезнью Паркинсона на разных стадиях заболевания. Мы выполнили мультимодальный подход, который включал систематический анализ тягового усилия, необходимого для достижения обратного предела устойчивости (FBLoS), оцениваемого механически созданными силами, смещений центра давления (CoP), зарегистрированных на силовой платформе, и задержек и паттерны активации стабилизирующих мышц.Сравнение между группами проводилось с помощью одномерного и многомерного статистического анализа. Были обследованы 64 здоровых субъекта и 32 пациента с болезнью Паркинсона, 22 стадии по Hoehn – Yahr (H – Y) I – II и 10 H – Y стадии III. У здоровых субъектов FBLoS снижался с возрастом и был ниже у женщин. Среднее (SD) FBLoS составило 98,1 (48,9) Ньютона (N) у здоровых субъектов, 70,5 (39,8) N у пациентов с PD H – Y стадий I-II и 37,7 (18,9) N у пациентов с PD H – Y стадии III. По сравнению со здоровыми субъектами и с поправкой на возраст и пол, пациенты с PD H – Y стадий I-II демонстрировали следующее: (a) снижение FBLoS; (б) большие смещения ЦП и более высокие скорости при той же приложенной силе; и (c) комбинированные стратегии голеностопного сустава и бедра, вызванные менее интенсивными тяговыми усилиями.Все эти нарушения были более выражены у пациентов с болезнью Паркинсона III стадии H-Y по сравнению с пациентами с болезнью Паркинсона I-II стадии H-Y. В заключение, пациенты на ранних стадиях БП уже демонстрируют определенную степень постуральной нестабильности из-за неэффективных постуральных корректировок, и их легче дестабилизировать небольшими возмущениями, чем здоровых субъектов. Это нарушение баланса становится более выраженным при более поздних стадиях болезни Паркинсона. В испытании на растяжение сила тяги для шага назад должна быть переменной, которую следует учитывать при проверке равновесия в клинической практике.
1. Введение
Постуральная нестабильность и нарушения походки являются одними из основных инвалидизирующих и не поддающихся лечению симптомов у пациентов с запущенной болезнью Паркинсона (БП). Они составляют главную причину падений, которые являются частым, повторяющимся и трансцендентным явлением при БП, связанным с повышенной заболеваемостью, смертностью, ухудшением качества жизни и высокими финансовыми затратами на здравоохранение [1–3]. Баланс определяется как способность поддерживать центр тяжести (CoG) в пределах устойчивости тела (LoS) как в статических, так и в динамических условиях [4].Постуральная нестабильность при БП связана с нарушением постуральных реактивных реакций и снижением функционального LoS [5, 6].
Тест на отрыв или тест ретропульсии остается основным клиническим тестом для оценки баланса при БП и других неврологических расстройствах [7]. Это единственный тест, который оценивает постуральную нестабильность в моторной части унифицированной рейтинговой шкалы болезни Паркинсона (UPDRS) [8], и его патологический ответ указывает на изменение стадии Хоена и Яра (H – Y) с II на III [ 9].Такое прогрессирование подразумевает клинический дисбаланс и, следовательно, повышенный риск падений [10].
Однако некоторые исследования показали, что точность теста на отрыв для прогнозирования падений ограничена [11–14]. Это может быть частично связано с тем, что падение является результатом сложного взаимодействия между балансом, походкой, познанием и факторами окружающей среды, и тест на тягу отражает только часть этого [7, 15]. Другое объяснение заключается в вариабельности характеристик и интерпретации теста на вытягивание у разных наблюдателей.Признанный источник вариабельности заключается в силе тяги плеча, другими словами, существует столько же различных сил теста тяги, сколько разные экзаменаторы выполняют тягу [16].
В исходном UPDRS шаг назад в тесте на отрыв был классифицирован как «ретропульсия» [8]. Однако в самой последней версии MDS-UPDRS указано, что тяговое усилие должно в достаточной степени смещать CoG, чтобы пациент должен был сделать хотя бы один шаг назад [17]. Этот практический консенсус не принимал во внимание концепцию функциональной LoS.LoS определяется как максимальное смещение массы тела во время реакции стопы на месте на внешние возмущения без падения или шага [18]. LoS снижается у пациентов с БП, и это считается признаком постуральной нестабильности [6]. В зависимости от интенсивности и характеристик тягового усилия, отступление назад, даже на один шаг, может означать снижение прямой видимости объекта назад и, следовательно, признак легкой постуральной нестабильности.
Испытание на растяжение не проводилось систематически с использованием воспроизводимых механически создаваемых сил.Целью нашего исследования было провести биомеханический анализ теста на отрыв у здоровых субъектов и пациентов с БП. Таким образом, мы оценили силу, необходимую для достижения обратной прямой видимости, смещения центра давления и стратегии стабилизации положения тела.
2. Материалы и методы
2.1. Участники
Выборка исследования включала 64 здоровых субъекта (38 женщин), которые варьировались в широком диапазоне по возрасту, росту и весу, чтобы иметь возможность адекватно оценить каждую из этих физиологических переменных.Здоровыми испытуемыми были в основном супруги пациента с БП или сотрудники больницы, которые вызвались добровольцами. Исключались здоровые субъекты с любым заболеванием, которое могло нарушить баланс (например, слепота, вестибулярная патология, инсульт в анамнезе, периферическая невропатия, когнитивные нарушения, значительная патология позвоночника или злоупотребление наркотиками или алкоголем). Критерии включения для здорового участника должны были быть от 18 до 90 лет и не страдать ни одним из исключенных заболеваний. Шесть субъектов были исключены (3 отказались от участия и у 3 была исключенная патология).
Были изучены 32 пациента с БП, которые соответствовали критериям банка мозга Великобритании [19], включая H – Y стадии I, II и III. Пациенты были набраны из амбулаторной клиники отделения двигательных расстройств при больнице Университарио Грегорио Мараньон неврологом, специализирующимся на двигательных расстройствах. Пациенты с БП с любым другим заболеванием, которое могло нарушить баланс, также были исключены. Пациенты, получавшие передовые методы лечения (нейрохирургия, леводопа или апоморфиновые насосы), и пациенты с умеренными и тяжелыми дискинезиями, которые могли повлиять на постурографическую оценку, были исключены.Восемь пациентов с БП были исключены (6 отказались от участия, у 1 была исключенная патология и у 1 была H – Y стадия IV).
Возраст, пол, рост, вес, индекс массы тела (ИМТ), медицинский и хирургический анамнез, текущие лекарства и история падений были оценены у всех участников. Человек считался «падшим», если он / она перенес одно или несколько падений за предыдущие 6 месяцев. Падение определялось как событие, в результате которого пациент непреднамеренно упал на землю или другой более низкий уровень, но не в результате серьезного внутреннего события или серьезной опасности [20].У пациентов продолжительность заболевания (от начала двигательных симптомов), наличие двигательных колебаний, двигательная часть UPDRS [8] и стадия H – Y [9] всегда регистрировались одним и тем же врачом (JRPS). ) непосредственно перед тестом. При тестировании все пациенты находились на приеме лекарств.
Исследование было одобрено местным комитетом по этике больницы Universitario Gregorio Marañón. Все участники подписали форму информированного согласия.
2.2. План эксперимента
Участники были обследованы в Лаборатории анализа осанки и походки нашего учреждения.Чтобы выполнить испытание на механическое растяжение, мы использовали специальное устройство с грузами и шкивами (Rehab selection QM959-AL0; TechnoGym Inc.), подключенное к ремню, окружающему плечи испытуемого, который доставлялся через регулируемый по высоте шнур, установленный на средней межлопаточной линии перпендикулярно к нему каудокраниальная ось тела, механически создаваемые воспроизводимые силы 21,6 Н, 36,3 Н, 51,0 Н, 65,7 Н, 80,4 Н, 95,1 Н, 118,6 Н, 142,1 Н, 165,6 Н, 189,1 Н, 212,7 Н и 236,2 Н
Испытания проводились на постурографической силовой платформе (AccuSway Plus; AMTI Inc.) для измерения смещения центра давления (ЦД). Паттерны мышечной активации изучались с помощью одновременной регистрации поверхностной электромиографии (ЭМГ) следующих мышц: передняя большеберцовая мышца, латеральная икроножная мышца, латеральная широкая мышца бедра, двуглавая мышца бедра, прямая мышца живота и паравертебральные мышцы.
Участники стояли прямо, с открытыми глазами и босиком, расставив ступни на расстоянии 10–15 см на силовой платформе. Ранее они были проинформированы о характере процедуры.Применялись быстрые механически ожидаемые обратные тяги с постепенным увеличением тягового усилия (только уникальное тяговое усилие на каждом уровне силы), пока субъект не сделал хотя бы один шаг назад. Последовательные тяги выполнялись с пятиминутными интервалами, чтобы обеспечить восстановление после предыдущего подхода. Каждого участника оценивали на одном занятии, которое длилось 60–90 минут.
В каждом сеансе записывались следующие данные: (1) Сила для достижения обратного предела устойчивости (FBLoS): сила тяги, необходимая для того, чтобы участник сделал хотя бы один шаг назад.(2) Смещения центра давления (ЦД): 19 постурографических переменных, относящихся к реактивным смещениям ЦД, были получены для каждой приложенной тянущей силы. Постурографические переменные определены в Таблице 1. (3) Записи ЭМГ были инициированы началом каждой приложенной тянущей силы. Были получены следующие переменные: (a) Латентность мышечной активации: время (мсек) до начала регистрируемой ЭМГ-активности. (B) Стратегии стабилизации положения: стратегии голеностопного или тазобедренного суставов были идентифицированы в соответствии с паттерном мышечной активации, как описано Хораком. и Нашнер [21].Стратегия голеностопного сустава рассматривалась, когда передние мышцы (передняя большеберцовая, латеральная широкая и прямая мышцы живота) активировались раньше соответствующих задних мышц на каждом уровне (икроножная мышца, двуглавая мышца бедра и паравертебральные мышцы соответственно) в каудокраниальном направлении. Комбинация голеностопных и тазобедренных стратегий рассматривалась при одновременной активации задних мышц (паравертебральные мышцы, двуглавая мышца бедра и латеральная икроножная мышца) и передних мышц (передняя большеберцовая мышца, латеральная широкая мышца бедра и прямая мышца живота).
| ||||||||||||||||||||||||||||||||||||||||||||||||||
CoP: центр давления; см: сантиметры; с: секунды. | ||||||||||||||||||||||||||||||||||||||||||||||||||
2.3. Анализ данных
Описательные результаты выражаются как средние (SD) или медианы [IQR] для непрерывных переменных и как частоты для категориальных переменных. Для определения базовых различий между группами использовался критерий хи-квадрат для категориальных переменных, тест Стьюдента t для нормальных непрерывных переменных и тест Манна – Уитни U для ненормальных непрерывных переменных.
Иерархический линейный регрессионный анализ был использован для изучения возможного влияния физиологических переменных возраста, пола, роста, веса и ИМТ (независимые переменные) на FBLoS (зависимая переменная) у здоровых субъектов.ИМТ был включен в другую модель без учета роста и веса, чтобы избежать мультиколлинеарности. Затем были выполнены многомерные модели линейной регрессии, скорректированные с учетом предыдущих статистически значимых физиологических переменных (ковариат), для сравнения FBLoS между группами (независимая переменная): здоровые субъекты и пациенты с болезнью Паркинсона, здоровые субъекты и PD H – Y стадии I-II, PD стадии I-II по сравнению с PD H – Y, стадия III, и нефалеры PD против упавших PD. Переменная FBLoS была преобразована в журнал (зависимая переменная) для улучшения нормального распределения переменной и статистических моделей.
Рото-тест Спирмена использовался для корреляции различных сил, испытываемых для каждого испытуемого, с реактивными смещениями CoP. Чтобы проанализировать смещения ЦП, был проведен многомерный анализ для каждой постурографической переменной (зависимая переменная) с поправкой на силу, возраст и пол (ковариаты) между группами (независимая переменная): здоровые субъекты против пациентов с БП, здоровые субъекты и • PD H – Y стадии I-II и PD стадии I-II в сравнении с PD H – Y стадии III.
Латентные периоды мышечной активации (зависимые переменные) были проанализированы с помощью многомерных моделей, контролируемых по силе, возрасту и полу (ковариаты) между группами (независимая переменная): здоровые субъекты vs.Пациенты с БП, здоровые люди в сравнении с PD H – Y стадии I-II, и PD стадии I-II по сравнению с PD H – Y стадии III.
Тест хи-квадрат использовался для сравнения стратегий стабилизации между группами.
Статистически значимым считалось значение — <0,05.
3. Результаты
Клинические и демографические данные здоровых субъектов, пациентов с БП и их подгрупп, описательные данные переменных исследования, FBLoS, постурографические переменные, мышечная латентность и стратегии стабилизации суммированы в таблице 2.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Данные представлены как средние (SD) и медианы [IQR] для непрерывных переменных. Возраст представлен со средним значением [минимум-максимум]. Качественные переменные выражаются в виде частот. Значения P были получены с использованием теста Манна – Уитни U для ненормальных непрерывных переменных, теста Стьюдента t для нормальных непрерывных переменных и критерия хи-квадрат для категориальных переменных.HS: здоровые люди; PD: пациенты с болезнью Паркинсона; y: лет; кг: килограммы; см: сантиметры; мсек: миллисекунды; UPDRS: унифицированная шкала оценки болезни Паркинсона; FBLoS: заставить достичь обратного предела устойчивости; N: Ньютон. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Результаты статистического анализа между различными группами с точки зрения FBLoS, постурографических переменных и мышечной латентности представлены в таблице 3.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В этой таблице обобщены модели регрессии, использованные в исследовании.В левом столбце показаны все зависимые переменные, а в верхнем ряду показаны различные группы, используемые в качестве независимых переменных в каждой модели. Контролируется по возрасту и полу; контролируется по силе, возрасту и полу; R 2 : значение модели полной регрессии; β : β — коэффициент; FBLoS: заставить достичь обратного предела устойчивости; HS: здоровые люди; PD: пациенты с болезнью Паркинсона; H – Y: Hoenh & Yahr. значения соответствуют перечисленным переменным и группам.Определение постурографических переменных приведено в таблице 1. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.1. Сила для достижения предела стабильности
У здоровых субъектов FBLoS снижается с возрастом (). Среднее снижение FBLoS на 9,9 N за каждое десятилетие жизни. FBLoS также был ниже у женщин (), и на него не влияли вес (), рост () или ИМТ () испытуемых.
Скорректированный по возрасту и полу FBLoS был ниже у пациентов с БП, чем у здоровых субъектов ().Например, согласно этой многомерной модели, семидесятилетний пациент с БП достигнет своего обратного предела устойчивости с силой тяги на 20,5 Н ниже, чем у здорового субъекта того же возраста и пола. FBLoS был значительно ниже на ранних стадиях БП (H – Y I и II) по сравнению со здоровыми субъектами (). У пациентов с БП FBLoS был снижен на стадии III H – Y по сравнению с стадиями I – II H – Y (). Кроме того, наблюдалось линейное снижение FBLoS с более высокими показателями моторного UPDRS (), а у пациентов с падением PD FBLoS было значительно ниже, чем у пациентов без падений PD ().Средняя разница в FBLoS между упавшими и непадающими составляла 31,1 (13,9) N. Графики, иллюстрирующие эти сравнения, показаны на Рисунке 1.
3.2. Смещения центра давления
Была положительная корреляция между приложенной силой и последующими смещениями ЦС. r > 0,3 (ро Спирмена) было найдено для 17 из 19 изученных постурографических переменных (таблица 1) и r ≥ 0,5 () для 8 переменных. Графический пример этой корреляции показан на Рисунке 2 (а).
После корректировки по силе, возрасту и полу пациенты с PD продемонстрировали большие смещения ЦП, чем здоровые субъекты, по средней боковой оси ( X в среднем) () и максимальные смещения вперед и назад ( Y муравьев Y пост) (и, соответственно), увеличенные скорости обратного движения CoP ( Vy post) () и средняя скорость ( V avg) (), большее общее расстояние, пройденное CoP (длина пути) (), увеличенные области смещения ЦП (прямоугольная область и площадь 95) (и, соответственно), а также длина большой оси эллипса процентиля 95 -го (большой 95) ().Графический пример показан на рисунке 2 (б). Подобные различия наблюдались на ранних стадиях БП (H – Y I и II) по сравнению со здоровыми субъектами. Кроме того, пациенты с PD H – Y стадии III демонстрировали большие максимальные медиолатеральные смещения ( X справа и X слева) (и, соответственно) и большие площади смещения ЦП (прямоугольная область и область 95) (и, соответственно), чем PD H –Y пациенты I-II стадии.
3.3. Задержки мышц и стратегии стабилизации
Латентные периоды мышечной активации, вызванные первым вытягиванием, были больше у пациентов с БП, чем у здоровых субъектов для передней большеберцовой мышцы ().При последующих вытягиваниях пациенты с ПД также демонстрировали большую латентность передней большеберцовой мышцы, латеральной икроножной мышцы, латеральной широкой мышцы бедра, двуглавой мышцы бедра и прямой мышцы живота (). В многофакторном анализе после поправки на силу, возраст и пол не было значительных различий в латентности между пациентами с БП и здоровыми субъектами для первого рывка. Однако для последующих подтягиваний значения латентности были все еще значительно выше у пациентов с БП для передней большеберцовой мышцы, латеральной икроножной мышцы, латеральной широкой мышцы бедра, двуглавой мышцы бедра и прямых мышц живота ().График задержек показан на рисунке 2 (c). Задержка мышечной активации при втором и последующих вытягиваниях уже была отмечена у пациентов с БП с H – Y стадиями I-II по сравнению со здоровыми субъектами во всех мышцах (), кроме паравертебральных мышц. Не было существенной разницы в мышечной латентности между пациентами с БП с H – Y стадиями I – II и H – Y III ни для первого, ни для последующих усилий ().
В группе здоровых субъектов оценка паттерна мышечной активации с помощью ЭМГ показала, что изолированная постуральная стратегия голеностопного сустава имела место у 80.4% выполненных тестов (254/316) и комбинация стратегии голеностопного сустава и бедра произошли в 19,6% тестов (62/316). В группе PD изолированная стратегия голеностопного сустава была зарегистрирована в 60,4% тестов (61/101), а комбинированная стратегия бедра и голеностопного сустава — в 39,6% тестов (40/101). Различия между здоровыми субъектами и группой PD были значительными (). Пациенты с БП с H — Y стадии I-II также демонстрировали более высокую долю комбинированных стратегий тазобедренного сустава и голеностопного сустава, чем здоровые субъекты (35.8% против 19,6%; ). Самая низкая сила натяжения (21,6 Н) вызвала стратегию голеностопного сустава у здоровых субъектов и пациентов с БП. У здоровых субъектов средняя сила, вызывающая комбинированную стратегию голеностопного сустава и бедра, составляла 78,1 (42,9) Н, тогда как у пациентов с БП она составляла 54,1 (33,2) Н () [59,2 (35,0) Н на ранней стадии БП H – Y. стадии I-II и 35,4 (15,5) N в PD стадии H – Y III ()]. После поправки на возраст и пол в многофакторном анализе различия, наблюдаемые в силе, вызывающей комбинированную стратегию голеностопного и тазобедренного суставов, были значительными между здоровыми субъектами и пациентами с PD H – Y I – II (), а также между PD H– Y I-II и пациенты с PD H – Y III ().
4. Обсуждение
Чтобы лучше понять реактивные постуральные реакции, вызываемые воспроизводимыми тяговыми силами, мы разработали мультимодальное исследование парадигмы тяговых испытаний, которое включало тяговые силы, необходимые для достижения обратного предела устойчивости, смещения движущихся частей тела. центр давления, записанный на силовой платформе, а также латентные периоды и паттерны активации стабилизирующих мышц. Насколько нам известно, это первое систематическое исследование теста на отрыв у здоровых субъектов и пациентов с болезнью Паркинсона с использованием такого подхода с использованием воспроизводимых механически создаваемых сил.
4.1. Сила для достижения обратного предела стабильности
У здоровых субъектов FBLoS прогрессивно уменьшался с возрастом (9,9 N за десятилетие). Снижение FBLoS у пожилых людей — вероятный биологический результат. Хорошо известно, что биомеханические и нейрофизиологических систем, участвующих в балансе ухудшаются с возрастом, как с точки зрения афферентных компонентов (зрительные, вестибулярные и проприоцептивные) и эфферентных компонентов (костно-мышечной системы и вязкоупругих свойств связок, сухожилий, и перекрестков) [22–24].
Кроме того, мы обнаружили, что у самок были более низкие значения FBLoS. Это открытие может быть связано с гендерными различиями в силе мышц [25]. Вес и ИМТ не имели значимого независимого влияния на FBLoS.
FBLoS у пациентов с БП с поправкой на возраст и пол был ниже, чем у здоровых субъектов. У пациентов с БП FBLoS уменьшался с прогрессированием заболевания (стадия Hoehn – Yahr и моторный UPDRS) и был на 31,1 N ниже у падающих.
Эти результаты предполагают, что более вероятно, что пациенты с паркинсонизмом могут быть дестабилизированы небольшими внешними возмущениями, чем здоровые субъекты, особенно пациенты с более запущенным заболеванием и те, кто пережил падения.
Интересный результат этого исследования заключается в том, что FBLoS уже был снижен у пациентов на стадиях I и II по Хон-Яру. Это говорит о том, что даже пациенты с БП на ранних стадиях заболевания нарушают постуральную адаптацию, чтобы поддерживать основу при воздействии потенциально дестабилизирующих внешних сил. Таким образом, легкое нарушение баланса может произойти уже в первые годы болезни, и это может сыграть роль в падениях, о которых сообщают пациенты до того, как они достигли стадии III по Хон-Яру [10].
На сегодняшний день существует несколько исследований, в которых пытались оценить FBLoS в PD с помощью таких терминов, как «вывод субъекта из равновесия» [26] или «ступенчатый порог» [27]. В этих исследованиях не было обнаружено значительных различий между пациентами и контрольной группой. Однако методологические различия — например, натяжная веревка, прикрепляемая на уровне поясницы, так как она находится ближе к центру тяжести человеческого тела [26], натягивает, для которого направление и сила меняются, что позволяет избежать обучающего компонента [27]. , исключение пациентов с историей падений и небольшое количество изученных предметов — может объяснить разницу в результатах.
4.2. Смещение центра давления
При одинаковой силе, приложенной в испытании на растяжение, пациенты с ПД имели большие смещения ЦП и более высокие средние и обратные скорости, чем здоровые субъекты, с поправкой на возраст и пол. Это ненормальное постуральное колебание, вызванное силами притяжения, предполагает, что пациенты с паркинсонизмом нуждаются в большем количестве корректировок позы для перемещения центра тяжести тела в пределах их устойчивости, чем нормальные пациенты, и это может быть частью механизмов, лежащих в основе постуральной нестабильности при БП.Более того, большие смещения ЦА в медиолатеральном направлении, которые также были обнаружены в нашем исследовании у пациентов с паркинсонизмом, были связаны с падениями при БП [28, 29].
Наши результаты согласуются с результатами предыдущих исследований, в которых было обнаружено усиление постурального колебания в статических и динамических условиях у пациентов с БП [28, 30–32]. Однако, насколько нам известно, это первое исследование, демонстрирующее увеличение смещений ЦП с использованием воспроизводимых сил в парадигме биомеханического испытания на отрыв.
Примечательно, что большие смещения ЦП и более высокие скорости уже были обнаружены у пациентов с стадией Хон-Яра I и II по сравнению с нормальными субъектами, и более выраженное постуральное колебание у пациентов со стадией Хон-Яра III. Эти результаты, наряду с наблюдениями других групп с использованием акселерометрии туловища [33], подтверждают, что пациенты с БП испытывают аномальное постуральное колебание до того, как станет очевидным клиническое нарушение равновесия.
4.3. Задержка в мышцах и стратегии стабилизации
Пациенты с PD и контрольные субъекты продемонстрировали стратегию голеностопного сустава с низкой силой натяжения.Задержки для первой активированной мышцы, передней большеберцовой мышцы, вызванной первой силой натяжения, были одинаковыми в обеих группах.
Предыдущие исследования [34] не обнаружили различий в мышечной латентности в ответ на поверхностные трансляции между пациентами с PD и здоровыми людьми из контрольной группы.
Однако в этом исследовании с последующими вытягиваниями у контрольных субъектов была более короткая латентность, тогда как латентность активации мышц у пациентов с БП оставалась неизменной. Это сокращение латентных периодов для активации стабилизирующих мышц после повторных тестов на вытягивание может быть связано с возможной адаптивной реакцией на ожидаемые возмущения у нормальных субъектов, в то время как пациенты с БП не проявляли признаков этой адаптации.Это наблюдение может соответствовать концепции нарушения моторного обучения у пациентов с БП [35].
У контрольных субъектов комбинация лодыжек и бедер наблюдалась только при приложении интенсивных тяговых усилий. Однако у пациентов с болезнью Паркинсона комбинированные стратегии тазобедренного сустава и голеностопного сустава были более частыми и вызывались менее интенсивными силами даже на ранних стадиях заболевания. Это преждевременное задействование обеих постуральных стратегий у пациентов с БП может быть компенсаторным механизмом уже нарушенной системы равновесия.
4.4. Клиническое значение и ограничения
Наши результаты имеют клиническое значение. При оценке баланса у пациентов с БП с помощью теста тяги, шаг назад в ответ на тянущее усилие низкой интенсивности может быть ранним признаком нарушения постуральных реакций. Таким образом, в испытании на растяжение сила тяги для шага назад должна быть переменной, которую следует учитывать при проверке баланса в клинической практике. Напротив, физиотерапевтические подходы, направленные на улучшение баланса, которые обычно предлагаются пациентам с БП с явной нестабильностью и падениями, могут быть рассмотрены для пациентов с легкой и средней стадиями заболевания.
Возможным ограничением этого исследования может быть размер выборки пациентов с болезнью Паркинсона III стадии по Хон-Яру. Однако результаты для этой группы были надежными и последовательными, несмотря на относительно небольшое количество случаев.
Таким образом, мы обнаружили, что пациенты на ранних стадиях БП, то есть на стадиях I и II по Хон-Яру, уже проявляют признаки постуральной нестабильности. Эти пациенты при воздействии сил натяжения испытали аномальное колебание позы. Чтобы попытаться компенсировать дестабилизирующий эффект, вызванный внешним воздействием, в дополнение к обычной постуральной стратегии голеностопного сустава пациенты с PD также преждевременно использовали постуральную стратегию бедра.Несмотря на комбинированные постуральные стратегии, пациенты с ПД имели более низкий FBLoS, что означало, что они могли быть дестабилизированы меньшими силами тяги, чем здоровые субъекты. На этом этапе они должны были активировать стратегию спасения, заключающуюся в отступлении, чтобы изменить базу поддержки и избежать падения.
5. Заключение
Постуральная нестабильность при БП может рассматриваться как континуум, варьирующийся от легкого нарушения равновесия, уже присутствующего на стадиях Хён – Яра I и II, до тяжелой постуральной нестабильности на более поздних стадиях заболевания.При тестировании баланса у пациентов с БП в клинической практике с помощью теста тяги следует учитывать силу тяги для шага назад, поскольку один шаг назад в ответ на тягу низкой интенсивности может указывать на раннее нарушение постуральных реакций.
Доступность данных
Данные, использованные для подтверждения результатов этого исследования, включены в статью. Дополнительные данные этого исследования были депонированы в Университете Комплутенсе в Мадриде в хранилище исследований PhD: https: // eprints.ucm.es/50108/1/T40642.pdf
Конфликт интересов
Авторы не сообщают о конфликте интересов.
Благодарности
Авторы благодарят всех добровольцев за участие в этом исследовании. Авторы благодарят Хосе Марию Беллон за его поддержку статистикой. Эта работа была частично поддержана Институтом исследований Санитарии Грегорио Мараньона (POST MIR Grant 2013).
Проспективное открытое технико-экономическое обоснование с двухмесячным наблюдением за действиями Лечение
Действие наблюдения за лечением было предложено в качестве терапевтического варианта в реабилитации пациентов, страдающих болезнью Паркинсона (БП), для улучшения эпизодов замораживания походки.Целью этого проспективного открытого технико-экономического обоснования было оценить влияние 8-недельного тренинга по наблюдению за действиями (видеотерапия) на лечение постуральной нестабильности и нарушения равновесия у пациентов с БП. Были набраны пятнадцать пациентов с БП в возрасте до 80 лет с оценками от 1 до 3 по шкале Хёна и Яра и без признаков остановки походки. Они прошли 24 сеанса видеотерапевтического обучения, основанного на внимательном просмотре видеоклипов о двигательных задачах, связанных с балансом, с последующим выполнением тех же наблюдаемых движений.Никаких статистически значимых различий в показателях результатов, определенных с помощью шкалы баланса Берга и шкалы уверенности в отношении конкретных видов деятельности, не наблюдалось после двух месяцев наблюдения. В настоящем исследовании короткий курс лечения с наблюдением кажется неэффективным для снижения нарушений баланса и постуральной нестабильности у пациентов, страдающих БП от легкой до умеренной. Дальнейшие исследования с более крупными выборками, более длительным периодом наблюдения и стандартизированными протоколами наблюдения за действиями необходимы для изучения эффектов этого метода реабилитации при лечении нарушений осанки и равновесия у пациентов с БП.
1. Введение
Постуральная нестабильность является одним из основных проявлений болезни Паркинсона (БП) и становится клинической проблемой на средних и поздних стадиях, обычно возникающей после появления других клинических проявлений [1]. Пациенты с болезнью Паркинсона имеют пониженную стабильность как при статических, так и при динамических двигательных задачах, и риск падения представляет собой серьезную проблему, приводящую к инвалидности, которая влияет на повседневную жизнь и личную автономию и, как правило, может не реагировать на дофаминергическое лечение.До 40% пациентов с БП с нестабильностью осанки имеют множественные падения, которые предрасполагают к травмам, включая переломы запястья и бедра, а также потребность в медицинской помощи [2, 3]. Кроме того, социальная изоляция возникает из-за боязни ходить. Патофизиология постуральной нестабильности все еще не ясна; однако такие факторы, как нарушение или потеря постуральных рефлексов, нарушение центральной сенсорной обработки, негибкость постуральных рефлексов, постуральные деформации, взаимодействия акинезии, брадикинезии, ригидности и застывания походки могут способствовать дисбалансу при БП [4, 5] .
В настоящее время основой управления нестабильностью осанки остается обычная физиотерапия (растяжка, аэробная тренировка, расслабление и активация мышц, а также ходьба на беговой дорожке), хотя появились новые стратегии, которые могут использоваться в реабилитационных условиях в сочетании с фармакологическим лечением. Основываясь на доказательствах участия системы зеркальных нейронов (MNS) в процессе моторного обучения, была сделана предположение о роли лечения с наблюдением за действием (AOT) в области нейрореабилитации у пациентов с БП.Наблюдение за действиями, выполняемыми другими, может активировать в наблюдателе ту же нейронную сеть, когда он / она фактически выполняет то же действие [6]. Эти наблюдения предполагают, что существует общая связь между наблюдением и выполнением движения посредством интернализации временных последовательностей наблюдателем и активацией одних и тех же корковых моторных областей. Это предположение представляет собой нейрофизиологическое обоснование АОТ у пациентов, страдающих неврологическими заболеваниями. АОТ (через видео) также успешно внедряется в программы клинической реабилитации после инсульта, значительно улучшая двигательную функцию, в большей степени, чем только физиотерапия [7, 8], а также у послеоперационных ортопедических пациентов [9].Последующее повторяющееся выполнение наблюдаемых действий, передаваемых через видео, обычно касающихся повседневных движений, является способом, которым можно стимулировать активацию MNS. Обнадеживающие результаты, полученные в недавних исследованиях, показали улучшение эпизодов замирания при походке, а затем и улучшение качества жизни у пациентов с БП, проходящих сеансы видеотерапии [10]. На сегодняшний день, насколько нам известно, ни одно исследование не оценило роль АОТ в лечении постуральной нестабильности. В частности, наше внимание было уделено оценке постуральной нестабильности и нарушений равновесия, измеренной по функциональным шкалам, но за исключением пациентов с застывшей походкой, которая, по-видимому, является единственной переменной, которая, по-видимому, изменилась в предыдущих исследованиях.Таким образом, целью настоящего проспективного открытого технико-экономического обоснования было оценить эффективность АОТ в улучшении нарушений осанки и равновесия, а во-вторых, оценить, может ли АОТ положительно повлиять на уверенность в себе при повседневной деятельности и риск падений. .
2. Методы
Настоящее исследование представляет собой проспективное открытое технико-экономическое обоснование, проведенное в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации 2008 года и Руководством по надлежащей клинической практике.Это исследование было одобрено институциональным наблюдательным советом Университета Фоджиа, Фоджа, Италия. Последовательные амбулаторные пациенты с клиническим диагнозом идиопатической БП в соответствии с диагностическими критериями UK Brain Bank [11], посещавшие кафедру физической медицины и реабилитации Университета Фоджиа, Италия, с января 2014 г. по март 2015 г., были приглашены к участию и прошли скрининг на право на учебу. Пациенты, включенные в настоящее исследование, имели следующие показатели: возраст <80 лет, время с момента постановки диагноза БП ≤ 10 лет, диагноз идиопатической БП, сделанный старшим неврологом, стадия Hoehn & Yahr (H&Y) ≤ 3 [12], функциональная Категория передвижений (FAC) ≥ 4 [13], стабильный режим приема лекарств в течение месяца до и в течение 2 месяцев периода исследования, а также любой тип реабилитации за три месяца до и во время протокола исследования.Критерии исключения: сосудистый и ятрогенный паркинсонизм; вестибулярная дисфункция, сердечно-сосудистой системы, опорно-двигательного аппарата и проблемы, которые могут повлиять на баланс; Синдром Пизы; сильное нарушение зрения; когнитивные нарушения, которые могли ограничить приверженность к лечению, в частности, пациенты с оценкой краткой шкалы оценки состояния (MMSE) <24 [14]; тяжелые дискинезии или колебания типа «включено-выключено»; и терапии, включающие стратегии подсказок или другие упражнения. Субъекты с застывшей походкой, идентифицированные с помощью пункта 3 опросника «Заморозка походки» (FOG-Q) [15], также были исключены из исследования.Кроме того, их попросили сделать быстрые узкие повороты на 360 ° из состояния покоя, на месте и в обоих направлениях в качестве дополнительного теста, чтобы объективно выявить застывание походки [16]. Всего было зарегистрировано 15 участников (9 женщин, 6 мужчин), отвечающих критериям включения, и после полного описания протокола предоставили информированное письменное согласие на участие в исследовании.
2.1. Процедуры
Участники прошли 8-недельную программу реабилитации 3 раза в неделю, и лечение проводилось под наблюдением опытного физиотерапевта.Каждый сеанс терапии проходил в светлом и не обставленном помещении, чтобы избежать элементов, которые могут повлиять на внимание пациентов. Общее количество тренировок на одного испытуемого составляло 24. Пациенты сидели в удобном кресле, а экран монитора (25 дюймов) располагался перед ними на расстоянии 100 см. Их проинструктировали внимательно просмотреть спроектированные видеоролики, касающиеся двигательных задач и двигательных последовательностей, связанных с балансом. Движения записывались спереди, сбоку и сзади, чтобы пациент понимал правильное выполнение в трех измерениях.Были показаны две разные серии из четырех видеороликов в первый месяц лечения и в последний месяц. Этот выбор был мотивирован необходимостью как выполнять все более сложные двигательные действия, так и добиться большей приверженности пациентов. Продолжительность каждого видео — 1,50 мин .; затем это было повторено еще два раза, последний раз был замедлен (2 ‘), так что общая продолжительность наблюдаемого действия составила 5 минут. В конце каждого видеоролика пациентов просили выполнять наблюдаемое действие в течение следующих 5 минут, а терапевт постоянно поощрял их выполнять свой полный потенциал.Каждый сеанс АОТ и индивидуальной реабилитации длился 40 минут. В таблице 1 показано содержание видеороликов, показанных для AOT. Во время исследования участников проинструктировали регулярно принимать лекарства от болезни Паркинсона и обучили во время фазы включения, в течение 2 часов после приема последней дозы.
| ||||||||||||||||||||||
2.2. Основные показатели результатов
Пациенты были оценены на исходном уровне ( t 0 ) и после окончания протокола реабилитационного лечения продолжительностью 8 недель ( t 1 ) тем же исследователем. Использовалась батарея клинических тестов, включая первичные и вторичные оценки результатов. Оценка проводилась в одно и то же время утром, во время состояния ON (<2 часов после приема дофаминергического препарата). Среди основных критериев оценки результатов, Шкала баланса Берга (BBS) представляет собой утвержденную шкалу из 14 пунктов (0–4 балла за задачу; высокий = наилучшая производительность), которая оценивает способность балансировать во время сидения, стоя и изменения положения.Общие баллы указывают на способность к общему равновесию, от 0 до 20 - на высокий риск падения; оценка от 21 до 40 указывает на средний риск падения; и оценка от 41 до 56, указывающая на низкий риск падения [17]. Оценка 43,5 или ниже предполагает риск падений [18]. Шкала уверенности в балансе по конкретным видам деятельности (ABC-16) применялась для исследования самооценки уровня уверенности в балансе при выполнении 16 повседневных жизненных действий с оценкой от 0 до 100 каждое. Пациенты с оценкой ниже 75.6 из них подвержены риску падений [18].
2.3. Вторичные критерии оценки результатов
Эти критерии оценки результатов включали Единую рейтинговую шкалу оценки болезни Паркинсона, часть III (UPDRS III) [19], тест с ходьбой на 10 метров (10MWT) [20] и тест Timed Up and Go (TUG) [21] . Единая шкала оценки болезни Паркинсона (UPDRS) с четырьмя разделами (I: немоторный опыт повседневной жизни; II: двигательный опыт повседневной жизни; III: двигательное обследование; и IV: двигательные осложнения) оценивается от 0 до 199 (199 представляет собой наихудшая инвалидность и 0 означает отсутствие инвалидности).Часть III использовалась как вторичный результат (оценка от 0 до 108). Пункты включают тремор покоя, тремор действий, мимику, ригидность, брадикинезию, походку и осанку [19]. 10MWT измеряет скорость походки по времени, необходимому для прохождения 10 метров. Тест Timed Up and Go оценивает функциональное равновесие и базовые навыки мобильности путем измерения секунд, когда испытуемого просят подняться из положения сидя, пройти 3 метра, вернуться и сесть [20]. Предлагаемый пороговый балл для прогнозирования падений Pd составляет 11.5 секунд [21].
2.4. Статистический анализ
Все переменные и разница между исходным уровнем ( t 0 ) и оценками результатов после лечения ( t 1 ) были выражены как средние значения (95% доверительные интервалы (ДИ)) и сравнивались с использованием шкалы Крускала. -Тест Уоллиса. Уровень статистической значимости был установлен как. Анализ данных проводился с использованием STATA MP 10.1.
3. Результаты
Пациенты с ПД в возрасте от 60 до 77 лет (среднее значение = 68.9 ± 4,7) имели среднюю продолжительность заболевания в месяцах. Демографические и клинические характеристики 15 пациентов с БП, включенных в настоящее исследование, показаны в таблице 2: 60% (n. 9) пациентов, включенных в исследование, составляли женщины. В таблице 3 показаны первичные (BBS и ABC-16) и вторичные (UPDRS III, 10MWT и TUG) баллы оценки исходов на исходном уровне ( t 0 ) и через 8 недель лечения ( t 1 ). с разницей в баллах и 95% доверительных интервалов. Статистически значимых различий по всем первичным и вторичным критериям результатов, использованным в настоящем исследовании, не наблюдалось.
| ||||||||||||||||||||
| H&Y: стадия Hoehn & Yahr; FAC: категория функциональной амбулатории; и MMSE: Краткий государственный экзамен. | ||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 95% ДИ: 95% доверительный интервал; BBS: шкала баланса Берга; ABC-16: Шкала уверенности в балансе по конкретным видам деятельности; 10MWT: тест на ходьбу на 10 метров; TUG: Timed Up and Go Test; UPDRS III: Единая рейтинговая шкала болезни Паркинсона, часть III. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение
Дисбаланс и постуральная нестабильность являются одними из самых инвалидизирующих проблем БП, которые все еще частично понимаются неправильно. В настоящем проспективном открытом технико-экономическом исследовании мы стремились продемонстрировать влияние АОТ на постуральную нестабильность и нарушения равновесия у пациентов с БП, а также на возникновение у этих пациентов замирания походки [10]. АОТ — это инновационный метод реабилитации, который успешно применяется, в частности, для реабилитации больных с инсультом [7, 8].К сожалению, настоящие результаты не свидетельствуют о том, что этот метод неэффективен для снижения нарушений равновесия и постуральной нестабильности у пациентов с легкой и средней степенью БП.
Несколько исследований и обзорных статей были посвящены эффективности АОТ у пациентов с БП [10, 22–25]. АОТ в сочетании с повторением наблюдаемых действий имеет положительный эффект с точки зрения сохранения информации, но только тогда, когда наблюдаемые движения соответствуют отрабатываемым движениям. Наблюдение за только что выполненным видео и повторение последовательностей движений, происходящих при АОТ, позволяют стимулировать ПНВ с участием базальных ганглиев.Фактически, предыдущие исследования показали обнаружение изменений потенциалов локальных полей (LFP), записанных из субталамического ядра у пациентов с БП во время наблюдения за движением, выполняемым другим человеком, тогда как во время наблюдения статического изображения сигналы LFP обнаружены не были. Эти изменения присутствовали как в «выключенном», так и в «включенном» моторном состоянии ПД и были аналогичны тем, которые наблюдались во время выполнения движения [26, 27]. Эти результаты могут объяснить эффективность реабилитации при брадикинезии или двигательных нарушениях при БП.
В частности, Pelosin и его коллеги показали, что АОТ оказывает дополнительный положительный эффект на восстановление способности ходить у пациентов с БП с застыванием походки [10]. В частности, испытуемые, включенные в исследование, прошли 60-минутную физиотерапевтическую тренировку по 3 занятия в неделю в течение 4 недель. Группа пациентов с болезнью Паркинсона просмотрела 6 видеоклипов, демонстрирующих стратегии, полезные для предотвращения остановки эпизодов походки. Во время каждой тренировки дважды демонстрировались два видеоролика (с разной последовательностью действий).Другая группа пациентов просмотрела два видеоклипа (представленные дважды), содержащие последовательности статических изображений гор и побережья, сельской местности и пустынь без каких-либо изображений живых существ (людей или животных). Пелосин и его коллеги заметили, что испытуемые, представившие видео с активными движениями, улучшили застывание походки лучше, чем пациенты, которые смотрели «статическое» видео [10], даже если также еще не ясно, будет ли более эффективным выполнение движений выполняются одновременно или после АОТ.Еще один значимый результат был получен в отношении уменьшения брадикинезии после всего лишь одного сеанса АОТ у пациентов с БП по сравнению с субъектами, получившими акустический сигнал [28]. Насколько нам известно, на сегодняшний день нет исследований, посвященных изучению роли АОТ в снижении баланса и нарушений осанки у пациентов с БП.
Патогенез связанных с БП нарушений баланса и постуральной нестабильности, вероятно, многофакторный: в качестве причинных факторов были предложены дистония, ригидность, проприоцептивная и сенсомоторная дезинтеграция, а также периферические дегенеративные процессы.Следовательно, возможно, что поражения недопаминергических систем могут играть роль в патофизиологии постуральной нестабильности при БП [27]. Стратегии упражнений, которые классически используются для улучшения баланса, включают внешние силы, против которых необходимо выполнять произвольное движение (и нервно-мышечные реакции), а также в ответ на неожиданное возмущение / раздражитель, чтобы поддерживать центр масс тела в управляемых пределах базы поддержки или в пути к новой базе поддержки. Между несколькими техниками реабилитации, глобальной постуральной реабилитацией, функциональной статической и динамической тренировкой равновесия стоя, компьютеризированной тренировкой равновесия с использованием визуальной обратной связи, укрепляющими упражнениями, танцами, йогой, вибрационной платформой, тайцзи и сенсорными сигналами можно оказывать физиологические эффекты на корковом уровне. действует на внутрикортикальное торможение или возбуждение в областях, контролирующих мышцы-сгибатели и разгибатели [29].Недавнее исследование показало, что четырехнедельных тренировок в помещении и четырехнедельной реабилитации на открытом воздухе достаточно для улучшения баланса и осанки у пациентов с БП [30]. Авторы использовали переобучение осанки, упражнения на гибкость, силовые тренировки с функциональными задачами, танец баланса, модифицированное Вин Чун (китайское боевое искусство) и Упражнение квадратного шага с восемью специальными схемами с прогрессивными уровнями сложности, направленными на разнонаправленное равновесие и навыки ходьбы [30]. Другое исследование показало, что двенадцать недель реабилитационных тренировок, сфокусированных на прогрессивных упражнениях, направленных на улучшение функции более глубоких мышц туловища, были эффективны для улучшения клинических показателей баланса у людей с БП [31].Более того, было показано, что подобные упражнения в сочетании с аэробными упражнениями и растяжкой значительно улучшают силу и подвижность мышц туловища у людей с БП. Комбинация постуральной реабилитации и кинезиотейпирования мышц туловища в реабилитационной программе, применяемой в течение четырех недель, может использоваться для уменьшения осевых нарушений осанки и риска падения при БП [32].
Разнообразие результатов, полученных в реабилитационных программах и процедурах, подтверждает отсутствие стандартных процедур для улучшения равновесия и осанки у субъектов, страдающих болезнью Паркинсона.Фактически, действие нескольких техник направлено на нарушенные системы контроля позы, включая гибкость и силу, упреждающую регулировку позы, сенсорную ориентацию в ответах позы и стабильность походки [33]. Целью настоящего исследования было оценить эффективность АОТ для уменьшения нарушений равновесия и осанки у пациентов с БП. В настоящем исследовании выбор типа движений и, следовательно, содержания видео для показа был результатом многочисленных оценок, экстраполированных из существующей литературы, а также адаптированных к нашей популяции пациентов с БП.Двигательные последовательности, содержащиеся в видеороликах, касались принятия положений, строго связанных с равновесием, когда пациенты с БП сидят или когда они стоят во время ходьбы. Мы сосредоточились на постуральной нестабильности, которая оценивалась в первую очередь с помощью BBS и лечилась с помощью AOT, терапии, которая была успешно интегрирована во многие области нейрореабилитации. Следовательно, пациенты с БП не проходили традиционные программы физической подготовки в период обучения видеотерапии, чтобы избежать возможных затруднений при изучении возможных эффектов АОТ.На сегодняшний день нет доказательств того, что АОТ может быть полезным для уменьшения нарушений равновесия и осанки у пациентов с БП. Наши результаты не подтверждают гипотезу об использовании этого реабилитационного метода в этой области. Фактически, анализ результатов, используемых для тестирования пациентов на исходном уровне и после двух месяцев лечения, показал лишь небольшое улучшение клинических характеристик пациентов, касающихся равновесия и осанки. Неожиданный эффект АОТ в отношении уменьшения эпизодов остановки походки и брадикинезии [10, 28], а также восстановления моторики руки у выживших после инсульта [7, 8] оказался безуспешным в отношении уменьшения нарушений равновесия и осанки.
AOT основан на привлечении моторных областей не только тогда, когда действия действительно выполняются, но также когда они мысленно репетируются или просто наблюдаются. Зеркальные нейроны локализованы в премоторной коре и прилегающей области 44, человеческом гомологе области F5 [34, 35], впервые описанной у обезьян, поэтому они действуют на двигательную систему, улучшая моторику верхних или нижних конечностей. Это может объяснить причины, по которым наши данные существенно не изменились после 8 недель AOT. Двигательная система лишь частично участвует в управлении позой и балансом.Это многофакторный процесс, основанный на проприоцептивной информации (тактильная, соматосенсорная, зрительная и вестибулярная обратная связь), которая посредством афферентных путей может изменять эфферентные реакции, опосредованные мозжечком и спинным мозгом, на антигравитарные мышцы, влияющие на мышечные веретена, органы сухожилия Гольджи, подкожные, соматосенсорные и активность механорецепторов и положение суставов. Все эти компоненты участвуют в планировании, организации, настройке и выполнении постуральных и произвольных движений. Несмотря на возможность увеличения двигательных функций пациентов с БП, представленных в нашем видео в течение 8 недель, наши субъекты не сообщили о статистически значимом улучшении нарушения равновесия и нарушений осанки, измеряемых с помощью первичных и вторичных показателей результатов.Более того, этот результат согласуется с выводом обзорной статьи о роли моторного обучения при БП [36]. Nieuwboer и его коллеги утверждали, что пациентам с БП действительно требуется больше времени для обучения, особенно для достижения автоматизации, и, особенно на более поздних стадиях болезни, могут быть приняты явные методы обучения, сенсорная информация и подсказки для улучшения обучения [36 ]. Однако даже на фоне нейродегенеративного состояния, такого как БП, поражающая базальные ганглии, модели БП на животных показали, что существует динамическое взаимодействие между дегенеративными и регенеративными механизмами этих структур, которые опосредуются упражнениями и обучением.Сфокусированная физическая активность может задействовать различные молекулярные механизмы репарации, которые не только восстанавливают моторную функцию, но и способствуют нейропротекции, по крайней мере, на моделях БП на животных [36].
5. Заключение
Несмотря на растущее количество доказательств использования АОТ в области нейрореабилитации, в настоящем исследовании не было обнаружено никаких положительных доказательств улучшения баланса и нарушений осанки у пациентов с БП легкой и средней степени тяжести в течение 8-недельных тренировок. сеансы. Мы должны признать некоторые ограничения настоящего исследования.Во-первых, небольшой размер выборки и возможность включения других форм дегенеративного паркинсонизма, несмотря на нашу точность, могут повлиять на полученные результаты. Вероятно, для достижения эффекта на постуральную нестабильность у пациентов с БП потребуются более целенаправленные и ориентированные на конкретные задачи действия программ АОТ (то есть ежедневные действия, разделенные на составляющие). Кроме того, не рассматривалось долгосрочное наблюдение. Опять же, никакой инструментальной оценки навыков равновесия, таких как компьютеризированная статическая и динамическая постурография, не проводилось, и к участникам не применялось обучение с указаниями.Наконец, учитывая отсутствие стандартизированного протокола относительно видео и динамических изображений для АОТ, нельзя сделать однозначных выводов относительно эффективности АОТ у пациентов с БП для снижения баланса и нарушения осанки. Хотя это было технико-экономическое обоснование с относительно небольшим размером выборки, результаты и данные по-прежнему важны для отчетности и предоставления ценной информации на местах. Будущие усилия будут направлены на совершенствование процессов и подходов на основе этих результатов и опыта. Следовательно, необходимы дальнейшие исследования с более крупными выборками, более длительным периодом наблюдения и стандартизованными протоколами с использованием только АОТ или плюс традиционная физиотерапия для изучения эффектов этого метода реабилитации для лечения нарушений осанки и равновесия у пациентов с БП.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Что такое постуральная нестабильность?
Постуральная нестабильность — это термин, обозначающий потерю равновесия. Это также известно как нарушение баланса. Это состояние обычно возникает у людей, у которых диагностирована болезнь Паркинсона. По мере прогрессирования заболевания у пациента могут начать теряться постуральные рефлексы, из-за чего он может чувствовать себя неуверенно на ногах.
Что такое болезнь Паркинсона?
Болезнь Паркинсона — это болезнь, поражающая мозг и его способность контролировать движения тела. Нейроны мозга производят дофамин, который влияет на движение. Когда человек страдает болезнью Паркинсона, эти нейроны дегенерируют и в конечном итоге перестают вырабатывать дофамин.
Болезнь Паркинсона в первую очередь поражает людей старше 60 лет. Болезнь Паркинсона — прогрессирующее заболевание, и симптомы со временем ухудшаются. Однако скорость ухудшения симптомов у разных пациентов сильно различается.Многие пациенты, у которых диагностирована болезнь Паркинсона, живут в течение нескольких лет, не имея каких-либо серьезных нарушений.
Симптомы постуральной нестабильности
Пациент может наклоняться вперед или назад, не контролируя это движение, что увеличивает склонность к падению. Пациент теряет рефлексы выпрямления, а это означает, что он не может предпринять корректирующие меры для предотвращения падения.
Пациенты с болезнью Паркинсона с наклоном назад часто делают шаг назад, когда начинают ходить.Если их ударили спереди, они также могут отступить. Это действие называется ретропульсией. Пациенты с нестабильностью осанки также обычно имеют сутулую осанку с опущенной головой и опущенными плечами. Пациент может делать очень короткие шаги, создавая впечатление, что он спешит вперед, чтобы восстановить равновесие. Это называется фестинацией. Иногда пациенты резко останавливаются при ходьбе и замирают на месте. В некоторых случаях это вызывает падение.
Постуральная нестабильность — это не просто надоедливое состояние; это может быть довольно серьезно.В результате такой неуравновешенности пациенты могут падать, что приводит к серьезным травмам, таким как переломы и травмы головы. Падения могут привести к госпитализации и даже смерти.
Постуральная нестабильность — ключевой показатель болезни Паркинсона. В некоторых случаях постуральная нестабильность присутствует во время диагностики болезни Паркинсона. В других случаях постуральная нестабильность может проявиться позже по мере прогрессирования заболевания. По мере развития болезни постуральная нестабильность может стать совершенно нетрудоспособной.Склонность падать может ограничивать подвижность и независимость человека, делая его более зависимым от других и менее способным заботиться о себе. Постуральная нестабильность оказывает сильное влияние на качество жизни пациента.
Избавьтесь от постуральной нестабильности
На ранних и средних стадиях болезни Паркинсона постуральную нестабильность можно лечить с помощью лекарств. По прошествии времени и прогрессирования болезни лекарства становятся менее эффективными. Тем не менее, многие пациенты на ранних и средних стадиях болезни Паркинсона достигают улучшения за счет приема дофаминергических препаратов.
Физиотерапия также может быть полезной для пациентов, которые борются с постуральной нестабильностью. Недавние данные показали, что физиотерапия даже более полезна, чем считалось ранее. Выполнение упражнений на балансировку может улучшить устойчивость и снизить риск падений.
Обувь также может способствовать стабилизации осанки. Ортопедическая обувь и ортопедические устройства могут добавить стабильности и поддержки, улучшая уровень устойчивости и равновесия пациента. Фактически, исследования показали, что ортопедические устройства — отличный выбор для раннего вмешательства у пациентов с болезнью Паркинсона.Ортезы улучшают стабильность и проприоцепцию, позволяя пациентам оставаться активными и независимыми.
Если вы страдаете от нестабильности осанки из-за болезни Паркинсона, посетите Foot Solutions UK. Мы предлагаем различные вставки для обуви, специальные опоры для свода стопы и поддерживающую обувь, которые могут значительно улучшить вашу устойчивость и помочь вам сохранить подвижность. Посетите Foot Solutions UK, чтобы узнать больше сегодня.
границ | Постуральная нестабильность, вызванная стимулами зрительного движения у пациентов с вестибулярной мигренью
Введение
Вестибулярная мигрень (ВМ) — одно из наиболее частых заболеваний, вызывающих головокружение / головокружение (1).Пациенты с ВМ более уязвимы к укачиванию, а чувствительность к движению с приступами укачивания встречается у двух третей пациентов с мигренью (2). Эта восприимчивость распространяется не только на стимулы, основанные на движении, но и на визуальные стимулы, которые создают иллюзию движения. Механизмы, лежащие в основе вестибулярных симптомов мигрени, включая эпизодическое головокружение и повышенную предрасположенность к укачиванию, еще предстоит выяснить (3).
Наиболее широко распространенным объяснением укачивания является теория сенсорного конфликта (4), которая утверждает, что комбинация сигналов, которая нарушает привычные паттерны и, таким образом, вызывает несоответствие между ожидаемыми и воспринимаемыми чувствами, приводит к укачиванию (5).Эта теория объясняет визуально вызванное укачивание в контексте того, что иллюзорное ощущение самодвижения при просмотре движущихся визуальных стимулов, называемое вектором, не соответствует вестибулярным или проприоцептивным сигналам, указывающим на то, что тело неподвижно. Напротив, субъективная вертикальная теория утверждает, что укачивание вызвано состоянием, при котором воспринимаемая вертикаль — как определено на основе интегрированной информации от зрительной, вестибулярной и проприоцептивной систем — не соответствует ожидаемой вертикали, как предсказано на на основе предыдущего опыта (6).Хотя конфликт в восприятии вертикальности подчеркивается в субъективной вертикальной теории, это похоже на теорию сенсорного конфликта (4). Также была выдвинута гипотеза, что укачивание возникает из-за нестабильности контроля положения тела или его сегментов (7). Эта гипотеза предполагает, что укачивание возникает, когда сочетание движения и визуальных стимулов действительно нарушает постуральную стабильность, определяемую как состояние, в котором неконтролируемые движения кинетической системы минимизированы (7, 8).Эта теория постуральной нестабильности фокусируется на механическом аспекте индивидуального взаимодействия между субъектом и окружающей средой, а не на врожденной вестибулярной нейрофизиологии, и может быть подтверждена доказательствами, получаемыми из результатов движения. Теория постуральной нестабильности утверждает, что постуральная нестабильность предшествует возникновению укачивания (9, 10).
Предыдущие исследования укачивания у пациентов с мигренью выявили лежащие в основе вестибулярные нарушения или аномалии движений глаз, которые обычно объяснялись на основе теории сенсорного конфликта вместе с вестибулоцеребеллярной патологией (11–13).Пациенты с ВМ часто демонстрируют спонтанный или позиционный нистагм (14), неточные саккады (13), повышенную постоянную времени вестибулоокулярного рефлекса (VOR) и большее подавление постротаторного нистагма при наклоне головы вперед (15). По сравнению с контрольной группой, пациенты с ВМ демонстрируют более слабую корреляцию между сбросом VOR и смещением его оси вращения во время постротационных наклонов (16), что предполагает дисфункцию центральной обработки для разрешения интравестибулярных сенсорных конфликтов между сигналами от отолита и полукружных каналов.Пациенты с ВМ и вестибулярными аномалиями также плохо справляются со статической постурографией и, по-видимому, больше полагаются на визуальные подсказки для контроля баланса (17). Однако количественный анализ позы, когда пациенты с мигренью попадают в ситуацию, которая может вызвать укачивание, не проводилось.
В этом исследовании мы измерили постуральную нестабильность у пациентов контрольной группы и пациентов с ВМ, когда они подвергались воздействию движущегося визуального дисплея. Мы предположили, что тяжесть нестабильности позы, вызванной применяемыми визуальными стимулами движения при сохранении статической позы, связана с предрасположенностью к укачиванию.В ходе исследования также были внесены изменения в стимулированное поле сетчатки и положение головы, чтобы определить факторы, увеличивающие постуральную нестабильность.
Материалы и методы
Участников
В это исследование было включено 18 пациентов с ВМ в период с октября по декабрь 2016 г., которые соответствовали диагностическим критериям определенной ВМ, разработанным рабочей группой Общества Барани (18). Исследуемая популяция включала 16 женщин и 2 мужчин со средним возрастом 45,67 года (стандартное отклонение 12.55 лет). Тринадцать здоровых добровольцев, включая 8 женщин и 5 мужчин со средним возрастом 37,62 года (стандартное отклонение 15,31 года), служили контрольной группой соответствующего возраста. Пациенты были исключены, если у них было нарушение внимания или в анамнезе другие неврологические, вестибулярные, зрительные или спинномозговые расстройства. Пациентам с ВМ были применены видеонистагмография и тесты на импульс головы, а пациенты с отклонениями в тестах вестибулярной функции, указывающими на другое вестибулярное расстройство, были исключены из этого исследования.У всех участников было нормальное зрение или зрение с поправкой на нормальное. Пациенты были обследованы, когда они не испытывали головной боли или головокружения / головокружения.
Аппарат
Постуральная стабильность измерялась с помощью системы с шестью степенями свободы (G4 TM , Polhemus, Колчестер, США). Работа системы G4 ™ основана на обнаружении электромагнитного поля тремя датчиками, прикрепленными к макушке, седьмому шейному и пятому поясничным позвонкам. Амплитуда электромагнитного поля на датчиках и их ориентация в нем обнаруживаются с частотой 120 Гц и передаются по беспроводной сети на концентратор, который в режиме реального времени предоставляет данные о трехмерном движении.Оси чувствительности ориентированы в анатомическом медиально-латеральном ( x -ось), передне-заднем ( y -ось) и вертикальном ( z -ось) направлениях. Стимулы зрительного движения были запрограммированы на Python с использованием программного обеспечения PsychoPy2 на ПК и представлены на 55-дюймовом мониторе (LN55C632, Samsung, Корея), расположенном в 90 см от роговицы участника. Высота монитора была отрегулирована так, чтобы стимулы подавались на той же высоте, что и глаза участника.
Протокол эксперимента
Каждому участнику было предложено встать пятками на пол и рассмотреть красную точку в центре монитора.Затем на дисплей проецировались три визуальных стимула: (1) пустой , содержащий серый фон, (2) центральный , содержащий визуальный стимул движения в виде движущейся вправо черно-белой решетки внутри центрального круга с диаметром 7,85 см, и (3) периферийный , содержащий решетчатый визуальный стимул движения, заполняющий периферию, но с центральным кругом, заполненным серым цветом (Рисунок 1). Центральный круг имел угол обзора примерно 5,0 °.Движущиеся зрительные стимулы отображались с пространственной частотой 7/200 циклов на градус угла зрения. Каждое испытание с участием трех зрительных стимулов выполнялось при двух условиях позы: (1) голова поднята вверх и (2) голова наклонена на 30 ° в одну сторону в плоскости вращения. Таким образом, каждый участник выполнил шесть испытаний (три визуальных условия × два состояния позы), и продолжительность каждого испытания была ограничена 30 секундами, чтобы минимизировать утомляемость, связанную с длительной позой и адаптацией к зрительным стимулам.Участников просили закрыть глаза и отдохнуть не менее 30 секунд между испытаниями. Во время периода покоя тяжесть головокружения и / или тошноты, вызванных каждым испытанием, измерялась с использованием субъективной 10-балльной шкалы укачивания в диапазоне от нулевого до тяжелого.
Рисунок 1 . Протокол эксперимента. Каждому участнику было предложено встать пятками на пол и рассмотреть красную точку в центре монитора. Затем на дисплей проецировались три визуальных стимула: (1) серый фон, (2) визуальный стимул движения, представляющий собой черно-белую решетку в центральном круге, ограничивающем центральный угол обзора приблизительно 5.0 ° перемещается с пространственной частотой 7/200 циклов на градус угла зрения, и (3) решетчатые стимулы зрительного движения, заполняющие зрительную периферию, но с центральным кругом, заполненным серым.
Анализ данных
Во время экспериментальных сессий необработанные сигналы были синхронно дискретизированы с частотой 120 Гц и сохранены в главном ПК через устройство концентратора. Временные ряды траекторий датчиков в трех направлениях были отфильтрованы нижними частотами с частотой 10 Гц с использованием фильтра Баттерворта четвертого порядка для удаления сигналов шума и тремора.После предварительной обработки сигналов измеренные данные включали динамическую скорость и ускорение при сохранении спокойной позиции. Среднеквадратичные значения (RMS) были рассчитаны на основе суммарной величины движения по трем осям (19) следующим образом:
суммарная скорость = vx2 + vy2 + vz2 суммарное ускорение = ax2 + ay2 + az2, где vx2, vy2 и vz2 — это отфильтрованные скорости по осям x -, y — и z — соответственно, а ax2, ay2 и az2 — соответствующие отфильтрованные ускорения.
Постуральная стабильность также была проанализирована с использованием площади качания, рассчитанной как площадь, покрывающая траекторию, образованную осями x и y , с использованием алгоритма выпуклой оболочки (20).
Статистика
Программное обеспечениеSPSS (версия 20.0, SPSS, Чикаго, США) использовалось для применения дисперсионного анализа с повторными измерениями (ANOVA) с одним фактором между субъектами (группы участников) и тремя факторами внутри субъектов (сегменты тела, визуальные стимулы и позы головы).Мы использовали простое тестирование основных эффектов для выявления попарных различий в любом значимом взаимодействии. Граница статистической значимости составляла значение вероятности p <0,05.
Результаты
RMS скорость
ANOVA с повторными измерениями скорости RMS выявил значимое трехстороннее взаимодействие для сегментов тела × визуальных стимулов × групп участников [ F (4, 128) = 2,97, p <0,05]. Среднеквадратичная скорость пациентов [0.34 ± 0,02 см / с (среднее значение ± стандартная ошибка)] было выше, чем в контроле (0,28 ± 0,02 см / с). Простое тестирование основных эффектов трехстороннего взаимодействия показало, что межгрупповая разница в среднеквадратичной скорости происходила в двух условиях: периферические зрительные стимулы в сочетании с вершиной (средняя разница [ Δ ] = 0,13 ± 0,04, F (1, 29) = 9,5, p <0,01) и периферические зрительные стимулы в сочетании с шейным отделом позвоночника [ Δ = 0.10 ± 0,03, F (1, 29) = 8,13, p <0,01; Фигура 2].
Рисунок 2 . Скорость. По сравнению с контрольной группой пациенты с вестибулярной мигренью (VM) показали значительно более высокую среднеквадратичную (RMS) скорость во время статической стойки в двух условиях: периферические зрительные стимулы в сочетании с вершиной и периферические зрительные стимулы в сочетании с шейной зоной [** p <0,01 в трехфакторном дисперсионном анализе (ANOVA) для множественных сравнений].Данные представляют собой средние значения и значения стандартной ошибки.
RMS ускорение
ANOVA с повторными измерениями среднеквадратичного ускорения выявил значимое трехстороннее взаимодействие для сегментов тела × положения головы × групп участников [ F (2, 58) = 5,66, p <0,01]. Среднеквадратичное ускорение пациентов (8,94 ± 0,74 см / с 2 ) было выше, чем у контролей (6,69 ± 0,87 см / с 2 ). Простое тестирование трехстороннего взаимодействия с основными эффектами показало, что три условия привели к межгрупповой разнице в среднеквадратичном ускорении: вертикальное положение головы в сочетании с вершиной [ Δ = 4.36 ± 1,93, F (1, 29) = 5,11, p <0,05], вертикальное положение головы в сочетании с шейным отделом позвоночника [ Δ = 3,78 ± 1,58, F (1 , 29) = 5,71, p <0,05], и поза с вертикальным положением головы в сочетании с поясничным отделом позвоночника [ Δ = 2,43 ± 1,01, F (1, 29) = 5,77, p <0,05; Рисунок 3]. Поза с наклоном головы в сочетании с каждым сегментом тела не привела к какой-либо значительной межгрупповой разнице в среднеквадратичном ускорении.
Рисунок 3 . Ускорение. Положение с вертикальным расположением головы в сочетании с каждым сегментом тела привело к тому, что RMS-ускорение во время статического положения значительно различается между контрольной группой и группами пациентов (* p <0,05 в трехфакторном дисперсионном анализе ANOVA для множественных сравнений). Напротив, поза с наклоном головы не привела к значительным межгрупповым различиям в ускорении. Данные представляют собой средние значения и значения стандартной ошибки. ВМ, вестибулярная мигрень.
Зона качания
Анализ области качания также выявил значимое трехстороннее взаимодействие для сегментов тела × визуальных стимулов × групп участников [ F (4, 116) = 2.66, p. <0,05]. Площадь качания пациентов (1,77 ± 0,22 см 2 ) была значительно больше, чем у контроля (1,04 ± 0,25 см 2 ). Простая проверка основных эффектов трехстороннего взаимодействия показала, что межгрупповое различие происходит при двух условиях: периферические зрительные стимулы в сочетании с вершиной [ Δ = 1,77 ± 0,67, F (1, 29) = 7.01, p <0,05], и периферические зрительные стимулы в сочетании с шейным отделом позвоночника [ Δ = 1.22 ± 0,55, F (1, 29) = 4,94, p <0,05; Рисунок 4]. Каждое визуальное состояние в сочетании с поясничным отделом позвоночника не приводило к каким-либо межгрупповым различиям в области качания.
Рисунок 4 . Зона качания. По сравнению с контрольной группой, пациенты с вестибулярной мигренью (VM) демонстрировали значительно большую зону качания при сохранении статической позы в следующих условиях: периферические стимулы в сочетании с макушкой и периферические стимулы в сочетании с шейным отделом позвоночника (A) .(* p <0,05 в трехфакторном дисперсионном анализе для множественных сравнений.) Примеры области качания, которая покрывала траекторию, образованную как медиально-латеральной, так и передне-задней осями для пациента с VM (B) и a контроль (С) .
Шкала субъективной болезни
Баллы по шкале субъективной болезни (SSS) значительно различались между группами пациентов и контрольной группой [ F (1, 29) = 11,08, p <0.01], а также по зрительным стимулам [ F (2, 58) = 47,03, p <0,001]. И у пациентов, и у контрольной группы визуальные двигательные стимулы увеличивали баллы по субъективной шкале болезни, особенно когда стимулы предъявлялись в периферическом поле (пустое <центральное <периферийное) (рис. 5). По сравнению с позой с поднятой головой, поза с наклоном головы в сочетании с каждым визуальным состоянием увеличивала баллы по SSS в обеих группах, но не было межгрупповых различий в величине изменения баллов [ F (1, 29) = 3.00, p. = 0,09].
Рисунок 5 . Субъективная шкала заболеваемости. Стимулы зрительного движения увеличивали баллы по шкале субъективной болезни как у пациентов с вестибулярной мигренью (VM), так и у пациентов контрольной группы, особенно когда стимулы были представлены в периферическом поле. По сравнению с положением головы вверх, поза с наклоном головы в сочетании с каждым визуальным стимулом увеличивала баллы по шкале субъективной болезни как у пациентов, так и у пациентов контрольной группы, но не было межгрупповых различий в величине изменения оценки.
Обсуждение
В этом исследовании оценивалась постуральная стабильность у пациентов с ВМ и контрольной группы с использованием парадигмы зрительного движения с двумя условиями стимулированного поля сетчатки и положения головы. Мы обнаружили, что три аспекта устойчивости позы различались между пациентами с ВМ и контрольной группой: среднеквадратичная скорость, среднеквадратичное ускорение и площадь колебания.
Результаты для среднеквадратичной скорости показали, что пациенты с ВМ в большей степени подвержены влиянию стимулов зрительного движения и демонстрируют больше движений при попытке сохранить статическую стойку, тогда как контрольная группа могла сохранять невозмутимое положение, несмотря на изменения зрительных стимулов.Пациенты с ВМ генерировали более крупные движения головы и шеи во время спокойного стояния, когда визуальные двигательные стимулы были представлены на периферии сетчатки. Это согласуется с предыдущими выводами о том, что визуальное восприятие движений является определяющим фактором в поддержании равновесия, в котором периферическое зрение играет основную роль (21, 22). Зрительные стимулы, исходящие от периферии сетчатки, передаются в вестибулоцеребеллум (23), который, как известно, проявляет дисфункцию у мигрени.Интериктальное нейротологическое обследование у пациентов с мигренью показало глазодвигательные аномалии, которые в основном связаны с вестибуллоцебеллярной дисфункцией (13). Вестибулоцеребеллум, включая узелок / язычок, отвечает за контроль вестибулярного накопительного механизма, который играет важную роль в минимизации интра-вестибулярного сенсорного конфликта (24). Вестибулярные мигрени действительно показали нарушение способности центральной интеграции вращательных сигналов из полукружных каналов и гравитационных сигналов от отолитовых органов (16).Помимо дисфункции подкорковых цепей, кортикальный путь, связанный с периферией сетчатки, отвечающий за обработку зрительных движений, также может играть роль в усилении укачивания у вестибулярных мигрени. Предыдущее исследование с использованием позитронно-эмиссионной томографии 18 F-фтордезоксиглюкозы показало усиление метаболизма в височно-теменно-инсулярных областях и двустороннем таламусе, что указывает на активацию вестибуло-таламо-кортикального пути во время приступов вестибулярной мигрени (25). ).
По сравнению с контрольной группой, наши пациенты с ВМ демонстрировали более высокие ускорения каждого оцениваемого сегмента тела, сохраняя при этом статическое положение с вертикальной позой головы. Напротив, среднеквадратичное ускорение в статической стойке с наклоненной головой не различалось между пациентами и контрольной группой. Эффект Кориолиса относится к состоянию, в котором объект вращается вокруг вертикальной оси Земли, а голова наклонена вокруг другой оси (26). В этой ситуации ощущение иллюзорного наклона обычно сопровождается сильным недомоганием.Эффект псевдо-Кориолиса относится к аналогичному состоянию, когда иллюзорное чувство вращения возникает из-за движущихся зрительных стимулов, а поворот головы от оси зрительного вращения вызывает ощущение наклона и вегетативные симптомы (27). Эффекты Кориолиса и псевдо-Кориолиса можно объяснить с помощью теории субъективной визуальной вертикали (26). Дополнительное вращение головы во время продолжающегося иллюзорного ощущения вращения приводит к смещению воспринимаемого вертикального вектора, что противоречит ожидаемой вертикальности Земли.В настоящем исследовании эффект псевдо-Кориолиса действительно вызвал сильное укачивание как у пациентов, так и у контрольной группы. Однако оценки по SSS одинаково увеличивались в двух группах во время состояния псевдокориолиса, и эффект псевдокориолиса не приводил к межгрупповой разнице в RMS-ускорении. В совокупности эти результаты предполагают, что, помимо конфликтов между воспринимаемой и ожидаемой вертикальностью, для объяснения повышенной укачивания у наших пациентов с ВМ требуются дополнительные факторы, такие как различная зрительная зависимость.
Зона колебания для пациентов с ВМ была больше, когда движущиеся зрительные стимулы предъявлялись к периферии сетчатки, и эти пациенты имели более высокие баллы по SSS, когда зрительные стимулы двигались в периферической области. Эти наблюдения показывают, что пациенты с ВМ больше зависят от визуальных входов для поддержания статической позы. Статическая стойка — это не вид состояния покоя, в котором отсутствуют видимые действия, это активное состояние, поддерживаемое системой контроля позы, которая взаимодействует с многомерной сенсорной системой.Движение, наблюдаемое как в группе пациентов, так и в контрольной группе, не следует рассматривать как шум во время пассивного невозмутимого стояния. Скорее, каждый параметр ускорения, скорости и расчетной площади качания отражает непрерывную активацию сегментов тела, необходимых для поддержания произвольной позы стоя. Учитывая, что активация при сохранении той же позы была выше у пациентов с ВМ, чем у контрольных, система контроля позы у этих пациентов, по-видимому, имеет относительно низкую эффективность. Помимо дисфункции вестибулоцеребеллума, эти характеристики более высокой зависимости от визуальных сигналов и более низкой эффективности кинетической системы могут, следовательно, привести к уязвимости к нарушению равновесия у пациентов с ВМ, что также вносит свой вклад в симптоматику ВМ, включая укачивание, тошноту и т. и головокружение.
Стабильность позы туловища при стоянии может быть количественным показателем нарушения способности равновесия при неврологических расстройствах (28). Учитывая, что проприоцепция шейки матки является одним из важных внутриконфликтных сенсорных компонентов, вызывающих укачивание, постуральная нестабильность, которая предшествует укачиванию, может не только ограничиваться центром тела, но и другие сегменты, такие как голова и шея, могут показывать гораздо больше движений для сохранение стойки у больных ВМ. Однако традиционная постурография позволяет измерять 2D-движения в поперечной плоскости и дает параметры, связанные с движением центра давления всего тела (29).Вместо традиционных платформ оценка движений тела с помощью трехосной сенсорной системы может обеспечить высокоточное измерение трехмерных движений нескольких сегментов тела (29). Анализ области качания в нашем исследовании действительно показал, что пациенты с ВМ демонстрируют более крупные движения головы и шеи, которые более удалены от центра давления тела, чем поясничная область. Поскольку трехосная сенсорная система реального времени, использованная в этом исследовании, дала обширные данные, требующие сложной предварительной обработки, однако наше исследование ограничивало количество участников.
Поскольку мы приняли парадигму, основанную на визуальном движении, для лечения укачивания, а не парадигму, основанную на физическом движении, в этом исследовании преобладало зрение. Зрение вносит основной вклад в ощущение самодвижения при наблюдении или просмотре вращения с постоянной скоростью, тогда как лабиринтные органы, специфическим стимулом которых является ускорение, могут ощущать изменения скорости, вызванные движениями головы. Таким образом, мы использовали позу с наклоном головы в качестве независимого фактора вариации для выявления эффекта псевдокориолиса, который, как известно, представляет собой сильную тошноту.Учитывая, что эффект псевдокориолиса не был ответственен за основные различия в постуральной нестабильности и баллах по шкале SSS между нашими пациентами и контрольной группой, преобладание зрения, по-видимому, является важным фактором повышенной постуральной нестабильности и учащения случаев укачивания. у пациентов с ВМ.
Заключение
Это исследование позволило количественно оценить постуральную стабильность путем измерения движений трех сегментов тела, когда стоящие участники подвергались визуальным двигательным стимулам.Постуральная стабильность значительно различалась между контрольной группой и пациентами с ВМ при тестировании с парадигмой, которая генерировала линейное движение и эффект псевдо-Кориолиса. В отличие от контроля, у пациентов с ВМ наблюдалась выраженная постуральная нестабильность головы и шеи при предъявлении зрительных стимулов на периферии сетчатки. Пациенты с ВМ показали более высокую зрительную зависимость и низкую стабильность системы контроля позы при сохранении спокойного стояния, что может быть связано с их предрасположенностью к укачиванию.
Заявление об этике
Это исследование было проведено в соответствии с рекомендациями Институционального наблюдательного совета больницы Чилгок Национального университета Кёнпук. Протокол был одобрен Наблюдательным советом больницы Чилгок Национального университета Кёнпук. Все субъекты дали письменное информированное согласие в соответствии с Хельсинкской декларацией.
Авторские взносы
Y-HL провел эксперименты, проанализировал данные и написал рукопись.J-SK внесла свой вклад в критический пересмотр рукописи. H-WL способствовал проведению экспериментов и сбору данных. Компания S-HK разработала исследование, проанализировала и интерпретировала данные и написала рукопись.
Финансирование
Эта работа была поддержана Министерством образования Республики Корея и Национальным исследовательским фондом Кореи (грант № NRF-2016S1A5B5A01025253) и грантом Корейского проекта исследований и разработок в области технологий здравоохранения Министерства здравоохранения и социального обеспечения (грант №HI16C2210).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим господина Джу-Хун Кима за помощь в проведении экспериментов.
Список литературы
7. Стоффреген Т.А., Риччио Г.Э. Экологическая теория ориентации и вестибулярного аппарата. Psychol Rev. (1988) 95 : 3–14.
PubMed Аннотация | Google Scholar
8. Стоффреген Т.А., Смарт Л.Дж. Младший. Постуральная нестабильность предшествует укачиванию. Brain Res Bull. (1998) 47 : 437–48.
PubMed Аннотация | Google Scholar
9. Koslucher F, Munafo J, Stoffregen TA. Постуральное колебание у мужчин и женщин при тошнотворном движении освещенной среды. Exp Brain Res. (2016) 234 : 2709–20. DOI: 10.1007 / s00221-016-4675-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Мурдин Л., Чемберлен Ф., Чима С., Аршад К., Грести М.А., Голдинг Дж. Ф., Бронштейн А. Морская болезнь при мигрени и вестибулярных расстройствах. J Neurol Neurosurg Psychiatry (2015) 86 : 585–7. DOI: 10.1136 / jnnp-2014-308331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Харно Х., Хирвонен Т., Каунисто М.А., Аалто Х., Лево Х., Исотало Э. и др.Субклиническая вестибулоцеребеллярная дисфункция при мигрени с аурой и без нее. Неврология (2003) 61 : 1748–52. DOI: 10.1212 / 01.WNL.0000098882.82690.65
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Чжон Ш., О Си, Ким Х. Дж., Ку Дж. У., Ким Дж. С.. Вестибулярная дисфункция при мигрени: эффекты связанного головокружения и укачивания. J Neurol. (2010) 257 : 905–12. DOI: 10.1007 / s00415-009-5435-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Ван Дж., Льюис РФ. Вклад интравестибулярного сенсорного конфликта в укачивание и головокружение при мигрени. J Neurophysiol. (2016) 116 : 1586–91. DOI: 10.1152 / jn.00345.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Тегги Р., Коломбо Б., Бернаскони Л., Беллини С., Коми Дж., Бусси М. Мигренозное головокружение: результаты калорийной пробы и стабилометрические данные. Головная боль (2009) 49 : 435–44. DOI: 10.1111 / j.1526-4610.2009.01338.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Секин М., Тамура Т., Йошида М., Суда Й., Кимура И., Миёси Х. и др. Измерение аномалии походки, основанное на среднеквадратическом значении ускорения туловища. J Neuroeng Rehabil. (2013) 10 : 118. DOI: 10.1186 / 1743-0003-10-118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Аль-Джавад А., Барлит А., Романовас М., Трахтлер М., Маноли Ю.Использование ориентационного фильтра Калмана для анализа статических постуральных колебаний. Процедура APCBEE (2013) 7 : 93–102. DOI: 10.1016 / j.apcbee.2013.08.018
CrossRef Полный текст | Google Scholar
21. Амблард Б., Карблан А. Роль фовеальной и периферической визуальной информации в поддержании постурального равновесия у человека. Навыки восприятия моторики (1980) 51 : 903–12. DOI: 10.2466 / pms.1980.51.3.903
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22.Брандт Т., Дичганс Дж., Кениг Э. Дифференциальные эффекты периферийного зрения центральных стихов на эгоцентрическое и экзоцентрическое восприятие движения. Exp Brain Res. (1973) 16 : 476–91.
PubMed Аннотация | Google Scholar
23. Бармак Н.Х., Содзяку Х. Вестибулярные и зрительные сигналы лазящих волокон, вызванные в узловом язычке мозжечка кролика естественной стимуляцией. J Neurophysiol (1995) 74 : 2573–89. DOI: 10.1152 / jn.1995.74.6.2573
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Шин Дж. Х., Ким Ю. К., Ким Х. Дж., Ким Дж. С.. Измененный метаболизм мозга при вестибулярной мигрени: сравнение интериктальных и иктальных результатов. Цефалгия (2014) 34 : 58–67. DOI: 10.1177 / 0333102413498940
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Дичганс Дж., Брандт Т. Оптокинетическая болезнь движения и эффекты псевдокориолиса, вызванные движущимися зрительными стимулами. Acta Otolaryngol.

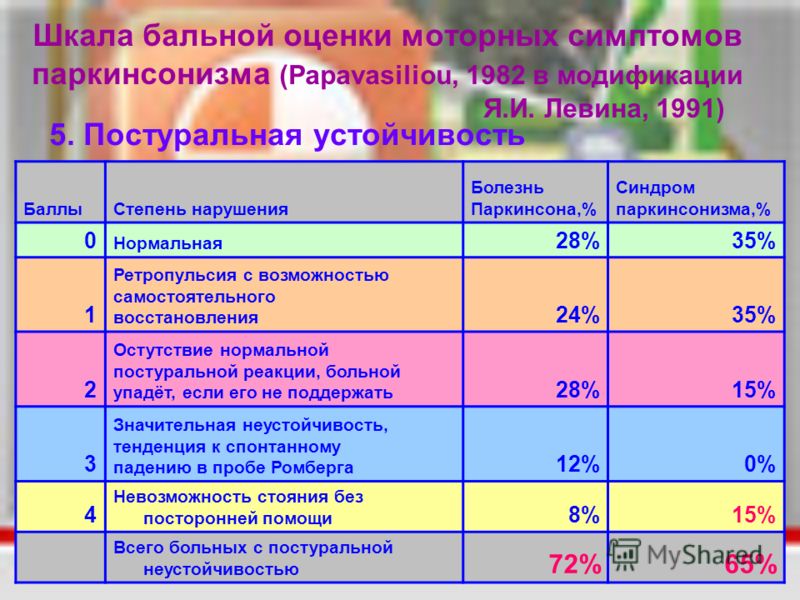 Тяжёлая инвалидизация.
Тяжёлая инвалидизация.