Патогенез ишемический инсульт: Этиология, патогенез, клиническая диагностика, дифференциальная диагностика и лечение острых нарушений мозгового кровообращения
Роль нейтрофилов в патогенезе ишемического инсульта | Долгушин
1. Виленский Б.С. Инсульт – современное состояние проблемы. Неврологический журнал. 2008; 13 (2): 1–11.
2. Wolf P.A., D’Agostino R.B., O’Neal M.A., Sytkowski P., Kase C.S., Belanger A., Kannel W.B. Secular trends in stroke incidence and mortality the Framingham Study. Stroke. 1992; 23 (11): 1551–1555. DOI: 10.1161/01.str.23.11.1551.
3. Katzan I.L., Cebul R.D., Husak S.H., Dawson N.V., Baker D.W. The effect of pneumonia on mortality among patients hospitalized for acute stroke. Neurology. 2003; 60 (4): 620–625. DOI: 10.1212/01.wnl.0000046586.38284.60.
4. Heuschmann P.U., Kolominsky-Rabas P.L.,Misselwitz B., Hermanek P., Leffmann C., Janzen R.W., Rother J., Buecker-Nott H.J., Berger K. Predictors of in-hospital mortality and attributable risks of death after ischemic stroke. Arch. Intern. Med. 2004; 164 (16): 1761–1768. DOI: 10.1001/archinte.164.16.1761.
5. Стаховская Л.В., Ключихина О.А., Богатырева М. Д., Коваленко В.В. Эпидемиология инсульта в России по результатам территориально-популяционного регистра (2009–2019). Журнал неврологии и психиартии им. С.С. Корсакова. 2013; 113 (5): 4–10.
Д., Коваленко В.В. Эпидемиология инсульта в России по результатам территориально-популяционного регистра (2009–2019). Журнал неврологии и психиартии им. С.С. Корсакова. 2013; 113 (5): 4–10.
6. Гусев Е.И., Скворцова В.И., Стаховская Л.В. Проблема инсульта в Российской Федерации: время активных совместных действий. Журнал неврологии и психиатрии им. С.С. Корсакова. 2007; 107 (8): 1–11.
7. Cкворцова В.И., Стаховская Л.В., Шерстнев В В., Грудень М.А., Мясоедов Н.Ф., Ефремова Н.М. и др. Роль аутоиммунных процессов в повреждающем действии церебральной ишемии. Журнал неврологии и психиатрии им. С.С. Корсакова. Инсульт. Приложение к журналу. 2001; 101 (1): 46–54.
8. Chamorro A., Hallenbeck J. The harms and benefits of inflammatory and immune responses in vascular disease. Stroke. 2006; 37 (1): 291–293. DOI: 10.1161/01.STR.0000200561.69611.f8.
9. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина, 2001: 328.
10. Крыжановский Г.Н., Магаева С.В., Макаров С. В., Сепиашвили Р. И. Нейроиммунопатология. Руководство. М., 2003: 282.
В., Сепиашвили Р. И. Нейроиммунопатология. Руководство. М., 2003: 282.
11. Пальцев М.А., Кветной М.И. Руководство по нейроиммуноэндокринологии. М.: Медицина, 2008: 497–499.
12. Долгушин И.И., Савочкина А.Ю., Курносенко И.В., Долгушина В.Ф., Савельева А.А., Самусева И.В., Маякова В.Б. Участие внеклеточных ДНК-ловушек в защитных и патологических процессах организма. Российский иммунологический журнал. 2015: 9 (18) 2: 164–170.
13. Долгушин И.И., Мезенцева Е.А., Савочкина А.Ю., Кузнецова Е.К. Нейтрофил как «многофункциональное устройство» иммунной системы. Инфекция и иммунитет. 2019; 9 (1): 9–38. DOI: 10.15789/2220-7619-2019-1-9-38.
14. Nesterova I.V., Kolesnikova N.V., Chudilova G.A. et al. The new look at neutrophilic granulocytes: rethinking old dogmas. Part 1. Russian Journal of Infection and Immunity. 2017; 7 (3): 219–230. DOI: 10.15789/2220-7619-2017-3-219-230.
15. Nesterova I.V., Kolesnikova N.V., Chudilova G.A. et al. The new look at neutrophilic granulocytes: rethinking old dogmas. Part 2. Russian Journal of Infection and Immunity. 2018; 8 (1): 7–18. DOI: 10.15789/2220-7619-2018-1-7-18.
Part 2. Russian Journal of Infection and Immunity. 2018; 8 (1): 7–18. DOI: 10.15789/2220-7619-2018-1-7-18.
16. Нестерова И.В., Швыдченко И.Н., Роменская В.А., Фомичева Е.В., Быковская Е.Ю. Нейтрофильные гранулоци ты – ключевые клетки иммунной системы. Аллергология и иммунология. 2008; 9 (4): 432–435.
17. Бережная Н.М. Нейтрофилы и иммунологический гомеостаз. Киев: Наукова думка, 1988: 205.
18. Neumann J., Riek-Burchardt M., Herz J. et al. Very-lateantigen- 4 (VLA-4)-mediated brain invasion by neutrophils leads to interactions with microglia, increased ischemic injury and impaired behavior in experimental stroke. Acta Neuropathologica. 2015; 129 (2): 259–277. DOI: 10.1007/s00401-014-1355-2.
19. Weston R.M., Jones N.M., Jarrott B., Callaway J.K. Inflammatory cell infiltration after endothelin-1-induced cerebral ischemia: histochemical and myeloperoxidase correlation with temporal changes in brain injury. J. Cerebral. Blood Flow and Metab. 2007; 27 (1): 100–114. DOI: 10. 1038/sj.jcbfm.9600324.
1038/sj.jcbfm.9600324.
20. Watcharotayangul J., Mao L., Xu H., Vetri F., Baughman V.L., Paisansathan C. et al. Post-ischemic vascular adhesion protein-1 inhibition provides neuroprotection in a rat temporary middle cerebral artery occlusion model. J. Neurochem. 2012; 123 (Suppl. 2): 116–124. DOI: 10.1111/j.1471-4159.2012.07950.x.
21. Perez-de-Puig I., Mirу-Mur F., Ferrer-Ferrer M., Gelpi E., Pedragosa J., Justicia C. et al. Neutrophil recruitment to the brain in mouse and human ischemic stroke. Acta Neuropathol. 2015; 129 (2): 239–257. DOI: 10.1007/s00401-014-1381-0.
22. Gelderblom M., Leypoldt F., Steinbach K., Behrens D., Choe C.-U., Siler D.A. et al. Temporal and spatial dynamics of cerebral immune cell accumulation in stroke. Stroke. 2009; 40 (5): 1849–1857. DOI: 10.1161/STROKEAHA.108.534503.
23. Martynov M.Y., Gusev E.I. Current knowledge on the neuroprotective and neuroregenerative properties of citicoline in acute ischemic stroke. J. Exp. Pharmacol. 2015; 7: 17–28. DOI: 10.2147/JEP.S63544.
DOI: 10.2147/JEP.S63544.
24. Jickling G.C., Liu D., Ander B.P., Stamova B., Zhan X., Sharp F.R. Targeting neutrophils in ischemic stroke: translational insights from experimental studies. J. Cereb. Blood Flow and Metab. 2015; 35 (6): 888–901. DOI: 10.1038/jcbfm.2015.45.
25. McCabe D.J.H., Harrison P., Mackie I.J., Sidhu P.S., Purdy G., Lawrie A.S. et al. Increased platelet count and leucocyte-platelet complex formation in acute symptomatic compared with asymptomatic severe carotid stenosis. Journal of Neurology, Neurosurgery and Psychiatry. 2005; 76 (9): 1249–1254. DOI: 10.1136/jnnp.2004.051003.
26. Ritter L.S., Stempel K.M., Coull B.M., McDonagh P.F. Leukocyte-platelet aggregates in rat peripheral blood after ischemic stroke and reperfusion. Biological Research for Nursing. 2005; 6 (4): 281–288. DOI: 10.1177/1099800405274579.
27. Kim J.Y., Park J., Chang J.Y., Kim S.H., Lee J.E. Inflammation after ischemic stroke: the role of leukocytes and glial cells. Exp. Neurobiol. 2016; 25 (5): 241–251. DOI: 10.5607/en.2016.25.5.241.
2016; 25 (5): 241–251. DOI: 10.5607/en.2016.25.5.241.
28. Hallevi H., Hazan-Halevy I., Paran Е. Modification of neutrophil adhesion to human endothelial cell line in acute ischemic stroke by dipyridamole and candesartan. European Journal of Neurology. 2007; 14 (9): 1002–1007. DOI: 10.1111/J.1468-1331.2007.01847.X.
29. Khan М.М., Motto D.G., Lentz S.R., Chauhan A.K. ADAMTS13 reduces VWF-mediated acute inflammation following focal cerebral ischemia in mice. Journal of Thrombosis and Haemostasis. 2012; 10 (8): 1665–1671. DOI: 10.1111/j.1538-7836.2012.04822.x.
30. Brinkmann V., Zychlinsky A. Beneficial suicide: why neutrophils die to make NETs. Nature Reviews Microbiology. 2007; 5 (8): 577–582. DOI: 10.1038/NRMICRO1710.
31. Martinod K., Wagner D.D. Thrombosis: tangled up in NETs. Blood. 2014; 123 (18): 2768–2776. DOI: 10.1182/blood-2013-10-463646.
32. Fuchs T.A., Brill A., Duerschmied D. Extracellular DNA traps promote thrombosis. Proceedings of the National Academy of Sciences of the United States of America.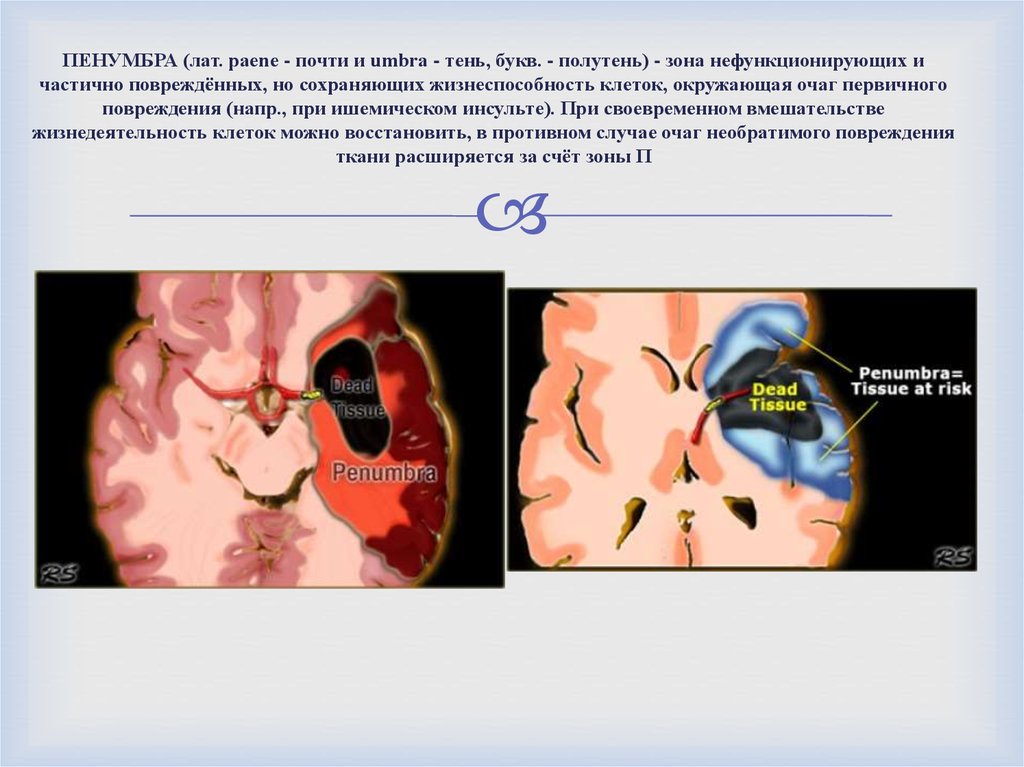 2010; 107 (36): 1580–1588. DOI: 10.1073/pnas.1005743107.
2010; 107 (36): 1580–1588. DOI: 10.1073/pnas.1005743107.
33. Semeraro F., Ammollo C.T., Morrissey J.H., Dale G.L., Friese P., Esmon N.L., Esmon C.T. Extracellular histones promote thrombin generation through platelet-dependent mechanisms: involvement of platelet TLR2 and TLR4. Blood. 2011; 118 (7): 1952–1961. DOI: 10.1182/blood-2011-03-343061.
34. Sreeramkumar V., Adrover J.M., Ballesteros I. et al. Neutrophils scan for activated platelets to initiate inflammation. Science. 2014; 346 (6214): 1234–1238. DOI: 10.1126/science.1256478.
35. Maugeri N., Campana L., Gavina M. et al. Activated platelets present high mobility group box 1 to neutrophils, inducing autophagy and promoting the extrusion of neutrophil extracellular traps, Journal of Thrombosis and Haemostasis. 2014; 12 (12): 2074–2088. DOI: 10.1111/jth.12710.
36. Brill A., Fuchs T.A., Savchenko A.S., Thomas G.M., Martinod K., De Meyer S.F., Bhandari A.A., Wagner D.D. Neutrophil extracellular traps promote deep vein thrombosis in mice. J. Thromb. Haemost. 2012; 10 (1): 136–144. DOI: 10.1111/j.1538-7836.2011.04544.x.
J. Thromb. Haemost. 2012; 10 (1): 136–144. DOI: 10.1111/j.1538-7836.2011.04544.x.
37. De Meyer S.F., Denorme F., Langhauser F., Geuss E., Fluri F., Kleinschnitz C. Thromboinflammation in stroke brain damage. Stroke. 2016; 47 (4): 1165–1172. DOI: 10.1161/STROKEAHA.115.011238.
38. Von Bruhl M.L., Stark K., Steinhart A., Chandraratne S., Konrad I., Lorenz M., Khandoga A., Tirniceriu A., Coletti R., Kollnberger M., Byrne R.A., Laitinen I., Walch A., Brill A., Pfeiler S., Manukyan D., Braun S., Lange P., Riegger J., Ware J. et al. Monocytes, neutrophils, and platelets cooperate to initiate and propagate venous thrombosis in mice in vivo. The Journal of Experimental Medicine. 2012; 209 (4): 819–835. DOI: 10.1084/jem.20112322Ю
39. De Meyer S.F., Suidan G.L., Fuchs T.A., Monestier M., Wagner D.D. Extracellular chromatin is an important mediator of ischemic stroke in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 2012; 32 (8): 1884–1891. DOI: 10.1161/ATVBAHA.112.250993.
40. Yaghi S., Boehme A.K., Dibu J. et al. Treatment and Outcome of Thrombolysis-Related Hemorrhage: A Multicenter Retrospective Study. JAMA Neurol. 2015; 72 (12): 1451–1457. DOI: 10.1001/jamaneurol.2015.2371.
41. Gill D., Sivakumaran P., Wilding P., Love M., Veltkamp R., Kar А. Trends in C-reactive protein levels are associated with neurological change twenty-four hours after thrombolysis for acute ischemic stroke. J. Stroke Cerebrovasc. Dis. 2016; 25 (8): 1966–1999. DOI: 10.1016/J.JSTROKECEREBROVASDIS.2016.05.003.
42. Uhl B., Zuchtriegel G., Puhr-Westerheide D. et al. Tissue plasminogen activator promotes postischemic neutrophil recruitment via its proteolytic and nonproteolytic properties. Arterioscler. Thromb. Vasc. Biol. 2014; 34 (7): 1495–1504. DOI: 10.1161/ATVBAHA.114.303721.
43. Dong Q., Dong Y., Liu L., Xu A., Zhang Y., Zheng H., Wang Y. The Chinese Stroke Association scientific statement: intravenous thrombolysis in acute ischaemic stroke. Stroke and Vascular Neurology.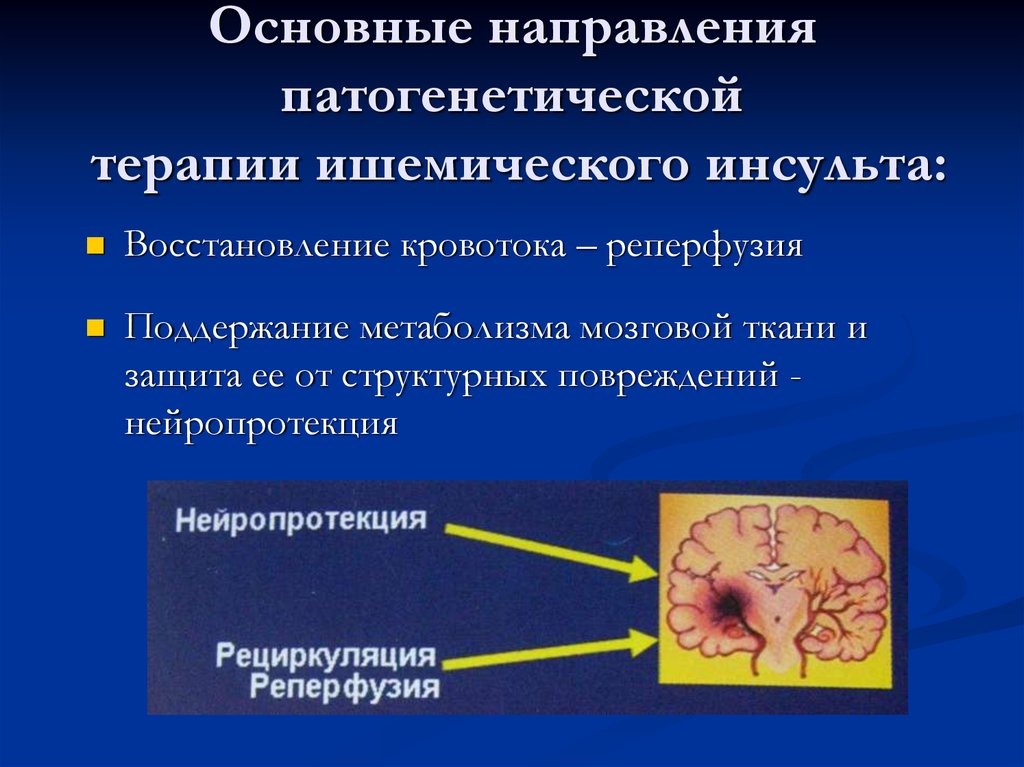 2017; 2 (3): 147–159. DOI: 10.1136/svn-2017-000074.
2017; 2 (3): 147–159. DOI: 10.1136/svn-2017-000074.
44. Guo Z., Yu S., Xiao L. et al. Dynamic change of neutrophil to lymphocyte ratio and hemorrhagic transformation after thrombolysis in stroke. J. Neuroinflammation. 2016; 13 (1): 199. DOI: 10.1186/S12974-016-0680-X.
45. Shi J., Peng H., You S., Liu Y., Xu J., Xu Y., Liu H., Shi R., Cao Y., Liu C.F. Increase in neutrophils after recombinant tissue plasminogen activator thrombolysis predicts poor functional outcome of ischaemic stroke: a longitudinal study. Eur. J. Neurol. 2018; 25 (4): 687–745. DOI: 10.1111/ene.13575.
46. Mangold A., Alias S., Scherz T., Hofbauer T., Jakowitsch J., Panzenbцck A. et al. Coronary neutrophil extracellular trap burden and deoxyribonuclease activity in ST-elevation acute coronary syndrome are predictors of ST-segment resolution and infarct size. Circ. Res. 2015; 116 (7): 1182–1192. DOI: 10.1161/CIRCRESAHA.116.304944.
47. Ducroux C., Di Meglio L., Loyau S., Delbosc S., Boisseau W., Deschildre C. , Maacha M.B., Blanc R. et. al. Thrombus neutrophil extracellular traps content impair tpa-induced thrombolysis in acute ischemic stroke. Stroke. 2018; 49 (3): 754–757. DOI: 10.1161/STROKEAHA.117.019896.
, Maacha M.B., Blanc R. et. al. Thrombus neutrophil extracellular traps content impair tpa-induced thrombolysis in acute ischemic stroke. Stroke. 2018; 49 (3): 754–757. DOI: 10.1161/STROKEAHA.117.019896.
48. Laridan E., Denorme F., Desender L., Franзois O., Andersson T., Deckmyn H. et al. Neutrophil extracellular traps in ischemic stroke thrombi. Ann. Neurol. 2017; 82 (2): 223–232. DOI: 10.1002/ana.24993.
49. Longstaff C., Varjú I., Sуtonyi P., Szabу L., Krumrey M., Hoell A. et al. Mechanical stability and fibrinolytic resistance of clots containing fibrin, DNA, and histones. J. Biol. Chem. 2013; 288 (10): 6946–6956. DOI: 10.1074/ jbc.M112.404301.
50. Westendorp W.F., Nederkoorn P.J., Vermeij J.-D., Dijkgraaf M.G., van de Beek D. Post-stroke infection: A systematic review and metaanalysis. BMC Neurol. 2011; 11: 110. DOI: 10.1186/1471-2377-11-110.
51. Chavan S.S., Pavlov V.A., Tracey K.J. Mechanisms and therapeuticиrelevance of neuro-immune communication. Immunity. 2017; 46 (6): 927–942. DOI: 10.1016/J.IMMUNI.2017.06.008.
2017; 46 (6): 927–942. DOI: 10.1016/J.IMMUNI.2017.06.008.
52. Meisel C., Schwab J.M., Prass K. et al. Central nervous system injury-induced immune deficiency syndrome. Nat. Rev. Neurosci. 2005; 6 (10): 775–786. DOI: 10.1038/NRN1765.
53. Rumer C., Engel O., Winek K. et al. Blocking stroke-induced immunodeficiency increases CNS antigen-specific autoreactivity but does not worsen functional outcome after experimental stroke. J. Neurosci. 2015; 35 (20): 7777–7794. DOI: 10.1523/JNEUROSCI.1532-14.2015.
54. Dirnagl U., Klehmet J., Braun J.S. et al. Stroke-induced immunodepression: experimental evidence and clinical relevance. Stroke. 2007; 38 (2 Suppl.): 770–783. DOI: 10.1161/01.STR.0000251441.89665.BC.
55. Hug A., Dalpke A., Wieczorek N. et al. Infarct volume is a major determiner of post-stroke immune cell function and susceptibility to infection. Stroke. 2009; 40 (10): 3226–3232. DOI: 10.1161/STROKEAHA.109.557967.
56. Chamorro A., Meisel A., Planas A.M., Urra X. , van de Beek D., Veltkamp R. The immunology of acute stroke. Nat. Rev. Neurol. 2012; 8 (7): 401–410. DOI: 10.1038/NRNEUROL.2012.98.
, van de Beek D., Veltkamp R. The immunology of acute stroke. Nat. Rev. Neurol. 2012; 8 (7): 401–410. DOI: 10.1038/NRNEUROL.2012.98.
57. Szabу C., Thiemermann C., Wu C.C. et al. Attenuation of the induction of nitric oxide synthase by endogenous glucocorticoids accounts for endotoxin tolerance in vivo. Proc. Natl. Acad. Sci. USA. 1994; 91 (1): 271–275. DOI: 10.1073/PNAS.91.1.271.
58. Zhang J., Shi K., Li Z. et al. Organ- and cell-specific immune responses are associated with the outcomes of intracerebral hemorrhage. Faseb. J. 2018; 32 (1): 220–229. DOI: 10.1096/fj.201700324R.
59. Van Gemmeren T., Schuppner R., Grosse G.M., Fering J., Gabriel M.M., Huber R., Worthmann H., Lichtinghagen R., Weissenborn R. Early post-stroke infections are associated with an impaired function of neutrophil granulocytes. J. Clin. Med. 2020; 9 (3): 872. DOI: 10.3390/jcm9030872 Ю
60. Krams M., Lees R.R., Hacke W., Grieve A.P., Orgogozo J.-M., Ford G.A. Acute stroke therapy by inhibition of neutrophils (ASTIN): an adaptive dose-response study of UK- 279,276 in acute ischemic stroke. Stroke. 2003; 34 (11): 2543–2548. DOI: 10.1161/01.STR.0000092527.33910.89.
Stroke. 2003; 34 (11): 2543–2548. DOI: 10.1161/01.STR.0000092527.33910.89.
61. Smedly L.A., Tonnesen M.G., Sandhaus R.A. et al. Neutrophil-mediated injury to endothelial cells. J. Clin. Invest. 1986; 77 (4): 1233–1243. DOI: 10.1172/JCI112426.
62. Мишланов В.Ю., Туев А.В., Шутов А.А., Байдина Т.В. Метод липидвысвобождающей способности лейкоцитов в диагностике механизмов атерогенеза у больных ишемической болезнью сердца и мозговым ишемическим инсультом. Клиническая лабораторная диагностика. 2006; 5: 9–12.
63. Higazi A.A., Nassar T., Ganz T., Rader D.J., Udassin R., Bdeir K, Hiss E., Sachais B.S., Williams K.J., Leitersdorf E., Cines D.B. The alpha-defensins stimulate proteoglycan-dependent catabolism of low-density lipoprotein by vascular cells: a new class of inflammatory apolipoprotein and a possible contributor to atherogenesis. Blood. 2000; 96 (4): 1393–1398.
64. Обухова О.В. Липидвысвобождающая способность лейкоцитов у больных с ишемической болезнью сердца. Кардиоваскулярная терапия и профилактика. 2009; 8 (6S1): 259.
2009; 8 (6S1): 259.
65. Qi H., Yang S., Zhang L. Neutrophil extracellular traps and endothelial dysfunction in atherosclerosis and thrombosis. Front. Immunol. 2017; 8: 928. DOI: 10.3389/fimmu.2017.00928.
66. Chistiakov D.A., Bobryshev Y.V., Orekhov A.N. Neutrophil’s weapons in atherosclerosis (review). Experimental and Molecular Pathology. 2015; 99 (3): 663–671. DOI: 10.1016/j.Yexmp.2015.11.011.
67. Rahman A., Fazal F. Blocking NF-kappaB: an inflammatory issue. Proc. Am. Thorac. Soc. 2011; 8 (6): 497–503. DOI: 10.1513/pats. 201101-009MW.
68. Xiao L., Liu Y., Wang N. New paradigms in inflammatory signaling in vascular endothelial cells. Am. J. Physiol. Heart Circ. Physiol. 2014; 306 (3): h417–325. DOI: 10.1152/ajpheart. 00182.2013.
69. Chistiakov D.A., Grechko A.V., Myasoedova V.A. et al. The role of monocytosis and neutrophilia in atherosclerosis. J. Cell Molec. Med. 2018; 22 (3): 1366–1382. DOI: 10.1111/jcmm.13462.
70. Hattar K., Heygster D., Eul B. et al. Amplification of LPS and LTA induced cytokine synthesis in NSCLC/neutrophil cocultures. J. Clin. Oncol. 2008; 26 (15): 22198. DOI: 10.1200/jco.2008.26.15_suppl.22198.
et al. Amplification of LPS and LTA induced cytokine synthesis in NSCLC/neutrophil cocultures. J. Clin. Oncol. 2008; 26 (15): 22198. DOI: 10.1200/jco.2008.26.15_suppl.22198.
71. Zychlinsky A. NETs: a new strategy for using old weapons. Trends in Immunology. 2009; 30 (11): 513–521. DOI: 10.1016/j.it.2009.07.011.
Онкологические заболевания как фактор риска криптогенного инсульта | Рамазанов
1. Hart RG, Diener HC, Coutts SB, Easton JD, Granger CB, O’Donnell MJ, et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014;13(4):429–438. PMID: 24646875 https://doi.org/10.1016/S1474-4422(13)70310-7
2. Adams Jr HP, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24(1):35–41. PMID: 7678184 https://doi.org/10.1161/01.STR.24.1.35
3. Harloff A, Schlachetzki F. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med. 2018;379(10):986– 987. https://doi.org/10.1056/NEJMoa1802686
Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med. 2018;379(10):986– 987. https://doi.org/10.1056/NEJMoa1802686
4. Diener HC, Sacco RL, Easton JD, Granger CB, Bernstein RA, Uchiyama S, et.al. Dabigatran for Prevention of Stroke after Embolic Stroke of Undetermined Source. N Engl J Med. 2019;380(200):1906–1917. https://doi.org/10.1056/NEJMoa1813959
5. AtRial cardiopathy and antithrombotic drugs in prevention after cryptogenic stroke (ARCADIA). 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03192215. [Accessed Jul 09,2021]
6. Apixaban for Treatment of Embolic Stroke of Undetermined Source (ATTICUS). 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT02427126 [Accessed Jul 09.2021]
7. Ntaios G, Perlepe K, Lambrou D, Sirimarco G, Strambo D, Eskandari A, et al. Prevalence and overlap of potential embolic sources in patients with embolic stroke of undetermined source. J Am Heart Assoc. 2019;8: e012858. PMID: 31364451 https://doi. org/10.1161/JAHA.119.012858
org/10.1161/JAHA.119.012858
8. Kim SJ, Park JH, Lee MJ, Park YG, Ahn MJ, Bang OY. Clues to occult cancer in patients with ischemic stroke. PLoS One. 2012;(9)7:e44959. PMID: 22984594 https://doi.org/10.1371/journal.pone.0044959
9. Graus F, Rogers LR, Posner JM. Cerebrovascular complication in patients with cancer. Medicine (Baltimore). 1985;64(1):16–35. PMID: 3965856 https://doi.org/10.1097/00005792-198501000-00002
10. Gon Y, Okazaki S, Terasaki Y, Sasaki T, Yoshimine T, Sakaguchi M, et al. Characteristics of cryptogenic stroke in cancer patients. Ann Clin Transl Neurol. 2016;3(4):280–287. PMID: 27081658 https://doi.org/10.1002/acn3.291
11. Chen PC, Muo CH, Lee YT, Yu YH, Sung FC. Lung cancer and incidence of stroke: a population – based cohort study. Stroke. 2011;42(11):3034–3039. PMID: 21903961 https://doi.org/10.1161/STROKEAHA.111.615534
12. Navi BB, Kasner SE, Elkind MSV, Cushman M, Bang OY, DeAngelis LM. Cancer and Embolic Stroke of Undetermined Source.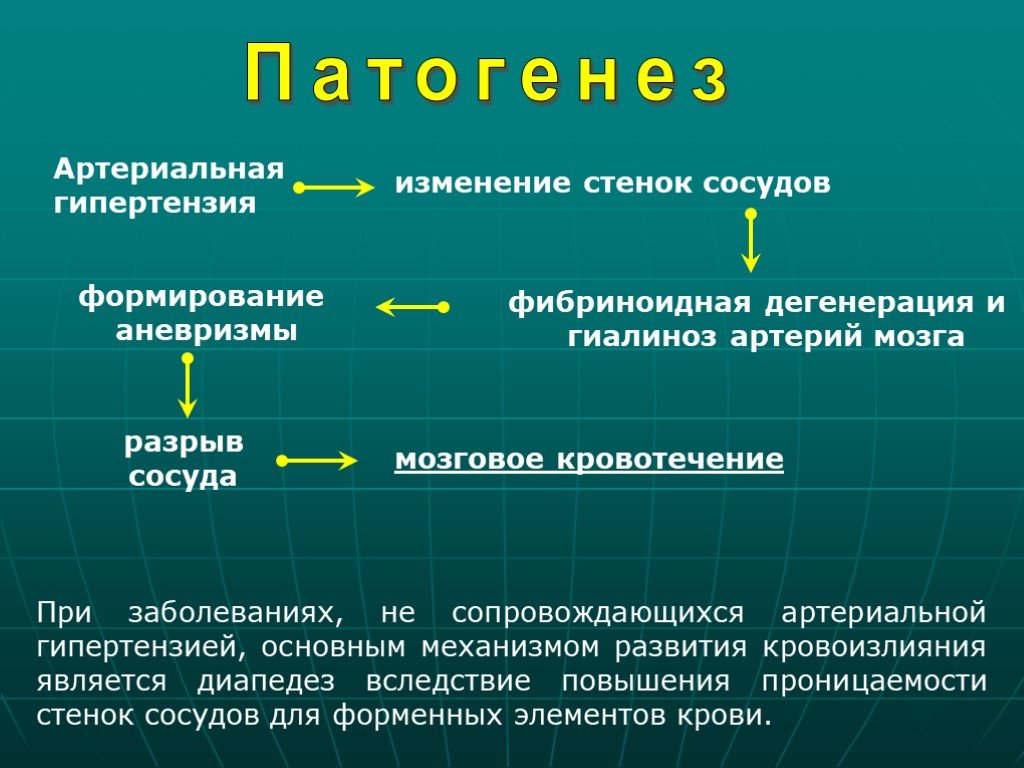
13. Welch HG, Kramer BS, Black WC. Epidemiologic signatures in cancer. N Engl J Med. 2019;381(14):1378–1386. PMID: 31577882 https://doi.org/10.1056/NEJMsr1905447
14. Howlader N, Forjaz G, Mooradian MJ, Meza R, Kong CY, Cronin KA, et al. The effect of advances in lung-cancer treatment on population mortality. N Engl J Med. 2020;383(7):640–649. PMID: 32786189 https://doi.org/10.1056/NEJMoa1916623
15. Navi BB, Howard G, Howard VJ, Zhao H, Judd SE, Elkind MSV, et al. New diagnosis of cancer and the risk of subsequent cerebrovascular events. Neurology. 2018;90(23):e2025–e2033. PMID: 29728524 https://doi.org/10.1212/WNL.0000000000005636
16. Navi BB, Reiner AS, Kamel H, Iadecola C, Okin PM, Elkind MSV, et al. Risk of arterial thromboembolism in patients with cancer. J Am Coll Cardiol. 2017;70(8):926–938. PMID: 28818202 https://doi.org/10.1016/j.jacc.2017.06.047
17. Navi BB, Singer S, Merkler AE, Cheng NT, Stone JB, Kamel H, et al. Cryptogenic subtype predicts reduced survival among cancer patients with ischemic stroke. Stroke. 2014;45(8):2292–2297. PMID: 24994717 https://doi.org/10.1161/STROKEAHA.114.005784
Cryptogenic subtype predicts reduced survival among cancer patients with ischemic stroke. Stroke. 2014;45(8):2292–2297. PMID: 24994717 https://doi.org/10.1161/STROKEAHA.114.005784
18. Hart RG, Catanese L, Perera KS, Ntaios G, Connolly SJ. Embolic stroke of undetermined source: a systematic review and clinical update. Stroke. 2017;48(4):867–872. PMID: 28265016 https://doi.org/10.1161/STROKEAHA.116.016414
19. Navi BB, DeAngelis LM, Segal AZ. Multifocal strokes as the presentation of occult lung cancer. J Neurooncol. 2007;85(3):307–309. PMID: 17611718 https://doi.org/10.1007/s11060-007-9419-y
20. Navi BB, Kawaguchi K, Hriljac I, Lavi E, DeAngelis LM, Jamieson DG. Multifocal stroke from tumor emboli. Arch Neurol. 2009;66(9):1174– 1175. PMID: 19752313 https://doi.org/10.1001/archneurol.2009.172
21. Grisold W, Oberndorfer S, Struhal W. Stroke and cancer: a review. Acta Neurol Scand. 2009;119(1):1–16. PMID: 18616624 https://doi.org/10.1111/j.1600-0404.2008.01059.x
22. Navi BB, Reiner AS, Kamel H, Iadecola C, Okin PM, Tagawa ST, et al. Arterial thromboembolic events preceding the diagnosis of cancer in older persons. Blood. 2019;133(8):781–789. PMID: 30578253 https://doi.org/ 10.1182/blood-2018-06-860874
Navi BB, Reiner AS, Kamel H, Iadecola C, Okin PM, Tagawa ST, et al. Arterial thromboembolic events preceding the diagnosis of cancer in older persons. Blood. 2019;133(8):781–789. PMID: 30578253 https://doi.org/ 10.1182/blood-2018-06-860874
23. Selvik HA, Bjerkreim AT, Thomassen L, Waje-Andreassen U, Naess H, Kvistad CE. When to screen ischaemic stroke patients for cancer. Cerebrovasc Dis. 2018;45(1-2):42–47. PMID: 29402826 https://doi.org/10.1159/000484668
24. Gon Y, Sakaguchi M, Takasugi J, Kawano T, Kanki H, Watanabe A, et al. Plasma D-dimer levels and ischaemic lesions in multiple vascular regions can predict occult cancer in patients with cryptogenic stroke. Eur J Neurol. 2017;24(3):503–508. PMID: 28026909 https://doi.org/10.1111/ene.13234
25. Cocho D, Gendre J, Boltes A, Espinosa J, Ricciardi AC, Pons J, et al. Predictors of occult cancer in acute ischemic stroke patients. J Stroke Cerebrovasc Dis. 2015;24(6):1324–1328. PMID: 25881772 https://doi.org/ 10.1016/j.jstrokecerebrovasdis. 2015.02.006
2015.02.006
26. Navi BB, Singer S, Merkler AE, Cheng NT, Stone JB, Kamel H, et al. Cryptogenic subtype predicts reduced survival among cancer patients with ischemic stroke. Stroke. 2014;45(8):2292–2297. PMID: 24994717 https://doi.org/10.1161/STROKEAHA.114.005784
27. Bang OY, Chung JW, Lee MJ, Seo WK, Kim GM, Ahn MJ, et al. CancerRelated Stroke: An Emerging Subtype of Ischemic Stroke with Unique Pathomechanisms. Stroke. 2020;22(1):1–10 PMID: 32027788 https://doi.org/10.5853/jos.2019.02278
28. Iguchi Y, Kimura K, Kobayashi K, Ueno Y, Inoue T. Ischaemic stroke with malignancy may often be caused by paradoxical embolism. J Neurol Neurosurg Psychiatry. 2006;77:1336–1339. PMID: 16847046 https://doi.org/10.1136/jnnp.2006.092940
29. Khorana AA, Dalal M, Lin J, Connolly GC. Incidence and predictors of venous thromboembolism (VTE) among ambulatory high-risk cancer patients undergoing chemotherapy in the United States. Cancer. 2013;119(3):648–655. PMID: 22893596 https://doi.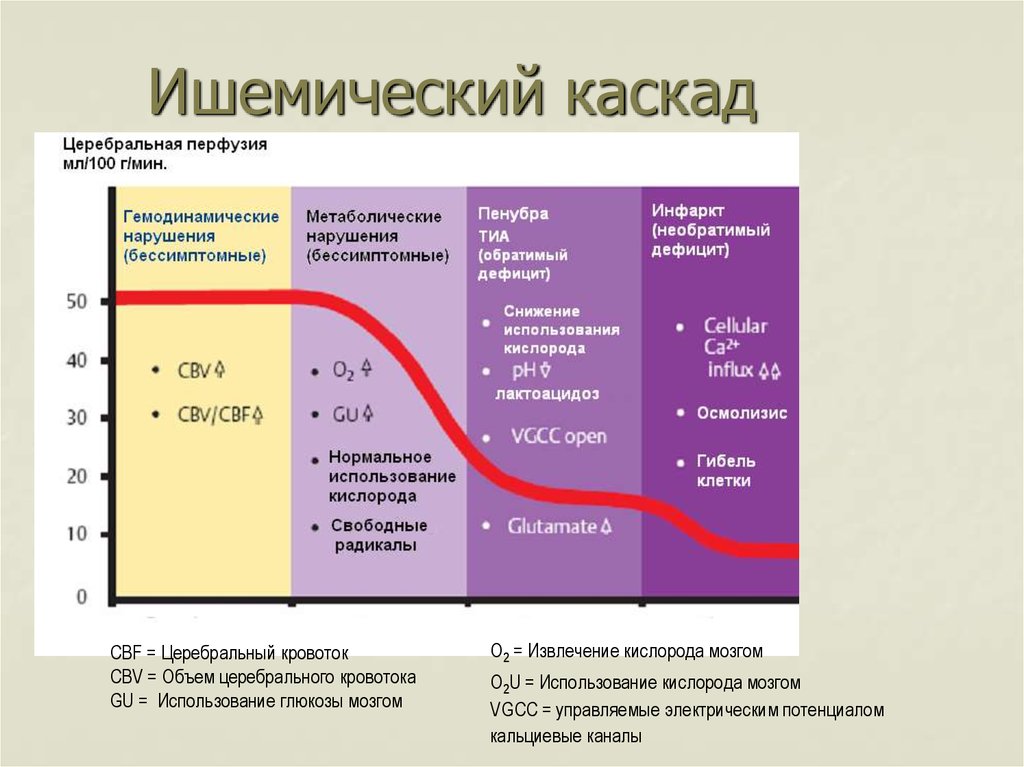 org/10.1002/cncr.27772
org/10.1002/cncr.27772
30. Thompson CM, Rodgers LR. Analysis of the autopsy records of 157 cases of carcinoma of the pancreas with particular reference to the incidence of thromboembolism. Am J Med Sci. 1952;223:469–478. PMID: 14923654 https://doi.org/10.1097/00000441-195205000-00001
31. Volkova M, Russell R 3rd. Anthracycline cardiotoxicity: prevalence, pathogenesis and treatment. Curr Cardiol Rev. 2011;7(4):214–220. PMID: 22758622. https://doi.org/10.2174/157340311799960645
32. Kim SG, Hong JM, Kim HY, Lee J, Chung PW, Park KY, et al. Ischemic stroke in cancer patients with and without conventional mechanisms: a multicenter study in Korea. Stroke. 2010;41:798–801. PMID: 20150545 https://doi.org/10.1161/STROKEAHA.109.571356
33. Schwarzbach CJ, Schaefer A, Ebert A, Held V, Bolognese M, Kablau M, et al. Stroke and cancer: the importance of cancer – associated hypercoagulation as a possible stroke etiology. Stroke. 2012;43:3029–3034. PMID: 22996958 https://doi.org/10. 1161/STROKEAHA.112.658625
1161/STROKEAHA.112.658625
34. Sheng B, Fong MK, Chu YP, Cheong AP, Teng SK, Chu JP, et al. Stroke and cancer: misfortunes never come singularly. Int J Stroke. 2013;8:E30. PMID: 23879755 https://doi.org/10.1111/ijs.12071
35. Virchow R. Gesammalte Abhandlungen zur Wissenschaftlichen Medtzin. Frankfurt, Germany: Medinger Sohn; 1856.
36. Von Tempelhoff GF, Heilmann L, Hommel G, Pollow K. Impact of rheological variables in cancer. Semin Thromb Hemost. 2003;29(5):499– 513. PMID: 14631550 https://doi.org/10.1055/s-2003-44641
37. Humphreys WV, Walker A, Charlesworth D. Altered viscosity and yield stress in patients with abdominal malignancy: relationship to deep vein thrombosis. Br J Surg. 1976;63(7):559–561. PMID: 953452 https://doi.org/10.1002/bjs.1800630715
38. Blann AD, Dunmore S. Arterial and venous thrombosis in cancer patients. Cardiol Res Pract. 2011;2011:394740. PMID: 21403876 https://doi.org/10.4061/2011/394740
39. Stefan O, Vera N, Otto B, Heinz L, Wolfgang G. Stroke in cancer patients: a risk factor analysis. J Neurooncol. 2009;94(2):221–226. PMID: 19280119 https://doi.org/10.1007/s11060-009-9818-3
Stroke in cancer patients: a risk factor analysis. J Neurooncol. 2009;94(2):221–226. PMID: 19280119 https://doi.org/10.1007/s11060-009-9818-3
40. Bang OY, Chung JW, Lee MJ, Kim SJ, Cho YH, Kim GM, et al. Cancer cell-derived extracellular vesicles are associated with coagulopathy causing ischemic stroke via tissue factor-independent way: the OASISCANCER study. PLoS One. 2016;11:e0159170. PMID: 27427978 https://doi.org/10.1371/journal.pone.0159170
41. Chung JW, Cho YH, Ahn MJ, Lee MJ, Kim GM, Chung CS, et al. Association of cancer cell type and extracellular vesicles with coagulopathy in patients with lung cancer and stroke. Stroke. 2018;49(5):1282–1285. PMID: 2961026 https://doi.org/10.1161/STROKEAHA.118.020995
42. Thålin C, Demers M, Blomgren B, Wong SL, von Arbin M, von Heijne A, et al. NETosis promotes cancer-associated arterial microthrombosis presenting as ischemic stroke with troponin elevation. Thromb Res. 2016;139:56–64. PMID: 26916297 https://doi.org/10.1016/j. thromres.2016.01.009
thromres.2016.01.009
43. Park H, Kim J, Ha J, Hwang IG, Song TJ, Yoo J, et al. Histological features of intracranial thrombi in stroke patients with cancer. Ann Neurol. 2019;86(1):143–149. PMID: 31025392 https://doi.org/10.1002/ana.25495
44. Falanga A, Marchetti M, Vignoli A. Coagulation and cancer: biological and clinical aspects. J Thromb Haemost. 2013;11(2):223–233. PMID: 23279708 https://doi.org/10.1111/jth.12075
45. Navi BB, Mathias R, Sherman CP, Wolfe J, Kamel H, Tagawa ST, et al. Cancer-related ischemic stroke has a distinct blood mRNA expression profile. Stroke. 2019;50(11):3259–3264. PMID: 31510897 https://doi.org/10.1161/STROKEAHA.119.026143
46. Yoo J, Choi JK, Kim YD, Nam HS, Park H, Lee HS, et al. Outcome of Stroke Patients with Cancer and Nonbacterial Thrombotic Endocarditis. Stroke. 2020;22(2):245–253. PMID: 32635688 https://doi.org/10.5853/jos.2020.00619
47. Seok JM, Kim SG, Kim JW, Chung CS, Kim GM, Lee KH, et al. Coagulopathy and embolic signal in cancer patients with ischemic stroke. Ann Neurol. 2010;68:213–219. PMID: 32635688 https://doi.org/10.1002/ana.22050
Ann Neurol. 2010;68:213–219. PMID: 32635688 https://doi.org/10.1002/ana.22050
48. Merkler AE, Navi BB, Singer S, Cheng NT, Stone JB, Kamel H, et al. Diagnostic yield of echocardiography in cancer patients with ischemic stroke. J Neurooncol. 2015;123:115–121. PMID: 25851114 https://doi.org/10.1007/s11060-015-1768-3
49. Hurrell H, Roberts-Thomson R, Prendergast BD. Non-infective endocarditis. Heart. 2020;106(13):1023–1029. PMID: 32376608 https://doi.org/10.1136/heartjnl-2019-315204
50. Vinter N, Christesen AMS, Fenger-Grøn M, Tjønneland A, Frost L. Atrial fibrillation and risk of cancer: a Danish population-based cohort study. J Am Heart Assoc. 2018;7(17):e009543. PMID: 30371150 https://doi.org/10.1161/JAHA.118.009543
51. Mitma AA, Varghese JG, Witt D, Zarich SW. Stroke and a valvular lesion in a patient with stage IV non-small cell lung cancer. BMJ Case Rep. 2016;2016:bcr2016215317. PMID: 27247207 https://doi.org/10.1136/bcr-2016-215317
52. Coussens LM, Werb Z. Inflammation and cancer. Nature. 2002;420(6917):860– 867. PMID: 12490959 https://doi.org/10.1038/nature01322
Inflammation and cancer. Nature. 2002;420(6917):860– 867. PMID: 12490959 https://doi.org/10.1038/nature01322
53. Libby P. Inflammatory mechanisms: the molecular basis of inflammation and disease. Nutr Rev. 2007;65(12 Pt 2):S140–146. PMID: 18240538 https://doi.org/10.1111/j.1753-4887.2007.tb00352.x
54. Berg AH, Scherer PE. Adipose tissue, inflammation, and cardiovascular disease. Circ Res. 2005;96(9):939–949. PMID: 15890981 https://doi.org/10.1161/01.RES.0000163635.62927.34
55. Frayn K, Bernard S, Spalding K, Arner P. Adipocyte triglyceride turnover is independently associated with atherogenic dyslipidemia. J Am Heart Assoc. 2012;1:e003467. PMID: 23316323 https://doi.org/10.1161/JAHA.112.003467
56. Rodríguez-Iturbe B, Pons H, Quiroz Y, Johnson RJ. The immunological basis of hypertension. Am J Hypertens. 2014;27(11):1327–1337. PMID: 25150828 https://doi.org/10.1093/ajh/hpu142
57. Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: role of oxidative stress.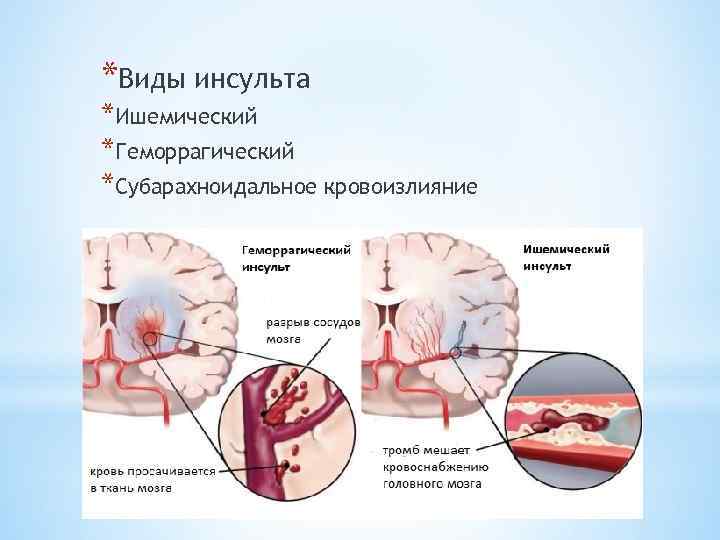 Circulation. 2002;106(16):2067–2072. PMID: 12379575 https://doi.org/10.1161/01.cir.0000034509.14906.ae
Circulation. 2002;106(16):2067–2072. PMID: 12379575 https://doi.org/10.1161/01.cir.0000034509.14906.ae
58. Campen CJ, Kranick SM, Kasner SE, Kessler SK, Zimmerman RA, Lustig R, et al. Cranial irradiation increases risk of stroke in pediatric brain tumor survivors. Stroke. 2012;43:3035–3040. PMID: 22968468 https://doi.org/10.1161/STROKEAHA.112.661561
59. Xu J, Cao Y. Radiation-induced carotid artery stenosis: a comprehensive review of the literature. Interv Neurol. 2014;2(4):183–192. PMID: 25337087 https://doi.org/10.1159/000363068
60. Ramos-Casals M, Brahmer JR, Callahan MK, Flores-Chávez A, Keegan N, Khamashta MA, et al. Immune-related adverse events of checkpoint inhibitors. Nat Rev Dis Primers. 2020;6(1):38. PMID: 32382051 https://doi.org/10.1038/s41572-020-0160-6
61. Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J. 2017;377(12):1119–1131. PMID: 28845751 https://doi.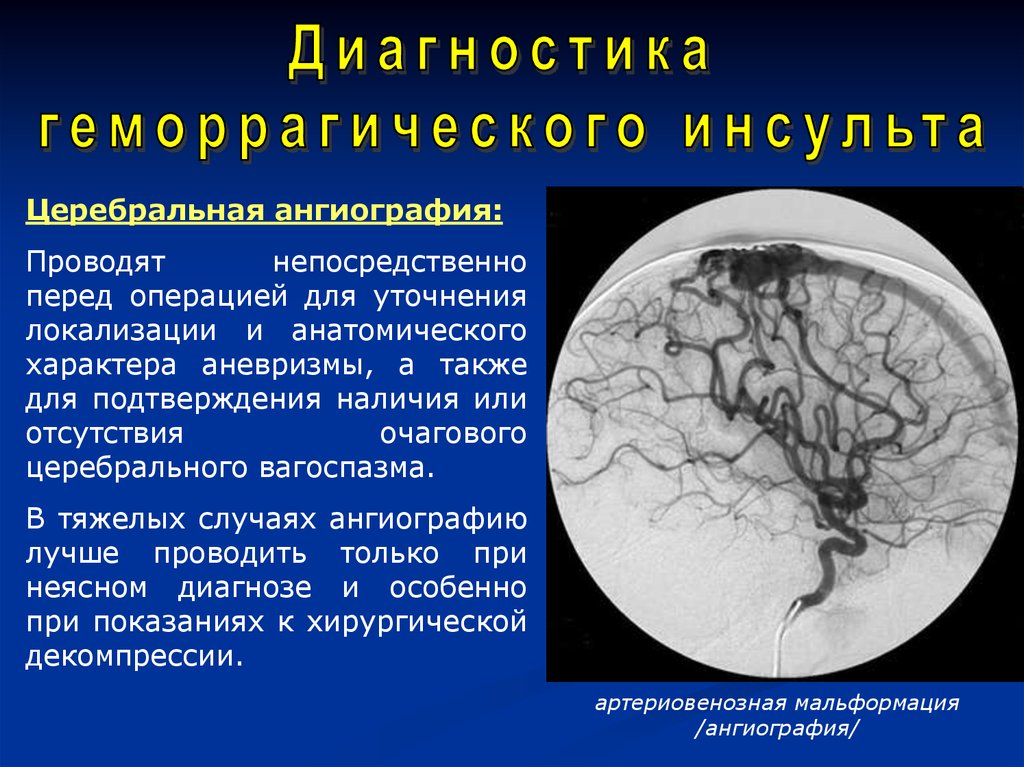 org/10.1056/NEJMoa1707914
org/10.1056/NEJMoa1707914
62. Lee MJ, Chung JW, Ahn MJ, Kim S, Seok JM, Jang HM, et al. Hypercoagulability and mortality of patients with stroke and active cancer: the OASIS-CANCER study. J Stroke. 2017;19(1):77–87. PMID: 28030894 https://doi.org/10.5853/jos.2016.00570
63. Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, et al. Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med. 2018;378:615–624. PMID: 29231094 https://doi.org/10.1056/NEJMoa1711948
64. Agnelli G, Becattini C, Meyer G, Muñoz A, Huisman MV, Connors JM, et al.; Caravaggio Investigators. Apixaban for the treatment of venous thromboembolism associated with cancer. N Engl J Med. 2020;382(17):1599–1607. PMID: 32223112 https://doi.org/10.1056/NEJMoa1915103
65. Edoxaban for the treatment of coagulopathy in patients with active cancer and acute ischemic stroke: a pilot study. (ENCHASE Study) (ENCHASE). 2018. Available at: https://clinicaltrials.gov/ct2/show/NCT03570281 [Accessed Jul 09. 2021]
2021]
66. Carrier M, Lazo-Langner A, Shivakumar S, Tagalakis V, Zarychanski R, Solymoss S, et al. Screening for occult cancer in unprovoked venous thromboembolism. N Engl J Med. 2015; 373:697–704. PMID: 26095467 https://doi.org/10.1056/NEJMoa1506623
Патофизиология ишемического инсульта — wikidoc [2], Айша Анвар, MBBS[3]
Обзор
Патофизиология ишемического инсульта может зависеть от основной причины ишемии. Ишемический инфаркт можно разделить на два типа в зависимости от пораженной области головного мозга: очаговый ишемический инсульт или глобальный ишемический инсульт. Гемодинамические изменения при ишемическом инсульте являются результатом дисфункции церебральной ауторегуляции, поскольку ткань головного мозга очень чувствительна к умеренным изменениям уровня кислорода. Несколько минут гипоксии приводят к необратимым повреждениям. Церебральная ауторегуляция поддерживает перфузионное давление в головном мозге в диапазоне 60-150 мм рт. ст. посредством вазоконстрикции и вазодилатации. Длительная ишемия снижает доставку кислорода к клеткам, вызывая анаэробный гликолиз и повышенную выработку свободного кислорода и нитратных радикалов, что, в свою очередь, вызывает повреждение клеточной мембраны, ДНК и гибель клеток.
Длительная ишемия снижает доставку кислорода к клеткам, вызывая анаэробный гликолиз и повышенную выработку свободного кислорода и нитратных радикалов, что, в свою очередь, вызывает повреждение клеточной мембраны, ДНК и гибель клеток.
Патофизиология
Физиология
Головной мозг получает кровь из двух источников: внутренних сонных артерий, которые берут начало на шее в месте бифуркации общих сонных артерий, и позвоночных артерий. Внутренние сонные артерии разветвляются, образуя две главные мозговые артерии: переднюю и среднюю мозговые артерии. Правая и левая позвоночные артерии сходятся на уровне моста на вентральной поверхности ствола мозга, образуя срединную базилярную артерию.
Базилярная артерия присоединяется к кровоснабжению внутренних сонных артерий в артериальное кольцо в основании головного мозга (в районе гипоталамуса и ножек мозга), называемое виллизиевым кругом. В месте слияния отходят задние мозговые артерии, а также две маленькие соединительные артерии — передняя и задняя соединительные артерии.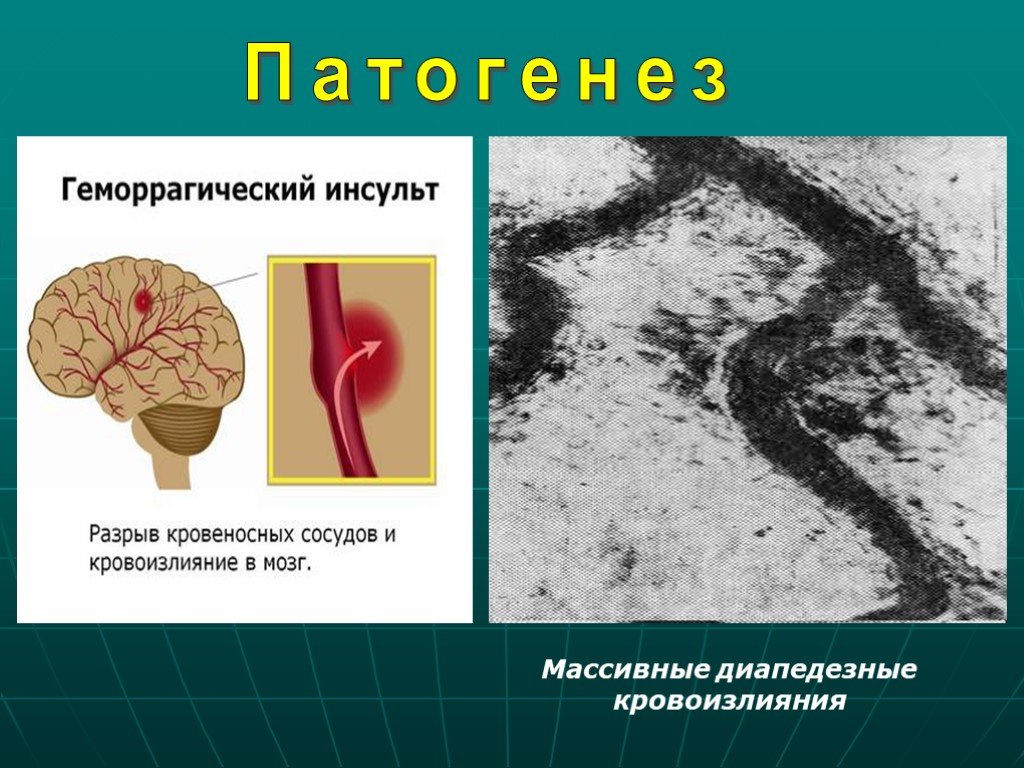 Соединение двух основных источников кровоснабжения головного мозга через круг Уиллиса, по-видимому, увеличивает шансы на то, что какая-либо область мозга продолжит получать кровь, если одна из основных артерий закупорится.
Физиологические потребности, обслуживаемые кровоснабжением мозга, имеют особое значение, поскольку нейроны более чувствительны к недостатку кислорода, чем другие виды клеток с более низкой скоростью метаболизма. Кроме того, мозг подвержен риску циркулирующих токсинов и в этом отношении особенно защищен гематоэнцефалическим барьером.
В результате высокой скорости метаболизма нейронов ткани головного мозга, лишенные кислорода и глюкозы в результате нарушения кровоснабжения, могут получить временные или необратимые повреждения. Кратковременная потеря кровоснабжения (называемая ишемией) может вызвать клеточные изменения, которые, если их быстро не обратить вспять, могут привести к гибели клеток. Устойчивая потеря кровоснабжения гораздо более непосредственно ведет к гибели и дегенерации лишенных клеток.
Соединение двух основных источников кровоснабжения головного мозга через круг Уиллиса, по-видимому, увеличивает шансы на то, что какая-либо область мозга продолжит получать кровь, если одна из основных артерий закупорится.
Физиологические потребности, обслуживаемые кровоснабжением мозга, имеют особое значение, поскольку нейроны более чувствительны к недостатку кислорода, чем другие виды клеток с более низкой скоростью метаболизма. Кроме того, мозг подвержен риску циркулирующих токсинов и в этом отношении особенно защищен гематоэнцефалическим барьером.
В результате высокой скорости метаболизма нейронов ткани головного мозга, лишенные кислорода и глюкозы в результате нарушения кровоснабжения, могут получить временные или необратимые повреждения. Кратковременная потеря кровоснабжения (называемая ишемией) может вызвать клеточные изменения, которые, если их быстро не обратить вспять, могут привести к гибели клеток. Устойчивая потеря кровоснабжения гораздо более непосредственно ведет к гибели и дегенерации лишенных клеток.
Патогенез
Патогенез ишемического инсульта может зависеть от основной причины ишемии. Ишемический инфаркт можно разделить на два типа в зависимости от пораженной области головного мозга: ] [8] [9] [10] [11] [12] [13] [14] [15] . ] [8]
| Тип ишемии | Патогенез | |||
|---|---|---|---|---|
| Основная причина | Вовлеченная часть мозга | Время инициации гибели клеток | Тип гибели клеток | |
| Фокус [12] | Тромбоз | Фокусная зона, обеспечиваемая окклюзированным сосудом | Острое начало (3-4 часа) | Некроз — центральная область |
| Глобальный [12] | Системная гипоперфузия | Область водосбора | Отсроченное начало (12 часов) | Апоптоз |
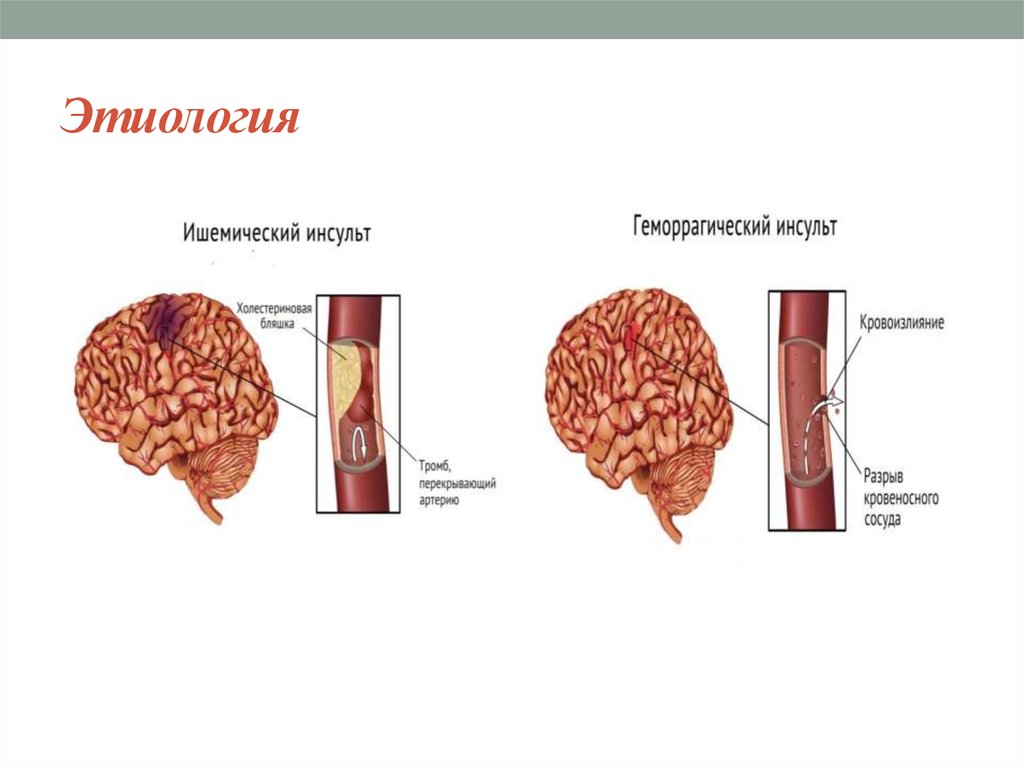
Традиционно инсульт подразделяют на 2 широкие категории синдрома инсульта: геморрагический (кровоточащий) инсульт и тромботический (ишемический) инсульт.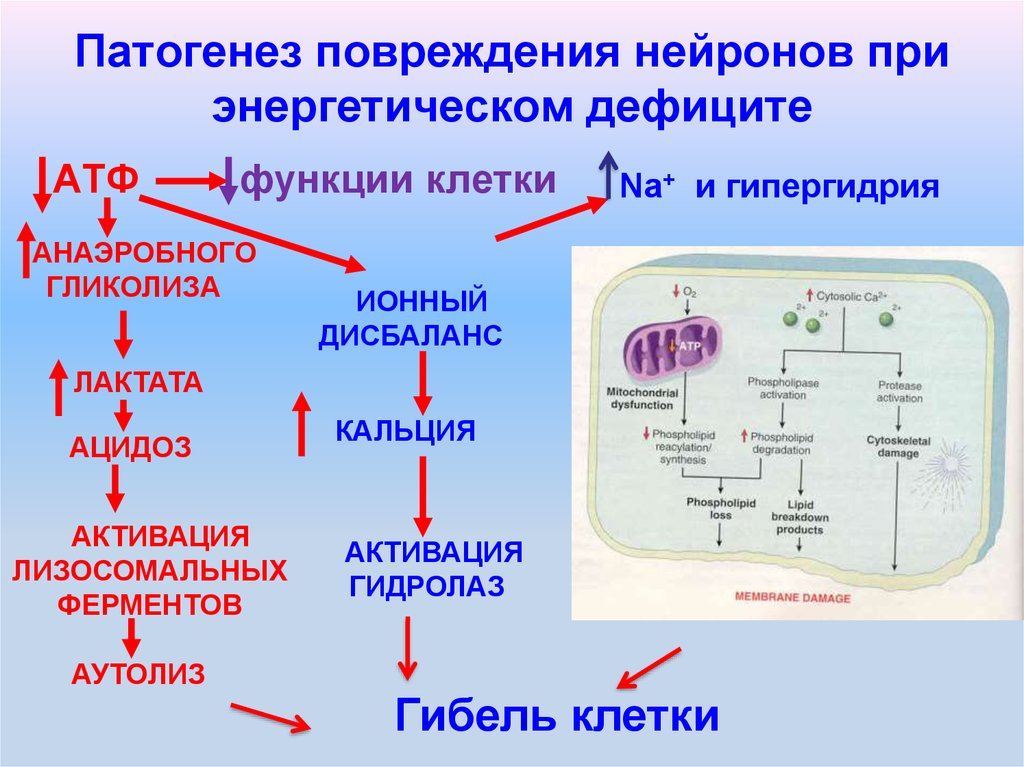 Эти 2 фенотипа считаются диаметрально противоположными состояниями, поскольку кровоизлияние характеризуется кровоизлиянием в ткань мозга, приводящим к гематоме и смещению ткани мозга, тогда как ишемия возникает из-за тромбоза, характеризующегося «сгустками крови» во внутричерепной сосудистой сети, что приводит к гипоксии в определенной части мозга. головного мозга из-за снижения кровоснабжения. Оба могут привести к различным клиническим мозговым синдромам даже в одной и той же местности. [17] [18]
Эти 2 фенотипа считаются диаметрально противоположными состояниями, поскольку кровоизлияние характеризуется кровоизлиянием в ткань мозга, приводящим к гематоме и смещению ткани мозга, тогда как ишемия возникает из-за тромбоза, характеризующегося «сгустками крови» во внутричерепной сосудистой сети, что приводит к гипоксии в определенной части мозга. головного мозга из-за снижения кровоснабжения. Оба могут привести к различным клиническим мозговым синдромам даже в одной и той же местности. [17] [18]
Патологии, поражающие крупные экстракраниальные сосуды, включают:
- Атеросклероз
- Гигантоклеточный артериит
- Вскрытие
- артериит Такаясу
- Фиброзно-мышечная дисплазия
Патологии, поражающие крупные внутричерепные сосуды, включают:
- Атеросклероз
- Вскрытие
- Артериит/васкулит
- Невоспалительная васкулопатия
- Вазоконстрикция
Эмболические инсульты делятся на четыре категории:
- Имеющие известный источник — сердце
- Пациенты с возможным сердечным или аортальным источником на основании данных трансторакальной и/или чреспищеводной эхокардиографии
- Пациенты с артериальным источником (артериальная эмболия)
- Пациенты с действительно неизвестным источником, у которых тесты на эмболические источники отрицательны
Гемодинамические изменения при ишемическом инсульте
- Гемодинамические изменения при ишемическом инсульте являются результатом нарушения церебральной ауторегуляции, поскольку ткань головного мозга очень чувствительна к умеренным изменениям уровня кислорода
- Несколько минут гипоксии приводят к необратимому повреждению [6] [8]
- Церебральная ауторегуляция поддерживает перфузионное давление в головном мозге в диапазоне 60–150 мм рт.
 ст. за счет вазоконстрикции и вазодилятации. [8]
ст. за счет вазоконстрикции и вазодилятации. [8] - Изменения давления ниже 60 мм рт.ст. и более 150 мм рт.ст. нарушают нормальную авторегуляцию.
- Ниже 60 мм рт. ст. вначале наблюдается выраженная вазодилатация пораженных сосудов для увеличения притока крови к пораженному участку. Это опосредовано увеличением продукции оксида азота эндотелием.
- Обширное увеличение продукции оксида азота из-за устойчивой гипоксии приводит к массивному расширению сосудов и образованию большого количества свободных радикалов оксида азота, вызывающих повреждение клеточных структур.
- Падение скорости кровотока ниже 30 мл/100 г приводит к ингибированию синтеза белка и увеличению анаэробного гликолиза
- Скорость кровотока ниже 20 мл/100 г приводит к обширному повреждению мембраны, вызывающему гибель клеток.
Молекулярная патофизиология при ишемическом инсульте
Последовательность молекулярных изменений, которые могут возникнуть вследствие ишемии, включает:
Клеточные изменения при ишемическом инсульте
Последовательность клеточных изменений при ишемическом инсульте приводит к потере структурной целостности головного мозга, вызывая нарушение гематоэнцефалического барьера и отек головного мозга.
- Высвобождение протеаз (матриксных металлопротеиназ, ММР) вследствие повреждения клеточной мембраны – истощения АТФ + свободных радикалов [1] [2]
- ММР вызывает деградацию коллагена и ламининов в базальной мембране клеток и кровеносных сосудов
- Нарушение гематоэнцефалического барьера может привести к кровоизлиянию
- Отек головного мозга из-за повышенного поступления Na+, Ca2+ и воды в клетки.
Генетика
Достижения в технологии секвенирования способствовали открытию моногенных нарушений, связанных с инсультом, помимо классических синдромов, таких как церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL) и серповидно-клеточная анемия. Кроме того, гетерозиготные мутации в 3′-нетранслируемой области COL4A1 (ген, кодирующий коллаген 4A1) идентифицированы как причина мостовой аутосомно-доминантной микроангиопатии с лейкоэнцефалопатией (PADMAL).
Гетерозиготные мутации (в частности, глициновые замены) в доменах тройной спирали COL4A1 или COL4A2 вызывают другой синдром, характеризующийся геморрагическим инсультом, наряду с дополнительными неврологическими и не-неврологическими проявлениями.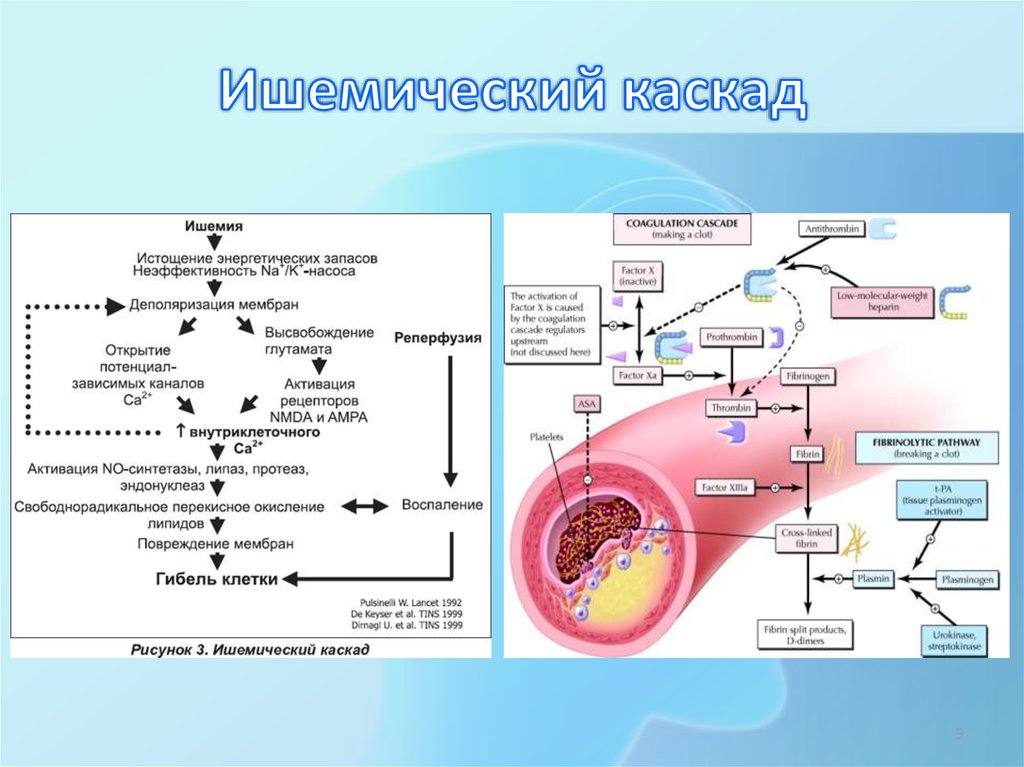 [19]
[19]
Следующие локусы генов также могут повышать риск инсульта:
- PITX2 и ZFHX3 – мерцательная аритмия и кардиоэмболический инсульт
- HDAC9- болезнь крупных сосудов
- АВО-ишемический инсульт
Макроскопическая патология
- Центральная некротизированная ткань называется umbra
- Периферическая ткань, которая окружает область некроза и может быть спасена за счет усиления кровотока, называется pneumbra [4]
Микроскопическая патология
- Через 1-6 мин ишемии красные нейроны и результаты вакуляции [13]
- Если ишемия длится > 6 мин, происходит карриорексис и гибель клеток
Продолжительность Макроскопическая патология Микроскопическая патология [13] Немедленная <24 часа
Без изменений Клеточный отек Острый <1 неделя
Отек Потеря соединения серого и белого вещества
Красные нейроны Некроз
Нейтрофилия [16]
Подострый 1-4 недели
Мягкая рыхлая ткань Кистозное образование
Макрофаги Разжижающий некроз
Хронический >4 недели
Фиброз Кисты, заполненные жидкостью, с темно-серыми краями
Глиоз Некротическая ткань, очищенная макрофагами
Ссылки
- ↑ 1,0 1,1 1,2 Родриго Р.
 , Фернас-Гэджардо Р., Гутерер-Р., Матамаль-А.М. и другие. (2013). «Окислительный стресс и патофизиология ишемического инсульта: новые терапевтические возможности». Лекарственные препараты для лечения нервных расстройств ЦНС . 12 (5): 698–714. PMID 23469845. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)
, Фернас-Гэджардо Р., Гутерер-Р., Матамаль-А.М. и другие. (2013). «Окислительный стресс и патофизиология ишемического инсульта: новые терапевтические возможности». Лекарственные препараты для лечения нервных расстройств ЦНС . 12 (5): 698–714. PMID 23469845. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка) - ↑ 2.0 2.1 2.2 Вудрафф ТМ, Тандиил Дж., Танг С.К., Соби К.Г., Тейлор С.М., Арумугам Т.В. (2011). «Патофизиология, лечение, животные и клеточные модели ишемического инсульта человека». Мол Нейродегенер . 6 (1): 11. doi:10.1186/1750-1326-6-11. ЧВК 3037909. PMID 21266064. CS1 maint: Несколько имен: список авторов (ссылка)
- ↑ Пульсинелли В. (1992). «Патофизиология острого ишемического инсульта». Ланцет . 339 (8792): 533–6. PMID 1346887.
- ↑ 4.0 4.1 Мустафа Р.
 Р., барон Дж. К. (2008). «Патофизиология ишемического инсульта: выводы из визуализации и последствия для терапии и открытия лекарств». Бр Дж Фармакол . 153 Приложение 1: S44–54. дои: 10.1038/sj.bjp.0707530. PMC 2268043. PMID 18037922.
Р., барон Дж. К. (2008). «Патофизиология ишемического инсульта: выводы из визуализации и последствия для терапии и открытия лекарств». Бр Дж Фармакол . 153 Приложение 1: S44–54. дои: 10.1038/sj.bjp.0707530. PMC 2268043. PMID 18037922. - ↑ 5.0 5.1 Дирнагл У., Ядекола С., Московиц М.А. (1999). «Патобиология ишемического инсульта: комплексный взгляд». Trends Neurosci . 22 (9): 391–7. PMID 10441299. CS1 maint: Несколько имен: список авторов (ссылка)
- ↑ 6.0 6.1 6.2 6.3 6.4 Xing C, Arai K, Lo EH, Hommel M (2012). «Патофизиологические каскады при ишемическом инсульте». Int J Ход . 7 (5): 378–85. doi:10.1111/j.1747-4949.2012.00839.x. PMC 3985770. PMID 22712739. CS1 maint: Несколько имен: список авторов (ссылка)
- ↑ Деб П., Шарма С., Хассан К.М. (2010). «Патофизиологические механизмы острого ишемического инсульта: обзор с упором на терапевтическое значение, выходящее за рамки тромболизиса».
 Патофизиология . 17 (3): 197–218. doi:10.1016/j.pathophys.2009.12.001. PMID 20074922. CS1 maint: Несколько имен: список авторов (ссылка)
Патофизиология . 17 (3): 197–218. doi:10.1016/j.pathophys.2009.12.001. PMID 20074922. CS1 maint: Несколько имен: список авторов (ссылка) - ↑ 8.0 8.1 8.2 8.3 дель Зоппо Г.Дж., Халленбек Дж.М. (2000). «Достижения в сосудистой патофизиологии ишемического инсульта». Тромб Res . 98 (3): 73–81. PMID 10812160.
- ↑ Футрелл Н. (1998). «Патофизиология острого ишемического инсульта: новые концепции мозговой эмболии». Цереброваск дис . 8 Приложение 1: 2–5. PMID 9547024.
- ↑ Тауфик Э., Проберт Л. (2008). «Ишемическое повреждение нейронов». Curr Pharm Des . 14 (33): 3565–73. PMID 1
- 33.
- ↑ Мангубат Э., Сани С. (2015). «Острый глобальный ишемический инсульт после краниопластики: клинический случай и обзор литературы». Невролог . 19 (5): 135–9. doi:10.1097/NRL.0000000000000024.
 PMID 25970836.
PMID 25970836. - ↑ 12,0 12,1 12,2 Сьесё Б.К., Кацура К., Чжао К., Фолбергрова Дж., Палмарк К., Сиесё П.; и другие. (1995). «Механизмы вторичного повреждения головного мозга при глобальной и очаговой ишемии: спекулятивный синтез». J Нейротравма . 12 (5): 943–56. PMID 8594224. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)
- ↑ 13.0 13.1 13.2 13.3 Маргэритеску О., Могоанта Л., Пиричи И., Пиричи Д., Черня Д., Мэргэритеш (Mărgă0rites). «Гистопатологические изменения при остром ишемическом инсульте». Rom J Morphol Embryol . 50 (3): 327–39. PMID 196
- : 196
- Проверить
|pmid=значение (помощь). - ↑ Бринджикджи В., Даффи С., Берроуз А., Хаке В., Либескинд Д., Мажуа К.Б.; и другие.
 (2016). «Корреляция визуализации и гистопатологии тромбов при остром ишемическом инсульте с этиологией и исходом: систематический обзор». Дж Нейроинтерв Хирург . doi:10.1136/neurintsurg-2016-012391. PMID 27166383. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)
(2016). «Корреляция визуализации и гистопатологии тромбов при остром ишемическом инсульте с этиологией и исходом: систематический обзор». Дж Нейроинтерв Хирург . doi:10.1136/neurintsurg-2016-012391. PMID 27166383. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка) - ↑ Сьерра С (2014). «Эссенциальная гипертензия, патология белого вещества головного мозга и ишемический инсульт». Curr Med Chem . 21 (19): 2156–64. PMID 24372222.
- ↑ 16.0 16.1 Прайс Си Джей, Менон Д.К., Питерс А.М., Баллинджер Дж.Р., Барбер Р.В., Балан К.К.; и другие. (2004). «Рекрутирование церебральных нейтрофилов, гистология и исход острого ишемического инсульта: исследование, основанное на визуализации». Ход . 35 (7): 1659–64. doi:10.1161/01.STR.0000130592.71028.92. PMID 15155970. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)
- ↑ Чанг Дж.
 К. (2020). «Классификация инсульта: критическая роль необычно больших мультимеров фактора фон Виллебранда и тканевого фактора в клинических фенотипах на основе новой «теории объединения двух путей» гемостаза». Clin Appl Thromb Hemost . 26 : 1076029620913634. doi: 10.1177/1076029620913634. PMC 7427029 Проверьте значение
К. (2020). «Классификация инсульта: критическая роль необычно больших мультимеров фактора фон Виллебранда и тканевого фактора в клинических фенотипах на основе новой «теории объединения двух путей» гемостаза». Clin Appl Thromb Hemost . 26 : 1076029620913634. doi: 10.1177/1076029620913634. PMC 7427029 Проверьте значение |pmc=(справка). PMID 32584600 Проверить|pmid= значение(помощь). - ↑ Каплан LR (июль 1993 г.). «Эмболия головного мозга, новый взгляд». Неврология . 43 (7): 1281–7. doi:10.1212/wnl.43.7.1281. PMID 8327124.
- ↑ Дичганс М., Пулит С.Л., Розанд Дж. (июнь 2019 г.). «Генетика инсульта: открытие, биология и клиническое применение». Ланцет Нейрол . 18 (6): 587–599. doi: 10.1016/S1474-4422(19)30043-2. PMID 30975520.
- ↑ Каплан LR (1992). «Внутримозговое кровоизлияние». Ланцет . 339 (8794): 656–8. PMID 1347346.

Шаблон:WS Шаблон: WH
Файлы cookie помогают нам предоставлять наши услуги. Используя наши услуги, вы соглашаетесь на использование нами файлов cookie.
[PDF] Воспаление в патогенезе ишемического инсульта.
- DOI:10.2741/4336
- Идентификатор корпуса: 24498223
@article{Pei2015InflammationIT, title={Воспаление в патогенезе ишемического инсульта.}, автор={Цзянь Пей и Сяо-синь Ю и Цинь-хуэй Фу}, journal={Рубежи в биологических науках}, год = {2015}, объем = {20}, страницы={ 772-83 } }- J. Pei, Xiao-xin You, Qin-hui Fu
- Опубликовано в 2015 г.
- Биология, медицина, психология
- Границы биологических наук
Ишемический инсульт является распространенной причиной постоянной инвалидности у взрослых во всем мире.
 Воспаление играет значительную роль в патогенезе ишемического инсульта, и его механизм сложен. В патогенезе ишемического инсульта участвуют как провоспалительные, так и противовоспалительные медиаторы, дисбаланс которых приводит к воспалению. Воспалительные клетки как врожденной, так и приобретенной иммунной системы участвуют в воспалении, связанном с ишемическим инсультом; процессы, связанные действием…
Воспаление играет значительную роль в патогенезе ишемического инсульта, и его механизм сложен. В патогенезе ишемического инсульта участвуют как провоспалительные, так и противовоспалительные медиаторы, дисбаланс которых приводит к воспалению. Воспалительные клетки как врожденной, так и приобретенной иммунной системы участвуют в воспалении, связанном с ишемическим инсультом; процессы, связанные действием… Просмотр в PubMed
bioscience.orgМелатонин и ишемический инсульт: механистические роли и действие
модели повреждения головного мозга, такие как черепно-мозговая травма и повреждение спинного мозга.
Повышенная регуляция CCL2 способствует ишемическому инсульту через сигнальный путь хемокинов.
Механизмы, профилактика и лечение ишемического инсульта: взгляд анестезиолога
- M. McCrary, Songjiao Wang, Ling Wei
Медицина, биология
- 2017
Оценка современного понимания патологии инсульта может помочь в разработке новых методов лечения или профилактических мер при инсульте, таких как анестезия прекондиционирования и привести к оптимальному периоперационному ведению пациентов с высоким риском инсульта.

Интерлейкин-17А способствует дифференцировке мезенхимальных стволовых клеток костного мозга в нейрональные клетки.
- Хэнлин Чен, Шаша Ли, Джиайай Хе
Биология, Медицина
Ткань и клетки
- 2020
Гипоксические предварительные предварительные. предварительное кондиционирование смягчает церебральную ишемию/реперфузионное повреждение у мышей за счет снижения экспрессии воспалительных процессов NLRP3.
Терапия стволовыми клетками для нейропротекции при инсульте: обзор
Терапия стволовыми клетками у пациентов с инсультом с использованием взрослых стволовых клеток впервые применялась в клинических испытаниях 15 лет назад, а клеточная терапия у человека все еще находится на начальной стадии.
Генетическая изменчивость воспалительных генов в отношении риска ишемического инсульта в популяции китайских ханьцев
Это исследование показало, что PTGS2 rs689466 C и rs5275 A потенциально связаны с подтипом ИИ окклюзии мелких сосудов и должны быть подтверждены дальнейшими исследованиями с большим размером выборки .

Характеристика дисрегуляции микроРНК в мононуклеарных клетках периферической крови пациентов с ишемическим инсультом
Сообщается о нарушении регуляции микроРНК в РВМС при ИИ и представлены доказательства их участия в изменении иммунной системы во время патофизиологии ИИ.
Биохимические маркеры, связанные с возникновением коронарного спазма
Анализ крови на указанные выше биомаркеры может быть полезен для диагностики КАС, а в некоторых случаях сомнительно, что это КАС, без признаков провокационного теста.
Рускогенин ослабляет индуцированную церебральной ишемией дисфункцию гематоэнцефалического барьера путем подавления активации воспаления TXNIP/NLRP3 и пути MAPK Эндотелиальные клетки микрососудов головного мозга мыши, поврежденные депривацией/реоксигенацией глюкозы (OGD/R), продемонстрировали некоторые новые взгляды на их потенциальное применение для профилактики и лечения ишемического инсульта.

ПОКАЗАНЫ 1-10 ИЗ 86 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантность Наиболее влиятельные статьиНедавность
Воспалительные механизмы при ишемическом инсульте: терапевтические подходы Обсуждаются.
Влияние воспаления на патогенез и прогноз ишемического инсульта
Роль воспаления в поражении и заболевании ЦНС
Комплексное взаимодействие между медиаторами воспаления, старением, генетическим фоном и факторами окружающей среды может в конечном итоге регулировать исход острого повреждения ЦНС и прогрессирование хронической нейродегенерации и иметь решающее значение для разработки эффективных методов лечения заболеваний ЦНС.
Избирательная абляция воспаления в острой стадии ишемического инсульта может быть новой стратегией стимуляции нейрогенеза.
- Цзе Чжоу, Ган Ченг, Жун-хуа Конг, Д. Гао, Сян Чжан
Медицина, биология
Медицинские гипотезы
- 2011
Нейтрализация оси ИЛ-17 уменьшает инвазию нейтрофилов и защищает от ишемического инсульта.

- M. Gelderblom, A. Weymar, T. Magnus
Биология, медицина
Кровь
- 2012
Предполагается, что избирательное нацеливание на терапевтический сигнал IL-17A может стать новым инсульта, и этот аспект воспалительного каскада также актуален для человеческого мозга.
Blocking Interleukin-1 as a Novel Therapeutic Strategy for Secondary Prevention of Cardiovascular Events
- A. Abbate, B. W. Tassell, G. Biondi-Zoccai
Medicine, Biology
BioDrugs
- 2012
Preliminary data у пациентов с острым инфарктом миокарда, ишемическим инсультом и сердечной недостаточностью являются многообещающими, и многие вопросы, касающиеся оптимального использования блокады ИЛ-1 и предпочтительного агента, остаются без ответа.
Воспаление, атеросклероз и инсульт
- М. Элкинд
Медицина, биология
.
 Невролог
Невролог- 2006 . необходимы профилактика инсульта и дальнейшие исследования, прежде чем воспалительные маркеры станут рутинной частью оценки пациентов с инсультом.
- A. Tuttolomondo, D. Di Raimondo, R. di Sciacca, A. Pinto, G. Licata
Biology
Текущий фармацевтический дизайн
- уровни 2008
- C. Kleinschnitz, P. Kraft, H. Wiendl
Биология, медицина
Кровь
- 2013
Воспалительные цитокины при остром ишемическом инсульте.
плазменные цитокины IL-1beta различен для каждого диагностического подтипа ишемического инсульта, и показано, как уровни некоторых иммуновоспалительных маркеров и тромбо-фибринолитических маркеров в плазме предсказывают диагноз острого ишемического инсульта в острых условиях.
Регуляторные Т-клетки являются сильными стимуляторами острого ишемического инсульта у мышей, индуцируя дисфункцию микроциркуляторного русла головного мозга.
Новое и неожиданное заболевание, определяемое микроваскулярным заболеванием, определяемым первичной неиммунологической ролью Tregs в тромбозе.

- ↑ 1,0 1,1 1,2 Родриго Р.

 ст. за счет вазоконстрикции и вазодилятации. [8]
ст. за счет вазоконстрикции и вазодилятации. [8]  , Фернас-Гэджардо Р., Гутерер-Р., Матамаль-А.М. и другие. (2013). «Окислительный стресс и патофизиология ишемического инсульта: новые терапевтические возможности». Лекарственные препараты для лечения нервных расстройств ЦНС . 12 (5): 698–714. PMID 23469845. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)
, Фернас-Гэджардо Р., Гутерер-Р., Матамаль-А.М. и другие. (2013). «Окислительный стресс и патофизиология ишемического инсульта: новые терапевтические возможности». Лекарственные препараты для лечения нервных расстройств ЦНС . 12 (5): 698–714. PMID 23469845. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)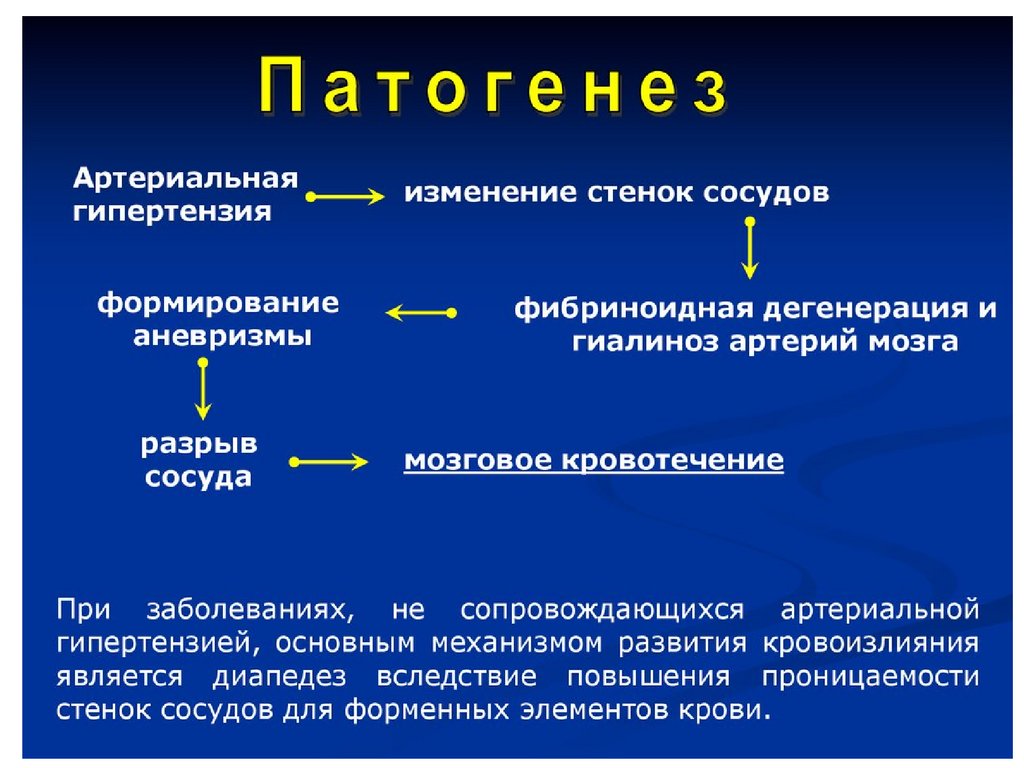 Р., барон Дж. К. (2008). «Патофизиология ишемического инсульта: выводы из визуализации и последствия для терапии и открытия лекарств». Бр Дж Фармакол . 153 Приложение 1: S44–54. дои: 10.1038/sj.bjp.0707530. PMC 2268043. PMID 18037922.
Р., барон Дж. К. (2008). «Патофизиология ишемического инсульта: выводы из визуализации и последствия для терапии и открытия лекарств». Бр Дж Фармакол . 153 Приложение 1: S44–54. дои: 10.1038/sj.bjp.0707530. PMC 2268043. PMID 18037922. 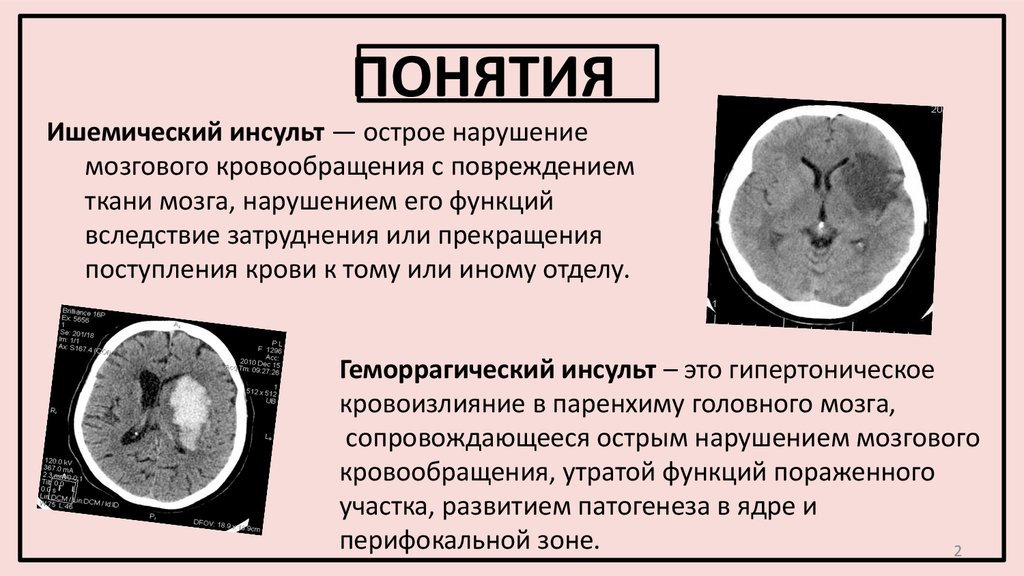 Патофизиология . 17 (3): 197–218. doi:10.1016/j.pathophys.2009.12.001. PMID 20074922. CS1 maint: Несколько имен: список авторов (ссылка)
Патофизиология . 17 (3): 197–218. doi:10.1016/j.pathophys.2009.12.001. PMID 20074922. CS1 maint: Несколько имен: список авторов (ссылка) PMID 25970836.
PMID 25970836.  (2016). «Корреляция визуализации и гистопатологии тромбов при остром ишемическом инсульте с этиологией и исходом: систематический обзор». Дж Нейроинтерв Хирург . doi:10.1136/neurintsurg-2016-012391. PMID 27166383. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)
(2016). «Корреляция визуализации и гистопатологии тромбов при остром ишемическом инсульте с этиологией и исходом: систематический обзор». Дж Нейроинтерв Хирург . doi:10.1136/neurintsurg-2016-012391. PMID 27166383. CS1 maint: явное использование et al. (ссылка) CS1 maint: Несколько имен: список авторов (ссылка)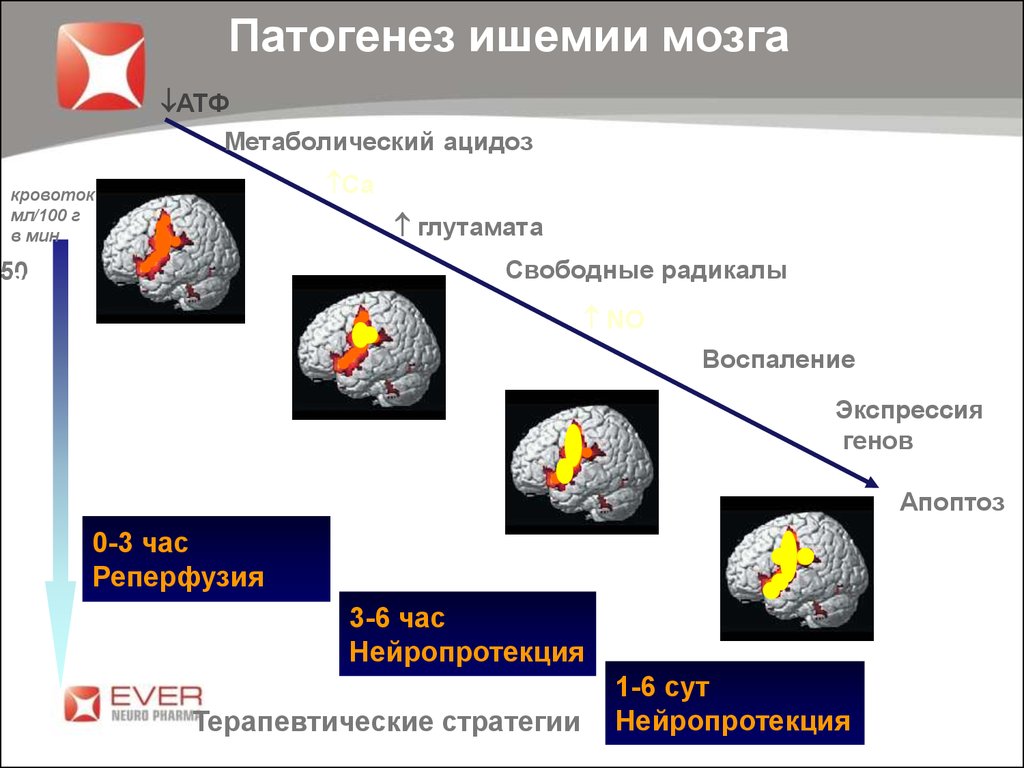 К. (2020). «Классификация инсульта: критическая роль необычно больших мультимеров фактора фон Виллебранда и тканевого фактора в клинических фенотипах на основе новой «теории объединения двух путей» гемостаза». Clin Appl Thromb Hemost . 26 : 1076029620913634. doi: 10.1177/1076029620913634. PMC 7427029 Проверьте значение
К. (2020). «Классификация инсульта: критическая роль необычно больших мультимеров фактора фон Виллебранда и тканевого фактора в клинических фенотипах на основе новой «теории объединения двух путей» гемостаза». Clin Appl Thromb Hemost . 26 : 1076029620913634. doi: 10.1177/1076029620913634. PMC 7427029 Проверьте значение 
 Воспаление играет значительную роль в патогенезе ишемического инсульта, и его механизм сложен. В патогенезе ишемического инсульта участвуют как провоспалительные, так и противовоспалительные медиаторы, дисбаланс которых приводит к воспалению. Воспалительные клетки как врожденной, так и приобретенной иммунной системы участвуют в воспалении, связанном с ишемическим инсультом; процессы, связанные действием…
Воспаление играет значительную роль в патогенезе ишемического инсульта, и его механизм сложен. В патогенезе ишемического инсульта участвуют как провоспалительные, так и противовоспалительные медиаторы, дисбаланс которых приводит к воспалению. Воспалительные клетки как врожденной, так и приобретенной иммунной системы участвуют в воспалении, связанном с ишемическим инсультом; процессы, связанные действием… 


 Невролог
Невролог