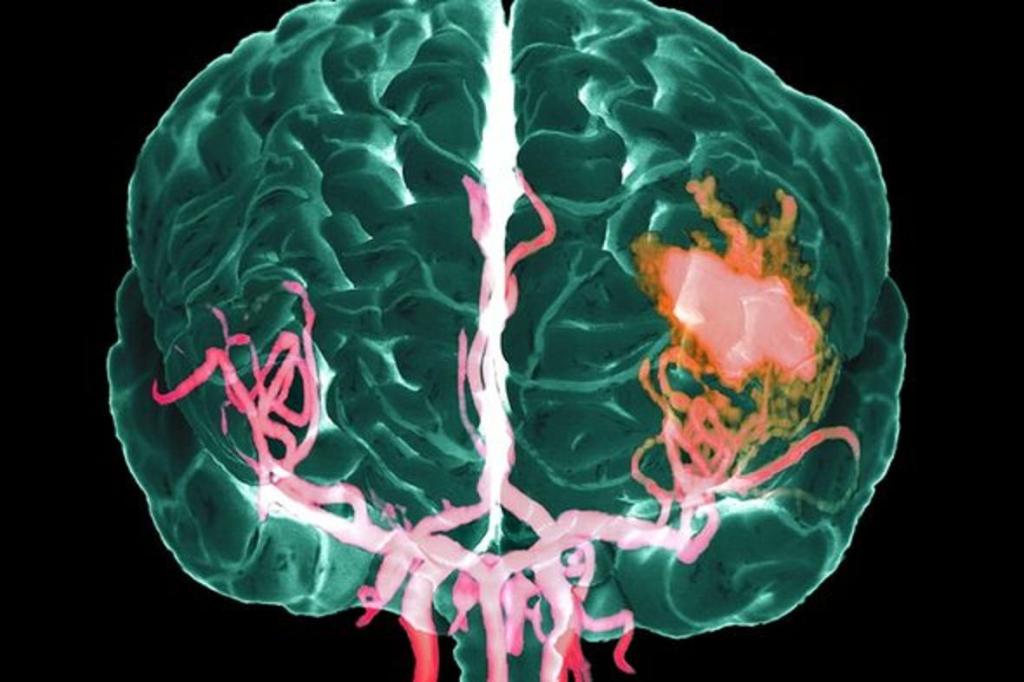
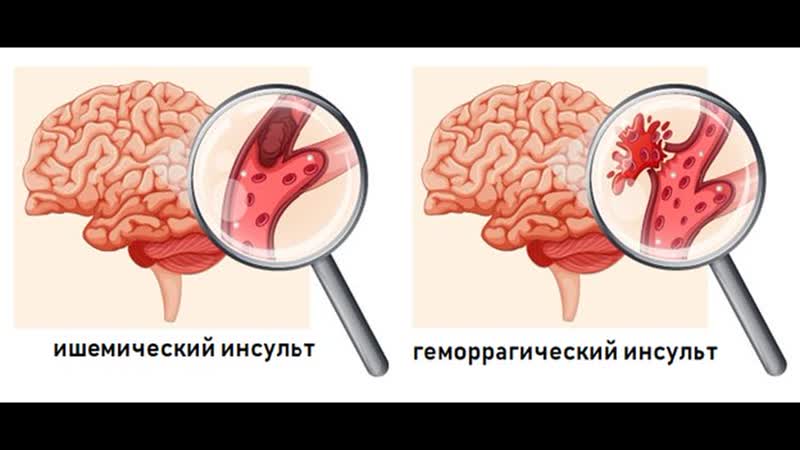
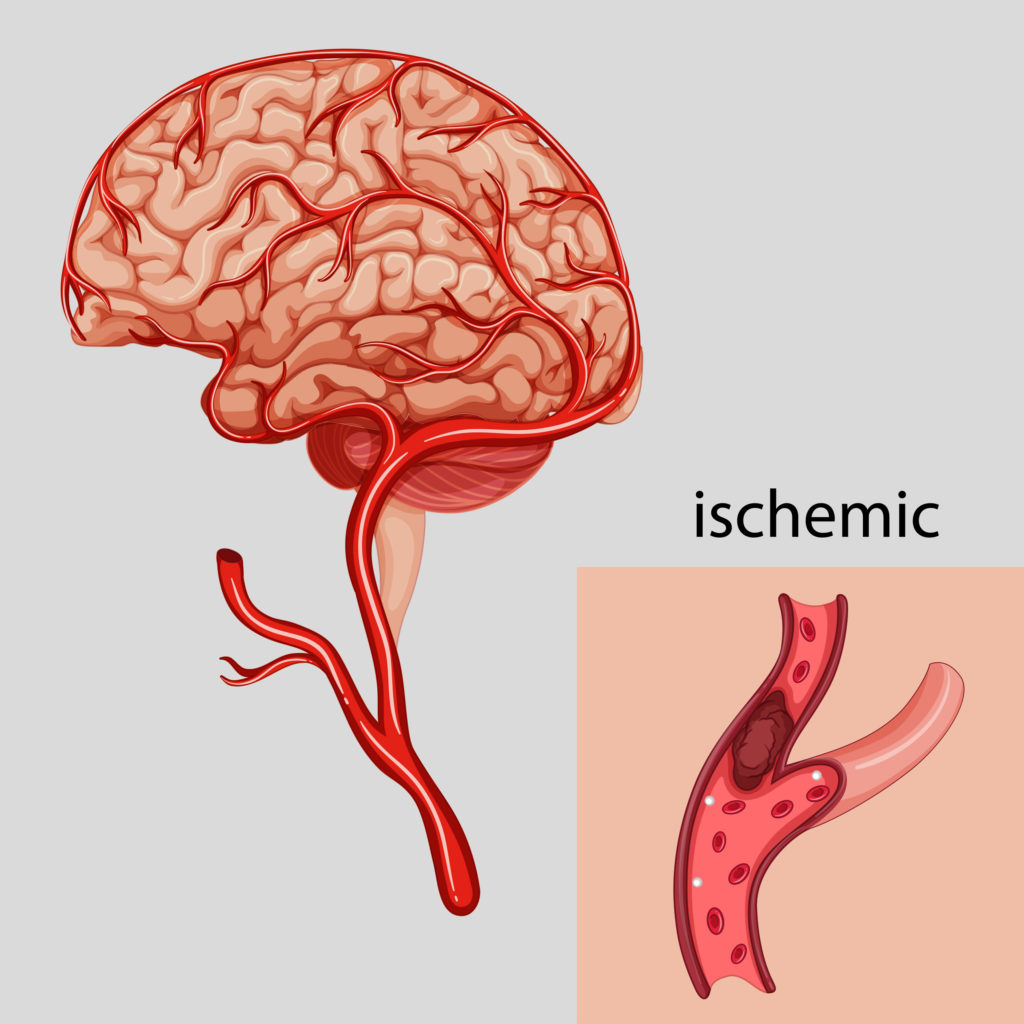
Острый ишемический инсульт: Ишемический инсульт: прогнозы, последствия и реабилитация
ГЕМОРЕОЛОГИЧЕСКИЙ ПРОФИЛЬ И ЛИПИДНЫЙ СПЕКТР У ПАЦИЕНТОВ В ОСТРОЙ ФАЗЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | Якусевич
1. Гусев Е.И., Скворцова В.И., Крылов В.В. Снижение смертности и инвалидности от сосудистой патологии мозга в РФ. Неврологический вестник 2007;XXXIX (1):128–33.
2. Кадыков А.С., Шахпаронова Н.В. Сосудистая катастрофа. Справочник поликлинического врача 2007;2:74–7.
3. Скворцова В.И. Снижение заболеваемости, смертности и инвалидности от инсультов в Российской Федерации. Сборник методических рекомендаций, программ, алгоритмов. М., 2008; с. 192.
4. Суслина З.А. Сосудистые заболевания головного мозга в России: достижения и нерешенные вопросы. Труды 1 Национального Конгресса «Кардионеврология».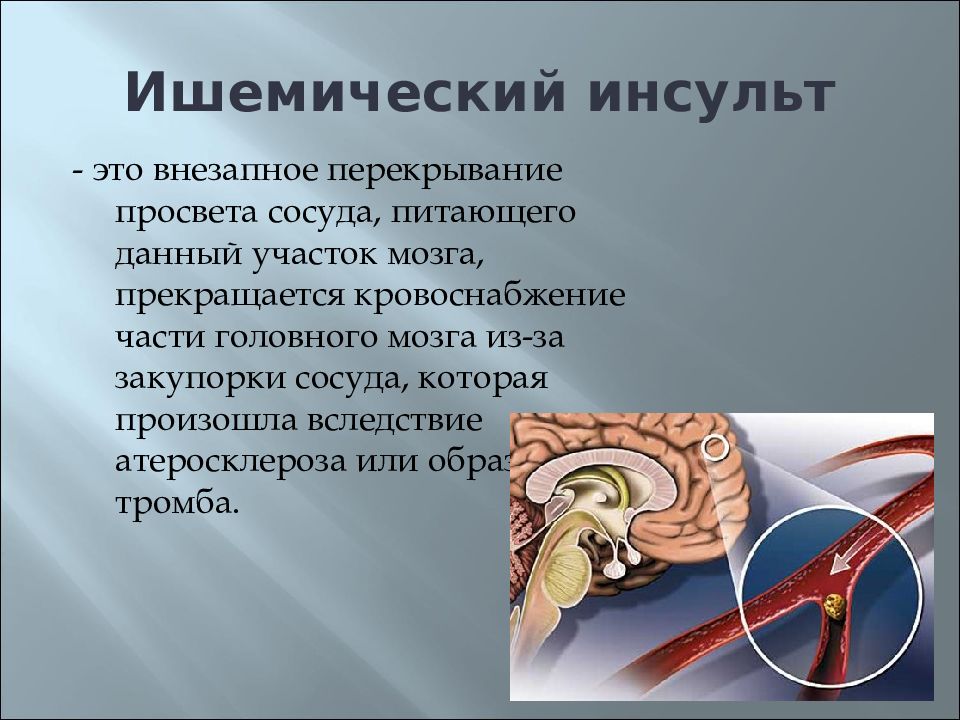
5. А.В. Фонякина. М., 2008.
6. Липовецкий Б.М. Атеросклероз и его осложнения со стороны сердца, мозга и аорты: Руководство для врачей. СПб.: СпецЛит, 2008.
7. Виленский Б.С., Яхно Н.Н. Ишемический инсульт. Справочник. СПб.: Фолиант, 2007.
8. Ионова В.Г., Суслина З.А. Реологические свойства крови при ишемических нарушениях мозгового кровообращения. Неврологический журнал 2002;(3):4–8.
9. Петроченко Е.П., Тихомирова И.А. Михайлова С.Г. и др. Микроциркуляция и реологические свойства крови при изменениях сосудистого тонуса. Материалы VII международной конференции
10. «Гемореология и микроциркуляция (от функциональных механизмов в практику)». Ярославль, 2009; с 36.
«Гемореология и микроциркуляция (от функциональных механизмов в практику)». Ярославль, 2009; с 36.
11. Муравьев А.В., Якусевич В.В. Параметры гемореологического профиля у больных эссенциальной артериальной гипертонией и их изменения под действием основных классов антигипертензивных
12. средств. Регионарное кровообращение и микроциркуляция 2004;3(4):25–32.
13. Широков Е.А., Леонова Ф.М. Нарушения гемостаза и реологических свойств крови у больных с высоким риском инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова 2003;(9):140.
15. Якусевич В.В., Семёнова Н.В, Тихомирова И.А. и др. Эффективность и безопасность препарата Гинкго билоба у пожилых пациентов с контролируемой артериальной гипертонией и дисциркуляторной энцефалопатией. Рациональная фармакотерапия в кардиологии2008;(4):59–64.
16. Baskurt O.K., Hardeman M.R. Handbook of hemorheology and hemodynamics. Amsterdam: IOS Press, 2007.
17. Pfafferott C., Nash G.B., Meiselman H.J. Red blood cell deformation in shear flow. Effects of internal and external phase viscosity and of in vivo aging. Biophys J 1985;47:695–704.
18. Dintenfass L. Red cell aggregation in cardiovascular diseases and crucial role of inversion phenomenon. Angiology 1985;36:315–26.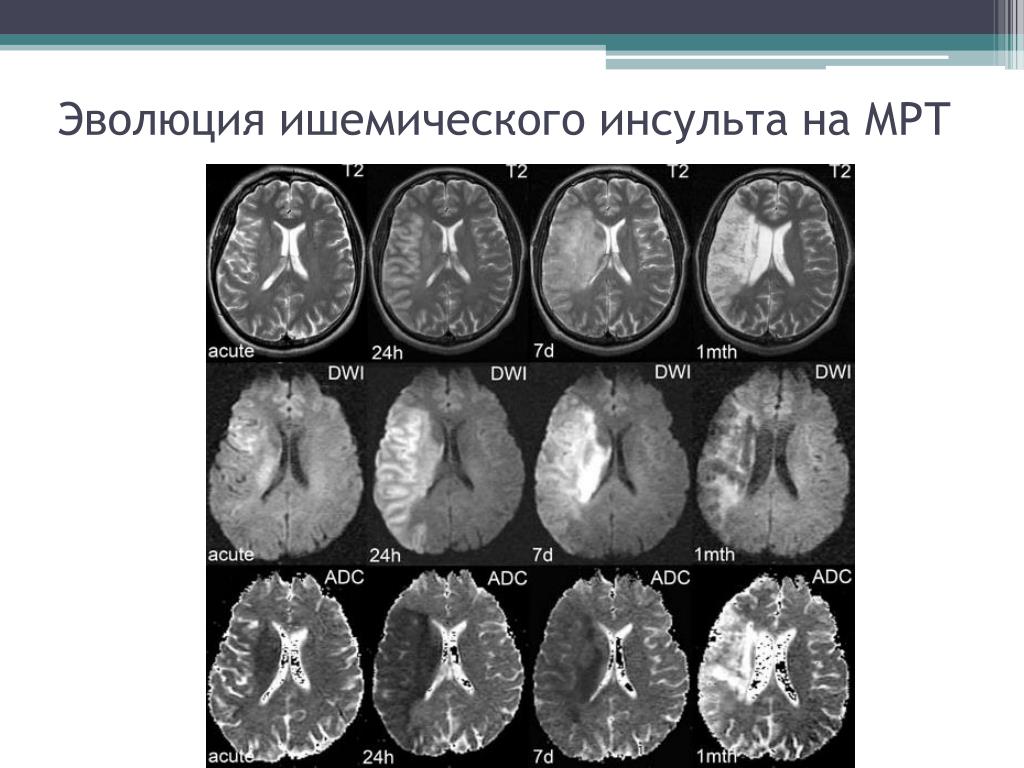
19. Brun J.F., Micallef J.F., Supparo I. et al. Maximal oxygen uptake and lactate thresholds during exercise are related to blood viscosity and erythrocyte aggregation in professional football players. Clin Hemorheol 1995;15(2):201–12.
20. Martini J., Carpentier B., Chavez Negrete A., et al. Beneficial effects due to increasing blood and plasma viscosity. Clin Hemorheol Microcirc 2006;35(1–2):51–7.
22. Ehrly A.M., Bauersachs R. Role of erythrocyte aggregation in the pathophysiology of vascular diseases. Clin Hemorheol 1995;15(3):429.
Clin Hemorheol 1995;15(3):429.
23. Maeda N., Cicha I., Tateishi N., Suzuki Y. Triglyceride in plasma: Prospective effects on microcirculatory functions. Clin Hemorheol Microcirc 2006;34(1–2):341–6.
24. Bishop J.J., Popel A.S., Intaglietta M., Johnson P.C. Effect of aggregation and shear rate on the dispersion of red blood cells flowing in venules. Am J Physiol Heart Circ Physiol 2002;283:1985–96.
25. Secomb T.W. Flow-dependent rheological properties of blood in capillaries. Microvasc Res 1987;34(1):46–58.
26. Stoltz J.F., Donner M., Muller S., Larcan A. Hemorheology in clinical practice. Introduction to the notion of hemorheologic profile. J Mal Vasc 1991;16:261–70.
27. Kon K., Maeda N., Shiga T. Erythrocyte deformation in shear flow: influences of internal viscosity, membrane stiffness, and hematocrit. Blood 1987;69:727–34.
Kon K., Maeda N., Shiga T. Erythrocyte deformation in shear flow: influences of internal viscosity, membrane stiffness, and hematocrit. Blood 1987;69:727–34.
28. Муравьев А.В., Чепоров С.В. Гемореология (экспериментальные и клинические аспекты реологии крови). Ярославль, 2009.
Острые нарушения мозгового кровообращения и коронавирусная болезнь | Пизова
1. Helms J., Kremer S., Merdji H., Clere-Jehl R., Schenck M., Kummerlen C., Collange O. et al. Neurologic Features in Severe SARS-CoV-2 Infection. N Engl J Med. 2020;382(23):2268–2270. doi: 10.1056/NEJMc2008597.
N Engl J Med. 2020;382(23):2268–2270. doi: 10.1056/NEJMc2008597.
2. Chen T., Wu D., Chen H., Yan W., Yang D., Chen G. et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study [published correction appears in BMJ. 2020 Mar 31;368:m1295]. BMJ. 2020;368:m1091. doi: 10.1136/bmj.m1091.
3. Divani А.А., Andalib S., Di Napoli V., Lattanzi S., Hussain M.S., Biller J. et al. Coronavirus Disease 2019 and Stroke: Clinical Manifestations and Pathophysiological Insights. J Stroke Cerebrovasc Dis. 2020;29(8):104941. doi: 10.1016/j.jstrokecerebrovasdis.2020.104941.
4. Zhao J., Rudd A., Liu R. Challenges and Potential Solutions of Stroke Care During the Coronavirus Disease 2019 (COVID-19) Outbreak. Stroke. 2020;51(5):1356–1357. doi: 10.1161/STROKEAHA.120.029701.
doi: 10.1161/STROKEAHA.120.029701.
5. Sharifi-Razavi A., Karimi N., Rouhani N. COVID-19 and intracerebral haemorrhage: causative or coincidental?. New Microbes New Infect. 2020;35:100669. doi: 10.1016/j.nmni.2020.100669.
6. Qin C., Zhou L., Hu Z., Yang S., Zhang S., Chen M. et al. Clinical Characteristics and Outcomes of COVID-19 Patients With a History of Stroke in Wuhan, China. Stroke. 2020;51(7):2219–2223. doi: 10.1161/STROKEAHA.120.030365.
7. Yaghi S., Ishida K., Torres J., Mac Grory B., Raz E., Humbert K. et al. SARS2- CoV-2 and Stroke in a New York Healthcare System. Stroke. 2020;51(7):2002–2011. doi: 10.1161/STROKEAHA.120.030335.
8. Mao L., Jin H., Wang M., Chen S. , He Q., Chang J. et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020;77(6):1–9. doi: 10.1001/jamaneurol.2020.1127.
, He Q., Chang J. et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020;77(6):1–9. doi: 10.1001/jamaneurol.2020.1127.
9. Li Y., Wang M., Zhou Y., Chang J., Xian Y., Mao L. et al. Acute cerebrovascular disease following COVID-19: a single center, retrospective, observational study. SSRN Electronic Journal. 2020. doi: 10.2139/ssrn.3550025.
10. Weston S., Frieman M.B. COVID-19: Knowns, Unknowns, and Questions. mSphere. 2020;5(2):e00203–20. doi: 10.1128/mSphere.00203-20.
11. Yang J., Zheng Y., Gou X., Pu K., Chen Z., Guo Q. et al. Prevalence of comorbidities and its effects in patients infected with SARS-CoV-2: a systematic review and meta-analysis. Int J Infect Dis. 2020;94:91–95. doi: 10.
12. Emami A., Javanmardi F., Pirbonyeh N., Akbari A. Prevalence of Underlying Diseases in Hospitalized Patients with COVID-19: a Systematic Review and Meta-Analysis. Arch Acad Emerg Med. 2020;8(1):e35. Available at: https://pubmed.ncbi.nlm.nih.gov/32232218.
13. Klok F.A., Kruip M.J.H.A., van der Meer N.J.M., Arbous M.S., Gommers D.A.M.P.J., Kant K.M. et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020;191:145–147. doi: 10.1016/j.thromres.2020.04.013.
14. Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-1062. doi: 10. 1016/S0140-6736(20)30566-3.
1016/S0140-6736(20)30566-3.
15. Onder G., Rezza G., Brusaferro S. Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy. JAMA. 2020. doi: 10.1001/jama.2020.4683.
16. Chen G., Wu D., Guo W., Cao Y., Huang D., Wang H. et al. Clinical and immunological features of severe and moderate coronavirus disease 2019. J Clin Invest. 2020;130(5):2620–2629. doi: 10.1172/JCI137244.
17. Conti P., Ronconi G., Caraffa A., Gallenga C.E., Ross R., Frydas I. et al. Induction of pro-inflammatory cytokines (IL-1 and IL-6) and lung inflammation by Coronavirus-19 (COVI-19 or SARS-CoV-2): anti-inflammatory strategies. J Biol Regul Homeost Agents. 2020;34(2):1. doi: 10.23812/CONTI-E.
18. Hamming I., Timens W., Bulthuis M.L., Lely A.T., Navis G., van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631-637. doi: 10.1002/path.1570.
Hamming I., Timens W., Bulthuis M.L., Lely A.T., Navis G., van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631-637. doi: 10.1002/path.1570.
19. Arabi Y.M., Balkhy H.H., Hayden F.G., Bouchama A., Luke T., Baillie J.K. et al. Middle East Respiratory Syndrome. N Engl J Med. 2017;376(6):584–594. doi: 0.1056/NEJMsr1408795.
20. Vaninov N. In the eye of the COVID-19 cytokine storm. Nat Rev Immunol. 2020;20(5):277. doi: 10.1038/s41577-020-0305-6.
21. Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844–847. doi: 10.1111/jth. 14768.
14768.
22. Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020. doi: 10.1001/jamainternmed.2020.0994.
23. Lippi G., Plebani M. Procalcitonin in patients with severe coronavirus disease 2019 (COVID-19): A meta-analysis. Clin Chim Acta. 2020;505:190–191. doi: 10.1016/j.cca.2020.03.004.
24. Zhang Y., Xiao M., Zhang S., Xia P., Cao W., Jiang W. et al. Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19. N Engl J Med. 2020;382(17):e38. doi: 10.1056/NEJMc2007575.
25. Varga Z., Flammer A.J., Steiger P.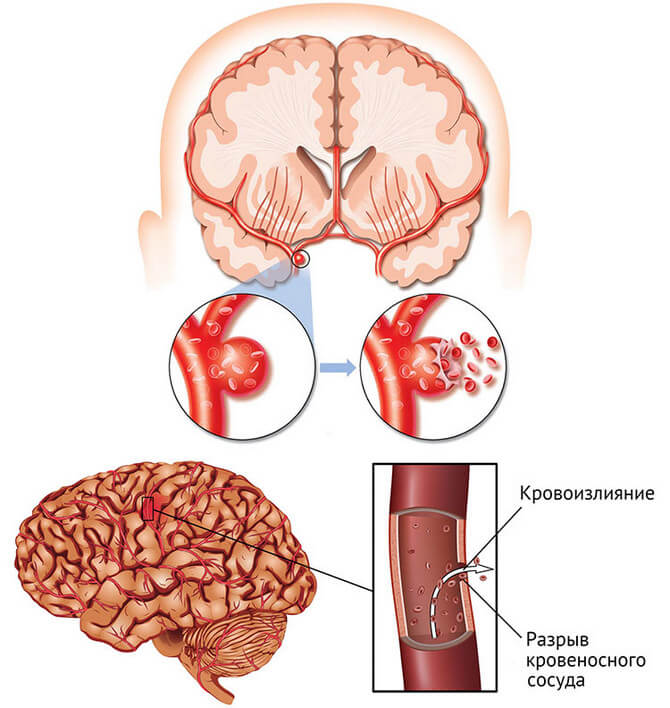 , Haberecker M., Andermatt R., Zinkernagel A.S. et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. doi: 10.1016/S0140-6736(20)30937-5.
, Haberecker M., Andermatt R., Zinkernagel A.S. et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. doi: 10.1016/S0140-6736(20)30937-5.
26. Bonetti P.O., Lerman L.O., Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk. Arterioscler Thromb Vasc Biol. 2003;23(2):168–175. doi: 10.1161/01.atv.0000051384.43104.fc.
27. Flammer A.J., Anderson T., Celermajer D.S., Creager M.A., Deanfield J., Ganz P. et al. The assessment of endothelial function: from research into clinical practice. Circulation. 2012;126(6):753–767. doi: 10.1161/CIRCULATIONAHA.112.093245.
28. Ding Y., Wang H., Shen H., Li Z., Geng J., Han H. et al. The clinical pathology of severe acute respiratory syndrome (SARS): a report from China. J Pathol. 2003;200(3):282–289. doi: 10.1002/path.1440.
J Pathol. 2003;200(3):282–289. doi: 10.1002/path.1440.
29. Wang C., Pan R., Wan X., Tan Y., Xu L., Ho C.S., Ho R.C. Immediate Psychological Responses and Associated Factors during the Initial Stage of the 2019 Coronavirus Disease (COVID-19) Epidemic among the General Population in China. Int J Environ Res Public Health. 2020;17(5):1729. doi: 10.3390/ijerph27051729.
30. Khosravani H., Rajendram P., Notario L., Chapman M.G., Menon B.K. Protected Code Stroke: Hyperacute Stroke Management During the Coronavirus Disease 2019 (COVID-19) Pandemic. Stroke. 2020;51(6):1891–1895. doi: 10.1161/STROKEAHA.120.029838.
31. Montaner J., Barragán-Prieto A., Pérez-Sánchez S., Escudero-Martínez I., Moniche F., Sánchez-Miura J.A. et al. Break in the Stroke Chain of Survival Due to COVID-19.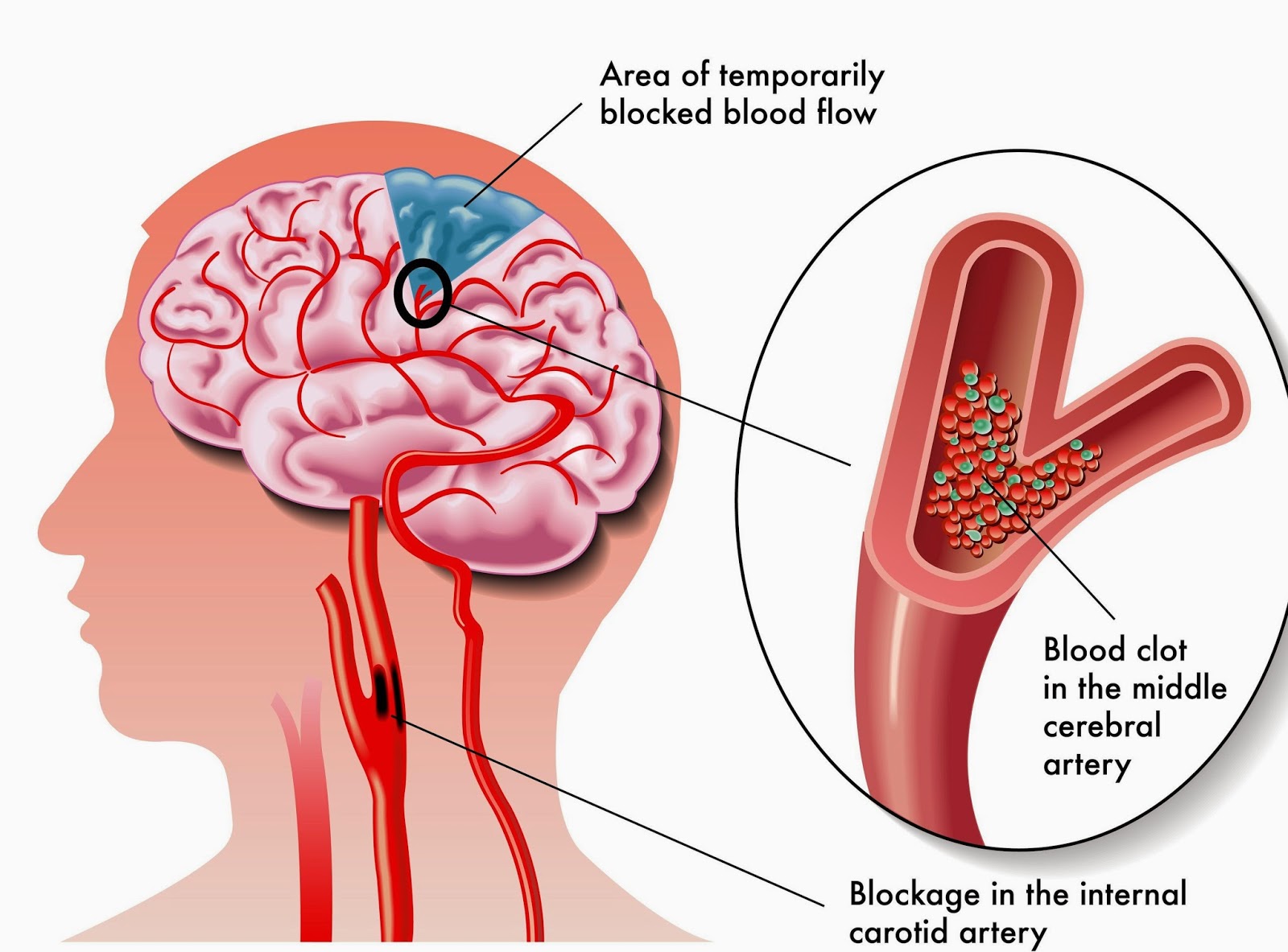 Stroke. 2020. doi: 10.1161/STROKEAHA.120.030106.
Stroke. 2020. doi: 10.1161/STROKEAHA.120.030106.
32. Klijn C.J., Paciaroni M., Berge E., Korompoki E., Kõrv J., Lal A. et al. Antithrombotic treatment for secondary prevention of stroke and other thromboembolic events in patients with stroke or transient ischemic attack and non-valvular atrial fibrillation: A European Stroke Organisation guideline. Eur Stroke J. 2019;4(3):198–223. doi: 10.1177/2396987319841187.
33. Palnum K.H., Mehnert F., Andersen G., Ingeman A., Krog B.R., Bartels P.D., Johnsen S.P. Use of secondary medical prophylaxis and clinical outcome among patients with ischemic stroke: a nationwide follow-up study. Stroke. 2012;43(3):802–807. doi: 10.1161/STROKEAHA.111.635342.
34. Asberg S., Henriksson K.M., Farahmand B., Asplund K., Norrving B. , Appelros P. et al. Ischemic stroke and secondary prevention in clinical practice: a cohort study of 14,529 patients in the Swedish Stroke Register. Stroke. 2010;41(7):1338–1342. doi: 10.1161/STROKEAHA.110.580209.
, Appelros P. et al. Ischemic stroke and secondary prevention in clinical practice: a cohort study of 14,529 patients in the Swedish Stroke Register. Stroke. 2010;41(7):1338–1342. doi: 10.1161/STROKEAHA.110.580209.
35. Bernhardt J., Dewey H., Thrift A., Collier J., Donnan G. A very early rehabilitation trial for stroke (AVERT): phase II safety and feasibility. Stroke. 2008;39(2):390–396. doi: 10.1161/STROKEAHA.107.492363.
36. Veerbeek J.M., van Wegen E., van Peppen R., van der Wees P.J., Hendriks E., Rietberg M., Kwakkel G. What is the evidence for physical therapy poststroke? A systematic review and meta-analysis. PLoS One. 2014;9(2):e87987. doi: 10.1371/journal.pone.0087987.
37. Танашян М.М., Домашенко М.А., Максимова М.Ю. Современная нейропротекция в комплексном лечении пациентов в остром и раннем восстановительном периоде ишемического инсульта. Нервные болезни. 2017;(3):36–41. Режим доступа: https://www.neurology.ru/sites/default/files/assets/documents/2017/11/nb-3-2017-36.pdf?download=1.
Нервные болезни. 2017;(3):36–41. Режим доступа: https://www.neurology.ru/sites/default/files/assets/documents/2017/11/nb-3-2017-36.pdf?download=1.
38. Прокопенко С.В., Шанина Е.Г., Петрова М.М., Можейко Е.Ю. Нейрорепарация: современные взгляды на проблему. Фарматека. 2014;(13):20–24. https://pharmateca.ru/ru/archive/article/30171.
39. Романова Г.А., Шакова Ф.М., Барсков И.В., Стельмашук Е.В., Петров Т.В., Соколов М.А. и др. Влияние целлекса на функциональные и морфологические изменения при экспериментальной фокальной ишемии префронтальной коры головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуск. 2010;110(9):52–56. Режим доступа: https://www.mediasphera.ru/issues/zhurnal-nevrologii-i-psikhiatrii-im-s-skorsakova-2/2010/9/031997-72982010910.
40. Хасанова Д.Р., Данилова Т.В., Дёмин Т.В., Кнни К.С., Гайфутдинова Л.В. Влияние препарата Целлекс на восстановление двигательных и речевых функций в ранней нейрореабилитации пациентов, перенесших ишемический инсульт. Медицинский совет. 2018;(9):14–19. doi: 10.21518/2079-701X-2018-9-14-19.
41. Пизова Н.В., Соколов М.А., Измайлов И.А. Целлекс в лечении больных с острым нарушением мозгового кровообращения: результаты российскоо многоцентрового сравнительного открытого клинического исследования. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;(5):22–26. Режим доступа: https://www.mediasphera.ru/issues/zhurnal-nevrologii-ipsikhiatrii-im-s-s-korsakova/2014/5/031997-7298201454.
42. Бельская Г.Н., Пизова Н.В., Соколов М.А., Измайлов И.А. Влияние нейропротективной терапии на течение церебрального инсульта. Медицинский совет. 2016;(11):14–19. doi: 10.21518/2079-701X-2016-11-26-31.
43. Бельская Г.Н., Чуприна С.Е., Воробьев А.А., Горожа Е.Н., Буторакина Т.Л., Соколов М.А., Измайлов И.А. Когнитивные нарушения при инсульте: возможности медикаментозной коррекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(5):33–37. doi: 10.17116/jnevro20161165133-37.
44. Котов С.В., Белова Ю.А., Щербакова М.М., Червинская А.Д., Исакова Е.В., Волченкова Е.В. Восстановление речевых функций у больных с афазией в раннем реабилитационном периоде ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(2):38–41. doi: 10.17116/jnevro20171172138-41.
45. Коваленко А.В., Сафронова М.Н. Влияние целлекса на восстановление когнитивных и речевых нарушений в остром периоде инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;115(1):40–44. doi: 10.17116/jnevro20151151140-44.
46. Бельская Г.Н., Крылова Л.Г., Соколов М.А., Измайлов И.А. Возможности коррекции речевых расстройств в остром периоде ишемического инсульта с помощью нейропротективной терапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;115(9):60–63. doi: 10.17116/jnevro20151159260-63.
47. Ковальчук В.В., Гусев А.О., Миннуллин Т.И., Нестерин К.В. Реабилитация пациентов после инсульта. Критерии эффективности и факторы успеха: роль физической, нейропсихологической и медикаментозной терапии. Эффективная фармакотерапия. Неврология и психиатрия. Спецвыпуск «Мысли, знания и опыт ведущих ученых-неврологов Санкт-Петербурга». 2017;(19):62–73. Режим доступа: https://umedp.ru/articles/reabilitatsiya_patsientov_posle_insulta_kriterii_effektivnosti_i_faktory_uspekha_rol_fizicheskoy_ney.html.
Учёные предложили новый надёжный метод для прогнозирования исхода у пациентов с острым ишемическим инсультом
Группа красноярских учёных разработала простой, надёжный и минимально инвазивный метод динамической оценки клинического течения острого ишемического инсульта и прогнозирования ранних результатов и перспектив восстановления для пациентов.
Исследовав концентрацию нейротрофического фактора головного мозга (BDNF) и васкулоэндотелиального фактора роста (VEGF) в плазме крови, учёные пришли к выводу, что прогностическое значение имеют не единичные, а серийные динамические измерения концентрации BDNF в плазме в острый период ишемического инсульта. Кроме того, чрезмерно высокие концентрации VEGF на протяжении первой недели от начала болезни говорят о менее благоприятном прогнозе реабилитации пациента. Основные результаты исследования опубликованы в сборнике Bioinformatics and Biomedical Engineering.
Инсульт — острое нарушение центральной нервной системы и одна из основных причин смертности и инвалидности среди населения всего мира. В России инсульт головного мозга ежегодно переносят около 450 тысяч человек, показатель смертности от этого заболевания в нашей стране в 4 раза выше, чем в США и Канаде. Среди всех инсультов 80 % составляют инсульты ишемического характера. Около трети пациентов, перенёсших инсульт, требуется посторонняя помощь и уход, некоторая часть пострадавших теряет способность самостоятельно передвигаться. Лишь около 20 % переживших инсульт могут вернуться к прежнему образу жизни и работе. В связи с этим чрезвычайно важно проводить своевременную диагностику, помогающую спрогнозировать течение заболевания в краткосрочной и долгосрочной перспективе.
«Иммунная система человека воспринимает собственный мозг как чужеродное тело и атакует его. При нарушениях мозгового кровообращения мозг начинает испытывать колоссальный дефицит питательных веществ. Чтобы состояние пациента, чей мозг подвергся такой атаке, восстановилось и приблизилось к доинсультному, в первую очередь, нужно восстановить систему кровоснабжения, а для этого нужно „вырастить“ новые кровеносные сосуды взамен поражённых. В плазме крови циркулируют так называемые факторы роста, биохимические соединения VEGF и BDNF — они отвечают за развитие мелких периферических кровеносных сосудов. Гипотеза моих соавторов состояла в том, что измерение уровня этих факторов в плазме крови пациентов на 1,7 и 21 день пребывания в медицинском учреждении поможет спрогнозировать, как будет проходить реабилитация в каждом отдельном случае», — рассказал профессор кафедры биофизики, старший научный сотрудник СФУ Михаил Садовский.
Исследователь отметил, что изначальная гипотеза подтвердилась лишь отчасти — наблюдение за пациентами и применение простых методов статистики не подтвердило прямой связи между колебаниями уровня VEGF и BDNF и самочувствием людей в долгосрочной перспективе. Однако же биоинформатический метод упругих карт дал более полную и достоверную информацию, позволяющую считать анализ крови на факторы роста эффективной мерой.
«Методом упругих карт удалось распределить 56 пациентов, участвовавших в эксперименте, по трём кластерам. Они распределились достаточно неожиданным для медиков образом: во второй группе, где показатели VEGF и BDNF скачкообразно увеличивались на 7 день болезни, был самый высокий уровень смертности. Это парадоксально, поскольку факторы роста сами по себе считаются полезными для восстановления кровеносной системы. Видимо, секрет здесь именно в резком возрастании количества этих веществ, и в данном случае „больше“ совершенно не означает „лучше“»,— объяснил Михаил Садовский.
Выстроив упругие карты и проанализировав выявленные закономерности, учёные удостоверились, что первые полученные результаты и метод в целом являются устойчивыми — искусственно «сгенерированный» или случайно «потерянный» в выборке пациент не смогли нарушить стройность системы.
«Для меня, как биоинформатика, в этой работе интересно применение метода упругих карт с целью прогноза. Эти карты позволяют визуализировать и анализировать многомерные данные. Метод универсальный и, как выяснилось, достаточно эффективный для применения в медицине — во всяком случае, эмпирические данные, которые мои коллеги собирали на протяжении двух лет, мы обработали таким образом, что получили ещё один инструмент прогнозирования отдалённых последствий ишемического инсульта», — резюмировал учёный.
Согласно ключевым выводам исследователей, в случае острого инсульта не так важны конкретные численные значения BDNF в плазме крови, как наблюдение за динамикой — ростом и падением уровня этого вещества на 1,7 и 21 дни. Кроме того, концентрация VEGF более 260 пг/мл в 1 и 7 день от начала ишемического инсульта с высокой вероятностью указывает на более тяжёлое течение заболевания. Возможно, это связано со способностью вещества не только «выращивать» новые сосуды, но и увеличивать их проницаемость, а также провоцировать отёк головного мозга.
Сообщается, что в исследовании приняли участие сотрудники и студенты Красноярского государственного медицинского университета им. имени профессора В. Ф. Войно-Ясенецкого, Красноярской межрайонной клинической больницы № 20 имени И. С. Берзона и Института вычислительного моделирования СО РАН (г. Красноярск).
ОПЕРАЦИИ НА СОННЫХ АРТЕРИЯХ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | Михайлов
1. Левин ОС, Усольцева НИ, Дударева МА. Когнитивные нарушения в раннем восстановительном периоде ишемического инсульта. Российский медицинский журнал. 2009;(4):20-25. [Levin OS, Iunishchenko NA, Dudarova MA. Cognitive disorders in the early rehabilitative period of ischemic stroke. Rossiiskii Meditsinskii Zhurnal=Medical Journal of Russian Federation. 2009;(4):20-25 (in Russ.)].
2. Виберс ДО, Фейгин ВЛ, Браун РД. Инсульт: клиническое руководство. Пер. с англ. ВЛ. Фейгина. СПб.:Диалект; М.:БИНОМ;2005. [Wiebers DO, Feigin VL, Brown RD. Handbook of Stroke. Rochester;1997. (Russ. ed.: Vibers DO, Feigin VL, Braun RD. Insult: klinicheskoe rukovodstvo. SPb:Dialekt; Moscow:BINOM;2005.)].
3. Ferrero E, Ferri M, Viazzo A, Labate C, Berardi G, Pecchio A, et al. A retrospective study on early carotid endarterectomy within 48 hours after transient ischemic attack and stroke in evolution. Ann Vasc Surg. 2014;28(1):227-38. DOI: 10.1016/j.avsg.2013.02.015.
4. Jetty P, Husereau D, Kubelik D, Nagpal S, Brandys T, Hajjar G, et al. Wait times among patients with symptomatic carotid artery stenosis requiring carotid endarterectomy for stroke prevention. J Vasc Surg. 2012;56(3):661-7. DOI: 10.1016/j.jvs.2012.03.001.
5. Rockman C, Riles T. Carotid artery disease: selecting the appropriate asymptomatic patient for intervention. Perspect Vasc Surg Endovasc Ther. 2010;22(1):30-7. DOI: 10.1177/1531003510379881.
6. Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K, et al. Guidelines for prevention of stroke in patients with ischaemic stroke or transient ischaemic attack: a statement for healthcare professionals from the American Heart Association/ American Stroke Association Council on Stroke: со– sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the vale of this guideline. Stroke. 2006;37(2):577617. DOI: 10.1161/01.STR.0000199147.30016.74.
7. European Stroke Organisation. Guidelines for management of ischemic stroke and transient ischemic attack. Cerebrovasc Dis. 2008;25(5):457-507. DOI: 10.1159/000131083. 2008;104.
8. Золотухин КН, Поляков ИВ, Самородов АВ. Сравнительный анализ мониторинга центральной гемодинамики монитором МПР 6-03 «Тритон» и «Picco Plus». Тольяттинский Медицинский Консилиум. 2012;(3-4):19-23. [Zolotukhin KN, Polyakov IV, Samorodov AV. Comparative analysis of circulatory dynamics monitoring with heartbeat monitor «Triton» vs. «PiccoPlus». Togliatti Medical Consultation. 2012;(3-4):19-23 (in Russ.)].
9. Bruetman ME, Fields WS, Crawford ES, de Bakey ME. Cerebral hemorrhage in carotid artery surgery. Arch Neurol. 1963;(9):458-67. DOI:10.1001/ archneur.1963.00460110026002.
10. Rob CG. Operation for acute completed stroke due to thrombosis of the internal carotid artery. Surgery. 1969;(65):862-65. PMID: 5777239.
11. Wyline EJ, Hein MF, Adams JE. Intracranial hemorrhage following surgical revascularization for treatment of acute strokes. J Neurosurg. 1964;(21):21215. DOI: 10.3171/jns.1964.21.3.0212.
12. Giles MF, Rothwell PM. Systematic review and pooled analysis of published and unpublished validations of the ABCD and ABCD2 transient ischemic attack risk scores. Stroke. 2010;41(4):667-73. DOI: 10.1161/STROKEAHA.109.571174.
13. Rerkasem K, Rothwell PM. Carotid endarterectomy for symptomatic carotid stenosis. Cochrane Database Syst Rev. 2011;(4):CD001081. DOI: 10.1002/14651858.
14. Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ. Sex difference in the effect of time from symptoms to surgery on benefit from carotid endarterectomy for transient ischemic attack and nondisabling stroke. Stroke. 2004;35(12):2855-61. DOI: 10.1161/01.STR.0000147040.20446.f6.
15. De Rango P, Brown MM, Chaturvedi S, Howard VJ, Jovin T, Mazya MV, et al. Summary of evidence on early carotid intervention for recently symptomatic stenosis based on meta-analysis of current risks. Stroke. 2015;46(12):3423-36. DOI: 10.1161/STROKEAHA.115.010764.
16. Дуданов ИП, Стафеева ИВ. Особенности когнитивных вызванных потенциалов у пациентов, перенесших каротидную эндартрэктомию в остром периоде ишемического инсульта. Современные проблемы науки и образования. 2015;(5):375. [Dudanov IP, Stafeeva IV. Features of cognitive evoked potentials in patients after carotid endarterectomy in acute is chemic stroke. Sovremennye problemy nauki I obrasovaniya=Modern problems of science and education. 2015;(5):375 (in Russ.)].
17. Игнатьев ИМ. Операции на сонных артериях в остром периоде ишемического инсульта. Ангиология и сосудистая хирургия. 2011;17(2):113-18. [Ignatiev IM. Operations on carotid arteries in an acute stage of ischaemic stroke. Angiology and Vascular Surgery. 2011;17(2):113-18 (in Russ.)].
18. Ючино К, Пари Д, Гротта Д. Острый ин сульт. Пер. с англ. М.: ГЭОТАР;2012. 255 c. [Uchino K, Pary J, Grotta J. Acute Stroke Care. Moscow: GEOTAR;2012. 255 p. (Russ. ed.: Yuchino K, Pati J, Grotta J. Ostyi insult. Moscow: GEOTAR;2012. 255 p.)].
19. Ураков АЛ, Самородов АВ, Камилов ФХ, Мустафин ИГ, Халиуллин ФА. Особенности экспрессии Р-селектина и агрегации тромбоцитов под действием лекарственных препаратов. Фармация. 2017;66(3):43-46. [Urakov AL, Samorodov AV, Kamilov FKh, Mustafin IG, Khaliullin FA. P-selectin expression of and platelet aggregation under the action of drugs. Pharmacy. 2017; 66(3):43-46 (in Russ.)].
20. Ураков АЛ, Самородов АВ, Камилов ФХ, Халиуллин ФА. Полирегионарная агрегатометрия крови пациентов с острым тромбозом, как потенциальная модель доклинических исследований новых корректоров системы гемостаза ex vivo. Регионарное кровообращение и микроциркуляция. 2017;16(1):65-71. [Urakov AL, Samorodov AV, Kamilov FKh, Khaliullin FA. Polyregional aggregatometry of blood in patients with acute thrombosis as a potential model for preclicinal studies of new correctors of hemostasis system ex vivo. Regional Haemodynamics and Microcirculation. 2017;16(1):65-71 (in Russ.)].
Уровень гемоглобина и ишемический инсульт
* By submitting the completed data in the registration form, I confirm that I am a healthcare worker of the Russian Federation and give specific, informed and conscious consent to the processing of personal data to the Personal Data Operator Pfizer Innovations LLC (hereinafter referred to as the “Operator”) registered at the address: St. Moscow, Presnenskaya embankment, house 10, 22nd floor.
I grant the Operator the right to carry out the following actions with my personal data, as well as information about my hobbies and interests (including by analyzing my profiles on social networks): collecting, recording, systematizing, accumulating, storing, updating (updating, changing) , extraction, use, transfer (access, provision), deletion and destruction, by automated and (or) partially automated (mixed) processing of personal data.
Consent is granted with the right to transfer personal data to affiliated persons of Pfizer Innovations LLC, including Pfizer LLC (Moscow, Presnenskaya naberezhnaya, 10, 22nd floor), and with the right to order the processing of personal data, incl. h. LLC «Redox» (Moscow, Volgogradskiy prospect, house 42, building 42A, floor 3, room 3) and LLC «Supernova» (Moscow, Varshavskoe shosse, house 132), which processes and stores personal data.
The processing of my personal data is carried out for the purpose of registering on the Operator’s website www.pfizerprofi.ru to provide me with access to information resources of the Pfizer company, as well as to interact with me by providing information through any communication channels, including mail, SMS, e-mail, telephone and other communication channels.
This consent is valid for 10 (ten) years.
I have been informed about the right to receive information regarding the processing of my personal data, in accordance with the Federal Law of July 27, 2006 No. 152-FZ «On Personal Data».
This consent can be revoked by me at any time by contacting the address of the Operator-Pfizer Innovations LLC or by phone. 8 495 287 5000.
*Отправляя заполненные данные в регистрационной форме, я подтверждаю, что являюсь работником здравоохранения Российской Федерации и даю конкретное, информированное и сознательное согласие на обработку персональных данных Оператору персональных данных ООО «Пфайзер Инновации» (далее «Оператор»), зарегистрированному по адресу: г. Москва, Пресненская набережная, дом 10, 22 этаж.
Я предоставляю Оператору право осуществлять с моими персональными данными, а также сведениями о моих хобби и увлечениях (в том числе с помощью анализа моих профилей в социальных сетях) следующие действия: сбор, запись, систематизация, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передача (доступ, предоставление), удаление и уничтожение, путем автоматизированной и (или) частично автоматизированной (смешанной) обработки персональных данных.
Согласие предоставляется с правом передачи персональных данных аффилированным лицам ООО «Пфайзер Инновации», в т. ч. ООО «Пфайзер» (г. Москва, Пресненская набережная, дом 10, 22 этаж), и с правом поручения обработки персональных данных, в т.ч. ООО «Редокс», (г. Москва, Волгоградский проспект, дом 42, корпус 42А, этаж 3, ком. 3) и ООО «Супернова» (г. Москва, Варшавское шоссе, дом 132), осуществляющим обработку и хранение персональных данных.
Обработка моих персональных данных осуществляется с целью регистрации на сайте Оператора www.pfizerprofi.ru для предоставления мне доступа к информационным ресурсам компании Пфайзер, а также для взаимодействия со мной путем предоставления информации через любые каналы коммуникации, включая почту, SMS, электронную почту, телефон и иные каналы коммуникации.
Срок действия данного согласия — 10 (десять)лет.
Я проинформирован (-а) о праве на получение информации, касающейся обработки моих персональных данных, в соответствии с Федеральным законом от 27.07.2006 г. №152-ФЗ «О персональных данных».
Данное согласие может быть отозвано мною в любой момент посредством обращения по адресу нахождения Оператора-ООО «Пфайзер Инновации» или по тел. 8 495 287 5000.
Влияние инсульт-ассоциированной пневмонии на исход острого каротидного ишемического инсульта | Чипова Д.Т., Сантикова Л.В., Жемухов А.Ч.
ВведениеМозговой инсульт на сегодняшний день является одной из наиболее частых причин стойкой утраты трудоспособности и летальности. В соответствии с опубликованными в 2020 г. данными о наиболее распространенных причинах ограничения трудоспособноcти по показателю DALY (англ.: disability-adjusted life year — годы жизни, скорректированные по нетрудоспособности, т. е. бремя болезни) в перечне из 369 заболеваний на 5-м месте находится инсульт [1]. Несмотря на усилия, предпринимаемые обществом для сокращения бремени, связанного с инсультом, реализацию мер первичной и вторичной профилактики нарушений мозгового кровообращения и совершенствование методов восстановительного лечения, число пациентов и уровень материальных потерь во многих регионах не только не уменьшаются, а наоборот, увеличиваются. Так, согласно результатам исследования [1] за период с 1990 по 2009 г. по показателю DALY инсульт переместился с 5-го на 3-е место, притом что максимальный прирост наблюдался среди лиц трудоспособного возраста. В первую очередь указанная динамика касается государств с низким и умеренным уровнем дохода на душу населения и недостаточной эффективностью региональных систем оказания медицинской помощи [2]. Одной из наиболее частых форм острых нарушений мозгового кровообращения является ишемический инсульт (ИИ), который в европейских и североамериканских популяциях, а также в Российской Федерации встречается в 4–5 раз чаще геморрагического [3, 4].
Среди наиболее важных причин наступления летального исхода при ИИ следует отметить нарастающий отек и дислокацию головного мозга при обширном очаге поражения, тромбоэмболию легочной артерии, источником которой являются вены нижних конечностей и малого таза, острый коронарный синдром, а также воспалительные заболевания [5]. Среди широкого спектра воспалительных заболеваний, развивающихся в остром периоде ИИ, бронхолегочные инфекции являются наиболее частыми, особенно у пациентов, госпитализированных в изначально более тяжелом состоянии, с ранним угнетением сознания, нарушениями дыхания и глотания [6, 7]. Серьезную проблему представляют собой нарушения правил ведения пациента с ограниченными возможностями передвижения и самообслуживания, в особенности в домашних условиях, когда неправильное кормление (в частности, прием пищи в лежачем положении) и длительное пребывание в положении лежа с опущенным головным концом создают предпосылки для заброса содержимого ротовой полости в бронхиальное дерево и возникновения аспирационной пневмонии [8]. Ряд указанных причин бронхолегочных осложнений потенциально предупредимы, так как гигиенические мероприятия, в частности туалет ротовой полости, установка назогастрального зонда или гастростомы значительно снижают риск аспирации, а систематическое проведение лечебной (дыхательной) гимнастики снижает вероятность гипостатических явлений в легких [9]. Важными причинами пневмонии являются внутрибольничная инфекция, пребывание, особенно длительное, в условиях искусственной вентиляции легких.
Вместе с тем причины бронхолегочных осложнений у пациентов с ИИ не могут быть объяснены исключительно аспирацией или нарушением легочной вентиляции. На сегодняшний день важная роль в развитии пневмонии отводится нарушениям иммунитета (непосредственно связанным с поражением вещества головного мозга), системной и локальной воспалительной реакции организма на возникновение очага некроза (в т. ч. реакции нейровоспаления) [10–12]. Существенную роль в модуляции клеточного ответа на ишемическое повреждение играет реакция окислительного стресса [13]. В настоящее время такого рода пневмонию, возникшую у пациента с острым инсультом на протяжении первых 7 сут от момента развития заболевания, предложено рассматривать как инсульт-ассоциированную пневмонию (ИАП) [14]. Авторами предложено выделять подтвержденную ИАП — при подтверждении клинических критериев характерной рентгенологической картиной и вероятную ИАП, при которой клиническая картина не подтверждается результатами даже повторных рентгенологических исследований. Также авторы отмечают относительно невысокую ценность исследования количества в периферической крови лейкоцитов, концентрации С-реактивного белка (СРБ) и прокальцитонина.
Установлено, что развитие воспалительных осложнений у больного с ИИ ассоциировано с более высоким уровнем летальности, необходимостью более длительного пребывания на больничной койке, в т. ч. в отделении интенсивной терапии, повышением риска тромбозов различной локализации и повторного ИИ [9]. Развитие воспалительных осложнений также связано с высокими материальными затратами, включая стоимость лекарственных препаратов, лабораторно-инструментального обследования, более длительного пребывания в стационаре [15, 16]. Вместе с тем требует изучения влияние ИАП не только на течение острого периода ИИ, но и на ранние и отдаленные исходы заболевания.
Цель исследования: изучить влияние ИАП на исход ИИ в системе внутренней сонной артерии.
Материал и методыПроведено проспективно-ретроспективное исследование. Протокол исследования одобрен локальным этическим комитетом.
Под наблюдением находились 87 человек, госпитализированных в отделение для лечения больных с острыми нарушениями мозгового кровообращения с подтвержденным диагнозом острого ИИ.
Критерии включения в исследование: острый нелакунарный ИИ; госпитализация в 1-е сут от момента развития ИИ; наличие очага ИИ, подтвержденного результатами рентгеновской компьютерной томографии (КТ) головного мозга. Критерии невключения в исследование: геморрагический инсульт; лакунарный ИИ; ИИ в вертебрально-базилярной системе; острое воспалительное/инфекционное заболевание, имевшее место до развития настоящего ИИ; системные заболевания с воспалительной реакцией; органические заболевания головного мозга (травматические, воспалительные, опухолевые).
Оценивали тяжесть неврологического дефицита (Шкала инсульта Национального института здоровья США, NIHSS), уровень бодрствования (Шкала комы Глазго) при госпитализации, выраженность инвалидизации при выписке из стационара (индекс Бартела). Диагноз «ИИ» устанавливали на основании клинической картины, КТ головного мозга, ультразвуковой допплерографии вне- и внутричерепных артерий. Клинический диагноз «пневмония» подтверждали лабораторно-инструментальным обследованием (формула крови, СОЭ, концентрация СРБ в крови, рентгенография легких). Также рассчитывали индекс сдвига лейкоцитов крови (ИСЛК) по формуле: эозинофилы + нейтрофилы + базофилы / лимфоциты + моноциты. Ранее было показано, что повышение ИСЛК является надежным маркером воспаления (норма 1,96±0,56) [17]. Обследование проводилось в 1, 5 и 9-е сут после ИИ, а также через 6 мес. и 12 мес. после выписки из стационара.
В 1-ю группу вошли 12 пациентов с ИАП (у 8 пациентов имела место подтвержденная ИАП и у 4 — вероятная ИАП), во 2-ю группу — 75 пациентов без воспалительных заболеваний бронхолегочной системы. Клинико-демографическая характеристика больных обеих групп представлена в таблице 1.
Статистическая обработка результатов выполнена с использованием параметрических критериев (нормальность распределения определялась при помощи критерия Колмогорова — Смирнова) с помощью программы SPSS 20.0; для изучения связи между независимыми переменными (связь случаев развития ИАП с потенциальными факторами риска) использовали коэффициент корреляции Пирсона (r). Статистически значимыми считали различия при p<0,05.
Результаты исследованияИсходно группы оказались сопоставимыми по основным демографическим показателям, выраженности неврологического дефицита и тяжести угнетения сознания по Шкале комы Глазго (табл. 2). Также не выявлено достоверных межгрупповых различий изучаемых лабораторных показателей. В 1-й группе 8 (66,7%) пациентов перенесли атеротромботический ИИ, 4 (33,3%) — кардиоэмболический, тогда как во 2-й группе 39 (52%) пациентов перенесли атеротромботический ИИ, 27 (36%) — кардиоэмболический и 9 (12%) — ИИ неуточненного патогенетического подтипа, т. е. в 1-й группе оказалось незначительно больше случаев атеротромботического ИИ (p>0,05).
За время пребывания в стационаре умерли 4 (33,1%) пациента в 1-й группе и 10 (13,3%) — в 2-й группе (p<0,05). Непосредственными причинами наступления летального исхода в обеих группах оказались нарастающий отек головного мозга, тромбоз вен таза и глубоких вен голеней с тромбоэмболией легочной артерии, острый инфаркт миокарда, в 1-й группе, наряду с отмеченным выше, — системная воспалительная реакция и полиорганная недостаточность. Внутривенная тромболитическая терапия чаще проводилась в 1-й группе (2 и 4 пациента соответственно), различия не носили достоверного характера.
На фоне проведенного лечения у выживших пациентов обеих групп наблюдалась положительная динамика: восстановление уровня бодрствования, уменьшение выраженности неврологического дефицита (по шкале NIHSS). При этом выраженность и темпы регресса неврологического дефицита в обеих группах носили различный характер (табл. 2). У пациентов 2-й группы начиная с 5-х сут наблюдалось уменьшений показателей по шкале NIHSS, которое достигало достоверных различий к окончанию стационарного периода лечения, при этом у пациентов 1-й группы динамика носила менее выраженный характер, в связи с чем регистрировались различия при обследовании на 9-е сут. Соответственно, значения индекса Бартела на 9-е сут у пациентов 1-й группы оказались ниже, чем во 2-й группе (p<0,05). В последующем, при обследовании через 6 мес. и 12 мес. между 1-й и 2-й группами отсутствовали различия в выраженности неврологического дефицита и способности к самообслуживанию.
Установлена связь между вероятностью развития ИАП и наличием нарушений глотания (r=0,672; p<0,05), возрастом больных (r=0,572; p<0,05) и наличием сахарного диабета (r=0,522; p<0,05).
Показатели клеточного состава периферической крови, значения СОЭ и СРБ были незначительно повышены на 5-е сут (различия не носили достоверного характера по сравнению с исходным уровнем) и нормализовались в последующем. При этом в 1-е сут различия показателей между группами отсутствовали. У пациентов 2-й группы при исследовании на 5-е сут имели место признаки воспалительной реакции, причем значения ИСЛК, СОЭ и СРБ достоверно отличались от исходных. На 9-е сут на фоне проводимой антибактериальной и противовоспалительной терапии указанные показатели демонстрировали тенденцию к снижению, однако превышали исходный уровень и были выше, чем у пациентов 1-й группы.
ОбсуждениеНа сегодняшний день связь воспалительных осложнений острого ИИ, с одной стороны, и увеличение сроков пребывания в стационаре и внутрибольничной летальности — с другой, убедительно доказана [7, 14]. В особенности велико влияние воспалительных осложнений на летальность и смертность и функциональное состояние больного в первые 3–6 мес. после ИИ [18, 19]. Более сложной представляется связь между осложнениями острого ИИ, в т. ч. ИАП, и отдаленными исходами заболевания. В частности, ряд исследователей отмечают, что сама по себе ИАП ассоциирована с худшим функциональным исходом ИИ, более высокой ранней летальностью, но не оказывает влияния на отдаленные исходы заболевания [16]. Вероятно, помимо более тяжелого и длительного течения острого периода ИИ, на выраженность последующей инвалидизации оказывает влияние отсроченное начало реабилитационных мероприятий, проведение которых невозможно у пациента с острым воспалительным заболеванием. Вместе с тем влияние осложнений острого периода ИИ, в т. ч. ИАП, на течение цереброваскулярной патологии по мере регресса воспалительного заболевания уменьшается. Соответственно, степень восстановления нарушенных функций, контроль риска повторных ИИ и иных сосудистых событий определяются другими факторами (локализация и объем первичного очага поражения, выраженность пареза, депрессивного расстройства, характер причины, которая привела к ИИ, и пр.).
Однако имеются свидетельства возможности отсроченного поражения мозгового вещества у пациентов, перенесших ИИ, осложненный воспалительными заболеваниями. Показано, что нарушение гематоэнцефалического барьера при остром ИИ обеспечивает возможность контакта нейроспецифических антигенов (белки нейронов и глии) с иммунокомпетентными клетками [20, 21]. Следствием этого является аутоиммунный процесс отсроченного поражения мозгового вещества, клинически способный проявляться нарастающими когнитивными расстройствами [22]. В частности, такой механизм рассматривается в качестве одной из возможных причин формирования постинсультной деменции [23]. В этой связи представляет интерес не только раннее выявление воспалительного заболевания, но и определение характера возбудителя, наличие которого связано с повышенным риском отсроченного поражения мозгового вещества.
Диагностика ИАП, учитывая не всегда четкую клиническую картину и отсутствие надежных клинико-лабораторных маркеров ранней диагностики, представляет собой серьезную проблему. Как вариант ее решения обсуждается возможность раннего превентивного назначения антибактериальной терапии пациентам с острым ИИ с высоким риском воспалительных осложнений [24, 25]. Учитывая многочисленные нежелательные побочные эффекты чрезмерно широкого применения антибиотиков, считаем более перспективным поиск ранних маркеров воспалительного процесса. В этой связи интерес вызывает оценка состава клеток белой крови в периферической крови в качестве надежного и недорогого диагностического теста [17]. Имеются данные об эффективности этого показателя как прогностического маркера исхода и ишемического, и геморрагического инсульта, что в определенной степени может отражать степень церебрального и внемозгового поражения [26].
ЗаключениеПолученные данные свидетельствуют о том, что развитие ИАП значительно осложняет течение острого периода ИИ, ассоциировано с более высокой летальностью и более выраженным неврологическим дефицитом на момент окончания стационарного периода лечения. Риск развития ИАП повышен у пациентов старшего возраста с нарушением глотания, страдающих сахарным диабетом. Вместе с тем в более позднем постинсультном периоде возможно достаточно полное восстановление нарушенных вследствие инсульта неврологических функций у пациентов, перенесших ИАП, при этом выраженность неврологического дефицита существенным образом не отличается от таковой у больных, не перенесших ИАП. Своевременная комплексная клиническая и лабораторно-инструментальная диагностика бронхолегочных осложнений способна обеспечить раннее выявление поражения нижних дыхательных путей, их своевременную профилактику, снижение риска развития пневмонии, проведение реабилитационных мероприятий в более полном объеме и тем самым улучшить ранние исходы ИИ.
Сведения об авторах:
Чипова Динара Туземовна — заведующая отделением общей неврологии ГБУЗ «ГКБ № 1»; 360000, Россия, г. Нальчик, ул. Головко, д. 7; ORCID iD 0000-0002-1641-3681.
Сантикова Лиана Владимировна — аспирант кафедры неврологии, психиатрии и наркологии Кабардино-Балкарского государственного университета им. Х.М. Бербекова; 360004, Россия, г. Нальчик, ул. Чернышевского, д. 173; ORCID iD 0000-0002-3361-6819.
Жемухов Аслан Черимович — аспирант кафедры неврологии, психиатрии и наркологии Кабардино-Балкарского государственного университета им. Х.М. Бербекова; 360004, Россия, г. Нальчик, ул. Чернышевского, д. 173; ORCID iD 0000-0002-8877-9965.
Контактная информация: Чипова Динара Туземовна, e-mail: [email protected]. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 03.09.2020, поступила после рецензирования 17.09.2020, принята в печать 01.10.2020.
About the authors:
Dinara T. Chipova — Head of the Department of General Neurology of City Clinical Hospital No. 1: 7, Golovko str., Nalchik, 360000, Russian Federation; ORCID iD 0000-0002-1641-3681.
Liana V. Santikova — post-graduate student of the Department of Neurology, Psychiatry and Narcology, Kabardino-Balkarian State University named after H.M. Berbekov; 173, Chernyshevskogo str., Nalchik, 360004, Russian Federation; ORCID iD 0000-0002-3361-6819.
Aslan Ch. Zhemukhov — post-graduate student of the Department of Neurology, Psychiatry and Narcology, Kabardino-Balkarian State University named after H.M. Berbekov; 173, Chernyshevskogo str., Nalchik, 360004, Russian Federation; ORCID iD 0000-0002-8877-9965.
Contact information: Dinara T. Chipova, e-mail: [email protected]. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 03.09.2020, revised 17.09.2020, accepted 01.10.2020.
.
границ | Острый ишемический инсульт и COVID-19: опыт Центра комплексного лечения инсульта на Среднем Западе США,
Введение
Вирус тяжелого острого респираторного дистресс-синдрома (SARS-CoV-2), вызывающий коронавирусное заболевание 2019 г. (COVID-19), был впервые обнаружен в Ухане, Китай, и с тех пор распространился по всему миру с угрожающей скоростью, затронув более 7 миллионов человек. по состоянию на 7 июня 2020 г. (1). Сообщалось о неврологических заболеваниях, включая инсульт (2, 3). Ишемический инсульт при COVID-19 был связан с плохими результатами, но данные в основном ограничены азиатским и белым населением.Данные о потенциальном повышенном риске инсульта при COVID-19 еще не поступали в расово разнообразных популяциях пациентов, таких как латиноамериканцы и афроамериканцы (4, 5).
В этой рукописи мы сообщаем клинические и лабораторные характеристики, а также результаты пациентов с COVID-19 и острым ишемическим инсультом (AIS), которые обратились в наш комплексный центр лечения инсульта в Чикаго, штат Иллинойс, в период с 1 марта 2020 года по 30 апреля 2020 года. Наш центр третичной медицинской помощи находился в эпицентре вспышки в Чикаго на Среднем Западе США и регулярно заботится о недостаточно обслуживаемых и разнообразных группах пациентов с низкой медицинской грамотностью.Чтобы подтвердить наши выводы, для дальнейшего определения механизмов инсульта и переменных исходов, мы сравнили нашу когорту с пациентами, перенесшими инсульт за тот же период времени в 2020 году, а также с исторической когортой из 2019 года.
Методы
Мы провели ретроспективный наблюдательный анализ медицинских карт всех пациентов, поступивших в Медицинский центр Университета Раш в Чикаго, Иллинойс, США, в период с 1 марта 2020 г. по 30 апреля 2020 г., с диагнозом AIS, подтвержденным на магнитно-резонансной томографии. (МРТ) или компьютерной томографии (КТ) и которые были положительными на COVID-19 с помощью анализа полимеразной цепной реакции с обратной транскриптазой в реальном времени из мазка из носоглотки.Чтобы компенсировать любые сезонные или ежемесячные колебания заболеваемости и смертности от AIS, мы сравнили когорту с контрольной группой пациентов с AIS без COVID-19, госпитализированных в согласованные сроки в 2020 году. Мы также сравнили с исторической когортой с 2019 по контроль любых изменений в популяции пациентов с течением времени. Две разные когорты использовались в качестве контроля, чтобы избежать случайных демографических различий между эпохой до COVID и эпохой COVID.
Демографические, клинические и лабораторные данные были собраны посредством анализа системы электронных медицинских карт.К ним относятся возраст, пол, этническая принадлежность, ранее существовавшие факторы риска сосудов, показатели жизненно важных функций при поступлении, лабораторные показатели и оценка по шкале инсульта Национального института здоровья (NIHSS) при поступлении и при выписке (или во время сбора данных для пациентов, все еще госпитализированных. ). Мы разделили пациентов с COVID-19 AIS на группу «COVID», определенную как пациенты, поступившие первоначально с симптомами COVID-19, а затем с последующим развитием AIS, и группу «нейро», с пациентами, поступившими на AIS в качестве начальных симптомов, и дали положительный результат. на COVID-19.Группа «COVID» прошла более обширное обследование воспалительных заболеваний и коагулопатии. Всем пациентам была оказана помощь в остром периоде инсульта в соответствии с рекомендациями Американской кардиологической ассоциации и Американской ассоциации по инсульту (6).
Мы использовали классификацию (TOAST) для определения этиологии инсульта (7). Все пациенты с AIS прошли тщательное обследование, включая расширенную визуализацию сердца, панель гиперкоагуляции и продолжительный мониторинг сердца во время госпитализации. Мы дополнительно оценили пациентов с криптогенным инсультом для выявления эмболического инсульта неизвестной этиологии (ESUS) в соответствии с опубликованными критериями (8).Пациенты с потенциальными механизмами инсульта, которые, как предполагается, были вызваны состоянием гиперкоагуляции из-за COVID-19, были помещены под криптогенные механизмы и / или ESUS.
Оценка результатов основывалась на распределении выписок и модифицированной шкале Рэнкина (mRS) (9). Тяжесть COVID-19 определялась как легкая, регулярная или тяжелая / критическая на основе 7-го издания «Плана диагностики и лечения новой коронавирусной пневмонии» со следующим описанием: легкая, определяется как незначительные клинические симптомы и отсутствие воспаления легких на визуализация; регулярный, с лихорадкой и симптомами со стороны дыхательных путей и очевидным воспалением легких на изображениях; тяжелая, с одышкой, RR более 30 вдохов в минуту или SpO2 <93% в состоянии покоя по данным пульсоксиметрии; и критические, с необходимостью искусственной вентиляции легких или наличием шока или сочетанной недостаточности других органов, требующих наблюдения в отделении интенсивной терапии (10).
Статистическое тестирование использовалось для выявления межгрупповых различий и ассоциации отдельных переменных с заранее выбранными исходами. Когортные группы сравнивали с использованием критерия Стьюдента t для параметрических непрерывных переменных, U-критерия Манна-Уитни для непараметрических непрерывных переменных и точного критерия Фишера для дихотомических переменных. Логистическая регрессия использовалась для анализа выбранных переменных (клинически значимых или имеющих статистическую связь в первом анализе) в отношении предварительно выбранных измерений результатов с корректировкой на смешивающие факторы.Все анализы были выполнены с использованием коммерчески доступного статистического программного обеспечения SPSS (v. 21, Chicago IL, USA). Значимость была установлена на уровне p <0,05. Данные были собраны с помощью REDCap, инструмента электронного сбора данных, размещенного в нашем учреждении (11). Этот протокол исследования был одобрен наблюдательным советом университета Раша.
Результаты
Демографические и клинические характеристики
В период с 1 марта 2020 г. по 30 апреля 2020 г. ~ 650 пациентов были госпитализированы с COVID-19, из которых 13 пациентов имели AIS (оценочный процент 2.0%). Когорта COVID-19 AIS в основном состояла из латиноамериканцев (46,1%) и афроамериканцев (30,7%) в возрасте от 31 до 80 лет (в среднем 61,6 года). В группе «COVID» было 6 пациентов (47%) и 7 в группе «Neuro» (53%). Среднее время диагностики ИИС в группе «COVID» после госпитализации составило 7,1 ± 5,1 дня. Обычные факторы риска сосудистых заболеваний были общими в обеих группах без особой склонности ни к группе «COVID», ни к группе «Neuro». Тремя наиболее частыми факторами риска в когорте COVID-19 AIS была артериальная гипертензия (69.2%), сахарный диабет 2 типа (СД) (69,2%) и гиперлипидемия (30,7%). COVID-19 считался тяжелым или критическим у 61,5% ( n = 8), разделенных между группами «COVID» (50%) и «Neuro» (71,4%), и легким и / или обычным — у 38,5% ( n = 5) пациентов. Из 13 пациентов 30,7% ( n = 4) также имели наложенную бактериальную инфекцию. Медиана госпитализации по NIHSS составила 16 (IQR 4–23) у всех пациентов с COVID-AIS, с более высоким показателем 13 в группе «Neuro» по сравнению с 4.5 в группе «COVID» (таблица 1).
Таблица 1 . Демографические и клинические особенности 13 последовательных пациентов с острым ишемическим инсультом с инфекцией COVID-19.
Лабораторные характеристики
Начальные жизненно важные и лабораторные показатели подробно представлены в таблице 2. Средняя температура составила 99,6 ± 1,8 градуса F, среднее артериальное давление — 82,6 ± 38,7 мм рт. Ст., Частота сердечных сокращений — 90,6 ± 29,4 ударов в минуту, частота дыхания — 22 ± 8 вдохов в минуту. минуту, а сатурация кислорода составила 93.3 ± 7,8%. Пациенты в группе «COVID» чаще имели полиорганную недостаточность и повышенные маркеры воспаления и коагулопатии (таблица 2).
Таблица 2 . Показатели жизненно важных показателей при поступлении и лабораторные показатели при поступлении пациентов с острым ишемическим инсультом с COVID-19.
Показатели результата
Ишемические инсульты были преимущественно кортикальными (84,6%), в распределении средней мозговой артерии (76,9%), за которой следовала задняя мозговая артерия (23%). Этиология инсульта была классифицирована как криптогенная и / или ESUS у 53 пациентов.8% ( n = 7), кардиоэмболия у 23% ( n = 3), атеросклероз крупных артерий у 15,3% (n = 2) и поражение мелких сосудов у 7% ( n = 1). ESUS подозревался у 71,4% пациентов «Neuro» по сравнению с 33,3% пациентов «COVID». В целом, 60% ( n = 3) пациентов с признаками окклюзии крупных сосудов (LVO) перенесли эндоваскулярную тромбэктомию. В то время как в группе «COVID» было больше LVO (50%), большему количеству пациентов в группе «Neuro» (42,8 против 16,6%) были проведены вмешательства по поводу острого инсульта, при этом задержки в выявлении симптомов AIS в группе «COVID» объяснялись маскировкой. симптомов системными проявлениями COVID-19.Терапевтическая антикоагуляция была начата у 38,4% ( n = 5) пациентов из-за опасений гиперкоагуляции и у 7% ( n = 1) из-за фибрилляции предсердий. Медиана NIHSS при выписке для когорты COVID AIS составляла 11 (IQR 4–23), при медиане mRS 4 (IQR 3–4). Благоприятный исход с выпиской на дом или в отделения неотложной реабилитации был отмечен у 61,5% ( n = 3), у двух пациентов (15,3%) умерли осложнения COVID-19, а двум (15,3%) потребовался долгосрочное лечение в учреждении.Один пациент остается госпитализированным (таблица 1).
Одномерный и логистический регрессионный анализ
За исключением СД 2 типа, который был более распространен в группе AIS с COVID-19 (64,2 против 24,5%, p 0,008), пациенты в целом были одинаково сбалансированы по возрасту, полу и сопутствующим заболеваниям с когортами инсульта без COVID с 2019 г. и 2020. В группе AIS COVID-19 было больше латиноамериканцев по сравнению с прошлыми когортами 2019 и 2020 (46,1 против 9%, p 0,0036 и 46,1 против 9,5%, p 0.0075). Процент афроамериканцев во всех группах был одинаковым (31% против 32%, p 0,989 и 31 против 36%, p 0,766). В то время как среднее значение NIHSS при поступлении не различается среди пациентов с COVID-19 AIS и пациентов с инсультом без COVID-19 в 2020 и 2019 годах, NIHSS при выписке был значительно выше [11 (IQR 4–23) по сравнению с 3 (IQR 2–13). ), p 0,036 и 11 (IQR 4–23) против 4 (IQR 1–11), p 0,042]. Наблюдалась тенденция к меньшему введению альтеплазы пациентам с COVID-19 AIS, хотя и не было статистически значимым (7.1 против 20,7%, p 0,435 и 7,1 против 27,2%, p 0,178). Когорта COVID-19 AIS имела худший показатель mRS> 2 при выписке (78,5 против 47,16%, p 0,047 и 78,5 против 40,9%, p 0,010) (Таблица 3), даже после поправки на возраст и пол в логистике. регрессионная модель [ p 0,046, OR 3,82, (CI 1,02–14,3)].
Таблица 3 . Сравнение пациентов с острым ишемическим инсультом с инфекцией COVID-19 и пациентов с острым ишемическим инсультом без инфекции COVID-19, поступивших в те же сроки с 1 марта 2020 г. по 30 апреля 2020 г. и с 1 марта 2019 г. по 30 апреля 2019 г.
Обсуждение
В этом одноцентровом ретроспективном наблюдательном исследовании мы идентифицировали 13 пациентов с AIS и сопутствующим COVID-19. Приблизительно у 2,0% всех пациентов с COVID-19 в нашем учреждении был диагностирован AIS, что на процент выше, чем ранее сообщалось в литературе из США (12), но аналогично таковому из Ухани, Китай (5). Средний возраст пациентов с AIS и COVID-19 составлял 61,6 лет, без значительной половой принадлежности. В отличие от данных, поступающих из Нью-Йорка (12), в нашей когорте был более высокий процент латиноамериканцев и афроамериканцев (76.8%), подчеркивая расовое неравенство COVID-19 в нашем столичном городе. Несколько исследований выявили непропорционально тяжелое бремя этой болезни для этих сообществ. Социальное и экономическое неравенство, ограниченный доступ к здравоохранению наряду с генетическими факторами, связанными с более сильным тромбовоспалительным ответом, могли способствовать более высокому уровню инфицирования и худшему исходу у латиноамериканцев и афроамериканцев (13, 14). У большинства наших пациентов была тяжелая или критическая форма COVID-19, что повторяет ранее опубликованные данные о высокой распространенности неврологических осложнений, наблюдаемых в этой группе (2).Кроме того, тенденция к кортикальным инсультам с этиологической классификацией как ESUS отражает коагулопатию и потенциальную причинную связь между COVID-19 и инсультом (12).
Задержка в традиционных вмешательствах при инсульте, особенно среди пациентов, у которых развился AIS, во время лечения от COVID-19, может быть объяснена маскировкой симптомов острого инсульта вирусным заболеванием, задержкой распознавания симптомов инсульта и / или использованием антикоагулянтов в то время. оценки.
Несколько потенциальных механизмов могут привести к инсульту на фоне COVID-19.Ангиотензин-превращающий фермент, который является мишенью для SARS-CoV2, экспрессируется клетками нервной системы. Это подвергает мозг риску прямой инфекции эндотелиальных клеток и диффузного эндотелиального воспаления (15). Коагулопатия, связанная с COVID, которая, вероятно, является результатом интенсивной воспалительной реакции, может привести к увеличению тромботических осложнений, включая ишемический инсульт (16). Поражение сердца также является характерной особенностью COVID-19, приводя к стрессовой кардиомиопатии, прямому повреждению миокарда и аритмиям с потенциально повышенным риском ишемического инсульта (17).Наконец, длительная госпитализация и дизавтономия могут привести к ишемическому инсульту, особенно на фоне септического шока и гипотонии (18).
Сильные стороны и ограничения
В нашем исследовании дается подробное описание пациентов с COVID-19 и AIS, а также подчеркиваются расовые различия и неблагоприятные исходы, связанные с этой очень заразной вирусной инфекцией. Это исследование также подчеркивает, что, несмотря на то, что COVID-19 сильнее влияет на пожилых пациентов, повышенный риск AIS при COVID-19 не зависит от возраста.Сравнение с текущими и историческими когортами предполагает прямую причинную связь COVID-19 и AIS, подчеркивая важность проверки на COVID-19 у пациентов с ESUS и / или криптогенными механизмами инсульта.
Наше исследование имеет несколько ограничений, связанных с его небольшим размером, ретроспективным подходом и отсутствием долгосрочного наблюдения и результатов. Мы также подозреваем, что частота AIS намного выше, поскольку многие пациенты с инфекцией могли умереть от болезни до выявления симптомов инсульта или, возможно, не были оценены неврологической службой, и, следовательно, неврологические симптомы могли не быть захвачен.
Заключение
Таким образом, ишемический инсульт при COVID-19- имеет тенденцию быть более тяжелым, в основном кортикальным, может возникать независимо от общих сосудистых факторов риска, не имеет склонности к половому признаку и может поражать также более молодое население. AIS при COVID-19 чаще наблюдалась нашей группой в латиноамериканских и афроамериканских сообществах, что является отражением неравенства в сфере здравоохранения и ограниченного доступа к медицинской помощи среди населения меньшинств.
Заявление о доступности данных
Необработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без излишних оговорок.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены институциональным наблюдательным советом Университета Раша. Письменное информированное согласие на участие не требовалось для этого исследования в соответствии с национальным законодательством и институциональными требованиями.
Авторские взносы
PG и PP в равной степени внесли свой вклад в качестве первых авторов в сбор данных, интерпретацию данных и написание рукописей. ID и JC в равной степени внесли свой вклад как последние авторы в интерпретации данных и критическом пересмотре рукописи с точки зрения интеллектуального содержания.JH, RD, TT, DP, RG, NO, AV и SJ внесли свой вклад в разработку и сбор данных. Все авторы несут полную ответственность за достоверность данных и результатов рукописи.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить наших координаторов данных, Анджали Астхана MPH, MS, Келси Феган BS, Викрама Пателя MSN, RN.
Сокращения
SARS-CoV-2, вирус тяжелого острого респираторного дистресс-синдрома; COVID-19, коронавирусная болезнь 19; NIHSS, Шкала инсульта Национального института здоровья.
Список литературы
1. Чжу Н., Чжан Д., Ван В., Ли Х, Ян Б., Сун Дж. И др. Новый коронавирус от пациентов с пневмонией в Китае, 2019 г. N Engl J Med. (2020) 382: 727–33. DOI: 10.1056 / NEJMoa2001017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Мао Л., Цзинь Х., Ван М., Ху И, Чен С., Хе Ц. и др. Неврологические проявления госпитализированных пациентов с коронавирусной болезнью 2019 г. в Ухане, Китай. JAMA Neurol . (2020) 77: 1–9. DOI: 10.1001 / jamaneurol.2020.1127
PubMed Аннотация | CrossRef Полный текст
3. Хелмс Дж., Кремер С., Мерджи Х., Клер-Джель Р., Шенк М., Куммерлен С. и др. Неврологические особенности при тяжелой инфекции sars-cov-2. N Engl J Med . (2020) 382: 2268–70. DOI: 10.1056 / NEJMc2008597
CrossRef Полный текст | Google Scholar
4.Escalard S, Maïer B, Redjem H, Delvoye F, Hébert S, Smajda S и др. Лечение острого ишемического инсульта из-за окклюзии крупных сосудов с помощью covid-19: опыт парижа. Инсульт. (2020) 51: 2540–3. DOI: 10.1161 / STROKEAHA.120.030574
PubMed Аннотация | CrossRef Полный текст
5. Цинь Ц., Чжоу Л., Ху З., Ян С., Чжан С., Чен М. и др. Клинические характеристики и исходы пациентов с covid-19 с инсультом в анамнезе в Ухане, Китай. Инсульт. (2020) 51: 2219–23.DOI: 10.1161 / STROKEAHA.120.030365
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Пауэрс В.Дж., Рабинштейн А.А., Акерсон Т., Адеойе О.М., Бамбакидис Н.К., Беккер К. и др. Рекомендации по раннему ведению пациентов с острым ишемическим инсультом: обновление 2019 г. до рекомендаций 2018 г. по раннему ведению острого ишемического инсульта: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации по инсульту. Инсульт. (2019) 50: e344–418.DOI: 10.1161 / STR.0000000000000211
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Адамс Х.П., Бендиксен Б.Х., Каппелле Л.Дж., Биллер Дж., Лав Б.Б., Гордон Д.Л. и др. Классификация подтипа острого ишемического инсульта. Определения для использования в многоцелевом клиническом исследовании. Тост. Испытание org 10172 в лечении острого инсульта. Инсульт. (1993) 24: 35–41. DOI: 10.1161 / 01.STR.24.1.35
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Hart RG, Diener HC, Coutts SB, Easton JD, Granger CB, O’Donnell MJ и др. Эмболические инсульты неустановленного источника: случай новой клинической конструкции. Lancet Neurol. (2014) 13: 429–38. DOI: 10.1016 / S1474-4422 (13) 70310-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Харрис П.А., Тейлор Р., Тилке Р., Пейн Дж., Гонсалес Н., Конде Дж. Электронный сбор исследовательских данных (redcap) — основанная на метаданных методология и рабочий процесс для обеспечения поддержки переводческих исследований в области информатики. Дж Биомед Информ. (2009) 42: 377–81 DOI: 10.1016 / j.jbi.2008.08.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Яги С., Исида К., Торрес Дж., Мак Грори Б., Раз Э., Хумберт К. и др. Sars2-cov-2 и инсульт в системе здравоохранения Нью-Йорка. Инсульт. (2020). 51: 2002–11. DOI: 10.1161 / STROKEAHA.120.030335
CrossRef Полный текст
14. Вепа А., Бэ Дж. П., Ахмед Ф, Парик М., Кхунти К. COVID-19 и этническая принадлежность: новая патофизиологическая роль воспаления. Синдр диабета . (2020) 14: 1043–51. DOI: 10.1016 / j.dsx.2020.06.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Варга З., Фламмер А.Дж., Штайгер П., Хаберекер М., Андерматт Р., Зинкернагель А.С. и др. Инфекция эндотелиальных клеток и эндотелиит при covid-19. Ланцет. (2020) 395: 1417–8 DOI: 10.1016 / S0140-6736 (20) 30937-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Ромеро-Санчес CM, Диас-Марото I, Фернандес-Диас Э., Санчес-Ларсен Б, Лайос-Ромеро А, Гарсия-Гарсия Дж и др.Неврологические проявления у госпитализированных пациентов с covid-19: регистр альбаковидов. Неврология . (2020). DOI: 10.1212 / WNL.0000000000009937
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Характеристики острого ишемического инсульта у госпитализированных пациентов в Тибете: ретроспективное сравнительное исследование | BMC Neurology
Факторы риска для пациентов
Пекин и Тибет возвышаются на 40 м и 3650 м над уровнем моря соответственно.Были выбраны две из лучших больниц Пекина и Тибета, PUFH и PHOTAR, соответственно, которые представляют медицинские учреждения высшего уровня. В PHOTAR, хотя средний возраст начала AIS был примерно на 4 года старше, чем 10 лет назад, он все еще был на 7 лет раньше, чем у пациентов с PUFH [6]. Как предполагается в настоящем исследовании, это различие может быть связано с независимыми факторами риска, эритроцитозом и гипергомоцистеинемией, причем первое могло быть результатом большой высоты и хронической аноксии, а второе — употребления большого количества животного белка в рационе.Точно так же эритроцитоз также был потенциальным фактором риска высокой частоты инсульта у молодых взрослых пациентов с PHOTAR, но, поскольку он не был обнаружен у пациентов с PUFH, точный количественный анализ не проводился. Кроме того, тот факт, что артериальная гипертензия, СД, гиперлипидемия, инсульт в анамнезе и тяжесть атеросклероза сонной артерии были значительно реже у пациентов с PHOTAR по сравнению с пациентами с PUFH, может частично компенсировать разницу из-за влияния эритроцитоза между двумя больницами.Более того, более низкий средний возраст в Тибете можно объяснить предположением, что молодые пациенты в Тибете с большей вероятностью обращались за медицинской помощью, чем пожилые пациенты, из-за лучших финансовых возможностей и образования [12]. Следовательно, в будущем потребуется провести хорошо контролируемое проспективное когортное исследование, чтобы лучше изучить инсульт у молодых взрослых и роль эритроцитоза в тибетской популяции. В обеих группах пациентов непропорционально большое количество мужчин было также выше, чем среднее соотношение мужчин и женщин в соответствующей общей популяции.Это может быть связано с региональным образом жизни и диетическими привычками, поскольку в обоих случаях не было описано значительных различий по признаку пола [4, 7, 13, 14].
Внутривенный тромболизис
В то время как 17,1% и 9,7% пациентов поступили на PUFH и PHOTAR, соответственно, в рамках IVTWT, только 5,2% и 0,4% пациентов получили IVT. По сравнению с пациентами PHOTAR, пациенты с PUFH продемонстрировали лучшую реализацию AIS и большее желание проконсультироваться с врачами. Фактически, исследование 1,11 миллиона госпитализированных случаев AIS в Германии ранее показало, что частота IVT составляет 15.9% [15]. В дополнение к отсутствию надлежащего образования, связанного с AIS, низкий доступ к тромболизису был в первую очередь из-за экономического бремени, которое было более тяжелым в Тибете, который относительно недостаточно развит. Тромботические подходы, используемые в двух больницах, также показали скрытые различия. В PHOTAR урокиназа, по-видимому, имела более высокий коэффициент использования из-за более широкого временного окна и более низкой цены. Из-за небольшого количества пациентов с тромболизисом в PHOTAR, это различие следует учитывать.
Распределение подтипов инсульта и локализация инфаркта
Большинство случаев АИС вызваны тромбозом или тромбоэмболией. Классификация TOAST и классификация OCSP были созданы для лучшей оценки AIS на основе ее механизма и местоположения. Подтип LAAS по классификации TOAST был несколько более распространен среди пациентов с PHOTAR; Факторы риска атеросклероза и результаты состояния сонной артерии у таких пациентов были менее тяжелыми, чем у пациентов с PUFH. Аналогичным образом, согласно классификации OSCP, подтипы TACI и PACI были значительно более распространены у пациентов с PHOTAR, в то время как подтипы LACI значительно чаще встречались у пациентов с PUFH.Эритроцитоз мог способствовать тенденции к переднему кровообращению у пациентов с PHOTAR, как было ранее продемонстрировано в серии исследований [16,17,18,19,20,21,22,23]. Здесь лежащий в основе механизм может быть связан с вязкостью и гематокритом, которые не имеют линейного характера, а скорее имеют теоретический «пороговый эффект» [21]. В этом состоянии небольшое увеличение выше порога гематокрита может вызвать огромное изменение вязкости и привести к дальнейшему нарушению кровотока, что в конечном итоге приведет к ишемическим событиям [19, 21, 24].Из-за сложного переднего мозгового кровообращения с многоэтапной системой ветвления чаще могут отмечаться инфаркт мозга переднего кровообращения и инфаркт водораздела [19, 20]. Любые изменения емкости крови могут изменить гематокрит и вызвать ишемический инсульт. Несмотря на то, что состояние сосудов было менее тяжелым при атеросклерозе сонной артерии, подтип LAAS составлял сравнительно большую долю AIS у пациентов PHOTAR. Чтобы установить общий профиль состояния сосудов, особенно внутричерепных артерий, необходимы дополнительные исследования.В будущих исследованиях следует выяснить, влияют ли и как на этот процесс хронические структурные и функциональные изменения в мозговой ткани в результате аноксии в высокогорных районах. Также возможно, что высокий гематокрит связан с повышенным риском АИС. Однако проспективное европейское исследование 1638 пациентов с полицитемией с гематокритом 0,472 ± 0,063 л / л ранее не показало какой-либо взаимосвязи между повышением гематокрита и тромботическими явлениями и выступило за агрессивный контроль этих параметров у пациентов с эритроцитозом [25].Другое ретроспективное исследование показало, что повышенный HGB при первичной госпитализации может быть связан с более тяжелым инсультом, большей инвалидностью при выписке и более высокими показателями 30-дневной смертности после AIS, в то время как более низкий HGB может указывать на длительное пребывание в больнице неотложной помощи [18]. Чтобы улучшить профилактику AIS, будущие исследования должны быть нацелены на установление критического порогового значения HGB или гематокрита у пациентов с полицитемией и выяснение рисков и лежащих в основе патологии высоких уровней HGB и гематокрита у пациентов с инсультом, которые находятся на большой высоте, но не соответствуют требованиям критерии эритроцитоза.
Лечение
На этапе госпитализации пациентам с PUFH чаще назначали антитромбоцитарную терапию, чем пациентам PHOTAR. Действительно, высокая частота назначения антигипертензивных, противодиабетических и антигиперлипидемических препаратов пациентам с PUFH отражает высокую распространенность этих заболеваний. Различия в использовании препаратов, снижающих ВЧД, и антикоагулянтов могут быть связаны с разными патогенами АИС. У пациентов PHOTAR AIS, вероятно, был связан с гемодинамическими изменениями, затронул большую область и имел тенденцию вызывать отек, в то время как в группе PUFH AIS, вероятно, был связан с атеросклерозом и тромбозом, у которых у пациентов был более прогрессирующий инсульт [26].
Ограничения
Во-первых, информация, касающаяся тяжести и прогноза, такая как шкала инсульта Национального института здравоохранения, модифицированная шкала Рэнкина, или летальность заболевания не оценивалась, и это могло привести к неадекватному пониманию этих двух групп. . Во-вторых, наше исследование было основано только на госпитализированных пациентах. Поскольку некоторые пациенты с инсультом, проходящие лечение в отделениях неотложной помощи, могли не быть госпитализированы, это могло способствовать систематической ошибке оценки AIS.В-третьих, даже несмотря на то, что обе когорты из двух больниц содержали более 200 случаев, размер когорт был разным, что может способствовать систематической ошибке, и поэтому результаты этого исследования следует интерпретировать с осторожностью. В-четвертых, отсутствовали данные о хирургических операциях, таких как тромбэктомия, что может привести к неадекватной оценке двух групп. Наконец, в это исследование не были включены другие факторы, такие как соблюдение режима лечения, интенсивность работы, эмоциональный статус и продолжительность сна, что также могло привести к неадекватной оценке двух групп.Тем не менее, насколько нам известно, это первое сравнительное исследование на базе больниц, описывающее АИС в Тибете.
Ишемический инсульт — AMBOSS
Резюме
Ишемический инсульт — это острое неврологическое состояние, вызванное нарушением мозгового кровотока (например, окклюзией сосудов или системной гипоперфузией). Хроническая системная гипертензия и сердечно-сосудистые заболевания являются наиболее важными факторами риска. Клинически ишемический инсульт характеризуется острым началом очаговых неврологических нарушений, которые зависят от территории головного мозга, покрытой соответствующим сосудом.Необходимо немедленно выполнить КТ головы без контрастирования, чтобы исключить внутричерепное кровоизлияние. Реваскуляризация сосудов, пораженных ишемическим инсультом, например, с помощью тканевого активатора плазминогена (tPA) или тромбэктомии, жизненно важна для сохранения ткани мозга. Вторичная профилактика направлена на управление изменяемыми факторами риска (например, гипертонией, атеросклерозом).
Для получения дополнительной информации см. Также временную ишемическую атаку, обзор инсульта, внутримозгового кровоизлияния и субарахноидального кровоизлияния.
Определение
Ссылки: [2] [3] [4]
Эпидемиология
Как для ишемического, так и для геморрагического инсультов возраст является наиболее важным немодифицируемым фактором риска, а артериальная гипертензия — наиболее важным изменяемым фактором риска!
Каталожные номера: [5] [6] [7]
Эпидемиологические данные относятся к США, если не указано иное.
Этиология
Ссылки: [6] [8] [9] [10] [11] [12] [13] [14] [15] ]
Дифференциальный диагноз
Перечисленные здесь дифференциальные диагнозы не являются исчерпывающими.
Клинические признаки
Подтипы и варианты
Лакунарный инфаркт
[11] [16]Инфаркт задней конечности внутренней капсулы является наиболее распространенным типом лакунарного инсульта и может клинически проявляться чисто моторным инсультом , чисто сенсорный инсульт (редко), сенсомоторный инсульт, синдром дизартрии и неуклюжей руки и / или атаксический гемипарез.
Инфаркт водораздела
[6] [17]- Определение: пограничный инфаркт в области между территорией двух крупных артерий, кровоснабжающих головной мозг (водораздел).
- Этиология: внезапное снижение артериального давления или прекращение кровотока по обоим сосудам → ишемия в чувствительной области между двумя сосудистыми территориями
- Клинические особенности
Патология
Инфаркт мозговой ткани обычно сопровождается разжижающим некрозом, в отличие от коагуляционного некроза, наблюдаемого после инфаркта в других органах.
Избирательный некроз нейронов
- Определение: избирательное разрушение нервных клеток с сохранением глиальных клеток.
- Механизм
- Гистология: нейрональный некроз с жизнеспособными глиальными клетками (которые могут пролиферировать и вызывать ламинарную или псевдоламинарную архитектуру ткани)
Паннекроз
- Определение: гибель всех типов клеток в данной области мозга, включая нейроны, глиальные клетки и сосудистые клетки
- Механизм: перманентная ишемия.
- Гистология: кистозные поражения и потеря структуры ткани
Гистологические изменения в области инфаркта
[18] [19]Каталожные номера: [18] [19]
Диагностика
Первичная оценка
- Определение времени появления симптомов: Время начала инсульта используется для определения вариантов лечения (тромболитическая терапия).
- При необходимости стабилизируйте пациента.
- Проверьте уровень глюкозы в сыворотке.
- Экстренная визуализация
Визуализация
- Немедленная неконтрастная КТ головы для оценки острого кровотечения перед проведением тромболитической терапии
- Дальнейший выбор изображения зависит от результатов компьютерной томографии головы.
- Диффузионно-взвешенная МРТ — более чувствительный тест на острую ишемию (например, если КТ головы отрицательна, но клиническое подозрение на острый инсульт велико).
- Нейроваскулярные исследования (например, КТА или МРА) для более точной идентификации закупоренного сосуда
Решение о получении дополнительных изображений не должно откладывать назначение тромболитической терапии подходящим кандидатам!
Неконтрастный CT
- Ишемические изменения могут быть обнаружены примерно через 6 часов после начала инсульта.
- Выводы
- Острая (в течение 12 часов с момента появления симптомов)
- Гиперплотные закупоренные сосуды (e.g., гиперплотный признак СМА, соответствующий острой тромбоэмболической окклюзии СМА)
- Гиподенсная паренхима
- Сглаживание борозд и потеря кортикомедуллярной дифференцировки
- 12–24 часа после появления симптома: гиподенсный
- Через 24 часа после появления симптома: гиперплотный
- Острая (в течение 12 часов с момента появления симптомов)
Взвешенный по диффузии 20 MRI
90 Ишемические изменения можно обнаружить примерно через 3 минуты после начала инсульта, но выполнение МРТ занимает больше времени.Нейроваскулярные исследования
- КТ-ангиография (КТА)
- Позволяет идентифицировать точное местоположение дефекта (в большинстве случаев)
- Показания
- Когда есть высокий индекс подозрения на инсульт, но на неконтрастных КТ или МРТ ишемических изменений не обнаружено.
- Если пациент не может получить tPA (например, вне временного окна), но может быть кандидатом на механическую тромбэктомию (см. «Лечение» ниже).
- МРТ-ангиография (МРА): показания аналогичны КТА
Лабораторная оценка
[20]- Первоначальная оценка: уровень глюкозы в сыворотке
- Последующие лабораторные анализы, которые необходимо рассмотреть (после завершения неотложной визуализации)
- Обследование с применением гиперкоагуляции: подумайте, если пациент старый и / или имеет в анамнезе тромбозы
Немедленное визуализацию или введение tPA при ишемическом инсульте не следует откладывать для получения лабораторных исследований!
Дополнительная диагностическая работа
Дополнительную информацию о диагностике других типов инсульта см. В разделе «Диагностика инсульта».
Каталожные номера: [13] [15] [20] [21]
Лечение
Реперфузионная терапия
- Цель — предотвратить дальнейшую ишемию тканей и необратимый инфаркт
- Следует назначать подходящим кандидатам как можно скорее (конкретные показания см. Ниже)
Реперфузионную терапию нельзя откладывать — «время — мозг»! Однако внутричерепное кровоизлияние является противопоказанием для реперфузионной терапии и должно быть исключено в первую очередь.
Внутривенная тромболитическая терапия
[20]- Определение: введение внутривенного рекомбинантного tPA (например, альтеплазы; тенектеплазы) для разрушения тромбов
- Показания
- Осложнения
- Кровотечение
- Внутричерепное и экстракраниальное кровоизлияние
- Ангионевротический отек
- Критерии исключения
- Текущие условия
- Ранее существовавшие условия
Внутриартериальный тромболизис
[20]- Определение: внутриартериальное (не внутривенное) введение тромболитического агента (например,g., проурокиназа)
- Показания: пациенты с инсультом MCA с появлением симптомов, которые не подходят для внутривенной тромболитической терапии.
Механическая тромбэктомия
[20]Управление артериальным давлением
[20]Поддерживающая терапия
Другое
Ссылки: [9] [10] [15] 20256 [15] 20256 [15] 20256 [22] [23] [24] [25] [26]
Контрольный список неотложной помощи
Осложнения
Мы перечисляем наиболее важные осложнения.Выбор не исчерпывающий.
Профилактика
Самым важным излечимым фактором риска вторичной профилактики инсульта является артериальная гипертензия! [12]
Каталожные номера: [12] [22] [28]
Доступ к пациенту с острым ишемическим инсультом
I. Цель данной группы
Эта глава написана для врачей, которые могут встретить пациентов с инсультом в неинсультных центрах. Он не является исчерпывающим руководством по ведению пациента с инсультом, а скорее предоставляет критические моменты, позволяющие быстро оказать пациенту с подозрением на острый ишемический инсульт наилучшую возможную помощь, даже если это означает перевод в учреждение более высокого уровня.
В то время как геморрагические инсульты являются важной подгруппой инсультов (15%), большинство таких пациентов должны лечиться экстренно нейро-реанимационным или нейрохирургическим специалистом, поэтому они выходят за рамки данной главы.
II. Распознавание инсульта и имитаторов инсульта
Шкала инсульта A. NIH (NIHSS)
Невозможно заменить нейроэкзамен. Необходимо ознакомиться с NIHSS и иметь хорошую практику (сертификат доступен бесплатно в Интернете), если есть вероятность, что вы столкнетесь с пациентами с острым инсультом.
NIHSS с оценкой от 0 до 42 баллов, по сути, представляет собой сокращенный нейроэкзамен, который можно пройти менее чем за 5 минут. Чем выше оценка, тем крупнее ход.
Оценка 8 или выше вызывает большее беспокойство при окклюзии крупных сосудов и должна быть принята с осторожностью при переводе в инсультный центр более высокого уровня, который имеет нейро-интервенционные возможности. См. ниже.
B. Острый очаг: внезапное начало, односторонние симптомы
Как правило, ключом к распознаванию инсульта является острая очаговая патология; Внезапно возникшие односторонние симптомы:
Обвисание лица
Односторонняя слабость (гемипарез)
Односторонняя атаксия конечностей (дисметрия / дискоординация)
Проблемы с речью (дизартрия или афазия)
Одностороннее онемение
Разрез поля зрения или принудительное отклонение глаза в одну сторону.
Любой один или несколько из этих симптомов должны вызвать у вас подозрение на инсульт. Если у вас есть пациент с общей слабостью, невнимательностью или низким уровнем сознания без очагов, это редко бывает острым ишемическим инсультом (хотя это могут быть большие, особенно срединные внутричерепные кровоизлияния). Если результаты вашей компьютерной томографии отрицательны на кровотечение, поищите в другом месте.
Примечание: афазия (неспособность выражать и / или понимать язык) у бодрствующего и внимательного человека считается очагом, потому что что-то воздействует на языковой центр, одновременно борясь со многими другими областями мозга.У кого-то только с невнятной речью (дизартрия) и с более низким уровнем сознания без фокальности, вероятно, есть процесс, который влияет на весь мозг, что указывает на инсульт.
Предупреждение: NIHSS ориентирован на удары по переднему кровообращению, то есть удары по средней мозговой артерии (СМА). Иногда пропускаются пациенты с такими признаками / симптомами заднего кровообращения, как:
Головокружение с непрекращающимся или изменяющим направление нистагмом
Проблемы с равновесием (атаксия походки)
Атаксия туловища или конечностей
Тошнота и рвота — (в сочетании с другими очаговыми признаками)
Будьте бдительны в этих случаях, особенно если вышеупомянутые симптомы возникли внезапно.
C. Имитаторы инсульта
Хотя существует множество имитаторов инсульта, лишь следующие из них являются общими и могут быть действительно важными:
Судороги (частичное начало)
Преобразование
Мигрень (комплексная)
Паралич Белла
Другие имитаторы, такие как энцефалопатия, сепсис и гипогликемия в целом, не вызывают очаговых симптомов, если уже не имеется основного поражения головного мозга или сосудов.
Однако будьте уверены, потому что даже если вы сделаете внутривенное введение tPA имитатора инсульта, который в остальном соответствует критериям tPA, риск кровотечений у этих пациентов приближается к 0%.
III. Неотложная помощь — * Всегда консультируйтесь с неврологом, если возможно *
Стабилизировать пациентов с нарушением гемодинамики
Быстро устраните гипоксию и гипогликемию, поскольку они затуманивают неврологическую картину
Лаборатории: CBC, CMP, PT / INR
Сделать ЭКГ / РКС (но не откладывать возможное лечение)
Статистическая КТ головы и, если есть, КТ-ангиограмма (КТА) сосудов головы и шеи
Если КТ головы положительна для острой крови, новообразования или нового крупного инсульта, обратитесь за консультацией к неврологу / нейрохирургу.
Если CTA положительный для окклюзии крупного сосуда, продолжите скрининг на соответствие tPA и получите неотложную неврологическую консультацию для переноса и возможной механической тромбэктомии. НЕ откладывайте tPA пациентам, которые соответствуют критериям.
IV. Стандарт лечения: внутривенное введение тканевого активатора плазминогена (tPA) и механическая тромбэктомия
A. Скорость имеет значение
Каждую минуту инсульта умирает в среднем два миллиона клеток мозга.Таким образом, ключом к эффективному лечению инсульта является скорость.
Несмотря на многочисленные опасения и догмы, внутривенное введение tPa является безопасным и эффективным средством лечения острого ишемического инсульта. Чем раньше он будет введен, тем лучше будет неврологический исход и ниже риск кровотечения. В целом, если дается <4,5 часов, у пациентов есть 30-40% шанс на почти полное неврологическое выздоровление по сравнению с 6% шансом кровотечения и 1% риском смерти.
Кроме того, если tPA вводится в первые 90 мин от начала инсульта, пациенту будет присвоено значение 2.6-кратная вероятность того, что результат будет хорошим, по сравнению с 1,3-кратной вероятностью, если результат будет получен через 4,5 часа.
B. Размер имеет значение
Чем крупнее закупоренный сосуд, тем меньше вероятность того, что он будет открыт только с помощью tPA.
Для филиала М2 коэффициент реканализации ТГК составляет 44%,
Для филиала М1 коэффициент реканализации ТГК составляет 30%,
Terminal ICA, tPA имеет коэффициент реканализации 6%.
При механической тромбэктомии с использованием стент-ретриверов частота реканализации составляет 70–90%.
Следовательно, подходящим пациентам с инсультом с окклюзией крупных сосудов должна быть выполнена механическая тромбэктомия в течение 7 часов с момента появления симптомов.
Пациенты, которые получают эту терапию, имеют более чем в 2 раза шанс почти полного неврологического выздоровления по сравнению с теми, кто этого не делает.
Примерно 30-55% пациентов, которым сделана в / в тромбэктомия, практически полностью выздоравливают.
C. Соответствие требованиям tPA — только абсолютные критерии
Возраст> 18 (без верхнего предела)
Подозрение на ишемический инсульт
Неврологические изменения по сравнению с «последней известной нормой» <4.5 часов
Для tPA начало инсульта (последнее известное нормальное время) должно было произойти менее чем через 4,5 часа после введения в соответствии с Американской кардиологической ассоциацией. Примечание: FDA одобрило его только на срок <3 часов, потому что они не включали данные европейских испытаний при вынесении этой рекомендации.
«Last Known Normal» — это последний раз, когда пациент был хорошо осмотрен. Если пациент проснулся в 7 часов утра с симптомами — это НЕ его последняя известная норма; обычно это время, когда они ложатся спать.
CT Head- «Чем чище, тем лучше»
Нормальная компьютерная томография подразумевает, что ишемического повреждения еще недостаточно, чтобы его можно было увидеть, и риск кровотечения при tPA ниже.Зачастую ишемическое изменение может быть обнаружено на КТ с радиологической задержкой до 6–12 часов, поэтому для пациента обычным (и обнадеживающим) является наличие большого числа инсультов при нормальной КТ.
CT должен быть отрицательным для:
Кровь любого возраста, в любом пространстве (например, эпидуральная / субдуральная / субарахноидальная / интрапаренхиматозная)
Образования: опухоль, метастаз, абсцесс, атриовентрикулярная мальформация
Недавний инсульт или раннее ишемическое изменение
Ранние ишемические изменения, видимые на КТ, указывают на то, что инфаркт уже далеко, и они представляют собой более высокий риск кровотечений с меньшей пользой.
При инсульте> 1/3 полушария головного мозга вам следует срочно обратиться за консультацией к неврологу / хирургу, так как при отеке и пике ВЧД (обычно через 72 часа) существует высокий риск образования грыжи.
Артериальное давление <185/110 до введения, затем <180/105 для поддержания
Диатез без кровотечения: тромбоциты> 100000, INR <1,7
Использование нового антикоагулянта <48 часов
В анамнезе не было серьезных травм головы, инсульта или нейрохирургии <90 дней
Нет Активное внутреннее кровотечение
Нет подозрений на эндокардит
Д.Введение IV tPA
1. Управление артериальным давлением
Крайне важно быть агрессивным в управлении АД, поскольку многие кровотечения из-за tPA возникают из-за неудач на этом этапе.
Цель <185/110 для инициации, а затем <180/105 после этого. * Избегайте падения САД <140 для большинства пациентов
PRN лабеталол 10-20 мг внутривенно или гидралазин 10-20 мг внутривенно первоначально, потому что они обычно легко доступны
Можно повторять дозы лабеталола каждые 10 мин до максимального значения 300 мг.
Капельницы с непрерывным титрованием (лабеталол или никардипин) на самом деле предпочтительнее, потому что они обеспечивают жесткий контроль без колебаний артериального давления.
Инициировать скорость подачи лабеталола по каплям 2-8 мг / мин ИЛИ
Инициировать скорость капельного введения никардапина на уровне 5 мг / час и титровать со скоростью 2,5 мг / час до желаемого диапазона
Имейте в виду, что саморегуляция сосудов головного мозга обычно значительно нарушается во время инсульта; Это означает, что большие изменения артериального давления часто могут быть более пагубными, чем очень высокие или низкие.
Мониторинг: каждые 15 минут в течение 2 часов, затем каждые 1 час в течение первых 24 часов после введения tPA.
2. Доза tPA
0,9 мг / кг, но не более 90 мг, 10% в виде болюса в течение 1 минуты
Оставшиеся 90% в виде постоянной инфузии в течение 1 часа (используйте инфузионный насос и не используйте предыдущий объем перед инфузией tPA)
E. Право на проведение механической тромбэктомии
С 2016 года нейротромбэктомия под контролем катетера с использованием устройств извлечения стента, таких как Trevo или Solitaire, стала стандартом лечения отдельных пациентов с внутричерепной окклюзией крупных сосудов.Несколько рандомизированных многоцентровых слепых исследований показали, что этот метод резко снижает заболеваемость и даже смертность у этих пациентов.
1. Шкала инсульта Оценка 8 должна усилить подозрение на окклюзию крупных сосудов. В таких ситуациях всегда необходимо получить раннюю консультацию невролога.
2. И пациенты, которые уже получили внутривенное введение tPA, и пациенты, у которых нет возможности (или исключены) по tPA, подходят для тромбэктомии IF:
CTA подтверждает окклюзию большого сосуда, что соответствует клиническим данным:
MCA: ответвления M1 или M2
ACA: A1 или A2
Базилар
Дистальная внутренняя сонная артерия
Время: Пункция паха должна быть осуществима <7 часов от начала инсульта.
Оценка ASPECT, полученная при КТ головы, должна быть не менее 6
ОценкаASPECT приблизительно соответствует раннему ишемическому изменению, которое можно увидеть на КТ, посмотрев на 10 конкретных областей территории СМА. Нормальная КТ начинается с 10 баллов (10 нормальных областей), более низкие баллы означают большую сердцевину инфаркта, поскольку поражено больше областей, и, следовательно, более высокий риск осложнений вмешательства.
Примечание: оценка ASPECT не является абсолютным критерием, так как на самом деле она предлагает значимую информацию только для мазков территории MCA, которые на самом деле являются большинством таких случаев.
3. У пациентов, готовящихся к тромбэктомии, необходимо строго контролировать АД.
4. Дальнейшее ведение таких пациентов выходит за рамки данной главы.
V. Управление после TPA в течение 24 часов
A. Поместитесь в кушетку интенсивной терапии или, как минимум, кушетку телеметрии со следующими рекомендациями: сохраняйте среду мозга как можно более питательной и здоровой, чтобы оптимизировать неврологическое восстановление. Каждый незначительный параметр сам по себе может показаться неважным или бессильным, но в совокупности они имеют огромное значение для восстановления.
1. Контроль артериального давления: каждые 15 минут в течение 2 часов, затем каждые 30 минут в течение 6 часов, затем каждый час в течение 18 часов, затем каждые 4 часа.
2. Vitals and Neurochecks: каждые 15 минут × 2 часа, затем каждые 30 минут × 6 часов, затем каждые 60 минут × 24 часа.
3. Неврологические изменения
Любые изменения в нейроэкзамене, усиление головной боли, снижение уровня сознания или повышение индекса NIHSS должны вызывать подозрение на внутричерепное кровоизлияние (ICH).
Особую тревогу вызывают баллы NIHSS, которые увеличиваются на 4 или более балла.
Если есть острые неврологические изменения:
Немедленно остановите tPA, если все еще работает
Получить статическую неконтрастную головку CT
Забор крови на PT, PTT, количество тромбоцитов и фибриноген
Если ICH выявлен при визуализации головного мозга:
10 единиц криопреципитата для повышения уровня фибриногена и фактора VIII
Дайте 6-8 единиц тромбоцитов
Консультация нейрохирургии
4. Управление температурой:
Важно поддерживать температуру пациента с неврологическим поражением в норме или немного ниже.
Более высокая температура является независимым маркером худших исходов при инсульте, включая смерть в первые 30 дней.
Более высокая температура увеличивает церебральную метаболическую потребность в геометрической прогрессии; для пациента, перенесшего инсульт, у которого изначально есть проблемы с питанием (закупорка кровеносных сосудов), это очень пагубно.
Для температур> 37,5 (цель 36-37 ° C)
Используйте PRN Тайленол 500 мг каждые 6 часов, затем, если необходимо,
Охлаждающие одеяла, I.е. арктическое солнце, бланкетрол или аналогичный блок
5. Контроль уровня глюкозы:
Следует строго контролировать режимы инсулина, основанные на весе. Плохой контроль также связан с худшими неврологическими исходами и более длительным пребыванием в больнице.
Рекомендуют инсулин 0,4 Ед / кг, особенно пациентам с уровнем глюкозы> 200.
50% инсулин длительного действия в ночное время,
Затем разделите оставшиеся 50% на три прандиальные дозы инсулина короткого действия.
Всегда иметь в наличии инсулин с корректирующей скользящей шкалой
6. Оцените ангионевротический отек каждые 20 мин × 4, начиная с инфузии tPA. Пациенты, принимающие ингибиторы АПФ, подвергаются наибольшему риску. Это может быть довольно опасно и требует незамедлительного и агрессивного лечения.
При подозрении на отек Квинке сразу:
Досрочное прекращение инфузии tPA (если все еще продолжается)
Бенадрил 50 мг внутривенно И
Внутривенно Ранитидин 50 мг Фамотидин 20 мг
Если увеличение продолжится, дайте Солумедрол 80-100 мг внутривенно
При дальнейшем усилении отека Квинке: Адреналин 0.1% 0,3 мл подкожно или через небулайзер 0,5 мл и позвоните в ЛОР или в анестезию для дальнейшего контроля проходимости дыхательных путей.
7. Изголовье кровати НЕ обязательно должно быть плоским, теперь это считается необязательным. Возможно, стоит избегать плоских кроватей у отдельных пациентов, т. Если есть стеноз высокой степени, можно предпочесть плоскую кровать, особенно если они позиционно симптоматичны.
8. Избегайте приема антикоагулянтов или антиагрегантов в течение 24 часов. Вместо этого следует использовать SCD.
9. По возможности избегайте введения постоянного катетера в мочевой пузырь, трубки NG или других инвазивных процедур в течение> 30 минут после введения tPA. В идеале должен быть завершен до начала.
10. Физиотерапия, логопедия, оценка трудотерапии
11. По возможности избегайте венепункции в несжимаемых участках в течение первых 24 часов. Если вам необходимо сделать центральную линию, избегайте подключичной линии. PICC или Internal Jugular были бы предпочтительнее.
12.Заказать КТ на 24 часа после tPA
B. Через 24 часа в реанимации
Выполните обычную 24-часовую КТ без контрастирования для оценки кровотечения.
Если CT отрицательный:
При наличии показаний начать антиагрегантный режим (часто двойная антитромбоцитарная терапия АСК / клопидогрель в течение 90 дней, а затем монотерапия — если антикоагулянты не требуются).
Старт химического ТГВ ppx: низкие дозы гепарина / эноксапарина.
Если пациент ранее получал антикоагулянтную терапию или показания к антикоагуляции уже обнаружены, начните ее.
Начните постепенно снижать АД на 10-20% в день до приемлемого диапазона. Начните прием пероральных лекарств от АД рано.
Начните прием статинов, если еще не принимаете их.
Ежедневная PT / OT / оценка речи и лечение в соответствии с рекомендациями.
Может потребоваться источник длительного кормления (например, зонд PEG), если исследования глотания не дали результатов — всегда рекомендуется раннее сотрудничество с речью / питанием.
Команды социальной работы и управления делами должны инициировать оценку для размещения.
C. Установление диагноза и этиологии инсульта — какие анализы следует заказывать?
К этому этапу госпитализации острота зрения пациента должна быть ниже (надеюсь), и вы должны попытаться выяснить причину инсульта. Диагностический подход должен включать оценку крови, головного мозга, сосудов и сердца. Этиология инсульта обычно классифицируется по:
Критерии TOAST:
Большой сосуд (например, стеноз сонной артерии или средней мозговой артерии, обычно в результате атеросклероза или расслоения)
Малое судно (т.е. лакунарные инфаркты и пациенты с множественными факторами риска, например, курильщики, АГ, СД, ДВУ — на МРТ описаны как «хронические изменения белого вещества»)
Кардиоэмболия / аортоэмболия (т. Е. Afib, CHF или аортальные бляшки)
Другое (гиперкоагулянты, серповидноклеточная форма, полицитемия, злокачественные новообразования)
Криптогенный или несколько причин
Оценка крови
Лаборатории должны быть получены для общего ведения, а также для выяснения факторов риска пациентов:
CBC, CMP, PT / INR
Панель липидов натощак
A1c
Trend тропонины PRN
Если пациент молодой или здоровый, следует рассмотреть гиперкоагуляцию и ревматологические панели.
Если есть опасения по поводу злокачественности, вызывающей гиперкоагуляцию, рассмотрите КТ грудной клетки таза с контрастом
Оценка сердца
Телемониторинг для оценки аритмий, таких как A-fib
Трансторакальная 2d эхокардиограмма для оценки тромба и общей функциональности сердца, то есть низкой EF или аномалий движения стенок, которые увеличивают риск тромба.
Примечание: если высокое подозрение на кардиоэмболический источник, сделайте чреспищеводную эхокардиограмму, чтобы лучше визуализировать левое предсердие и придаток.
Оценка кровеносных сосудов: аорты, сонных артерий, позвоночника и Виллисова круга.
Если призыв к действию головы и шеи уже был получен, этот шаг можно пропустить. В противном случае рекомендуется визуализация сосудов головы и шеи.
МРА головы и шеи, если возможно (с контрастированием, если возможно).
В зависимости от учреждения и пациента существуют преимущества CTA или MRA. Однако оба метода приемлемы и предлагают преимущество, заключающееся в возможности оценить дугу аорты на предмет заболевания (т.е. атерома).
Каротидный допплер— хорошее дополнительное или первичное исследование, особенно если есть опасения по поводу стеноза сонной артерии и вы хотите получить подтверждающее исследование для определения степени.
Транскраниальный допплерография может быть полезен для оценки степени внутричерепного стеноза и для обнаружения эмболов, если исследование пузырей завершено.
Оценка мозга
МРТ головного мозга, неконтрастная — помимо подтверждения диагноза, дающего ключ к разгадке этиологии, она также позволяет неврологу, наблюдающему за пациентом в будущем, получить полное исходное изображение мозга пациента на случай будущих изменений.
Что делать, если этиология криптогенная?
Рассмотрите возможность долгосрочного мониторинга сердца, например, с помощью имплантируемого петлевого регистратора (устройства Linq), который может повысить уровень обнаружения A-fib с 3% до 30% за 3 года.
Рассмотрим парадоксальные источники, то есть большие ПФО и ТГВ.
VI. Общие подводные камни
A. Путаница в отношении «допустимой гипертензии»
В отличие от «разрешающей гипертензии», которая используется у пациентов с инсультом, которым не проводилось экстренное вмешательство, если пациент получил tPA, у них ДОЛЖЕН активно контролироваться артериальное давление.
Допустимая артериальная гипертензия у пациента с инсультом, не получавшего tPA, должна выполняться в течение 24 часов до 220/110.
Через 24 часа АД следует постепенно снижать на 10-20% в день до приемлемого диапазона.
B. НЕ ПРЕДНАЗНАЧЕН ВЕРХНИЙ ВОЗРАСТ для введения tPA — не откладывайте, если указано.
C. «Очистить сосуды»
У всех пациентов следует тщательно контролировать АД. Только после получения изображения сосудов, которое «очищает» их от стеноза высокой степени, ваше целевое САД должно быть нормотензивным.
, т.е. если у вас стеноз высокой степени и давление быстро падает, это может вызвать ухудшение симптомов инсульта или новые инфаркты.
Если пациент получает tPA, цель состоит в том, чтобы снизить его до целевого значения 160–180 SBP, а не сделать его нормотензивным! Пациентам без tPA рекомендуется постепенное снижение через 24 часа.
D. Перезапустить антитромбоциты и химический ТГВ через 24 часа. Об этом обычно забывают, и пациенты с инсультом могут подвергаться высокому риску тромботических / эмболических побочных эффектов.
E. Ранняя физиотерапия, трудотерапия, логопедия и услуги питания часто упускаются из виду, но они имеют решающее значение для выздоровления пациента и являются важными факторами, влияющими на продолжительность пребывания в больнице.
VII. Ведение инсульта с сопутствующими медицинскими заболеваниями.
A. Почечная недостаточность.
Учитывайте при заказе контрастных исследований и дозировке действительно очищенных лекарств, например, леветирацетама (Кеппра) или DOAC.
Остерегайтесь уремической энцефалопатии, ухудшающей симптомы инсульта; если у пациента есть необъяснимые изменения в нейроэкспертизах, рассмотрите метаболическую панель на ранней стадии.
B. Печеночная недостаточность.
Учитывайте дозировку лекарств, например варфарина и вальпроевой кислоты.
Как и в случае с почечными пациентами, остерегайтесь метаболической энцефалопатии, ухудшающей симптомы инсульта.
C. Систолическая и диастолическая сердечная недостаточность.
Если для контроля АД необходимо использовать капельницы, необходимо следить за перегрузкой по объему.
Обязательно держите изголовье кровати приподнятым, чтобы избежать респираторной недостаточности у таких пациентов.
D. Заболевание коронарной артерии или заболевание периферических сосудов.
E. Диабет или другие эндокринные проблемы.
F. Злокачественность.
G. Иммуносупрессия (ВИЧ, хронические стероиды и др.).
H. Первичное заболевание легких (ХОБЛ, астма, ILD).
I. Проблемы с желудочно-кишечным трактом или питанием.
J. Проблемы гематологии или коагуляции.
K. Деменция или психическое заболевание / Лечение.
Следует проявлять повышенную бдительность в отношении делирия интенсивной терапии; эти пациенты будут более восприимчивы к путанице из-за изменений окружающей среды.Приложите все усилия, чтобы сориентировать этих пациентов, держать свет включенным днем, выключать свет ночью и обеспечивать, чтобы пациент мог спать всю ночь, когда это возможно (т. Е. Как можно скорее понижайте оценку пациента, чтобы избежать частых ночных пробуждений). Умеренно используйте нейролептики.
VIII. Переходы ухода.
A. Рекомендации по выходу из системы во время госпитализации.
Подчеркивая, что полученные tPA очень важны. Следует выделить необычные заказы по уходу:
Да, вам действительно нужны каждые 1 час артериальное давление и нейрохирургия в течение первых 24 часов.
Объясните необходимость поддержания АД <180/105, используя протокол для пробы и капельницы, как описано выше.
Напомните им, что никаких артериальных или венозных палочек на несжимаемых участках.
B. Ожидаемая продолжительность пребывания.
За исключением осложнений, внутривенное введение tPA должно прибавлять только один день к обычным госпитализациям при ишемическом инсульте. Кроме того, если tPA была эффективной, она может значительно сократить время госпитализации, если пациент сможет избежать реабилитации или длительного помещения в лечебное учреждение.
C. Когда пациент готов к выписке?
По прошествии первых 24 часов пациента можно вернуть к обычному лечению острого ишемического инсульта, включая диагностику, как описано выше.
D. Организация последующего наблюдения в клинике
Когда следует организовать последующее наблюдение в клинике и с кем?
Последующее наблюдение должно быть неврологическим, желательно в клинике инсульта в течение 6-8 недель.
Клиника варфарина / кумадина, если это необходимо, и если DOAC не выбран для антикоагуляции.
Кардиология, если используется имплантируемый кардиомонитор.
Какие анализы следует провести перед выпиской, чтобы лучше всего пройти первый визит в клинику.
Ничего особенного
E. Какие анализы следует назначить амбулаторно перед визитом в клинику?
Следует контролировать такие факторы риска, как: A1c, липиды, АД, INR, если вы принимаете варфарин.
Может потребоваться последующая визуализация головы, если во время госпитализации было кровотечение и необходимо решить, следует ли начинать АК.
F. Рекомендации по размещению
Широко варьируется в зависимости от неврологического исхода. Диапазон от исходного уровня / дома, дома с амбулаторной терапией, дома с лечением на дому, стационарной реабилитации, SNF, дома престарелых и т. Д.
G. Прогноз и консультирование пациентов для тех, кто получает tPA.
Прогноз хороший для пациентов, перенесших инсульт после tPA, если АД контролируется (согласно исходному исследованию NINDS, tPA дает 30% шанс небольшого / нулевого остаточного дефицита через 3 месяца после инсульта, но несет риск 6% большого кровотечения, риск 1%. смерти — помните, что большая часть риска зависит от контроля АД.
IX. Меры безопасности и качества пациентов
A. Стандарты и документация по основным показателям в отношении пациентов с tPA.
ИндикаторыJCAHO охватывают введение tPA соответствующим кандидатам и частям их лечения, относящимся к общей помощи при остром ишемическом инсульте, а не специфическим для ведения после tPA.
B. В зависимости от обозначения инсульта в больнице (первичный, комплексный центр и т. Д.) Используются разные показатели. Соответствующая профилактика, стратегии вторичной профилактики инсульта (т.е. своевременное лечение тромбоцитов), ранняя речь, PT, OT и услуги по ведению пациентов — все это среди наиболее распространенных используемых мер качества.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
новых идей из двух исследований больших баз данных — обратитесь к QD
Два недавних анализа общенациональных баз данных дали интересные выводы о ведении пациентов с острым ишемическим инсультом.Один показал, что перевод в больницу связан с худшими результатами, а другой продемонстрировал, что лечение инсульта с момента запуска инициативы по качеству «Цель: инсульт» Американской кардиологической ассоциацией было связано с более быстрым тромболитическим лечением и несколько более низкими показателями повторной госпитализации в течение года. .
Клиника Кливленда — некоммерческий академический медицинский центр. Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем Политику в отношении продуктов или услуг, не принадлежащих Cleveland Clinic.
Исследования, проведенные под руководством исследователей Cleveland Clinic, кратко описаны ниже.
Перевод в больницу и исходы инсульта
В первом исследовании, опубликованном исследователями клиники Кливленда в журнале Journal of Stroke and Cerebrovascular Diseases (29 [12] декабря 2020 г .: 105331), сравнивались результаты лечения пациентов с ишемическим инсультом в рамках программы Medicare в зависимости от того, были ли они переведены в другую больницу или напрямую. поступил из отделения неотложной помощи больницы.
«Это исследование было направлено на изучение моделей межбольничного переноса при ишемическом инсульте с целью дальнейшей оптимизации национальной системы оказания помощи при инсульте», — говорит старший автор Кен Учино, доктор медицинских наук, невролог, специализирующийся на инсульте, и руководитель отдела исследований и образования в отделе мозгового кровообращения Кливлендской клиники. Центр.«Мы обнаружили существенные различия в оказании помощи при инсульте в Соединенных Штатах как с точки зрения возможностей больниц, так и с точки зрения результатов».
Дизайн и результаты исследования. Анализ был сосредоточен на получателях платы за услуги по программе Medicare в возрасте 65 лет и старше, госпитализированных в течение 2012 года и имевших первичный диагноз ишемического инсульта при выписке. Из 312 367 госпитализированных 5,7% пациентов прошли межбольничный перевод. Этот порог использовался для классификации больниц в соответствии с их статусом перевода пациентов, перенесших инсульт, следующим образом:
- Принимающие больницы (n = 411), т.е., куда было переведено более 5,7% поступлений и переведено менее 5,7%
- Отправляющие больницы (n = 559), т. Е. Те, в которые было переведено менее 5,7% госпитализаций и более 5,7% переведено
- Больницы с малым числом госпитализаций (n = 1863), т. Е. Те, где переводы туда и обратно составляли менее 5,7% госпитализаций
- Больницы с частыми переводами (n = 43), т. Е. Те, в которые переводы приходили и уходили более 5,7% госпитализаций
Принимающие больницы, как правило, были значительно больше (по среднему количеству коек), с большей вероятностью были сертифицированными центрами инсульта и с меньшей вероятностью располагались в сельской местности.
В ходе исследования были получены следующие основные результаты:
- В принимающих больницах была сопоставима смертность через 30 дней (10% против 10%) и один год (23% против 24%) для пациентов, поступающих в стационар, и госпитализированных пациентов, соответственно.
- В отправляющих больницах смертность среди переведенных пациентов была выше, чем среди госпитализированных в течение 30 дней (14% против 11%) и одного года (30% против 27%).
- В больницах с ограниченным числом пациентов смертность среди пациентов, поступающих и отправляемых из больницы, была выше, чем при поступлении в отделение неотложной помощи через 30 дней (13% vs.10%) и один год (28% против 25%).
Исследователи пришли к выводу, что у получателей Medicare с ишемическим инсультом, переведенных в другую больницу, как правило, худшие исходы, чем у пациентов, поступивших непосредственно из больничного отделения неотложной помощи. «Не исключено, что различия в результатах могут быть связаны с переводом более тяжелых пациентов», — говорит д-р Учино. «Но этот анализ подчеркивает необходимость улучшения стандартизированной помощи при инсульте, чтобы устранить пробелы в лечении в больницах нашей страны.”
Влияние «Целевого показателя: инсульт» на продолжительность лечения и годовые результаты
Второе исследование, опубликованное в издании Circulation: Cardiovascular Quality and Outcomes (13 декабря 2020 г. [12]: e007150), проанализировало записи из двух связанных баз данных — национального реестра по улучшению качества инсульта Get With The Guidelines — Stroke и Medicare база данных претензий по оплате услуг. Его цель состояла в том, чтобы оценить влияние запуска в 2010 г. программы Target: Stroke, национальной инициативы в области качества Американской кардиологической ассоциации, на время и результаты тромболитического лечения через год.
«Это первое исследование по оценке долгосрочных результатов с помощью Target: Stroke», — отмечает Шумей Ман, доктор медицинских наук, медицинский директор Центра лечения тромбэктомии при больнице Кливлендской клиники Фэйрвью и первый автор многоцентровой группы авторов исследования. .
Дизайн и результаты исследования. Анализ выявил 42 053 участника программы Medicare в возрасте 65 лет и старше, которые получали внутривенную тромболитическую терапию в течение 4,5 часов с момента появления симптомов в больницах, участвующих в программе Get With The Guidelines – Stroke, с января 2006 года по декабрь 2014 года.Когорты до и после вмешательства (n = 10 804 и 31 249 соответственно) были определены как получавшие лечение либо до, либо после января 2010 г., когда была начата цель: инсульт.
Результаты исследованиявключали следующие различия между группами до и после вмешательства:
- Среднее время от двери к игле уменьшилось с 80 до 68 минут ( P <0,001).
- Доля пациентов, получающих тромболитическую терапию в течение 45 минут, увеличилась с 9.От 6% до 17,1%; доля получавших его в течение 60 минут увеличилась с 24,8% до 40,6% ( P <0,001 для обоих).
- Частота повторной госпитализации через один год снизилась с 44,1% до 40,1% (отношение рисков [HR] = 0,91; 95% ДИ 0,88–0,95).
- Частота повторной госпитализации по сердечно-сосудистой системе через год снизилась с 22,9% до 19,7% (ОР = 0,85; 95% ДИ, 0,80-0,89).
- Смертность от всех причин через один год снизилась с 36,9% до 35,2% (ОР = 0,98; 95% ДИ; 0,94–1,02). Это снижение было ослаблено после корректировки рисков.
«Мы обнаружили значительное сокращение времени лечения с помощью тромболитической терапии с появлением Target: Stroke», — отмечает д-р Ман. «Это сопровождалось умеренным улучшением клинических исходов, в частности, повторных госпитализаций по всем причинам и сердечно-сосудистых заболеваний — через один год. Эти результаты способствуют более интенсивному и повсеместному внедрению стратегий, предусмотренных инициативой Target: Stroke Quality ».
|
Церебральная ауторегуляция и ответ на внутривенный тромболизис при остром ишемическом инсульте
Насколько нам известно, это первое исследование, в котором сообщается о статусе КА при внутривенной тромболитической терапии. Главный вывод заключается в том, что ОРИ был ниже во время тромболитической терапии у лиц, не ответивших на лечение, и, таким образом, может рассматриваться как потенциальный инструмент оценки для прогнозирования ответа на терапию, а также может иметь важное значение при планировании нейропротективных стратегий при ишемической полутени.
Из-за своего ограниченного запаса энергии мозг сильно зависит от стабильного кровотока и развил ряд защитных механизмов для поддержания церебральной перфузии 12 . Однако эти регуляторные механизмы могут быть нарушены во время и после ишемии 12 , и это имеет особое значение для управления АД в острейшем периоде после АИС, когда связанные нарушения АД могут увеличивать риск дальнейшего повреждения 13,14,15 . В нескольких исследованиях оценивалась острая ХА (<24 ч) согласно AIS 11,13,16,17,18,19,20,21 , и только в одном исследовании небольшая выборка пациентов с АИС с большим инсультом переднего кровообращения (NIHSS ≥ 10), проходящих тромболитическую терапию, проводилась в среднем через 20 ч после появления симптомов.В этом исследовании сообщается, что тяжелое нарушение КА при АГ (оцениваемое по индексу Mx и фазовому сдвигу) было связано с плохим исходом 11 . Хотя наше исследование выявило менее тяжелые нарушения, оно распространило эти наблюдения на более широкую популяцию AIS (NIHSS 4–24), как для АГ, так и для UH, и с записями, сделанными во время тромболизиса, что дает потенциальную возможность для будущего вмешательства на более ранней стадии эволюции. ишемической полутени. Кроме того, предыдущие исследования продемонстрировали, что CA может быть связана с размером инфаркта 13,16,17 , но неясно, определяет ли ишемическое поражение нарушение CA или наоборот; хотя в нашем исследовании объем инфаркта не оценивался, разница CA на очень ранней стадии между двумя группами (респонденты x не ответившие) без разницы через 24–48 часов предполагает, что в нашей популяции на ухудшение CA не повлияло по распространению инфаркта.Мы также не смогли продемонстрировать прямую связь между внутричерепным кровотечением и ХА во время тромболитической терапии, поскольку это осложнение произошло только у одного пациента; однако можно предположить, что нарушение СА во время терапии могло повлиять на это осложнение, как показано в предыдущей работе 18 .
Хотя основной целью лечения острого инсульта является реканализация закупоренного сосуда, значительный процент пациентов не имеет хорошего неврологического результата, несмотря на успешную реканализацию, так называемую «бесполезную реканализацию». 6,7 .Были выдвинуты различные гипотезы, пытающиеся объяснить это явление, такие как коллатеральный статус и / или окклюзия микрососудов 7 ; однако также кажется правдоподобным рассмотреть роль нарушения регуляторных механизмов CBF в ухудшении неврологического исхода у пациентов с бесполезной реканализацией. Например, нарушение CA может привести к дальнейшему повреждению полутени, вторичному по отношению к реперфузии, как сообщалось в предыдущем исследовании в течение 6 часов по AIS 18 . Интересно, что в основном исследовании NINDS 1 не было различий в раннем неврологическом улучшении среди групп пациентов, получавших лечение, и пациентов, получавших плацебо; это открытие подтверждает нашу гипотезу о том, что помимо реканализации существуют и другие факторы, которые влияют на клинический исход на ранних стадиях после ишемического инсульта.Таким образом, наши результаты важны для исследования стратегий, направленных на сохранение ткани полутени и улучшение неврологического восстановления, независимо от успешной реканализации или нет.
ROC-анализ в нашем исследовании показал, что пороговое значение 4,0 имело лучшую чувствительность и специфичность для прогнозирования ответа на терапию и согласуется с предыдущими публикациями, предполагающими, что ARI <4 для определения нарушенного CA 22,23 . Это пороговое значение является новым открытием в популяции пациентов с инсультом и должно быть дополнительно изучено и воспроизведено в более крупных исследованиях, которые будут использоваться в качестве действительного инструмента оценки для выявления нарушения СА.
Наше исследование имеет ряд ограничений. Во-первых, существует известное ограничение TCD при использовании в качестве суррогата CBF 24 . Во-вторых, мы включили пациентов со стенозом сонной артерии, который также может нарушать СА, хотя мы не обнаружили различий в распространенности или тяжести стеноза сонной артерии между респондентами и не отвечающими. В-третьих, до тромболизиса не проводилась оценка СА, поэтому было невозможно оценить, может ли ранее существовавшее нарушение СА предсказать плохой ответ, несмотря на реканализацию; тем не менее, было бы сложно и потенциально неэтично откладывать лечение, чтобы позволить провести предварительную оценку ХА до тромболизиса.В-четвертых, оценка СА была невозможна во время тромболизиса у пациентов с проксимальной окклюзией СМА (n = 3), а эффекты реканализации, внутричерепного стеноза и механизма инсульта не учитывались; это могло привести к переоценке или недооценке прогностического эффекта нарушения перитромболизиса ОРИ. Кроме того, это исследование включало только пациентов, получавших тромболизис, а не пациентов, получавших терапию механической реканализацией. Тем не менее, эта терапия по-прежнему используется ограниченно как в развитых, так и в развивающихся странах 25,26 , и вполне возможно, что эта группа пациентов с более высокими показателями реканализации имеет большее влияние статуса СА на неврологический исход.Примечательно, что использование медицинской реперфузии увеличивается у пациентов с инсультом без окклюзии крупных сосудов после публикации исследований по пробуждающему инсульту и расширенному терапевтическому окну 27,28 . В-пятых, в нашем исследовании изучалась только ранняя реакция на терапию; таким образом, влияние КА на отдаленные неврологические исходы должно стать предметом будущих исследований. Наконец, количество пациентов, включенных в это исследование, относительно невелико из-за неоднородности пациентов, и полученные результаты являются гипотезами; кроме того, можно утверждать, что включение одного пациента с вертебробазилярным инсультом (группа респондентов) могло повлиять на результаты.Мы намеренно включили эту подгруппу, чтобы попытаться продемонстрировать, что изменение CA является более глобальным, чем локальным явлением. Удаление этого пациента из анализа не повлияло на наши результаты.
В заключение, настоящее исследование показало, что нарушение СА на очень ранней стадии AIS увеличивает вероятность плохого ответа на тромболитическую реканализацию, по оценке по шкале NIHSS через 24–48 часов.
