Инсульт ишемия головного мозга: причины, симптомы и лечение всех видов заболеваний в ФНКЦ ФМБА
Хроническая ишемия головного мозга: причины и симптомы заболевания
Хроническая ишемия головного мозга: причины и симптомы заболевания
Это не просто усталость, а симптомы хронической ишемии мозга, которая в будущем может привести или к инсульту, или к нарушениям памяти (слабоумию).
Как заподозрить у себя сосудистую патологию мозга и как не допустить удара?
Корреспонденту «АиФ» рассказывает Маринэ Танашян, доктор медицинских наук, профессор, член-корреспондент РАН, заместитель директора Научного центра неврологии.
— Маринэ Мовсесовна, долгое время считалось, что инсульт предсказать невозможно. Это так?
— То, что существуют факторы риска, которые провоцируют развитие инсульта, неврологи знали всегда. Однако методы ангионейровизуализации, позволяющие заглянуть в мозг и увидеть существующие в нём проблемы, появились лишь в последние 20 лет. Они позволили нам совершить прорыв в лечении инсульта (смертность от него за последние годы снизилась почти на 30%) и реабилитации после (методы магнитной стимуляции зон мозга позволяют вернуть после инсульта к нормальной жизни людей, которые раньше были обречены доживать свой век в инвалидной коляске), а также разработать способы профилактики сосудистых заболеваний мозга. Сегодня высокоточные методы обследования позволяют увидеть бессимптомные очаги поражения сосудов, питающих головной мозг, которые приводят к инсульту. Как показывают обследования, сосудистая патология, хроническая ишемия мозга сегодня есть практически у всех. А это значит, что от инсульта не застрахован никто.
Сегодня высокоточные методы обследования позволяют увидеть бессимптомные очаги поражения сосудов, питающих головной мозг, которые приводят к инсульту. Как показывают обследования, сосудистая патология, хроническая ишемия мозга сегодня есть практически у всех. А это значит, что от инсульта не застрахован никто.
— Как возникают эти проблемы и можно ли их предотвратить?
— Нарушения кровоснабжения головного мозга провоцируют болезни сердца и сосудов, сахарный диабет, метаболический синдром (изменения, связанные с нарушением обмена веществ). Ухудшают кровоснабжение мозга и любые виды анестезии (после общего наркоза нередко отмечаются т. н. «немые» инфаркты мозга).
Ещё один провоцирующий фактор, важность которого нам ещё предстоит оценить, — малоподвижный образ жизни. Исследования показывают, что гиподинамия ведёт к сосудистым катастрофам в той же степени, что алкоголь и курение. Практически у всех представителей сидячих профессий при обследовании выявляется хроническая ишемия головного мозга и асимптомные стенозы (сужения) его сосудов.
— Может ли человек сам заподозрить у себя эти проблемы?
— Не всегда симптомы нарушения мозгового кровоснабжения явные (см. инфографику), а нередко они вообще никак не проявляют себя.
Выявить их можно только при скрининговом исследовании сосудов головного мозга. Такое обследование необходимо включить в стандарты обследования — зная факторы риска, можно успешно с ними бороться. Сотрудники Научного центра неврологии проводили скрининг сотрудников крупных предприятий (Новолипецкого, Магнитогорского металлургических комбинатов, Тушинского машиностроительного завода), и наш опыт показывает, что при своевременном выявлении сосудистой патологии и её правильном ведении проблемных пациентов (с контролем артериального давления и приёмом препаратов) заболеваемость инсультом можно снизить почти в 2 раза.
— Сегодня на первый план выходит ещё одна напасть — старческое слабоумие, деградация мышления и поведения в зрелом возрасте.
— Раньше люди не доживали до этих проблем, а сегодня увеличение продолжительности жизни и успехи в лечении инсультов привели в тому, что слабоумие стало проблемой № 1 пожилых людей.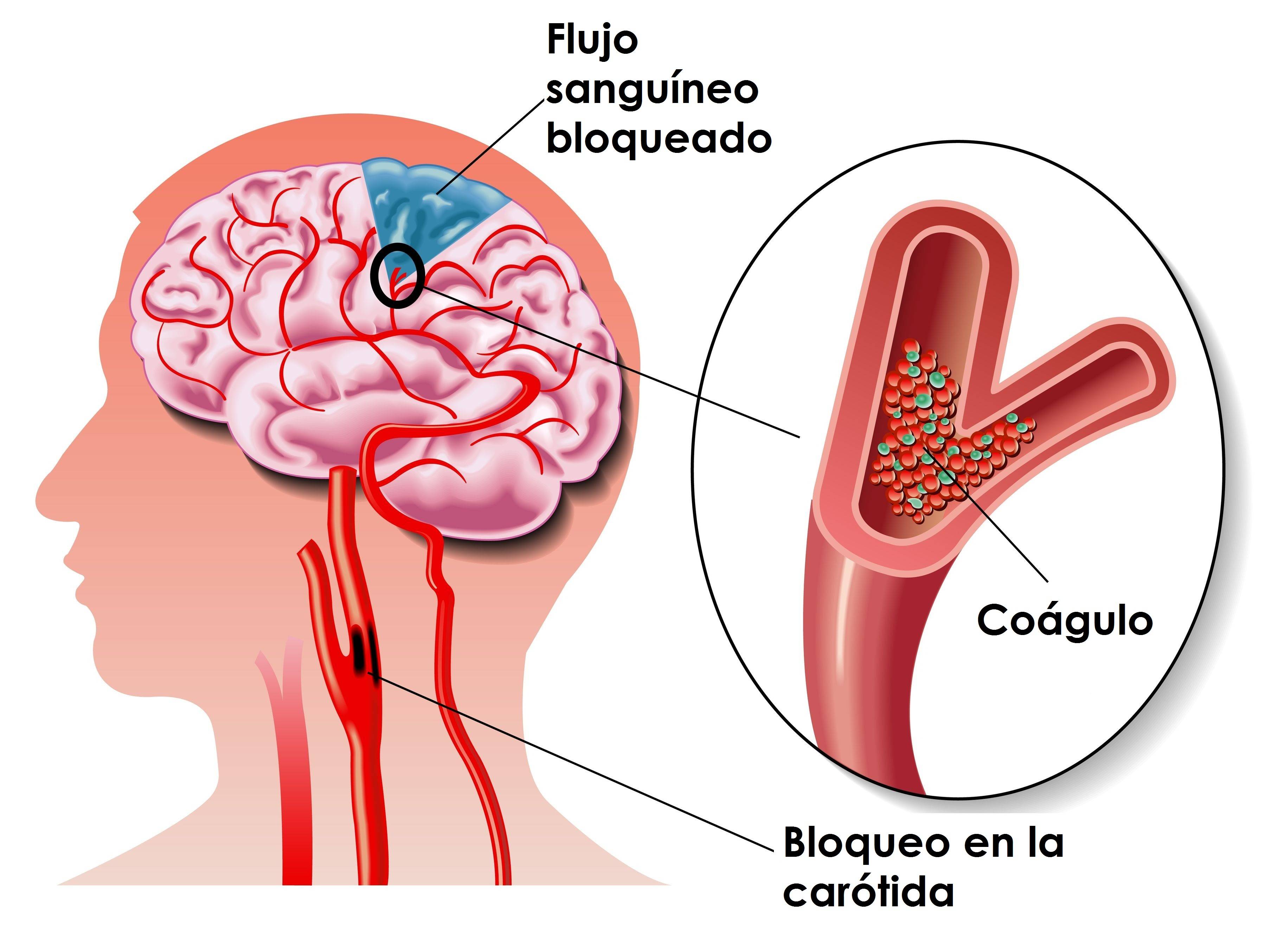 Врачи ищут методы профилактики и способы лечения. А они достаточно простые — контроль за факторами риска и их коррекция.
Врачи ищут методы профилактики и способы лечения. А они достаточно простые — контроль за факторами риска и их коррекция.
— Такой центр — один на всю страну. Наверняка к вам могут попасть не все желающие?
— Научный центр неврологии — крупнейшее научно-исследовательское клиническое учреждение России. Мы принимаем жителей из всех регионов страны по направлению и полису ОМС. К сожалению, и по полису, и в рамках госзаданий можно получить далеко не все виды медпомощи. Поэтому мы проводим широкомасштабную образовательную программу для врачей в областях России, а региональных пациентов консультируем во время телемостов.
Инсульт, острое нарушение мозгового кровообращения, ишемия головного мозга, кровоизлияние в мозг
Отделение реанимации и интенсивной терапии № 3 КБ № 122 оказывает высококвалифицированную помощь пациентам с острым нарушением мозгового кровообращения как в остром периоде болезни, так и пациентам с последствиями перенесенных инсультов!
Понятие «Острое нарушение мозгового кровообращения» (ОНМК) включает в себя: транзиторные ишемические атаки, острую гипертоническую энцефалопатию и инсульт.
Инсульт – это заболевание сосудов головного мозга, характеризующееся внезапным (в течение нескольких минут, часов) появлением очаговой и/или общемозговой неврологической симптоматики, которая сохраняется более 24 часов или приводит к смерти больного в более короткий промежуток времени.
Выделяют несколько видов инсульта: ишемический, когда возникает нарушение поступления крови в мозг вследствие различных причин (тромбы, спазм и т.д.) и геморрагический – разрыв сосуда с излитием крови в полость черепа и/или образованием внутримозговой гематомы.
Инсульт в настоящее время становится основной социально-медицинской проблемой неврологии. Инвалидами становятся 70—80% выживших после инсульта, 20—30% из них нуждаются в постоянном постороннем уходе. Летальность среди заболевших к концу года достигает 45-50%.
Всем пациентам с острым нарушением мозгового кровообращения (даже, если жалобы и симптомы быстро прошли) показана экстренная госпитализация.
Госпитализация должна осуществляться в специализированный стационар. По всем международным рекомендациям «пациенты должны лечиться в центрах, где есть опытные цереброваскулярные хирурги и мультидисциплинарная нейроинтенсивная терапия. При поступлении пациента в стационар, где лечение пациентов с ОНМК составляет менее 10 в год, следует рассмотреть возможность раннего перевода.
Наша больница является именно таким высокоспециализированным центром, где осуществляется комплексное обследование с целью выявления причин возникновения заболевания, консервативное и хирургическое лечение, ранняя реабилитация. Наши хирурги проводят тромболизис и тромбоэкстракцию, удаление атеросклеротических бляшек, коррекцию патологических извитостей сосудов, эмболизацию, клипирование и удаление артериовенозных мальформаций, артериальных аневризм, каверном. Анестезиологическое пособие проводят высококвалифицированные анестезиологи. Поступление пациента сразу в отделение реанимации является важной составляющей успешного лечения. Только в нейрореанимационном отделение за больным осуществляется непрерывное наблюдение, проводится мониторинг всех жизненно важных функций. При изменении состояния – незамедлительно принимается решение об изменении тактики лечения. В нашем отделение работают высококвалифицированные врачи и медицинские сестры, лечение пациентов осуществляется по международным и собственным запатентованным методикам с использованием самого современного оборудования.
Только в нейрореанимационном отделение за больным осуществляется непрерывное наблюдение, проводится мониторинг всех жизненно важных функций. При изменении состояния – незамедлительно принимается решение об изменении тактики лечения. В нашем отделение работают высококвалифицированные врачи и медицинские сестры, лечение пациентов осуществляется по международным и собственным запатентованным методикам с использованием самого современного оборудования.
Мы также успешно занимаемся реабилитацией больных с последствиями нарушений мозгового кровообращения. Используемые нашими специалистами методики позволяют улучшить качество жизни пациентов: уменьшить неврологический дефицит, улучшить глотание, речь, движения, уменьшить депрессию.
И, самое главное, помните! Инсульт проще предотвратить, чем лечить. Если у Вас есть предрасположенность к развитию ОНМК (избыточный вес, артериальная гипертензия, сахарный диабет, частые головные боли или головокружения, транзиторные ишемические атаки, наличие инсультов у Ваших родственников) – обратитесь к нам! Наши специалисты (неврологи, кардиолог, эндокринолог, нутрициолог, врач УЗИ-диагностики) проведут комплексное обследование и назначат необходимое лечение.
Отделение реанимации и интенсивной терапии № 3
Цереброваскулярные заболевания —
Цереброваскулярные заболевания занимают 3-е место среди наиболее распространенных причин смерти в Соединенных Штатах Америки, при этом, они имеют самые высокие показатели также и по инвалидности. Кроме того, эти заболевания вызываются кровотечением, вызывающего ишемию или сжатие сосудов, которые в свою очередь могут вызвать общий или очаговый инфаркт, летальный исход или травмы.
Ишемическая болезнь сосудов (Паралич)
Ишемическая болезнь сосудов наблюдается в результате ишемии или инфаркта миокарда в любой области сосудистого распределения головного мозга. Таким образом, воздействие может быть оказано на головной мозг, мозжечок, ствол мозга или любую другую область головного мозга. В результате того, что основная часть кровопотока в мозг обеспечивается посредством сонной артерии, при снижении кровоснабжения в мозг довольно часто происходит инсульт или инфаркт.
Артериальная эмболия обычно возникает из атеросклеротических бляшек или язвы в бифуркации сонной артерии, сосредоточенной в области сердца. Возникающие после наступления инфаркта миокарда, тромб стенок сосудов или фибрилляция предсердий, развивается в результате эмболии сосудов сердца. Другими факторами риска развития ишемии головного мозга являются гипертония, сахарный диабет, высокий уровень холестерина, ожирение, курение и наследственность.
Поскольку не существует эффективных лекарственных препаратов или хирургических способов для лечения инсульта, преследуемой целью в нейрохирургии является выявление пациентов, имеющих вероятность перенести инсульт, а также снижение риска возникновения ишемии головного мозга. Такие пациенты с высоким риском, лучше всего определяются после выявления в их истории болезни транзиторной ишемии головного мозга или же проявления транзиторных ишемических атак (ТИА). Транзиторная ишемия головного мозга, образованная в области циркуляции сонной артерии, состоит гемианестезии, гемипареза или афазии. Amorozis fugax предоставляет собой временную потерю зрения в одном глазу. Ишемия, возникающая в вертебробазиларной системе, может вызывать временную диплопию, головокружение, дисфагию, слабость, онемение, потеря зрения и даже привести к потере памяти.
Случаи проявления ишемии, как правило, длятся всего лишь несколько секунд или минут и редко занимают время дольше, чем 30 минут. Если неврологические расстройства проходят в течение 24 часов, то такие случаи определяются как (ТИА). Обратимый ишемический неврологический дефицит (RIND) может продолжаться от 24 часов до 3-х недель. Продолжающиеся в течение длительного срока, ишемические расстройства, определяются как наступивший/устоявшийся паралич. В ходе детального опроса, проведенного с пациентами, перенесших паралич, было установлено, что 60% пациентов в прошлом перенесли ТИА, а у 20% развитие паралича происходило поэтапно, при этом, только у 20% паралич наступил внезапно.
Обратимый ишемический неврологический дефицит (RIND) может продолжаться от 24 часов до 3-х недель. Продолжающиеся в течение длительного срока, ишемические расстройства, определяются как наступивший/устоявшийся паралич. В ходе детального опроса, проведенного с пациентами, перенесших паралич, было установлено, что 60% пациентов в прошлом перенесли ТИА, а у 20% развитие паралича происходило поэтапно, при этом, только у 20% паралич наступил внезапно.
Лечение
Пациенты, перенесшие ТИА или те у кого проявляется поэтапное развитие инсульта, являются потенциальными кандидатами для профилактической операции. Профилактика инсульта направлена на ликвидацию очага эмболии или увеличение кровотока, поступающего в мозг. Операции, проводимые для таких целей, включают каротидную эндартерэктомию и операцию байпас микрососудов. Для проведения оценки и степени инфаркта в головном мозге, а также для устранения имеющейся опухоли, субдуральной гематомы или субарахноидального кровоизлияния, потенциальные кандидаты подвергаются обследованию, проводимому при помощи КТ и МРТ. Позже эти пациенты проходят ангиографию дуги аорты, сонной артерии, позвоночных сосудов и других различных сосудов головного мозга. Несмотря на недостаточность и не точность результатов, исследование системы каротидной циркуляция при помощи неинвазивных методов, может проводиться в качестве метода скрининга из-за отсутствия какого-либо риска для здоровья пациента.
Позже эти пациенты проходят ангиографию дуги аорты, сонной артерии, позвоночных сосудов и других различных сосудов головного мозга. Несмотря на недостаточность и не точность результатов, исследование системы каротидной циркуляция при помощи неинвазивных методов, может проводиться в качестве метода скрининга из-за отсутствия какого-либо риска для здоровья пациента.
Если имеются такие симптомы, как ипсилатеральная церебральная ишемия или amorozis fugax (потеря зрения), или же на ангиографии выявляется расширенный стеноз (обычно более 75%) или же наблюдается образование язвы, то это указывает на каротидною эндартерэктомию. Процедура включает в себя открытие сжатой части сонной артерии и удаление атеросклеротических бляшек. Смертность, вызываемая каротидной эндартерэктомией, при квалифицированном вмешательстве составляет всего 1%, при этом, смертность при неврологических заболеваниях составляет 5%.
В группе пациентов, доступ к каротидной артерии затруднен или невозможно проведение хирургического вмешательства, то в сегментах средней мозговой артерии наступает ишемия головного мозга.
Ишемия головного мозга — Визуализация при инсульте — 24Radiology.ru
Данный системный подход на основе презентации Majda Thurnher и адаптирован для Radiology Assistant Robin Smithus.
Содержание.
Роль КТ и МРТ в диагностике инсульта.
Ранние признаки инфаркта на КТ и МРТ.
Введение.
Цель визуализации у пациентов с острым инфарктом.- 1) исключить кровотечение.
- 2) дифференцировать мертвую ткань головного мозга и ткань в риске-пенумбры.
- 3) выявить стеноз или окклюзию экстра- и интракраниальных артерий.
Ранние признаки инсульта на КТ.
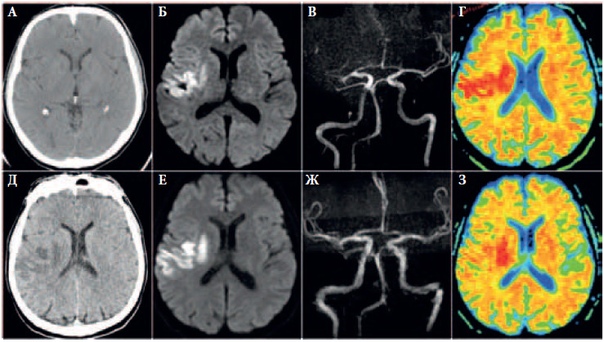
КТ является золотым стандартом для выявления геморрагии в первые 24 часа. Геморрагии также выявляются на МРТ. На КТ возможно определить 60% инфарктов в первые 3-6 часов, остальную часть возможно выявить впервые 24 часа. Общая чувствительность КТ при диагностике инфаркта составляет 64% и специфичность 85%. Ниже представлены ранние признаки на КТ.
КТ ранние признаки инсульта.
- — Зона с гиподенсной плотностью головного мозга.
- — Обскурация чечевицеобразных ядер.
- — Симптом плотной СМА.
- — Островковый ленточный симптом.
- — Потеря островковых очертаний.
Гиподенсная зона головного мозга.
Причиной, по которой визуализируется зона ишемии с цитотоксическим отеком, является нарушение работы натрий-калиевого насоса, что в свою очередь связано со снижением количества АТФ. Увеличение содержания воды в мозге на 1% приводит к снижению плотности головного мозга на КТ на 2,5 единицы Хаусфильда. У пациента выше представленного гиподенсивная область головного мозга в правом полушарии. Вытекающий диагноз из данных находок — инфаркт так, как локализация средней мозговой артерии и вовлечение в патологический процесс белого и серого вещества, что типично для инфаркта. Обнаружение в первые 6 часов гиподенсной зоны является специфичным признаком необратимого ишемического повреждения мозга. У пациентов с клиникой инсульта и выявленным гиподенсной областью впервые 6 часов есть риск увеличения зона ишемии, ухудшения симптоматики и кровотечения, а также данная группа пациентов имеет более хуже ответ на проводимую медикаментозную терапию в сравнении с пациентами с клиникой инсульта, у которых данная область не выявлена. Таким образом выявления гиподенсной зоны является неблагоприятным прогнозом. Соответственно, что если гиподенсная зона не выявлена, это благоприятный прогноз.
У пациента выше представленного гиподенсивная область головного мозга в правом полушарии. Вытекающий диагноз из данных находок — инфаркт так, как локализация средней мозговой артерии и вовлечение в патологический процесс белого и серого вещества, что типично для инфаркта. Обнаружение в первые 6 часов гиподенсной зоны является специфичным признаком необратимого ишемического повреждения мозга. У пациентов с клиникой инсульта и выявленным гиподенсной областью впервые 6 часов есть риск увеличения зона ишемии, ухудшения симптоматики и кровотечения, а также данная группа пациентов имеет более хуже ответ на проводимую медикаментозную терапию в сравнении с пациентами с клиникой инсульта, у которых данная область не выявлена. Таким образом выявления гиподенсной зоны является неблагоприятным прогнозом. Соответственно, что если гиподенсная зона не выявлена, это благоприятный прогноз.
У данного пациента выявлен гиподенсная область — это инфаркт в области средней мозговой артерии — безвозвратная ишемия головного мозга.
Обскурация чечевицеобразного ядра.
Обскурация чечевицеобразного ядра также ещё называют симптом расплывшегося пятна базальных ядер и является важным признаком инфаркта. Данный симптом является одним из ранних изменений при инсульте и часто встречаемым признаком инфаркта. Базальные ганглии также часто поражаются при инсульте в средней мозговой артерии.
Обскурация чечевицеобразного ядра.Островковый ленточный симптом.
Данный симптом включает в себя: гиподенсную зону и отек коры головного мозга в области островка. Данный симптом также относится к ранним проявлениям ишемии в средней мозговой артерии. Область головного мозга, относящаяся к средней мозговой артерии, очень чув- ствительна к гипоксии в связи с тем, что СМА не имеет коллатералей. Дифференциацию стоит проводить с поражением ГМ при герпесном энцефалите.
Симптом плотной СМА.
Данный симптом проявляется в следствии тромбирования или эмболизации СМА.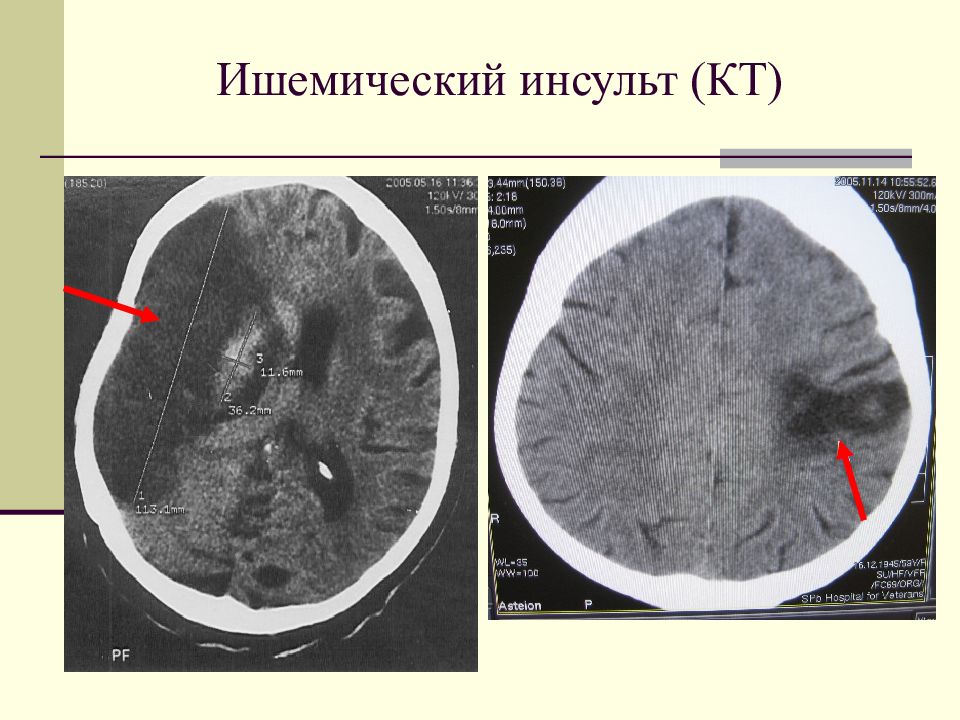 У ниже представленного пациента симптом плотной СМА. На КТ ангиография визуализируется окклюзия СМА.
У ниже представленного пациента симптом плотной СМА. На КТ ангиография визуализируется окклюзия СМА.
Гемморагический инсульт.
По статистике 15% инсультов в бассейне СМА являются геморрагическими.
Геморрагии хорошо визуализируются на КТ, а также отлично на МРТ при использовании Gradient ECHO.
КТА и КТ-перфузия.
После того, как лучевой диагност обнаружил область ишемии, используя КТ-ангиографию ищет тот сосуд, который вовлечён в патологический процесс.
Нормальная КТА.
Оцените ниже лежащие изображения после того, как оцените — продолжите чтение.
В данном случае признаки инфаркта едва уловимые. Гиподенсная зона в островковой области справа. В данном случае эти изменения соответствуют инфаркту, но у пожилых пациентов с лейкоэнцефалопатией тяжело отдифференцировать эти две разные патологии.
Вышележащие изображения — КТ-ангиография.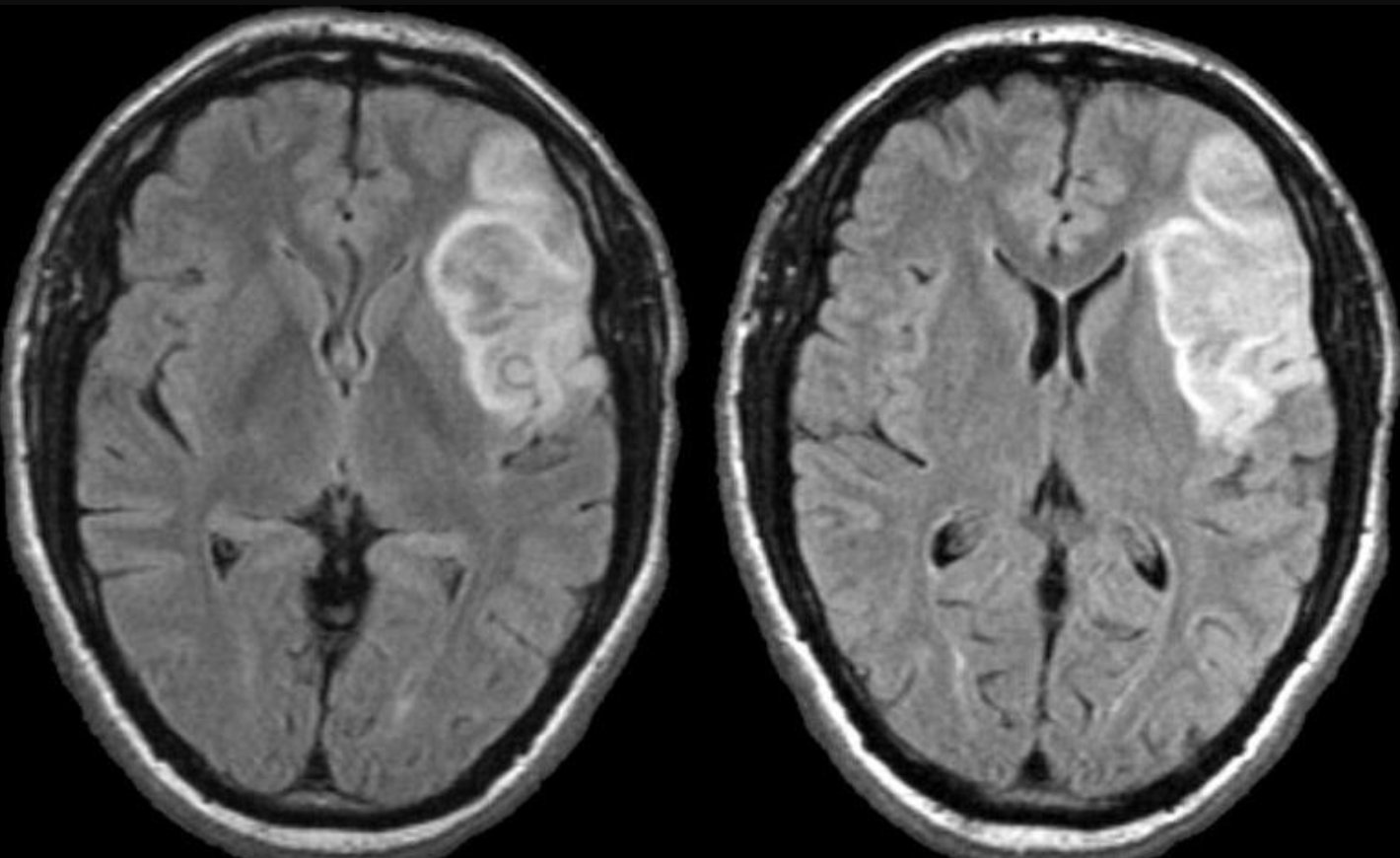 После выполнения КТА — диагноз инфаркта в области СМА, как на ладоне.
После выполнения КТА — диагноз инфаркта в области СМА, как на ладоне.
КТ-перфузия (КТП).
При использовании КТ и МРТ-диффузии мы можем с уверенностью найти ту зону, которая ишемизирована, но не сможем сказать о зоне большой ишемической пенумбры (ткань риска).
При помощи перфузии можем ответить на вопрос, какая ткань находится в риске. По статистике 26% пациентам следовало бы выполнить перфузию для уточнения диагноза. Возможности МРТ перфузии и КТ сопоставимы.
Было проведено исследование для сравнения КТ и МРТ, при котором было установлено, что для выполнения КТ, КТА и КТП при условии, что у вас хорошо сложенная команда, требуется 15 минут. В данном случае была выполнена только КТ так, как выявлено кровоизлияние. В этом случае изначально выполнены КТ без контрастирования и КТ-перфузия так, как выявлен дефект перфузии было целесообразно выполнение КТ-ангиографии, на которой выявлено диссекция левой внутренней артерии.
МРТ при диагностике острого нарушения мозгового кровообращения.

На PD/T2WI и FLAIR выглядит гиперинтенсивно. На PD/T2WI и FLAIR последовательностях возможно диагностировать до 80% инфарктов впервые 24 часа, но впервые 2-4 часа после инсульта изображение также может быть неоднозначным. На PD/T2WI и FLAIR продемонстрировано гиперинтенсивность в районе левой средней мозговой артерии. Обратите внимание на вовлечение в процесс лентиформного ядра и островковой доли. Область с гиперинтенсивным сигналом на PD/T2WI и FLAIR соответствует гиподенсивной области на КТ, что в свою очередь прямой признак гибели клеток мозга.
Диффузно-взвешенное изображение.
DWI наиболее чувствительна к инсульту. В результате цитотоксического отека возникает дисбаланс внеклеточной воды к Броуновскому движению, поэтому данные изменения выявляются отлично на DWI. В норме протоны воды диффундируют внеклеточно, поэтому теряется сигнал. Высокая интенсивность сигнала на DWI указывает на ограничение протонов воды диффундировать внеклеточно.
Есть некоторая гиподенсность и отек в левой лобной доли со старостью борозд в сравнении с контр-латеральной стороной. Далее DWI снимки того же пациента. После просмотра DWI нет сомнения, что это инфаркт. Именно поэтому DWI называют инсульт последовательностью.
Когда мы сравниваем результаты на T2WI и DWI во времени, мы заметим следующее: В острой фазе T2WI норма, но со временем зона инфаркта станет гиперинтенсивной. Гиперинтенсивность на T2WI достигает своего максимума между 7 и 30 дней. После этого сигнал начинает угасать. На DWI гиперинтенсивная область в острой фазе, а затем становится более интенсивной с максимумом на 7 дней. На DWI у пациента с инфарктом головного мозга визуализируется гиперинтенсивная область примерно на 3 недели после начала заболевания (при инфаркте спинного мозга на DWI визуализируется гиперинтенсивная область на одну неделю!). На ADC будет сигнал низкой интенсивности с минимальной интенсивностью в первые 24 часа, после сигнал будет увеличиваться в интенсивности и, наконец, становится максимально интенсивным в хроническую стадию.
На ADC будет сигнал низкой интенсивности с минимальной интенсивностью в первые 24 часа, после сигнал будет увеличиваться в интенсивности и, наконец, становится максимально интенсивным в хроническую стадию.
Псевдо-улучшение на DWI.
Псевдо-улучшение наблюдается на 10-15 день. Слева показана норма на DWI. На T2WI там могут быть гиперинтенсивная область в правой затылочной доле в сосудистой территории задней мозговой артерии. В T1WI после введения контрастного препарата на основе гадолиния визуализируется повышение сигнала (зона инфаркта указана стрелкой).
Псевдо-улучшение на ДВИ после 2 недельного инфаркта.
Прежде считалось, что гиперинтенсивный сигнал на DWI — это мертвые ткани. Новейшие исследования доказывают, что некоторые очаги из них вероятно могут быть потенциально обратимым повреждениям. Это наглядно показано, если сравнить изображения одного и того же пациента DWI в острейшую фазу и Т2WI в хроническую фазу. Размер поражения на DWI намного больше.
МРТ перфузия.
Перфузия на МРТ сопоставима с КТ-перфузией. При МР-перфузии используется болюс с контрастным веществом Gd-DTPA. Т2 последовательности более чувствительны к изменению сигнала, поэтому используются для МР-перфузии.
Зона с дефектом перфузии является безвозвратно ишемизированной тканью или зоной пенумбры (ткань риска). При комбинировании диффузно-взвешенного изображения и перфузии есть возможность отдифференцировать зоны пенумбры и зоны безвозвратной ишемии.
На нижележащих изображениях слева представлена диффузно-взвешенное изображение, на котором возможно выявить ишемизированную ткань. Среднее изображение соответствует мр- перфузии, на котором визуализируется огромная область гипоперфузии. На крайне правом изображении diffusion-perfusion mismatch визуализируется зона ткани-риска, которая отмечена синим и возможно будет сохранена после терапии.
Ниже представлены изображения пациента, у которого были установлены неврологические проявления около часа назад. Постарайтесь выявить патологические изменения, а после продолжите чтение.
Постарайтесь выявить патологические изменения, а после продолжите чтение.
Данные изображения соответствуют норме, поэтому следует перейти к диффузно-взвешенному изображению. Взгляните на следующие изображения.
На DWI выявляется зона ограничения диффузии, и если после выполнения перфузии не будет выявляться зона перфузии, то следовательно нет смысла выполнять тромболизис.
На выше лежащих изображениях визуализируется инфаркт в бассейне СМА. На КТ четко визуализируются необратимые изменения. Далее представлены DWI и перфузия. При сопоставлении зон становится ясно, что не нужно выполнять тромболизис
Выше представлены ADC и DWI map.
При ознакомлении с перфузионными изображениями, то визуализируется несоответствие. В левом полушарии выявлена область гипоперфузии. Данный пациент абсолютный кандидат на тромболитическую терапию.
- Acute stroke: usefulness of early CT findings before thrombolytic therapyby R von Kummer et al.
 Radiology 1997, Vol 205, 327-333,
Radiology 1997, Vol 205, 327-333, - Early CT finding in cerebral infarction: obscuration of the lentiform nucleusby N Tomura et al Radiology 1988, Vol 168, 463-467
- State-of-the-Art Imaging of Acute Strokeby Ashok Srinivasan et al RadioGraphics 2006;26:S75-S95
Ишемия сосудов головного мозга: симптомы, лечение
Для ишемии головного мозга характерна частичная закупорка и сужение сосудов головы чаще всего из-за атеросклеротических отложений. Поврежденные сосуды не в состоянии пропускать нормальный объем крови, поэтому ткани головного мозга недополучают необходимое количество кислорода и питательных веществ. Со временем человек замечает провалы памяти, ухудшение работоспособности, проблемы со сном на фоне хронической усталости. Эти тревожные симптомы должны стать причиной для посещения квалифицированного врача. В противном случае пациенту может грозить инсульт, потеря памяти и инвалидность.
Как возникает ишемия головного мозга?
Ишемия сосудов головного мозга – это в основном явление возрастное. Нормальное функционирование сосудов предусматривает снабжение всех органов достаточным объемом крови. С возрастом эластичность сосудистых стенок ухудшается, они «обрастают» скоплениями холестериновых бляшек. Наибольшую опасность несут повреждения крупных артерий.
Нормальное функционирование сосудов предусматривает снабжение всех органов достаточным объемом крови. С возрастом эластичность сосудистых стенок ухудшается, они «обрастают» скоплениями холестериновых бляшек. Наибольшую опасность несут повреждения крупных артерий.
Сосуды головы особенно чувствительны к данным ухудшениям, ведь через них проходит пятая часть всей крови в организме. Человеческий мозг не может нормально работать без постоянного притока кислорода и питательных веществ, которые содержит кровь. Снижение их объемов неизменно приводит к деградации тканей головного мозга, гибели нейронов и потере части функций, зачастую жизненно важных.
Провоцировать ишемические процессы в головном мозге также может изменение свойств и состава крови (в частности, повышение свертываемости) из-за болезней почек, дисфункций щитовидной железы, нарушения обмена веществ. Также снизить активность кровотока в сосудах головы могут проблемы в работе сердца, токсические отравления. Сейчас вы можете пройти консультацию и комплекс подготовительных обследований при записи на курс усиленной наружной контрпульсации или ударно-волновой терапии сердца абсолютно бесплатно!
Сейчас вы можете пройти консультацию и комплекс подготовительных обследований при записи на курс усиленной наружной контрпульсации или ударно-волновой терапии сердца абсолютно бесплатно!
Акция
Только до конца осени пройди бесплатную консультацию и комплекс подготовительных обследований* при записи на курс усиленной наружной контрпульсации или ударно-волновой терапии сердца.**
Спешите оставить заявку, период действия акции ограничен.
Причины заболевания
Атеросклероз, артериальная гипертензия – две причины, на которые приходится абсолютное большинство случаев ишемии сосудов головного мозга. Холестерин особенно активно откладывается на стенках сосудов у людей после 40 лет. Именно в этом возрасте растет риск ишемических явлений. Если пациент не корректирует свой образ жизни, рост холестериновых отложений только прогрессирует и приводит к ухудшению работы головного мозга.
Вторая по распространенности причина – хроническая сердечная недостаточность. Если сердце вырабатывает недостаточный объем крови, это автоматически нарушает питание головного мозга. Также симптомы ишемии нередко проявляются у пациентов с различными видами аритмии, так как нарушение динамики кровотока негативно сказывается на кровоснабжении головного мозга.
Если сердце вырабатывает недостаточный объем крови, это автоматически нарушает питание головного мозга. Также симптомы ишемии нередко проявляются у пациентов с различными видами аритмии, так как нарушение динамики кровотока негативно сказывается на кровоснабжении головного мозга.
Среди других причин:
- наследственные ангиопатии;
- болезни почек;
- заболевания крови;
- сахарный диабет;
- нарушения обмена веществ;
- эндокринные заболевания;
- системные васкулиты.
Ухудшение притока крови к мозгу могут вызвать деформации и аномалии сосудов шеи, аорты и других крупных артерий. Это могут быть как сугубо сосудистые заболевания (например, аневризмы), так и повреждения, сдавливания сосудов соседними тканями и структурами (позвонками при остеохондрозе, опухолями).
Симптомы ишемии головного мозга
Заболевание достаточно коварное и на ранних стадиях может проявлять себя симптомами, на которые человек едва обращает внимание или не связывает их с деятельностью головного мозга. К примеру, потеря внимания, резкие смены настроения, нарушения сна (бессонница или, наоборот, сонливость). Чаще всего эти признаки списывают на рабочую усталость.
К примеру, потеря внимания, резкие смены настроения, нарушения сна (бессонница или, наоборот, сонливость). Чаще всего эти признаки списывают на рабочую усталость.
Однако позднее симптомы становятся явными и нарушают привычный ритм жизни человека.
-
Головокружение, тошнота.
-
Головные боли различной степени выраженности.
-
Забывчивость.
-
Ощущение холода в ступнях и ладонях.
-
Онемение конечностей.
Если на данном этапе не предпринять действий по устранению симптомов средствами медицины, заболевание будет быстро прогрессировать. Дальнейшие признаки уже невозможно игнорировать.
-
Временная потеря зрения (частично или полностью).
-
Проблемы с речью (несвязность, невнятность).

-
Головные боли до рвоты.
-
Бессонница.
-
Провалы в памяти.
-
Двигательные расстройства при ходьбе.
-
Нарушение ориентации во времени и пространстве.
Ситуация становится чрезвычайно опасной, так как при данных симптомах пациенту остается всего лишь один шаг до инсульта.
Диагностика ишемии сосудов головного мозга
Важнейший метод обследования при указанных симптомах – УЗИ сосудов головного мозга. «Золотым стандартом» является дуплексное сканирование брахиоцефальных артерий, эффективно выявляющее нарушения функциональности и структуры сосудов.
Объективную картину заболевания представляет также ультразвуковая транскраниальная допплерография сосудов головного мозга. Исследование показывает скорость кровотока, степень поражения сосудистых стенок и т.д.
Исследование показывает скорость кровотока, степень поражения сосудистых стенок и т.д.
Данные обследования проводит Центр патологии органов кровообращения CBCP. Для этого используется новейшее оборудование экспертного класса.
Степени ишемии сосудов головного мозга
В медицине принято классифицировать данную патологию по трем степеням. Наиболее сложной является ишемия головного мозга 3 степени.
1-я степень. Характеризуется легкими расстройствами внимания и интеллектуальной деятельности. Чаще всего пациенты справляются со сложными задачами, однако на это у них уходит больше времени. Явных ограничений жизнедеятельности и расстройств координации еще нет, однако мелкие признаки расстройства уже заметны:
-
шаркающая походка;
-
боли и онемения рук после физических нагрузок;
-
раздражительность;
-
частая слабость.

2-я степень. Пациент в ряде случаев слабо контролирует свои действия. При выполнении рабочих задач часто нуждается в помощи и подсказках, что негативно сказывается на профессиональной деятельности. Человек также может утратить часть жизненных навыков. Все чаще его мучают общие недомогания с характерными симптомами, описанными выше.
3-я степень. Появляются ярко выраженные неврологические расстройства в виде болезни Паркинсона, недержания мочи, проблем с координацией. Пациент может потерять способность самостоятельно передвигаться, так как плохо владеет ногами и теряет способность ориентироваться в пространстве. Возникают нарушения мышления, памяти, речи. При отсутствии медицинской помощи больного с ишемией 3-й степени ждут полный распад личности, ишемический инсульт, кровоизлияние в мозг.
Хроническая ишемия головного мозга
Симптомы хронической ишемии головного мозга развиваются постепенно, но с заметными проявлениями. Зачастую они связаны с нарушениями работы сердца, стенокардией, аритмией, сахарным диабетом, атеросклерозом периферических артерий, другими заболеваниями.
Зачастую они связаны с нарушениями работы сердца, стенокардией, аритмией, сахарным диабетом, атеросклерозом периферических артерий, другими заболеваниями.
Чаще всего хроническую фирму ишемия головного мозга приобретает при болезни 2-й степени. Для данного вида заболевания характерно длительное развитие без особых осложнений. Однако это вовсе не означает, что болезнь не прогрессирует. Обычно ухудшение здоровья наступает неожиданно. А спровоцировать его может любое нервное или физическое перенапряжение.
Хроническая ишемия не требует обязательной госпитализации.
Лечение ишемии сосудов головного мозга
Пациенту назначают комплексное лечение, в которое входят:
-
массажные и физиотерапевтические процедуры для улучшения кровоснабжения;
-
гипокситерапия для насыщения тканей кислородом;
-
медикаментозная терапия для нормализации артериального давления и восстановления кровообращения;
-
хирургическое вмешательство для удаления из сосудов атеросклеротических бляшек.

Лечение хронической ишемии головного мозга комбинируют с терапией для других органов и систем.
Прогноз и профилактика
Последствия ишемии сосудов головного мозга можно свести к минимуму, если своевременно обратиться к квалифицированному врачу. Сделать это нужно уже при появлении симптомов 1-й степени сложности. На данной стадии достаточно профилактических действий:
-
поддержания физической активности;
-
коррекции питания;
-
воздержания от нервных нагрузок.
Даже при симптомах 2-й степени тяжести прогноз положительный – при условии соблюдения пациентом всех назначений врача. Обращение за помощью на 3-й стадии развития болезни в большинстве случаев уже малоэффективно.
Лечение ишемии головного мозга в клинике CBCP
Если вы обратили внимание на появление у вас или у ваших близких явных симптомов ишемии головного мозга, в том числе хронической, обратитесь в клинику CBCP. К вашим услугам опытные врачи с высокой квалификацией и наиболее современные средства диагностики.
К вашим услугам опытные врачи с высокой квалификацией и наиболее современные средства диагностики.
Исследование ГМ и сосудов у пациентов с ишемическими атаками и последствиями НМК
Комплексная программа обследования головного мозга и сосудов предназначена для пациентов с подозрением на сосудистые заболевания головного мозга при ранее выявленном стенозе по УЗИ.
Врач рекомендует пройти исследование пациентам, у которых наблюдаются следующие симптомы:
- головокружения
- эпизодические потери сознания
- нарушение зрения, двоение предметов
- слабость в конечностях
- затрудненная речь
- ассиметрия лица
Когда назначается комплексная программа
Программа предназначена для пациентов с подозрением на следующие заболевания:
- цереброваскулярная болезнь
- инсульт
- транзиторные ишемические атаки
- димиелинизирующие заболевания
- опухоль головного мозга
- последствия черепно-мозговой травмы
- аневризма головного мозга
- метастазы в головной мозг
Преимущества комплексной программы над обычными исследованиями
Стандартное исследование головного мозга проводится от 20 до 30 минут, а его результаты не всегда отвечают на поставленные в направлении на исследование задачи. Множество пациентов неврологического профиля имеют направление от врача с назначением метода томографического исследования, не отвечающего его цели.
Множество пациентов неврологического профиля имеют направление от врача с назначением метода томографического исследования, не отвечающего его цели.
Комплексная программа позволяет оптимизировать диагностический этап лечебного процесса, снизить затраты, временной интервал между постановкой диагноза и началом лечения, а также может быть одним из оценочных критериев эффективности лечебного процесса.
Что покажет комплексное исследование головного мозга и сосудов
Наполнение Программы специализированными методиками, включая:
- DWI, GRE, бесконтрастная МР перфузия (ASL), позволит выявить нарушение мозгового кровообращения, также увидеть опухоли головного мозга, в том числе метастатические, воспалительные заболевания мозга
- МСКТ ангиография сосудов головы и шеи даст врачу понимание о состоянии кровеносных сосудов (окклюзия, атеросклеротическая бляшка и др.), кровоснабжающих головной мозг
- Лабораторная диагностика укажет на основные показатели обменных и воспалительных процессов
Рэмси Диагностика предлагает пройти полный комплекс исследований входящих в комплексную программу «Обследование головного мозга и сосудов у пациентов с ишемическими атаками и последствиями НМК» всего за 1 час.
Диагностику проведут опытные специалисты — рентгенологи Москвы и Петербурга высшей квалификационной категории, использующие в своей работе передовой опыт ведущих зарубежных клиник. Полученные результаты помогу вашему лечащему врачу поставить правильный диагноз и назначить эффективное лечение.
Хроническая ишемия головного мозга — излечимо ли это?
Ишемия головного мозга – это состояние, которое развивается в ответ на кислородное голодание вследствие недостаточности мозгового кровообращения.
Выделяют острую и хроническую ишемию головного мозга. Острая ишемия возникает при резком развитии кислородного голодания и протекает по типу транзиторной ишемической атаки или ишемического инсульта (инфаркта мозга). Хроническая ишемия формируется постепенно в ответ на длительно существующую недостаточность мозгового кровообращения.
В данной статье мы рассмотрим хроническую ишемию головного мозга.
Хроническая ишемия мозга — особая разновидность сосудистой церебральной патологии, обусловленная медленно прогрессирующим диффузным нарушением кровоснабжения головного мозга с постепенно нарастающими разнообразными дефектами его функционирования. Термин «хроническая ишемия мозга» используется в соответствии с Международной классификацией болезней 10-го пересмотра вместо применявшегося ранее термина «дисциркуляторная энцефалопатия».
Термин «хроническая ишемия мозга» используется в соответствии с Международной классификацией болезней 10-го пересмотра вместо применявшегося ранее термина «дисциркуляторная энцефалопатия».
Причины развития хронической ишемии головного мозга
Причины развития хронической ишемии мозга тесно связаны с атеросклеротическими стенозами, тромбозами, эмболиями. Определенную роль играют посттравматическое расслоение позвоночных артерий, экстравазальные (внесосудистые) компрессии при патологии позвоночника или мышц шеи, деформация артерий с постоянными или периодическими нарушениями их проходимости, гемореологические изменения крови. Необходимо иметь в виду, что симптоматика, аналогичная той, что имеет место при хронической ишемии, может быть обусловлена не только сосудистыми, но и другими факторами — хронической инфекцией, неврозами, аллергическими состояниями, злокачественными опухолями и прочими причинами, с которыми следует проводить дифференциальный диагноз.
Признаки нарушения мозгового кровотока наблюдаются при таких заболеваниях:
-
гипертонической болезни,
-
атеросклерозе,
-
гипотонии,
-
васкулитах (воспалениях сосудов) аллергической и инфекционной этиологии,
-
облитерирующем тромбангиите,
-
травмах черепа,
-
аномалиях сосудистого русла мозга и аневризмах,
-
нарушениях в сердечной деятельности,
-
болезнях крови,
-
эндокринной патологии,
-
заболеваниях почек и других болезнях.

Развитию хронической ишемии мозга способствует ряд причин, которые принято называть факторами риска. Факторы риска делятся на корригируемые и некорригируемые. К некорригируемым факторам относятся пожилой возраст, пол, наследственная предрасположенность. Известно, например, что инсульт или энцефалопатия у родителей увеличивает вероятность сосудистых заболеваний у детей. На эти факторы нельзя повлиять, но они помогают заранее выявить лиц с повышенным риском развития сосудистой патологии и помочь предотвратить развитие болезни. Основными корригируемыми факторами развития хронической ишемии являются атеросклероз и гипертоническая болезнь. Сахарный диабет, курение, алкоголь, ожирение, недостаточная физическая нагрузка, нерациональное питание — причины, приводящие к прогрессированию атеросклероза и ухудшению состояния больного. В этих случаях нарушается свертывающая и противосвертывающая система крови, ускоряется развитие атеросклеротических бляшек. За счет этого просвет артерии уменьшается или полностью закупоривается. При этом особую опасность представляет кризовое течение гипертонической болезни: оно приводит к возрастанию нагрузки на сосуды головного мозга.
При этом особую опасность представляет кризовое течение гипертонической болезни: оно приводит к возрастанию нагрузки на сосуды головного мозга.
Симптомы и стадии развития хронической ишемии головного мозга
Хроническая ишемия ГМ – это прогрессирующее заболевание, которое сопровождается нарастающими нарушениями работы центральной, периферической и вегетативной нервной системы. Первые признаки заболевания часто остаются незамеченными, так как не имеют каких-либо острых проявлений, а выражаются в общем недомогании, головных болях, сонливости, рассеянности, раздражительности. Обычно такое состояние списывается на переутомление либо возрастные изменения, однако, под ним может скрываться дебют ишемии головного мозга. Вовремя обратиться за медицинской помощью очень важно.
Проявления хронической ишемии мозга делятся на три стадии: начальных проявлений, субкомпенсации и декомпенсации.
В 1-й стадии доминируют субъективные расстройства в виде головных болей и ощущения тяжести в голове, общей слабости, повышенной утомляемости, эмоциональной лабильности, головокружения, снижения памяти и внимания, нарушения сна. Эти явления сопровождаются хотя и легкими, но достаточно стойкими объективными расстройствами в виде анизорефлексии (разность симметричных сухожильных рефлексов), дискоординаторных явлений, глазодвигательной недостаточности, симптомов орального автоматизма, снижения памяти и астении. В этой стадии, как правило, еще не происходит формирования отчетливых неврологических синдромов (кроме астенического) и при адекватной терапии возможно уменьшение выраженности или устранение как отдельных симптомов, так и заболевания в целом.
Эти явления сопровождаются хотя и легкими, но достаточно стойкими объективными расстройствами в виде анизорефлексии (разность симметричных сухожильных рефлексов), дискоординаторных явлений, глазодвигательной недостаточности, симптомов орального автоматизма, снижения памяти и астении. В этой стадии, как правило, еще не происходит формирования отчетливых неврологических синдромов (кроме астенического) и при адекватной терапии возможно уменьшение выраженности или устранение как отдельных симптомов, так и заболевания в целом.
В жалобах больных со 2-й стадией ХИМ чаще отмечаются нарушения памяти, потеря трудоспособности, головокружение, неустойчивость при ходьбе, реже присутствуют проявления астенического симптомокомплекса. При этом более отчетливой становится очаговая симптоматика: оживление рефлексов орального автоматизма, центральной недостаточности лицевого и подъязычного нервов, координаторные и глазодвигательные расстройства, пирамидная недостаточность, амиостатический синдром, усиление мнестико-интеллектуальных нарушений. В этой стадии возможно вычленить определенные доминирующие неврологические синдромы — дискоординаторный, пирамидный, амиостатический, дисмнестический и др., которые могут помочь при назначении симптоматического лечения. На этом этапе уже нарушается социальная и трудовая активность больного, в некоторых случаях даже в повседневных делах уже требуется помощь посторонних людей. Полностью обратить изменения, произошедшие в нервной системе невозможно, но можно нивелировать симптоматику и замедлить прогрессирование заболевания.
В этой стадии возможно вычленить определенные доминирующие неврологические синдромы — дискоординаторный, пирамидный, амиостатический, дисмнестический и др., которые могут помочь при назначении симптоматического лечения. На этом этапе уже нарушается социальная и трудовая активность больного, в некоторых случаях даже в повседневных делах уже требуется помощь посторонних людей. Полностью обратить изменения, произошедшие в нервной системе невозможно, но можно нивелировать симптоматику и замедлить прогрессирование заболевания.
При 3-й стадии ХИМ более выраженными оказываются объективные неврологические расстройства в виде дискоординаторного, пирамидного, псевдобульбарного, амиостатического, психоорганического синдромов. Чаще наблюдаются пароксизмальные состояния — падения, обмороки. В стадии декомпенсации возможны нарушения мозгового кровообращения в виде «малых инсультов», или пролонгированного обратимого ишемического неврологического дефицита, длительность очаговых расстройств при котором составляет от 24 ч до 2 нед. При этом клиника диффузной недостаточности кровоснабжения мозга соответствует таковой при энцефалопатии средней степени выраженности. Другим проявлением декомпенсации могут быть прогрессирующий «законченный инсульт» и остаточные явления после него. Этой стадии процесса при диффузном поражении соответствует клиническая картина выраженной энцефалопатии. Очаговая симптоматика нередко сочетается с диффузными проявлениями мозговой недостаточности. Лечение на данной стадии имеет скорее поддерживающий характер, так как большая часть повреждений головного мозга и утраченных вследствие этого функций необратима.
При этом клиника диффузной недостаточности кровоснабжения мозга соответствует таковой при энцефалопатии средней степени выраженности. Другим проявлением декомпенсации могут быть прогрессирующий «законченный инсульт» и остаточные явления после него. Этой стадии процесса при диффузном поражении соответствует клиническая картина выраженной энцефалопатии. Очаговая симптоматика нередко сочетается с диффузными проявлениями мозговой недостаточности. Лечение на данной стадии имеет скорее поддерживающий характер, так как большая часть повреждений головного мозга и утраченных вследствие этого функций необратима.
Наряду с прогрессированием неврологической симптоматики, по мере развития патологического процесса в нейронах головного мозга, происходит нарастание когнитивных расстройств. Это касается не только памяти и интеллекта, нарушающихся в 3-й стадии до уровня деменции, но и таких нейропсихологических синдромов, как праксис (способность выполнять последовательные комплексы сознательных произвольных движений и совершать целенаправленные действия по выработанному индивидуальной практикой плану) и гнозис (узнавание объектов (предметов, лиц) при сохранности элементарных форм чувствительности, зрения, слуха. Начальные, по существу субклинические расстройства этих функций наблюдаются уже в 1-й стадии, затем они усиливаются, видоизменяются, становятся отчетливыми. 2-я и особенно 3-я стадии болезни характеризуются яркими нарушениями высших мозговых функций, что резко снижает качество жизни и социальную адаптацию больных.
Начальные, по существу субклинические расстройства этих функций наблюдаются уже в 1-й стадии, затем они усиливаются, видоизменяются, становятся отчетливыми. 2-я и особенно 3-я стадии болезни характеризуются яркими нарушениями высших мозговых функций, что резко снижает качество жизни и социальную адаптацию больных.
Независимо от того, в какой стадии обнаруживаются признаки хронической ишемии головного мозга, важно как можно быстрее обратиться к врачу, так как на ранней стадии заболевания изменения ещё обратимы, а на более поздних возможно приостановить прогрессирование болезни и улучшить качество жизни и социальной адаптации.
Диагностика хронической ишемии головного мозга
С подозрениями на хроническую ишемию головного мозга и любые другие нарушения мозгового кровообращения необходимо обратиться к неврологу. В клинике неврологии «Аксимед» опытный специалист во время консультации изучит жалобы больного, уточнит его личный и семейный анамнез, проведёт физикальное обследование и неврологические тесты.
Обязательные обследования, которые назначит врач, следующие:
-
лабораторные исследования крови
-
консультация офтальмолога
-
МРТ головного мозга
-
допплерография сосудов головы и шеи
-
электроэнцефалограмма
-
консультация терапевта
-
рентгенография шейного отдела позвоночника
-
и другие исследования по показаниям
Лечение хронической ишемии головного мозга
В зависимости от стадии заболевания, его причин и состояния больного может быть выбрана различная тактика лечения.
В первую очередь лечебные мероприятия будут направлены на устранение причин ишемии. Для этих целей применяют лекарственные препараты (снижающие артериальное давление, уменьшающие уровень холестерина и вязкость крови, снижающие повышенный уровень глюкозы крови, нейрометаболики, венотоники, улучшающие когнитивные функции и другие. В комплексе лечебных мероприятий успешно используют физиотерапию, лечебные массажи. По показаниям проводят оперативное вмешательство — при наличии опухолей, аневризмах сосудов, тяжёлых сердечных пороках.
Для этих целей применяют лекарственные препараты (снижающие артериальное давление, уменьшающие уровень холестерина и вязкость крови, снижающие повышенный уровень глюкозы крови, нейрометаболики, венотоники, улучшающие когнитивные функции и другие. В комплексе лечебных мероприятий успешно используют физиотерапию, лечебные массажи. По показаниям проводят оперативное вмешательство — при наличии опухолей, аневризмах сосудов, тяжёлых сердечных пороках.
При лечении ишемии головного мозга 2 и 3 степени больному необходимы реабилитационные мероприятия, которые замедлят развитие болезни, будут способствовать нивелированию симптоматики, социальной адаптации и улучшению качества жизни. В центре реабилитации «Аксимед» для пациента будет разработана индивидуальная программа восстановления, учитывая текущее состояние больного, степень поражения головного мозга и прогнозы невролога.
Неврологи клиники “Аксимед” напоминают, при своевременном начале лечения хронической ишемии головного мозга прогнозы позитивные, однако, заболевание склонно к прогрессированию и осложнениям, поэтому при наличии данного диагноза необходимо регулярно проходить диспансерное обследование и соблюдать предписания врача относительно лекарственных препаратов, диеты и здорового образа жизни.
Ишемия головного мозга — StatPearls — Книжная полка NCBI
Непрерывное обучение
Ишемия головного мозга — распространенный механизм острой травмы головного мозга, которая возникает в результате нарушения кровотока в головном мозге. Ишемия головного мозга требует неотложной медицинской помощи; без лечения это может привести к инфаркту мозга или глобальной гипоксически-ишемической энцефалопатии, что может привести к смерти или стойкой инвалидности. В этом упражнении рассматриваются этиология, эпидемиология, патофизиология, оценка и лечение церебральной ишемии, а также подчеркивается роль межпрофессиональной группы в оценке и лечении пациентов с этим заболеванием.
Цели:
Определить этиологию церебральной ишемии.
Опишите соответствующее обследование пациента с подозрением на церебральную ишемию.
Обобщите доступные варианты лечения церебральной ишемии.

Введение
Человеческий мозг — очень метаболически активный орган, на который приходится около 25% метаболических потребностей человека, хотя он состоит только из двух.5% от массы тела типичного человека. Следовательно, мозг чрезвычайно чувствителен к нарушениям кровотока. Сложные гомеостатические механизмы действуют для поддержания церебрального кровотока на относительно стабильной скорости около 50 мл / 100 г ткани мозга в минуту посредством процесса, известного как цереброваскулярная ауторегуляция. Когда этот кровоток нарушается, возникает церебральная ишемия, один из наиболее распространенных механизмов дисфункции и повреждения мозга. Степень повреждения нейронов в результате нарушения церебральной перфузии зависит как от степени, так и от продолжительности гипоперфузии.
Этиология
Ишемия головного мозга может быть глобальной или очаговой. Глобальная ишемия головного мозга — результат системных процессов, часто шока. Наиболее частой причиной глобальной ишемии головного мозга является системная гипотензия. Преходящая церебральная гипоперфузия может возникать при нарушении вегетативных и нейрогормональных механизмов, контролирующих артериальное давление и частоту сердечных сокращений, как при вазовагальных обмороках и синдромах постуральной тахикардии. Структурные и функциональные проблемы с сердцем, в основном аритмии, являются второй по частоте причиной преходящей глобальной ишемии головного мозга.Когда эффект временный, состояние часто проявляется в виде предобморочного состояния или обморока. С другой стороны, длительная глобальная ишемия может привести к стойкому неврологическому повреждению [1].
Преходящая церебральная гипоперфузия может возникать при нарушении вегетативных и нейрогормональных механизмов, контролирующих артериальное давление и частоту сердечных сокращений, как при вазовагальных обмороках и синдромах постуральной тахикардии. Структурные и функциональные проблемы с сердцем, в основном аритмии, являются второй по частоте причиной преходящей глобальной ишемии головного мозга.Когда эффект временный, состояние часто проявляется в виде предобморочного состояния или обморока. С другой стороны, длительная глобальная ишемия может привести к стойкому неврологическому повреждению [1].
Напротив, очаговая ишемия головного мозга чаще всего возникает из-за препятствия артериальному кровотоку к мозгу, часто в результате тромбоза или эмболии. Если ишемия сохраняется достаточно долго, происходит необратимая потеря нейронов, что приводит к ишемическому инсульту. Внезапный тромбоз бляшки с разрывом ранее стенозированной церебральной или внутренней сонной артерии приведет к ишемии в области, снабжаемой пораженной артерией. Эмболизация сгустка, образовавшегося в сердце или крупной артерии, является наиболее частым источником ишемии головного мозга, составляя от 60% до 70% случаев ТИА головного мозга и инсультов. Возможны эмболы из других материалов, таких как жир, воздух ятрогенного происхождения или околоплодные воды во время беременности, но гораздо реже.
Эмболизация сгустка, образовавшегося в сердце или крупной артерии, является наиболее частым источником ишемии головного мозга, составляя от 60% до 70% случаев ТИА головного мозга и инсультов. Возможны эмболы из других материалов, таких как жир, воздух ятрогенного происхождения или околоплодные воды во время беременности, но гораздо реже.
Есть и другие редкие причины ишемии. Рассечение шейных кровеносных сосудов редко может вызывать ишемию головного мозга, а у молодых пациентов может быть причиной инсульта. Спазм сосудов — относительно редкая вторичная причина ишемии головного мозга.Это может быть спровоцировано лекарствами или может быть вторичным по отношению к травме, воспалению или недавнему субарахноидальному кровоизлиянию. В редких случаях инфекция может привести к инсульту. Примечательно, что COVID-19 увеличивает частоту инсульта. [2]
Одним из простых методов классификации причин ишемии головного мозга и ишемического инсульта является критерий TOAST. [3] Это подразделяет этиологию ишемического инсульта на категории заболеваний крупных артерий (обычно вторичных по отношению к атеросклерозу, окклюзионных), кардиоэмболических (сердечные причины, такие как фибрилляция предсердий, клапанные аномалии или аномалии движения стенки сердца), окклюзионных заболеваний мелких сосудов (поражает мелкие перфорирующие артерии. , часто вторичный по отношению к основной гипертонии), инсульт другой этиологии (известная этиология инсульта, например, васкулит или употребление наркотиков) или инсульт неизвестной этиологии (также называемый криптогенным инсультом, причина не обнаружена после медицинского обследования).
, часто вторичный по отношению к основной гипертонии), инсульт другой этиологии (известная этиология инсульта, например, васкулит или употребление наркотиков) или инсульт неизвестной этиологии (также называемый криптогенным инсультом, причина не обнаружена после медицинского обследования).
Эпидемиология
Инсульт является одним из наиболее распространенных сосудистых заболеваний в мире и неизменно занимает пятое место среди причин смерти в Соединенных Штатах. В отчете AHA за 2019 год о статистике сердечных заболеваний и инсульта говорится, что 20 миллионов американцев старше 20 лет перенесли инсульт. Приблизительно 795 000 человек ежегодно переносят инсульт. [4] Распространенность увеличивается с возрастом, и почти 75% случаев поражают людей старше 65 лет. Распространенность инсультов выше среди афроамериканцев и латиноамериканцев, чем среди кавказцев.Распространенность инсульта примерно одинакова как у женщин, так и у мужчин, с небольшим преобладанием женщин, поскольку за последние 15 лет распространенность у мужчин снизилась.
Инсульт — это широкий термин, обозначающий неврологическое повреждение, вызванное любой сосудистой причиной. Ишемический инсульт — самый распространенный тип инсульта, составляющий 87% всех инсультов. Они вызваны острой ишемией области мозга, снабжаемой одной артерией (очаговая ишемия), и являются одной из основных причин инвалидности и смерти в США и во всем мире.Обморок, последствие временной ишемии всего мозга (глобальная ишемия), является одним из наиболее распространенных «симптомов» во всех популяциях. Итак, ишемия мозга — одна из самых частых причин инвалидности в мире.
Патофизиология
Ишемия головного мозга в широком смысле слова может быть фокальной или мультифокальной, вызванной внезапным закрытием или значительным уменьшением диаметра артерии, снабжающей область мозга, будь то ранее стенозированные или нормальные артерии (то есть аорта, над- ствол аорты или внутричерепные артерии).Ишемия головного мозга часто может быть вызвана отсутствием глобального кровоснабжения головного мозга, что связано с более проксимальными причинами гемодинамической дисфункции, вызывающими внезапное падение артериального давления [5].
Ишемическая ткань головного мозга перестает работать в течение нескольких секунд и подвергается некрозу уже через 5 минут после полного отсутствия поступления кислорода и глюкозы, по сравнению с 20-40 минутами в других частях тела. Некоторые области особенно подвержены ишемии, явлению, известному как избирательная уязвимость. Эти области включают артериальные пограничные зоны, пирамидные клетки в области СА1 гиппокампа и клетки Пуркинье мозжечка.Артериальные пограничные зоны также известны как водоразделы; одним из распространенных мест является верхняя выпуклость головного мозга, которая представляет собой область между территориями передней и средней церебральных артерий, которая очень чувствительна к снижению церебрального перфузионного давления. Причина избирательной уязвимости конкретных типов нейронов до конца не изучена, но считается, что это связано с вариациями в экспрессии возбуждающих рецепторов нейротрансмиттеров глутамата на нейронах.
Стойкие осложнения ишемии головного мозга возникают из-за необратимого повреждения головного мозга и являются последним общим путем к некрозу: сокращение и гибель нейронов, глиоз с астроцитозом и потеря объема. Чувствительность нейронов к ишемии многофакторна: мозг имеет высокую базальную скорость метаболизма, а высокая передача сигналов между клетками активирует такие пути, как гибель нейронов, вызванная глутаматом, потенцирование ишемического повреждения, вызванное допамином, высвобождение свободных радикалов, токсичность цинка и высвобождение ферментов что приводит к сочетанию апоптоза и катаболического некроза. [6]
Чувствительность нейронов к ишемии многофакторна: мозг имеет высокую базальную скорость метаболизма, а высокая передача сигналов между клетками активирует такие пути, как гибель нейронов, вызванная глутаматом, потенцирование ишемического повреждения, вызванное допамином, высвобождение свободных радикалов, токсичность цинка и высвобождение ферментов что приводит к сочетанию апоптоза и катаболического некроза. [6]
Гистопатология
При глобальном ишемическом повреждении гистологические изменения становятся очевидными в течение 12–24 часов после повреждения. Первые видимые изменения — это сокращение или набухание нейронов.После этого «красные нейроны» могут развиться как следствие цитоплазматической эозинофилии, ядерного пикноза и других некротических изменений. Также могут стать очевидными другие признаки отека, такие как пустые области в паренхиме с расширенными перицеллюлярными и периваскулярными пространствами.
Грубо говоря, это может выглядеть как нерегулярные зоны обесцвечивания с размытием зон между серым и белым веществом. Со временем это перерастает в потерю нейронов и глиоз. В то время как большинство частей тела, пораженных ишемией, подвергаются коагулятивному некрозу, мозг уникален тем, что подвергается разжижающему некрозу.Под микроскопом он выглядит как вязкий материал, содержащий многочисленные воспалительные клетки, такие как нейтрофилы и клеточные остатки.
Со временем это перерастает в потерю нейронов и глиоз. В то время как большинство частей тела, пораженных ишемией, подвергаются коагулятивному некрозу, мозг уникален тем, что подвергается разжижающему некрозу.Под микроскопом он выглядит как вязкий материал, содержащий многочисленные воспалительные клетки, такие как нейтрофилы и клеточные остатки.
Анамнез и физика
Самая важная часть оценки любого пациента с неврологическими симптомами — это анамнез подающей жалобы. Ишемия головного мозга приводит к негативным симптомам, связанным с потерей функции ишемизированной ткани. Глобальная ишемия головного мозга обычно проявляется изменением сознания. Кратковременное изменение сознания, такое как обморок или предобморочное состояние, может быть вызвано такими маневрами, как стояние, что может привести к падению церебрального перфузионного давления.Часто симптомы облегчаются при опускании головы пациента. Тяжелая или стойкая глобальная ишемия головного мозга может привести к тому, что пациент попадет в кому.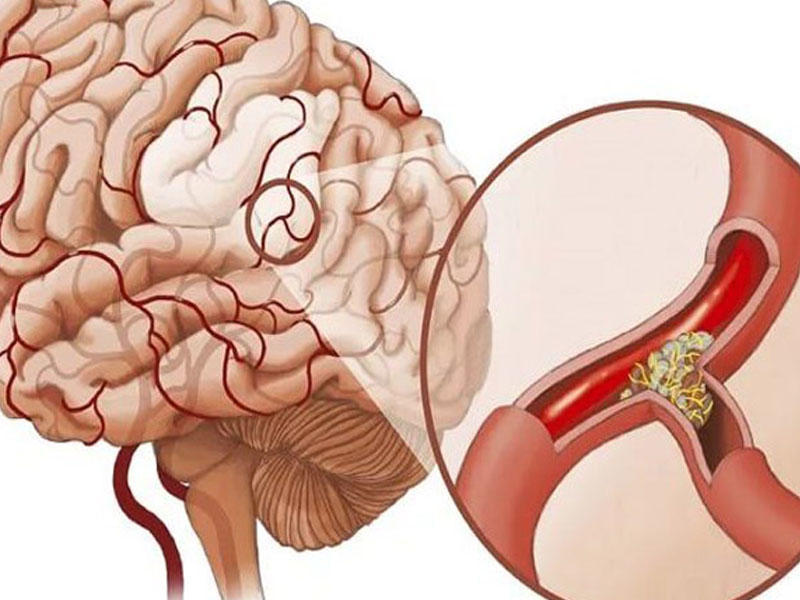
Симптомы очаговой церебральной ишемии будут зависеть от конкретных ишемических участков мозга. Важно установить время начала и продолжительность подачи жалобы, поскольку это может существенно повлиять на решения о лечении. Идеально определить время появления симптомов, но это может быть невозможно.В случаях, когда точное начало не может быть определено, принятие клинического решения определяется последним известным временем, когда пациент был нормальным. [7]
Квалифицированные врачи учатся распознавать специфические синдромы инсульта, которые представляют собой паттерны неврологической дисфункции, связанные с закупоркой определенных кровеносных сосудов. Например, поражения полушарий головного мозга могут привести к контралатеральной слабости и / или потере чувствительности. Признаки корковой дисфункции вызывают беспокойство по поводу обструкции крупной артерии, например, окклюзии средней мозговой артерии.Корковая дисфункция в доминирующем полушарии — обычно в левом — часто приводит к афазии. Недоминантная корковая дисфункция обычно представляет собой геминеглект, хотя это также можно увидеть при инфаркте доминирующего полушария. Другие потенциальные признаки коркового поражения могут включать дефекты поля зрения, акалькулию и гемиагнозию. Инсульты, связанные с патологией заднего кровообращения, например, вертебробазилярной системы, могут проявляться атаксией, диплопией или офтальмопарезом или перекрестными проявлениями. Раннее распознавание синдромов инсульта, связанных с окклюзией крупных сосудов, имеет решающее значение, поскольку эти пациенты могут быть кандидатами на эндоваскулярную тромбэктомию, что более подробно обсуждается ниже.
Недоминантная корковая дисфункция обычно представляет собой геминеглект, хотя это также можно увидеть при инфаркте доминирующего полушария. Другие потенциальные признаки коркового поражения могут включать дефекты поля зрения, акалькулию и гемиагнозию. Инсульты, связанные с патологией заднего кровообращения, например, вертебробазилярной системы, могут проявляться атаксией, диплопией или офтальмопарезом или перекрестными проявлениями. Раннее распознавание синдромов инсульта, связанных с окклюзией крупных сосудов, имеет решающее значение, поскольку эти пациенты могут быть кандидатами на эндоваскулярную тромбэктомию, что более подробно обсуждается ниже.
Поскольку исходы инсульта в значительной степени зависят от времени до лечения, неврологическое сообщество предприняло многочисленные усилия по информированию общественности о признаках и симптомах острого инсульта. Один из распространенных мнемоник — БЫТЬ БЫСТРО: Баланс — потеря равновесия, Глаза — изменение зрения, Опущение лица, Руки — асимметрия силы верхних конечностей, Речь — трудности с речью или невнятной речи и Время — чтобы предупредить публику о том, что время больница необходима для лечения.
В дополнение к определению времени появления симптомов, необходимо получить целенаправленный медицинский анамнез.Необходимо установить наличие сосудистых факторов риска, таких как гипертония, сахарный диабет, фибрилляция предсердий, гиперлипидемия и злоупотребление табаком, поскольку эта информация может дать ключ к разгадке этиологии инсульта. Текущий список лекарств также важен, потому что внутривенные тромболитики, которые часто используются для лечения ишемического инсульта, противопоказаны пациентам, принимающим антикоагулянты.
Физическая оценка должна быть направлена на выявление признаков неврологической дисфункции с целью определения местоположения поражения головного мозга.Одним из инструментов, обычно используемых врачами для оценки инсульта, является Шкала инсульта NIH [8]. Это скрининговое обследование позволяет быстро оценить уровень сознания пациента, глазодвигательную функцию, поля зрения, двигательную функцию, ощущения, функцию мозжечка, язык и внимание или пренебрежение. Результаты экзаменов оцениваются по шкале от 0 до 40, что облегчает общение между поставщиками услуг и позволяет отслеживать колебания дефицита во времени.
Результаты экзаменов оцениваются по шкале от 0 до 40, что облегчает общение между поставщиками услуг и позволяет отслеживать колебания дефицита во времени.
Оценка
Первоначальное обследование симптомов, указывающих на церебральную ишемию, должно включать базовые лабораторные исследования, включая определение уровня глюкозы в крови, общий анализ крови, химию, факторы свертывания крови, ЭКГ и сердечные ферменты.Статическая неконтрастная компьютерная томография головы должна быть сделана, чтобы исключить кровоизлияние или массовое поражение. [9] Визуализация сосудов, такая как КТ-ангиограмма или МР-ангиограмма, может быть очень полезной в острых случаях. Визуализация сосудов может помочь определить этиологию инсульта, особенно в случаях атеросклероза крупных сосудов; в случае острой окклюзии крупных сосудов место обструкции сосуда может быть очевидным.
Часто при остром ишемическом инсульте КТ головки без контрастирования может не выявить заметных отклонений от нормы, особенно если пациент обратился за помощью в начале болезни. В этом случае перфузия МРТ или КТ может быть полезной для определения жизнеспособности ишемической ткани. Поскольку судьба ишемической нейрональной ткани зависит как от степени и продолжительности ишемии, у пациентов с острой фокальной церебральной ишемией часто имеется область инфаркта мозговой ткани (основной инфаркт), окруженная большей областью ишемизированного мозга, которая все еще может быть повреждена. жизнеспособный. Эта потенциально жизнеспособная область известна как полутень. В последнее десятилетие было проведено обширное исследование методов нейровизуализации для определения объема ишемической полутени.[10] [11] [12]
В этом случае перфузия МРТ или КТ может быть полезной для определения жизнеспособности ишемической ткани. Поскольку судьба ишемической нейрональной ткани зависит как от степени и продолжительности ишемии, у пациентов с острой фокальной церебральной ишемией часто имеется область инфаркта мозговой ткани (основной инфаркт), окруженная большей областью ишемизированного мозга, которая все еще может быть повреждена. жизнеспособный. Эта потенциально жизнеспособная область известна как полутень. В последнее десятилетие было проведено обширное исследование методов нейровизуализации для определения объема ишемической полутени.[10] [11] [12]
Хотя тщательный анализ методов визуализации острого инсульта выходит за рамки данной статьи, важно понимать, что пациентам с подозрением на окклюзию крупных сосудов может быть полезна расширенная визуализация для определения кандидатуры эндоваскулярных заболеваний. вмешательства. Если у пациента наблюдаются симптомы окклюзии крупных сосудов, включая признаки цереброкортикальной ишемии, следует рассмотреть вопрос о переводе в центр комплексного лечения инсульта или центр лечения тромбэктомии.
Лечение / ведение
Лечение глобальной ишемии головного мозга обычно направлено на устранение основной причины. Для обеспечения адекватного церебрального кровотока необходимо проводить поддерживающую терапию; это можно облегчить, поместив пациента на горизонтальную поверхность или в положение Тренделенбурга, пока принимаются другие поддерживающие меры.
В случае острого ишемического инсульта первоочередной задачей является определение того, подходит ли пациент для лечения острой реперфузии.Внутривенные тромболитики используются для лечения острого ишемического инсульта более 25 лет. Активатор тканевого плазминогена (ТРА) в настоящее время является единственным тромболитическим агентом, одобренным Управлением по контролю за продуктами и лекарствами для лечения острого ишемического инсульта, хотя исследования эффективности тенектеплазы продолжаются. [13] TPA одобрен для лечения острого ишемического инсульта, если его можно ввести в течение 3 часов с момента появления симптомов; тем не менее, исследования показывают, что он может быть безопасным и эффективным, если ввести до 4. 5 часов после появления симптомов. [14]
5 часов после появления симптомов. [14]
Пациентам с острым ишемическим инсультом из-за окклюзии большого сосуда может быть показана механическая тромбэктомия. Как обсуждалось выше, определение того, является ли пациент кандидатом на тромбэктомию, зависит от времени появления симптомов, тяжести дефицита пациента, локализации окклюзии большого сосуда и жизнеспособности ишемической ткани. Пациенты с подозрением на окклюзию крупных сосудов должны быть переведены в центр комплексного лечения инсульта или центр с возможностью тромбэктомии как можно скорее.Однако решение о переводе пациента не должно откладывать или препятствовать лечению тромболитиками, если пациент также соответствует критериям TPA.
Вне острого периода лечение ишемического инсульта направлено на вторичную профилактику и ускорение выздоровления. Для оценки факторов риска инсульта, включая сахарный диабет, гипертензию, употребление табака, гиперлипидемию и фибрилляцию предсердий, необходим подробный медицинский анамнез. Следует оптимизировать управление факторами риска, чтобы свести к минимуму риск повторного инсульта.Большинству выживших после инсульта антиагреганты, такие как аспирин или клопидогрель, показаны для вторичной профилактики инсульта. При некоторых подтипах инсульта короткий курс двойной антитромбоцитарной терапии с аспирином и клопидогрелом может снизить риск раннего рецидива [15].
Следует оптимизировать управление факторами риска, чтобы свести к минимуму риск повторного инсульта.Большинству выживших после инсульта антиагреганты, такие как аспирин или клопидогрель, показаны для вторичной профилактики инсульта. При некоторых подтипах инсульта короткий курс двойной антитромбоцитарной терапии с аспирином и клопидогрелом может снизить риск раннего рецидива [15].
Кроме того, было доказано, что высокоинтенсивная терапия статинами дает положительный эффект. [16] При инсульте, связанном с мерцательной аритмией, показаны антикоагулянты; Ингибиторы фактора Ха предпочтительнее варфарина из-за улучшенных профилей безопасности.[17] Пациентам с симптоматическим стенозом сонной артерии, например, гемодинамически значимым стенозом сонной артерии на стороне инсульта или транзиторной ишемической атакой, необходимо провести каротидную эндартерэктомию или стентирование.
Всем лицам, пережившим инсульт, следует поощрять отказ от курения, поддержание идеальной массы тела и регулярные физические упражнения. Фактически, есть доказательства того, что изменение образа жизни приносит больше пользы, чем лекарства для профилактики инсульта. [18] Чтобы способствовать оптимальному выздоровлению, пациенты с острым инсультом должны лечиться в рамках междисциплинарных бригад, включая профессиональных терапевтов, физиотерапевтов и логопедов.
Фактически, есть доказательства того, что изменение образа жизни приносит больше пользы, чем лекарства для профилактики инсульта. [18] Чтобы способствовать оптимальному выздоровлению, пациенты с острым инсультом должны лечиться в рамках междисциплинарных бригад, включая профессиональных терапевтов, физиотерапевтов и логопедов.
Дифференциальный диагноз
Дифференциальный диагноз симптомов, подобных ишемическому инсульту, включает гипогликемию, электролитный дисбаланс, такой как гипонатриемия, употребление наркотиков, инфекции, включая менингит, кардиогенный обморок, ТИА, васкулит, мигрень, опухоль, кровоизлияние в мозг и судороги.
Прогноз
В зависимости от продолжительности ишемии головного мозга может наблюдаться легкая дисфункция головного мозга, длительная дисфункция с необратимым повреждением головного мозга, с постоянными симптомами и инвалидностью или без них.
Результаты для пациентов после церебральной ишемии могут варьироваться от отсутствия постоянных эффектов (транзиторная ишемическая атака) до постоянной инвалидности до смерти. Тяжесть нарушения связана с функциональным статусом пациента до ишемического события. Например, пациенты с легкими когнитивными нарушениями или деменцией имели более выраженные относительные когнитивные нарушения после ишемического инсульта, что свидетельствует о более низкой толерантности нейронов к ишемии [19]. Это также связано с возрастом пациента. [20]
Тяжесть нарушения связана с функциональным статусом пациента до ишемического события. Например, пациенты с легкими когнитивными нарушениями или деменцией имели более выраженные относительные когнитивные нарушения после ишемического инсульта, что свидетельствует о более низкой толерантности нейронов к ишемии [19]. Это также связано с возрастом пациента. [20]
Осложнения
Хотя быстрая реперфузия после ишемии / инфаркта необходима для сохранения неврологической функции, она может ускорить тканевую дисфункцию и некроз клеток в результате разрушения обратимо поврежденных клеток.Церебральная ишемия-реперфузионное повреждение может возникнуть после тромболизиса или механической тромбэктомии. Хотя это восстанавливает мозговой поток и спасает обратимо поврежденную ткань, реперфузия после более длительного периода ишемии может вызвать более крупный инфаркт, чем первоначальная окклюзия. Механизм этого повреждения включает инфильтрацию лейкоцитов, активацию тромбоцитов, активацию комплемента и нарушение гематоэнцефалического барьера, что приводит к вазогенной ишемии. [21]
[21]
Еще одним осложнением является преобразование в геморрагический инсульт после tPA.Следует серьезно подумать, если состояние пациента ухудшается после тромболитических приемов. Симптомы могут включать изменение сознания или сознания, ухудшение неврологического осмотра, усиление слабости, новую или усиливающуюся головную боль или изменения артериального давления или пульса. Если это произойдет, первым делом следует незамедлительно провести КТ головного мозга, обратиться в базовые лаборатории и проконсультироваться в нейрохирургии.
Пациенты с острым ишемическим инсультом также подвержены риску осложнений, связанных с неподвижностью, включая инфекции и тромбоэмболические осложнения.Из-за риска аспирации пациенты должны пройти обследование глотания перед тем, как им предложат пищу или питье через рот. Следует соблюдать осторожность, чтобы свести к минимуму инфекцию, используя меры предосторожности при аспирации и минимизируя использование инвазивных устройств, таких как мочевые катетеры. Кроме того, по возможности следует применять механическую профилактику тромбоза глубоких вен (ТГВ). Также следует рассмотреть возможность фармакологической профилактики ТГВ, хотя это противопоказано в течение 24 часов после введения TPA и может быть противопоказано пациентам с геморрагической конверсией.
Кроме того, по возможности следует применять механическую профилактику тромбоза глубоких вен (ТГВ). Также следует рассмотреть возможность фармакологической профилактики ТГВ, хотя это противопоказано в течение 24 часов после введения TPA и может быть противопоказано пациентам с геморрагической конверсией.
Сдерживание и обучение пациентов
Факторы риска церебральной ишемии включают сердечные заболевания, включая такие сердечные заболевания, как фибрилляция предсердий, диабет, ожирение, гипертония, атеросклероз / гиперлипидемия и инсульты в анамнезе. К поведенческим факторам риска относятся отсутствие физической активности, плохой сон, ожирение, чрезмерное употребление алкоголя и табакокурение. Серповидно-клеточная анемия и другие гематологические нарушения, особенно состояния гиперкоагуляции, также могут повышать риск ишемического инсульта.Сведение к минимуму риска инсульта включает лечение этих состояний с помощью здоровой диеты, физических упражнений и приема лекарств. В частности, было доказано, что статины и антикоагулянты снижают риск ишемического инсульта. [22] [23]
В частности, было доказано, что статины и антикоагулянты снижают риск ишемического инсульта. [22] [23]
Улучшение результатов медицинской бригады
Пациентам с инсультом требуется помощь многопрофильных бригад для оптимизации результатов. Необходимость в междисциплинарной помощи возникает на догоспитальном этапе из-за раннего распознавания, и критически важно незамедлительное лечение симптомов ишемического инсульта.[24] Поставщики неотложной медицинской помощи играют важную роль в ранней диагностике, и все чаще организуются системы оказания помощи, чтобы направлять пациентов в больницы, готовые к инсульту. В некоторых районах используются мобильные инсультные отделения для облегчения сортировки и раннего лечения инсульта. [25] По прибытии в отделение неотложной помощи было показано, что внедрение, способствующее быстрой оценке и облегчение тромболитического введения, улучшает результаты для пациентов. [26]
После того, как было принято решение об остром лечении, госпитализация в специализированные инсультные отделения продемонстрировала улучшение результатов.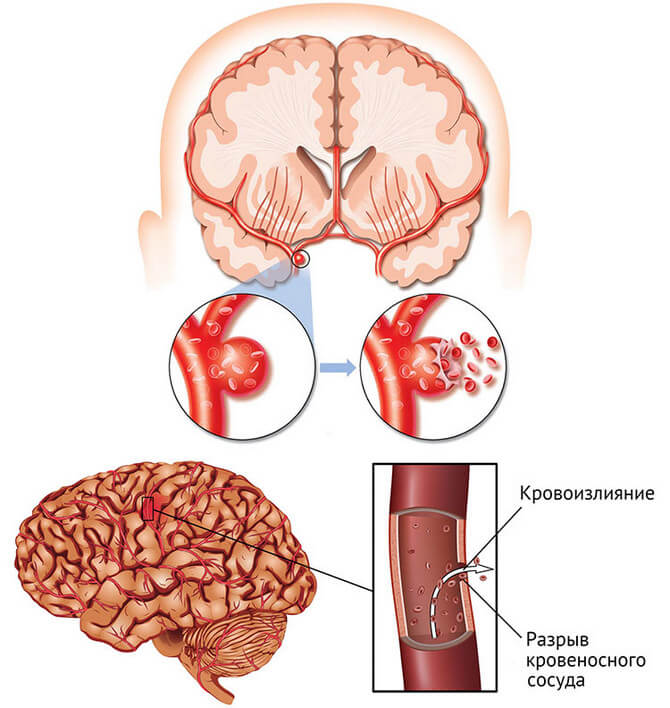 В идеале эти отделения включают в себя обученный медперсонал, а также специалистов по реабилитации, таких как физиотерапевты, эрготерапевты и речевые патологи. [16] Организованные инсультные отделения позволяют раннее выявить возможные осложнения и облегчить реабилитационную помощь, что снижает смертность и оказывает длительное влияние на инвалидность пациента. [27] [28] [29] [Уровень 1]
В идеале эти отделения включают в себя обученный медперсонал, а также специалистов по реабилитации, таких как физиотерапевты, эрготерапевты и речевые патологи. [16] Организованные инсультные отделения позволяют раннее выявить возможные осложнения и облегчить реабилитационную помощь, что снижает смертность и оказывает длительное влияние на инвалидность пациента. [27] [28] [29] [Уровень 1]
Дополнительное образование / Контрольные вопросы
Ссылки
- 1.
- Li Y, Zhang E, Yuan H.Церебральная углекислая эмболия после лапароскопической операции по поводу рака почки с полным неврологическим восстановлением: клинический случай. Медицина (Балтимор). 02 июля 2020; 99 (27): e20986. [Бесплатная статья PMC: PMC7337529] [PubMed: 32629713]
- 2.
- Zhou Y, Li W, Wang D, Mao L, Jin H, Li Y, Hong C, Chen S, Chang J, He Q, Wang M , Ху Б. Клиническая динамика COVID-19, его неврологические проявления и некоторые мысли по лечению. Stroke Vasc Neurol. 2020 июн; 5 (2): 177-179.
 [Бесплатная статья PMC: PMC7211099] [PubMed: 32366614]
[Бесплатная статья PMC: PMC7211099] [PubMed: 32366614] - 3.
- Adams HP, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, Marsh EE. Классификация подтипа острого ишемического инсульта. Определения для использования в многоцелевом клиническом исследовании. ТОСТ. Испытание Org 10172 в лечении острого инсульта. Инсульт. 1993 Январь; 24 (1): 35-41. [PubMed: 7678184]
- 4.
- Бенджамин Э.Дж., Мунтнер П., Алонсо А., Биттенкурт М.С., Каллавей К.В., Карсон А.П., Чемберлен А.М., Чанг А.Р., Ченг С., Дас С.Р., Деллинг Ф.Н., Джусс Л., Элкинд МСВ, Ferguson JF, Fornage M, Jordan LC, Khan SS, Kissela BM, Knutson KL, Kwan TW, Lackland DT, Lewis TT, Lichtman JH, Longenecker CT, Loop MS, Lutsey PL, Martin SS, Matsushita K, Moran AE, Mussolino ME , О’Флаэрти М., Пандей А., Перак А.М., Розамонд В.Д., Рот Г.А., Сэмпсон UKA, Сато ГМ, Шредер Э.Б., Шах С.Х., Спартано Н.Л., Стокс А., Тиршвелл Д.Л., Цао С.В., Турахия депутат, Ван Вагнер Л. , Вонг СС, Вирани СС., Комитет по статистике эпидемиологии и профилактики Американской кардиологической ассоциации и Подкомитет по статистике инсультов.
 Обновление статистики сердечных заболеваний и инсульта за 2019 г .: отчет Американской кардиологической ассоциации. Тираж. 5 марта 2019 г .; 139 (10): e56-e528. [PubMed: 30700139]
Обновление статистики сердечных заболеваний и инсульта за 2019 г .: отчет Американской кардиологической ассоциации. Тираж. 5 марта 2019 г .; 139 (10): e56-e528. [PubMed: 30700139] - 5.
- Формизано Л., Гуида Н., Масколо Л., Серани А., Лаудати Г., Пиццоруссо В., Аннунциато Л. Транскрипционная и эпигенетическая регуляция ncx1 и ncx3 в головном мозге. Клеточный кальций. 2020 Май; 87: 102194. [PubMed: 32172011]
- 6.
- Lee JM, Grabb MC, Zipfel GJ, Choi DW. Ответы тканей мозга на ишемию. J Clin Invest. 2000 сентябрь; 106 (6): 723-31. [Бесплатная статья PMC: PMC381398] [PubMed: 10995780]
- 7.
- Takase KI. Кардиогенный инфаркт головного мозга в теменной доле позволяет прогнозировать развитие постинсультной эпилепсии. Захват. 2020 Август; 80: 196-200. [PubMed: 32623354]
- 8.
- Kwah LK, Diong J. Шкала инсульта Национального института здравоохранения (NIHSS). J Physiother. 2014 Март; 60 (1): 61. [PubMed: 24856948]
- 9.

- Бирн Д., Уолш Дж. П., Сугрю Дж., Николау С., Рор А. КТ-изображение острого ишемического инсульта [Формула: см. Текст]. Can Assoc Radiol J. 2020, август; 71 (3): 266-280. [PubMed: 32157894]
- 10.
- Albers GW, Lansberg MG, Kemp S, Tsai JP, Lavori P, Christensen S, Mlynash M, Kim S, Hamilton S, Yeatts SD, Palesch Y, Bammer R, Broderick J, Марки МП. Многоцентровое рандомизированное контролируемое исследование эндоваскулярной терапии после визуализации ишемического инсульта (DEFUSE 3). Int J Stroke.2017 Октябрь; 12 (8): 896-905. [Бесплатная статья PMC: PMC57] [PubMed: 28946832]
- 11.
- Atchaneeyasakul K, Shang T., Haussen D, Ortiz G, Yavagal D. Влияние выбора МРТ на выбор эндоваскулярной терапии при остром ишемическом инсульте: MRI in Реестр неотложной помощи при ишемическом инсульте (MIAMIS). Interv Neurol. 2020 Янв; 8 (2-6): 135-143. [Бесплатная статья PMC: PMC7253863] [PubMed: 32508895]
- 12.
- Сильва Г.С., Ногейра Р.Г.
 Эндоваскулярное лечение острого ишемического инсульта.Континуум (Миннеап Минн). 2020 Апрель; 26 (2): 310-331. [PubMed: 32224754]
Эндоваскулярное лечение острого ишемического инсульта.Континуум (Миннеап Минн). 2020 Апрель; 26 (2): 310-331. [PubMed: 32224754] - 13.
- Ramakrishnan TCR, Kumaravelu S, Narayan SK, Buddha SS, Murali C, Majeed PHA, Meenakshi-Sundaram S, Wadia RS, Sharma V, Basu I, Vijaya P, Salam KA, Barmare S, Vaid Z, Nirmal Raj KK, Wattamwar PR, Asokan K, Dhonge V, Nellikunja S, Namjoshi D, Srinivasa R, Laddhad DS, Deshpande SD, Raghunath B, Kalita J, Kumar M, Misra UK, Pradeep M., Tenecteplase в исследователях инсульта. Эффективность и безопасность внутривенного болюса тенектеплазы при остром ишемическом инсульте: результаты двух открытых многоцентровых исследований.Am J Cardiovasc Drugs. 2018 Октябрь; 18 (5): 387-395. [PubMed: 29948822]
- 14.
- Cronin CA. Внутривенный тканевый активатор плазминогена при инсульте: обзор результатов ECASS III в связи с предыдущими клиническими испытаниями. J Emerg Med. 2010 Янв; 38 (1): 99-105. [PubMed: 19765940]
- 15.
- Pan Y, Elm JJ, Li H, Easton JD, Wang Y, Farrant M, Meng X, Kim AS, Zhao X, Meurer WJ, Liu L, Dietrich D, Wang Y, Johnston SC.
 Результаты, связанные с использованием клопидогреля-аспирина при малом инсульте или транзиторной ишемической атаке: объединенный анализ клопидогреля у пациентов из группы высокого риска с острыми не инвалидизирующими цереброваскулярными событиями (ШАНС) и тромбоцитарным ингибированием при новой ТИА и малом ишемическом инсульте (ТОЧКА) Испытания.JAMA Neurol. 2019 Aug 19; [Бесплатная статья PMC: PMC6704730] [PubMed: 31424481]
Результаты, связанные с использованием клопидогреля-аспирина при малом инсульте или транзиторной ишемической атаке: объединенный анализ клопидогреля у пациентов из группы высокого риска с острыми не инвалидизирующими цереброваскулярными событиями (ШАНС) и тромбоцитарным ингибированием при новой ТИА и малом ишемическом инсульте (ТОЧКА) Испытания.JAMA Neurol. 2019 Aug 19; [Бесплатная статья PMC: PMC6704730] [PubMed: 31424481] - 16.
- Powers WJ, Rabinstein AA, Ackerson T., Adeoye OM, Bambakidis NC, Becker K, Biller J, Brown M, Demaerschalk BM, Hoh B, Jauch EC , Kidwell CS, Leslie-Mazwi TM, Ovbiagele B, Scott PA, Sheth KN, Southerland AM, Summers DV, Tirschwell DL. Рекомендации по раннему ведению пациентов с острым ишемическим инсультом: Обновление 2019 г. к Рекомендациям по раннему ведению пациентов с острым ишемическим инсультом 2018 г .: Руководство для медицинских работников от Американской кардиологической ассоциации / Американской ассоциации по инсульту.Инсульт. 2019 декабрь; 50 (12): e344-e418. [PubMed: 31662037]
- 17.
- Casula M, Fortuni F, Fabris F, Leonardi S, Gnecchi M, Sanzo A, Greco A, Rordorf R. Прямые пероральные ингибиторы Ха по сравнению с варфарином у пациентов с раком и фибрилляцией предсердий: a метаанализ. J Cardiovasc Med (Хагерстаун). 2020 августа; 21 (8): 570-576. [PubMed: 32628422]
- 18.
- Liljehult J, Christensen T, Molsted S, Overgaard D, Mesot Liljehult M, Møller T. Эффект и эффективность изменений образа жизни в качестве вторичной профилактики.Acta Neurol Scand. 2020 Октябрь; 142 (4): 299-313. [Бесплатная статья PMC: PMC7540464] [PubMed: 32620044]
- 19.
- Béjot Y, Duloquin G, Crespy V, Durier J, Garnier L, Graber M, Giroud M. Влияние предшествующего когнитивного нарушения на клиническую тяжесть ишемического инсульта : Дижонский регистр инсультов. Инсульт. 2020 июн; 51 (6): 1667-1673. [PubMed: 32397931]
- 20.
- Квах Л.К., Харви Л.А., Дионг Дж., Герберт Р.Д. Модели, содержащие возраст и NIHSS, предсказывают восстановление способности передвигаться и функции верхних конечностей через шесть месяцев после инсульта: обсервационное исследование.J Physiother. 2013 сентябрь; 59 (3): 189-97. [PubMed: 23896334]
- 21.
- Пан Дж., Констас А.А., Бейтман Б., Ортолано Г.А., Пайл-Спеллман Дж. Реперфузионное повреждение после церебральной ишемии: патофизиология, МРТ и возможные методы лечения. Нейрорадиология. 2007 февраль; 49 (2): 93-102. [Бесплатная статья PMC: PMC1786189] [PubMed: 17177065]
- 22.
- Katsanos AH, Lioutas VA, Charidimou A, Catanese L, Ng KKH, Perera K, de Sa Boasquevisque D, Tsivgoulis G, Smith EE, Sharma M, Селим М.Х., Шоаманеш А.Лечение статинами и накопление скрытой церебральной ишемии при нейровизуализации: систематический обзор и метаанализ рандомизированных исследований. Eur J Neurol. 2020 июн; 27 (6): 1023-1027. [PubMed: 32133735]
- 23.
- Суссман Е.С., Джин М., Пендхаркар А.В., Пулли Б., Фенг А., Хейт Дж.Дж., Телищак Н.А. Двойная антитромбоцитарная терапия после стентирования сонной артерии: тенденции и результаты в большой национальной базе данных. J Neurointerv Surg. 2021 Янв; 13 (1): 8-13. [PubMed: 32414894]
- 24.
- Фассбендер К., Вальтер С., Грюнвальд И.К., Мерзу Ф., Матур С., Лесмейстер М., Лю Й., Бертч Т., Гротта Дж. К..Догоспитальное ведение инсульта в эпоху тромбэктомии. Lancet Neurol. 2020 Июл; 19 (7): 601-610. [PubMed: 32562685]
- 25.
- Фатима Н., Саккур М., Хусейн М.С., Шуайб А. Мобильное инсультное отделение в сравнении со стандартной медицинской помощью при ведении пациентов с острым инсультом: систематический обзор и метаанализ. Int J Stroke. 2020 Авг; 15 (6): 595-608. [PubMed: 32515695]
- 26.
- Darehed D, Blom M, Glader EL, Niklasson J, Norrving B., Eriksson M. Задержки в больнице при тромболизисе инсульта: каждая минута на счету.Инсульт. 2020 август; 51 (8): 2536-2539. [PubMed: 32586222]
- 27.
- Glader EL, Stegmayr B, Johansson L., Hulter-Asberg K, Wester PO. Различия в отдаленных результатах лечения пациентов в инсультных отделениях и в обычных палатах: двухлетнее наблюдение за пациентами, перенесшими инсульт, в Швеции. Инсульт. 2001 сентябрь; 32 (9): 2124-30. [PubMed: 11546906]
- 28.
- Krespi Y, Gurol ME, Coban O, Tuncay R, Bahar S. Инсультное отделение по сравнению с отделением неврологии — исследование до и после. J Neurol. 2003 ноя; 250 (11): 1363-9.[PubMed: 14648154]
- 29.
- Jauch EC, Saver JL, Adams HP, Bruno A, Connors JJ, Demaerschalk BM, Khatri P, McMullan PW, Qureshi AI, Rosenfield K, Scott PA, Summers DR, Wang DZ, Винтермарк М., Йонас Х., Совет по инсульту Американской кардиологической ассоциации. Совет по уходу за сердечно-сосудистыми заболеваниями. Совет по заболеваниям периферических сосудов. Совет по клинической кардиологии. Рекомендации по раннему ведению пациентов с острым ишемическим инсультом: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта.Инсульт. 2013 Март; 44 (3): 870-947. [PubMed: 23370205]
Ишемия головного мозга | Центр мозга и позвоночника Weill Cornell
Церебральная ишемия — это состояние, при котором закупорка артерии ограничивает доставку богатой кислородом крови в мозг, что приводит к повреждению ткани мозга. Ишемию головного мозга иногда называют ишемией головного мозга или ишемией сосудов головного мозга.
Ишемия головного мозга может приводить не только к повреждению клеток головного мозга, но и к их гибели. Преходящая ишемическая атака (ТИА), также известная как мини-инсульт, возникает, когда церебральная ишемия вызывает временную потерю функции мозга .Ишемический инсульт , также известный как церебральный инфаркт или атака головного мозга, возникает, когда кровеносный сосуд закупорен и потеря функции мозга необратима, потому что ткань головного мозга умирает (иногда это называется некрозом). Ишемический инсульт — самая распространенная форма инсульта.
Что вызывает ишемию головного мозга?
Сгустки крови часто являются источником закупорки, приводящей к ишемии головного мозга. Нормальное функционирование мозга требует адекватного снабжения богатой кислородом крови, которая доставляется через два основных набора кровеносных сосудов, известных как внутренние сонные артерии и вертебробазилярная система (состоящая из двух позвоночных артерий и базилярной артерии).
Со сгустками крови связано множество заболеваний:
- Атеросклероз, накопление бляшек или жировых отложений в артериях, может привести к сужению проходов и появлению препятствий, ограничивающих кровоток. Следующие факторы риска связаны с атеросклерозом и цереброваскулярными заболеваниями.
- Семейный анамнез сердечных заболеваний
- Гиперлипидемия (повышенное содержание жиров в крови)
- Гипертония (высокое кровяное давление)
- Бездействие
- Ожирение
- Пожилой возраст
- Курение
- Диабет
- Все, что вызывает сжатие кровеносных сосудов, включая опухоли, может привести к ограничению поступления кислорода в мозг.
- Ишемия головного мозга также может быть вызвана сердечным приступом. Невылеченный сердечный приступ может замедлить кровоток до образования сгустка, препятствующего попаданию крови в мозг.
- Люди с врожденными пороками сердца, влияющими на формирование и соединение артерий, могут с большей вероятностью страдать от образования тромбов, которые приводят к церебральной ишемии.
- Серповидно-клеточная анемия связана с церебральной ишемией, поскольку она влияет на гемоглобин, который является переносящей кислород частью красных кровяных телец.При серповидно-клеточной анемии наблюдается нехватка эритроцитов, а те, которые действительно существуют, не плоские, а имеют форму серпа (в форме полумесяца) и имеют тенденцию к более легкому свертыванию.
Некоторые тяжелые инфекции, разрыв кровеносного сосуда или травма, которая приводит к большой потере крови, могут привести к низкому кровяному давлению (гипотонии) и снижению притока крови к мозгу.
Типы ишемии:
Снижение кровотока может быть ограничено только одной конкретной областью мозга; этот тип церебральной ишемии называется очаговой ишемией .Это может быть вызвано тромбозом — сгустком крови в одной из церебральных артерий, ограничивающим кровоток в одной области. Эмболия, представляющая собой небольшой кусок сгустка, который отрывается и перемещается, в конечном итоге застревая или сильно ограничивая кровоток, также может вызвать очаговую ишемию.
Глобальная ишемия , с другой стороны, описывает состояние, при котором обширные области мозга лишены богатой кислородом крови. Это может быть вызвано остановкой сердца (когда сердце перестает биться) или сердечным приступом (когда кровоток к сердцу заблокирован).
Рецензент: доктор Филип Э. Стиг
Последнее рассмотрение / обновление: октябрь 2020 г.
Иллюстрация Тома Грейвса
Модели инсульта и ишемии мозга у грызунов
Инсульт является причиной номер один инвалидности и третьей по значимости причиной смерти в мире. Creative Biolabs предлагает различные хорошо охарактеризованные модели ишемического инсульта (фокальный ишемический инсульт и глобальный ишемический инсульт) для исследований нейропротекции и уменьшения инфаркта. Мы можем провести ряд поведенческих тестов, тестов функционального восстановления и невропатологического анализа, адаптированных к потребностям клиентов.
Введение в инсульт и ишемию головного мозга
Сток — это заболевание, при котором плохой приток крови к мозгу приводит к гибели клеток. Сток делится на две основные категории: ишемический (ишемия мозга) и геморрагический (субарахноидальное кровоизлияние и внутримозговое кровоизлияние). Ишемия головного мозга — это состояние, при котором нет достаточного притока в мозг для удовлетворения метаболических потребностей, что приводит к гипоксии головного мозга и, следовательно, к инфаркту головного мозга / ишемическому инсульту.Есть два типа ишемии: очаговая ишемия, которая ограничивается определенной областью мозга; и глобальная ишемия, охватывающая обширные участки ткани головного мозга. Около 87% инсультов являются ишемическими, остальные — геморрагическими.
Обзор моделей Стокса и ишемии мозга
Были разработаны различные модели инсульта на животных с целью выявления механизмов, лежащих в основе церебральной ишемии, и разработки новых средств для лечения инсульта.В большинстве экспериментов с инсультом используются мелкие животные (например, мыши, крысы, кролики) из-за их явных преимуществ перед более крупными животными: более низкая стоимость и большая приемлемость с этической точки зрения. Крыса — одно из наиболее часто используемых животных по многим причинам: сосуды головного мозга и физиология сходны с человеческими, небольшой размер мозга, подходящий для фиксации, простота проведения воспроизводимых исследований. Генно-инженерные мыши особенно полезны для углубления нашего понимания компонентов ишемической патофизиологии и для разработки потенциальных новых профилактических, нейропротекторных и терапевтических препаратов и вмешательств.
В настоящее время для исследования инсульта существует ряд хорошо охарактеризованных моделей ишемического инсульта, включая как глобальные модели ишемии, так и модели фокальной ишемии. Как исследовательский партнер, специализирующийся на разработке фармакологических исследований и исследований эффективности различных неврологических заболеваний, Creative Biolabs может использовать следующие модели для оценки потенциальных терапевтических средств:
Модель окклюзии средней мозговой артерии (MCAO) (временная / постоянная)
Модель преходящей или постоянной окклюзии средней мозговой артерии (MCAO) является одной из моделей, наиболее точно имитирующих ишемический инсульт у человека.Он участвовал в большинстве исследований, посвященных патофизиологическим процессам или нейропротекторным средствам.
Эндотелин-1 Модель
Модель очагового инсульта с эндотелином-1 основана на применении эндотелина-1 (ЕТ-1), который представляет собой мощный сосудосуживающий пептид длительного действия. Его можно наносить непосредственно на обнаженную СМА в виде внутримозговой инъекции или на корковую поверхность, что приводит к дозозависимому ишемическому поражению с краевым ишемическим отеком.
Фототромботическая ишемия Модель
Модель фототромботического инсульта направлена на то, чтобы вызвать ишемическое повреждение в данной области коры посредством фотоактивации ранее введенного светочувствительного красителя. Вкратце, фотоактивный краситель (например, бенгальский эоз) вводят внутрибрюшинно (мыши) или внутривенно (крысы), и неповрежденный череп облучают в течение нескольких минут световым лучом с определенной длиной волны. Эта процедура генерирует кислородные радикалы, которые приводят к повреждению эндотелия, активации тромбоцитов и тромбозу, что приводит к локальному прерыванию кровотока.
Глобальная ишемическая окклюзия четырех сосудов (4-VO) Крыса Модель
4 VO у крыс представляет собой модель обратимой ишемии переднего мозга на грызунах. Он широко использовался для изучения механизмов гибели нейронов, вызванной ишемией, и для тестирования эффектов нейрозащитных препаратов. Эта глобальная модель ишемии включает постоянную окклюзию позвоночных артерий и временную окклюзию сонных артерий.
Широкий спектр моделей неврологических заболеваний грызунов, доступных в Creative Biolabs для проверки эффективности различных вмешательств, включает:
Creative Biolabs устанавливает гибко адаптированные протоколы исследований, которые соответствуют требованиям каждого терапевтического тестирования.Кроме того, наши ученые имеют опыт быстрой проверки моделей из литературы. Если здесь нет нужной вам модели, не стесняйтесь обращаться к нам, чтобы узнать, как мы можем адаптировать нашу программу к вашим конкретным потребностям.
Только для лабораторных исследований.
Специальный выпуск: Молекулярные и клеточные механизмы ишемии головного мозга
Уважаемые коллеги,
Ишемия головного мозга является ведущей причиной смерти во всем мире.Несмотря на большие усилия по разработке потенциального лечения, молекулярные и клеточные механизмы церебральной ишемии до конца не изучены.
До сих пор многие исследователи использовали различные животные модели церебральной ишемии с разными видами животных, разными методами окклюзии кровеносных сосудов и разными периодами времени окклюзии. Модели церебральной ишемии можно разделить на фокальные и глобальные. Фокальная ишемия характеризуется снижением церебрального кровотока в отдельной области мозга, тогда как при глобальной ишемии уменьшение кровотока затрагивает весь мозг или передний мозг.Повреждение нейронов или тканей различается в зависимости от типа ишемического поражения. На животных моделях глобальной транзиторной ишемии головного мозга или переднего мозга повреждение / гибель (потеря) нейронов происходит в уязвимых областях мозга (например, в гиппокампе), тогда как в животных моделях транзиторной фокальной ишемии отрубей потеря нейронов происходит при продолжительности ишемии (повреждении). короткий (легкий), или инфаркт (некроз) возникает, когда ишемическое повреждение (длительность) тяжелое (длительное). В этом отношении механизмы потери нейронов или инфаркта, по-видимому, различаются в зависимости от типа ишемического поражения.
Были предложены различные механизмы патофизиологических событий ишемических повреждений, включая активацию рецепторов глутамата, устойчивое увеличение внутриклеточного кальция, окислительный стресс, вызванный свободными радикалами, и активацию резидентной микроглии, связанную с нейровоспалительной реакцией. Кроме того, дисфункция клеток, связанных с гематоэнцефалическим барьером (ГЭБ), включая эндотелиальные клетки, астроциты и перициты, а также микроглию, также предполагается в качестве возможного механизма ишемических повреждений.
Этот специальный выпуск направлен на изучение контроля или модуляции различных путей во время или после ишемических повреждений на молекулярном и клеточном уровнях с целью предотвращения, ослабления или лечения ишемических повреждений, вызванных различными ишемическими поражениями головного мозга.
Проф. Му-Хо ВонПриглашенный редактор
Информация для подачи рукописей
Рукописи должны быть отправлены онлайн по адресу www.mdpi.com, зарегистрировавшись и войдя на этот сайт. После регистрации щелкните здесь, чтобы перейти к форме отправки.Рукописи можно подавать до установленного срока. Все статьи будут рецензироваться. Принятые статьи будут постоянно публиковаться в журнале (как только они будут приняты) и будут перечислены вместе на веб-сайте специального выпуска. Приглашаются исследовательские статьи, обзорные статьи, а также короткие сообщения. Для запланированных статей название и краткое резюме (около 100 слов) можно отправить в редакцию для объявления на этом сайте.
Представленные рукописи не должны были публиковаться ранее или рассматриваться для публикации в другом месте (за исключением трудов конференции).Все рукописи тщательно рецензируются в рамках процесса одинарного слепого рецензирования. Руководство для авторов и другая важная информация для подачи рукописей доступна на странице Инструкции для авторов. Cells — это международный рецензируемый ежемесячный журнал с открытым доступом, публикуемый MDPI.
Пожалуйста, посетите страницу Инструкции для авторов перед отправкой рукописи. Плата за обработку статьи (APC) для публикации в этом журнале с открытым доступом составляет 2000 швейцарских франков.Представленные документы должны быть хорошо отформатированы и написаны на хорошем английском языке. Авторы могут использовать MDPI Услуги редактирования на английском языке перед публикацией или во время редактирования автора.
Травма головного мозга после транзиторной глобальной церебральной ишемии и субарахноидального кровоизлияния
Клинически часто встречаются повреждения головного мозга различной этиологии. Таким образом, менеджмент разнообразен. Транзиторная глобальная ишемическая травма (TGI) головного мозга может возникнуть в результате остановки сердца, когда церебральная перфузия снижается до такой степени, что кровоснабжение больше не может удовлетворить метаболические потребности мозга, или из-за аневризматического субарахноидального кровоизлияния, когда кровоизлияние из внутричерепной аневризмы повышает внутричерепное давление выше уровня артериальное давление, приводящее к кратковременной остановке перфузии.
Хотя есть общие черты и различия в этиологии и патогенезе этих двух повреждений головного мозга, не ясно, требовали ли они дифференцированного лечения или их можно было сгруппировать вместе. Некоторые факторы риска TGI и SAH являются общими и общими, а другие — уникальными для травмы. Общие факторы риска включают высокое кровяное давление, курение, злоупотребление алкоголем и стресс. Факторами риска, уникальными для TGI, являются такие клинические состояния, как остановка сердца (основная причина), шок, вызывающий длительную гипоксию или гипогликемию, патологически повышенный уровень церебрального метаболизма или снижение церебрального перфузионного давления.Фактором риска, уникальным для САК, является наличие внутричерепной аневризмы. Другими противоположными факторами риска являются возраст и пол; в то время как пожилой возраст увеличивает риск ИГН, САК встречается у более молодого населения со средним возрастом 52–55 лет. У женщин значительно больше внутричерепных аневризм, чем у мужчин, и, следовательно, они чаще становятся жертвами САК. Хотя средний возраст женщин с САК выше, чем у мужчин, результат аналогичен [1]. Напротив, риску ишемического инсульта подвержено больше мужчин, чем женщин, а женщины с ишемическим инсультом обычно старше и с большей вероятностью умирают от инсульта, чем мужчины [2].
Повреждение головного мозга после TGI можно разделить на начальную фазу ишемии, которая длится в течение всего времени, пока кровоснабжение мозга остается сниженным (обычно ≤10 минут, в противном случае смерть неизбежна), и фазу реперфузии, которая начинается сразу после восстановления церебрального кровоснабжения. (> 10 минут). Начальная фаза черепно-мозговой травмы после САК более сложна и длится от 48 до 72 часов. На этой начальной (ранней) фазе происходит сложная серия событий, включая вызванную кровью механическую травму, оксигемоглобин (высвобождающийся при разложении крови), вызванный окислительным стрессом, воспаление и ишемию [3].Отсроченная фаза черепно-мозговой травмы, уникальная для САК, развивается через 3-7 дней после САК. Эта травма характеризуется ангиографическим вазоспазмом и отсроченной церебральной ишемией [4].
Чтобы помочь понять лечение травм головного мозга после TGI и SAH, в этом специальном выпуске сравниваются и противопоставляются различные механизмы травм головного мозга после TGI и SAH. В нем представлены две оригинальные исследовательские статьи и 7 обзоров. В исследовательской статье C. S. Jung et al. изучает корреляцию маркеров повреждения сыворотки и спинномозговой жидкости с ишемическими событиями у пациентов с САК, а также S.O. Eicker et al. сравнивает нейрозащитные свойства фактора роста сосудистого эндотелия (VEGF) против инсульта и церебрального вазоспазма после САК. F. A. Sehba и R.M. Pluta рассматривают существующие модели животных TGI и aSAH и представляют модифицированную модель aSAH, которая эффективно имитирует заболевание и может стать лучшим ресурсом для изучения механизмов повреждения мозга и разработки лечения. M. A. Kamp et al. рассмотреть механизмы и клиническое значение изменения кальциевых и калиевых каналов после САК и ТГИ.M. K. Tso и R. L. Macdonald проводят обзор доклинических исследований микрососудистых изменений и их терапевтических модификаций после SAH и TGI. N. Plesnila сравнивает и противопоставляет патофизиологические события, происходящие в экспериментальных моделях SAH и TGI, и оценивает вклад и важность глобальной церебральной ишемии в патофизиологии SAH. M. Koide et al. обобщить текущие знания о влиянии САК и глобальной ишемии на нейрососудистую коммуникацию. J. A. Frontera рассматривает клинические испытания при остановке сердца и САК и приходит к выводу, что клинические испытания при САК для оценки острого повреждения головного мозга проводятся и что эти испытания могут получить пользу от успешно выявленных вмешательств в отношении травм головного мозга после остановки сердца.
Мы надеемся, что данный специальный выпуск стимулирует дальнейшие исследования по этой теме и привлекает внимание к информации, которая поможет лучше понять ведение пациентов с TGI и SAH.
Fatima A. Sehba
Ryszard M. Pluta
R. Loch Macdonald
Copyright
Copyright © 2013 Fatima A. Sehba et al. Это статья в открытом доступе, распространяемая под лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта глава предназначена для введения в основные концепции патофизиологии ишемического повреждения головного мозга и цереброваскулярных заболеваний. Общие характеристики энергетического метаболизма мозга, избирательная уязвимость и эксайтотоксичность Доставка кислорода и глюкозы в мозг Перфузионное давление головного мозга определяется следующим соотношением: Церебральное перфузионное давление = среднее артериальное давление — внутричерепное давление Одним из следствий этой взаимосвязи является то, что по мере увеличения внутричерепного давления церебральная перфузия снижается.Повышенное внутричерепное давление может быть вызвано многими процессами, включая набухание мозга из-за цитотоксического или вазогенного отека или любого объемного поражения, такого как гематома, опухоль или абсцесс. В определенных пределах, независимо от среднего артериального давления, церебральный кровоток поддерживается на постоянном уровне. Это известно как церебральная ауторегуляция. Средний мозговой кровоток (CBF) составляет 50 мл / 100 г / мин, но серое вещество имеет больший кровоток, чем белое вещество. Это означает, что в большинстве случаев серое вещество более уязвимо для прерывания кровотока по любой причине, чем белое вещество. Локальный CBF связан с метаболизмом, так что области мозга, которые электрически активны, имеют больший кровоток, чем области, которые относительно спокойны и имеют более низкую электрическую и метаболическую активность. Это известно как местная саморегуляция. Факторы, ответственные за этот процесс, неизвестны, но могут включать pH, концентрацию аденозина или оксид азота. Энергетический метаболизм мозга Ишемия — Ишемия — это отсутствие кровотока. Последствия ишемии — Эффекты ишемии модулируются рядом факторов, в том числе:
Инсульт — Клиническая картина — Внезапное появление симптомов характерно для сосудистых событий, однако важно отметить, что другие расстройства могут проявляться внезапно.При инсульте начальные неврологические признаки и симптомы отражают функциональную анатомию пораженной области мозга, но позже могут произойти вторичные изменения, которые изменят клинические признаки. Эти более поздние изменения могут включать грыжу из-за отека или спазма сосудов, особенно при наличии крови. Спазм сосудов может вызвать инфаркт дополнительной мозговой ткани. Факторы риска Общие представления о анатомии сосудов и его связь с патофизиологией инсульта: Очаговый ишемический инфаркт —
Эмболия — различные материалы в кровотоке могут перемещаться вниз по потоку и оседать в сосудах, просветы которых слишком узкие, чтобы позволить материалу пройти. Небольшие эмболы имеют тенденцию скапливаться в дистальных ветвях поверхностных сосудов, что приводит к инфаркту на серо-белом соединении.Множественные небольшие инфаркты, распределенные по полушариям головного мозга на серо-белом стыке, характерны для эмболического инфаркта. Возникновение единичного большого клиновидного инфаркта также является еще одним распространенным типом церебральной эмболии. Чаще всего эмболический инфаркт находится на территории средней мозговой артерии («артерия эмболизации»). Эмболы могут поступать из различных источников, в том числе от артерии к артерии, сердца, воздушной эмболы в результате хирургических вмешательств и костного мозга (после перелома длинных костей). Эмболизация артерии может происходить, когда фрагменты атеросклеротических бляшек смещаются и эмболируют в дистальные кровеносные сосуды, или когда фрагменты тромбов могут эмболизировать. Сердце — частый источник эмболического материала. Бактериальные или небактериальные вегетации на клапанах, тромбы предсердий, которые развиваются при фибрилляции предсердий, и эндокардиальные тромбы стенокардии после инфаркта миокарда являются относительно распространенными типами сердечной эмболии.
Существует множество других, менее распространенных причин инфаркта головного мозга.
Развитие патологического процесса — Грубые изменения — Первоначально, в течение нескольких часов после инфаркта, в головном мозге могут не быть обнаруживаемых грубых изменений. Через несколько часов может наблюдаться небольшой отек и размягчение ткани, а также небольшие изменения цвета пораженной ткани. Отек и размягчение увеличиваются в течение следующих нескольких дней. В случае инфаркта коры головного мозга происходит потеря различимости серо-белого перехода в коре головного мозга. Примерно через неделю область инфаркта начинает отделяться от прилегающей жизнеспособной ткани мозга.Следующие несколько недель или месяцев характеризуются уменьшением отека и увеличением кавитации, пока, наконец, область инфаркта не станет полостью.
Внутричерепное кровоизлияние — Примерно 2% взрослых имеют мешковидные аневризмы, и существует риск разрыва 23% в год. Наибольший риск разрыва — от 40-60 лет.1/3 пациентов с катастрофическими субарахноидальными кровоизлияниями мертвы до лечения, 1/3 умирает в больнице или имеет серьезные последствия, а 1/3 выздоравливает. Очень большой процент имеет предупреждающие знаки, которые представляют собой незначительные кровотечения, чаще всего за две недели до катастрофического кровотечения. Важно распознать эти «дозорные» кровоизлияния, потому что катастрофическое кровотечение часто можно предотвратить. Другие, менее распространенные причины спонтанного (нетравматического) кровоизлияния в мозг включают амилоидную ангиопатию, артериовенозную мальформацию, другие сосудистые мальформации и нарушения свертываемости крови.Иногда мешковидная аневризма разрывается в паренхиму, что приводит к паренхиматозному кровоизлиянию, а не субарахноидальному кровоизлиянию. Амилоидная ангиопатия может быть заподозрена как причина кровотечения у пожилого человека, у которого наблюдается крупозное кровоизлияние (доля головного мозга), а не в базальных ганглиях. В случае коагулопатии часто возникают множественные, беспорядочно распределенные кровоизлияния.
Венозный инфаркт Факторы, предрасполагающие к тромбозу дурального синуса, следующие: Признаки и симптомы венозного тромбоза включают: головную боль (75%), отек диска зрительного нерва (54%), очаговый моторный или сенсорный дефицит (34%), судороги (37%) и изменение уровня сознания (30%). Нейровизуализация выявляет тромбированные вены, отсутствие увеличения пораженной пазухи, усиление скопления вен и твердой мозговой оболочки, а также геморрагические инфаркты.
|
Нейровоспаление: друг и враг ишемического инсульта | Журнал нейровоспаления
Московиц М.А., Ло Э. Х., Иадекола С. Наука об инсульте: механизмы в поисках лечения. Нейрон. 2010. 67 (2): 181–98.
CAS PubMed PubMed Central Статья Google Scholar
Lallukka T, Ervasti J, Lundström E, Mittendorfer-Rutz E, Friberg E, Virtanen M, et al. Тенденции инвалидности по конкретным диагнозам до и после инсульта: продольное популяционное исследование в Швеции. J Am Heart Assoc. 2018; 7 (1): e006991.
PubMed PubMed Central Статья CAS Google Scholar
Rammal SA, Almekhlafi MA. Сахарный диабет и инсульт в арабском мире. Университет Дж. Тайбы, мед. Наук.2016; 11 (4): 295–300.
Артикул Google Scholar
Фейгин В.Л., Абаджобир А.А., Абате К.Х., Абдаллах Ф., Абдулле А.М., Абера С.Ф. и др. Глобальное, региональное и национальное бремя неврологических расстройств в 1990–2015 гг .: систематический анализ для исследования глобального бремени болезней 2015 г. Lancet Neurol. 2017; 16 (11): 877–97.
Артикул Google Scholar
Катанезе Л., Тарсия Дж., Фишер М.Обзор терапии острого ишемического инсульта. Циркуляционные исследования. 2017; 120 (3): 541–58.
CAS PubMed Статья PubMed Central Google Scholar
Дуге Р., Нат М, Дуге А, Бароне ФК. Роль про- и противовоспалительных цитокинов при черепно-мозговой травме и остром ишемическом инсульте. Механизмы нейровоспаления: IntechOpen; 2017.
Google Scholar
Хан М., Хашим Х, Ниса З., Камран С., Алрукн С. Тромболизис при остром ишемическом инсульте: опыт в Дубае и сравнение арабского и неарабского населения. J Neurol Stroke. 2016; 4 (6): 00156.
Артикул Google Scholar
Хаджат К., Харрисон О., Аль Сиксек З. Векая: программа скрининга сердечно-сосудистых заболеваний для всего населения в Абу-Даби, Объединенные Арабские Эмираты. Am J Public Health. 2012. 102 (5): 909–14.
PubMed PubMed Central Статья Google Scholar
Абдулле А., Алнаими А., Альджунаиби А., Аль Али А., Аль Саеди К., Аль Зааби Е. и др. Исследование «Здоровое будущее» в ОАЭ: пилотное исследование для проспективного когортного исследования с участием 20 000 граждан Объединенных Арабских Эмиратов. BMC Public Health. 2018; 18 (1): 101.
PubMed PubMed Central Статья CAS Google Scholar
Ди Карло А. Человеческое и экономическое бремя инсульта. Возраст и старение. 2009. 38 (1): 4–5.
Мишра М, Хедна В.С.Нейровоспаление после острого ишемического инсульта: вулкан трудно удержать. Китайский журнал современной неврологии и нейрохирургии. 2013; 13 (11): 964–70.
CAS Google Scholar
Джин Р., Ян Г., Ли Г. Воспалительные механизмы при ишемическом инсульте: роль воспалительных клеток. Журнал биологии лейкоцитов. 2010. 87 (5): 779–89.
CAS PubMed PubMed Central Статья Google Scholar
Iadecola C, Anrather J. Иммунология инсульта: от механизмов к переводу. Природная медицина. 2011; 17 (7): 796.
CAS PubMed PubMed Central Статья Google Scholar
Гурусвами Р., Эль-Али А. Сложные роли микроглиальных клеток в патобиологии ишемического инсульта: новые идеи и будущие направления. Международный журнал молекулярных наук. 2017; 18 (3). https://doi.org/10.3390/ijms18030496.
PubMed Central Статья CAS PubMed Google Scholar
Франк-Кэннон TC, Alto LT, McAlpine FE, Tansey MG. Раздувает ли нейровоспаление пламя нейродегенеративных заболеваний? Молекулярная нейродегенерация. 2009; 4 (1): 47.
PubMed PubMed Central Статья CAS Google Scholar
Ким Дж.Й., Пак Дж., Чанг Дж.Й., Ким Ш., Ли Дж. Воспаление после ишемического инсульта: роль лейкоцитов и глиальных клеток. Экспериментальная нейробиология. 2016; 25 (5): 241–51.
PubMed PubMed Central Статья Google Scholar
Emmrich JV, Ejaz S, Neher JJ, Williamson DJ, Baron JC. Региональное распределение избирательной потери нейронов и активации микроглии по территории СМА после временной очаговой ишемии: количественная и полуколичественная систематическая иммуногистохимическая оценка. J Cereb Blood Flow Metab. 2015; 35 (1): 20–7.
PubMed Статья PubMed Central Google Scholar
Ма МВт, Ван Дж., Чжан К., Ван Р., Дхандапани К.М., Вадламуди Р.К. и др.НАДФН-оксидаза при черепно-мозговой травме и нейродегенеративных расстройствах. Mol Neurodegener. 2017; 12 (1): 7.
PubMed PubMed Central Статья CAS Google Scholar
Kim JY, Kawabori M, Yenari MA. Врожденные воспалительные реакции при инсульте: механизмы и потенциальные терапевтические цели. Curr Med Chem. 2014; 21 (18): 2076–97.
CAS PubMed PubMed Central Статья Google Scholar
Sun M, Deng B, Zhao X, Gao C, Yang L, Zhao H, et al. Предварительное кондиционирование изофлураном обеспечивает нейрозащиту от инсульта, регулируя экспрессию сигнального пути TLR4 для облегчения активации микроглии. Научный доклад 2015; 5: 11445.
PubMed PubMed Central Статья Google Scholar
Чон ХК, Джи К., Мин К., Джо Э. Воспаление мозга и микроглия: факты и заблуждения. Exp Neurobiol. 2013. 22 (2): 59–67.
PubMed PubMed Central Статья Google Scholar
Zhou M, Wang CM, Yang WL, Wang P. Микроглиальный CD14, активированный iNOS, способствует нейровоспалению при ишемии головного мозга. Brain Res. 2013; 1506: 105–14.
CAS PubMed PubMed Central Статья Google Scholar
Facci L, Barbierato M, Marinelli C, Argentini C, Skaper SD, Giusti P.Toll-подобные рецепторы 2, -3 и -4 запускают микроглию, но не астроциты в областях центральной нервной системы для АТФ-зависимого высвобождения интерлейкина-1β. Научный отчет 2014; 4: 6824.
CAS PubMed PubMed Central Статья Google Scholar
МакДонаф А., Ли Р.В., Нур С., Ли С., Ле Т., Йорга М. и др. Ишемия / реперфузия индуцирует экспрессию генов в микроглии, стимулированную интерфероном. J Neurosci. 2017; 37 (34): 8292–308.
CAS PubMed PubMed Central Статья Google Scholar
Пономарев Э.Д., Веремейко Т, Вайнер Х.Л. МикроРНК являются универсальными регуляторами дифференцировки, активации и поляризации микроглии и макрофагов в нормальной и больной ЦНС. Глия. 2013. 61 (1): 91–103.
PubMed Статья Google Scholar
Parada E, Egea J, Buendia I, Negredo P, Cunha AC, Cardoso S, et al. Никотиновый рецептор α7-ацетилхолина микроглии является ключевым элементом в обеспечении нейрозащиты, индуцируя гемоксигеназу-1 через ядерный фактор, связанный с эритроидом-2, фактор 2.Антиоксиданты и редокс-сигналы. 2013. 19 (11): 1135–48.
CAS Статья Google Scholar
Yuan Y, Zha H, Rangarajan P, Ling EA, Wu C. Противовоспалительные эффекты Edaravone и Scutellarin в активированной микроглии при экспериментально индуцированном ишемическом повреждении у крыс и в микроглии BV-2. BMC Neurosci. 2014; 15: 125.
PubMed PubMed Central Статья CAS Google Scholar
Liska GM, Lippert T, Russo E, Nieves N, Borlongan CV. Двойная роль гипербарического кислорода в нейропротекции инсульта: предварительное кондиционирование мозга и стволовых клеток. Cond Med. 2018; 1 (4): 151–66.
PubMed PubMed Central Google Scholar
Lalancette-Hébert M, Swarup V, Beaulieu JM, Bohacek I, Abdelhamid E, Weng YC и др. Галектин-3 необходим для активации и пролиферации резидентной микроглии в ответ на ишемическое повреждение.J Neurosci. 2012. 32 (30): 10383–95.
PubMed Статья CAS Google Scholar
ЭльАли А., Жан Леблан Н. Роль моноцитов в патобиологии ишемического инсульта: новые направления для изучения. Front Aging Neurosci. 2016; 8: 29.
PubMed PubMed Central Статья CAS Google Scholar
Neumann J, Gunzer M, Gutzeit HO, Ullrich O, Reymann KG, Dinkel K.Микроглия обеспечивает нейрозащиту после ишемии. FASEB J. 2006; 20 (6): 714–6.
CAS PubMed Статья PubMed Central Google Scholar
Denes A, Vidyasagar R, Feng J, Narvainen J, McColl BW, Kauppinen RA, et al. Пролиферирующая резидентная микроглия после очаговой ишемии головного мозга у мышей. J Cereb Blood Flow Metab. 2007. 27 (12): 1941–53.
CAS PubMed Статья PubMed Central Google Scholar
Arumugam TV, Salter JW, Chidlow JH, Ballantyne CM, Kevil CG, Granger DN. Вклад LFA-1 и Mac-1 в повреждение головного мозга и дисфункцию микрососудов, вызванную преходящей окклюзией средней мозговой артерии. Am J Physiol Heart Circ Physiol. 2004; 287 (6): h3555 – H60.
CAS PubMed Статья PubMed Central Google Scholar
Тейлор Р.А., Чанг К.Ф., Гудз Б.А., Хаммонд М.Д., Мак Грори Б., Ай И и др. TGF-β1 модулирует фенотип микроглии и способствует восстановлению после внутримозгового кровоизлияния.J Clin Invest. 2017; 127 (1): 280–92.
PubMed Статья PubMed Central Google Scholar
Джин В.Н., Ши С.Х., Ли З., Ли М., Вуд К., Гонсалес Р.Дж. и др. Истощение микроглии усугубляет постишемическое воспаление и повреждение головного мозга. J Cereb Blood Flow Metab. 2017; 37 (6): 2224–36.
CAS PubMed PubMed Central Статья Google Scholar
Singhal G, Baune BT. Микроглия: граница между потерей нейропластичности и депрессией. Front Cell Neurosci. 2017; 11 (270).
Былицкий М.А., Мюллер Г.П., День РМ. Механизмы эндогенного нейропротекторного действия астроцитов при черепно-мозговой травме. Oxid Med Cell Longev. 2018; 2018: 6501031.
PubMed PubMed Central Статья CAS Google Scholar
Takano T, Oberheim N, Cotrina ML, Nedergaard M.Астроциты и ишемическое повреждение. Инсульт. 2009; 40 (3 доп. 1): S8 – S12.
PubMed Статья PubMed Central Google Scholar
Ketheeswaranathan P, Turner NA, Spary EJ, Batten TF, McColl BW, Saha S. Изменения в экспрессии транспортера глутамата в областях переднего мозга мыши после очаговой ишемии. Brain Res. 2011; 1418: 93–103.
CAS PubMed Статья PubMed Central Google Scholar
Хеннесси Э., Гриффин Э. У., Каннингем С. Астроциты примированы хронической нейродегенерацией, чтобы производить преувеличенные хемокиновые и клеточные инфильтрационные ответы на острую стимуляцию цитокинами IL-1β и TNF-α. J Neurosci. 2015; 35 (22): 8411–22.
CAS PubMed PubMed Central Статья Google Scholar
Ван Х., Сонг Дж., Чуанг Х., Чиу С., Абдельмаксуд А., Йе Й и др. Портрет глиального рубца при неврологических заболеваниях.Int J Immunopathol Pharmacol. 2018; 31: 2058738418801406.
PubMed PubMed Central Google Scholar
Сыкова Е.Глиальные диффузионные барьеры при старении и патологических состояниях. Prog Brain Res. 2001; 132: 339–63.
CAS PubMed Статья PubMed Central Google Scholar
Ремпе Р.Г., Харц А.М.С., Бауэр Б. Матричные металлопротеиназы головного мозга и гематоэнцефалического барьера: универсальные разрушители и производители.J Cereb Blood Flow Metab. 2016; 36 (9): 1481–507.
CAS PubMed PubMed Central Статья Google Scholar
Оверман Дж. Дж., Кларксон А. Н., Ваннер И. Б., Оверман В. Т., Экштейн И., Магуайр Дж. Л. и др. Роль эфрина-A5 в отрастании аксонов, восстановлении и пластичности, зависящей от активности, после инсульта. Proc Natl Acad Sci U S. A. 2012; 109 (33): E2230–9.
CAS PubMed PubMed Central Статья Google Scholar
Новицка Д., Рогозинская К., Алексий М., Витте О. В., Скангель-Крамска Дж. Пространственно-временная динамика астроглиальных и микроглиальных ответов после фототромботического инсульта в мозге крысы. Acta Neurobiol Exp. 2008; 68 (2): 155.
Google Scholar
Эндох М., Майезе К., Вагнер Дж. Экспрессия индуцибельной формы синтазы оксида азота реактивными астроцитами после временной глобальной ишемии. Brain Res. 1994. 651 (1-2): 92–100.
CAS PubMed Статья PubMed Central Google Scholar
Li M, Li Z, Yao Y, Jin W-N, Wood K, Liu Q и др. Интерлейкин-15, полученный из астроцитов, усугубляет ишемическое повреждение головного мозга за счет распространения клеточного иммунитета. Proc Natl Acad Sci. 2017; 114 (3): E396–405.
CAS PubMed Статья PubMed Central Google Scholar
Liu Z, Li Y, Cui Y, Roberts C, Lu M, Wilhelmsson U, et al. Благоприятные эффекты реактивных астроцитов gfap / виментина для ремоделирования аксонов и восстановления двигательного поведения у мышей после инсульта.Глия. 2014. 62 (12): 2022–33.
PubMed PubMed Central Статья Google Scholar
Шидловска К., Завадска М., Каминска Б. Нейропротектор FK506 ингибирует глутамат-индуцированный апоптоз астроцитов in vitro и in vivo. J Neurochem. 2006; 99 (3): 965–75.
CAS PubMed Статья PubMed Central Google Scholar
Дворянчикова Г., Баракат Д., Брамбилла Р., Агудело С., Эрнандес Е., Бетеа Дж. Р. и др.Инактивация астроглиального NF-каппа B способствует выживанию нейронов сетчатки после ишемического повреждения. Eur J Neurosci. 2009. 30 (2): 175–85.
PubMed PubMed Central Статья Google Scholar
Vogelgesang A, Becker KJ, Dressel A. Иммунологические последствия ишемического инсульта. Acta Neurol Scand. 2014; 129 (1): 1–12.
CAS PubMed Статья PubMed Central Google Scholar
Del Zoppo GJ. Сосудисто-нервный аппарат на фоне инсульта. J Intern Med. 2010. 267 (2): 156–71.
PubMed PubMed Central Статья CAS Google Scholar
Yang Y, Rosenberg GA. Матричные металлопротеиназы как терапевтические мишени при инсульте. Brain Res. 2015; 1623: 30–8.
CAS PubMed PubMed Central Статья Google Scholar
Armulik A, Mäe M, Betsholtz C. Перициты и гематоэнцефалический барьер: последние достижения и значение для лечения ЦНС. Ther Deliv. 2011; 2 (4): 419–22.
PubMed Статья PubMed Central Google Scholar
Фернандес-Клетт Ф., Приллер Дж. Различные функции перицитов в регуляции мозгового кровотока и ишемии. J Cereb Blood Flow Metab. 2015; 35 (6): 883–7.
PubMed PubMed Central Статья Google Scholar
ElAli A, Thériault P, Rivest S. Роль перицитов в ремоделировании нервно-сосудистых единиц при заболеваниях головного мозга. Int J Mol Sci. 2014; 15 (4): 6453–74.
PubMed PubMed Central Статья CAS Google Scholar
Янссон Д., Рустенховен Дж., Фенг С., Херли Д., Олдфилд Р.Л., Бергин П.С. и др. Роль перицитов головного мозга человека в нейровоспалении. J Нейровоспаление. 2014; 11: 104.
PubMed PubMed Central Статья CAS Google Scholar
Persidsky Y, Hill J, Zhang M, Dykstra H, Winfield M, Reichenbach NL, et al. Нарушение функции перицитов головного мозга при хроническом нейровоспалении. J Cereb Blood Flow Metab. 2016; 36 (4): 794–807.
CAS PubMed Статья PubMed Central Google Scholar
Накагоми Т., Кубо С., Накано-Дои А., Сакума Р., Лу С., Нарита А. и др. Перициты сосудов головного мозга после ишемии обладают мультипотенциальной активностью стволовых клеток для дифференцировки в клетки нервного и сосудистого происхождения.Стволовые клетки (Дейтон, Огайо). 2015; 33 (6): 1962–74.
CAS Статья Google Scholar
Озен I, Дейерборг Т., Михарада К., Падель Т., Энглунд Э, Дженов Г. и др. После инсульта перициты мозга приобретают микроглиальный фенотип. Acta neuropathologica. 2014; 128 (3): 381–96.
PubMed PubMed Central Статья Google Scholar
Сакума Р., Кавахара М., Накано-Дои А., Такахаши А., Танака И., Нарита А. и др.Перициты головного мозга служат в качестве мультипотентных сосудистых стволовых клеток, генерирующих микроглию после ишемического инсульта. J Нейровоспаление. 2016; 13 (1): 57.
PubMed PubMed Central Статья CAS Google Scholar
Shi Y, Zhang L, Pu H, Mao L, Hu X, Jiang X, et al. Быстрая реорганизация эндотелиального цитоскелета делает возможным раннее нарушение гематоэнцефалического барьера и длительное ишемическое реперфузионное повреждение головного мозга. Nat Commun. 2016; 7: 10523.
CAS PubMed PubMed Central Статья Google Scholar
Димитриевич О.Б., Стаматович С.М., Кипр РФ, Анджелкович А.В. Влияние хемокина CCL2 на проницаемость гематоэнцефалического барьера во время ишемии-реперфузионного повреждения. J Cereb Blood Flow Metab. 2006. 26 (6): 797–810.
CAS PubMed Статья PubMed Central Google Scholar
Candelario-Jalil E. Механизмы повреждения и восстановления при ишемическом инсульте: соображения для разработки новых нейротерапевтических средств. Curr Opin исследует наркотики. 2009. 10 (7): 644–54.
CAS PubMed PubMed Central Google Scholar
Ceulemans A-G, Zgavc T, Kooijman R, Hachimi-Idrissi S, Sarre S, Michotte Y. Двойная роль нейровоспалительного ответа после ишемического инсульта: модулирующие эффекты гипотермии.J Нейровоспаление. 2010; 7 (1): 74.
PubMed PubMed Central Статья Google Scholar
Kleinschnitz C, Blecharz K, Kahles T., Schwarz T., Kraft P, Gobel K, et al. Нечувствительность к глюкокортикоидам на гипоксическом гематоэнцефалическом барьере может быть устранена путем ингибирования протеасомы. Инсульт. 2011; 42 (4): 1081–9.
CAS PubMed Статья PubMed Central Google Scholar
Цзян X, Анджелкович А.В., Чжу Л., Ян Т., Беннетт М.В.Л., Чен Дж. И др. Дисфункция гематоэнцефалического барьера и восстановление после ишемического инсульта. Prog Neurobiol. 2018; 163-164: 144–71.
CAS PubMed Статья PubMed Central Google Scholar
Мартынов М.Ю., Гусев Е.И. Современные знания о нейропротекторных и нейрорегенеративных свойствах цитиколина при остром ишемическом инсульте. J Exp Pharmacol. 2015; 7: 17–28.
CAS PubMed PubMed Central Статья Google Scholar
Джиклинг ГК, Лю Д., Андер Б.П., Стамова Б., Чжан Х, Шарп Фр. Нацеливание на нейтрофилы при ишемическом инсульте: выводы экспериментальных исследований. J Cereb Blood Flow Metab. 2015; 35 (6): 888–901.
CAS PubMed PubMed Central Статья Google Scholar
Хуанг Л., Ву З.Б., Чжугэ Q, Чжэн В., Шао Б., Ван Б. и др. Образование глиальных рубцов происходит в головном мозге человека после ишемического инсульта. Международный журнал медицинских наук.2014; 11 (4): 344–8.
PubMed PubMed Central Статья Google Scholar
Деринг Ю., Дрекслер М., Зенляйн О., Вебер К. Нейтрофилы при атеросклерозе. Артериосклероз, тромбоз и сосудистая биология. 2015; 35 (2): 288–95.
PubMed Статья CAS PubMed Central Google Scholar
Wang Q, Tang XN, Yenari MA. Воспалительная реакция при инсульте.J Neuroimmunol. 2007. 184 (1): 53–68.
CAS PubMed Статья PubMed Central Google Scholar
Перера М.Н., Ма Х.К., Аракава С., Хауэллс Д.В., Маркус Р., Роу СС и др. Воспаление после инсульта. J Clin Neurosci. 2006; 13 (1): 1–8.
CAS Статья Google Scholar
Ту X-k, Yang W-z, Shi S-s, Wang C-h, Zhang G-l, Ni T-r, et al. Пространственно-временное распределение воспалительной реакции и экспрессии сигнального пути TLR2 / 4 в головном мозге крыс после перманентной очаговой церебральной ишемии.Neurochem Res. 2010. 35 (8): 1147–55.
CAS PubMed Статья PubMed Central Google Scholar
Furlan J, Vergouwen M, Silver F. Количество лейкоцитов как маркер тяжести инсульта и клинических исходов после острого ишемического инсульта (P03.011). Неврология. 2012; 78 (1 приложение): P03.011 – P03.
Google Scholar
Ян Дж., Лю Дж., Грир Дж. М., МакКомб, Пенсильвания.Повышенная экспрессия генов, связанных с гипоксией, в лейкоцитах периферической крови людей с острым ишемическим инсультом. Clin Exp Neuroimmunology. 2014. 5 (2): 216–26.
CAS Статья Google Scholar
Amantea D, Nappi G, Bernardi G, Bagetta G, Corasaniti MT. Постишемическое поражение головного мозга: патофизиология и роль медиаторов воспаления. FEBS J. 2009; 276 (1): 13–26.
CAS PubMed Статья PubMed Central Google Scholar
Kriz J. Воспаление при ишемической травме головного мозга: важно время. Crit Rev Neurobiol. 2006. 18 (1-2): 145–57.
CAS Статья Google Scholar
Шиллинг М., Бессельманн М., Леонард С., Мюллер М., Рингельштейн Э. Б., Кифер Р. Активация микроглии предшествует инфильтрации макрофагов и преобладает над инфильтрацией макрофагов при временной фокальной ишемии головного мозга: исследование на зеленых флуоресцентных белках, трансгенных химерных мышах костного мозга. Exp Neurol.2003. 183 (1): 25–33.
PubMed Статья PubMed Central Google Scholar
Танака Р., Комине-Кобаяши М., Мочизуки Х., Ямада М., Фуруя Т., Мигита М. и др. Миграция усиленного зеленого флуоресцентного белка, экспрессирующего микроглию / макрофаги костного мозга, в мозг мыши после перманентной очаговой ишемии. Неврология. 2003. 117 (3): 531–9.
CAS PubMed Статья PubMed Central Google Scholar
Прайс С, Менон Д., Питерс А., Баллинджер Дж., Барбер Р., Балан К. и др. Набор церебральных нейтрофилов, гистология и исход при остром ишемическом инсульте: исследование на основе изображений. Инсульт. 2004. 35 (7): 1659–64.
CAS PubMed Статья PubMed Central Google Scholar
Бак Б. Х., Либескинд Д. С., Савер Дж. Л., Банг О. Ю., Юн С. В., Старкман С. и др. Ранняя нейтрофилия связана с объемом ишемической ткани при остром инсульте.Инсульт. 2008. 39 (2): 355–60.
PubMed Статья PubMed Central Google Scholar
Йилмаз Г., Грейнджер Д.Н. Молекулы клеточной адгезии и ишемический инсульт. Neurol Res. 2008. 30 (8): 783–93.
PubMed PubMed Central Статья Google Scholar
Ян Й., Джалал Ф.Й., Томпсон Дж. Ф., Уокер Е. Дж., Канделарио-Джалил Е., Ли Л. и др. Тканевый ингибитор металлопротеиназы-3 опосредует гибель незрелых олигодендроцитов через TNF-α / TACE при очаговой ишемии головного мозга у мышей.J Нейровоспаление. 2011; 8 (1): 108.
CAS PubMed PubMed Central Статья Google Scholar
Zinnhardt B, Viel T, Wachsmuth L, Vrachimis A, Wagner S, Breyholz HJ, et al. Мультимодальная визуализация выявляет временную и пространственную активность микроглии и матриксной металлопротеиназы после экспериментального инсульта. J Cereb Blood Flow Metab. 2015; 35 (11): 1711–21.
CAS PubMed PubMed Central Статья Google Scholar
Ян Й, Хилл Дж. У., Розенберг, Джорджия. Множественная роль металлопротеиназ в неврологических расстройствах. Prog Mol Biol Transl Sci. 2011; 99: Elsevier: 241–63.
CAS PubMed Статья PubMed Central Google Scholar
Тейлор Р.А., Сансинг Л.Х. Ответы микроглии после ишемического инсульта и внутримозгового кровоизлияния. Clin Dev Immunol. 2013; 2013: 746068.
PubMed PubMed Central Статья CAS Google Scholar
Gülke E, Gelderblom M, Magnus T. Опасные сигналы при инсульте и их роль в активации микроглии после ишемии. Ther Adv Neurol Disord. 2018; 11: 1756286418774254.
PubMed PubMed Central Статья CAS Google Scholar
Zhao SC, Ma LS, Chu ZH, Xu H, Wu WQ, Liu F. Регулирование активации микроглии при инсульте. Acta Pharmacol Sin. 2017; 38 (4): 445–58.
CAS PubMed PubMed Central Статья Google Scholar
Mracsko E, Javidi E, Na S-Y, Kahn A, Liesz A, Veltkamp R. Инвазия лейкоцитов в мозг после экспериментального внутримозгового кровоизлияния у мышей. Инсульт. 2014. 45 (7): 2107–14.
PubMed Статья PubMed Central Google Scholar
Schilling M, Besselmann M, Müller M, Strecker JK, Ringelstein EB, Kiefer R. Преобладающая фагоцитарная активность резидентной микроглии над гематогенными макрофагами после транзиторной фокальной ишемии головного мозга: исследование с использованием зеленых флуоресцентных белков, трансгенных химерных мышей костного мозга .Exp Neurol. 2005. 196 (2): 290–7.
CAS PubMed Статья PubMed Central Google Scholar
Шиллинг М., Стрекер Дж. К., Шебитц В. Р., Рингельштейн Е., Кифер Р. Влияние хемоаттрактантного белка 1 моноцитов на рекрутирование переносимых кровью клеток после временной фокальной церебральной ишемии у мышей. Неврология. 2009. 161 (3): 806–12.
CAS PubMed Статья PubMed Central Google Scholar
Breckwoldt MO, Chen JW, Stangenberg L, Aikawa E, Rodriguez E, Qiu S и др. Отслеживание воспалительной реакции при инсульте in vivo путем определения фермента миелопероксидазы. Proc Natl Acad Sci. 2008. 105 (47): 18584–9.
CAS PubMed Статья PubMed Central Google Scholar
Коковай Э., Ли Л., Каннингем Л.А. Ангиогенный набор перицитов из костного мозга после инсульта. J Cereb Blood Flow Metab. 2006. 26 (4): 545–55.
CAS PubMed Статья PubMed Central Google Scholar
Кроненберг Г., Улеманн Р., Рихтер Н., Клемпин Ф., Вегнер С., Штаерк Л. и др. Отличительные особенности макрофагов, происходящих из микроглии и моноцитов, после инсульта. Acta neuropathologica. 2018; 135 (4): 551–68.
CAS PubMed Статья PubMed Central Google Scholar
Вестон Р.М., Джонс Н.М., Джарротт Б., Каллавей Дж. К..Воспалительная клеточная инфильтрация после церебральной ишемии, вызванной эндотелином-1: гистохимическая и миелопероксидазная корреляция с временными изменениями при травме головного мозга. J Cereb Blood Flow Metab. 2007. 27 (1): 100–14.
CAS PubMed Статья PubMed Central Google Scholar
Watcharotayangul J, Mao L, Xu H, Vetri F, Baughman VL, Paisansathan C, et al. Ингибирование протеина-1 постишемической сосудистой адгезии обеспечивает нейрозащиту на модели временной окклюзии средней мозговой артерии у крыс.J Neurochem. 2012; 123 (Приложение 2): 116–24.
CAS PubMed PubMed Central Статья Google Scholar
Перес-де-Пуч И., Миро-Мур Ф., Феррер-Феррер М., Гелпи Е., Педрагоса Дж., Джастисия С. и др. Рекрутирование нейтрофилов в мозг при ишемическом инсульте у мышей и людей. Acta Neuropathol. 2015. 129 (2): 239–57.
CAS PubMed Статья PubMed Central Google Scholar
Gelderblom M, Leypoldt F, Steinbach K, Behrens D, Choe C-U, Siler DA, et al. Временная и пространственная динамика накопления церебральных иммунных клеток при инсульте. Инсульт. 2009. 40 (5): 1849–57.
PubMed Статья PubMed Central Google Scholar
Джин Г, Цудзи К., Син Си, Ян И-Г, Ван Х, Ло Э. Нокаут гена CD47 защищает от временной очаговой ишемии головного мозга у мышей. Exp Neurol. 2009. 217 (1): 165–70.
CAS PubMed PubMed Central Статья Google Scholar
Tsai NW, Chang WN, Shaw CF, Jan CR, Lu CH. Апоптоз лейкоцитов у пациентов с острым ишемическим инсультом. Clin Exp Pharmacol Physiol. 2010. 37 (9): 884–8.
CAS PubMed Статья PubMed Central Google Scholar
Гохан С., Ожасенеклер А., Мансур Дургун Х., Акил Е., Устундаг М., Орак М. Соотношение нейтрофильных лимфоцитов при подтипах инсульта и транзиторной ишемической атаке. Eur Rev Med Pharmacol Sci. 2013. 17 (5): 653–7.
CAS PubMed PubMed Central Google Scholar
Фэн И, Ляо С., Вэй К., Цзя Д., Вуд К., Лю К. и др. Инфильтрация и персистенция лимфоцитов во время поздней стадии церебральной ишемии в моделях окклюзии средней мозговой артерии и фототромботического инсульта. J Нейровоспаление. 2017; 14 (1): 248.
PubMed PubMed Central Статья CAS Google Scholar
Jander S, Kraemer M, Schroeter M, Witte OW, Stoll G. Лимфоцитарная инфильтрация и экспрессия молекулы межклеточной адгезии-1 при фотохимической ишемии коры головного мозга крысы. J Cereb Blood Flow Metab. 1995. 15 (1): 42–51.
CAS PubMed Статья Google Scholar
Йилмаз Г., Арумугам Т.В., Стокс К.Ю., Грейнджер Д.Н. Роль Т-лимфоцитов и гамма-интерферона при ишемическом инсульте. Тираж. 2006. 113 (17): 2105–12.
PubMed Статья Google Scholar
Hum PD, Subramanian S, Parker SM, Afentoulis ME, Kaler LJ, Vandenbark AA, et al. У мышей с дефицитом Т- и В-клеток с экспериментальным инсультом размер поражения и воспаление уменьшились. J Cereb Blood Flow Metab. 2007. 27 (11): 1798–805.
Артикул CAS Google Scholar
Се Л., Ян Ш. Взаимодействие астроцитов и Т-клеток в физиологических и патологических состояниях.Brain Res. 2015; 1623: 63–73.
CAS PubMed PubMed Central Статья Google Scholar
Liesz A, Suri-Payer E, Veltkamp C, Doerr H, Sommer C, Rivest S, et al. Регуляторные Т-клетки являются ключевыми церебропротекторными иммуномодуляторами при остром экспериментальном инсульте. Nat Med. 2009. 15 (2): 192–9.
CAS PubMed Статья PubMed Central Google Scholar
Ren X, Akiyoshi K, Vandenbark AA, Hurn PD, Offner H. CD4 + FoxP3 + регуляторные Т-клетки при церебральном ишемическом инсульте. Metab Brain Dis. 2011; 26 (1): 87–90.
PubMed Статья CAS PubMed Central Google Scholar
Kleinschnitz C, Kraft P, Dreykluft A, Hagedorn I, Gobel K, Schuhmann MK, et al. Регуляторные Т-клетки являются сильными промоторами острого ишемического инсульта у мышей, вызывая дисфункцию микрососудов головного мозга.Кровь. 2013. 121 (4): 679–91.
CAS PubMed PubMed Central Статья Google Scholar
Синнинг К., Вестерманн Д., Клемменсен П. Окислительный стресс при ишемии и реперфузии: современные концепции, новые идеи и перспективы на будущее. Biomark Med. 2017; 11 (11): 11031–40.
PubMed Статья CAS Google Scholar
Van Hemelrijck A, Hachimi-Idrissi S, Sarre S, Ebinger G, Michotte Y.Постишемическая умеренная гипотермия подавляет апоптоз в области полутени за счет снижения нейрональной активности синтазы оксида азота и, таким образом, предотвращения образования гидроксильных радикалов, индуцированного эндотелином-1. Eur J Neurosci. 2005. 22 (6): 1327–37.
PubMed Статья Google Scholar
Ширли Р., Ord EN, Work LM. Окислительный стресс и использование антиоксидантов при инсульте. Антиоксиданты (Базель, Швейцария). 2014; 3 (3): 472–501.
PubMed Central PubMed Google Scholar
Chen ZQ, Mou RT, Feng DX, Wang Z, Chen G. Роль оксида азота при инсульте. Med Gas Res. 2017; 7 (3): 194–203.
CAS PubMed PubMed Central Статья Google Scholar
Лю П, Сюй Б, Hock CE, Nagele R, Sun FF, Wong PY. NO модулирует экспрессию мРНК P-селектина и ICAM-1 и гемодинамические изменения в I / R печени. Am J Physiol. 1998; 275 (6): h3191 – H8.
CAS PubMed Google Scholar
Lundblad C, Grände P-O, Bentzer P. Гемодинамические и гистологические эффекты черепно-мозговой травмы у мышей с дефицитом eNOS. J Neurotrauma. 2009. 26 (11): 1953–62.
PubMed Статья Google Scholar
Гарсия-Бонилья Л., Мур Дж. М., Ракчуми Дж., Чжоу П., Батлер Дж. М., Иадекола С. и др. Индуцируемая синтаза оксида азота в нейтрофилах и эндотелии способствует ишемическому повреждению головного мозга у мышей. J Immunol. 2014. 193 (5): 2531–7.
CAS PubMed PubMed Central Статья Google Scholar
Ли В., Ян С. Ориентация на окислительный стресс для лечения ишемического инсульта: терапевтические стратегии выше и ниже по течению. Циркуляция мозга. 2016; 2 (4): 153–63.
PubMed PubMed Central Статья Google Scholar
van der Worp HB, Bar PR, Kappelle LJ, de Wildt DJ.Уровни витамина Е в рационе влияют на исход перманентной очаговой ишемии головного мозга у крыс. Инсульт. 1998; 29 (5): 1002–5 обсуждение 5–6.
PubMed Статья Google Scholar
Гарсия-Эстрада Дж., Гонсалес-Перес О, Гонсалес-Кастанеда Р. Э., Мартинес-Контрерас А., Лукин С., де ла Мора П. Г. и др. Смесь альфа-липоевая кислота-витамин Е снижает перекисное окисление липидов после эмболии, инфаркт мозга и неврологический дефицит у крыс. Neurosci Res.2003. 47 (2): 219–24.
CAS PubMed Статья PubMed Central Google Scholar
van der Worp HB, Thomas CE, Kappelle LJ, Hoffman WP, de Wildt DJ, Bar PR. Ингибирование железозависимого и вызванного ишемией повреждения мозга аналогом альфа-токоферола 74 722 лей. Exp Neurol. 1999. 155 (1): 103–8.
PubMed Статья PubMed Central Google Scholar
Ascherio A, Rimm EB, Hernan MA, Giovannucci E, Kawachi I, Stampfer MJ, et al. Связь потребления витамина E, витамина C и каротиноидов с риском инсульта среди мужчин в США. Анналы внутренней медицины. 1999. 130 (12): 963–70.
CAS PubMed Статья PubMed Central Google Scholar
Rabadi MH, Kristal BS. Влияние добавок витамина С на восстановление после инсульта: исследование случай-контроль.Клинические вмешательства при старении. 2007. 2 (1): 147–51.
CAS PubMed PubMed Central Статья Google Scholar
Schürks M, Glynn RJ, Rist PM, Tzourio C, Kurth T. Влияние витамина E на подтипы инсульта: метаанализ рандомизированных контролируемых исследований. BMJ. 2010; 341: c5702.
PubMed PubMed Central Статья Google Scholar
Като Н., Янака К., Нагасе С., Хираяма А., Нос Т.Антиоксидант EPC-K1 уменьшает травмы головного мозга, ингибируя перекисное окисление липидов на крысиной модели транзиторной фокальной церебральной ишемии. Acta neurochirurgica. 2003; 145 (6): 489–93 обсуждение 93.
CAS PubMed PubMed Central Google Scholar
Ямамото С., Хагивара С., Хидака С., Шингу С., Гото К., Кашима К. и др. Антиоксидант EPC-K1 ослабляет ишемическое реперфузионное повреждение почек на модели крыс. Американский журнал нефрологии.2011; 33 (6): 485–90.
CAS PubMed Статья Google Scholar
Antonic A, Dottori M, Macleod MR, Donnan GA, Howells DW. NXY-059, неэффективный нейропротектор при инсульте, не обеспечивает защиты нейронам человека, полученным из стволовых клеток. J Stroke Cerebrovasc Dis. 2018; 27 (8): 2158–65.
PubMed Статья PubMed Central Google Scholar
van der Worp HB, Kappelle LJ, Algra A, Bär PR, Orgogozo JM, Ringelstein EB, et al.Влияние тирилазада мезилата на объем инфаркта у пациентов с острым ишемическим инсультом. Неврология. 2002. 58 (1): 133–5.
PubMed Статья PubMed Central Google Scholar
Ватанабэ К., Танака М., Юки С., Хираи М., Ямамото Ю. Как эдаравон эффективен при остром ишемическом инсульте и боковом амиотрофическом склерозе? J Clin Biochem Nutr. 2018; 62 (1): 20–38.
CAS PubMed Статья PubMed Central Google Scholar
Toyoda K, Fujii K, Kamouchi M, Nakane H, Arihiro S, Okada Y и др. Поглотитель свободных радикалов, эдаравон, при инсульте с окклюзией внутренней сонной артерии. J Neurol Sci. 2004. 221 (1-2): 11–7.
CAS PubMed Статья Google Scholar
Кларк WM. Эффективность цитиколина при лечении острого инсульта. Мнение специалиста по фармакотерапии. 2009. 10 (5): 839–46.
CAS PubMed Статья Google Scholar
Гриб П. Нейропротекторные свойства цитиколина: факты, сомнения и нерешенные вопросы. Препараты ЦНС. 2014. 28 (3): 185–93.
CAS PubMed PubMed Central Статья Google Scholar
Rajah GB, Ding Y. Экспериментальная нейропротекция при ишемическом инсульте: краткий обзор. Нейрохирургическая направленность. 2017; 42 (4): E2.
PubMed Статья Google Scholar
Альварес-Сабин Дж., Роман ГК. Роль цитиколина в нейропротекции и нейрорепарации при ишемическом инсульте. Brain Sci. 2013. 3 (3): 1395–414.
PubMed PubMed Central Статья CAS Google Scholar
Давалос А., Альварес-Сабин Дж., Кастильо Дж., Диез-Техедор Е., Ферро Дж., Мартинес-Вила Е. и др. Цитиколин в лечении острого ишемического инсульта: международное рандомизированное многоцентровое плацебо-контролируемое исследование (исследование ICTUS).Ланцет (Лондон, Англия). 2012. 380 (9839): 349–57.
CAS Статья Google Scholar
Secades JJ, Alvarez-Sabin J, Castillo J, Diez-Tejedor E, Martinez-Vila E, Rios J, et al. Цитиколин при остром ишемическом инсульте: систематический обзор и формальный метаанализ рандомизированных, двойных слепых и плацебо-контролируемых исследований. J Stroke Cerebrovasc Dis. 2016; 25 (8): 1984–96.
PubMed Статья Google Scholar
Ши PY, Чжоу XC, Инь XX, Xu LL, Zhang XM, Bai HY. Раннее применение цитиколина в лечении острого инсульта: метаанализ рандомизированных контролируемых исследований. J Huazhong Univ Sci Technolog Med Sci. 2016; 36 (2): 270–7.
CAS PubMed Статья Google Scholar
Овергаард К. Эффекты цитиколина при остром ишемическом инсульте: обзор. J Stroke Cerebrovasc Dis. 2014; 23 (7): 1764–9.
PubMed Статья Google Scholar
Столп НВ. Нейропоэтические цитокины при нормальном развитии мозга и нарушениях нервного развития. Молекулярная и клеточная нейронауки. 2013; 53: 63–8.
CAS PubMed Статья Google Scholar
Лахан С.Е., Кирхгесснер А., Хофер М. Воспалительные механизмы при ишемическом инсульте: терапевтические подходы. J Translational Med. 2009; 7 (1): 97.
Артикул CAS Google Scholar
Рейес Р., Карденс Б., Мачадо-Пинеда Ю., Кабаньяс С. Тетраспанин CD9: ключевой регулятор клеточной адгезии в иммунной системе. Границы иммунологии. 2018; 9 (863). https://doi.org/10.3389/fimmu.2018.00863.
Сайранен Т., Карпен О., Карьялайнен-Линдсберг М.-Л., Паэтау А., Турпейнен Ю., Касте М. и др. Эволюция продукции фактора некроза опухоли головного мозга-α во время ишемического инсульта у человека. Инсульт. 2001. 32 (8): 1750–8.
CAS PubMed Статья Google Scholar
He H-Y, Ren L, Guo T, Deng Y-H. Нейрональная аутофагия усугубляет воспалительное повреждение микроглии, подавляя CX3CL1 / фракталкин после ишемического инсульта. Исследование нейронной регенерации. 2019; 14 (2): 280–8.
PubMed PubMed Central Статья Google Scholar
Лай А.Ю., Тодд К.Г. Микроглия при ишемии головного мозга: молекулярные действия и взаимодействия. Канадский журнал физиологии и фармакологии. 2006. 84 (1): 49–59.
CAS PubMed Статья Google Scholar
Disdier C, Chen X, Kim JE, Threlkeld SW, Stonestreet BS. Антицитокиновая терапия для ослабления ишемического реперфузионного повреждения головного мозга в перинатальном периоде. Brain Sci. 2018; 8 (6). https://doi.org/10.3390/brainsci8060101.
PubMed Central Статья PubMed Google Scholar
Ян К., Хокинс К.Э., Доре С., Канделарио-Джалил Э.Нейровоспалительные механизмы повреждения гематоэнцефалического барьера при ишемическом инсульте. Американский журнал физиологии-клеточной физиологии. 2019; 316 (2): C135 – C53.
CAS PubMed Статья Google Scholar
Рамиро Л., Симатс А., Гарсия-Беррокосо Т., Монтанер Дж. Воспалительные молекулы могут стать как биомаркерами, так и терапевтическими мишенями для лечения инсульта. Терапевтические достижения при неврологических расстройствах. 2018; 11: 1756286418789340.
PubMed PubMed Central Статья CAS Google Scholar
Dziewulska D, Mossakowski MJ. Клеточная экспрессия фактора некроза опухоли а и его рецепторов при ишемическом инсульте у человека. Клиническая невропатология. 2003. 22 (1): 35–40.
CAS PubMed Google Scholar
Заремба Дж., Лози Дж. Ранние уровни TNF-альфа коррелируют с тяжестью ишемического инсульта.Acta Neurol Scand. 2001. 104 (5): 288–95.
CAS PubMed Статья Google Scholar
Собовале О.А., Парри-Джонс А.Р., Смит С.Дж., Тиррелл П.Дж., Ротвелл, штат Нью-Джерси, Аллан С.М. Интерлейкин-1 при инсульте. Инсульт. 2016; 47 (8): 2160–7.
PubMed Статья Google Scholar
Ламбертсен К.Л., Бибер К., Финсен Б. Воспалительные цитокины при экспериментальном инсульте и инсульте человека.J Cereb Blood Flow Metab. 2012; 32 (9): 1677–98.
CAS PubMed PubMed Central Статья Google Scholar
Ormstad H, Aass HCD, Lund-Sørensen N, Amthor KF, Sandvik L. Исправление к: Уровни цитокинов и С-реактивного белка в сыворотке крови у пациентов с острым ишемическим инсультом и их связь с латерализацией инсульта, тип, и объем инфаркта. Журнал неврологии. 2012; 259 (2): 400.
Артикул Google Scholar
Тарковски Е., Розенгрен Л., Бломстранд С., Виккелсо С., Йенсен С., Экхольм С. и др. Ранняя интратекальная продукция интерлейкина-6 позволяет прогнозировать размер поражения мозга при инсульте. Инсульт. 1995. 26 (8): 1393–8.
CAS PubMed Статья Google Scholar
Waje-Andreassen U, Krakenes J, Ulvestad E, Thomassen L, Myhr KM, Aarseth J, et al. IL-6: ранний маркер исхода острого ишемического инсульта. Acta Neurol Scand. 2005. 111 (6): 360–5.
CAS PubMed Статья Google Scholar
Gredal H, Thomsen BB, Boza-Serrano A, Garosi L, Rusbridge C, Anthony D, et al. Уровень интерлейкина-6 повышен в плазме и спинномозговой жидкости у домашних собак, живущих в сообществе, с острым ишемическим инсультом. Нейроотчет. 2017; 28 (3): 134–40.
CAS PubMed PubMed Central Статья Google Scholar
Сингх Н., Хопкинс С.Дж., Халм С., Галеа Дж. П., Ходли М., Вейл А. и др. Эффект внутривенного антагониста рецептора интерлейкина-1 на медиаторы воспаления в спинномозговой жидкости после субарахноидального кровоизлияния: рандомизированное контролируемое исследование фазы II. Журнал нейровоспаления. 2014; 11 (1). https://doi.org/10.1186/1742-2094-11-1.
PubMed PubMed Central Статья CAS Google Scholar
Cekanaviciute E, Fathali N, Doyle KP, Williams AM, Han J, Buckwalter MS.Передача сигналов астроцитарного трансформирующего фактора роста-бета снижает подострое нейровоспаление после инсульта у мышей. Глия. 2014; 62 (8): 1227–40.
PubMed PubMed Central Статья Google Scholar
Doll DN, Barr TL, Simpkins JW. Цитокины: их роль при инсульте и потенциальное использование в качестве биомаркеров и терапевтических мишеней. Старение и болезни. 2014. 5 (5): 294–306.
PubMed PubMed Central Google Scholar
Рансохофф Р.М., Треттель Ф. Редакционная тема исследования «Хемокины и хемокиновые рецепторы в гомеостазе мозга». Границы клеточной неврологии. 2015; 9 (132). https://doi.org/10.3389/fncel.2015.00132.
Раман Д., Соболик-Дельмэр Т., Ричмонд А. Хемокины в здоровье и болезнях. Экспериментальные исследования клеток. 2011. 317 (5): 575–89.
CAS PubMed PubMed Central Статья Google Scholar
Мерфи ПМ. Хемокины и хемокиновые рецепторы. Клиническая иммунология: Elsevier. 2019; e1: 157–70.
Google Scholar
Hughes CE, Nibbs RJB. Справочник по хемокинам и их рецепторам. Журнал FEBS. 2018; 285 (16): 2944–71.
CAS PubMed PubMed Central Статья Google Scholar
Mennicken F, Maki R, de Souza EB, Quirion R. Хемокины и хемокиновые рецепторы в ЦНС: возможная роль в нейровоспалении и формировании паттерна.Направления фармакологических наук. 1999. 20 (2): 73–8.
CAS PubMed Статья Google Scholar
Бэкон КБ, Харрисон Дж. Хемокины и их рецепторы в нейробиологии: перспективы физиологии и гомеостаза. Журнал нейроиммунологии. 2000. 104 (1): 92–7.
CAS PubMed Статья Google Scholar
Vidale S, Consoli A, Arnaboldi M, Consoli D.Постишемическое воспаление при остром инсульте. Журнал клинической неврологии (Сеул, Корея). 2017; 13 (1): 1–9.
Артикул Google Scholar
Брайт В.Х., Ривера Дж., Бротон Б.Р., Ли С., Драммонд Г.Р., Соби К.Г. Экспрессия генов, связанных с хемокинами, в головном мозге после ишемического инсульта: CXCR2 не играет роли в исходе. Исследование мозга. 2011; 1372: 169–79.
CAS PubMed Статья Google Scholar
Hughes PM, Allegrini PR, Rudin M, Perry VH, Mir AK, Wiessner C. Дефицит белка-1 хемоаттрактанта моноцитов является защитным в модели инсульта на мышах. J Cereb Blood Flow Metab. 2002. 22 (3): 308–17.
CAS PubMed Статья Google Scholar
Fang W, Zhai X, Han D, Xiong X, Wang T, Zeng X и др. CCR2-зависимые моноциты / макрофаги усугубляют острое повреждение головного мозга, но способствуют функциональному восстановлению после ишемического инсульта у мышей.Тераностика. 2018; 8 (13): 3530–43.
CAS PubMed PubMed Central Статья Google Scholar
Димитриевич О.Б., Стаматович С.М., Кипр РФ, Анджелкович А.В. Отсутствие хемокинового рецептора CCR2 защищает от церебральной ишемии / реперфузионного повреждения у мышей. Инсульт. 2007. 38 (4): 1345–53.
CAS PubMed Статья Google Scholar
Guo YQ, Zheng LN, Wei JF, Hou XL, Yu SZ, Zhang WW и др.Экспрессия CCL2 и CCR2 в гиппокампе и интервенционная роль пропофола в ишемии / реперфузии головного мозга у крыс. Экспериментальная и лечебная медицина. 2014. 8 (2): 657–61.
CAS PubMed PubMed Central Статья Google Scholar
Гарсия-Беррокосо Т., Хиральт Д., Лломбарт В., Бустаманте А., Пенальба А., Флорес А. и др. Хемокины после ишемического инсульта у человека: от нервно-сосудистой системы до крови с использованием протеиновых массивов.Трансляционная протеомика. 2014; 3: 1–9.
Артикул CAS Google Scholar
Hammond MD, Taylor RA, Mullen MT, Ai Y, Aguila HL, Mack M, et al. Привлечение воспалительных моноцитов CCR2 + Ly6C (hi) усугубляет острую инвалидность после внутримозгового кровоизлияния. J Neurosci. 2014; 34 (11): 3901–9.
PubMed PubMed Central Статья CAS Google Scholar
Ваттананит С., Торнеро Д., Граубардт Н., Меманишвили Т., Монни Е., Татаришвили Дж. И др. Макрофаги, происходящие из моноцитов, способствуют спонтанному долгосрочному функциональному восстановлению после инсульта у мышей. J Neurosci. 2016; 36 (15): 4182–95.
CAS PubMed Статья Google Scholar
Greenhalgh AD, Zarruk JG, Healy LM, Baskar Jesudasan SJ, Jhelum P, Salmon CK, et al. Макрофаги периферического происхождения модулируют функцию микроглии, чтобы уменьшить воспаление после повреждения ЦНС.PLoS биология. 2018; 16 (10): e2005264.
PubMed PubMed Central Статья CAS Google Scholar
Глиэм М., Маусберг А.К., Ли Дж. И., Симиантонакис И., ван Ройен Н., Хартунг Х. П. и др. Макрофаги предотвращают трансформацию геморрагического инфаркта в моделях инсульта у мышей. Анналы неврологии. 2012. 71 (6): 743–52.
CAS PubMed Статья PubMed Central Google Scholar
Terao Y, Ohta H, Oda A, Nakagaito Y, Kiyota Y, Shintani Y. Макрофагальный воспалительный белок-3альфа играет ключевую роль в воспалительном каскаде фокальной церебральной ишемии у крыс. Неврологические исследования. 2009. 64 (1): 75–82.
CAS PubMed Статья PubMed Central Google Scholar
Лю X, Лю Дж., Чжао С., Чжан Х., Цай В., Цай М. и др. Интерлейкин-4 необходим для поляризации микроглии / макрофага M2 и длительного восстановления после церебральной ишемии.Инсульт. 2016; 47 (2): 498–504.
CAS PubMed PubMed Central Статья Google Scholar
Баджетто А., Бонавиа Р., Барберо С., Флорио Т., Скеттини Г. Хемокины и их рецепторы в центральной нервной системе. Границы нейроэндокринологии. 2001. 22 (3): 147–84.
CAS PubMed Статья PubMed Central Google Scholar
Ransohoff RM.Хемокины и хемокиновые рецепторы: на перекрестке иммунобиологии и нейробиологии. Иммунитет. 2009. 31 (5): 711–21.
CAS PubMed PubMed Central Статья Google Scholar
Leick M, Azcutia V, Newton G, Luscinskas FW. Рекрутинг лейкоцитов при воспалении: основные концепции и новые представления о механизмах, основанные на новых моделях и технологиях микроскопической визуализации. Клеточные и тканевые исследования. 2014. 355 (3): 647–56.
CAS PubMed PubMed Central Статья Google Scholar
Чен Ю., Халленбек Дж. М., Рютцлер К., Бол Д., Томас К., Берман Н. Э. и др. Сверхэкспрессия моноцитарного хемоаттрактантного белка 1 в головном мозге усугубляет ишемическое повреждение головного мозга и связана с привлечением воспалительных клеток. J Cereb Blood Flow Metab. 2003. 23 (6): 748–55.
Артикул CAS Google Scholar
Ким Дж. С., Гаутам С. К., Чопп М., Залога С., Джонс М. Л., Уорд П. А. и др. Экспрессия хемоаттрактантного белка-1 моноцитов и воспалительного белка-1 макрофагов после очаговой ишемии головного мозга у крыс. Журнал нейроиммунологии. 1995. 56 (2): 127–34.
CAS PubMed Статья PubMed Central Google Scholar
Chu HX, Arumugam TV, Gelderblom M, Magnus T, Drummond GR, Sobey CG. Роль CCR2 в воспалительных заболеваниях центральной нервной системы.J Cereb Blood Flow Metab. 2014; 34 (9): 1425–9.
CAS PubMed PubMed Central Статья Google Scholar
Стаматович С.М., Шакуи П., Кип Р.Ф., Мур Б.Б., Кункель С.Л., Ван Ройен Н. и др. Моноциты, хемоаттрактантный белок-1, регулируют проницаемость гематоэнцефалического барьера. J Cereb Blood Flow Metab. 2005. 25 (5): 593–606.
CAS PubMed Статья PubMed Central Google Scholar
Barone FC, Feuerstein GZ. Медиаторы воспаления и инсульт: новые возможности для новых методов лечения. Журнал мозгового кровотока и метаболизма. 1999. 19 (8): 819–34.
CAS Статья Google Scholar
Willard SS, Koochekpour S. Глутамат, рецепторы глутамата и нижестоящие пути передачи сигналов. Int J Biol Sci. 2013; 9 (9): 948–59.
CAS PubMed PubMed Central Статья Google Scholar
Mázala DA, Grange RW, Chin ER. Роль протеаз в нарушении связи возбуждения и сокращения при мышечной дистрофии. Am J Physiol Cell Physiol. 2015; 308 (1): C33–40.
PubMed Статья CAS PubMed Central Google Scholar
Weber JT. Измененная кальциевая сигнализация после черепно-мозговой травмы. Границы фармакологии. 2012; 3:60.
PubMed PubMed Central Статья CAS Google Scholar
Tymianski M, Charlton MP, Carlen PL, Tator CH. Специфичность источника ранней нейротоксичности кальция в культивируемых эмбриональных спинномозговых нейронах. J Neurosci. 1993. 13 (5): 2085–104.
CAS PubMed Статья PubMed Central Google Scholar
Саттлер Р., Тимянски М. Молекулярные механизмы опосредованной глутаматным рецептором эксайтотоксической гибели нейрональных клеток. Молекулярная нейробиология. 2001. 24 (1-3): 107–29.
CAS PubMed Статья PubMed Central Google Scholar
Xu J, Kurup P, Zhang Y, Goebel-Goody SM, Wu PH, Hawasli AH, et al. Внесинаптические рецепторы NMDA связываются преимущественно с эксайтотоксичностью через кальпаин-опосредованное расщепление STEP. J Neurosci. 2009. 29 (29): 9330–43.
CAS PubMed PubMed Central Статья Google Scholar
Casas AI, Kleikers PWM, Geuss E, Langhauser F, Egea J, Lopez MG, et al. Кальцийзависимое образование реактивного кислорода и разрушение гематоэнцефалического барьера NOX5 ограничивают постреперфузионные исходы при инсульте.bioRxiv. 2018: 359893. https://doi.org/10.1101/359893
Лю Ф., Лу Дж., Манаенко А., Тан Дж., Ху К. Митохондрии при ишемическом инсульте: новое понимание и последствия. Старение и болезни. 2018; 9 (5): 924–37.
PubMed PubMed Central Статья Google Scholar
Zhu J, Xu S, Li S, Yang X, Yu X, Zhang X. Повышающая регуляция GluN2A-содержащего рецептора NMDA защищает культивируемые нейронные клетки коры от окислительного стресса.Гелион. 2018; 4 (11): e00976-e.
Артикул Google Scholar
Wu QJ, Tymianski M. Нацеливание на рецепторы NMDA при инсульте: новая надежда на нейрозащиту. Молекулярный мозг. 2018; 11 (1): 15.
PubMed PubMed Central Статья CAS Google Scholar
Zhou L, Li F, Xu HB, Luo CX, Wu HY, Zhu MM, et al. Лечение ишемии головного мозга путем нарушения индуцированного ишемией взаимодействия nNOS с PSD-95.Nat Med. 2010. 16 (12): 1439–43.
CAS PubMed Статья PubMed Central Google Scholar
Ли Х. Дж., Чжэн Дж. Дж. Домены PDZ и их партнеры по связыванию: структура, специфичность и модификация. Сотовая связь и сигнализация. 2010; 8 (1): 8.
PubMed Статья CAS PubMed Central Google Scholar
Sattler R, Xiong Z, Lu WY, Hafner M, MacDonald JF, Tymianski M.Специфическое связывание активации рецептора NMDA с нейротоксичностью оксида азота белком PSD-95. Наука (Нью-Йорк, Нью-Йорк). 1999. 284 (5421): 1845–8.
CAS Статья Google Scholar
Кук Д. Д., Тевес Л., Тимянски М. Лечение инсульта с помощью ингибитора PSD-95 в головном мозге гринцефальных приматов. Природа. 2012. 483 (7388): 213–7.
CAS PubMed Статья PubMed Central Google Scholar
Чен Й, Бреннан-Миннелла А.М., Шет С., Эль-Бенна Дж., Суонсон, РА. Tat-NR2B9c предотвращает выработку эксайтотоксического нейронального супероксида. J Cereb Blood Flow Metab. 2015; 35 (5): 739–42.
CAS PubMed PubMed Central Статья Google Scholar
Teves LM, Cui H, Tymianski M. Эффективность ингибитора PSD95 Tat-NR2B9c у мышей требует трансляции доз между видами. J Cereb Blood Flow Metab. 2016; 36 (3): 555–61.
CAS PubMed Статья PubMed Central Google Scholar
Hill MD, Martin RH, Mikulis D, Wong JH, Silver FL, Terbrugge KG и др. Безопасность и эффективность NA-1 у пациентов с ятрогенным инсультом после эндоваскулярного восстановления аневризмы (ENACT): рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2. Ланцетная неврология. 2012; 11 (11): 942–50.
CAS PubMed Статья PubMed Central Google Scholar
Луо С-Х, Линь И-Х, Цянь Х-Д, Тан И, Чжоу Х-Х, Джин Х и др.Взаимодействие nNOS с PSD-95 отрицательно влияет на регенеративное восстановление после инсульта. Журнал неврологии. 2014. 34 (40): 13535–48.
PubMed Статья CAS PubMed Central Google Scholar
Лай TW, Zhang S, Wang YT. Эксайтотоксичность и инсульт: определение новых мишеней для нейрозащиты. Прогресс нейробиологии. 2014; 115: 157–88.
CAS PubMed Статья PubMed Central Google Scholar
Bach A, Pedersen SW, Dorr LA, Vallon G, Ripoche I, Ducki S, et al. Биохимические исследования механизма действия малых молекул ZL006 и IC87201 как потенциальных ингибиторов взаимодействий nNOS-PDZ / PSD-95-PDZ. Научные отчеты. 2015; 5: 12157.
CAS PubMed PubMed Central Статья Google Scholar
Hong JM, Choi MH, Sohn S.-I, Hwang Y-H, Ahn SH, Lee Y-B, et al. Безопасность и оптимальная нейрозащита neu2000 при остром ишемическом инсульте с повторной канализацией: протокол рандомизированного двойного слепого плацебо-контролируемого исследования фазы II.Испытания. 2018; 19 (1): 375.
PubMed PubMed Central Статья CAS Google Scholar
Чо С.И., Парк Ю.Дж., Чанг Дж.М., Гваг Б.Дж. Neu2000, NR2B-селективный, умеренный антагонист рецептора NMDA и мощный улавливающий спин молекулы при инсульте. Новости и перспективы наркотиков. 2010. 23 (9): 549–56.
CAS Статья Google Scholar
Fujikawa DG.Роль эксайтотоксического запрограммированного некроза в острой травме головного мозга. Журнал вычислительной и структурной биотехнологии. 2015; 13: 212–21.
CAS PubMed PubMed Central Статья Google Scholar
Тейлор Д.Л., Джонс Ф., Кубота ESCS, Покок Дж. М.. Стимуляция метаботропного глутаматного рецептора микроглии mGlu2 запускает нейротоксичность, индуцированную фактором некроза опухоли α, вместе с лигандом Fas, полученным из микроглии. Журнал неврологии.2005. 25 (11): 2952–64.
CAS PubMed Статья PubMed Central Google Scholar
Тан Х.К., Хейвуд Д., Ральф Г.С., Бинеманн А., Бейкер А.Х., Уни Дж. Б.. Тканевый ингибитор металлопротеиназы 1 подавляет эксайтотоксическую гибель клеток нейронов. Молекулярная и клеточная неврология. 2003. 22 (1): 98–106.
CAS PubMed Статья Google Scholar
Вандурен Дж., Ван Дамм Дж., Опденаккер Дж.О структуре и функциях желатиназы B / матричной металлопротеиназы-9 при нейровоспалении. Прогресс в исследованиях мозга. 2014; 214: Elsevier: 193–206.
PubMed Статья Google Scholar
Morancho A, Rosell A, García-Bonilla L, Montaner J. Металлопротеиназа и размер инсульта: роль в противовоспалительном лечении? Летопись Нью-Йоркской академии наук. 2010. 1207 (1): 123–33.
CAS PubMed Статья Google Scholar
Park KP, Rosell A, Foerch C, Xing C, Kim WJ, Lee S и др. Металлопротеиназа-9 плазмы и матрикса головного мозга после острой очаговой ишемии головного мозга у крыс. Инсульт. 2009. 40 (8): 2836–42.
CAS PubMed PubMed Central Статья Google Scholar
Розенберг Г.А. Матричные металлопротеиназы при нейровоспалении. Глия. 2002. 39 (3): 279–91.
PubMed Статья Google Scholar
Gasche Y, Soccal PM, Kanemitu M, Copin J-C. Матричные металлопротеиназы и заболевания центральной нервной системы с особым акцентом на ишемию головного мозга. Front Biosci. 2006. 11 (5): 1289–301.
CAS PubMed Статья Google Scholar
Golab P, Kielbus M, Bielewicz J, Kurzepa J. Влияние рекомбинантного тканевого активатора плазминогена на активности MMP-2 и MMP-9 in vitro. Неврологическое исследование. 2015; 37 (1): 9–13.
CAS PubMed Статья Google Scholar
Rosenberg G, Estrada E, Dencoff J. Матричные металлопротеиназы и TIMP связаны с открытием гематоэнцефалического барьера после реперфузии в головном мозге крысы. Инсульт. 1998. 29 (10): 2189–95.
CAS PubMed Статья Google Scholar
Курзепа Дж., Курзепа Дж., Голаб П., Черска С., Билевич Дж. Значение матричной металлопротеиназы (ММП) -2 и ММП-9 в ишемическом инсульте.Int J Neurosci. 2014. 124 (10): 707–16.
CAS PubMed Статья Google Scholar
Lenglet S, Montecucco F, Mach F, Schaller K, Gasche Y, Copin JC. Анализ экспрессии девяти секретируемых матриксных металлопротеиназ и их эндогенных ингибиторов в головном мозге мышей, перенесших ишемический инсульт. Тромбоз и гемостаз. 2014; 112 (02): 363–78.
CAS PubMed Статья Google Scholar
Cuadrado E, Rosell A, Borrell-Pagès M, García-Bonilla L, Hernández-Guillamon M, Ortega-Aznar A, et al. Матриксная металлопротеиназа-13 активируется и обнаруживается в ядре нервных клеток после церебральной ишемии. Журнал мозгового кровотока и метаболизма. 2009. 29 (2): 398–410.
CAS Статья Google Scholar
Amantea D, Certo M, Russo R, Bagetta G, Corasaniti MT, Tassorelli C. Раннее реперфузионное повреждение связано с повышением MMP2 и IL-1β в корковых нейронах крыс, подвергшихся окклюзии средней мозговой артерии.Неврология. 2014; 277: 755–63.
CAS PubMed Статья PubMed Central Google Scholar
Орбе Дж., Барренеткс Дж., Родригес Дж. А., Вивьен Д., Орсет С., Паркс В. и др. Матричная металлопротеиназа-10 эффективно уменьшает размер инфаркта при экспериментальном инсульте за счет усиления фибринолиза через механизм, опосредованный ингибитором фибринолиза, активируемый тромбином. Тираж. 2011: CIRCULATIONAHA. 111.047100.
Данг Б., Дуань X, Ван З., Хе В., Чен Г. Терапевтическая мишень церебрального геморрагического инсульта: матриксная металлопротеиназа-9. Текущие мишени для лекарств. 2017; 18 (12): 1358–66.
CAS PubMed Статья PubMed Central Google Scholar
Монтанер Дж., Альварес-Сабин Дж., Молина С., Англес А., Абиллейра С., Аренильяс Дж. И др. Экспрессия матричной металлопротеиназы после кардиоэмболического инсульта у человека: временной профиль и связь с неврологическими нарушениями.Инсульт. 2001. 32 (8): 1759–66.
CAS PubMed Статья PubMed Central Google Scholar
Ma F, Rodriguez S, Buxo X, Morancho A, Riba-Llena I, Carrera A, et al. Металлопротеиназы матрикса плазмы у больных с инсультом в процессе интенсивной реабилитационной терапии. Архивы физической медицины и реабилитации. 2016; 97 (11): 1832–40.
PubMed Статья Google Scholar
Абдельнасир М.М., Эльфауоми Н.М., Эсмаил Э.Х., Камаль М.М., Эльсави Э.Х. Матриксная металлопротеиназа-9 и восстановление после острого ишемического инсульта. Журнал инсульта и цереброваскулярных заболеваний. 2017; 26 (4): 733–40.
PubMed Статья Google Scholar
Steenport M, Khan KM, Du B, Barnhard SE, Dannenberg AJ, Falcone DJ. Матричная металлопротеиназа (MMP) -1 и MMP-3 индуцируют макрофаги MMP-9: доказательства роли TNF-альфа и циклооксигеназы-2.Журнал иммунологии (Балтимор, Мэриленд: 1950). 2009. 183 (12): 8119–27.
CAS Статья Google Scholar
Станимирович Д., Сато К. Воспалительные медиаторы церебрального эндотелия: роль в ишемическом воспалении головного мозга. Патология головного мозга. 2000. 10 (1): 113–26.
CAS PubMed Статья PubMed Central Google Scholar
Табучи С., Уодзуми Н., Исии С., Симидзу Ю., Ватанабэ Т., Симидзу Т.Мыши с дефицитом цитозольной фосфолипазы А2 менее восприимчивы к церебральной ишемии / реперфузионному повреждению. Вена: Шпрингер Вена; 2003.
Книга. Google Scholar
Rouzer CA, Marnett LJ. Циклооксигеназы: структурные и функциональные взгляды. Журнал липидных исследований. 2009. 50 Приложение: S29–34.
PubMed PubMed Central Статья CAS Google Scholar
Iadecola C, Sugimoto K, Niwa K, Kazama K, Ross ME. Повышенная восприимчивость к ишемическому повреждению головного мозга у мышей с дефицитом циклооксигеназы-1. J Cereb Blood Flow Metab. 2001. 21 (12): 1436–41.
CAS PubMed Статья Google Scholar
Candelario-Jalil E, González-Falcón A, García-Cabrera M, Álvarez D, Al-Dalain S, Martínez G, et al. Оценка относительного вклада изоформ ЦОГ-1 и ЦОГ-2 в вызванное ишемией окислительное повреждение и нейродегенерацию после временной глобальной церебральной ишемии.Журнал нейрохимии. 2003. 86 (3): 545–55.
CAS PubMed PubMed Central Статья Google Scholar
Chen C, Bazan NG. Липидная передача сигналов: сон, синаптическая пластичность и нейрозащита. Простагландины и другие липидные медиаторы. 2005; 77 (1-4): 65–76.
CAS Статья Google Scholar
Нива К., Араки Э., Морхам С.Г., Росс М.Э., Иадекола К.Циклооксигеназа-2 способствует функциональной гиперемии в коре головного мозга усов. Журнал неврологии. 2000. 20 (2): 763–70.
CAS PubMed Статья Google Scholar
Minghetti L. Циклооксигеназа-2 (ЦОГ-2) при воспалительных и дегенеративных заболеваниях головного мозга. Журнал невропатологии и экспериментальной неврологии. 2004. 63 (9): 901–10.
CAS Статья Google Scholar
Nogawa S, Zhang F, Ross ME, Iadecola C. Экспрессия гена циклооксигеназы-2 в нейронах способствует ишемическому повреждению головного мозга. Журнал неврологии. 1997. 17 (8): 2746–55.
CAS PubMed Статья Google Scholar
Иадекола С., Форстер С., Ногава С., Кларк Х. Б., Росс МЭ. Иммунореактивность циклооксигеназы-2 в головном мозге человека после церебральной ишемии. Acta neuropathologica. 1999. 98 (1): 9–14.
CAS PubMed Статья Google Scholar
Sairanen T, Ristimäki A, Karjalainen-Lindsberg ML, Paetau A, Kaste M, Lindsberg PJ. Циклооксигеназа-2 индуцируется глобально в инфаркте головного мозга человека. Анналы неврологии. 1998. 43 (6): 738–47.
CAS PubMed Статья Google Scholar
Topol EJ. Неудача для общественного здравоохранения — рофекоксиб, Merck и FDA. Медицинский журнал Новой Англии. 2004. 351 (17): 1707–9.
CAS PubMed Статья Google Scholar
Кавано Т., Анратер Дж., Чжоу П., Парк Л., Ван Г., Фрис К.А. и др. Рецепторы простагландина E 2 EP1: нижестоящие эффекторы нейротоксичности COX-2. Природная медицина. 2006; 12 (2): 225.
CAS PubMed Статья Google Scholar
Хата А.Н., Брейер Р.М. Фармакология и передача сигналов рецепторов простагландина: множественные роли в воспалении и иммунной модуляции. Фармакология и терапия. 2004. 103 (2): 147–66.
CAS Статья Google Scholar
Ахмад А.С., Салим С., Ахмад М., Доре С. Рецептор простагландина EP1 способствует эксайтотоксичности и очаговым ишемическим повреждениям головного мозга. Токсикологические науки. 2005. 89 (1): 265–70.
PubMed Статья CAS PubMed Central Google Scholar
Zhou P, Qian L, Chou T., Iadecola C. Нейропротекция посредством ингибирования рецептора PGE2 EP1 включает путь PTEN / AKT. Нейробиология болезни. 2008. 29 (3): 543–51.
CAS PubMed Статья PubMed Central Google Scholar
Baeuerle PA, Henkel T. Функция и активация NF-kappaB в иммунной системе. Ежегодный обзор иммунологии. 1994; 12 (1): 141–79.
CAS PubMed Статья PubMed Central Google Scholar
Хан М., Джатана М., Эланго С., Пейнтлия А.С., Сингх А.К., Сингх И. Защита сосудов головного мозга с помощью различных доноров оксида азота у крыс после экспериментального инсульта. Оксид азота. 2006. 15 (2): 114–24.
CAS PubMed Статья PubMed Central Google Scholar
Harari OA, Liao JK. NF-κB и врожденный иммунитет при ишемическом инсульте. Летопись Нью-Йоркской академии наук. 2010; 1207: 32–40.
CAS PubMed PubMed Central Статья Google Scholar
Херрманн О., Бауманн Б., де Лоренци Р., Мухаммад С., Чжан В., Клизик Дж. И др. IKK опосредует гибель нейронов, вызванную ишемией. Nat Med. 2005; 11 (12): 1322–9.
CAS PubMed Статья PubMed Central Google Scholar
Fann DY-W, Lim Y-A, Cheng Y-L, Lok K-Z, Chunduri P, Baik S-H и др. Доказательства того, что передача сигналов NF-κB и MAPK способствует активации воспаления NLRP в нейронах после ишемического инсульта. Молекулярная нейробиология. 2018; (2): 1082–1096. https://doi.org/10.1007/s12035-017-0394-9.
PubMed Статья CAS PubMed Central Google Scholar
Ким Э.К., Чой Э.Дж. Нарушение передачи сигналов MAPK при заболеваниях человека: обновление.Архив токсикологии. 2015; 89 (6): 867–82.
CAS PubMed Статья PubMed Central Google Scholar
Sun J, Nan G. Путь передачи сигналов митоген-активируемой протеинкиназы (MAPK) как открытая цель при инсульте. Журнал молекулярной неврологии. 2016; 59 (1): 90–8.
CAS PubMed Статья Google Scholar
Рой Чоудхури Дж., Рё М.-Дж., Потит Э, Вэнь Й., Хе Р, Сун Ф. и др.Участие p38 MAPK в реактивном астроглиозе, вызванном ишемическим инсультом. Исследование мозга. 2014; 1551: 45–58.
CAS PubMed Статья Google Scholar
Sims NR, Yew WP. Реактивный астроглиоз при инсульте: вклад астроцитов в восстановление неврологической функции. Международная нейрохимия. 2017; 107: 88–103.
CAS PubMed Статья Google Scholar
Уолтон К.М., ДиРокко Р., Бартлетт Б.А., Кури Э., Марси В.Р., Джарвис Б. и др. Активация p38MAPK в микроглии после ишемии. Журнал нейрохимии. 1998. 70 (4): 1764–7.
CAS PubMed Статья Google Scholar
Сугино Т., Нодзаки К., Такаги Ю., Хаттори И., Хашимото Н., Моригути Т. и др. Активация митоген-активируемых протеинкиназ после временной ишемии переднего мозга в гиппокампе песчанок. Журнал неврологии.2000. 20 (12): 4506–14.
CAS PubMed Статья Google Scholar
Maddahi A, Kruse LS, Chen QW, Edvinsson L. Роль рецепторов фактора некроза опухоли-альфа и TNF-альфа в церебральных артериях после церебральной ишемии у крыс. Журнал нейровоспаления. 2011; 8: 107.
CAS PubMed PubMed Central Статья Google Scholar
Maddahi A, Edvinsson L. Церебральная ишемия индуцирует экспрессию провоспалительных цитокинов микрососудов через путь MEK / ERK. Журнал нейровоспаления. 2010; 7: 14.
PubMed PubMed Central Статья CAS Google Scholar
Тао Х, Сунь Х, Инь Л, Хань Х, Сюй Л, Ци Й и др. Диосцин уменьшает церебральную ишемию / реперфузионное повреждение за счет подавления передачи сигналов TLR4 посредством ингибирования HMGB-1. Free Radic Biol Med.2015; 84: 103–15.
CAS PubMed Статья Google Scholar
Хаякава К., Араи К., Ло Э. Роль киназы карты ERK и CRM1 в стимулированном IL-1beta высвобождении HMGB1 из кортикальных астроцитов. Глия. 2010. 58 (8): 1007–15.
PubMed Google Scholar
Сингх В., Рот С., Вельткамп Р., Лис А. HMGB1 как ключевой медиатор иммунных механизмов при ишемическом инсульте.Антиоксиданты и редокс-сигналы. 2016; 24 (12): 635–51.
CAS Статья Google Scholar
Štros M. HMGB белки: взаимодействие с ДНК и хроматином. Biochimica et Biophysica Acta (BBA) — механизмы регуляции генов. 2010. 1799 (1): 101–13.
Артикул CAS Google Scholar
Уэда Т., Йошида М. Белки HMGB и регуляция транскрипции.Biochimica et Biophysica Acta (BBA) — механизмы регуляции генов. 2010. 1799 (1): 114–8.
CAS Статья Google Scholar
Кан Р., Чен Р., Чжан К., Хоу В., Ву С., Цао Л. и др. HMGB1 в здоровье и болезни. Молекулярные аспекты медицины. 2014; 40: 1–116.
CAS PubMed Статья Google Scholar
Мартинотти С., Патрон М., Ранзато Э. Новые роли белка HMGB1 в иммунитете, воспалении и раке.Иммуно-мишени и терапия. 2015; 4: 101–9.
CAS PubMed PubMed Central Google Scholar
Magna M, Писецкий Д.С. Роль HMGB1 в патогенезе воспалительных и аутоиммунных заболеваний. Молекулярная медицина (Кембридж, Массачусетс). 2014. 20 (1): 138–46.
PubMed Central Статья CAS PubMed Google Scholar
Ян Х., Трейси К.Дж.Нацеливание на HMGB1 при воспалении. Biochimica et Biophysica Acta (BBA) — механизмы регуляции генов. 2010. 1799 (1): 149–56.
CAS Статья Google Scholar
Ян Х, Ван Х, Чура CJ, Трейси KJ. Цитокиновая активность HMGB1. Журнал биологии лейкоцитов. 2005; 78 (1): 1–8.
CAS PubMed Статья Google Scholar
Qiu J, Nishimura M, Wang Y, Sims JR, Qiu S, Savitz SI, et al.Раннее высвобождение HMGB-1 из нейронов после начала ишемии головного мозга. J Cereb Blood Flow Metab. 2008. 28 (5): 927–38.
CAS PubMed Статья Google Scholar
Choi JY, Cui Y, Chowdhury ST, Kim BG. Высокомобильная группа Box-1 как аутокринный трофический фактор при инсульте белого вещества. Proc Natl Acad Sci U S. A. 2017; 114 (25): E4987 – e95.
CAS PubMed PubMed Central Статья Google Scholar
Choi JY, Kim BG. Толл-подобный рецептор 2: новая терапевтическая мишень для лечения ишемического повреждения белого вещества и гибели олигодендроцитов. Экспериментальная нейробиология. 2017; 26 (4): 186–94.
PubMed PubMed Central Статья Google Scholar
Цукагава Т., Кацумата Р., Фудзита М., Ясуи К., Акхун С., Оно К. и др. Повышенный уровень белка бокс-1 группы высокой подвижности в сыворотке крови связан с плохим функциональным исходом при ишемическом инсульте.J Stroke Cerebrovasc Dis. 2017; 26 (10): 2404–11.
PubMed Статья Google Scholar
Садат-Хатамнежад Л., Таноманд А., Махмуди Дж., Сандогчиан Шоторбани С. Активация толл-подобных рецепторов 2 высокоподвижным блоком 1 группы в моноцитах пациентов с ишемическим инсультом. Иранский биомедицинский журнал, 2016; 20 (4): 223–8.
Google Scholar
Фарако Г., Фоссати С., Бьянки М., Патрон М., Педрацци М., Спараторе Б. и др.Белок группы 1 с высокой подвижностью высвобождается нервными клетками при различных стрессах и ухудшает ишемическую нейродегенерацию in vitro и in vivo. Журнал нейрохимии. 2007. 103 (2): 590–603.
CAS PubMed Статья Google Scholar
Сапожникова Н., Картвелишвили Т., Асатиани Н., Зинкевич В., Каландадзе И., Гугуцидзе Д. и др. Корреляция между MMP-9 и внеклеточным цитокином HMGB1 в прогнозировании исхода ишемического инсульта у человека.Biochimica et biophysica acta. 2014; 1842 (9): 1379–84.
CAS PubMed Статья Google Scholar
Биерхаус А., Хамперт П.М., Моркос М., Вендт Т., Чавакис Т., Арнольд Б. и др. Понимание RAGE, рецептора конечных продуктов гликирования. Журнал молекулярной медицины. 2005. 83 (11): 876–86.
CAS PubMed Статья Google Scholar
Палумбо Р., Гальвез Б.Г., Пустерла Т., Де Маркис Ф., Коссу Г., Марку К.Б. и др. Клетки, мигрирующие к участкам повреждения тканей в ответ на сигнал опасности HMGB1, требуют активации NF-κB. J Cell Biol. 2007. 179 (1): 33–40.
CAS PubMed PubMed Central Статья Google Scholar
Miranda HV, Outeiro TF. Кислая сторона нейродегенеративных расстройств: эффекты гликирования белков. Журнал патологии.2010. 221 (1): 13–25.
CAS Статья Google Scholar
Downes CE, Wong CH, Henley KJ, Guio-Aguilar PL, Zhang M, Ates R, et al. MyD88 является критическим регулятором нейропротекции, опосредованной гемопоэтическими клетками, наблюдаемой после инсульта. ПлоС один. 2013; 8 (3): e57948.
CAS PubMed PubMed Central Статья Google Scholar
Kim J-B, Choi JS, Yu Y-M, Nam K, Piao C-S, Kim S-W, et al.HMGB1, новый цитокиноподобный медиатор, связывающий острую гибель нейронов и замедленное нейровоспаление в постишемическом мозге. Журнал неврологии. 2006. 26 (24): 6413–21.
CAS PubMed Статья Google Scholar
Мухаммад С., Баракат В., Стоянов С., Мурикинати С., Ян Х., Трейси К. Дж. И др. Рецептор HMGB1 RAGE опосредует ишемическое повреждение головного мозга. Журнал неврологии. 2008. 28 (46): 12023–31.
CAS PubMed Статья Google Scholar
de Souza AW, Westra J, Limburg PC, Bijl M, Kallenberg CG. HMGB1 при сосудистых заболеваниях: его роль в сосудистом воспалении и атеросклерозе. Обзоры аутоиммунитета. 2012. 11 (12): 909–17.
PubMed Статья CAS Google Scholar
Kim JB, Sig Choi J, Yu YM, Nam K, Piao CS, Kim SW, et al. HMGB1, новый цитокиноподобный медиатор, связывающий острую гибель нейронов и замедленное нейровоспаление в постишемическом мозге.J Neurosci. 2006. 26 (24): 6413–21.
CAS PubMed Статья Google Scholar
Ян Дж., Хуанг С., Ян Дж., Цзян Х., Дин Дж. Статины ослабляют активацию эндотелия сосудов, индуцированную белком бокс-1 группы высокой подвижности: ключевая роль для сигнального пути TLR4 / NF-kappaB. Молекулярная и клеточная биохимия. 2010. 345 (1-2): 189–95.
CAS PubMed Статья Google Scholar
Wilkins HM, Swerdlow RH. TNFα при ишемии головного мозга: еще один удар против вас? Журнал нейрохимии. 2015; 132 (4): 369–72.
CAS PubMed PubMed Central Статья Google Scholar
Бохари Ф.А., Шакури Т.А., Батт А, Гафур Ф. TNF-альфа: фактор риска ишемического инсульта. JAMC. 2014; 26 (2): 111–4.
PubMed Google Scholar
Герц К., Кроненберг Г., Келин Р. Э., Бальдингер Т., Вернер С., Балкая М. и др. Существенная роль интерлейкина-6 в постинсультном ангиогенезе. Мозг. 2012; 135 (Pt 6): 1964–80.
PubMed PubMed Central Статья Google Scholar
Рот Дж., Раммель С., Харре Э. М., Фосс Т., Мютце Дж., Герстбергер Р. и др. Является ли интерлейкин-6 необходимым пирогенным цитокином? Журнал термобиологии. 2004. 29 (7): 383–9.
CAS Статья Google Scholar
Фахми Р.М., Эльзаид А.Ф. Размер инфаркта, интерлейкин-6 и их взаимодействие являются предикторами краткосрочного исхода инсульта у молодых египтян. J Stroke Cerebrovasc Dis. 2016; 25 (10): 2475–81.
PubMed Статья Google Scholar
Беккер К.Дж., Данква Д., Ли Р., Шульце Дж., Зиерат Д., Танзи П. и др. Инсульт, IL-1ra, IL1RN, инфекция и исход. Нейрокритическая помощь. 2014. 21 (1): 140–6.
CAS PubMed PubMed Central Статья Google Scholar
Мюррей К.Н., Парри-Джонс А.Р., Аллан С.М. Интерлейкин-1 и острая черепно-мозговая травма. Front Cell Neurosci. 2015; 9:18.
PubMed PubMed Central Статья CAS Google Scholar
Zaremba J, Losy J. Интерлейкин-12 у пациентов с острым ишемическим инсультом. Folia Neuropathologica. 2006. 44 (1): 59–66.
CAS PubMed Google Scholar
Накамура К., Шичита Т.Клеточные и молекулярные механизмы стерильного воспаления при ишемическом инсульте. Журнал биохимии. 2019; 165 (6): 459–64.
PubMed Статья Google Scholar
Clarkson BDS, Ling C, Shi Y, Harris MG, Rayasam A, Sun D, et al. Интерлейкин (ИЛ) -21, производный от Т-клеток, способствует повреждению мозга после инсульта у мышей. Журнал экспериментальной медицины. 2014. 211 (4): 595–604.
CAS PubMed PubMed Central Статья Google Scholar
Nayak AR, Kashyap RS, Kabra D, Purohit HJ, Taori GM, Daginawala HF. Динамика воспалительных цитокинов у пациентов с острым ишемическим инсультом и их связь с тяжелой цепью 4 ингибитора альфа трипсина и исходы. Летопись Индийской академии неврологии. 2012; 15 (3): 181–5.
PubMed PubMed Central Статья Google Scholar
Лахан С.Е., Кирхгесснер А., Теппер Д., Леонард А. Матричные металлопротеиназы и нарушение гематоэнцефалического барьера при остром ишемическом инсульте.Границы неврологии. 2013; 4:32.
CAS PubMed PubMed Central Google Scholar
Чатурведи М., Качмарек Л. Ингибирование Mmp-9: терапевтическая стратегия при ишемическом инсульте. Молекулярная нейробиология. 2014; 49 (1): 563–73.
PubMed PubMed Central Статья CAS Google Scholar
Терполилли Н.А., Московиц М.А., Плеснила Н. Оксид азота: рекомендации по лечению ишемического инсульта.J Cereb Blood Flow Metab. 2012. 32 (7): 1332–46.
CAS PubMed PubMed Central Статья Google Scholar
Сюэ Q, Ян Y, Zhang R, Xiong Х. Регулирование iNOS на иммунных клетках и его роль в заболеваниях. Int J Mol Sci. 2018; 19 (12). https://doi.org/10.3390/ijms1
PubMed Central Статья CAS Google Scholar
Зайферт Х.А., Кольер Л.А., Чапман С.Б., Бенкович С.А., Уиллинг А.Е., Пеннипакер КР.Передача сигналов провоспалительного гамма-интерферона напрямую связана с нейродегенерацией, вызванной инсультом. J Neuroimmune Pharmacol. 2014. 9 (5): 679–89.
PubMed PubMed Central Статья Google Scholar
Planas AM. Роль иммунных клеток, мигрирующих в ишемический мозг. Инсульт. 2018; 49 (9): 2261–7.
PubMed Статья PubMed Central Google Scholar
Dobolyi A, Vincze C, Pál G, Lovas G. Нейрозащитные функции трансформирующих белков фактора роста бета. Международный журнал молекулярных наук. 2012. 13 (7): 8219–58.
CAS PubMed PubMed Central Статья Google Scholar
Гарсия Дж. М., Стиллингс С. А., Леклерк Дж. Л., Филлипс Х., Эдвардс Н. Дж., Робичек С. А. и др. Роль интерлейкина-10 при острых повреждениях головного мозга. Границы неврологии. 2017; 8: 244.
PubMed PubMed Central Статья Google Scholar
Lambertsen KL, Finsen B, Clausen BH. Постинсультное воспаление — цель или средство терапии? Acta Neuropathologica. 2019; 137 (5): 693–714.
PubMed Статья PubMed Central Google Scholar
Ричард Сейду А., Саки М., Су З., Сюй Х. Основная нейровоспалительная и терапевтическая роль блока 1 группы высокой мобильности при ишемическом инсульте. Отчеты по биологии. 2017; 37 (6): BSR20171104.
PubMed PubMed Central Статья CAS Google Scholar
Tian X, Liu C, Shu Z, Chen G. Обзор: терапевтическое воздействие на HMGB1 при инсульте. Текущая доставка лекарств. 2017; 14 (6): 785–90.
CAS PubMed Статья PubMed Central Google Scholar
Chen C, Chu SF, Liu DD, Zhang Z, Kong LL, Zhou X, et al. Хемокины играют сложную роль в ишемии головного мозга. Международная нейрохимия. 2018; 112: 146–58.
CAS PubMed Статья PubMed Central Google Scholar
Amin M, Vakilian A, Mahmoodi MH, Hassanshahi G, Falahati-Pour SK, Dolatabadi MR, et al. Уровни циркуляции хемокиновых лигандов 1, 9 и 10 мотива C-X-C повышены у пациентов с ишемическим инсультом. Евразийский медицинский журнал. 2017; 49 (2): 92–6.
CAS PubMed PubMed Central Статья Google Scholar
Ван Дж, Ган И, Хан П, Инь Дж, Лю Кью, Ганиан С. и др. Вызванная ишемией гибель нейрональных клеток опосредуется хемокиновым рецептором CX3CR1.Научные отчеты. 2018; 8 (1): 556.
PubMed PubMed Central Статья CAS Google Scholar
Родриго Р., Фернандес-Гахардо Р., Гутьеррес Р., Матамала Дж. М., Карраско Р., Миранда-Мерчак А. и др. Окислительный стресс и патофизиология ишемического инсульта: новые терапевтические возможности. Цели для лекарств от неврологических расстройств и ЦНС. 2013. 12 (5): 698–714.
CAS Статья Google Scholar
Ян Дж. Л., Мукда С., Чен С. Д. Различная роль митохондрий при ишемическом инсульте. Редокс-биология. 2018; 16: 263–75.
CAS PubMed PubMed Central Статья Google Scholar
Sun M-S, Jin H, Sun X, Huang S, Zhang F-L, Guo Z-N и др. Повреждение свободных радикалов при ишемии-реперфузии: препятствие при остром ишемическом инсульте после реваскуляризационной терапии. Окислительная медицина и клеточное долголетие. 2018; 2018: 17.
Google Scholar
Narne P, Pandey V, Phanithi PB. Роль оксида азота и сероводорода в ишемическом инсульте и возникающих эпигенетических основах.

 Radiology 1997, Vol 205, 327-333,
Radiology 1997, Vol 205, 327-333,
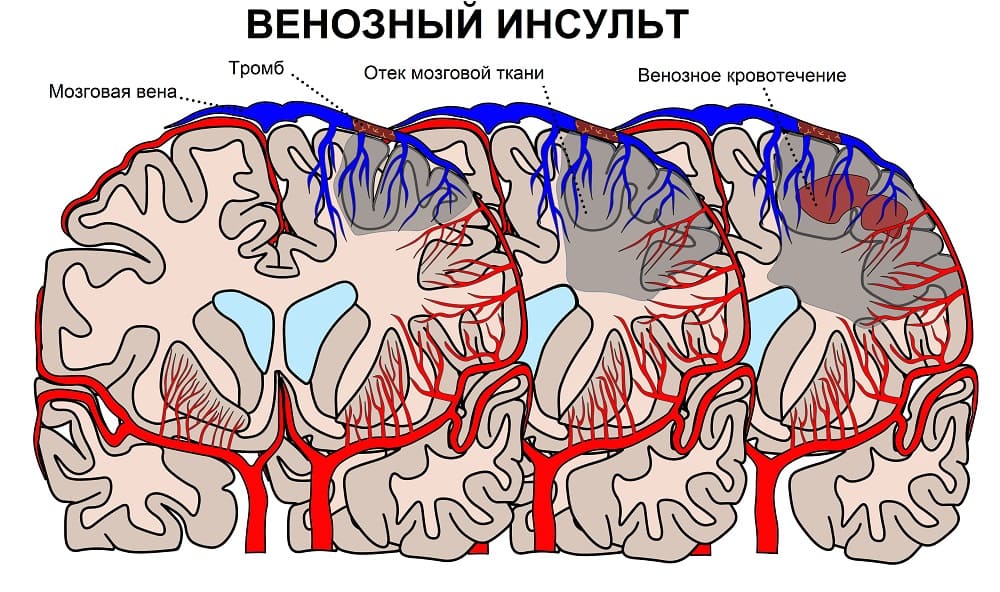


 [Бесплатная статья PMC: PMC7211099] [PubMed: 32366614]
[Бесплатная статья PMC: PMC7211099] [PubMed: 32366614] Обновление статистики сердечных заболеваний и инсульта за 2019 г .: отчет Американской кардиологической ассоциации. Тираж. 5 марта 2019 г .; 139 (10): e56-e528. [PubMed: 30700139]
Обновление статистики сердечных заболеваний и инсульта за 2019 г .: отчет Американской кардиологической ассоциации. Тираж. 5 марта 2019 г .; 139 (10): e56-e528. [PubMed: 30700139]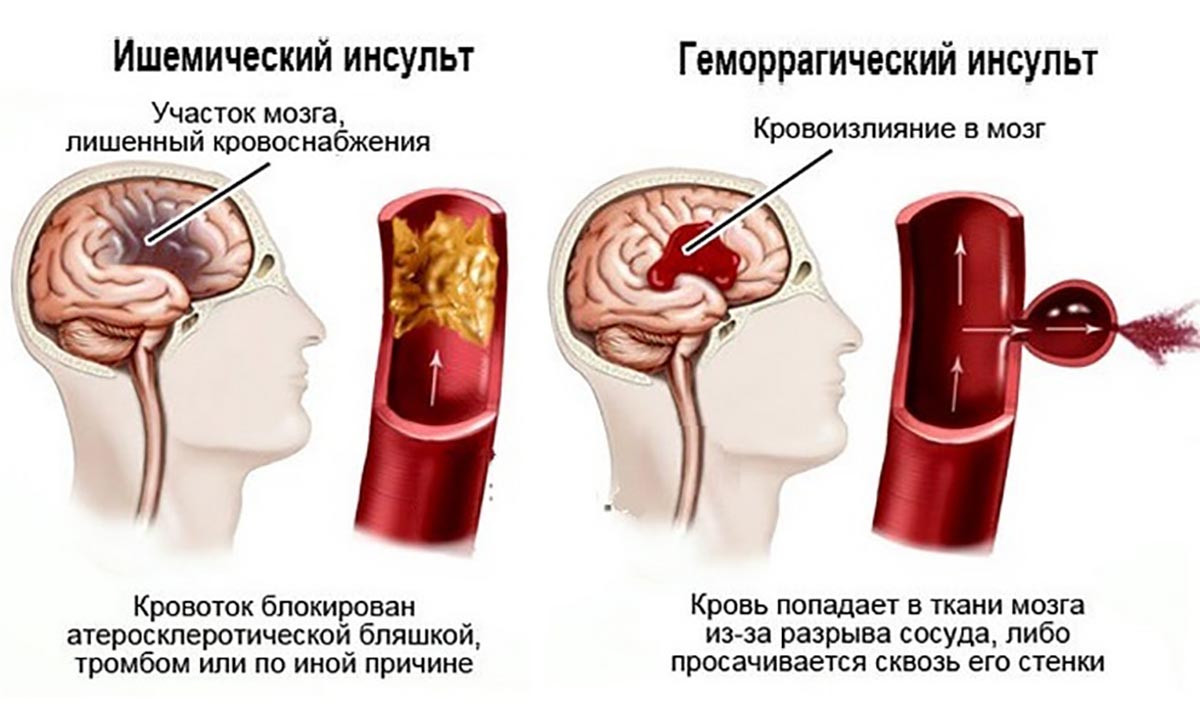
 Эндоваскулярное лечение острого ишемического инсульта.Континуум (Миннеап Минн). 2020 Апрель; 26 (2): 310-331. [PubMed: 32224754]
Эндоваскулярное лечение острого ишемического инсульта.Континуум (Миннеап Минн). 2020 Апрель; 26 (2): 310-331. [PubMed: 32224754] Результаты, связанные с использованием клопидогреля-аспирина при малом инсульте или транзиторной ишемической атаке: объединенный анализ клопидогреля у пациентов из группы высокого риска с острыми не инвалидизирующими цереброваскулярными событиями (ШАНС) и тромбоцитарным ингибированием при новой ТИА и малом ишемическом инсульте (ТОЧКА) Испытания.JAMA Neurol. 2019 Aug 19; [Бесплатная статья PMC: PMC6704730] [PubMed: 31424481]
Результаты, связанные с использованием клопидогреля-аспирина при малом инсульте или транзиторной ишемической атаке: объединенный анализ клопидогреля у пациентов из группы высокого риска с острыми не инвалидизирующими цереброваскулярными событиями (ШАНС) и тромбоцитарным ингибированием при новой ТИА и малом ишемическом инсульте (ТОЧКА) Испытания.JAMA Neurol. 2019 Aug 19; [Бесплатная статья PMC: PMC6704730] [PubMed: 31424481]