Лекарства от деменции для пожилых: чем и как лечат старческую, сосудистую и сенильную деменцию?
Средства для лечения болезни Альцгеймера
Заказать препараты для лечения болезни Альцгеймера
Необходимые при лечении болезни Альцгеймера препараты жители Московской и Ленинградской областей, включая обе столицы, могут заказать на ресурсе 366.ru. Выберите одну из более чем 1290 аптек сети «36,6», в которой вам удобно оплатить и получить свой заказ, там же нужно будет предъявить рецепт, если речь идет о рецептурных препаратах.
Поиск средств на сайте можно осуществлять не только по наименованию лекарства или производителя, но и по действующему веществу, что позволяет выбрать аналог, устраивающий по стоимости.
Цены доступны, бывают акции и скидки, при предъявлении карты «Клуба 36,6» можно использовать бонусные баллы. Вся продукция сертифицирована.
Показания
Болезнь Альцгеймера была описана немецким психиатром Алоисом Альцгеймером[1] в начале XX века. Эту форму деменции диагностируют обычно у людей
старше 65 лет, существует редкая форма, поражающая более молодых.
Профилактика заболевания включает в себя регулярные физические и умственные нагрузки, прогулки на свежем воздухе, сбалансированный рацион, богатый омега-3-жирными кислотами.
Использование новых препаратов, комплексная терапия и грамотный уход замедляют развитие болезни и улучшают качество жизни больного и его близких.
Основные признаки заболевания:
- нарушения памяти;
- угасание интеллекта;
- потерю пространственной и временной ориентации;
- нарушения рефлексов;
- бредовые и маниакальные идеи, галлюцинации, другие психические отклонения.
Специалисты Европейской федерации неврологических обществ (EFNS) в ходе исследований выявили, что на лёгкой стадии из лекарств от болезни
Альцгеймера наиболее действенны ингибиторы холинэстераз, далее целесообразно использовать мемантин, ослабляющий проявления деменции.
В состав терапии могут входить средства для улучшения памяти и мозгового кровообращения, седативные средства и др. Назначать лечение должен специалист.
Противопоказания
Использовать медикаменты этой группы противопоказано при:
- беременности и грудном вскармливании,
- при тяжелой почечной или печеночной недостаточности,
- детям и подросткам до 18 лет.
С осторожностью врач назначает их при:
- тиреотоксикозе,
- судорогах,
- одновременном приеме ряда других препаратов.
Формы выпуска
Лекарства от деменции альцгеймеровского типа выпускают в форме:
- таблеток и капсул,
- пластырей,
- растворов для внутреннего применения,
- ампул для инъекций.
Нейролептики, антидепрессанты, транквилизаторы, успокоительные таблетки и народные средства используют при болезни Альцгеймера для облегчения симптомов.
Страны изготовители
Кроме российских медикаментов, на сайте вы можете найти и заказать лекарства от болезни Альцгеймера, произведенные в:
- Германии,
- Польше,
- Швейцарии и других европейских странах.

ПЕРЕД ПРИМЕНЕНИЕМ ПРЕПАРАТОВ НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ПО ПРИМЕНЕНИЮ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Список литературы:
- [i] БМЭ. Главный редактор Б. В. Петровский, издание третье, онлайн версия. Доступ по ссылке http://xn--90aw5c.xn--c1avg/index.php/%D0%90%D0%9B%D0%AC%D0%A6%D0%93%D0%95%D0%99%D0%9C%D0%95%D0%A0%D0%90_%D0%91%D0%9E%D0%9B%D0%95%D0%97%D0%9D%D0%AC
лекарства от деменции — не компенсируемые / Статья
Население Латвии стареет. В прошлом году каждому пятому жителю Латвии было больше 65 лет. Но легко ли быть пожилым? Русское вещание LTV7 продолжает серию материалов о вызовах, проблемах, успехах и возможностях старшего поколения. Одна из проблем старшего поколения — деменция.
Потеря самостоятельности, нарушение памяти, галлюцинации и иллюзии, побеги туда, где человек провел детские годы своей жизни. Каждый третий латвийский пенсионер после 80 лет страдает деменцией — психиатрическим и неврологическим заболеванием. Что делать близким и почему государство не компенсирует медикаменты против этого заболевания?
Что делать близким и почему государство не компенсирует медикаменты против этого заболевания?
Инга Кадике-Скадиня, специалист по уходу в резиденции сениоров Dzintara melodija, перечисляет типичные симптомы:
«Они все забывают. Клиент идет куда-то, а сам не знает, куда. Он не может свою комнату найти. Надо показать, открыть двери, чтобы он убедился, что это его комната».
Кто-то сталкивался с этим заболеванием пожилого родственника лично. Кто-то слышал ужасные истории, как бабушка или дедушка забывали выключить в квартире газ. Или уезжали на общественном транспорте в другой район или даже город. Зачем? Они не знают.
Эвия Розенлаука, психолог резиденции сениоров Dzintara melodija, говорит, что усугубляющаяся деменция — действительно «впадение в детство»:
«Если маленький ребенок развивается, становится все более умным, развивается интеллектуально, то если у человека деменция, есть периоды, когда он стоит на месте, есть периоды, когда он интеллектуально регрессирует. И если смотреть самые тяжелые точки деменции, то это совсем маленький грудной ребенок. Со всеми вытекающими последствиями».
И если смотреть самые тяжелые точки деменции, то это совсем маленький грудной ребенок. Со всеми вытекающими последствиями».
Реальность такова, говорят психиатры, что латвийское общество о деменции знает мало. Близкие часто считают, что странное поведение дедушки или бабушки просто неизбежные последствия старости. Но это не так, подчеркивает психиатр Марис Таубе, глава амбулаторного психиатрического центра Veldre:
«Мы должны давать людям лекарства, чтобы эту болезнь остановить. Чтобы остановить тот процесс. Не так, что мы определили деменцию — и человека отдали в пансионат, где только уход. Это неправильно. Мы должны делать все, чтобы человек остался в семье, чтобы с лекарствами, уходом и лечением он как можно дольше остался в обществе».
Но с лекарствами все не так просто. С направлением семейного врача, невролога или психиатра в определенных случаях пожилой человек с деменцией может пройти курс лечения в психиатрическом или неврологическом отделении. Там медикаменты он получает бесплатно. Однако как только больного выписывают — его близкие должны покупать препараты самостоятельно. Самые дешевые стоят начиная от 40 евро в месяц, говорит Таубе.
Однако как только больного выписывают — его близкие должны покупать препараты самостоятельно. Самые дешевые стоят начиная от 40 евро в месяц, говорит Таубе.
«Это в психиатрии у нас реальность. Пенсии у людей маленькие, если человек не работал, заболел, 70 или 80 евро он получает — ему и 70 евроцентов за рецепт большая сумма. Он не может иногда это себе позволить. Это так кажется, что все красиво. А в реальной жизни есть люди, которые амбулаторно ко мне приходят и говорят, что кушать нечего».
Государство препараты, останавливающие деменцию, например, мемантин, не компенсирует. Во всяком случае, пока.
«Сейчас медикамент не находится в списке компенсируемых лекарств. Также этот препарат не подан для рассмотрения для включения в списки компенсируемых лекарств. Один из главных факторов — доступное финансирование. Без сомнения, необходимых медикаментов намного больше, чем реально доступных бюджетных средств», — заявила Русскому вещанию LTV7 по телефону представитель Национальной службы здоровья Синтия Гулбе.
Пожалуйста, выделите в тексте соответствующий фрагмент и нажмите Ctrl+Enter.
Пожалуйста, выделите в тексте соответствующий фрагмент и нажмите Сообщить об ошибке.
Сообщить об ошибке
Почему человечество проигрывает борьбу с болезнью Альцгеймера?
В последнем докладе Всемирной организации интеллектуальной собственности этому заболеванию, которое представляет огромную социальную значимость, посвятили отдельную главу. В ближайшие десять лет число людей с болезнью Альцгеймера – одной из самых серьезных форм деменции – удвоится и составит 82 млн человек, а к середине века показатели могут утроиться.
Фармацевтические компании по всему миру пытаются разработать препараты, которые помогли бы хотя бы отложить начало заболевания: подсчитано, что если симптомы удастся отсрочить даже на год, к 2050 году число больных сократится на 9 млн.
Болезнь Альцгеймера – это хроническое, прогрессирующее заболевание, которое, как правило, поражает людей старше 65 лет. Ранние симптомы включают в себя ухудшение памяти и мыслительных способностей, которые замечают, как правило, только сами пациенты. Позднее проявляются когнитивные проблемы и изменения в поведении, которые впоследствии приводят к инвалидности: люди теряют способность самостоятельно обслуживать себя и часто бывают вынуждены переехать в дорогостоящие дома для пожилых. Сегодня с деменцией живут 50 млн человек, но, как уже отмечалось, их будет гораздо больше уже в ближайшее десятилетие.
Изменения в мозге отмечаются еще за 10-20 лет до проявления первых клинических симптомов, еще до ухудшения памяти. Под микроскопом ученые могут обнаружить определенные молекулярные особенности, которые являются признаком патологических процессов и предшественниками болезни.
Ученые ищут лекарство от деменции
Если коротко, то последние тридцать лет разработки ведутся главным образом на основе «гипотезы амилоидного каскада», который предполагает несколько стадий – от отложений крахмалоподобного белка амилоида до клинических проявлений деменции.
В настоящее время испытание проходят сразу несколько препаратов. Ученые полагают, что одного единственного лекарства, способного вылечить болезнь Альцгеймера или другую форму деменции, не существует; скорее всего это будет комплексная терапия, вроде той, что сегодня с успехом применяется для лечения, например, ВИЧ.
Тем не менее, эти исследования занимают много времени и требуют больших вложений. В связи с масштабами проблемы и ее социальной значимостью, государства, как считают в ВОИС, должны создавать благоприятные условия для частных компаний и инвесторов, готовых участвовать в этих расходах. Речь идет, в том числе, о послаблении правил, связанных с длительностью испытательного периода. Эксперты напоминают, что именно таким образом удалось добиться прорыва в разработке препаратов для лечения СПИДа, рака и других смертельных болезней. Теперь, по мнению авторов доклада, необходимо принять аналогичные меры в отношении болезни Альцгеймера.Кроме того, есть такое понятие как «эксклюзивность информации»: согласно правилам, фармацевтические компании передают данные, связанные с разработками того или иного препарата государству.
Больные с Альцгеймером нуждаются в поддержке государства и общества
Специалисты также призывают правительства обеспечить социальную помощь, чтобы как можно больше пациентов могли покупать дорогостоящие новые препараты. Согласно данным исследования, проведенного в 15 развитых странах мира, обеспечивая людей эффективными лекарствами, государства экономят на дальнейших затратах по их лечению в больничных условиях. В США, например, где пожилым предоставляется бесплатное медицинское страхование, удалось сократить расходы на охрану здоровья этой группы населения после того, как государство взяло на себя оплату нужных им медикаментов.
И еще один важный аспект: отношение общества к болезни. В 2017 году Всемирная ассамблея здравоохранения включила в повестку дня разработанный Всемирной организацией здравоохранения Глобальный план действий в области борьбы с деменцией. Один из пунктов этого документа предусматривает повышение осведомленности о болезни и доброжелательное отношение к людям с деменцией. По мнению экспертов, просвещение населения, лучшее понимание ситуации, будет способствовать улучшению качества жизни больных, в том числе, предоставит им возможность сохранить самостоятельность и даже участвовать в общественной жизни.
В 2017 году Всемирная ассамблея здравоохранения включила в повестку дня разработанный Всемирной организацией здравоохранения Глобальный план действий в области борьбы с деменцией. Один из пунктов этого документа предусматривает повышение осведомленности о болезни и доброжелательное отношение к людям с деменцией. По мнению экспертов, просвещение населения, лучшее понимание ситуации, будет способствовать улучшению качества жизни больных, в том числе, предоставит им возможность сохранить самостоятельность и даже участвовать в общественной жизни.
Доктор Мясников объяснил, что есть, чтобы не глупеть
Обеденный перерыв в телевизионной клинике «Доктор Мясников» на канале «Россия 1» – время разговора о здоровом питании. На этот раз речь шла о пище не только для тела, но и для ума. А именно: какие продукты препятствуют оскудению работы и способствуют сохранности головного мозга.
Чего бы такого съесть, чтобы не только не толстеть, но и не глупеть: остаться бодрым, умным и ничего не забывать? Деменция – снижение когнитивной способности – очень распространенная проблема пожилых людей. Почему в ее профилактике такое внимание уделяется питанию? А потому что лекарств от деменции практически нет.
Почему в ее профилактике такое внимание уделяется питанию? А потому что лекарств от деменции практически нет.
«Что мы можем предложить? Да, мы можем предложить лечить те состояния, которые стоят за снижением функции мозга. Например, артериальную гипертонию. Нелеченая гипертония – самый большой риск-фактор для возрастной деменции, но нормализация давления – это долгий процесс», – объясняет Александр Мясников.
Между тем специалисты обратили внимание, что правильное питание снижает риски деменции до 50%. «То есть ни одно лекарство не может действовать так, как действует диета. Даже если уже начались симптомы, но ты начал правильно питаться и строго придерживаешься диеты, улучшение наступает в 50% случаев. Когда эти исследования вышли, это был шок, потому что ни одно лекарство не дает такого эффекта», – говорит Александр Леонидович. Существует даже специальный термин – MIND-diet (диета для ума). За ее основу взяты средиземноморская и так называемая северная диеты.
Итак, что нужно исключить из рациона пожилому человеку? Соль. Выпечку. Жареное. Фаст-фуд. Красное мясо – по крайней мере, резко снизить его потребление. Сыр. Сливочное масло. «Я не говорю, что сливочное масло – вред, оно полезно, я сам его адвокатирую, потому что оно, в частности, повышает хороший холестерин. Сыр – прекрасный источник кальция и так далее. Но мы сейчас говорим конкретно о той диете, которая помогает пожилому человеку сохранить ясность ума и отсрочить наступление деменции», – уточняет доктор.
Выпечку. Жареное. Фаст-фуд. Красное мясо – по крайней мере, резко снизить его потребление. Сыр. Сливочное масло. «Я не говорю, что сливочное масло – вред, оно полезно, я сам его адвокатирую, потому что оно, в частности, повышает хороший холестерин. Сыр – прекрасный источник кальция и так далее. Но мы сейчас говорим конкретно о той диете, которая помогает пожилому человеку сохранить ясность ума и отсрочить наступление деменции», – уточняет доктор.
Что можно и нужно? Овощи и фрукты – это прекрасный источник не только клетчатки, но и того, что нужно для работы мозга – калия и кальция. Зеленые листья: шпинат, брокколи. Морепродукты – морская рыба, креветки и устрицы, которые, по некоторым сведениям, сделали из наших далеких африканских предков homo sapiens – человека разумного. Изредка позволяйте себе, конечно, и мясо как источник витамина B12, железа и многих микроэлементов. Но не чаще трех раз в неделю человеку обычному, а вот пожилому лучше заменять его курицей. Обязательно бобы, например, фасоль. Обязательно хлеб из цельных зерен. Как источник жиров – оливковое масло. Орехи. Что еще? Красное вино! Небольшие его дозы действительно полезны: биологически активные вещества, которые в нем содержатся, помогают предотвращать не только заболевания сердца, но и мозга.
Обязательно хлеб из цельных зерен. Как источник жиров – оливковое масло. Орехи. Что еще? Красное вино! Небольшие его дозы действительно полезны: биологически активные вещества, которые в нем содержатся, помогают предотвращать не только заболевания сердца, но и мозга.
Главная страница
О том, что деменция неизлечима, могут говорить только люди, весьма далекие от современных научных представлений о проблеме, её сущности и причинах. Человеческий мозг – невероятно сложная система, и когда он начинает работать со сбоями, поправить это довольно трудно, но вполне возможно.
Зачем лечить неизлечимое
Лечение деменции специфично. Лечить ее, как лечат, например, некоторые болезни печени или сердца, действительно, не получится, поскольку деменция не является собственно заболеванием. Это синдром – особое сочетание симптомов (нарушение памяти, расстройство речи, потеря ориентировки и другие изменения, затрудняющие повседневную жизнь человека в быту и в работе). Эти симптомы могут появляться при самых разных заболеваниях (посмотрите нашу статью Деменция, там перечислены основные причины). Некоторые заболевания обратимы, особенно когда связаны с проблемами в других системах организма (щитовидной железе, печени и т.п.), и тогда способность пациента к самообслуживанию можно полностью восстановить, устранив причину. При других заболеваниях (самое распространенное из них – болезнь Альцгеймера) устранить причину не получится – современная медицина пока не знает, как лечить нейродегенеративные заболевания, ведущие к деменции, но и в этом случае лечение необходимо. Оно будет не воздействовать на болезнь, а смягчать симптомы, отсрочивать появление их более грубых форм. Для ухаживающих смягчение агрессии или бредовых идей, нормализация сна, максимально долгое сохранение речи, позволяющее больному доносить свои мысли и чувства – это не просто статистика, а ощутимое улучшение качества жизни всей семьи. В этом смысле лечение деменции не только возможно, но и необходимо, как при обратимых заболеваниях, так и при неизлечимых.
Эти симптомы могут появляться при самых разных заболеваниях (посмотрите нашу статью Деменция, там перечислены основные причины). Некоторые заболевания обратимы, особенно когда связаны с проблемами в других системах организма (щитовидной железе, печени и т.п.), и тогда способность пациента к самообслуживанию можно полностью восстановить, устранив причину. При других заболеваниях (самое распространенное из них – болезнь Альцгеймера) устранить причину не получится – современная медицина пока не знает, как лечить нейродегенеративные заболевания, ведущие к деменции, но и в этом случае лечение необходимо. Оно будет не воздействовать на болезнь, а смягчать симптомы, отсрочивать появление их более грубых форм. Для ухаживающих смягчение агрессии или бредовых идей, нормализация сна, максимально долгое сохранение речи, позволяющее больному доносить свои мысли и чувства – это не просто статистика, а ощутимое улучшение качества жизни всей семьи. В этом смысле лечение деменции не только возможно, но и необходимо, как при обратимых заболеваниях, так и при неизлечимых.
Разница между бездействием и лечением показана на следующем графике. Если провести вертикальную линию из любой точки на оси Время, будет видно, что степень тяжести симптомов деменции существенно слабее при лечении.
Поскольку у деменции может быть много самых разных причин, лечение деменции должно предваряться системным обследованием у специалиста. Только врач после разноплановых диагностических мероприятий может установить, какими нарушениями были вызваны проблемы памяти и другие дисфункции (почитайте нашу статью Диагностика деменции). А затем принять решение о назначении терапии.
Общая установка
Пациент, страдающий от деменции, и его родственники, сталкиваются с разноплановыми проблемами. Негативные изменения затрагивают практически все сферы. Наряду с когнитивной симптоматикой (нарушения памяти, внимания, мышления), возникают нейропсихиатрические проблемы (психозы, патологическое беспокойное поведение, апатия, нарушения сна), разрушаются бытовые навыки, дают о себе знать другие заболевания. Поэтому на любом этапе развития болезни нельзя ограничиваться только оценкой памяти и коррекцией когнитивных нарушений. Сюда также входят коррекция поведения с помощью лекарственных и немедикаментозных средств, меры психологического воздействия, изменение условий жизни, пересмотр лекарств, принимаемых по поводу сопутствующих заболеваний.
Поэтому на любом этапе развития болезни нельзя ограничиваться только оценкой памяти и коррекцией когнитивных нарушений. Сюда также входят коррекция поведения с помощью лекарственных и немедикаментозных средств, меры психологического воздействия, изменение условий жизни, пересмотр лекарств, принимаемых по поводу сопутствующих заболеваний.
За последние 10 лет опубликованы результаты около сотни рандомизированных клинических исследований, посвященных лечению деменции. Чудодейственного средства не найдено, и перспективы остаются туманными. Поэтому сегодня эксперты подчеркивают важность разумной комбинации различных мер медикаментозной и иной помощи в сочетании с персональным подходом, основанным на четкой оценке состояния пациента. Все симптомы, которые могут быть скорректированы должны быть четко определены, их выраженность оценена. Важную роль в повышении эффективности терапии могут играть правильно выстроенное общение с больным, адаптация дома, где он живет, к развивающемуся заболеванию.
Не последнее место занимает и оценка рисков, которые возникают главным образом из-за снижения у человека с деменцией способности к самообслуживанию, адекватной оценке ситуации и обеспечению собственной безопасности. Нарушения памяти, ориентации во времени и пространстве, неспособность контролировать внимание, психоэмоциональные нарушения – всё это может привести к беде. Недооценка рисков и недостаточный контроль чреваты недоеданием и обезвоживанием, нарушениями в графике приема лекарств, падениями, некорректным использованием газовых и электрических приборов, а также иной домашней техники, неконтролируемым уходом их дома. Оставленный без присмотра больной потенциально уязвим для преступлений и злоупотреблений.
Все перечисленные и иные риски меняются с течение деменции и потому требуют регулярной переоценки.
Лечение расстройств в когнитивной сфере (лекарственная терапия)
Именно когнитивные нарушения определяют деменцию как специфическое состояния по сравнению с другими инвалидизирующими проблемами со здоровьем. К когнитивным нарушениям, как уже отмечалось, относят нарушение памяти, расстройство речи, потерю ориентировки, ослабление внимания и другие изменения, затрудняющие повседневную жизнь человека в быту и на работе. Для коррекции этих нарушений были разработаны так называемые противодементные препараты. Они одобрены для коррекции когнитивных симптомов при большинстве заболеваний, ведущих к деменции: болезни Альцгеймера, деменции с тельцами Леви, деменции при болезни Паркинсона, сосудистой деменции и других заболеваниях. Принцип их положительного действия основан на компенсации биохимических нарушений, приводящих к потере нейронов. В основном они не влияют на развитие патологических процессов и лишь смягчают симптоматику. Мемантин (оригинальный препарат – Акатинол) ослабляет токсические эффекты глутамата, выделяющегося при дегенерации нейронов. Ингибиторы холинэстеразы (оригинальные препараты – Арисепт, Экселон, Реминил) могут частично восстанавливать дефицит ацетилхолина, возникающий в результате потери нейронов.
К когнитивным нарушениям, как уже отмечалось, относят нарушение памяти, расстройство речи, потерю ориентировки, ослабление внимания и другие изменения, затрудняющие повседневную жизнь человека в быту и на работе. Для коррекции этих нарушений были разработаны так называемые противодементные препараты. Они одобрены для коррекции когнитивных симптомов при большинстве заболеваний, ведущих к деменции: болезни Альцгеймера, деменции с тельцами Леви, деменции при болезни Паркинсона, сосудистой деменции и других заболеваниях. Принцип их положительного действия основан на компенсации биохимических нарушений, приводящих к потере нейронов. В основном они не влияют на развитие патологических процессов и лишь смягчают симптоматику. Мемантин (оригинальный препарат – Акатинол) ослабляет токсические эффекты глутамата, выделяющегося при дегенерации нейронов. Ингибиторы холинэстеразы (оригинальные препараты – Арисепт, Экселон, Реминил) могут частично восстанавливать дефицит ацетилхолина, возникающий в результате потери нейронов. Обычно врач выписывает либо то, либо другое. Реже в комбинации.
Обычно врач выписывает либо то, либо другое. Реже в комбинации.
Чтобы понять, хотя бы приблизительно, принцип работы названных лекарств, нужно понимать, как работают нервные клетки в норме и что мешает им работать при патологии.
В норме клетки головного мозга работают слаженно, обмениваясь между собою сигналами. Обмен сигналами – основа памяти, речи, мышления, да всей жизнедеятельности. Чтобы сигнал проходил нормально, в месте соединения нервных клеток выделяются специальные вещества, так называемые нейромедиаторы: ацетилхолин и глутамат. Первый влияет на силу сигнала, второй – на готовность клетки его принять.
Рис. 1. На рисунке показано, как на фоне незначительного физиологического шума проходит сигнал.
Под воздействием неблагоприятных факторов: токсических отложений (бляшек), как при болезни Альцгеймера, или нарушений в сосудах головного мозга, или при воспалении – работа медиаторов нарушается. Ацетилхолина становится меньше, а значит, ослабевает сигнал, и клетке сложнее его распознавать.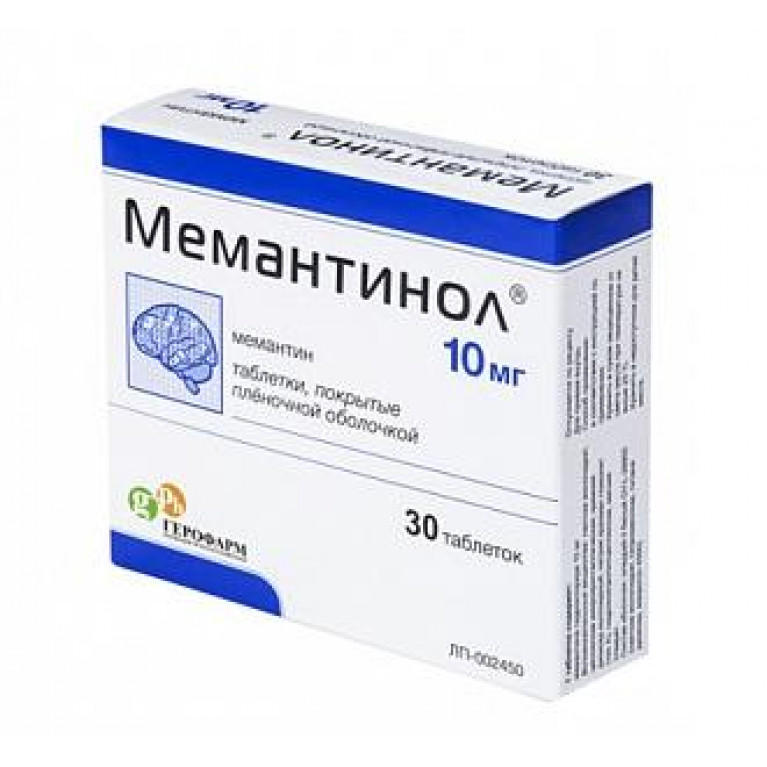 А вот глутамата, наоборот, становится больше, и в клетку идет ток даже в спокойном состоянии. Она постоянно возбуждена без надобности, и когда приходит действительно нужный сигнал, плохо его слышит.
А вот глутамата, наоборот, становится больше, и в клетку идет ток даже в спокойном состоянии. Она постоянно возбуждена без надобности, и когда приходит действительно нужный сигнал, плохо его слышит.
Вот поэтому – из-за более слабого сигнала, а также из-за сильного фонового шума – у больного начинаются «проблемы с головой». Он всё хуже усваивает, накапливает и использует информацию.
Здравый смысл подсказывает, что решить проблему можно либо через усиление сигнала, либо через снижение шума. Прием ингибиторов АХ – это движение по первому направлению.
Рис. 3. Мы видим, что ненужный шум остается, но сила сигнала увеличивается. Так у него больше шансов быть услышанным.Прием мемантина – альтернативный путь. Его молекула как бы закрывает клетку, восстанавливая поляризацию и прекращая аномальный ток.
Рис. 4. На фоне снижения шума даже более слабый сигнал может быть услышан клеткой.
Итак, мы видим, что две группы препаратов, которые назначают для лечения деменции, имеют принципиально разный механизм действия. Они решают одну и ту же проблему с противоположных сторон. Поэтому их сочетание может оказаться более эффективным, чем отдельный прием. Вместе они приближают обмен к нормальному состоянию – с сильным сигналом и низким шумом. Разумеется, степень этого приближения будет в каждом отдельном случае зависеть от миллиона нюансов, которые влияют на результат. Ведь нередко пациент или его родственники обращаются за помощью, когда много клеток уже просто погибло, и оптимизировать гораздо сложнее. Потому и говорят врачи, что главный залог успешного лечения – это его начало на самых ранних стадиях.
Каждый из перечисленных выше препаратов показал свою эффективность в сотнях качественных исследованиях, и выбор одного из них при назначении пациенту определяется в большей степени положительным опытом врача при их использовании в терапии. Определенную роль при выборе также может играть профиль безопасности лекарства.:max_bytes(150000):strip_icc()/GettyImages-748326033-5a5e38e9980207003742d8b8.jpg) В этом отношении мемантин (по крайней мере его оригинальный препарат Акатинол) продемонстрировал заметное превосходство над ингибиторами холинэстеразы. У него существенно меньше побочных действий.
В этом отношении мемантин (по крайней мере его оригинальный препарат Акатинол) продемонстрировал заметное превосходство над ингибиторами холинэстеразы. У него существенно меньше побочных действий.
Другие лекарственные средства для лечения деменции
В поисках препаратов, которые не только смягчали бы симптоматику и замедляли развитие болезни, как перечисленные выше лекарства, но излечивали пациента, ученые во всем мире испытывают самые разные средства: противовоспалительные, гормональные (например, эстроген), омега-3 жирные кислоты, витамин В (фолиевую кислоту, витамины В6 и В12), витамин Е, статины, популярные в России вытяжки из мозга и крови коров или свиней и многие другие. Хотя в некоторые исследованиях некоторые средства демонстрировали положительный эффект у некоторых пациентов, общие результаты их испытаний не дали убедительных свидетельств их клинической эффективности. Поэтому целесообразность использования других групп препаратов (или бадов) для коррекции когнитивных нарушений при деменции сомнительна. Это же относится к многочисленным ноотропам, столь любимым в России. Мировым экспертным сообществом их эффективность не признается, а некоторые из них даже запрещены на территории ряда государств.
Это же относится к многочисленным ноотропам, столь любимым в России. Мировым экспертным сообществом их эффективность не признается, а некоторые из них даже запрещены на территории ряда государств.
А теперь самое главное. Наш организм невероятно сложен. Мы пока еще слишком далеки от полного понимания механизмов работы человеческого мозга, а человеческий мозг дающий по той или иной причины сбои, перестающий нормально работать – еще более сложная загадка. Поэтому ученые пока не нашли универсального способа лечения деменции. В каждом конкретном случае врач ищет ответ на вопросы, которые ставит перед ним болезнь, но лечит он при этом не болезнь, а пациента. Поэтому не спешите без обсуждения с лечащим врачом применять к своим близким те подходы к лечению, который, по рассказам других, хорошо сработали в их семье.
Прием лекарств без предписания врача опасен. Лекарства, которые хорошо подходят при деменции одного типа, могут оказаться губительными для больных c деменцией другого типа. Обнаружить нюансы и назначить медикаментозную терапию с их учетом может только опытный медик. Да и все больные разные, особенно в пожилом возрасте, с букетом хронических заболеваний.
Обнаружить нюансы и назначить медикаментозную терапию с их учетом может только опытный медик. Да и все больные разные, особенно в пожилом возрасте, с букетом хронических заболеваний.
Кстати, сами врачи подчеркивают необходимость воздерживаться от избыточного приема лекарственных средств, назначая их больному только в случае крайней необходимости (болевые синдромы, инфекционные заболевания…). Прежде чем будут использованы лекарства, необходимо исчерпать возможности немедикаментозной терапии. При ряде типичных расстройств (бессоннице, возбуждении и других) положительный результат может дать правильная организация общения с близкими людьми, надлежащий уход за больным, поддержание его повседневной активности. В некоторых случаях для улучшения состояния больного может оказаться достаточно консультации психолога или психотерапевта.
Также стоит обратить внимание на рекомендации в Справочнике, посвященные нелекарственным методам лечения. Выраженность некоторых поведенческих расстройств может быть снижена такими средствами, как фитотерапия, ароматерапия и другими практиками. Однако и в этом случае не следует руководствоваться только собственными соображениями или рекомендациями знакомых. Использование этих методов следует согласовывать с врачом.
Однако и в этом случае не следует руководствоваться только собственными соображениями или рекомендациями знакомых. Использование этих методов следует согласовывать с врачом.
Не злоупотребляйте лекарствами! Не принимайте лекарства без назначения врача!
Если врач принял решение об использовании медикаментов, обратите внимание на несколько рекомендаций:
- Строго придерживайтесь рекомендаций специалиста и инструкции. Нейролептики и антидепрессанты относятся к тем лекарствам, эффективность которых проявляется лишь при регулярном приеме. Эпизодический прием на фоне обострений неэффективен.
- Обязательно помогайте больному следить за регулярным и своевременным приемом лекарств. Важно также убедиться в том, что лекарство принимается в правильных дозах.
- Не следует ожидать сиюминутного результата. У некоторых лекарств положительный эффект возникает лишь спустя несколько дней или даже недель.
- У всех лекарств есть побочные эффекты.
 Некоторые из них со временем проходят по мере привыкания организма к новому средству. Если вред от побочных эффектов явно превосходит положительное действие, обратитесь к врачу. Многие лекарства могут быть заменены аналогом.
Некоторые из них со временем проходят по мере привыкания организма к новому средству. Если вред от побочных эффектов явно превосходит положительное действие, обратитесь к врачу. Многие лекарства могут быть заменены аналогом. - Некоторые лекарства плохо сочетаются между собою. Сообщайте врачу, какие лекарства принимает больной, чтобы избежать нежелательного эффекта. Обращайте внимание на соответствующие параграфы в инструкции.
- Не следует полагать, что лекарство, которое помогло однажды, остается эффективным постоянно. Деменция связана с изменениями в структуре и функционировании мозга, одно и то же лекарство может действовать по–разному на разных этапах.
- Назначенное лечение нуждается в регулярной коррекции. Лекарства, связанные с коррекцией поведения, не следует выписывать более чем на 3 месяца. Затем необходимо попробовать приостановить прием и посмотреть на результат.
- Помните, что многие лекарства, используемые для коррекции эмоционального фона, поведенческих и психиатрических симптомов, опасны для жизни, если принимать их в больших количествах.
 Поэтому препараты необходимо хранить с особой тщательностью.
Поэтому препараты необходимо хранить с особой тщательностью.
Немедикаментозное воздействие на когнитивную сферу
Эксперты включают в число эффективных методов поддержания и улучшения когнитивных функций следующие подходы к воздействию на когнитивную сферу.
Когнитивная стимуляция
Когнитивная стимуляция – это метод психологического воздействия, который реализуется обычно при работе в группе, проводимой специально обученным координатором. Его задача – организовать взаимодействие участников в ходе выполнения простых заданий, активизирующих познавательные процессы, а также использовать элементы реминисцентной терапии. Чем разнообразнее воздействие на участников групповой работы, тем лучше. Воздействия на разные органы чувств компенсируют снижение чувственных впечатлений, связанное с возрастом и заболеваниями пациента. Стандартная модель включает 14 тематических занятий продолжительностью 45 минут, проводимых дважды в неделю На данный момент существуют пособия по когнитивной стимуляции, позволяющие проводить занятия любому человеку, занимающемуся уходом за пациентами с деменцией в больницах, пансионатах, «дневных стационарах». Программа включает разминку (игры с мячом, пение…) и последующее занятие по разнообразным темам (детство, питание, повседневные дела, денежные расчеты, лица…). Используются наглядные материалы, загадки, игры, инсценировки.
Программа включает разминку (игры с мячом, пение…) и последующее занятие по разнообразным темам (детство, питание, повседневные дела, денежные расчеты, лица…). Используются наглядные материалы, загадки, игры, инсценировки.
Эффективность когнитивной стимуляции доказана в самых строгих исследованиях, включая метаанализы и систематические обзоры. Эффект от грамотно проведенных занятий может быть сопоставим с действием лекарств. Кроме того, кохрановский обзор показал, что занятия в группах социальной стимуляции могут улучшать субъективную оценку качества жизни, хотя не оказывают значимого влияния на повседневную активность.
Отметим также, что эксперты, проанализировавшие финансовых затрат на организацию таких занятий и их влияние на общие расходы, связанные с уходом за пациентом, страдающим от деменции, признали рентабельность их проведения. На данный момент они рекомендованы Национальным институтом здоровья Великобритании для пациентов с деменцией легкого и умеренного течения.
К сожалению, формат занятий, предполагающих сочетание разных воздействий на пациентов в ходе разноплановых активностей, не позволяет оценить, какой из аспектов занятий наиболее полезен, а также какую роль играет фактор социализации во время групповых занятий. Дополнительную сложность создает то, что в отличие от медикаментозной терапии, эффективность подобных занятий может в значительной степени зависеть от ведущего, созданной обстановки и т.п.
Когнитивный тренинг
Когнитивный тренинг – еще один метод когнитивного воздействия, в ходе которого пациенту предлагается выполнение специальных упражнений, требующих использование той или иной когнитивной функции. Обычно упражнения адаптируются по уровню сложности к состоянию пациента.
Качественных исследований, посвященных когнитивному тренингу, относительно не много. Но есть несколько исследований, показавших эффективность выполнения упражнений. Поэтому, хотя сделать твердое заключение о пользе выполнения упражнений на разные когнитивные функции не представляется возможным, мы все же рекомендуем их в соответствующей разделе на нашем сайте.
Когнитивная реабилитация
Когнитивная реабилитация нацелена на улучшение в выполнении пациентом повседневных дел за счет помощи в постановке индивидуальных целей и построения стратегий их достижения.
Такая помощь может быть эффективна для пациентов с легкой до умеренной деменцией альцгеймеровского типа, так как индивидуализированные цели положительно сказываются на выполнении отдельных функций и на качестве жизни в целом. Исследований этого метода когнитивного воздействия мало, и данных об эффективности недостаточно. Хотя в отдельных группах положительный результат был достигнут.
Влияние физических упражнений на когнитивный статус
Отдельно следует сказать о физических упражнениях. Физкультура – одно из важных направлений профилактики деменции, признанное во всем мире. Однако польза от физических упражнений для тех, кто уже страдает от деменции, признается не так однозначно. Исследования этого вопроса дают противоречивые результаты. К тому же общий вывод сделать сложно, ведь в разных исследованиях оценивались занятия разной частоты, продолжительности и интенсивности. Сложно отделить влияние физических упражнений от других факторов.
К тому же общий вывод сделать сложно, ведь в разных исследованиях оценивались занятия разной частоты, продолжительности и интенсивности. Сложно отделить влияние физических упражнений от других факторов.
В целом, возможно, связь между физическими упражнением и состоянием когнитивных функций существует. Возможно также, что упражнения высокой интенсивности оказывают более выраженный положительный эффект на когнитивный статус пациента. Другими словами, связь может носить дозозависимый характер и при достижении определенного порога интенсивности польза становится более выраженной. Эту гипотезу поддерживают результаты исследования ADEX для пациентов с деменцией альцгеймеровского типа умеренного течения. Участники, выполнявшие упражнения высокой интенсивности (>70% от максимально пульса), продемонстрировали лучшую динамику в когнитивной сфере, чем контрольная группа. Участники, выполнявшие упражнения умеренной интенсивности, значимых отличий не показали.
Так или иначе, вовлечение пациента в выполнение упражнений полезно по ряду причин, включая состояние сердечно-сосудистой системы, мозговое кровообращение, профилактику диабета, ожирения, укрепление мышц.
Здесь мы рассмотрели когнитивные аспекты лечения деменции. О коррекции нейропсихиатрических нарушений читайте здесь: https://memini.ru/glossary/31210
Если у вашего родственника деменция
Если у вашего родственника деменция
Памятку для ухаживающих за пациентами с когнитивными нарушениями подготовил специалист сети «РЖД-Медицина» Качурин Артём Александрович, врач-психиатр, нарколог высшей квалификационной категории.
Врачам различных специальностей, особенно участковым терапевтам, кардиологам, эндокринологам, часто приходится сталкиваться с пациентами с когнитивными нарушениями, из которых умеренные и выраженные являются основанием для консультации невролога, психиатра для установления точного нозологического диагноза.
Адекватная оценка статуса пациента имеет большое значение для выбора наиболее правильной тактики терапии и ведения больного. Популяционные исследования свидетельствуют, что среди лиц старше 65 лет не менее 5% соответствуют диагностическим критериям деменции.
Для достоверного диагноза «Деменция» нарушение когнитивных функций (память, интеллект, внимание, речь, праксис, гнозизис) должно наблюдаться в течение по меньшей мере 6 месяцев, а при более меньшем сроке данный диагноз только предположительный. При этом в более старших возрастных группах встречаемость деменции увеличивается, достигая среди пациентов 90-летнего возраста 20% и более.
Безусловными лидерами в списке причин деменции в пожилом возрасте являются: болезнь Альцгеймера (БА), сосудистая деменция и так называемая смешанная форма (сочетание БА с церебавскулярными заболеваниями). На долю данных форм когнитивного дефекта приходится до 80% всех случаев.
Когнитивные нарушения, достигающие степени деменции, очень часто снижают качество жизни не только самого пациента, но и его ближайшего окружения. При этом родственники страдают даже в большей степени, чем сам «заболевший». Вот почему так необходимы психологическое консультирование и поддержка близких людей, проживающих и находящихся рядом.
Хотелось бы дать несколько советов этим людям:
- Спорить с дементным человеком бессмысленно.
При любой форме деменции мозг больного человека перестает нормально функционировать. Когда больной произносит какие-либо фразы, эти фразы «диктует «больной» мозг. У родственника возникает инстинктивное желание поправить, но невозможно победить там, где больше невозможно использовать логику и разумные объяснения. - Если игнорировать симптомы, они никуда не денутся.
Когда родные замечают, что у их близких людей снижается память, они не могут мыслить логически, становится страшно, так как возможно это деменция. Хочется исправить, изменить, полечить, но приходится принимать это, особенно, если диагноз подтвержден врачом-специалистом (психиатром, неврологом). - Соглашайтесь с близким больным человеком. Порой приходится идти на «терапевтическую» ложь, чтобы отвечать ему максимально по-доброму.
Нужно задавать открытые вопросы о человеке, которого болеющий хочет навестить, (даже если тот умер) или о том действии, которое ему здесь и сейчас «по душе», что сделает его более счастливым и спокойным, а не приведет к растерянности, страху, гневу дементного.
- Никогда не поздно улучшить функцию мозга.
Реально затормозить прогрессирование заболевания, если оно уже установлено, можно регулярными физическими упражнениями и участием в различных видах деятельности, которые стимулируют «пострадавший» мозг. - Делитесь своими трудностями и не отказывайтесь от помощи.
Уход за человеком с деменцией — изнуряющая работа, особенно при выполнении ее в одиночестве. Ищите людей, готовых помочь Вам (и не только среди родственников). - Делайте что-то приятное для себя, расставляя правильно приоритеты.
Хотя бы 5 минут или 1 час в день уделить себе — это поможет Вам восстановиться и снизить риск выгорания во время ухода за слабоумным близким человеком. В противном случае, даже самый качественный уход приведет к разочарованию и полному истощению Ваших моральных, физических сил. - Старайтесь поддерживать достойное качество жизни болеющего, сосредоточившись на позитивных моментах, не важно много их или мало осталось и адаптировать деятельность под те возможности, которые еще есть.
Деменция не должна заставлять знакомиться заново!
Ежегодно 21 сентября отмечается Всемирный день борьбы с болезнью Альцгеймера. Цель этого движения – привлечь внимание общества к проблеме такого социально значимого заболевания как приобретенное слабоумие, поражающее огромное количество трудоспособных пожилых людей в разных странах. Сегодня деменцию по праву можно назвать «чумой XXI века» — по данным ВОЗ в мире насчитывается около 35,6 миллиона людей с деменцией. Ожидается, что это число удвоится к 2030 году, достигнув 65,7 миллионов, и более чем утроится к 2050 году, превысив отметку 115 миллионов человек. Средняя продолжительность жизни при болезни составляет 8-10 лет. По оценкам экспертов, общая численность больных, страдающих болезнью Альцгеймера, в России может составлять около 1,8 млн. человек.
Деме́нция (лат. Dementia — безумие) — приобретённое слабоумие, стойкое снижение познавательной деятельности с утратой в той или иной степени ранее усвоенных знаний и практических навыков и затруднением или невозможностью приобретения новых. Болезнь характеризуется проблемами с памятью, суждением, языком, ориентацией, общением и исполнительными функциям. Эти наиболее распространенные синдромы чаще отмечаются у людей пожилого возраста. По эпидемиологическим данным частота деменций составляет не менее 10% в возрастной группе 65-75 лет, и от 15 до 20% — на восьмом десятилетии жизни.
«ГЕРОФАРМ» обратился к теме деменций неслучайно. Неврологическое направление для группы компаний является приоритетным. В портфель «ГЕРОФАРМ» входят оригинальные препараты Кортексин (эффективный нейропроектор) и Кортексин для детей (детская форма выпуска). В 2013 году рынку был представлен препарат Леветинол (эффективное противоэпилептическое средство). Продолжая последовательную политику расширения портфеля в профильных направлениях, компания приступила к выпуску еще одного препарата в данной линейке: Мемантинол — современное лекарственное средство для лечения деменции средней и тяжелой степени при болезни Альцгеймера. Препарат улучшает когнитивные процессы, повышает повседневную активность. Мемантинол выходит на российский рынок со слоганом «Деменция не должна заставлять знакомиться заново!»
Представить препарат медицинской общественности компания планирует 21 сентября – в дату, которая является знаковой для всемирного движения против болезни Альцгеймера.
Сегодня в России информированность населения о деменции, к сожалению, не соответствует масштабам проблемы. Многие семьи, столкнувшись с первыми симптомами заболевания у близкого человека: забывчивость, неопрятность, потеря интереса к жизни, списывают их на естественное старение и обращаются к врачу лишь тогда, когда болезнь переходит в тяжелую форму. Между тем своевременно начатая терапия позволяет на годы отложить наступление всех неприятных последствий, которые снижают качество жизни и самого пациента, и его близких.
Активная просветительская работа вот уже несколько лет дополняет основную деятельность «ГЕРОФАРМ» по разработке и производству современных фармацевтических препаратов. Компания ежегодно инициирует мероприятия и присоединяется к глобальным акциям, направленным на информирование населения о мерах профилактики социально значимых заболеваний, а также на помощь в реабилитации и социализации людей с неврологическими заболеваниями. Выпуск нового препарата в сегменте неврологии и просветительская работа по деменции – еще один важный шаг, который компания сделает на пути улучшения качества жизни людей.
Справка
Всемирный день борьбы с болезнью Альцгеймера отмечается ежегодно, начиная с 1994 года по инициативе Международной организации по борьбе с болезнью Альцгеймера.
Ало́ис Альцге́ймер (нем. Alois Alzheimer, 14 июня 1864, Марктбрайт, Германия) — немецкий психиатр и невролог, автор множества статей по таким проблемам как алкогольный психоз, шизофрения, эпилепсия, сифилис мозга, хорея Хантингтона, артериосклеротическая атрофия мозга (1894), пресенильный психоз (1907). Получил медицинское образование в Вюрцбурге, затем жил и работал во Франкфурте.
Альцгеймер внёс значительный вклад в изучение патологии нервной системы. Увековечило его имя изучение сенильной деменции, известной как «болезнь Альцгеймера». Основываясь на результатах собственных фундаментальных исследований, он описал принципиальные различия между слабоумием сосудистого и нейродегенеративного генеза. Коллега Альцгеймера, немецкий психиатр Эмиль Крепелин позднее назвал разновидность старческого слабоумия именем Альцгеймера.
«Ведение» пожилых пациентов без сильнодействующих антипсихотических препаратов — Consumer Health News
ПОНЕДЕЛЬНИК, 25 июля 2016 г. (Новости HealthDay) — Около 25 процентов пациентов с деменцией в домах престарелых в США все еще успокаиваются с помощью опасных антипсихотических препаратов. Небольшое исследование показывает, что лечение этих сложных пациентов, вместо того, чтобы лечить их лекарствами, могло бы улучшить результаты.
«Лекарства имеют место, но не должны быть препаратами первой линии. Они не работают должным образом и имеют побочные эффекты», — сказал автор исследования д-р.Генри Бродати, профессор старения и психического здоровья Университета Нового Южного Уэльса в Сиднее, Австралия.
Антипсихотические препараты, такие как Риспердал (рисперидон), Абилифай (арипипразол) и Сероквель (кветиапин), одобрены для лечения серьезных психических заболеваний, таких как биполярное расстройство и шизофрения. Но у пожилых людей они часто используются для успокоения агрессивного или агрессивного поведения, связанного с деменцией.
«По сути, это успокаивающее средство», — сказал Дин Хартли, директор по научным инициативам U.S. на основе Alzheimer’s Association. Хотя он согласился с тем, что лекарства нужны в некоторых ситуациях, он сказал, что пациенты с деменцией, которые принимают сильнодействующие лекарства, более подвержены падению и имеют более высокий риск смерти.
Новое исследование рекламирует программу, которая обучает сотрудников домов престарелых сосредотачиваться на решении конкретных проблем, беспокоящих пациентов, а не на автоматическом усыплении их.
Неясно, сколько будет стоить такая программа в Соединенных Штатах и смогут ли дома престарелых адаптироваться к новому образу жизни.Но очевидно, что транквилизаторы, применяемые для пациентов с деменцией, могут быть опасными, сказал Хартли.
Представители здравоохранения США пытались сократить использование нейролептиков в домах престарелых. С 2008 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США требует, чтобы все антипсихотические препараты были помещены в рамку с предупреждением о повышении риска смерти у пожилых пациентов с психозом, связанным с деменцией.
Согласно справочным материалам исследования, процент пациентов, употребляющих наркотики, снизился с 24 процентов в конце 2011 года до 17 процентов в 2015 году.
Тем не менее, пациенты с деменцией часто нуждаются в особом лечении. По словам Бродаты, 90 процентов людей с деменцией также испытывают возбуждение, депрессию, агрессию, блуждание, бред и / или галлюцинации.
Его исследование включало 156 пациентов из 24 домов престарелых в Австралии. Все они были старше 60 лет и регулярно принимали антипсихотические препараты.
медсестер научили справляться с трудным поведением, не полагаясь на наркотики.
Из 135 пациентов, отменявших антипсихотические препараты, 76 процентов все еще не принимали их 12 месяцев спустя, говорят исследователи.
Хартли, ученый из Ассоциации Альцгеймера, сказал, что сосредоточение внимания на потребностях пациентов требует понимания проблем, которые их обременяют. Например, по его словам, они могут страдать от боли при инфекциях мочевыводящих путей, но не могут сказать об этом своим опекунам.
Хартли упомянул случай с пациентом, который все время хотел покинуть учреждение, говоря, что на улице идет дождь. Когда ее спросили, она объяснила, что ее детей, которые теперь выросли, нужно забрать на автобусной остановке. «Они сказали, что заберут их для нее», — сказал Хартли, и женщина успокоилась.
А как насчет стоимости? По словам Хартли, такая программа может фактически сократить расходы, потому что пациенты будут менее деструктивны и будут меньше обращаться в отделение неотложной помощи из-за травм в результате падений.
Хартли предупредил, что исследование было небольшим и нуждается в подтверждении. «Это важное исследование, но это только начало», — сказал он. Тем не менее, такой подход «может помочь лицам, осуществляющим уход, или семьям узнать, что с членами их семей обращаются гуманно».
Исследование было запланировано для презентации в понедельник на Международной конференции Ассоциации Альцгеймера в Торонто.Медицинские исследования, опубликованные на конференциях, следует рассматривать как предварительные, пока они не будут опубликованы в рецензируемом журнале.
Дополнительная информация
Чтобы узнать больше о деменции, посетите Ассоциацию Альцгеймера.
Проблемы, связанные с наркотиками, у пожилых людей с деменцией
Абстрактные
Фон
По сравнению с пациентами без деменции пожилые пациенты с деменцией, поступившие в отделения неотложной помощи, имеют более высокий риск триадной комбинации полипрагмазии (PP), потенциально несоответствующих лекарств (PIM) и лекарственного взаимодействия (DDI), что, как следствие, может привести к вредное здоровье.Цели этого исследования заключались в оценке факторов риска, связанных с триадной комбинацией PP, PIM и DDI среди госпитализированных пожилых пациентов с деменцией, а также для оценки распространенности и характеристик PP, PIM и DDI в этой популяции.
Методы
В это ретроспективное поперечное исследование были включены 416 пожилых стационарных пациентов с диагнозом деменция, направленных на консультацию специалиста-гериатра в третичную больницу в Брисбене, Австралия, в 2006–2016 годах. Пациенты были разделены на две группы в соответствии с их воздействием комбинации PP, PIM и DDI: «триадная комбинация» и «нетриадная комбинация».Данные были собраны с использованием инструмента оценки interRAI Acute Care (AC). Независимые факторы риска воздействия комбинации триад были оценены с использованием двумерного и многомерного анализа логистической регрессии.
Результаты
В целом, 181 человек (43,5%) был отнесен к группе комбинированной триады. Большинство населения принимало как минимум 1 PIM (56%) или испытало хотя бы один потенциальный DDI (76%). Более 75% участников подверглись полипрагмазии. Чаще всего назначались антипсихотические препараты, за которыми следовали бензодиазепины.Независимыми факторами риска комбинации триад были наличие диагноза фибрилляции предсердий и более частое использование лекарств в кардиотерапии, психолептических и психоаналептических средствах.
Выводы
Воздействие комбинации триад PP, PIM и DDI часто встречается среди людей с деменцией в результате их уязвимых состояний и повышенного риска побочных эффектов от приема лекарств. Это исследование выявило использование кардиотерапии, психолептических и психоаналептических средств в качестве предикторов воздействия PP, PIM и DDI.Таким образом, следует тщательно обдумать и тщательно контролировать использование этих лекарств. Кроме того, для этой уязвимой группы следует начать и постоянно проводить всесторонние обзоры лекарств для оптимизации назначения лекарств.
Образец цитирования: Ruangritchankul S, Peel NM, Hanjani LS, Gray LC (2020) Проблемы, связанные с наркотиками, у пожилых людей, живущих с деменцией. PLoS ONE 15 (7): e0236830. https://doi.org/10.1371/journal.pone.0236830
Редактор: Мойтаба Вайсморади, Северный университет, НОРВЕГИЯ
Поступила: 6 апреля 2020 г .; Принята к печати: 14 июля 2020 г .; Опубликовано: 31 июля 2020 г.
Авторские права: © 2020 Ruangritchankul et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Автор (ы) не получил специального финансирования для этой работы.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
В течение последних десятилетий рост старения населения и значительный рост продолжительности жизни привели к увеличению распространенности нейродегенеративных заболеваний, включая деменцию. Во всем мире число людей, страдающих деменцией, составляло почти 50 миллионов в 2017 году и, по прогнозам, увеличится до 131,5 миллиона к 2050 году [1]. В Австралии число людей, живущих с деменцией, составляло 447 115 в 2019 году. В следующие четыре десятилетия это число увеличится более чем вдвое и к 2058 году достигнет расчетного числа 1076 129 человек [2].
Деменция — это термин, используемый для описания клинических синдромов, связанных с необратимо прогрессирующим ухудшением нескольких высших корковых функций, включая язык, память, расчет, понимание, мышление, навыки обучения и соответствующее суждение, что приводит к нарушению функциональных способностей и повседневной жизни [3, 4]. Из-за ухудшения корковых функций, особенно памяти, люди с деменцией могут многократно принимать лекарство или принимать неправильные лекарства, что приводит к проблемам, связанным с лекарствами (DRP), и увеличению использования лекарств.Эти проблемы имеют разрушительные последствия для здоровья, такие как побочные эффекты лекарств, заболеваемость и смертность. Деменция — самый большой фактор риска инвалидности и преждевременной смертности у австралийских пожилых людей в возрасте 65 лет и старше [5,6]. В 2017 г. деменция была второй по значимости причиной смерти в Австралии сразу после заболеваний коронарной артерии [7]. Средняя продолжительность жизни людей с деменцией колеблется от 3 до 13 лет [8,9]. Наконец, экономические последствия деменции вызывают серьезную озабоченность.Ориентировочная стоимость деменции в Австралии составила более 15 миллиардов долларов в 2019 году и, по оценкам, вырастет до 36,8 миллиарда долларов к 2056 году [6].
Деменция обычно связана с развитием трех или более хронических заболеваний, включая гипертонию, инсульт, диабет и ишемическую болезнь сердца, что приводит к увеличению потребностей в медицинской помощи и использованию лекарств [10–16]. Деменция и связанные с деменцией осложнения являются частыми причинами незапланированных посещений отделений неотложной помощи, а затем способствуют неблагоприятным последствиям, включая падения, наложенный делирий, слабость, недоедание, повышенную смертность и более длительное пребывание в больнице [17–26].В Австралии около 83 000 человек с деменцией ежегодно попадают в отделения неотложной помощи [27]. В предыдущих исследованиях от 15% до 40% госпитализированных пациентов были диагностированы с деменцией, и на них приходилось 10% койко-дней неотложной помощи [28–32]. Что касается приема лекарств, люди с деменцией с большей вероятностью будут принимать многие лекарства для лечения когнитивных проблем, психо-поведенческих симптомов и множественных сопутствующих заболеваний по сравнению с людьми без деменции [33,34]. Большинство гериатрических пациентов с деменцией обычно принимают в среднем пять или более лекарств, обычно определяемых как полипрагмазия (ПП) [35–39].Хотя для лечения деменции и хронических заболеваний может потребоваться прием нескольких лекарств, использование нескольких лекарств может привести к большему риску DRP, включая потенциально несоответствующие лекарства (PIM), лекарственные взаимодействия (DDI) и побочные реакции на лекарства ( ADR) [40–45]. Помимо полипрагмазии, возрастные фармакокинетические и фармакодинамические изменения могут представлять более высокий риск нежелательных DRP [46,47]. Кроме того, у пожилых людей с деменцией наблюдается изменение проницаемости крови и головного мозга и уровней эндогенных нейромедиаторов, что может повысить их чувствительность к неврологическим эффектам лекарств, что приводит к большему количеству побочных эффектов [46,48,49].PP и DRP приводят к повышенному риску госпитализации, заболеваемости, смертности и бремени медицинской помощи [50–53]. Эти проблемы, как правило, возникают чаще и более серьезны у пожилых людей с деменцией из-за их уязвимости, чем у более молодого населения. Воздействие комбинации PP и DRP обычно выявляется у пожилых пациентов с деменцией. Во многих предыдущих исследованиях сообщалось о высокой распространенности PP и DRP среди пожилых пациентов с деменцией, госпитализированных в больницы.Исследования показали, что 82–98% этой уязвимой группы населения подвержены воздействию PP [54–56], 22,4–96% — PIM [56–59] и 43,2% — DDI [60].
Однако, хотя во многих исследованиях оценивались аспекты, связанные с PP, PIM или DDI, ни одно из предыдущих исследований не изучало распространенность и связанные факторы риска воздействия трех критериев или сочетания триад PP, PIM и DDI среди пожилых людей с деменцией, госпитализированных в отделение неотложной помощи.
Первой целью настоящего исследования была оценка факторов риска, связанных с воздействием комбинации триады PP, PIM и DDI среди пациентов с деменцией.Другая цель заключалась в оценке распространенности и характеристик PP, PIM и DDI, а также в определении наиболее часто используемых лекарств в контексте этой уязвимой группы населения.
Материалы и методы
Дизайн исследования, постановка и участники
Настоящее исследование представляет собой вторичный анализ данных из базы данных комплексной электронной гериатрической оценки [61] пациентов, направленных на гериатрическую консультацию к специалисту в больницу принцессы Александры, Брисбен, Австралия, в период с 1 января 2006 года по 31 декабря 2016 года.Инструмент interRAI Acute Care (AC) использовался для комплексной гериатрической оценки [62]. Критериями отбора людей для исследования были пациенты в возрасте 65 лет и старше с деменцией на основании медицинских карт с диагнозом «деменция» в сочетании с оценками шкалы когнитивных способностей (CPS) от 2 до 6, полученных на основе InterRAI Acute Care. оценка. Участники были разделены на две группы: группа комбинации триад и группа комбинации нетриад. Группа комбинированной триады включала пациентов, подвергавшихся всем трем критериям: PP, PIM и DDI.Группа без сочетания триад включала тех, кто не подвергался сочетанию трех критериев: PP, PIM и DDI.
Инструменты для сбора данных и измерения
В этом исследовании все данные были обезличены данными о состоянии здоровья, полученными из базы данных interRAI Acute Care (AC) [62,63]. Стандартизированный инструмент оценки interRAI Acute Care (AC) использовался для поддержки всесторонней гериатрической оценки (CGA) в условиях острого состояния для пожилых пациентов [61] при поступлении, обученные медсестры-оценщики собрали исчерпывающие данные о здоровье, включая физические, физиолого-поведенческие и социальные данные. -экономический статус и проведено множество клинических оценок, например, когнитивного статуса, психо-поведенческих условий и повседневной активности.Если пациенты не могли предоставить медицинскую информацию, их родственники или доверенные лица могли предоставить необходимую информацию. Индивидуальные переменные (ковариаты) включали исходные характеристики, жизненную ситуацию, первичный диагноз, сопутствующие заболевания, гериатрический синдром, повседневную активность (ADL), инструментальную повседневную активность (IADL), настроения и модели поведения, когнитивные функции, использование услуг и все остальное. прописанные лекарства [62]. В течение 24 часов с момента поступления обученные медсестры-оценщики собрали и записали все данные о состоянии здоровья и списки назначенных лекарств.Когнитивная функция участника оценивалась с помощью встроенных компьютерных алгоритмов InterRAI Acute Care (AC), которые интерпретировали собранные клинические данные, такие как настроение, поведение и когнитивные функции, для создания CPS, коррелированного с краткой оценкой психического состояния (MMSE), с оценкой от 0 (когнитивные способности без изменений) до 6 (очень тяжелые когнитивные нарушения) [64]. Функциональные возможности и уровни зависимости оценивались по короткой шкале ADL при поступлении и преморбидной шкале IADL, которые также были встроены в базу данных InterRAI Acute Care (AC) [63,65].Краткая шкала ADL при поступлении оценивает полученную помощь в выполнении четырех видов деятельности, включая прием пищи, личную гигиену, пользование туалетом и ходьбу, в диапазоне от 0 до 16 с более высокими баллами, указывающими на более высокий уровень нетрудоспособности [63,66]. Шкала Premorbid IADL суммировала эффективность по семи пунктам IADL (работа по дому, приготовление еды, покупки, финансы, транспорт, использование телефона и прием лекарств). Оценки эффективности по каждому пункту варьируются от 0 (независимый) до 6 (полная зависимость). Суммарные баллы были проанализированы для создания шкалы от 0 до 42, причем более высокие баллы указывали на более высокий уровень зависимости [63,66].Что касается данных о лекарствах, то в базы данных вносились название, частота, способ применения и дозы лекарств. Все зарегистрированные лекарства были классифицированы по анатомо-терапевтическим химическим кодам (АТХ) [67] в соответствии с рекомендацией Всемирной организации здравоохранения в качестве международного стандарта для представления данных об использовании лекарств. Наконец, распространенность и характеристики PP, PIM и DDI были определены гериатром и / или фармацевтом с использованием следующих определений.
Определения
Проблема, связанная с наркотиками (DRP).
DRP определяется как любое нежелательное обстоятельство, связанное с медикаментозной терапией, которое потенциально препятствует желаемым последствиям для здоровья [68]. В текущем исследовании DRP состоит из присутствия PIM и DDI.
Полифармация (ПП).
PP определяется как одновременное потребление пяти или более прописанных лекарств на основании количества регулярно прописываемых лекарств, задокументированных в базе данных InterRAI Acute Care (AC) [69].
Потенциально неподходящие лекарства (PIM).
По определению, PIM — это лекарство, которого следует избегать, поскольку риск для здоровья перевешивает клиническую пользу [70]. В этом исследовании PIMs были определены с использованием критериев Пива ® Американского гериатрического общества (AGS) 2019 года (AGS Beers Criteria ® ), которые являются пятым обновленным критерием AGS Beers ® [71]. В настоящем исследовании были определены PIMs, не зависящие от состояния здоровья, и PIM, которых следует избегать у пожилых людей из-за взаимодействий лекарств с заболеванием или лекарством с синдромом.
Лекарственное взаимодействие (DDI).
Определение DDI — это ситуация, в которой одно вещество влияет на активность другого лекарственного средства при одновременном применении обоих, независимо от того, возникнут побочные эффекты или нет [72]. Все прописанные лекарства были проанализированы с помощью базы данных Micromedex Drug Interaction Database [73], чтобы определить лекарственные взаимодействия, которые считались только одной парной комбинацией лекарств. В этом исследовании о потенциальных лекарственных взаимодействиях сообщалось с точки зрения тяжести и эффекта взаимодействия.Что касается степени риска, то DDI были разделены на четыре категории: незначительные, средние, серьезные и противопоказанные DDI [73]. Изучался только риск потенциальных неблагоприятных исходов, связанных с лекарственными взаимодействиями, но не учитывались клинически значимые исходы.
Статистический анализ
Статистический анализ выполняли с использованием пакета программного обеспечения SPSS для Windows, версия 25 (SPSS Inc., Чикаго, Иллинойс, США). Для описания популяционных характеристик и профилей лекарств для категориальных переменных использовался процент, а для непрерывных переменных — среднее ± стандартное отклонение (SD) или медиана ± межквартильный размах (IQR).Критерий хи-квадрат Пирсона или точный критерий Фишера для категориальных переменных и непарный t-критерий Стьюдента или U-критерий Манна-Уитни для непрерывных переменных были выполнены для сравнения исходных характеристик, физической и когнитивной функции, профилей лекарств между группой с комбинацией триад и группой без комбинации триад. . Сначала использовали одномерный логистический регрессионный анализ, чтобы оценить влияние переменных на воздействие комбинации триад PP, PIM и DDI. Факторы, определенные как значимые переменные из одномерного логистического анализа (значимость установлена при p <0.05), возраст, пол, количество сопутствующих заболеваний, короткая шкала ADL при поступлении и преморбидные IADL были включены в окончательный многомерный логистический регрессионный анализ для оценки независимых факторов риска, связанных с воздействием комбинации триад PP, PIM и DDI. Кроме того, был проведен анализ подгрупп для оценки факторов риска, связанных с большей подверженностью каждому критерию PP, PIM и DDI, с использованием двумерного и многомерного анализа логистической регрессии. Результаты логистического регрессионного анализа были представлены в виде отношения нечетности (OR) и 95% доверительных интервалов (CI).Уровни статистической значимости для переменных определялись на уровне p <0,05.
Настоящее исследование представляет собой вторичный ретроспективный перекрестный анализ обезличенных данных, предоставленных оценочной базой данных interRAI Acute Care (AC). От исследователей не требовалось идентифицировать данные и связываться с участниками. Освобождение от этического одобрения было получено от Комитета по этике исследований на людях Южного метро и исследований на людях.
Результаты
Исходные и клинические характеристики
Из 2992 пожилых пациентов в возрасте 65 лет и старше, направленных на гериатрическую консультацию в больницу принцессы Александры с 2006 по 2016 год, всего 416 пожилых пациентов с деменцией (13.9%) были зачислены. Приемлемые участники были разделены на две группы: группа с комбинацией триад и группа без комбинации. В целом, 181 (43,5%) участник и 235 (56,5%) участников были классифицированы как группа с комбинацией триад и группа без комбинации триад соответственно. Описательный анализ и сравнение популяционного исследования с точки зрения исходных и клинических характеристик между двумя группами представлены в таблице 1.
Большинство участников были женщины (n = 224; 53.8%). Возраст варьировался от 65 до 101 года, в среднем 82,3 года (стандартное отклонение 7,1 года), что незначительно отличалось между двумя группами. Более половины участников овдовели, развелись или разошлись. Большинство населения (> 80%) проживало в собственных домах, но менее половины из них жили одни. В текущем исследовании было обнаружено, что количество пациентов, живших в одиночестве в группе с комбинацией триад, было значительно ниже по сравнению с группой без комбинации триад.Примерно одна десятая была госпитализирована из интернатных учреждений по уходу за престарелыми. Средняя продолжительность госпитализации существенно не различалась между двумя группами (p = 0,408). Что касается пункта выгрузки, то более 40% было выгружено в RACF. В обеих группах примерно 6% закончили свою жизнь в больнице. Деменция с психоповеденческими симптомами (29,8%), падения (22,8%) и инфекция мочевыводящих путей (15,4%) были основными причинами нынешней госпитализации. У участников в группе комбинации триад было значительно больше сопутствующих заболеваний по сравнению с группой без комбинации триад (p = 0.001). Более трех четвертей всего населения имели три или более сопутствующих заболеваний. В обеих группах участники чаще страдали гипертонией, инфекциями и ишемической болезнью сердца. Было обнаружено, что количество участников, страдающих диабетом, ишемической болезнью сердца, фибрилляцией предсердий и остеопорозом в комбинации триад, было заметно выше по сравнению с группой без комбинации триад (p <0,05). Что касается функциональных возможностей и гериатрического синдрома, у большинства участников была более высокая вероятность нарушения слуха (49.3%), недержание мочи (65,4%) и когнитивные нарушения от легкой до умеренной (78,8%) с оценкой CPS от 2 до 4. Участники в группе комбинированной триады имели тенденцию к большей зависимости от IADL по сравнению с те, что в группе комбинации без триад [31,8 (SD 11,2) в группе комбинации триад против 29,3 (SD 12,8) в группе без комбинации триад, p = 0,032].
Использование лекарств
Наиболее часто назначаемые лекарства, классифицированные по кодам ATC, представлены в таблице 2.Общее количество регулярно выписываемых лекарств составило 3027. Количество регулярно прописываемых лекарств на человека варьировалось от 0 до 19. Два участника в группе комбинированной нетриады и шесть в группе комбинированной тройки употребляли более 15 лекарств. Среднее количество прописанных лекарств составляло 8 (IQR 6–10 препаратов) в группе комбинированной триады и 6 (IQR 4-8 препаратов) в группе комбинированной нетриады. Это значительно различается между двумя группами (p <0,001).Тремя наиболее часто назначаемыми категориями лекарств были антитромботические препараты (76,4%), за которыми следовали препараты от запора (41,8%) и препараты, действующие на ренин-ангиотензиновую систему (39,4%). В группе комбинированной триады назначения кардиотерапии, диуретиков, психолептических и психоаналептических средств были значительно выше по сравнению с группой без комбинации триад (p <0,001). До 10% от общего числа участников использовали лекарства от деменции, которые состояли из трех ингибиторов холинэстеразы и одного антагониста рецептора N-метил-D-аспартата (NMDA).
PP, PIM и DDI
В обеих группах примерно 78% участников подвергались воздействию полипропилена. Примерно 76% участников испытали как минимум 1 потенциальный DDI, а 233 участника (56%) имели как минимум 1 PIM, как показано в Таблице 3.
Четыре участника (1%) были на 4 PIM. Что касается DDI, 23 участника (5,5%) подверглись воздействию> 10 потенциальных DDI. В целом 373 участника (89,7%) были подвергнуты как минимум 1 критерию PP, PIM и / или DDI. Из этих 373 50 (12%) подвергались одному критерию, 142 (34.1%) по двум критериям и 181 (43,5%) по всем трем критериям.
Всего среди исследуемой популяции было идентифицировано 657 PIM, как показано в Таблице 4. Чаще всего назначались PIM для неврологической и сердечно-сосудистой систем. Чаще всего назначались антипсихотические препараты и бензодиазепины.
В текущем исследовании 1360 комбинаций лекарств привели к потенциальным DDI, как показано в таблицах 3 и 5. Большинство участников (49,4%) подвергались воздействию основных DDI.Три отдельных парных комбинации препаратов способствовали возникновению противопоказанных DDI, например, комбинация галоперидола с метоклопрамидом, циталопрама с метоклопрамидом и оксибутинина с калием. Комбинация лекарств, часто участвующая в потенциальном DDI, представляла собой комбинацию гепарина с аспирином, интерактивный эффект которого увеличивает риск кровотечения.
Факторы, связанные с воздействием комбинации триад
После проведения одномерного логистического регрессионного анализа были определены значимые переменные для воздействия всех трех критериев PP, PIM и DDI, как показано в таблице 6.Эти важные переменные, возраст, пол, количество сопутствующих заболеваний, кратковременный ADL при поступлении, преморбидный IADL были добавлены для корректировки многомерной логистической модели. После этой корректировки независимыми факторами риска комбинации триад были наличие диагноза фибрилляции предсердий (OR = 2,12 [1,93–3,96]) и увеличение использования лекарств в кардиотерапии (OR = 3,49 [1,76–6,92]), психолептических средств (OR = 2,12 [1,93–3,96]). = 7,09 [4,23–11,87]) и психоаналептиков (OR = 2,41 [1,44–4,03]). Однако степень когнитивных нарушений, возраст, пол, ADL и количество сопутствующих заболеваний не были ассоциированными факторами воздействия комбинации триад PP, PIM и DDI.
Факторы, связанные с полипрагмазией
Результаты многомерного логистического регрессионного анализа для независимых факторов риска полипрагмазии представлены в таблице 7. Результаты показали, что наличие диагноза гастроэзофагеальной рефлюксной болезни (ГЭРБ) (OR = 6,03 [1,64–22,09]) и диагноза DDI (OR = 34,16 [9,59–121,69]) были связаны с повышенной полипрагмазией. Более того, большее количество прописанных лекарств от запоров, минеральных добавок, антитромботических средств, диуретиков, агентов, действующих на ренин-ангиотензиновую систему, липид-модифицирующих агентов, антибактериальных препаратов, анальгетиков и психолептиков, были сильными факторами риска полипрагмазии (P <0.001).
Факторы, связанные с ненадлежащим использованием лекарств
Скорректированный анализ логистической регрессии показал больший риск PIM, который существенно увеличивался при условии более широкого использования лекарств в кардиотерапии (OR = 3,47 [1,80–6,66]), гипотензивных средств (OR = 6,24 [1,26–30,83]), психолептических ( OR = 18,38 [9,73–34,73]) и психоаналептиков (OR = 2,26 [1,30–3,93]), как показано в таблице 7. Кроме того, возникновение DDI было связано с PIM (OR = 1.97 [1.08–3.62]).
Факторы, связанные с лекарственными взаимодействиями
Согласно многомерному анализу логистической регрессии, ассоциированными независимыми факторами риска более высокого DDI были большее количество сопутствующих заболеваний (OR = 1,24 [1,03–1,48]) и прописанные лекарства (OR = 1,46 [1,17–1,82]), а также наличие полипрагмазия (OR = 3,04 [1,12–8,27]) и PIM (OR = 2,07 [1,07–4,00]). Назначения диуретиков (OR = 12,72 [1,64–98,68]) и психоаналептиков (OR = 6,14 [2.35–16.08]) незначительно увеличили распространенность DDI, как показано в таблице 7.
Обсуждение
В текущем исследовании описаны факторы риска, связанные с воздействием трех критериев или триадной комбинации PP, PIM и DDI, а также изучены распространенность и характеристики PP, PIM и DDI среди пожилых людей с деменцией, поступивших в отделение неотложной помощи в период с 2006 по 2016 год. Распространенность деменции среди госпитализированных пожилых пациентов в возрасте 65 лет и старше составила 13 лет.9%, аналогично результатам предыдущих исследований [74,75]. Что касается первичного диагноза, в соответствии с исследованием Toot et al и Andrieu et al, пациенты с поведенческими и психологическими симптомами деменции (BPSD) связаны с повышенным риском госпитализации [76,77] в результате стресса лиц, осуществляющих уход. и бремя [78,79]. Кроме того, падения и инфекции мочевыводящих путей также являются частыми причинами госпитализации людей, страдающих деменцией, что согласуется с данными предыдущих исследований [17,79–88].Однако в этой гериатрической популяции можно было предотвратить падения и инфекцию мочевыводящих путей. Среди пациентов с диагнозом деменция более частое использование постоянных катетеров, обезвоживание, плохая гигиена и недержание мочи могут быть связаны с повышенным риском инфекции мочевыводящих путей (ИМП) [89–92]. Кроме того, с точки зрения нейропсихиатрического лечения широко назначаются седативные или антипсихотические средства, которые могут усугубить задержку мочи и снизить активность пациента, что приведет к ухудшению ИМП.Падения являются распространенной проблемой у этих пациентов из-за нарушения зрительно-пространственных и исполнительных функций, а также развития негативных последствий для здоровья от некоторых лекарств для поддержания когнитивных функций и поведенческих симптомов [93]. Наиболее частыми сопутствующими заболеваниями являются артериальная гипертензия, за которой следуют инфекция и ишемическая болезнь сердца. Результаты настоящего исследования аналогичны обычным комбинациям хронических заболеваний, обнаруженным в предыдущих исследованиях [94–97]. Наиболее распространенные ранее существовавшие сопутствующие заболевания с деменцией, такие как гипертония и сердечно-сосудистые заболевания, можно объяснить тем, что они являются предикторами риска деменции [95,96,98].По сравнению с группой без комбинации триад количество пациентов с сахарным диабетом, ишемической болезнью сердца и фибрилляцией предсердий в комбинации триад было значительно выше. Благодаря такому лечению большинство пациентов с этими хроническими заболеваниями лечились несколькими лекарствами и узкими терапевтическими препаратами, такими как дигоксин и варфарин, что приводило к повышенному риску воздействия трех критериев: PP, PIM и DDI [98].
Наиболее часто назначаемыми категориями лекарств были антитромботические агенты и агенты, действующие на ренин-ангиотензиновую систему, которые назначались для лечения общих хронических заболеваний, таких как гипертония и болезни коронарных артерий [99].Более того, антитромботические средства широко назначались пациентам с переломом шейки бедра для предотвращения венозной тромбоэмболии [54]. По сравнению с группой без комбинации триад, количество лекарств, используемых в кардиотерапии, диуретиков, психолептических и психоаналептических средств в группе комбинации триад было значительно выше.
Как и следовало ожидать, госпитализированным пожилым пациентам с деменцией обычно назначают пять или более лекарств в день [41,100], что связано с более высокими сопутствующими заболеваниями и более серьезными осложнениями, связанными с деменцией [33,40].Согласно исследованию Brunet et al и Von-Ranteln Kruse et al, от 82 до 98% госпитализированных пожилых людей, живущих с деменцией, испытали полипрагмазию [55,56]. Что касается факторов, связанных с полипрагмазией, было выявлено большее количество назначенных медикаментов в кардиотерапии, психолептических и психоаналептических средствах. Результаты предыдущих исследований вносят вклад в растущий объем доказательств, демонстрирующих наличие лекарственных взаимодействий, связанных с более высоким риском полипрагмазии [101–103].Согласно исследованию Park H-Y el al [104] полипрагмазия связана с увеличением числа сопутствующих заболеваний, чего не было в нашем исследовании.
В случае ненадлежащего использования лекарств более половины этой гериатрической популяции с большей вероятностью подверглись хотя бы 1 PIM. Эта распространенность была выше, чем результаты предыдущих исследований [57,105,106]. Однако вариабельность распространенности PIM зависит от характеристик населения, медицинских учреждений и используемых списков PIM, таких как критерии Пива, критерии STOPP / START, список PRISCUS и список Лароша [71,107–109].Что касается характеристик PIM в соответствии с критериями Beers 2019 года, наиболее распространенными классификациями PIM являются лекарства для сердечно-сосудистой системы, включая кардиотерапию (антиаритмические средства), и лекарства для центральной нервной системы, включая психолептики и психоаналептики. Эти данные могут объяснить, почему использование кардиотерапии, психолептических и психоаналептических средств являются надежными предикторами возникновения PIM. Согласно критериям Beers 2019 года, антипсихотики и бензодиазепины считаются часто назначаемыми PIM, которые могут привести к ухудшению когнитивной функции и пагубным последствиям для здоровья [71,110–116].Кроме того, известно, что нейролептики повышают риск сердечно-сосудистых событий (инсульт и сердечная аритмия) и смертности [117–120], тогда как бензодиазепины считаются предиктором падений и переломов [121]. Тем не менее, эти PIMs можно было бы предотвратить, если бы назначение лекарств было тщательно сбалансировано между рисками и преимуществами и избегало их для неподходящих пациентов. Хотя некоторые отпускаемые по рецепту лекарства, такие как нейролептики и бензодиазепины, могут облегчить ДПБС, эти препараты не следует использовать в качестве терапии первой линии [114].Следовательно, необходимо устранить провоцирующие причины и предпринять немедикаментозное лечение до начала приема антипсихотических средств [122, 123]. В отличие от предыдущих исследований [39,124–126], PP и количество лекарств не были связаны с использованием PIM в этом исследовании. При деменции распространенными факторами риска PIMs является использование лекарств для облегчения BPSD, таких как психолептики и психоаналептики. В отличие от наших результатов, другие исследования [39,127] показали связь некоторых заболеваний, таких как недержание мочи и остеоартрит, с использованием PIM.
Распространенность DDI в этой гериатрической популяции с деменцией в условиях неотложной помощи была значительно выше, чем в предыдущем исследовании [60]. В этом исследовании более одной трети пожилых пациентов с деменцией подвергались серьезному потенциальному DDI, что согласуется с исследованием Богетти-Салазара [128]. Наиболее распространенным потенциальным DDI была комбинация гепарина с аспирином, которые назначаются для лечения распространенных сопутствующих заболеваний, таких как сердечно-сосудистые заболевания. Эта распространенная комбинация лекарств в исследовании может быть назначена для предотвращения венозной тромбоэмболии как осложнения при падениях и переломах.Это исследование демонстрирует, что чем больше пациенты принимают прописанные лекарства, тем выше риск DDI, с которым они сталкиваются [60,101,128]. Кроме того, прием PIM и PP представляет собой значительный риск лекарственного взаимодействия [101,129]. Кроме того, определенные классификации лекарств, включая психоаналептики (антидепрессанты и препараты от деменции) и диуретики, связаны с более высоким риском DDI из-за возрастных фармакокинетических и фармакодинамических изменений [60,128,130,131]. Однако не было обнаружено никакой связи между DDI и каким-либо конкретным фактором медицинского состояния, полом, возрастом, повседневной активностью [60,128].
Что касается воздействия комбинации триад, пожилые пациенты с диагнозом деменция склонны к комбинации триады PP, PIM и DDI. Что касается предикторов комбинации триад, было обнаружено, что пожилые пациенты с деменцией с фибрилляцией предсердий с большей вероятностью будут подвергаться воздействию комбинации триад PP, PIM и DDI по сравнению с пациентами без фибрилляции предсердий. При лечении фибрилляции предсердий и профилактических осложнений многие типы лекарств, такие как антиаритмические препараты и антитромботические средства, назначаются в виде комбинации препаратов выбора.Эти препараты обладают значительным узким терапевтическим индексом и вариабельностью реакции на дозу, что может способствовать увеличению риска PIM и DDI [132]. Кроме того, более широкое использование кардиотерапии, психоаналептиков и психолептических средств были важными факторами риска воздействия комбинации триады PP, PIM и DDI.
Управление лекарствами должно варьироваться в зависимости от индивидуума, и лица, назначающие лекарства, должны тщательно учитывать предпочтения пациентов в отношении лечения, а также принимать во внимание риски и преимущества назначения лекарств.Более того, повышение осведомленности практикующих врачей об осторожном использовании лекарств имеет важное значение для предотвращения нежелательных проблем с наркотиками, таких как PIM и DDI, значительную часть которых можно предотвратить. Следовательно, следует инициировать стратегии комплексных обзоров лекарств и согласования лекарств врачами и фармацевтами для оптимизации назначения лекарств госпитализированным пожилым пациентам с деменцией, чтобы ограничить возникновение PP, PIM и DDI.
Сильные стороны и ограничения
Насколько нам известно, это первое исследование, в котором изучаются факторы риска, связанные с воздействием комбинации триады PP, PIM и DDI, и оценивается распространенность и характеристики PP, PIM и DDI среди пожилых пациентов с деменцией в отделениях неотложной помощи. постановка в течение десятилетнего периода.Кроме того, для сбора клинической информации, социальных характеристик и профилей назначения лекарств гериатрической популяции с деменцией использовался стандартизованный инструмент оценки interRAI Acute Care (AC). Обученные медсестры-оценщики собрали всю исчерпывающую информацию о здоровье и провели множество клинических оценок деменции, чтобы обратиться к базам данных interRAI для оказания неотложной помощи (AC), которые являются стандартной базой данных для оценок для учреждений неотложной помощи. Участники были определены с использованием комбинации медицинских записей со стандартным когнитивным тестированием, включая баллы CPS в диапазоне от 2 до 4, чтобы поддержать точность диагностики деменции.
Необходимо принять во внимание несколько ограничений этого исследования. Во-первых, это исследование проводилось только у пожилых пациентов с деменцией, направленных на консультацию к специалисту-гериатру в одном учреждении неотложной помощи; следовательно, результаты могут быть неприменимы к пожилым людям, поступившим в другие учреждения или у которых не диагностировано слабоумие. Пациенты обычно направляются для гериатрической оценки в связи с потребностями в комплексном уходе и мультиморбидностью, а также для принятия решений о выписке в учреждения по уходу за престарелыми, поступлении в программы ухода за переходным периодом и возможности реабилитации.Не все пациенты с деменцией направляются на консультацию к специалисту, поэтому число, включенное в это исследование, вероятно, будет заниженным числом пациентов пожилого возраста с деменцией, госпитализированных в больницу. Во-вторых, количество пожилых пациентов с деменцией может быть недооценено из-за неполного диагноза перед госпитализацией [12,17,20,21]. В-третьих, идентификация подтипов деменции может привести к различиям в результатах, но деменция не была классифицирована по этиологии в этом исследовании. В-четвертых, отсутствие подробной продолжительности и указания назначения лекарств при госпитализации может привести к недооценке PIM.В-пятых, не учитывались клинически значимые исходы, связанные с лекарственными взаимодействиями. Более того, все лекарственные взаимодействия учитывались только для одной пары комбинации лекарств, но взаимодействия от трех или более комбинаций лекарств не учитывались. Наконец, это исследование не рассматривало другие распространенные DRP среди пожилых людей с деменцией, такие как ADR [44].
Заключение
Воздействие триадной комбинации PP, PIM и DDI часто встречается среди людей с деменцией в результате их уязвимых состояний и повышенного риска побочных эффектов от приема лекарств.Это исследование выявило использование кардиотерапии, психолептических и психоаналептических средств в качестве предикторов воздействия PP, PIM и DDI. Таким образом, следует тщательно обдумать и тщательно контролировать использование этих лекарств. Кроме того, для этой уязвимой группы следует начать и постоянно проводить всесторонние обзоры лекарств для оптимизации назначения лекарств.
Благодарности
Авторы хотели бы поблагодарить всех обученных медсестер-оценщиков за сбор исчерпывающих данных в базе данных системы оценки interRAI Acute Care (AC).
Ссылки
- 1. Международная ассоциация болезни Альцгеймера. Статистика деменции. 2017 [Цитировано 24 октября 2019 г.]. Доступно по ссылке: https://www.alz.co.uk/research/statistics
- 2. Деменция Австралия (2018). Данные о распространенности деменции за 2018–2058 гг., Исследование проводилось по заказу Национального центра социального и экономического моделирования (NATSEM) Университета Канберры. 2018 [цитировано 25 октября 2019 г.]. Доступно по адресу: https://www.dementia.org.au/files/documents/2018-2058%20Prevalence%20CED_AUSTRALIA_alpha.pdf
- 3. Министерство здравоохранения, Национальная рамочная программа действий по борьбе с деменцией на 2015–2019 гг. 2019 15 февраля [цитируется 25 октября 2019]. Доступно по адресу: https://agedcare.health.gov.au/sites/default/files/documents/09_2015/national-framework-for-action-on-dementia-2015-2019.pdf
- 4. МКБ-10, Органические, включая симптоматические, психические расстройства (F00-F09). 2016 г. [цитировано 25 октября 2019 г.] Доступно по адресу: https://icd.who.int/browse10/2016/en#/F00-F09
- 5. Австралийский институт здравоохранения и социального обеспечения, 2012 г.Деменция в Австралии. Кот. нет. ВОЗРАСТ 70. Канберра: AIHW. 2012 [цитировано 25 октября 2019 г.]. Доступно по ссылке: https://www.aihw.gov.au/getmedia/13995.pdf.aspx
- 6. Национальный центр социально-экономического моделирования NATSEM (2016) Экономические издержки деменции в Австралии, 2016–2056 гг. 2017 фев. [Цитировано 25 октября 2019 г.]. Доступно по адресу: http://www.dementia.org.au/files/NATIONAL/documents/The-economic-cost-of-dementia-in-Australia-2016-to-2056.pdf
- 7. Австралийское статистическое бюро (2019).Причины смерти, Австралия, 2018. Кат. нет. 3303,0. Канберра. 2019 25 сентября [цитируется 25 октября 2019 года]. Доступно по адресу: http://www.abs.gov.au/ausstats/[email protected]/mf/3303.0
- 8. Brodaty H, Seeher K, Gibson L. Dementia time to death: систематический обзор литературы о времени выживания и потерянных годах жизни у людей с деменцией. Int Psychogeriatr. 2012; 24 (7): 1034–45.
- 9. Staekenborga SS, Pijnenburg YA, Lemstra AW, Scheltensa P, Vd Flier WM. Деменция и быстрая смертность: кто в опасности? J. Alzheimers Dis.2016; 53 (1): 135–42. pmid: 27104894
- 10. Байнум Дж. П., Рабинс П. В., Веллер В., Нифельд М., Андерсон Г. Ф., Ву А. В.. Взаимосвязь между диагнозом деменции, хроническим заболеванием, расходами на медицинское обслуживание и обращением в больницу. J Am Geriatr Soc. 2004. 52 (2): 187–94. pmid: 14728626
- 11. Банн Ф., Берн А.М., Гудман С., Райт Г., Нортон С., Робинсон Л. и др. Коморбидность и деменция: обзор литературы. BMC Med. 2014; 12: 192.
- 12. Тиммонс С., Мэннинг Е., Барретт А., Брэди Н.М., Браун В., О’Ши Е. и др.Деменция у пожилых людей, госпитализированных в больницу: региональное многобольничное обсервационное исследование распространенности, ассоциаций и распознавания случаев. Возраст Старение. 2015; 44 (6): 993–9. pmid: 26420638
- 13. Ассоциация Альцгеймера (2011). Факты и цифры о болезни Альцгеймера. Альцгеймера и слабоумие, 7 (2), 208–244. 2011. [Цитировано 25 октября 2019 г.]. Доступно по адресу: http://www.sciencedirect.com/science/journal/15525260/7/2.
- 14. Хилл Дж., Филлит Х., Шах С.Н., дель Валле М.С., Футтерман Р.Модели использования здравоохранения и затраты на сосудистую деменцию среди населения, проживающего в сообществах. J. Alzheimers Dis. 2005. 8 (1): 43–50. pmid: 16155348
- 15. Чжао Ю., Куо Т.С., Вейр С., Крамер М.С., Эш А.С. Затраты на здравоохранение и его использование для участников программы Medicare с болезнью Альцгеймера. BMC Health Serv Res. 2008; 8: 108. pmid: 18498638
- 16. Фелан Э.А., Борсон С., Гротхаус Л., Балч С., Ларсон Е.Б. Связь инцидентного слабоумия с госпитализацией. ДЖАМА. 2012. 307 (2): 165–72.pmid: 22235087
- 17. Sampson EL, Blanchard MR, Jones L, Tookman A, King M. Деменция в больнице неотложной помощи: проспективное когортное исследование распространенности и смертности. Br J Psychiatry. 2009. 195 (1): 61–6. pmid: 19567898
- 18. Австралийская комиссия по безопасности и качеству здравоохранения (2013 г.). Доказательства проблем безопасности и качества, связанных с уходом за пациентами с когнитивными нарушениями в условиях неотложной помощи: быстрый обзор. ACSQHC Сидней. 2013. [Цитировано 30 октября 2019 г.].Доступно по адресу: http://www.safetyandquality.gov.au
- 19. Коннолли С., О’Ши Э. Влияние деменции на продолжительность пребывания в больницах неотложной помощи в Ирландии. Деменция (Лондон). 2015; 14 (5): 650–8.
- 20. Фогг С., Гриффитс П., Мередит П., Бриджес Дж. Исходы больниц для пожилых людей с когнитивными нарушениями: интегративный обзор. Int J Geriatr Psychiatry. 2018; 33 (9): 1177–97.
- 21. Рейниш Е.Л., Хапка С.М., Де Соуза Н., Цворо В., Доннан П.Т., Гатри Б.Эпидемиология и исходы людей с деменцией, делирием и неуточненными когнитивными нарушениями в больнице общего профиля: проспективное когортное исследование с участием 10 014 госпитализаций. BMC Med. 2017; 15 (1): 140. pmid: 28747225
- 22. Sheehan B, Lall R, Gage H, Holland C, Katz J, Mitchell K. 12-месячное последующее исследование людей с деменцией, направленных в психиатрические службы общего профиля. Возраст Старение. 2013. 42 (6): 786–90. pmid: 24166239
- 23. Гихарро Р., Сан-Роман К.М., Гомес-Уэльгас Р., Вильялобос А., Мартин М., Гиль М. и др.Влияние деменции на госпитализацию. Нейроэпидемиология. 2010. 35 (2): 101–8. pmid: 20551696
- 24. Кинг Б., Джонс С., Брэнд С. Взаимосвязь между деменцией и продолжительностью пребывания общих медицинских пациентов, поступивших в отделение неотложной помощи. Австралас Дж. Старение. 2006. 25 (1): 20–3.
- 25. Фонг Т.Г., Джонс Р.Н., Маркантонио Э.Р., Томмет Д., Гросс А.Л., Хабтемариам Д. и др. Неблагоприятные исходы после госпитализации и делирий у лиц с болезнью Альцгеймера. Ann Intern Med. 2012. 156 (12): 848–56.pmid: 22711077
- 26. Мукадам Н, Сампсон ЭЛ. Систематический обзор распространенности, ассоциаций и исходов деменции у пожилых стационарных пациентов больниц общего профиля. Int Psychogeriatr. 2011. 23 (3): 344–55. pmid: 20716393
- 27. Макдермотт С., Йейтс М., Теобальд М., Морвелл М., Мохебби М., Вест Э. и др. Национальное развертывание и оценка программы лечения деменции в больницах (DCHP), Балларат: Виктория (Подготовлено для Министерства здравоохранения). 2017 [цитируется 27 октября 2019 г.].Доступно по адресу: http://www.healthroundtable.org/Portals/0/PublicLibrary/2017/FinalReport_DCHP_Evaluation2015_2017.pdf
- 28. Бриггс Р., Коари Р., Коллинз Р., Кофлан Т., О’Нил Д., Кеннелли С.П. Неотложная больничная помощь: насколько активна помощь пациентам с деменцией? QJM: Int J Med. 2016; 109 (1): 41–4.
- 29. Зекри Д., Херрманн Ф. Р., Гранджан Р., Витале А. М., Де Пиньо М. Ф., Мишель Дж. П. и др. Предсказывает ли деменция неблагоприятный исход госпитализации? Проспективное исследование у пожилых стационарных пациентов.Int J Geriatr Psychiatry. 2009. 24 (3): 283–91. pmid: 18727147
- 30. Королевский колледж психиатров. Кого это волнует, победит, 2006. [Цитировано 15 ноября 2019 г.]. Доступно по адресу: http://www.yumpu.com/en/document/view/4279828/who-cares-wins-royal-college-of-psychiatrists
- 31. Мукаетова-Ладинская Е.Б., Теодорчук А., Цережейра Ж.М. Деменция в больнице неотложной помощи. Брит Дж. Психиатр. 2009. 195 (5): 461–2. pmid: 19880940
- 32. Тиммонс С., Барретт А., Браун В., Мэннинг Э., Кэхилл С., О’Салливан К. и др.Многобольничное исследование деменции у пожилых людей, госпитализированных в больницы неотложной помощи: распространенность, связи и долгосрочные исходы (Cork Dementia Study). Ir Aging Stud Rev.2015; 6 (1): 105.
- 33. Clague F, Mercer SW, McLean G, Reynish E, Gurthrie B. Коморбидность и полипрагмазия у людей с деменцией: выводы из большого популяционного поперечного анализа данных первичной медико-санитарной помощи. Возраст Старение. 2017; 46 (1): 33–9. pmid: 28181629
- 34. Peron EP, Slattum PW, Powers KE и др.Фармакотерапия: патофизиологический подход. В: DiPiro JT, Talbert RL, Yee GC и др., Редакторы. Болезнь Альцгеймера. Нью-Йорк (NY): McGraw-Hill Education; 2017. 10д.
- 35. Мюллер С., Молохия М., Перера Дж., Веронезе Н., Стаббс Б., Шетти Н. и др. Полифармация у людей с деменцией: ассоциации с неблагоприятными последствиями для здоровья. Exp Gerontol. 2018; 106: 240–5. pmid: 29452289
- 36. Hoffmann F, van den Bussche H, Wiese B, Schön G, Koller D, Eisele M и др. Влияние гериатрической коморбидности и полипрагмазии на назначение ингибиторов холинэстеразы при деменции.BMC Psychiatry. 2011; 11: 190. pmid: 22145796
- 37. Leelakanok N, D’Cunha RR. Связь между полипрагмазией и деменцией — систематический обзор и метаанализ. Старение психического здоровья. 2019; 23 (8): 932–41. pmid: 29746153
- 38. Андерсен Ф., Виитанен М., Халворсен Д.С., Страуме Б., Энгстад ТА. Сопутствующие заболевания и медикаментозное лечение болезни Альцгеймера. Поперечное исследование участников исследования деменции в северной Норвегии. BMC Geriatr. 2011; 11 (1): 58.
- 39.Lau DT, Mercaldo ND, Harris AT, Trittschuh E, Shega J, Weintraub S. Полифармация и потенциально несоответствующее использование лекарств пожилыми людьми с деменцией, проживающими в общинах. Alzheimer Dis Assoc Disord. 2010. 24 (1): 56–63. pmid: 19561441
- 40. Lalic S, Sluggett JK, Ilomaki J, Wimmer BC, Tan EC, Robson L, et al. Полифармация и сложность режима лечения как факторы риска госпитализации среди пациентов учреждений длительного ухода: проспективное когортное исследование.J Am Med Dir Assoc. 2016; 17 (11): 1067.e1–6.
- 41. Пфистер Б., Йонссон Дж., Густафссон М. Проблемы, связанные с наркотиками, и обзоры лекарств среди пожилых людей с демнцией. BMC Pharmacol Toxicol. 2017; 18 (1): 52. pmid: 28655357
- 42. Хукинс Д., Маклеод Ю., Боланд Дж. У. Выявление потенциально несоответствующих назначений пожилым людям с деменцией: систематический обзор. Eur J Clin Pharmacol. 2019; 75 (4): 467–81. pmid: 30610274
- 43. Эшети Т.К., Нгуен Т.А., Гиллам М.Х., Калиш Эллетт Л.М.Повествовательный обзор проблем с использованием лекарств у людей с деменцией. Экспертное мнение Drug Saf. 2018; 17 (8): 825–36. pmid: 29993294
- 44. Густафссон М., Шоландер М., Пфистер Б., Йонссон Дж., Шнеде Дж., Ловхейм Х. Госпитализация в связи с наркотиками среди пожилых людей с деменцией. Eur J Clin Pharmacol. 2016; 72 (9): 1143–53. pmid: 27377393
- 45. Wucherer D, Thyrian JR, Eichler T., Hertel J, Kilimann I, Richter S и др. Проблемы, связанные с наркотиками, у пациентов первичной медико-санитарной помощи, проживающих в общинах, оказались положительными на деменцию.Int Psychogeriatr. 2017; 29 (11): 1857–68. pmid: 28780910
- 46. Рив Э., Тренаман С.К., Роквуд К., Хилмер С.Н. Фармакокинетические и фармакодинамические изменения у пожилых людей с деменцией. Мнение эксперта Drug Metab Toxicol. 2017; 13 (6): 651–68. pmid: 28460576
- 47. Мангони А.А., Джексон Ш. Возрастные изменения фармакокинетики и фармакодинамики: основные принципы и практическое применение. Br J Clin Pharmacol. 2004. 57 (1): 6–14. pmid: 14678335
- 48.Николасцо Дж. А., Мехта, округ Колумбия. Транспортировка лекарств через гематоэнцефалический барьер при болезни Альцгеймера. Ther Deliv. 2010. 1 (4): 595–611. pmid: 22833970
- 49. Ши С., Морике К., Клотц У. Клинические последствия старения для рациональной лекарственной терапии. Eur J Clin Pharmacol. 2008. 64 (2): 183–99. pmid: 18180915
- 50. Пейн Р.А., Абель Г.А., Эйвери А.Дж., Мерсер С.В., Роланд Миссури. Всегда ли полипрагмазия опасна? Ретроспективный когортный анализ с использованием связанных электронных медицинских карт первичной и вторичной медико-санитарной помощи.Br J Clin Pharmacol. 2014; 77 (6): 1073–82. pmid: 24428591
- 51. Лай SW, Liao KF, Liao CC, Muo CH, Liu CS, Sung FC. Полифармация коррелирует с повышенным риском перелома шейки бедра у пожилых людей: популяционное исследование. Медицина (Балтимор). 2010. 89 (5): 295–9.
- 52. Ричардсон К., Анану А., Лафортюн Л., Брейн С., Мэтьюз Ф. Э. Изменения во времени в связи между полипрагмазией и смертностью у пожилого населения. Наркотики старения. 2011. 28 (7): 547–60.pmid: 21721599
- 53. Ричардсон К., Беннет К., Кенни Р.А. Полифармация, включая прием лекарств, повышающих риск падений, и последующие падения у людей среднего и пожилого возраста, проживающих в общественных местах. Возраст Старение. 2015; 44 (1): 90–6. pmid: 25313240
- 54. Кейбл А., Фуллертон А., Фрейзер С., Палацци К., Халлик С., Олдмидоу С. и др. Сравнение потенциально неподходящих лекарств для людей с деменцией при поступлении и выписке при незапланированной госпитализации: результаты исследования деменции SMS.Здравоохранение (Базель). 2019; 7 (1) .pii: E8.
- 55. Молист-Брюнет Н., Севилья-Санчес Д., Амблас-Новеллас Дж., Кодина-Джейн С., Гомес-Батист X, Маклнтош Дж. И др. (2014) Оптимизация лекарственной терапии у пациентов с запущенной деменцией: подход, ориентированный на пациента. Eur Geriatr Med. 2014; 5 (1): 66–71.
- 56. фон Рентельн-Крузе В., Нойманн Л., Клугманн Б., Либетрау А., Гольгерт С., Дапп У. и др. Гериатрические пациенты с когнитивными нарушениями: характеристика пациентов и результаты лечения в специализированном отделении.Dtsch Arztebl Int. 2015; 112 (7): 103–12. pmid: 25780869
- 57. Wawruch M, Fialova D, Zikavska M, Wsolová L, Jezova D, Kuzelova M, et al. Факторы, влияющие на использование потенциально неподходящих лекарств пожилыми пациентами в Словакии. J Clin Pharm Ther. 2008; 33 (4): 381–92. pmid: 18613856
- 58. Redston MR, Hilmer SN, McLachlan AJ, Clough AJ, Gnjidic D. Распространенность потенциально несоответствующего использования лекарств у пожилых пациентов с когнитивными нарушениями и без них: систематический обзор.J. Alzheimers Dis. 2018; 61 (4): 1639–52. pmid: 29278890
- 59. Гутьеррес-Валенсия М., Искьердо М., Малафарина В., Алонсо-Ренедо Дж., Гонсалес-Глария Б., Ларрайос-Сола Б. и др. Влияние госпитализации в отделение неотложной медицинской помощи на полипрагмазию и потенциально несоответствующие рецепты: ретроспективное исследование. Гериатр Геронтол Инт. 2017; 17 (12): 2354–60. pmid: 28422415
- 60. Sönnerstam E, Sjölander M, Lövheim H, Gustafsson M. Клинически значимые лекарственные взаимодействия среди пожилых людей с деменцией.Eur J Clin Pharmacol. 2018; 74 (10): 1351–60. pmid: 29967921
- 61. Грей Л., Вуттон Р. Комплексная гериатрическая оценка «онлайн». Australas J Aging 2008; 27 (4): 205–8. pmid: 1 23
- 62. Gray LC, Bernabei R, Berg K, Finne-Soveri H, Fries BE, Hirdes JP, et al. Стандартизация оценки пожилых людей в отделениях неотложной помощи: инструмент interRAI Acute Care. J Am Geriatr Soc. 2008. 56 (3): 536–41. pmid: 18179498
- 63. Gray L, Ariño-Blasco S, Berg K, Bernabei R, Carpenter I, Finne-Soveri H et al.Форма оценки и руководство пользователя interRAI Acute Care (AC). Вашингтон, округ Колумбия: InterRAI; 2010.
- 64. Travers C, Byrne GJ, Pachana NA, Klein K, Gray L. Валидация шкалы когнитивных способностей interRAI в сравнении с независимым клиническим диагнозом и краткой оценкой психического состояния у госпитализированных пациентов пожилого возраста. J Nutr Здоровье Старения. 2013. 17 (5): 435–9. pmid: 23636544
- 65. Gray LC, Berg K, Fries BE, Henrard JC, Hirdes JP, Steel K и др. Обмен клинической информацией в разных учреждениях по уходу: рождение интегрированной системы оценки.BMC Health Serv Res. 2009; 9: 71. pmid: 19402891
- 66. Лакхан П., Джонс М., Уилсон А., Кортни М., Хирдес Дж., Грей Л.С. Проспективное когортное исследование гериатрических синдромов среди пожилых пациентов, госпитализированных в больницы неотложной помощи. J Am Geriatr Soc. 2011. 59 (11): 2001–8. pmid: 22092231
- 67. Сотрудничающий центр ВОЗ по методологии статистики лекарственных средств. Руководство по классификации УВД и присвоению DDD. Осло. 2019 [Цитировано 15 ноября 2019 г.]. Доступно по адресу: http: // www.whocc.no/filearchive/publications/2019_guidelines_web.pdf.
- 68. Европейский фонд Pharmaceutical Care Network. Классификация PCNE V 9.0 — Классификация проблем, связанных с наркотиками. 2019 [Цитировано 15 ноября 2019 г.]. Доступно по адресу: http://www.pcne.org/upload/files/_PCNE_classification_V9-0.pdf.
- 69. Gnjidic D, Hilmer SN, Blyth FM, Naganathan V, Waite L, Seibel MJ, et al. Прекращение действия полипрагмазии и исходы: для выявления пожилых мужчин, проживающих в общинах, с риском различных неблагоприятных исходов использовалось пять или более лекарств.J Clin Epidemiol. 2012. 65 (9): 989–95. pmid: 22742913
- 70. Пиво MH. Явные критерии определения потенциально несоответствующего использования лекарств пожилыми людьми. Обновление. Arch Intern Med. 1997. 157 (14): 1531–6. pmid: 9236554
- 71. Составлено группой экспертов по обновлению критериев пива Американского гериатрического общества 2019 года. Американское гериатрическое общество 2019 обновило критерии AGS Beers для потенциально несоответствующего использования лекарств у пожилых людей. J Am Geriatr Soc. 2019; 67 (4): 674–94.pmid: 30693946
- 72. Триплитт С. Лекарственное взаимодействие лекарств, обычно используемых при диабете. Сахарный диабет. 2006. 19 (4): 202–11.
- 73. Micromedex® HealthCare Series (Интернет-база данных) Версия 2.0. Гринвуд-Виллидж, Колорадо: Thomson Healthcare Inc., 2013 [цитировано 5 ноября 2019 г.]. Доступно по адресу: http://www.micromedexsolutions.com.
- 74. Bickel H, Hendlmeier I, Hessler JB, Junge MN, Leonhardt-Achilles S, Weber J, et al. Распространенность деменции и когнитивных нарушений в больницах.Dtsch Arztebl Int. 2018; 115 (44): 733–40. pmid: 30565543
- 75. Travers C, Byrne G, Pachana N, Klein K, Gray L. Проспективное обсервационное исследование деменции и делирия в условиях интенсивной больницы. Intern Med J. 2013; 43 (3): 262–9. pmid: 22998322
- 76. Тут С., Дивайн М., Акпоробаро А., Оррелл М. Причины госпитализации людей с деменцией: систематический обзор и метаанализ. J Am Med Dir Assoc. 2013. 14 (7): 463–70. pmid: 23510826
- 77.Андрие С., Рейниш Э., Нурхашеми Ф., Шекспир А., Мулиас С., Уссет П. Дж. И др. Факторы прогнозирования острой госпитализации у 134 пациентов с болезнью Альцгеймера: проспективное исследование в течение одного года. Int J Geriatr Psychiatry. 2002. 17 (5): 422–6. pmid: 11994930
- 78. Брэдшоу Л. Е., Голдберг С. Е., Шнайдер Дж. М., Харвуд Р. Х. Лица, осуществляющие уход за пожилыми людьми с сопутствующими когнитивными нарушениями в больнице общего профиля: характеристики и психологическое благополучие. Int J Geriatr Psychiatry.2013. 28 (7): 681–90. pmid: 22887452
- 79. Куррле С., Бродати Х., Хогарт Р. Физические сопутствующие заболевания деменции. 1-е изд. Кембридж, Великобритания: Издательство Кембриджского университета; 2012.
- 80. Дрейпер Б., Кармел Р., Гибсон Д., Пеут А., Андерсон П. Проект больничных служб деменции: возрастные различия в сроках пребывания в больницах для пожилых людей с деменцией и без нее. Int Psychogeriatr. 2011. 23 (10): 1649–58. pmid: 21 1
- 81. Австралийский институт здравоохранения и социального обеспечения (2019 г.).Больничная помощь людям с деменцией, 2016–17. Кот. нет. ВОЗРАСТ 94. Канберра: AIHW. 2019 [Цитировано 15 ноября 2019 г.]. Доступно по адресу: http://www.aihw.gov.au/getmedia/aihw-age-94.pdf.aspx
- 82. Картер М.В., Порелл Ф.В. Уязвимые группы населения, которым грозит потенциально предотвратимая госпитализация: случай жителей домов престарелых с болезнью Альцгеймера. Am J Alzheimers Dis Other Demen. 2005; 20 (6): 349–58. pmid: 16396440
- 83. Беверидж Л.А., Дэйви П.Г., Филипс Дж., Макмердо МЕТ.Оптимальное лечение инфекций мочевыводящих путей у пожилых людей. Clin Interv Aging. 2011; 6: 173–80. pmid: 21753872
- 84. Мэлоун Д.К., Маклафлин Т.П., Уол П.М., Лейбман С., Арриги Х.М., Чираки М.Дж. и др. Бремя болезни Альцгеймера и связь с негативными последствиями для здоровья. Am J Manag Care. 2009. 15 (8): 481–8. pmid: 19670951
- 85. Чанг Дж. Т., Мортон С. К., Рубинштейн Л. З., Мохика В. А., Маглион М., Сутторп М. Дж. И др. Вмешательства для предотвращения падений у пожилых людей: систематический обзор и метаанализ рандомизированных клинических исследований.BMJ. 2004; 328 (7441): 680. pmid: 15031239
- 86. Департамент здравоохранения и старения 2003a. Излишняя госпитализация пожилых людей, которой можно избежать. Канберра: Австралийское Содружество. 2006 [Цитировано 15 ноября 2019 г.]. Доступно по адресу: http://www.aihw.gov.au/getmedia/14347_20130321.pdf.aspx
- 87. Шарма С., Мюллер С., Стюарт Р., Веронезе Н., Ванкампфорт Д., Коянаги А. и др. Предикторы падений и переломов, ведущих к госпитализации у людей с деменцией: репрезентативное когортное исследование.J Am Med Dir Assoc. 2018; 19 (7): 607–12. pmid: 29752159
- 88. Скраттон Дж., Бранкати К.Ю. Деменция и сопутствующие заболевания. Обеспечение паритета заботы. Лондон, Великобритания: ILC; 2016.
- 89. Бейл К., Берри Х., Грилиш Л., Дрейпер Б., Кармель Р., Гибсон Д. и др. Потенциально предотвратимые осложнения инфекций мочевыводящих путей, зон давления, пневмонии и делирия у госпитализированных пациентов с деменцией: ретроспективное когортное исследование. BMJ Open. 2013; 3: e002770. pmid: 23794540
- 90.Сакакибара Р., Паникер Дж., Фаулер С.Дж., Татено Ф., Киши М., Цуюзаки Ю. и др. Недержание мочи: недержание мочи у пожилых людей из-за ишемических изменений белого вещества. Neurol Int. 2012; 4 (2): e13. pmid: 23139851
- 91. Томази Р., Сильвейра ЛВА, Боас PJFV, Хасинто А.Ф. Частота деменции среди пожилых людей, госпитализированных в гериатрический стационар государственной больницы Бразилии. Dement Neuropsychol. 2018; 12 (1): 35–9. pmid: 29682231
- 92. Mecocci P, von Strauss E, Cherubini A, Ercolani S, Mariani E, Senin U, et al.Когнитивные нарушения являются основным фактором риска развития гериатрических синдромов во время госпитализации: результаты исследования GIFA. Демент Гериатр Cogn Disord. 2005; 20 (4): 262-9. pmid: 16103670
- 93. Куррле С., Бродати Х., Хогарт Р., Гупта А. Физические сопутствующие заболевания деменции. Здравоохранение. Местный медицинский округ Северного Сиднея. 2018 [Цитировано 15 ноября 2019 г.]. Доступно по адресу: www.nslhd.health.nsw.gov.au.
- 94. Синнидж Дж., Браспеннинг Дж., Шеллевис Ф., Штирбу-Вагнер И., Вестерт Дж., Кореваар Дж.Распространенность кластеров заболеваний у пожилых людей с множественными хроническими заболеваниями — систематический обзор литературы. PLoS One. 2013; 8 (11): e79641. pmid: 24244534
- 95. Нагаи М., Хошид С., Карио К. Гипертония и деменция. Am J Hypertens. 2010. 23 (2): 116–24. pmid: 19927134
- 96. Джастин Б.Н., Турек М., Хаким А.М. Болезни сердца как фактор риска деменции. Clin Epidemiol. 2013; 5: 135–45. pmid: 23658499
- 97. Tate JA, Snitz BE, Alvarez KA, Nahin RL, Weissfeld LA, Lopez O, et al.Госпитализация в связи с инфекцией увеличивает риск деменции у пожилых людей. Crit Care Med, 2014; 42 (5): 1037–46. pmid: 24368344
- 98. Лай С.В., Линь СН, Ляо К.Ф., Су LT, Сун ФК, Лин СС. Связь между полипрагмазией и деменцией у пожилых людей: популяционное исследование случай-контроль на Тайване. Гериатр Геронтол Инт. 2012; 12 (3): 491–8. pmid: 22233227
- 99. Лю Э., Дайер С.М., О’Доннелл Л.К., Милте Р., Брэдли С., Харрисон С.Л. и др. Связь препаратов сердечно-сосудистой системы с когнитивной функцией и деменцией у пожилых людей, живущих в домах престарелых в Австралии.J Geriatr cardiol. 2017; 14 (6): 407–15. pmid: 248
- 100. Бриггс Р., Дайер А., Набил С., Коллинз Р., Доэрти Дж., Кофлан Т. и др. Деменция в больнице неотложной помощи: распространенность и клинические исходы у остро нездоровых пациентов с деменцией. QJM: Int J Med. 2017; 110 (1): 33–7.
- 101. Остерхус Р., Арсланд Д., Соеннесин Н., Ронгве А., Сельбек Г., Кьосавик С. Р.. Потенциально несоответствующие лекарства и лекарственные взаимодействия у проживающих в домашних условиях людей с легкой формой деменции.Int J Getriatr Psychiatry. 2017; 32 (2): 183–92.
- 102. Ferreira F, Diniz JSV, Medeiros-Souza P, Freitas MPD, Camargos EF, Kusano LTE и др. Возможные лекарственные взаимодействия высокого риска среди амбулаторных пациентов пожилого возраста с деменцией: кросс-секционное исследование. Гериатр Геронтол Старение. 2015; 9 (1): 21–5.
- 103. Wastesson JW, Morin L, Tan ECK, Johnell K. Обновленная информация о клинических последствиях полипрагмазии у пожилых людей: повествовательный обзор. Мнение экспертов о наркотиках.2018; 17 (12): 1185–96. pmid: 30540223
- 104. Парк Х.Й., Парк Дж. У., Сон Х. Дж., Сон Х. С., Квон Дж. У. Связь между полипрагмазией и деменцией: вложенное исследование случай-контроль, основанное на 12-летней базе данных продольных когорт в Южной Корее. PLoS One. 2017; 12 (1): e0169463. pmid: 28056068
- 105. Джонелл К. Несоответствующее употребление наркотиков людьми с когнитивными нарушениями и деменцией: систематический обзор. Curr Clin Pharmacol. 2015; 10 (3): 178–84. pmid: 26054404
- 106.Sönnerstam E, Sjölander M, Gustafsson M. Оценка распространенности потенциально несоответствующих лекарств у пожилых людей с когнитивными нарушениями, проживающих в Северной Швеции, с использованием списка EU (7) -PIM. Eur J Clin Pharmacol. 2017; 73 (6): 735–42. pmid: 28246889
- 107. Галлахер П., Райан С., Бирн С., Кеннеди Дж., О’Махони Д. STOPP (средство проверки рецептов пожилых людей) и START (средство проверки, предупреждающее врачей о правильном лечении). Подтверждение консенсуса.Int J Clin Pharmacol Ther. 2008. 46 (2): 72–83. pmid: 18218287
- 108. Holt S, Schmiedl S, Thürmann PA. Потенциально неподходящие лекарства для пожилых людей: список PRISCUS. Dtsch Arztebl Int. 2010. 107 (31–32): 543–51. pmid: 20827352
- 109. Ларош М.Л., Шармес Дж. П., Мерль Л. Потенциально неподходящие лекарства для пожилых людей: список французских консенсусных панелей. Eur J Clin Pharmacol. 2007. 63 (8): 725–31. pmid: 17554532
- 110. Густафссон М., Карлссон С., Ловхейм Х.Неправильное длительное использование антипсихотических препаратов распространено среди людей с деменцией, проживающих в специализированных медицинских учреждениях. BMC Pharmacol Toxicol. 2013; 14: 10. pmid: 23391323
- 111. Пак Х., Сато Х., Мики А., Урушихара Х., Савада Ю. Лекарства, связанные с падениями у пожилых людей: систематический обзор публикаций за последние 5 лет. Eur J Clin Pharmacol. 2015; 71 (12): 1429–40. pmid: 26407688
- 112. Белл Дж. С., Мезрани С., Блэкер Н., Леблан Т., Фрэнк О., Олдерман С. П. и др.Рекомендации по назначению антихолинергических и седативных препаратов людям с деменцией. Врач Ост Фам. 2012; 41 (1–2): 45–9. pmid: 22276284
- 113. Гатри Б., Кларк С.А., МакКоуэн С. Бремя назначения психотропных препаратов людям с деменцией: исследование базы данных населения. Возраст Старение. 2010. 39 (5): 637–42. pmid: 20625185
- 114. Эшети Т.К., Нгуен Т.А., Гиллам М.Х., Калиш Эллетт Л.М. Потенциально несоответствующее назначение людям с деменцией: исследование на основе населения Австралии.Int J Geriatr Psychiatry. 2019; 34 (10): 1498–1505. pmid: 31173395
- 115. Маркота М, Рамманс Т.А., Боствик Дж. М., Лапид Мичиган. Использование бензодиазепинов у пожилых людей: опасности, лечение и альтернативные методы лечения. Mayo Clin Proc. 2016; 91 (11): 1632-39. pmid: 27814838
- 116. Pariente A, de Gage SB, Moore N, Bégaud B. Связь с бензодиазепиновыми расстройствами и деменцией: текущее состояние знаний. Препараты ЦНС. 2016; 30 (1): 1–7. pmid: 26715389
- 117. Дуглас Эй Джей, Смит Л.Воздействие нейролептиков и риск инсульта: самостоятельное исследование серии случаев. BMJ. 2008; 337: а1227. pmid: 18755769
- 118. Лю ME, Цай SJ, Чанг WC, Hsu CH, Lu T, Hung KS и др. Пятилетнее популяционное исследование деменции и риска инсульта на Тайване. PLoS One. 2013; 8 (4): e61771. pmid: 23626726
- 119. Pariente A, Fourrier-Reglat A, Ducruet T., Farrington P, Beland SG, Dartigues JF, et al. Антипсихотические препараты и инфаркт миокарда у пожилых пациентов с пролеченной деменцией.Arch Intern Med. 2012. 172 (8): 648–53. pmid: 22450214
- 120. Ральф SJ, Espinet AJ. Повышение общей смертности от приема антипсихотических препаратов: обновленный обзор и метаанализ по деменции и общей психиатрической помощи. Журнал Alzheimers Dis Rep. 2018; 2 (1): 1-26. pmid: 30480245
- 121. Ю. Н., Чен П. Дж., Цай Х. Дж., Хуанг С. В., Чиу Ю. В., Цай В. И.. Связь употребления бензодиазепинов и Z-наркотиков с риском госпитализации из-за травм, связанных с падением, среди пожилых людей: общенациональное вложенное исследование «случай-контроль» на Тайване.BMC Geriatr. 2017; 17 (1): 140. pmid: 28693443
- 122. Общество Альцгеймера. Оптимизация лечения и ухода за людьми с поведенческими и психологическими симптомами деменции. 2011 [Цитировано 15 ноября 2019 г.]. Доступно по адресу: http://www.alzheimers.org.uk/site/scripts/download_info
- 123. Азермай М., Петрович М., Эльзевирс М.М., Буржуа Дж., Ван Бортел Л.М., Вандер Стихеле Р.Х. Систематическая оценка руководящих принципов деменции по управлению поведенческими и психологическими симптомами.Aging Res Rev.2012; 11 (1): 78–86. pmid: 21856452
- 124. Гатри Б., МакКоуэн С., Дэйви П., Симпсон С.Р., Драйшульте Т., Барнетт К. Назначение препаратов с высоким риском для пациентов первичной медико-санитарной помощи, особенно уязвимых к побочным эффектам лекарств: анализ поперечной базы данных населения в общей врачебной практике Шотландии. BMJ. 2011; 342: d3514. pmid: 21693525
- 125. Cross AJ, George J, Woodward MC, Ames D, Brodaty H, Ilomaki J и др. Потенциально несоответствующие лекарства и антихолинергическая нагрузка у пожилых людей, посещающих клиники памяти в Австралии.Наркотики старения. 2016; 33 (1): 37–44. pmid: 26645294
- 126. Montastruc F, Gardette V, Cantet C, Piau A, Lapeyre-Mestre M, Vellas B и др. Потенциально несоответствующее использование лекарств среди пациентов с болезнью Альцгеймера в когорте REAL.FR: помните об атропиновых и бензодиазепиновых препаратах !. Eur J Clin Pharmacol. 2013; 69 (8): 1589–97. pmid: 23588564
- 127. Кояма А., Штейнман М., Энсруд К., Хиллиер Т.А., Яффе К. Десятилетняя траектория потенциально несоответствующих лекарств у очень старых женщин: важность когнитивного статуса.J Am Geriatr Soc. 2013. 61 (2): 258–63. pmid: 23320787
- 128. Богетти-Салазар М., Гонсалес-Гонсалес С., Хуарес-Седильо Т., Санчес-Гарсия С., Росас-Карраско О. Тяжелые потенциальные лекарственные взаимодействия у пожилых людей с деменцией и связанными факторами. Клиники (Сан-Паулу). 2016; 71 (1): 17–21.
- 129. Gustafsson M, Sjölander M, Pfister B, Schneede J, Lövheim H. Влияние вмешательств фармацевтов на несоответствующее употребление наркотиков и повторную госпитализацию, связанную с наркотиками, у людей с деменцией — вторичный анализ рандомизированного контролируемого исследования.Аптека (Базель). 2018; 6 (1) .pii: E7.
- 130. Паскуалетти Г., Тоньини С., Калсоларо В., Полини А., Монзани Ф. Возможные лекарственные взаимодействия у пациентов с болезнью Альцгеймера с поведенческими симптомами. Clin Interv Aging. 2015; 10: 1457–66. pmid: 26392756
- 131. Серитан АЛ. Предотвратить лекарственные взаимодействия с ингибиторами холинэстеразы. Curr Psychiatry. 2008. 7 (2): 57–66.
- 132. Январь СТ, Ванн Л.С., Калкинс Х., Чен Л.Й., Сигарроа Дж. Э., Кливленд Дж. К. мл. И др.Актуальное обновление рекомендаций AHA / ACC / HRS 2014 г. по ведению пациентов с фибрилляцией предсердий: отчет Американского колледжа кардиологов / Американской кардиологической ассоциации по клиническим практическим рекомендациям и Общества сердечного ритма. Куркуляция. 2019; 140: e125 – e151.
Некоторые лекарства усугубляют слабоумие
Лекарства: некоторые лекарства усугубляют деменцию
ВАЖНО! Эта информация предназначена для использования только в качестве общей информации в соответствии с текущей медицинской информацией и практическим опытом этого гериатра и никогда не должна использоваться отдельно, кроме медицинских рекомендаций личного врача.
Большинство лекарств, специально разработанных для лечения деменции, стремятся повысить уровень «холина», химического вещества, которое необходимо клеткам мозга для взаимодействия друг с другом. Тем не менее, некоторые распространенные лекарства являются «антихолинергическими», то есть снижают уровень холина. Таким образом, эти препараты могут усугубить деменцию, что приведет к еще большему замешательству и возбуждению. Они также могут вызвать сухость во рту, запор и затрудненное мочеиспускание.
Сюда входят:
- Бенадрил , содержится в сиропах от кашля, лекарствах от аллергии и снотворных, таких как Тайленол PM ® .Иногда при аллергической реакции может потребоваться однократная доза Бенедрила, но обычно есть более предпочтительные варианты.
- Таблетки для мочевого пузыря, такие как Толтеродин / Детрол ® , Оксибутинин / Дитропан ®
- Tropsium / Sanctura ® , действительно помогает, когда пациентам требуется частое мочеиспускание. Однако они вызывают много недоумения и волнения. Лучше принять более простые меры: прекратить употребление кофеина; отводить человека в ванную каждые два часа. Предлагайте интересные занятия.Нортриптилин (низкая доза) может быть полезным, но может вызвать меньшую сухость во рту, а при передозировке — сердечные осложнения.
- Гликопирролат / Робинул ® сушит выделения, вызывает спутанность сознания и возбуждение.
- Атропин / AtroPen ™ глазные капли следует использовать с осторожностью при деменции. Применяется в хосписе для сушки выделений; но лучше не использовать его, если человек без сознания.
- Амитриптилин , лекарство, которое использовалось в прошлом для лечения депрессии, а теперь прописано для лечения невропатии и раздраженного кишечника.Нортриптилин может использоваться для решения этих проблем с меньшими антихолинергическими побочными эффектами.
- Дифеноксилат и атропин / Ломотил ® , лекарство, прописанное от диареи, может подойти, если его использовать только один или два раза. Но при регулярном использовании его антихолинергические эффекты могут вызвать проблемы у пациентов с деменцией.
Различные стероиды — лекарства, обычно используемые для уменьшения воспалений различного типа — также могут представлять проблему для человека с деменцией:
- Преднизон ® и другие стероиды, используемые для лечения эмфиземы и других заболеваний легких, могут вызывать спутанность сознания, возбуждение (также называемое делирием в медицинских контекстах) и бессонницу.Если необходимо лечить приступ эмфиземы, их следует быстро уменьшить. В недавнем исследовании сообщается о незначительной пользе продолжения приема этого препарата более двух недель.
Дополнительная информация о лекарствах:
Некоторые лекарства усугубляют деменцию | Лечение поведенческих симптомов деменции | Рекомендации по лечению | Антипсихотические средства (нейролептики) | Антидепрессанты | Стабилизирующее настроение лекарство
Плановая низкая доза рисперидона для ажитации у пожилых пациентов
У гериатрических пациентов ажитация из-за делирия или слабоумия является частой причиной или осложнением госпитализации по медицинским показаниям.Возбуждение продлевает госпитализацию и увеличивает риск заболеваемости и смертности. Нейролептики были основой фармакологического лечения возбуждения у пожилых людей. Авторы сообщают о двух пациентах в возрасте 70 лет, которые обратились в больницу с возбуждением и замешательством, которые переросли в агрессию. После лечения низкими дозами рисперидона по расписанию их симптомы быстро исчезли с минимальными побочными эффектами. Авторы указывают, что субклинические и клинические симптомы возбуждения и спутанности сознания можно успешно и эффективно лечить низкими дозами запланированных нейролептиков, а не использовать по мере необходимости более высокие дозы, когда симптомы переросли в физическое возбуждение и агрессию.Авторы предполагают, что этот общий курс лечения снизит общие суточные дозы лекарств и, следовательно, минимизирует риск побочных эффектов и длительных госпитализаций у гериатрических пациентов.
_____________________________________________________________________________________________________
Ажитация — распространенная проблема у пожилых пациентов, госпитализированных по поводу делирия, деменции или того и другого. Это скорее симптом состояния, чем само состояние. 1 Пожилые пациенты имеют повышенный риск возбуждения в больничных условиях из-за нарушенных циклов сна и бодрствования, наличия нескольких сопутствующих заболеваний и приема нескольких лекарств. 12 Одним из наиболее важных факторов риска развития делирия является деменция. 2 Антипсихотики являются основой фармакологического лечения возбуждения у пожилых пациентов с делирием или деменцией, при этом галоперидол является наиболее изученным агентом первого поколения 3 , а рисперидон является одним из наиболее изученных агентов второго поколения. 4 Несколько исследований продемонстрировали эффективность как типичных, так и атипичных нейролептиков, включая рисперидон, в лечении возбуждения и агрессии у людей с делирием, деменцией или и тем, и другим. 4-6
_______________________________________________________________________________________________________________________________________________
Сопутствующие материалы
Влияние персонализированного музыкального плейлиста на пациента с деменцией и вечерним возбуждением
Лечение боли для уменьшения возбуждения и агрессии у пациентов с деменцией, находящихся на длительном лечении
____________________________________________________________________________________________________________________________________________ 9000
Нейролептики обычно используются по мере необходимости для контроля сильного возбуждения у пожилых пациентов.Это часто требует приема высоких доз лекарств, что может привести к чрезмерной седации или другим побочным эффектам. Этот отчет служит для ознакомления с концепцией запланированного дозирования низких доз нейролептиков и предполагает, что такая стратегия дозирования может позволить более эффективное лечение возбужденных состояний. В идеале это позволило бы вводить меньшие общие суточные дозы нейролептиков, тем самым дополнительно минимизируя возможность побочных эффектов. Последний пункт особенно важен с учетом включения U.S. Предупреждения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в отношении антипсихотических препаратов с указанием повышенного риска смертности от сердечных заболеваний и инфекций у пожилых пациентов с деменцией, получающих эти препараты для лечения поведенческих расстройств. 7
Корпус 1
70-летний белый мужчина поступил в отделение внутренней медицины из дома престарелых из-за повышенного возбуждения и физической агрессии. Сообщалось, что у него изначально была деменция, но время и начало его симптомов были неясными, поскольку не было членов семьи, которые могли бы подробно рассказать о природе его деменции.В отчетах домов престарелых указывалось, что за несколько дней до поступления в отделение внутренней медицины пациент стал еще более возбужденным, чем обычно, и, как сообщается, замахнулся на сотрудника, что привело к его переводу в отделение неотложной помощи. Компьютерная томография (КТ) головы и рутинные лабораторные исследования, включая общий анализ крови (CBC), базовую метаболическую панель (BMP), тесты функции печени, тест на тиреотропный гормон и анализ мочи, не выявили значительных отклонений, которые могли бы учитывать изменение поведения пациента.
Во время госпитализации пациенту потребовались 4-точечные мягкие фиксаторы, потому что он пытался вытащить свои внутривенные (IV) шланги, вел физическую борьбу с медперсоналом, и его агрессию нельзя было перенаправить. Бригада первичной медико-санитарной помощи пациента пыталась использовать галоперидол и лоразепам по мере необходимости. Галоперидол в дозе 5 мг внутримышечно (в / м) успокаивал пациента, но в первую очередь успокаивал его. Лоразепам 1 мг внутримышечно также первоначально помог контролировать его возбуждение, но медсестры сообщили, что эти преимущества исчезли в течение 24-48 часов, предшествовавших первичной консультации с психиатром, которая произошла на 7-й день больницы.
При первоначальном психиатрическом обследовании пациент носил 4-точечные ограничители и чувствовал сонливость. Краткая шкала оценки психического состояния (MMSE) по Фолштейну показала 7/27. Пациент был дезориентирован во времени и месте, знал только свое имя и с трудом выполнял одношаговые команды; однако в течение 24-часового периода, предшествовавшего первичной психиатрической оценке, пациент получил две дозы лоразепама 1 мг внутримышечно и одну дозу галоперидола 5 мг внутримышечно. Основываясь на нашей оценке, мы сделали следующие рекомендации бригаде первичной медико-санитарной помощи пациента: (1) выполните базовую электрокардиограмму (ЭКГ), чтобы определить его скорректированный интервал QT (QTc), поскольку нейролептики имеют склонность к удлинению интервала QTc, особенно у пациентов. пожилые пациенты с предсуществующими факторами сердечного риска или электролитными нарушениями 7 ; (2) прекратить прием лоразепама по мере необходимости, поскольку бензодиазепины могут ухудшить поведенческое растормаживание; (3) контролировать уровень креатининфосфокиназы (КФК), поскольку пациент периодически находился в ограничениях и необнаруженный рабдомиолиз мог привести к острой почечной недостаточности; и (4) начать прием рисперидона 0 по графику.125 мг перорально три раза в день.
В первый день после начала приема рисперидона пациент получил одну дозу галоперидола 5 мг внутримышечно от физической агрессии. На второй день дозу рисперидона увеличили до 0,25 мг перорально три раза в день, чтобы свести к минимуму потребность в галоперидоле по мере необходимости. После корректировки дозы пациенту больше не требовалось лечения галоперидолом. В течение следующих нескольких дней удерживающие средства требовались реже, и в конце концов пациент освободился от удерживающих средств.Медицинское обследование бригады первичной медико-санитарной помощи не выявило четкого источника резкого изменения психического статуса, о котором сообщили в учреждении сестринского ухода. Хотя пациент оставался дезориентированным во времени и месте, его способность общаться с персоналом улучшилась. После 48-часового периода практически полного отсутствия физической агрессии и снижения возбуждения без использования ограничений, пациент был выписан обратно в учреждение сестринского ухода и принимал рисперидон 0,25 мг перорально три раза в день.
Корпус 2
75-летняя чернокожая женщина поступила в отделение внутренней медицины из внешней больницы с рефрактерной тромбоцитопенией.Во время госпитализации у нее развился тромбоз глубоких вен передних конечностей и множественные инфекции, включая инфекцию мочевыводящих путей, метициллин-резистентный дискит Staphylococcus aureus и последующую бактериемию. Было неясно, была ли у нее исходная деменция, поскольку она жила одна, и члены семьи не могли рассказать о ее недавнем психическом состоянии. В то время как раньше она была любезной и отзывчивой, через 2 недели после госпитализации она начала становиться растерянной и агрессивной.Она начала бросать предметы в персонал своей комнаты и неоднократно вытаскивала периферически введенный центральный катетер (PICC) и периферические капельницы, что потребовало использования ограничителей. Она также начала отказываться от еды и приема пероральных лекарств и не позволяла персоналу оценивать ее жизненные показатели.
Лабораторная оценка при поступлении показала BMP в пределах нормы и общий анализ крови, отмеченный повышенным количеством лейкоцитов 13,4 x 109 / л (нормальный, 4,5-11,0 x 109 / л) и пониженным количеством тромбоцитов 36 x 109 / л. (нормальный, 150-450 х 109 / л).Образец мочи, полученный через катетер, был положительным на Pseudomonas aeruginosa . Компьютерная томография и магнитно-резонансная томография головы показали остановку гидроцефалии, которая не изменилась на протяжении всей госпитализации. ЭКГ показала QTc 445 мс (удлинение у женщин> 470 мс). Бригада первичной медико-санитарной помощи назначила ей 0,5 мг рисперидона перорально каждую ночь, но это сделало ее слишком седативной. На 30-й день больницы обратились к психиатру, чтобы помочь ей справиться с возбуждением.
При первичном психиатрическом обследовании пациент лежал в постели в 4-точечных ограничителях.Ее зрительный контакт и ухоженность были плохими, она казалась вялой и страдала психомоторной отсталостью. Также наблюдались притупленный аффект и недостаток речи, пациент лишь периодически отвечал «да» или «нет». Пациент был ориентирован на правильное состояние и пребывание в стационаре, но в остальном не мог участвовать в MMSE. Основываясь на нашей оценке пациента, мы сделали следующие рекомендации бригаде первичной медико-санитарной помощи: (1) уменьшить рисперидон до 0,125 мг перорально на ночь, так как более высокая доза равна 0.5 мг были слишком успокаивающими; (2) повторить ЭКГ, чтобы оценить ее интервал QTc; и (3) контролировать КФК, поскольку пациент периодически находился в ограничениях и необнаруженный рабдомиолиз мог привести к острой почечной недостаточности.
На следующий день после первичной консультации психиатра пациентка не получала никаких доз рисперидона, поскольку продолжала отказываться от пероральных препаратов. Мы рекомендовали продолжать использовать мягкие фиксаторы по мере необходимости и установить гибкий назогастральный зонд для кормления, чтобы можно было вводить питание и пероральные препараты.Запланированный прием рисперидона был увеличен до 0,25 мг перорально два раза в день, а еще 0,25 мг перорально вводили по мере необходимости каждые 6 часов для возбуждения. Мы рекомендовали увеличенную дозу и дозирование два раза в день, потому что несоблюдение пациентом режима приема, вероятно, помешало бы ей получать все дозы более низкого, более часто запланированного режима. После первого дня приема 0,25 мг рисперидона два раза в день через зонд для питания пациентка была достаточно спокойна, чтобы можно было сделать PICC и периферическое внутривенное введение.На 3-й день лечения рисперидоном мы увеличили дозу до 0,25 мг перорально три раза в день, и ей не потребовалось никаких дополнительных доз по мере необходимости. Она начала принимать пероральные препараты, позволяющие удалить назогастральный зонд. Она продолжала получать рисперидон и внутривенно антибиотики на протяжении всего оставшегося периода пребывания в больнице. После того, как она оставалась без возбуждения в течение 48 часов, считалось безопасным выписать ее из больницы на 0,25 мг рисперидона перорально три раза в день.
Обсуждение
Антипсихотические препараты помогают контролировать возбуждение у пожилых пациентов с делирием, деменцией или и тем и другим одновременно 4-6 ; однако возбуждение — не единственный симптом делирия или слабоумия.Путаница, дезориентация и нарушение памяти характерны для обоих расстройств и могут спровоцировать возбуждение или агрессивное поведение. Снижение активности ацетилхолина, которое наблюдается как при деменции, так и при делирии, способствует спутанности сознания и ухудшению памяти, поскольку передача ацетилхолина важна для формирования памяти. 8 Поскольку существует обратная зависимость между дофамином и ацетилхолином, нейролептики могут способствовать формированию памяти за счет снижения уровня дофамина, что приводит к относительному увеличению уровня ацетилхолина. 8
Обоснование более низких запланированных доз
Назначение антипсихотических препаратов может помочь пациентам с делирием или деменцией и спутанностью сознания восстановить некоторую ориентацию и уменьшить спутанность сознания до того, как они станут физически возбужденными. Напротив, ожидание использования антипсихотических средств по мере необходимости предотвращает лечение субклинических симптомов до того, как они перерастут в клинический синдром возбуждения, для контроля которого могут потребоваться более высокие дозы лекарств. Кроме того, взволнованный пациент может нуждаться в физических ограничениях, что может привести к травмам и усугублению возбуждения, что потребует помощи значительно большего числа сотрудников.Лечение субклинического делирия перед приступом ажитации выгодно и безопасно для пациентов и персонала. В идеале такое лечение также должно включать нефармакологические вмешательства, такие как изменение освещения для точного отражения времени дня, размещение в комнате правильно установленных часов и / или календаря и обеспечение соответствующего количества слуховой и визуальной стимуляции. 9
Наш опыт показывает, что можно использовать меньшие общие суточные дозы нейролептиков, если они запланированы.Для обоих пациентов общая суточная доза 0,75 мг (вводимая по 0,25 мг три раза в день) была достаточной. Запланированные низкие дозы могут минимизировать пики и спады уровня в крови, обеспечивая более равномерное устойчивое состояние лекарства. Этот принцип можно соблюдать при рассмотрении использования базальных доз инсулина для контроля гипергликемии в стационаре, вместо того, чтобы полагаться исключительно на инсулин по скользящей шкале. Использование скользящей шкалы для реакции на экстремальные колебания уровня глюкозы имеет тенденцию к превышению и слишком низкому уровню глюкозы, в конечном итоге вызывая физиологический ответ, который увеличивает уровень глюкозы до менее желательного уровня, чем тот, который наблюдался до начала лечения инсулином. 10 Точно так же лечение крайних форм поведения, таких как физическое возбуждение, высокими дозами нейролептиков, может привести к передозировке лекарств, увеличивая риск чрезмерной седации и других побочных эффектов. Дневная избыточная седация из-за приема антипсихотиков может еще больше нарушить цикл сна и бодрствования пациента, приводя к повторной бессоннице ночью и, потенциально, к феномену, известному как закат , который представляет собой состояние замешательства в конце дня и в ночное время, которое может способствовать развитию или обострению делирия.Так же, как базальный инсулин с корректирующими дозами предпочтительнее для лечения гипергликемии, 10 запланированные низкие дозы антипсихотиков могут уменьшить частоту пиков и спадов сознания и возбуждения, тем самым более успешно лечить спутанность сознания и возбуждение при деменции или делирии.
Наш выбор рисперидона
Мы предпочли рисперидон другим атипичным антипсихотикам для лечения наших пациентов, потому что он получил больше доказательств в двойных слепых контролируемых испытаниях, показывающих, что он безопасен и эффективен при лечении возбуждения, агрессии и психоза у пациентов с деменцией. 4 Рисперидон часто рассматривается как средство первой линии для лечения возбуждения при деменции, 5 частично из-за его благоприятного профиля побочных эффектов и относительного отсутствия склонности вызывать экстрапирамидные симптомы при низких дозах. 5,6 Рисперидон также менее склонен по сравнению с другими атипичными нейролептиками вызывать антихолинергические побочные эффекты, которые могут усугублять делирий или деменцию, нарушая формирование антероградной памяти. 7
Ограничения нашей рекомендации по лечению
Есть несколько ограничений наших результатов и последующих рекомендаций по использованию запланированных низких доз нейролептиков для лечения возбуждения у пациентов с делирием, деменцией или и тем, и другим.Клинически трудно отличить делирий от возбуждения при деменции. Нам не удалось получить много сопутствующей информации от семей наших пациентов или из их медицинских карт, чтобы установить их исходное психическое состояние перед госпитализацией, но вполне вероятно, что эти пациенты также страдали деменцией. Когда деменция и делирий возникают одновременно, клиницистам может быть сложно определить, какие симптомы вызваны тем или иным состоянием 2 ; однако, поскольку пациенты с деменцией более склонны к делирию, и было показано, что антипсихотические препараты помогают контролировать возбуждение в обоих состояниях, 3,11 наша схема лечения имеет свои достоинства независимо от того, какое состояние (состояния) вызывает симптомы.Остается ответить на вопрос, требуются ли более высокие дозы нейролептиков у пациентов с делирием, наложенным на деменцию, по сравнению с одним заболеванием.
Еще одно ограничение состоит в том, что наша рекомендация основана на улучшении психического статуса, которое мы наблюдали после нашей схемы лечения у двух пациентов, а не на результатах рандомизированных контролируемых исследований. Мы также не использовали какие-либо шкалы оценки делирия или деменции для определения клинического улучшения у наших пациентов.Кроме того, в отделение психиатрии обращались только после того, как бригада первичной медико-санитарной помощи попыталась контролировать ажитацию. В случае 1 использовались бензодиазепины, которые могли усилить формирование антероградной памяти. В случае 2 была введена более высокая доза нейролептика, что могло привести к передедации. Возможно, что отказ от этих лечебных стратегий также способствовал клиническому улучшению, наблюдаемому у наших пациентов.
Способность пациента принимать пероральные препараты имеет решающее значение для рекомендуемой нами схемы лечения, что может ограничивать ее полезность.В случае 2 необходимо установить зонд для кормления, чтобы можно было вводить лекарство. Некоторым пациентам, страдающим ажитацией из-за делирия, деменции или того и другого, прием пероральных препаратов может быть затруднен, и в таких случаях следует рассмотреть альтернативные стратегии.
Необходимость будущих исследований
Необходимы дополнительные исследования для изучения специфической терапевтической эффективности использования меньших запланированных доз нейролептиков для лечения возбуждения у пациентов с деменцией, делирием или и тем, и другим.Кроме того, отсутствуют данные о протоколе снижения или прекращения приема антипсихотических препаратов, как только симптомы исчезнут или будут лучше контролироваться. В практических рекомендациях Американской психиатрической ассоциации по лечению пациентов с делирием указывается различный диапазон продолжительности делирия от менее 1 недели до 2 месяцев, при этом у пожилых пациентов с большей вероятностью будет продолжительный курс продолжительностью не менее 1 месяца. По этой причине мы обычно рекомендуем продолжать прием лекарства в течение как минимум 2 недель с последующим наблюдением в амбулаторной психиатрии, чтобы определить, требуется ли корректировка приема лекарств.
Заключение
В результате обширного поиска в литературе не было обнаружено никаких статей или отчетов о случаях, в которых обсуждались бы запланированные дозы низких доз нейролептиков для лечения возбуждения у пожилых пациентов. Также не было литературы, сравнивающей эффекты запланированного дозирования с дозированием по мере необходимости у пожилых людей. В нашем отчете представлена идея о том, что запланированные низкие дозы нейролептиков могут быть столь же эффективными, если не более эффективными, чем высокие, по мере необходимости, дозы при лечении ажитации у пожилых пациентов.Более низкая общая суточная доза сводит к минимуму возможность побочных реакций. Это особенно важно для пожилых людей, так как эти пациенты могут быть более чувствительны к психоактивным препаратам, которые отмечены в предупреждениях FDA о черном ящике для повышения риска заболеваемости и смертности. 7,12
Авторы сообщают об отсутствии соответствующих финансовых отношений. Д-р Нгуен — руководитель консультационной службы психиатрии Департамента психиатрии Медицинского колледжа Университета Флориды, Гейнсвилл, Флорида; ДокторПатель — научный сотрудник гериатрической психиатрии, PGY-5, факультет психиатрии, Йельский университет, Нью-Хейвен, Коннектикут; и доктор Шапиро — ординатор по общей психиатрии, PGY-3, Департамент психиатрии, Медицинский колледж Университета Флориды, Гейнсвилл, Флорида.
Список литературы
1. Дьюинг Дж. Реагирование на возбуждение у людей с деменцией. Медсестры для пожилых людей . 2010; 22 (6): 18-25.
2. Коул М.Г., Маккаскер Дж., Дендукури Н., Хан Л. Симптомы делирия у пожилых стационарных пациентов с деменцией или без нее. J Neuropsychiatry Clin Neurosci . 2002; 14 (2): 167-175.
3. Lonergan E, Britton AM, Luxenberg J, Wyller T. Антипсихотические средства от делирия. Кокрановская база данных Syst Rev . 2007; 18 (2): CD005594.
4. Де Дин П.П., Кац И.Р., Бродаты Х. и др. Управление возбуждением, агрессией и психозом, связанными с деменцией: объединенный анализ, включающий три рандомизированных плацебо-контролируемых двойных слепых исследования с участием жителей домов престарелых, получавших рисперидон. Clin Neurol Neurosurg .2005; 107 (6): 497-508.
5. Алексопулос Г.С., Стрейм Дж., Карпентер Д., Дочерти Дж. П.; Группа экспертов по использованию антипсихотических препаратов у пожилых людей. Использование антипсихотических средств у пожилых пациентов. Дж. Клиническая психиатрия . 2004; 65 (приложение 2): 5-104.
6. Zuidema SU, van Iersel MB, Koopmans RT, et al. Эффективность и побочные реакции нейролептиков при нейропсихиатрических симптомах при деменции: систематический обзор [на голландском языке]. Ned Tijdschr Geneeskd . 2006; 150 (28): 1565-1573.
7. Rosack J. FDA издает новое предупреждение об атипичных антипсихотических средствах. Новости психиатрии . 2005; 40 (9): 1.
8. Trzepacz PT. Есть ли последний общий нервный путь при делирии? Сосредоточьтесь на ацетилхолине и дофамине. Semin Clin Нейропсихиатрия . 2000; 5 (2): 132-148.
9. Американская психиатрическая ассоциация. Практическое руководство по лечению пациентов с делирием. Ам Дж. Психиатрия . 1999; 156 (5 доп.): 1-20.
10. Савин Г., Шонесси А.Ф.Контроль уровня глюкозы у госпитализированных пациентов. Ам Фам Врач . 2010; 81 (9): 1121-1124.
11. Заудиг М. Оценка риска и пользы рисперидона для лечения поведенческих и психологических симптомов деменции. Лекарственная безопасность . 2000; 23 (3): 183-195.
12. Озболт Л.Б., Паниагуа М.А., Кейзер РМ. Атипичные нейролептики для лечения делириоза у пожилых людей. J Am Med Dir Assoc . 2008; 9 (1): 18-28.
Обезболивание у пожилых людей и людей с деменцией
Боль у пожилого пациента может быть труднее оценить из-за когнитивных и физических нарушений.Традиционные подходы к лечению боли могут нуждаться в изменении из-за иногда неуловимого диагноза, измененной физиологии пациента и риска более заметных побочных эффектов.
Цели терапии — уменьшить боль при одновременном улучшении функций и улучшении качества жизни.
Поскольку хроническую боль, не связанную с раком, можно уменьшить, но нельзя полностью устранить, у пациентов с деменцией часто бывает постоянное сообщение о боли.
Хроническая боль у пожилых людей
- Постоянная боль (от трех до шести месяцев) присутствует у 25–50% пожилых людей и усиливается с возрастом.Распространенность среди пациентов домов престарелых может достигать 45–80% 33.
- Хронологические маркеры старости произвольны; однако различные факторы, такие как социально-экономические последствия, выбор стиля здоровья и сопутствующие медицинские заболевания, могут влиять на физиологический возраст пациента.
Обследование пожилого пациента
- Определите источник боли и влияние, которое боль оказывает на пациента. Оцените предыдущие консультации, обследования и визуализационные исследования. С подозрением относитесь к усилению боли выше исходного уровня, поскольку патологические стимуляторы боли гораздо более вероятны в пожилом возрасте.
- Когнитивные нарушения, возникающие в результате делирия, деменции или других состояний психического здоровья, могут затруднить как оценку, так и лечение симптомов.
- У пациента со сложными эмоциональными проблемами они могут описать боль неточно и непоследовательно.
- Полиаптека обычная. Помните о возможных побочных эффектах от нескольких лекарств.
- Визуализация должна быть основана на симптомах и обследовании. Избегайте дублирования предыдущего тестирования.
- Лечение симптомов у пожилых пациентов осуществляется по тем же принципам, что и у молодых людей. Однако пожилые люди более чувствительны к побочным эффектам лекарств34
Цели лечения
- Цели лечения — модулированная боль; способность выполнять ценные действия; улучшенная функция; чувствовать себя достаточно хорошо, чтобы общаться; получить дополнительную свободу от хронических болезненных состояний; и повышение качества жизни35
- Постоянная боль многофакторна.Это излечимое, но неизлечимое состояние. Сообщите пациенту, что, хотя боль не может быть устранена, существенное улучшение функции является реальной целью.
Нефармацевтический подход
- Часто бывает полезным, с низкой стоимостью и минимальными побочными эффектами.
- Включает физиотерапию, трудотерапию, иглоукалывание, хиропрактику и массаж. Заказывая терапию, обязательно уточняйте, на какие условия вы хотите воздействовать и какие цели лечения.Следите за модальностями, чтобы убедиться, что они применяются надлежащим образом (позиционирование, горячая / холодная).
- Behavioral — Когнитивно-поведенческая терапия и медитация наряду с обучением пациентов.
- Локальная терапия — инъекции в суставы и инъекции в триггерные точки.
- Продолжайте эти процедуры при введении лекарств, чтобы свести к минимуму лекарства и их побочные эффекты.
Фармацевтический подход
Неопиоиды
Неопиоиды предпочтительнее опиоидов.Используется в первую очередь при ноцицептивной боли (послеоперационная боль, механическая боль в пояснице, травмы / травмы, артрит). Обратитесь к фармацевту за помощью в изучении побочных эффектов и сопутствующих лекарств (включая добавки) при взаимодействии лекарств с лекарствами / добавками.
- Ацетаминофен — это средство первой линии для облегчения устойчивой боли:
- ацетаминофен не обладает воспалительной активностью; поэтому его эффекты могут быть ограничены при длительном лечении воспалительных состояний.
- Остерегайтесь потенциальных лекарственных взаимодействий и пределов дозирования лекарств (определите дозы всех продуктов, содержащих ацетаминофен).
- Обоснованное назначение: 3 грамма / 24 часа ИЛИ менее 2 граммов для ослабленных пациентов, лиц старше 80 лет или тех, кто употребляет алкоголь на регулярной основе.
- Нестероидные противовоспалительные препараты (НПВП)
- Начните с низких доз для пожилых людей.
- Используйте кратковременно; не более одной-двух недель в периоды повышенной боли.
- Подбирайте лекарства с учетом кардиологических и желудочно-кишечных факторов риска пациента.
- Для тех, кто подвержен риску желудочно-кишечных осложнений, добавьте желудочно-защитный агент.
- Существует потенциально более низкий риск со стороны желудочно-кишечного тракта при приеме неацетилат салицилата или ингибиторов ЦОГ-2.
- Антидепрессанты — при хронической нейропатической боли (постгерпетическая невралгия, невропатическая боль в спине, полинейропатия, невралгия тройничного нерва). Все они имеют повышенные побочные эффекты у пожилых людей36.
- TCAs — Трициклические антидепрессанты показали свою эффективность в предотвращении мигрени и головных болей напряжения, а также в лечении хронической боли. Общие побочные эффекты — седативный эффект, когнитивная дисфункция и ортостатическая гипотензия.Следите за лекарственными взаимодействиями.
- SNRIs — селективные ингибиторы обратного захвата норадреналина (например, дулоксетин, венлафаксин) часто используются при лечении нейропатической боли.
- СИОЗС — селективные ингибиторы обратного захвата серотонина (например, пароксетин, циталопрам) использовались для лечения нейропатической боли. Эти агенты могут быть особенно полезны для пожилых пациентов из-за их благоприятных профилей побочных эффектов.
- Противосудорожные препараты — габапентин, прегабалин и карбамазепин могут быть эффективными при невропатической боли.Использование этих препаратов часто ограничено из-за головокружения, сонливости, утомляемости и увеличения веса. Переносимость со временем улучшается. Побочные эффекты и возможность лекарственного взаимодействия ограничивают их полезность у пожилых людей.37
- Начните с низких доз, постепенно увеличивайте дозу и постепенно уменьшайте дозу при прекращении приема лекарства.
- Трансдермальный лидокаин может быть полезен пожилым людям для лечения нейропатической и локализованной ноцицептивной боли и имеет низкую частоту побочных эффектов.
- Миорелаксантов следует избегать людям старше 65 лет из-за непереносимости побочных эффектов.
Опиоиды — общие соображения
- Опиоидные анальгетики являются основным средством лечения умеренной и сильной боли у пациентов с запущенными стадиями заболевания. При длительной боли следует использовать анальгетики длительного действия или с замедленным высвобождением. Прорывную боль следует выявлять и лечить с помощью препаратов быстрого действия и быстрого действия.
- Пожилые люди более чувствительны к действию опиоидов из-за возрастных физиологических изменений (например, снижение функции почек или печени и изменение распределения жира в организме), а также сопутствующих заболеваний.
- Всегда учитывайте, есть ли альтернативная терапия, которая, вероятно, будет иметь такой же или лучший терапевтический эффект для контроля боли, функционального восстановления и улучшения качества жизни.
- Обдумайте, может ли пациент (или лицо, осуществляющее уход) ответственно управлять употреблением опиоидов.
- Пациентам могут потребоваться другие лекарства, кроме таблеток. Это может быть жидкость, пластырь или инъекции. Старайтесь придерживаться наименее сложного режима лечения, чтобы обеспечить соблюдение режима лечения.
- Опиоиды могут вызывать помутнение сознания, которое со временем может исчезнуть. Однако во время приема лекарства могут наблюдаться стойкие седативные эффекты, когнитивные и психомоторные нарушения, галлюцинации, сны и кошмары.
- Никогда не начинайте опиоидную терапию пластырями или другими опиатами длительного действия у пациентов, ранее не принимавших опиоиды.
- Разумные рекомендации по дозировке должны начинаться с 30–50% рекомендуемой начальной дозы с теми же интервалами дозирования, а затем увеличивать дозу с шагом 25% для обеспечения комфорта и толерантности к побочным эффектам. Существует значительная индивидуальная вариативность реакции на различные опиоиды, и невозможно предсказать лекарство с наиболее благоприятным балансом между обезболиванием и побочными эффектами.
- Возможные варианты лекарств:
- Морфин, оксикодон, гидрокодон +/- ацетаминофен, гидроморфон, трамадол, фентанил, бупренорфин.Избегайте меперидина и метадона. При выборе лекарства укажите целевую цель лечения, предпочтительный путь введения, слабость пациента и сопутствующие заболевания, а также свой клинический опыт.
- Опиоидные побочные эффекты:
- Запор. Этот побочный эффект со временем практически не меняется. Запор предсказуем, поэтому начните профилактическую слабительную терапию при приеме наркотиков.
- Баланс / Падение
- Особенно у пациентов, принимающих полиаптека, у которых нарушена физическая подготовка или у которых проблемы со зрением.
- Если есть доказательства риска падений, рассмотрите возможность отказа от опиоидов.
- Рассмотрите возможность направления к специалисту по физическому лечению и вспомогательным средствам передвижения до начала лечения.
- Обеспечьте безопасную среду для пациента с ограниченной подвижностью. Рассмотрите возможность проведения оценки безопасности дома через соответствующее агентство.
- Респираторный
- При употреблении наркотиков наблюдаются апноэ во сне и нарушение дыхания во сне.
- Преувеличенное угнетение дыхания, наблюдаемое при употреблении опиоидов, можно свести к минимуму, начав с низких доз и с соответствующим титрованием.Соблюдайте особую осторожность при увеличении доз, особенно у пожилых людей с факторами риска апноэ во сне.
- Тошнота — обычное дело. Тошноту можно свести к минимуму с помощью медленного увеличения дозы опиоидов.
- Депрессия — Опиоиды могут вызывать или усугублять депрессию, которая является излечимым состоянием, которое может поддаваться лечению.
- Опиоиды влияют на функционирование гипоталамо-гипофизарно-надпочечниковой системы, приводя к повышению уровня пролактина, снижению уровня половых гормонов и, в редких случаях, к вторичной надпочечниковой недостаточности.
Лечение боли у пациентов с деменцией
- Поскольку хроническая боль, не связанная с раком, с большей вероятностью будет уменьшена, чем устранена, постоянное сообщение о боли является обычным явлением.
- Людям с развитой деменцией, которые могут быть не в состоянии вербально рассказать о своей боли, вам может потребоваться оценить их состояние (и их реакцию на лечение) по мимике, вербализации, движениям тела, изменениям в межличностных взаимодействиях, моделям активности и распорядку дня, таким как как нарушение сна и подавление аппетита.Было разработано множество вопросников с разной степенью успешности определения уровней боли у лиц с деменцией, при этом нет единого мнения о том, какой из них лучше.38
- Пациенты также могут демонстрировать вычеркивание, отказ от лекарств, возбуждение, бред, повышенное беспокойство и социальную изоляцию. Исключите другие потенциальные инфекционные, метаболические, связанные с приемом лекарств и социальные изменения ситуации как возможные причины резкого снижения.
- Назначьте исследование запланированных лекарств (будьте осторожны с запланированными НПВП).Используйте пошаговый подход.
- Начинайте с малого, двигайтесь медленно, помните о возможном лечении.
- Тщательно наблюдайте за пациентом, чтобы сбалансировать риски и преимущества лечения.
- Обратите внимание на травяные и диетические добавки, которые принимают пожилые пациенты, которые не могут добровольно предоставлять эту информацию. Они могут быть склонны к взаимодействию с лекарственными добавками.
- Пациенты, которые не реагируют на одно лекарство, могут реагировать на другое.
6 главных проблем с приверженностью к лечению у пожилых людей
В зависимости от того, как принимаются лекарства, они могут иметь решающее значение для хорошего здоровья или вызывать серьезные проблемы со здоровьем.Когда пропускаются дозы или принимается слишком много лекарств, результаты могут быть смертельными.
Несоблюдение режима приема лекарств широко распространено среди пожилых людей. По данным Министерства здравоохранения и социальных служб:
- Пятьдесят пять процентов пожилых людей не соблюдают предписания о рецептурных лекарствах, что означает, что они не принимают лекарства в соответствии с инструкциями врача.
- Около 200 000 пожилых людей ежегодно госпитализируются из-за побочных реакций на лекарства.
Есть много причин, по которым пожилые люди не принимают лекарства в соответствии с предписаниями. Вот шесть распространенных причин ошибок при приеме лекарств и советы о том, как члены семьи могут помочь их предотвратить.
Проблемы со зрением
Для пожилых людей, у которых есть проблемы со зрением, неспособность читать мелкий шрифт на этикетках бутылок с таблетками или различать таблетки может привести к потенциально опасному злоупотреблению лекарствами.
Решения
Спросите фармацевта вашего любимого о доступных этикетках с рецептурными лекарствами.Многие аптеки предлагают этикетки с крупным шрифтом и даже этикетки с инструкциями по Брайлю. Другой вариант для пожилых людей со значительной потерей зрения, которые принимают несколько разных лекарств, — это использование говорящей системы приема лекарств. Эти системы включают в себя специальные этикетки с микрочипами и «считыватель», который может сканировать отдельные флаконы с таблетками и произносить важную информацию, такую как название лекарства, дозировка, инструкции, номер рецепта, дата пополнения, информация о аптеке, предупреждения и информационные буклеты для пациентов, вслух, чтобы терпение.Эти более сложные рецептурные этикетки обычно доступны в более крупных аптеках с доставкой по почте.
Потеря памяти
Пожилые люди, страдающие болезнью Альцгеймера и другими родственными формами деменции, склонны ко многим проблемам с приемом лекарств. Пациент с деменцией может просто забыть принять лекарство, из-за чего он пропускает прием. У них также могут быть проблемы с запоминанием того, принимали ли они уже лекарство, и они начинают принимать несколько доз, рискуя передозировкой.
Решения
В зависимости от прогрессирования слабоумия близкого человека на ранних стадиях может быть достаточно коробки для таблеток, чтобы помочь ему организовать и отслеживать прием лекарств.Доступно много типов продуктов, в том числе компьютеризированные коробки для таблеток, которые звонят по указанному номеру, если таблетки не были приняты вовремя, коробки для таблеток с тревогой и автоматические диспенсеры.
Пожилые люди с более выраженной деменцией часто теряют способность безопасно принимать собственные лекарства. По этой причине должен присутствовать кто-то, чтобы напоминать о приеме лекарств и следить за тем, чтобы старейшина принимала лекарства в соответствии с инструкциями. Профессиональные сиделки на дому могут предоставить эту и многие другие услуги, которые помогают продлить независимость пациентов с деменцией.
Прочтите: Услуги на дому, которые могут помочь пожилым людям продолжать вести самостоятельную жизнь
Ограниченный доход
Пожилые люди после выхода на пенсию часто живут на фиксированный доход. К сожалению, это означает, что многие не могут позволить себе все необходимые лекарства. Пожилые люди с низким доходом могут прибегать к разделению таблеток, принимая меньшую, чем предписанную дозу, или обходясь без лекарств в течение длительного времени.
Решения
К счастью, существуют стратегии предоставления лекарств в рамках бюджета.Один из важных советов — по возможности использовать рецептурные непатентованные лекарства. Дженерики содержат те же активные ингредиенты, что и их фирменные аналоги, но обычно намного дешевле. Спросите у врача или фармацевта вашего любимого, есть ли альтернатива дженерику.
Изучите программы финансовой помощи для рецептурных лекарств. Аптека вашего близкого может предложить программу скидок, или фармацевт может быть осведомлен о программах скидок производителя и государственных программах помощи по рецептам, которые могут помочь значительно снизить затраты на лекарства.
К сожалению, только программа Original Medicare (части A и B) покрывает только ограниченное количество рецептурных лекарств для амбулаторных больных на определенных условиях. Дополнительный план Medicare по рецепту на лекарства (часть D) может помочь минимизировать затраты на лекарства, но получатели помощи должны платить ежемесячные взносы за это дополнительное покрытие. Однако пожилые люди с ограниченным доходом и ресурсами могут иметь право на получение дополнительной помощи от Medicare для оплаты своих страховых взносов по Части D, франшиз и совместного страхования.
Прочтите: Пытаетесь платить за лекарства? Рассмотрите программу дополнительной помощи Medicare
Просмотрите наши бесплатные руководства для пожилых людей
Проблемы с глотанием
У некоторых пожилых людей возникают проблемы с проглатыванием таблеток или капсул с лекарствами из-за проблем со здоровьем.Это состояние называется дисфагией. Пожилые люди, испытывающие трудности с глотанием, могут попытаться жевать, раздавить, разбить или смешать свои таблетки или капсулы с едой или напитками. Это может быть опасно, потому что некоторые лекарства представляют собой формулы длительного действия, которые будут высвобождаться слишком быстро, если их сломать или раздавить. Другие лекарства либо не подействуют должным образом, либо могут вызвать заболевание.
Растворы
Важное практическое правило — никогда не жевать, измельчать, разбивать или смешивать лекарства в жидкости, если только врач или фармацевт вашего близкого не говорит, что это приемлемо.Если у пожилого человека возникают проблемы с глотанием лекарств, спросите врача или фармацевта, выпускаются ли их лекарства в виде небольших таблеток, которые легче глотать, или есть ли жидкий раствор.
Потеря слуха
Глухой или слабослышащий пожилой человек может плохо слышать и понимать инструкции врача или фармацевта о том, как принимать лекарства.
Решения
Поговорите со стареющим любимым человеком о том, чтобы его не смущала потеря слуха.Если они не слышат, что говорит врач или фармацевт, посоветуйте старшим попросить их повторить сказанное. Убедитесь, что они используют соответствующие слуховые аппараты, например слуховые аппараты, во время приема к врачу и при покупке лекарств в аптеке. Если им по-прежнему трудно понимать устные инструкции или они отказываются носить слуховые аппараты, то, возможно, будет разумно попросить родственника или профессионального опекуна сопровождать их на прием, чтобы получать обновления плана ухода и четкие инструкции.
Социальная изоляция
Многие пожилые люди живут самостоятельно в сообществе. Несколько исследований показали, что одинокие люди чаще не соблюдают режим приема лекарств.
Решения
Поговорите со своим близким о найме компаньона или профессионального помощника по уходу. Сиделки на дому могут помочь пожилым людям придерживаться правильного режима приема лекарств, а также обеспечить ценную социализацию, которой не хватает многим пожилым людям. Без регулярного общения с другими людьми пожилые люди могут легко почувствовать себя одинокими, впасть в депрессию и даже выпасть из старого распорядка, например, графика приема лекарств.
Пациенты с деменцией часто получают психотропные препараты, опиоиды
Психотропные препараты и опиоиды часто прописывались взрослым с деменцией, показал анализ пациентов, проживающих в сообществах по программе Medicare.
Почти 75% пожилых людей с деменцией получали по крайней мере один рецепт на лекарство, активное для центральной нервной системы (ЦНС) — антидепрессант, опиоидное обезболивающее, лекарство от эпилепсии, лекарство от тревожности или антипсихотическое лекарство, — заполненное в течение 1 года , сообщил Донован Мауст, доктор медицинских наук, из Университета Мичигана в Анн-Арборе, и соавторы в JAMA.
Ни один из этих препаратов не одобрен в США для лечения деменции или ее поведенческих симптомов, и все они связаны с побочными эффектами у пожилых людей, включая падения, седативный эффект и повышенный риск смерти, отметили исследователи.
«Было проведено много исследований и внимания со стороны регулирующих органов к использованию этих лекарств для пациентов с деменцией в условиях длительного ухода, но их использование в обществе было настоящим слепым пятном», — сказал Мауст MedPage Today. «Мы обнаружили, что их использование в основном такое же высокое, как и при длительном лечении, и намного превышает доказательную базу, поддерживающую использование для пациентов с деменцией».
«Это важное исследовательское письмо, в котором подчеркивается недостаточно признанная проблема», — сказала Дженнифер Ватт, доктор медицинских наук из Университета Торонто, которая не принимала участия в исследовании.
«Подобно людям с деменцией, живущим в домах престарелых, пожилым людям с деменцией, живущим в общественных местах, обычно назначают лекарства, для которых у нас нет убедительных доказательств пользы, и у нас есть все больше доказательств потенциального вреда», — сказала она MedPage Today.
В ходе анализа были рассмотрены 737 839 проживающих в сообществах участников программы Medicare, у которых была диагностирована деменция в связи с заявлением о личной клинической встрече с 1 октября 2014 года по 30 сентября 2015 года. Исследователи ограничили свой анализ людьми с программой Medicare Part D. покрытие рецептурных препаратов и 100 дней или меньше в доме престарелых в течение периода наблюдения.
Средний возраст группы 82 года, две трети составляли женщины. В целом 73,5% были прописаны препараты, действующие на ЦНС; распространенность была самой высокой среди женщин (75.3%) и среди людей в возрасте от 65 до 74 лет (80,6%), белых (74,6%) или людей с низким доходом (76,5%).
Лидерами заполнения были два опиоида: гидрокодон (Викодин) на 13,5% и трамадол (Ультрам) на 12,1%. Следующими были антипсихотический кветиапин (Сероквель) в дозе 12,0%, антидепрессант сертралин (Золофт) в дозе 11,3%, противоэпилептический габапентин (Нейронтин) в дозе 11,2% и анксиолитик лоразепам (Ативан) в дозе 9,6%.
Всего 49,8% пациентов выполнили рецепты на антидепрессанты, 29,8% пациентов выполнили рецепты на опиоиды, 26.8% для анксиолитиков, 21,9% для противоэпилептических средств и 21,6% для нейролептиков. Пациенты с деменцией в сельской местности чаще получали рецепт на опиоиды (34,6% против 29,1%), чем пациенты, проживающие в городских или пригородных почтовых индексах.
Опиоиды выписывались в относительно небольших объемах, в среднем 26 и 30 дней на человека для гидрокодона и трамадола, соответственно. Напротив, средний запас габапентина на человека составлял 240 дней.
«Это открытие высокого уровня использования опиоидов и психоактивных препаратов у пожилых пациентов вызывает беспокойство», — сказал Джерри Аворн, доктор медицины из Гарвардской медицинской школы в Бостоне, который также не участвовал в исследовании.«Пожилые люди подвержены более высокому риску всех побочных эффектов лекарств, особенно тех, которые влияют на мозг», — отметил он.
«Большое количество опиоидов вызывает особое беспокойство, поскольку к настоящему времени мы должны знать, что, если у пациента нет неизлечимой болезни, эти лекарства часто приносят гораздо больше вреда, чем пользы», — сказал Аворн MedPage Today . «Полученные данные указывают на необходимость в дополнительных программах по обучению специалистов здравоохранения необходимости более разумного использования этих сильнодействующих лекарств, особенно у этих уязвимых пациентов.«
Клиницисты могут помочь взрослым с деменцией и лицам, осуществляющим уход, лучше понять потенциальные преимущества и вред от использования этих лекарств и научить их «альтернативам нефармакологического лечения, которые могут быть столь же эффективными, но без такого же потенциального вреда», — добавил Ватт.
У исследования было несколько ограничений, отметили Мауст и соавторы. Полученные данные основаны на схемах назначения лекарств несколько лет назад и не могут быть распространены на пожилых людей в 2020 году. Кроме того, исследователи использовали заполнение рецептов в качестве косвенного показателя употребления лекарств и не имели информации о целесообразности назначений.
«Интересно отметить и, возможно, не удивительно, что антипсихотики, которые привлекли наибольшее внимание после предупреждений FDA о черном ящике, — это класс, который назначают меньше всего», — заметил Мауст. «Но это также означает, что в политике, ориентированной только на этот класс, отсутствует множество других предписаний, которые имеют место».
Последнее обновление 18 августа 2020 г.
Джуди Джордж освещает новости неврологии и нейробиологии для MedPage Today, пишет о старении мозга, болезни Альцгеймера, деменции, рассеянном склерозе, редких заболеваниях, эпилепсии, аутизме, головной боли, инсульте, болезни Паркинсона, БАС, сотрясении мозга, CTE, сне, боли и многом другом.Подписаться
Раскрытие информации
Работа поддержана грантом Национального института старения.
Один исследователь сообщил о получении грантов от Ассоциации Альцгеймера.


 Некоторые из них со временем проходят по мере привыкания организма к новому средству. Если вред от побочных эффектов явно превосходит положительное действие, обратитесь к врачу. Многие лекарства могут быть заменены аналогом.
Некоторые из них со временем проходят по мере привыкания организма к новому средству. Если вред от побочных эффектов явно превосходит положительное действие, обратитесь к врачу. Многие лекарства могут быть заменены аналогом. Поэтому препараты необходимо хранить с особой тщательностью.
Поэтому препараты необходимо хранить с особой тщательностью.