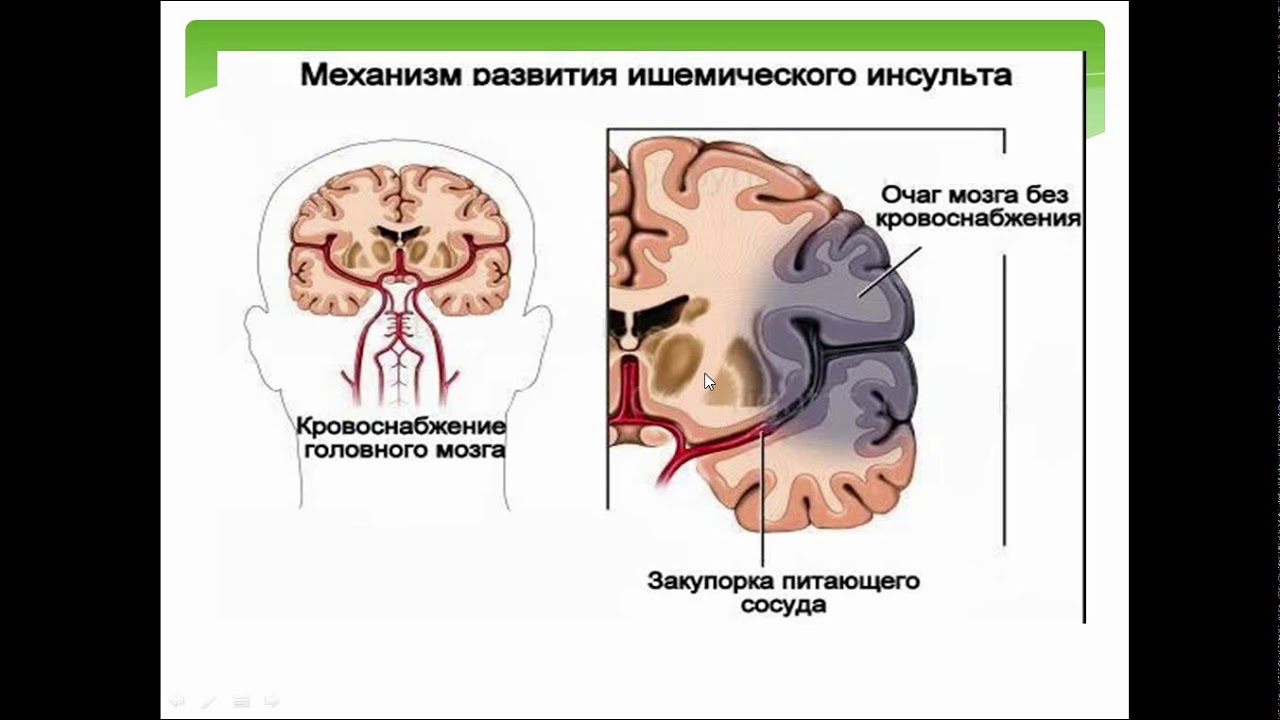
Лечение при ишемическом инсульте головного мозга: Ишемический инсульт: прогнозы, последствия и реабилитация
Возможности лечения ишемического инсульта в неврологическом стационаре uMEDp
Мозговой инсульт – одна из важнейших медицинских и социальных проблем в большинстве экономически развитых стран, что обусловлено связанными с инсультом длительной утратой трудоспособности, высоким уровнем смертности и инвалидизации. Выделяют множество факторов риска развития ишемического инсульта, среди них самую важную роль играют церебральный атеросклероз и артериальная гипертензия. Лечение инсульта преследует такие цели, как сведение к минимуму повреждения мозга, предотвращение инвалидизации и вторичных осложнений. Методом выбора лечения инсульта является назначение тромболитических препаратов. Спорным остается вопрос эффективности при ишемическом инсульте нейропротекторов, воздействующих на различные этапы ишемического каскада.
Актуальность проблемы
Мозговой инсульт определяется как клинический синдром острого сосудистого поражения головного мозга, для него характерно внезапное появление очаговой неврологической и/или общемозговой симптоматики, сохраняющейся более 24 часов.
В зависимости от патогенетического механизма развития острой фокальной ишемии мозга различают несколько патогенетических вариантов ишемического инсульта. Наибольшее распространение получила классификация TOAST [2]. В ней выделены следующие варианты ишемического инсульта: атеротромботический, кардиоэмболический, лакунарный и связанный с другими, более редкими причинами (васкулопатией, гиперкоагуляцией, гематологическими заболеваниями, гемодинамическими нарушениями, расслоением стенки крупных артерий).
В большинстве стран острые нарушения мозгового кровообращения входят в четверку самых частых причин смертности. Не менее трети случаев инсульта приводят к летальному исходу в остром периоде. Кроме того, мозговой инсульт является одной из наиболее распространенных причин инвалидизации.
В России заболеваемость инсультом остается одной из самых высоких в мире и занимает второе место (39%) в структуре смертности от болезней системы кровообращения. Ежегодно в нашей стране инсульт переносят более 450 тыс. человек (частота инсульта составляет 3,4 на 1000 человек в год). Кроме того, в нашей стране наблюдается тенденция к «омоложению» инсульта с увеличением его распространенности среди лиц трудоспособного возраста [5].
Патофизиология инсульта
Острая фокальная ишемия вызывает определенную последовательность молекулярно-биохимических изменений в веществе мозга, способных привести к тканевым нарушениям, заканчивающимся гибелью клеток. Характер изменений зависит от величины и длительности снижения мозгового кровотока, а также от чувствительности вещества мозга к ишемии.
Характер изменений зависит от величины и длительности снижения мозгового кровотока, а также от чувствительности вещества мозга к ишемии.
Модель повреждения нервных клеток при ишемии мозга изучена достаточно хорошо. Критическое снижение кровотока до 25 мл/мин на 100 г вещества мозга приводит к гибели клеток. При этом развивается глутаматная эксайтотоксичность и увеличивается содержание внутриклеточного кальция, последнее запускает механизмы структурного повреждения мембран и других внутриклеточных образований. При значительной ишемии происходит аноксическая деполяризация мембран, гибель клеток обычно наступает в течение шести – восьми минут.
Зона ишемии, если в ней нет реперфузии, обычно перерастает в зону ишемического инфаркта с некрозом всех клеток. Однако при транзиторной фокальной или распространенной ишемии до полной гибели нейронов может пройти два-три дня в зависимости от специализации и преобладающего типа клеток соответствующего участка нервной ткани. Для зоны «полутени» (пенумбры), окружающей ишемический очаг, характерна сохранность ионного статуса и наличие отдельных участков ишемизированных нейронов в интактной зоне. Вокруг очага некроза также неопределенно долгое время может существовать зона олигемии, в ней сохраняется баланс между тканевыми потребностями и процессами, обеспечивающими эти потребности [6].
Вокруг очага некроза также неопределенно долгое время может существовать зона олигемии, в ней сохраняется баланс между тканевыми потребностями и процессами, обеспечивающими эти потребности [6].
Факторы риска инсульта
К основным факторам риска развития ишемического инсульта относят пожилой и старческий возраст, курение, злоупотребление алкоголем, артериальную гипертензию, повышенный уровень холестерина в сыворотке крови, атеросклеротическое поражение аорты, сонных и позвоночных артерий, заболевания сердца (мерцательную аритмию, инфаркт миокарда, аневризму левого желудочка, искусственный клапан сердца, ревматическое поражение клапанов сердца, кардиомиопатию, бактериальный эндокардит), а также сахарный диабет, ожирение, гиподинамию и синдром обструктивного апноэ сна.
В большинстве случаев (90–95%) развитие ишемического инсульта обусловлено атеросклерозом крупных церебральных артерий и аорты, поражением мелких церебральных артерий вследствие артериальной гипертензии или сахарного диабета, а также кардиогенной эмболией [7].
Клиническая картина при ишемическом инсульте разнообразна и зависит от локализации и объема очага поражения головного мозга. Наиболее частой локализацией очага инфаркта мозга является каротидный (80–85%), реже вертебробазилярный (15–20%) бассейн.
Лечение и профилактика инсульта
Сложность патогенетического подхода к лечению ишемического инсульта обусловлена гетерогенностью патогенетических механизмов, лежащих в основе его развития. Основными задачами проводимых лечебных мероприятий (медикаментозных, хирургических и реабилитационных) являются восстановление нарушенных неврологических функций, профилактика осложнений и борьба с ними, а также вторичная профилактика повторных нарушений мозгового кровообращения.
Методом выбора в лечении ишемического инсульта является проведение тромболитической терапии. Тромболизис позволяет устранить причину ишемии – окклюзию мозгового сосуда тромботическим или атеротромботическим сгустком – путем внутривенного введения раствора тканевого активатора плазминогена алтеплазы.
Первым крупным исследованием по изучению эффективности применения алтеплазы, внушившим оптимизм, явилось международное двойное слепое плацебоконтролируемое исследование ECASS I. Достоверное снижение суммарной частоты смертельных исходов и инвалидизации при лечении в сравнении с показателем группы плацебо через три месяца наблюдения было отмечено у 59,1 и 70,8% больных соответственно. Однако такой показатель, как 30-дневная летальность, был сопоставим между группами препарата и плацебо, а частота геморрагической трансформации инфаркта мозга оказалась в три раза выше в группе больных, получавших активатор плазминогена, чем в контрольной группе [8].
В последующие годы опубликовано несколько крупных метаанализов по вопросам внутривенной тромболитической терапии в ангионеврологии [9]. Особого внимания заслуживает объединенный анализ (pooled analysis) индивидуальных данных 2799 пациентов, вошедших в исследования NINDS, ECASS I и II, ATLANTIS, который продемонстрировал, что даже в течение трехчасового окна более раннее начало лечения приводит к лучшим результатам. В этом исследовании не было выявлено увеличения смертности (прежде всего вследствие геморрагических осложнений) на фоне тромболитической терапии, начатой во временном интервале от трех до четырех с половиной часов после инсульта [10]. Эти данные стали предпосылкой к проведению международного двойного слепого плацебоконтролируемого исследования ECASS III, целью которого была оценка эффективности и безопасности терапии алтеплазой в терапевтическом окне от трех до четырех с половиной часов после ишемического инсульта. Положительного эффекта удалось достичь у 52,4% пациентов, получавших тромболитическую терапию, и у 45,2% пациентов группы плацебо.
Одним из наиболее тяжелых осложнений тромболитической терапии являются внутримозговые кровоизлияния, как симптомные, так и фатальные. Симптомные внутричерепные кровоизлияния – это кровотечение в зоне инфаркта или новое кровотечение в другой анатомической области или окружающих тканях. На каждые 17 пролеченных тромболитиками больных наблюдается один случай внутричерепного кровоизлияния, или четырехкратное увеличение частоты его развития по сравнению с контролем. Следует отметить, что частота развития внутримозговых геморрагий благодаря созданию современных тромболитиков снизилась с 10–56 до 6% [12].
В настоящее время согласно рекомендациям Американской ассоциации по лечению инсульта 2013 г. применение тромболитической терапии рекомендовано независимо от типа ишемического инсульта лицам старше 18 лет с наличием очевидного неврологического дефицита при давности заболевания менее трех часов [13]. Наиболее значимыми противопоказаниями к проведению тромболитической терапии являются крупный размер инфаркта (одна треть полушария), черепно-мозговая травма, внутричерепные кровотечения в анамнезе, уровень артериального давления более 185/110 мм рт. ст. Допустимо введение алтеплазы и в сроки до четырех с половиной часов от начала заболевания с дополнительными ограничениями: возраст не старше 80 лет, тяжесть инсульта не более 25 баллов по шкале оценки тяжести инсульта, разработанной Национальным институтом здоровья CША (National Institutes of Health Stroke Scale), отсутствие приема оральных антикоагулянов, отсутствие сочетания сахарного диабета и ишемического инсульта в анамнезе. В США внутривенная тромболитическая терапия на настоящий момент остается пока единственным видом фармакотерапии в остром периоде ишемического инсульта, одобренным FDA.
Однако возможность получить лечение в период «терапевтического окна» существует не у всех больных. Так, за период с 2003 по 2012 г. в Германии с внедрением системы дистанционного принятия решений TeleStroke удалось увеличить частоту применения тромболитической терапии у больных ишемическим инсультом с 2,6 до 15,5% в год [14]. В остальных случаях главным направлением усилий медперсонала во время пребывания больного в стационаре остается обеспечение жизненных функций и применение вспомогательных методов лечения с недостаточно доказанной эффективностью. Такое лечение в остром периоде ишемического инсульта включает мероприятия по уходу за больными, мониторинг и поддержание жизненно важных функций (функции глотания), профилактику и лечение инфекционных осложнений (пролежней, пневмонии, инфекций мочевыводящих путей).
Осуществляется мониторинг основных физиологических показателей (артериального давления, частоты сердечных сокращений, показателей электрокардиограммы, частоты дыхания, насыщения гемоглобина кислородом в артериальной крови, температуры тела, содержания глюкозы в крови) как минимум в первые 48 часов после начала инсульта вне зависимости от тяжести состояния больного. Для этого пациент должен находиться в специализированном «сосудистом» неврологическом или реанимационном отделении. Это позволяет осуществлять адекватную коррекцию и поддержание показателей гемодинамики, дыхания, водно-электролитного обмена, коррекцию отека мозга и повышенного внутричерепного давления, нутритивную поддержку, профилактику и борьбу с осложнениями [13, 15].
Для этого пациент должен находиться в специализированном «сосудистом» неврологическом или реанимационном отделении. Это позволяет осуществлять адекватную коррекцию и поддержание показателей гемодинамики, дыхания, водно-электролитного обмена, коррекцию отека мозга и повышенного внутричерепного давления, нутритивную поддержку, профилактику и борьбу с осложнениями [13, 15].
Если проведение тромболизиса после нейровизуализационного исследования невозможно, то пациентам с ишемическим инсультом как можно раньше (в пределах 48 часов) назначают ацетилсалициловую кислоту в суточной дозе 325 мг [13]. Антитромботический эффект ацетилсалициловой кислоты связан с подавлением агрегации тромбоцитов за счет необратимой блокады в них фермента циклооксигеназы 1 и почти полного подавления продукции тромбоксана А2. Раннее назначение препарата уменьшает частоту возникновения повторных инсультов на 30% и 14-дневную летальность на 11% [15]. Другие антитромбоцитарные препараты (клопидогрел, дипиридамол, абциксимаб, эптифибатид) пока убедительно не продемонстрировали свою эффективность в остром периоде ишемического инсульта [13].
Одним из спорных моментов терапии инсульта является нейропротективная терапия, цель которой – воздействие на различные этапы ишемического каскада изменений в клетке с целью их прерывания и предотвращения апоптоза. Это может быть эрадикация нейротоксических веществ из поврежденного участка мозга (глутамат, свободные радикалы, трансмембранный кальций), улучшение обмена веществ в нейронах, достижение мембраностабилизирующего эффекта. В многочисленных исследованиях пока получены неутешительные результаты. Применение различных лекарственных средств с нейропротективной целью не обеспечило редукции ишемического очага и уменьшение неврологического дефицита. Более того, многие из них оказались токсичными и неблагоприятно влияли на течение инсульта [13].
По мнению некоторых ученых, например R. Young, проблема недостаточной эффективности нейропротекторных средств, вероятно, состоит в том, что исследователи концентрируют внимание лишь на защите нейронов. Однако инсульт представляет собой не только процесс повреждения и гибели нейронов, а болезнь головного мозга в целом с нарушением нормальных функциональных взаимоотношений. Именно поэтому нейропротекция должна подразумевать защиту не только нейронов, но и астроцитов, олигодендроцитов, микроглии и восстановление других механизмов, нарушающихся при ишемии [16]. Кроме того, важной задачей является предупреждение вторичных повреждений нейронов после успешной реперфузии, поскольку восстановление кровотока в ишемизированной мозговой ткани с пораженным микроциркуляторным руслом само по себе способно усугубить состояние пациента.
Именно поэтому нейропротекция должна подразумевать защиту не только нейронов, но и астроцитов, олигодендроцитов, микроглии и восстановление других механизмов, нарушающихся при ишемии [16]. Кроме того, важной задачей является предупреждение вторичных повреждений нейронов после успешной реперфузии, поскольку восстановление кровотока в ишемизированной мозговой ткани с пораженным микроциркуляторным руслом само по себе способно усугубить состояние пациента.
Исследования нейропротекции при ишемическом инсульте продолжаются, наиболее активно изучаются препараты, которые в тандеме с тромболитиком могут сыграть дополнительную нейропротективную роль при инсульте, в частности расширить терапевтическое окно и защитить ткань мозга после реканализации. Отечественные ученые вносят свой вклад в разработку новых лекарственных веществ, которые могли бы обеспечивать нейропротекцию в рамках этой концепции.
Димефосфон – оригинальный препарат, полученный путем целенаправленного поиска в ряду неантихолинэстеразных фосфорорганических соединений в Институте органической и физической химии им. А.Е. Арбузова (Казань). Димефосфон представляет собой диметиловый эфир 1,1-диметил-3-оксобутил-фосфоновой кислоты. Антиоксидантное действие препарата осуществляется за счет предотвращения активации перекисного окисления липидов и повышения активности антиоксидантных ферментов в тканях головного мозга [17, 18].
А.Е. Арбузова (Казань). Димефосфон представляет собой диметиловый эфир 1,1-диметил-3-оксобутил-фосфоновой кислоты. Антиоксидантное действие препарата осуществляется за счет предотвращения активации перекисного окисления липидов и повышения активности антиоксидантных ферментов в тканях головного мозга [17, 18].
Димефосфон усиливает энергетические процессы в мозге как прямо, воздействуя непосредственно на митохондрии, так и косвенно, стимулируя гипофиз-тиреоидную систему, повышая потребление тканями тиреоидных гормонов, что сопровождается активизацией энергетических и катаболических процессов в митохондриях клеток. Кроме того, препарат проявляет свойства некоторых нейротрансмиттеров (обладает ГАМКергической, Н-холино- и дофаминергической активностью).
Антиацидотическое действие препарата реализуется за счет интенсификации почечного и легочного механизмов регуляции кислотно-щелочного состояния, усиления внутриорганного кровотока и тканевого метаболизма, также Димефосфон уменьшает содержание молочной и пировиноградной кислот в тканях головного мозга. В отличие от известных антиацидотических средств, непосредственно влияющих на кислотность крови за счет введения соответствующего щелочного раствора, эффект Димефосфона осуществляется за счет вмешательства в метаболические процессы.
В отличие от известных антиацидотических средств, непосредственно влияющих на кислотность крови за счет введения соответствующего щелочного раствора, эффект Димефосфона осуществляется за счет вмешательства в метаболические процессы.
Полярографический метод при помощи имплантированных в кору электродов во время хирургического вмешательства по удалению опухолей мозга показал, что применение препарата сопровождается уменьшением потребления кислорода тканью головного мозга. По результатам ультрасонографической оценки реактивности мозговых сосудов, восстановление реактивности мозговых сосудов при применении Димефосфона происходит быстрее, чем при применении ницерголина и пирацетама. В другом исследовании также было установлено, что реактивность сосудов, расположенных рядом с ложем опухоли, восстанавливалась быстрее, если в течение пяти дней до операции пациенты получали Димефосфон [19, 20].
В неврологических и нейрохирургических клиниках Москвы, Санкт-Петербурга, Риги, Тбилиси и Казани был продемонстрирован положительный эффект препарата при инсультах, после нейрохирургических операций, при болезни Меньера, рассеянном склерозе и вегетативной дисфункции. При ишемическом инсульте Димефосфон рекомендуется применять в жидкой форме перорально по 15 мл три раза в день [18].
При ишемическом инсульте Димефосфон рекомендуется применять в жидкой форме перорально по 15 мл три раза в день [18].
Вторичная профилактика инсульта и период реабилитации
Для больных, перенесших ишемический инсульт, должен быть разработан индивидуальный план вторичной профилактики с учетом имеющихся факторов риска, а также программа реабилитационных мероприятий. Установлено, что у пациентов, выживших после инсульта, вероятность развития повторного нарушения мозгового кровообращения в девять раз превышает таковую в общей популяции и достигает 30% [15].
Основой всех рекомендаций по вторичной профилактике ишемического инсульта является антигипертензивная терапия (при наличии артериальной гипертензии). Показано, что благодаря гипотензивному лечению относительный риск повторного инсульта уменьшается на 19%, а снижение абсолютного риска составляет 25%. Для предотвращения одного повторного инсульта в год с помощью антигипертензивной терапии необходимо пролечить всего 45 больных с повышенным артериальным давлением [21]. С целью профилактики предлагается использовать в схеме лечения тиазидные (гидрохлоротиазид) и тиазидоподобные (индапамид) диуретики, в том числе в комбинации с ингибиторами ангиотензинпревращающего фермента [13, 22]. Рациональное антигипертензивное лечение также способствует замедлению прогрессирования сосудистых когнитивных расстройств и уменьшению риска коронарных осложнений.
С целью профилактики предлагается использовать в схеме лечения тиазидные (гидрохлоротиазид) и тиазидоподобные (индапамид) диуретики, в том числе в комбинации с ингибиторами ангиотензинпревращающего фермента [13, 22]. Рациональное антигипертензивное лечение также способствует замедлению прогрессирования сосудистых когнитивных расстройств и уменьшению риска коронарных осложнений.
Учитывая протективный эффект повышенного артериального давления в раннем периоде ишемического инсульта, начинать снижать артериальное давление рекомендуется в период после 24 часов от момента появления симптомов [13]. Вместе с тем следует учитывать не только сроки развития инсульта, но и степень повышения артериального давления. Целесообразность раннего начала базисной антигипертензивной терапии, особенно при значительном повышении артериального давления, обосновывается тем, что комплаентность больного в отношении медикаментозной профилактики повторного инсульта намного выше при наличии конкретных рекомендаций в момент выписки из стационара. При этом стратегической целью является улучшение суммарного сердечно-сосудистого прогноза в отдаленные сроки. Целевые значения артериального давления в рамках вторичной профилактики до сих пор не определены, но снижение артериального давления даже на 10/5 мм рт. ст. сопровождается существенным уменьшением риска повторного инсульта [15].
При этом стратегической целью является улучшение суммарного сердечно-сосудистого прогноза в отдаленные сроки. Целевые значения артериального давления в рамках вторичной профилактики до сих пор не определены, но снижение артериального давления даже на 10/5 мм рт. ст. сопровождается существенным уменьшением риска повторного инсульта [15].
Атеросклероз, в основе которого лежит сложное нарушение метаболизма липидов, наряду с артериальной гипертонией является важнейшим фактором, приводящим к развитию ишемических сосудистых катастроф. В настоящее время большое значение придается оценке уровня не только общего холестерина, но и отдельных фракций липидов: липопротеинов низкой и высокой плотности, липопротеина (а), триглицеридов. Основным атерогенным потенциалом обладают липопротеины низкой плотности, особенно если они модифицированы под воздействием гликанов (у больных сахарным диабетом) или перекисного окисления.
Для снижения уровня холестерина и нормализации липидного спектра применяют статины – препараты, которые конкурентно связываются с ферментом ГМГ-КоА-редуктазой и ингибируют его активность, что приводит к снижению внутриклеточного содержания холестерина и ускорению катаболизма липопротеинов низкой плотности. В результате достигается снижение уровня липопротеинов низкой плотности на 20–40%, триглицеридов – на 10–15% и повышение уровня липопротеинов высокой плотности на 5–8% [23].
В результате достигается снижение уровня липопротеинов низкой плотности на 20–40%, триглицеридов – на 10–15% и повышение уровня липопротеинов высокой плотности на 5–8% [23].
Немаловажное значение имеет учет влияния наличия расстройств дыхания во сне на возникновение и течение мозговых инсультов. По данным лонгитудинального исследования, у больных мозговыми инсультами с выявленными в стационаре расстройствами дыхания во сне в течение года наблюдения значения по индексу Бартел оставались достоверно более низкими, чем у пациентов группы сравнения, не имевших расстройств дыхания [24].
В рандомизированном контролируемом исследовании 235 больных с впервые перенесенным ишемическим инсультом в течение двух лет дополнительно к основному лечению получали СиПАП-терапию для устранения обструктивного апноэ сна. Было продемонстрировано, что раннее начало СиПАП-терапии ускоряет неврологическое восстановление и уменьшает смертность от повторных сосудистых эпизодов [25].
Депрессия развивается почти у каждого третьего больного, перенесшего инсульт, и может негативно влиять на процесс реабилитации. В патогенезе постинсультной депрессии рассматривается роль психологических факторов, генетической предрасположенности, локализации поражения головного мозга и недостаточности моноаминов.
В патогенезе постинсультной депрессии рассматривается роль психологических факторов, генетической предрасположенности, локализации поражения головного мозга и недостаточности моноаминов.
Показано, что для профилактики постинсультной депрессии эффективна психотерапия. Сочетание психотерапии и лечения антидепрессантами обладает более выраженным действием. В случае развития депрессии на фоне остаточных проявлений инсульта отмечается положительное действие длительного (шесть и более месяцев) приема трициклических антидепрессантов и селективных ингибиторов обратного захвата серотонина [26].
Кинезиотерапия, или лечебная физкультура, – основной и наиболее эффективный метод реабилитации постинсультных больных. Этот метод подразумевает выполнение лечебных движений, направленных на разработку и улучшение подвижности крупных и мелких суставов, сегментов позвоночника, увеличение эластичности сухожилий, мышечной ткани. В процессе повторяемых движений поток афферентных импульсов от проприорецепторов опорно-двигательного аппарата вовлекает в ответную реакцию все звенья нервной системы, стимулируя процессы нейропластичности в коре головного мозга и «передачу функций» погибших клеток клеткам, соседствующим с ними [27].
Осложнения инсульта
Наиболее тяжело инсульт протекает в случаях развития выраженного отека головного мозга, острой обструктивной гидроцефалии, прорыва крови в желудочки и субарахноидальное пространство, вторичного кровоизлияния в ишемизированную ткань. Вследствие этих процессов повышается внутричерепное давление с дислокацией мозга и компрессией жизненно важных образований ствола или компрессионной ишемией коры мозга, резко снижается уровень бодрствования и углубляется неврологический дефицит.
Отек мозга – избыточное накопление жидкости в нервной ткани, увеличивающее ее объем. Чем больше выражен отек, тем тяжелее течение инсульта. Для лечения этого состояния чаще всего используют гипервентиляцию и осмотические диуретики. Гипервентиляция (снижение РаСО2 до уровня 26–27 мм рт. ст.) является наиболее быстрым и эффективным методом снижения внутричерепного давления, но имеет непродолжительное действие (около двух-трех часов). Среди осмотических диуретиков чаще всего применяется маннитол.
К острой обструктивной гидроцефалии при ишемическом инсульте приводит выраженная экстравентрикулярная компрессия ликворных путей. Это состояние возможно диагностировать только по данным компьютерной томографии, оно развивается чаще всего при инфарктах мозжечка, занимающих не менее трети его полушария. Оптимальными методами лечения острой обструктивной гидроцефалии являются дренаж боковых желудочков, декомпрессия задней черепной ямки или некротизированной ткани мозжечка. Применение только противоотечной терапии в этих ситуациях не оказывает должного эффекта.
Вторичное кровоизлияние в некротизированную ткань наблюдается, как правило, на первые сутки при больших по размерам инфарктах мозга или на фоне проведения тромболитической терапии (5–6% случаев). Как и в двух предыдущих случаях, диагноз устанавливается на основании данных компьютерной томографии. Выявить геморрагическую трансформацию удается только при повторных рентгенологических исследованиях. Лечение назначают такое же, как и при геморрагическом инсульте [13].
Заключение
Эпизоды ишемических инсультов нередко заканчиваются летальным исходом или полной потерей трудоспособности и значительным снижением качества жизни больных. Исходя из этого чрезвычайно важно предупредить гибель нервных клеток, защитить их от повреждения при ишемии, восстановить нарушенный кровоток при патологических изменениях кровообращения. Такой подход позволяет не только спасти жизни пациента, но и восстановить его трудоспособность. Перспективным направлением в лечении ишемического инсульта представляется применение эффективной комбинации лекарственных средств, влияющих на разные этапы биохимического каскада при острой церебральной ишемии и стимулирующих восстановительные процессы в нервной ткани.
Проект ученых ТГУ поможет улучшить диагностику и лечение инсульта
ТОМСК, 18 фев – РИА Томск. Ученые Томского госуниверситета (ТГУ) провели
исследование, результаты которого могут стать основой нового метода для
диагностики последствий ишемического инсульта и дальнейшего лечения, сообщается
в четверг на сайте вуза.
Ранее сообщалось, что ученые ТГУ совместно с коллегами из Бельгии и США создали неинвазивный инструмент для отслеживания молодых нейронов в головном мозге. Применять разработку на людях нельзя, но она позволяет оценить на лабораторных животных, как мозг восстанавливается после инсульта, что поможет создать новые методы лечения людей.
Также сообщалось, что нейробиологи ТГУ получили грант Российского научного фонда (РНФ) и первыми в мире проследили процессы гибели и восстановления нервных клеток и аксонов после инсульта головного мозга. Исследование было проведено на лабораторных животных с помощью созданной ими новой диагностической технологии.
«Ученые в ходе экспериментов, проведенных с использованием модели
ишемического инсульта у крыс, получили новые данные о процессах, которые
происходят в очаге поражения головного мозга. Эта информация может стать
основой неинвазивного диагностического метода, позволяющего оценивать степень
воспаления, прогнозировать течение заболевания, выбирать стратегию лечения
людей», – говорится в сообщении.
Добавляется, что результаты исследований опубликованы в высокорейтинговом журнале «International Journal of Molecular Sciences».
Как проходило новое исследование
© с сайта Томского госуниверситета Целью исследования было изучение процесса образования новых нейронов при ишемическом инсульте. Для этого был создан особый способ маркировки молодых нейронов. Ученые ТГУ вместе с коллегами из Университета Левена (Бельгия) сконструировали «курьера» для транспортировки генетического материала в клетки головного мозга – специальные векторы на основе ленитивирусов и аденоассоциированных вирусов«Генные инженеры вставили в обезвреженный вирус ген белка ферритина и
особую генетическую последовательность, которая позволяет увеличить выработку
ферритина только в молодых нейронах. Молодые нейроны, накопившие ферритин,
содержащий атомы железа, можно «увидеть» при использовании
специального протокола МРТ», – сообщает пресс-служба.
По словам заведующей лаборатории нейробиологии Биологического института ТГУ Марины Ходанович, при сканировании мозга животных, у которых был смоделирован ишемический инсульт, ученые увидели две области со специфичным изменением МРТ-сигнала, указывающим на присутствие большого количества клеток, содержащих ферритин.
«Сигнал был зафиксирован в неишемической зоне, где после инсульта обычно начинается активная выработка молодых нейронов. Это не стало сюрпризом для нас, но вот наличие такого же сигнала в очаге инсульта оказалось неожиданным», – цитируется Ходанович в сообщении.
© сайт Томского госуниверситета Последующее исследование срезов головного мозга показало, что такой сигнал подавали макрофаги – клетки иммунной системы, которые еще называют «большими пожирателями». Макрофаги способны к активному захвату и перевариванию бактерий, чужеродных или токсичных для организма частиц и фрагментов погибших клеток.
«После инсульта головного мозга макрофаги мигрируют в ишемический очаг, где поглощают не только разрушенную нервную ткань, но и эритроциты, богатые железом, благодаря чему становятся «заметными» на МРТ», – объясняется в сообщении.
Как исследование может помочь пациентам
По мнению нейробиологов ТГУ, наблюдение за скоплениями макрофагов с помощью МРТ можно использовать для создания нового диагностического подхода, который будет полезен врачам-клиницистам. Технология позволит оценивать интенсивность воспаления в очаге инсульта, получать больше информации о состоянии пациента, точнее прогнозировать течение заболевания и подбирать медикаментозную терапию.
«Задача, которую нужно решить нейробиологам, – найти способ
разграничения сигналов от макрофагов и новых нейронов с генетическими метками.
Для этого необходимо продолжить начатые исследования. В случае продления гранта
РНФ исследования ученых ТГУ будет направлены на решение именно этих задач»,
– резюмирует пресс-служба.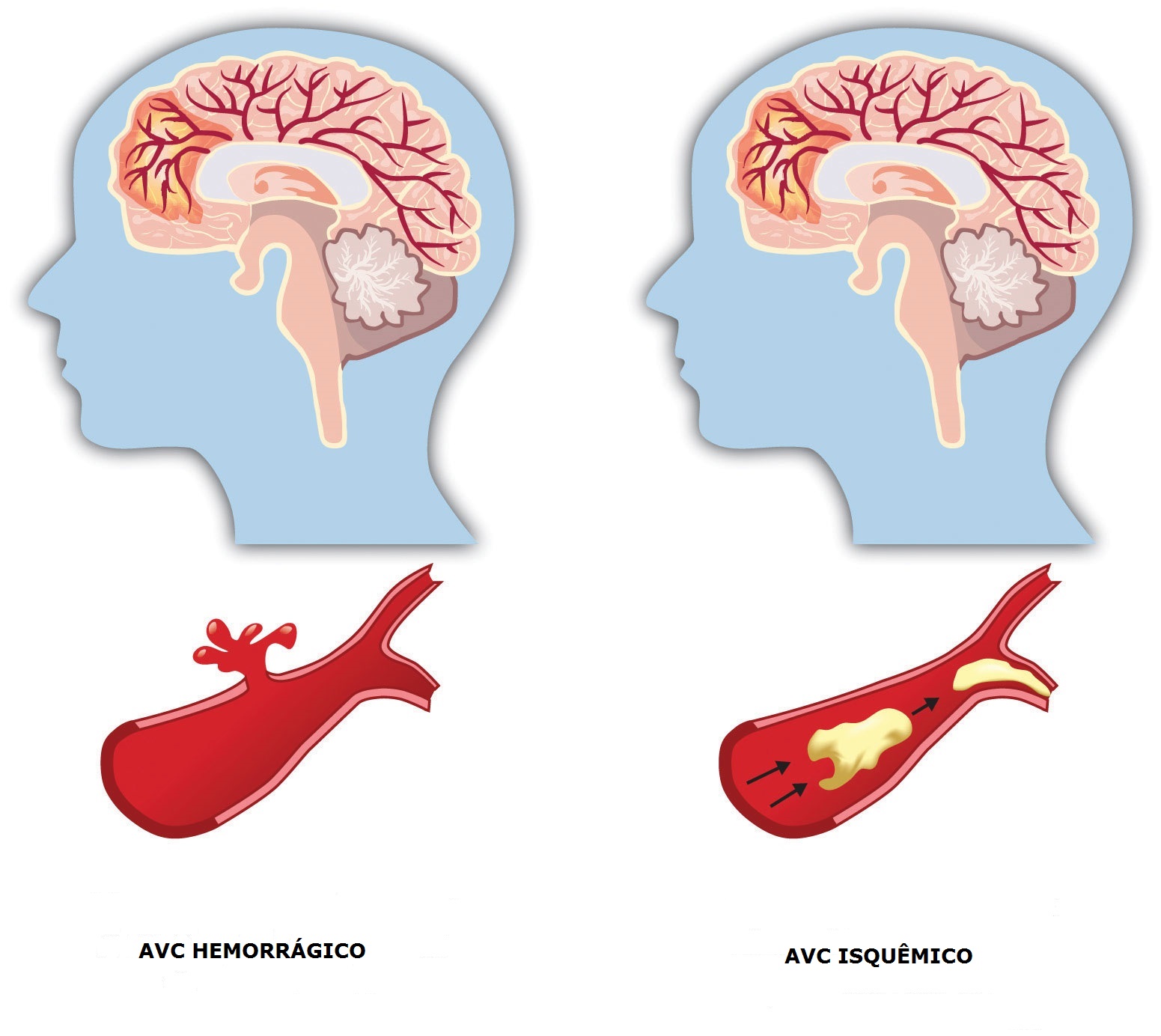
МЕТАБОЛИЧЕСКАЯ ТЕРАПИЯ ПРИ ИШЕМИЧЕСКОМ ИНСУЛЬТЕ | Завалий
1. Анацкая Л.Н. Инфаркт мозга у пациентов пожилого возраста. Журнал неврологии и психиатрии имени С.С. Корсакова. 2011; (8, Вып. 2: Инсульт):74–80.
2. Kulikov A., Abdrashitova G. Budget Impact Analysis of Cerebrolysin In The Treatment of Acute Ischemic Stroke of Moderate and Severe Degrees of Severity In The Russian Federation. Value Health. 2015; 18(7): A699. PMID: 26533918. doi: 10.1016/j.jval.2015.09.2612.
3. Ziganshina L.E., Abakumova T., Vernay L. Cerebrolysin for acute ischaemic stroke. Cochrane Database Syst Rev. 2016; 12: CD007026. PMID: 27918088. doi: 10.1002/14651858.CD007026.pub4.
4. Справочник Видаль.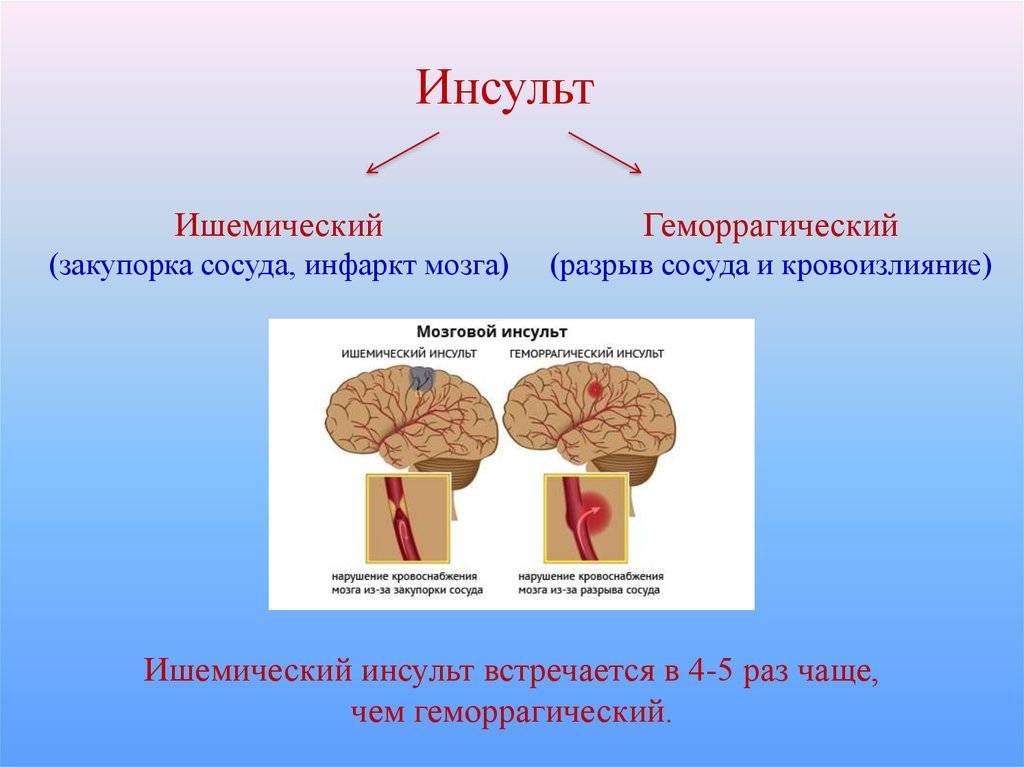 Лекарственные препараты в России — 2017. М.: Видаль Рус, 2017. 1240 с.
Лекарственные препараты в России — 2017. М.: Видаль Рус, 2017. 1240 с.
5. Яснецов В.В., Просвирова Е.П., Цублова Е.Г., и др. Сравнительное исследование противогипоксического, нейропротекторного и обезболивающего действия сукцинатсодержащих препаратов. Авиакосмическая и экологическая медицина. 2012; 46(6): 41–45.
6. Одинак М.М., Янишевский С.Н., Цыган Н.В., и др. Применение сук- цинатов для коррекции метаболических нарушений в зоне ишемической полутени у пациентов с инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113(12, Вып. 2: Инсульт): 55–60.
7. Скворцова В.И., Стаховская Л.В., Нарциссов Я.Р., и др. Рандомизи- рованное двойное слепое плацебо-контролируемое исследование эффективности и безопасности мексидола в комплексной терапии ишемического инсульта в остром периоде. Журнал неврологии и психиатрии им. С.С. Корсакова. 2006; (18, Вып.2: Инсульт): 47–54.
Журнал неврологии и психиатрии им. С.С. Корсакова. 2006; (18, Вып.2: Инсульт): 47–54.
8. Серёгин В.И., Дронова Т.В. Применение Мексидола в интенсивной терапии острого тяжелого ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115 (3, Вып. 2: Инсульт): 85–87.
9. Андрофагина О.В., Кузнецова Т.В., Светкина А.А. Мексидол в реабилитации больных в остром периоде ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115(12, Вып. 2: Инсульт): 77–79.
10. Киспаева Т.Т. Превентивно-терапевтическая коррекция формирования и прогрессирования когнитивного дефицита у перенесших инсульт пациентов. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113(7): 76–79.
11. Новикова Л.Б., Шарафутдинова Л.Р., Шарапова К.М. Применение Мексидола в остром периоде ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113(9): 83–85.
Новикова Л.Б., Шарафутдинова Л.Р., Шарапова К.М. Применение Мексидола в остром периоде ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113(9): 83–85.
12. Луцкий М.А. Анализ эффективности Мексидола в комплексном лечении больных с ишемическим инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2010; 110 (4, Вып.2: Инсульт): 57–59.
13. Курушина О.В., Барулин А.Е., Коновалова О.В. Коррекция психоэмоциональных и вегетативных нарушений у пациентов, перенесших ишемический инсульт. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113 (9, Вып.2: Инсульт 2): 50–54.
14. Щепанкевич Л.А., Николаев Ю.А., Долгова Н.А., Чипова Д.Т. Оптимизация липидснижающей терапии у пациентов с ишемическим инсультом и сахарным диабетом 2-го типа. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016; 116(2): 42–45.
Журнал неврологии и психиатрии им. С.С. Корсакова. 2016; 116(2): 42–45.
15. Ковальчук В.В. Нейрометаболическая терапия как средство вторичной профилактики инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; 114(3): 24–28.
16. Чефранова Ж.Ю., Макотрова Т.А., Удачин В.А., Колединцева Е.В. Оценка эффективности применения мексидола в сочетании с тромболитической терапией у больных с ишемическим инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012; 112(4): 49–52.
17. Цыган Н.В., Трашков А.П., Яковлева В.А., и др. Особенности регуляции нейротрофических механизмов при мозговом ишемическом инсульте. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115(7): 112–116.
18. Ковальчук В.В, Хафизова Т.Л., Галкин А.С. Применение нейро- метаболической терапии в составе комплексной реабилитации пациентов после инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; (11): 61–66.
Ковальчук В.В, Хафизова Т.Л., Галкин А.С. Применение нейро- метаболической терапии в составе комплексной реабилитации пациентов после инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; (11): 61–66.
19. Румянцева С.А., Силина Е.В., Цукурова Л.А., и др. Современные методы коррекции энергетического гомеостаза у пациентов пожилого и старческого возраста. Успехи геронтологии. 2014; 27(4): 746–752.
20. Румянцева С.А., Силина Е.В., Чичановская Л.В., и др. Эффективность антиоксидантной энергокоррекции при инфаркте головного мозга (результаты многоцентрового рандомизированного исследования). Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; 114(10): 49–55.
21. Чичановская Л.В., Цукурова Л.А., Коваленко А.Л., и др. Оценка эффективности комплексной цитопротекторной терапии разной длительности у больных инфарктом мозга. Экспериментальная и клиническая фармакология. 2015; 78(1): 21–26.
Экспериментальная и клиническая фармакология. 2015; 78(1): 21–26.
22. Каракулова Ю.В., Селянина Н.В., Желнин А.В., и др. Влияние антиоксидантной терапии на нейротрофины и процессы реабилитации после инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016; 116(8): 36–39.
23. Сазонов И.Э., Лаврентьева И.В., Головина Н.П. Применение Цитоф- лавина при реперфузионной терапии ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016; 116(3): 25–28.
24. Hassanein S.M., Deifalla S.M., El-Houssinie M., Mokbel S.A. Safety and Efficacy of Cerebrolysin in Infants with Communication Defects due to Severe Perinatal Brain Insult: A Randomized Controlled Clinical Trial. J. Clin. Neurol. 2016; 12(1): 79–84. PMID: 26365023. doi: 10.3988/ jcn. 2016.12.1.79.
2016.12.1.79.
25. Плавинский С.Л., Шабалкин П.И. Мета-анализ. Церебролизин, Кор- тексин, Целлекс: эффективность при сосудистой деменции, болезни Альцгеймера и ишемическом инсульте [Электронный ресурс]. Медицина. 2016; (2). Ссылка активна на 28.08.2017. URL: http://fsmj. ru/015231.html
26. Zhang L., Chopp M., Lu M., et al. Cerebrolysin dose-dependently improves neurological outcome in rats after acute stroke: A prospective, randomized, blinded, and placebo-controlled study. Int. J. Stroke. 2016; 11(3): 347-355. PMID: 26763925. doi: 10.1177/1747493015625645.
27. Xue L.X., Zhang T., Zhao Y.W., et al. Efficacy and safety comparison of DL-3-n-butylphthalide and Cerebrolysin: Effects on neurological and behavioral outcomes in acute ischemic stroke. Exp. Ther.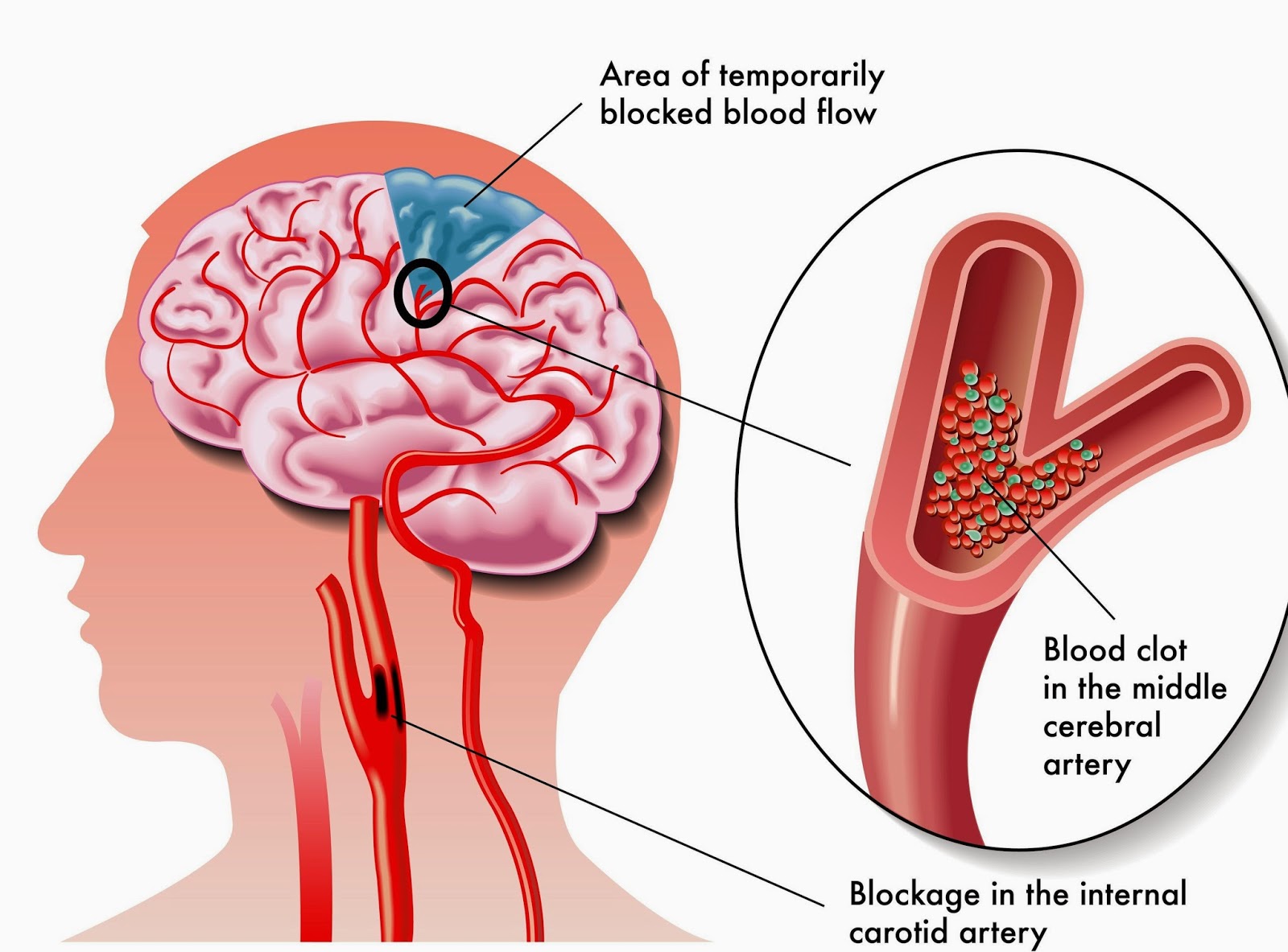 Med. 2016; 11(5): 2015-2020. PMID: 27168844. doi: 10.3892/etm.2016.3139.
Med. 2016; 11(5): 2015-2020. PMID: 27168844. doi: 10.3892/etm.2016.3139.
28. Heiss W.D., Brainin M., Bornstein N.M. et al. Cerebrolysin in patients with acute ischemic stroke in Asia: results of a double-blind, placebocontrolled randomized trial. Stroke. 2012; 43(3): 630–636. doi: 10.1161/STROKEAHA.111.628537.
29. Muresanu D.F., Heiss W.D., Hoemberg V., et al. Cerebrolysin and Recovery After Stroke (CARS): A Randomized, Placebo-Controlled, Double-Blind, Multicenter Trial. Stroke. 2016; 47(1): 151–159. PMID: 26564102. doi: 10.1161/STROKEAHA.115.009416.
30. Chang W.H., Park C.H., Kim D.Y., et al. Cerebrolysin combined with rehabilitation promotes motor recovery in patients with severe motor impairment after stroke. BMC Neurol. 2016; 16: 31. PMID: 26934986. doi: 10.1186/s12883-016-0553-z.
doi: 10.1186/s12883-016-0553-z.
31. Шишкова В.Н., Зотова Л.И., Малюкова Н.Г., и др. Оценка влияния терапии Церебролизином у пациентов с постинсультной афазией на уровень BDNF в зависимости от наличия или отсутствия нарушений углеводного обмена. Журнал невропатологии и психиатрии им. С.С. Корсакова. 2015; 115(5, Вып.1): 57–63.
32. Lang W., Stadler C.H., Poljakovic Z. et al. A prospective, randomized, placebo-controlled, double-blind trial about safety and efficacy of combined treatment with alteplase (rt-PA) and Cerebrolysin in acute ischaemic hemispheric stroke. Int. J. Stroke. 2013; 8(2): 95–104. PMID: 23009193. doi: 10.1111/j.1747-4949.2012.00901.x.
33. Nazari S., Mazdeh M., Taheri M. et al. A double-blind, placebo-controlled and randomized trial of Cerebrolysin in patients with acute ischemic stroke in Iran. Glob. Adv. Res. J. Med. Med. Sci. 2015; 4(5): 235–239.
Glob. Adv. Res. J. Med. Med. Sci. 2015; 4(5): 235–239.
34. Чуканова Е.И., Гусев Е.И., Белоусов Д.Ю. и др. Результаты многоцентрового рандомизированного контролируемого клинико-экономического исследования терапии острого периода ишемического инсульта Церебролизином. Качественная клиническая практика. 2011; (3): 14–37.
35. Amiri-Nikpour M.R., Nazarbaghi S., Ahmadi-Salmasi B. et al. Cerebrolysin effects on neurological outcomes and cerebral blood flow in acute ischemic stroke. Neuropsychiatr. Dis. Treat. 2014; (10): 2299–2306. PMID: 25516711. PMCID: PMC4263193. doi: 10.2147/NDT.S75304.
36. Куликов А.Ю., Абдрашитова Г.Т. Фармакоэкономический анализ лечения пациентов с ишемическим инсультом средней и тяжелой степени тяжести (с показателем более 12 баллов по шкале NIHSS). Фармакоэкономика: Теория и практика. 2015; 3 (4): С. 30–40.
Фармакоэкономика: Теория и практика. 2015; 3 (4): С. 30–40.
37. Алифирова В.М., Дадашев М.Н., Доронин Б.М. и др. Клиническая эффективность и фармакоэкономические характеристики нейропротекции низкими дозами Кортексина в терапии острого ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; 114(4): 41–46.
38. Стаховская Л.В., Мешкова К.С., Дадашева М.Н. и др. Многоцентровое рандомизированное проспективное двойное слепое плацебо- контролируемое исследование безопасности и эффективности кортексина в остром и раннем восстановительном периоде ишемического инсульта. Вестник Российской Военно-медицинской академии. 2012; № 1(37): 238–244.
39. Белова Л.А., Машин В.В., Абрамова В.В., и др. Эффективность Кор- тексина в остром и восстановительном периодах полушарного ишемического инсульта. Журнал невропатологии и психиатрии им. С.С. Корсакова. 2016; 116(10): 38–42.
Журнал невропатологии и психиатрии им. С.С. Корсакова. 2016; 116(10): 38–42.
40. Белова Л.А., Машин В.В., Абрамова В.В., и др. Динамика когнитивных нарушений у больных с полушарным ишемическим инсультом в остром и раннем восстановительном периодах на фоне низко- дозной нейропротекции препаратом Кортексин. Журнал невропатологии и психиатрии им. С.С. Корсакова. 2016; 116(8, Вып. 2: Инсульт): 40–43. doi: 10.17116/jnevro20161168240-43.
41. Белова Л.А., Машин В.В., Абрамова В.В., и др. Влияние Кортексина на качество жизни в раннем восстановительном периоде полушарного ишемического инсульта. Клиническая медицина. 2016; 94(2): 138–143.
42. Дьяконов М.М., Шабанов П.Д. Многолетний опыт низкодозирован- ной пептидной нейропротекции в медицине. Вестник Казахского Национального медицинского университета.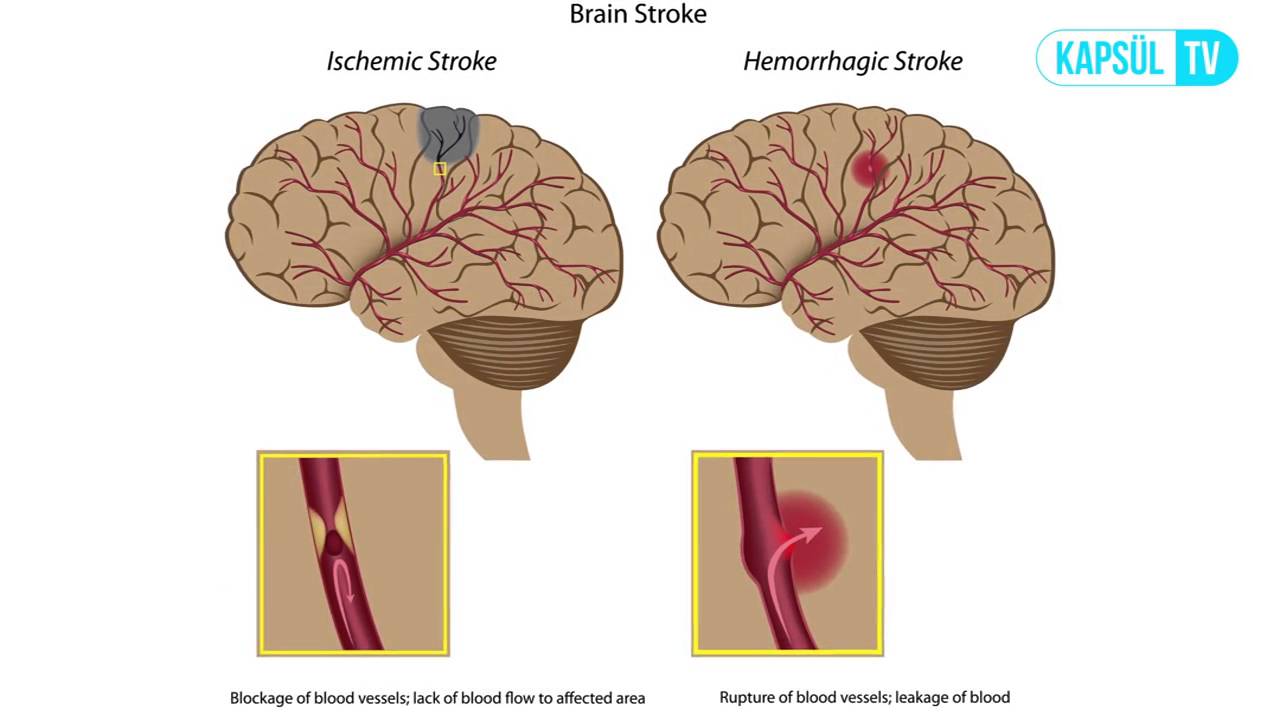 2015; (2): 371–373.
2015; (2): 371–373.
43. Евзельман М.А., Александрова Н.А. Когнитивные расстройства и их коррекция у пациентов с ишемическим инсультом. Журнал Неврологии и Психиатрии им. С.С. Корсакова. 2013; 113(10): 36–39.
44. Зырянов С.К., Стаховская Л.В., Гильдеева Г.Н., Мешкова К.С. Клинико-экономический анализ эффективности Кортексина у больных с полушарным ишемическим инсультом в остром и раннем восстановительном периоде в условиях специализированных сосудистых центров. Вестник Российской Военно-медицинской академии. 2012. (3): 69–74.
45. Яворская В.А., Фломин Ю.В., Гребенюк А.В. Цитиколин при остром инсульте: механизм действия, безопасность и эффективность (научный обзор). Международный неврологический журнал. 2011; 2: 98–104.
46. Álvarez-Sabín J., Román G.C. The Role of Citicoline in Neuroprotection and Neurorepair in Ischemic Stroke. Brain Sci. 2013; 3(3): 1395– 1414. PMID: 24961534. PMCID: PMC4061873. doi: 10.3390/ brainsci3031395.
Álvarez-Sabín J., Román G.C. The Role of Citicoline in Neuroprotection and Neurorepair in Ischemic Stroke. Brain Sci. 2013; 3(3): 1395– 1414. PMID: 24961534. PMCID: PMC4061873. doi: 10.3390/ brainsci3031395.
47. Старчина Ю.А. Применение препарата Церетон в неврологической практике. Неврология, нейропсихиатрия, психосоматика. 2011; (2): 81–85.
48. Одинак М.М., Вознюк И.А., Пирадов М.А., и др. Многоцентровое (пилотное) исследование эффективности Глиатилина при остром ишемическом инсульте. Анналы клинической и экспериментальной неврологии. 2010; (1): 20–28.
49. Виноградов О.И., Даминов В.Д., Рыбалко Н.В. Применение Холина Альфосцерата (Глиатилин) у пациентов с ишемическим инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113(1): 43–45.
50. Мищенко Т.С., Мищенко В.Н., Лапшина И.А. Глиатилин в лечении постинсультных больных. Международный Неврологический Журнал. 2016; 4(82): 25–31.
51. Мищенко В.Н., Лапшина И.А. Глиатилин в лечении больных в восстановительном периоде мозгового инсульта. Международный Неврологический Журнал. 2011; 5(43): 101–108.
52. Ончул Л. Глиатилин: современный взгляд на проблему холинергической терапии в лечении ишемического инсульта. Медицина неотложных состояний. 2015; 7(70): 53–55.
53. Amenta F., Carotenuto A., Fasanaro A.M., et al. The ASCOMALVA (Association between the Cholinesterase Inhibitor Donepezil and the Cholinergic Precursor Choline Alphoscerate in Alzheimer’s Disease) Trial: interim results after two years of treatment. J. Alzheimers. Dis. 2014; 42 (Suppl. 3): S281–288. PMID: 24898643. doi: 10.3233/JAD140150.
J. Alzheimers. Dis. 2014; 42 (Suppl. 3): S281–288. PMID: 24898643. doi: 10.3233/JAD140150.
54. Guekht A., Skoog I., Edmundson S., et al. ARTEMIDA Trial (A Randomized Trial of Efficacy, 12 Months International Double-Blind Actovegin): A Randomized Controlled Trial to Assess the Efficacy of Actovegin in Poststroke Cognitive Impairment. Stroke. 2017; 48: 1262–1270. PMID: 28432265. PMCID: PMC5404405. doi: 10.1161/ STROKEAHA.116.014321.
55. Meilin S., Machicao F., Elmlinger M. Treatment with Actovegin improves spatial learning and memory in rats following transient forebrain ischaemia. J. Cell. Mol. Med. 2014; 18(8): 1623–1630. PMID: 24797227. PMCID: PMC4190908. doi: 10.1111/jcmm.12297.
56. Якупов Э.З., Налбат А.В. Показатели вегетативного гомеостаза как предикторы индивидуального риска развития инсульта и их динамика на фоне лечения Актовегином. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115 (10, Вып.2: В помощь практическому врачу): 31–42. doi: 10.17116/jnevro201511510231- 42.
Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115 (10, Вып.2: В помощь практическому врачу): 31–42. doi: 10.17116/jnevro201511510231- 42.
57. Ершов В.И. Сравнительные аспекты применения нейропротек- торов при ведении больных с ишемическим инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011; 111 (8, Вып. 2: Инсульт): 41–44. PMID: 22224244.
58. Cкopoмeц А.А., Ковальчук В.В. Медикаментозная реабилитация пациентов после инсульта. Международный Неврологический Журнал. 2007. 2(12): 9–12.
59. Ижбульдина Г.И. Изменения в системе гемостаза и свободнора- дикальное окисление липидов в острой стадии ишемического инсульта у пациентов с нейропротективной терапией. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012; 112 (3, Вып. 2: Инсульт): 31–37.
60. Кузнецова Е.Б., Салина Е.А., Шоломов И.И. Возможность лечения когнитивных нарушений в комплексной терапии больных с последствиями инфаркта головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115 (11): 103–106.
61. Кухтевич И.И., Алешина Н.И., Левашова О.А. Активная нейропро- тективная терапия острого каротидного ишемического инсульта средней степени тяжести. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; 114 (12, Вып. 2: Инсульт): 38–42.
62. Lo E.H. A new penumbra: transitioning from injury into repair after stroke. Nat Med. 2008; 14(5): 497–500. PMID: 18463660. doi: 10.1038/ nm1735.
63. Павлов И.Э. Осторожно: Актовегин, Солкосерил, Кортексин, Церебролизат! [Электронный ресурс]. 2012. Ссылка активна на 28.08.2017. URL: http://www.medkrug.ru/blog/display_entry/54283
2012. Ссылка активна на 28.08.2017. URL: http://www.medkrug.ru/blog/display_entry/54283
Диагностика и лечение инсульта › МРТ КТ Хмельницкий Медицинский центр «Ультрадиагностика»
|
МРТ головного мозга |
1250 грн. |
|
МРТ ангиография сосудов головы |
1000 грн. |
| КТ головного мозга | 700 грн. |
| КТ ангиография сосудов головы с контрастом | 1900 грн. |
| Прием (осмотр, консультация, назначение лечения) — Степанюк Людмила Владимировна — врач — невролог высшей категории. Ведущий в Украине врач по инсульту. | 300 грн. |
ВСЕ ЦЕНЫ
Своевременная и правильная диагностика инсульта позволяет эффективно бороться с возможными последствиями и осложнениями, а также снижает риск повторных острых нарушений мозгового кровообращения, что, увы, не редкость.
Корректная диагностика инсульта головного мозга позволяет быстро определить истинную причину недомогания. Многие проявления недомогания, возможные при инсульте, могут свидетельствовать об опухолях головного мозга, транзитных ишемических атаках, передозировке наркотических средств. Чтобы исключить все побочные причины, важно правильно установить диагноз.
Современной аппаратуре под силу диагностика ишемического инсульта. Существуют также методы, которые быстро определяют наступление геморрагического поражения сосудов головного мозга. Важно суметь правильно и быстро определить, о каком инсульте идёт речь. От правильной диагностики инсульта головного мозга зависит оперативность выбора нужной схемы лечения, что крайне важно при таком серьёзном заболевании.
Информативными методами диагностики являются магнитно-резонансная томография (МРТ) и компьютерная томография (КТ). Каждый из них поможет определить очаги распространения инсульта и дать чёткую характеристику поражения.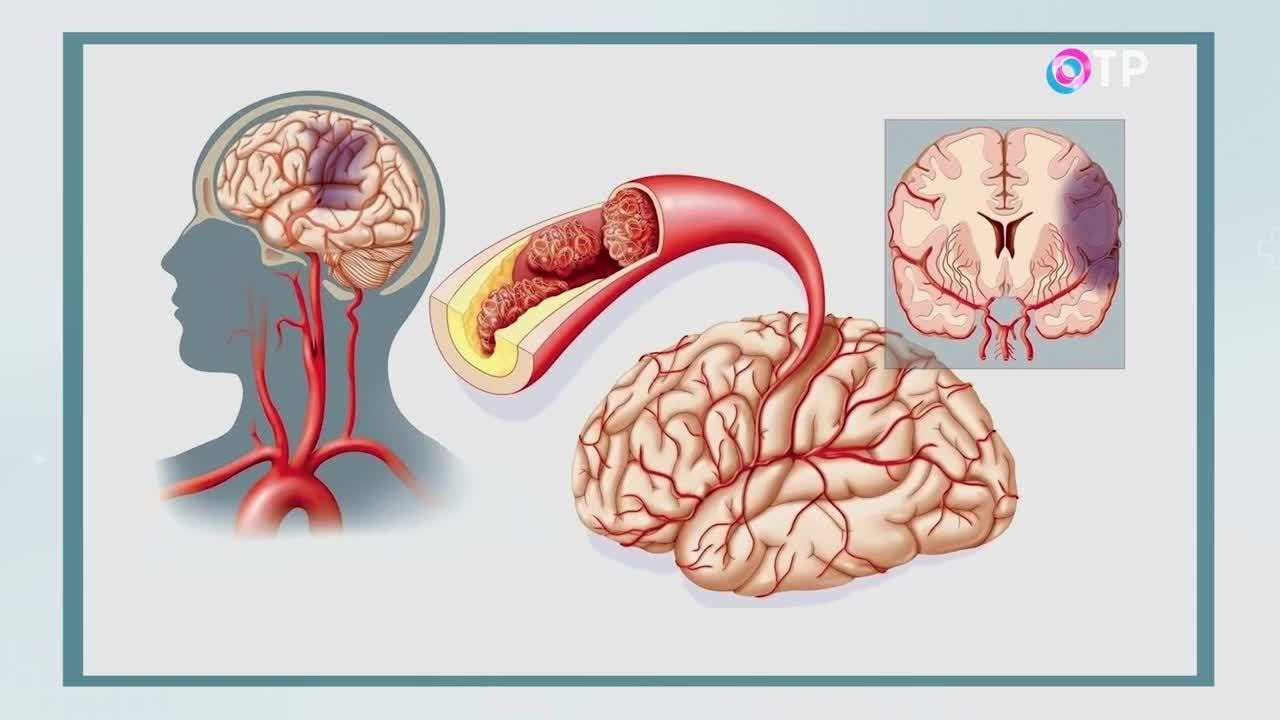
Диагностика и лечение инсультов при помощи МРТ и КТ
Диагностика, проведенная на аппаратах КТ и МРТ при инсульте, позволяют разграничить ишемические, геморрагические и субарахноидальные поражения. В зависимости от причин, предшествующих нарушению мозгового кровообращения, различают:
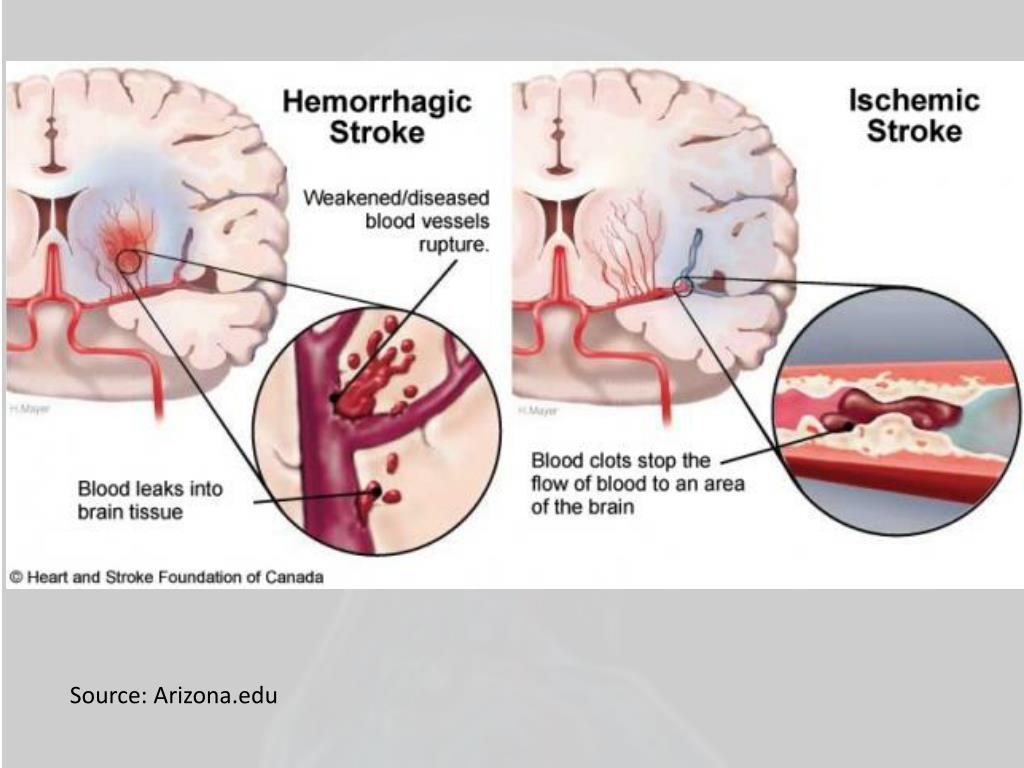
- Ишемический инсульт (повреждение ткани мозга).
При отсутствии полноценного насыщения тканей мозга кислородом наступает гипоксия того или иного отдела. Мозговая ткань размягчается, что ведет к инфаркту мозга.
При ишемическом типе инсульта применение МРТ в 80 — 90% случаев точно определяет участки гиперинтенсивности уже через 4-6 часов от момента начала мозговой катастрофы. В следующие часы, до двух суток область гиперинтенсивности расширяется ещё бльше. При МР-ангиографии уже в первые часы на томограммах видны признаки обескровливания вокруг ишемической зоны, что подтверждает факт инсульта.
В отличие от МРТ, при КТ признаки инфаркта в виде зон пониженной плотности определяются в половине случаев только через 12 часов от начала развития ишемического инсульта.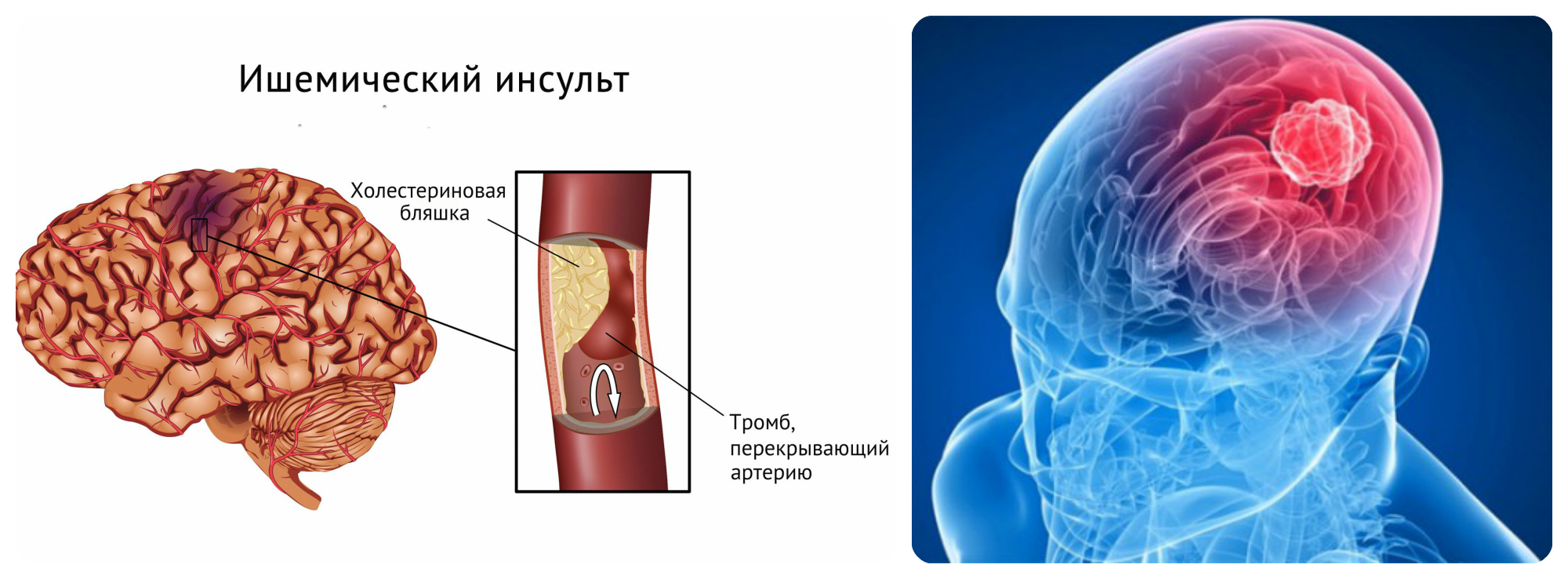 Причем очаги в стволе головного мозга и лакунарные инфаркты определяются только посредством КТ с введением контрастирующих препаратов.
Причем очаги в стволе головного мозга и лакунарные инфаркты определяются только посредством КТ с введением контрастирующих препаратов.
Таким образом, МРТ представляет собой метод, который более эффективным на ранних стадиях диагностики лакунарного инфаркта, чем КТ.
- Геморрагический инсульт (нетравматическое внутримозговое кровоизлияние).
При остро возникшем нетравматическом поражении мозга врачом должно быть быстро и последовательно решено, относиться ли данное нарушение к инсульту и если да, то к какому виду инсульта. Найти правильный ответ и поставить верный диагноз поможет КТ исследование.
Уже спустя шесть, максимум десять часов с момента геморрагического инсульта на КТ визуализируется очаг повышенной плотности, где и находится кровоизлияние. А менее чем через полсуток после случившегося геморрагического инсульта, вокруг больших очагов кровоизлияний может распознать признаки отёка, которые видно, как овал пониженной плотности.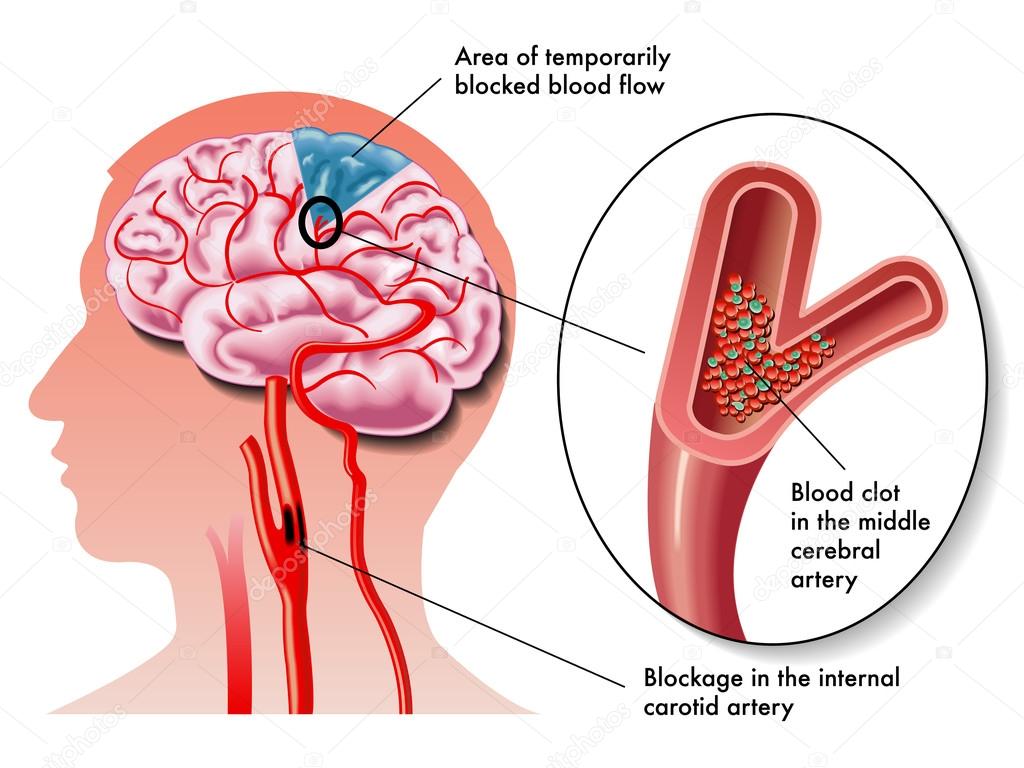
Данные МРТ в первые часы после геморрагического инсульта не позволяют выявить его, так как МРТ не улавливает сигналы от крови так хорошо, как от белого вещества. На более поздних сроках магнитно-резонансная томография при геморрагическом инфаркте обнаруживает месторасположение очага и объём сосудистых аномалий, что позволяет отказаться от классической ангиографии с использованием контрастных веществ.
Данные КТ и МРТ в сочетании с показателями степени тяжести состояния больных, являются факторами, определяющими необходимость хирургических вмешательств после геморрагического инсульта.
- Субарахноидальное кровоизлияние (острое нарушение кровообращения мозга).
Субарахноидальное кровоизлияние в очаге поражения диагностируются посредством компьютерной и магнитно-резонансной томографии, в особенности КТ с контрастным усилением и МР-ангиографией, у 95% пациентов в течение ближайшей половины суток. Такие исследования позволяют установить месторасположение и объём кровоизлияния, а также проникновение крови в вещество головного мозга.
В поздние сроки МРТ информативнее, чем КТ. Повторные исследования на МРТ позволяют судить о динамике сужения сосудов, осложнений, а также о сроках формирования ишемических очагов и их объеме. Результаты МРТ являются одним из двух определяющих ориентиров для решения вопроса о возможном оперативном (хирургическом) лечении субарахноидальных кровоизлияний, обусловленных разрывом артериальных аневризм и артериовенозных мальформаций. Вторым ориентиром является тяжесть состояния больного.
- Острое нарушение мозгового кровообращения, которое вы даже не заметите (Микроинсульт)
Микроинсульт, обладающий менее выраженной симптоматикой, так же опасен для жизни человека, как и лакунарный. По сути, это тот же инсульт, но затронувший менее значительные сосуды в очаге и протёк без видимых пациенту последствий. Микроинсульт — тревожный звонок к тому, что сосудистая система в будущем может дать такой сбой, который уже не пройдет незамеченным.
Единственными признаками случившегося микроинсульта бывают асимметрия лица, нарушения зрения. Человек может внезапно начать бессвязно говорить, заикаться, не реагировать на вопросы окружающих.
Человек может внезапно начать бессвязно говорить, заикаться, не реагировать на вопросы окружающих.
МРТ является единственным действенным диагностическим инструментом в поиске микроинсультов. Оно способно показать точечные кровоизлияния в мозг. Одновременно проводится обследование сердечно-сосудистой системы, так как патология этих органов является причиной микроинсульта.
Помимо диагностики типа инсульта, классические методы КТ и МРТ дают возможность отличить острое нарушение кровообращения головного мозга (инсульт) от опухолей, абсцессов головного мозга, посттравматических эпидуральных и субдуральных гематом.
Новые медицинские технологии помогут улучшить лечение инсульта — Российская газета
Инсульт, или острое нарушение мозгового кровообращения, не случайно называют сосудистой катастрофой. Порой на фоне полного благополучия тромб попадает в сосуд, который питает головной мозг, или возникает резкий спазм такого сосуда — и человек в считаные часы погибает или остается инвалидом.
Многие считают, что это болезнь пожилых. Но это далеко не так — около 20 процентов «мозгового удара» происходит у людей моложе 50 лет, треть из них трудоспособного возраста, зафиксированы случаи инсульта у совсем молодых мужчин и женщин и даже у детей.
В последние годы многое сделано для оказания экстренной помощи больным, страдающим сердечно-сосудистыми заболеваниями. Кардиологическая служба стала работать эффективнее, появился целый спектр новых препаратов, в регионах созданы сосудистые центры, вошли в практику даже городских больниц такие методы лечения острого инфаркта, как стентирование и аорто-коронарное шунтирование. В результате врачи отмечают, что пациентов с инфарктом стало меньше, но с инсультом их становится больше. Исходы этого заболевания уже много лет остаются неблагоприятными: до 40 процентов больных умирает в течение первого года после инсульта, около 80 процентов навсегда остаются инвалидами. Ежегодно в мире инсульт переносят более 15 миллионов человек. В нашей стране ежегодно возникает более полумиллиона случаев острых нарушений мозгового кровообращения. Россия занимает второе место в мире по количеству инсультов, впереди нас — только Болгария. И в ближайшие годы существенного снижения заболеваемости инсультом специалисты не прогнозируют. Что с этим делать?
Россия занимает второе место в мире по количеству инсультов, впереди нас — только Болгария. И в ближайшие годы существенного снижения заболеваемости инсультом специалисты не прогнозируют. Что с этим делать?
Ведущим методом лечения ишемического инсульта (когда нарушается кровообращение в сосудах головного мозга) остается тромболитическая терапия — лечение препаратами, которые могут «растворить» образовавшийся в сосуде тромб. Но его эффективность зависит от того, насколько быстро больному будет оказана помощь. «Терапевтическое окно», как его называют специалисты, невелико — максимум 4,5 часа с момента развития инсульта. Если помощь вовремя не оказана, эта возможность исчезает.
Однако в медицинской практике существуют и другие методы лечения острого нарушения мозгового кровообращения — например, механическая тромбоэкстракция. Суть его в том, что закупоривший просвет сосуда тромб можно удалить с помощью специальных катетеров, которые вводятся в сосуд. В сравнении с тромболитической терапией тромбоэкстракция является даже более эффективной, для ее проведения терапевтическое окно больше, у метода меньше противопоказаний и осложнений. Однако в российских больницах этот метод распространен мало. Основная причина — низкий тариф на этот вид лечения, установленный на федеральном уровне.
Однако в российских больницах этот метод распространен мало. Основная причина — низкий тариф на этот вид лечения, установленный на федеральном уровне.
Механическая тромбоэкстракция — дорогостоящая процедура, важно, чтобы у больницы была возможность ее выполнить
«Механическая тромбоэкстракция — это дорогостоящая процедура, и очень важно, чтобы у больницы была возможность ее выполнить», — подчеркнул на встрече с журналистами, которую провела Ассоциация международных производителей медицинских изделий IMEDA, главный внештатный специалист по рентгенэндоваскулярным диагностике и лечению Минздрава Московской области , заведующий отделением рентгенэндоваскулярной хирургии МОНИКИ им. Владимирского» Борис Гегенава.
Инвазивные методики есть и для лечения стеноза, то есть сужения артерий, питающих кровью головной мозг. Но все они требуют сложной и недешевой медицинской техники, которая позволяет контролировать ход вмешательства и обеспечивает безопасность пациента. Такая техника нуждается и в соответствующей подготовке медицинского персонала, и сервисном обслуживании, и бесперебойных поставках расходных материалов и инструментов. Большинству региональных систем здравоохранения на это недостает средств. Но не только в этом дело. Внедрению перспективных методов мешают и неотработанная логистика доставки пациентов с инсультом в хирургические стационары, где владеют методом, и недостаточная подготовка врачей «скорой помощи» и сосудистых хирургов, и просто нехватка информации для пациентов.
Большинству региональных систем здравоохранения на это недостает средств. Но не только в этом дело. Внедрению перспективных методов мешают и неотработанная логистика доставки пациентов с инсультом в хирургические стационары, где владеют методом, и недостаточная подготовка врачей «скорой помощи» и сосудистых хирургов, и просто нехватка информации для пациентов.
«Новые технологии — это всегда дорого, а здравоохранение находится в рамках ограниченного бюджета, — согласна и начальник отдела развития и внешних коммуникаций «Центра экспертизы и контроля качества медицинской помощи» Минздрава России Нурия Мусина. — Поэтому появилось такое направление, как оценка технологий здравоохранения (ОТЗ), которая позволяет оценить как клинические, так и экономические, и социальные последствия внедрения новой технологии. В нашей стране эта процедура применяется в обязательном порядке только в отношении лекарств. Однако новые дорогостоящие медицинские изделия, их также необходимо подвергать оценке для принятия правильных и прозрачных решений о финансировании».
Эксперты центра провели клинико-экономическое исследование метода тромбэкстракции, которое показало, что в перспективе затраты на внедрение этой технологии полностью окупаются. Уменьшается смертность, снижается уровень инвалидизации, а самое главное — перенесшие инсульт люди сохраняют трудоспособность. В целом внедрение метода снижает экономическое бремя, не говоря уже о ценности самой жизни и здоровья для конкретного человека и его семьи.
Инсульт:Причины, диагностика и лечение — ПроМедицина Уфа
Инсульт является острым нарушением мозгового кровообращения, развивающимся стремительно – от нескольких минут до нескольких часов – и влечет за собой гибель нервных клеток от кислородного голодания.
В зависимости от причины инсульта, его разделяют на три типа:
- геморрагический,
- ишемический,
- субарахноидальный.
В медицинской статистике преобладает инсульт по ишемическому типу (70–85%), когда происходит сдавливание или закупорка сосудов в результате тромбоза, эмболии или других заболеваний сосудов, сердца или крови.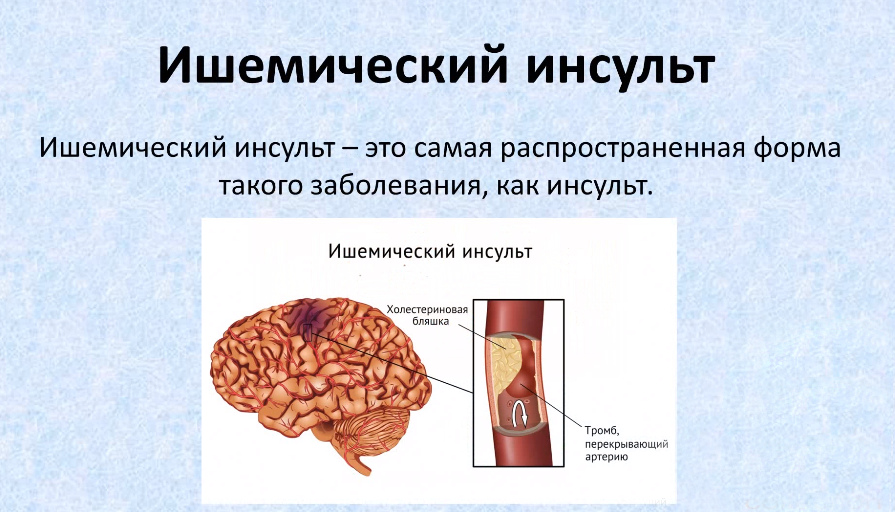
В отличие от ишемического инсульта, где имеет место сдавливание сосудов, при геморрагическом типе (20–25%) происходит их разрыв с последующим кровоизлиянием в мозг, под его оболочки или в желудочки. Реже всего (1–7%) встречается субарахноидальный инсульт, который имеет травматическую природу: по причине разрыва артериальной аневризмы или черепно-мозговой травмы. При нем происходит кровоизлияние в пространство между паутинной и мягкой оболочками мозга.
Инсультом считают приступ, при котором неврологический дефицит (очаговый или общемозговой) длится более суток, этот период называют преходящими нарушениями кровоснабжения головного мозга. Состояние, при котором неврологические функции восстанавливаются в течение трех недель, обозначают малым инсультом.
Причины
К наиболее распространенным причинам возникновения инсультов можно отнести:
- полную обтурацию или сужение артерий головного мозга;
- разрыв сосуда головного мозга;
- заболевания крови;
- изменения сосудов головного мозга вследствие их воспаления;
- артериальную гипертензию и гипертонический криз.

В группе риска находятся больные, страдающие сахарным диабетом, инфарктом миокарда, ревматическими пороками сердца, нарушением проводимости сердца, нарушением сердечного ритма,атеротическим кардиосклерозом, гипертонической болезнью, хроническим алкоголизмом,табакокурением, чрезмерной массой тела.
Симптомы
Основные симптомы инсульта:
- Нарушения движения, прежде всего в конечностях. Снижение силы или полное прекращение движений в руках или ногах;
- Чувствительные нарушения: снижение или выпадение восприятия боли, температуры и т.д. обычно наиболее заметные в конечностях;
- Нарушения зрения. Например, может выпадать половина зрения (левая или правая) одного глаза;
- Нарушения речи: невнятная, нечеткая речь, полная невозможность говорить или понимать речь;
- Нарушения стояния: в положении стоя больной качается и может упасть;
- Нарушение сознания: от сонливости до полной потери сознания.

Менее важными симптомами, часто встречаемыми и при других заболеваниях являются: головная боль (может быть при мигрени), головокружение (часто бывает при заболевании уха), мышечные судороги (эпилепсия).
Если у человека внезапно появились вышеописанные симптомы, необходимо заподозрить развитие инсульта и срочно проконсультироваться с врачом.
Диагностика
Определяется три этапа установления диагноза при инсульте. В первую очередь необходимо отличить инсульт от других патологических состояний у больного, при которых поражается мозг. После этого устанавливают, какой именно тип инсульта имеет место. Третий этап – определение того, где локализируется кровоизлияние. Для определения типа инсульта необходимо провести лабораторные анализы, биохимические исследования, а также исследование спинномозговой жидкости. При необходимости проводится ряд дополнительных исследований.
Лечение
Для того чтобы лечение инсульта проводилось по правильной схеме, лечащий врач в первую очередь определяет, в каком состоянии на данный час пребывают жизненно важные функции больного. Речь идет о дыхании и кровообращении. При наличии проблемных моментов в работе этих систем или присутствии других состояний, имеющих неотложный характер, сначала принимаются все меры для предотвращения таких проблем и нормализации работы указанных систем. И только после этого врач выясняет тип инсульта и назначает лечение.
Речь идет о дыхании и кровообращении. При наличии проблемных моментов в работе этих систем или присутствии других состояний, имеющих неотложный характер, сначала принимаются все меры для предотвращения таких проблем и нормализации работы указанных систем. И только после этого врач выясняет тип инсульта и назначает лечение.
Лечение инсульта назначается в зависимости от того, каков его тип. Если диагностирован ишемический инсульт, то все усилия в первую очередь будут направлены на восстановление кровообращения в головном мозге. В случае геморрагического инсульта важно снизить кровяное давление и остановить кровотечение в черепе или в мозге.
Также в процессе лечения инсульта проводится сосудистая терапия, назначаются лекарственные средства, которые стимулируют мозговой обмен. Также проводится кислородотерапия. После основного курса лечения следует длительная восстановительная терапия.
Реабилитация после инсульта проводится с использованием целого ряда действенных методов. Это курсы массажа, физиолечение, специальная лечебная физкультура.
Это курсы массажа, физиолечение, специальная лечебная физкультура.
Важно настроиться на длительный период реабилитации после инсульта, и некоторые функции у человека могут восстановиться только частично.
Отделение нейрореанимации для пациентов с инсультом в Городской клинической больнице Москвы 67 имени Л.А.Ворохобова
ОТДЕЛЕНИЕ НЕЙРОРЕАНИМАЦИИ ДЛЯ ПАЦИЕНТОВ С ИНСУЛЬТОМ
Попов Дмитрий Александрович
ВЕДУЩИЙ ВРАЧ
Квалификационная категория вторая.
Стаж работы – 6 лет.
В 2010 году окончил ГБОУ ВПО Первый Московский Государственный
медицинский Университет им. И.М. Сеченова, специальность «лечебное дело».
2010-2011г. клиническая ординатура по анестезиологии и реаниматологии
на кафедре ПМГМУ им. И. М. Сеченова.
С 2011 года работает в должности врача анестезиолога-реаниматолога в 1 отделении анестезиологии
и реанимации ГБУЗ ГКБ № 67 им. Л. А. Ворохобова.
Контакты отделения:
+7 (495) 530-30-55 — заведующий
+7 (495) 530-30-55 — ординаторская
Правила посещения родственниками пациентов отделений анестезиологии-реанимации:
Скачать
Памятка для посетителей отделения анестезиологии-реанимации
Скачать
Отделение нейрореанимации ГКБ №67 является подразделением Регионального Сосудистого центра. Мы оказываем специализированную высококвалифицированную помощь в острейшем периоде инсульта – пациентам с транзиторными ишемическими атаками, ишемическими инсультами, внутримозговыми кровоизлияниями, субарахноидальными кровоизлияниями (как спонтанными гипертензивными, так и на фоне патологии сосудов головного мозга).
Мы применяем современные методы обследования, которые позволяют детально исследовать состояние вещества головного мозга, сосудов головного мозга, исключить патологию сердечно-сосудистой системы, свертывающей системы крови. К ним относятся компьютерная томография (КТ), магнитно-резонансная томография (МРТ), методы исследования сосудов головного мозга (КТ-ангиография, МР-ангиография, дигитальная субтракционная ангиография), триплексное ангиосканирование магистральных сосудов головы, эхокардиография, холтеровское мониторирование, суточное мониторирование артериального давления, развернутое исследование системы гемостаза.
К ним относятся компьютерная томография (КТ), магнитно-резонансная томография (МРТ), методы исследования сосудов головного мозга (КТ-ангиография, МР-ангиография, дигитальная субтракционная ангиография), триплексное ангиосканирование магистральных сосудов головы, эхокардиография, холтеровское мониторирование, суточное мониторирование артериального давления, развернутое исследование системы гемостаза.
До 60% случаев ишемических нарушений мозгового кровообращения развиваются из-за того, что сосуд, несущий кровь к головному мозгу, закрывается в результате образования тромба или эмбола, на фоне атеросклероза или эмболии. Приоритетным направлением в лечении ишемических инсультов является тромболитическая терапия – то есть введение препарата, который разрушает кровяной сгусток, закупоривающий сосуд, а также улучшает кровоток по микрососудам. Этот метод устраняет саму причину нарушения мозгового кровообращения. К сожалению, он имеет ряд ограничений, из которых наиболее важное – сроки применения. Начать тромболитическую терапию можно только в пределах 4,5 часов от появления симптомов инсульта и только при ишемическом инсульте. При своевременном начале лечения (первые 4,5 часа с момента развития симптомов) у многих пациентов отмечается значимое улучшение вплоть до полного регресса симптоматики.
Все неврологи отделения имеют многолетний опыт ведения неврологических пациентов. Принципы обследования и лечения соответствуют международным рекомендациям по ведению пациентов с острыми нарушениями мозгового кровообращения. Наши специалисты участвуют в российских и международных научных конференциях и семинарах, на которых докладывают результаты собственных научных исследований и сложные клинические случаи. Кроме того, врачи принимали участие в неврологических курсах и стажировались в России, Франции, Чехии, Австрии, Германии, Испании, получив возможность обучаться у специалистов международного уровня.
В состав Регионального сосудистого центра также входит отделение нейрохирургии, в котором проводится хирургическое лечение при наличии показаний (удаление гематом головного мозга, декомпрессивная краниотомия). Налажено тесное сотрудничество со специалистами в области сосудистой хирургии, благодаря чему пациентам проводят такие операции, как каротидная эндартерэктомия, стентирование внутренней сонной артерии, клипирование аневризм сосудов головного мозга.
Каждый пациент в отделении нейрореанимации курируется неврологом и анестезиологом-реаниматологом. В условиях многопрофильного стационара это позволяет осуществлять междисциплинарный подход к лечению каждого больного.
Отделение нейрореанимации работает с декабря 2015 г, рассчитано на 12 коек.
Ведение острого ишемического инсульта
Реферат
Цели:
Краткий «синтетический» обзор современного состояния лечения острого ишемического инсульта.
Источники данных:
Имеющаяся литература на PubMed.
Выбор исследования:
Мы выбрали знаковые исследования, недавние клинические испытания, обсервационные исследования и профессиональные руководства по ведению инсульта, включая последние 10 лет.
Извлечение данных:
Были определены подходящие исследования, и результаты, приведшие к рекомендациям, были обобщены.
Обобщение данных:
Смертность от инсульта снижалась за последние 6 десятилетий, и в результате инсульт переместился со второй на пятое место среди причин смерти в Соединенных Штатах. Эта тенденция может последовать за недавними достижениями в лечении инсульта, которые подчеркивают важность раннего распознавания и ранней реваскуляризации. Недавние исследования показали, что раннее распознавание, экстренное интервенционное лечение острого ишемического инсульта и лечение в специализированных центрах по инсульту могут значительно снизить связанные с инсультом заболеваемость и смертность.Однако инсульт остается второй ведущей причиной смерти во всем мире и причиной номер один приобретенной длительной инвалидности, приводящей к ежегодному глобальному экономическому бремени.
Выводы:
Надлежащее лечение ишемического инсульта имеет важное значение для снижения смертности и заболеваемости. Лечение инсульта включает междисциплинарный подход, который начинается и выходит за рамки госпитализации.
Ключевые слова: отек головного мозга, полутень, вторичное повреждение нейронов
Лечение острого ишемического инсульта (ОИИ) включает междисциплинарный подход, который более чем когда-либо требует участия специалиста по интенсивной терапии.До 1990-х годов варианты лечения ОИС были ограничены и в основном были сосредоточены на симптоматическом лечении, вторичной профилактике и реабилитации. С тех пор в этой области произошла революция за счет двух основных представлений. Первым революционным нововведением, которое радикально изменило лечение острого инсульта на основе знаменательного исследования Национального института неврологических заболеваний и инсульта (NINDS), было одобрение Федерального управления лекарственных средств (FDA) на внутривенный тканевый активатор плазминогена (IV-tPA) в 1995 году (1 ).IV-tPA оставался основой лечения в течение примерно 2 десятилетий до 2015 года, когда более сложные клинические испытания показали надежные результаты эндоваскулярной терапии (EVT) (2). В отделении интенсивной терапии дополнительные стратегии, направленные на оптимизацию физиологии пациента, могут взаимодействовать между сортировкой и / или реваскуляризацией и выпиской на реабилитацию.
РАННЕЕ ОБНАРУЖЕНИЕ
Ишемический инсульт может произойти как в сообществе, так и в больнице и должен быть признан посторонними лицами и / или поставщиками медицинских услуг. Раннее распознавание активирует цепочку выживания, специфичную для инсульта ( таблица ) (3).Инсульт — это клинический диагноз, и некоторые особенности клинической картины пациента могут быть использованы для идентификации пациентов с инсультом ( таблица ). Системы неотложной медицинской помощи играют ключевую роль в обнаружении, сортировке и транспортировке пациентов, перенесших инсульт, в приемные учреждения.
ТАБЛИЦА 1.
8 этапов лечения инсульта
| Обнаружение: включает распознавание признаков и симптомов острого инсульта (BEFAST, таблица) |
| Отправка: активация служб неотложной медицинской помощи.В большинстве случаев это включает вызов службы 911 или инсультной бригады |
| Доставка: означает оперативную транспортировку пациента в больницу, предпочтительно в инсультный центр, или в больницу для дальнейшей оценки инсультной бригадой |
| Дверь: относится к прибытию пациента в отделение неотложной помощи. Согласно рекомендациям Национального института неврологических расстройств и инсульта, оценка должна быть завершена врачом неотложной помощи в течение 10 минут после прибытия в ED |
| Данные: Сбор данных включает результаты лабораторных тестов, а также физических и неврологических обследование (шкала инсульта Института неврологии) |
| Решение: информация, такая как тип инсульта, последний нормальный вид инсульта и время появления симптомов, рассматривается до принятия решения о лечении |
| Лекарственное средство / устройство : Фибринолитическая терапия назначается в течение 4 мес.5 часов от появления симптомов. Даже если пациент не является кандидатом на фибринолиз, он все равно может претендовать на эндоваскулярную терапию для механического удаления сгустка |
| Решение: рекомендуется, чтобы пациенты были госпитализированы в отделение интенсивной терапии или инсульт в течение 3 часов после прибытия в отделение неотложной помощи |
ТАБЛИЦА 2.
BEFAST, Обнаружение инсульта
| Баланс, резкое или внезапное начало потери равновесия или координации |
| Глаза, нечеткое или нечеткое зрение, двоение в глазах и предпочтение взгляда |
| Слабость или асимметрия лица |
| Слабость рук и / или ног |
| Проблемы с речью / невнятность речи |
| Время — это мозг, пора активировать систему удара и часы удара |
ПРЕГОСПИТАЛЬНЫЙ УПРАВЛЕНИЕ
Рабочие процессы и организованные системы оказания помощи могут эффективно сократить задержки во времени до лечения ( Рис.). С развертыванием мобильных инсультных отделений (MSU), оснащенных компьютерными томографами и каналами телемедицины, распознавание пациентов и назначение лечения могут быть более точными и эффективными. Недавние исследования показали, что внедрение MSU привело к более высоким показателям и сокращению времени до введения IV-tPA и времени от двери до иглы по сравнению с обычным транспортом скорой помощи в отделения неотложной помощи (ED) (4–8). Теоретически начало лечения внутримозгового кровоизлияния (ICH), такое как контроль артериального давления и отмена антикоагуляции, также может быть осуществлено на догоспитальном этапе.В дополнение к клиническому обследованию с использованием обычных шкал, таких как шкала инсульта Неврологического института здоровья (NIHSS), были успешно подтверждены несколько догоспитальных шкал и быстрое распознавание тяжелых инсультов с окклюзией крупных сосудов (LVO) ( таблица ) (9).
ТАБЛИЦА 3.
Шкала быстрой оценки артериальной окклюзии
| Паралич лица: отсутствует (0), легкий (1) и средний (2) |
| Нарушение моторики руки: от нормального до легкого (0), умеренная (1) и тяжелая (2) |
| Нарушение моторики ног: от нормального до легкого (0), среднего (1) и тяжелого (2) |
| Отклонение головы / взгляда: отсутствует (0) и присутствует (1) |
| Афазия: выполняет задачи правильно (0), выполняет одну задачу правильно (1) и не выполняет ни одной задачи (2) |
| Агнозия: распознает свою руку и дефицит (0), распознает его / ее рука, но нет или дефицит (1), и не распознает его / ее руку или дефицит (2) |
Организация инсультных центров.EVT = эндоваскулярная терапия, IV tPA = IV тканевый активатор плазминогена.
ОТДЕЛЕНИЕ ЧРЕЗВЫЧАЙНЫХ СИТУАЦИЙ, ИНСУЛЬТАРНЫЕ ГРУППЫ И КОД ИНСУЛЬТА
Бригада по инсульту может оказывать круглосуточные услуги пациентам с инсультом. Такая команда состоит из врачей, специализирующихся в области экстренной медицины, сосудистой неврологии / нейрохирургии и радиологов; поставщики медицинских услуг, медсестры, клинические фармацевты, терапевты и технические специалисты; и лабораторный персонал (10). В ЭД эффективность и точность распознавания синдромов инсульта могут быть выполнены с помощью телемедицины (11).В исследовании удаленной оценки инсультной бригады с использованием цифровой камеры наблюдения (STRokE-DOC) двусторонняя аудиовизуальная консультация превосходила телефонную консультацию в точном определении пациентов, перенесших инсульт, что приводило к более высокому уровню внутривенного введения tPA с аналогичной долей в ICH. но без влияния на общий функциональный результат (11). В новую эру реканализации AIS с LVO (12) системы телемедицины помогли улучшить распознавание пациентов с инсультом, нуждающихся в эндоваскулярной терапии, что привело к лучшим функциональным результатам и качеству жизни (13–16).
NEUROIMAGING
Обычная неконтрастная компьютерная томография может быть реализована на догоспитальном уровне в специализированных MSU. Неконтрастная компьютерная томография обладает достаточной чувствительностью, чтобы исключить геморрагический инсульт, такой как субарахноидальное кровоизлияние или ICH. Оценка ранней компьютерной томографии (ASPECTS) программы инсульта Альберты была разработана для определения тяжести инфаркта средней мозговой артерии (СМА) с использованием неконтрастной компьютерной томографии головы. Один балл вычитается из максимальной оценки 10 за любой признак ранней ишемии в каждой из 10 предопределенных зон (диапазоны 0–10) (17) ( Рис.). Пациент с высокой оценкой быстрой артериальной окклюзии / NIHSS и нормальным внешним видом мозга или ASPECTS более 6 (рис. A ) означает, что инфаркт, возможно, не наступил и что можно применять стратегии реваскуляризации. Ранние признаки инфаркта на КТ или более низких уровнях ASPECTS обычно связаны с плохим прогнозом и геморрагической конверсией (рис. B ). В соответствии с действующими инструкциями, время до КТ и предоставления предварительных данных должно составлять менее 20 минут. КТ-ангиография (КТ-А) может эффективно обнаружить LVO и предоставить полезную информацию об анатомии сосудов пациента и этиологии инсульта ( Рис.) (18). Основываясь на ее быстром освоении, многие учреждения теперь включают технологию CT-перфузии (CT-P) для оценки церебрального кровотока (CBF) путем количественного анализа пороговых значений времени до максимума (T-max) транзита и объемов церебральной крови. Количественная оценка ишемического «ядра» (CBF <30%) и оценка «полутени» или ткани, подверженной риску (T-max> 6 с), могут предоставить немедленную информацию для принятия решения о лечении. Клинические испытания показали, что соотношение несоответствия перфузии ядро / полутень превышает 1.8 может указывать на право на получение EVT ( рис. ) (19, 20). Пороги CT-P для прогнозирования инфаркта зависят от времени от появления симптома инсульта до визуализации, времени от визуализации до реперфузии и качества реперфузии (21). С этой целью процесс, который включает расширенную визуализацию с помощью CT-A / CT-P или MRI, не должен задерживать внутривенный тромболизис или EVT.
Оценка ранней компьютерной томографии программы инсульта Альберты (ASPECTS). Подсчет очков для каждой из 10 зон. Каждой зоне присваивается оценка 1 (нормальная) или 0 (ненормальная).Сумма всех зон дает АСПЕКТЫ. A , нормальный вид мозга с ASPECTS = 10. B , мозг с ишемическими изменениями и ASPECTS менее 6. C = хвостатый, Ic = внутренняя капсула, In = кора островка, M = средняя мозговая артерия, P = скорлупа.
КТ-ангиография, демонстрирующая резкую окклюзию левой средней мозговой артерии пациента ( стрелка ). L = левый, R = правый.
Анализ соотношения несоответствия мозгового кровотока (CBF) путем количественного анализа пороговых значений времени до максимального (T-max) прохождения у пациента с окклюзией правой средней мозговой артерии.CBF цвета темно-серый и T-max светло-серый . Соотношение более 1,8 обычно указывает на право на эндоваскулярную терапию. RAPID = быстрая обработка системы анализа перфузионных и диффузионных изображений.
РЕВАСКУЛЯРИЗАЦИЯ
Основной целью расширенного лечения инсульта является реваскуляризация и ограничение вторичного нейронального повреждения. Для некоторых пациентов теперь доступны внутривенный тромболизис и EVT.
Внутривенный тромболизис
Первое знаменательное клиническое испытание, продемонстрировавшее безопасность и эффективность внутривенного tPA в 1995 году, превратило лечение АИС из чисто симптоматического в очень срочный вопрос.Это показывает, что если в / в-tPA вводят в течение первых 3 часов с момента появления симптомов, вероятность того, что пациенты будут иметь минимальную инвалидность или вообще не будет через 90 дней, по крайней мере на 30% выше. Разница в смертности между IV-tPA и группой плацебо была незначительной, несмотря на увеличение симптоматических кровотечений в группе лечения (1). Хотя до недавнего времени IV-tPA был единственным методом лечения AIS, использование IV-tPA составляло всего 3,2–5,2% всех пациентов с AIS в США (22). Одной из основных причин низкой скорости лечения является ограниченное время для IV-tPA.Основываясь на европейском исследовании «Тромболизис с помощью альтеплазы через 3–4,5 часа после острого ишемического инсульта» (ECASS-3), Американская кардиологическая ассоциация / Американская ассоциация инсульта (AHA / ASA) увеличили окно внутривенного введения tPA с 3 до 4,5 часов в 2009 г. критерии исключения (22–24). Это расширение увеличило использование IV-tPA до 20% (25).
Недавно проведенные клинические испытания показали, что визуализация, а не известное время начала (в последний раз было нормальным) может помочь клиницистам лечить пациентов с использованием временных расхождений, показывающих острый инсульт.Данные европейского многоцентрового клинического исследования «Тромболизис под контролем МРТ при инсульте с неизвестным временем начала» (WAKE-UP) предполагают, что почти 50% инсультов с пробуждением и дневных инсультов с неизвестным началом являются кандидатами IV-tPA при использовании критериев MRI 26). Однако стоимость, время, затрачиваемое на проверку металла, и часто большое расстояние до сканера — явные ограничения для его реализации. В клиническом исследовании тромболизиса под контролем перфузионной визуализации до 9 часов после начала инсульта (EXTEND) визуализация CT-P использовалась для оценки соответствия критериям для внутривенного введения tPA и показала, что эффективность и безопасность внутривенного tPA может увеличиваться до 9 часов, а реваскуляризация может длиться до 24 часов (27).
Тенектеплаза, новый тромболитический агент с высокой специфичностью к фибриногену и длительным периодом полувыведения, позволяющий вводить его в виде одного болюса, дал многообещающие результаты в недавних клинических испытаниях. Сравнение тенектеплазы и альтеплазы перед тромбэктомией при ишемическом инсульте (EXTENT-IA-TNK) продемонстрировало, что введение тенектеплазы приводило к более высокой скорости реперфузии и лучшему функциональному результату, чем альтеплаза, у пациентов с AIS, подходящих для EVT (28, 29). Тенектеплаза, по-видимому, столь же эффективна с таким же профилем побочных эффектов, как и альтеплаза, при использовании у пациентов без LVO (30, 31).Однако в настоящее время тенектеплаза не одобрена FDA для внутривенного тромболизиса у пациентов с AIS и не имеет того же уровня рекомендаций AHA / ASA, что и альтеплаза. Это могло бы объяснить, почему многие учреждения не приняли тенектеплазу в качестве тромболитика при АИС.
Эндоваскулярная терапия
Одобрение FDA IV-tPA внесло новшества во всю область неотложной неврологии. Однако до 69% пациентов с инсультом не имеют права на внутривенное введение ТАП из-за позднего обращения в больницу (32, 33).За последние 3 года временной интервал для лечения AIS расширился благодаря EVT и предоставил врачам более сильный терапевтический арсенал. Успех EVT измеряется степенью или качеством реваскуляризации. Шкала тромболизиса при инфаркте мозга (TICI) — это инструмент для стандартизации различных степеней реперфузии: от отсутствия перфузии (TICI 0) до полной перфузии (TICI 3) ( таблица ) (34). Оценка TICI от 2B до 3 обычно считается успешной реперфузией.Предыдущие исследования не показали улучшенных результатов с EVT и уменьшили первоначальный оптимизм в отношении вмешательства для AIS (35–37). Тем не менее, дизайн этих клинических испытаний подвергся критике за то, что они не требовали подтверждения изображения LVO, использовали более старые технологии для извлечения сгустков и имели длительный инсульт до времени прокола. С 2015 года многочисленные испытания показали эффективность EVT в дополнение к стандартной медицинской помощи в улучшении общего исхода у пациентов с AIS с окклюзией проксимальной СМА или внутренней сонной артерии (ICA), когда EVT проводилась в течение 6 часов (20, 38–41). ), Через 8 часов (42) или 12 часов (43) с момента появления симптомов.Объединенный метаанализ продемонстрировал, что современный EVT более чем в два раза увеличивает шансы на лучший функциональный результат по сравнению со стандартной терапией без каких-либо существенных различий в смертности или риске паренхиматозного кровоизлияния через 90 дней (2). Из 100 пациентов, получавших EVT, у 38 был лучший функциональный результат, чем при стандартной медицинской помощи. Число пациентов, нуждающихся в лечении (NNT), по крайней мере, для одного пациента, для которого требуется снижение на 1 балл по модифицированной шкале Рэнкина (mRS), составляет 2,6. Преимущество EVT остается существенным, если рассматривать только подгруппу пациентов, получавших IV-tPA до тромбэктомии, и, следовательно, EVT следует продолжать после введения IV-tPA.Также предполагается, что не следует отказываться от EVT только на основании возраста, и пациенты старше 80 лет также могут получить пользу от EVT (12). Два недавних клинических испытания показали, что временное окно может быть увеличено до 24 часов после появления симптома, если есть либо несоответствие между клиническим дефицитом и размером инфаркта, либо несоответствие перфузии на изображениях (19, 44). Эти испытания уводят нас от произвольного ограничения времени на часах и меняют наше представление о такте и «биологических часах».В большинстве этих исследований средний NIHSS составлял 16 или больше, и необходимы дальнейшие клинические испытания для изучения эффективности EVT при LVO, проявляющемся как незначительные инсульты (NIHSS <5).
ТАБЛИЦА 4.
Тромболизис по шкале инфаркта мозга
| Оценка | Рентгенографические характеристики |
|---|---|
| 0 | Нет перфузии за пределами точки окклюзии |
| 1 | Контраст проходит через обструкцию, но не позволяет визуализировать все церебральное русло за точкой обструкции |
| 2 | Частичная перфузия. Контраст проходит через препятствие и визуализирует церебральное русло за препятствием. Однако поток контраста в дистальное русло медленнее, чем в других сосудах без закупорки |
| 2A | Визуализируется только <2/3 всей сосудистой территории |
| 2B | Полная визуализация сосудистой территории, но с более медленной наполнение больше обычного |
| 3 | Полная перфузия.Вся сосудистая территория визуализируется с нормальным потоком |
УПРАВЛЕНИЕ ОИТ
Оксигенация и вентиляция
Дополнительный кислород может потребоваться, если сатурация пациента менее 94%. Быстрое неврологическое ухудшение и последующая потеря сознания с нарушением рефлексов, поддерживающих дыхательные пути, требуют окончательного контроля дыхательных путей. Неспособность распознать неизбежную потерю дыхательных путей может привести к таким осложнениям, как аспирация, гипоксемия и гиперкапния, что может привести к вторичному повреждению нейронов.Было показано, что гипербарический кислород либо не оказывает эффекта, либо вреден для пациентов с ОИС, и его следует избегать (45). Для пациентов с ОИС в критическом состоянии с дыхательной недостаточностью и невозможностью отлучения от аппарата ИВЛ может потребоваться длительная трахеостомия. Польза ранней трахеостомии спорна, но в настоящее время изучается в рамках проспективного клинического исследования «Ранняя трахеостомия у вентилируемых пациентов с инсультом 2» (SETPOINT-2) (ClinicalTrials.gov: {«type»: «клиническое испытание», «attrs»: {» text «:» NCT02377167 «,» term_id «:» NCT02377167 «}} NCT02377167).
Кровяное давление
Как часть ауторегуляции головного мозга, кровяное давление обычно повышается во время острой фазы AIS, увеличивая перфузию в ишемизированных областях (46, 47). Однако тяжелая артериальная гипертензия может привести к геморрагической трансформации инфаркта, гипертонической энцефалопатии, а также сердечно-легочным и почечным осложнениям. Текущие руководящие принципы AHA / ASA рекомендуют разрешающую гипертензию с целевым артериальным давлением ниже или равным 220/120 мм рт. Ст. В течение первых 24–48 часов.Тем не менее, эти переменные артериального давления применимы только в том случае, если пациенту не проводится какое-либо острое вмешательство, такое как IV-tPA или EVT. Если пациент получает внутривенное введение tPA, увеличивается риск геморрагической трансформации, и артериальное давление должно быть снижено до менее или равного 185/110 мм рт. после введения в / в-tPA (48). Реперфузионное повреждение и геморрагическая трансформация вызывают беспокойство в случае EVT; таким образом, артериальное давление необходимо тщательно контролировать во время и после ЭВТ.Ретроспективное когортное исследование предлагает поддерживать целевое значение MAP 70–90 мм рт. Ст. Во время EVT для улучшения функционального результата (49). Текущие рекомендации AHA / ASA рекомендуют артериальное давление после EVT не ниже 180/105 мм рт. Ст. (48). Однако в этом руководстве не учитывается степень реперфузии, достигаемая во время ЭВТ. У пациентов с успешной реканализацией, определяемой как TICI 2b и TICI 3, оптимальное послеоперационное артериальное давление может быть ниже, чем указано в руководствах, чтобы минимизировать риск реперфузионного повреждения и ICH.Было показано, что умеренный контроль артериального давления с целевым систолическим артериальным давлением, меньшим или равным 160 мм рт.ст., снижает частоту ВЧГ и смертности при успешном достижении ЭВТ (50). Anadani et al (51) продемонстрировали, что диапазон артериального давления после процедуры от 121 до 140 мм рт. Ст. Был связан с улучшенным функциональным результатом по сравнению с более высоким артериальным давлением, если у пациентов была успешная реканализация. Учитывая эти данные, представляется, что артериальное давление после ЭВТ следует индивидуализировать в зависимости от степени реканализации.
Гипотонию и гиповолемию следует избегать и корректировать у пациентов с AIS. Этиологии гипотонии в идеале следует устранять с помощью неинвазивных методов, таких как ультразвуковое исследование в месте оказания медицинской помощи. При коррекции гиповолемии следует избегать применения гипотонических растворов из-за риска увеличения отеков. Польза лекарственной гипертензии до конца не установлена, поэтому рандомизированное многоцентровое клиническое исследование безопасности и эффективности терапевтически индуцированной гипертензии при остром некардиоэмболическом ишемическом инсульте (SETIN-HYPERTENSION) (ClinicalTrials.gov: {«type»: «клиническое испытание», «attrs»: {«text»: «NCT01600235», «term_id»: «NCT01600235»}} NCT01600235) направлено на определение безопасности и эффективности фенилэфрина у пациентов с некардиоэмболическими заболеваниями. Инсульт.
Гликемический контроль
Доказательства указывают на то, что стойкая внутрибольничная гипергликемия в течение первых 24 часов после АИС связана с худшими исходами по сравнению с нормогликемией из-за множества потенциальных механизмов, таких как эндотелиальная дисфункция, повышенный окислительный стресс и нарушение фибринолиза.Однако в клинических испытаниях сети инсулиновых инсулинов при инсульте (SHINE), финансируемых NINDS, протокол интенсивного внутривенного введения инсулина для достижения системной глюкозы между 80 и 130 мг / дл не был связан с благоприятными исходами через 90 дней по сравнению со стандартным режимом инсулина. по «скользящей шкале», чтобы поддерживать уровень глюкозы в пределах от 80 до 180 мг / дл (52). Интенсивный протокол инсулина был связан со значительными гипогликемическими событиями и более высоким уровнем лечения. С этой целью целесообразно лечить гипергликемию для достижения уровня глюкозы в крови в диапазоне 140–180 мг / дл и тщательно контролировать, чтобы предотвратить гипогликемию у пациентов с AIS.
Отек головного мозга
Крупные инфаркты СМА или ВСА связаны с высокой заболеваемостью до 80%. Пациенты с инфарктом большого полушария (LHI) подвержены повышенному риску отека мозга и быстрого неврологического ухудшения, что привело к термину «злокачественный инфаркт MCA» (MMI) (53). Гипоплотность, наблюдаемая более чем на 50% территории СМА (рис. B ), или объем инфаркта более 145 см3 в течение 14 часов после ИКТ являются наиболее надежными предикторами злокачественного течения с повышенным внутричерепным давлением, грыжей и потребностью для декомпрессивной гемикраниэктомии (ДГК) (54).Окончательным вмешательством для снижения повышенного внутричерепного давления и предотвращения образования грыжи при ЛГИ со значительным отеком является хирургическая декомпрессия с помощью DHC. В трех европейских клинических испытаниях оценивалась польза DHC у пациентов в возрасте 60 лет и младше (55–57). Объединенный анализ этих исследований показал, что DHC не только снижает смертность на 50%, но и улучшает долгосрочные функциональные результаты (58). NNT для предотвращения смерти — 2 (mRS = 6), тогда как NNT для предотвращения смерти и инвалидности от самой тяжелой до умеренно тяжелой — 4 (mRS = 4–6).Доля живых пациентов с минимальной и средней степенью инвалидности (mRS = 0–3) увеличилась с 21% до 43%. С другой стороны, DHC привел к снижению абсолютного риска смерти на 49% и к абсолютному увеличению доли пациентов с оценкой mRS = 2 из 12%, mRS = 3 из 10% и mRS = 4 из 29% (58 ).
Клиническое исследование DE-компрессионной хирургии для лечения злокачественного инфаркта средней мозговой артерии (DESTINY-II) оценивало исходы DHC у пациентов старше 60 лет.Он продемонстрировал, что DHC увеличивает вероятность выживания, но большинство выживших имели значительные нарушения (mRS = 4–5) (59). Во всех этих испытаниях DHC выполняли в течение 48 часов, и в настоящее время нет никаких указаний на «выжидательную стратегию» (например, ожидание неврологического ухудшения или рентгенологического сдвига средней линии). Тем не менее, идеальное время для DHC все еще неясно, и необходимы дополнительные данные, включая стандартизованное медицинское управление. Кроме того, остается спорным, что такое определение благоприятного функционального результата и какая степень инвалидности считается приемлемой.Дополнительные хирургические вмешательства, которые могут проводиться у пациентов с ОИС в критическом состоянии, включают дренаж наружного желудочка для лечения гидроцефальной и субокципитальной краниэктомии при инфаркте задней черепной ямки / мозжечка с опасным для жизни отеком мозга.
В отличие от трех европейских испытаний DHC, финансируемое NINDS клиническое испытание Гемикраниэктомия и дуротомия после ухудшения состояния по сравнению с исследованием отека, связанного с инфарктом (HeADFIRST), не обнаружило преимущества DHC в отношении смертности или заболеваемости по сравнению со стандартизированным подходом к лечению, которое включало нормогликемию. (глюкоза <200 мг / дл), пермиссивная гипернатриемия (натрий <155 мэкв / дл) и гиперосмолярная терапия (60).Это поднимает вопрос, следует ли опробовать консервативный подход до DHC.
Данных о применении гиперосмолярной терапии при ММИ немного, и доказательства снижения ВЧД в основном экстраполируются из литературы о черепно-мозговой травме. Несмотря на отсутствие четких доказательств в отношении MMI, гиперосмолярная терапия маннитом или гипертоническим раствором (HTS) была предложена для уменьшения цитотоксического отека (61, 62). Нет окончательных данных о том, превосходит ли один гиперосмолярный агент другой, и при выборе можно руководствоваться их индивидуальными побочными эффектами.Возможными осложнениями применения HTS являются перегрузка жидкостью, отек легких, гипокалиемия, сердечные аритмии, гиперхлоремический метаболический ацидоз, острое повреждение почек и дилюционная коагулопатия (63, 64). Чтобы избежать отека, уровень HTS следует постепенно снижать, и уровень натрия в сыворотке никогда не должен падать более чем на 10–12 мэкв / л в течение 24 часов (63, 65). Возможные осложнения маннита включают острое повреждение почек, гипотензию из-за диуреза, отскок ВЧД, электролитный дисбаланс (гипо- / гипернатриемия) и кислотно-щелочные нарушения.
Глибурид, сульфонилмочевина, вводимая внутривенно, была предложена в качестве потенциального агента для лечения отека мозга из-за его ионных свойств в канале меластатин-4 рецептор сульфонилмочевины-1-переходный потенциал рецептора меластатина-4 в нейронах, астроцитах и эндотелии. Недавнее клиническое исследование безопасности и эффективности внутривенного глибурида при отеке мозга после инфаркта большого полушария (GAMES-RP) продемонстрировало существенное снижение отека мозга и сдвига средней линии без влияния на результаты (66).В настоящее время проводится спонсируемое промышленностью исследование фазы 3 по оценке эффективности и безопасности внутривенного введения BIIB093 (глибенкламида) при тяжелом отеке мозга после инфаркта большого полушария (CHARM), в котором проверяется аналогичная гипотеза с глибенкламидом сульфонилмочевины (ClinicalTrials2895).
Лихорадка и целевая модуляция температуры
Наблюдательные исследования продемонстрировали пагубное влияние лихорадки на все показатели исходов после инсульта (67, 68). Оказывается, эффект лихорадки (температура ядра [Tc]> 37.5 ° C) уместно для пациентов с тяжелой травмой головного мозга в отделении интенсивной терапии (69). Клинические исследования показали потенциальный эффект терапевтической гипотермии (Tc, 34–35 ° C) на лечение отека головного мозга и внутричерепной гипертензии. В одном исследовании оценивалось влияние целевой температурной модуляции на смертность и неврологический исход у пациентов с ИГН, но не было выявлено различий с тенденцией к лучшему функциональному результату (70). Недавно было проведено крупнейшее рандомизированное клиническое испытание терапевтической гипотермии после ишемического инсульта. Европейское многоцентровое рандомизированное клиническое испытание III фазы терапевтической гипотермии плюс лучшее медикаментозное лечение vs.Только лучшее медицинское лечение острого ишемического инсульта (EURO-HYP) было прекращено на основании безрезультатности. Аналогичным образом, исследование «ДЕкомпрессивная хирургия плюс гипотермия при инсульте, занимающем пространство» (DEPTH-SOS), в котором использовались терапевтическая гипотермия и DHC после LHI, было преждевременно прекращено на основании причинения вреда в группе терапевтической гипотермии (71). Текущее рандомизированное клиническое исследование «Воздействие профилактики лихорадки у пациентов с повреждениями головного мозга» (INTREPID) проверяет гипотезу о том, что ранняя профилактика лихорадки для достижения нормотермии (Tc = 37 ° C) после инсульта связана с улучшенными результатами (ClinicalTrials.gov: {«тип»: «клиническое испытание», «attrs»: {«текст»: «NCT02996266», «term_id»: «NCT02996266»}} NCT02996266). Хотя имеется мало данных высокого качества в поддержку контроля лихорадки после ишемического инсульта, рекомендуется, чтобы пациенты с тяжелой травмой головного мозга и лихорадкой, не поддающейся лечению, получали некоторую степень профилактики лихорадки во время пребывания в отделении интенсивной терапии (72).
Реабилитация
Считается, что ранняя мобилизация имеет большое значение для максимального функционального восстановления и независимости после АИС.Модели на животных показали, что нейропластичность и корковая реорганизация, способствующие функциональному улучшению, достигают пика через 7–14 дней после инсульта и длятся около 1 месяца (73). Считается, что ранняя реабилитация еще больше усиливает эту динамическую фазу после инсульта и помогает пациентам обрести механизмы компенсации оставшейся инвалидности. Данные показывают, что даже у пациентов в отделении интенсивной терапии ранняя реабилитация и интенсивность реабилитационных сеансов были связаны с лучшим функциональным результатом (74). Тем не менее, оптимальная интенсивность и сроки ранней мобилизации остаются неопределенными.Клиническое испытание фазы III A по очень ранней реабилитации после инсульта (AVERT) продемонстрировало, что очень ранняя мобилизация (<24 часов после инсульта) с частыми и продолжительными сеансами реабилитации приводила к снижению благоприятного исхода. Однако анализ реакции на дозу показал, что короткие и частые мобилизации могут быть полезными на раннем этапе после острого инсульта, тогда как длительные сеансы вне постели снижают шансы на хороший результат (75). Кроме того, необходимы рандомизированные контролируемые испытания, чтобы прояснить эти неопределенности.
Nutrition
Как и в случае со всеми тяжелобольными неврологическими пациентами, энтеральное питание следует начинать в течение 48 часов, чтобы избежать катаболизма белков и недостаточности питания. Назодуоденальный зонд с малым диаметром отверстия может снизить риск аспирации. У пациентов с АИС необходимо обязательно оценить функцию речи и глотания, чтобы определить необходимость длительного энтерального питания с чрескожной кишечной гастростомией.
Модификация фактора риска (вторичная профилактика)
Классификация подтипа / этиологии AIS основана на определениях, используемых в многоцентровом исследовании Org 10172 по лечению острого инсульта, и включает следующее: 1) атеросклероз крупных артерий, 2) кардиоэмболия, 3) окклюзия мелких сосудов, 4) инсульт другой установленной этиологии и 5) инсульт неустановленной этиологии (криптогенный) (76).Тщательное обследование, включающее визуализацию сосудов, МРТ, трансторакальную эхокардиограмму с оценкой пузырьков (для оценки шунта), липидную панель и гемоглобин A1C, среди прочего, необходимо для определения основной этиологии и адаптации соответствующей вторичной профилактики инсульта. Антитромбоцитарная терапия — важный краеугольный камень лечения для предотвращения инсульта и транзиторных ишемических атак (ТИА). Чаще всего используется аспирин, поскольку он относительно безопасен, дешев и широко доступен.Он снижает риск повторного инсульта в острой фазе через 2–4 недели после AIS, если его вводить в течение 48 часов после начала (77, 78). Метаанализ 16 исследований вторичной профилактики показал, что аспирин снижает риск повторного ишемического инсульта на 22% и оказывает наиболее сильное действие в первые недели после АИС (79, 80). Ингибитор P2Y12 клопидогрель является еще одним широко используемым антиагрегантом при AIS. Исследование клопидогрела с аспирином при остром малом инсульте или транзиторной ишемической атаке (CHANCE), исследование с участием представителей первичной азиатской национальности, продемонстрировало снижение 90-дневной заболеваемости инсультом после легких инсультов (NIHSS <4) или ТИА при комбинированной терапии аспирином и клопидогрелом. (двойная антитромбоцитарная терапия) в течение 21 дня после инсульта по сравнению с одним аспирином без увеличения кровотечений (81).Американское исследование клопидогреля и аспирина при остром ишемическом инсульте и ТИА высокого риска (POINT) позволило воспроизвести эти результаты в более разнообразной в этническом отношении когорте (82). Наконец, кардиоэмболические инсульты, на долю которых приходится до 40%, могут потребовать лечения полной антикоагулянтной терапией для предотвращения рецидива. Однако, в зависимости от размера инфаркта, полная антикоагуляция может привести к геморрагической трансформации сразу после инсульта. Для этих пациентов широко принята первоначальная стратегия антитромбоцитарной терапии с переходом к полной антикоагуляции в течение 10–14 дней после инсульта, и она основана на клинических испытаниях, которые продемонстрировали, что риск рецидива инсульта в этот период времени минимален (48, 83, 84).Некоторым пациентам с эмболическими инсультами неустановленного источника может быть показан длительный кардиологический мониторинг для повышения эффективности диагностики пароксизмальной фибрилляции предсердий (85).
Статины — препарат выбора при дислипидемии, которая является важным фактором риска атеросклеротического заболевания. В последние годы исследования показали, что статины обладают плейотропным эффектом, помимо снижения холестерина, включая антитромботические, противовоспалительные и эндотелиальные защитные свойства (86). В клиническом исследовании «Профилактика инсульта путем агрессивного снижения уровня холестерина» (SPARCL) оценивалось влияние статинов на вторичную профилактику инсульта и было продемонстрировано, что аторвастатин высокой интенсивности снижает количество летальных и нефатальных рецидивов инсульта с наибольшим эффектом в группе стеноза сонной артерии.В исследование были включены пациенты с окклюзией мелких сосудов, атеросклерозом крупных сосудов и неизвестной этиологией, за исключением кардиоэмболических инсультов (87). Недавние клинические испытания показывают, что уровень холестерина и липопротеинов низкой плотности ~ 70 мг / дл не является обязательным для уменьшения рецидивов инсульта (88). Хотя некоторые исследования показали повышенный риск ВЧГ при терапии статинами (89, 90), другие объединенные анализы не смогли продемонстрировать эту взаимосвязь (91, 92).
Фармакологическое лечение инсульта
US Pharm. 2012; 37 (2): HS-12-HS-15.
Инсульт (также называемый цереброваскулярным поражением ) — это состояние, при котором снижается приток крови к центральной нервной системе, в частности, к мозгу. Хотя его заболеваемость снизилась с 1980-х годов, инсульт в настоящее время является четвертой ведущей причиной смерти в Соединенных Штатах, и в 2007 году он унес жизни почти 136 000 человек. Каждый год около 795 000 человек (в среднем 1 человек каждые 40 секунд). ) испытает новый или повторный инсульт. Заболеваемость наиболее высока среди афроамериканцев в возрасте 18 лет и старше (3.2%), на втором месте по заболеваемости белое (2,5%) и азиатское (1,3%) население. 1,2
Снижение кровотока, происходящее во время инсульта, в основном происходит из-за ишемии или кровотечения. Из двух основных типов инсульта (ишемического и геморрагического) чаще встречается ишемическая форма, на которую приходится от 85% до 87% случаев инсульта. 3 Ишемический инсульт возникает, когда артерия, кровоснабжающая мозг, закупорена, что приводит к снижению притока крови к пораженному участку.Различные заболевания могут вызывать окклюзию, чаще всего болезнь крупных артерий, болезнь мелких сосудов и кардиоэмболию. 4 Причины ишемического инсульта в более общем плане можно разделить на эмболию и тромбоз, причем тромбоз встречается чаще. Тромботический удар возникает, когда сгусток образуется в сосуде и снижает приток крови к мозгу из места его образования. При эмболическом инсульте сгусток образуется в области, отличной от мозга, разрыхляется и перемещается, пока не достигает кровеносного сосуда, который слишком узок, чтобы позволить ему пройти.Эта окклюзия препятствует притоку крови к мозгу.
Геморрагический инсульт возникает, когда кровеносный сосуд в головном мозге становится слабым и разрывается. Затем кровь просачивается в другие части мозга, повреждая окружающие ткани. Геморрагический инсульт можно классифицировать одним из двух способов в зависимости от места кровотечения. Субарахноидальное кровоизлияние возникает в результате разрыва кровеносного сосуда между поверхностью мозга и черепом. Восемьдесят пять процентов субарахноидальных кровоизлияний вызваны разрывом мешковидной аневризмы у основания головного мозга. Внутримозговое кровоизлияние , чаще всего в результате болезни мелких сосудов, возникает при разрыве кровеносного сосуда внутри головного мозга. Внутримозговые кровоизлияния можно далее разделить на долевых кровоизлияний, (с участием коры) и подкорковых кровоизлияний, (с участием области под корой). 4,5
Мозг содержит более 100 миллиардов нейронов. За каждую минуту отсутствия лечения у пациента с ишемическим инсультом крупных сосудов в среднем 1.9 миллионов нейронов потеряны. 6 Инсульт — это состояние, зависящее от времени, поэтому для пациентов, лиц, осуществляющих уход, и медицинских работников важно распознать его признаки и симптомы. Симптомы могут различаться в зависимости от пораженной области мозга, но Национальный институт неврологических расстройств и инсульта (NINDS) перечисляет пять ключевых признаков и симптомов ( ТАБЛИЦА 1 ), которые необходимо идентифицировать. 7 Если у человека наблюдаются какие-либо из этих признаков и симптомов, следует незамедлительно позвонить в службу 911.
Аббревиатура F.A.S.T. можно использовать для определения того, может ли человек пережить инсульт: F ace — попросите человека улыбнуться; это поможет определить онемение или слабость на одной стороне лица. A rms — попросите человека поднять обе руки; обратите внимание, опускается ли одна рука ниже другой. S peech — попросите человека повторить простую фразу; это покажет, есть ли у него проблемы с речью или с пониманием речи. T ime — Немедленно позвоните в службу 911, если у человека появятся какие-либо из этих признаков и симптомов. 8
Фармакологическую терапию инсульта можно разделить на специфическое для инсульта лечение и профилактику инсульта. 9 Фармакологическое лечение инсульта зависит от того, является ли инсульт ишемическим или геморрагическим. Вариантами фармакотерапии первичного ишемического инсульта являются тканевой активатор плазминогена (tPA) и — при определенных условиях — антиагреганты. Фармакотерапевтическое лечение геморрагического инсульта направлено на контроль артериального и внутричерепного давления у пациента.
Лечение ишемического инсульта
tPA: Из доступных внутривенных препаратов tPA альтеплаза — единственное средство, одобренное FDA для лечения ишемического инсульта. Это показание было подтверждено после того, как эффективность препарата была продемонстрирована в исследовании инсульта NINDS rt-PA. Это исследование, в которое вошли 624 пациента, рандомизированных для получения 0,9 мг / кг (максимум 90 мг) внутривенного tPA или плацебо, показало, что те, кто получал tPA (£ 3 часа появления симптомов), были по крайней мере на 30% чаще, чем те, кто получал плацебо через 3 месяца после лечения иметь минимальную инвалидность или нет. 10
Безопасное применение тромболизиса при инсульте — Международный регистр инсультов (SITS-ISTR) продолжительностью от 3 до 4,5 часов не обнаружило различий между пациентами, получавшими лечение в течение 3 часов, и пациентами, получавшими лечение в течение 3-4,5 часов, в отношении симптоматического внутримозгового кровоизлияния, смертности, или по модифицированной шкале Рэнкина (которая измеряет степень инвалидности / зависимости в повседневной деятельности пациентов, перенесших инсульт), оценка от 0 до 2 через 90 дней. 11 В то время как пациенты с инсультом, подходящие для внутривенного введения tPA, должны лечиться в течение 3 часов, в рекомендациях по лечению инсульта, опубликованных Американской кардиологической ассоциацией / Американской ассоциацией инсульта (AHA / ASA) в 2007 году, рекомендуется, чтобы tPA все же можно было вводить подходящим пациентам 3 к 4.Через 5 часов после инсульта. 11,12 Поскольку кровотечение является наиболее частой побочной реакцией, связанной с альтеплазой, чрезвычайно важно следовать инструкциям по назначению ( ТАБЛИЦА 2 ). Другие побочные реакции, о которых сообщалось при использовании альтеплазы при ишемическом инсульте, включают отек мозга, церебральную грыжу, судороги и новый ишемический инсульт. 13
Антитромбоцитарные агенты: Аспирин — единственный пероральный антитромбоцитарный агент, который был оценен для лечения острого ишемического инсульта. Терапию аспирином (325 мг) следует начинать в течение 24–48 часов после ишемического инсульта, но не в течение 24 часов после завершения терапии альтеплазой. 12 В качестве альтернативы рекомендуется, чтобы пациенты, которые не подходят для лечения тромболитиками, получали раннюю терапию аспирином (начальная доза 150–325 мг). Хотя существует повышенный риск кровотечения при использовании аспирина, положительная роль видна, когда аспирин вводится во время острого ишемического инсульта. 14
Вторичная профилактика: Лечение ишемического инсульта не прекращается после устранения острой проблемы.Вторичное лечение направлено на предотвращение рецидивов путем контроля метаболических факторов риска, а именно артериального давления и липидов. Было показано, что снижение артериального давления снижает риск инсульта на 30-40%, при этом нет четких доказательств в пользу определенного класса антигипертензивных средств. 15 Совместная публикация AHA / ASA обобщила метаанализ семи рандомизированных клинических испытаний, а также испытаний MOSES и PRoFESS. Основываясь на результатах этих исследований, AHA / ASA рекомендует снижение артериального давления с или без документированной истории гипертонии.Хотя оптимальное целевое артериальное давление не определено и должно быть индивидуализировано, было замечено снижение на 10/5 мм рт.ст. 15
Конкретный режим артериального давления также остается неопределенным. Было показано, что использование диуретиков по отдельности или в комбинации с ингибитором ангиотензинпревращающего фермента приносит пользу. Руководства AHA / ASA рекомендуют, чтобы схема была основана на фармакологических свойствах, механизме действия и учете конкретных характеристик пациента.Повышенный уровень ЛПНП и общего холестерина связан с повышенным риском ишемического инсульта. В литературе наиболее широко используется статиновая терапия для профилактики рецидивирующего ишемического инсульта, но ниацин, фибраты и ингибиторы абсорбции холестерина также могут использоваться у пациентов, которые не переносят терапию статинами. Терапия статинами рекомендуется пациентам с ишемическим инсультом с атеросклерозом, ЛПНП ≥100 мг / дл и неизвестной ишемической болезнью сердца. Снижение по крайней мере на 50% или ЛПНП £ 70 мг / дл нацелено на обеспечение оптимального эффекта.Пациенты с ишемическим инсультом с повышенным уровнем холестерина или сопутствующей болезнью коронарных артерий должны лечиться в соответствии с рекомендациями Национальной образовательной программы по холестерину ATP III. 15
Лечение геморрагического инсульта
Варианты лечения: Хотя геморрагический инсульт составляет около 15% случаев инсульта в год, уровень смертности для этих пациентов непропорционально высок (50%). 2 Варианты фармакологического лечения геморрагического инсульта ограничены.Лечение любого пациента, перенесшего геморрагический инсульт, включает следующие этапы: определение причины кровотечения; контроль артериального давления пациента; прекращение приема любых лекарств, которые могут повысить риск дальнейшего кровотечения; и контроль внутричерепного давления пациента. 16
Субарахноидальное кровоизлияние чаще всего возникает из-за аневризмы. В таких случаях может применяться хирургическое лечение (клипирование или спиральная эмболизация). 17 Внутримозговое кровоизлияние, связанное с варфарином, встречается относительно часто, с ежегодным риском около 2%.Эта форма геморрагического инсульта часто имеет мрачный прогноз, поскольку обычно поражает пожилых пациентов и приводит к большему объему кровотечения. Все лекарства, повышающие риск кровотечения, такие как варфарин, аспирин и гепарин, должны быть отменены у пациента с геморрагическим инсультом. Если внутричерепное кровоизлияние вызвано именно варфарином, международное нормализованное отношение пациента (МНО) может быть скорректировано путем внутривенного введения витамина К и свежезамороженной плазмы. 17 Введение 10 мг витамина К в / в потенциально нормализует МНО через 6–24 часа; могут вводиться дополнительные дозы от 5 до 10 мг каждые 12 часов, максимальная доза — 25 мг. Количество вводимой свежезамороженной плазмы зависит от МНО пациента, массы тела и целевого МНО после коррекции. 18
Повышение артериального давления обычно происходит во время острой фазы геморрагического инсульта. Это повышение артериального давления было связано с повышенной смертностью, инвалидностью и риском развития гематом.Было показано, что многочисленные агенты, включая тиазидные диуретики, ингибиторы АПФ, блокаторы рецепторов ангиотензина, бета-блокаторы и блокаторы кальциевых каналов, эффективно снижают артериальное давление во время инсульта. Контроль артериального давления пациента также снижает риск повторного инсульта. 17
Есть несколько способов снизить внутричерепное давление. Вентрикулостомия может выполняться для слива крови, скопившейся в головном мозге. В тяжелых случаях может быть выполнена декомпрессивная трепанация черепа, при которой удаляется часть черепа и откачивается кровь для снижения внутричерепного давления. 16
Вторичная профилактика внутримозгового геморрагического инсульта: Частота рецидивов внутримозгового кровоизлияния составляет от 2,1% до 3,7% на пациенто-год. 19 Факторами, влияющими на частоту рецидивов, являются местоположение предыдущего кровоизлияния, пожилой возраст и антикоагулянтная терапия после внутримозгового кровоизлияния. Гипертония остается изменяемым фактором риска, который может помочь снизить риск первичного внутримозгового кровоизлияния, а также его рецидива.Хотя целевое целевое артериальное давление не было установлено, Объединенный национальный комитет по профилактике, выявлению, оценке и лечению повышенного артериального давления рекомендует артериальное давление <140/90 мм рт. Ст. Или <130/80 мм рт. Ст. У пациентов с хроническим заболеванием почек. или диабет; это также может быть достижимой целью для предотвращения вторичного внутримозгового кровоизлияния. Пероральные антикоагулянты являются фактором риска повторного внутримозгового кровоизлияния. Рекомендации AHA / ASA предполагают, что антиагреганты являются более безопасной альтернативой после первичного внутримозгового кровоизлияния. 19
Инсульт — это заболевание, чувствительное ко времени, независимо от того, является ли он ишемическим или геморрагическим. Хотя варианты фармакотерапевтического лечения ограничены, было показано, что они уменьшают осложнения, связанные с инсультом. Варианты фармакотерапевтического лечения также снижают риск повторного инсульта.
ССЫЛКИ 1. Национальный центр статистики здравоохранения. Health, США, 2010: со специальной статьей о смерти и умирании. Hyattsville, MD: Министерство здравоохранения и социальных служб США; 2011. DHHS Pub № 2011-1232.
2. Роджер В.Л., Гоу А.С., Ллойд-Джонс Д.М. и др. Статистика сердечных заболеваний и инсульта — обновление 2011 г .: отчет Американской кардиологической ассоциации. Тираж . 2011; 123: e18-e209.
3. Hinkle JL, Guanci MM. Обзор острого ишемического инсульта. J Neurosci Nurs . 2007; 39: 285-293 310.
4. Маркус Х. Инсульт: причины и клинические особенности. Медицина . 2004; 32: 57-61.
5. Американская ассоциация инсульта. Виды инсульта.
www.strokeassociation.org/
6. Сэвер Дж. Время — это мозг в количественном выражении. Инсульт. , 2006; 37: 263-266.
7. Национальный институт неврологических расстройств и инсульта. Знай инсульт. Знайте знаки. Действуйте вовремя.
www.ninds.nih.gov/disorders/stroke/knowstroke.htm. По состоянию на 28 декабря 2011 г.
8. Национальная ассоциация инсульта.Предупреждающие признаки инсульта.
www.stroke.org/site/
9. Пеховски-Йозвяк Б., Богоуславский Ю. Фармакотерапия инсульта. евро Neurol Dis . 2006; 1: 52-62.
10. Исследовательская группа по инсульту Национального института неврологических расстройств и инсульта. Активатор тканевого плазминогена при остром ишемическом инсульте. N Engl J Med . 1995; 333: 1581-1587.
11. del Zoppo GJ, Saver JL, Jauch EC, Adams HP Jr. Расширение временного окна для лечения острого ишемического инсульта с помощью внутривенного тканевого активатора плазминогена: научный совет Американской кардиологической ассоциации / Американской ассоциации инсульта. Ход . 2009; 40: 2945-2948.
12. Адамс HP мл., Дель Зоппо Дж., Альбертс М.Дж. Рекомендации по раннему ведению взрослых с ишемическим инсультом: рекомендации Американской кардиологической ассоциации / Американского совета по инсульту, Совета по клинической кардиологии, Совета по сердечно-сосудистой радиологии и вмешательствам, а также Совета по атеросклеротическим заболеваниям периферических сосудов и качеству лечения в междисциплинарных исследованиях Группы: Американская академия неврологии подтверждает ценность этого руководства как учебного пособия для неврологов. Ход . 2007; 38: 1655-1711.
13. Вкладыш в упаковку Activase (alteplase). Южный Сан-Франциско, Калифорния: Genentech, Inc; Апрель 2011 г.
14. Hirsh J, Guyatt G, Albers GW и др. Антитромботическая и тромболитическая терапия. Краткое изложение: Практические рекомендации Американского колледжа врачей-терапевтов по доказательной клинической практике (8-е издание). Сундук . 2008; 133: 71С-105С.
15. Фьюри К.Л., Каснер С.Е., Адамс Р.Дж. и др. Рекомендации по профилактике инсульта у пациентов с инсультом или транзиторной ишемической атакой: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта. Ход . 2011; 42: 227-276.
16. Caplan LR. Информация для пациентов: лечение геморрагического инсульта.
www.uptodate.com/contents/
17. Марш Дж. Д., Кейруз С. Г.. Профилактика и лечение инсульта. Дж. Ам Кол Кардиол . 2010; 56: 683-691.
18. Агилар М.И., Харт Р.Г., Касе С.С. и др. Лечение варфарин-ассоциированного внутримозгового кровоизлияния: обзор литературы и мнения экспертов. Mayo Clin Proc .2007; 82: 82-92.
19. Morgenstern LB, Hemphill JC III, Anderson C, et al. Рекомендации по лечению спонтанного внутримозгового кровоизлияния: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта. Ход . 2010; 41: 2108-2129.
Чтобы прокомментировать эту статью, обращайтесь [email protected].
Острый ишемический инсульт | Penumbra Состояние пациента
Симптомы
Аббревиатура F.A.S.T. (лицо, рука, речь, время) были популяризированы в Соединенных Штатах и в других странах, чтобы научить их явным признакам инсульта и острой необходимости незамедлительно обращаться в службы экстренной помощи. Обвисшее лицо, слабость рук и трудности с речью — внешние признаки того, что пора звонить в службу экстренной помощи.
Симптомы зависят от тяжести инсульта и расположения в головном мозге. Некоторые люди не испытывают никаких симптомов, а другие испытывают только один. Однако у большинства людей наблюдается сочетание симптомов.
Симптомы могут включать:
- Паралич одной стороны тела
- Изменение бдительности
- Изменения слуха или вкуса
- Проблемы с глотанием
- Головокружение или потеря равновесия
- Проблемы со зрением
Диагностика
Ваш врач может:
- Спросите вас или члена вашей семьи о ваших факторах риска, таких как высокое кровяное давление, курение, болезни сердца, а также личный или семейный анамнез инсульта.
- Спросите о своих признаках и симптомах и о том, когда они начались.
- Проведите физический осмотр, чтобы оценить вашу умственную активность, координацию и равновесие. Он или она может проверить, нет ли у вас онемения или слабости на вашем лице, руках и ногах; проблемы с речью и четкостью зрения; и путаница.
- Посмотрите на признаки заболевания сонной артерии, частой причины ишемического инсульта. Стетоскоп может обнаружить свистящий звук, называемый шумом, который может указывать на изменение или снижение кровотока из-за накопления бляшек.
Ваш врач может назначить один или несколько из следующих тестов:
- Церебральная ангиография , также называемая церебральной артериографией, использует инъекцию водорастворимого красителя, называемого контрастным веществом, для выделения пораженного участка, чтобы его можно было увидеть на рентгеновских снимках.
- Компьютерная томография (компьютерная томография) использует рентгеновские лучи для получения четких и подробных изображений вашего мозга.
- Компьютерная томографическая ангиография (CTA) использует комбинацию компьютерной томографии, специальных компьютерных методов и красителя, вводимого в кровь для получения изображений кровеносных сосудов.
- Магнитно-резонансная томография (МРТ) использует магнитные поля и радиоволны для создания подробных изображений, которые могут показать тонкие изменения в неврологических тканях.
- Магнитно-резонансная ангиография (MRA) может регистрировать характер и скорость кровотока через сосудистые поражения, а также поток спинномозговой жидкости в головном мозге.
- Транскраниальный допплеровский ультразвук оценивает кровоток в головном мозге, направляя высокочастотные звуковые волны через череп в определенные артерии.Полученные в результате сигналы звуковой волны, которые отражаются от клеток крови, интерпретируются компьютером, чтобы создать изображение скорости кровотока.
Дополнительные тесты могут включать: УЗИ сонных артерий, каротидную ангиографию, электрокардиографию (ЭКГ), эхокардиографию и / или анализы крови.
Лечение
Лечение этого состояния всегда необходимо обсуждать со своим врачом.
для полного обсуждения вариантов, рисков, преимуществ и другой информации.
Лечение состоит из одного или комбинации двух основных подходов для восстановления надлежащего кровотока: 1) инъекция препарата, разрушающего сгустки крови, и 2) механическая тромбэктомия, минимально инвазивная процедура, которая физически удаляет сгусток из заблокированных артерий. Врачи могут использовать механическую тромбэктомию и фармацевтические препараты в комбинации или независимо друг от друга. Период лечения пациентов, перенесших механическую тромбэктомию, зависит от времени.
Поддержка более широкого использования эндоваскулярного лечения значительно усилилась, начиная с 2014 г., когда были опубликованы результаты нескольких клинических испытаний, которые продемонстрировали эффективность лечения.Эти новые исследования побудили специализированные общества, такие как Общество нейроинтервенционной хирургии (SNIS), обновить свои рекомендации по лечению, чтобы отразить новые данные.
Типы и причины ишемии головного мозга
Ишемия головного мозга, также известная как церебральная ишемия или цереброваскулярная ишемия, возникает при недостаточном притоке крови к мозгу.Кислород и жизненно важные питательные вещества переносятся кровью по артериям — кровеносным сосудам, по которым кислород и богатая питательными веществами кровь поступают в каждую часть тела.
Артерии, доставляющие кровь в мозг, следуют определенному пути, который обеспечивает адекватное снабжение каждой области мозга кровью из одной или нескольких артерий. Когда артерия в головном мозге блокируется или кровоточит, это приводит к снижению снабжения кислородом той области мозга, которая зависит от этой конкретной артерии.
Даже временный дефицит кислорода может нарушить работу кислородно-дефицитной области мозга.Фактически, если клетки мозга лишены кислорода более чем на несколько минут, может произойти серьезное повреждение, которое может привести к гибели ткани мозга. Этот тип смерти мозговой ткани также известен как инфаркт мозга или ишемический инсульт.
Sudok1 / Getty ImagesСимптомы ишемии головного мозга
Симптомы ишемии головного мозга могут варьироваться от легких до тяжелых. Они могут длиться от нескольких секунд до нескольких минут. Если ишемия непродолжительна и проходит до того, как может произойти необратимое повреждение (инфаркт), то это событие часто называют транзиторной ишемической атакой (ТИА).
Если мозг повреждается в результате ишемии, симптомы могут стать постоянными. Симптомы ишемии головного мозга включают следующее:
- Слабость тела с одной или обеих сторон тела
- Потеря чувствительности с одной или обеих сторон тела
- Замешательство или дезориентация
- Изменения зрения одного или обоих глаз
- Головокружение, головокружение
- Двойное зрение
- Невнятная речь
- Потеря сознания или снижение сознания
- Проблемы с равновесием и проблемы с координацией
Типы
Ишемию головного мозга можно разделить на несколько различных типов.Это включает:
- Тромботическая : Этот тип ишемии вызывается закупоркой кровеносного сосуда, обычно из-за тромба или внезапного спазма артерии.
- Эмболия : Этот тип ишемии обычно вызывается тромбом, который мог образоваться в сердце или артерии, который затем перемещается в другую (часто меньшую) артерию, вызывая закупорку в артерии назначения.
- Гипоперфузия : Этот тип вызван полным отсутствием кровоснабжения.Сердечный приступ, сильная кровопотеря в результате травмы или хирургического вмешательства могут вызвать снижение общего кровотока к мозгу.
Ишемия может поражать небольшую область мозга или большую область или даже весь мозг:
- Очаговая ишемия ограничивается определенной областью мозга. Обычно это происходит, когда сгусток крови заблокировал артерию в головном мозге. Очаговая ишемия может быть результатом тромба или эмбола.
- Глобальная ишемия поражает более широкую область мозга и обычно возникает, когда кровоснабжение мозга резко снижено или прекращается.Обычно это вызвано остановкой сердца.
Причины и факторы риска
Ишемия головного мозга связана с множеством различных заболеваний или нарушений. Они могут включать следующее:
Факторы риска ишемического инсульта включают:
- Высокое кровяное давление
- Курительный табак
- Ожирение
- Высокий холестерин
- Диабет
- Предыдущий TIA
- Мерцательная аритмия
Бесшумное цереброваскулярное заболевание — распространенное заболевание, поражающее пожилых людей, связанное с риском ишемии мозга, часто называемое «тихим инсультом».«
Поскольку бесшумные инсульты не вызывают клинически признанных симптомов инсульта, Американская кардиологическая ассоциация и Американская ассоциация инсультов совместно выпустили рекомендации, которые помогут клиницистам использовать визуализационные тесты для оценки риска бессимптомных цереброваскулярных заболеваний.
Профилактика и лечение
Ишемию мозга можно предотвратить. Лечение ишемии головного мозга включает ряд лекарств, которые используются для лечения и профилактики ишемического инсульта.
Профилактика ишемии головного мозга включает в себя лекарства, которые могут помочь вам достичь идеального артериального давления, а также лекарства для снижения уровня холестерина и жира в крови. Модификация диеты также может помочь в достижении идеального уровня холестерина.
Лечение внезапной ишемии включает внутривенное введение препарата альтеплазы (tPA). Было показано, что при введении в течение трех часов после постановки диагноза это неотложное лечение улучшает исход болезни после инсульта.Иногда tPA можно назначить в течение 4,5 часов после появления симптомов инсульта.
Этот препарат восстанавливает кровоток, растворяя сгусток крови, вызвавший инсульт. Существуют также экстренные эндоваскулярные процедуры, при которых врач может непосредственно обработать закупоренный кровеносный сосуд.
Иногда после инсульта выжившие подвергаются более высокому риску развития постинсультных припадков. Противосудорожные препараты могут помочь предотвратить некоторые приступы после инсульта, а также могут контролировать приступы после инсульта, если они действительно развиваются.
Инсульт: Часть II. Ведение острого ишемического инсульта
1. Статистическое приложение о сердце и инсульте. Даллас: Американская кардиологическая ассоциация, 1998 ….
2. Фоулкс М.Р., Вольф ПА, Цена TR, Мор JP, Hier DB. Банк данных об инсульте: дизайн, методы и исходные характеристики. Ход . 1988; 19: 547–54.
3. Харт Р.Г., Бенавенте О. Инсульт: Часть I. Обновленная клиническая информация о профилактике. Ам Фам Врач .1999; 59: 2475–82.
4. Адамс HP мл., Бротт Т.Г., Кроуэлл Р.М., Фурлан А.Дж., Гомес ЧР, Гротта J, и другие. Рекомендации по ведению пациентов с острым ишемическим инсультом. Заявление для специалистов в области здравоохранения от специальной группы авторов Совета по инсульту Американской кардиологической ассоциации. Тираж . 1994; 90: 1588–601.
5. Бротт Т., Маккарти Е.П. Антигипертензивная терапия при инсульте. В: Фишер М., изд.Медикаментозная терапия острого инсульта. Нью-Йорк: Деккер, 1989: 117–41.
6. Райт Дж., Йоргенсен Х.С., Педерсен П.М., Накаяма Х, Раашу HD, Jeppesen LL, и другие. Температура тела при остром инсульте: связь с тяжестью инсульта, размером инфаркта, смертностью и исходом. Ланцет . 1996; 347: 422–5.
7. Сотрудничество специалистов по инсульту. Совместный систематический обзор рандомизированных исследований организованной стационарной помощи (инсультное отделение) после инсульта. BMJ . 1997; 314: 1151–9.
8. Исследовательская группа по инсульту Национального института неврологических расстройств и инсульта. Активатор тканевого плазминогена при остром ишемическом инсульте. N Engl J Med . 1995; 333: 1581–7.
9. Исследовательская группа по инсульту NINDS t-PA. Внутримозговое кровоизлияние после внутривенной терапии t-PA при ишемическом инсульте. Ход . 1997. 28: 2109–18.
10. Hacke W, Kaste M, Фиески C, Тони Д, Lesaffre E, фон Куммер Р., и другие.Внутривенный тромболизис рекомбинантным тканевым активатором плазминогена при остром полушарном инсульте. Европейское совместное исследование острого инсульта (ECASS). JAMA . 1995; 274: 1017–25.
11. Hacke W, Kaste M, Фиески C, фон Куммер Р., Давалос А, Мейер Д, и другие. Рандомизированное двойное слепое плацебо-контролируемое исследование тромболитической терапии с внутривенным введением альтеплазы при остром ишемическом инсульте (ECASS II).Второе европейско-австралийское исследование острого инсульта. Ланцет . 1998. 352: 1245–51.
12. Каплан Л.Р., Мор JP, Кистлер JP, Корошец В. Должна ли тромболитическая терапия быть терапией первой линии при остром ишемическом инсульте? Тромболизис — не панацея от ишемического инсульта. N Engl J Med . 1997; 337: 1309–13.
13. Бротт Т. Тромболизис при инсульте. Arch Neurol . 1996; 53: 1305–8.
14.Wardlaw JM, Варлоу CP, Советник К. Систематический обзор данных о тромболитической терапии острого ишемического инсульта. Ланцет . 1997; 350: 607–14.
15. Танне Д., Kasner SE, Мансбах H, Binder JR, Верро П, Скотт PA, и другие. Внутримозговое кровоизлияние после внутривенного введения t-PA при остром ишемическом инсульте в клинической практике: частота и предикторы. Цереброваск Дис. . 1998; 8 (добавление 4): 48.
16. Адамс HP мл., Бротт Т.Г., Фурлан А.Дж., Гомес ЧР, Гротта JC, Хельгасон С.М., и другие. Руководство по тромболитической терапии острого инсульта: дополнение к руководству по ведению пациентов с острым ишемическим инсультом. Заявление для специалистов в области здравоохранения от Специальной письменной группы Совета по инсульту Американской кардиологической ассоциации. Тираж . 1996; 94: 1167–74.
17. Международная группа по исследованию инсульта.Международное исследование инсульта (IST): рандомизированное исследование аспирина, подкожного гепарина, обоих или ни одного из 19435 пациентов с острым ишемическим инсультом. Ланцет . 1997; 349: 1569–81.
18. Группа сотрудничества CAST (Китайское исследование острого инсульта). CAST: рандомизированное плацебо-контролируемое исследование раннего применения аспирина у 20 000 пациентов с острым ишемическим инсультом. Ланцет . 1997; 349: 1641–9.
19. Исследователи Комитета по публикациям по исследованию ORG 10172 в лечении острого инсульта (TOAST).Низкомолекулярный гепариноид ORG 10172 (данапароид) и исход после острого ишемического инсульта: рандомизированное контролируемое исследование. JAMA . 1998. 279: 1265–72.
20. Кей Р., Вонг К.С., Ю ЫЛ, Чан Ю.В., Цой ТД, Ахуджа А.Т., и другие. Низкомолекулярный гепарин для лечения острого ишемического инсульта. N Engl J Med . 1995; 333: 1588–93.
21. Хоммель М, для исследовательской группы FISS bis.Флаксипарин в исследовании ишемического инсульта (FISS bis). Цереброваск Дис. . 1998; 8 (добавление 4): 52.
Обзор терапии острого инсульта: прошлое, настоящее и будущее | Цереброваскулярные заболевания | JAMA Internal Medicine
Усилия по разработке эффективных методов лечения острого ишемического инсульта позволили добиться нескольких важных успехов за последнее десятилетие, но также и многих разочаровывающих неудач. Два основных успеха были связаны с тромболизисом. Первым было исследование NINDS rt-PA (Национальный институт неврологических расстройств и инсульта, рекомбинантного тканевого активатора плазминогена), о котором было сообщено в 1995 году.Это исследование продемонстрировало, что начало внутривенного (IV) rt-PA в течение 3 часов после начала острого ишемического инсульта значительно улучшило исход через 3 месяца. 1 Это исследование привело к одобрению rt-PA, инициируемого в течение 3 часов после начала инсульта, в качестве единственной доступной в настоящее время терапии острого инсульта. Вторым крупным успехом была демонстрация того, что внутриартериальная проурокиназа, инициированная в течение 6 часов после начала инсульта у пациентов с ангиографически подтвержденной окклюзией проксимальной средней мозговой артерии (СМА), также улучшила исход через 3 месяца. 2 В третьем исследовании с незначительным положительным результатом острого инсульта использовался анкрод, дефибриногенизирующий агент, полученный из малазийской гадюки. 3 Анкрод, начатый в течение 3 часов после начала инсульта, также улучшил 3-месячный исход, но в меньшей степени, чем прием RT-PA в течение 3 часов или проурокиназа, инициированная в течение 6 часов. Эти успешные испытания терапии острого инсульта были перевешены большим количеством неудачных испытаний нейропротективных средств. В настоящее время ни один из многих предполагаемых нейропротективных методов лечения, оцененных в основных клинических испытаниях, не продемонстрировал однозначного, статистически значимого улучшения клинических исходов. 4 Все испытания нейрозащиты включали пациентов, перенесших инсульт через 3 часа после начала, и методы лечения, использованные для каждого пациента, оказались неэффективными по множеству причин, которые будут подробно изучены.
В этом обзоре текущего состояния и будущего направления терапии острого инсульта мы подробно обсудим текущую ситуацию с тромболитической терапией острого ишемического инсульта, рассмотрев результаты опубликованных клинических испытаний, постмаркетинговый опыт применения rt-PA, представленный в течение 3 дней. -часовое окно и будущие направления потенциального расширения этого окна для внутривенной тромболитической терапии.Будет рассмотрен статус различных нейропротективных методов лечения острого ишемического инсульта, а также предварены потенциальные новые нейропротективные стратегии. Наконец, мы пытаемся представить вероятные подходы к множеству терапевтических вмешательств, стратегию лечения, которая, вероятно, приведет к максимальному улучшению у наибольшего числа пациентов, перенесших инсульт.
Тромболитическая терапия при остром ишемическом инсульте
Исследование NINDS rt-PA было первым испытанием острого ишемического инсульта, недвусмысленно продемонстрировавшим, что этому расстройству может помочь любое терапевтическое вмешательство. 1 В этом исследовании 624 тщательно отобранным пациентам случайным образом вслепую назначили терапию rt-PA (0,9 мг / кг) или плацебо в течение 3 часов от начала инсульта. Половина пациентов была вылечена в течение 90 минут после начала болезни, что стало достижением исследователей, участвовавших в испытании. У пациентов, получавших rt-PA, уровень абсолютного улучшения составлял от 11% до 13% через 90 дней по сравнению с пациентами, получавшими плацебо, по различным критериям результатов, которые оценивали как неврологический, так и функциональный статус.У пациентов, получавших rt-PA, частота симптоматических внутримозговых кровоизлияний составляла 6,4% (почти половина пациентов умерла) в течение 36 часов от начала, тогда как в группе плацебо этот показатель составлял только 0,6%. Несмотря на этот ранний риск геморрагии, 90-дневная смертность составила 17% в группе rt-PA и 21% в группе плацебо. Последующий анализ данных исследования продемонстрировал, что ранняя компьютерная томография (КТ), демонстрирующая обширный отек или гипоплотность, наличие в анамнезе сахарного диабета и повышенный исходный показатель по шкале инсульта Национального института здравоохранения (NIHSS) были предикторами плохого исхода. 5 Использование rt-PA было связано с улучшением результатов у всех подтипов инсульта, включенных в исследование, у пациентов с широким диапазоном исходной тяжести инсульта и во всех возрастных группах. Первоначальный анализ данных исследования не выявил различий в пользе rt-PA в зависимости от времени начала лечения. Однако в последующем анализе, скорректированном с учетом исходной тяжести неврологического нарушения, более раннее время до начала терапии было связано с более благоприятным исходом, демонстрируя обратную линейную зависимость между временем до лечения и отношением шансов благоприятного исхода. 6 Доверительный интервал для благоприятного исхода пересек 1 у пациентов, получавших лечение через 2 часа 40 минут после начала инсульта, что позволяет предположить, что лечение, начатое после этого момента времени, может не иметь доказанной эффективности.
Доступны несколько постмаркетинговых исследований IV rt-PA. 7 -15 В эти исследования были включены пациенты с использованием общих рекомендаций по лечению, использованных в исследовании NINDS. Наиболее важным критерием включения было начало терапии в течение 3 часов от начала инсульта.Большинство исследований охватывало относительно небольшое количество пациентов, от 14 до 75 (таблица 1). Тем не менее, доступно несколько более крупных исследований, в том числе исследование, о котором сообщили Гронд и его коллеги: 11 100 пациентов и исследование STARS (стандартное лечение активазой для обратного инсульта) с участием 296 пациентов. 12 Среднее время от начала инсульта до начала терапии rt-PA варьировалось от 124 минут в исследовании Grond и его коллег до 165 минут в исследовании STARS.Процент пациентов, достигших модифицированной оценки Рэнкина 0-1, результатов , определенных как благоприятный исход в исследовании NINDS, варьировался от 34% до 57%; хотя в некоторых отчетах данные за 90-й день не были представлены.
На первый взгляд, показатели благоприятного функционального исхода, продемонстрированные в этих постмаркетинговых исследованиях, кажутся довольно хорошими, превосходя в некоторых исследованиях показатель Рэнкина 39% 0-1 через 90 дней, наблюдаемый в исследовании NINDS. Эти результаты следует интерпретировать с осторожностью, поскольку исходная степень тяжести пациентов, получавших лечение в этих постмаркетинговых исследованиях, не была такой серьезной, как в исследовании NINDS.Например, в двух крупнейших постмаркетинговых исследованиях, исследовании Grond et al. И исследовании STARS, медиана исходных значений NIHSS составляла 12 и 13, в то время как в исследовании NINDS медиана исходного уровня NIHSS в группе плацебо составляла 14 в части 1 и 15 в части 2. В других исследованиях острого инсульта, в которых исходный показатель NIHSS составлял 11, процент пациентов, достигших оценки по шкале Рэнкина 0–1, составляет около 37% 13 , а когда исходный показатель NIHSS составлял 13, 29% достигли этого результата. 14 Сравнение результатов в исследовании Grond et al. И исследовании STARS с результатами в группе плацебо, имевшей аналогичную степень исходной тяжести, демонстрирует абсолютный уровень улучшения от 3% до 6%, а не примерно 12% абсолютного показателя. улучшения, наблюдаемого при лечении rt-PA в исследовании NINDS.Однако постмаркетинговые исследования предоставляют обнадеживающие данные о частоте симптоматических внутримозговых кровоизлияний. Процент пациентов, испытывающих это серьезное осложнение тромболизиса, колебался от 0% до 19%, и только в 2 исследованиях наблюдалась двузначная частота внутримозговых кровоизлияний. В 2 крупнейших исследованиях частота внутримозговых кровоизлияний составляла всего от 4% до 5%. Таким образом, представляется, что распространение внутривенного применения rt-PA в общую практику не связано со значительным повышением риска внутримозгового кровоизлияния, если следовать руководящим принципам отбора пациентов, использованным в исследовании NINDS.
Были проведены исследования, оценивающие эффективность внутривенного введения rt-PA за пределами 3-часового временного окна. Первым клиническим испытанием для оценки внутривенного введения rt-PA в срок до 6 часов после начала инсульта было Европейское совместное исследование острого инсульта (ECASS-1). 14 Пациенты были случайным образом слепо распределены в группы rt-PA (1,1 мг / кг) или плацебо в течение 6-часового периода после начала острого инсульта на территории СМА. Предварительно определенные критерии исключения включали свидетельства гипоплотности КТ или сглаживания борозды, охватывающих более трети территории СМА при КТ перед лечением.Общие результаты, проанализированные в анализе намерения начать лечение, были отрицательными, но, когда нарушители протокола были исключены, некоторые показатели результатов были лучше в группе rt-PA. Критерий исключения КТ (более трети территории СМА с признаками раннего инфаркта%) встречался у 63 (58%) из 109 нарушителей протокола, и эти пациенты имели высокий риск симптоматических часто фатальных внутримозговых кровоизлияний при получении rt-PA. . Второе исследование ECASS было выполнено с использованием дозы rt-PA, 0, NINDS.9 мг / кг, и в этом исследовании исследователи прошли более качественную тренировку КТ для выявления острейших изменений КТ, указывающих на ранний инфаркт. 13 Пациенты снова были рандомизированы через 6 часов после начала инсульта. В ECASS-2 первичной конечной точкой был процент пациентов в 2 группах лечения, достигших балла Рэнкина 0-1, и этот результат наблюдался в 40,3% группы, получавшей rt-PA, и 36,6% в группе плацебо. группа, разница несущественная. Медианное исходное значение NIHSS составляло только 11 в 2 группах.Следовательно, исходная тяжесть инсульта, включенных в ECASS-2, была меньше, чем в первом исследовании ECASS или исследовании NINDS, что, вероятно, частично объясняет лучший результат, наблюдаемый в группе плацебо этого исследования, чем в двух других исследованиях внутривенного тромболизиса. . Апостериорный анализ данных ECASS-2 продемонстрировал значительную разницу между группой, получавшей rt-PA, и группой плацебо, когда оценка Рэнкина была разделена на 0: 2 и больше 2. В этом анализе 54,3% rt Пациенты с ПА достигли 90-дневного результата от 0 до 2, в то время как только 46% пациентов, получавших плацебо, имели 90-дневный результат по шкале Рэнкина от 0 до 2.Разница между оценкой 1 или 2 по шкале Рэнкина невелика, и этот результат свидетельствует о трудностях, присущих определению наилучшего критерия исхода для использования в исследованиях острого инсульта. Доступно еще одно крупное внутривенное исследование rt-PA, тромболизис альтеплазой для острой нетрадиционной терапии ишемического инсульта (ATLANTIS), оценивающее терапию, начатую через 3-5 часов после начала инсульта. В этом исследовании пациенты получали 0,9 мг / кг rt-PA внутривенно, и основным критерием оценки был процент пациентов, достигших 0 или 1 балла по шкале NIHSS через 90 дней. 15 В исследование было включено 547 пациентов, и первичная конечная точка была практически идентична в 2 группах. Медиана исходного уровня по шкале NIHSS составляла 11 в 2 группах, а на 90-й день модифицированный показатель Ранкина 0-1 был достигнут у 42% пациентов из группы rt-PA и 40% пациентов из группы плацебо. Один положительный результат испытаний ECASS-2 и ATLANTIS заключался в том, что частота симптоматических внутримозговых кровоизлияний составляла 8,8% и 7,0%, соответственно, не сильно увеличиваясь по сравнению с частотой 6,4%, наблюдаемой с rt-PA в исследовании NINDS с 3-часовым окном.
Внутриартериальное исследование PROACT-2 (рекомбинантная проурокиназа при острой церебральной тромбоэмболии) представляло собой исследование тромболизиса продолжительностью от 0 до 6 часов, которое продемонстрировало значительный лечебный эффект. В этом исследовании использовалась рекомбинантная проурокиназа (r-proUK%), доставленная локально в ангиографически задокументированный проксимальный тромб СМА с низкими дозами гепарина внутривенно. 2 В группах активного лечения и плацебо среднее время лечения в PROACT-2 составляло 5,3 часа, а средний исходный показатель NIHSS составлял 17.В исследование были включены 180 пациентов, рандомизированных 2: 1 на r-proUK или плацебо. На 90-й день 40% пациентов, получавших r-proUK, достигли первичного результата по шкале Рэнкина от 0 до 2, в то время как только 25% пациентов, получавших плацебо, достигли этого благоприятного результата ( P = 0,04). Вторичные показатели исходов также были лучше в группе r-proUK. Симптоматическое внутримозговое кровоизлияние в течение 24 часов произошло у 10,2% пациентов группы r-proUK и 1,9% пациентов контрольной группы. Несмотря на ранний риск симптоматического внутримозгового кровоизлияния, 90-дневная смертность была почти одинаковой в 2 группах, 25% в группе r-proUK и 27% в контрольной.Исследование PROACT-2 демонстрирует, что тромболитическая терапия может быть эффективной, если ее начать в срок до 6 часов после начала инсульта у тщательно отобранных пациентов, и должна инициировать дополнительные попытки успешно расширить временное окно для внутривенного тромболизиса при остром ишемическом инсульте.
В настоящее время с ограниченным трехчасовым временным окном, необходимым для использования в / в rt-PA в терапии инсульта, по оценкам, только от 1% до 2% пациентов с острым инсультом получат это вмешательство. 16 В то время как усилия по обучению пациентов и институциональные инициативы могут увеличить процент пролеченных пациентов до 5–10%, расширение временного окна для успешного внутривенного тромболизиса должно иметь гораздо большее влияние на количество пролеченных пациентов. Как можно расширить терапевтическое временное окно для полезного внутривенного тромболизиса при остром ишемическом инсульте? Возможны как минимум 2 стратегии, которые могут быть синергетическими. Первая стратегия — это более точное определение пациентов, которые могут ответить на лечение через 3 часа после начала инсульта.В PROACT-2 использование ангиографии помогло идентифицировать пациентов и, вероятно, частично привело к успеху испытания. 2 К сожалению, ангиография требует много времени и недоступна во многих учреждениях в течение дня. Кроме того, ангиография предоставляет информацию только о наличии или отсутствии окклюзии сосудов и не дает информации о статусе ишемического повреждения в паренхиме головного мозга.
Новые методы магнитно-резонансной томографии (МРТ) диффузионной и перфузионной МРТ в сочетании с магнитно-резонансной ангиографией могут предоставить обширную информацию о степени и локализации ишемического повреждения и состоянии перфузии в микрососудистой сети, а также задокументировать наличие или отсутствие окклюзия крупных внутримозговых сосудов. 17 Эти методы МРТ могут быть выполнены примерно за то же время, которое требуется для получения компьютерной томографии, и становятся широко доступными. Предварительные данные свидетельствуют о том, что пациенты с острым инсультом, у которых объем перфузионных поражений больше, чем объемы диффузных поражений, так называемое несоответствие диффузии и перфузии, имеют ишемические области в пределах несоответствия, которые с большей вероятностью будут реагировать на терапевтические вмешательства, такие как тромболизис. 18 Несколько исследований показали, что примерно 70% пациентов с острым инсультом, обследованных в течение 6 часов после начала инсульта, демонстрируют этот паттерн несоответствия перфузии и диффузии. 19 , 20 Последующие исследования пациентов с несоответствием диффузии и перфузии документально подтверждают, что диффузионный объем расширяется в область нарушения перфузии у большинства пациентов, оставшихся без лечения. В одном предварительном исследовании пациенты с несоответствием диффузии и перфузии, которые были успешно реканализированы с помощью в / в rt-PA, имели гораздо лучший клинический результат, чем пациенты, которые не реперфузировали. 18 Необходимы дальнейшие исследования, чтобы задокументировать, являются ли пациенты с несоответствием диффузии и перфузии, наблюдаемыми через 3–6 часов после начала инсульта, хорошими кандидатами на внутривенное введение rt-PA.
Возникли опасения, что МРТ не может точно определить острое внутримозговое кровоизлияние. Однако в нескольких недавних отчетах документально подтверждается, что МРТ-исследования, взвешенные по чувствительности, могут достоверно продемонстрировать кровоизлияния. 21 , 22 Следовательно, вероятно, что компьютерная томография не потребуется при скрининге пациентов для включения в клинические испытания на основе МРТ с внутривенным тромболизисом.
Второй потенциальный подход к продлению терапевтического временного окна для успешного тромболизиса — это проведение нейропротекторной терапии до, во время или после вливания rt-PA внутривенно.Нейропротекторная терапия, начатая до или во время внутривенного введения rt-PA, может продлить время, в течение которого ишемическая полутень, предполагаемая терапевтическая мишень как для тромболизиса, так и для нейропротекции, остается пригодной для спасения. 23 Исследования на животных подтверждают, что нейропротекторная терапия может продлить временное окно для успешной реперфузии. 24 В настоящее время нет доказательств того, что rt-PA и нейропротекторное лекарство, используемые в комбинации, действуют синергетически для увеличения временного окна для внутривенного тромболизиса у пациентов с инсультом, но такие комбинированные исследования рассматриваются.Другой потенциальной терапевтической комбинацией может быть использование внутривенного введения rt-PA с последующим введением агента, предназначенного для ингибирования реперфузионного повреждения, вызванного успешным лизисом сгустка. Возможность вторичного реперфузионного повреждения мозга после лизиса сгустка поднималась в прошлом без прямых подтверждающих доказательств.
Недавно исследования МРТ как на животных, так и на людях продемонстрировали, что вторичное повреждение после успешной реперфузии действительно происходит, хотя точные механизмы, ответственные за это, еще предстоит выяснить. 25 , 26 Наиболее вероятными процессами, ответственными за вторичное повреждение после успешной реперфузии, являются рекрутирование и активация воспалительных белых кровяных телец (в первую очередь полиморфно-ядерных лейкоцитов), высвобождение цитокинов, образование свободных радикалов кислорода и апоптоз. Вполне возможно, что более чем один из этих потенциальных индукторов вторичного повреждения активен в разных областях реперфузированной ткани. Предыдущие исследования на животных продемонстрировали, что препараты, ингибирующие активность полиморфноядерных лейкоцитов или акцепторов свободных радикалов, почти исключительно полезны в моделях реперфузии и демонстрируют незначительный эффект, если вообще какой-либо, в моделях постоянной окклюзии. 4 Сочетание этих типов лекарств с тромболизисом у животных действительно увеличивает терапевтическое временное окно для успешной реперфузии. 27 Использование этих типов лекарств после документально подтвержденной реперфузии, вызванной внутривенным введением rt-PA, может быть еще одним способом продления времени для благоприятного тромболизиса у пациентов с инсультом, предположительно путем ингибирования реперфузионного повреждения, которое повлияет на показатели исхода, определенные через несколько месяцев после начала инсульта.
Патофизиологические мишени для нейрозащиты
Нейропротекторные агенты и стратегии изучались в течение многих лет и оказались эффективными в различных доклинических моделях инсульта.Однако ни один из препаратов не доказал свою эффективность у людей. Трудно перевести данные, касающиеся дозировки лекарств, временного окна, половых различий и, в частности, целевой популяции инсульта с животных на людей. Непонимание и неправильное толкование этих вопросов могло вызвать отрицательные результаты испытаний и пессимистический взгляд на нейропротекцию инсульта в целом. Данные недавних клинических испытаний демонстрируют, что субпопуляции пациентов с инсультом могут получить пользу от нейропротекторного подхода.Есть надежда, что в ближайшем будущем будет доказана эффективность первого нейропротектора.
По сравнению с тромболизисом нейропротекторный подход к лечению инсульта более сложен и отражает разнообразие ишемического каскада (рис. 1). Нейропротекторы были разработаны и протестированы почти для всех компонентов ишемического каскада. Как видно из недавно обнаруженных механизмов, таких как экспрессия генов или роль цинка после инсульта, могут быть разработаны новые агенты и появятся новые терапевтические возможности.Открытие, что индуцированная кальцием эксайтотоксичность возникает после ишемии, относительно давно (около 20 лет) и было широко признано как ключевое событие после церебральной ишемии. Энергетический сбой, вызванный ишемией, вызывает деполяризацию мембраны и высвобождение возбуждающих аминокислот, таких как глутамат, во внеклеточное пространство. 28 , 29 Глутаматные рецепторы активируются, что приводит к перегрузке нейронных клеток кальцием. Этот этап может эффективно блокироваться антагонистами каналов N, -метил-D-аспартата (NMDA) и α-амино-3-гидрокси-5-метил-4-изоксазол пропионовой кислоты (AMPA%).Вода, натрий и хлорид перемещаются внутри клетки через каналы одновалентных ионов в клетку, вызывая так называемый цитотоксический отек. Большое количество внутриклеточного клация активирует протеолитические ферменты, которые разрушают белки цитоскелета и внеклеточного матрикса. Кальций также активирует фосфолипазу А2 и циклооксигеназу, вырабатывая свободные радикалы кислорода. Оксид азота (NO) синтезируется из L-аргинина и молекулярного кислорода кальций-зависимой NO-синтазой (NOS), и NO реагирует с супероксидом с образованием пероксинитрита.Высвобождение свободных радикалов способствует дальнейшему повреждению мембран и, как следствие, дисфункции митохондрий. Активность свободных радикалов может быть заблокирована антиоксидантами и улавливателями свободных радикалов.
Вторично по отношению к этим событиям экспрессия провоспалительных генов индуцируется синтезом факторов транскрипции и высвобождением медиаторов воспаления, таких как фактор активации тромбоцитов, фактор некроза опухоли и интерлейкин 1β (IL-1β). 30 Следовательно, экспрессия молекул адгезии, молекулы межклеточной адгезии-1 (ICAM-1), P-селектинов и E-селектинов происходит на эндотелиальной поверхности. 31 -33 После связывания с молекулами адгезии нейтрофилы прикрепляются к эндотелию, вызывают обструкцию микрососудов, пересекают сосудистую стенку и проникают в паренхиму головного мозга с последующими макрофагами и моноцитами. Блокирование молекул адгезии может предотвратить эти события. Активированные воспалительные клетки и поврежденные нейроны продуцируют ряд токсичных медиаторов, которые могут усугубить ишемию. Например, проникающие нейтрофилы продуцируют токсичное количество NO за счет активации индуцибельной NOS (iNOS). 34 Фармакологическая блокада ингибиторов iNOS, следовательно, уменьшает ишемическое повреждение головного мозга. 35 Ишемические нейроны также экспрессируют циклооксигеназу 2, фермент, который опосредует ишемическое повреждение, продуцируя супероксид и токсичные простаноиды. 36 Ингибирование фермента блокаторами циклооксигеназы 2 значительно снижает ишемическое повреждение головного мозга. Кроме того, поврежденные нейроны продуцируют провоспалительный цитокин IL-1β, который может блокироваться ингибиторами IL-1β для уменьшения размера инфаркта после ишемии. 37
Другим механизмом, который способствует ишемическому повреждению, является апоптоз, хотя роль апоптотического повреждения у пациентов с инсультом остается неопределенной. Запущенный рядом патофизиологических процессов, включая эксайтотоксичность, свободные радикалы, воспалительную реакцию, а также повреждение митохондрий и ДНК, апоптоз возникает после легкого ишемического повреждения, особенно в пределах ишемической полутени. 38 Апоптоз опосредуется каскадом экспрессии генов, включая каспазы, семейство аспартат-специфичных цистеиновых протеаз, а также гены, которые подавляют (например, Bcl-2) или увеличивают (например, Bax) гибель клеток. 39 , 40 Активность каспазы может блокироваться ингибиторами каспаз, уменьшая размер инфаркта и апоптоз, а также улучшая исход. 41 , 42 Другими агентами, которые могут противодействовать апоптозу после фокальной церебральной ишемии через Bcl-2 / Bax-зависимые механизмы, являются факторы роста, такие как нейротрофический фактор роста мозга. 43
Восстановление и реорганизация мозга после очагового ишемического повреждения происходит в течение нескольких недель и может существенно повлиять на исход после инсульта. 44 , 45 Основные механизмы восстановления включают прорастание нейронов и синаптогенез, которые являются частью процесса спонтанного восстановления, особенно после небольших очаговых поражений. Улучшение выздоровления с последующим улучшением поведенческого результата может быть достигнуто у животных с помощью таких препаратов, как факторы роста и амфетамины. 46 , 47
Стратегии неотложного лечения
Различные нейрозащитные агенты, которые могут вмешиваться в ишемический каскад, представлены на рисунке 2.
Антагонисты кальциевых каналов были одними из первых препаратов, оцениваемых для нейропротекции после инсульта. Они уменьшают приток кальция в клетку через чувствительные к напряжению кальциевые каналы. В нескольких экспериментальных исследованиях действительно было показано, что антагонисты кальция обладают нейропротекторным действием после очаговой ишемии головного мозга. 48 Наиболее изученным препаратом является дигидропиридиновое соединение нимодипин, которое обычно блокирует кальциевые каналы L-типа. Нимодипин тестировался как минимум в 10 рандомизированных плацебо-контролируемых исследованиях инсульта.Помимо положительных результатов в виде снижения смертности и улучшения неврологического исхода через 6 месяцев после инсульта в раннем испытании, все другие испытания дали отрицательные результаты. 49 Побочные эффекты нимодипина внутривенно включают гипотензию, которая напрямую коррелировала с увеличением смертности. 50 Метаанализ 9 исследований с участием 3719 пациентов показал преимущество перорального приема нимодипина (30 мг в течение 6 часов) в подгруппе, получавшей лечение в течение 12 часов после начала инсульта. 51 Таким образом, лечение нимодипином перорально снова было изучено в течение 6 часов с момента появления симптомов в исследовании «Очень раннее применение нимодипина при инсульте» (VENUS). 52 В исследовании VENUS не наблюдалось положительного влияния на исход после инсульта. Тем не менее, нимодипин является стандартным препаратом для профилактики ишемического неврологического дефицита после субарахноидального кровоизлияния. 53
Антагонисты NMDA уменьшают приток кальция в нейроны через кальциевые каналы, управляемые постсинаптическими агонистами. Они были первыми препаратами, которые значительно уменьшили размер инфаркта (40% -70%) после экспериментальной очаговой ишемии головного мозга, прежде всего в ишемической полутени. 54 , 55 Этот эффект может быть достигнут с помощью конкурентных и неконкурентных антагонистов NMDA. Конкурентные антагонисты NMDA, такие как фосфонаты или селфотел, блокируют сайт распознавания глутамата рецептора. Неконкурентные антагонисты NMDA, включая фенциклидин, кетамин, дизоцилпин малеат, гидрохлорид декстрорфана и церестат, блокируют связанный с NMDA ионный канал в зависимости от применения. Отрицательная модуляция активности рецепторов может быть достигнута цинком и водородом.Магний блокирует канал в зависимости от напряжения и, как было показано, уменьшает размер инфаркта после очаговой церебральной ишемии. Помимо основного сайта распознавания глутамата, рецептор также содержит сайт глицина, и ингибирование действия глицина снижает активность рецептора NMDA. Антагонисты глицинового участка рецептора также уменьшают размер инфаркта после экспериментальной фокальной церебральной ишемии. 56 , 57 Хотя доклинические исследования на различных видах животных продемонстрировали сильные эффекты уменьшения инфаркта, клинические испытания с использованием антагонистов NMDA (селфотел, элипродил, церестат, декстрорфан) были отрицательными или были прекращены из-за побочных эффектов. 58 -61 Побочные эффекты некоторых из этих препаратов возникали до достижения нейропротективного уровня в плазме. Побочные эффекты имели дозозависимый характер и включали психоневрологические симптомы (возбуждение, спутанность сознания, галлюцинации, кататонию, атаксию, дизартрию) и гипертонию. Известно, что эти побочные эффекты связаны с фенциклидином и не должны возникать при нацеливании на другую субъединицу рецептора NMDA. Действительно, антагонисты глицинового сайта рецептора NMDA (GV150526, ACEA1021) обычно лучше переносятся без нейропсихиатрических побочных эффектов. 62 , 63 Испытание GV150526 фазы 3 было завершено, и результаты были отрицательными. 64 Еще одно соединение, которое действует на рецептор NMDA и в настоящее время изучается в многоцентровых клинических испытаниях, — это магний. Пилотное исследование показало, что препарат хорошо переносится и связан с тенденцией к меньшему количеству ранних смертей в группе, получавшей магний. 65
Антагонисты рецептора AMPA предотвращают приток натрия в клетку путем блокирования рецептора AMPA / каината и предотвращают деполяризацию клетки и последующую перегрузку клетки кальцием внутри клетки.Антагонисты рецепторов AMPA, такие как NBQX и ZK200775, обладают мощными нейрозащитными свойствами при введении после экспериментальной фокальной церебральной ишемии 66 , но побочные эффекты включают нефротоксичность (NBQX) и седативный эффект (ZK200775).
Повышение активности рецептора подтипа γ-аминомасляной кислоты A является еще одним механизмом индукции нейрозащиты. 67 Эта тормозная система нейротрансмиссии гиперполяризует и стабилизирует мембранный потенциал покоя и, следовательно, может ингибировать периинфарктно-деполяризующие события, явление, которое связано с развитием инфаркта в моделях инсульта на животных. 68 Агонисты γ-аминомасляной кислоты клометиазол и мусцимол уменьшают размер инфаркта у животных. 69 , 70 Клометиазол изучался в европейском исследовании фазы 3, и общие результаты были отрицательными. 71 Однако пациенты с тотальным инфарктом переднего кровообращения, которые составляли 40% исследуемой популяции, показали абсолютное улучшение на 11% по основному функциональному критерию результата, индексу Бартеля. Основными нежелательными явлениями, связанными с применением клометиазола, были сонливость и ринит.На основе этих обнадеживающих результатов было организовано второе испытание эффективности, ограниченное пациентами с обширными инсультами переднего кровообращения, которое вскоре будет завершено.
Любелузол, соединение бензотиазола, является блокатором натрия, который предотвращает пресинаптическое высвобождение глутамата и снижает постсинаптическую эксайтотоксичность. Любелузол также предотвращает опосредованное глутаматом увеличение продукции NO, ингибируя активность NOS. Экспериментальные исследования продемонстрировали нейропротекторный эффект после очаговой ишемии головного мозга. 72 , 73 Завершены два крупных клинических, многоцентровых и плацебо-контролируемых исследования: 1 в Северной Америке и 1 в Европе и Австралии. 74 , 75 Помимо случайных и преходящих удлинений интервала QT на электрокардиографии, любелузол хорошо переносился в концентрациях, указанных в обоих исследованиях (7,5 мг / ч внутривенно, а затем — 10 мг / сут в течение 5 дней внутривенно). Однако значительного влияния на смертность в первичной конечной точке не наблюдалось, хотя американское исследование 74 , 75 показало значительное увеличение на 7% у пациентов, у которых была небольшая инвалидность или она отсутствовала через 3 месяца после инсульта.Мета-анализ 1375 пациентов показал положительный эффект при инсультах легкой и средней степени тяжести, но не повлиял на тяжелые инсульты. 76 Таким образом, было проведено третье испытание (LUB-INT-13), предназначенное для выявления приблизительно 7% функционального преимущества в группе активного лечения. 77 Результаты отрицательные, разработка остановлена.
Тирилазад мезилат, 21-аминостероид, действует как поглотитель свободных радикалов и обладает антиоксидантным действием.Лечение тирилазадом уменьшает размер инфаркта после преходящей, но не после перманентной очаговой ишемии головного мозга. Тирилазад был протестирован в нескольких клинических испытаниях с неубедительными результатами. Препарат хорошо переносился в суточной дозе 6 мг / кг. 78 , 79 Исследование RANTTASS (рандомизированное испытание тирилазада мезилата у пациентов с острым инсультом) было прекращено из-за недостаточной эффективности. 80 Высвобождение NO и пероксинитрита может подавляться NOS нейронами или индуцибельными блокаторами iNOS.Селективный нейрональный блокатор NOS 7-нитроиндазол и 1- (2-трифторметилфенил%) имидазол значительно уменьшали размер инфаркта после очаговой и глобальной церебральной ишемии у животных. 81 , 82 Блокировка iNOS может быть избирательно достигнута с помощью аминогуанидинов. Сообщалось, что аминогуанидины являются мощными нейропротекторами после очаговой церебральной ишемии. 83 Аминогуанидины, кажется, даже защищают, когда лечение откладывается на 24 часа, что делает их интересными для будущего использования людьми. 84
Еще один многообещающий антиоксидант — селенорганическое соединение эбселен. Эбселен действует посредством эффекта, подобного глутатионпероксидазе. Он подавляет перекисное окисление мембранных фосфолипидов и липоксигеназы в арахидонатном каскаде. Эбселен также блокирует производство супероксид-анионов активированными лейкоцитами, ингибирует iNOS и защищает от пероксинитрита. Было показано, что эбселен обладает нейропротективным действием после временной и постоянной экспериментальной фокальной церебральной ишемии. 85 , 86 Клиническое пилотное исследование показало, что пероральный эбселен (300 мг / сут) хорошо переносится и значительно улучшает функциональный результат при введении в течение 24 часов после инсульта. 87 При введении в течение 12 часов (150 мг / сут%) после ишемии наблюдалась тенденция к уменьшению объема инфаркта и улучшению результатов у пациентов, получавших эбселен. Значительное уменьшение объема инфаркта и исхода произошло только в 6-часовой подгруппе. 88
Антитела к молекулам межклеточной адгезии
Моноклональные антитела против рецептора ICAM-1 на эндотелии сосудов предотвращают активацию лейкоцитов и закупорку.Было показано, что антитела ICAM-1 уменьшают размер инфаркта и улучшают исход после временной, но не постоянной экспериментальной фокальной церебральной ишемии. 89 Результаты рандомизированного плацебо-контролируемого исследования (625 пациентов) с использованием энлимомаба анти-ICAM антитела были отрицательными. Группа лечения получала внутривенно 160 мг в первый день, 40 мг в следующие 4 дня (временное окно 6 часов) и имела еще худший исход и повышенную смертность из-за более высоких показателей лихорадки, инфекции и пневмонии. 90 Считалось, что побочные эффекты связаны с опосредованной комплементом реакцией, запускаемой энлимомабом.
Наиболее изученными цитокинами, которые играют ключевую роль после ишемии и которые можно подавлять фармакологически, являются IL-1β и фактор некроза опухоли α. IL-1β опосредует эксайтотоксичность через активацию рецептора NMDA и активирует молекулы поверхностной адгезии. 91 Следовательно, сверхэкспрессия эндогенных антагонистов рецептора IL-1β или лечение протопорфирином цинка антагонистом IL-1β уменьшает размер инфаркта и отека с временной очаговой ишемией. 92 , 93 Другой цитокин, TFN-α, также может усугублять ишемическое и, в частности, реперфузионное повреждение. 94 Ингибирование фактора некроза опухоли α улучшает церебральный кровоток и уменьшает размер инфаркта после очаговой церебральной ишемии. 95 Другими цитокинами, участвующими в реперфузионном повреждении после ишемии, являются IL-1 и IL-6, фактор активации тромбоцитов и трансформирующий фактор роста-β. Как показали доклинические исследования, ингибирование этих цитокинов может иметь нейропротекторный эффект после церебральной ишемии. 96 -98 Дальнейшие экспериментальные исследования по оценке дозировки и времени приема антагонистов цитокинов в различных моделях фокальной ишемии и у разных видов должны быть завершены до будущей клинической разработки.
Недавние испытания ингибиторов 3-гидрокси-3-метилглутарил-кофермента А-редуктазы (статинов) продемонстрировали значительное снижение частоты ишемического инсульта у пациентов с ишемической болезнью сердца в анамнезе. 99 , 100 Поскольку это снижение не зависело от снижения уровня холестерина в сыворотке, статины могут иметь другие эффекты, помимо их антиартеросклеротических свойств. Профилактическая терапия статинами у животных улучшает церебральный кровоток за счет усиления эндотелиальной NOS и уменьшает размер инфаркта (30%). 101 Статины также ингибируют опосредованную цитокинами (IL-1β, фактор некроза опухоли α%) повышающую регуляцию iNOS и продукцию NO в астроцитах и макрофагах крыс. 102 Кроме того, статины могут снижать окисление липопротеинов и ослаблять повреждения свободными радикалами. 103 , 104 Необходимы дополнительные исследования для определения временного окна, дозировки и механизмов действия, прежде чем статины следует рассматривать для будущего клинического использования при инсульте.
Факторы роста — это эндогенно возникающие полипептиды, которые обладают не только нейропротекторными, но также регенеративными и пролиферативными способностями и поэтому могут быть уникальными кандидатами для лечения инсульта. Было показано, что некоторые факторы роста обладают нейропротективным действием после экспериментальной ишемии in vivo и in vitro.Наиболее изученными факторами роста после очаговой ишемии головного мозга являются основной фактор роста фибробластов, 105 нейротрофический фактор роста мозга, 106 инсулиноподобный фактор роста, 107 и остеогенный белок-1. 108 Все они являются надежными нейропротекторами после острого инсульта и уменьшают размер инфаркта у животных на 35–50%. Возможные механизмы действия после инсульта включают ослабление эксайтотоксичности, улучшение мозгового кровотока и уменьшение апоптоза. 109 , 110 Регенеративные и пролиферативные способности факторов роста после очаговых ишемических поражений убедительно показаны для основного фактора роста фибробластов и остеогенного белка-1. Оба соединения вызывали значительное улучшение поведенческого результата без изменения размера инфаркта при введении через 24 часа после ишемии. 111 , 112 Лечение факторами роста усиливало синаптогенез и прорастание дендритов. 111 Основной фактор роста фибробластов продемонстрировал хороший профиль безопасности в исследовании фазы 2, но исследования фазы 3 были остановлены. 113
Цитиколин (цитидин-5′-дифосфат холин), эндогенное соединение природного происхождения, которое служит промежуточным звеном в синтезе мембранного фосфатидилхолина, как полагают, обладает мембраностабилизирующими функциями и снижает образование свободных жирных кислот во время инсульта. Цитиколин уменьшает размер инфаркта и улучшает неврологический исход в экспериментальных моделях фокальной церебральной ишемии. 114 , 115 В клинических исследованиях лечение цитиколином улучшало когнитивные и поведенческие функции у пациентов с дефицитом памяти. 116 , 117 В исследованиях на людях препарат хорошо переносился без каких-либо известных побочных эффектов. 118 Таким образом, цитиколин был протестирован в исследовании доза-ответ в дозе 0,5, 1 и 2 г, начиная с 24 часов после инсульта. Результат, основанный на индексе Бартеля, был значительно лучше только для группы 0,5 г. 119 Рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3 цитиколина в дозе 0,5 г продемонстрировало отрицательные результаты, хотя апостериорный анализ показал, что лечение у пациентов со средним и тяжелым инсультом улучшилось. 120 Исследование, нацеленное на пациентов с инсультом от средней до тяжелой степени, было недавно завершено и не показало значительного влияния на критерий первичного результата. 121
Пирацетам представляет собой производное γ-аминомасляной кислоты и ноотропное средство с нейропротекторными способностями, опосредованными восстановлением текучести клеточных мембран и поддержанием функций мембраносвязанных клеток. Экспериментальные исследования продемонстрировали нейропротекторный и регенерирующий эффект пирацетама после очаговых поражений. 122 Однако рандомизированное плацебо-контролируемое внутривенное исследование с участием 927 пациентов дало отрицательные результаты по смертности и исходу через 12 недель после инсульта. Только подгруппа пациентов, получавших лечение в течение 7 часов, показала тенденцию к лучшему неврологическому исходу. 123 Начато новое рандомизированное плацебо-контролируемое многоцентровое исследование с 7-часовым временным окном. Амфетамины увеличивают высвобождение норадренергических окончаний норадреналина, дофамина и серотонина и могут быть будущими кандидатами для исследований восстановления после инсульта.D-амфетамин улучшал поведенческий исход и функцию памяти до 60 дней после очаговой церебральной ишемии. Это коррелировало с усилением разрастания неокортекса и синаптогенеза в группе, получавшей D-амфетамин. 47
Изучение эффективных комбинированных методов лечения инсульта кажется рациональным, поскольку церебральная ишемия запускает множество патофизиологических и биохимических событий, которые по-разному влияют на развитие очаговой ишемии.Преодоление различных этапов этого каскада с помощью различных терапевтических агентов может не только синергетически усилить нейрозащитный эффект, но также может позволить использовать более низкие дозы каждого лекарства и, соответственно, уменьшить побочные эффекты. Этот подход продемонстрировал многообещающие результаты в нескольких экспериментальных исследованиях и может служить будущей стратегией терапии инсульта у людей. Например, сочетание низких доз цитиколина с дизоцилпином 124 или основным фактором роста фибробластов 125 значительно уменьшает размер инфаркта после очаговой церебральной ишемии, тогда как одна низкая доза соединений не была эффективной.Стратегии включают не только комбинацию различных нейрозащитных агентов, но также комбинацию тромболизиса и нейропротекции. Добавление акцепторов свободных радикалов, таких как тирилазад, 126 антагонистов AMPA (NBQX), 127 антагонистов NMDA (дизоцилпин), 128 или цитиколин 129 к лечению rt-PA, увеличивает временное окно и усиливает эффект тромболиза после инсульта. Комбинирование агентов для лечения острого заболевания (например, rt-PA, антагонисты NMDA, поглотители свободных радикалов) и восстановительного лечения (например, факторы роста или цитиколин%) могло бы стать важным будущим подходом к терапии инсульта.Однако необходимо провести дополнительные доклинические исследования, прежде чем комбинированная терапия перейдет в клиническую стадию.
Текущее состояние терапии острого инсульта можно уместно охарактеризовать как сочетание «лучших времен и худших времен». Преимущество внутривенного введения rt-PA, начатого в течение 3 часов после начала инсульта, свидетельствует о том, что острый ишемический инсульт действительно может поддаваться лечению. Результаты PROACT-2 демонстрируют, что успешное лечение может быть распространено на отдельных пациентов в течение 6 часов после начала инсульта при введении внутриартериального тромболитического агента.Этим новостям противодействует текущее отсутствие документации о том, что любой предполагаемый нейропротекторный препарат значительно улучшает результат при введении после начала инсульта. Кроме того, одобренное использование в / в rt-PA ограничено США и Канадой, где только очень небольшой процент пациентов с инсультом получает это вмешательство. Многие уроки были извлечены из бесчисленных успешных и безуспешных испытаний тромболитических и нейропротекторных средств, что позволяет предположить, что будущие, лучше спланированные испытания, вероятно, продемонстрируют значительные преимущества при надлежащем безопасном и эффективном медикаментозном лечении, начатом в течение 6 часов после начала инсульта.Кроме того, быстро приближается эпоха испытаний комбинированных лекарственных средств, и именно комбинированные методы лечения, направленные как на сосудистые, так и на клеточные механизмы ишемического повреждения головного мозга, вероятно, будут иметь наибольшее влияние на инвалидность, вызванную инсультом. Сейчас не время отказываться от надежды на разработку безопасных и эффективных методов лечения инсульта, которые будут полезны, если их начать через несколько часов после начала. Скорее, пришло время поразмышлять над уроками, извлеченными из последних научных достижений и клинических испытаний, чтобы лучше двигаться вперед в новое тысячелетие.
Острое лечение ишемического инсульта для улучшения неврологических и функциональных результатов остается сложной задачей, которая может принести огромные выгоды как пациентам, так и системе оказания медицинской помощи. В настоящее время единственной одобренной терапией является внутривенное введение активатора плазминогена тканевого типа, которое назначают в течение 3 часов после начала инсульта у надлежащим образом отобранных пациентов. Внутриартериальная инфузия другого тромболитического агента, проурокиназы, в течение 6 часов после начала инсульта также улучшила исход в одном испытании, но препарат еще не одобрен для общего применения.Большое количество нейропротекторных препаратов было разработано на основе более глубокого понимания механизмов очагового ишемического повреждения головного мозга. Они были изучены в основных клинических испытаниях, и до сих пор нет убедительных доказательств эффективности какого-либо из этих агентов. Есть надежда, что в ближайшее время будет доступна эффективная нейропротективная терапия острого ишемического инсульта, и этот терапевтический подход затем можно будет комбинировать с тромболизисом для усиления преимуществ терапии острого инсульта.
Принята к публикации 14 июня 2000 г.
Мы благодарим Грегори В. Альберса, доктора медицины, и Элейн Дж. Скалабрин, доктора медицины, за их полезные комментарии, а также Линду М. Дикман за ее секретарскую поддержку.
Отпечатки: Marc Fisher, MD, 119 Belmont St, Worcester, MA 01605.
1. Национальный институт неврологических расстройств и инсульта Исследовательская группа rt-PA Stroke, Тканевый активатор плазминогена при остром ишемическом инсульте. N Engl J Med. 1995; 3331581-1587Google ScholarCrossref 2.Фурлан AJHigashida RWechsler L и другие. PROACT II: рекомбинантная проурокиназа (r-ProUK) при острой церебральной тромбоэмболии, первоначальные результаты исследования [аннотация]. Инсульт. 1999; 3030 Google Scholar 3. Шерман Группа авторов DGSTAT, Дефибриногенация с випринексом (анкродом) для лечения острого ишемического инсульта [аннотация]. Инсульт. 1999; 3030 Google Scholar4.Fisher M Нейропротекция острого ишемического инсульта: где мы? Невролог. 1999; 6392-401Google Scholar 5. Национальный институт неврологических расстройств и инсульта, Общая эффективность t-PA при остром инсульте: анализ подгрупп исследования NINDS t-PA Stroke Trial. Инсульт. 1997; 282119-2125Google ScholarCrossref 6.Marler JRTilley BCLu M и другие. Более раннее лечение ассоциировалось с лучшими результатами в исследовании инсульта NINDS t-PA [аннотация]. Инсульт. 1999; 3030Google Scholar7.Chiu DKrieger DVillar-Cordova C и другие.Внутривенный тканевый активатор плазминогена при остром ишемическом инсульте: возможность, безопасность и эффективность в первый год клинической практики. Инсульт. 1998; 2918-22Google ScholarCrossref 8.Egan Р.Луцеп HLClark WR и другие. Открытый тканевый активатор плазминогена при инсульте: опыт штата Орегон. J Stroke Cerebrovasc Dis. 1999; 8298-290Google Scholar9.Tanne DMansbach HHVerro п и другие. Внутривенная терапия RT-PA при инсульте в клинической практике: многоцентровая оценка результатов [аннотация]. Инсульт. 1998; 2929Google ScholarCrossref 10.Wang DZMcLean JMRose JAHonings DMilbrandt JC. Результат внутривенного введения rt-PA при остром ишемическом инсульте в OSF Comprehensive Stroke Center [аннотация]. Неврология. 1998; 50A436Google ScholarCrossref 11.Grond MStenzel CSchmulling S и другие. Ранний внутривенный тромболизис при остром ишемическом инсульте на уровне сообщества. Инсульт. 1998; 2-1549Google ScholarCrossref 12.Albers GWBates VEClark WM и другие. Внутривенный активатор плазминогена тканевого типа для лечения острого инсульта: исследование стандартного лечения активазой для обратного инсульта (STARS).
JAMA. 2000; 2831145-1150Google ScholarCrossref 13.Hacke WKaste М.Фиески C и другие. Рандомизированное двойное слепое плацебо-контролируемое исследование тромболитической терапии с внутривенным введением альтеплазы при остром ишемическом инсульте (ECASS II): исследователи второго европейско-австралийского исследования острого инсульта. Ланцет. 1998; 3521245-1251Google ScholarCrossref 14.Hacke WKaste М.Фиески C и другие. Внутривенный тромболизис рекомбинантным тканевым активатором плазминогена при остром полушарном инсульте: Европейское совместное исследование острого инсульта (ECASS). JAMA. 1995; 2741017-1025Google ScholarCrossref 15. Кларк WMWissman САЛЬБЕРЫ ГВт и другие. Рекомбинантный активатор плазминогена тканевого типа (альтеплаза) при ишемическом инсульте через 3-5 часов после появления симптомов: исследование ATLANTIS. JAMA. 1999; 2822019-2026Google ScholarCrossref 16.Hacke WBrott TCaplan LR и другие. Тромболизис при остром ишемическом инсульте: контролируемые испытания и клинический опыт. Неврология. 1999; 53 (доп.) S3- S14Google ScholarCrossref 17.Fisher МАЛЬБЕРЫ GW Применение диффузионно-перфузионной магнитно-резонансной томографии при остром ишемическом инсульте. Неврология. 1999; 521750–1756Google ScholarCrossref 18.Jansen O Ранняя реканализация при остром ишемическом инсульте сохраняет ткани с риском, определяемым МРТ. Ланцет. 1999; 3532036-2037Google ScholarCrossref 19. Тонг DCYenari MAAlbers GWO’Brien MMarks MPMoseley ME Корреляция МРТ, взвешенных по перфузии и диффузии, с оценкой NIHSS в остром периоде ( Neurology. 1998; 50864-870Google ScholarCrossref 20.Barber PADarby Д.Г.Десмонд ВЕЧЕРА и другие. Прогнозирование исхода инсульта с помощью эхопланарной перфузионной и диффузионно-взвешенной МРТ. Неврология. 1998; 51418-426Google ScholarCrossref 21.Patel М.Р.Дельман RRWarach S Обнаружение острейшего первичного внутрипаренхиматозного кровоизлияния с помощью магнитно-резонансной томографии. Инсульт. 1996; 272321-2324Google ScholarCrossref 22.Schellinger PDJansen OFiebach JBHacke WSartor K Стандартизированный протокол инсульта МРТ: сравнение с КТ при остром внутримозговом кровоизлиянии. Инсульт. 1999; 30765-768Google ScholarCrossref 24.Bowers MPRothlein RFagan Щивин Моноклональные антитела JA, предотвращающие активацию лейкоцитов, уменьшают экспериментальное неврологическое повреждение и повышают эффективность тромболитической терапии. Неврология. 1995; 45815-819Google ScholarCrossref 25.Li FHsu Статлисумак Т и другие. Устранение явных аномалий коэффициента диффузии и отсроченной гибели нейронов после временной фокальной церебральной ишемии у крыс. Ann Neurol. 1999; 46333-342Google ScholarCrossref 26.Кидвелл CSSaver JCMattiello J и другие. Тромболитическая реверсия острого ишемического повреждения головного мозга человека, продемонстрированная с помощью диффузно-перфузионной МРТ [аннотация]. Ann Neurol. 2000; 47462-469Google ScholarCrossref 27.Zhang RLZhang З.Г.Чопп M Повышенная терапевтическая эффективность лечения инсульта у крыс с помощью rt-PA и антител к CD18. Неврология. 1999; 52273-279Google ScholarCrossref 28.Siesjo Б.К. Патофизиология и лечение очаговой ишемии головного мозга, часть II: механизмы поражения и лечение. J Neurosurg. 1992; 77337-354Google ScholarCrossref 30.Rothwell NJHopkins SJ Цитокины и нервная система, II: действия и механизмы действия. Trends Neurosci. 1995; 18130-136Google ScholarCrossref 31. Lindsberg П.Дж.Халленбек JMFeuerstein G Фактор активации тромбоцитов при инсульте и черепно-мозговой травме. Ann Neurol. 1991; 30117–129Google ScholarCrossref 32. Haring HPBerg ЭЛЦурушита NTagaya Мдел Зоппо GJ E-селектин появляется в неишемизированной ткани во время экспериментальной фокальной церебральной ишемии. Инсульт. 1996; 271381-1391Google ScholarCrossref 33.Zhang RChopp Мчжан ZJiang NPowers C Экспрессия P- и E-селектинов в трех моделях окклюзии средней мозговой артерии. Brain Res. 1998; 785207-214Google ScholarCrossref 34.Forster CClark HBRoss MEIadecola C Индуцируемая экспрессия синтазы оксида азота при инфарктах головного мозга человека. Acta Neuropathol (Berl). 1999; 97215-220Google ScholarCrossref 35.Иадекола Чжан FCasey РНагаяма MRoss ME Замедленное уменьшение ишемического повреждения головного мозга и неврологического дефицита у мышей, лишенных индуцибельного гена синтазы оксида азота. J Neurosci. 1997; 179157-9164Google Scholar, 36. Ногава. SZhang FRoss MEIadecola Экспрессия гена C циклооксигеназы-2 в нейронах способствует ишемическому повреждению головного мозга. J Neurosci. 1997; 172746-2755Google Scholar 37.Loddick SARothwell NJ Нейропротекторные эффекты человеческого рекомбинантного антагониста рецептора интерлейкина-1 при очаговой церебральной ишемии у крыс. J Cereb Blood Flow Metab. 1996; 16932-940Google ScholarCrossref 38.Li YChopp MJiang NYao ФЗалога C. Временной профиль фрагментации ДНК in situ после временной окклюзии средней мозговой артерии у крысы. J Cereb Blood Flow Metab. 1995; 15389-397Google ScholarCrossref 40.Adams JMCory S Семейство белков Bcl-2: арбитры выживания клеток. Наука. 1998; 2811322-1326Google ScholarCrossref 41.Финк КЖУ ДжНамура S и другие. Длительное терапевтическое окно при ишемическом повреждении головного мозга, вызванном отсроченной активацией каспаз. J Cereb Blood Flow Metab. 1998; 181071-1076Google ScholarCrossref 42.Endres MNamura Шимидзу-Сасамата M и другие. Ослабление отсроченной гибели нейронов после легкой очаговой ишемии у мышей путем ингибирования семейства каспаз. J Cereb Blood Flow Metab. 1998; 18238-247Google ScholarCrossref 43.Schäbitz WRSommer CZoder WKiessling MSchwab S Внутривенный BDNF уменьшает размер инфаркта и противодействует экспрессии Bax и Bcl-2 после временной фокальной церебральной ишемии. Инсульт. 2000; 312212-2217Google ScholarCrossref 44.Nudo RJMilliken GW Реорганизация двигательных представлений в первичной моторной коре после очаговых ишемических инфарктов у взрослых беличьих обезьян. J Neurophysiol. 1996; 752144-2149Google Scholar 45.Нудо RJWise BMSiFuentes FMilliken GW Нейронные субстраты для влияния реабилитационных тренировок на восстановление моторики после ишемического инфаркта. Наука. 1996; 2721791-1794Google ScholarCrossref 46. Kawamata TAlexis NEDietrich WDFinklestein SP Интракистернальный основной фактор роста фибробластов (bFGF) усиливает восстановление поведения после очагового инфаркта мозга у крыс. J Cereb Blood Flow Metab. 1996; 16542-547Google ScholarCrossref 47.Штромер РПКент Т.А. Хульсебош CE Усиление разрастания неокортикальных нервов, синаптогенеза и восстановления поведения при терапии D-амфетамином после инфаркта неокортекса у крыс. Инсульт. 1998; 292381-2393Google ScholarCrossref 48.Grotta JC Клинические аспекты использования антагонистов кальция при цереброваскулярных заболеваниях. Clin Neuropharmacol. 1991; 14373-390Google ScholarCrossref 49. Гельмеры HJGorter Кде Вердт CJWiezer HJ Контролируемое исследование нимодипина при остром ишемическом инсульте. N Engl J Med. 1988; 318203-207Google ScholarCrossref 50.Wahlgren NMacMahon DGDeKeyser J и другие. Внутривенное введение нимодипина в Западноевропейское исследование инсульта (INWEST) нимодипина в лечении острого ишемического инсульта. Cerebrovasc Dis. 1994; 4204-210Google ScholarCrossref 51.Mohr JOrgagozzo JMHarrison MJG и другие. Метаанализ исследований перорального приема нимодипина при остром ишемическом инсульте. Cerebrovasc Dis. 1994; 4197-203Google ScholarCrossref 52.Рог JHaas RVermuelen MLimburg M VENUS (очень раннее применение нимодипина при инсульте): предварительные результаты испытаний [аннотация]. Инсульт. , 1999; 3030, Google Scholar, 53. Фейгин. В.Л.Ринкель GJEAlgra AVermuelen MVan Gijn J Антагонисты кальция у пациентов с аневризматическим субарахноидальным кровоизлиянием: систематический обзор. Неврология. 1998; 50876-883Google ScholarCrossref 54.Park CKNehls Д.Г.Грэм Д.И.Тисдейл GMMcCulloch J Антагонист глутамата MK-801 снижает очаговое ишемическое повреждение головного мозга у крыс. Ann Neurol. 1988; 24543-551Google ScholarCrossref 55.Choi DW Методы противодействия нейротоксичности глутамата. Cerebrovasc Brain Metab Rev. 1990; 2105-147 Google Scholar 56. Татлисумак TTakano KMeiler MRFisher M Антагонист сайта глицина, ZD9379, уменьшает количество распространяющихся углублений и размер инфаркта у крыс с постоянной окклюзией средней мозговой артерии. Инсульт. 1998; 29190-195Google ScholarCrossref 57.Takano К.Татлисумак TFormato J и другие.Антагонист глицинового сайта уменьшает размер инфаркта при экспериментальной очаговой ишемии: исследования патологоанатомического исследования и диффузионного картирования. Инсульт. 1997; 281255-1262Google ScholarCrossref 58.Lees KR Cerestat и другие антагонисты NMDA при ишемическом инсульте. Неврология. 1997; 49S66- S69Review.Google ScholarCrossref 59.Davis SMAlbers GWDiener HCLees KRNorris J Прекращение исследований острого инсульта, включающих лечение Сельфотелем: Руководящий комитет ASSIST [письмо]. Ланцет. 1997; 349349Google ScholarCrossref 60.Albers GWAtkinson Р.П.Келли Розенбаум DMDextrorphan Study Group, Безопасность, переносимость и фармакокинетика декстрорфана, антагониста N -метил-D-аспартата у пациентов с острым инсультом. Инсульт. 1995; 26254-258Google ScholarCrossref 61. Fisher MCNS1102 Investigators, Cerestat (CNS 1102), неконкурентный антагонист NMDA, у пациентов с ишемическим инсультом: исследование безопасности с повышением дозы [аннотация]. Cerebrovasc Dis. 1994; 44Google ScholarCrossref 62.Albers GWClark WMAtkinson RP и другие. Исследование увеличения дозы антагониста сайта глицина NMDA, ACEA, при остром ишемическом инсульте [аннотация]. Инсульт. 1997; 2828Google Scholar63.Lees KRLavelle Дж. Ф. Хоббингер Европейская исследовательская группа SFGain, Безопасность и переносимость GV150526 при остром инсульте [аннотация]. Cerebrovasc Dis. 1998; 88 Google Scholar 64.Lees Международная исследовательская группа КРГАИН, Результаты международного исследования GAIN.Документ представлен на 25-й Международной конференции по инсульту, собрании Американской ассоциации по инсульту, январь 2000 г. Новый Орлеан, штат Луизиана
65. Мюр KWLees KR Рандомизированное двойное слепое плацебо-контролируемое пилотное исследование внутривенного введения магния при остром инсульте. Инсульт. 1995; 261183-1186Google ScholarCrossref 66.Turski LHuth ASheardown M и другие. ZK200775: антагонист фосфонат хиноксалиндиона AMPA для нейропротекции при инсульте и травмах. Proc Natl Acad Sci U S A. 1998; 9510960-10965Google ScholarCrossref 67.Green ARCross AJSnape MFdeSouza RJ Непосредственные последствия окклюзии СМА на синтез ГАМК в коре головного мозга и мозжечке мышей. Neurosci Lett. 1992; 138141-144Google ScholarCrossref 68.Hossman К.А. Деполяризации периинфаркта. Cerebrovasc Brain Metab Rev. 1996; 16202-213 Google Scholar 69.Sydserff SGCross AJGreen AR Нейропротекторный эффект хлометиазола на ишемическое повреждение нейронов после стойкой ишемии средней мозговой артерии у крысы. Нейродегенерация. 1995; 4323-328Google ScholarCrossref 70.Lyden ПД ГАМК и нейропротекция. Зеленый ARCross AJ Нейропротекторные средства и церебральная ишемия . Лондон, Англия Academic Press Ltd 1997; 233–258 Google Scholar 71. Уолгрен NGRawasinha KWРозолаччи Т и другие. Исследование острого инсульта клометиазолом (CLASS): результаты рандомизированного контролируемого исследования клометиазола по сравнению с плацебо у 1360 пациентов с острым инсультом. Инсульт. 1999; 3021-28Google ScholarCrossref 72.Aronowski JStrong RGrotta JC Лечение экспериментальной очаговой ишемии у крыс любелузолом. Нейрофармакология. 1996; 35689-693Google ScholarCrossref 73.Culmsee CJunker VWolz П.С. Семкова И.Кригльштейн J Lubeluzole защищает нейроны гиппокампа от эксайтотоксичности in vitro и снижает повреждение мозга, вызванное ишемией. Eur J Pharmacol. 1998; 342193-201Google ScholarCrossref 74.Гротта JUS и канадская группа изучения ишемического инсульта любелузолом, лечение острым ишемическим инсультом любелузолом. Инсульт. 1997; 282338-2346Google ScholarCrossref 75.Diener HC Европейская и австралийская группа изучения ишемического инсульта любелузола, Многонациональное рандомизированное контролируемое исследование любелузола при остром ишемическом инсульте. Cerebrovasc Dis. 1998; 8172-181Google ScholarCrossref 76. Hantson LWessel T Лечебные эффекты любелузола при ишемическом инсульте [аннотация]. Инсульт. 1998; 2929Google ScholarCrossref 77.Diener HC Lubeluzole при остром инсульте: отсутствие эффективности в большом исследовании III фазы с 8-часовым окном [аннотация]. Инсульт. 1999; 3030Google Scholar78.STIPAS Investigators, Исследование безопасности тирилазада мезилата у пациентов с острым ишемическим инсультом (STIPAS). Инсульт. 1994; 25418-423Google ScholarCrossref 79.Peters GRHwang LJMusch BBrosse DMOrgogozzo JM Безопасность и эффективность 6 мг / кг / сут мезилата тирилазада у пациентов с острым ишемическим инсультом. Инсульт. 1996; 2727Google Scholar80.RANTTAS Investigators, Рандомизированное исследование мезилата тирилазада у пациентов с острым ишемическим инсультом. Инсульт. 1996; 271453-1458Google ScholarCrossref 81. Escott KJBeech JSHaga К.К.Уильямс SCMeldrum BSBath PM Церебропротекторный эффект ингибиторов синтазы оксида азота, 1- (2-трифторметилфенил%) имидазола и 7-нитроиндазола после временной фокальной церебральной ишемии у крыс. J Cereb Blood Flow Metab. 1998; 18281–287Google ScholarCrossref 82.Nanri KMontecot CSpringhetti VSeylaz JPinard E Селективный ингибитор нейрональной синтазы оксида азота, 7-нитроиндазол, снижает отсроченное повреждение нейронов из-за ишемии переднего мозга у крыс. Инсульт. 1998; 2-1253Google ScholarCrossref 83.Cockcroft KMMeistrell М. Циммерман GA и другие. Церебропротекторный эффект аминогуанидина на модели инсульта на грызунах. Инсульт. 1996; 271393–1398Google ScholarCrossref 84.Iadecola Чжан FXu X Ингибирование iNOS улучшает ишемическое повреждение головного мозга. Am J Physiol. 1995; 268R286- R292Google Scholar85 Dawson Дамасаясу HGraham DIMacrae IM Нейропротекторная эффективность эбселена (% миметика глутатионпероксидазы) при повреждении головного мозга, вызванном транзиторной фокальной церебральной ишемией у крыс. Neurosci Lett. 1995; 18565-69Google ScholarCrossref 86.Такасаго TPeters EEGraham ДИМасаясу HMacrae IM Нейропротекторная эффективность эбселена, антиоксиданта с противовоспалительным действием, на модели постоянной окклюзии средней мозговой артерии на грызунах. Br J Pharmacol. 1997; 1221251-1256Google ScholarCrossref 87. Ямагути TSano К.Такакура K и другие. Эбселен при остром ишемическом инсульте: плацебо-контролируемое двойное слепое клиническое исследование. Инсульт. 1998; 2912-17Google ScholarCrossref 88.Огава AYoshimoto Т.Кикучи ЧАС и другие. Эбселен при острой окклюзии средней мозговой артерии: плацебо-контролируемое двойное слепое клиническое исследование. Cerebrovasc Dis. 1999; 9112–118Google ScholarCrossref 89.Zhang RLChopp MSiang N и другие. Антитело против молекулы-1 межклеточной адгезии снижает повреждение ишемических клеток после временной, но не постоянной окклюзии средней мозговой артерии у крыс Wistar. Инсульт. 1995; 261438–1442Google ScholarCrossref 90.Группа исследования острого инсульта энлимомаба, Окончательные результаты исследования острого инсульта энлимомаба. Неврология. 1997; 48A270Google ScholarCrossref 91.Jean WCSpellman SRNussbaum ESLow WC Реперфузионное повреждение после очаговой ишемии головного мозга: роль воспаления и терапевтический горизонт. Нейрохирургия. 1998; 431382-1396Google Scholar92.Betz ALYang GYDavidson BL Уменьшение размера удара у крыс с использованием аденовирусного вектора для индукции сверхэкспрессии антагониста рецептора интерлейкина-1 в головном мозге. J Cereb Blood Flow Metab. 1995; 15547-551Google ScholarCrossref 93.Kadoya CDomino EFYang GYStern JDBetz AL Преишемическая, но не постишемическая терапия протопорфирином цинка уменьшает размер инфаркта и накопление отека после временной фокальной церебральной ишемии у крыс. Инсульт. 1995; 261035-1038Google ScholarCrossref 94.Barone FCArvin BWhite РФ и другие. Фактор некроза опухоли альфа: медиатор очагового ишемического повреждения головного мозга. Инсульт. 1997; 281233-1244Google ScholarCrossref 95.Dawson Д.А.Мартин Д.Халленбек JM Ингибирование фактора некроза опухоли альфа снижает очаговое ишемическое повреждение головного мозга у крыс со спонтанной гипертензией. Neurosci Lett. 1996; 21841-44Google ScholarCrossref 96.Panetta TMarcheselli VLBraquet ПБазан Н.Г. Метаболизм арахидоновой кислоты и церебральный кровоток в нормальном, ишемизированном и реперфузированном мозге песчанок. Ann N Y Acad Sci. 1989; 559340-351Google ScholarCrossref 97.Prehn JHBackhauss CKrieglstein J Трансформирующий фактор роста-бета 1 предотвращает нейротоксичность глутамата в культурах неокортекса крыс и защищает неокортекс мыши от ишемического повреждения in vivo. J Cereb Blood Flow Metab. 1993; 13521-525Google ScholarCrossref 98.Gross CEBednar MMHoward DBSporn MB, трансформирующий фактор роста бета 1, уменьшает размер инфаркта после экспериментальной церебральной ишемии на модели кролика. Инсульт. 1993; 24558-562Google ScholarCrossref 99.Sacks FMPepper МАМой ЛА и другие. Исследователи по холестерину и рецидивирующим явлениям, Влияние правастатина на коронарные события после инфаркта миокарда у пациентов со средним уровнем холестерина. N Engl J Med. 1996; 3351001-1009Google ScholarCrossref 100.Stalenhoef AF Скандинавское исследование симвастатина (4S). Ланцет. 1994; 3441766-1767Google Scholar101.Endres MLaufs Ухуанг Z и другие.Защита от инсульта с помощью ингибиторов 3-гидрокси-3-метилглутарил (HMG) -CoA-редуктазы, опосредованных эндотелиальной синтазой оксида азота. Proc Natl Acad Sci U S A. 1998; 958880- 8885Google ScholarCrossref 102.Pahan К.Шейх Ф.Г.Намбудири AMSingh I Ловастатин и фенилацетат подавляют индукцию синтазы оксида азота и цитокинов в первичных астроцитах, микроглии и макрофагах крыс. J Clin Invest. 1997; 1002671-2679Google ScholarCrossref 103.Хусейн OSchlezinger С.Розенблат М.Кейдар Савирам M Пониженная восприимчивость липопротеинов низкой плотности (ЛПНП) к перекисному окислению липидов после терапии флувастатином связана с гипохолестеринемическим действием препарата и его связыванием с ЛПНП. Атеросклероз. 1997; 12811-18Google ScholarCrossref 104.Chen LHaught ПОЧЕМУ BSaldeen TGParathasarathy SMehta JL Сохранение эндогенной антиоксидантной активности и ингибирование перекисного окисления липидов как общие механизмы антиатеросклеротического действия витамина Е, ловастатина и амлодипина. J Am Coll Cardiol. 1997; 30569-575 Google ScholarCrossref 105. Fisher MMeadows MEDo Т и другие. Отсроченное введение основного фактора роста фибробластов внутривенно уменьшает размер инфаркта после перманентной очаговой ишемии головного мозга у крыс. J Cereb Blood Flow Metab. 1995; 15953-959Google ScholarCrossref 106.Schäbitz WRSchwab SSpranger MHacke W Внутрижелудочковый нейротрофический фактор головного мозга уменьшает размер инфаркта после очаговой церебральной ишемии у крыс. J Cereb Blood Flow Metab. 1997; 17500-506Google ScholarCrossref 107.Loddick SALiu XJLu ZX и другие. Вытеснение инсулиноподобных факторов роста из связывающих их белков как потенциальное лечение инсульта. Proc Natl Acad Sci U S A. 1998; 951894-1898Google ScholarCrossref 108.Lin С.Жоффер BJKaplan PWang Y OP-1 защищает от инфаркта мозга, вызванного лигированием MCA у крыс. Инсульт. 1999; 30126-133Google ScholarCrossref 109.Freese А.Финклештейн SPDiFiglia M Основной фактор роста фибробластов защищает нейроны полосатого тела in vitro от опосредованной NMDA-рецепторами эксайтотоксичности. Brain Res. 1992; 575351-355Google ScholarCrossref 110.Tanaka RMiyasaka YYada KOhwada Т.Камея T Основной фактор роста фибробластов увеличивает регионарный церебральный кровоток и уменьшает размер инфаркта после экспериментальной ишемии на модели крыс. Инсульт. 1995; 262154-2159Google ScholarCrossref 111.Кавамата TRen JChan Т.К. Шаретт MFinklestein SP Интракистернальный остеогенный белок-1 способствует восстановлению функций после фокального инсульта. Нейроотчет. 1998;–1445Google ScholarCrossref 112.Kawamata TDietrich DWSchallert E и другие. Интракистернальный основной фактор роста фибробластов усиливает функциональное восстановление и регулирует экспрессию молекулярного маркера разрастания нейронов после очагового инфаркта мозга. Proc Natl Acad Sci U S. A. 1997; 948179-8184Google ScholarCrossref 113. Группа исследования безопасности FIBLAST, Клиническая безопасность внутривенного bFGF при остром инсульте. Инсульт. 1998; 2929Google ScholarCrossref 114.Schabitz WRWeber JTakano K и другие. Эффекты длительного лечения цитиколином при временной экспериментальной очаговой ишемии. J Neurol Sci. 1996; 13821-25Google ScholarCrossref 115.Aronowski JStrong RGrotta JC Citicoline для лечения экспериментальной очаговой ишемии: гистологические и поведенческие результаты. Neurol Res. 1996; 18570-574Google Scholar 116.Spiers PAMyers DHochanadel Г.С.Либерман HRWurtman Цитиколин RJ улучшает словесную память при старении. Arch Neurol. 1996; 53441-448Google ScholarCrossref 117.Alvarez XA и другие. Цитиколин улучшает память у пожилых людей. Методы Найдите Exp Clin Pharmacol. 1997; 19201–210 Google Scholar118.Tazaki Ысакаи FOtomo E и другие.Лечение острого инфаркта мозга предшественником холина в многоцентровом двойном слепом плацебо-контролируемом исследовании. Инсульт. 1988; 19211-216Google ScholarCrossref 119. Кларк WMWarach С.Дж.Петтигрю LCGammans RESabounjian LACiticoline Stroke Study Group, рандомизированное исследование зависимости реакции от дозы цитиколина у пациентов с острым ишемическим инсультом. Неврология. 1997; 49671-678Google ScholarCrossref 120.Clark WMWilliams BJSelzer KA. Для группы исследования острого ишемического инсульта с цитиколином: рандомизированное исследование эффективности цитиколина у пациентов с острым ишемическим инсультом. Инсульт. 1999; 302592-2597Google ScholarCrossref 121.Gammans RESherman Исследователи DGECCO 200, исследование ECCO цитиколина для лечения острого ишемического инсульта [аннотация]. Инсульт. 2000; 3131 Google Scholar122.Coq JOXerri C Острая реорганизация представительства передней лапы в коре SI крыс после очагового коркового повреждения: нейропротективные эффекты лечения пирацетамом. Eur J Neurosci. 1999; 112597-2608Google ScholarCrossref 123.Де Дейн PPReuck JDDeberdt WVlietinck Роргогозо JMPiracetam в группе исследования острого инсульта (PASS), лечение острого ишемического инсульта пирацетамом. Инсульт. 1997; 282347-2352Google ScholarCrossref 124.Önal MZLi Ф.Татлисумак Т и другие. Синергетические эффекты цитиколина и МК-801 при временной экспериментальной очаговой ишемии у крыс. Инсульт. 1997; 281060-1065Google ScholarCrossref 125.Schäbitz WRLi FIrie K и другие.Синергетические эффекты комбинации низких доз bFGF и цитиколина после временной экспериментальной очаговой ишемии. Инсульт. 1999; 30427- 432Google ScholarCrossref 126.Meden Повергард KPedersen HBoysen G Эффект раннего лечения тирилазадом в сочетании с отсроченной тромболитической терапией при эмболическом инсульте у крыс. Cerebrovasc Dis. 1996; 6141-148Google ScholarCrossref 127.Meden Повергард KSereghy TBoysen G Повышение эффективности тромболизиса за счет блокирования рецептора AMPA с помощью NBQX на модели эмболического инсульта на крысах. J Neurol Sci. 1993; 119209-216Google ScholarCrossref 128.Zivin JAMazzarella V Тканевый активатор плазминогена в сочетании с антагонистами глутамата улучшает исход после эмболического инсульта. Arch Neurol. 1991; 481235-1240Google ScholarCrossref 129.Anderson MMeden Повергард KBoysen G Эффекты комбинированной терапии цитиколином на модели эмболического инсульта у крыс. Инсульт. 1999; 301464-1471Google ScholarCrossrefграниц | Контроль артериального давления во время и после реканализационной терапии острого ишемического инсульта
Введение
Инсульт — это обычная неотложная неврологическая ситуация во всем мире, частота которой в целом растет, особенно в странах с низким и средним уровнем дохода, где за последние четыре десятилетия число инсультов увеличилось более чем на 100% (1).Приблизительно 85% из них имеют ишемическое происхождение, и в течение последних двух десятилетий внутривенный тканевый активатор плазминогена (IV t-PA) был основой лечения пациентов с острым ишемическим инсультом (AIS), который проявлялся в течение 3 часов, а затем увеличился до 4,5 часов. с момента последней хорошо известной (2, 3). Внутривенное введение t-PA снижает частоту функциональной зависимости примерно у одной трети людей, но многим пациентам с AIS это лечение не приносит пользы (2, 3). За последние несколько лет многочисленные исторические исследования предоставили неопровержимые доказательства того, что внутриартериальная терапия (IAT) с механической тромбэктомией, проводимая в течение 6 часов после последней хорошо известной окклюзии крупных сосудов (LVO), приводит к значительному улучшению функциональных результатов и снижению смертности (4). –7).Совсем недавно исследования DEFUSE III и DAWN продемонстрировали, что IAT может принести пользу пациентам, пролеченным до 16 и 24 часов, если у них есть благоприятный образец несоответствия при визуализации перфузии (8, 9). Хотя эти достижения изменили парадигму лечения острого инсульта и могут рассматриваться как часть рутинной помощи, остается несколько нерешенных вопросов, касающихся оптимального лечения пациентов с AIS, особенно в отношении гемодинамического управления. Хотя повышение артериального давления (АД) часто встречается при ОИС, прогностическое значение этого неясно (10, 11).Некоторые исследования обнаружили корреляцию между артериальной гипертензией и плохими результатами, в то время как другие сообщили об обратной связи (12–15). Кроме того, рекомендации по гемодинамическому лечению после тромболитической терапии при AIS в значительной степени экстраполированы из исследований IV t-PA, а также ретроспективного анализа (16). Таким образом, отсутствуют высококачественные доказательства для руководства лечением после IAT. Цель этого обзора — обсудить физиологию и доступные данные, касающиеся гемодинамики в AIS, с особым акцентом на том, как можно оптимально управлять артериальным давлением на протяжении всего процесса реваскуляризации.
Патофизиология
Чтобы понять принципы управления артериальным давлением во время реваскуляризации AIS, полезно рассмотреть фундаментальные аспекты кровотока при церебральной ишемии и инфаркте. После полного прекращения мозгового кровотока (CBF) происходит потеря нормальной нейрональной электрической активности в течение нескольких секунд из-за энергетического сбоя, нарушения ионного гомеостаза и деполяризации мембраны (17, 18). Если перфузия не восстанавливается в течение нескольких минут, возникает необратимое повреждение, ведущее к инфаркту (19).Однако ишемический инсульт — это очаговый процесс, и полная потеря CBF наблюдается редко. Вместо этого вокруг окклюзированной сосудистой территории существуют области умеренной гипоперфузии с сохранной функцией, ишемическая ткань, которую можно спасти, но с нерегулируемыми клеточными процессами (так называемая полутень), и инфаркт с необратимым повреждением (17).
Ранние клинические исследования с использованием пережатия сонной артерии показали, что риск перехода от ишемической ткани к инфаркту зависит как от величины, так и от продолжительности гипоперфузии (17).Кроме того, если CBF восстанавливается своевременно, ишемическая ткань может быть спасена и восстановлена до нормального функционирования. Нейроны в пределах полутени очень уязвимы к изменениям местного перфузионного давления, вызванным отеком, изменениями системного АД или изменениями церебральной вазореактивности, и поддерживают относительно сохраненное потребление кислорода, несмотря на более низкий CBF из-за увеличения фракции экстракции кислорода (20). , 21). Хотя порог инфаркта во многом зависит от продолжительности и степени гипоперфузии, индивидуальные факторы, включая эластичность сосудов и коллатеральные сосуды между внутричерепным и экстракраниальным кровообращением, могут влиять на устойчивость полутени (17).После острой окклюзии сосуда перфузионное давление дистальнее сгустка падает, что приводит к градиенту давления, при котором начинается ретроградный ток через коллатерали, тем самым достигая достаточного уровня CBF для поддержания жизнеспособности полутени (22). В этом случае падение АД или увеличение тканевого давления из-за местного масс-эффекта может привести к ослаблению коллатерального градиента и усугубить ишемию (23). Клинически это продемонстрировано в AIS, поскольку пациенты с более прочными коллатералями часто имеют более низкое АД, вероятно, из-за адекватной перфузии до полутени, и улучшенные клинические результаты по сравнению с пациентами с плохой коллатерализацией (24, 25).Кроме того, наличие устойчивого коллатерального кровообращения предсказывает более высокую вероятность реканализации после IAT, а в случаях, когда процедура не увенчалась успехом, наблюдается уменьшение объема инфаркта по сравнению с пациентами с плохой коллатерализацией (26, 27).
В здоровом мозге CBF жестко регулируется для удовлетворения региональных метаболических потребностей, и это достигается за счет процесса церебральной ауторегуляции, в результате чего кровеносные сосуды уровня сопротивления сужаются или расширяются в диапазоне системного давления (обычно среднее артериальное давление [MAP] между 50 и 150 мм рт. Ст.), Чтобы поддерживать более постоянный поток (28).Когда давление падает ниже нижнего предела ауторегуляции, окружающая паренхима мозга становится ишемической и, в конечном итоге, инфарктом, если CBF быстро не восстанавливается. И наоборот, когда MAP превышает способность церебральной ауторегуляции, происходит линейное увеличение CBF, что приводит к отеку и кровоизлиянию. При AIS нарушение кровотока приводит к нарушению регуляции множественных клеточных процессов, которые могут включать механизмы ауторегуляции в пределах полутени, что делает CBF напрямую зависимым от системного давления (28, 29).Хотя ранние исследования с использованием инъекции радиоактивных индикаторов подтвердили изменения CBF в ишемическом полушарии пропорционально изменениям в MAP, разрешение этих методов не позволило отличить полутень от основного инфаркта (28). В более новых исследованиях были получены различные результаты: сообщения о нарушении ауторегуляции как в глобальном масштабе, так и в пределах ишемического полушария контрастируют с недавним исследованием, в котором не было обнаружено изменений в региональном CBF после изменений в MAP с использованием позитронно-эмиссионной томографии (ПЭТ) высокого разрешения (30, 31).Хотя эти выводы были сделаны на основе измерений статической ауторегуляции, в которых региональные изменения CBF оценивались в один момент времени после манипуляции с АД, в последнее время акцент сместился в сторону динамической ауторегуляции с использованием таких методов, как транскраниальный допплер, для отслеживания мгновенных изменений кровотока в ответ. к колебаниям АД (28, 30). В отличие от статической ауторегуляции, которая часто сохраняется в AIS, недавние исследования показали, что динамическая ауторегуляция может быть особенно уязвимой для ишемического инсульта и может оставаться ненормальной в течение нескольких недель после обращения (30, 32).Хотя нарушения динамической ауторегуляции кажутся обычными для ряда подтипов инсульта и могут указывать на избирательное повреждение центральных вегетативных управляющих сетей, клиническая значимость остается неясной и является предметом продолжающихся исследований (30, 33).
Хотя восстановление CBF важно для выживания ишемической ткани, реперфузия сама по себе может способствовать значительному неврологическому повреждению в виде инфаркта, отека и геморрагической трансформации (34, 35). Реперфузионное повреждение — сложный и не до конца понятный процесс, однако было идентифицировано несколько важных основных патофизиологических механизмов.Сразу после реканализации часто наблюдается резкое увеличение CBF, вероятно, в результате нарушения ауторегуляции, а также высвобождения сосудорасширяющих веществ, что приводит к гиперперфузии и возможности вторичного клеточного повреждения (18, 36). На величину церебральной гиперемии, по-видимому, отчасти влияет продолжительность ишемии, и в исследованиях МРТ гиперперфузия после тромболизиса чаще всего наблюдалась в областях гипоперфузии до лечения и была независимым предиктором возможного инфаркта (36).После реканализации также может существовать парадоксальное состояние гипоперфузии, называемое феноменом отсутствия перфузии, которое может привести к стойкому инфаркту и, как полагают, является результатом дисфункции микрососудов, связанной с набуханием астроцитов и эндотелиальных клеток, а также усилением воспаления и агрегации тромбоцитов (37, 38 ). На клеточном уровне реперфузия после продолжительной ишемии приводит к гиперпродукции митохондрий токсичных активных форм кислорода, вызывающих воспаление и запускающих высвобождение металлопротеиназ внеклеточного матрикса (ММП), которые ферментативно разрушают базальную пластинку эндотелия и увеличивают проницаемость микрососудов (39, 40).Нарушение целостности гематоэнцефалического барьера (ГЭБ), в свою очередь, приводит к формированию вазогенного отека мозга и в клинических исследованиях является сильным предиктором геморрагической трансформации и плохого неврологического исхода после реваскуляризации (41).
Артериальное давление при остром инсульте
Повышенное АД часто встречается у пациентов с ОИС: в одном исследовании с участием более 250 000 пациентов было продемонстрировано систолическое артериальное давление (САД)> 140 мм рт.ст. примерно у трех четвертей пациентов (10).Тяжелая артериальная гипертензия также относительно распространена, почти у 10% пациентов наблюдается САД> 200 мм рт. Ст. (42). Многочисленные обсервационные исследования определили повышенное АД как фактор риска отека мозга, кровоизлияний и, как правило, худших клинических исходов после AIS (43–45). Однако эта связь не обязательно указывает на причинную связь. Напротив, артериальная гипертензия может быть маркером тяжести инсульта, например, в случае окклюзии конца сонной артерии или плохой коллатерализации, когда спонтанно повышенное артериальное давление может служить компенсаторным механизмом для поддержания церебральной перфузии (25, 46).При каких обстоятельствах эти механизмы становятся неадаптивными и непосредственно способствуют повреждению головного мозга, остается неясным и требует дальнейшего уточнения в ходе клинических испытаний.
В нескольких когортах существует U-образная связь между АД и исходом в AIS, в которой оба крайних значения АД имеют прогностическое значение для смерти и инвалидности. В ретроспективном анализе Международного исследования инсульта пациенты с САД 140–179 мм рт. Ст. Имели самую низкую вероятность смерти или зависимости через 6 месяцев с надиром около 150 мм рт. Ст. (42).На каждые 10 мм рт. Ст. Выше САД 150 мм рт. Ст. У пациентов наблюдалось повышение риска смерти на 3,6% и повышение риска повторного инсульта на 4,2% в течение следующих 6 месяцев. Для пациентов с САД> 200 мм рт.ст. риск инсульта увеличивался более чем на 50%. Напротив, относительная гипотензия также была пагубной: риск смерти на каждые 10 мм рт. Ст. Ниже 150 мм рт. Ст. Повышался на 17,9%; пациенты с САД <120 мм рт. ст. имели худшие результаты и более высокую частоту коронарных событий. Аналогичные результаты были получены в других исследованиях с немного другими пороговыми значениями АД, дающими наиболее благоприятные исходы.В работе, проведенной Веммосом и его коллегами, наилучшие результаты наблюдались при значениях САД около 130 мм рт. Ст., В то время как в исследовании клиники Мэйо оптимальный порог САД находился в диапазоне 156–220 мм рт. повышение риска смертности при эпизодах гипотензии (47). Аналогичным образом в работе Castillo et al. пациенты имели более низкую смертность и большую функциональную независимость при САД около 180 мм рт.ст., причем конечные объемы инфаркта были самыми высокими среди пациентов с САД значительно выше или ниже этого значения (15).Интересно, что резкое снижение САД (> 20 мм рт. Ст.) Было определено как самый сильный предиктор неблагоприятного исхода и было связано с большим конечным объемом инфаркта более 60 мл, что позволяет предположить, что динамические изменения АД могут быть особенно вредными для уязвимой ишемической ткани.
В клинических исследованиях динамические колебания АД были идентифицированы как сильный прогностический маркер при AIS и увеличивают риск внутричерепного кровоизлияния после в / в t-PA (12). Вариабельность АД может быть особенно вредной в условиях обширных инфарктов, где она была независимо связана с худшими клиническими исходами (12, 48).В одном исследовании пациенты с вариабельностью АД, по-видимому, имели худшие результаты при наличии надежных коллатералей, несмотря на схожие гемодинамические профили (48). Причины этих открытий не совсем ясны, однако это может быть связано с повышенной передачей колебаний давления в ишемическую полутень. Хотя влияние вариабельности АД кажется более очевидным на начальных стадиях ишемии, одно исследование показало, что ежедневная вариабельность в течение 1 недели была выше у пациентов с плохими результатами через 1 год (14).В целом, похоже, что ишемическая ткань может быть особенно восприимчивой к колебаниям системного АД, вероятно, в результате нарушения ауторегуляции и узких ишемических порогов, что приводит либо к гипоперфузии с инфарктом, либо к скачкам перфузии с последующим отеком (15, 28). В таблице 1 представлены результаты нескольких наблюдательных исследований, связанных с артериальным давлением и исходом ишемического инсульта.
Таблица 1 . Наблюдательные исследования, изучающие влияние артериального давления на острый ишемический инсульт.
Гемодинамическое лечение острого ишемического инсульта
Текущие практические рекомендации и этапы управления
В рекомендациях Американской кардиологической ассоциации (AHA) по лечению AIS от 2018 г. может быть разрешено повышение АД до 220/120 мм рт.ст. у пациентов с AIS, которые не являются кандидатами на внутривенное введение t-PA или IAT и не имеют другого противопоказание к повышению АД (16). У пациентов, у которых существует такое противопоказание, например, при остром коронарном приступе, декомпенсированной сердечной недостаточности или преэклампсии, снижение АД должно быть индивидуальным, с рекомендуемым начальным снижением на 15%.Пациентам, которым назначена внутривенная терапия t-PA, рекомендуется поддерживать АД ниже 185/110 мм рт. Ст. Во время инфузии и 180/105 мм рт. Ст. В течение следующих 24 часов. Эти пороговые значения в значительной степени экстраполированы из исследований тромболизиса при инфаркте миокарда, а также пилотных данных до исследования t-PA Национального института неврологических заболеваний (NINDS) и впоследствии были подтверждены в ретроспективных исследованиях, где более высокое АД значительно увеличивало риск геморрагической трансформации 2, 16, 45, 50).Напротив, существует нехватка проспективных данных, которые могли бы помочь в управлении АД при IAT, особенно при рассмотрении степени постпроцедурной реканализации. Помимо исследования ESCAPE, во всех исследованиях стержневой тромбэктомии пороговое значение АД составляло 185/110 мм рт. Таким образом, текущие руководящие принципы AHA рекомендуют поддерживать АД ниже 185/110 мм рт.ст., но признают отсутствие рандомизированных контролируемых исследований, подтверждающих эту позицию (рекомендация класса IIb) (16).
Общий подход к лечению AIS многогранен и основан на оптимизированных системах помощи для выявления, сортировки и лечения пациентов с острыми неврологическими симптомами с целью восстановления церебральной перфузии и минимизации вторичных травм. Чтобы оценить аспекты гемодинамического управления в AIS, конструктивно разделить его на этапы лечения, начиная с начальной оценки, во время реваскуляризации и после вмешательства (см. Рисунок 1).На каждом этапе представлены несколько разные соображения относительно гемодинамического управления, а также стратегии физиологической оптимизации, направленные на максимальное увеличение шансов на хорошее выздоровление.
Рисунок 1 . Схема управления гемодинамикой на разных этапах реваскуляризации острого ишемического инсульта. (A) Компьютерная томография (КТ), ангиограмма, демонстрирующая отсутствие помутнения (красная стрелка) правой средней мозговой артерии (R MCA), соответствующее окклюзии крупных сосудов.Среднее время прохождения увеличивалось в пределах территории R MCA при сохранении объема церебральной крови, соответствующем полутени. (B) КТ выявляет геморрагическую трансформацию на территории R MCA. (C) Магнитно-резонансная томография (МРТ), демонстрирующая повышенный сигнал на диффузионно-взвешенной визуализации (DWI) в пределах территории R MCA, соответствующий острому инфаркту. (D) Отсутствие реперфузии (красная стрелка) в R MCA (оценка тромболизиса при инфаркте мозга (TICI) 0). (E) Полная реперфузия в пределах R MCA (оценка TICI 3). * Рекомендации Американской кардиологической ассоциации / Американской ассоциации инсульта по раннему ведению пациентов с острым ишемическим инсультом, 2018 г. ‡ Общество нейробиологов в области анестезиологии и реанимации. Консенсусное заявление экспертов: анестезиологическое обеспечение эндоваскулярного лечения острого инсульта.
Этап I: Первоначальная оценка
Гипертензия очень распространена в AIS: 21–50% пациентов с артериальным давлением выше порогового значения, подходящим для внутривенного введения t-PA (11, 42, 49).Наибольшую озабоченность в отношении терапии t-PA вызывает риск кровотечения, который составлял приблизительно 6% в первоначальном исследовании NINDS t-PA и был в значительной степени подтвержден в последующем анализе при соблюдении пороговых значений АД по тому же протоколу (2, 51, 52). Анализ исследования SITS-ISTR (ретроспективный анализ безопасного применения тромболизиса при инсульте — Международный регистр тромболизиса инсульта) продемонстрировал линейную взаимосвязь между САД и симптоматическим кровотечением, при этом риск в четыре раза выше для пациентов с САД> 170 мм рт. те, у которых 141–150 мм рт. ст. (53).В свете этих данных целесообразно достичь порога 185/110 мм рт. Ст. Для пациентов, которым назначена внутривенная терапия t-PA. Однако следует соблюдать осторожность, чтобы избежать значительных колебаний артериального давления, которые могут быть связаны с побочными эффектами. В исследовании NINDS t-PA пациенты, получавшие препараты, снижающие АД, имели более резкое снижение АД и худшие результаты через 3 месяца по сравнению с пациентами с гипертонией, не получавшими лекарств (54). В последующем анализе общее снижение САД> 50 мм рт.ст. или резкое падение> 30 мм рт.ст. было связано с плохими функциональными результатами, в то время как резкое падение> 60 мм рт.ст. увеличивало риск смерти в 2 раза (55).
Для пациентов, которые являются кандидатами на IAT, имеется значительно меньше данных для управления исходным артериальным давлением. Однако ретроспективный анализ позволяет сделать некоторые выводы. В исследовании «Механическое удаление эмбола при церебральной ишемии» (MERCI) у пациентов с САД> 150 мм рт. Ст. Реканализация была ниже, чем у пациентов с более низким давлением, несмотря на схожие характеристики тромба (56). Поскольку более высокое АД часто связано с плохими коллатералями, эти данные могут означать, что у этих пациентов максимальный градиент давления на сгусток, приводящий к закупорке и более сложному извлечению (25).Влияние повышенного САД на ВАТ не может быть связано только с успехом реваскуляризации, однако одно когортное исследование показало, что более низкое САД при поступлении было независимо связано с более благоприятным трехмесячным исходом даже после статистической корректировки для полной реваскуляризации (57). В многоцентровом рандомизированном клиническом исследовании эндоваскулярного лечения острого ишемического инсульта в Нидерландах (MR CLEAN) была очевидна U-образная взаимосвязь между САД и плохим функциональным исходом с нижним (наиболее благоприятным) уровнем АД 120 мм рт. На 21% увеличивается относительный риск кровотечения на каждые 10 мм рт. Ст. Выше этого значения (58).Следует отметить, что не было никакой взаимосвязи между АД и преимуществами IAT по клиническим или рентгенологическим показателям, что указывает на то, что тромбэктомия безопасна и эффективна в широком диапазоне АД. Аналогичные результаты были отмечены в реестре эндоваскулярного лечения ишемического инсульта, где риск смертности при САД <110 и> 180 мм рт. Ст. Был в 3,78 и 1,81 раза выше, соответственно, по сравнению со 150 мм рт. Ст. (59). Подобно другим исследованиям в AIS, крайние значения АД, по-видимому, имеют негативные прогностические последствия для пациентов, подходящих для IAT, независимо от успеха реканализации.Существует значительная потребность в проспективных исследованиях, оценивающих, каким пациентам может быть полезно повышение артериального давления до лечения. На основании имеющихся данных испытаний, а также наблюдательных исследований, демонстрирующих худшие результаты и менее успешную реканализацию при более высоком АД, разумно снизить АД в острой стадии до менее 185/110 мм рт.ст., особенно если пациенты также могут быть кандидатами на внутривенное вливание. t-PA терапия.
Еще один важный аспект, который следует учитывать при оценке пациентов с АИС на начальном этапе, — это состояние внутрисосудистого объема.В нескольких обсервационных исследованиях до половины пациентов с AIS дегидратированы (что определяется как повышенное отношение BUN к креатинину), и это коррелирует с повышением внутрибольничной смертности и помещением в стационар при выписке (60, 61). Пациенты, особенно подверженные риску обезвоживания, включают пожилых людей и женщин, которые предположительно имеют более низкую мышечную массу, а также тех, кто прописал диуретики до появления инсульта (60, 62). При AIS гиповолемия может нарушать CBF в восприимчивых к ишемии областях и отрицательно влиять на развитие коллатеральных сосудов (63).В то время как Кокрановский обзор 2015 года не обнаружил разницы между режимами парентерального введения коллоидной или кристаллоидной жидкости в отношении исходов в AIS, ни каких-либо данных для определения надлежащего объема или продолжительности терапии, исследования не были предназначены для оценки эффективности лечения в острых условиях или для пациентов, которые обладали серологическими маркерами обезвоживания (64). Необходимы дальнейшие исследования для оценки влияния режимов жидкостной реанимации на пациентов с AIS и обезвоживанием. В то же время разумно следить за тем, чтобы пациенты не истощились, особенно если было длительное время простоя, и лечить парентеральными жидкостями, если это необходимо для борьбы с эуволемией.
Фаза II: во время реваскуляризации
Для пациентов, перенесших IAT, предикторами неблагоприятного исхода являются более высокий балл по шкале инсульта Национального института здравоохранения (NIHSS), более низкий балл по шкале инсульта Альберты (ASPECTS), окклюзия конца сонной артерии и неудачная реканализация (65, 66). Как и в других аспектах AIS, повышенное АД во время IAT было связано с худшими результатами: в одном крупном обсервационном исследовании было определено максимальное внутрипроцедурное САД как самый сильный гемодинамический предиктор (66).В этом исследовании пациенты с благоприятными исходами имели среднее максимальное САД 164 мм рт. Ст. По сравнению с пациентами с неблагоприятными исходами, у которых среднее максимальное САД составляло 181 мм рт. Эти результаты подчеркивают уязвимое состояние, которое существует в реперфузированной ткани из-за нарушения ауторегуляции и нарушения ГЭБ с повышением системного давления, способствующим вторичному повреждению. Однако следует соблюдать осторожность перед агрессивным снижением повышенного АД, поскольку внутрипроцедурное снижение АД сильно коррелирует с менее благоприятными исходами.В одном исследовании снижение MAP более чем на 40% было определено как особый фактор риска стойких неврологических нарушений (66, 67). Принимая во внимание очевидные пагубные последствия любого из крайних значений АД во время процедуры, Общество нейробиологов в области анестезиологии и интенсивной терапии рекомендует поддерживать САД на уровне 140-180 мм рт.ст. во время ВАТ с тщательным исследованием любых эпизодов гипотонии, которые могут указывать на повреждение конечного органа или кровотечение. или истощение объема (68).
С появлением IAT в качестве популярного метода лечения пациентов с LVO возникло множество вопросов относительно оптимальных методов лечения, в том числе о том, предпочтительнее ли общая анестезия (GA) или седация (CS) для пациентов, перенесших тромбэктомию.CS предлагает преимущества, позволяющие проводить неврологическое обследование на протяжении всей процедуры и устранять задержки, связанные с введением анестезии. GA, с другой стороны, может снизить риск аспирации и устранить движение пациента, что потенциально делает процедуру более безопасной и технически выполнимой (68). Ранние обсервационные исследования обнаружили тесную связь между ГА и увеличением времени до вмешательства, процедурными осложнениями, продолжительностью пребывания в ОИТ и частотой трахеостомии (69–71).Кроме того, в Североамериканском реестре SOLITAIRE лечение CS было связано с 40% большей вероятностью хорошего клинического исхода и в три раза меньшим риском смерти по сравнению с GA (70).
Хотя эти исследования, кажется, предоставляют убедительные доказательства того, что CS предпочтительнее GA, необходимо решить несколько важных методологических вопросов. Во-первых, все эти исследования были ретроспективными и обладают значительной систематической ошибкой отбора, поскольку пациенты, получавшие ГА, с большей вероятностью имели более высокие баллы по шкале NIHSS, более низкие показатели ASPECTS и с большей вероятностью имели окклюзию конца сонной артерии и вертебробазилярную окклюзию, а также преморбидную ишемическую болезнь сердца (69, 70, 72–75).В нескольких исследованиях после контроля исходной тяжести инсульта с помощью ASPECTS или NIHSS отрицательное влияние ГА больше не было статистически значимым (72, 73). Во-вторых, обычное наблюдение во многих из этих анализов заключалось в том, что ГА связана со значительной гипотензией и колебаниями артериального давления, особенно во время индукционной фазы анестезии (70, 73, 75, 76). В исследовании Davis et al., Внутрипроцедурное САД> 140 мм рт. Ст. Было связано с хорошими результатами, однако это было достигнуто только у 4% пациентов, получавших GA, по сравнению с 60%, получавших CS (75).Точно так же в исследовании MR CLEAN использование GA было связано с более значительным падением MAP с более длительными эпизодами гипотензии, несмотря на увеличение использования вазопрессоров (76). Эти наблюдения подчеркивают влияние, которое анестетики могут оказывать на сосудистый тонус, и возможность провоцировать гипотензию при AIS. Однако эти риски не изолированы только от GA. В исследовании, посвященном оценке пациентов, получавших CS, было обнаружено, что более низкое САД перед реканализацией является независимым предиктором результата, так что на каждые 10 мм рт. Ст. Снижение ниже 100 мм рт. > 10% — самый высокий риск смерти или инвалидности (77).
Недавно были опубликованы три рандомизированных контролируемых клинических испытания, сравнивающих влияние CS на GA у пациентов, получавших IAT. В отличие от предыдущих ретроспективных анализов, пациенты, получавшие CS, не имели лучших результатов по сравнению с теми, кто прошел GA, и в обоих случаях седация и интубация для эндоваскулярного лечения инсульта (SIESTA) и общая или местная анестезия при внутриартериальной терапии (GOLIATH) исследований, ГА была связана с более высокими показателями функциональной независимости через 3 месяца (78–80).В то время как время до пункции в паховой области было немного увеличено для ГА, общее время до реперфузии было значительно уменьшено, а показатели успешной реканализации были улучшены в исследовании GOLIATH, что подчеркивает потенциальную пользу ГА для улучшения эффективности процедуры (78). Другой ключевой вывод из этих исследований — важность агрессивного внутрипроцедурного контроля АД с точки зрения результатов лечения пациентов. Хотя GA был связан с более частым падением MAP> 20% от исходного уровня по сравнению с CS, не было значимой разницы в больших падениях MAP (определяемых как снижение> 40% или MAP <70 мм рт. Ст.) Между GA и CS (78, 80).Поразительное несоответствие этих результатов по сравнению с предыдущими обсервационными исследованиями может быть связано с повышенным вниманием к внутрипроцедурной гипотензии и строгими протоколами для поддержания узкого целевого САД 140–160 мм рт. Ст. И САД> 70 мм рт. Ст. (78, 79). Эти испытания предоставляют неопровержимые доказательства того, что как CS, так и GA являются разумными подходами к ведению пациентов, подвергающихся IAT, при условии строгого контроля АД и наличия систем, обеспечивающих минимальные задержки при подготовке пациентов к интервенционному комплексу и на протяжении всей реканализации. процедура.Кроме того, в случаях, когда существуют потенциальные противопоказания для КС, может быть более выгодным начать с ГА, а не срочно преобразовывать тип анестезии в менее контролируемую среду. Это подчеркивается в исследовании GOLIATH, где четыре пациента, первоначально назначенных на CS, должны были быть переведены на GA из-за движения или потери защиты дыхательных путей и в конечном итоге перенесли обширные инфаркты (78).
Фаза III: после реваскуляризации
Рекомендации AHA по ишемическому инсульту рекомендуют поддерживать АД <180/105 мм рт. Ст. В течение не менее 24 часов у пациентов, получавших внутривенный t-PA или IAT, для улучшения перфузии в ишемические области при одновременном снижении потенциальных рисков внутричерепного кровоизлияния (16, 53).У пациентов, получавших только t-PA внутривенно по поводу LVO, эти рекомендации имеют смысл с патофизиологической точки зрения, поскольку индивидуальный статус реканализации часто неизвестен в клинических условиях, а в исследованиях, где проводилась ангиография, частота ранней реваскуляризации составляет только около 20% (81). , 82). Напротив, ВБТ связана с реканализацией в 70–80% случаев, и это можно легко подтвердить во время процедуры путем полной антероградной реперфузии или реперфузии более чем на половине ранее окклюзированной территории (оценка тромболизиса при инфаркте мозга [TICI] 3 и 2б соответственно) (83).У этих пациентов риск реперфузионного повреждения при давлении, приближающемся к 180/105 мм рт.ст., предположительно может превышать риск гипоперфузии с более низкими целевыми значениями АД.
После успешной реканализации часто наблюдается значительное спонтанное снижение АД в течение 12–24 часов по сравнению с пациентами со стойкой окклюзией (84, 85). Как для реканализированных, так и для нереканализированных пациентов устойчивое повышение АД в течение первых 24–48 часов после лечения было определено как фактор риска внутричерепного кровоизлияния, а также как худшие функциональные исходы (86–89).Точно так же вариабельность артериального давления чаще встречается у пациентов с плохой или неполной реканализацией и коррелирует с большим размером инфаркта, внутричерепным кровоизлиянием и худшими исходами после тромбэктомии (85, 89–91). Поскольку большинство этих исследований носят наблюдательный характер, остаются вопросы относительно причинности этих отношений. Например, работа, проделанная Дельгадо-Медерос и его коллегами, показала, что вариабельность артериального давления была связана с увеличением роста поражения DWI, хотя эта взаимосвязь присутствовала только у пациентов с отсутствующей реканализацией, что ставит под сомнение, является ли вариабельность артериального давления сама по себе фактором риска для церебральная травма или маркер более тяжелого инсульта (85).Несмотря на эти ограничения, при сравнении пациентов на основании статуса реканализации было сделано несколько интересных наблюдений. В португальском исследовании пациентов, перенесших тромболизис, люди с плохой реканализацией продемонстрировали U-образную зависимость АД и исходов с надиром 120–130 мм рт. благоприятные исходы, возникающие при самом низком давлении (<110 мм рт. ст.) (88).Эти результаты показывают, что баланс между гипоперфузией и реперфузионным повреждением может быть смещен у пациентов после хорошей реканализации, так что риски обострения ишемии снижаются при физиологических параметрах, в то время как более высокое системное давление напрямую способствует церебральному повреждению. Подобные результаты были получены в большой группе пациентов после IAT, где среднее САД для внутричерепного кровоизлияния было ниже после успешной реканализации (170 против 196 мм рт. Ст.), Что указывает на разницу в порогах реперфузионного повреждения в зависимости от степени реканализации сосудов (92).
Хотя рандомизированные исследования контроля АД после IAT отсутствуют, Goyal et al. опубликовал опыт одного центра с различными целевыми показателями BP после IAT в течение 4 лет. После хорошей реперфузии пациентам назначалось разрешающее (<220/110 мм рт. Ст. Или 180/110 мм рт. Ст. При внутривенном введении t-PA), умеренное (<160/90 мм рт. Ст.) Или интенсивное (<140/90 мм рт. нерандомизированная мода (87). В то время как пациенты в группах средней и интенсивной терапии чаще получали гипотензивные препараты, трехмесячная смертность в этих группах была значительно ниже (6.5%) по сравнению с теми, у кого разрешительный порог (28,7%). Из-за неконтролируемого ретроспективного дизайна исследования нельзя исключить смешение между целевыми показателями АД и когортными популяциями, и поэтому результаты следует рассматривать с осторожностью. Тем не менее, это исследование предоставляет доказательства того, что более низкий порог АД может быть полезным у пациентов, достигших хорошего статуса реканализации. С введением IAT в качестве стандарта лечения LVO, теперь необходимы проспективные многоцентровые исследования для более точной оценки оптимальных целевых значений АД у пациентов с полной, частичной или отсутствующей реканализацией после попытки тромбэктомии.Между тем, может быть разумным установить более низкое целевое АД для пациентов с отличной реперфузией (TICI 2b / 3) и минимальным объемом инфаркта, как это было в случае исследования DAWN, где пациентам назначали интенсивную (<140 мм рт. Ст.) цель, чтобы предотвратить реперфузионное повреждение (93). В случаях неполной или плохой реперфузии существует значительно меньше данных, которые могут помочь в ведении лечения. Тем не менее, более высокое целевое значение АД является разумным в попытке предотвратить дальнейшую ишемию, особенно если есть доказательства колебаний неврологического обследования в контексте изменений системного АД.
Фармакология
Для лечения артериальной гипертензии при инсульте обычно используются различные агенты, однако клинические испытания с использованием агентов АД в AIS оказались безрезультатными с некоторыми сообщениями о предельной пользе или ее отсутствии, в то время как другие предполагают риск более тяжелой инвалидности у пролеченных пациентов. Исследования с использованием ингибиторов ангиотензинпревращающего фермента (АПФ) или блокаторов кальциевых каналов в острой гипертонической фазе AIS продемонстрировали значительное резкое снижение артериального давления, однако это не сопровождалось изменениями смертности или инвалидности через 14 или 90 дней (94–96) .Более того, в исследовании инсульта с бета-блокаторами (BEST) использование атенолола или пропранолола сразу после AIS было связано с тенденцией к увеличению смертности, особенно среди пожилых людей (97). В соответствии с этими разрозненными выводами, в Кокрановском обзоре 26 исследований 2014 г. было обнаружено недостаточно доказательств, подтверждающих немедленное возобновление или рутинное введение препаратов АД во время острой фазы инсульта (98). Важно отметить, что многие из этих испытаний включали участников с первичным внутримозговым кровоизлиянием, и ни одно из них не относилось к пациентам, получавшим внутривенное лечение t-PA или IAT, что еще раз подчеркивает необходимость исследований, специально оценивающих целевые значения АД после реваскуляризационной терапии.Одним из исследований, которое может помочь восполнить этот пробел в знаниях, является исследование усиленного контроля гипертонии и тромболизиса (ENCHANTED), которое представляет собой рандомизированное контролируемое испытание 2 × 2, в котором одна группа оценивает влияние раннего интенсивного снижения АД до САД 130– 140 мм рт. Ст. У пациентов, которым назначена тромболитическая терапия (99). Учитывая текущее клиническое уравновешивание различных агентов по исходам, выбор часто определяется побочными реакциями, специфичными для терапии, и их доступностью. В целом агенты с быстрым началом действия и короткой продолжительностью действия предпочтительны в острых условиях, чтобы быстро достичь гемодинамических целей и избежать длительных периодов гипотензии.В таблице 2 представлена фармакология некоторых наиболее часто используемых препаратов для лечения острого артериального давления.
Таблица 2 . Внутривенные гипотензивные средства при АИС.
Лабеталол
Лабеталол — это смешанный альфа- и бета-адреноблокатор, часто используемый для контроля артериального давления после АИС. Хотя лабеталол имеет меньшую активность β-1 по сравнению с другими бета-блокаторами, он может оказывать отрицательные хронотропные эффекты, тем самым ограничивая его полезность у пациентов со значительной брадикардией (100).Однако он оказывает минимальное влияние на CBF или потребление кислорода, что делает его подходящим средством для пациентов с AIS или другой внутричерепной патологией (101).
Никардипин
Как блокатор дигидропиридиновых кальциевых каналов, никардипин более селективен в отношении сосудистых, чем миокардиальных кальциевых каналов, и обычно оказывает нейтральное влияние на частоту сердечных сокращений (102). По сравнению с лабеталолом, никардипин обеспечивает более быстрое и контролируемое снижение АД со значительно меньшей вариабельностью (100, 101).Несмотря на эти очевидные преимущества, прямые исследования не выявили различий в клинических исходах между двумя препаратами, а стоимость терапии никардипином значительно выше (101, 103).
Клевидипин
Клевидипин — это новый дигидропиридиновый блокатор кальциевых каналов, который также включен в качестве лечебного средства в рекомендации AHA 2018 (16). Подобно никардипину, клевидипин, как правило, не снижает частоту сердечных сокращений и, согласно ретроспективному анализу, имеет аналогичную эффективность в снижении АД, хотя требует введения меньшего объема, что может быть оптимальным для пациентов с перегрузкой объемом (104, 105).Поскольку клевидипин изготавливается в виде липидной эмульсии, существует неотъемлемый риск гипертриглицеридемии и панкреатита, для которых рекомендуется суточный максимум 1000 мл (или около 21 мг / ч в день) (106).
Гидралазин
Гидралазин — это сосудорасширяющее средство прямого действия, которое часто используется при неотложных состояниях гипертонии (107). Несмотря на свою эффективность в снижении АД, гидралазин может повышать внутричерепное давление (ВЧД), одновременно снижая САД, что приводит к снижению перфузионного давления и увеличению риска ишемии (108).Кроме того, гидралазин оказывает длительное и часто непредсказуемое действие на АД, что может способствовать резкому падению давления и значительной вариабельности (109). По этим причинам гидралазин менее предпочтителен для AIS, однако его можно рассматривать, когда другие агенты недоступны.
Эналаприлат
Эналаприлат, активный метаболит эналаприла, является внутривенным ингибитором ангиотензинпревращающего фермента (АПФ), который может снижать АД, не влияя на хронотропию сердца (107).Кроме того, считается, что ингибиторы АПФ нейтральны по отношению к ВЧД, что делает эналаприл потенциально полезным для пациентов с внутричерепной патологией (110). Однако ограничением является большая продолжительность действия, 12–24 ч, что ограничивает возможность титрования агента до конкретных целей АД (107). Кроме того, следует соблюдать осторожность при использовании ингибиторов АПФ в контексте введения tPA, поскольку существует повышенный риск оролингвального ангионевротического отека, который встречается редко, но может быть опасным для жизни (111).
Нитропруссид натрия
Нитропруссид натрия является сильнодействующим венозным и артериальным сосудорасширяющим средством, часто используемым в качестве инфузии при неотложной гипертонической болезни (112). Однако из-за своего сосудорасширяющего действия на сосуды головного мозга нитропруссид натрия может приводить к увеличению ВЧД у пациентов с нарушенной ауторегуляцией за счет увеличения объема крови внутри внутричерепного свода (113, 114). Кроме того, соединение нитропруссида натрия содержит цианид, который может накапливаться, что приводит к токсичности (112).В группу риска входят пациенты, которым вводят умеренные или высокие дозы, а также пациенты с гипоальбуминемией или перенесшие искусственное кровообращение (115). Таким образом, несмотря на мощные антигипертензивные свойства нитропруссида, возможность влияния на объем церебральной крови и ВЧД делает его менее идеальным при АИС и других формах внутричерепной патологии. Однако его можно рассмотреть в случаях, когда другие препараты недоступны или противопоказаны из-за особенностей пациента.
Тринитрат глицерина
Глицерилтринитрат, или нитроглицерин, является донором оксида азота, который в первую очередь вызывает расширение вен, а также расширение артерий при высоких дозах, тем самым эффективно снижая преднагрузку и АД (106). Глицерилтринитрат чаще всего используется при остром инфаркте миокарда и нестабильной стенокардии из-за его способности снижать потребность сердца в кислороде, но в последнее время появилась литература, в которой оценивается его использование при AIS. В исследовании ENOS (эффективность оксида азота при инсульте), которое в основном проводилось в Европе и Азии, исследователи изучали использование трансдермального пластыря тринитрата глицерина у пациентов с AIS или геморрагическим инсультом в дозе 5 мг в день в течение 7 дней по сравнению с плацебо.Хотя трансдермальный тринитрат глицерина был эффективен в снижении артериального давления, значительного улучшения функционального результата через 90 дней не наблюдалось (116). Следует отметить, что в литературе, содержащей в основном небольшие обсервационные исследования, предполагается, что нитроглицерин может повышать ВЧД, хотя клиническое значение этого неясно (117).
Урапидил
Урапидил — это антигипертензивное средство, доступное в Европе и Азии и рекомендованное Европейской инициативой по борьбе с инсультом (EUSI), хотя в настоящее время оно не одобрено Ассоциацией по контролю за продуктами и лекарствами США (FDA).Урапидил — уникальное антигипертензивное средство, которое вызывает периферическую вазодилатацию за счет антагонизма к альфа-1-адренорецепторам, а также оказывает симпатолитическое действие через стимуляцию рецептора серотонина 5HT1A (118). Исследования на животных также продемонстрировали потенциальные нейропротекторные эффекты урапидила, что еще больше увеличивает его потенциал для лечения пациентов с AIS (119). Хотя обычно считается, что урапидил оказывает нейтральное влияние на ВЧД, более поздние исследования, в которых участвовали два пациента с травмой головы, а также когорта здоровых добровольцев, предполагают, что введение препарата может привести к увеличению ВЧД (119, 120).
Индуцированная гипертензия
На животных моделях AIS индуцированная гипертензия (IH) улучшает CBF до ишемической территории и снижает конечный объем инфаркта по сравнению с контрольной группой с нормальным давлением (121, 122). В этом случае часто используется фенилэфрин из-за его чистых агонистических свойств рецептора α-1, который вызывает периферическую вазоконстрикцию без значительного воздействия на сосудистую сеть головного мозга, тем самым улучшая перфузионное давление (123). Хотя ИГ иногда используется в клинической практике, особенно если есть свидетельства изменений в неврологическом обследовании при различных значениях артериального давления, имеется мало клинических данных, подтверждающих его использование.В пилотном исследовании 2001 г., в котором использовался фенилэфрин у пациентов с ОИС, целевое значение АД не менее 160 мм рт.ст. или повышение на 20% по сравнению с поступлением было связано с краткосрочным улучшением показателей NIHSS у более чем половины пациентов без каких-либо связанных с этим осложнений (124). . Последующее пилотное клиническое испытание с использованием IH у пациентов с большим несоответствием диффузии и перфузии продемонстрировало значительное улучшение NIHSS, когнитивных показателей и гипоперфузии ткани в течение 3 дней по сравнению с контролем (125). В свете этих результатов необходимы дальнейшие исследования для определения клинической применимости IH.Этому посвящено рандомизированное многоцентровое исследование фазы III SETIN-HYPERTENSION (NCT01600235), целью которого является определение безопасности и эффективности фенилэфрина у пациентов с некардиоэмболическим инсультом.
Заключение
Управление гемодинамикой в AIS — это сложный и сложный процесс, направленный на уравновешивание конкурирующих интересов поддержки CBF до ишемической полутени при одновременном предотвращении реперфузионного повреждения. Десятилетия наблюдательных исследований продемонстрировали U-образную связь между АД и исходами инсульта.Однако исследования, направленные на контроль гемодинамики, оказались безрезультатными. В условиях тромболитической терапии маятник может сместиться от более высокого риска гипоперфузии к риску реперфузионного повреждения, поэтому контроль АД особенно важен. Это особенно актуально при IAT, где частота реканализации LVO значительно выше, чем при других методах лечения, и пациенты, подвергшиеся реваскуляризации, могут получить пользу от более низких пороговых значений АД для предотвращения внутричерепного кровоизлияния и отека мозга.Хорошо спланированные проспективные многоцентровые контролируемые клинические испытания теперь необходимы для лучшего понимания взаимосвязи между различными целевыми показателями АД во время и после эмболэктомии с особым вниманием к взаимодействиям со статусом реканализации. Между тем, тщательный мониторинг и управление гемодинамикой необходимы для предотвращения значительной гипо- или гипертензии, а также для минимизации вариабельности АД, чтобы наилучшим образом способствовать восстановлению тканей при одновременном предотвращении вторичного повреждения.
Авторские взносы
Концепция и дизайн рукописи JH и JV.Первоначальный проект рукописи СП. MT и JH критический обзор рукописи и добавление разделов. Все авторы просмотрели, отредактировали и одобрили окончательную версию.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Фейгин В.Л., Лоус К.М., Беннетт Д.А., Баркер-Колло С.Л., Параг. В. Заболеваемость инсультом и ранняя летальность во всем мире, указанные в 56 популяционных исследованиях: систематический обзор. Ланцет Нейрол . (2009) 8: 355–69. DOI: 10.1016 / S1474-4422 (09) 70025-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Группа изучения инсульта Национального института неврологических расстройств и инсульта. Активатор тканевого плазминогена при остром ишемическом инсульте. N Engl J Med . (1995) 333: 1581–8. DOI: 10.1056 / NEJM199512143332401
CrossRef Полный текст
3. Хаке В., Касте М., Блумки Е., Брозман М., Давалос А., Гвидетти Д. и др.Тромболизис альтеплазой через 3–4,5 часа после острого ишемического инсульта. New Engl J Med. (2008) 359: 1317–29. DOI: 10.1056 / NEJMoa0804656
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Saver JL, Goyal M, Bonafe A, Diener HC, Levy EI, Pereira VM, et al. Стент-ретриверная тромбэктомия после внутривенного введения t-PA по сравнению с одним t-PA при инсульте. New Engl J Med. (2015) 372: 2285–2295. DOI: 10.1056 / NEJMoa1415061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Беркхемер OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ, et al. Рандомизированное исследование внутриартериального лечения острого ишемического инсульта. N Engl J Med. (2015) 372: 11–20. DOI: 10.1056 / NEJMoa1411587
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Кэмпбелл BC, Mitchell PJ, Kleinig TJ, Dewey HM, Churilov L, Yassi N, et al. Эндоваскулярная терапия ишемического инсульта с выбором перфузионной томографии. N Engl J Med. (2015) 372: 1009–18.DOI: 10.1056 / NEJMoa1414792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Гоял М., Демчук А.М., Менон Б.К., Иса М., Ремпель Д.Л., Торнтон Дж. И др. Рандомизированная оценка быстрого эндоваскулярного лечения ишемического инсульта. N Engl J Med . (2015) 372: 1019–30. DOI: 10.1056 / NEJMoa1414905
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Ногейра Р.Г., Джадхав А.П., Хаусен Д.К., Бонафе А., Будзик Р.Ф., Бхува П. и др. Тромбэктомия через 6-24 часа после инсульта с несоответствием между дефицитом и инфарктом. N Engl J Med . (2018) 378: 11. DOI: 10.1056 / NEJMoa1706442
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Альберс Г.В., Маркс М.П., Кемп С., Кристенсен С., Цай Дж. П., Ортега-Гутьеррес С. и др. Тромбэктомия при инсульте через 6–16 часов с выбором перфузионной томографии. N Engl J Med. (2018) 378: 708. DOI: 10.1056 / NEJMoa1713973
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Куреши А.И., Эззеддин М.А., Насар А., Сури М.Ф., Кирмани Д.Ф., Хусейн Н.М. и др.Распространенность повышенного артериального давления у 563704 взрослых пациентов с инсультом, поступивших в отделение неотложной помощи США. Am J Emerg Med. (2007) 25: 32–8. DOI: 10.1016 / j.ajem.2006.07.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Мэннинг Л.С., Ротвелл П.М., Поттер Дж. Ф., Робинсон Т. Г.. Прогностическое значение краткосрочной вариабельности артериального давления при остром инсульте: систематический обзор. Инсульт. (2015) 46: 2482–2490. DOI: 10.1161 / STROKEAHA.115.010075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Робинсон Т.Г., Доусон С.Л., Ахмед У., Манктелоу Б., Фотерби, доктор медицины, Поттер Дж. Ф. Круглосуточное систолическое артериальное давление позволяет прогнозировать долгосрочную смертность после острого инсульта. J Hyperten. (2001) 19: 2127–34. DOI: 10.1097 / 00004872-200112000-00003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ши Зи, Ли Е.С., Чжун Дж.С., Юань Дж.Л., Ли Л.Р., Чжэн С.В. Прогностическая значимость ежедневной изменчивости артериального давления при остром ишемическом инсульте для 12-месячных функциональных результатов. Ам Дж. Гипертен . (2017) 30: 1769. DOI: 10.1093 / ajh / hpx005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Кастильо Дж., Лейра Р., Гарсия М.М., Серена Дж., Бланко М., Давалос А. Снижение артериального давления во время острой фазы ишемического инсульта связано с травмой головного мозга и плохим исходом инсульта. Инсульт (2004) 35: 520–6. DOI: 10.1161 / 01.STR.0000109769.22917.B0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Пауэрс В., Рабинштейн А., Акерсон Т., Адеойе О.М., Бамбакидис Н.С., Беккер К. и др. Рекомендации 2018 г. по раннему ведению пациентов с острым ишемическим инсультом: руководство для медицинских работников от американской кардиологической ассоциации / американской ассоциации по инсульту. Инсульт (2018) 49: e46–110. DOI: 10.1161 / STR.0000000000000158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Хатри Р., Маккинни А.М., Свенсон Б., Джанардхан В. Гематоэнцефалический барьер, реперфузионное повреждение и геморрагическая трансформация при остром ишемическом инсульте. Неврология (2012) 79 (13 Приложение 1): S52. DOI: 10.1212 / WNL.0b013e3182697e70
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Heiss WD, Sobesky J, Hesselmann V. Определение пороговых значений для полутени и необратимого повреждения тканей. Stroke (2004) 35 (11 Прил. 1): 2671–4. DOI: 10.1161 / 01.STR.0000143329.81997.8a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Маршал Г., Серрат С., Риу П., Пети-Табу М.С., Виадер Ф., де ла Сайетт В. и др.ПЭТ-изображение церебральной перфузии и потребления кислорода при остром ишемическом инсульте: связь с исходом. Ланцет. (1993) 341: 925–7. DOI: 10.1016 / 0140-6736 (93) -7
CrossRef Полный текст | Google Scholar
22. Brozici M, van der Zwan A, Hillen B. (2003). Анатомия и функциональность лептоменингеальных анастомозов: обзор. Инсульт (8850) 34: 2750–62. DOI: 10.1161 / 01.STR.0000095791.85737.65
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Шуайб А., Мясник К., Мохаммад А.А., Саккур М., Либескинд Д.С. Коллатеральные кровеносные сосуды при остром ишемическом инсульте: потенциальная терапевтическая мишень. Lancet Neurol. (2011) 10: 909–21. DOI: 10.1016 / S1474-4422 (11) 70195-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Лима Ф.О., Фури К.Л., Сильва Г.С., Лев М.Х., Камарго Э.С., Сингхал А.Б. и др. Картина лептоменингеальных коллатералей на КТ-ангиографии является надежным предиктором долгосрочного функционального результата у пациентов с инсультом с внутричерепной окклюзией крупных сосудов. Инсульт (2010) 41: 2316–22. DOI: 10.1161 / STROKEAHA.110.592303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Либескинд Д.С., Джахан Р., Ногейра Р.Г., Зайдат О.О., Савер Дж.Л. Влияние коллатералей на успешную реваскуляризацию в пасьянсе FR с целью тромбэктомии. Инсульт (2014) 45: 2036–40. DOI: 10.1161 / STROKEAHA.114.004781
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Беркхемер О.А., Янсен И.Г., Боймер Д., Франсен П.С., ван ден Берг Л.А., Ю А.Дж. и др.Коллатеральный статус исходной компьютерной томографической ангиографии и внутриартериальный эффект лечения у пациентов с инсультом проксимального отдела передней циркуляции. Инсульт (2016) 47: 768–76. DOI: 10.1161 / STROKEAHA.115.011788
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Bang OY, Saver JL, Buck BH, Alger JR, Starkman S, Ovbiagele B и др. Влияние коллатерального кровотока на судьбу тканей при остром ишемическом инсульте. J Neurol Neurosurg Psychiatry (2008) 79: 625–9.DOI: 10.1136 / jnnp.2007.132100
CrossRef Полный текст | Google Scholar
29. Имс П.Дж., Блейк М.Дж., Доусон С.Л., Панерай Р.Б., Поттер Дж.Ф. При остром ишемическом инсульте нарушается динамическая ауторегуляция головного мозга и контроль артериального давления. J Neurol Neurosurg Psychiatry (2002) 72: 467–72. DOI: 10.1136 / jnnp.72.4.467
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Xiong L, Liu X, Shang T., Smielewski P, Donnelly J, Guo ZN, et al.Нарушение ауторегуляции головного мозга: измерение и применение при инсульте. J Neurol Neurosurg Psychiatry (2017) 88: 520. DOI: 10.1136 / jnnp-2016-314385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Доусон С.Л., Блейк М.Дж., Панерай Р.Б., Поттер Дж.Ф. При остром ишемическом инсульте нарушается динамическая, но не статическая ауторегуляция головного мозга. Cerebrovasc Dis. (2000) 10: 126–32. DOI: 10.1159 / 000016041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Овен М.Дж., Элтинг Дж. В., Де Кейсер Дж., Кремер Б.П., Вромен ПК. Церебральная ауторегуляция при инсульте Обзор транскраниальных допплерографических исследований. Инсульт (2010) 41: 2697–704. DOI: 10.1161 / STROKEAHA.110.594168
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Кидвелл С.С., Савер Дж.Л., Старкман С., Даквилер Дж., Джахан Р., Веспа П. и др. Позднее вторичное ишемическое повреждение у пациентов, получавших внутриартериальный тромболизис. Энн Нейрол . (2002) 52: 698–703. DOI: 10.1002 / ана.10380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Пан Дж., Констас А.А., Бейтман Б., Ортолано Г.А., Пайл-Спеллман Дж. Реперфузионное повреждение после церебральной ишемии: патофизиология, МРТ и возможные методы лечения. Нейрорадиология (2007) 49: 93–102. DOI: 10.1007 / s00234-006-0183-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Кидвелл С.С., Савер Дж. Л., Маттиелло Дж., Старкман С., Винуела Ф., Даквилер Дж. И др.Диффузионно-перфузионная МРТ-характеристика гиперперфузии после реканализации у людей. Неврология (2001) 57: 2015. DOI: 10.1212 / WNL.57.11.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Ng F, Coulton B, Chambers B, Thijs V. Постоянно повышенное сопротивление микрососудов после реканализации: клинический маркер феномена отсутствия оплавления. Инсульт (2018) 49: 2512–5. DOI: 10.1161 / STROKEAHA.118.021631
CrossRef Полный текст | Google Scholar
38.Гарсия Дж. Х., Лю К. Ф., Йошида Ю., Чен С., Лиан Дж. Микрососуды мозга: факторы, изменяющие их проходимость после окклюзии средней мозговой артерии (крыса Вистар). Ам Дж. Патол . (1994) 145: 728–40.
PubMed Аннотация | Google Scholar
39. Кастелланос М., Лейра Р., Серена Дж., Пумар Дж. М., Лизасоайн И., Кастильо Дж. И др. Концентрация металлопротеиназы-9 в плазме позволяет прогнозировать геморрагическую трансформацию при остром ишемическом инсульте. Инсульт (2003) 34: 40–6. DOI: 10.1161 / 01.STR.0000046764.57344.31
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Bai J, Lyden PD. Пересмотр церебрального постишемического реперфузионного повреждения: новые взгляды на понимание отказа реперфузии, кровоизлияния и отека. Int J Stroke (2015) 10: 143–52. DOI: 10.1111 / ijs.12434
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Латур Л.Л., Канг Д.В., Эззеддин М.А., Чалела Дж. А., Варах С. Раннее нарушение гематоэнцефалического барьера при очаговой ишемии головного мозга человека. Энн Нейрол . (2004) 56: 468–77. DOI: 10.1002 / ana.20199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Леонарди-Би Дж., Бат П.М., Филлипс С.Дж., Сандеркок, Пенсильвания. Артериальное давление и клинические исходы в международном исследовании инсульта. Инсульт (2002) 33: 1315–20. DOI: 10.1161 / 01.STR.0000014509.11540.66
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Ишицука К., Камучи М., Хата Дж., Фукуда К., Мацуо Р., Курода Дж. И др.Высокое кровяное давление после острого ишемического инсульта связано с плохими клиническими исходами: регистр инсульта фукуока. Гипертония (2014) 63: 54–60. DOI: 10.1161 / HYPERTENSIONAHA.113.02189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Веммос К.Н., Цивгулис Г., Спенгос К., Закопулос Н., Синетос А., Коцис В. и др. Связь между параметрами суточного мониторинга артериального давления и отеком мозга у пациентов с острым инсультом. Дж. Гипертен .(2003) 21: 2167–73. DOI: 10.1097 / 00004872-200311000-00027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Йонг М., Касте М. Ассоциация характеристик профилей артериального давления и исходов инсульта в исследовании ECASS-II. Инсульт (2008) 39: 366–72. DOI: 10.1161 / STROKEAHA.107.492330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Кимберли Т., Дутра Б., Боерс А., Алвес Х. Связь реперфузии с отеком мозга у пациентов с острым ишемическим инсультом. JAMA Neurol. (2018) 8: 529–34. DOI: 10.1001 / jamaneurol.2017.5162
CrossRef Полный текст | Google Scholar
47. Стед Л.Г., Гилмор Р.М., Деккер В.В., Уивер А.Л., Браун Р.Д. Первоначальное артериальное давление в отделении неотложной помощи как предиктор выживаемости после острого ишемического инсульта. Неврология (2005) 65: 1179–83. DOI: 10.1212 / 01.wnl.0000180939.24845.22
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. де Хэвенон А., Беннетт А., Стоддард Дж. Дж., Смит Дж., Чанг Л., О’Доннелл С. и др.Детерминанты влияния вариабельности артериального давления на неврологический исход после острого ишемического инсульта. BMJ (2017) 2: 1–6.
PubMed Аннотация | Google Scholar
49. Веммос К.Н., Цивгулис Г., Спенгос К., Закопулос Н., Синетос А., Маниос Е. и др. U-образная зависимость между смертностью и давлением при поступлении у пациентов с острым инсультом. Дж. Интер Мед . (2004) 255: 257–65. DOI: 10.1046 / j.1365-2796.2003.01291.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50.Мясник К., Кристенсен С., Парсонс М., Де Сильва Д.А., Эбингер М., Леви С. и др. Повышение артериального давления после тромболизиса связано с геморрагической трансформацией. Инсульт (2010) 41: 72–7. DOI: 10.1161 / STROKEAHA.109.563767
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Lansberg MG, Albers GW, Wijman CA. Симптоматическое внутримозговое кровоизлияние после тромболитической терапии острого ишемического инсульта: обзор факторов риска. Цереброваск Дис. .(2007) 24: 1–10. DOI: 10.1159 / 000103110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Lopez-Yunez AM, Bruno A, Williams LS, Yilmaz E, Zurrú C., Biller J. Нарушения протокола лечения инсульта с rTPA на уровне сообщества связаны с симптоматическим внутримозговым кровоизлиянием. Stroke (2001) 32: 12–6. DOI: 10.1161 / 01.STR.32.1.12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Ахмед Н., Форд Г.А., Касте М., Лис К.Р., Тони Д.Взаимосвязь артериального давления, антигипертензивной терапии и исходов при ишемическом инсульте, леченном с помощью внутривенного тромболизиса: ретроспективный анализ безопасного внедрения тромболизиса в международный регистр тромболизиса инсульта (SITS-ISTR). Инсульт (2009) 70: 2442–9. DOI: 10.1161 / STROKEAHA.109.548602
CrossRef Полный текст | Google Scholar
54. Brott T, Lu M, Kothari R, Fagan SC, Frankel M, Grotta JC и др. Артериальная гипертензия и ее лечение в исследовании инсульта NINDS rt-PA. Stroke (1998) 29: 1504–9. DOI: 10.1161 / 01.STR.29.8.1504
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Сильвер Б., Лу М., Моррис Д.К., Мициас П.Д., Левандовски С., Чопп М. Снижение артериального давления и менее благоприятные исходы в исследовании инсульта NINDS tPA. J Neurol Sci (2008) 271: 61–7. DOI: 10.1016 / j.jns.2008.03.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Ногейра Р.Г., Либескинд Д.С., Сунг Дж., Даквилер Дж., Смит В.С., MERCI и др.Предикторы хороших клинических исходов, смертности и успешной реваскуляризации у пациентов с острым ишемическим инсультом, перенесших тромбэктомию: объединенный анализ механического удаления эмбола при церебральной ишемии (MERCI) и несколько исследований MERCI. Инсульт (2009) 40: 3777–83. DOI: 10.1161 / STROKEAHA.109.561431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Гоял Н., Цивгулис Г., Ифтихар С., Хорхид Ю., Фавад Ишфак М., Досс В. Т. и др. Приемное систолическое артериальное давление и исходы инсультов окклюзии крупных сосудов, леченных эндоваскулярным лечением J NeuroInterv Surg. (2017) 9: 451. DOI: 10.1136 / нейринцург-2016–012386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Mulder MJHL, Ergezen S, Lingsma HF, Berkhemer OA, Fransen PSS, Beumer D, et al. Влияние исходного уровня артериального давления на пользу и безопасность внутриартериального лечения в MR CLEAN (многоцентровое рандомизированное клиническое исследование эндоваскулярного лечения острого ишемического инсульта в Нидерландах). Инсульт (2017) 48: 1869–76.DOI: 10.1161 / STROKEAHA.116.016225
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Майер Б., Гори Б., Тейлор Дж., Лабреш Дж., Блан Р., Обадиа М. и др. Смертность и инвалидность в зависимости от исходного уровня артериального давления у пациентов с острым ишемическим инсультом, получавших тромбэктомию: совместный объединенный анализ. Дж. Эм Харт Асс . (2017) 6: e006484. DOI: 10.1161 / JAHA.117.006484
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61.Schrock JW, Glasenapp M, Drogell K. Повышенное соотношение азота мочевины / креатинина в крови связано с плохим исходом у пациентов с ишемическим инсультом. Clin Neurol Neurosurg. (2012) 114: 881–4. DOI: 10.1016 / j.clineuro.2012.01.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Wu FF, Hung YC, Tsai YH, Yang JT, Lee TH, Liow CW и др. Влияние обезвоживания на прогноз острого ишемического инсульта у пациентов, получавших тканевый активатор плазминогена. BMC Cardiovasc Disord . (2017) 17: 154. DOI: 10.1186 / s12872-017-0590-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Чанг С.В., Хуанг Ю.С., Линь Л.К., Ян Дж. Т., Вен Х. Х., Цай Й. Х. и др. Влияние обезвоживания на развитие коллатералей при острой окклюзии средней мозговой артерии. евро J Neurol . (2016) 23: 494–500. DOI: 10.1111 / ene.12841
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Вишванатан А., Деннис М., Уайтли В.Режимы парентерального введения жидкости для улучшения функционального результата у людей с острым инсультом. Ход (2016) 47: e7. DOI: 10.1161 / STROKEAHA.115.011452
CrossRef Полный текст | Google Scholar
65. Kaesmacher J, Kaesmacher M, Maegerlein C, Zimmer C., Gersing AS, Wunderlich S, et al. Геморрагические трансформации после тромбэктомии: факторы риска и клиническая значимость. Цереброваск Дис. . (2017) 43: 278. DOI: 10.1159 / 000460265
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Джон С., Хазаа В., Учино К., Тот Г., Бейн М., Тибо У и др. Более низкое внутрипроцедурное систолическое артериальное давление предсказывает хорошие результаты у пациентов, получающих эндоваскулярную терапию по поводу острого ишемического инсульта. Interv Neurol. (2016) 4: 151–7. DOI: 10.1159 / 000444098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Лёвхаген Хенден П., Рентзос А., Карлссон Дж. Э., Розенгрен Л., Сундеман Х., Райнсфельт Б. и др. Гипотония при эндоваскулярном лечении ишемического инсульта является фактором риска плохого неврологического исхода. Инсульт (2015) 46: 2678–80. DOI: 10.1161 / STROKEAHA.115.009808
CrossRef Полный текст | Google Scholar
68. Talke PO, Sharma D, Heyer EJ, Bergese SD, Blackham KA, Stevens RD. Переиздано: Общество нейробиологов в анестезиологии и консенсусе экспертов по реанимации: анестезиологическое обеспечение эндоваскулярного лечения острого ишемического инсульта. Инсульт (2014) 45: e150. DOI: 10.1161 / STROKEAHA.113.003412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Джумаа М.А., Чжан Ф., Руиз-Арес Г., Гельзинис Т., Малик А.М., Алеу А. и др. Сравнение безопасности и клинических и рентгенологических результатов эндоваскулярной терапии острого инсульта при окклюзии проксимальной средней мозговой артерии с интубацией и общей анестезией по сравнению с состоянием без интубации. Инсульт (2010) 41: 1180–4. DOI: 10.1161 / STROKEAHA.109.574194
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Абу-Чебл А., Зайдат О.О., Кастонгуай А.С., Гупта Р., Сан С.Х., Мартин СО и др.Регистр острого инсульта со стент-ретривером в Северной Америке SOLITAIRE: выбор анестезии и исходы. Инсульт (2014) 45: 1396–401. DOI: 10.1161 / STROKEAHA.113.003698
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Бринджикджи В., Пастернак Дж., Мурад М.Х., Клофт Х.Дж., Велч Т.Л., Каллмес Д.Ф. и др. Связанные с анестезией результаты реваскуляризации эндоваскулярного инсульта: систематический обзор и метаанализ. Инсульт (2017) 48: 2784–91. DOI: 10.1161 / STROKEAHA.117.017786
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Бринджикджи В., Мурад М.Х., Рабинштейн А.А., Клофт Г.Дж., Ланзино Дж., Каллмес Д.Ф. Сознательная седация в сравнении с общей анестезией во время эндоваскулярного лечения острого ишемического инсульта: систематический обзор и метаанализ. AJNR Am J Neuroradiol. (2015) 36: 525–9. DOI: 10.3174 / ajnr.A4159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Whalin MK, Lopian S, Wyatt K, Sun CH, Nogueira RG, Glenn BA, et al.Дексмедетомидин: безопасная альтернатива общей анестезии при эндоваскулярном лечении инсульта. J Neurointer Surg. (2014) 6: 270–5. DOI: 10.1136 / нейринцург-2013-010773
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Абу-Шебл А., Лин Р., Хусейн М.С., Джовин Т.Г., Леви Е.И., Либескинд Д.С. и др. Сознательная седация по сравнению с общей анестезией во время эндоваскулярной терапии острого инсульта переднего кровообращения: предварительные результаты ретроспективного многоцентрового исследования. Инсульт (2010) 41: 1175–9. DOI: 10.1161 / STROKEAHA.109.574129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Дэвис М.Дж., Менон Б.К., Багирзада Л.Б., Кампос-Эррера С.Р., Гоял М., Хилл М.Д. и др. Анестезиологическое обеспечение и исходы у пациентов во время эндоваскулярной терапии острого инсульта. Анестезиология (2012) 116: 396–405. DOI: 10.1097 / ALN.0b013e318242a5d2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76.Treurniet KM, Berkhemer OA, Immink RV, Lingsma HF, Ward-van der Stam VMC, Hollmann MW, et al. Снижение артериального давления связано с неблагоприятным исходом у пациентов, перенесших тромбэктомию под общим наркозом. J Neurointer Surg. (2017) 10: 107–11. DOI: 10.1136 / нейринцург-2017-012988
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Whalin MK, Halenda KM, Haussen DC, Rebello LC, Frankel MR, Gershon RY, et al. Даже небольшое снижение артериального давления во время седации в сознании влияет на клинический исход после инсульта тромбэктомии: анализ гемодинамических порогов. Am J Neuroradiol. (2017) 38: 294–8. DOI: 10.3174 / ajnr.A4992
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Симонсен С., Ю А., Соренсен Л., Юул Н., Йонсен С.П., Андерсен Г. и др. Влияние общей анестезии и седации в сознании во время эндоваскулярной терапии на рост инфаркта и клинические исходы при остром ишемическом инсульте: рандомизированное клиническое исследование. JAMA Neurol (2018) 75: 470–7. DOI: 10.1001 / jamaneurol.2017.4474
CrossRef Полный текст | Google Scholar
79.Schönenberger S, Uhlmann L, Hacke W., Schieber S, Mundiyanapurath S, Purrucker JC и др. Эффект седации с сознанием по сравнению с общей анестезией на раннее неврологическое улучшение у пациентов с ишемическим инсультом, перенесших эндоваскулярную тромбэктомию: рандомизированное клиническое исследование. JAMA (2016) 316: 1986–96. DOI: 10.1001 / jama.2016.16623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Лёвхаген Хенден П., Рентзос А., Карлссон Дж. Э., Розенгрен Л., Лейрам Б., Сундеман Н. и др.Общая анестезия в сравнении с седацией в сознании для эндоваскулярного лечения острого ишемического инсульта: исследование AnStroke (анестезия во время инсульта). Инсульт (2017) 48: 1601. DOI: 10.1161 / STROKEAHA.117.016554
CrossRef Полный текст | Google Scholar
81. Бхатиа Р., Хилл М.Д., Шобха Н., Менон Б., Бал С., Кочар П. и др. Низкие показатели острой реканализации с внутривенным введением рекомбинантного тканевого активатора плазминогена при ишемическом инсульте: реальный опыт и призыв к действию. Инсульт (2010) 41: 2254–8. DOI: 10.1161 / STROKEAHA.110.592535
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Ли К.Ю., Хан С.В., Ким С.Х., Нам Х.С., Ан С.В., Ким Д.Д. и др. Ранняя реканализация после внутривенного введения рекомбинантного тканевого активатора плазминогена по данным пре- и посттромболитической ангиографии у пациентов с острым ишемическим инсультом. Инсульт (2007) 38: 192–3. DOI: 10.1161 / 01.STR.0000251788.03914.00
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83.Зайдат О.О., Ю А.Дж., Хатри П., Томсик Т.А., фон Куммер Р., Савер Дж.Л. и др. Рекомендации по стандартам классификации ангиографической реваскуляризации при остром ишемическом инсульте: согласованное заявление. Инсульт (2013) 44: 2650. DOI: 10.1161 / STROKEAHA.113.001972
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Мэттл HP, Каппелер Л., Арнольд М., Фишер Ю., Недельчев К., Ремонда Л. и др. Артериальное давление и реканализация сосудов в первые часы после ишемического инсульта. Инсульт (2005) 36: 264–8. DOI: 10.1161 / 01.STR.0000153052.59113.89
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Дельгадо-Медерос Р., Рибо М., Ровира А., Рубьера М., Мунуэра Дж., Сантамарина Е. и др. Прогностическое значение вариабельности артериального давления после тромболизиса при остром инсульте. Неврология (2008) 71: 552–8. DOI: 10.1212 / 01.wnl.0000318294.36223.69
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86.Майер И.Л., Цогкас И., Беме Д., Бэр М., Кнаут М., Психогиос М.Н. и др. Высокое систолическое артериальное давление после успешного эндоваскулярного лечения влияет на ранний функциональный результат при остром ишемическом инсульте. Цереброваск Дис. . (2018) 45: 18–25. DOI: 10.1159 / 000484720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Гоял Н., Цивгулис Г., Панди А., Чанг Дж. Дж., Диллард К., Ишфак М. Ф. и др. Уровни артериального давления после механической тромбэктомии и исходы инсультов с окклюзией крупных сосудов. Неврология (2017) 89: 540–7. DOI: 10.1212 / WNL.0000000000004184
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Мартинс А.И., Сардженто-Фрейтас Дж., Сильва Ф., Хесус-Рибейро Дж., Коррейя И., Гомес Дж. П. и др. Реканализация модулирует связь между артериальным давлением и функциональным исходом при остром ишемическом инсульте. Инсульт (2016) 47: 1571–6. DOI: 10.1161 / STROKEAHA.115.012544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89.Берге Э., Коэн Дж., Линдли Р.И., Сандеркок П., Уордлоу Дж. М., Сэндсет ЕС и др. Эффекты артериального давления и артериального давления — терапия для снижения артериального давления в течение первых 24 часов среди пациентов в третьем международном испытании тромболитического лечения острого ишемического инсульта при инсульте. Инсульт (2015) 46: 3362–9. DOI: 10.1161 / STROKEAHA.115.010319
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Kellert L, Hametner C, Ahmed N, Rauch G, MacLeod MJ, Perini F, et al.Взаимное взаимодействие 24-часовой вариабельности артериального давления и систолического артериального давления с исходом тромболизиса при инсульте. Инсульт (2017) 48: 1827–34. DOI: 10.1161 / STROKEAHA.117.016876
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Беннетт А.Е., Уайлдер М.Дж., МакНалли Дж. С., Уолд Дж. Дж., Стоддард Дж. Дж., Майерсик Дж. Дж. И др. Повышенная вариабельность артериального давления после эндоваскулярной тромбэктомии по поводу острого инсульта связана с худшим клиническим исходом. J Neurointer Surg .(2018) 964. doi: 10.1136 / нейринтсург-2017-013473
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Мистри Э.А., Мистри А.М., Накава М.О., Хаттар Н.К., Фортуни Э.М., Круз А.С. и др. Систолическое артериальное давление в течение 24 часов после тромбэктомии по поводу острого ишемического инсульта коррелирует с исходом. Дж. Эм Харт Асс . (2017) 6: e006167. DOI: 10.1161 / JAHA.117.006167
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Джовин Т.Г., Савер Дж.Л., Рибо М., Перейра В., Фурлан А., Бонафе А. и др.Диффузионно-взвешенная визуализация или компьютерная томография для оценки перфузии с клиническим несоответствием в сортировке инсультов после пробуждения и поздних инсультов, подвергнутых нейроинтервенции с помощью методов исследования Trevo (DAWN). Int J Stroke (2017) 12: 641–52. DOI: 10.1177 / 1747493017710341
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Поттер Дж. Ф., Робинсон Т. Г., Форд Г. А., Мистри А., Джеймс М., Чернова Дж. И др. Контроль артериальной гипертензии и гипотензии сразу после инсульта (CHHIPS): рандомизированное плацебо-контролируемое двойное слепое пилотное исследование. Ланцет Нейрол . (2009) 8: 48–56. DOI: 10.1016 / S1474-4422 (08) 70263-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. He J, Zhang Y, Xu T, Zhao Q, Wang D, Chen CS, et al. Влияние немедленного снижения артериального давления на смерть и серьезную инвалидность у пациентов с острым ишемическим инсультом: рандомизированное клиническое исследование CATIS. JAMA 311: 479–89. DOI: 10.1001 / jama.2013.282543
PubMed Аннотация | CrossRef Полный текст
96.Eveson DJ, Робинсон TG, Поттер JF. (2007). Лизиноприл для лечения артериальной гипертензии в течение первых 24 часов после острого ишемического инсульта и последующее наблюдение. Am J Hyperten. (2014) 20: 270–7. DOI: 10.1016 / j.amjhyper.2006.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Барер Д.Х., Крукшанк Дж. М., Эбрахим С. Б., Митчелл Дж. Р.. Бета-блокада низкими дозами при остром инсульте (исследование «BEST»): оценка. Британский медицинский журнал. (1988) 296: 737–41.DOI: 10.1136 / bmj.296.6624.737
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Bath PMW, Кришнан К. Вмешательства для преднамеренного изменения артериального давления при остром инсульте. Кокрановская база данных Syst Rev . (2014) 10: CD000039. DOI: 10.1002 / 14651858.CD000039.pub3
CrossRef Полный текст | Google Scholar
99. Хуанг Ю., Шарма В.К., Робинсон Т., Линдли Р.И., Чен Х, Ким Дж.С. и др. Обоснование, дизайн и ход исследования исследования усиленного контроля гипертонии и тромболизиса инсульта (ENCHANTED): международное многоцентровое квазифакторное рандомизированное контролируемое исследование 2 × 2 по сравнению сстандартная доза rt-PA и раннее интенсивное снижение артериального давления по сравнению с рекомендованным в руководствах у пациентов с острым ишемическим инсультом, которым назначено лечение тромболизисом. Int J Stroke (2015) 10: 778–8. DOI: 10.1111 / ijs.12486
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Лю-Дерике X, Дженисс Дж., Коплин В.М., Паркер Д., Норрис Дж., Рони Д.Х. Сравнение никардипина и лабеталола для лечения острой гипертензии после инсульта. Neurocrit Care (2008) 9: 167–76.DOI: 10.1007 / s12028-008-9057-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Лю-Дерик X, Леви П.Д., Паркер Д., Коплин В., Рони Д.Х. Проспективная оценка лабеталола по сравнению с никардипином для контроля артериального давления у пациентов с острым инсультом. Neurocrit Care (2013) 19: 41–7. DOI: 10.1007 / s12028-013-9863-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Opie LH. Фармакологические различия антагонистов кальция. Euro Heart J . (1997) 18 Дополнение A (Дополнение A): 71.
PubMed Аннотация | Google Scholar
103. Hecht JP, Richards PG. Непрерывная инфузия лабеталола по сравнению с никардипином для лечения артериальной гипертензии у пациентов с инсультом. J Stroke Cerebrovasc Dis . (2018) 27: 460–5. DOI: 10.1016 / j.jstrokecerebrovasdis.2017.09.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Розенфельдт З., Конклен К., Джонс Б., Феррилл Д., Дешпанде М., Сиддики Ф.М.Сравнение никардипина и клевидипина при лечении артериальной гипертензии при острых цереброваскулярных заболеваниях. J Stroke Cerebrovasc Dis . (2018) 27: 2067–73. DOI: 10.1016 / j.jstrokecerebrovasdis.2018.03.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Фингер Дж. Р., Курчевский Л. М., Брофи Г. М.. Клевидипин по сравнению с никардипином для острого снижения артериального давления у пациентов интенсивной терапии неврологии. Neurocrit Care (2017) 26: 167–73.DOI: 10.1007 / s12028-016-0349-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Брауэр К.И., Мерфи К., Ариас-Моралес К.Э., Ранкин Д., Палеттас М., Бергезе С.Д. Безопасность и эффективность внутривенного клевидипина для периоперационного контроля острой гипертензии у нейрохирургических пациентов: обновление дозы. Clin Med Insights (2017) 2017. doi: 10.1177 / 1179559X17712517
CrossRef Полный текст | Google Scholar
110. Шмидт Дж. Ф., Андерсен А. Р., Гьеррис Ф., Полсон ОБ.Не влияет на ВЧД ингибирования АПФ при индуцированной гипотензии. В: Хофф Дж. Т., Бец А. Л., редакторы. Внутричерепное давление VII . Берлин; Гейдельберг: Springer (1989). п. 536–8. DOI: 10.1007 / 978-3-642-73987-3_140
CrossRef Полный текст | Google Scholar
112. Хоттингер Д.Г., Биби Д.С., Кожиманнил Т., Приэлипп Р.Ц., Белани К.Г. Нитропруссид натрия в 2014 году: обзор клинических концепций. J Anaesthesiol Clin Pharmacol. (2014) 30: 462. DOI: 10.4103 / 0970-9185.142799
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113.Международный симпозиум по внутричерепному давлению. Внутричерепное давление VI. В: Международный симпозиум по внутричерепному давлению . Берлин; Глазго: Стратчклайд (1986). Доступно в Интернете по адресу: http://catalog.hathitrust.org/Record/000807264
114. Weiss MH, Spence J, Apuzzo ML, Heiden JS, McComb JG, Kurze T. Влияние нитропруссида на ауторегуляцию церебрального давления. Нейрохирургия (1979) 4: 56–9. DOI: 10.1227 / 00006123-197
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116.Бат П., Вудхаус Л., Скатт П., Кришнан К., Вардлоу Дж. М., Берецки Д. и др. Эффективность оксида азота в сочетании с продолжением антигипертензивной терапии или без нее для лечения высокого кровяного давления при остром инсульте (ENOS): частичное факторное рандомизированное контролируемое исследование. Ланцет. (2015) 385: 617–28. DOI: 10.1016 / S0140-6736 (14) 61121-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Гани Г.А., Сунг Ю.Ф., Вайнштейн М.С., Тиндалл Г.Т., Флейшер А.С. Влияние внутривенного нитроглицерина на внутричерепное давление и реакцию объемного давления. Дж. Нейросург . (1983) 58: 562–5. DOI: 10.3171 / jns.1983.58.4.0562
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. van Zwieten PA, Blauw GJ, van Brummelen P. Фармакологический профиль гипотензивных препаратов с серотониновыми рецепторами и α-адренорецепторами. Наркотики (1990) 40: 1–8. DOI: 10.2165 / 00003495-19
04-00003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Chileuitt L, Leber K, McCalden T, Weinstein PR.Вызванная гипертензия при ишемии уменьшает площадь инфаркта после временной окклюзии средней мозговой артерии у крыс. Surg Neurol. (1996) 46: 229–34. DOI: 10.1016 / 0090-3019 (95) 00453-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Драммонд Дж. С., О Й. С., Коул Д. Д., Шапиро Х. М.. Вызванная фенилэфрином гипертензия снижает ишемию после окклюзии средней мозговой артерии у крыс. Stroke (1989) 20: 1538–44. DOI: 10.1161 / 01.STR.20.11.1538
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123.Овергаард CB, Дзавик В. Инотропы и вазопрессоры: Обзор физиологии и клинического применения при сердечно-сосудистых заболеваниях. Тираж (2008) 118: 1047–56. DOI: 10.1161 / CIRCULATIONAHA.107.728840
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Рордорф Г., Корошец В.Дж., Эззеддин М.А., Сегал А.З., Буонанно Ф.С. Пилотное исследование лекарственной гипертензии для лечения острого инсульта. Неврология (2001) 56: 1210–3. DOI: 10.1212 / WNL.56.9.1210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125.Hillis AE, Ulatowski JA, Barker PB, Torbey M, Ziai W., Beauchamp NJ, et al. Пилотное рандомизированное исследование индуцированного повышения артериального давления: влияние на функцию и очаговую перфузию при остром и подостром инсульте.