Изокалорическая смесь что это: Энтеральное питание в сухом и жидком виде | Купить по оптовой цене в «АМС-Мед»
Нутризон эдванст нутридринк смесь сухая 322 гр

Питание при COVID-19 | partners
Новая коронавирусная инфекция, ставшая причиной глобальной пандемии 2019 года, продолжает вызывать активный интерес международного научного и медицинского сообщества. Широко изучаются как особенности патогенеза этого заболевания, так и возможные методы терапии, немедикаментозной поддержки и реабилитации тяжелых пациентов.
Широко изучаются как особенности патогенеза этого заболевания, так и возможные методы терапии, немедикаментозной поддержки и реабилитации тяжелых пациентов.
Вирус SARS-CoV-2 поражает все органы и системы организма. Известно, что наиболее распространенными клиническими проявлениями являются лихорадка, кашель и одышка. Однако до 10% пациентов обнаруживает и желудочно-кишечные симптомы, включая диарею, тошноту и рвоту. Поражение новой инфекцией пищеварительного транспортного конвейера, через который организм получает жизненно необходимые нутриенты, энергетические, пластические, регуляторные вещества, заставляет самым внимательным образом отнестись к аспекту питания при COVID-19. На сегодняшний день необходимость этапной нутритивной поддержки, которая будет сопровождать пациентов с коронавирусной инфекцией от отделения реанимации и интенсивной терапии до общей палаты и даже до домашней реабилитации, уже не вызывает сомнений.
Воздействие SARS-CoV-2 на желудочно-кишечный тракт
Проникая через слизистую оболочку носа, гортани и бронхиального дерева в периферическую кровь, вирус SARS-CoV-2 поражает целевые органы: легкие, пищеварительный тракт, сердце, почки, клетки которых экспрессируют ангиотензинпревращающий фермент 2 (АПФ-2, ACE2). Большой S-белок коронавируса связывается с ACE2 на инфицированных клетках, в результате чего комплекс SARS-CoV-2/ACE2 беспрепятственно проникает в цитоплазму. После высвобождения вирусной РНК, с нее транслируются два полипротеина, структурные протеины, и начинается репликация вирусного генома.
Большой S-белок коронавируса связывается с ACE2 на инфицированных клетках, в результате чего комплекс SARS-CoV-2/ACE2 беспрепятственно проникает в цитоплазму. После высвобождения вирусной РНК, с нее транслируются два полипротеина, структурные протеины, и начинается репликация вирусного генома.
Альвеолярные эпителиальные клетки и эпителиальные клети тонкого кишечника, развивающиеся из одного эмбрионального листка, отличатся высоким уровнем экспрессии ACE2. Это объясняет не только причину преимущественного поражения нижних дыхательных путей при COVID-19, но и довольно высокую частоту возникновения абдоминального и диспептического синдромов.
Уязвимость желудочно-кишечного тракта также может быть связана с тем, что коронавирус нового типа использует в качестве входных ворот в слизистые не только дыхательных путей, но и пищеварительной системы. Последние исследования показывают, что вирус попадает в организм и выделяется из него через ЖКТ. Согласно некоторым данным, у больных с гастроэнтеральными симптомами РНК SARS-CoV-2 выявлялась в кале более чем в 52% случаев, и у пациентов без гастроэнтеральных жалоб – в 39%.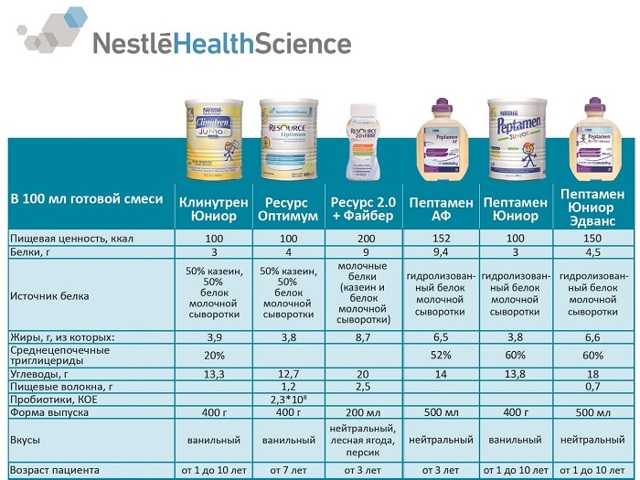
На данный момент предполагается, что поражение пищеварительной системы вирусом COVID-19 может быть обусловлено сразу несколькими причинами, включая:
- рецептор-опосредованное проникновение вируса в клетки;
- индукцию воспаления и изменение проницаемости слизистых оболочек;
- влияние на состав микробиоты кишечника.
Немаловажно, что нарушение функций ЖКТ утяжеляет общее состояние и дополнительно способствует прогрессированию респираторных симптомов, что в свою очередь усугубляет патологические процессы в кишечнике.
Гастроэнтеральные симптомы при COVID-19
Результаты обследования группы больных с COVID-19, имевших гастроэнтеральные симптомы, показали, что самой частой жалобой была диарея (24,2%), за которой следовала анорексия (17,9%) и тошнота (17,9%). Авторы исследования, тем не менее, обратили внимание, что чаще всего диарея развивалась уже во время госпитализации и потенциально могла быть обусловлена применением антибиотиков.
Интересно, что наличие гастроэнтеральных симптомов достоверно коррелирует с тяжестью состояния пациентов. Так, при оценке течения заболевания 74 больных с COVID-19, имевших гастроэнтеральные жалобы, было показано, что тяжелые и критические формы встречались достоверно чаще (22,97% и 31,08% соответственно), чем у пациентов, у которых эти симптомы отсутствовали (8,14% и 20,45% соответственно). У больных с COVID-19 с желудочно-кишечными симптомами также чаще отмечались лихорадка, общая слабость, одышка и головная боль.
Таким образом, наличие гастроэнтеральных жалоб можно считать настораживающим признаком. Пациенты их предъявляющие требуют повышенного внимания и назначения дополнительных исследований на предмет изучения желудочно-кишечных функций. По некоторым данным, из-за отсутствия аппетита, тошноты и других гастроэнтеральных симптомов пациенты с COVID-19 могут терять 5-10 кг веса, и из-за резкого дефицита нутриентов, в первую очередь протеинов, быстро восстановить функции иммунной, нейроэндокринной и собственно пищеварительной системы проблематично.
С целью восполнения недостающих жизненно-важных веществ и укрепления местного и общего иммунитета целесообразно назначение адекватного лечебно-профилактического питания, содержащего сбалансированное количество легкодоступного протеина, триглицеридов, витаминов и микроэлементов.
Этапная нутритивная поддержка при COVID-19
Коронавирусная инфекция в большинстве (81%) случаев протекает в нетяжелой или неосложненной форме. Однако у 14% пациентов развиваются серьезные состояния, которые требуют дыхательной поддержки, и в 5% случаев требуется лечение в отделении реанимации и интенсивной терапии.
Нутритивная поддержка у тяжелых пациентов с выраженной интоксикацией, резким снижением аппетита, нарушением функции внешнего дыхания, дисфагией и другими симптомами, начинается непосредственно в отделении реанимации. Больному на фоне терапии может назначаться энтеральное питание с использованием метаболически направленных смесей, при выборе которых необходимо учитывать степень скомпрометированности различных органов и систем.
После компенсации патологического процесса пациент переводится на стандартные сбалансированные смеси, а потом на щадящий вариант диеты, в которой используется принцип химического, механического и температурного щажения при приготовлении и подаче блюд. Нутритивная поддержка сипинговыми смесями рассматривается и как необходимая мера при домашней реабилитации после перенесенной инфекции больных, особенно пожилого и старческого возраста.
Питание у пациентов с COVID-19 на ИВЛ
Искусственная вентиляция легких (ИВЛ), полностью или частично замещающая спонтанное дыхание, –одна из самых частых мер в терапии дыхательной недостаточности у пациентов с COVID-19 в тяжелом состоянии.
Современные клинические рекомендации предписывают раннее начало энтерального питания при отсутствии критических изменений гемодинамики – в течение 24-48 часов после поступления в ОРИТ. Доказано, что ранняя нутритивная поддержка способствует снижению уровня смертности у пациентов в критическом состоянии, находящихся на ИВЛ, а также уменьшает число инфекционных осложнений и продолжительность пребывания в стационаре.
Энтеральный путь введения без сомнения является наиболее физиологичным, и до тех пор, пока не будут использованы все стратегии для оптимизации энтерального питания, парентеральный метод применять не стоит. Тем не менее, возможности использования энтерального питания у тяжелых пациентов с COVID-19 зачастую ограничены в связи с их положение на животе. В таком случае питание сначала вводится парентерально, но по мере возможности сразу сменяется зондовым.
Зондовое питание пациентов с COVID-19
Для определения потребности в калориях у пациентов на ИВЛ сегодня используются непрямая калориметрия или различные прогностические формулы. Необходимо учитывать, что для этой категории больных состав и качество получаемых нутриентов имеют огромное значение. Учитывая уязвимое и часто скомпрометированное состояние желудочно-кишечного тракта при COVID-19, требуемые калории должны поступать в организм в наиболее легкодоступном виде, и их усвоение не должно требовать дополнительных энергозатрат. Количество поступающего протеина должно компенсировать потерю белка при катаболических процессах: существующие клинические руководства предписывают начинать с 1,2 – 2 г/кг/сутки.
Количество поступающего протеина должно компенсировать потерю белка при катаболических процессах: существующие клинические руководства предписывают начинать с 1,2 – 2 г/кг/сутки.
Оптимальные продукты для зондового питания:
- Nestle Peptamen. Смесь на основе сывороточного белка облегчает усвоение всех необходимых питательных веществ у пациентов с нарушенной функцией ЖКТ. Продукт с содержанием калорий 1000 ккал/л и белка 40 г/л полностью удовлетворяет энергетические потребности организма. Смесь хорошо переносится за счет гидролизованного белка 100% молочной сыворотки, не содержит лактозу. Легкодоступным источником энергии являются среднецепочечные триглицериды (70% жирового компонента смеси), усваивание которых проходит без участия ферментов двенадцатиперстной кишки. Высокий уровень цистеина помогает контролировать воспалительный процесс путем нейтрализации свободных радикалов.
- Nestle Resource Optimum. Изокалорическая полноценная сбалансированная смесь для профилактики и лечения недостаточности питания отличается очень хорошей усвояемостью даже у тяжелых пациентов.
 Сочетание казеинов и сывороточных белков обеспечивает полный набор эссенциальных аминокислот. Продукт содержит высокие концентрации омега-6 и омега-3 жирных кислот (в соотношении 4:1), а также СЦТ (25%), рапсовое и кукурузные масла, широкий набор витаминов и микроэлементов.
Сочетание казеинов и сывороточных белков обеспечивает полный набор эссенциальных аминокислот. Продукт содержит высокие концентрации омега-6 и омега-3 жирных кислот (в соотношении 4:1), а также СЦТ (25%), рапсовое и кукурузные масла, широкий набор витаминов и микроэлементов. - Nestle Impact. Этот продукт занимает первое место на мировом рынке иммунного питания. Эффективность Нестле Импакт клинически доказана на основе мета-анализа результатов лечения более 2000 пациентов с различной хирургической патологией в ведущих мировых центрах. Полноценная сбалансированная смесь обогащена аргинином, омега-3-жирными кислотами и нуклеотидами, а также содержит жизненно необходимые витамины и микроэлементы.
Немаловажно, что все указанные смеси подходят не только для зондового, но и для перорального питания.
Питание после отлучения от ИВЛ
После того, как пациент снимается с искусственной вентиляции легких, рекомендуется провести логопедическую оценку его способности к глотанию, а, следовательно, к самостоятельному пероральному питанию.
Питание при неинвазивной вентиляции и дыхательной поддержке
Пациентам с неинвазивной дыхательной поддержкой для обеспечения клинического выздоровления также необходима метаболическая стабильность и адекватный статус питания. В этих случаях важно оценивать адекватность перорального приема пищи индивидуальным нуждам больных и при необходимости использовать сбалансированные сипинговые смеси для нутритивной поддержки.
Дополнительное сипинговое питание Nestle Resource с повышенным содержанием белка (9г/100 мл) и полным набором эссенциальных микро- и макронутриентов поддерживает оптимальную скорость восстановления иммунной системы и регенерации тканей после инфекционного процесса. Широкая линейка продуктов – Nestle Resource 2.0+fibre, Resource 2.0, Resource Protein, Resource diabet plus – дает возможность подобрать смесь под индивидуальные энергетические и питательные нужды и учесть потенциальное наличие коморбидных патологий, например, диабета или нарушения толерантности к глюкозе.
Широкая линейка продуктов – Nestle Resource 2.0+fibre, Resource 2.0, Resource Protein, Resource diabet plus – дает возможность подобрать смесь под индивидуальные энергетические и питательные нужды и учесть потенциальное наличие коморбидных патологий, например, диабета или нарушения толерантности к глюкозе.
Питание при COVID-19 после ОРИТ
По мере восстановления пациента, после купирования основных гастроэнтеральных симптомов, диареи, тошноты, болей, можно постепенно переводить его на щадящую диету, предпочтительно не отказываясь и от поддержки сипинговым питанием Resource Nestle. При комплектовании индивидуального рациона следует учитывать энерготраты больного, его состояние и коэффициент активности.
Основные принципы диеты у пациентов с COVID-19
- При переводе на щадящий вариант диеты необходимо сохранить высокую квоту употребления полноценного суточного белка (1,5 стакана молока или 30 г сыра, или равнозначное количество других молочных продуктов).

- Рекомендуется ограничить прием жиров до 30% от суточной потребности. Основной упор должен быть сделан на употребление ПНЖК омега-3 с целью ускорения восстановления структуры слизистых оболочек и профилактики микротромбозов.
- Стоит уменьшить прием соли и сахара до 5 г в сутки.
- В рацион необходимо включить овощи и фрукты (сначала в виде отваров, компотов, пюре, продуктов детского питания), а также бобовых и цельнозерновых продуктов, содержащих пищевые волокна, витамины группы В.
- С учетом длительного пребывания в помещении рекомендовано ежедневное употребление витамина D в дозе 10 мкг, минералов цинка, железа, селена.
Профилактическая нутритивная поддержка
Эпидемические исследования, проведенные сотрудниками института питания РАМН в различных регионах России, показали, что до 80% населения нашей страны испытывают дефицит тех или иных микро- или макронутриентов. Безусловно, это не может не сказываться на состоянии иммунитета, рисках инфекционных заболеваний и сроках реабилитации после них.
Для восполнения имеющихся дефицитов, а также для восстановления нарушенной под действием экопатогенов и стресса функции адаптационных регулирующих механизмов организма, требуется повышенная обеспеченность эссенциальными нутриентами. Этого, однако, невозможно достичь только за счет стандартных рационов питания, не превышая их разумных объемов. Ключом к решению этого вопроса, по мнению специалистов, является регулярное включение в рацион специализированных функциональных пищевых продуктов и функциональных напитков, примером которых являются, в частности, сипинговые смеси Resource Nestle.
В заключение
Нарушение пищеварения – один из самых распространенных симптомов нового коронавируса, наряду с респираторными проявлениями. Пациентам с COVID-19 на всех стадиях лечения необходимо обеспечить полноценное питание, которое не только восполнит дефицит жизненно необходимых нутриентов и станет полноценным источником энергии для восстановления, но и будет максимально безопасным и легко усвояемым для скомпрометированной пищеварительной системы. Продукты Nestle для зондового и перорального питания, подходящие для каждого этапа терапии – от ИВЛ в условиях реанимации до амбулаторной реабилитации, оптимально способствует компенсации нужд пациентов с коронавирусной инфекцией. Специализированные смеси обладают сбалансированным составом аминокислот, жиров, витаминов и микроэлементов и усваиваются при минимальных ферментных и энергетических тратах.
Продукты Nestle для зондового и перорального питания, подходящие для каждого этапа терапии – от ИВЛ в условиях реанимации до амбулаторной реабилитации, оптимально способствует компенсации нужд пациентов с коронавирусной инфекцией. Специализированные смеси обладают сбалансированным составом аминокислот, жиров, витаминов и микроэлементов и усваиваются при минимальных ферментных и энергетических тратах.
Источники:
- Питание при COVID-19. Лекция для специалистов. Сергеев Валерий Николаевич, д.м.н, главный научный сотрудник одела соматической реабилитации, репродуктивного здоровья и активного долголетия ФГБУ «НМИЦ РК» Минздрава России. https://www.youtube.com/watch?v=6D0BZzuY_-A&list=PLd6NR3OWlpzz4HOa1uSxXZOb94mg9PZ76&index=15
- Питание после Covid-пневмонии. Интервью с профессором Сергеевым В.Н. Школа жизни пациента после Covid. https://www.youtube.com/watch?v=vDRRzQNcxl8&list=PLd6NR3OWlpzz4HOa1uSxXZOb94mg9PZ76&index=19
Изокалорийная манипуляция макронутриентами в рамках диеты с высоким содержанием углеводов/умеренным содержанием жиров оказывает уникальное влияние на печеночный липогенез, стеатоз и повреждение печени
[1] Samocha-Bonet D, Dixit VD, Kahn CR, Leibel RL, Lin X, Nieuwdorp M , и другие. Метаболически здоровое и нездоровое ожирение — отчет Stock Conference 2013. Obes Rev. 2014; 15: 697–708. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Метаболически здоровое и нездоровое ожирение — отчет Stock Conference 2013. Obes Rev. 2014; 15: 697–708. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[2] Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, et al. Распространенность стеатоза печени среди городского населения США: влияние этнической принадлежности. Гепатология. 2004; 40: 1387–9.5. [PubMed] [Google Scholar]
[3] Тетри Л.Х., Басараноглу М., Брант Э.М., Ериан Л.М., Нойшвандер-Тетри Б.А. Тяжелая НАЖБП с некровоспалительными изменениями в печени у мышей, получавших трансжиры и эквивалент кукурузного сиропа с высоким содержанием фруктозы. Am J Physiol Gastrointest Liver Physiol. 2008; 295:G987–95. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[4] Kohli R, Kirby M, Xanthakos SA, Softic S, Feldstein AE, Saxena V, et al. Диета с высоким содержанием фруктозы и трансжиров со средней длиной цепи вызывает фиброз печени и повышает уровень коэнзима Q9 в плазме.в новой мышиной модели ожирения и неалкогольного стеатогепатита. Гепатология. 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
Гепатология. 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
[5] Charlton M, Krishnan A, Viker K, Sanderson S, Cazanave S, McConico A, et al. Мыши, питающиеся фаст-фудом: новая модель НАСГ у мелких животных с вздутием живота, прогрессирующим фиброзом и высокой физиологической точностью состояния человека. Am J Physiol Gastrointest Liver Physiol. 2011; 301:G825–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[6] Savard C, Tartaglione EV, Kuver R, Haigh WG, Farrell GC, Subramanian S, et al. Синергетическое взаимодействие пищевого холестерина и пищевого жира при индуцировании экспериментального стеатогепатита. Гепатология. 2013; 57: 81–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[7] Mells JE, Fu PP, Kumar P, Smith T, Karpen SJ, Anania FA. Насыщенные жиры и холестерин имеют решающее значение для индукции метаболического синдрома у мышей с выраженным неалкогольным стеатогепатитом. Дж. Нутр Биохим. 2015;26:285–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[8] Yao ZM, Vance DE. Активный синтез фосфатидилхолина необходим для секреции липопротеинов очень низкой плотности гепатоцитами крысы. Дж. Биол. Хим. 1988;263:2998–3004. [PubMed] [Google Scholar]
Активный синтез фосфатидилхолина необходим для секреции липопротеинов очень низкой плотности гепатоцитами крысы. Дж. Биол. Хим. 1988;263:2998–3004. [PubMed] [Google Scholar]
[9] Vance JE, Vance DE. Роль биосинтеза фосфатидилхолина в секреции липопротеинов гепатоцитами. Может J Biochem Cell Biol. 1985; 63: 870–81. [PubMed] [Google Scholar]
[10] Леклерк И.А., Фаррелл Г.К., Филд Дж., Белл Д.Р., Гонсалес Ф.Дж., Робертсон Г.Р. CYP2E1 и CYP4A как микросомальные катализаторы перекисей липидов при неалкогольном стеатогепатите мышей. Джей Клин Инвест. 2000; 105:1067–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[11] Rizki G, Arnaboldi L, Gabrielli B, Yan J, Lee GS, Ng RK, et al. У мышей, получавших диету с дефицитом липогенного метионина-холина, развивается гиперметаболизм, совпадающий с печеночной супрессией SCD-1. J липидный рез. 2006;47:2280–90. [PubMed] [Google Scholar]
[12] Pickens MK, Yan JS, Ng RK, Ogata H, Grenert JP, Beyson C, et al. Пищевая сахароза необходима для развития повреждения печени в модели MCD стеатогепатита. J липидный рез. 2009;50:2072–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J липидный рез. 2009;50:2072–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[13] Пикенс М.К., Огата Х., Сун Р.К., Гренерт Д.П., Махер Д.Дж. Диетическая фруктоза усугубляет гепатоцеллюлярное повреждение, когда она включена в диету с дефицитом метионина-холина. Печень инт. 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
[14] Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, et al. Разработка и валидация гистологической системы оценки неалкогольной жировой болезни печени. Гепатология. 2005;41:1313–21. [PubMed] [Google Scholar]
[15] Лакнер С., Гогг-Камерер М., Затлукал К., Штумптнер С., Брант Э.М., Денк Х. Раздутые гепатоциты при стеатогепатите: значение иммуногистохимии кератина для диагностики. Журнал гепатологии. 2008;48:821–8. [PubMed] [Академия Google]
[16] Фолч Дж., Лиз М., Слоан Стэнли Г.Х. Простой метод выделения и очистки общих липидов из тканей животных. Дж. Биол. Хим. 1957; 226: 497–509. [PubMed] [Google Scholar]
[17] Lee GS, Yan JS, Ng RK, Kakar S, Maher JJ. Полиненасыщенные жиры в рационе с дефицитом метионина-холина влияют на воспаление печени, но не на гепатоцеллюлярное повреждение. J липидный рез. 2007; 48: 1885–96. [PubMed] [Google Scholar]
Полиненасыщенные жиры в рационе с дефицитом метионина-холина влияют на воспаление печени, но не на гепатоцеллюлярное повреждение. J липидный рез. 2007; 48: 1885–96. [PubMed] [Google Scholar]
[18] Hellerstein MK, Christiansen M, Kaempfer S, Kletke C, Wu K, Reid JS, et al. Измерение печеночного липогенеза de novo у людей с использованием стабильных изотопов. Джей Клин Инвест. 1991;87:1841–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[19] Hellerstein MK, Kletke C, Kaempfer S, Wu K, Shackleton CH. Использование массовых распределений изотопомеров в секретируемых липидах для отбора проб липогенного пула ацетил-КоА in vivo у людей. Am J Physiol. 1991; 261:E479–86. [PubMed] [Google Scholar]
[20] Hellerstein MK, Neese RA. Анализ массового распределения изотопомеров за восемь лет: теоретические, аналитические и экспериментальные соображения. Am J Physiol. 1999; 276:E1146–70. [PubMed] [Академия Google]
[21] Джонс П.Дж. Отслеживание липогенеза у людей с использованием дейтерированной воды. Может J Physiol Pharmacol. 1996; 74: 755–60. [PubMed] [Google Scholar]
Может J Physiol Pharmacol. 1996; 74: 755–60. [PubMed] [Google Scholar]
[22] Lee WN, Bassilian S, Ajie HO, Schoeller DA, Edmond J, Bergner EA, et al. Измерение in vivo жирных кислот и синтеза холестерина с использованием D2O и анализа массы изотопомеров. Am J Physiol. 1994; 266:E699–708. [PubMed] [Google Scholar]
[23] Ведала А., Ван В., Низ Р.А., Кристиансен М.П., Хеллерштейн М.К. Отсроченный вклад секреторного пути в триглицериды ЛПОНП из плазмы NEFA, диеты и липогенеза de novo у людей. J липидный рез. 2006; 47: 2562–74. [PubMed] [Академия Google]
[24] Peter A, Cegan A, Wagner S, Lehmann R, Stefan N, Konigsrainer A, et al. Липидный состав печени и экспрессия мРНК стеароил-кофермента А-десатуразы 1 можно оценить по соотношению жирных кислот ЛПОНП в плазме. Клин Хим. 2009;55:2113–20. [PubMed] [Google Scholar]
[25] Flowers MT. Индекс десатурации дельта9 жирных кислот как предиктор метаболических заболеваний. Клин Хим. 2009;55:2071–3. [PubMed] [Google Scholar]
[26] Мацузава Н. , Такамура Т., Курита С., Мису Х., Ота Т., Андо Х. и др. Индуцированный липидами окислительный стресс вызывает стеатогепатит у мышей, получавших атерогенную диету. Гепатология. 2007;46:1392–403. [PubMed] [Google Scholar]
, Такамура Т., Курита С., Мису Х., Ота Т., Андо Х. и др. Индуцированный липидами окислительный стресс вызывает стеатогепатит у мышей, получавших атерогенную диету. Гепатология. 2007;46:1392–403. [PubMed] [Google Scholar]
[27] Monetti M, Levin MC, Watt MJ, Sajan MP, Marmor S, Hubbard BK, et al. Диссоциация стеатоза печени и резистентности к инсулину у мышей со сверхэкспрессией DGAT в печени. Клеточный метаб. 2007; 6: 69–78. [PubMed] [Google Scholar]
[28] Ishimoto T, Lanaspa MA, Rivard CJ, Roncal-Jimenez CA, Orlicky DJ, Cicerchi C, et al. Диета с высоким содержанием жиров и сахарозы (западная) вызывает стеатогепатит, который зависит от фруктокиназы. Гепатология. 2013; 58:1632–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[29] Jiang JX, Chen X, Fukada H, Serizawa N, Devaraj S, Torok NJ. Конечные продукты усиленного гликирования индуцируют фиброгенную активность при неалкогольном стеатогепатите путем модулирования активности фермента, превращающего TNF-альфа, у мышей. Гепатология. 2013; 58:1339–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гепатология. 2013; 58:1339–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[30] Ouyang X, Cirillo P, Sautin Y, McCall S, Bruchette JL, Diehl AM, et al. Потребление фруктозы как фактор риска неалкогольной жировой болезни печени. J Гепатол. 2008; 48: 993–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[31] Zelber-Sagi S, Nitzan-Kaluski D, Goldsmith R, Webb M, Blendis L, Halpern Z, et al. Длительное потребление пищи и риск неалкогольной жировой болезни печени (НАЖБП): популяционное исследование. J Гепатол. 2007; 47: 711–7. [PubMed] [Google Scholar]
[32] Abdelmalek MF, Suzuki A, Guy C, Unalp-Arida A, Colvin R, Johnson RJ, et al. Повышенное потребление фруктозы связано с тяжестью фиброза у пациентов с неалкогольной жировой болезнью печени. Гепатология. 2010;51:1961–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[33] Tappy L, Le KA. Влияет ли потребление фруктозы на неалкогольную жировую болезнь печени? Клин Рез Гепатол Гастроэнтерол. 2012; 36: 554–60. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[34] Чанг М., Ма Дж., Патель К., Бергер С., Лау Дж., Лихтенштейн А.Х. Фруктоза, кукурузный сироп с высоким содержанием фруктозы, сахароза и неалкогольная жировая болезнь печени или показатели здоровья печени: систематический обзор и метаанализ. Am J Clin Nutr. 2014; 100:833–49. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[35] Chiu S, Sievenpiper JL, de Souza RJ, Cozma AI, Mirrahimi A, Carleton AJ, et al. Влияние фруктозы на маркеры неалкогольной жировой болезни печени (НАЖБП): систематический обзор и метаанализ испытаний с контролируемым питанием. Eur J Clin Nutr. 2014;68:416–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[36] Kanerva N, Sandboge S, Kaartinen NE, Mannisto S, Eriksson JG. Более высокое потребление фруктозы обратно связано с риском неалкогольной жировой болезни печени у пожилых финнов. Am J Clin Nutr. 2014; 100:1133–8. [PubMed] [Академия Google]
[37] Мур Дж. Б., Ганн П. Дж., Филдинг Б. А. Роль пищевых сахаров и липогенеза de novo при неалкогольной жировой болезни печени. Питательные вещества. 2014; 6: 5679–703. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Питательные вещества. 2014; 6: 5679–703. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[38] Rosqvist F, Iggman D, Kullberg J, Cedernaes J, Johansson HE, Larsson A, et al. Перекармливание полиненасыщенными и насыщенными жирами оказывает выраженное влияние на накопление печени и висцерального жира у людей. Диабет. 2014;63:2356–68. [PubMed] [Google Scholar]
[39] Musso G, Gambino R, De Michieli F, Cassader M, Rizzetto M, Durazzo M, et al. Пищевые привычки и их связь с инсулинорезистентностью и постпрандиальной липемией при неалкогольном стеатогепатите. Гепатология. 2003;37:909–16. [PubMed] [Google Scholar]
[40] Musso G, Gambino R, Pacini G, De Michieli F, Cassader M. Длительное, вызванное насыщенными жирами, глюкозозависимое повышение уровня инсулинотропного полипептида связано с дисбалансом адипокинов и повреждением печени при неалкогольном алкоголизме. стеатогепатит: дисрегуляция оси энтероадипоцитов как новая особенность жировой печени. Am J Clin Nutr. 2009; 89: 558–67. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[41] Da Silva HE, Arendt BM, Noureldin SA, Therapondos G, Guindi M, Allard JP. Поперечное исследование, оценивающее потребление пищи и физическую активность у канадских пациентов с неалкогольной жировой болезнью печени по сравнению со здоровыми людьми из контрольной группы. Дж. Акад Нутр Диета. 2014; 114:1181–94. [PubMed] [Google Scholar]
[42] Anderson EL, Howe LD, Fraser A, Macdonald-Wallis C, Callaway MP, Sattar N, et al. Потребление энергии в детстве связано с неалкогольной жировой болезнью печени у подростков. Дж Нутр. 2015; 145:983–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[43] Donnelly KL, Smith CI, Schwarzenberg SJ, Jessurun J, Boldt MD, Parks EJ. Источники жирных кислот, хранящихся в печени и секретируемых липопротеинами, у больных с неалкогольной жировой болезнью печени. Джей Клин Инвест. 2005; 115:1343–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[44] Lambert JE, Ramos-Roman MA, Browning JD, Parks EJ. Повышенный липогенез de novo является отличительной чертой лиц с неалкогольной жировой болезнью печени. Гастроэнтерология. 2014; 146:726–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Повышенный липогенез de novo является отличительной чертой лиц с неалкогольной жировой болезнью печени. Гастроэнтерология. 2014; 146:726–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[45] Pierce AA, Pickens MK, Siao K, Grenert JP, Maher JJ. Дифференциальная гепатотоксичность пищевого пальмитата и пальмитата, полученного из DNL, в модели стеатогепатита с дефицитом метионина-холина. БМК Гастроэнтерол. 2015;15:72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[46] Мали Х., Баррейро Ф.Дж., Исомото Х., Бронк С.Ф., Горес Г.Дж. Свободные жирные кислоты повышают чувствительность гепатоцитов к цитотоксичности, опосредованной TRAIL. Кишка. 2007; 56:1124–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[47] Holzer RG, Park EJ, Li N, Tran H, Chen M, Choi C, et al. Насыщенные жирные кислоты индуцируют кластеризацию c-Src внутри мембранных субдоменов, что приводит к активации JNK. Клетка. 2011; 147:173–84. [Статья бесплатно PMC] [PubMed] [Google Scholar]
[48] Sharma M, Urano F, Jaeschke A. Cdc42 и Rac1 вносят основной вклад в стимулируемый насыщенными жирными кислотами путь JNK в гепатоцитах. Журнал гепатологии. 2012;56:192–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Cdc42 и Rac1 вносят основной вклад в стимулируемый насыщенными жирными кислотами путь JNK в гепатоцитах. Журнал гепатологии. 2012;56:192–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[49] McGarry JD, Mannaerts GP, Foster DW. Возможная роль малонил-КоА в регуляции окисления жирных кислот в печени и кетогенеза. Джей Клин Инвест. 1977; 60: 265–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[50] McGarry JD, Brown NF. Митохондриальная карнитинпальмитоилтрансферазная система. От концепции к молекулярному анализу. Евр Дж Биохим. 1997; 244:1–14. [PubMed] [Google Scholar]
[51] Sampath H, Miyazaki M, Dobrzyn A, Ntambi JM. Стеароил-КоА-десатураза-1 опосредует пролипогенные эффекты пищевых насыщенных жиров. Дж. Биол. Хим. 2007; 282:2483–93. [PubMed] [Google Scholar]
[52] Lin J, Yang R, Tarr PT, Wu PH, Handschin C, Li S, et al. Гиперлипидемические эффекты пищевых насыщенных жиров, опосредованные коактивацией SREBP PGC-1beta. Клетка. 2005; 120: 261–73. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[53] Ntambi JM. Диетическая регуляция экспрессии гена стеароил-КоА-десатуразы 1 в печени мыши. Дж. Биол. Хим. 1992; 267:10925–30. [PubMed] [Google Scholar]
[54] Turner SM, Roy S, Sul HS, Neese RA, Murphy EJ, Samandi W, et al. Диссоциация между потоками жировой ткани и экспрессией липогенных генов у мышей ob/ob. Am J Physiol Endocrinol Metab. 2007;292: E1101–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[55] Bassilian S, Ahmed S, Lim SK, Boros LG, Mao CS, Lee WN. Потеря регуляции липогенеза у диабетических крыс Zucker. II. Изменения в синтезе стеаратов и олеатов. Am J Physiol Endocrinol Metab. 2002; 282:E507–13. [PubMed] [Google Scholar]
[56] Duarte JA, Carvalho F, Pearson M, Horton JD, Browning JD, Jones JG, et al. Диета с высоким содержанием жиров подавляет липогенез de novo и десатурацию, но не элонгацию и синтез триглицеридов у мышей. J липидный рез. 2014;55:2541–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[57] Delgado TC, Pinheiro D, Caldeira M, Castro MM, Geraldes CF, Lopez-Larrubia P, et al. Источники накопления печеночных триглицеридов при кормлении с высоким содержанием жиров у здоровых крыс. ЯМР Биомед. 2009;22:310–7. [PubMed] [Google Scholar]
Источники накопления печеночных триглицеридов при кормлении с высоким содержанием жиров у здоровых крыс. ЯМР Биомед. 2009;22:310–7. [PubMed] [Google Scholar]
[58] Бруненграбер Д. З., Маккейб Б. Дж., Касумов Т., Александр Дж. К., Чандрамули В., Превис С. Ф. Влияние диеты на моделирование триглицеридов жировой ткани в процессе роста. Am J Physiol Endocrinol Metab. 2003; 285:E917–25. [PubMed] [Академия Google]
[59] Baumgardner JN, Shankar K, Hennings L, Badger TM, Ronis MJ. Новая модель неалкогольного стеатогепатита у крыс, использующих полное энтеральное питание для перекармливания рациона с высоким содержанием полиненасыщенных жиров. Am J Physiol Gastrointest Liver Physiol. 2008;294:G27–38. [PubMed] [Google Scholar]
Влияние последовательности изокалорийных приемов пищи с различным содержанием белка на биохимические показатели плазмы у свиней
1.
Ойке Х., Оиси К., Кобори М. Питательные вещества, часовые гены и хронопитание. Curr Nutr Rep. 2014; 3: 204–212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Oishi K, Uchida D, Itoh N. Диета с низким содержанием углеводов и высоким содержанием белка влияет на ритмическую экспрессию генов, регулирующих глюконеогенез и циркадные часы, в периферических тканях мыши. Хронобиол Инт. 2012 г.; 29: 799–809. 10.3109/07420528.2012.699127 [PubMed] [CrossRef] [Google Scholar]
3. Фернстром Дж. Д., Вуртман Р. Дж., Хаммарстром-Виклунд Б., Рэнд В. М., Манро Х. Н., Дэвидсон К. С. Суточные колебания концентрации триптофана, триозина и других нейтральных аминокислот в плазме: влияние потребления белка с пищей. Am J Clin Nutr. 1979; 32: 1912–1922. [PubMed] [Google Scholar]
4. Нассет Э.С., Хилд Ф.П., Кэллоуэй Д.Х., Марген С., Шнееман П. Аминокислоты в плазме крови человека после однократного употребления мяса, масла, сахарозы и виски. Дж Нутр. 1979 год; 109: 621–630. [PubMed] [Google Scholar]
5.
Нишиока М., Имаидзуми А., Андо Т., Точикубо О. Ночное влияние энергетического баланса рациона на постпрандиальные профили свободных аминокислот в плазме (PFAA) у взрослых японских мужчин. ПЛОС Один. 2013; 8: e62929
10.1371/journal.pone.0062929
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС Один. 2013; 8: e62929
10.1371/journal.pone.0062929
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Репперт С.М., Уивер Д.Р. Координация циркадных ритмов у млекопитающих. Природа. 2002 г.; 418: 935–941. [PubMed] [Google Scholar]
7. Панда С., Хогенеш Дж.Б. Все дело во времени: много тактов, много выходов. Журнал биологических ритмов. 2004 г.; 19: 374–387. [PubMed] [Google Scholar]
8. Oosterman JE, Kalsbeek A, la Fleur SE, Belsham DD. Влияние питательных веществ на циркадные ритмы. Am J Physiol Regul Integr Comp Physiol. 2014: ajpregu 00322 02014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Фрой О. Метаболизм и циркадные ритмы – последствия ожирения. Эндокринные обзоры. 2010 г.; 31: 1–24. 10.1210/er.2009-0014 [PubMed] [CrossRef] [Google Scholar]
10.
Марчева Б., Рэмси К.М., Бур Э.Д., Кобаяши Ю., Су Х., Ко Ч.Х. и др.
Нарушение часовых компонентов CLOCK и BMAL1 приводит к гипоинсулинемии и диабету. Природа. 2010 г. ; 466: 627–631. 10.1038/природа09253
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
; 466: 627–631. 10.1038/природа09253
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Турек Ф.В., Джошу С., Косака А., Лин Э., Иванова Г., МакДирмон Э. и др. Ожирение и метаболический синдром у мышей с мутацией циркадных часов. Наука. 2005 г.; 308: 1043–1045. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Арбл Д.М., Басс Дж., Лапоски А.Д., Витатерна М.Х., Турек Ф.В. Циркадный график приема пищи способствует увеличению веса. Ожирение (Серебряная весна). 2009 г.; 17: 2100–2102. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Инь Дж., Дуань Дж.Л., Цуй З.Дж., Цуй З., Рен В.К., Ли Т.Дж. и др. Окислительный стресс, вызванный перекисью водорода, активирует сигналы NF-kB и Nrf2/Keap1 и запускает аутофагию у поросят. RSC Adv., 2015; 5: 15479–15486 [Google Scholar]
14.
Xiao H, Wu MM, Shao F, Tan BE, Li TJ, Ren WK и др.
Метаболические профили в ответ на добавление составных антимикробных пептидов у поросят, зараженных дезоксиниваленолом. J Anim Sci.2015; 10.2527/jas2014-8229[PubMed] [CrossRef] [Google Scholar]
J Anim Sci.2015; 10.2527/jas2014-8229[PubMed] [CrossRef] [Google Scholar]
15. Инь Дж., Рен В.К., Дуан Дж.Л., Ву Л., Чен С., Ли Т.Дж. и др. Пищевые добавки с аргинином усиливают экспрессию SLC7A7 и SLC7A1 в кишечнике и облегчают депрессию роста у свиней, зараженных микотоксинами. Аминокислоты, 2014; 46: 883–892 10.1007/s00726-013-1643-5 [PubMed] [CrossRef] [Google Scholar]
16. Инь Ю.Л., Хуан Р.Л., Ли Т.Дж., Руан З., Се М.Ю., Дэн З.И. и др. Метаболизм аминокислот во внутренних органах молодых свиней с портальным дренажем: влияние пищевых добавок с хитозаном и гороховой шелухой. Аминокислоты 2010. 39: 1581–1587 10.1007/s00726-010-0577-4 [PubMed] [CrossRef] [Google Scholar]
17. Wu X, Ruan Z, Gao Y, Yin Y, Zhou X, Wang L и др. Пищевые добавки с L-аргинином и N-карбамилглутаматом усиливают рост кишечника и экспрессию белка теплового шока 70 у поросят-отъемышей, получающих рацион на основе кукурузной и соевой муки. Аминокислоты. 2010 г.; 39: 831–839. 10.1007/с00726-010-0538-у [PubMed] [CrossRef] [Google Scholar]
18. Wu X, Ruan Z, Gao Y, Wang L, Ruan Z, Liu ZQ и др.
Пищевые добавки с L-аргинином или N-карбамилглутаматом усиливают рост кишечника и экспрессию белка теплового шока-70 у поросят-отъемышей, получающих корм на основе кукурузной и соевой муки. Аминокислоты. 2010 г.; 39: 831–9. 10.1007/с00726-010-0538-у
[PubMed] [CrossRef] [Google Scholar]
Wu X, Ruan Z, Gao Y, Wang L, Ruan Z, Liu ZQ и др.
Пищевые добавки с L-аргинином или N-карбамилглутаматом усиливают рост кишечника и экспрессию белка теплового шока-70 у поросят-отъемышей, получающих корм на основе кукурузной и соевой муки. Аминокислоты. 2010 г.; 39: 831–9. 10.1007/с00726-010-0538-у
[PubMed] [CrossRef] [Google Scholar]
19. Инь Ю.Л., Яо К., Лю З., Гонг З., Руан Д., Дэн Б.Е. и др. Добавление L-лейцина в рацион с низким содержанием белка увеличивает синтез белка в тканях у поросят-отъемышей. Аминокислоты. 2010 г.; 39: 1477–1486. 10.1007/s00726-010-0612-5 [PubMed] [CrossRef] [Google Scholar]
20. Дэн Дж., У С., Бин С., Гонг З., Руан Д., Дэн Б.Е. и др. Соотношение амилозы и амилопектина в рационе и содержание резистентного крахмала влияет на уровень глюкозы в плазме, молочной кислоты, уровень гормонов и синтез белка в тканях внутренних органов. Zeitschrift für Tierphysiologie, Tierernährung und Futtermittelkunde 2010 г.; 94: 220–226 [PubMed] [Google Scholar]
21. Тан З.Р., Инь Л.И., Ньячоти К.М., Хуанг Р.Л., Ли Т.Дж., Ян К.Б. и др.
Влияние пищевых добавок хитозана и галакто-маннаноолигосахаридов на параметры сыворотки и экспрессию мРНК инсулиноподобного фактора роста-I у поросят в раннем отъеме. Эндокринология домашних животных
2005 г.; 28: 430–441.
[PubMed] [Google Scholar]
Тан З.Р., Инь Л.И., Ньячоти К.М., Хуанг Р.Л., Ли Т.Дж., Ян К.Б. и др.
Влияние пищевых добавок хитозана и галакто-маннаноолигосахаридов на параметры сыворотки и экспрессию мРНК инсулиноподобного фактора роста-I у поросят в раннем отъеме. Эндокринология домашних животных
2005 г.; 28: 430–441.
[PubMed] [Google Scholar]
22. Ren WK, Yin J, Wu MM, Liu G, Yang G, Xion Y и др. (2014)Аминокислотный профиль сыворотки и благотворное влияние добавок L-аргинина или L-глютамина при колите с декстрансульфатом натрия. ПЛОС ОДИН,2014,9: e88335 10.1371/journal.pone.0088335 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Yin YL, Huang R, Zhong HY (1993) Сравнение илеоректального анастомоза и обычного метода измерения усвояемости подвздошной кишки источников белка и смешанных рационов у растущих свиней. Наука и технология кормов для животных 42: 297–308. [Google Scholar]
24.
Хуанг Р.Л., Инь Ю.Л., Ву Г.Ю., Чжан Ю.Г., Ли Т.Дж., Ли Л.Л. и др. (2005) Влияние пищевых добавок с олигохитозаном на усвояемость питательных веществ в подвздошной кишке и продуктивность бройлеров. Птицеводство, 84: 1383–1388.
[PubMed] [Академия Google]
Птицеводство, 84: 1383–1388.
[PubMed] [Академия Google]
25. Репперт С.М., Уивер Д.Р. Координация циркадных ритмов у млекопитающих. Природа. 2002 г.; 418: 935–941. [PubMed] [Google Scholar]
26. Фрой О. Связь между питанием и циркадными ритмами у млекопитающих. Передний нейроэндокринол. 2007 г.; 28: 61–71. [PubMed] [Google Scholar]
27. Ромон М., Эдме Дж.Л., Буленгес С., Лескроарт Дж.Л., Фримат П. Циркадные вариации термогенеза, вызванного диетой. Am J Clin Nutr. 1993 год; 57: 476–480. [PubMed] [Google Scholar]
28. Гроенен М.А., Арчибальд А.Л., Уениши Х., Таггл К.К., Такеучи Ю., Ротшильд М.Ф. и др. Анализ геномов свиней дает представление о демографии и эволюции свиней. Природа. 2012 г.; 491: 393–398. 10.1038/природа11622 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29.
Помар С., Помар Дж., Дюбо Ф., Джоаннопулос Э., Дюссо Дж. П. Влияние ежедневного многофазного кормления на продуктивность животных, состав тела, выделение азота и фосфора и затраты на корма у свиней на доращивании и откорме. Животное. 2014; 8: 704–713. 10.1017/С1751731114000408
[PubMed] [CrossRef] [Google Scholar]
Животное. 2014; 8: 704–713. 10.1017/С1751731114000408
[PubMed] [CrossRef] [Google Scholar]
30. Перейра М.А., Эриксон Э., Макки П., Шранклер К., Раатц С.К., Литл Л.А. и соавт. Частота и качество завтрака могут влиять на гликемию и аппетит у взрослых и детей. Дж Нутр. 2011 г.; 141: 163–168. 10.3945/инн.109.114405 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Блуэ С., Мариотти Ф., Аззоут-Марниш Д., Бос С., Мате В., Том Д. и др. Пониженное потребление энергии крысами, получавшими высокобелковую низкоуглеводную диету, объясняет более низкое отложение жира, но замена макронутриентов объясняет улучшение гликемического контроля. Дж Нутр. 2006 г.; 136: 1849–1854. [PubMed] [Google Scholar]
32. Боуэн Дж., Ноукс М., Тренерри С., Клифтон П.М. Потребление энергии, грелин и холецистокинин после различной предварительной нагрузки углеводами и белками у мужчин с избыточным весом. J Clin Endocrinol Metab. 2006 г.; 91: 1477–1483. [PubMed] [Google Scholar]
33. Ламия К.А., Шторх К.Ф., Вейц К.Дж. Физиологическое значение циркадных часов периферических тканей. Proc Natl Acad Sci U S A. 2008; 105: 15172–15177. 10.1073/пнас.0806717105
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ламия К.А., Шторх К.Ф., Вейц К.Дж. Физиологическое значение циркадных часов периферических тканей. Proc Natl Acad Sci U S A. 2008; 105: 15172–15177. 10.1073/пнас.0806717105
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Lee SY, Sung E, Chang Y. Повышенный уровень гамма-глутамилтрансферазы в сыворотке крови является сильным маркером резистентности к инсулину у детей с ожирением. Int J Endocrinol. 2013; 2013: 578693 10.1155/2013/578693 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Zhou J, Mo Y, Li H, Ran X, Yang W, Li Q и др. Аланинаминотрансфераза связана с неблагоприятным ночным профилем глюкозы в крови у людей с нормальной регуляцией уровня глюкозы. ПЛОС Один. 2013; 8: e56072 10.1371/journal.pone.0056072 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Данлэп Дж. Молекулярные основы циркадных часов. Клетка. 1999 г.; 96: 271–290. [PubMed] [Google Scholar]
37.
Риджио О., Мерли М., Пьече У., Ромити А. , Паскуалетти П., Коппола А. и др.
Суточная ритмичность вариаций аминокислот в плазме крови у здоровых людей. Недавние прог-мед. 1989; 80: 591–593.
[PubMed] [Google Scholar]
, Паскуалетти П., Коппола А. и др.
Суточная ритмичность вариаций аминокислот в плазме крови у здоровых людей. Недавние прог-мед. 1989; 80: 591–593.
[PubMed] [Google Scholar]
38. Цай П.Дж., Ву В.Х., Хуанг ПК. Циркадные колебания концентрации нейтральных и основных аминокислот в плазме у молодых мужчин на обычной тайваньской диете. J Formos Med Assoc. 2000 г.; 99: 151–157. [PubMed] [Google Scholar]
39. Адиби СА. Метаболизм аминокислот с разветвленной цепью при измененном питании. Метаболизм. 1976 год; 25: 1287–1302. [PubMed] [Google Scholar]
40. Yin Y, Yao K, Liu Z, Gong M, Ruan Z, Deng D, et al. Добавление L-лейцина в рацион с низким содержанием белка увеличивает синтез белка в тканях у поросят-отъемышей. Аминокислоты. 2010 г.; 39: 1477–1486. 10.1007/s00726-010-0612-5 [PubMed] [CrossRef] [Google Scholar]
41.
Сурьяван А., Джеяпалан А.С., Орельяна Р.А., Уилсон Ф.А., Нгуен Х.В., Дэвис Т.А. Лейцин стимулирует синтез белка в скелетных мышцах новорожденных свиней, усиливая активацию mTORC1. Am J Physiol Endocrinol Metab. 2008 г.; 295: E868–875. 10.1152/айпендо.90314.2008
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Am J Physiol Endocrinol Metab. 2008 г.; 295: E868–875. 10.1152/айпендо.90314.2008
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Ранавана В., Каур Б. Роль белков в секреции инсулина и гликемическом контроле. Adv Food Nutr Res. 2013; 70: 1–47. 10.1016/В978-0-12-416555-7.00001-1 [PubMed] [CrossRef] [Google Scholar]
43. Raben A, Agerholm-Larsen L, Flint A, Holst JJ, Astrup A. Пища с одинаковой плотностью энергии, но богатая белками, жирами, углеводами или алкоголем по-разному влияет на расход энергии и метаболизм субстрата, но не на аппетит и потребление энергии. Am J Clin Nutr. 2003 г.; 77: 91–100. [PubMed] [Google Scholar]
44. Ахмед М., Наттолл Ф.К., Гэннон М.С., Ламуса Р.Ф. Реакция глюкагона плазмы и азота альфа-аминокислот на различные диеты у нормальных людей. Am J Clin Nutr. 1980; 33: 1917–1924. [PubMed] [Google Scholar]
45.
Манро ХН. Факторы, влияющие на потребность в углеводах, жирах и аминокислотах. Nutr Dieta Eur Rev Nutr диета. 1963 год; 5: 298–304.
[PubMed] [Google Scholar]
1963 год; 5: 298–304.
[PubMed] [Google Scholar]
46. Yin FG, Zhang ZZ, Huang J, Yin YL (2010)Скорость переваривания пищевого крахмала влияет на системную циркуляцию аминокислот у поросят-отъемышей. Брит Джей Нутр 103: 1404–1412 гг. 10.1017/S0007114509993321 [PubMed] [CrossRef] [Google Scholar]
47. ван Лун Л.Дж., Сарис В.Х., Верхаген Х., Вагенмакерс А.Дж. Инсулиновые реакции плазмы после приема различных смесей аминокислот или белков с углеводами. Am J Clin Nutr. 2000 г.; 72: 96–105. [PubMed] [Google Scholar]
48. Тидген М., Зейтц Х.Дж. Диетический контроль циркадных колебаний инсулина в сыворотке, глюкагона и циклического АМФ в печени. Дж Нутр. 1980 г.; 110: 876–882. [PubMed] [Google Scholar]
49.
Peret J, Fousstock S, Chanez M, Bois-Joyeux B, Assan R. Концентрации глюкагона и инсулина в плазме и активность фосфоенолпируваткарбоксикиназы и пируваткиназы в печени во время и после адаптации крыс к диете с высоким содержанием белка. Дж Нутр. 1981 год; 111: 1173–1184.

 Сочетание казеинов и сывороточных белков обеспечивает полный набор эссенциальных аминокислот. Продукт содержит высокие концентрации омега-6 и омега-3 жирных кислот (в соотношении 4:1), а также СЦТ (25%), рапсовое и кукурузные масла, широкий набор витаминов и микроэлементов.
Сочетание казеинов и сывороточных белков обеспечивает полный набор эссенциальных аминокислот. Продукт содержит высокие концентрации омега-6 и омега-3 жирных кислот (в соотношении 4:1), а также СЦТ (25%), рапсовое и кукурузные масла, широкий набор витаминов и микроэлементов.