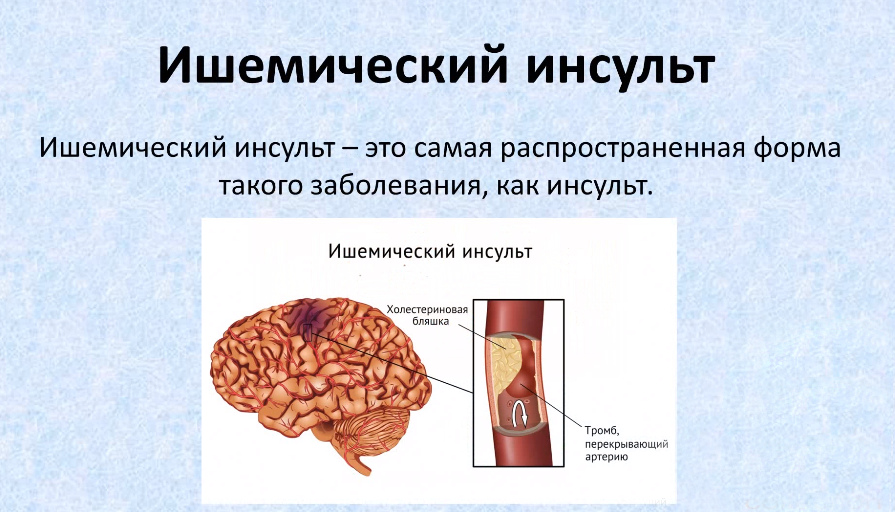
Ишемический инсульт острый: причины, симптомы и лечение всех видов заболеваний в ФНКЦ ФМБА
Острый ишемический инсульт и в 30, и в 80 лет – мы можем помочь -Наши новости
БудниГКБ15 — Острый ишемический инсульт и в 30, и в 80 лет – мы можем помочьПациентка Ш. (33 г.) приехала в Москву из Волгоградской области. Почувствовала себя плохо, потеряла сознание. «Скорую» вызвала подруга. Врачи заподозрили острое нарушение мозгового кровообращения. Рано утром, минуя приемный покой Городской клинической больницы № 15 имени О. Филатова, её доставили в кабинет компьютерной томографии. Экстренно было сделано КТ головного мозга. По результатам ее: картина закупорки на уровне дистальных отделов М1 и проксимальных отделов М2 сегментов правой средней мозговой артерии, с сохранением незначительного периферического кровотока. Экстренно консилиумом с участием специалистов отделений нейрореанимации, неврологии, лучевой диагностики и рентгеноэндоваскулярной хирургии принято решение выполнить экстренную эндоваскулярную тромбоэкстракцию из средней мозговой артерии головного мозга.
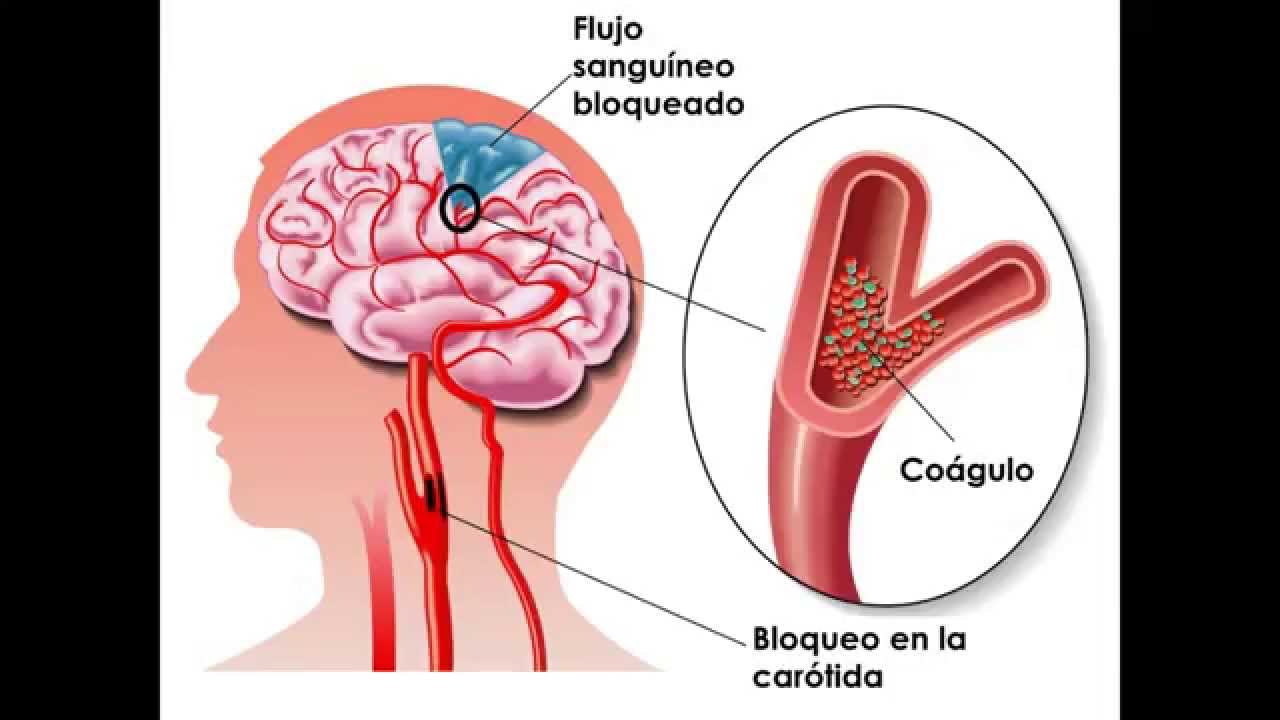 Именно эти два фактора риска могут быть пусковыми факторами для образования тромбов в таком молодом возрасте.
Именно эти два фактора риска могут быть пусковыми факторами для образования тромбов в таком молодом возрасте.Другая история спасения… Больная Г., 79 лет, потеряла сознание дома. Ее обнаружили родственники. Вызвали скорую помощь. Бригада доставила ее в ГКБ № 15 имени О.М. Филатова. Практически сразу направлена в кабинет компьютерной томографии, где выявлена закупорка на уровне дистальных отделов М1 и проксимальных отделов М2 сегментов правой средней мозговой артерии с сохранением незначительного периферического кровотока. Выполнена экстренная тромбэкстракция, левосторонний гемипарез регрессировал на операционном столе, но сохранялись легкие речевые расстройства, которые также разрешились на вторые сутки после операции. Пациентка выписана из отделения неврологии в хорошем самочувствии на 9 сутки.
Лечение пациентов с острым нарушением мозгового кровообращения является эффективным только при командной работе на догоспитальном и внутригоспитальном этапах. Методы эндоваскулярной тромбоэкстрации позволяют улучшить результаты лечения пациентов с острым ишемическим инсультом.
Острый ишемический инсульт | mgzt.ru
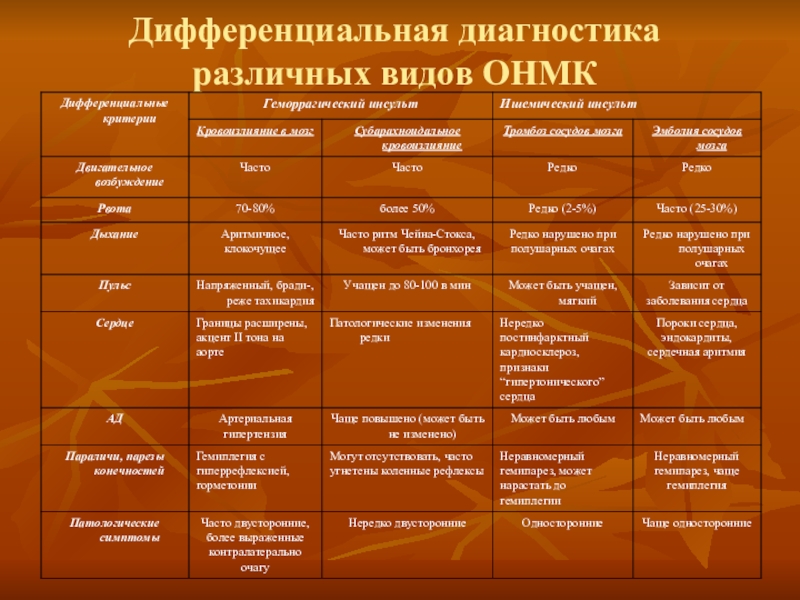
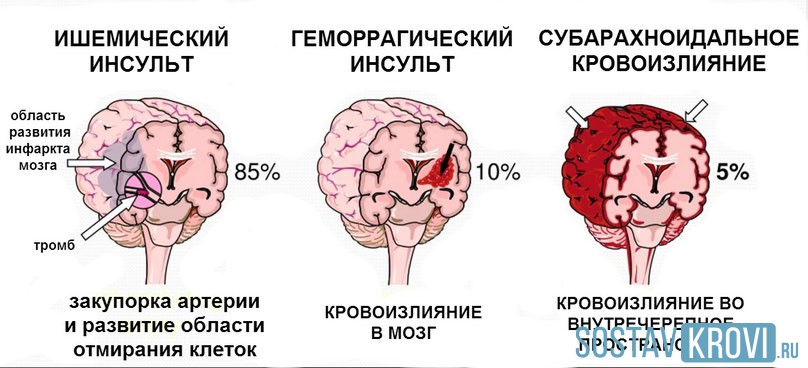
Инсульт занимает второе место после ИБС как причина инвалидности в странах с высоким уровнем жизни и как причина смерти — повсеместно. В западных странах около 80% инсультов вызвано ишемией головного мозга вследствие окклюзии артерий, остальные 20% — кровоизлияниями.
Ишемическое повреждение головного мозга вызывается каскадом процессов, приводящих к энергетическому истощению и смерти клеток. Промежуточные факторы включают избыток экстрацеллюлярных аминокислот, образование свободных радикалов и воспаление. Сразу после окклюзии артерий вокруг места снижения перфузии возникает область дисфункции, вызванной метаболическими и ионными нарушениями, но структурность тканей сохраняется (ишемическая пенумбра — полутень). Поэтому в первые минуты и часы клиническая симптоматика не обязательно отражает необратимость нарушений. В зависимости от степени остаточного кровеносного потока и длительности ишемии пенумбра в конце концов инкорпорируется в инфаркт, если не удается достигнуть реперфузии.
Острый инсульт в типичных случаях характеризуется внезапным началом фокальной неврологической недостаточности, хотя у некоторых пациентов имеет место постепенное прогрессирование клинической картины. Наиболее частыми неврологическими нарушениями являются дисфазия, дизартрия, гемианопия, слабость, атаксия, потеря чувствительности. Симптомы отмечаются с одной стороны, сознание, как правило, нормальное или слегка нарушено.

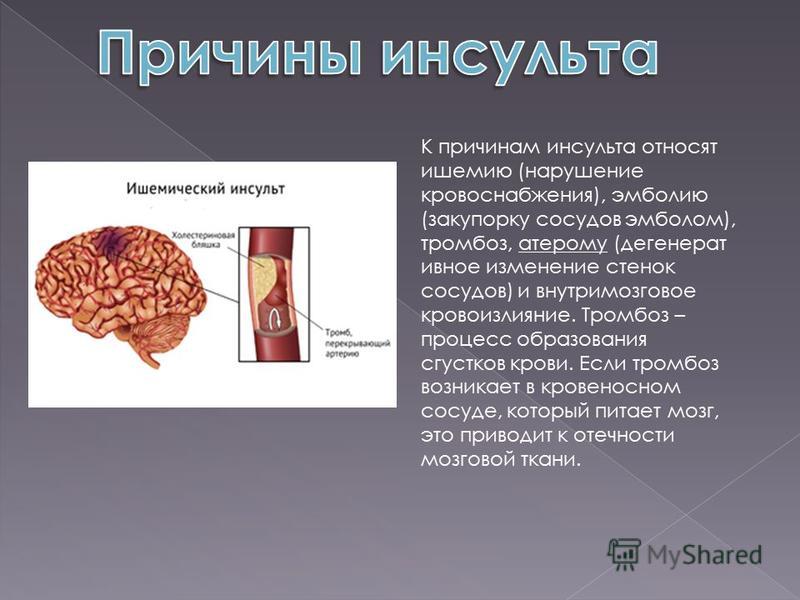
Атеросклероз (ведущий к тромбоэмболии или локальной окклюзии) и кардиоэмболия являются ведущими причинами ишемии головного мозга. Однако следует иметь в виду возможность необычных причин, особенно у пациентов до 50 лет и не имеющих факторов риска кардиоваскулярных болезней. В некоторых случаях следует предположить альтернативный диагноз: при наличии птоза и миоза — расслаивающую аневризму сонной артерии; лихорадка и шум при аускульта-ции сердца может свидетельствовать об инфекционном эндокардите; головная боль и увеличение СОЭ у больных старше 50 лет — о гигантоклеточном артериите.
Неврологические симптомы требуют внимательного обследования. Существует несколько шкал для количественной оценки неврологического дефицита, используемые, главным образом, для научно-исследовательских целей. Наиболее часто применяется шкала, разработанная Национальным институтом здоровья. Нерегулярный пульс позволяет предположить фибрилляцию предсердий, очень высокое АД — гипертоническую энцефалопатию.
Лабораторные исследования в острую фазу болезни должны включать определение уровня глюкозы крови (так как гипогликемия также может вызвать фокальную неврологическую симптоматику), клинический анализ крови, определение протромбинового времени и времени частичного тромбопластина, особенно в тех случаях, когда обсуждается применение тромболизиса. ЭКГ может выявить фибрилляцию предсердий, острый или предшествующий инфаркт миокарда как потенциальную причину тромбоэмболизма. Поскольку инсульт может осложниться ишемией миокарда и аритмией, в течение первых 24 часов показан кардиальный мониторинг. ЭхоКГ в первые часы инсульта показана только в редких случаях, например при подозрении на инфекционный миокардит. В последующие дни для исключения кардиоэмболизма показано проведение трансторакальной или, предпочтительнее, трансэзофагальной ЭхоКГ.
 Всем больным с подозрением на ишемический инсульт требуется проведение КТ или МРТ головного мозга. Неконтрастная КТ может оказаться вполне достаточной. По сравнению с МРТ она более доступна, производится быстро, менее подвержена артефакту, если больной лежал не вполне спокойно. Как КТ, так и МРТ обладают высокой чувствительностью для выявления острой интракраниальной геморрагии. Но МРТ более высокочувствительна, чем КТ, для выявления острых ишемических нарушений, особенно в задней ямке и в первые часы после ишемического инсульта. Цитотоксический отек определяется в первые минуты после начала ишемии, с уменьшением диффузионного коэффициента. Однако пока не ясно, является ли ранняя визуализация ишемии важным показателем для лечения.
Всем больным с подозрением на ишемический инсульт требуется проведение КТ или МРТ головного мозга. Неконтрастная КТ может оказаться вполне достаточной. По сравнению с МРТ она более доступна, производится быстро, менее подвержена артефакту, если больной лежал не вполне спокойно. Как КТ, так и МРТ обладают высокой чувствительностью для выявления острой интракраниальной геморрагии. Но МРТ более высокочувствительна, чем КТ, для выявления острых ишемических нарушений, особенно в задней ямке и в первые часы после ишемического инсульта. Цитотоксический отек определяется в первые минуты после начала ишемии, с уменьшением диффузионного коэффициента. Однако пока не ясно, является ли ранняя визуализация ишемии важным показателем для лечения.Для больных, у которых рассматриваются показания к острой инвазивной стратегии лечения (интраартериальный тромболизис или механическое удаление сгустка), ургентная КТ или магнитно-резонансная ангиография является полезной для идентификации места артериальной окклюзии.

Внутривенный тромболизис. Мультицентровое рандомизированное исследование, проведенное Национальным институтом нервных болезней, продемонстрировало эффективность лечения внутривенным рекомби-нантным активатором тканевого плазминогена (rt-PA) (альтепла-за), начатого в первые 3 часа после начала клинической картины инсульта. Среди тех, кто получал препарат (0,9 мг/кг — 10% дозы в виде болюса, остальное вводилось инфузионно в течение часа, общая доза — 90 мг), 31-50% показали положительную неврологическую динамику в течение 3 месяцев, в то время как среди получавших плацебо — только 20-38%. Смертность, однако, была одинаковой в обеих группах. У получавших препарат rt-PA внутричерепные кровотечения отмечались чаще (6,4%), чем в контрольной группе (0,6%).
 В четырех других клинических испытаниях, где испытуемый препарат начинали давать только спустя 6 часов от начала клинической симптоматики, не были получены положительные результаты. Было показано тем не менее, что чем раньше (ранее 3 часов от начала болезни) начинали применять альтеплазу, тем лучше был результат.
В четырех других клинических испытаниях, где испытуемый препарат начинали давать только спустя 6 часов от начала клинической симптоматики, не были получены положительные результаты. Было показано тем не менее, что чем раньше (ранее 3 часов от начала болезни) начинали применять альтеплазу, тем лучше был результат.Риск внутричерепной геморрагии после тромболизиса выше при тяжелом инсульте и увеличивается с возрастом больных. Эффективность и безопасность препарата выше у тех больных, у которых при КТ рано были выявлены ишемические изменения.
В двух рандомизированных исследованиях, в которых применяли аспирин (160 или 300 мг/ день) в первые 48 часов от начала инсульта и в течение 2 недель или до выписки из больницы, отмечено уменьшение частоты летальных исходов и риска повторных ишемических атак. Хотя эффективность в общем невысока, но аспирин недорог, имеет хороший профиль безопасности. Поскольку эффект от комбинации аспирина с rt-PA не определен, будет уместным воздержаться от приема аспирина в течение 24 часов больным, у которых применялся внутривенный тромболизис.

Антикоагулянты. Метаанализ 6 рандомизированных испытаний, включавших 21 966 больных, не выявил доказательств того, что применение антикоагулянтов (нефракционированный гепарин, низкомолекулярный гепарин, ингибиторы тромбина или пероральные антикоагулянты) в острой фазе инсульта улучшает неврологические функции. Согласно этому анализу, на 1000 леченых ими больных приходится по меньшей мере 9 случаев повторных ишемических атак, но более 9 случаев симптоматических интракраниальных геморрагий. Метаанализ 7 рандомизированных испытаний показал сходные результаты — отсутствие улучшения при применении антикоагулянтов при остром кардиоэмболическом инсульте.
Профилактика и лечение осложнений. У больных, госпитализированных по поводу инсульта, часто затруднено кормление. Однако в рандомизированных исследованиях показано, что рутинное питание через рот или раннее кормление через зонд, не предотвращающие потерю массы тела у больных, находящихся на госпитальной койке, дает хороший функциональный результат в долговременном плане.

У больных с острым ишемическим инсультом повышен риск тромбоза глубоких вен и легочного эмболизма, который увеличивается с возрастом больных и тяжестью инсульта. Хотя применение антикоагулянтов не улучшает неврологические функции, применение подкожно низких доз нефракционированного гепарина или гепарина с малой молекулярной массой рекомендуют больным с высоким риском тромбоза глубоких вен, в частности иммобилизированным (например, паралич ног).
В обобщенном анализе трех рандомизированных испытаний сравнивалось хирургическое (гемикраниэктомия и дурапластика) и терапевтическое лечение у 93 больных 60 лет и моложе с инфарктом в области средней мозговой артерии. Хирургическое лечение в первые 48 часов после начала инсульта уменьшило частоту как летального исхода (22% против 71% при терапевтическом лечении), так и инвалидности средней или тяжелой степени (57% против 79%). Менее эффективным оно оказалось у больных с афазией, у пациентов старше 50 лет и у тех, кому оперативное вмешательство было выполнено на второй день после инсульта.
 Данные ряда рандомизированных испытаний показали, что больные, которые госпитализировались в специализированные отделения, получали больше шансов остаться в живых и не нуждались в посторонней помощи.
Данные ряда рандомизированных испытаний показали, что больные, которые госпитализировались в специализированные отделения, получали больше шансов остаться в живых и не нуждались в посторонней помощи.Стратегия уменьшения риска рецидива инсульта заключается в детальном обсуждении рекомендуемой программы, которая включает: прием аспирина в низких дозах и дипиридамола больными с ишемическим инсультом артериальной природы; пероральные антикоагулянты — больными с кардиальным эмболизмом; лечение гипертонии; статины для снижения уровня липидов; контроль за уровнем сахара в крови для больных диабетом; прекращение курения; ка-ротидная эндартерэктомия у больных с существенным ипсилатеральным каротидным стенозом.
Дополнительное лечение
Высокие АД, уровень сахара в крови и температура тела в первые часы и дни от начала инсульта, как правило, ассоциируется с плохим долгосрочным прогнозом. Эффект от раннего снижения АД и поддержания нормотермии и нормогликемии в настоящее время изучается в рандомизированных исследованиях.

Соображения о нежелательном эффекте от быстрого снижения АД для церебральной перфузии нашли отражение в рекомендациях, основанных на консенсусе о том, что следует воздерживаться от антигипертензивный терапии в течение острой фазы инсульта до тех пор, пока диастолическое АД не превышает 120 мм рт.ст. или систолическое — 220 мм рт.ст., если речь идет о больных, которым не предполагается назначение лечения внутривенным введением rt-PA. Внутривенная антигипертензивная терапия рекомендуется для поддержания САД ниже 180 мм рт.ст. и ДАД ниже 105 мм рт.ст.
Нейропротекторы. Как было показано на моделях животных с фокальной церебральной ишемией, гипотермия уменьшает объем инфаркта и улучшает неврологический статус. Она также улучшает, как было показано в рандомизированных исследованиях, функциональные показатели у больных с глобальной церебральной ишемией при остановке сердца, но не оказывает такого же эффекта при травматическом повреждении головного мозга. Необходимы обширные клинические испытания для оценки эффекта гипотермии для больных с острым ишемическим инсультом.

Области неопределенности
Даже в богатых странах, таких как США, только незначительное меньшинство больных с острым ишемическим инсультом получает терапию rt-PA. Ее использование ограничивается «окном времени» в 3 часа от начала симптоматики. Однако результаты 6 рандомизированных испытаний показали такой же эффект от применения этого вида терапии при 3-часовом «окне». Исследования в этом направлении продолжаются. Предварительные данные показывают целесообразность контроля эффективности тромболизиса проведением через 3 часа количественной оценки пенумбры с помощью диффузионно-перфузионной МРТ или перфузионной КТ. Это положение также подлежит проверке дальнейшими исследованиями. Хотя внутривенный тромболизис призван вызвать реканализацию окклюзированных артерией, для установления факта реканализации, никаких исследований не было проведено. Имеются исследования, в которых отмечено, что через 2 часа после начала тромболизиса только у одного из трех больных была достигнута реканализация средней церебральной артерии.
 Имеются ограниченные данные о том, что дополнение терапии внутривенным введением микропузырьков галактозы может в дальнейшем повысить частоту реканализации. Однако подчеркивается, что такие методы лечения не должны проводиться до завершения клинических исследований.
Имеются ограниченные данные о том, что дополнение терапии внутривенным введением микропузырьков галактозы может в дальнейшем повысить частоту реканализации. Однако подчеркивается, что такие методы лечения не должны проводиться до завершения клинических исследований.По сравнению с внутривенным внутриартериальный тромболизис может повысить вероятность наступления реканализации, но эти два метода не были испытаны в достаточно больших сравнительных рандомизированных исследованиях.
В небольшом по объему рандомизированном исследовании назначение интраартериально проурокиназы и внутривенно гепарина при сравнении только с внутривенным гепарином в первые 6 часов инсульта показало преимущество комбинации указанных двух препаратов — реканализация средней мозговой артерии наступала в 66% против 18%. Преимущество было и в более частом восстановлении функциональных показателей — полное восстановление или частичное в 40% против 15%.
Тромболитическая терапия, при которой вслед за внутривенным тромболизисом проводится внутриартериальный, может дать более быстрый терапевтический эффект и увеличить частоту реканализации.
 Однако такая тактика пока может применяться только в ограниченных масштабах. Попытки механической тромбоэктомии у больных с острым ишемическим инсультом значительно повышали частоту реканализации, но контролируемых исследований этой методики недостаточно.
Однако такая тактика пока может применяться только в ограниченных масштабах. Попытки механической тромбоэктомии у больных с острым ишемическим инсультом значительно повышали частоту реканализации, но контролируемых исследований этой методики недостаточно.Рудольф АРТАМОНОВ.
По материалам
«New England Journal of Medicine».
Результаты операций каротидной эндартерэктомии, выполненных в остром периоде ишемического инсульта
ЖУРНАЛ «АНГИОЛОГИЯ И СОСУДИСТАЯ ХИРУРГИЯ» •
2016 • ТОМ 22 • №2
Шатравка А.В.1, Сокуренко Г.Ю.2, Суворов С.А.3, Ризаханова М.Р.4, Логинов И.А.3, Алексеева Н.В.1
1) Кафедра госпитальной хирургии №2, Первый Санкт-Петербургский государственный медицинский университет им. aкад. И.П. Павлова,
2) Клиника №2, Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России,
3) Отделение хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции, Городская больница №26,
4) Кафедра сердечно-сосудистой хирургии, Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия
И.И. Мечникова, Санкт-Петербург, Россия
В последние годы проведено несколько исследований, касающихся оптимальных сроков выполнения каротидной эндартерэктомии после перенесенного острого нарушения мозгового кровообращения (ОНМК). Однако до сих пор нет единого мнения о целесообразности и безопасности выполнения каротидной эндартерэктомии в остром периоде ишемического инсульта. В Российских национальных рекомендациях по хирургическому лечению заболеваний экстракраниальных артерий 2013 г. указано на целесообразность выполнения каротидной эндартерэктомии в сроки до 2 недель после перенесенного ишемического инсульта (уровень доказательности B). В то же время нет данных о возможности выполнения этой операции у больных с неврологическим дефицитом 4 балла по шкале Рэнкин.
Проведенный в исследовании анализ результатов 110 каротидных эндартерэктомий, выполненных у больных с гемодинамически значимым стенозом сонных артерий в сроки от 2 до 14 дней после развития ипсилатерального ОНМК, демонстрирует безопасность операции (частота послеоперационных нарушений мозгового кровообращения составила 0,9% – 1 пациент) и ее эффективность в профилактике повторных ишемических осложнений. Установлен также регресс неврологической симптоматики у подавляющего большинства – 86 (78%) больных.
Установлен также регресс неврологической симптоматики у подавляющего большинства – 86 (78%) больных.
Несмотря на отсутствие рекомендаций о возможности выполнения каротидной эндартерэктомии пациентам после перенесенного ОНМК с неврологическим дефицитом 4 степени по модифицированной шкале Рэнкин, нами доказана эффективность и целесообразность выполнения этой операции у данной группы пациентов. Ни одного случая трансформации ишемического очага в геморрагический отмечено не было. У одного пациента развился фатальный ОНМК. За время наблюдения (12 месяцев) регресс неврологической симптоматики отмечен у 16 (66,7%) из 24 оперированных больных с исходным дефицитом 4 степени по шкале Рэнкин.
КЛЮЧЕВЫЕ СЛОВА: каротидная эндартерэктомия, острое нарушение мозгового кровообращения, ишемический инсульт, острый период, шкала Рэнкин.
Стр. 133-136
« Назад
Нейровизуализация острого ишемического инсульта: современное состояние | Алдатов
1. Best AC, Acosta NR, Fraser JE et al. Recognizing False Ischemic Penumbras in CT Brain Perfusion Studies. Radiographics. 2012;32(4):П79-П96.
Best AC, Acosta NR, Fraser JE et al. Recognizing False Ischemic Penumbras in CT Brain Perfusion Studies. Radiographics. 2012;32(4):П79-П96.
2. Hacke W, Furlan AJ, Al-Rawi Y et al. Intravenous Desmoteplase in Patients with Acute Ischaemic Stroke Selected by MRI Perfusion-Diffusion Weighted Imaging or Perfusion CT (DIAS-2): A Prospective, Randomised, Double-Blind, Placebo-Controlled Study. Lancet Neurol. 2009;8(2):141-150.
3. Ahmed N, Kellert L, Lees KR et al. Results of Intravenous Thrombolysis Within 4.5 to 6 Hours and Updated Results within 3 to 4.5 Hours of Onset of Acute Ischemic Stroke Recorded in the Safe Implementation of Treatment in Stroke International Stroke Thrombolysis Register (SITS-ISTR): An Observational Study. JAMA Neurol. 2013;70(7):837-844.
4. de Los Rios la Rosa F, Khoury J, Kissela BM et al. Eligibility for Intravenous Recombinant Tissue-Type Plasminogen Activator within a Population: The Effect of the European Cooperative Acute Stroke Study (ECASS) III Trial. Stroke. 2012;43(6):1591-1595.
5. Musuka TD, Wilton SB, Traboulsi M et al. Diagnosis and Management of Acute Ischemic Stroke: Speed is Critical. CMAJ. 2015;187(12):887-893.
6. Hacke W, Donnan G, Fieschi C et al. Association of Outcome with Early Stroke Treatment: Pooled Analysis of ATLANTIS, ECASS, and NINDS rt-PA Stroke Trials. Lancet. 2004;363(9411):768-774.
7. Ferrari J, Knoflach M, Seyfang L et al. Differences in Process Management and In-Hospital Delays in Treatment with iv Thrombolysis. PLoS One. 2013;8(9):e75378.
8. Mohan S, Agarwal M, Pukenas B. Computed Tomography Angiography of the Neurovascular Circulation. Radiol Clin North Am. 2016;54(1):147-162.
9. McVerry F, Liebeskind DS, Muir KW. Systematic Review of Methods for Assessing Leptomeningeal Collateral Flow. AJNR Am J Neuroradiol. 2012;33(3):576-582.
10. Hochberg AR, Young GS. Cerebral Perfusion Imaging. Semin Neurol. 2012;32(4):454-465.
11. Xu S, Wang L, Zhao L. Clinical Application Value of Brain CT Perfusion Imaging in the Treatment of Acute Ischemic Stroke Thrombolytic Therapy. Exp Ther Med. 2019;17(5):3971-3976.
12. Campbell BC, Christensen S, Levi CR et al. Comparison of Computed Tomography Perfusion and Magnetic Resonance Imaging Perfusion-Diffusion Mismatch in Ischemic Stroke. Stroke. 2012;43(10):2648-2653.
13. Burton KR, Dhanoa D, Aviv RI et al. Perfusion CT for Selecting Patients with Acute Ischemic Stroke for Intravenous Thrombolytic Therapy. Radiology. 2015;274(1):103-114.
14. Michel P, Ntaios G, Reichhart M et al. Perfusion-CT Guided Intravenous Thrombolysis in Patients with Unknown-Onset Stroke: A Randomized, Double-Blind, Placebo-Controlled, Pilot Feasibility Trial. Neuroradiology. 2012;54(6):579-588.
15. Федоров М. А., Диомидова В. Н., Мигушкина Л. П. Роль магнитно-резонансной томографии в повышении качества оказания медицинской помощи больным с ишемическим инсультом. Практическая медицина. 2015;6(91):115—118.
16. Meuree C, Maurel P, Ferre JC et al. Patch-Based Super-Resolution of Arterial Spin Labeling Magnetic Resonance Images. Neuroimage. 2019;189:85-94.
17. Hendrikse J, Petersen ET, Golay X. Vascular Disorders: Insights from Arterial Spin Labeling. Neuroimaging Clin N Am. 2012;22(2):259-269,x-xi.
18. Zaharchuk G. Arterial Spin Labeling for Acute Stroke: Practical Considerations. Transl Stroke Res. 2012;3(2):228-235.
19. Griebe M, Fischer E, Kablau M et al. Thrombolysis in Patients with Lacunar Stroke is Safe: An Observational Study. J Neurol. 2014;261(2):405-411.
20. Wintermark M, Sanelli PC, Albers GW et al. Imaging Recommendations for Acute Stroke and Transient Ischemic Attack Patients: A Joint Statement by the American Society of Neuroradiology, the American College of Radiology and the Society of NeuroInterventional Surgery. J Am Coll Radiol. 2013;10(11):828-832.
21. Фокин В. А., Янишевский С. Н., Труфа-нов А. Г МРТ в диагностике ишемического инсульта. СПб.: ЭЛБИ-СПб. 2012. с. 96.
22. Moreau F, Asdaghi N, Modi J et al. Magnetic Resonance Imaging Versus Computed Tomography in Transient Ischemic Attack and Minor Stroke: The More You See the More You Know. Cerebrovasc Dis Extra. 2013;3(1):130-136.
23. Kidwell CS, Wintermark M, De Silva DA et al. Multiparametric MRI and CT Models of Infarct Core and Favorable Penumbral Imaging Patterns in Acute Ischemic Stroke. Stroke. 2013;44(1):73-79.
24. Forster A, Griebe M, Wolf ME et al. How to Identify Stroke Mimics in Patients Eligible for Intravenous Thrombolysis? J Neurol. 2012;259(7):1347-1353.
25. Madai VI, Wood CN, Galinovic I et al. Clinical-Radiological Parameters Improve the Prediction of the Thrombolysis Time Window by Both MRI Signal Intensities and DWI-FLAIR Mismatch. Cerebrovasc Dis. 2016;42(1-2):57-65.
26. Tong E, Hou Q, Fiebach JB et al. The Role of Imaging in Acute Ischemic Stroke. Neurosurg Focus. 2014;36(1):E3.
27. Kawano H, Hirano T, Nakajima M et al. Diffusion-Weighted Magnetic Resonance Imaging May Underestimate Acute Ischemic Lesions: Cautions on Neglecting a Computed Tomography-Diffusion-Weighted Imaging Discrepancy. Stroke. 2013;44(4):1056-1061.
28. Hirano T Searching for Salvageable Brain: The Detection of Ischemic Penumbra Using Various Imaging Modalities? J Stroke Cerebrovasc Dis. 2014;23(5):795-798.
29. Stinear CM, Ward NS. How Useful is Imaging in Predicting Outcomes in Stroke Rehabilitation? Int J Stroke. 2013;8(1):33-37.
30. Campbell BC, Purushotham A, Christensen S et al. The Infarct Core is Well Represented by the Acute Diffusion Lesion: Sustained Reversal is Infrequent. J Cereb Blood Flow Metab. 2012;32(1):50-56.
31. Максимова М. Ю., Домашенко М. А., Кротенкова М. В. и др. Нейровизуализация в оценке показаний для тромболизиса. Труды Национального конгресса «Неотложные состояния в неврологии». 2009:114-115.
32. Kushwaha S, Malik S, Sarraf G et al. Thrombolysis in Recurrent Stroke-Beyond Guidelines: A Case Report. J Stroke Cerebrovasc Dis. 2014;23(8):e407-e408.
33. Davis S, Donnan GA. Time is Penumbra: Imaging, Selection and Outcome. The Johann Jacob Wepfer Award 2014. Cerebrovasc Dis. 2014;38(1):59-72.
34. Deprez N, De Herdt V, Vandersteene J et al. Delayed Intravenous Thrombolysis Based on MRI Mismatch in Posterior Circulation Stroke. Acta Neurol Belg. 2014;114(2):113-115.
35. Tisserand M, Naggara O, Legrand L et al. Patient “Candidate” for Thrombolysis: MRI is Essential. Diagn Interv Imaging. 2014;95(12):1135-1144.
36. Albers GW, Thijs Vn, Wechsler L et al. Magnetic Resonance Imaging Profiles Predict Clinical Response to Early Reperfusion: The Diffusion and Perfusion Imaging Evaluation for Understanding Stroke Evolution (DEFUSE) Study. Ann Neurol. 2006;60(5):508-517.
37. Davis SM, Donnan GA, Parsons MW et al. Effects of Alteplase Beyond 3 h After Stroke in the Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET): A Placebo-Controlled Randomised Trial. Lancet Neurol. 2008;7(4):299-309.
38. Dani KA, Thomas RG, Chappell FM et al. Computed Tomography and Magnetic Resonance Perfusion Imaging in Ischemic Stroke: Definitions and Thresholds. Ann Neurol. 2011;70(3):384-401.
39. Bivard A, Krishnamurthy V, Stanwell P et al. Arterial Spin Labeling Versus Bolus-Tracking Perfusion in Hyperacute Stroke. Stroke. 2014;45(1):127-133.
40. Mlynash M, Lansberg mG, De Silva DA et al. Refining the Definition of the Malignant Profile: Insights from the DEFUSE-EPITHET Pooled Data Set. Stroke. 2011;42(5):1270-1275.
41. Lansberg MG, Straka M, Kemp S et al. MRI Profile and Response to Endovascular Reperfusion After Stroke (DEFUSE 2): A Prospective Cohort Study. Lancet Neurol. 2012;11(10):860-867.
42. Albers GW, Marks MP, Kemp S et al. Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med. 2018;378(8):708-718.
43. Ginsberg MD. The Cerebral Collateral Circulation: Relevance to Pathophysiology and Treatment of Stroke. Neuropharmacology. 2018;134(Pt B):280-292.
COVID-ассоциированный ишемический инсульт
Пандемия коронавирусной инфекции 2019-2020 продемонстрировала не только высокую агрессивность нового инфекционного агента, но и его способность вызывать тяжелые сердечно-сосудистые осложнения. Ишемический инсульт (ИИ) в последние десятилетия является одной из ведущих причин смерти в старших возрастных группах [1]. Обобщение первых результатов лечения пострадавших от коронавирусной инфекции показало, что развитие ИИ у таких больных весьма вероятно. Высокая летальность больных пожилого возраста, зараженных COVID-19, отчасти связана с развитием фатальных сердечно-сосудистых осложнений, наиболее тяжелым из которых является инсульт.
Анализ немногочисленных доступных публикаций в которых упоминается проблема COVID-ассоциированного ишемического инсульта может показать не только значимость проблемы, но и раскрыть механизмы острой церебральной ишемии. Предупреждение острых нарушений мозгового кровообращения (ОНМК) у инфицированных COVID-19 представляется одной из важных клинических задач, которые необходимо решать в условиях высокой загруженности специализированных стационаров и дефицита специалистов.
Новый патогенетический подтип ишемического инсульта?
По данным первых публикаций, в которых были проанализированы неврологические осложнения коронавирусной инфекции острые нарушения мозгового кровообращения (ОНМК) обнаруживались у 6% больных [2]. Первые обобщения клинических наблюдений показывают, что в структуре патогенетических подтипов ишемического инсульта (ИИ) преобладают синдромы тромботической окклюзии крупных артерий [3]. Кроме того, высокая частота нарушений сознания (более 15% по данным Mao L. 2020) может свидетельствовать о возможности диффузных повреждений мозга по типу острой (токсической, гипоксемической, ишемической) энцефалопатии.
Для уточнения патогенеза острой церебральной ишемии в настоящее время принято выделять патогенетические подтипы ИИ в соответствии с этиологической классификацией TOAST. Согласно этой классификации, около 80% всех ИИ распределяются между основными подтипами – атеротромботический (атеросклеротическая болезнь крупных артерий), кардиоэмболический (основная причина – фибрилляция предсердий), лакунарный (микроангиопатия – болезнь мелких артерий). Формально, ОНМК на фоне коронавирусной инфекции можно отнести в категорию «другие установленные причины». Однако существуют несколько важных аргументов «против» такого формального распределения. Эти аргументы требуют более детального анализа причин и механизмов COVID-ассоциированного ишемического инсульта. Первый аргумент исходит из предположения, что эта форма ОНМК не ассоциирована с атеросклерозом, а следовательно, имеет оригинальный патогенез и совершенно другую этиологию. Второй аргумент основывается на фактах, свидетельствующих об участии активного воспалительного процесса в патогенезе COVID-ассоциированного ишемического инсульта. Наконец, третий аргумент исходит из сложившейся практики лечения таких больных. В отличии от стандартных методов лечения, основанных на применении антитромбоцитарной и гиполипидемической терапии с целью предупреждения атеротромбоза, у больных с коронавирусной инфекцией лучшие результаты демонстрируют антикоагулянты (не соответствует действующим клиническим рекомендациям) [4].
Анализ клинических данных показывает, что больные переносят инсульт в острый период коронавирусной инфекции на фоне гипертермии и часто пневмонии. Для инсульта характерно крупноочаговое повреждение в каротидном сосудистом бассейне, больше похожее на синдром тромботической окклюзии крупной артерии. Существенным отличием COVID-зависимого от атеротромботического ИИ является отсутствие связи тромба с атеросклеротической бляшкой и наличие признаков воспаления сосудистой стенки. D.McNamara (2020) обращает внимание воспаление и отёк артерий сосудистого бассейна в котором развивается инфаркт мозга, что можно расценивать как острый васкулит. Воспаление и отёк сосудистой стенки прямо или косвенно связанный с воздействием вируса или аутоиммунной реакцией представляется возможным, но не облигатным признаком развития и генерализации инфекционного процесса. Более того, неврологический синдром, ассоциированный с воспалением крупных артерий – это скорее редкость, чем закономерность. Анализ первых данных, содержащих сопоставление клинической картины ОНМК и результатов лабораторных тестов может в некоторой степени объяснить факт и частоту развития синдрома поражения крупных артерий. L. Mao c соавт. (2020) представляют анализ лабораторных данных 124 больных, находившихся на стационарном лечении с коронавирусной инфекцией. Средний возраст больных — 54 года, тяжелое течение заболевания отмечалось у 59%. Цереброваскулярные синдромы выявлены у 6% больных, все в группе тяжелого течения. Авторы сравнили результаты лабораторных тестов в группе тяжелого и легкого течения коронавирусной инфекции. Достоверные различия отмечены в отношении содержания лимфоцитов (0,9 (01,-2,6) и 1,3 (0,4-2,6) соответственно), С-реактивного белка (мг/л) – 37,1 (0,1-212,1) и 9,4 (0,4-112) соответственно, D-димер (мг/л) – 0,9 (0,1-20,0) и 0,4 (0,2-8,7) соответственно. Даже поверхностный взгляд на результаты лабораторных тестов показывает, что активные воспалительные и тромбогенные реакции развиваются только у тяжелых больных. Однако и в группе тяжелых отмечается очень высокая дисперсность лабораторных показателей – от нормы до выраженных превышений обычных значений. Это, вероятно, значит, что гипервоспаление и гиперкоагуляция отмечается не у всех, а только у некоторых больных с иммунным ответом, который определяется индивидуальными особенностями больного. Такая гиперреактивность может быть обусловлена генетическими особенностями больного или состоянием иммунитета. Вероятно, определение предикторов и биомаркеров агрессивного течения болезни является важной научной и практической задачей, решение которой позволит избежать таких тяжелых осложнений как инсульт. Однако возможность такой гиперреактивности наводит на мысль о применении активной иммуносупрессии при появлении признаков васкулита.
Итак, следует ли считать, что существует особый патогенетический подтип ишемического инсульта – COVID-зависимый инсульт? Да. COVID-зависимый ИИ – это острое нарушение мозгового кровообращения, обусловленное острой воспалительной васкулопатией и тромбозом крупных артерий головного мозга. Признание нового подтипа ИИ не исключает развития у больных с коронавирусной инфекцией и других вариантов ОНМК, если речь идет о пациентах, демонстрирующих соответствующие ассоциированные с атеросклерозом заболевания и синдромы (артериальная гипертония, фибрилляция предсердий, атеросклероз). Сам факт заболевания COVID-19, госпитализация с неясными перспективами представляют из себя фактор дестабилизации заболевания сердечно-сосудистой системы, протекавшего ранее относительно стабильно. Гиперкоагуляционный статус больных с коронавирусной инфекцией – это другой важный фактор изменения стабильного течения заболеваний, ассоциированных с атеросклерозом.
Коагулопатия – как причина сосудистых событий и цель лечения
Показательна эволюция представлений врачей о наиболее значимых звеньях патогенеза коронавирусной инфекции. В первых публикациях китайских специалистов основное внимание уделялось респираторному дистресс-синдрому, гипертермии и интоксикации. С распространением эпидемии на страны Европы и американский континент, накоплением клинических наблюдений и лабораторных данных, специалисты больше внимание стали уделять системным нарушениям гемостаза у больных в остром и подостром периоде заболевания. Наряду с общеинфекционным синдромом, внутрисосудистое тромбообразование во многих случаях достигающее степени диссеминированного внутрисосудистого свертывания крови является ключевым фактором, определяющим исход заболевания. Коагулопатия, развивающаяся при коронавирусной инфекции имеет сложный патогенез, который выходит за пределы триады Вирхова и приводит к образованию венозных и артериальных тромбозов. Действие мощных прокоагулянтых факторов таких как повреждение эндотелия сосудов, системное воспаление с формированием нейтрофильных внеклеточных ловушек и выбросом гистонов, ферментов и пептидов приводит к формированию множественных внутрисосудистых тромбов [5-8]. Наряду с обтурирующими тромбами вен и крупных артерий, микротромбы блокируют микроциркуляцию, создавая условия для ишемии органов и тканей. Создаются условия для тромбоэмболизма как в венозной, так и в артериальной системе, включая механизм парадоксальной эмболии для реализации которого без коагулопатии не было необходимых условий. Особенностью коагулопатии при коронавирусной инфекции является высокая скорость развития патологических процессов, которые протекают с быстрым истощением системы физиологических антикоагулянтов, в том числе протеинов С и S, снижением фибринолитического потенциала крови. Скрининговая коагулограмма демонстрирует увеличение концентрации фибриногена, снижение антитромбона III, протеинов S и C, время свертывания крови укорачивается. Установлено, что уровень D-димера коррелирует с тяжестью заболевания и его увеличение часто свидетельствует о развитии коагулопатии. На сегодняшний день уровень D-димера считается наиболее надёжным биомаркером гиперкоагуляции у больных с коронавирусной инфекцией.
Понимание одного из ключевых механизмов системных повреждений органов и тканей при коронавирусной инфекции привело к изменению лечебной стратегии [6,7]. Тромбопрофилактика является одним из главных направлений терапии больных, которые находятся в отделении интенсивной терапии. Особенности коагулопатии при коронавирусной инфекции привели к признанию низкомолекулярных гепаринов в качестве основного антитромботического средства, которое используется на протяжении всего острого периода заболевания. В качестве поддерживающего лечения, которое может проводится до 40 дней, а при необходимости и дольше, рассматриваются такие антикоагулянты как ривароксабан (10 мг в сутки). Вопрос о применении глюкокортикоидов для подавления острого воспаления остается открытым до накопления и обобщения результатов клинической практики и специальных исследований.
Выводы
Особенности коагулопатии при коронавирусной инфекции создают условия для ОНМК в основе которых лежит тромботическая окклюзия крупной артерии, не связанная с атеротромбозом – COVID-зависимый ИИ. Опасное инфекционное заболевание способствует развитию и других вариантов ИИ: атеротромботического, кардиоэмболического и парадоксальной эмболии. Однако в целом, вероятность ишемического инсульта при острой коронавирусной инфекции не очень велика (примерно 6%). Профилактика COVID-зависимого ИИ основывается на применении антикоагулянтов, целесообразность назначения которых определяется тяжестью заболевания и биомаркерами тромбообразования, наиболее надёжным из которых является D-димер.
Д.м.н., профессор Евгений Алексеевич Широков
Библиография
1. Mozaffarian D., Benjamin E., Go A.et al. Heart Disease and Stroke Statistics—2016 Update. Circulation. 2016; 133(4):e38-e360.
2. Mao L., Jin H., Wang M. et.al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China/
JAMANeurol.doi:10.1001/jamaneurol.2020.1127 PublishedonlineApril10,2020.
4. Powers W., Rabinstein A., Ackerson T. et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2018;49:eXXX– eXXX. doi: 10.1161/STR.0000000000000158.
5. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18: 844–47.
8. Fuchs N.A., Brill A.,, Wagner D.D. Neutrophil Extracellular Trap (NET) Impact on Deep Vein Thrombosis. Arterioscler. Thromb. Vasc. Biol. 2012;32(: 1777–1783.
COVID-19 – независимый фактор риска острого ишемического инсульта: результаты ретроспективного анализа
Согласно исследованию случай-контроль, опубликованному в Американском журнале нейрорадиологии, COVID-19 независимо связан с острым ишемическим инсультом.
Исследователи ретроспективно проанализировали данные пациентов, которым в период с 16 марта по 5 апреля 2020 года в 6 больницах г. Нью-Йорк, США, была проведена визуализирующая диагностика (КТ и/или МРТ головного мозга) предполагаемого инсульта из-за гемиплегии, очаговой полушарной симптоматики, дизартрии, опущения мышц лица, афазии или острого психического расстройства. Пациенты с острым ишемическим инсультом (окклюзия мелких или крупных сосудов) были сопоставлены с пациентами без инсульта по возрасту, полу и основным сосудистым факторам риска (АГ, ИБС, СД 2 типа, ФП, ХСН, дислипидемия, курение, признаки перенесенного инсульта, ИМТ 25-29,9 кг/м2 или ожирение) в соотношении 1:2 случай к контролю, что привело к 41 пациенту в группе случая и 82 пациентам в группе контроля.
Средний возраст пациентов группы случая и контрольной группы составил 65,5 ± 15,3 года и 68,8 ± 13,2 года соответственно. Половой состав между группами был одинаковым и составил 56,1% мужчин в каждой. Статистически значимых различий по возрасту, полу или сосудистым факторам риска между группами пациентов не наблюдалось. Из числа пациентов с подтвержденным острым ишемическим инсультом 19 из 41 (46,3%) имели COVID-19 по сравнению с 15 из 82 (18,3%) в группе контроле. Частота COVID-19 была достоверно выше у пациентов с острым ишемическим инсультом по сравнению с контрольной группой (р=0,001).
После корректировки по возрасту, полу и сосудистым факторам риска, было обнаружено, что наличие COVID-19 имело достоверную независимую связь с острым ишемическим инсультом по сравнению с группой контроля (ОШ = 3,9; 95% ДИ 1,7-8,9; р=0,001).
Таким образом, было показано, что наличие COVID-19 значимо связано с острым ишемическим инсультом, подтвержденным визуализирующими методами, в связи с чем пациенты с COVID-19 должны подвергаться более тщательному мониторингу его развития.
Источник: P. Belani, J. Schefflein, S. Kihira, et al. COVID-19 Is an Independent Risk Factor for Acute Ischemic Stroke. American Journal of Neuroradiology. Jun 2020, DOI: 10.3174/ajnr.A6650
Подготовила: Грацианская С.Е.
ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ МЕЛЬДОНИЯ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | Котов
1. Стаховская ЛВ, Котов СВ, ред. Инсульт: руководство для врачей. М.: МИА; 2014. 400 с. Stakhovskaya LV, Kotov SV, editors. Insul’t: rukovodstvo dlya vrachey [Stroke: Manual for doctors]. Moscow: MIA; 2014. 400 p. (in Russian).
2. Elkins JS, Johnston SC. Thirty-year projections for deaths from ischemic stroke in the United States. Stroke. 2003;34(9):2109–12.
3. Kruyt ND, Nederkoorn PJ, Dennis M, Leys D, Ringleb PA, Rudd AG, Vermeulen M, Stam J, Hacke W, Roos YB. Door-to-needle time and the proportion of patients receiving intravenous thrombolysis in acute ischemic stroke: uniform interpretation and reporting. Stroke. 2013;44(11):3249–53.
4. Хасанова ДР, Гильманов АА, Прокофьева ЮВ, Гаврилов ИА. Результаты внедрения многоуровневой системы оказания медицинской помощи больным с инсультом в Республике Татарстан. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(7, 2):86–9. Khasanova DR, Gil’manov AA, Prokof’eva YuV, Gavrilov IA. Rezul’taty vnedreniya mnogourovnevoy sistemy okazaniya meditsinskoy pomoshchi bol’nym s insul’tom v Respublike Tatarstan [Results of introduction multilevel system of medical care to the patient with a stroke in the Tatarstan Republic]. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. 2013;113(7, 2):86–9 (in Russian).
5. Dirnagl U. Bench to bedside: the quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 2006;26(12):1465–78.
6. Kleinschnitz C, Grund H, Wingler K, Armitage ME, Jones E, Mittal M, Barit D, Schwarz T, Geis C, Kraft P, Barthel K, Schuhmann MK, Herrmann AM, Meuth SG, Stoll G, Meurer S, Schrewe A, Becker L, Gailus-Durner V, Fuchs H, Klopstock T, de Angelis MH, Jandeleit-Dahm K, Shah AM, Weissmann N, Schmidt HH. Poststroke inhibition of induced NADPH oxidase type 4 prevents oxidative stress and neurodegeneration. PLoS Biol. 2010;8(9).pii: e1000479.
7. Dambrova M, Liepinsh E, Kalvinsh I. Mildronate: cardioprotective action through carnitinelowering effect. Trends Cardiovasc Med. 2002;12(6):275–9.
8. Jaudzems K, Kuka J, Gutsaits A, Zinovjevs K, Kalvinsh I, Liepinsh E, Liepinsh E, Dambrova M. Inhibition of carnitine acetyltransferase by mildronate, a regulator of energy metabolism. J Enzyme Inhib Med Chem. 2009;24(6):1269–75.
9. Стаценко МЕ, Беленкова СВ, Спорова ОЕ, Шилина НН. Применение милдроната в комбинированной терапии хронической сердечной недостаточности в постинфарктном периоде у больных сахарным диабетом 2-го типа. Клиническая медицина. 2007;85(7):39–42. Statsenko ME, Belenkova SV, Sporova OE, Shilina NN. Primenenie mildronata v kombinirovannoy terapii khronicheskoy serdechnoy nedostatochnosti v postinfarktnom periode u bol’nykh sakharnym diabetom 2-go tipa [The use of mildronate in combined therapy of postinfarction chronic heart failure in patients with type 2 diabetes mellitus]. Klinicheskaya meditsina. 2007;85(7):39–42 (in Russian).
10. Суслина З, Максимова М, Федорова Т. Хронические цереброваскулярные заболевания: клиническая и антиоксидантная эффективность Милдроната. Врач. 2007;(4):40–5. Suslina Z, Maksimova M, Fedorova T. Khronicheskie tserebrovaskulyarnye zabolevaniya: klinicheskaya i antioksidantnaya effektivnost’ Mildronata [Chronic cerebrovascular disorders: clinical and antioxidant efficacy of Mildronate]. Vrach. 2007;(4):40–5 (in Russian). 11. Максимова МЮ, Федорова ТН, Шарыпова ТН. Применение Милдроната в лечении больных с нарушениями мозгового кровообращения. Фарматека. 2013;(9):84–94. Maksimova MYu, Fedorova TN, Sharypova TN. Primenenie Mildronata v lechenii bol’nykh s narusheniyami mozgovogo krovoobrashcheniya [The use of Mildronate in patients with cerebrovascular disease]. Pharmateca. 2013;(9):84–94 (in Russian).
11. Волченкова ТВ, Колчу ИГ, Исакова ЕВ, Котов СВ. Углеводный обмен у больных с церебральным инсультом. Бюллетень сибирской медицины. 2010;(4):35–7. Volchenkova TV, Kolchu IG, Isakova EV, Kotov SV. Uglevodnyy obmen u bol’nykh s tserebral’nym insul’tom [Carbohydrate metabolism in cerebral stroke patients]. Bulletin of Siberian Medicine. 2010;(4):35–7 (in Russian).
12. Суслина ЗА, Максимова МЮ, Кистенев БА, Федорова ТН, Ким ЕК. Антиоксидантная терапия у больных дисциркуляторной энцефалопатией, отягощенной сахарным диабетом типа 2. Фарматека. 2005;(12):68–71. Suslina ZA, Maksimova MYu, Kistenev BA, Fedorova TN, Kim EK. Antioksidantnaya terapiya u bol’nykh distsirkulyatornoy entsefalopatiey, otyagoshchennoy sakharnym diabetom tipa 2 [Antioxidant therapy in patients with discirculatory encephalopathy complicated by type 2 diabetes mellitus]. Pharmateca. 2005;(12): 68–71 (in Russian).
13. Лобанова МВ, Полетаева ЛВ, Романюк СС. Влияние Милдроната на уровень глюкозы крови и гликированного гемоглобина у больных сахарным диабетом типа 2. Вестник РГМУ. 2008;2(61):37. Lobanova MV, Poletaeva LV, Romanyuk SS. Vliyanie Mildronata na uroven’ glyukozy krovi i glikirovannogo gemoglobina u bol’nykh sakharnym diabetom tipa 2 [The effect of Mildronate on blood glucose and glycated haemoglobin levels in type 2 diabetic patients]. Vestnik RGMU. 2008;2(61):37 (in Russian).
границ | Острый ишемический инсульт при COVID-19: систематический обзор случая
Ключевые выводы
• Острый ишемический инсульт является важным, но недостаточно признанным осложнением инфекции SARS-CoV2, из-за которого большинство выздоровевших пациентов остаются со значительной инвалидностью на нынешней стадии пандемии в июле 2020 года.
• Маркеры гиперкоагуляции, такие как D-димер, значительно повышены у всех пациентов на ранних стадиях прогрессирования заболевания.
• Соотношение нейтрофилов и лимфоцитов, С-реактивный белок и сывороточный ферритин являются прогностическими маркерами.
• Пациенты с более высоким соотношением нейтрофилов и лимфоцитов при поступлении демонстрируют более короткий интервал между инфекционными симптомами COVID-19 и клиническими проявлениями острого ишемического инсульта.
• Окклюзия крупных сосудов является основным этиологическим подтипом, и лишь небольшая часть пациентов получает стандартное лечение.
• Семьдесят пять процентов пациентов с COVID-19 и острым ишемическим инсультом умерли или остались инвалидами.
• Пандемия COVID-19 создала уникальную возможность для развития всей области нейрореабилитации на основе более качественного биологического и научного обоснования точных протоколов нейрореабилитации.
Введение
В декабре 2019 года в Ухане, Китай, впервые был обнаружен новый вирус короны, связанный с серией острых атипичных респираторных заболеваний. С тех пор вирус, теперь известный как SARS-CoV2 (тяжелый острый респираторный синдром, коронавирус 2), распространился в более чем 200 стран и теперь признан основной пандемией в мире (1). По состоянию на 30 мая 2020 года сообщалось о смертности от COVID-19 с количеством подтвержденных смертей с зарегистрированными случаями во всем мире. С тех пор как патогенез SARS-CoV2 только начал выясняться, были выявлены многочисленные другие клинические системные проявления.
Неврологические проявления инфекции SARS-CoV 2 были впервые зарегистрированы у ряда пациентов в Ухане, Китай, Zhou et al. (2). Острый ишемический инсульт (ОИС) диагностирован в 5% случаев (2). Однако гораздо более низкий показатель — всего 0,9% изображений подтвердил AIS, то есть 32 из 3556 общего числа случаев заболевания COVID-19 было зарегистрировано в Нью-Йорке, США (3). Последующие ретроспективные отчеты из Европы также подтвердили, что AIS является частым нервно-сосудистым осложнением SARS-CoV2 (4, 5). Интересно, что Oxley et al.отметили повышенную частоту молодых пациентов, инфицированных вирусом SARS CoV2, без значительных традиционных факторов риска для AIS, с окклюзией крупных сосудов (6). Предполагаемые механизмы, предположительно индуцирующие AIS в сочетании с SARS CoV2, включают системное воспаление, воспалительный цитокиновый шторм, гиперкоагуляцию и дисбаланс в классической и альтернативной ренин-ангиотензиновой системе (RAS) в отношении связывания гликопротеина SARS-CoV-2 с ACE2. родственные молекулярные механизмы (3, 7–19).Система RAS включает в себя плазменный RAS, регулирующий сердечно-сосудистую систему, и тканевый RAS, регулирующий долгосрочные изменения через сложную гормональную систему, эндокринную, паракринную и аутокринную. Таким образом, RAS контролирует почечную, надпочечниковую и сердечно-сосудистую системы с важными последствиями для контроля артериального давления, а также контроля жидкости / электролитов, которые критически важны для поддержания жизни, очень подверженной повреждению SARS-CoV 2. Воспалительный путь лежит в основе различные клинические проявления инфекции SARS-CoV2.Также называемый «цитокиновый шторм», он вызывает всплеск различных воспалительных цитокинов, таких как IL-2, IL-7, IL-10 (20, 21), вызывает состояние лимфоцитопении (22-24), а также активирует всплеск острофазовых реагентов, таких как CRP и ферритин (25, 26).
Были предложены различные параметры для прогнозирования прогноза и исходов у пациентов с COVID, включая соотношение нейтрофилов к лимфоцитам (NLR) (27–30). Метанализ шести исследований с участием 1141 пациента показал, что повышенный NLR связан с тяжелыми проявлениями заболевания (28).Тот же метаанализ также показал, что наряду с СОЭ и ИЛ-6, СРБ коррелировал с увеличением тяжести у пациентов с инфекцией SARS-CoV2 (28). Роль ферритина как предиктора смертности среди подтвержденных SARS-CoV2 также была подтверждена в другом метанализе 10 исследований с участием более 1400 субъектов (31). Кроме того, было показано, что повышенный уровень D-димера и гиперфибриногенемия, которые являются биомаркерами воспаления и состояния гиперкоагуляции, предсказывают тяжесть указанной инфекции (31, 32).Интересно, что подобные биомаркеры позволяют прогнозировать исходы инсульта (33–39). В частности, известно, что пациенты с повышенным уровнем NLR, ферритина, СРБ, D-димера и фибриногена имеют более высокий риск инсульта и имеют потенциально худшие клинические исходы (33–39).
На сегодняшний день, несмотря на теоретическую ассоциацию воспалительных и прокоагуляционных состояний, связывающих инсульт и инфекцию SARS-CoV2, имеется ограниченное количество опубликованной литературы о фактической совместимости обоих. Также имеется ограниченная информация о биологических маркерах, которые могут быть связаны с плохими неврологическими исходами.Таким образом, это исследование направлено на описание клинических характеристик пациентов с острым ишемическим инсультом и сопутствующей инфекцией SARS-CoV2. Путем дальнейшего анализа доступных лабораторных данных будет изучена динамика воспалительных биомаркеров, таких как NLR, CRP, сывороточный ферритин, фибриноген и D-димер, а также результаты выписки из больницы.
В настоящее время имеется ограниченная информация о клинических характеристиках и конкретных проблемах нейрореабилитации у пациентов с АИС с инфекцией SARS-CoV 2 (40–43).Однако ожидается, что рост числа пациентов, текущие проблемы с нехваткой средств индивидуальной защиты (СИЗ) и связанное с этим беспокойство медицинских работников по поводу возможности заражения COVID-19 (и фактического заражения медицинских работников) рабочих и обязательная самоизоляция в течение 14 дней, даже если у этих участников минимальные симптомы или их нет), создаст серьезную проблему для традиционных практик и способов нейрореабилитации, по крайней мере, во время пандемии, возможно, в течение длительного времени.Таким образом, эти обстоятельства являются вескими доводами в пользу превращения катастрофы [Сложная перестройка больничных помещений в рамках подготовки к пандемии также вызвала значительные проблемы и добавила ресурсные проблемы для систем здравоохранения во всем мире (44–50) в возможность. по обновлению реабилитационных протоколов. В настоящее время появляются данные о дальнейшем расширении парадигм телемедицины с включением технологии удаленного мониторинга на основе планшетов (поля зрения Melbourne Rapid Field, носимые устройства и искусственный интеллект), что указывает на дальнейший путь нейрореабилитации AIS в эпоху пандемии COVID19, по крайней мере, для обозримое будущее (43, 51–53).
Таким образом, этот систематический обзор направлен на выявление и сопоставление клинических и лабораторных характеристик, острого и длительного лечения, а также результатов всех опубликованных отчетов о пациентах с сопутствующим диагнозом подтвержденной инфекции SARS-CoV 2 и острого ишемического инсульта с особым акцентом на по клинико-лабораторным особенностям.
Назначение
Настоящее исследование было проведено с целью предоставить систематический обзор AIS и COVID-19 в отношении определения, распространенности, патофизиологии, клинических характеристик, острых, подострых особенностей и исходов по прогностическим маркерам.
Участников
Информация о пациентах с ишемическим инсультом с подтвержденной инфекцией SARS-CoV2 и радиологически или клинически подтвержденным AIS, включенная в опубликованные исследования с ноября 2019 года по 30 мая 2020 года с использованием стратегии поиска, описанной ниже, будет рассмотрена здесь.
Виды занятий
Были включены все типы исследований, включая качественные, систематические обзоры, метаанализы, отчеты о случаях и серии случаев.
Методы поиска
Опубликованные статьи на английском языке и о людях, опубликованные с ноября 2019 г. по 30 мая 2020 г., были критериями включения в поиск.Была принята следующая стратегия поиска:
1. На первом этапе был проведен поиск в базах данных MEDLINE, Cochrane и CINAHL с последующим поиском по заголовку и аннотации.
2. На втором этапе ключевые слова использовались при поиске в базах данных Ovid MEDLINE, Cochrane, PubMed, CINAHL и EMBASE.
3. На третьем этапе был проведен ручной поиск, чтобы убедиться, что ни одно исследование не было случайно пропущено.
Ключевые слова, использованные для поиска: инсульт, тромбоз, коронавирус, неврологические осложнения, нейрореабилитация, COVID19, SARS-COV2.
Извлечение данных
В данном обзоре использовалась методологическая основа Аркси и О’Мэлли (54).
Библиографии отдельных исследований были дополнительно изучены вручную. Статьи просматривали два независимых исследователя.
4. На четвертом этапе вторичный анализ проводился следующим образом.
Были извлечены клинические и лабораторные данные каждого пациента. Также были исследованы демографические данные и детали их соответствующих лабораторных данных.В частности, исследователей интересовали следующие стандартные лабораторные показатели: NLR, CRP, ферритин, фибриноген и D-димер. Отдельные исходы для пациентов также учитывались и классифицировались как хорошие [с модифицированными оценками Рэнкина (mRS) 0, 1, 2 и 3 и плохими mRS 4, 5, 6]. Пациенты без доступных лабораторных данных и исходов были исключены из количественного анализа.
Результаты поиска
Обширный поиск по базе данных дал 595 ссылок, и четыре исследования были добавлены с помощью ручного поиска.Всего было исключено 257 дубликатов, что дало 342 ссылки. Эти заголовки и отрывки были дополнительно проверены, в результате чего в ходе второго процесса проверки было получено 90 окончательных публикаций, имеющих отношение к рассмотрению инсульта и инфекции SARS-COV2. Одна публикация не существовала, несмотря на то, что на нее ссылались несколько авторов в своих публикациях. Дальнейшая оценка полных текстов 89 исследований двумя независимыми неврологами (TW и CS) исключила 74 цитирования из 15 исследований. Три дополнительных исследования были добавлены TW и CS в результате ручного поиска с 18 публикациями, которые были включены в этот систематический обзор всеми авторами.
Год и страна обучения
Исследования, опубликованные с 2019 по 2020 годы, включенная литература была получена из Северной Америки, Европы и Азии.
Исследуемая популяция
В это исследование были включены все пациенты с инфекцией SARS-COV2 и сопутствующим диагнозом острого ишемического инсульта и / или острых / подострых исходов, если таковые имеются.
Электронный поиск, проведенный с 10 по 30 мая 2020 года с использованием идентифицированных ключевых слов, дал 342 ссылки после удаления дубликатов.Это было дополнительно оценено на уровне заголовка и аннотации, в результате чего было написано 90 статей. После полной оценки полного текста каждого из них, 18 были сочтены имеющими отношение к исследованию, в дополнение к трем статьям, которые были добавлены в результате ручного исследования. На рисунке 1 показан процесс поиска.
Рисунок 1 . Блок-схема ПРИЗМЫ.
В исследование было включено 18 статей с участием 87 пациентов из США, Италии, Турции, Франции, Филиппин и Великобритании.Большинство исследований были описаниями случаев и сериями случаев, тогда как три из включенных исследований были ретроспективными и проспективными когортами. В таблице 1 приведены характеристики отдельных исследований.
Таблица 1 . Включены характеристики исследований.
Клинические характеристики пациентов представлены в таблице 2.
Таблица 2 . Описана клиническая характеристика больных.
Большинство пациентов относились к возрастной группе 50–70 лет, в то время как почти одна треть пациентов была моложе 50 лет.Наиболее частой сопутствующей патологией была артериальная гипертензия, за которой следовали диабет, дислипидемия и, реже, фибрилляция предсердий. Также описаны средние гематологические параметры. Нейроваскулярная визуализация с помощью магнитно-резонансной ангиографии (MRA) или компьютерной томографической ангиографии (CTA) была доступна для 35 пациентов, у большинства из которых имелась передняя циркуляция крови, окклюзия крупных сосудов. Схемы лечения также были описаны для большинства пациентов, значительному числу которых была проведена системная антикоагулянтная терапия, внутривенный тромболизис и механическая тромбэктомия.Из 87 описанных пациентов доступны 72 исхода, при этом почти 75% приводят к плохим неврологическим исходам по модифицированной шкале Рэнкина (mRS) 4 и выше.
Также были проанализированы маркеры воспаления и свертывания крови у отдельных пациентов. Неврологические исходы были классифицированы как хорошие (mRS 3 и ниже) или плохие (mRS 4 и выше). Соответствующие воспалительные параметры, такие как отношение нейтрофилов к лимфоцитам, С-реактивный белок и сывороточный ферритин, анализировали для каждой группы. То же самое было выполнено для маркеров коагуляции, таких как D-димер и фибриноген.Пациенты с хорошими неврологическими исходами имели более низкие средние значения NLR, CRP и сывороточного ферритина (4,39 ± 1,44, 53,09 ± 92,70 мг / л, 449 ± 482,3 мкг / л соответственно) по сравнению с пациентами с mRS 4 и выше (7,51 ± 5,84, 88,69). ± 70,45 мг / л, 1086 ± 1220 мкг / л соответственно). Аналогичные тенденции наблюдались в отношении маркеров коагуляции: уровни D-димера и фибриногена составляли 2509 ± 4093 мкг / л и 4,70 ± 1,70 г / л, соответственно, для пациентов с mRS 3 и ниже, тогда как значения для пациентов с плохим неврологическим статусом. исходы составили 7 223 ± 6 781 мкг / л для D-димера и 6.086 ± 2,69 г / л для фибриногена соответственно. Сводка указанных значений представлена на рисунках 2A – E.
Рис. 2. (A – C) Средние маркеры воспаления среди пациентов с инсультом и подтвержденными инфекциями SARA-CoV2. (D – E) Средние маркеры коагуляции у пациентов с инсультом и подтвержденной инфекцией SARS-CoV2.
Была установлена взаимосвязь между NLR при поступлении и временным интервалом от появления симптомов SARS-CoV2 до появления симптомов инсульта.Как показано на Рисунке 3, пациенты с более высоким NLR в начале имеют более короткий временной интервал между инфекционными симптомами и возникновением ишемического события.
Рисунок 3 . Связь между NLR и возникновением инсульта от появления симптомов SARS-CoV2.
Обсуждение
На сегодняшний день нет всеобъемлющего обзора, описывающего потенциальную роль воспалительных биомаркеров и биомаркеров коагуляции в определении клинических исходов у пациентов с инфекцией SARS-CoV2 и сопутствующим острым ишемическим инсультом.Представленные данные также дополнят ограниченную в настоящее время информацию о возникновении нейроваскулярных событий у пациентов с инфекцией SARS-CoV2.
На сегодняшний день предложен ряд теоретических моделей для объяснения возникновения нейроваскулярных событий среди пациентов с SARS-CoV2. Большинство из них основаны на идее о том, что вирусная инфекция SARS-CoV2 вызывает воспаление и связанное с этим иммунологическое высвобождение цитокинов из крови и эндотелиальных клеток, а также одновременную активацию тромбоцитов, приводящую к микротромбозу (69).Истощение кардиозащитных и нейропротекторных рецепторов ACE-2 по всему телу и микроглии в головном мозге в результате того, что рецепторы являются предпочтительной клеточной мишенью вирусной инвазии, также было предложено в качестве еще одного нейропатологического механизма независимо от возраста (8). ). Однако состояние гиперкоагуляции инфекции SARS-COV2 как единственной основы этого механизма является спорным, учитывая, что исследования сосудов при криптогенном инсульте не были подробно описаны в большинстве тематических исследований.Кроме того, рост «бремени болезни», особенно у пожилых людей, вероятно, будет еще больше усугубляться ожидаемым возрастным истощением рецепторов АПФ-2, что приведет к преобладанию повреждающего действия на органы-мишени за счет увеличения АПФ-1 / Соотношение ангиотензина II (70–72).
На сегодняшний день большинство участков поражения АИС у пациентов, описанных в литературе, связаны с окклюзией крупных сосудов. Однако остается неясным, связано ли это с механизмом, связанным с тромбозом или эмболией, или с отсутствием изображений головного мозга.К сожалению, на сегодняшний день нет исследований, которые бы полностью сообщали о результатах вскрытия смертей, зарегистрированных среди пациентов, перенесших инсульт, с инфекцией SARS-CoV. В другом, хотя и недавнем исследовании, описывающем результаты аутопсии 12 пациентов с SARS-CoV2 в немецком центре, в большинстве случаев была выявлена массивная венозная тромбоэмболия без сообщений об артериальном тромбозе (73). Механизмы, которые могут способствовать внутричерепному артериальному тромбозу, включают цитокин-индуцированное начало образования тромбина, которое запускает активацию тромбоцитов, что впоследствии приводит к развитию микро- и макротромбов (74–87).Это усугубляется свободным превращением фибриногена в фибрин и вызванным воспалением истощением физиологических антикоагулянтов, таких как антитромбин III, ингибитор пути тканевого фактора и система протеина C (74–88). Что касается лечения, в то время как в 30 случаях было зарегистрировано окклюзии крупных сосудов, было выполнено только 20 механических тромбэктомий. Комплексный центр по инсульту в Барселоне, Испания, сообщил о снижении количества кодов инсульта и механических тромбэктомий на 18 и 23% в начале пандемии, соответственно, хотя без каких-либо изменений в реперфузии и клинических исходах (89) Всемирная организация по инсульту признает упомянутые трудности и подчеркивает полезность телемедицины, а также обмена передовым опытом для дальнейшей оптимизации и рационализации процессов инсульта (90, 91).
Хотя это не отражает истинную эпидемиологическую картину, очевидно, что пациенты с инфекцией AIS и SARS-CoV2 имеют плохие неврологические исходы в виде смерти или тяжелой инвалидности. Aggarwal et al. (92) пришли к выводу в результате точечного анализа четырех исследований, что у пациентов с инсультом в анамнезе вероятность тяжелой инфекции COVID в 2,5 раза выше, но не было выявлено какой-либо значительной связи со смертностью (92). Ретроспективное когортное исследование ишемического инсульта сообщает о смертности, близкой к 50% (3), в то время как проспективное исследование с участием 10 пациентов с АИС привело к четырем смертельным исходам (55). Очевидно, что необходимы дополнительные проспективные исследования с участием большего числа отдельных пациентов, чтобы установить истинный уровень смертности в этой популяции.
В этом исследовании наблюдается тенденция к тому, что пациенты с хорошими исходами имеют более низкие уровни NLR, CRP и сывороточного ферритина по сравнению с пациентами, которые умерли или остались в критическом состоянии. Было показано, что NLR имеет хорошую прогностическую ценность при оценке пациентов, которые могут иметь тяжелую инфекцию SARS-CoV2 (30, 93–96). В частности, было высказано предположение, что пожилым пациентам со значениями NLR более 3, вероятно, потребуется интенсивная терапия (27). Ян и др. также предсказал, что высокие значения NLR при поступлении связаны с большей вероятностью осложнений, связанных с COVID-инфекцией (97).С другой стороны, известно, что высокий NLR используется как фактор плохого прогноза для пациентов с церебральной ишемией, внутримозговым кровоизлиянием и постинсультными осложнениями (98–107). Двойное последствие лимфопении, связанной с COVID, наряду с миграцией нейтрофилов в ишемическую ткань, может способствовать значительному увеличению уровней NLR у пациентов с инсультом и сопутствующей инфекцией SARS-CoV2 (107).
Еще одним гипервоспалительным биомаркером, который, как было показано, стратифицирует исходы у пациентов с инфекцией SARS-CoV2, является CRP.Помимо прогнозирования тяжести и смертности, он имеет прогностическое значение при определении того, каким пациентам в конечном итоге потребуется искусственная вентиляция легких (108–110). В опубликованной литературе отмечается, что повышенный уровень СРБ связан с плохими результатами у пациентов с нервно-сосудистыми заболеваниями (111, 112). Есть также данные, позволяющие предположить, что CRP является не просто «маркером», но «создателем» атерогенеза (110). В экспериментальных исследованиях было продемонстрировано, что экзогенный CRP способствует атерогенезу, способствуя экспрессии молекул адгезии и клеточных медиаторов наряду с уменьшением артериальных вазодилататоров (113–115).Метаанализ девяти исследований также предоставляет доказательства дозозависимой связи СРБ и повышенного риска венозной тромбоэмболии (112). Вопрос о том, является ли повышение уровня СРБ причинной этиологией или последствиями многофакторного процесса, связывающего инфекцию SARS-CoV2 с воспалением, атерогенезом или эмболией, требует дальнейшего изучения.
Гиперферритинемия, которая подразумевает повышенное состояние иммунологической реактивности, также была связана с повышенной смертностью в недавних публикациях, связанных с инфекцией SARS-CoV2 (116).Он сигнализирует об активации макрофагов и ретикулоэндотелиальной системы, что приводит к повреждению органов-мишеней (117). У пациентов с SARS-CoV2, леченных от пневмонии токулизумабом, отмечалось заметное снижение воспалительных маркеров, таких как CRP и ферритин, а также значительное клиническое улучшение после инфузии (118). У пациентов с острым инсультом этот запасной белок железа потенциально может усугубить железозависимый окислительный стресс в ишемической полутени, что может привести к дальнейшему ухудшению неврологического статуса (119).Это дополнительно подтверждается в исследовании, которое показывает прямую корреляцию между ферритином сыворотки и маркерами нарушения нервного и гематоэнцефалического барьера, такими как глутамат, интерлейкин-6, матриксная металлопротеиназа-9 и клеточный фибронектин, среди пациентов, получающих тромболизис (39). Дополнительные воспалительные последствия инфекции SARS-CoV2 и ишемического инсульта являются вероятной причиной гиперферритинемии при инсультах, связанных с SARS-CoV2.
Коагулопатия, связанная с SARS-CoV2, является причиной различных тромботических событий, связанных со смертностью.Инфекция SARS-CoV2, описываемая как фибринолитическое «отключение», способствует развитию про и гиперкоагуляции, что приводит к диссеминированному (внутрисосудистому свертыванию (ДВС), микротромбам и другим венозным и артериальным тромботическим явлениям (4, 120–122). фибриноген считаются важными биомаркерами тяжести коагулопатии у пациентов с инфекцией SARS-CoV 2 (123, 124). Olive et al. в ретроспективном анализе 21 пациента с инфекцией SARS-CoV пришли к выводу, что D-димер был связан с повышенный риск тромбоэмболии легочной артерии (125).Аналогичное наблюдение было сделано в более крупном исследовании, которое предполагает, что уровни D-димера выше 1 мкг / мл могут помочь в стратификации пациентов с плохим прогнозом в начале (26). Повышение фибриногена также наблюдалось среди пациентов с тяжелой пневмонией, связанной с SARS-CoV2, по сравнению с легкой формой (126). Непропорциональное увеличение этих биомаркеров, особенно на ранних стадиях, требует скрининга тромбоэмболических событий и начала тромбопрофилактики (124). Тенденция этих биомаркеров коагуляции аналогичным образом наблюдается при инсультах, не связанных с COVID.В исследовании ARISTOTLE пациенты с ФП и повышенным уровнем D-димера имели более высокую частоту инсульта, системной эмболии и смертности от всех причин (127). Choi и его коллеги также предполагают, что D-димер можно использовать в качестве биомаркера рецидива у пациентов с предшествующей ФП и инсультами, не связанными с ФП (128). Исследование EUROSTROKE также подтверждает полезность фибриногена для прогнозирования пациентов, подверженных риску инсульта (36). Указанный риск приравнивается к различным клиническим рискам, таким как курение, сахарный диабет, инфаркт миокарда и холестерин ЛПВП (36).В этом исследовании мы предоставили основу для потенциальной тенденции между исходами и параметрами коагуляции для инсультов, связанных с SARS-CoV2. Хотя наиболее распространенным механизмом этого явления является нарушение системы свертывания крови, вызванное сепсисом, Iba et al. предполагают, что более сложные прокоагулянтные ответы приводят к отчетливому взаимодействию между иммунологической системой хозяина и системой свертывания крови (124).
Это исследование также подчеркивает возникновение ишемического события через несколько дней или недель после появления симптомов SARS-CoV2.Что еще более важно, мы установили обратную зависимость между воспалительным биомаркером, NLR при поступлении и продолжительностью между инсультом и появлением симптомов SARS-CoV2. Вероятно, это связано с воспалительной нагрузкой, которая запускает каскад прокоагуляции. Кроме того, Amiral et al. связывают это с аллоиммунной гипотезой, которая была продемонстрирована на грызунах (129). Развитие аутоантител к другим рецепторам ACE-2, таким как микроглия в головном мозге, после начала вирусной инфекции, по-видимому, привело к экспоненциальному увеличению цитокинового шторма и значительному разрушению тканей, что может быть связано с отсроченным началом сосудистое событие после вирусного продрома (129).
И, наконец, поскольку пандемия COVID-19 наносит ущерб национальным системам здравоохранения во всем мире, следует ожидать, что в ближайшее время начнется волна цунами, связанная с потребностями в нейрореабилитации и проблемами, связанными с долгосрочными последствиями пандемии. Таким образом, мы считаем, что при сильной человечности и сотрудничестве между дисциплинами настало время преобразовать эту ситуацию в возможность, которую с помощью видения, творчества, инноваций и использования интеллектуальных технологий можно использовать с целью выживания в этом глобальном кризисе в области здравоохранения ( 43, 130).
Заключение
Инсульт — важное нервно-сосудистое осложнение инфекции SARS-CoV2. Этиопатогенез церебральной ишемии связан с гиперактивацией иммунных механизмов и механизмов гиперкоагуляции. Это подтверждается непропорциональным увеличением биомаркеров, таких как NLR, CRP, сывороточный ферритин, D-димер и фибриноген, среди пациентов, которые умерли или были в критическом состоянии. Повышенный NLR при поступлении также означает повышенное бремя воспаления в начале инфекции SARS-CoV, что может привести к раннему проявлению церебральных ишемических событий.
Авторские взносы
TW и LK воплотили представленную идею. TW, SC и LK разработали теорию. TW и CS выполнили поиск литературы. TW написал рукопись при поддержке CS, LK и SC. Все четыре автора одобрили окончательную рукопись.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2.Чжоу Ю., Ли В., Ван Д., Мао Л., Цзинь Х., Ли Ю. и др. Клиническая динамика COVID-19, его неврологические проявления и некоторые мысли по лечению. Stroke Vasc Neurol . (2020) 5: 177–9. DOI: 10.1136 / svn-2020-000398
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Яги С., Исида К., Торрес Дж., Мак Грори Б., Раз Э., Хумберт К. и др. SARS2-CoV-2 и инсульт в системе здравоохранения Нью-Йорка. Инсульт. (2020) 51: 2002–11. DOI: 10.1161 / STROKEAHA.120.030335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Лодиджиани К., Япичино Г., Карензо Л., Чеккони М., Феррацци П., Себастьян Т. и др. Венозные и артериальные тромбоэмболические осложнения у пациентов с COVID-19, госпитализированных в академическую больницу в Милане, Италия. Thromb Res. (2020) 191: 9–14. DOI: 10.1016 / j.thromres.2020.04.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Оксли Т.Дж., Мокко Дж., Маджиди С., Келлнер С.П., Шойра Х., Сингх И.П. и др.Инсульт крупных сосудов как признак Covid-19 у молодых. N Engl J Med . (2020) 382: e60. DOI: 10.1056 / NEJMc2009787
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Spiezia L, Boscolo A, Poletto F, Cerruti L, Tiberio I, Campello E, et al. Связанная с COVID-19 тяжелая гиперкоагуляция у пациентов, поступивших в отделение интенсивной терапии по поводу острой дыхательной недостаточности. Тромб Хемост . (2020) 120: 998–1000. DOI: 10.1055 / с-0040-1710018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.Джакомелли Э., Дориго В., Фаргион А, Калуги Дж., Чианки Дж., Пратеси С. Острый тромбоз протезного протеза аорты у пациента с тяжелой пневмонией, связанной с COVID-19. Энн Васк Сург . (2020) 66: 8–10. DOI: 10.1016 / j.avsg.2020.04.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Гриффин Д.О., Дженсен А., Хан М., Чин Дж., Чин К., Парнелл Р. и др. Артериальные тромбоэмболические осложнения COVID-19 у пациентов с низким риском, несмотря на профилактику. Br J Haematol .(2020) 190: e11 – e13. DOI: 10.1111 / bjh.16792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Бенхаму Д., Кейта Х., Bouthors AS, Group Cw. Изменения коагуляции и риск тромбоэмболии у беременных с COVID-19. Anaesth Crit Care Pain Med . (2020) 39: 351–3. DOI: 10.1016 / j.accpm.2020.05.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Векка М., Радованович Д., Форлео Г.Б., Сантус П. Лечение с усиленным ингибированием тромбоцитов улучшает гипоксемию у пациентов с тяжелым Covid-19 и гиперкоагуляцией.Случай-контроль, доказательство концепции исследования. Pharmacol Res . (2020) 158104950. doi: 10.1016 / j.phrs.2020.104950
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Райт Флорида, Фоглер Т.О., Мур Е.Е., Мур Х.Б., Вохлауэр М.В., Урбан С. и др. Отключение фибринолиза коррелирует с тромбоэмболическими событиями при тяжелой инфекции COVID-19. J Am Coll Surg . (2020) 231: 203–4. DOI: 10.1016 / j.jamcollsurg.2020.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Terpos E, Ntanasis-Stathopoulos I, Elalamy I, Kastritis E, Sergentanis TN, Politou M, et al. Гематологические данные и осложнения COVID-19. Ам Дж. Гематол . (2020) 95: 834–47. DOI: 10.1002 / ajh.25829
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Панигада М., Боттино Н., Тальябу П., Грасселли Дж., Новембрино С., Чантарангкул В. и др. Гиперкоагуляция пациентов с COVID-19 в отделении интенсивной терапии. Отчет о результатах тромбоэластографии и других параметрах гемостаза. J Thromb Haemost . (2020) 18: 1738–42. DOI: 10.1111 / jth.14850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Гриффин Д.О., Дженсен А., Хан М., Чин Дж., Чин К., Саад Дж. И др. Легочная эмболия и повышенный уровень d-димера у пациентов с коронавирусной болезнью. Emerg Infect Dis. (2020) 26: 1941–3. DOI: 10.3201 / eid2608.201477
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Хуанг Ц., Ван И, Ли Х, Рен Л., Чжао Дж, Ху И и др.Клинические особенности пациентов, инфицированных новым коронавирусом 2019 г., в Ухане, Китай. Ланцет. (2020) 395: 497–506. DOI: 10.1016 / S0140-6736 (20) 30183-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Конти П., Ронкони Дж., Караффа А., Галленга С.Э., Росс Р., Фридас И. и др. Индукция провоспалительных цитокинов (IL-1 и IL-6) и воспаление легких с помощью коронавируса-19 (COVI-19 или SARS-CoV-2): противовоспалительные стратегии. J Biol Regul Homeost Agents. (2020) 34: 327–31. DOI: 10.23812 / CONTI-E
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Ким Е.С., Чин Б.С., Кан С.К., Ким Н.Дж., Кан Ю.М., Чой Дж. П. и др. Клиническое течение и исходы пациентов с тяжелым острым респираторным синдромом, инфицированным коронавирусом 2: предварительный отчет первых 28 пациентов из корейского когортного исследования COVID-19. J Korean Med Sci. (2020) 35: e142. DOI: 10.3346 / jkms.2020.35.e142
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Ян X, Yu Y, Xu J, Shu H, Xia Ja, Liu H и др. Клиническое течение и исходы тяжелобольных пациентов с пневмонией SARS-CoV-2 в Ухане, Китай: одноцентровое ретроспективное наблюдательное исследование. Ланцет Респир Мед. (2020) 8: 475–81. DOI: 10.1016 / S2213-2600 (20) 30079-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Тан Ц., Хуанг Й., Ши Ф., Тан К., Ма К., Чен И и др. С-реактивный белок коррелирует с результатами компьютерной томографии и предсказывает тяжелую форму COVID-19 на ранней стадии. J Med Virol. (2020) 92: 856–62. DOI: 10.1002 / jmv.25871
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z и др. Клиническое течение и факторы риска смертности взрослых пациентов с COVID-19 в Ухане, Китай: ретроспективное когортное исследование. Ланцет. (2020) 395: 1054–62. DOI: 10.1016 / S0140-6736 (20) 30566-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Чиккулло А., Боргетти А., Зилери Даль Верме Л., Тосони А., Ломбарди Ф., Гаркович М. и др.Отношение нейтрофилов к лимфоцитам и клинические исходы при COVID-19: отчет с итальянской линии фронта. Int J Антимикробные агенты . (2020) 56: 106017. DOI: 10.1016 / j.ijantimicag.2020.106017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Фэн X, Ли С., Сун К., Чжу Дж., Чен Б., Сюн М. и др. Иммуно-воспалительные параметры в случаях COVID-19: систематический обзор и метаанализ. Front Med. (2020) 7: 301. DOI: 10.3389 / fmed.2020.00301
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Хенека М.Т., Голенбок Д., Латц Э., Морган Д., Браун Р. Непосредственные и отдаленные последствия инфекций COVID-19 для развития неврологических заболеваний. Alzheimers Res Ther. (2020) 12:69. DOI: 10.1186 / s13195-020-00640-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Лю Дж, Ли С., Лю Дж, Лян Б., Ван Х, Ван Х и др. Продольные характеристики ответов лимфоцитов и цитокиновых профилей в периферической крови пациентов, инфицированных SARS-CoV-2. EBioMedicine. (2020) 55: 102763. DOI: 10.1016 / j.ebiom.2020.102763
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Хуанг И., Праната Р., Лим М.А., Охадиан А., Алисджахбана Б. С-реактивный белок, прокальцитонин, D-димер и ферритин при тяжелой коронавирусной болезни-2019: метаанализ. Therap Adv Respir Dis. (2020) 14: 1753466620937175. DOI: 10.1177 / 1753466620937175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Фрейзер Дж. С., Тайринис Эверден AJ. Новые модели гиперкоагуляции, связанные с критическим COVID-19: обзор. Trends Anaesth Criti Care . (2020). DOI: 10.1016 / j.tacc.2020.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Switońska M, Słomka A, Korbal P, Piekuś-Słomka N, Sinkiewicz W., Sokal P, et al. Связь соотношения нейтрофилов и лимфоцитов и соотношения лимфоцитов к моноцитам с методами лечения острого ишемического инсульта: пилотное исследование. Medicina. (2019) 55: 342. DOI: 10.3390 / medicina55070342
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Лим Х. Х., Чон И. Х., Ан Г. Д., Ву К. С., Ким К. Х., Ким Дж. М. и др. Раннее прогнозирование тяжести острого ишемического инсульта и транзиторной ишемической атаки с использованием параметров тромбоцитов и соотношения нейтрофилов к лимфоцитам. J Clin Lab Анал. (2019) 33: e22714. DOI: 10.1002 / jcla.22714
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Fang Y-N, Tong M-S, Sung P-H, Chen Y-L, Chen C-H, Tsai N-W и др. Более высокое количество нейтрофилов и соотношение нейтрофилов к лимфоцитам позволяют прогнозировать исходы у пациентов после ишемического инсульта, не вызванного фибрилляцией предсердий. Биомедицинский журнал. (2017) 40: 154–62. DOI: 10.1016 / j.bj.2017.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Боты М.Л., Элвуд П.К., Салонен Дж. Т., Фрейре де Конкальвес А., Сивениус Дж., Ди Карло А. и др. Уровень фибриногена и риск смертельного и нефатального инсульта.EUROSTROKE: совместное исследование исследовательских центров Европы. J Epidemiol Community Health. (2002) 56 (Дополнение 1): i14–8. DOI: 10.1136 / jech.56.suppl_1.i14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Бустаманте А., Симатс А., Вилар-Бергуа А., Гарсия-Беррокосо Т., Монтанер Дж. Биомаркеры воспаления крови / мозга после инсульта и их связь с исходом: от С-реактивного белка до молекулярных паттернов, связанных с повреждениями. Нейротерапия. (2016) 13: 671–84. DOI: 10.1007 / s13311-016-0470-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Ван А., Мандиго Г., Йим П., Мейерс П., Лавин С. Инсульт и механическая тромбэктомия у пациентов с COVID-19: технические наблюдения и характеристики пациентов. J Нейроинтервенционная хирургия . (2020) 12: 648–53. DOI: 10.1136 / нейринтсург-2020-016220
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Миллан М., Собрино Т., Аренильяс Дж. Ф., Родригес-Яньес М., Гарсиа М., Номбела Ф. и др.Биологические признаки повреждения головного мозга, связанные с высоким уровнем ферритина в сыворотке крови у пациентов с острым ишемическим инсультом и тромболитическим лечением. Маркеры Dis. (2008) 25: 181–8. DOI: 10.1155 / 2008/380356
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Carda S, Invernizzi M, Bavikatte G, Bensmail D, Bianchi F, Deltombe T. и др. Роль физической и реабилитационной медицины в пандемии COVID-19: взгляд клинициста. Энн Физи Ребил Мед .(2020). DOI: 10.1016 / j.rehab.2020.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Carda S, Invernizzi M, Bavikatte G, Bensmail D, Bianchi F, Deltombe T. и др. COVID-19 пандемия. Что делать специалистам по PRM? Взгляд клинициста. Eur J Phys Rehabil Med . (2020). DOI: 10.23736 / S1973-9087.20.06317-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Бартоло М., Интисо Д., Лентино С., Сандрини Дж., Паолуччи С., Замполини М. и др.Неотложные меры по сдерживанию эпидемии коронавируса (Covid-19) в отделениях нейрореабилитации / реабилитации в фазе максимального распространения эпидемии. Front Neurol. (2020) 11: 423. DOI: 10.3389 / fneur.2020.00423
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Kampf G, Scheithauer S, Lemmen S, Saliou P, Suchomel M. Связанная с COVID-19 нехватка спиртосодержащих средств для протирания рук, масок для лица, медицинских перчаток и халатов — предложение по подходу, адаптированному к риску, для обеспечения пациента и безопасность медицинского работника. Дж Хосп Инфекция . (2020) 105: 424–7. DOI: 10.1016 / j.jhin.2020.04.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Роуэн Нью-Джерси, Лаффи Дж. Проблемы и решения для решения проблемы острой нехватки в цепочке поставок средств индивидуальной защиты и средств индивидуальной защиты (СИЗ), возникшей в результате пандемии коронавирусного заболевания (COVID19) — пример из Ирландской Республики. Sci Total Environ. (2020) 725: 138532. DOI: 10.1016 / j.scitotenv.2020.138532
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Garzotto F, Ceresola E, Panagiotakopoulou S, Spina G, Menotto F, Benozzi M и др. COVID-19: обеспечение того, чтобы наше медицинское оборудование могло справиться с этой проблемой. Эксперт Рев Мед Устройства . (2020) 17: 483–9. DOI: 10.1080 / 17434440.2020.1772757
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Рипп Дж., Пеккорало Л., Чарни Д. Забота об эмоциональном благополучии медицинских работников в системе здравоохранения Нью-Йорка во время пандемии COVID-19. Акад. Мед. .(2020) 95: 1136–9. DOI: 10.1097 / ACM.0000000000003414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Олботт С.С., Возняк Дж. Р., МакГлинч Б. П., Уолл М. Х., Голд Б. С., Виноградов С. Боевые товарищи: быстрое развертывание мер психологической устойчивости для медицинских работников во время пандемии COVID-19. Анест Анальг . (2020). DOI: 10.1213 / ANE.0000000000004912
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Wijesundera C, Vingrys AJ, Wijeratne T, Crewther SG.Приобретенные нарушения зрения независимо от места поражения при остром инсульте. Передний Neurol . (2020) 11: 705. DOI: 10.3389 / fneur.2020.00705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Wijesundera C, Vingrys AJ, Kong YXG, Wijeratne T, Crewther SG. Зрительная функция и зрительно-моторная координация при остром инсульте. Investig Ophthalmol Visual Sci. (2019) 60: 1046.
PubMed Аннотация | Google Scholar
53. Wijesundera CN, Crewther S, Vingrys A, Wijeratne T.Резюме WP187: значительное выздоровление от острого дефицита зрения до трех-шести месяцев после ишемического инсульта. Инсульт. (2019) 50: AWP187-AWP. DOI: 10.1161 / str.50.suppl_1.WP187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Берекашвили К., Дмитриев А.А., Вулканов В., Агарвал С., Ханеджа А., Тюркель-Парелла Д. и др. Этиологические подтипы ишемического инсульта у пациентов с вирусом SARS-COV-2. (2020). DOI: 10.1101 / 2020.05.03.20077206
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56.Бейрути Р., Адамс М.Э., Бенджамин Л. и др. Характеристики ишемического инсульта, связанного с COVID-19. J Neurol Neurosurg Psychiatry . (2020) 91: 889–91. DOI: 10.1136 / jnnp-2020-323586
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Тунч А., Унлюбаш И Алемдар М. Акьюз Э. Сосуществование COVID-19 и острого ишемического инсульта. Отчет о четырех случаях. Дж. Clin Neurosci . (2020) 77: 227–9. DOI: 10.1016 / j.jocn.2020.05.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60.Вигье А., Деламар Л., Дюплантье Дж., Оливот Дж. М., Бонневиль Ф. Острый ишемический инсульт, осложняющий тромбоз общей сонной артерии во время тяжелой инфекции COVID-19. Дж. Нейрорадиол . (2020) 47: 393–4. DOI: 10.1016 / j.neurad.2020.04.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Co COC, Yu JRT, Laxamana LC, David-Ona DIA. Внутривенный тромболизис при инсульте у филиппинского пациента с положительной реакцией на COVID-19, отчет о болезни. Дж. Clin Neurosci .(2020) 77: 234–6. DOI: 10.1016 / j.jocn.2020.05.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Деливала С., Абдулхамид С., Абусалих М.Ф., Аль-Касми М.М., Бачува Г. Энцефалопатия как контрольный признак коркового инсульта у пациента, инфицированного коронавирусной болезнью-19 (COVID-19). Cureus . (2020) 12: e8121. DOI: 10.7759 / cureus.8121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Аль Сайег Ф., Гош Р., Лейболд А. и др.Состояние SARS-CoV-2 в спинномозговой жидкости пациентов с COVID-19 и инсультом. J Neurol Neurosurg Psychiatry . (2020) 91: 846–8. DOI: 10.1136 / jnnp-2020-323522
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Гонсалес-Пинто Т., Луна-Родригес А., Морено-Эстебанес А., Агирре-Бейтия Дж., Родригес-Антигуедад А., Руис-Лопес М. Неврология отделения неотложной помощи во время COVID-19: злокачественный ишемический инсульт и SARS-CoV -2 инфекции. евро J Neurol .(2020). DOI: 10.1111 / ene.14286
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Вальдеррама Э., Гумберт К., Лорд А., Фронтера Дж., Яги С. Тяжелый острый респираторный синдром, инфекция, вызванная коронавирусом 2, и ишемический инсульт. Ход . (2020) 51. doi: 10.1161 / strokeaha.120.030153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Мошайеди П., Райан Т.Э., Mejia LLP, Нур М., Либескинд Д.С. Сортировка острого ишемического инсульта при подтвержденном COVID-19: окклюзия крупных сосудов, связанная с коронавирусной инфекцией. Передний Neurol . (2020) 11: 353. DOI: 10.3389 / fneur.2020.00353
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Бикдели Б., Мадхаван М.В., Хименес Д., Чуич Т., Дрейфус И., Дриггин Э. и др. COVID-19 и тромботическая или тромбоэмболическая болезнь: значение для профилактики, антитромботической терапии и последующего наблюдения. Джам Колл Кардиол . (2020) 75: 2950–73. DOI: 10.1016 / j.jacc.2020.04.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70.Магрон Т., Магрон М., Джирилло Э. Сосредоточение внимания на рецепторах коронавирусов с особым упором на ангиотензин-превращающий фермент 2 как потенциальную мишень для лекарств — перспектива. Препарат для лечения иммунных расстройств Endocr Metab нацелен на . (2020) 20: 807–11. DOI: 10.2174 / 1871530320666200427112902
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Лопес Р.Д., Маседо А.В.С., де Баррос ЭСПГМ, Молл-Бернардес Р.Дж., Фельдман А., Д’Андреа Саба Арруда Г. и др. Продолжение по сравнению с приостановкой приема ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов ангиотензина: влияние на неблагоприятные исходы у госпитализированных пациентов с тяжелым острым респираторным синдромом, вызванным коронавирусом 2 (SARS-CoV-2). Am Heart J . (2020) 226: 49–59. DOI: 10.1016 / j.ahj.2020.05.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Ларсон А.С., Савастано Л., Кадирвел Р., Каллмес Д.Ф., Хассан А.Е., Бринджикджи В. COVID-19 и сердечно-сосудистые системы: что мы знаем на данный момент? Дж. Эм Харт Асс . (2020) 9: e016793. DOI: 10.1161 / JAHA.120.016793
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Wichmann D, Sperhake JP, Lutgehetmann M, Steurer S, Edler C, Heinemann A, et al.Результаты аутопсии и венозная тромбоэмболия у пациентов с COVID-19. Энн Интерн Мед. . (2020) 173: 268–77. DOI: 10.7326 / M20-2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ, et al. COVID-19: рассмотрите синдромы цитокинового шторма и иммуносупрессию. Ланцет. (2020) 395: 1033–4. DOI: 10.1016 / S0140-6736 (20) 30628-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Линь Дж. Х., Чен Ю. С., Лу К. Л., Сюй Ю. Н., Ван В. Применение плазмафереза в сочетании с более высокими дозами CVVH при цитокиновом шторме, осложняющем COVID-19. J Formos Med Assoc. (2020) 119: 1116–8. DOI: 10.1016 / j.jfma.2020.04.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Чжоу Г., Чен С., Чен З. Достижения в области COVID-19: вирус, патогенез, научно-обоснованный контроль и терапевтические стратегии. Front Med. (2020) 14: 117–25. DOI: 10.1007 / с11684-020-0773-х
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Zhu Z, Cai T., Fan L, Lou K, Hua X, Huang Z, et al. Клиническое значение иммуно-воспалительных параметров для оценки степени тяжести коронавирусной болезни (2019). Int J Infect Dis. (2020) 95: 332–9. DOI: 10.1016 / j.ijid.2020.04.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Туфан А., Аваноглу Гюлер А., Матуччи-Цериник М. COVID-19, реакция иммунной системы, гипервоспаление и перепрофилирование противоревматических препаратов. Turk J Med Sci. (2020) 50: 620–32. DOI: 10.3906 / sag-2004-168
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Яо З., Чжэн З., Ву К., Цзюньхуа З. Модуляция иммунной среды у пациентов с пневмонией, вызванной коронавирусом: SARS-CoV, MERS-CoV и SARS-CoV-2. Старение. (2020) 12: 7639–51. DOI: 10.18632 / старение.103101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Азкур А.К., Акдис М., Азкур Д., Соколовска М., ван де Вин В., Брюгген М.С. и др.Иммунный ответ на SARS-CoV-2 и механизмы иммунопатологических изменений при COVID-19. Аллергия . (2020) 75: 1564–81. DOI: 10.1111 / all.14364
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Алижотас-Рейг Дж., Эстев-Вальверде Э., Белизна С., Сельва-О’Каллаган А., Пардос-Геа Дж., Кинтана А. и др. Иммуномодулирующая терапия для лечения тяжелой формы COVID-19. Помимо противовирусной терапии: всесторонний обзор. Аутоиммун Ред. . (2020) 19: 102569.DOI: 10.1016 / j.autrev.2020.102569
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Чжэн Ю., Ли Р., Лю С. Иммунорегуляция с помощью ингибиторов mTOR для предотвращения серьезности COVID-19: новая стратегия вмешательства, выходящая за рамки вакцин и конкретных противовирусных препаратов. J Med Virol . (2020). DOI: 10.20944 / препринты202004.0060.v1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Серрано-Кастро П.Дж., Эстивиль-Торрус Дж., Кабесудо-Гарсия П., Рейес-Буэно Дж. А., Чиано Петерсен Н., Агилар-Кастильо М. Дж. И др.Влияние инфекции SARS-CoV-2 на нейродегенеративные и психоневрологические заболевания: отсроченная пандемия? Неврология . (2020) 35: 245–51. DOI: 10.1016 / j.nrleng.2020.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Чау В.К., Оливерос Э., Махмуд К., Сингхви А., Лала А., Мосс Н. и др. Несовершенный цитокиновый шторм: тяжелый COVID-19 с ОРДС у пациента, находящегося на прочной поддержке LVAD. Реплика корпуса JACC . (2020) 2: 1315–20. DOI: 10.1016 / j.jaccas.2020.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Бенхаду Ф., Дель Мармол В. Улучшение симптомов SARS-CoV2 после инъекции гуселкумаба пациенту с псориазом. J Eur Acad Dermatol Venereol . (2020) 34: e363–4. DOI: 10.1111 / jdv.16590
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Ковалевски М., Фина Д., Сломка А., Раффа Г.М., Мартуччи Г., Ло Коко В. и др. COVID-19 и ЭКМО: взаимодействие между свертыванием и воспалением — повествовательный обзор. Crit Care. (2020) 24: 205. DOI: 10.1186 / s13054-020-02925-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Рудилоссо С., Ларедо С., Вера В., Варгас М., Рену А., Ллулл Л. и др. Лечение острого инсульта находится под угрозой в эпоху COVID-19: опыт работы в центре комплексного лечения инсульта в барселоне. Ход . (2020) 51: 1991–5. DOI: 10.1161 / STROKEAHA.120.030329
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91.Джул Джули, Праната Р. Влияние пандемии коронавирусной болезни на количество инсультов и механических тромбэктомий: систематический обзор и метаанализ: COVID-19 и помощь при инсульте. J Stroke Cerebrovasc Dis . (2020) 29: 105185. DOI: 10.1016 / j.jstrokecerebrovasdis.2020.105185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Аггарвал Дж., Липпи Дж., Майкл Генри Б. Цереброваскулярное заболевание связано с повышенной тяжестью заболевания у пациентов с коронавирусной болезнью 2019 (COVID-19): объединенный анализ опубликованной литературы. Int J Stroke . (2020) 15: 385–9. DOI: 10.1177 / 1747493020921664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Лю И, Ду Икс, Чен Дж, Джин И, Пэн Л., Ван ХХХ и др. Соотношение нейтрофилов и лимфоцитов как независимый фактор риска смертности у госпитализированных пациентов с COVID-19. J Заражение. (2020) 81: e6–12. DOI: 10.1016 / j.jinf.2020.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Ся Х, Вэнь М., Чжан С., Хэ Дж, Чен В.[Повышенное соотношение нейтрофилов / лимфоцитов является ранним предупреждением о тяжелой форме COVID-19]. Нан Фанг И Кэ Да Сюэ Сюэ Бао. (2020) 40: 333–6. DOI: 10.12122 / j.issn.1673-4254.2020.03.06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Лю И-П, Ли Г-М, Хе Дж, Лю И, Ли М, Чжан Р. и др. Комбинированное использование соотношения нейтрофилов и лимфоцитов и СРБ для прогнозирования 7-дневной тяжести заболевания у 84 госпитализированных пациентов с пневмонией COVID-19: ретроспективное когортное исследование. Ann Transl Med. (2020) 8: 635. DOI: 10.21037 / атм-20-2372
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Ван Ц., Дэн Р., Гоу Л., Фу З., Чжан Х, Шао Ф и др. Предварительное исследование для выявления тяжелых и умеренных случаев COVID-19 с использованием комбинированных гематологических параметров. Ann Transl Med. (2020) 8: 593. DOI: 10.21037 / атм-20-3391
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Ян Х, Ли Ф, Ван Х, Ян Дж., Чжу Ф., Тан С. и др.Соотношение нейтрофилов и лимфоцитов как прогностический и прогностический фактор у пациентов с коронавирусной болезнью 2019: ретроспективное перекрестное исследование. J Med Virol . (2020). DOI: 10.1002 / jmv.26061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Целикбилек А., Исмаилогуллари С., Зарарсиз Г. Соотношение нейтрофилов и лимфоцитов предсказывает плохой прогноз при ишемической цереброваскулярной болезни. J Clin Lab Анал. (2014) 28: 27–31. DOI: 10.1002 / jcla.21639
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99.Qun S, Tang Y, Sun J, Liu Z, Wu J, Zhang J и др. Отношение нейтрофилов к лимфоцитам позволяет прогнозировать трехмесячный исход острого ишемического инсульта. Исследование нейротоксичности. (2017) 31: 444–52. DOI: 10.1007 / s12640-017-9707-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Zhao L, Dai Q, Chen X, Li S, Shi R, Yu S, et al. Отношение количества нейтрофилов к лимфоцитам позволяет прогнозировать продолжительность пребывания в стационаре и стоимость больницы для оказания неотложной помощи пациентам с острым ишемическим инсультом. J Stroke Cerebrovasc Dis. (2016) 25: 739–44. DOI: 10.1016 / j.jstrokecerebrovasdis.2015.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Kocaturk O, Besli F, Gungoren F, Kocaturk M, Tanriverdi Z. Взаимосвязь между соотношением нейтрофилов и лимфоцитов, территорией инсульта и трехмесячной смертностью у пациентов с острым ишемическим инсультом. Neurol Sci. (2019) 40: 139–46. DOI: 10.1007 / s10072-018-3604-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102.Guo Z, Yu S, Xiao L, Chen X, Ye R, Zheng P и др. Динамическое изменение соотношения нейтрофилов и лимфоцитов и геморрагическая трансформация после тромболизиса при инсульте. J Neuroinflamm. (2016) 13: 199. DOI: 10.1186 / s12974-016-0680-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Цинь Дж., Ли З., Гонг Дж., Ли Х., Чен Л., Сун Б. и др. Раннее повышение отношения нейтрофилов к лимфоцитам связано с плохими 3-месячными исходами спонтанного внутримозгового кровоизлияния. PLoS ONE. (2019) 14: e0211833. DOI: 10.1371 / journal.pone.0211833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Tao C, Hu X, Wang J, Ma J, Li H, You C. Количество нейтрофилов при поступлении и соотношение нейтрофилов к лимфоцитам предсказывают 90-дневный исход внутримозгового кровоизлияния. Biomark Med. (2017) 11: 33–42. DOI: 10.2217 / bmm-2016-0187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Латтанци С., Бриго Ф, Тринка Э, Каньетти С., Ди Наполи М., Сильвестрини М.Отношение нейтрофилов к лимфоцитам при остром мозговом кровоизлиянии: системный обзор. Transl Stroke Res. (2019) 10: 137–45. DOI: 10.1007 / s12975-018-0649-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Lattanzi S, Cagnetti C, Provinciali L, Silvestrini M. Отношение нейтрофилов к лимфоцитам и неврологическое ухудшение после острого кровоизлияния в мозг. Oncotarget. (2017) 8: 57489–94. DOI: 10.18632 / oncotarget.15423
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109.Чжан З-Л, Хоу И-Л, Ли Д-Т, Ли Ф-З. Лабораторные данные COVID-19: систематический обзор и метаанализ. Scand J Clin Lab Invest . (2020) 23: 1–7. DOI: 10.1080 / 00365513.2020.1768587
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Герольд Т., Юринович В., Арнрайх К., Липуорт Б.Дж., Хельмут Дж.С., Бергвельт-Бейлдон М.В. и др. Повышенные уровни IL-6 и CRP предсказывают необходимость искусственной вентиляции легких при COVID-19. J Allergy Clin Immunol. (2020) 146: 128–36.e4. DOI: 10.1016 / j.jaci.2020.05.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Кунуцор С.К., Сейду С., Блом А.В., Хунти К., Лаукканен Я. С-реактивный белок сыворотки увеличивает риск венозной тромбоэмболии: проспективное исследование и метаанализ опубликованных проспективных данных. Eur J Epidemiol. (2017) 32: 657–67. DOI: 10.1007 / s10654-017-0277-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Pasceri V, Cheng JS, Willerson JT, Yeh ET.Модуляция C-реактивного белка-опосредованной индукции хемоаттрактантного белка-1 моноцитов в человеческих эндотелиальных клетках с помощью антиатеросклеротических препаратов. Тираж. (2001) 103: 2531–4. DOI: 10.1161 / 01.CIR.103.21.2531
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Пассери В., Виллерсон Дж. Т., Йе, ETH. Прямое провоспалительное действие c-реактивного белка на эндотелиальные клетки человека. Тираж. (2000) 102: 2165–8. DOI: 10.1161 / 01.CIR.102.18.2165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Венугопал С.К., Деварадж С., Джиалал И. С-реактивный белок снижает высвобождение простациклина из эндотелиальных клеток аорты человека. Тираж. (2003) 108: 1676–8. DOI: 10.1161 / 01.CIR.0000094736.10595.A1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Рушитти П., Берардикурти О., Ди Бенедетто П., Чиприани П., Ягнокко А., Шенфельд Ю. и др. Тяжелый COVID-19 — еще один фрагмент головоломки гиперферритинемического синдрома.Иммуномодулирующее средство для облегчения шторма. Front Immunol. (2020) 11: 1130. DOI: 10.3389 / fimmu.2020.01130
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Тониати П., Пива С., Катталини М., Гаррафа Е., Регола Ф., Кастелли Ф. и др. Тоцилизумаб для лечения тяжелой пневмонии COVID-19 с гипервоспалительным синдромом и острой дыхательной недостаточностью: одноцентровое исследование 100 пациентов в Брешии, Италия. Autoimmun Rev. (2020) 19: 102568.DOI: 10.1016 / j.autrev.2020.102568
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Dolhnikoff M, Duarte-Neto AN, de Almeida Monteiro RA, da Silva LFF, de Oliveira EP, Saldiva PHN, et al. Патологические свидетельства легочных тромботических явлений при тяжелой форме COVID-19. J Thrombo Haemosta. (2020) 18: 1517–9. DOI: 10.1111 / jth.14844
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Затроч И., Смудла А., Бабик Б., Танцос К., Ковори Л., Сабо З и др.Прокоагуляция, гиперкоагуляция и фибринолиз остановлены », — сказал ClotPro ® viszkoelasztikus tesztek segítségével COVID − 19-betegekben. Орвоси Хэтилап . (2020) 161: 899–907. DOI: 10.1556 / 650.2020.31870
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Tveita A, Hestenes S, Sporastøyl ER, Pettersen SA, Neple BL, Myrstad M, et al. Легочная эмболия при COVID-19. Tidsskrift Den Norske Legeforen . (2020) 190: 58–9.DOI: 10.1016 / j.thromres.2020.04.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Tang N, Li D, Wang X, Sun Z. Аномальные параметры коагуляции связаны с плохим прогнозом у пациентов с новой коронавирусной пневмонией. J Thromb Haemost. (2020) 18: 844–7. DOI: 10.1111 / jth.14768
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Гарсия-Оливе И., Синтес Х., Радуа Дж., Абад Капа Дж., Розелл А. D-димер у пациентов, инфицированных COVID-19 с подозрением на тромбоэмболию легочной артерии. Respir Med. (2020) 169: 106023. DOI: 10.1016 / j.rmed.2020.106023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Zou Y, Guo H, Zhang Y, Zhang Z, Liu Y, Wang J, et al. Анализ параметров свертывания крови у пациентов с COVID-19 в Шанхае, Китай. Biosci Trends . (2020). DOI: 10.5582 / bst.2020.03086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Кристерсон К., Валлентин Л., Андерссон Ю., Александр Дж. Х., Анселл Дж., Де Катерина Р. и др.D-димер и риск тромбоэмболических событий и кровотечений у пациентов с фибрилляцией предсердий — наблюдения из исследования ARISTOTLE. J Thromb Haemost. (2014) 12: 1401–12. DOI: 10.1111 / jth.12638
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Чой К. Х., Сео В. К., Пак М. С., Ким Дж. Т., Чунг Дж. В., Банг О. Ю. и др. Исходные уровни D-димера как биомаркер оценки риска повторного инсульта у пациентов с сочетанием фибрилляции предсердий и атеросклероза. J Clin Med. (2019) 8: 1457. DOI: 10.3390 / jcm8091457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
129. Амирал Дж., Виссак А.М., Сегатчиан Дж. Ковид-19, индуцированная активация гемостаза и иммунные реакции: Может ли аутоиммунная реакция способствовать отложенным тяжелым осложнениям, наблюдаемым у некоторых пациентов? Transfus Apher Sci . (2020) 59: 102804. DOI: 10.1016 / j.transci.2020.102804
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130.Сакель М., Сондерс К., Чанди Дж., Хакша С., Фаруки Р. Служба нейрореабилитации во время пандемии COVID-19: передовой опыт Великобритании. J Pak Med Assoc. (2020) 70 (Дополнение 3): S136–40. DOI: 10.5455 / JPMA.33
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Инсульт: Часть II. Ведение острого ишемического инсульта
1. Статистическое приложение о сердце и инсульте. Даллас: Американская кардиологическая ассоциация, 1998 ….
2. Фоулкс М. Р., Вольф ПА, Цена TR, Мор JP, Hier DB.Банк данных об инсульте: дизайн, методы и исходные характеристики. Ход . 1988; 19: 547–54.
3. Харт Р.Г., Бенавенте О. Инсульт: Часть I. Обновленная клиническая информация о профилактике. Врач Фам . 1999; 59: 2475–82.
4. Адамс HP мл., Бротт Т.Г., Кроуэлл Р.М., Фурлан А.Дж., Гомес ЧР, Гротта J, и другие. Рекомендации по ведению пациентов с острым ишемическим инсультом.Заявление для медицинских работников от специальной группы авторов Совета по инсульту Американской кардиологической ассоциации. Тираж . 1994; 90: 1588–601.
5. Бротт Т., Маккарти Е.П. Антигипертензивная терапия при инсульте. В: Фишер М., изд. Медикаментозная терапия острого инсульта. Нью-Йорк: Деккер, 1989: 117–41.
6. Райт Дж., Йоргенсен Х.С., Педерсен П.М., Накаяма Х, Раашу HD, Jeppesen LL, и другие. Температура тела при остром инсульте: связь с тяжестью инсульта, размером инфаркта, смертностью и исходом. Ланцет . 1996; 347: 422–5.
7. Сотрудничество исследователей инсульта. Совместный систематический обзор рандомизированных исследований организованной стационарной помощи (инсультное отделение) после инсульта. BMJ . 1997; 314: 1151–9.
8. Исследовательская группа по инсульту Национального института неврологических расстройств и инсульта. Активатор тканевого плазминогена при остром ишемическом инсульте. N Engl J Med . 1995; 333: 1581–7.
9. Исследовательская группа по инсульту NINDS t-PA.Внутримозговое кровоизлияние после внутривенной терапии t-PA при ишемическом инсульте. Ход . 1997. 28: 2109–18.
10. Hacke W, Kaste M, Фиески C, Тони Д, Lesaffre E, фон Куммер Р., и другие. Внутривенный тромболизис рекомбинантным тканевым активатором плазминогена при остром полушарном инсульте. Европейское совместное исследование острого инсульта (ECASS). JAMA . 1995; 274: 1017–25.
11.Хаке W, Kaste M, Фиески C, фон Куммер Р., Давалос А, Мейер Д., и другие. Рандомизированное двойное слепое плацебо-контролируемое исследование тромболитической терапии с внутривенным введением альтеплазы при остром ишемическом инсульте (ECASS II). Второе европейско-австралийское исследование острого инсульта. Ланцет . 1998. 352: 1245–51.
12. Каплан Л.Р., Мор JP, Кистлер JP, Корошец В. Должна ли тромболитическая терапия быть терапией первой линии при остром ишемическом инсульте? Тромболизис — не панацея от ишемического инсульта. N Engl J Med . 1997; 337: 1309–13.
13. Бротт Т. Тромболизис при инсульте. Arch Neurol . 1996; 53: 1305–8.
14. Wardlaw JM, Варлоу CP, Советник К. Систематический обзор данных о тромболитической терапии острого ишемического инсульта. Ланцет . 1997; 350: 607–14.
15. Танне Д., Kasner SE, Мансбах H, Binder JR, Верро П, Скотт PA, и другие.Внутримозговое кровоизлияние после внутривенного введения t-PA при остром ишемическом инсульте в клинической практике: частота и предикторы. Цереброваск Дис . 1998; 8 (добавление 4): 48.
16. Адамс HP мл., Бротт Т.Г., Фурлан А.Дж., Гомес ЧР, Гротта JC, Хельгасон С.М., и другие. Руководство по тромболитической терапии острого инсульта: дополнение к руководству по ведению пациентов с острым ишемическим инсультом. Заявление для специалистов в области здравоохранения от Специальной письменной группы Совета по инсульту Американской кардиологической ассоциации. Тираж . 1996; 94: 1167–74.
17. Международная группа по исследованию инсульта. Международное исследование инсульта (IST): рандомизированное исследование аспирина, подкожного гепарина, обоих или ни одного из 19435 пациентов с острым ишемическим инсультом. Ланцет . 1997; 349: 1569–81.
18. Группа сотрудничества CAST (Китайское исследование острого инсульта). CAST: рандомизированное плацебо-контролируемое исследование раннего применения аспирина у 20 000 пациентов с острым ишемическим инсультом. Ланцет . 1997; 349: 1641–9.
19. Исследователи Комитета по публикациям по исследованию ORG 10172 в лечении острого инсульта (TOAST). Низкомолекулярный гепариноид ORG 10172 (данапароид) и исход после острого ишемического инсульта: рандомизированное контролируемое исследование. JAMA . 1998. 279: 1265–72.
20. Кей Р., Вонг К.С., Ю ЫЛ, Чан Ю.В., Цой ТД, Ахуджа А.Т., и другие. Низкомолекулярный гепарин для лечения острого ишемического инсульта. N Engl J Med . 1995; 333: 1588–93.
21. Хоммель М, для исследовательской группы FISS bis. Флаксипарин в исследовании ишемического инсульта (FISS bis). Цереброваск Дис . 1998; 8 (добавление 4): 52.
Острый ишемический инсульт и выздоравливающий COVID-19 у мужчин
Quick Takes
- Бессимптомная инфекция COVID-19 может быть связана с повышенным риском ишемического инсульта.
- Эти инсульты произошли у более молодых пациентов без типичных сосудистых факторов риска, что предполагает этиологическую роль предшествующей инфекции COVID-19.
Учебных вопросов:
Каков риск ишемического инсульта у пациентов с бессимптомной инфекцией коронавирусной болезни 2019 (COVID-19)?
Методы:
В этом исследовании были определены все пациенты с острым ишемическим инсультом, госпитализированные в больницы Сингапура с конца весны до осени 2020 года, то есть примерно за 5 месяцев.Большинство (94%) случаев COVID-19 в Сингапуре произошло среди иностранных рабочих, проживающих в общежитиях, и активное отслеживание контактов имело место в этой группе населения. В анализ были включены пациенты с положительным результатом теста на антитела к коронавирусу 2 (SARS-CoV-2) тяжелого острого респираторного синдрома. Авторы исключили пациентов с активными респираторными симптомами или положительным результатом теста полимеразной цепной реакции (ПЦР) SARS-CoV-2. Годовой уровень заболеваемости инсультом в исследуемой популяции сравнивался с историческими данными с учетом возраста, пола и этнической принадлежности.
Результатов:
Было 18 пациентов с ишемическим инсультом, у которых были серологические доказательства предшествующего COVID-19, и все они ранее имели отрицательный результат ПЦР-теста на SARS-CoV-2. Все пациенты были мужчинами, средний возраст составлял 41 год, и медиана между положительным тестом на антитела и проявлением острого инсульта составляла 54 дня. У большинства пациентов (67%) в анамнезе не было факторов риска инсульта, а у 56% была окклюзия крупных сосудов.Наиболее частая этиология инсульта была «неустановленной» (72%), за ней следовали кардиоэмболия (17%) и заболевание мелких сосудов (11%). У четырех пациентов (22%) был повышенный уровень гомоцистеина, а у 17% пациентов был повышен уровень D-димера. Было два пациента с положительными антикоагулянтными антителами к волчанке, но в остальном тест на другие антифосфолипидные антитела был отрицательным.
Годовой уровень заболеваемости острым ишемическим инсультом в этой популяции составлял 82,6 на 100 000, что выше, чем в скорректированном историческом контроле38.2 на 100 000 (соотношение частот 2,16; 95% доверительный интервал 1,36–3,48).
Выводы:
Бессимптомный COVID-19 может быть фактором риска ишемического инсульта.
Перспектива:
Острая инфекция COVID-19 определена как фактор риска ишемического инсульта. О последствиях бессимптомной инфекции известно меньше, и это исследование начинает заполнять эти пробелы в знаниях.Молодой возраст пациентов и отсутствие у них сосудистых факторов риска позволяют предположить, что COVID-19 был связан с их острым инсультом. Этиология инсульта у этих пациентов требует дополнительного изучения и может отличаться от механизма инфаркта при острой инфекции COVID-19. Возможно, будет разумным поискать серопозитивный вирус SARS-CoV-2 у пациентов с инсультом, если обследование не выявило никаких других проблем. Учитывая всемирное бремя COVID-19, связь между ишемическим инсультом и бессимптомной инфекцией имеет значение для общественного здравоохранения.Ограничения исследования включают его наблюдательный характер и тот факт, что большинство пациентов с инфекцией COVID-19 в Сингапуре были иностранными рабочими-мужчинами, что влияет на обобщаемость этих результатов. Поскольку эта работа была проведена до того, как вакцинация COVID-19 стала доступна, неясно, как результаты передаются пациентам, которые были вакцинированы и, следовательно, вероятно, имеют антитела.
Клинические темы: Профилактика
Ключевые слова: Антитела, Бессимптомные инфекции, Ишемия головного мозга, Отслеживание контактов, Коронавирус, COVID-19, Этнические группы, CoVID-19, Лунные группы , Ингибитор Полимеразная цепная реакция, Первичная профилактика, Факторы риска, SARS-CoV-2, Инсульт, Вакцинация, Заболевания сосудов
<Вернуться к спискам
COVID-19 — независимый фактор риска острого ишемического инсульта
Аннотация
ИСТОРИЯ И ЦЕЛЬ: Коронавирусная болезнь 2019 (COVID-19) — активная всемирная пандемия с различными осложнениями.Инсульт как презентация не был сильно связан с COVID-19. Авторы стремились ретроспективно рассмотреть связь между COVID-19 и острым инсультом.
МАТЕРИАЛЫ И МЕТОДЫ: Мы провели ретроспективное исследование «случай-контроль» с участием 41 случая и 82 контрольных субъектов, сопоставимых по возрасту, полу и факторам риска. Случаи заболевания — это пациенты, которым в период с 16 марта по 5 апреля 2020 года в 6 больницах Нью-Йорка была проведена визуализация с предупреждением об инсульте с подтвержденным острым инсультом. Контрольными объектами были те, кто прошел диагностику инсульта в течение того же периода времени без визуальных доказательств острого инфаркта.Были собраны данные, касающиеся диагностики инфекции COVID-19, демографических данных пациентов и факторов риска. Был проведен одномерный анализ для оценки ковариативного влияния факторов риска и статуса COVID-19 на визуализацию инсульта с положительными результатами.
РЕЗУЛЬТАТЫ: Средний возраст для случаев и контроля составил 65,5 ± 15,3 года и 68,8 ± 13,2 года, соответственно. Из пациентов с острым ишемическим инсультом у 46,3% была инфекция COVID-19 по сравнению с 18,3% в контрольной группе ( P =.001). После поправки на возраст, пол и факторы риска инфекция COVID-19 имела значительную независимую связь с острым ишемическим инсультом по сравнению с контрольными субъектами (OR, 3,9; 95% ДИ, 1,7–8,9; P = 0,001).
ВЫВОДЫ: Мы продемонстрировали, что инфекция COVID-19 в значительной степени связана с визуальным подтверждением острого ишемического инсульта, и пациенты с COVID-19 должны проходить более агрессивный мониторинг инсульта.
СОКРАЩЕНИЯ:
- COVID-19
- коронавирусная болезнь 2019
- SARS-CoV-2
- Тяжелый острый респираторный синдром коронавирус 2
- ОТ-ПЦР 9098
- Полимераза обратной транскрипции 972 новый коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2) появился в Ухане, Китай. 1 Коронавирусная болезнь 2019 (COVID-19), клиническое проявление инфекции SARS-CoV-2, с тех пор переросла в мировую пандемию. 2 По данным Всемирной организации здравоохранения, по состоянию на 22 апреля 2020 года не менее 2,5 миллиона подтвержденных случаев COVID-19 было выявлено в 213 странах, при этом не менее 169000 пациентов умерли от своего заболевания или его осложнений. 3
С момента первоначальной вспышки в Китае передача была выявлена воздушно-капельным путем и фомитами, при этом первоначально сообщалось о таких симптомах, как лихорадка, одышка, кашель и тяжелая гипоксия.Благодаря большему клиническому опыту появился более широкий спектр симптомов, таких как желудочно-кишечные заболевания, головная боль, изменение психического статуса, аносмия и спутанность сознания. 4 — 6 Острая геморрагическая некротическая энцефалопатия также была отмечена вторично по отношению к инфекции COVID-19. 7
Было известно, что еще до COVID-19 предшествующие респираторные инфекции увеличивали краткосрочный риск ишемического инсульта. 8 — 16 Ранние сообщения из Китая показывают, что неврологические симптомы наблюдаются примерно у 36% пациентов, госпитализированных с COVID-19. 16 Плохие исходы инфекции COVID-19 связаны с сосудистыми факторами риска, такими как гипертония, ишемическая болезнь сердца и сахарный диабет. 17 Было высказано предположение, что вирус SARS-CoV-2 может вызывать цитокиновый шторм через связывание рецептора ангиотензинпревращающего фермента 2, что приводит к состоянию гиперкоагуляции и увеличению частоты тромбозов сосудов у пациентов с COVID-19. 18,19
Насколько нам известно, в литературе не опубликовано рецензируемое исследование, оценивающее частоту острого ишемического инсульта, связанного с COVID-19, при контроле традиционных факторов риска сосудов.В связи с резким увеличением числа пациентов с COVID-19 в Нью-Йорке в марте 2020 года авторы начали наблюдать непропорционально большую частоту инсульта среди пациентов с COVID-19 по сравнению с популяцией, не связанной с COVID-19. Авторы полагают, что между инфекцией COVID-19 и риском инсульта может быть связь. В этом исследовании наши цели заключались в следующем: 1) определить, действительно ли инфекция COVID-19 связана с увеличением частоты инсульта, и 2) оценить, является ли COVID-19 независимым фактором риска инсульта при контроле обычных сосудистых заболеваний. факторы риска.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор пациентов
Проект проводился как ретроспективное исследование «случай-контроль» с данными, собранными из 6 больниц, расположенных в районах Манхэттена, Квинса и Бруклина в Нью-Йорке. Шесть больниц состояли из 1 большой академической больницы и 5 небольших общественных больниц. Утверждение институционального наблюдательного совета было получено в ускоренном порядке. В общей сложности 139 пациентов имели предупреждение об инсульте в связи с острыми неврологическими симптомами в период с 16 марта по 5 апреля 2020 года.Всем пациентам с предупреждением об инсульте выполнялась КТ головы без контрастирования с последующим визуализацией сосудов (обычно КТ-ангиография), если не было медицинских противопоказаний или клинической нестабильности. Пациенты были включены по следующим причинам: 1) у них было активировано предупреждение об инсульте, 2) КТ головы и изображения сосудов и 3) клинические данные, подтверждающие статус COVID-19. Пациенты с первичным кровотечением, опухолью и васкулитом были исключены ( n = 12). Пациенты без клинических данных были исключены ( n = 1).На этом этапе было обследовано 126 пациентов. Пациенты с острым ишемическим инсультом (окклюзия мелких или крупных сосудов) были сопоставлены с пациентами без инсульта по возрасту, полу и основным сосудистым факторам риска в соотношении 1: 2 случай / контроль, что дало 41 случай и 82 контроля. пациенты (3 пациента были исключены из контрольной группы для сохранения этого соотношения). Таким образом, окончательная численность когорты составила 123 пациента. Наличие или отсутствие инсульта было подтверждено на КТ и / или МРТ сертифицированным радиологом, прошедшим стажировку в области нейрорадиологии.Считалось, что у пациентов был острый инсульт при визуализации, если у них была острая потеря серо-белой дифференциации на КТ или ограничивающая диффузию фокусировка на МРТ, соответствующая инфаркту. Если первоначальные результаты КТ были отрицательными, но сохранялось клиническое подозрение на инсульт, оно подтверждалось или опровергалось на МРТ головного мозга, если не было противопоказаний.
Контрольные субъекты были определены как стационарные пациенты и пациенты в отделении неотложной помощи с отрицательными неврологическими результатами визуализации (КТ или МРТ) для острого инсульта в условиях клинического подозрения на острый инсульт.Пациенты с первоначальными отрицательными результатами визуализации наблюдались клинически, а также при повторной визуализации (если это было сочтено клинически необходимым) для подтверждения отсутствия острого инсульта. Факторы сосудистого риска, которые были получены из медицинской документации, включали артериальную гипертензию, ишемическую болезнь сердца, сахарный диабет 2 типа, фибрилляцию предсердий, застойную сердечную недостаточность, дислипидемию, текущий или бывший статус курения, данные о перенесенном инсульте и индекс массы тела, соответствующий избыточный вес (25–29,9 кг / м 2 ) или ожирение (≥30 кг / м 2 ).Данные, относящиеся к одновременному диагнозу инфекции COVID-19 и демографические данные пациентов, также были собраны из электронной медицинской карты. Инфекция COVID-19 была подтверждена с помощью внутренней полимеразной цепной реакции с обратной транскриптазой (RT-PCR) in vitro мазков из носоглотки, выполненной на системах cobas 6800/8800 (Roche Diagnostics) при экстренном разрешении Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. Пациенты считались отрицательными на COVID-19, если результаты теста ОТ-ПЦР были отрицательными.
Статистический анализ
Пациенты, визуализация и клинические данные которых соответствовали острому ишемическому инфаркту, были сопоставлены по возрасту, полу и количеству основных сосудистых факторов риска в сравнении с контрольной группой, визуализация и клинические данные которых не соответствовали острому ишемическому инфаркту. Для каждого случая было по 2 контроля.
Тест Пирсона χ 2 был выполнен для категориальных переменных, а тест t был выполнен для непрерывных переменных для оценки статистической разницы между группами наблюдения и контроля.Все тесты были двусторонними, и значение P 0,05 считалось статистически значимым. Все статистические анализы проводились с помощью статистического пакета SPSS для Windows версии 25 (IBM).
РЕЗУЛЬТАТЫ
Клинические характеристики популяции пациентов
Предупреждения об инсульте чаще всего активировались у пациентов с гемиплегией, потерей полусенсора, дизартрией, опущением лица, афазией и острым измененным психическим статусом. Наша популяция пациентов состояла из 123 пациентов, из которых 41 пациент с острым ишемическим инсультом (переднее или заднее кровообращение) был сопоставлен по возрасту, полу и факторам риска сосудистых заболеваний с 82 пациентами без инсульта.Средний возраст для случаев и контроля составлял 65,5 ± 15,3 года и 68,8 ± 13,2 года соответственно. Половой состав был идентичным между группами, по 56,1% мужчин в каждой.
Анализ факторов риска
Не было статистически значимых различий по возрасту, полу или основным сосудистым факторам риска между группами пациентов и контрольной группой (таблица). Инфекция COVID-19 была подтверждена у 19 из 41 пациента (46,3%) с острым ишемическим инсультом, по сравнению с 15 из 82 пациентов (18,3%) в контрольной группе.Частота инфицирования COVID-19 была значительно выше у пациентов с острым ишемическим инсультом по сравнению с контрольными субъектами ( P = 0,001).
Демографические характеристики пациентов с острым ишемическим инсультом
После того, как мы скорректировали возраст, пол и основные сосудистые факторы риска, было установлено, что инфекция COVID-19 независимо и значимо связана с пациентами с острым ишемическим инсультом по сравнению с контрольными субъектами с OR 3,9 (95% ДИ 1,7–8,9; P =.001).
ОБСУЖДЕНИЕ
Мы обнаружили, что COVID-19 является независимым фактором риска острого ишемического инсульта, подтвержденного визуализацией, во время оценки предупреждений об инсульте после учета традиционных сосудистых факторов риска. Это открытие предполагает, что инфекция COVID-19 связана с повышенной заболеваемостью и смертностью, которые превосходят основные сердечно-легочные последствия инфекции. Было замечено, что у большого числа пациентов, инфицированных COVID-19, имеется сопутствующее сосудистое заболевание.В метаанализе 6 опубликованных исследований из Китая, включающих 1527 пациентов с COVID-19, сообщается о распространенных сопутствующих заболеваниях, включая диабет (9,7%), сердечно-сосудистые заболевания (16,4%) и гипертонию (17,1%). 20 В частности, у пациентов с тяжелой формой COVID-19 частота сердечно-сосудистых заболеваний в 3 раза выше, чем у пациентов с легкой и средней степенью заболевания.
В многочисленных исследованиях сообщалось, что недавние респираторные инфекции, как известно, повышают краткосрочный риск ишемического инсульта. 8,9,11,12,14,15 Например, Грау и др. 11 сообщили, что бактериальные и вирусные инфекции являются факторами риска эмболических и тромботических инфарктов. Они обнаружили, что инфекция в течение предыдущей недели была фактором риска церебральной ишемии в анализе множественной логистической регрессии с поправкой на возраст (OR 2,9; 95% ДИ 1,31–6,4). Из 221 пациента с COVID-19 в больнице в Ухане у 20 11 (5%) развился острый ишемический инсульт. Эта группа пациентов была значительно старше и чаще имела факторы риска сердечно-сосудистых заболеваний и тяжелую инфекцию COVID-19.У них была более вероятно повышенная воспалительная реакция и состояние гиперкоагуляции, проявляющееся повышенными уровнями С-реактивного белка и D-димера. 21
В нашем исследовании делается попытка оценить влияние COVID-19 на инсульт независимо от других сосудистых факторов риска. Пациенты с острым инсультом и пациенты из контрольной группы без инсульта принадлежали к одной и той же медицинской системе и клиническому учреждению. Наше исследование подтверждает, что частота острого ишемического инсульта у пациентов с инфекцией COVID-19 была значительно выше, чем у пациентов без инфекции.После того, как мы скорректировали основные сосудистые факторы риска, диагноз COVID-19 был связан со значительно большим количеством случаев, чем у контрольных субъектов.
Несколько теорий связывают инфекционные / воспалительные синдромы с повышенным риском инсульта, вероятно, из-за различных механизмов, включающих протромботическое состояние, изменения липидного обмена и агрегацию тромбоцитов, изменения функции эндотелия, а также нестабильность и разрыв бляшек. 22,23 Текущий предпочтительный механизм включает связывание SARS-CoA-2 с рецептором ангиотензинпревращающего фермента 2, что может привести к цитокиновому шторму и, в конечном итоге, к состоянию гиперкоагуляции у пациентов с COVID-19. 18,19 Кроме того, у тяжелобольных пациентов с SARS-CoV-2 часто наблюдаются повышенные уровни D-димера и количество тромбоцитов, что может сделать пациентов предрасположенными к острым цереброваскулярным заболеваниям. 24 На модели гриппа мышей было показано, что после селективного блокирования цитокинов наблюдалось уменьшение объема инфаркта и улучшение выживаемости. 25
Ограничения нашего исследования — это те, которые применяются ко всем ретроспективным исследованиям случай-контроль. Мы попытались ограничить смешанные переменные, такие как демографические данные и медицинские факторы риска инсульта, чтобы уменьшить систематическую ошибку.Мы уменьшили систематическую ошибку направления к специалистам, включив случаи предупреждения об инсульте из нескольких больниц из разных сообществ Нью-Йорка. Еще одно ограничение — размер нашей выборки в 123 пациента; тем не менее, это все пациенты с предупреждениями об инсульте, поступившие в 6 больниц, в том числе 1 крупную академическую больницу и 5 более мелких общественных больниц, в течение короткого промежутка времени, составляющего 2,5 недели. Кроме того, возможно, что некоторые пациенты с клиническими и радиологическими признаками инфекции, которые дали положительный результат на COVID-19 при ОТ-ПЦР, могли быть ложноположительными и иметь вместо этого другие вирусные или бактериальные респираторные инфекции.
Чувствительность и специфичность теста ОТ-ПЦР, используемого для диагностики COVID-19, окончательно не установлены, поскольку тест одобрен при разрешении на использование в экстренных случаях. Также возможно, что мы занижали количество пациентов с COVID-19 (т. Е. Клинически бессимптомных носителей, которые не тестировались на COVID-19), но это могло повлиять как на инсульт, так и на исходы без инсульта. Наконец, еще одним важным соображением является возможность неожиданного смещения отбора с более высокими порогами для представления в больницу из-за социального дистанцирования / страха перед больничными условиями во время пандемии.Это в сочетании с общей повышенной распространенностью COVID-19 может искажать истинное влияние COVID-19 на риск инсульта.
ВЫВОДЫ
Насколько нам известно, это первое исследование, которое связывает SARS-CoV-2 с повышенным риском подтвержденного визуализацией острого ишемического инсульта при учете смешанных факторов риска. Будущие усилия могут оценить, сохраняется ли эта взаимосвязь в большей популяции и с патофизиологическими механизмами (такими как провоспалительное протромботическое состояние и цитокиновый шторм), присущими COVID-19, которые определяют эту связь.Следует также попытаться увидеть, верна ли эта ассоциация для инсультов больших и малых сосудов. Пациентов с COVID-19 следует на ранней стадии обследовать на предмет острых неврологических изменений, а пациентам с подозрением на инсульт следует проводить своевременное обследование для снижения заболеваемости и смертности.
Сноски
Раскрытие информации: Брэдли Н. Делман — НЕ СВЯЗАННО : Оплата лекций, включая услуги бюро докладчиков : Bayer HealthCare Pharmaceuticals, Комментарии : специальные лекции, в среднем 1 в год.Дэниел Левон — НЕ СВЯЗАННЫЕ: Показания эксперта: Разное.
- Поступила 23 апреля 2020 г.
- Принята после доработки 17 мая 2020 г.
- © 2020 Американский журнал нейрорадиологии
Острый ишемический инсульт — Национальный фонд основания черепа
Внутриартериальное лечение для острого ишемического инсульта (AIS)
Ишемический инсульт является наиболее распространенным типом и составляет 87% всех инсультов. [1] Это происходит из-за закупорки кровеносных сосудов, как правило, тромбом или жировыми отложениями. При лечении острого ишемического инсульта (AIS) основной целью является быстрое восстановление кровотока путем растворения сгустка с помощью лекарств, разрывающих сгусток, или путем физического удаления сгустка с помощью внутриартериального лечения. Лекарства, разрушающие сгустки, такие как внутривенный тканевый активатор плазминогена (t-PA), можно вводить в течение 4,5 часов с момента появления симптомов. Некоторые пациенты могут не иметь права на получение t-PA из-за болезни, заболеваний крови, недавней операции или одновременного приема других лекарств, которые могут влиять на эффекты t-PA.Из-за узкого окна лечения t-PA и его эффективности у небольшого процента пациентов с окклюзией крупных сосудов оптимальным лечением AIS является внутриартериальное лечение, которое представляет собой метод введения катетеров в кровеносные сосуды головного мозга и растворения сгустка. путем местного внутриартериального t-PA или путем физического удаления сгустка, что называется механической тромбэктомией. (см. рисунок):
Тромбэктомия может выполняться с использованием аспирационных устройств или ретриверов с максимальной эффективностью, если она выполняется в течение 6 часов после появления симптомов инсульта.(см. рисунок) В некоторых исследованиях механическая тромбэктомия показала хороший клинический результат, если она была проведена в течение 8 часов после начала инсульта. [2] Эффективность механической тромбэктомии за 8 часов до начала инсульта неизвестна.
Лечение ишемического инсульта является зависимым, и основная цель механической тромбэктомии — восстановить кровоток путем устранения закупорки пораженного кровеносного сосуда головного мозга.
Рисунок: Механическая тромбэктомия при остром ишемическом инсульте из-за сгустка крови (Изображение любезно предоставлено Stryker Neurovascular)
Рисунок: Развитие острой ишемии с помощью механической тромбэктомии с использованием ретривера (Изображение любезно предоставлено Stryker Neurovascular)Слева ICA
Рисунок: , Сгусток MCA и ACA на церебральной ангиограмме (A) До механической тромбэктомии (B) После механической тромбэктомии
Рисунок: Сгусток крови, удаленный стент-ретриверомСсылки
- American Heart Association. Обзор сердечных заболеваний и инсульта за 2017 год.
- Уолгрен, Н., Мачо, Дж. Киллер М., Либескинд Д., Янсен О. Окончательные результаты исследования Трево (реваскуляризация тромбэктомии окклюзии крупных сосудов при остром ишемическом инсульте). Международная конференция по инсульту, 2012 г.
Что такое острый (или внезапный) инсульт?
Острый инсульт, как и большинство других форм инсульта, начинается внезапно и быстро ухудшается.Некоторым инсультам может предшествовать транзиторная ишемическая атака (ТИА), временный инсульт, который проходит до того, как вызовет какие-либо длительные эффекты. Узнав больше о признаках, симптомах и прогнозе, вы сможете подготовиться к распознаванию инсульта, а также будете готовы к дальнейшей жизни.
utah778 / Получение изображенийТипы острого инсульта
Острые инсульты классифицируются одним из двух способов:
Ишемический инсульт
Во время ишемического инсульта прекращается кровоснабжение определенной области мозга, поскольку кровеносный сосуд заблокирован сгустком крови.Несколько состояний могут предрасполагать человека к ишемическому инсульту, включая болезнь сердца, высокий уровень холестерина и высокое кровяное давление. Другие причины ишемического инсульта включают употребление рекреационных наркотиков (в частности, алкоголя, кокаина и героина), нарушения свертываемости крови. , или травма кровеносных сосудов шеи.
Геморрагический инсульт
Геморрагический инсульт возникает при кровотечении из артерии в головном мозге. Это может произойти при разрыве артерии аномальной формы, например, при артериальной венозной мальформации (АВМ) или при разрыве аневризмы.Кровь, которая просачивается в мозг при кровотечении из кровеносного сосуда, вызывает повышение давления внутри черепа, сдавливая мозг и потенциально вызывая необратимое повреждение мозга.
Симптомы
Симптомы инсульта могут быстро прогрессировать, но могут усиливаться и уменьшаться в течение нескольких часов. Невозможно предсказать, насколько серьезным станет инсульт или как долго он будет сохраняться.
Наиболее частые симптомы острого инсульта включают:
- Онемение или слабость с одной стороны тела
- Затруднения при разговоре или трудности с пониманием того, что говорят другие
- Проблемы со зрением или потеря зрения
- Нарушение равновесия или координации
- Затруднения при ходьбе или падении
- Внезапная сильная головная боль, характеризующаяся ригидностью шеи, лицевой болью, болью между глазами и рвотой
- Путаница
TIA: Предупреждающий знак
Преходящая ишемическая атака похожа на инсульт, но симптомы исчезают, не вызывая необратимого повреждения мозга.Если у вас ТИА, вероятно, у вас есть хотя бы один фактор риска инсульта. У большинства людей, перенесших ТИА, инсульт будет в течение трех-шести месяцев, если факторы риска не будут выявлены и обработаны.
Причины и факторы риска
Острый инсульт вызывается прерыванием кровотока в определенной области головного мозга. Он может быть ишемическим или геморрагическим.
Ишемический инсульт
Во время ишемического инсульта прекращается кровоснабжение определенной области мозга, поскольку кровеносный сосуд заблокирован сгустком крови.Несколько состояний могут предрасполагать человека к ишемическому инсульту. Эти состояния включают сердечные заболевания, высокий уровень холестерина и высокое кровяное давление. Другие причины ишемического инсульта включают употребление рекреационных наркотиков, нарушения свертываемости крови или травмы кровеносных сосудов шеи.
Геморрагический инсульт
Геморрагический инсульт возникает при кровотечении из артерии в головном мозге. Это может произойти, когда артерия неправильной формы, например, артериальная венозная мальформация (АВМ) или аневризма, разрывается.Кровь, которая просачивается в мозг при кровотечении из кровеносного сосуда, вызывает повышение давления внутри черепа, сдавливая мозг и потенциально вызывая необратимое повреждение мозга.
Факторы риска
Многие факторы риска инсульта можно устранить, изменив образ жизни. Эти факторы риска включают болезни сердца, высокое кровяное давление, высокий уровень холестерина, курение и диабет. Дополнительные факторы риска инсульта включают следующее:
- Предыдущий ход или TIA
- Предыдущий инфаркт
- В семейном анамнезе инсульт
- Ожирение
- Болезнь сонной артерии
- Малоподвижный образ жизни / малоподвижный образ жизни
- Использование противозачаточных таблеток или другой гормональной терапии
- Беременность
- Пьянство или запой
- Рекреационное употребление наркотиков
Диагностика
Если вы испытываете симптомы острого инсульта или находитесь с кем-то, у кого вы подозреваете инсульт, немедленно обратитесь за медицинской помощью в ближайшее отделение неотложной помощи.Медицинская бригада проведет неврологическое обследование, чтобы подтвердить диагноз инсульта.
Скорее всего, за этим последуют различные визуализационные тесты для определения причины инсульта и составления плана лечения, например:
- Компьютерная томография (КТ) головы для поиска кровотечения или повреждения клеток головного мозга
- Магнитно-резонансная томография (МРТ) головного мозга для выявления изменений в головном мозге, кровотечения и исключения таких проблем, как опухоль, как источника симптомов
- КТ или МР-ангиограмма — рентгеновский снимок, который показывает, как течет кровь с помощью красителя, вводимого в артерии и вены.
- УЗИ сонных артерий , кровоснабжающих головной мозг. Используя звуковые волны, этот тест может показать, блокирует ли скопление налета кровоток.
- Транскраниальный допплер (TCD) УЗИ, еще один тест с использованием звуковых волн для определения места закупорки артерии.
- Электроэнцефалограмма (ЭЭГ), запись электрической активности головного мозга для исключения припадка.
- Электрокардиограмма (ЭКГ или ЭКГ) для записи электрической активности сердца.Это может помочь определить, могла ли фибрилляция предсердий (нерегулярная частота сердечных сокращений) стать причиной инсульта.
Также могут проводиться анализы крови:
- Общий анализ крови (CBC), , который может помочь обнаружить инфекцию, анемию или проблемы со свертыванием крови
- Электролиты сыворотки, , которые могут исключить проблемы с электролитами, которые могут вызывать симптомы, похожие на инсульт, а также выявить любые проблемы с почками
- Панель коагуляции для измерения скорости свертывания крови
- Тесты на сердечный приступ — особенно важны для женщин, у многих из которых симптомы сердечного приступа сочетаются с симптомами инсульта
- Тесты щитовидной железы: Повышенный уровень гормонов щитовидной железы (гипертиреоз) может увеличить риск фибрилляции предсердий.
- Уровень глюкозы в крови: Низкий уровень сахара в крови, частое осложнение приема лекарств от диабета, может вызывать симптомы, похожие на инсульт.
- Тесты на холестерин , чтобы определить, мог ли высокий холестерин спровоцировать инсульт
- Тест на С-реактивный белок и тест на белок крови для поиска признаков воспаления, указывающих на повреждение артерий
Процедуры
Острый ишемический инсульт потенциально поддается лечению с помощью ряда медицинских методов лечения, включая мощное лечение, называемое тканевым активатором плазминогена (t-PA).Это лечение эффективно, если инсульт быстро диагностируется и оценивается, а лечение можно начинать в течение нескольких часов после появления симптомов.
Для лечения острого геморрагического инсульта может использоваться комбинация хирургии кровеносных сосудов и лекарств для остановки кровотечения. Лечение может включать процедуры, включающие клипирование разорванной аневризмы или эндоваскулярную эмболизацию, при которой спираль вводится в аневризму для уменьшения кровоток.
Слово от Verywell
Нет никаких сомнений в том, что инсульт может иметь потенциально изменяющие жизнь последствия, особенно если симптомы не очевидны сразу и лечение откладывается.Тем не менее, своевременное лечение инсульта, скорее всего, приведет к положительному исходу. И хотя восстановление после острого инсульта требует времени, существует множество методов лечения, посвященных реабилитации после инсульта, а также разрабатываются многообещающие новые подходы, такие как электротерапия и зеркальная терапия, которые, вероятно, сделают эти положительные результаты еще более вероятными.
4. Отделение неотложной помощи и ведение пациентов с острым инсультом и TIA
Таблица доказательств 4
Первоначальная оценка
Пациенты требуют немедленного обследования при обращении в отделение неотложной помощи (ED) с подозрением на инсульт или транзиторную ишемическую атаку (ТИА).Для пациентов с ТИА можно оценить риск неминуемого инсульта (то есть в течение одной недели) и начать исследования / лечение для предотвращения инсульта в будущем. Стандартные обследования пациентов с подозрением на острый инсульт включают неврологическое обследование, мониторинг основных показателей жизнедеятельности, анализ крови, визуализацию и сердечно-сосудистые исследования, скрининг на дисфагию и оценку судорог. Также важно выявлять пациентов, которые «имитируют» ТИА, чтобы избежать ненужных и дорогостоящих исследований, неправильной диагностической маркировки и ненадлежащего долгосрочного профилактического лечения.У пациентов с симптомами инсульта в конечном итоге могут быть диагностированы другие состояния, такие как мигренозная головная боль, головокружение, метаболические нарушения, опухоли головного мозга, предобморочное состояние / обморок или тревога (Karliński et al.2015, Lee & Frayne 2015). По оценкам, процент лиц, имитирующих инсульт, среди пациентов, поступающих в отделение неотложной помощи с острыми симптомами, составляет примерно 30% (Goyal et al., 2016, Merino et al., 2013).
Нейроваскулярная визуализация
Немедленный доступ к изображениям головного мозга и сосудов необходим всем пациентам, поступающим в больницу с подозрением на инсульт или ТИА.Неконтрастная компьютерная томография считается стандартом визуализации, который первоначально используется для выявления острого ишемического инсульта и исключения внутричерепного кровоизлияния. КТ выполняется быстро, легко переносится и, как известно, очень надежна для обнаружения внутримозгового кровоизлияния. Раннее обнаружение кровотечения имеет важное значение, поскольку наличие крови в головном мозге или субарахноидальном пространстве является основным противопоказанием для приема аспирина, антикоагулянтов и тромболитической терапии. Ранняя визуализация особенно важна для пациентов, которые могут быть потенциальными кандидатами на тромболитическую терапию, поскольку она имеет узкое терапевтическое окно для введения.Wardlaw et al. (2004) обнаружили, что сканирование компьютерной томографии (КТ) для всех пациентов с подозрением на инсульт при поступлении в больницу было наиболее рентабельной стратегией, несмотря на повышенную стоимость сканирования, выполняемого в нерабочее время. Более высокие затраты были компенсированы экономией, полученной за счет сокращения продолжительности пребывания в больнице.
КТ-ангиография (КТА) должна выполняться как часть первоначального протокола КТ-визуализации острого инсульта. Это быстро, просто и помогает идентифицировать пациентов с небольшими центральными инфарктами (ASPECTS 6 или выше) в переднем круге кровообращения, которым следует рассмотреть возможность эндоваскулярной терапии.По сравнению с однофазной КТА рекомендуется либо многофазная, либо динамическая КТА, поскольку первая может использоваться для оценки как внутричерепной артериальной окклюзии, так и пиального артериального коллатерального кровообращения (Menon et al. 2015). Наличие адекватных пиальных коллатералей может предсказать лучший ответ на реперфузию и исходы у пациентов с острым ишемическим инсультом (Christoforidis et al. 2005). КТА хорошо переносится с очень низким риском аллергической реакции или почечной недостаточности при введении контрастного вещества и фармакологически не взаимодействует с t-PA.
КТ-перфузия (CTP) — еще один передовой метод компьютерной томографии, который можно использовать для определения размера ядра инфаркта (на основе карт объема церебральной крови [CBV]) и ишемической полутени (с использованием мозгового кровотока [CBF] или временных карт). CTP использовался в недавних испытаниях эндоваскулярной терапии для выявления пациентов, которые были кандидатами на лечение. В исследовании EXTEND-IA (Campbell et al. 2015) для включения требовалось 20% несоответствия между основным инфарктом и ишемической полутенью, идентифицированным с помощью CTP. Из-за различий в программном обеспечении поставщиков конкретные пороговые значения CBV для размера сердечного инфаркта не стандартизированы.Использование CTP для пациентов с острым инсультом должно быть зарезервировано для центров с хорошо известными протоколами CTP и опытом интерпретации CTP или использования программного обеспечения для количественного анализа CTP, и не должно существенно откладывать принятие решений о лечении острого инсульта.
Хотя КТ рекомендуются для первоначальной визуализации головного мозга после инсульта, есть случаи, когда магнитно-резонансная томография (МРТ) с диффузионно-взвешенными последовательностями (DWI) может быть лучше. Было показано, что МРТ более чувствительна в обнаружении ранних изменений, связанных с ишемией, особенно у пациентов с небольшими инфарктами.Используя результаты 8 исследований, Brazzelli et al. (2009) сообщили, что чувствительность магнитно-резонансной томографии (МРТ) для выявления ишемического инсульта может быть выше, чем у КТ (99% против 39%), хотя авторы подвергли сомнению обобщаемость своих результатов. Если МРТ доступна и выполняется вместо КТ, показаны улучшенные изображения в форме DWI, GRE и FLAIR. Brunser et al. (2013) включили 842 пациента, поступивших в отделение неотложной помощи с подозрением на ишемический инсульт.Для всех пациентов были выполнены исследования с диффузионно-взвешенной визуализацией (DWI). Для пациентов с окончательным диагнозом инсульта чувствительность DWI в выявлении ишемического инсульта составила 90% (95% ДИ 87,9–92,6), а специфичность — 97% (95% ДИ 91,8–99,0).
Сердечно-сосудистые исследования
Электрокардиограмма (ЭКГ) должна быть выполнена немедленно для выявления аритмий у всех пациентов с инсультом и ТИА, поступающих в отделение неотложной помощи. Фибрилляция предсердий (ФП) обычно диагностируется после инсульта и вызывает особую озабоченность из-за ее роли в формировании эмболов.Sposato et al. (2015) включили результаты 11 исследований, в которых кардиологический мониторинг был начат в отделении неотложной помощи. По оценкам, 7,7% пациентов без ФП в анамнезе были диагностированы впервые. Suissa et al. (2012) включили 946 пациентов с ишемическим инсультом без ФП в анамнезе и обнаружили, что вероятность обнаружения была наибольшей в течение первых 24 часов после инсульта (OR = 9,82; 95% ДИ от 3,01 до 32,07). Пациенты, которые получали группу непрерывного кардиологического мониторинга, с большей вероятностью были идентифицированы с ФП по сравнению с теми, кто получил исходную ЭКГ, 24-часовой холтеровский монитор и дополнительные ЭКГ при необходимости (прил. OR = 5.29; 95% ДИ от 2,43 до 11,55). Независимо от типа используемого мониторинга, исходная ЭКГ не всегда выявляет все случаи ФП. В том же исследовании было обнаружено, что мониторинг ЭКГ за пределами исходной оценки привел к выявлению дополнительных случаев ФП у 2,3–14,9% населения (Suissa et al. 2012). Использование серийных оценок ЭКГ в течение первых 72 часов после инсульта может быть эффективным средством диагностики ФП. Например, Douen et al. (2008) сообщили, что не было значительной разницы в частоте выявления между группами кардиологического мониторинга.ФП была выявлена у 15 новых пациентов с помощью серийной ЭКГ и у 9 новых пациентов с помощью монитора Холтера. Большинство этих случаев были выявлены в течение 72 часов (83%).
Использование чреспищеводной эхокардиографии (TEE) показано при подозрении на поражение сердечной эмболии. Было обнаружено, что у пациентов с неизвестной причиной инсульта после исходных диагностических оценок и без противопоказаний к антикоагулянтной терапии ЧЭЭ позволяет выявить возможные источники сердечной эмболии (de Bruijn et al.2006 г.). У 231 пациента с недавним инсультом (всех типов) или ТИА было обнаружено, что ЧЭЭ значительно лучше, чем трансторакальная эхокардиография (ТТЭ) при выявлении возможных источников сердечной эмболии (55% против 39%). Среди 39 пациентов младше 45 лет потенциальный сердечный источник был выявлен у 13 пациентов. Из них аномалия была выявлена с помощью TEE в 10 случаях и в 3 случаях с помощью TTE. Среди 192 пациентов старше 45 лет потенциальный источник эмболии сердца был выявлен у 59% пациентов.TEE подтвердила потенциальный сердечный источник у 34 пациентов, но также выявила потенциальный кардиоэмболический источник еще у 80 пациентов.
Управление острым артериальным давлением
Нет данных, свидетельствующих о том, что вмешательства по устранению сильных отклонений артериального давления с помощью вазоактивных препаратов помогают улучшить исход инсульта. В исследовании CATIS (He et al., 2014) 4071 пациент с острым ишемическим инсультом были рандомизированы для получения или отказа от антигипертензивной терапии во время госпитализации.Хотя среднее систолическое артериальное давление было значительно ниже среди пациентов в группе вмешательства, лечение не было связано со значительным снижением риска смерти или серьезной инвалидности ни через 14 дней (OR = 1,00, 95% ДИ от 0,88 до 1,14), ни за 3 дня. месяцев (OR = 0,99, 95% ДИ 0,86–1,15) после включения в исследование. В двух Кокрановских обзорах изучалась потенциальная польза от искусственного повышения и понижения артериального давления с помощью вазоактивных препаратов в течение первой недели после инсульта. Один из обзоров ограничивался включением РКИ и включал результаты 12 исследований (Geeganage & Bath, 2008), а другой также включал не РКИ (Geeganage & Bath, 2010).В обоих обзорах в центре внимания большинства включенных исследований было снижение артериального давления. Лечение было связано со значительным ранним и поздним снижением САД и ДАД, но не было связано со значительным снижением риска смерти или неблагоприятного исхода в течение одного месяца или в конце периода наблюдения. Однако использование вазоактивных препаратов, используемых для повышения артериального давления, значительно увеличило шансы смерти или инвалидности в конце испытания (OR = 5,41; 95% ДИ 1,87–15,64) (Geeganage & Bath, 2010).Дальнейшие данные мета-регрессионного исследования (Geeganage & Bath, 2009), в которое вошли результаты 37 исследований, также предполагают, что большие изменения артериального давления в раннем постинсультном периоде связаны с повышенным риском смерти и комбинированным исход смерти / зависимости. Хотя авторы также предположили, что снижение артериального давления между 8 и 14,6 мм рт. Ст. Было связано с наименьшими шансами неблагоприятного исхода (смерть, зависимость и внутримозговое кровоизлияние), результаты не были статистически значимыми.(Geeganage & Bath, 2009).
Пациентам, лечившимся тромболизисом, может быть показано снижение артериального давления, когда оно сильно повышено (например, САД ≥220 мм рт. Ст. Или ДАД ≥120 мм рт. Ст.). Используя результаты 11080 пациентов, включенных в исследование SITS-ISTR, которые лечились тромболизисом, Ahmed et al (2009) сообщили, что высокое систолическое АД через 2–24 часа после тромболизиса было связано с худшим исходом (p> 0,001). Артериальное давление выше 170 мм рт. Ст. Было связано с более высокими шансами смерти, зависимости и последующего кровотечения по сравнению с артериальным давлением между 141 и 150 мм рт.Результаты исследования ENCHANTED, проведенного в группе снижения артериального давления, после публикации предоставят дополнительную информацию для руководства лечением пациентов.
Контроль уровня глюкозы
Исходная гипергликемия была определена как независимый предиктор неблагоприятного исхода инсульта и может быть маркером увеличения тяжести инсульта. Наличие гипергликемии может вызывать особую озабоченность у пациентов без преморбидного диабета в анамнезе. Используя данные пациентов из исследования ECASS II, Yong & Kaste (2008) изучили связь между исходами инсульта и четырьмя моделями уровня глюкозы в сыворотке крови в течение первых 24 часов после инсульта.Среди 161 пациента с преморбидным диабетом шансы на плохой исход не были значительно увеличены для пациентов со стойкой гипергликемией или среди пациентов с гипергликемией через 24 часа по сравнению с пациентами с стойкой нормогликемией. Однако среди 587 людей, не страдающих диабетом, пациенты со стойкой гипергликемией испытали значительно худшие результаты по сравнению с пациентами со стойкой нормогликемией. Шансы на хороший функциональный результат через 30 дней, минимальную нетрудоспособность через 90 дней или неврологическое улучшение через 7 дней были значительно снижены по сравнению с пациентами со стойкой нормогликемией, в то время как вероятность 90-дневной смертности и паренхиматозного кровоизлияния значительно увеличилась.Поскольку первоначальная гипергликемия была связана с плохим исходом инсульта, в нескольких исследованиях оценивалась потенциальная польза жесткого контроля уровня глюкозы в крови на раннем этапе после инсульта. Самым крупным из таких исследований было исследование GIST-UK (Gray et al., 2007), в котором 899 пациентов были рандомизированы для получения инсулина, глюкозы, калия, инсулина с переменной дозой инсулина (GKI) для поддержания концентрации глюкозы в крови в пределах 4-7 ммоль / л или физиологического раствора ( контроль) в виде непрерывной внутривенной инфузии в течение 24 часов. Для пациентов контрольной группы, если капиллярная глюкоза> 17 ммоль / л, можно было начинать инсулинотерапию по усмотрению лечащего врача.Лечение GKI не было связано со значительным снижением 90-дневной смертности (OR = 1,14; 95% CI от 0,86 до 1,51; p = 0,37) или с предотвращением тяжелой инвалидности (OR = 0,96; 95% CI от 0,70 до 1,32). Спасательная декстроза была назначена 15,7% пациентов, получавших GKI, по поводу бессимптомной длительной гипогликемии. Исследование было преждевременно прекращено из-за медленного набора. Совсем недавно Россо и др. (2012) рандомизировали 120 пациентов для внутривенного введения инсулина (ИИТ) на постоянной основе или подкожного введения (каждые 4 часа) в течение 24 часов (ВИТ).Точка остановки лечения была <5,5 ммоль / л в группе IIT и 8 ммоль / л в группе SIT. Хотя значительно большее количество пациентов в группе ИИТ достигло и поддерживало средний уровень глюкозы в крови <7 ммоль / л, средний размер инфаркта был значительно выше среди пациентов в группе ИИТ (27,9 против 10,8 см3, p = 0,04 ), было значительно больше случаев бессимптомной гипогликемии среди пациентов в группе ИИТ (8 против 0, p = 0,02), и не было значительной разницы в количестве пациентов, у которых был хороший исход (45.6% против 45,6%) или смерть (15,6% против 10,0%) через 3 месяца. В Кокрановском обзоре (Bellolio et al., 2014) использованы результаты 11 РКИ с участием 1583 взрослых пациентов с уровнем глюкозы в крови> 6,1 ммоль / л, полученные в течение 24 часов после инсульта.
