Инсульт химический: Ишемический инсульт: прогнозы, последствия и реабилитация
Перспективы лечения больных, перенесших ишемический инсульт: место и роль цитофлавина
Одной из главных социально значимых проблем здравоохранения в третьем тысячелетии остается церебральный инсульт [2, 5, 12]. Летальность среди лиц, перенесших инсульт, к концу 1-го года заболевания высока [8]. В последнее десятилетие наблюдается тенденция к повышению частоты инсульта в молодом возрасте [6, 15]; треть заболевших — лица трудоспособного возраста, из которых к труду возвращаются лишь 15-20%, остальные остаются инвалидами, требующими постоянной медико-социальной поддержки [9, 14].
Известно, что острый период ишемического инсульта протекает на фоне окислительного стресса (ОС) [4]. ОС сопровождается интенсивной генерацией активных форм кислорода (АФК), обладающих выраженным токсическим действием, что проявляется в окислительной деструкции белков, липидов, нуклеиновых кислот. Параллельно отмечается снижение активности антиоксидантной защиты (АОЗ).
Процесс интенсификации свободнорадикального окисления и развитие ОС в настоящее время признаны универсальным общебиологическим механизмом при развитии любого вида патологии.
Состоянию гипоксии/ишемии мозга и роли ОС при острых инсультах посвящены многочисленные экспериментальные работы, в которых четко выявлены нарушения баланса между анти- и прооксидантной системами в сторону усиления последней [1, 23]. Роль ОС у больных с последствиями церебральных инсультов остается малоизученной. Фактически отсутствуют работы, в которых проводился бы анализ интенсивности ОС и его связи с характером клинических проявлений в постинсультном периоде. В связи с увеличением распространенности сосудистых церебральных нарушений и их тяжелыми последствиями одной из важнейших задач неврологии является поиск новых подходов к лечению клинических проявлений последствий инсультов, одним из которых является применение антиоксидантной терапии.
Роль ОС у больных с последствиями церебральных инсультов остается малоизученной. Фактически отсутствуют работы, в которых проводился бы анализ интенсивности ОС и его связи с характером клинических проявлений в постинсультном периоде. В связи с увеличением распространенности сосудистых церебральных нарушений и их тяжелыми последствиями одной из важнейших задач неврологии является поиск новых подходов к лечению клинических проявлений последствий инсультов, одним из которых является применение антиоксидантной терапии.
Целью данного исследования явилось изучение состояния анти- и прооксидантной систем у больных, перенесших ишемический инсульт, в зависимости от неврологических проявлений заболевания, а также оценка эффективности влияния препаратов цитофлавин и кортексин, обладающих антиоксидантными и антигипоксантными свойствами, на неврологические симптомы и параметры ОС.
Материал и методы
В исследовании участвовали 80 человек, из них 60 больных, 26 мужчин и 34 женщины, в возрасте от 52 до 79 лет (средний — 65,13±0,84 года), перенесших ишемический инсульт в каротидном и вертебрально-базилярном бассейнах давностью от 10 мес до 5 лет, и 20 практически здоровых пожилых людей в возрасте от 52 до 72 лет, составивших контрольную группу.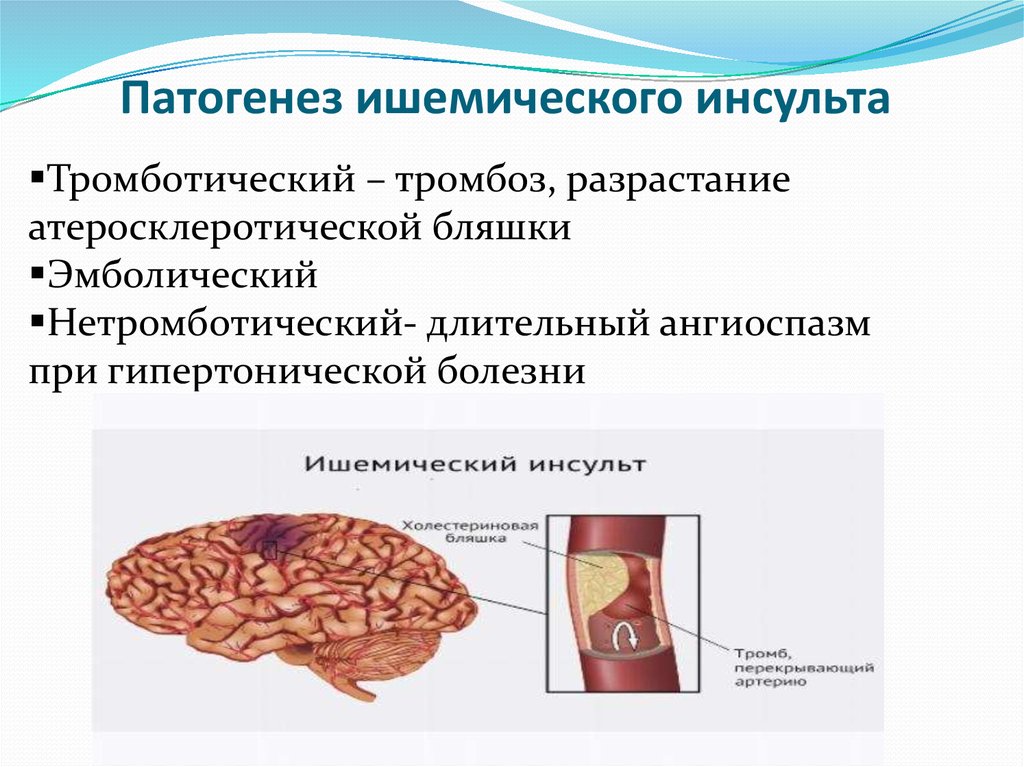
Длительность заболевания в группе больных в среднем была 2,4±0,3 года. Все лица из группы контроля не имели жалоб на состояние здоровья, были физически активны, продолжали работать, психические и когнитивные функции у них оставались сохранными.
Всем больным проводилось комплексное обследование, включающее неврологический осмотр, общие анализы крови и мочи, биохимический анализ крови, ЭКГ, МРТ головного мозга, транскраниальную допплерографию (ТКДГ) и биохимические исследования анти- и прооксидантной систем.
Для интегративной оценки функциональных возможностей больных, перенесших инсульт, использовались индекс активности повседневной жизни Бартель (Barthel ADL Index) и шкала Рэнкина (Rankin Scale). Нейропсихологическое обследование включало определение степени выраженности и характера функционирования основных психических процессов (память, внимание, мышление, умственная работоспособность), а также выявление особенностей эмоционально-психологического статуса обследуемых. Исследование осуществляли с помощью стандартных нейропсихологических тестов (проба «10 слов», тест зрительной ретенции Бентона, таблицы Шульте, методики «Исключение лишнего», «Классификация», корректурные пробы, личностный опросник MMPI).
Исследование осуществляли с помощью стандартных нейропсихологических тестов (проба «10 слов», тест зрительной ретенции Бентона, таблицы Шульте, методики «Исключение лишнего», «Классификация», корректурные пробы, личностный опросник MMPI).
В крови больных до и после лечения оценивали показатели ОС. Активность прооксидантной системы исследовали с помощью методов: люминол-зависимой хемилюминесценции (ХЛ) цельной крови по методике
C. Fasmon и соавт. [22], определения малонового диальдегида (МДА) — конечного продукта перекисного окисления липидов (ПОЛ) по методу В.Б. Гаврилова и соавт. [3]. Активность антиоксидантной системы оценивали путем определения восстановленного и окисленного глутатиона по методу В.П. Чернышoва [19], специфической активности супероксиддисмутазы (СОД) в крови по методу В.А. Костюк и соавт. [11] с помощью готовых тест-систем и активности каталазы эритроцитов крови по методике E. Beutler [21].
Изучение влияния антиоксидантной терапии на последствия ишемического инсульта проводилось с использованием лекарственных препаратов цитофлавин и кортексин.
Цитофлавин содержит 500 мг янтарной кислоты, 100 мг рибоксина, 50 мг никотинамида и 10 мг рибофлавина; он оказывает антиоксидантное и антигипоксантное действие, уменьшает продукцию свободных радикалов и восстанавливает активность ферментов АОЗ [17, 18].
Кортексин состоит из 20 L-аминокислот и 15 микроэлементов, получаемых из коры головного мозга крупного рогатого скота; он оказывает тканеспецифическое действие на клетки головного мозга. Кортексин регулирует соотношение тормозных и возбуждающих аминокислот, уровень серотонина и дофамина, оказывает ГАМКергическое влияние, обладает антиоксидантной активностью и способностью нормализации биоэлектрической активности головного мозга [13].
Все пациенты с последствиями инсульта были разделены на 3 группы. В 1-ю группу включили 20 больных, которые помимо стандартного лечения (антиагреганты, вазоактивные и ноотропные средства, в отдельных случаях – малые транквилизаторы и антидепрессанты), получали антиоксидант цитофлавин.
Использовались методы параметрической и непараметрической статистики: дисперсионный анализ (Краскела-Уоллеса), t-критерий Стьюдента, критерий Манна-Уитни, парный критерий Стьюдента, критерий Вилкоксона. При анализе клинических показателей использовались способы обработки таблиц перекрестного табулирования — критерий χ2 Пирсона и χ2 максимального правдоподобия. Для определения связи клинических и биохимических показателей в динамике был применен ковариационный анализ. Уровень значимости определялся при р<0,05.
Для определения связи клинических и биохимических показателей в динамике был применен ковариационный анализ. Уровень значимости определялся при р<0,05.
Результаты
Клиническая картина заболевания у всех пациентов, перенесших ишемический инсульт, характеризовалась наличием комплекса неврологических и психопатологических синдромов, но ее ядром были двигательные и когнитивные нарушения, что совпадает с данными других авторов [4, 15].
Полученные биохимические показатели крови исследуемых больных показали повышение активности прооксидантной системы и снижение АОЗ (табл. 1).
Так, об интенсификации прооксидантной системы свидетельствует достоверное повышение в плазме крови больных уровня МДА – конечного продукта ПОЛ. Параллельно отмечалось снижение активности основных ферментов АОЗ — СОД и каталазы. Также у всех больных обнаружено достоверное снижение уровня как окисленного, так и восстановленного глутатиона. Восстановленный глутатион активно включается в процессы нейтрализации АФК. Выявленное снижение уровня обеих форм глутатиона обусловлено как интенсивной мобилизацией глутатионовой системы в условиях ОС, так и снижением их синтеза. Достоверное снижение показателей ХЛ у больных после перенесенного инсульта свидетельствует о нарушении функции нейтрофилов в процессе «дыхательного взрыва», сопровождающегося генерацией АФК, которые активно включаются в процесс фагоцитоза.
Выявленное снижение уровня обеих форм глутатиона обусловлено как интенсивной мобилизацией глутатионовой системы в условиях ОС, так и снижением их синтеза. Достоверное снижение показателей ХЛ у больных после перенесенного инсульта свидетельствует о нарушении функции нейтрофилов в процессе «дыхательного взрыва», сопровождающегося генерацией АФК, которые активно включаются в процесс фагоцитоза.
Эти показатели проанализированы у больных с последствиями как однократного, так и повторного инсультов. Оказалось, что при повторном инсульте усугубляются изменения со стороны ферментативной АОЗ, что проявляется в достоверном снижении активности каталазы, так как у этих больных более выражен синдром недостаточности кровоснабжения мозга.
Была выявлена корреляционная взаимосвязь между фактором «нарушение чувствительности» и уровнем МДА. Так, у больных с нарушением чувствительности уровень МДА был достоверно выше. Такая же закономерность была обнаружена у больных с расстройствами речи, что свидетельствует о более выраженной интенсивности ОС, показателем которого является высокий уровень ПОЛ, и является одним из признаков нарушения клеточных структур мозга и снижения церебральной резистентности к ОС у этих больных.
Не было обнаружено взаимосвязи между биохимическими показателями ОС и наличием атрофических изменений на МРТ. Однако было показано, что при множественных ишемических очагах, обнаруженных на МРТ, активность СОД достоверно ниже; у больных с единичными очагами на МРТ отмечается более высокая активность СОД — ключевого фермента АОЗ, что свидетельствует о менее выраженной интенсивности хронического ОС. Для этой группы больных характерно состояние относительной стабилизации заболевания.
При анализе показателей ХЛ также отмечена связь с клинической симптоматикой. Так, при наличии умеренно выраженных когнитивных нарушений обнаружены более низкие величины спонтанной ХЛ по сравнению с больными, у которых имелись легкие когнитивные нарушения, но в обоих случаях спонтанная ХЛ была ниже нормы. При наличии гемодинамического стеноза на ТКДГ наблюдается снижение спонтанной ХЛ. Таким образом, для больных с более выраженными нервно-психическими и гемодинамическими нарушениями характерны более низкие величины ХЛ, интенсивность которой зависит от функционального состояния нейтрофилов, их способности включаться в процессы генерации АФК за счет реакций «дыхательного взрыва», направленного на разрушение чужеродных агентов. Нарушение этой способности нейтрофилов у больных после перенесенного инсульта свидетельствует о глубоких структурных нарушениях фагоцитирующих клеток, о возможном их «перевозбуждении» в результате длительного ОС. Вероятно, это обусловлено нарушениями в системе регуляции НАДФН-оксидазного комплекса фагоцитов, с которым связана генерация АФК в условиях стресса.
Нарушение этой способности нейтрофилов у больных после перенесенного инсульта свидетельствует о глубоких структурных нарушениях фагоцитирующих клеток, о возможном их «перевозбуждении» в результате длительного ОС. Вероятно, это обусловлено нарушениями в системе регуляции НАДФН-оксидазного комплекса фагоцитов, с которым связана генерация АФК в условиях стресса.
Состояние хронического ОС после перенесенного инсульта поддерживается за счет сохранения более высокого уровня АФК, связанного с гипоксией тканей. Истощение ферментативной АОЗ и переключение ее частично на неферментативные компоненты, повышение отдельных элементов прооксидантной системы, в частности, ПОЛ, состояние «истощения» макрофагов крови после их «перевозбуждения» при остром инсульте можно расценивать показатели группы риска возможного развития повторных инсультов.
Полученные результаты свидетельствуют о том, что больные, перенесшие инсульт, находятся в состоянии хронического ОС, который играет патогенетическую роль в повреждении мозга [4]. А.Н. Карнеев [10] считает, что основной причиной увеличения окисляемости составляющих плазмы является гипоксическое состояние мозга. Подтверждением этого является выявленная корреляционная взаимосвязь между показателями ОС и выраженностью ведущих синдромов недостаточности кровоснабжения мозга, тяжестью нервно-психических нарушений и гемодинамическими изменениями.
А.Н. Карнеев [10] считает, что основной причиной увеличения окисляемости составляющих плазмы является гипоксическое состояние мозга. Подтверждением этого является выявленная корреляционная взаимосвязь между показателями ОС и выраженностью ведущих синдромов недостаточности кровоснабжения мозга, тяжестью нервно-психических нарушений и гемодинамическими изменениями.
При сравнении групп больных, получавших различные виды лечения, отмечалась тенденция к уменьшению выраженности неврологической симптоматики, о чем свидетельствовали результаты сравнительной эффективности терапии по шкале Рэнкина и индексу Бартель. Субъективно у пациентов всех групп отмечены существенное уменьшение общей слабости, раздражительности, нарушений сна, улучшение памяти. В результате лечения у больных наблюдались регресс координаторных нарушений, частичное восстановление двигательных и чувствительных функций, уменьшение вегетативно-трофических симптомов. Результаты динамического нейропсихологического обследования свидетельствовали о повышении активности, улучшении внимания, кратковременной, оперативной и зрительной памяти. Эти изменения прежде всего обнаружены у пациентов, получавших цитофлавин, тогда как у больных, лечившихся кортексином и без антиоксидантов, положительный эффект был выражен менее отчетливо.
Эти изменения прежде всего обнаружены у пациентов, получавших цитофлавин, тогда как у больных, лечившихся кортексином и без антиоксидантов, положительный эффект был выражен менее отчетливо.
Полученные данные свидетельствуют о некотором клиническом преимуществе цитофлавина, что находит свое подтверждение при анализе показателей ОС, которые, однако, не достигали величин контрольной группы. Во всех группах отмечалась тенденция к повышению активности АОЗ. Следует отметить достоверное повышение индуцированной ХЛ, что является одним из показателей частичного восстановления функциональной активности нейтрофилов, которая, однако, не достигала нормативных показателей. Отмечено достоверное снижение уровня МДА, что свидетельствует о снижении интенсивности ПОЛ. Выявлено достоверное повышение активности ферментов-антиоксидантов СОД и каталазы, уровня восстановленного глутатиона. В результате лечения, независимо от его характера, у всех больных установлено достоверное (р<0,001) повышение восстановленного глутатиона.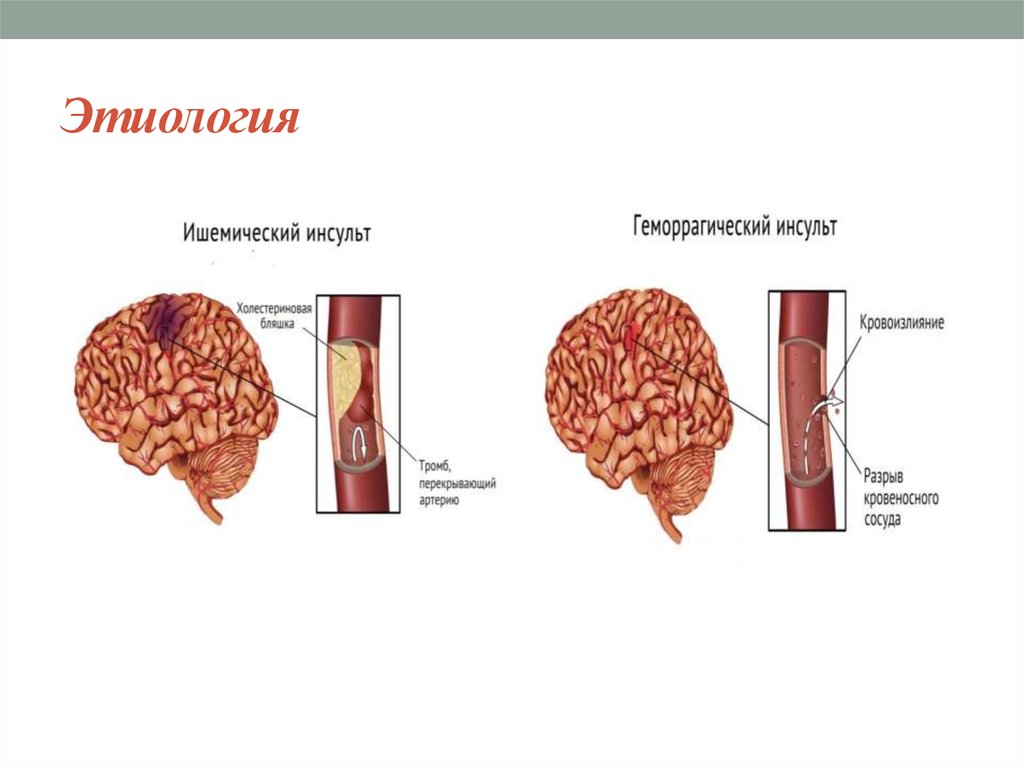 Однако только при применении цитофлавина устанавливалось оптимальное соотношение между восстановленной и окисленной формами глутатиона. Это свидетельствует об активной мобилизации глутатионовой системы в нейтрализации свободнорадикальных продуктов при введении цитофлавина. Таким образом, полученные данные свидетельствуют о положительном действии цитофлавина на показатели АОЗ.
Однако только при применении цитофлавина устанавливалось оптимальное соотношение между восстановленной и окисленной формами глутатиона. Это свидетельствует об активной мобилизации глутатионовой системы в нейтрализации свободнорадикальных продуктов при введении цитофлавина. Таким образом, полученные данные свидетельствуют о положительном действии цитофлавина на показатели АОЗ.
При сопоставлении биохимических показателей с неврологическими симптомами после проведенного курса лечения цитофлавином у больных с двигательными и чувствительными нарушениями, когнитивными расстройствами отмечалось достоверное повышение уровня компонентов глютатионовой системы и одного из главных ферментов АОЗ – каталазы (табл. 2).
При сопоставлении биохимических показателей ОС с неврологическими симптомами после лечения кортексином обнаружено только статистически достоверное повышение уровня спонтанной ХЛ у больных с нарушением поверхностной и глубокой чувствительности. Полученные данные свидетельствуют об антиоксидантной активности кортексина, но степень ее является недостаточной при длительном хроническом ОС.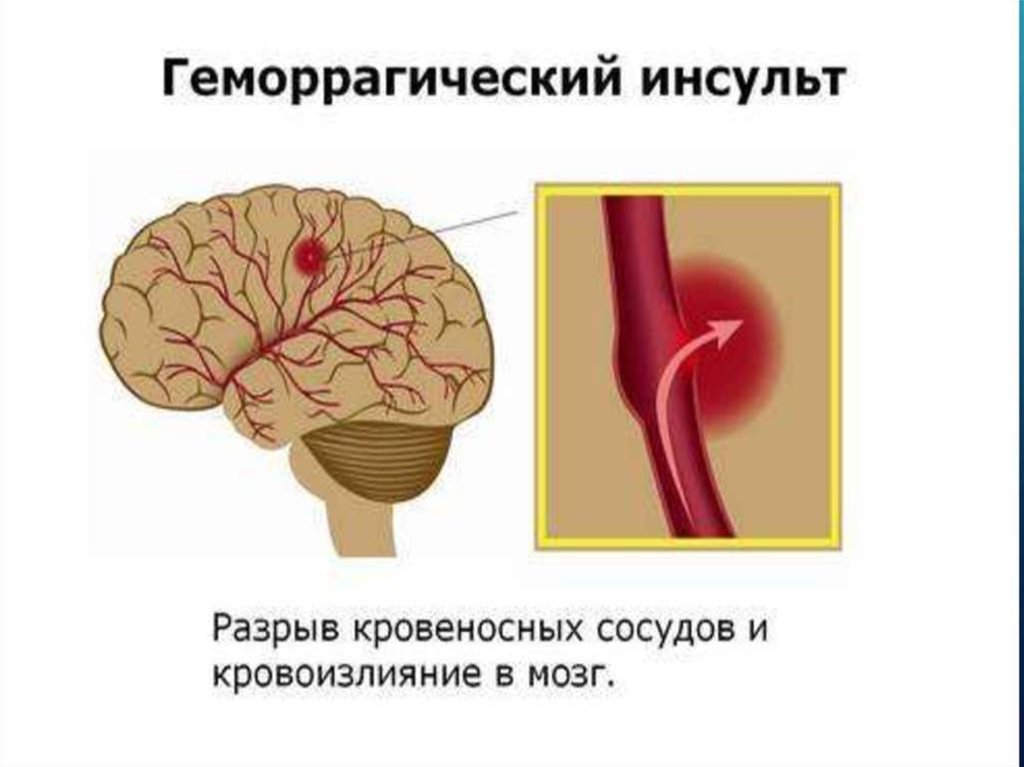
Заключение
После перенесенного ишемического инсульта больной находится в состоянии хронического ОС, который играет патогенетическую роль в повреждении мозга. Степень его выраженности коррелирует с тяжестью последствий инсульта, что является обоснованием необходимости использования антиоксидантных препаратов для коррекции выявленных нарушений. Системный подход к оценке свободнорадикальных процессов у больных, перенесших ишемический инсульт, служит основой для разработки дополнительных тестов ранней диагностики, оценки прогноза заболевания и эффективности лечения. Результаты исследования подтвердили, что лечение последствий ишемического инсульта должно быть комплексным, а необходимость назначения антиоксидантных препаратов должна определяться на основе индивидуальной оценки выраженности параметров ОС и активности эндогенных антиоксидантов у каждого конкретного больного. Для достижения положительного антиоксидантного эффекта, особенно в условиях хронического ОС, очевидной является необходимость поиска быстродействующих, высокоэффективных средств АОЗ, обладающих высоким сродством к ткани мозга, достаточной терапевтической специфичностью и полифункциональным действием.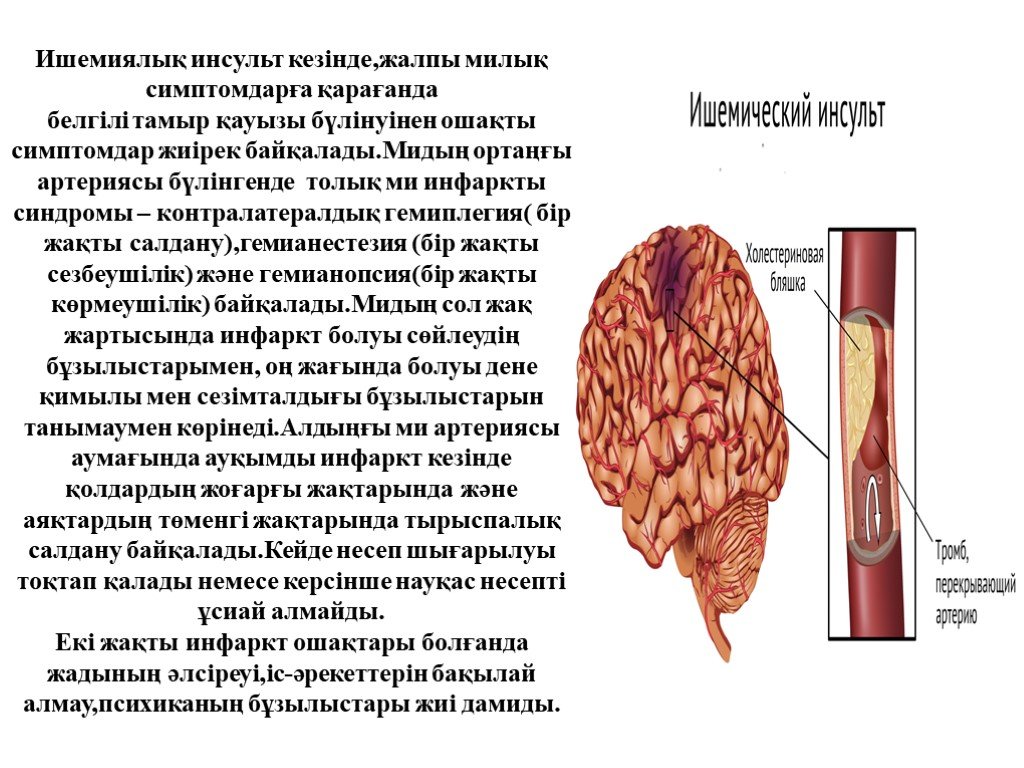 Для коррекции сформировавшихся глубоких нарушений в антиоксидантной системе таким больным недостаточно стандартных схем и дозировок антиоксидантных препаратов. Вероятно, им необходимо проводить более длительные курсы введения цитофлавина, с последующим использованием его в таблетированных формах, что совпадает с мнением других авторов [15, 16, 20].
Для коррекции сформировавшихся глубоких нарушений в антиоксидантной системе таким больным недостаточно стандартных схем и дозировок антиоксидантных препаратов. Вероятно, им необходимо проводить более длительные курсы введения цитофлавина, с последующим использованием его в таблетированных формах, что совпадает с мнением других авторов [15, 16, 20].
Новое соединение поможет в восстановлении даже спустя сутки после инсульта
14 октября, 2022 12:22
Источник: пресс-служба РНФ
Российские ученые определили, что снизить воспаление в мозге при ишемическом инсульте помогают некоторые производные N-гетероциклов — колец из атомов углерода и азота с дополнительно «навешенными» на них химическими группами. Эксперименты показали, что такие соединения способствуют разрешению патологического воспаления и позволяют крысам быстрее восстановиться, причем даже если лечение началось лишь спустя сутки.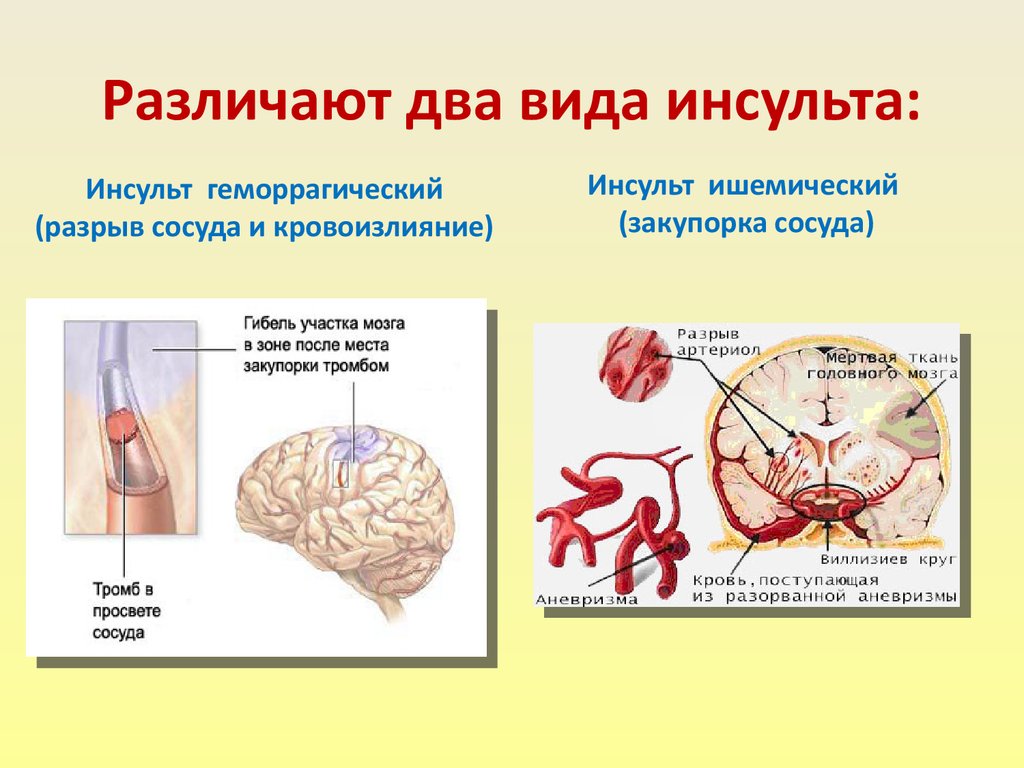 Результаты дают надежду, что предложенные вещества помогут и людям после инсульта, особенно когда упущены критические «золотые часы» для оказания первой помощи. Исследование, поддержанное грантом Российского научного фонда (РНФ), опубликовано в журнале Molecules.
Результаты дают надежду, что предложенные вещества помогут и людям после инсульта, особенно когда упущены критические «золотые часы» для оказания первой помощи. Исследование, поддержанное грантом Российского научного фонда (РНФ), опубликовано в журнале Molecules.
Согласно данным Всемирной организации здравоохранения, ишемический инсульт, который также называют инфарктом мозга, — одна из наиболее частых причин смертей и инвалидности. Заболевание возникает из-за нарушений кровоснабжения мозга: формирования тромбов, расширений просветов артерий, повышенного артериального давления и, как следствие, недостаточного поступления кислорода к тканям. В зависимости от того, какая часть мозга и насколько сильно пострадала, могут быть нарушения памяти, подвижности и речи.
При повреждениях тканей возникает острое воспаление, в норме стимулирующее восстановление: за счет выделения особых сигнальных молекул к месту дефекта привлекаются различные «помощники», и после разрешения воспалительной реакции ткань в той или иной степени восстанавливается. В случае инсульта важную роль играет микроглия — клетки-«няньки», обеспечивающие связь между нейронами и их работу, участвующие в развитии нервной системы, а в случае каких-либо повреждений способные выполнять функцию макрофагов — поглощать потенциально опасные объекты. Вместе с тем их избыточная активность приводит к хроническим воспалениям и заболеваниям. В ответе на постинсультное повреждение также участвуют астроциты — тоже своего рода «няньки» для нейронов, обеспечивающие постоянство окружающей их среды, а при серьезных повреждениях способные даже превратиться в своих «подопечных». После инсульта астроциты могут поддерживать хроническое воспаление, которое мешает нормальной регенерации и способствует прогрессирующей гибели нервных клеток. Часто поломка в одном из звеньев приводит к нарушениям всей цепи, а потому важно снизить чрезмерную активность защитников. Так можно помочь пациентам быстрее восстановиться и избежать инвалидности.
Часто поломка в одном из звеньев приводит к нарушениям всей цепи, а потому важно снизить чрезмерную активность защитников. Так можно помочь пациентам быстрее восстановиться и избежать инвалидности.
Более ранние исследования показали, что химические вещества класса рацетамов ускоряют процесс реабилитации после инсульта. Для простоты эти вещества можно рассматривать как производные различных N-гетероциклов (азот-углеродных колец с боковыми группировками). Ученые из Российского национального исследовательского медицинского университета имени Н. И. Пирогова (Москва) и Национального медицинского исследовательского центра психиатрии и наркологии имени В. П. Сербского (Москва) решили выяснить, можно ли создать на их основе более эффективное лекарство. Авторы синтезировали новое соединение с длинным алкильным «хвостом», содержащим на конце полярную группу, и провели его доклинические испытания. Алкильный «хвост» не только сам обладает биологической активностью, но и повышает растворимость вещества, что также улучшает его усвоение.
На основании данных, полученных из серии экспериментов (в том числе на животных), исследователи предположили, что предложенная модификация позволит создать лекарственное средство для более быстрого восстановления после инсульта. Ранее ученые уже рассматривали влияние вставки фрагмента калиевой соли таурина (таурин также используется в терапии после повреждений мозга). Она привела к более эффективному восстановлению двигательных функций и улучшению когнитивных способностей у животных, перенесших инсульт.
В ходе эксперимента гипотезу проверили на живых клетках и лабораторных крысах. К культуре макрофагов добавляли липополисахарид, который входит в состав клеточной стенки грамотрицательных бактерий, а потому распознается организмом как чужеродный агент — таким образом можно спровоцировать воспаление. Затем авторы добавили к клеткам новое вещество и проанализировали активность генов и молекул, ответственных за начало, развитие и разрешение этой защитной реакции. Они выяснили, что препарат изменяет профили особых сигнальных молекул цитокинов. Так, например, его добавление привело к десятикратному увеличению содержания интерлейкина-2 и интерлейкина-4, которые подавляют чрезмерную активность иммунных клеток, приводящую к разрушению нервных тканей.
Так, например, его добавление привело к десятикратному увеличению содержания интерлейкина-2 и интерлейкина-4, которые подавляют чрезмерную активность иммунных клеток, приводящую к разрушению нервных тканей.
Далее исследователи изучили действие вещества на лабораторных крысах, перенесших ишемический инсульт, и вводили им лекарство через сутки после операции. Результаты показали, что животные на терапии проявляли более высокую исследовательскую и двигательную активности в поведенческих тестах, чем те, которые не получали препарат.
Исследователи оценили число астроцитов в разных областях мозга на иммуногистохимических препаратах тканей мозга. После инсульта они могут образовать скопление, так называемый глиальный рубец: с одной стороны, он отделяет пораженную область, не давая ей распространяться, а с другой — ограничивает к ней доступ тех молекул и клеток, которые могли бы помочь восстановлению. Именно поэтому небольшое число астроцитов в месте постинсультного дефекта — хороший знак, и препарат позволил снизить их количество почти вдвое. Возможно, именно этим объясняются обнаруженные поведенческие отличия у крыс на фоне приема нового препарата.
Возможно, именно этим объясняются обнаруженные поведенческие отличия у крыс на фоне приема нового препарата.
«Существует правило так называемых «золотых часов» — необходимо оказать помощь больному в течение шести часов после инсульта, чтобы последствия были минимальными. В нашей стране существует большое число удаленных от районных центров местностей, поэтому соблюсти это правило не всегда возможно — мы не случайно выжидали целые сутки, прежде чем ввести лекарство нашим подопытным. Полученные результаты показали перспективность дальнейших исследований производных N-гетероциклов для создания эффективных отечественных препаратов для восстановления пациентов после перенесенного инсульта», — рассказывает Вадим Негребецкий, доктор химических наук, профессор РАН, директор научно-испытательного центра РНИМУ имени Н. И. Пирогова.
Теги
Пресс-релизы
Химическое кондиционирование как подход к устойчивости к ишемическому инсульту: митохондрии как мишень
1. Китагава К., Мацумото М., Тагая М., Хата Р., Уэда Х., Ниинобе М., Ханда Н., Фукунага Р. , Кимура К., Микошиба К. и др. В головном мозге обнаружен феномен «ишемической толерантности». Мозг Res. 1990; 528: 21–24. doi: 10.1016/0006-8993(90)
Китагава К., Мацумото М., Тагая М., Хата Р., Уэда Х., Ниинобе М., Ханда Н., Фукунага Р. , Кимура К., Микошиба К. и др. В головном мозге обнаружен феномен «ишемической толерантности». Мозг Res. 1990; 528: 21–24. doi: 10.1016/0006-8993(90)
2. Делла-Морте Д., Гуадагни Ф., Пальмиротта Р., Феррони П., Теста Г., Каччиаторе Ф., Абете П., Ренго Ф., Перес- Пинзон М.А., Сакко Р.Л. и соавт. Генетика и геномика ишемической толерантности: основное внимание уделяется прекондиционированию сердечной и церебральной ишемии. Фармакогеномика. 2012; 13:1741–1757. doi: 10.2217/стр.12.157. [PubMed] [CrossRef] [Академия Google]
3. Prass K., Scharff A., Ruscher K., Lowl D., Muselmann C., Victorov I., Kapinya K., Dirnagl U., Meisel A. Индуцированная гипоксией толерантность к инсульту у мышей опосредована эритропоэтин. Инсульт. 2003; 34:1981–1986. doi: 10.1161/01.STR.0000080381.76409.B2. [PubMed] [CrossRef] [Google Scholar]
4. Обренович Т.П. Молекулярная физиология индуцированной прекондиционированием толерантности мозга к ишемии. Физиол. 2008; 88: 211–247. doi: 10.1152/physrev.00039.2006. [PubMed] [CrossRef] [Академия Google]
Физиол. 2008; 88: 211–247. doi: 10.1152/physrev.00039.2006. [PubMed] [CrossRef] [Академия Google]
5. Ван Ю., Рейс К., Эпплгейт Р., 2-й, Стиер Г., Мартин Р., Чжан Дж.Х. Эндогенная защита мозга, вызванная ишемическим кондиционированием: применение до, во время или после инсульта. Эксп. Нейрол. 2015; 272:26–40. doi: 10.1016/j.expneurol.2015.04.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Куомо О., Винчигерра А., Серулло П., Анзилотти С., Бранкаччо П., Било Л., Скорциелло А., Молинаро П. , ди Ренцо Г., Пиньятаро Г. Ионный гомеостаз в кондиционировании мозга. Фронт. Неврологи. 2015;9doi: 10.3389/fnins.2015.00277. [PMC бесплатная статья] [PubMed] [CrossRef] [Google Scholar]
7. Pan J., Li X., Peng Y. Дистанционное ишемическое кондиционирование при остром ишемическом инсульте: Рассвет в темноте. Преподобный Нейроски. 2016 г.: 10.1515/ревнейро-2015-0043. [PubMed] [CrossRef] [Google Scholar]
8. Yamashita T., Abe K. Недавний прогресс в терапевтической стратегии при ишемическом инсульте. Трансплантация клеток. 2016 г.: 10.3727/096368916X6
Трансплантация клеток. 2016 г.: 10.3727/096368916X6
9. Fairbanks S.L., Brambrink A.M. Прекондиционирование и посткондиционирование для нейропротекции: самые последние данные. Лучшая практика. Рез. клин. Анестезиол. 2010; 24: 521–534. doi: 10.1016/j.bpa.2010.10.004. [PubMed] [CrossRef] [Академия Google]
10. Pignataro G., Cuomo O., Vinciguerra A., Sirabella R., Esposito E., Boscia F., di Renzo G., Annunziato L. Ncx как ключевой игрок в нейропротекции, обеспечиваемой ишемическим прекондиционирования и посткондиционирования . Доп. Эксп. Мед. биол. 2013; 961: 223–240. [PubMed] [Google Scholar]
11. Пиньятаро Г., Скорциелло А., ди Ренцо Г., Аннунциато Л. Постишемическое повреждение головного мозга: влияние ишемического прекондиционирования и посткондиционирования и выявление потенциальных кандидатов для терапии инсульта. Февраль 2009 г.;276:46–57. doi: 10.1111/j.1742-4658.2008.06769.x. [PubMed] [CrossRef] [Google Scholar]
12. Чжао Х. Ишемическое посткондиционирование как новый способ защиты от повреждения головного мозга после инсульта. Дж. Цереб. Кровоток Метаб. 2009; 29: 873–885. doi: 10.1038/jcbfm.2009.13. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Чжао Х. Ишемическое посткондиционирование как новый способ защиты от повреждения головного мозга после инсульта. Дж. Цереб. Кровоток Метаб. 2009; 29: 873–885. doi: 10.1038/jcbfm.2009.13. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Yamashita T., Deguchi K., Sehara Y., Lukic-Panin V., Zhang H., Kamiya T., Abe K. Терапевтическая стратегия на ишемический инсульт. Нейрохим. Рез. 2009; 34: 707–710. doi: 10.1007/s11064-008-9842-2. [PubMed] [CrossRef] [Google Scholar]
14. Дезфулиан С., Гаррет М., Гонсалес Н.Р. Клиническое применение прекондиционирования и посткондиционирования для достижения нейропротекции. Перевод Инсульт Рез. 2013;4:19–24. doi: 10.1007/s12975-012-0224-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
15. Рыбникова Е., Самойлов М. Современные представления о молекулярных механизмах гипоксического пре- и посткондиционирования с использованием гипобарической гипоксии. Фронт. Неврологи. 2015;9 doi: 10.3389/fnins.2015.00388. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Эспозито Э., Десаи Р., Джи С., Ло Э.Х. Фармакологическое пре- и посткондиционирование при инсульте: основные механизмы и трансляционные возможности. Мозг Цирк. 2015;1:104–113. [Google Scholar]
Эспозито Э., Десаи Р., Джи С., Ло Э.Х. Фармакологическое пре- и посткондиционирование при инсульте: основные механизмы и трансляционные возможности. Мозг Цирк. 2015;1:104–113. [Google Scholar]
17. Шарма А., Гоял Р. Экспериментальное прекондиционирование мозга при ишемии: концепция предполагаемых целей. ЦНС Нейрол. Беспорядок. Цели для наркотиков. 2015 в печати. [PubMed] [Google Scholar]
18. Hassell K.J., Ezzati M., Alonso-Alconada D., Hausenloy D.J., Robertson N.J. Новые горизонты защиты мозга новорожденных: усиление эндогенной нейропротекции. Арка Дис. Ребенок. Фетальный неонатальный. Эд. 2015;100:F541–F552. doi: 10.1136/archdischild-2014-306284. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Dirnagl U., Becker K., Meisel A. Прекондиционирование и толерантность к церебральной ишемии: от экспериментальных стратегий к клиническому применению. Ланцет Нейрол. 2009; 8: 398–412. doi: 10.1016/S1474-4422(09)70054-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Dirnagl U., Meisel A. Эндогенная нейропротекция: митохондрии как ворота к прекондиционированию головного мозга? Нейрофармакология. 2008; 55: 334–344. doi: 10.1016/j.neuropharm.2008.02.017. [PubMed] [CrossRef] [Академия Google]
Dirnagl U., Meisel A. Эндогенная нейропротекция: митохондрии как ворота к прекондиционированию головного мозга? Нейрофармакология. 2008; 55: 334–344. doi: 10.1016/j.neuropharm.2008.02.017. [PubMed] [CrossRef] [Академия Google]
21. Дэвис Д.П., Патель П.М. Ишемическое прекондиционирование головного мозга. Курс. мнение Анестезиол. 2003; 16: 447–452. doi: 10.1097/00001503-200310000-00002. [PubMed] [CrossRef] [Google Scholar]
22. Моро М.А., Алмейда А., Боланос Дж.П., Лизасоайн И. Митохондриальная дыхательная цепь и образование свободных радикалов при инсульте. Свободный Радик. биол. Мед. 2005; 39: 1291–1304. doi: 10.1016/j.freeradbiomed.2005.07.010. [PubMed] [CrossRef] [Google Scholar]
23. Симс Н.Р., Андерсон М.Ф. Вклад митохондрий в повреждение тканей при инсульте. Нейрохим. Междунар. 2002; 40: 511–526. дои: 10.1016/S0197-0186(01)00122-Х. [PubMed] [CrossRef] [Google Scholar]
24. Zhan R.Z., Fujihara H., Baba H., Yamakura T., Shimoji K. Ишемическое прекондиционирование способно вызывать митохондриальную толерантность в мозге крыс. Анестезиология. 2002; 97: 896–901. doi: 10.1097/00000542-200210000-00022. [PubMed] [CrossRef] [Google Scholar]
Анестезиология. 2002; 97: 896–901. doi: 10.1097/00000542-200210000-00022. [PubMed] [CrossRef] [Google Scholar]
25. Джексон М.Дж., Папа С., Боланос Дж., Брукдорфер Р., Карлсен Х., Эллиотт Р.М., Флиер Дж., Гриффитс Х.Р., Хилс С., Холст Б. , и другие. Антиоксиданты, активные формы кислорода и азота, индукция генов и функция митохондрий. Мол. Асп. Мед. 2002;23:209–285. doi: 10.1016/S0098-2997(02)00018-3. [PubMed] [CrossRef] [Google Scholar]
26. Warner D.S., Sheng H., Batinic-Haberle I. Оксиданты, антиоксиданты и ишемический мозг. Дж. Эксп. биол. 2004; 207:3221–3231. doi: 10.1242/jeb.01022. [PubMed] [CrossRef] [Google Scholar]
27. Леназ Г. Митохондрии и активные формы кислорода. Какую роль в физиологии и патологии? Доп. Эксп. Мед. биол. 2012; 942: 93–136. [PubMed] [Google Scholar]
28. Брукс П.С., Юн Ю., Роботэм Дж.Л., Андерс М.В., Шеу С.С. Кальций, АТФ и АФК: митохондриальный треугольник любви-ненависти. Являюсь. Дж. Физиол. Клеточная физиол. 2004; 287:C817–C833. doi: 10.1152/ajpcell.00139.2004. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1152/ajpcell.00139.2004. [PubMed] [CrossRef] [Google Scholar]
29. Чучани Э.Т., Пелл В.Р., Джеймс А.М., Ворк Л.М., Саеб-Парси К., Фрезза К., Криг Т., Мерфи М.П. Объединяющий механизм продукции митохондриального супероксида при ишемически-реперфузионном повреждении. Клеточный метаб. 2016;23:254–263. doi: 10.1016/j.cmet.2015.12.009. [PubMed] [CrossRef] [Google Scholar]
30. Genova M.L., Pich M.M., Bernacchia A., Bianchi C., Biondi A., Bovina C., Falasca A.I., Formiggini G., Castelli G.P., Lenaz G. митохондриальная продукция активных форм кислорода в связи со старением и патологией. Анна. Н. Я. акад. науч. 2004; 1011: 86–100. дои: 10.1196/Анналы.1293.010. [PubMed] [CrossRef] [Google Scholar]
31. Griffiths E.J., Halestrap A.P. Митохондриальные неспецифические поры остаются закрытыми во время сердечной ишемии, но открываются при реперфузии. Биохим. Дж. 1995; 307: 93–98. doi: 10.1042/bj3070093. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
32. Li P., Nijhawan D., Budihardjo I., Srinivasula S.M., Ahmad M., Alnemri E.S., Wang X. Цитохром c и dATP-зависимый образование комплекса Apaf-1/каспаза-9 инициирует каскад апоптотических протеаз. Клетка. 1997;91:479–489. doi: 10.1016/S0092-8674(00)80434-1. [PubMed] [CrossRef] [Google Scholar]
Li P., Nijhawan D., Budihardjo I., Srinivasula S.M., Ahmad M., Alnemri E.S., Wang X. Цитохром c и dATP-зависимый образование комплекса Apaf-1/каспаза-9 инициирует каскад апоптотических протеаз. Клетка. 1997;91:479–489. doi: 10.1016/S0092-8674(00)80434-1. [PubMed] [CrossRef] [Google Scholar]
33. Budihardjo I., Oliver H., Lutter M., Luo X., Wang X. Биохимические пути активации каспазы при апоптозе. Анну. Преподобный Cell Dev. биол. 1999; 15: 269–290. doi: 10.1146/annurev.cellbio.15.1.269. [PubMed] [CrossRef] [Google Scholar]
34. Wu J., Luo X., Yan LJ Двумерный синий нативный / SDS-PAGE для идентификации субъединиц митохондриального комплекса I, модифицированных 4-гидроксиноненалем (HNE) Front. Физиол. 2015;6:98. doi: 10.3389/fphys.2015.00098. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
35. Ян Л.Дж. Анализ окислительной модификации белков. Курс. протокол Белковая наука. 2009 г.: 10.1002/0471140864.ps1404s56. [PubMed] [CrossRef] [Google Scholar]
36. Андерсон Э.Дж., Катунга Л.А., Уиллис М.С. Митохондрии как источник и мишень продуктов перекисного окисления липидов в здоровом и больном сердце. клин. Эксп. Фармакол. Физиол. 2012; 39: 179–193. doi: 10.1111/j.1440-1681.2011.05641.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Андерсон Э.Дж., Катунга Л.А., Уиллис М.С. Митохондрии как источник и мишень продуктов перекисного окисления липидов в здоровом и больном сердце. клин. Эксп. Фармакол. Физиол. 2012; 39: 179–193. doi: 10.1111/j.1440-1681.2011.05641.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Эймс Б.Н., Шигенага М.К. Оксиданты являются основной причиной старения. Анна. Н. Я. акад. науч. 1992; 663: 85–96. doi: 10.1111/j.1749-6632.1992.tb38652.x. [PubMed] [CrossRef] [Google Scholar]
38. Шактер Э. Окислительное повреждение белков. Методы Энзимол. 2000; 319: 428–436. [PubMed] [Google Scholar]
39. Chen H., Yoshioka H., Kim G.S., Jung J.E., Okami N., Sakata H., Maier C.M., Narasimhan P., Goeders C.E., Chan P.H. Окислительный стресс при ишемическом повреждении головного мозга: механизмы гибели клеток и потенциальные молекулярные мишени для нейропротекции. Антиоксид. Окислительно-восстановительный сигнал. 2011;14:1505–1517. дои: 10.1089/ars.2010.3576. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Brookes P.S., Hoffman D.L. Старение и сердечная ишемия-митохондрии и рассмотрение свободных радикалов. В: Мива С., Бехкман К.Б., Мюллер Ф.Л., редакторы. Окислительный стресс при старении: от модельных систем до болезней человека. Хумана Пресс; Тотова, Нью-Джерси, США: 2008. стр. 253–268. [Google Scholar]
Brookes P.S., Hoffman D.L. Старение и сердечная ишемия-митохондрии и рассмотрение свободных радикалов. В: Мива С., Бехкман К.Б., Мюллер Ф.Л., редакторы. Окислительный стресс при старении: от модельных систем до болезней человека. Хумана Пресс; Тотова, Нью-Джерси, США: 2008. стр. 253–268. [Google Scholar]
41. Lebuffe G., Schumacker P.T., Shao Z.H., Anderson T., Iwase H., Vanden Hoek T.L. АФК и NO запускают раннее прекондиционирование: связь с митохондриальным КАТФ-каналом. Являюсь. Дж. Физиол. Цирк Сердца. Физиол. 2003;284:h399–х408. doi: 10.1152/ajpheart.00706.2002. [PubMed] [CrossRef] [Google Scholar]
42. Wang X., Wang H., Xu L., Rozanski D.J., Sugawara T., Chan P.H., Trzaskos J.M., Feuerstein G.Z. Значительная нейропротекция против ишемического повреждения головного мозга путем ингибирования протеинкиназы MEK1 у мышей: изучение потенциального механизма, связанного с апоптозом. Дж. Фармакол. Эксп. тер. 2003; 304: 172–178. doi: 10.1124/jpet.102.040246. [PubMed] [CrossRef] [Google Scholar]
43. Liang H.W., Xia Q., Bruce I.C. Активные формы кислорода опосредуют нейропротекцию, обеспечиваемую митохондриальным АТФ-чувствительным открывателем калиевых каналов во время ишемии в срезе гиппокампа крысы. Мозг Res. 2005;1042:169–175. doi: 10.1016/j.brainres.2005.02.031. [PubMed] [CrossRef] [Google Scholar]
Liang H.W., Xia Q., Bruce I.C. Активные формы кислорода опосредуют нейропротекцию, обеспечиваемую митохондриальным АТФ-чувствительным открывателем калиевых каналов во время ишемии в срезе гиппокампа крысы. Мозг Res. 2005;1042:169–175. doi: 10.1016/j.brainres.2005.02.031. [PubMed] [CrossRef] [Google Scholar]
44. Понг К. Ишемическое прекондиционирование: терапевтические последствия инсульта? Мнение эксперта. тер. Цели. 2004; 8: 125–139. doi: 10.1517/14728222.8.2.125. [PubMed] [CrossRef] [Google Scholar]
45. Бланко М., Лизасоайн И., Собрино Т., Виванкос Дж., Кастильо Дж. Ишемическое прекондиционирование: новая цель для нейропротекторной терапии. Цереброваскулярная. Дис. 2006; 21:38–47. doi: 10.1159/000091702. [PubMed] [CrossRef] [Академия Google]
46. Кирино Т. Ишемическая толерантность. Дж. Цереб. Кровоток Метаб. 2002; 22:1283–1296. doi: 10.1097/01.WCB.0000040942.89393.88. [PubMed] [CrossRef] [Google Scholar]
47. Чжао Х. Защитный эффект ишемического посткондиционирования против ишемического повреждения: от сердца к мозгу.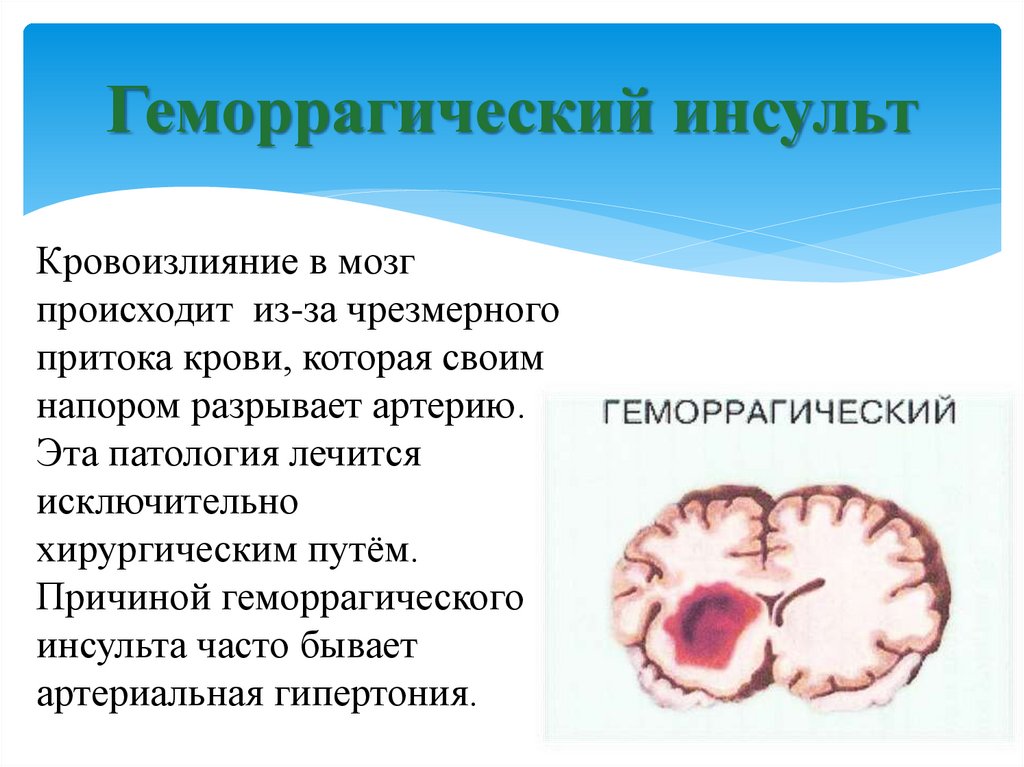 J. Neuroimmune Pharmacol. 2007; 2: 313–318. doi: 10.1007/s11481-007-9089-8. [PubMed] [CrossRef] [Google Scholar]
J. Neuroimmune Pharmacol. 2007; 2: 313–318. doi: 10.1007/s11481-007-9089-8. [PubMed] [CrossRef] [Google Scholar]
48. Томпсон Дж. В., Дэйв К. Р., Янг Дж. И., Перес-Пинзон М. А. Ишемическое прекондиционирование изменяет эпигенетический профиль мозга с ишемической непереносимости на ишемическую толерантность. Нейротерапия. 2013;10:789–797. doi: 10.1007/s13311-013-0202-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. N T.V., Sangwan A., Sharma B., Majid A., Gk R. Церебральное ишемическое прекондиционирование: дорога до сих пор. Мол. Нейробиол. 2015 г.: 10.1007/s12035-015-9278-z. [PubMed] [CrossRef] [Google Scholar]
50. Zhao H., Ren C., Chen X., Shen J. От быстрого к отсроченному и отдаленному посткондиционированию: развивающаяся концепция ишемического посткондиционирования при ишемии головного мозга. Курс. Цели для наркотиков. 2012;13:173–187. дои: 10.2174/138945012799201621. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Stowe A.M., Wacker B.K., Cravens P.D., Perfater J.L., Li M.K., Hu R., Freie A.B., Stuve O., Gidday JM CCL2 активация запускает защиту от инсульта, индуцированную гипоксическим прекондиционирования. Дж. Нейровоспаление. 2012; 9 doi: 10.1186/1742-2094-9-33. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Stowe A.M., Wacker B.K., Cravens P.D., Perfater J.L., Li M.K., Hu R., Freie A.B., Stuve O., Gidday JM CCL2 активация запускает защиту от инсульта, индуцированную гипоксическим прекондиционирования. Дж. Нейровоспаление. 2012; 9 doi: 10.1186/1742-2094-9-33. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Галле А.А., Джонс Н.М. Нейропротекторное действие гипоксического прекондиционирования и посткондиционирования в модели гипоксически-ишемического повреждения головного мозга у новорожденных крыс. Мозг Res. 2013;1498:1–8. doi: 10.1016/j.brainres.2012.12.026. [PubMed] [CrossRef] [Google Scholar]
53. Стоу А. М., Алтай Т., Фрейе А. Б., Гиддей Дж. М. Повторяющаяся гипоксия расширяет эндогенную нейроваскулярную защиту при инсульте. Анна. Нейрол. 2011;69:975–985. doi: 10.1002/ana.22367. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Riepe M.W., Ludolph A.C. Химическое предварительное кондиционирование: стратегия цитопротекции. Мол. Клетка. Биохим. 1997; 174: 249–254. doi: 10.1023/A:1006820927262. [PubMed] [CrossRef] [Академия Google]
Биохим. 1997; 174: 249–254. doi: 10.1023/A:1006820927262. [PubMed] [CrossRef] [Академия Google]
55. Хоши А., Накахара Т., Каяма Х., Ямамото Т. Ишемическая толерантность при химическом прекондиционировании: возможная роль астроцитарной глутаминсинтетазы, буферизующей глутамат-опосредованную нейротоксичность. Дж. Нейроски. Рез. 2006; 84: 130–141. doi: 10.1002/jnr.20869. [PubMed] [CrossRef] [Google Scholar]
56. Riepe M.W., Esclaire F., Kasischke K., Schreiber S., Nakase H., Kempski O., Ludolph A.C., Dirnagl U., Hugon J. Повышенная толерантность к гипоксии путем химического ингибирования окислительного фосфорилирования: «Химическое прекондиционирование» J. Cereb. Кровоток Метаб. 1997;17:257–264. doi: 10.1097/00004647-199703000-00002. [PubMed] [CrossRef] [Google Scholar]
57. Stetler R.A., Leak R.K., Gan Y., Li P., Zhang F., Hu X., Jing Z., Chen J., Zigmond M.J., Gao Y. Прекондиционирование обеспечивает нейропротекцию в моделях заболеваний ЦНС: парадигмы и клиническое значение. прог. Нейробиол. 2014; 114:58–83. doi: 10.1016/j.pneurobio.2013.11.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
прог. Нейробиол. 2014; 114:58–83. doi: 10.1016/j.pneurobio.2013.11.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Jeong J.I., Lee Y.W., Kim Y.K. Индуцированная химической гипоксией гибель клеток глиомы человека: роль активных форм кислорода, истощение АТФ, повреждение митохондрий и Ca 2+ Нейрохим. Рез. 2003; 28:1201–1211. doi: 10.1023/A:1024280429036. [PubMed] [CrossRef] [Google Scholar]
59. Roemgens A., Singh S., Beyer C., Arnold S. Индукторы химической гипоксии действуют в зависимости от пола и региона мозга на первичную жизнеспособность астроцитов и цитохром. в оксидаза. Нейротокс. Рез. 2011; 20:1–14. doi: 10.1007/s12640-010-9213-z. [PubMed] [CrossRef] [Google Scholar]
60. Даниелисова В., Готлиб М., Неметова М., Кравчукова П., Доморакова И., Мечирова Е., Бурда Дж. смерть в гиппокампе крысы. Клетка. Мол. Нейробиол. 2009 г.;29:871–878. doi: 10.1007/s10571-009-9369-3. [PubMed] [CrossRef] [Google Scholar]
61. Луо X. , Ли Р., Ян Л. Дж. Роль пирувата, над и митохондриального комплекса I в окислительно-восстановительном балансе и дисбалансе в функции и дисфункции β-клеток. Дж. Диабет Рез. 2015; 2015 doi: 10.1155/2015/512618. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
, Ли Р., Ян Л. Дж. Роль пирувата, над и митохондриального комплекса I в окислительно-восстановительном балансе и дисбалансе в функции и дисфункции β-клеток. Дж. Диабет Рез. 2015; 2015 doi: 10.1155/2015/512618. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
62. Luo X., Wu J., Jing S., Yan L.J. Гипергликемический стресс и углеродный стресс при диабетической глюкозотоксичности. Старение Дис. 2016;7:90–110. doi: 10.14336/AD.2015.0702. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Либерман М., Маркс А.Д. Базовая медицинская биохимия Маркса: клинический подход. 4-е изд. Уолтерс Клювер/Липпинкотт Уильямс и Уилкинс; Филадельфия, Пенсильвания, США: 2013. [Google Scholar]
64. Sun X., Sun J., Liu L., Ding Z. Прекондиционирование и посткондиционирование изофлураном при полиорганной защите. Дж. Биохим. Фармакол. Рез. 2013; 1:6–14. [Google Scholar]
65. Хэнли П.Дж., Рэй Дж., Брандт У., Даут Дж. Галотан, изофлуран и севофлуран ингибируют НАДН: убихиноноксидоредуктазу (комплекс I) сердечных митохондрий.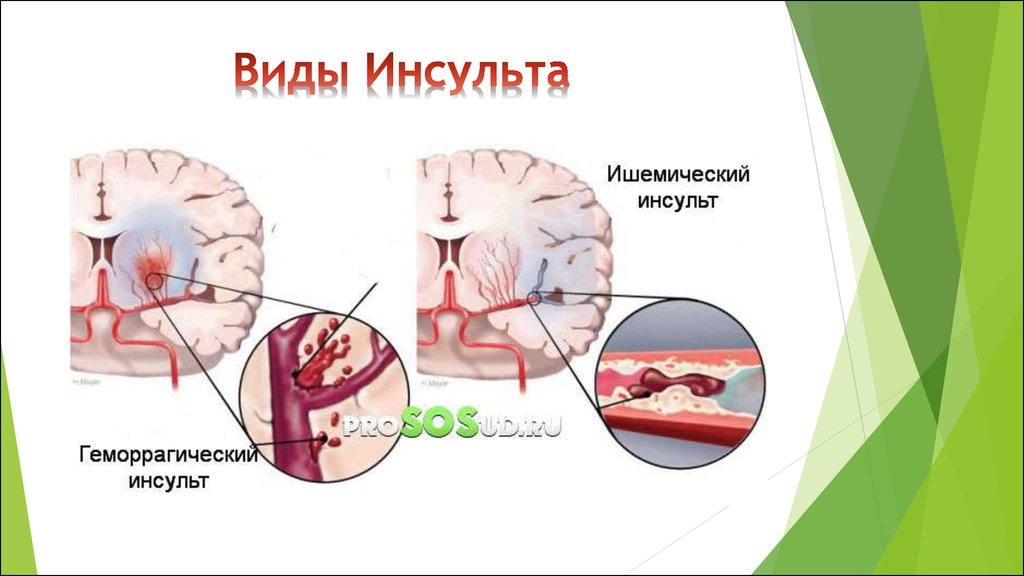 Дж. Физиол. 2002; 544: 687–69.3. doi: 10.1113/jphysiol.2002.025015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Физиол. 2002; 544: 687–69.3. doi: 10.1113/jphysiol.2002.025015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Кайзер Э.Б., Сутхаммарак В., Морган П.Г., Седенский М.М. Изофлуран избирательно ингибирует дистальный митохондриальный комплекс I у Caenorhabditis elegans . Анест. аналг. 2011; 112:1321–1329. doi: 10.1213/ANE.0b013e3182121d37. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
67. Правдич Д., Хирата Н., Барбер Л., Седлич Ф., Босняк З.Дж., Биненграбер М. Комплекс I и АТФ-синтаза опосредуют деполяризацию мембраны и подкисление матрикса изофлураном в митохондриях. Евро. Дж. Фармакол. 2012;690: 149–157. doi: 10.1016/j.ejphar.2012.07.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Агарвал Б., Дэш Р.К., Стоу Д.Ф., Босняк З.Дж., Камара А.К. Изофлуран модулирует биоэнергетику митохондрий сердца путем избирательного ослабления дыхательных комплексов. Биохим. Биофиз. Акта. 2014; 1837: 354–365. doi: 10. 1016/j.bbabio.2013.11.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
1016/j.bbabio.2013.11.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
69. Сосунов С.А., Амир Х., Неецецкая З.В., Уткина-Сосунова И., Ратнер В.И., Тен В.С. Анестезия изофлураном, начатая в начале реперфузии, ослабляет оксидативное и гипоксически-ишемическое повреждение головного мозга. ПЛОС ОДИН. 2015;10:351. doi: 10.1371/journal.pone.0120456. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Шапира А.Х. Дефекты человеческого комплекса I при нейродегенеративных заболеваниях. Биохим. Биофиз. Акта. 1998; 1364: 261–270. doi: 10.1016/S0005-2728(98)00032-2. [PubMed] [CrossRef] [Google Scholar]
71. Лефорт Н., Глэнси Б., Боуэн Б., Уиллис В.Т., Байловиц З., де Филиппис Э.А., Брофи К., Мейер К., Хойлунд К., Йи З. и др. Повышенная продукция активных форм кислорода и более низкое количество субъединиц комплекса I и белка карнитинпальмитоилтрансферазы 1B, несмотря на нормальное митохондриальное дыхание в резистентных к инсулину скелетных мышцах человека.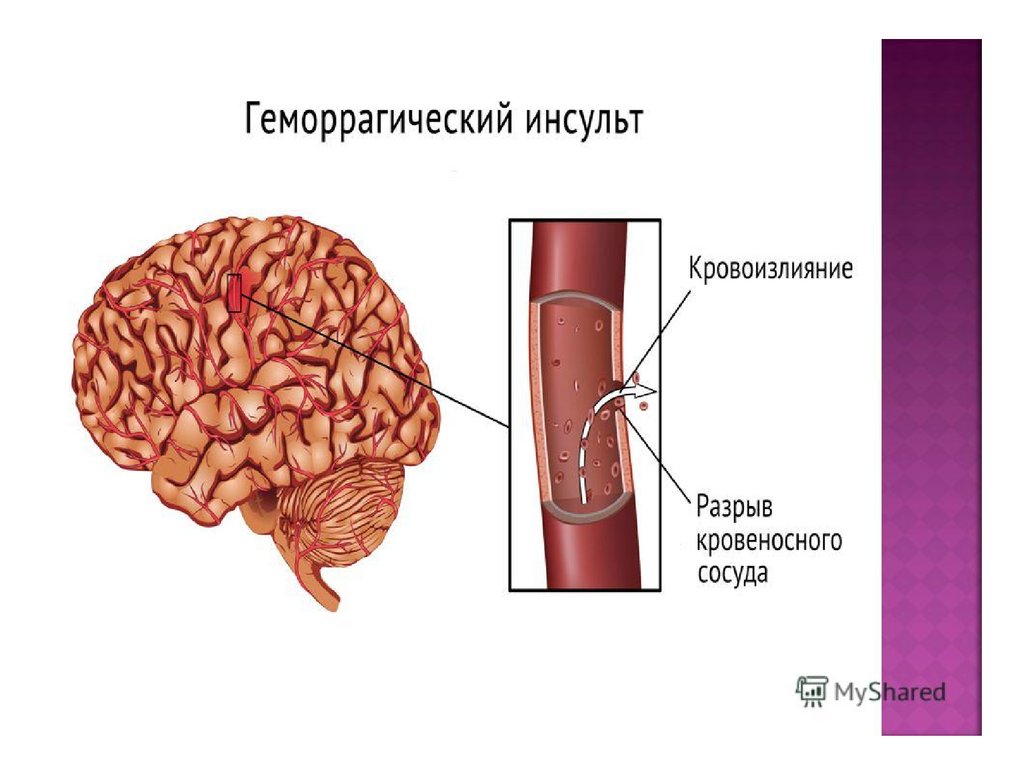 Диабет. 2010;59: 2444–2452. doi: 10.2337/db10-0174. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Диабет. 2010;59: 2444–2452. doi: 10.2337/db10-0174. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. St-Pierre J., Buckingham J.A., Roebuck S.J., Brand MD. Топология производства супероксида из разных участков митохондриальной цепи переноса электронов. Дж. Биол. хим. 2002; 277:44784–44790. doi: 10.1074/jbc.M207217200. [PubMed] [CrossRef] [Google Scholar]
73. Херст Дж., Кинг М.С., Прайд К.Р. Производство активных форм кислорода комплексом i. Биохим. соц. Транс. 2008;36:976–980. doi: 10.1042/BST0360976. [PubMed] [CrossRef] [Google Scholar]
74. Ludwig L.M., Tanaka K., Eells J.T., Weihrauch D., Pagel P.S., Kersten J.R., Warltier D.C. цепной комплекс III. Анест. аналг. 2004; 99: 1308–1315. doi: 10.1213/01.ANE.0000134804.09484.5D. [PubMed] [CrossRef] [Google Scholar]
75. Teixeira G., Chiari P., Fauconnier J., Abrial M., Couture-Lepetit E., Harisseh R., Pillot B., Lacampagne A., Tourneur Y. ., Гариб А. и др. Участие циклофилина D и кальция в прекондиционировании, индуцированном изофлураном. Анестезиология. 2015; 123:1374–1384. дои: 10.1097/АЛН.0000000000000876. [PubMed] [CrossRef] [Google Scholar]
Анестезиология. 2015; 123:1374–1384. дои: 10.1097/АЛН.0000000000000876. [PubMed] [CrossRef] [Google Scholar]
76. Zhao P., Ji G., Xue H., Yu W., Zhao X., Ding M., Yang Y., Zuo Z. Посткондиционирование изофлураном улучшилось на длительное время. неврологический исход, возможно, через ингибирование поры перехода митохондриальной проницаемости у новорожденных крыс после гипоксии-ишемии головного мозга. Неврология. 2014; 280:193–203. doi: 10.1016/j.neuroscience.2014.09.006. [PubMed] [CrossRef] [Google Scholar]
77. Perier C., Bove J., Vila M., Przedborski S. Ротеноновая модель болезни Паркинсона. Тренды Нейроси. 2003; 26: 345–346. дои: 10.1016/S0166-2236(03)00144-9. [PubMed] [CrossRef] [Google Scholar]
78. Schonfeld P., Reiser G. Ротенон-подобное действие фитановой кислоты с разветвленной цепью вызывает окислительный стресс в митохондриях. Дж. Биол. хим. 2006; 281:7136–7142. doi: 10.1074/jbc.M513198200. [PubMed] [CrossRef] [Google Scholar]
79. Marella M., Seo B. B., Nakamaru-Ogiso E., Greenamyre J.T., Matsuno-Yagi A., Yagi T. Защита геном NDI1 от нейродегенерации в Ротеноновая крысиная модель болезни Паркинсона. ПЛОС ОДИН. 2008; 3:351. doi: 10.1371/journal.pone.0001433. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
B., Nakamaru-Ogiso E., Greenamyre J.T., Matsuno-Yagi A., Yagi T. Защита геном NDI1 от нейродегенерации в Ротеноновая крысиная модель болезни Паркинсона. ПЛОС ОДИН. 2008; 3:351. doi: 10.1371/journal.pone.0001433. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Zhou Q., Liu C., Liu W., Zhang H., Zhang R., Liu J., Zhang J., Xu C., Liu L., Huang S., et al. Ротенон, индуцирующий перекись водорода, ингибирует mTOR-опосредованные пути S6K1 и 4E-BP1/eIF4E, что приводит к апоптозу нейронов. Токсикол. науч. 2015; 143:81–96. doi: 10.1093/toxsci/kfu211. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Yan LJ, Sumien N., Thangthaeng N., Forster MJ Обратимая инактивация дигидролипоамиддегидрогеназы митохондриальной перекисью водорода. Свободный Радик. Рез. 2013;47:123–133. дои: 10.3109/10715762.2012.752078. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
82. Turrens J.F., Alexandre A., Lehninger A.L. Убисемихинон является донором электронов для образования супероксида комплексом III митохондрий сердца.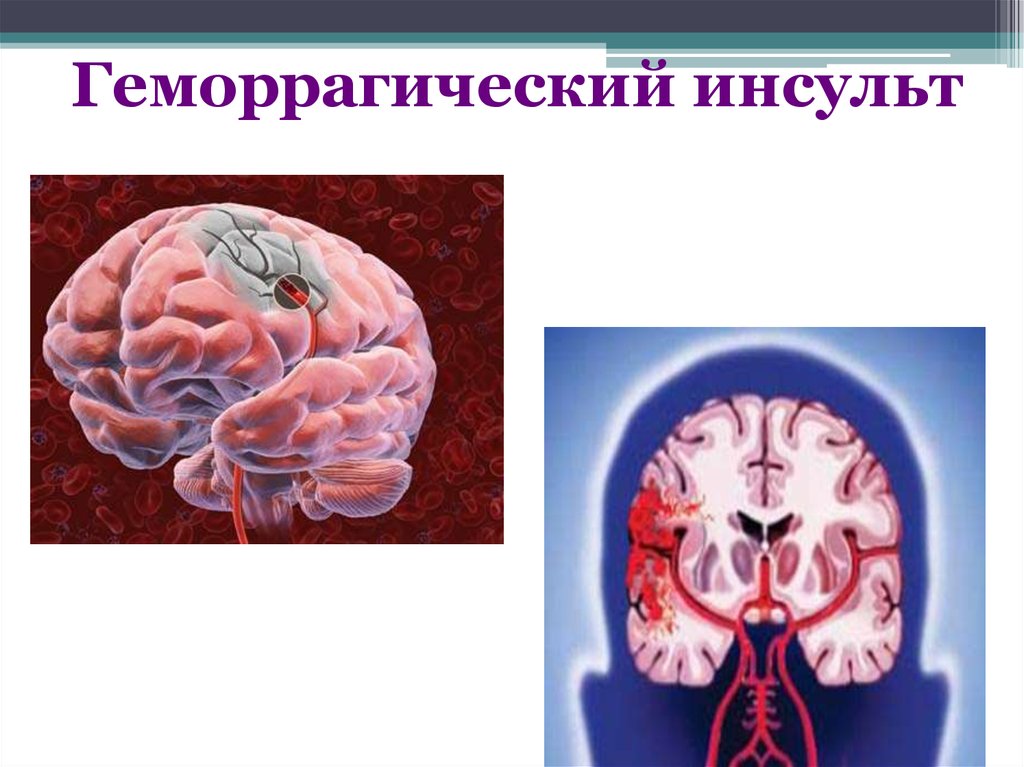 Арка Биохим. Биофиз. 1985; 237: 408–414. doi: 10.1016/0003-9861(85)
Арка Биохим. Биофиз. 1985; 237: 408–414. doi: 10.1016/0003-9861(85)
83. Sun F., Huo X., Zhai Y., Wang A., Xu J., Su D., Bartlam M., Rao Z. Кристаллическая структура митохондриальных респираторных мембранный белковый комплекс II. Клетка. 2005; 121:1043–1057. doi: 10.1016/j.cell.2005.05.025. [PubMed] [CrossRef] [Академия Google]
84. Hirata T., Fukuse T., Ishikawa S., Hanaoka S., Chen Q., Shoji T., Wada H. «Химическое предварительное кондиционирование» 3-нитропропионатом уменьшает ишемически-реперфузионное повреждение в легких крыс с остановкой сердца. . Трансплантация. 2001; 71: 352–359. doi: 10.1097/00007890-200102150-00003. [PubMed] [CrossRef] [Google Scholar]
85. Брамбринк А.М., Шнайдер А., Нога Х., Астеймер А., Гоц Б., Корнер И., Хейманн А., Вельшоф М., Кемпски О. Допуск- индуцирующая доза 3-нитропропионовой кислоты модулирует баланс bcl-2 и bax в мозге крыс: потенциальный механизм химического прекондиционирования.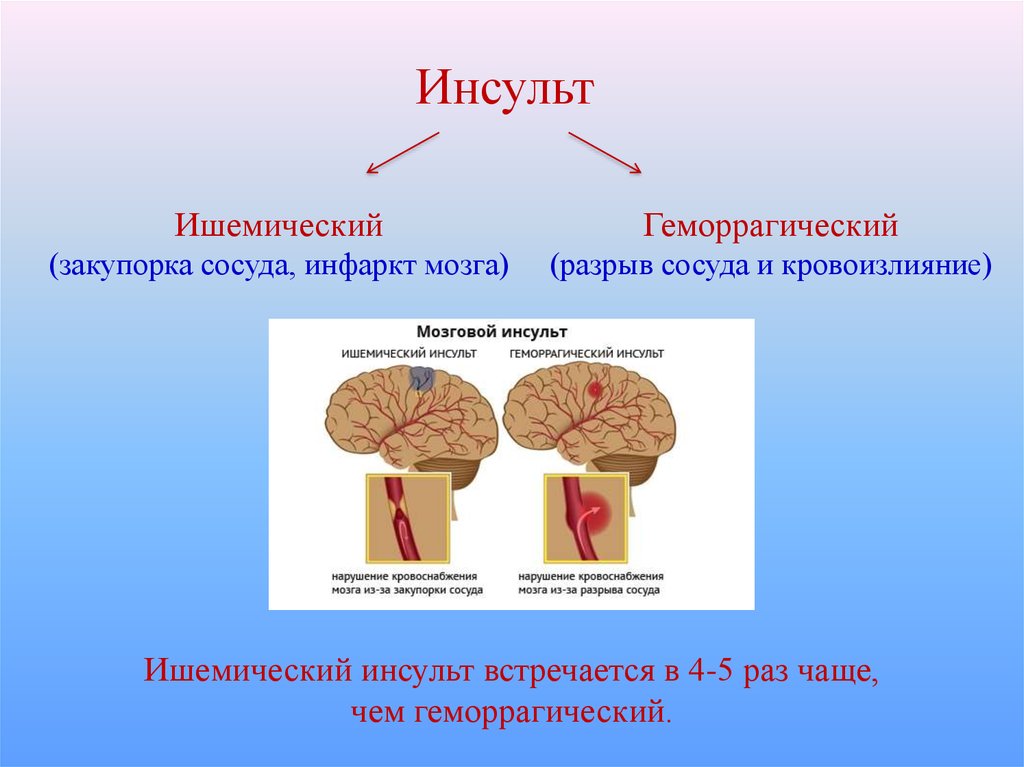 Дж. Цереб. Кровоток Метаб. 2000;20:1425–1436. дои: 10.1097/00004647-200010000-00004. [PubMed] [CrossRef] [Google Scholar]
Дж. Цереб. Кровоток Метаб. 2000;20:1425–1436. дои: 10.1097/00004647-200010000-00004. [PubMed] [CrossRef] [Google Scholar]
86. Хоши А., Накахара Т., Огата М., Ямамото Т. Критический порог индуцированной 3-нитропропионовой кислотой ишемической толерантности у крыс. Мозг Res. 2005;1050:33–39. doi: 10.1016/j.brainres.2005.05.028. [PubMed] [CrossRef] [Google Scholar]
87. Wiegand F., Liao W., Busch C., Castell S., Knapp F., Lindauer U., Megow D., Meisel A., Redetzky A., Рушер К. и др. Ингибирование дыхательной цепи индуцирует толерантность к очаговой церебральной ишемии. Дж. Цереб. Кровоток Метаб. 1999;19:1229–1237. doi: 10.1097/00004647-199911000-00007. [PubMed] [CrossRef] [Google Scholar]
88. Cooper C.E., Brown G.C. Ингибирование митохондриальной цитохромоксидазы газами окисью углерода, окисью азота, цианистым водородом и сероводородом: химический механизм и физиологическое значение. Дж. Биоэнергия. биомембрана 2008; 40: 533–539. doi: 10.1007/s10863-008-9166-6. [PubMed] [CrossRef] [Google Scholar]
89. Correia S.C., Santos R.X., Cardoso S.M., Santos M.S., Oliveira C.R., Moreira P.I. Предварительное кондиционирование цианидом защищает эндотелиальные клетки головного мозга и нейроноподобные клетки NT2 от глюкозотоксичности: роль митохондриальных активных форм кислорода и HIF-1α Neurobiol. Дис. 2012;45:206–218. doi: 10.1016/j.nbd.2011.08.005. [PubMed] [CrossRef] [Академия Google]
Correia S.C., Santos R.X., Cardoso S.M., Santos M.S., Oliveira C.R., Moreira P.I. Предварительное кондиционирование цианидом защищает эндотелиальные клетки головного мозга и нейроноподобные клетки NT2 от глюкозотоксичности: роль митохондриальных активных форм кислорода и HIF-1α Neurobiol. Дис. 2012;45:206–218. doi: 10.1016/j.nbd.2011.08.005. [PubMed] [CrossRef] [Академия Google]
90. Jensen M.S., Ahlemeyer B., Ravati A., Thakur P., Mennel H.D., Krieglstein J. Индуцированная предварительным кондиционированием защита от нейротоксичности, вызванной цианидом, опосредована сохранением митохондриальной функции. Нейрохим. Междунар. 2002; 40: 285–293. doi: 10.1016/S0197-0186(01)00096-1. [PubMed] [CrossRef] [Google Scholar]
91. Queiroga C.S., Almeida A.S., Martel C., Brenner C., Alves PM, Vieira HL Глутатионилирование транслоказы адениннуклеотидов, индуцированное монооксидом углерода, предотвращает проницаемость митохондриальной мембраны и апоптоз. Дж. Биол. хим. 2010; 285:17077–17088. дои: 10.1074/jbc.M109.065052. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
дои: 10.1074/jbc.M109.065052. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
92. Hochgrafe F., Mostertz J., Albrecht D., Hecker M. Анализ модификации флуоресценции тиолов: окислительно модифицированные белки в Bacillus subtilis . Мол. микробиол. 2005; 58: 409–425. doi: 10.1111/j.1365-2958.2005.04845.x. [PubMed] [CrossRef] [Google Scholar]
93. Лим С.Ю., Дэвидсон С.М., Хаусенлой Д.Дж., Йеллон Д.М. Прекондиционирование и посткондиционирование: существенная роль переходной поры митохондриальной проницаемости. Кардиовас. Рез. 2007; 75: 530–535. doi: 10.1016/j.cardiores.2007.04.022. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Ян Л.Дж., Христианс Э.С., Лю Л., Сяо С., Сохал Р.С., Бенджамин И.Дж. Дефицит транскрипционного фактора 1 теплового шока мыши изменяет окислительно-восстановительный гомеостаз сердца и увеличивает окислительное повреждение митохондрий. EMBO J. 2002; 21: 5164–5172. doi: 10.1093/emboj/cdf528. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Fan Y.Y., Shen Z., He P., Jiang L., Hou W.W., Shen Y., Zhang X.N., Hu W.W., Chen Z. Новая нейропротекторная стратегия при ишемическом инсульте: лечение транзиторного легкого ацидоза с помощью CO 2 вдыхание при реперфузии. Дж. Цереб. Кровоток Метаб. 2014; 34: 275–283. doi: 10.1038/jcbfm.2013.193. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Fan Y.Y., Shen Z., He P., Jiang L., Hou W.W., Shen Y., Zhang X.N., Hu W.W., Chen Z. Новая нейропротекторная стратегия при ишемическом инсульте: лечение транзиторного легкого ацидоза с помощью CO 2 вдыхание при реперфузии. Дж. Цереб. Кровоток Метаб. 2014; 34: 275–283. doi: 10.1038/jcbfm.2013.193. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
96. Гарсия де Арриба С., Франке Х., Писсарек М., Нибер К., Иллес П. Нейропротекция АТФ-зависимыми калиевыми каналами в неокортексе крысы срезы головного мозга при гипоксии. Неврологи. лат. 1999; 273:13–16. doi: 10.1016/S0304-3940(99)00603-5. [PubMed] [CrossRef] [Google Scholar]
97. Yamauchi T., Kashii S., Yasuyoshi H., Zhang S., Honda Y., Akaike A. Митохондриальный АТФ-чувствительный калиевый канал: новый сайт нейропротекции. расследование Офтальмол. Вис. науч. 2003; 44: 2750–2756. doi: 10.1167/iovs.02-0815. [PubMed] [CrossRef] [Академия Google]
98. Кис Б., Раджапаксе Н.К., Снайпс Дж.А., Надь К. , Хоригучи Т., Бусия Д.В. Диазоксид индуцирует отсроченное прекондиционирования в культивируемых нейронах коры головного мозга крыс. Дж. Нейрохим. 2003; 87: 969–980. doi: 10.1046/j.1471-4159.2003.02072.x. [PubMed] [CrossRef] [Google Scholar]
, Хоригучи Т., Бусия Д.В. Диазоксид индуцирует отсроченное прекондиционирования в культивируемых нейронах коры головного мозга крыс. Дж. Нейрохим. 2003; 87: 969–980. doi: 10.1046/j.1471-4159.2003.02072.x. [PubMed] [CrossRef] [Google Scholar]
99. Robin E., Simerabet M., Hassoun S.M., Adamczyk S., Tavernier B., Vallet B., Bordet R., Lebuffe G. Посткондиционирование при очаговой церебральной ишемии: Роль митохондриального АТФ-зависимого калиевого канала. Мозг Res. 2011;1375:137–146. doi: 10.1016/j.brainres.2010.12.054. [PubMed] [CrossRef] [Академия Google]
100. О’Салливан Дж.К., Яо С.Л., Алам Х., Маккейб Дж.Т. Диазоксид, как триггер посткондиционирования и отсроченного прекондиционирования, увеличивает HSP25 и HSP70 в центральной нервной системе после сочетанного церебрального инсульта и геморрагического шока. Дж. Нейротравма. 2007; 24: 532–546. doi: 10.1089/neu.2006.0128. [PubMed] [CrossRef] [Google Scholar]
101. Wu L., Shen F., Lin L., Zhang X., Bruce I.C., Xia Q. Нейропротекция, обеспечиваемая активацией митохондриального АТФ-чувствительного K + канал опосредован ингибированием митохондриальной поры перехода проницаемости. Неврологи. лат. 2006; 402:184–189. doi: 10.1016/j.neulet.2006.04.001. [PubMed] [CrossRef] [Google Scholar]
Нейропротекция, обеспечиваемая активацией митохондриального АТФ-чувствительного K + канал опосредован ингибированием митохондриальной поры перехода проницаемости. Неврологи. лат. 2006; 402:184–189. doi: 10.1016/j.neulet.2006.04.001. [PubMed] [CrossRef] [Google Scholar]
102. Farkas E., Timmer N.M., Domoki F., Mihaly A., Luiten P.G., Bari F. Постишемическое введение диазоксида ослабляет долговременную активацию микроглии у крыс. головного мозга после постоянной окклюзии сонной артерии. Неврологи. лат. 2005; 387: 168–172. doi: 10.1016/j.neulet.2005.06.036. [PubMed] [CrossRef] [Академия Google]
103. Stetler R.A., Leak R.K., Yin W., Zhang L., Wang S., Gao Y., Chen J. Митохондриальный биогенез способствует ишемической нейропротекции, обеспечиваемой предварительным кондиционированием LPS. Дж. Нейрохим. 2012; 123:125–137. doi: 10.1111/j.1471-4159.2012.07951.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
104. Розенцвейг Х.Л., Минами М., Лессов Н. С., Кост С.К., Стивенс С.Л., Хеншолл Д.К., Меллер Р., Саймон Р.П., Стензел-Пур М.П. Предварительное кондиционирование эндотоксином защищает от цитотоксического действия TNFα после инсульта: новая роль TNFα в ЛПС-ишемической толерантности. Дж. Цереб. Кровоток Метаб. 2007; 27: 1663–1674. doi: 10.1038/sj.jcbfm.9600464. [PubMed] [CrossRef] [Google Scholar]
С., Кост С.К., Стивенс С.Л., Хеншолл Д.К., Меллер Р., Саймон Р.П., Стензел-Пур М.П. Предварительное кондиционирование эндотоксином защищает от цитотоксического действия TNFα после инсульта: новая роль TNFα в ЛПС-ишемической толерантности. Дж. Цереб. Кровоток Метаб. 2007; 27: 1663–1674. doi: 10.1038/sj.jcbfm.9600464. [PubMed] [CrossRef] [Google Scholar]
105. Вартанян К.Б., Стивенс С.Л., Марш Б.Дж., Уильямс-Карнески Р., Лессов Н.С., Стензел-Пур М.П. Прекондиционирование LPS перенаправляет передачу сигналов TLR после инсульта: TRIF-IRF3 играет основополагающую роль в опосредовании толерантности к ишемическому повреждению. Дж. Нейровоспаление. 2011; 8 doi: 10.1186/1742-2094-8-140. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
106. Марш Б., Стивенс С.Л., Паккард А.Е., Гопалан Б., Хантер Б., Леунг П.Ю., Харрингтон К.А., Стензел-Пур М.П. Системный липополисахарид защищает мозг от ишемического повреждения, перепрограммируя реакцию мозга на инсульт: решающая роль IRF3. Дж. Нейроски. 2009 г.;29:9839–9849. doi: 10.1523/JNEUROSCI.2496-09.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Нейроски. 2009 г.;29:9839–9849. doi: 10.1523/JNEUROSCI.2496-09.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
107. Li W.C., Jiang R., Jiang DM, Zhu F.C., Su B., Qiao B., Qi X.T. Липополисахаридное прекондиционирование ослабляет апоптотические процессы и улучшает нейропатологические изменения после повреждения спинного мозга у крыс. Междунар. Дж. Нейроски. 2013 г.: 10.3109/00207454.2013.864289. [PubMed] [CrossRef] [Google Scholar]
Что это за инсульт? | Клиническая химия
Журнальная статья
Майкл Д Хилл
Майкл Д Хилл
Ищите другие работы этого автора на:
Оксфордский академический
Google ученый
Клиническая химия , том 54, выпуск 12, 1 декабрь 2008 г., страницы 1943–1944, https://doi.org/10.1373/clinchem.2008.117382
Опубликовано:
01 декабрь 2008 9000 3
Фильтр поиска панели навигации Клиническая химияЭтот выпускЖурналы AACCБиохимияМедицинские навыкиПатологияМетоды исследования в науках о жизниКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Клиническая химияЭтот выпускЖурналы AACCБиохимияМедицинские навыкиПатологияМетоды исследования в науках о жизниКнигиЖурналыOxford Academic Термин поиска на микросайте
Расширенный поиск
Поиск белковых биомаркеров в периферической крови для помощи в диагностике инсульта и предсказании прогноза после инсульта и риска повторного инсульта является активной областью исследований. Хотя было показано, что некоторые маркеры, такие как S100b и нейрон-специфическая енолаза, имеют прогностическое значение при ишемическом инсульте (1) (2), ни один из биохимических маркеров не оказался действительно полезным в рутинной клинической практике. В этом выпуске Clinical Chemistry , Nybo и соавт. представили аналогичные обескураживающие данные по остеопротегерину как потенциальному биомаркеру инсульта (3). Почему мы по-прежнему наблюдаем отсутствие продемонстрированной клинической пользы в исследованиях биомаркеров инсульта? Следует ли отказаться от поиска биомаркеров инсульта?
Хотя было показано, что некоторые маркеры, такие как S100b и нейрон-специфическая енолаза, имеют прогностическое значение при ишемическом инсульте (1) (2), ни один из биохимических маркеров не оказался действительно полезным в рутинной клинической практике. В этом выпуске Clinical Chemistry , Nybo и соавт. представили аналогичные обескураживающие данные по остеопротегерину как потенциальному биомаркеру инсульта (3). Почему мы по-прежнему наблюдаем отсутствие продемонстрированной клинической пользы в исследованиях биомаркеров инсульта? Следует ли отказаться от поиска биомаркеров инсульта?
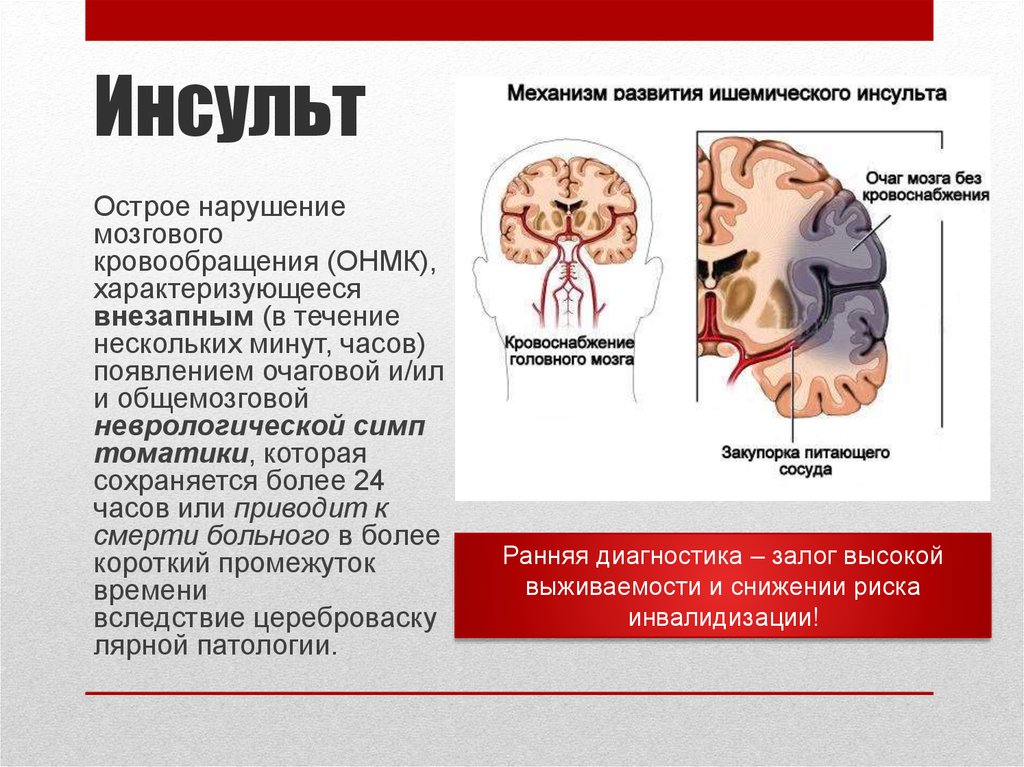
Некоторые ответы могут заключаться в обманчиво простом вопросе: что такое инсульт?
Инсульт в настоящее время определяется как нарушение функции головного мозга вследствие сосудистого инсульта с симптомами, длящимися 24 часа или более. Это определение, ныне устаревшее, постоянно меняется, и, по правде говоря, наше понимание инсульта значительно изменилось с развитием новых диагностических технологий.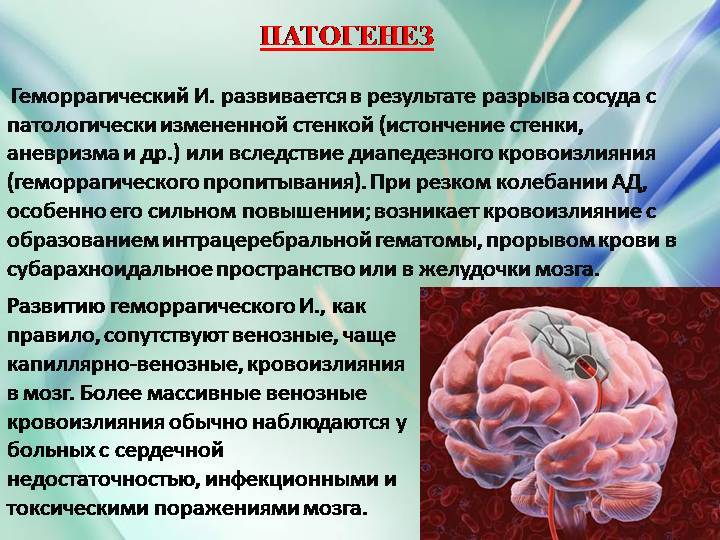 МРТ позволила нам показать, что повреждение ишемического инсульта может произойти с полным исчезновением симптомов задолго до 24-часового срока. Транзиторная ишемическая атака может быть вызвана микрокровоизлиянием. А сложная визуализация сердца, магистральных сосудов, экстракраниальных и интракраниальных сосудов головного мозга показала, что инсульт может быть вызван несколькими причинами. Таким образом, современное определение может заключаться в том, что инсульт — это синдром дисфункции головного мозга, временной или постоянной, с основной сосудистой причиной.
МРТ позволила нам показать, что повреждение ишемического инсульта может произойти с полным исчезновением симптомов задолго до 24-часового срока. Транзиторная ишемическая атака может быть вызвана микрокровоизлиянием. А сложная визуализация сердца, магистральных сосудов, экстракраниальных и интракраниальных сосудов головного мозга показала, что инсульт может быть вызван несколькими причинами. Таким образом, современное определение может заключаться в том, что инсульт — это синдром дисфункции головного мозга, временной или постоянной, с основной сосудистой причиной.
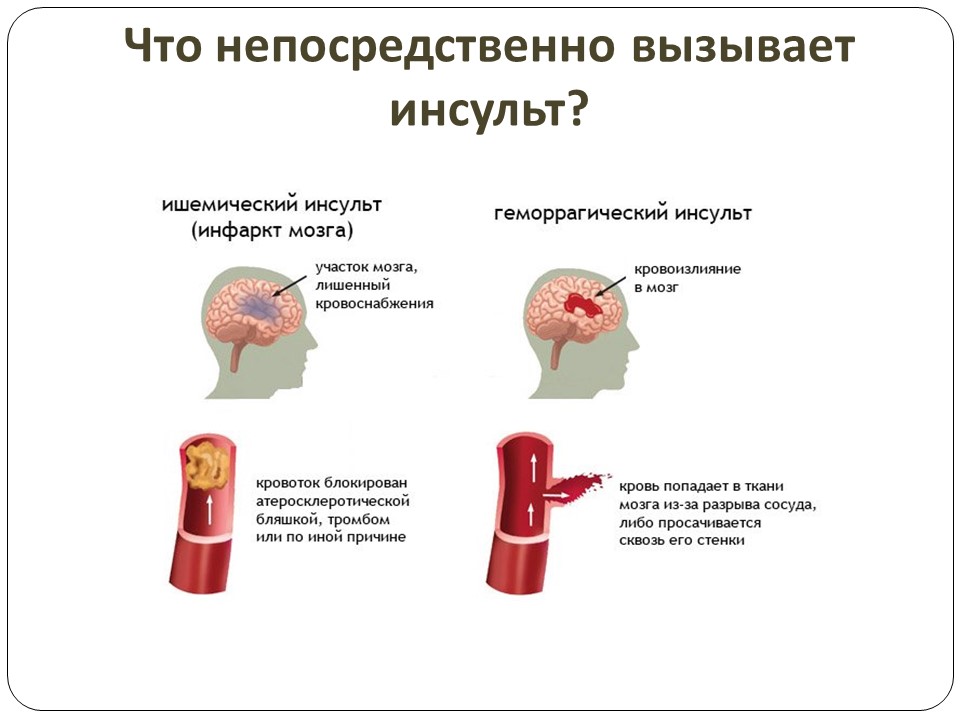
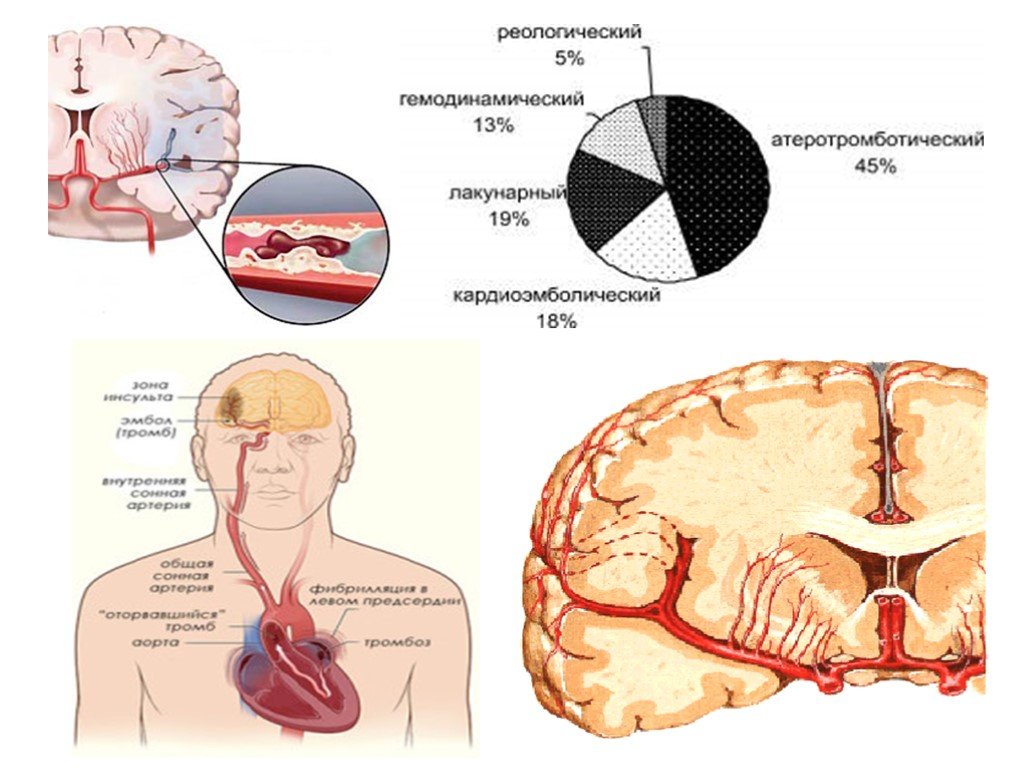
Инсульт можно разделить на 4 основных типа: ишемический (ишемический инсульт и транзиторная ишемическая атака, 85% всех инсультов), внутримозговое кровоизлияние (7–8% всех инсультов), субарахноидальное кровоизлияние (7–8% всех инсультов). все инсульты) и тромбоз церебральных венозных синусов (≪1% всех инсультов). В свою очередь, каждый из этих типов инсульта имеет несколько возможных основных причин. Безусловно, общие факторы риска, такие как гипертония, сахарный диабет и курение сигарет, могут лежать в основе многих инсультов и более чем одного типа инсульта. Система классификации ORG 10172 в лечении острого инсульта (TOAST) обычно используется для классификации ишемического инсульта на заболевание крупных артерий, кардиоэмболический инсульт, лакунарное заболевание и другие, но даже это деление является грубым (4).
Система классификации ORG 10172 в лечении острого инсульта (TOAST) обычно используется для классификации ишемического инсульта на заболевание крупных артерий, кардиоэмболический инсульт, лакунарное заболевание и другие, но даже это деление является грубым (4).
Лакунарный инсульт может быть эмболическим (5)(6)(7). Кардиоэмболический инсульт может включать пристеночный тромб после инфаркта миокарда, мерцательную аритмию, порок сердца и артероэмболию дуги аорты. Заболевание крупных артерий может быть наиболее однородной категорией, поскольку оно представляет собой внутреннее атеросклеротическое заболевание экстракраниальных или интракраниальных артерий.
В исследовании, о котором сообщается в этом выпуске, Nybo и его коллеги использовали тщательный план случай-контроль в большой проспективно собранной когорте из Скандинавии (3). Кровь, взятая на исходном уровне, использовалась для измерения концентрации остеопротегерина для прогнозирования инсульта в будущем. Случаи инсульта выявляли с помощью кодирования административных данных об инсульте. Выбранное определение было либеральным и, вероятно, очень чувствительным к пациентам, госпитализированным с инсультом любого типа (8). Однако многие пациенты с транзиторной ишемической атакой или легким инсультом либо не обращаются за медицинской помощью, либо их осматривают в клинике или отделении неотложной помощи и никогда не госпитализируют. Без госпитализации эти пациенты никогда не будут закодированы как «выписка после инсульта». Таким образом, возможность ошибочной классификации, хотя и небольшая, остается.
Выбранное определение было либеральным и, вероятно, очень чувствительным к пациентам, госпитализированным с инсультом любого типа (8). Однако многие пациенты с транзиторной ишемической атакой или легким инсультом либо не обращаются за медицинской помощью, либо их осматривают в клинике или отделении неотложной помощи и никогда не госпитализируют. Без госпитализации эти пациенты никогда не будут закодированы как «выписка после инсульта». Таким образом, возможность ошибочной классификации, хотя и небольшая, остается.
Авторы тщательно классифицировали подтипы ишемического инсульта в соответствии с критериями TOAST. Они выполнили эту классификацию ретроспективно, просмотрев диаграммы. Не зная объема проведенных расследований, трудно быть уверенным в точности классификации. Однако качество инсультных отделений в Дании в целом отличное, поэтому мы можем заключить, что этот подход, вероятно, был достаточно точным. Распределение типов инсульта аналогично тому, которое наблюдалось в других когортных исследованиях и в рандомизированных исследованиях пациентов с ишемическим инсультом.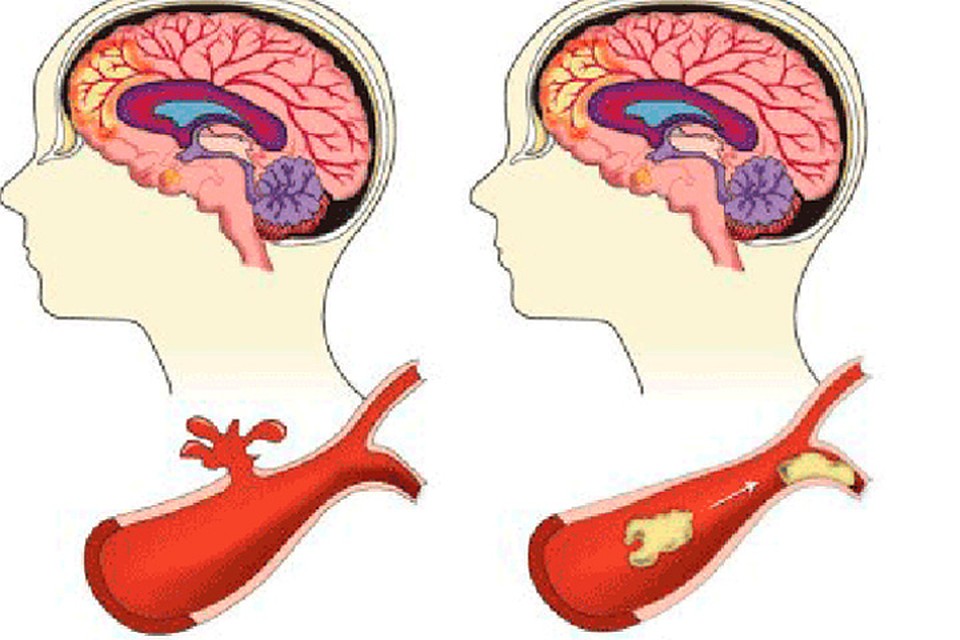 Тем не менее, категории TOAST показывают, что мы имеем дело с множественными патологическими процессами, вызывающими ишемический инсульт. Поэтому неудивительно, что не возникает никакой связи с одним биомаркером. Учитывая предполагаемый биологический механизм ингибирующей роли остеопротегерина в кальцификации сосудов, было бы очень интересно увидеть, можно ли установить связь между ишемическим инсультом, вызванным поражением крупных артерий, и остеопротегерином.
Тем не менее, категории TOAST показывают, что мы имеем дело с множественными патологическими процессами, вызывающими ишемический инсульт. Поэтому неудивительно, что не возникает никакой связи с одним биомаркером. Учитывая предполагаемый биологический механизм ингибирующей роли остеопротегерина в кальцификации сосудов, было бы очень интересно увидеть, можно ли установить связь между ишемическим инсультом, вызванным поражением крупных артерий, и остеопротегерином.
Учитывая, что инсульт является эпизодическим проявлением его основной причины или причин, почему мы должны предполагать, что одно измерение, проведенное в определенный момент времени, позволит предсказать будущие события инсульта? Возможно, когда основная причина (например, мерцательная аритмия) находится в состоянии покоя, биомаркер остается в состоянии покоя. Время измерения белка может иметь большое значение.
Таким образом, поиск биомаркеров инсульта должен продолжаться, но в соответствии с конкретными типами инсульта. По мере того, как наше понимание инсульта прогрессирует, мы также должны корректировать наши методы исследования. Детальное понимание механизмов инсульта (как при ишемии, так и при кровоизлиянии) необходимо для выявления клинически значимых корреляций инсульта с белковыми биомаркерами и генетическими характеристиками. Объединение всех типов инсульта в одну кучу больше не является плодотворным подходом к таким исследованиям.
По мере того, как наше понимание инсульта прогрессирует, мы также должны корректировать наши методы исследования. Детальное понимание механизмов инсульта (как при ишемии, так и при кровоизлиянии) необходимо для выявления клинически значимых корреляций инсульта с белковыми биомаркерами и генетическими характеристиками. Объединение всех типов инсульта в одну кучу больше не является плодотворным подходом к таким исследованиям.
Вклад авторов: Все авторы подтвердили, что они внесли свой вклад в интеллектуальное содержание этой статьи и выполнили следующие 3 требования: (а) значительный вклад в концепцию и дизайн, сбор данных или анализ и интерпретацию данных ; (b) составление или пересмотр статьи на предмет интеллектуального содержания; и (c) окончательное утверждение опубликованной статьи .
Заявление авторов о потенциальном конфликте интересов: После подачи рукописи все авторы заполнили форму «Раскрытие информации о потенциальном конфликте интересов».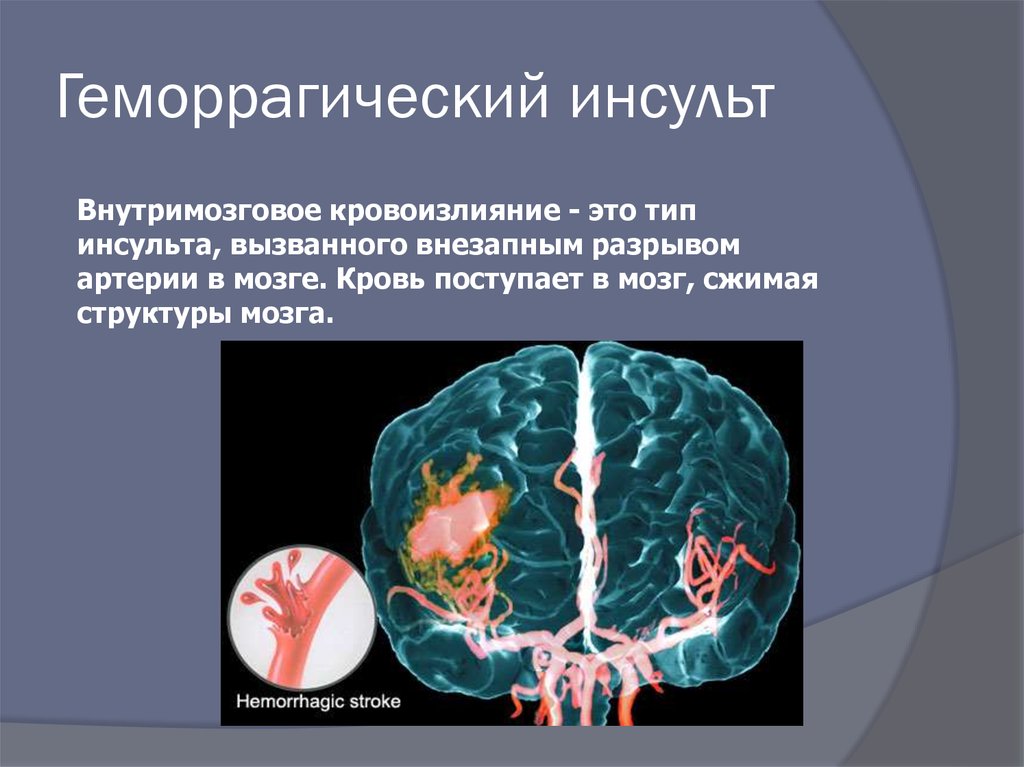 Возможные конфликты интересов:
Возможные конфликты интересов:
Занятость или руководство: Доктор медицины Хилл был главным исследователем в клиническом испытании.
Роль консультанта или советника: MD Hill был консультантом Sanofi Canada, Portola Therapeutics, Genentech, Vernalis Group и Stem Cell Therapeutics.
Владение акциями: Не объявлено.
Гонорар: M.D. Hill получил гонорары от BMS Canada, Boehringer Ingelheim Canada, Sanofi Canada и NovoNordisk Canada.
Финансирование исследования: M.D. Hill получил лекарство в натуральной форме от Merck Canada для клинических испытаний.
Заключение эксперта: Не заявлен.
Роль спонсора: Финансирующие организации не играли никакой роли в разработке исследования, выборе включенных в исследование пациентов, обзоре и интерпретации данных, подготовке или утверждении рукописи.
1
Фассбендер К. , Шмидт Р., Шрайнер А. и др. Утечка белков головного мозга в периферическую кровь: временной профиль и диагностическое значение при раннем ишемическом инсульте.
, Шмидт Р., Шрайнер А. и др. Утечка белков головного мозга в периферическую кровь: временной профиль и диагностическое значение при раннем ишемическом инсульте.
J Neurol Sci
1997
;
148
:
101
-105.
2
Hill MD, Bayer N, Lawrence M, Jaeschke R, Jackowski G. Биохимические маркеры острого ишемического инсульта.
CMAJ
2000
;
162
:
1139
-1140.
3
Нюбо М., Йонсен С.П., Детлефсен С., Овервад К., Тьённеланд А., Йоргенсен Й.О.Л., Расмуссен Л.М. Отсутствие наблюдаемой связи между высокими концентрациями остеопротегерина в плазме и риском ишемического инсульта у здоровых людей.
Клин Хим
2008
;
54
:
1969
-1974.
4
Адамс Х.П., младший, Бендиксен Б.Х., Каппелль Л.Дж., Биллер Дж., Лав Б.Б., Гордон Д.Л. и др. Классификация подтипа острого ишемического инсульта: определения для использования в многоцентровом клиническом исследовании: TOAST, Trial of Org 10172 in Acute Stroke Treatment.
Ход
1993
;
24
:
35
-41.
5
Ламми Г.А., Уордлоу Дж.М. Небольшие инфаркты овального центра: патологическое исследование.
Цереброваск дис
1999
;
9
:
82
-90.
6
Милликен С., Футрелл Н. Ошибочность лакунной гипотезы.
Ход
1990
;
21
:
1251
-1257.

 Разделенный вид
Разделенный вид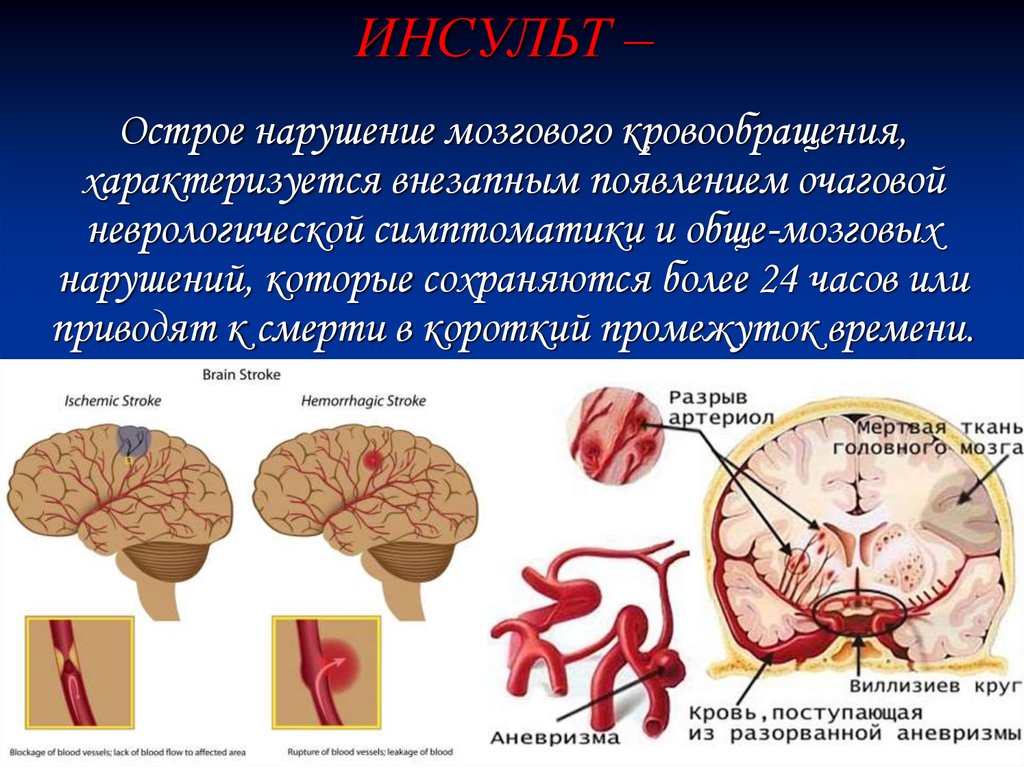 Хилл, Что это за инсульт?, Клиническая химия , том 54, выпуск 12, 1 декабря 2008 г., страницы 1943–1944, https://doi.org/10.1373/clinchem.2008.117382
Хилл, Что это за инсульт?, Клиническая химия , том 54, выпуск 12, 1 декабря 2008 г., страницы 1943–1944, https://doi.org/10.1373/clinchem.2008.117382