Гемодинамический инсульт: Мозговой инсульт — КГБУЗ «МАНСКАЯ РАЙОННАЯ БОЛЬНИЦА»
ПОНЯТЬ ПАТОГЕНЕЗ И ПРЕДОТВРАТИТЬ ОСЛОЖНЕНИЯ — «ИнфоМедФармДиалог»
Skip to content ИШЕМИЧЕСКИЙ ИНСУЛЬТ: ПОНЯТЬ ПАТОГЕНЕЗ И ПРЕДОТВРАТИТЬ ОСЛОЖНЕНИЯИШЕМИЧЕСКИЙ ИНСУЛЬТ: ПОНЯТЬ ПАТОГЕНЕЗ И ПРЕДОТВРАТИТЬ ОСЛОЖНЕНИЯКлючевые моменты оказания помощи пациентам с ОНМК обсуждались на семинаре «Нейровизуализация в отборе пациентов для тромбоэкстракции. Вторичная профилактика кардиоэмболических инсультов». Как отметил его модератор, главный внештатный специалист по рентген‑эндоваскулярным методикам диагностики и лечения ДЗМ, профессор кафедры кардиологии МГМСУ им. А.И. Евдокимова, д.м.н. Д.В. Скрыпник, залог эффективной помощи пациентам – тщательный анализ каждого этапа работы.
РАБОТАЕМ АНАЛИЗИРУЯ
Рассказывая о московской «Инсультной сети», главный внештатный специалист невролог ДЗМ, профессор, д.м.н. Н.А. Шамалов проанализировал не только заболеваемость, но и качество оказания помощи пациентам с ОНМК, отметил основные достижения и ошибки. За три года существенно улучшилась диагностика сосудистых поражений мозга, а время от первых симптомов инсульта до начала терапии сведено к минимуму – от 43 минут в 2017 г. до 40 минут в 2019 г. Казалось бы, 3 минуты – это немного, но стоит вспомнить, что в отсутствие кровотока мозг за 1 минуту теряет 1,9 млн нейронов. Поэтому организация помощи инсультным пациентам должна предупреждать временные потери на любом этапе. К сожалению, как отметил Н.А. Шамалов, доля пациентов, доставленных в стационар в пределах 4–6‑часового терапевтического окна, пока невелика – 28,3%. Это свидетельствует о необходимости пропаганды среди населения важности экстренной госпитализации при первых клинических проявлениях инсульта.
За три года существенно улучшилась диагностика сосудистых поражений мозга, а время от первых симптомов инсульта до начала терапии сведено к минимуму – от 43 минут в 2017 г. до 40 минут в 2019 г. Казалось бы, 3 минуты – это немного, но стоит вспомнить, что в отсутствие кровотока мозг за 1 минуту теряет 1,9 млн нейронов. Поэтому организация помощи инсультным пациентам должна предупреждать временные потери на любом этапе. К сожалению, как отметил Н.А. Шамалов, доля пациентов, доставленных в стационар в пределах 4–6‑часового терапевтического окна, пока невелика – 28,3%. Это свидетельствует о необходимости пропаганды среди населения важности экстренной госпитализации при первых клинических проявлениях инсульта.
ПАТОГЕНЕЗ – ОСНОВА УСПЕШНОГО ЛЕЧЕНИЯ ИНСУЛЬТА
Н.А. Шамалов отметил, что краеугольным камнем в улучшении качества оказания помощи пациентам с инсультом служит правильная диагностика его патогенетического варианта. По данным «Инсультной сети», за три года ее работы уменьшилась доля атеротромботических инсультов, что соответствует мировым тенденциям.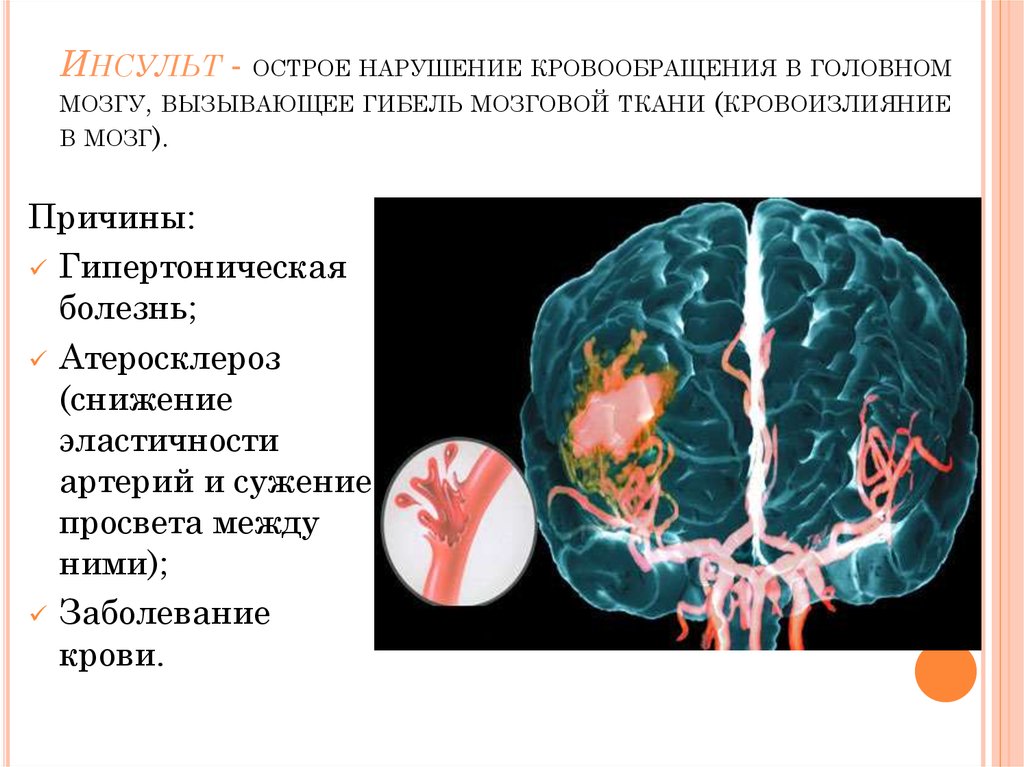 Однако одновременно увеличилась доля инсультов с неуточненной этиологией.
Однако одновременно увеличилась доля инсультов с неуточненной этиологией.
Такая динамика может свидетельствовать как о неудачных попытках более основательно разобраться с причинами инсульта, так и, к сожалению, о нежелании врачей за неимением времени уточнять диагноз. А это, по мнению Н.А. Шамалова, чревато упущенными возможностями профилактики повторных инсультов и транзиторных ишемических атак (ТИА).
ВЕРИФИКАЦИЯ ПАТОГЕНЕТИЧЕСКОГО ВАРИАНТА ИНСУЛЬТА
Атеротромботический инсульт должен быть подтвержден, согласно классификации TOAST. Патогенетический вариант инсульта подтверждает дуплексное сканирование интра- и экстракраниальных сосудов (>50% симптомной артерии), транскраниальная доплерография с микроэмболодетекцией и весь спектр ЭКГ (ЭхоКГ, холтер‑ЭКГ) для исключения кардиоэмболии. Из ангиографических методов используют рентгеноконтрастную субтракционную ангиографию, КТ- и МР‑ангиографию.
Кардиоэмболический инсульт предполагают при подтверждении, как минимум, одного источника кардиоэмболии, при этом размер инфарктов превышает 1,5 см в диаметре и в анамнезе у пациента присутствуют транзиторные сосудистые события или инсульт (эмболия). В соответствии с критериями TOAST, причины кардиоэмболического инсульта делятся на группы высокого и среднего риска. Наиболее частым патогенетическим фактором служит ФП, вследствие которой возникает стаз крови в левом предсердии и его ушке. Кроме того, высока вероятность кардиоэмболического инсульта при наличии механических клапанов, митрального стеноза в сочетании с ФП, синдрома слабости синусового узла, недавнего инфаркта миокарда, дилятационной кардиомиопатии, миксомы предсердия, инфекционного эндокардита.
В соответствии с критериями TOAST, причины кардиоэмболического инсульта делятся на группы высокого и среднего риска. Наиболее частым патогенетическим фактором служит ФП, вследствие которой возникает стаз крови в левом предсердии и его ушке. Кроме того, высока вероятность кардиоэмболического инсульта при наличии механических клапанов, митрального стеноза в сочетании с ФП, синдрома слабости синусового узла, недавнего инфаркта миокарда, дилятационной кардиомиопатии, миксомы предсердия, инфекционного эндокардита.
Клиническая картина кардиоэмболического инсульта сопровождается внезапным началом и быстрым нарастанием симптоматики. Верификация кардиоэмболического патогенетического инсульта должна включать КТ/МРТ‑подтверждение очагов инфаркта >1,5 см и ЭКГ‑признаки. Используются также транскраниальная доплерография с микроэмболодетекцией и трансторакальная или чреспищеводная ЭхоКГ (особенно у молодых пациентов).
Эффективность эндоваскулярного вмешательства определяется точной диагностикой жизнеспособных тканей головного мозга
Лакунарный инсульт исключает признаки поражения коры больших полушарий. Клинический диагноз подтверждает наличие в анамнезе сахарного диабета или гипертензии. По данным КТ или МРТ часто выявляются субкортиальные инфаркты диаметром <1,5 см в одном полушарии. При этом отсутствуют потенциальные источники кардиоэмболии и стенозы импсилатеральной сонной артерии >50%.
Клинический диагноз подтверждает наличие в анамнезе сахарного диабета или гипертензии. По данным КТ или МРТ часто выявляются субкортиальные инфаркты диаметром <1,5 см в одном полушарии. При этом отсутствуют потенциальные источники кардиоэмболии и стенозы импсилатеральной сонной артерии >50%.
Диссекция артерии относится к числу более редких причин инсульта. Однако, по мнению Н.А. Шамалова, с улучшением методов диагностики, в частности МРТ на сверхвысокопольном томографе, число случаев диссекции артерий заметно увеличивается. Заподозрить диссекцию сонной артерии можно в случае жалоб пациента на боли в глазнице или лобной области, а также при появлении симптомов ишемии в каротидном бассейне (утрата зрения на одноименной стороне, контралатеральные гемипарезы и гемианестезии, нарушения речи). Характерны также ипсилатеральный синдром Горнера и пульсирующий шум в ушах, может выслушиваться шум на шее.
При диссекции позвоночной артерии пациенты могут жаловаться на боль в шее и затылке. Могут также присутствовать признаки ишемии в вертебро‑базиллярном бассейне.
Могут также присутствовать признаки ишемии в вертебро‑базиллярном бассейне.
К числу редких причин инсультов, которые все‑таки следует учитывать, относятся гемодинамический инсульт и тромбофилии. Диагноз криптогенного инсульта (неуточненной этиологии) следует выставлять только при наличии двух или более возможных причин, например у пациента с ФА и ипсилатеральным стенозом >50%. При этом заподозрить какой‑либо вариант инсульта можно с учетом возрастного ценза (рис. 1).
В заключение своего сообщения Н.А. Шамалов еще раз подчеркнул важность диагностики патогенетического варианта инсульта для последующей профилактики вторичных сосудистых катастроф. Тем более что, по последним данным, доля кардиоэмболического инсульта, профилактика которого включает пожизненное назначение антикоагулянтов, составляет около 60%. И, что еще более важно, из‑за отсутствия необходимой патогенетической терапии каждый третий пациент с кардиоэмболическим инсультом попадает в стационар с повторным событием.
НЕЙРОВИЗУАЛИЗАЦИЯ: ТЕХНИЧЕСКОЕ ОСНАЩЕНИЕ И АЛГОРИТМ ИССЛЕДОВАНИЙ
Только экстренная диагностика ишемического поражения головного мозга дает пациенту реальный шанс на восстановление его функций. Заведующий отделением лучевой диагностики ГКБ им. И.В. Давыдовского к.м.н. К.Н. Журавлев подробно остановился не только на преимуществах того или иного метода нейровизуализации, но и на аппаратном обеспечении. Для нативной КТ и КТ‑ангиографии достаточно 16‑срезового томографа, однако КТ‑перфузия может быть выполнена только на томографе с числом срезов 64 и более.
В соответствии с протоколом исследования предусмотрена скорость введения контраста не менее 5 мл/с в объеме 50–60 мл (после введения контраста дополнительно вводят 20–30 мл 0,9% NaCl). Сканирование выполняют от дуги аорты, что позволяет посмотреть анатомию шейных сосудов (важно для последующего вмешательства). При КТ‑перфузии, которую, как правило, выполняют после КТ‑ангиографии, сканирование начинают на 1–2 см выше турецкого седла (или в зоне интереса) параллельно основанию черепа.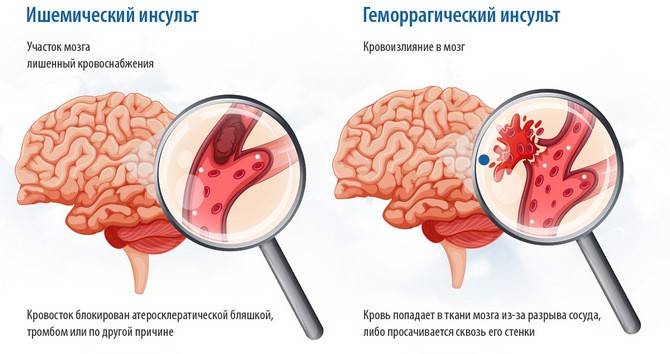
Нативная КТ, которую выполняют в первую очередь, позволяет диагностировать внутримозговое кровоизлияние. Если оно локализуется в области базальных ядер, что служит следствием гипертензионного влияния, КТ‑ангиография не требуется. При атипичном расположении внутримозговой гематомы и субарахноидальном кровоизлиянии следует выполнять КТ‑ангиографию. Еще одна задача нативной КТ – выявление ранних признаков инсульта и подсчет баллов по шкале ASPECTS.
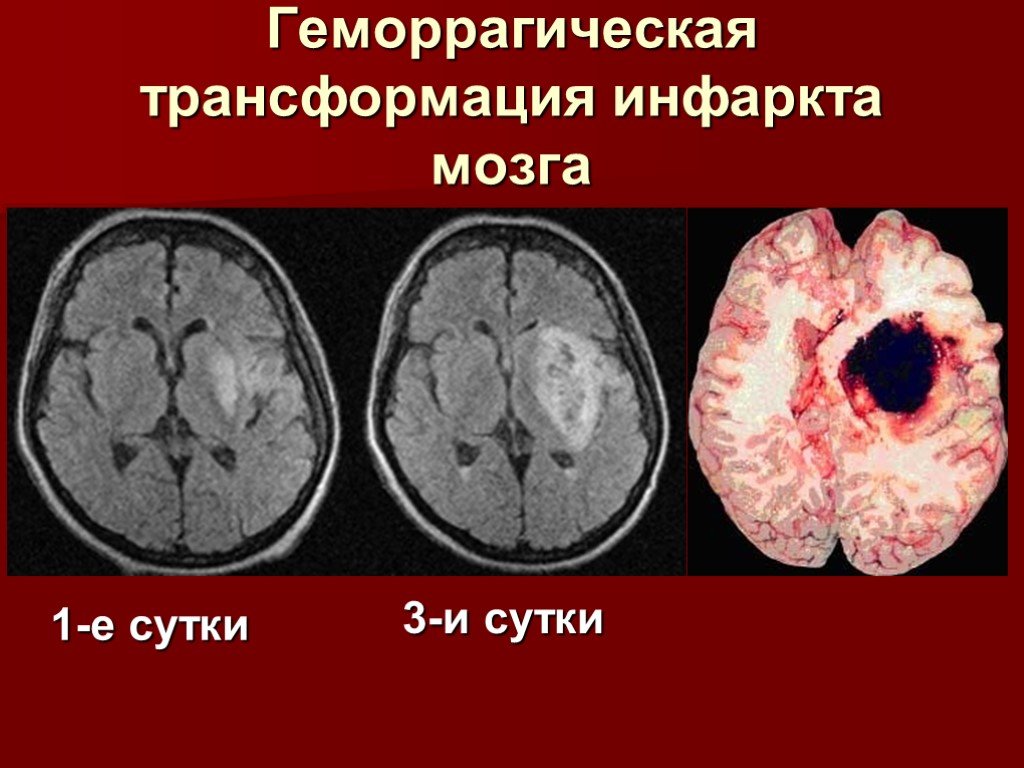
КТ‑перфузия в соответствии с клиническими протоколами, как отметил К.Н. Журавлев, не показана пациентам, поступившим в стационар в 6‑часовое терапевтическое окно. Однако она необходима в случае при ОНМК после ночного сна при поступлении больных в период 6–24 ч после первых симптомов инсульта. В этом случае она помогает оценить степень коллатерального кровотока и жизнеспособность вещества мозга после окклюзии. КТ‑перфузия позволяет выделить ядро инфаркта со скоростью кровотока 30–40% от нормальной и область пенумбры, т. е. участка живой ткани в зоне риска. Пенумбра определяется по задержке времени контрастирования ишемизированных зон. Если в нормальных тканях задержка составляет 4 с., то в пенумбре она увеличивается до 6 с. и более. Объем патологически измененных зон необходимо подсчитывать в миллилитрах, что возможно только при использовании специализированного программного обеспечения.
е. участка живой ткани в зоне риска. Пенумбра определяется по задержке времени контрастирования ишемизированных зон. Если в нормальных тканях задержка составляет 4 с., то в пенумбре она увеличивается до 6 с. и более. Объем патологически измененных зон необходимо подсчитывать в миллилитрах, что возможно только при использовании специализированного программного обеспечения.
АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯ ПРИ ФП
ФП в 5 раз увеличивает риск инсульта, который у таких пациентов, кроме того, протекает тяжелее, чем у пациентов без ФП. Увеличивается и число летальных исходов после инсульта – на 25% в течение 30 дней и 50% в течение года. Поэтому, как отметила кардиолог ГКБ им. И.В. Давыдовского, к.м.н., доцент А.И. Калинская, важно оценивать риск эмболических осложнений и кровотечений при назначении антикоагулянтной терапии, по возможности воздействуя на модифицируемые факторы риска. Они включают анемию, почечную недостаточность, артериальную гипертензию, плохой контроль МНО, сопутствующую терапию антиагрегантами и НПВС. При назначении терапии пациентам с ФП следует учитывать преимущество ОАК (варфарин) перед антиагрегантными средствами (аспирин+клопидогрель) не только в отношении частоты инсульта, но и любых первичных конечных точек.
При назначении терапии пациентам с ФП следует учитывать преимущество ОАК (варфарин) перед антиагрегантными средствами (аспирин+клопидогрель) не только в отношении частоты инсульта, но и любых первичных конечных точек.
Своевременная диагностика патогенетического варианта ишемического инсульта способствует профилактике дальнейших сосудистых катастроф
Однако прием варфарина сопряжен с необходимостью решать множество проблем, связанных, в частности, с необходимостью лабораторного контроля, трудностью титрации дозы, несовпадением значений МНО в разных лабораториях. Поэтому в последние годы варфарин стали заменять новым классом ОАК, в числе которых А.И. Калинская назвала дабигатран, апиксабан, ривароксабан и эдоксабан. Все они показали сравнимую эффективность с варфарином в отношении предупреждения инсульта и сопровождались меньшим риском массивных кровотечений. Выбор конкретного НОАК из этого списка должен проводиться с учетом ряда факторов: доступности препарата, особенностей метаболизма (печень/почки), лекарственного взаимодействия, риска геморрагических или тромбоэмболических событий.
Риск эмболических осложнений и кровотечений при назначении антикоагулянтной терапии можно снизить, воздействуя на модифицируемые факторы риска
При назначении НОАК рекомендуется использовать стандартные дозы, а при их снижении руководствоваться четкими критериями (рис. 2). А.И. Калинская отметила также возможность применения антидотов НОАК при тяжелых кровотечениях. Так, идаруцизумаб показан при кровотечениях на фоне приема дабигатрана, а при его отсутствии могут быть использованы концентраты факторов свертываемости.
Вопросов по приему различных ОАК возникает достаточно много, они касаются перехода с одного препарата на другой, оценки их пользы/риска, комбинации с другими лекарственными средствами. В рамках одного семинара можно было лишь кратко осветить основные положения терапии пациентов с инсультами.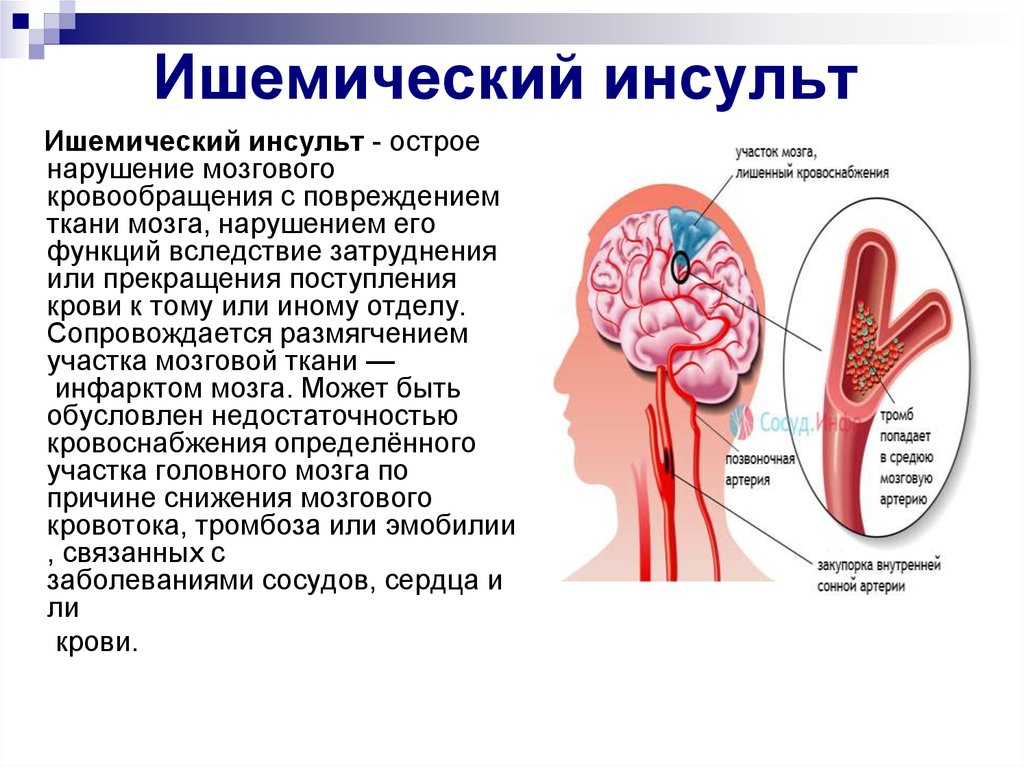
Какие бывают патогенетические варианты ишемического инсульта
Актуальность проблемы
Проблема предупреждения и лечения острых нарушений мозгового кровообращения (ОНМК), в последние годы, становится все более актуальной. Ежегодно в мире мозговой удар настигает более 15 млн. человек. Рост заболеваемости инсультом связывают с увеличением средней продолжительности жизни в большинстве стран мира. Однако, существует и другая тенденция — инсульт молодеет. В последние годы не менее 20% ОНМК диагностируется у больных моложе 50 лет [4,7,8]. Несмотря на внедрение в клиническую практику новых методов диагностики и лечения заболеваний сердечно-сосудистой системы, в ближайшие годы существенного снижения заболеваемости инсультом ожидать нельзя.
Гетерогенность инсульта предполагает существование различных механизмов нарушения мозгового кровообращения, которые укладываются в треугольнике: «сердце-сосуды-кровь» [1,3,8]. Современное кардионеврологическое обследование (исследование центральной и церебральной гемодинамики, лабораторные тесты, визуализация мозга и сосудов), позволяет выявить относительно небольшое количество клинических, клинико-лабораторных и клинико-инструментальных синдромов, «ответственность» которых за ОНМК доказана достоверным уменьшением числа инсультов при использовании соответствующей тактики превентивного лечения – репрезентативных синдромов.
 Такими синдромами являются: артериальная гипертония, нарушения сердечного ритма, гиперкоагуляция крови, атеросклеротические стенозы и окклюзии брахиоцефальных артерий [2,5,6]. Существуют и другие патологические процессы, течение которых осложняется ОНМК, но коррекция этих четырех симптомокомплексов имеет наибольший превентивный потенциал и может оказать заметное влияние на заболеваемость. Антигипертензивная терапия способна снизить частоту ОНМК на 28 – 30%, антикоагулянты и дезагреганты – на 30 – 60%, реконструктивные операции при стенозировании брахиоцефальных артерий – на 12-35% [5-8].
Такими синдромами являются: артериальная гипертония, нарушения сердечного ритма, гиперкоагуляция крови, атеросклеротические стенозы и окклюзии брахиоцефальных артерий [2,5,6]. Существуют и другие патологические процессы, течение которых осложняется ОНМК, но коррекция этих четырех симптомокомплексов имеет наибольший превентивный потенциал и может оказать заметное влияние на заболеваемость. Антигипертензивная терапия способна снизить частоту ОНМК на 28 – 30%, антикоагулянты и дезагреганты – на 30 – 60%, реконструктивные операции при стенозировании брахиоцефальных артерий – на 12-35% [5-8].  Репрезентативные синдромы создают необходимые условия для декомпенсации мозгового кровообращения, но не являются причинами инсульта. Артериальная гипертония может всю жизнь сопутствовать больному и никогда не осложниться ОНМК. Обнаруженный при ультразвуковом исследовании критический стеноз сонной артерии формируется много лет и не всегда приводит к инсульту. Между патологическим процессом, создающим условия для ОНМК, и мозговой катастрофой всегда происходит событие, которое декомпенсирует гемодинамические и гемостатические резервы. В патокинезе ОНМК существует одна общая закономерность: инсульт развивается внезапно на фоне длительного существования патологических процессов. Беспричинных инсультов не бывает. Непосредственной причиной инсульта всегда является гемодинамический криз – острое нарушение системной или региональной гемодинамики, приводящее к повреждению зависимых органов [8,10].
Репрезентативные синдромы создают необходимые условия для декомпенсации мозгового кровообращения, но не являются причинами инсульта. Артериальная гипертония может всю жизнь сопутствовать больному и никогда не осложниться ОНМК. Обнаруженный при ультразвуковом исследовании критический стеноз сонной артерии формируется много лет и не всегда приводит к инсульту. Между патологическим процессом, создающим условия для ОНМК, и мозговой катастрофой всегда происходит событие, которое декомпенсирует гемодинамические и гемостатические резервы. В патокинезе ОНМК существует одна общая закономерность: инсульт развивается внезапно на фоне длительного существования патологических процессов. Беспричинных инсультов не бывает. Непосредственной причиной инсульта всегда является гемодинамический криз – острое нарушение системной или региональной гемодинамики, приводящее к повреждению зависимых органов [8,10].Гемодинамический криз и его варианты
Гемодинамический криз — результат накопления последовательно и параллельно протекающих патологических процессов, создающих «критическую массу» органических и функциональных нарушений, которые при определенном стечении обстоятельств, приводят к возникновению лавинообразно нарастающих изменений, затрагивающих всю систему кровообращения. Для большинства хронических заболеваний сердечно-сосудистой системы характерно длительное течение с периодами обострений. Но в некоторых случаях такое обострение носит характер обвала, криза (crisis – внезапная перемена в течении болезни). Криз отличается от обострения болезни скоротечностью событий и декомпенсацией кровообращения на уровне центральной, региональной гемоднамики и микроциркуляции. Различные варианты гемодинамических кризов описывали отечественные и зарубежные клиницисты (P.Jacob, D.Brown, Ф.Л.Мясников, У.И.Шмидт, Н.К.Боголепов, И.В.Шхвацабая и другие). В клинической практике широко известны такие понятия как гипертонический (гипертензивный) или сосудистый криз. В последние годы, с внедрением в клиническую практику методов мониторирования ЭКГ и АД, ультразвуковых методов исследования сосудов, появилась возможность расширить представления о кризовом течении заболеваний сердечно-сосудистой системы. Оказалось, что внезапные нарушения системной и региональной гемодинамики, которые можно характеризовать как гемодинамический криз, возникают в результате декомпенсации работы сердца, нарушения сердечного ритма, изменений сосудистого тонуса, увеличения вязкости крови, внутрисосудистого тромбообразования, активации атеросклеротических бляшек, гормональных нарушений.
Для большинства хронических заболеваний сердечно-сосудистой системы характерно длительное течение с периодами обострений. Но в некоторых случаях такое обострение носит характер обвала, криза (crisis – внезапная перемена в течении болезни). Криз отличается от обострения болезни скоротечностью событий и декомпенсацией кровообращения на уровне центральной, региональной гемоднамики и микроциркуляции. Различные варианты гемодинамических кризов описывали отечественные и зарубежные клиницисты (P.Jacob, D.Brown, Ф.Л.Мясников, У.И.Шмидт, Н.К.Боголепов, И.В.Шхвацабая и другие). В клинической практике широко известны такие понятия как гипертонический (гипертензивный) или сосудистый криз. В последние годы, с внедрением в клиническую практику методов мониторирования ЭКГ и АД, ультразвуковых методов исследования сосудов, появилась возможность расширить представления о кризовом течении заболеваний сердечно-сосудистой системы. Оказалось, что внезапные нарушения системной и региональной гемодинамики, которые можно характеризовать как гемодинамический криз, возникают в результате декомпенсации работы сердца, нарушения сердечного ритма, изменений сосудистого тонуса, увеличения вязкости крови, внутрисосудистого тромбообразования, активации атеросклеротических бляшек, гормональных нарушений. Термин «гемодинамический криз», очевидно шире, чем «сосудистый» или «гипертонический».
Термин «гемодинамический криз», очевидно шире, чем «сосудистый» или «гипертонический».
Гемодинамические кризы могут быть вызваны стрессом, изменениями климатических факторов, нарушениями режима или характера питания и другими факторами дестабилизации. Клинические данные, анамнез и современные методы исследования дают возможность выделять и идентифицировать восемь вариантов гемодинамических кризов: гипертонический, гипотонический, аритмический, коронарный, ангиодистонический, гемореологический, нейроэндокринный, обтурационный [8].
Гипертонический криз – одна из наиболее частых причин развития ОНМК. С гипертоническим кризом связано абсолютное большинство ОНМК, 20% поводов для вызова бригад скорой помощи и 30% всех оснований, требующих оказания неотложной помощи. Повышение артериального давления часто сопутствует другим гемодинамическим кризам, является следствием, а не причиной церебральной ишемии. Поскольку регистрация высоких цифр АД осуществляется, чаще всего, в ходе развития криза, можно предполагать, что с гипертоническим кризом связано меньшее количество ОНМК, чем это принято считать. Гипертонический криз может быть спровоцирован стрессом, употреблением алкоголя, отменой приема лекарств. В зависимости от сократительной функции сердца и состояния сосудов мозга, гипертонический криз может привести к развитию лакунарного, гемодинамического ишемического инсульта [7-9]. Снижение сократительной способности миокарда (фракции выброса и минутного объема крови) у больных гипертонической болезнью позволяет предполагать развитие лакунарного или крупноочагового гемодинамического инфаркта мозга. Другие признаки надвигающейся мозговой катастрофы отражает суточный профиль АД: извращение суточного ритма, ночные эпизоды повышения АД и другие изменения можно обнаружить задолго до инсульта.
Гипертонический криз может быть спровоцирован стрессом, употреблением алкоголя, отменой приема лекарств. В зависимости от сократительной функции сердца и состояния сосудов мозга, гипертонический криз может привести к развитию лакунарного, гемодинамического ишемического инсульта [7-9]. Снижение сократительной способности миокарда (фракции выброса и минутного объема крови) у больных гипертонической болезнью позволяет предполагать развитие лакунарного или крупноочагового гемодинамического инфаркта мозга. Другие признаки надвигающейся мозговой катастрофы отражает суточный профиль АД: извращение суточного ритма, ночные эпизоды повышения АД и другие изменения можно обнаружить задолго до инсульта.
В последние годы исследователи стали обращать внимание на абсолютную и относительную артериальную гипотонию у больных, адаптированных к высоким цифрам АД. Эпизоды снижения системного АД приобретают особое значение у больных с выраженными атеросклеротическими изменениями брахиоцефальных артерий [8]. Гипотонические кризы характерны для больных паркинсонизмом, они могут быть следствием неадекватного применения антигипертензивных лекарственных средств. По данным Научного центра неврологии не менее 21% ОНМК происходит на фоне значительного снижения АД, вызванного неадекватным использованием различных лекарственных средств. Гипотонический криз может быть связан с нарушениями суточного ритма АД, которые можно выявить методом длительного мониторирования. Идиопатическая артериальная гипотония приобретает клиническое значение в пожилом возрасте, вместе с проявлениями ишемической болезни сердца. Гипотонический криз может быть вызван интоксикацией, инфекцией, болью и другими внутренними и внешними факторами. Гипотонические кризы ассоциируются с серийными преходящими нарушениями мозгового кровообращения и гемодинамическими инсультами с мультифокальными мелкоочаговыми повреждениями мозга.
Гипотонические кризы характерны для больных паркинсонизмом, они могут быть следствием неадекватного применения антигипертензивных лекарственных средств. По данным Научного центра неврологии не менее 21% ОНМК происходит на фоне значительного снижения АД, вызванного неадекватным использованием различных лекарственных средств. Гипотонический криз может быть связан с нарушениями суточного ритма АД, которые можно выявить методом длительного мониторирования. Идиопатическая артериальная гипотония приобретает клиническое значение в пожилом возрасте, вместе с проявлениями ишемической болезни сердца. Гипотонический криз может быть вызван интоксикацией, инфекцией, болью и другими внутренними и внешними факторами. Гипотонические кризы ассоциируются с серийными преходящими нарушениями мозгового кровообращения и гемодинамическими инсультами с мультифокальными мелкоочаговыми повреждениями мозга.
Коронарный криз – одна из частых, но не всегда диагностируемых причин декомпенсации мозгового кровообращения. Не только стенокардия, но и безболевая ишемия миокарда способны привести к снижению эффективной работы сердца. Не менее, чем у 16% больных с гемодинамическим инсультом при холтеровском мониторировании выявляются транзиторные эпизоды безболевой ишемии миокарда [9-12]. Кроме того, коронарная недостаточность часто сопровождается кратковременными нарушениями ритма сердца (желудочковой экстрасистолией, фибрилляцией предсердий). Коронарный атеросклероз, проявляющийся стенокардией или безболевой ишемией миокарда, как правило, сочетается со стенозами брахиоцефальных артерий. Кратковременное снижение ударного объема крови не может быть компенсировано патологически измененной артериальной системой мозга. Коронарный криз является причиной сочетанного повреждения сердца и мозга при инфаркте миокарда. Предикторы коронарного криза обнаруживаются на ЭКГ (признаки коронарной недостаточности, желудочковая экстрасистолия). С большей вероятностью коронарные эпизоды можно выявить при суточном мониторировании ЭКГ или нагрузочных пробах.
Не только стенокардия, но и безболевая ишемия миокарда способны привести к снижению эффективной работы сердца. Не менее, чем у 16% больных с гемодинамическим инсультом при холтеровском мониторировании выявляются транзиторные эпизоды безболевой ишемии миокарда [9-12]. Кроме того, коронарная недостаточность часто сопровождается кратковременными нарушениями ритма сердца (желудочковой экстрасистолией, фибрилляцией предсердий). Коронарный атеросклероз, проявляющийся стенокардией или безболевой ишемией миокарда, как правило, сочетается со стенозами брахиоцефальных артерий. Кратковременное снижение ударного объема крови не может быть компенсировано патологически измененной артериальной системой мозга. Коронарный криз является причиной сочетанного повреждения сердца и мозга при инфаркте миокарда. Предикторы коронарного криза обнаруживаются на ЭКГ (признаки коронарной недостаточности, желудочковая экстрасистолия). С большей вероятностью коронарные эпизоды можно выявить при суточном мониторировании ЭКГ или нагрузочных пробах. Коронарный криз обычно приводит к развитию гемодинамического или кардиоэмболического инсульта.
Коронарный криз обычно приводит к развитию гемодинамического или кардиоэмболического инсульта.
Аритмический криз (пароксизмальные формы нарушений ритма сердца) – одна из самых частых причин ОНМК. Пароксизм мерцательной аритмии снижает минутный объем крови на 20 – 25%, что составляет патофизиологическую основу для ишемии мозга [1,11]. Фибрилляция предсердий создает условия для образования тромбов в полостях сердца. Известно, что синдром слабости синусового узла встречается значительно чаще у пациентов с инсультами не установленной этиологии. У 48% больных с инсультом, пароксизмы аритмии протекали бессимптомно [8,10-12]. Предикторы ОНМК в этом случае – выявляемые при суточном мониторировании ЭКГ пароксизмальные нарушения ритма. В некоторых случаях при ЭхоКГ удается обнаружить пристеночные тромботические массы в полостях сердца или спонтанные эхо-контрастные тени. Аритмический криз является основной причиной кардиоэмболического инсульта. В некоторых случаях, при выраженных атеросклеротических изменениях артериальной системы мозга, возможен гемодинамический механизм церебральной ишемии.
Ангиодистонический криз обычно сопутствует вертеброгенным нарушениям сосудистого тонуса. Типичная иллюстрация – синдром позвоночной артерии. Для ангиодистонических кризов характерны эпизоды недостаточности кровообращения в вертебрально-базилярной системе. Проявлением ангиодистонического криза может служить приступ мигрени. Тяжелые формы мигрени предполагают возможность очаговых повреждений мозга (мигренозный инсульт). Вторичные ишемические повреждения головного мозга, возникающие при внутричерепных кровоизлияниях, являются следствием спазма внутримозговых артерий. Предикторы ангиодистонического криза выявляются при транскраниальной ультразвуковой допплерографии – асимметрия, увеличение линейной скорости в дистальных отрезках внутримозговых артерий. Ангиодистонический криз чаще приводит к преходящим нарушениям мозгового кровообращения, реже – к развитию гемодинамического ишемического инсульта с мелкоочаговыми повреждениями мозга [8].
Нейроэндокринный криз – всегда следствие гормональной дисфункции или нарушений нейрогенной регуляции. Нейроэндокринные кризы можно наблюдать у женщин в период климакса, у больных с тиреотоксикозом. Наиболее демонстративны проявления нейроэндокринного криза у больных с нейроэндокринными опухолями. В этом случае патофизиологической основой повреждения сердечно-сосудистой системы является массивный выброс в кровь катехоламинов, который кроме выраженных гемодинамических эффектов, приводит к повреждению миокарда и сосудистой стенки. Не случайно феохромоцитома примерно в 20% случаев дебютирует ОНМК. Не только феохромоцитома, но и карциноиды, другие опухоли, могут стимулировать нейроэндокринные кризы. Предикторами нейроэндокринного криза являются, определяемые соответствующими лабораторными тестами, признаки, подтверждающие повышенное содержание в крови катехоламинов, гистамина, серотонина и продуктов их деградации. Нейроэндокринные кризы приводят к развитию гемодинамических и атеротромботических ишемических инсультов [7-9].
Нейроэндокринные кризы можно наблюдать у женщин в период климакса, у больных с тиреотоксикозом. Наиболее демонстративны проявления нейроэндокринного криза у больных с нейроэндокринными опухолями. В этом случае патофизиологической основой повреждения сердечно-сосудистой системы является массивный выброс в кровь катехоламинов, который кроме выраженных гемодинамических эффектов, приводит к повреждению миокарда и сосудистой стенки. Не случайно феохромоцитома примерно в 20% случаев дебютирует ОНМК. Не только феохромоцитома, но и карциноиды, другие опухоли, могут стимулировать нейроэндокринные кризы. Предикторами нейроэндокринного криза являются, определяемые соответствующими лабораторными тестами, признаки, подтверждающие повышенное содержание в крови катехоламинов, гистамина, серотонина и продуктов их деградации. Нейроэндокринные кризы приводят к развитию гемодинамических и атеротромботических ишемических инсультов [7-9].
Гемореологический криз – одна из наиболее частых причин декомпенсации мозгового кровообращения. Гиперкоагуляция, гипервискозность крови служат основой для системных нарушений микроциркуляции. При определенных условиях (гипертермия, обезвоживание, интоксикация, стресс) системные расстройства регионального кровообращения могут привести к блокаде микроциркуляции. Микроциркуляторный блок создает условия для ишемии стандартных органов-мишеней: мозг, сердце, почки. Артериальная гипертония в таких случаях носит симптоматический характер и лишь увеличивает нагрузку на миокард. Гемореологический криз осложняется ОНМК по типу гемореологической микроокклюзии (гемореологический инсульт), гемодинамическим или атеротромботическим инсультом. Предикторами гемореологического криза могут служить результаты лабораторных исследований, свидетельствующие о гипергкоагуяции, снижении гемостатических резервов и высокой вязкости крови.
Гиперкоагуляция, гипервискозность крови служат основой для системных нарушений микроциркуляции. При определенных условиях (гипертермия, обезвоживание, интоксикация, стресс) системные расстройства регионального кровообращения могут привести к блокаде микроциркуляции. Микроциркуляторный блок создает условия для ишемии стандартных органов-мишеней: мозг, сердце, почки. Артериальная гипертония в таких случаях носит симптоматический характер и лишь увеличивает нагрузку на миокард. Гемореологический криз осложняется ОНМК по типу гемореологической микроокклюзии (гемореологический инсульт), гемодинамическим или атеротромботическим инсультом. Предикторами гемореологического криза могут служить результаты лабораторных исследований, свидетельствующие о гипергкоагуяции, снижении гемостатических резервов и высокой вязкости крови.
Обтурационный криз предполагает острую закупорку артерии среднего или крупного калибра тромбом или фрагментом распадающейся атеросклеротической бляшки. Расслаивание стенки артериального ствола так же может стать причиной обтурации. Закупорка крупной артерии обычно возникает в местах наиболее выраженных артеросклеротических изменений вследствие «активации» бляшек или тромботических осложнений. Предикторы обтурационного криза — рыхлые, гетерогенные бляшки, атеросклеротические стенозы и окклюзии брахиоцефальных артерий, обнаруживаемые при ультразвуковом сканировании или ангиографии. В результате обтурационного криза развиваются тяжелые крупноочаговые ишемические повреждения мозга, протекающие по типу атеротромботического инсульта.
Закупорка крупной артерии обычно возникает в местах наиболее выраженных артеросклеротических изменений вследствие «активации» бляшек или тромботических осложнений. Предикторы обтурационного криза — рыхлые, гетерогенные бляшки, атеросклеротические стенозы и окклюзии брахиоцефальных артерий, обнаруживаемые при ультразвуковом сканировании или ангиографии. В результате обтурационного криза развиваются тяжелые крупноочаговые ишемические повреждения мозга, протекающие по типу атеротромботического инсульта.
Гемодинамические кризы и их связь с патогенетическими подтипами ишемического инсульта
Патофизиология различных вариантов гемодинамических кризов имеет много общего. Критическое повышение или снижение системного АД, коронарная недостаточность, аритмия с нарушениями внутрисердечной гемодинамики, микроциркуляторный блок или закупорка крупной артерии – приводят к возникновению комплекса патологических процессов, которые завершаются развитием инсульта [8,10]. Эксплозивное течение гемодинамического криза связано с феноменом взаимного отягощения, который характерен для декомпенсированных патологических процессов. Гиперкоагуляция и артериальная гипертония составляют ядро любого гемодинамического криза, выступая в качестве пускового и (или) поддерживающего механизма каскада взаимосвязанных нарушений системной и региональной гемодинамики и микроциркуляции. Несмотря на общность патофизиологии различных вариантов гемодинамических кризов, они ассоциируются с определенными подтипами ишемических инсультов. Целенаправленный анализ 200 наблюдений больных, госпитализированных в специализированный неврологический стационар, позволил провести необходимые сопоставления (Таблица 1).
Гиперкоагуляция и артериальная гипертония составляют ядро любого гемодинамического криза, выступая в качестве пускового и (или) поддерживающего механизма каскада взаимосвязанных нарушений системной и региональной гемодинамики и микроциркуляции. Несмотря на общность патофизиологии различных вариантов гемодинамических кризов, они ассоциируются с определенными подтипами ишемических инсультов. Целенаправленный анализ 200 наблюдений больных, госпитализированных в специализированный неврологический стационар, позволил провести необходимые сопоставления (Таблица 1).
Таблица 1. Гемодинамические кризы и их связь с патогенетическими подтипами ишемического инсульта
| Гемодинамический криз | Связь с инсультом | Патогенетический подтип ишемического инсульта |
| Гипертонический | 30% | Лакунарный, гемодинамический |
| Аритмический | 24% | Кардиоэмболический, гемодинамический |
| Обтурационный | 16% | Атеротромботический |
| Гемореологический | 10% | Гемореологическая микроокклюзия, атеротромботический |
| Гипотонический | 8% | Гемодинамический |
| Ангиодистонический | 6% | Гемодинамический |
| Коронарный | 4% | Кардиоэмболический, гемодинамический |
| Нейроэндокринный | 2% | Лакунарный, атеротромботический, гемодинамический |
Необходимость клинической оценки гемодинамических кризов обусловлена тем важным обстоятельством, что кризы предшествуют ОНМК и определяют характер будущего инсульта. Результаты тщательного кардионеврологического обследования в большинстве случаев дают достаточные основания предполагать развитие того или иного варианта гемодинамического криза. [8,12]. Предполагая возможную причину ОНМК можно прогнозировать патогенетический подтип инсульта. Полученные сведения могут оказать существенное влияние на тактику ведения больного. Превентивное лечение становится эффективным, если оно с достаточной степенью надежности устраняет гемодинамические кризы – непосредственные причины ОНМК. Концепция гемодинамических кризов в превентивной кардионеврологии позволяет выработать оптимальные алгоритмы клинического, лабораторного и инструментального обследования больных и, в конечном счете, повысить эффективность индивидуальных профилактических программ.
Результаты тщательного кардионеврологического обследования в большинстве случаев дают достаточные основания предполагать развитие того или иного варианта гемодинамического криза. [8,12]. Предполагая возможную причину ОНМК можно прогнозировать патогенетический подтип инсульта. Полученные сведения могут оказать существенное влияние на тактику ведения больного. Превентивное лечение становится эффективным, если оно с достаточной степенью надежности устраняет гемодинамические кризы – непосредственные причины ОНМК. Концепция гемодинамических кризов в превентивной кардионеврологии позволяет выработать оптимальные алгоритмы клинического, лабораторного и инструментального обследования больных и, в конечном счете, повысить эффективность индивидуальных профилактических программ.
Литература
1. Артериальная гипертония и профилактика инсульта. (Краткое руководство для врачей под редакцией Верещагина Н.В. и Чазова Е.И). -М:, -1996. –31 с.
2. Бокарев И.Н. Атеросклероз – проблема современности. Тромбоз, гемостаз и реология. 2000; 1: 6-7.
Тромбоз, гемостаз и реология. 2000; 1: 6-7.
3. Верещагин Н.В. Гетерогенность инсульта: взгляд с позиций клинициста//Журнал неврологии и психиатрии им. С.С.Корсакова. 2003. 9: 8-9.
4. Виленский Б.С. Современная тактика борьбы с инсультом. –СПб.: ООО «Издательство ФОЛИАНТ», 2005. – 288 с.
5. Гогин Е.Е. Синдром артериальной гипертонии как признак дезадаптационных нарушений. Клин. Мед. 2002; 11: 4 – 7.
6. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина. 2000. –328 с.
7. Симоненко В.Б., Широков Е.А., Виленский Б.С. Профилактика инсульта: традиции и перспективы//Военно-мед. журн. 1999. 4: 31 — 34.
8. Симоненко В.Б., Широков Е.А. Превентиваня кардионеврология. –СПб: ООО «Издательство ФОЛИАНТ», 2008. – 224 с.
9. Суслина З.А., Гераскина Л.А., Фонякин А.В. Особенности антигипертензивной терапии при цереброваскулярных заболеваниях. Клиническая фармакология и терапия. 2002; 5: 83 – 87.
10. Широков Е.А., Симоненко В.Б. Современные представления о роли гемодинамических кризов в этиологии и патогенезе инсульта. Клиническая медицина. -2001. 8: 4 – 7.
Широков Е.А., Симоненко В.Б. Современные представления о роли гемодинамических кризов в этиологии и патогенезе инсульта. Клиническая медицина. -2001. 8: 4 – 7.
11. Фонякин А.В., Гераскина Л.А., Суслина З.А. Патогенетическая оценка нарушений ритма сердца и ишемии миокарда при гемодинамическом инсульте. Клин. Мед. –2002; 10: 17-20.
12. Фонякин А.В., Суслина З.А., Гераскина Л.А. Кардиологическая диагностика при ишемическом инсульте. –СПб.: ИНКАРТ, 2005. – 224 с.
Гемодинамические нарушения и риск инсульта: доказать это
Передовая редакционная статья
Колин П. Дердейн
Американский журнал нейрорадиологии, февраль 2001 г., 22 (2) 233-234;
- Статья
- Информация и показатели
- Ссылки
Miyazawa et al (стр. 243) в этом выпуске AJNR пациенты со средней артерио-окклюзией и бессимптомным течением при окклюзии внутренней сонной артерии (ВСА). Кроме того, они сообщают о связи между появлением новых ишемических поражений на МРТ-изображениях и наличием гемодинамических нарушений.
Клинические исследования гемодинамических факторов риска инсульта, такие как настоящее исследование, сложны по многим причинам. Многие физиологические, клинические и эпидемиологические проблемы остаются в значительной степени неясными. Существующие клинические методы гемодинамической оценки основаны на различных гемодинамических механизмах и косвенно основаны на предположениях (некоторые из них, вероятно, неточны) относительно лежащих в основе физиологических процессов. Патофизиологические механизмы, посредством которых тяжелые гемодинамические нарушения могут предрасполагать к ишемическому инсульту, неизвестны. Кроме того, связь между аномальным результатом большинства, но не всех, этих клинических методов и риском инсульта не доказана (1). Для каждого из доступных методов гемодинамической оценки требуется эмпирическое доказательство связи аномального гемодинамического ответа и риска будущего инсульта. В этой области еще предстоит собрать много важных данных, и это должно быть сделано тщательным образом. Наконец, после установления связи следующей задачей является доказательство того, что связь является причинно-следственной: т. е. исправление гемодинамической аномалии с помощью медицинского или механического вмешательства фиксирует риск инсульта. Пилотные данные Миядзавы и др., опубликованные в этом выпуске 9-го0020 AJNR следует интерпретировать с учетом этих соображений.
Наконец, после установления связи следующей задачей является доказательство того, что связь является причинно-следственной: т. е. исправление гемодинамической аномалии с помощью медицинского или механического вмешательства фиксирует риск инсульта. Пилотные данные Миядзавы и др., опубликованные в этом выпуске 9-го0020 AJNR следует интерпретировать с учетом этих соображений.
Когда артерия сильно сужается или полностью закупоривается, давление в сосуде за пределами поражения может падать. Артериальное давление в дистальном отделе кровообращения, питаемом этим сосудом, будет зависеть не только от степени сужения, но и от способности коллатеральных сосудов обеспечивать кровоток. Круг Уиллиса обеспечивает адекватный коллатеральный кровоток для многих пациентов с полной окклюзией общей или ВСА, например (2). Однако у некоторых пациентов эти коллатеральные каналы не поддерживают нормальное артериальное давление. Экспериментальные исследования, в основном на животных и с участием острой и тяжелой гипотензии, показали, что начальным рефлекторным ответом цереброваскулярной системы является ауторегуляторная вазодилатация мелких артериол (3). Это служит для поддержания нормального кровотока за счет снижения сосудистого сопротивления. При дальнейшем снижении давления способность ауторегуляции превышается, и кровоток пассивно падает в зависимости от давления. Симптомы ишемии не обязательно развиваются при таком снижении кровотока, так как мозг может увеличивать долю извлечения кислорода из крови (фракция извлечения кислорода) и поддерживать нормальный метаболизм кислорода и функцию мозга (4). Однако степень, в которой эти различные физиологические реакции на снижение перфузионного давления сохраняются у людей с хроническими заболеваниями, неизвестна.
Это служит для поддержания нормального кровотока за счет снижения сосудистого сопротивления. При дальнейшем снижении давления способность ауторегуляции превышается, и кровоток пассивно падает в зависимости от давления. Симптомы ишемии не обязательно развиваются при таком снижении кровотока, так как мозг может увеличивать долю извлечения кислорода из крови (фракция извлечения кислорода) и поддерживать нормальный метаболизм кислорода и функцию мозга (4). Однако степень, в которой эти различные физиологические реакции на снижение перфузионного давления сохраняются у людей с хроническими заболеваниями, неизвестна.
Кроме того, не установлен механизм, посредством которого тяжелое нарушение гемодинамики может привести к последующему ишемическому инфаркту. Одна из гипотез заключается в том, что наличие тяжелых гемодинамических нарушений может увеличить вероятность ишемического повреждения вследствие эмболии. Транскраниальные допплеровские исследования сообщают о частых клинически бессимптомных эмболических событиях у пациентов с атеросклеротическим заболеванием (5).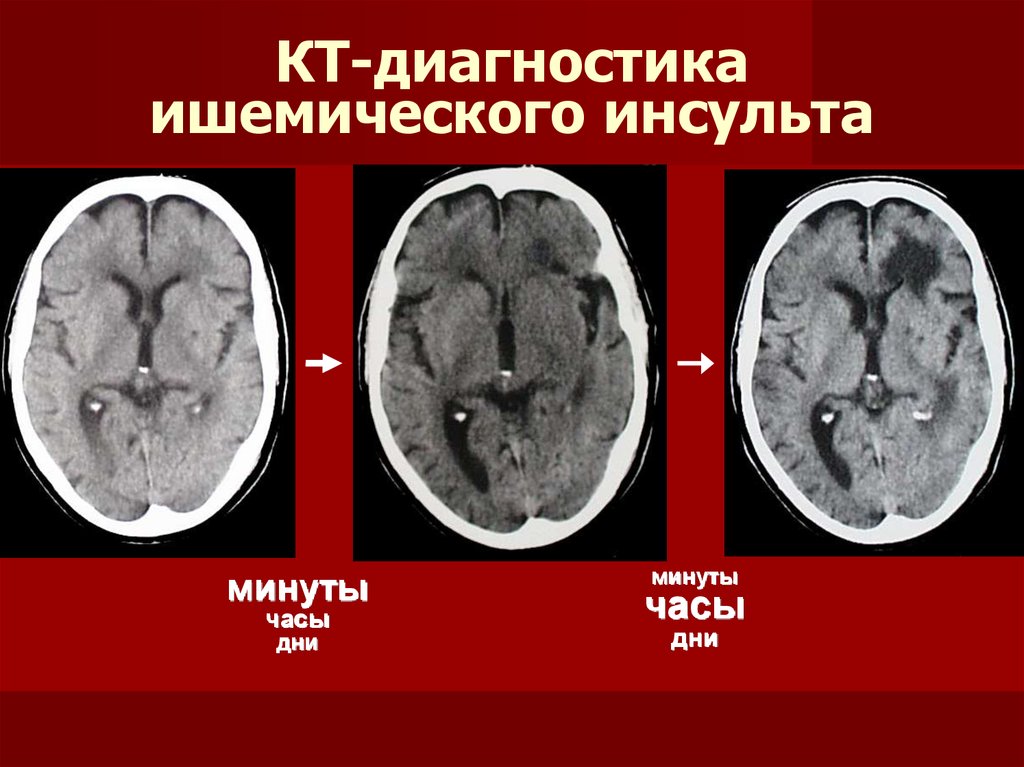 Эмбол, застрявший в сосуде, в котором артериальное давление и кровоток низкие, а экстракция тканей кислородом уже максимальна, с большей вероятностью может вызвать ишемическое повреждение. Эта гипотеза подтверждается исследованиями на животных с использованием микросферической модели эмболического инсульта в нормальных и коллатеральных полушариях (6).
Эмбол, застрявший в сосуде, в котором артериальное давление и кровоток низкие, а экстракция тканей кислородом уже максимальна, с большей вероятностью может вызвать ишемическое повреждение. Эта гипотеза подтверждается исследованиями на животных с использованием микросферической модели эмболического инсульта в нормальных и коллатеральных полушариях (6).
Определение нарушений гемодинамики у живых людей, как правило, производится на основе вывода с использованием одного из трех различных клинических подходов. Первые два теоретически проверяют наличие ауторегуляторной вазодилатации. В первом методе наличие ауторегуляторной вазодилатации предполагается, когда нормальный устойчивый ответ CBF или скорости кровотока на вазодилататорную нагрузку ослаблен или отсутствует. Метод парного потока использовался в исследовании Miyazawa et al., с количественными измерениями CBF, выполненными с помощью стабильного ксенона CT (Xe-CT) до и после введения ацетазоламида, мощного сосудорасширяющего средства. При втором подходе предполагается наличие ауторегуляторной вазодилатации, когда увеличиваются измерения среднего времени транзита или церебрального объема крови. Третий подход основан на измерении увеличения извлечения кислорода.
При втором подходе предполагается наличие ауторегуляторной вазодилатации, когда увеличиваются измерения среднего времени транзита или церебрального объема крови. Третий подход основан на измерении увеличения извлечения кислорода.
Корреляция между этими методами может быть очень плохой (1). Например, гемодинамические исследования пациентов с окклюзионным заболеванием сонных артерий, сравнивающие сосудорасширяющие эффекты ацетазоламида с гиперкапнией или физиологической активацией, выявили поразительные расхождения (7, 8). Kazumata и коллеги измерили увеличение CBF, связанное с гиперкапнией, у 10 из 11 пациентов, у которых отсутствовало повышение или парадоксальное снижение CBF после введения ацетазоламида (8). Расширение сосудов в ответ на ацетазоламид опосредуется механизмами, отличными от механизмов ауторегуляции (9).). Дополнительным мешающим фактором при использовании Xe-CT для измерения CBF является то, что ксенон сам по себе также является мощным сосудорасширяющим средством. Вместо аналогии со слепыми, которые ощупывают разные части слона и приходят к разным выводам о природе слона, в этой ситуации слепые могут чувствовать разных слонов.
Вместо аналогии со слепыми, которые ощупывают разные части слона и приходят к разным выводам о природе слона, в этой ситуации слепые могут чувствовать разных слонов.
Требуется эмпирическое доказательство связи между аномальным результатом каждого из этих тестов и риском последующего инсульта. Необходимо оценить исходные факторы риска инсульта, такие как артериальная гипертензия, курение и гиперлипидемия. Различия в риске инсульта, наблюдаемые между группами, могут быть связаны с различиями в этих факторах, а не с нарушениями гемодинамики. Следовательно, клинические исследования, призванные доказать такую связь, должны включать несколько из следующих факторов.
Во-первых, популяция пациентов должна быть четко определена и недвусмысленна с точки зрения наличия предшествующих ишемических симптомов и типа поражения артерий. Данные текущего и других исследований иллюстрируют необходимость этого требования. Риск инсульта у пациентов с бессимптомной окклюзией сонных артерий очень низок и, вероятно, связан с низкой частотой гемодинамических нарушений в этой популяции (10).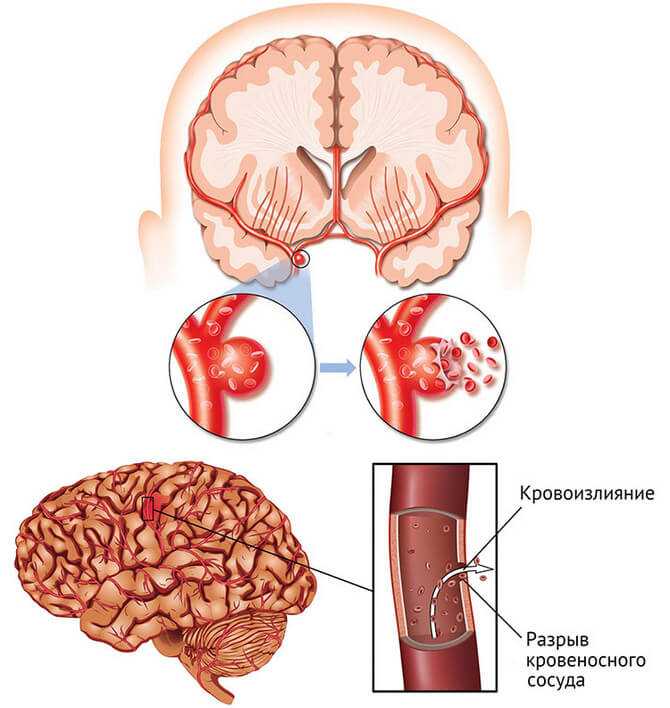 И наоборот, частота гемодинамических нарушений у пациентов с окклюзией СМА, вероятно, довольно высока (11). Во-вторых, гемодинамический фактор риска должен быть определен проспективно (а не ретроспективное определение порога аномального теста, основанное на знании исхода пациента). В-третьих, сравнение групп высокого и низкого риска (определяется с помощью гемодинамического теста) и исхода (инсульт или новое ишемическое поражение, определяемое с помощью МРТ) должно быть статистически достоверным (анализ кривой выживаемости, а не тест хи-квадрат, для пример). Наконец, необходимо оценить независимость (многофакторный анализ по сравнению с другими факторами риска инсульта) и силу связи. На сегодняшний день наиболее вескими доказательствами в пользу оценки гемодинамики как предиктора риска инсульта является измерение увеличенной фракции извлечения кислорода с помощью позитронно-эмиссионной томографии у пациентов с окклюзией сонных артерий (1, 12).
И наоборот, частота гемодинамических нарушений у пациентов с окклюзией СМА, вероятно, довольно высока (11). Во-вторых, гемодинамический фактор риска должен быть определен проспективно (а не ретроспективное определение порога аномального теста, основанное на знании исхода пациента). В-третьих, сравнение групп высокого и низкого риска (определяется с помощью гемодинамического теста) и исхода (инсульт или новое ишемическое поражение, определяемое с помощью МРТ) должно быть статистически достоверным (анализ кривой выживаемости, а не тест хи-квадрат, для пример). Наконец, необходимо оценить независимость (многофакторный анализ по сравнению с другими факторами риска инсульта) и силу связи. На сегодняшний день наиболее вескими доказательствами в пользу оценки гемодинамики как предиктора риска инсульта является измерение увеличенной фракции извлечения кислорода с помощью позитронно-эмиссионной томографии у пациентов с окклюзией сонных артерий (1, 12).
В исследовании Miyazawa et al., опубликованном в этом выпуске AJNR, бессимптомный пациент с окклюзией СМА (n = 18) или окклюзией ВСА (n = 17) был выявлен с помощью МР-ангиографии во время МРТ-исследований 3965 пациентов с неишемическими неврологическими симптомами. . Парные измерения CBF до и после введения актазоламида были выполнены с помощью Xe-CT. Время Xe-CT по отношению к включению в исследование не было указано, равно как и определение аномальной реакции кровотока (пороговый уровень, определяющий нормальный от аномального). Исходные клинические и эпидемиологические факторы риска инсульта не регистрировались и не анализировались. Всем больным выполнялась контрольная МРТ (в среднем 3,8 раза с неустановленными интервалами). Методика клинического наблюдения не описана.
. Парные измерения CBF до и после введения актазоламида были выполнены с помощью Xe-CT. Время Xe-CT по отношению к включению в исследование не было указано, равно как и определение аномальной реакции кровотока (пороговый уровень, определяющий нормальный от аномального). Исходные клинические и эпидемиологические факторы риска инсульта не регистрировались и не анализировались. Всем больным выполнялась контрольная МРТ (в среднем 3,8 раза с неустановленными интервалами). Методика клинического наблюдения не описана.
Хотя это и не является статистически значимым, клинические ишемические события, возникающие в течение периода наблюдения, чаще встречались у пациентов с окклюзией СМА (4 из 18 по сравнению с одним из 17 пациентов с окклюзией сонных артерий). Три из этих пяти ишемических событий были на территории исходного артериального поражения. Бессимптомный инфаркт был обнаружен у семи пациентов (пять с окклюзией СМА и два с окклюзией ВСА). Расположение бессимптомных поражений относительно артериальной окклюзии не сообщалось. Как группа, пациенты с новыми поражениями (как бессимптомными, так и симптоматическими) имели значительно более низкий ответ CBF на ацетазоламид, чем пациенты без новых поражений, проявляющихся при МРТ. Взаимосвязь между нарушением гемодинамики и появлением новых поражений у отдельных пациентов не изучалась.
Как группа, пациенты с новыми поражениями (как бессимптомными, так и симптоматическими) имели значительно более низкий ответ CBF на ацетазоламид, чем пациенты без новых поражений, проявляющихся при МРТ. Взаимосвязь между нарушением гемодинамики и появлением новых поражений у отдельных пациентов не изучалась.
Исследование Miyazawa et al. дает важные экспериментальные данные о прогнозе бессимптомной окклюзии СМА. Эти пациенты имели высокий риск развития клинического инсульта или бессимптомного инфаркта (50%). Возможно, что этот риск мог быть из-за высокой частоты гемодинамических нарушений. Необходимо хорошо спланированное проспективное исследование гемодинамических факторов и риска инсульта у этой популяции пациентов.
- ↵
Дердейн С.П., Грабб Р.Л., мл., Пауэрс В.Дж. Нарушение церебральной гемодинамики: методы измерения и связь с риском инсульта. Neurology 1999;53:251-259
- ↵
Gibbs JM, Wise RJS, Leendeers KL, Jones T.
 Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314
Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314 - ↵
Rapela CE, зеленый HD. Ауторегуляция мозгового кровотока у собак. Circ Res 1964;15:I205-I211
- ↵
Кети С.С., Кинг Б.Д., Хорват С.М., Джефферс В.А., Хафкеншил Д.Х. Влияние острого снижения артериального давления посредством дифференциальной спинальной симпатической блокады на мозговое кровообращение у больных гипертонической болезнью. J Clin Invest 1950;29:402-407
- ↵
Моллой Дж., Маркус Х.С. Бессимптомная эмболизация предсказывает риск инсульта и ТИА у пациентов со стенозом сонных артерий. Ход 1999;30:1440-1443
- ↵
Omae T, Li F, Fisher M. Бессимптомная гемодинамическая недостаточность усугубляет ишемическое повреждение в модели микроэмболического инсульта у крыс. Инсульт 2000;31:346
- ↵
Инао С.
 , Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967
, Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967 - ↵
Казумата К., Танака Н., Исикава Т., Курода С., Хоукин К., Мицумури К. Диссоциация вазореактивности на ацетазоламид и гиперкапния. Сравнительное исследование пациентов с хронической окклюзионной болезнью крупных мозговых артерий. Stroke 1996;27:2052-2058
- ↵
Demolis P, Florence G, Thomas L, Dinh YRT, Giudicelli J.-F, Seylaz J. расширение сосудов? Экспериментальное исследование. Ход 2000;31:508-515
- ↵
Powers WJ, Derdeyn CP, Yundt KD, Carpenter DA, Fritsch SM, Videen TO, Spitznagel EJ, Grubb RL, Jr. Доброкачественное течение бессимптомной окклюзии сонной артерии. Neurology 2000;54:878-882
- ↵
Derdeyn CP, Grubb RL, Jr, Powers WJ.
 Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469
Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469 Grubb RL, Jr, Derdeyn CP, Fritsch SM, et al. Значение гемодинамических факторов в прогнозе симптоматической окклюзии сонных артерий. JAMA 1998;280:1055-1060
ПредыдущийСледующий
Наверх
Влияние артериального давления на гемодинамику при остром ишемическом инсульте: проспективное когортное исследование | Международный журнал экстренной медицины
- Оригинальные исследования
- Открытый доступ
- Опубликовано:
- Latha Ganti Stead 1,4 ,
- Sailaja Enduri 1 ,
- M Fernanda Bellolio 1 ,
- Anunaya R Jain 1 ,
- Lekshmi Vaidyanathan 1 ,
- Rachel M Гилмор 1 ,
- Рахул Кашьяп 1 ,
- Эми Л.
 Уивер 3 и
Уивер 3 и - …
- Роберт Д. Браун мл. 2
Международный журнал экстренной медицины том 5 , номер статьи: 3 (2012) Процитировать эту статью
7384 Доступ
8 цитирований
1 Альтметрика
Сведения о показателях
Abstract
Цель
Оценить взаимосвязь между гемодинамическими показателями артериального давления и исходами после острого ишемического инсульта, включая тяжесть инсульта, инвалидность и смерть.
Методы
Исследовательская группа состояла из 189пациенты, поступившие в наше отделение неотложной помощи с ишемическим инсультом, начавшимся менее чем через 24 часа, у которых были зарегистрированы и доступны для просмотра гемодинамические параметры. Артериальное давление (АД) измеряли неинвазивно с 5-минутными интервалами в течение всего пребывания пациента в отделении неотложной помощи. Систолическое АД (сАД) и диастолическое АД (дАД) измеряли для каждого пациента и рассчитывали разницу (максимальное минус минимальное АД). Были изучены три исхода: тяжесть инсульта, инвалидность при выписке из стационара и смерть в возрасте 9 лет.0 дней. Используемые статистические тесты включали корреляции Спирмена (для тяжести инсульта), критерий Уилкоксона (для инвалидности) и модели Кокса (для смерти).
Результаты
Большие различия ДАД (p = 0,003) или сАД (p < 0,001) были значимо связаны с более тяжелыми инсультами. Большая разница ДАД (р = 0,019) или сАД (р = 0,036) была связана со значительно худшим функциональным исходом при выписке из стационара. Пациенты с более высокими дифференциалами ДАД (р = 0,008) или САД (0,007) также значительно чаще умирали в возрасте 9 лет.0 дней, независимо от базального АД.
Большая разница ДАД (р = 0,019) или сАД (р = 0,036) была связана со значительно худшим функциональным исходом при выписке из стационара. Пациенты с более высокими дифференциалами ДАД (р = 0,008) или САД (0,007) также значительно чаще умирали в возрасте 9 лет.0 дней, независимо от базального АД.
Заключение
Большая разница систолического или диастолического артериального давления в течение 24 часов после появления симптомов острого ишемического инсульта, по-видимому, связана с более тяжелыми инсультами, худшим функциональным исходом и ранней смертью
Введение
Инсульт связан с высокая смертность и значительная длительная функциональная инвалидность. Всемирная организация здравоохранения сообщает, что из 15 миллионов пациентов, ежегодно перенесших инсульт во всем мире, почти треть этих пациентов умирает, а еще треть остается инвалидом. Артериальная гипертензия является причиной почти 12,7 миллионов инсультов во всем мире [1].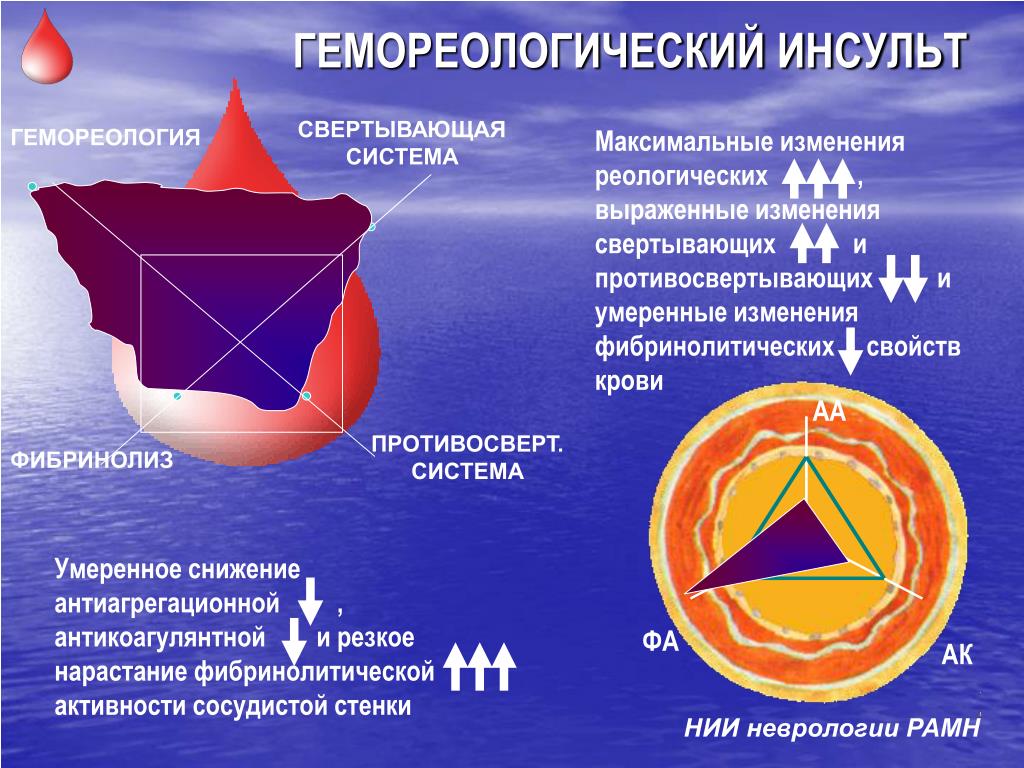
Около 80% пациентов с острым ишемическим инсультом (ОИС) имеют повышенное артериальное давление [2]. Повышение артериального давления (АД) после ПИС имеет множество причин, начиная от хронической гипертензии и симпатической реакции на стресс и заканчивая самой патологией, связанной с инсультом [3]. Предыдущие исследования показали, что локализация инсульта [4] и тип инсульта [5] имеют определенное влияние на реакцию артериального давления, отмечаемую остро после ПИС. Некоторые когортные исследования также предположили, что артериальное давление при поступлении предсказывает исход после острого ишемического инсульта [6], тогда как другие, проведенные аналогичным образом, опровергли вышеуказанный результат [7, 8].
Стратегии лечения артериальной гипертензии после ОИС сосредоточены на спасении ишемической полутени [9], но лечение артериальной гипертензии у пациентов с острым ишемическим инсультом широко обсуждается, и нет четкого консенсуса относительно того, насколько и как скоро снизить давление [10].
Хорошо известно, что в норме церебральная саморегуляция поддерживает перфузию в широком диапазоне системного артериального давления. В острой фазе инсульта церебральная ауторегуляция становится дисфункциональной [11], а церебральное перфузионное давление становится напрямую зависимым от системного давления. В результате мозговой кровоток становится пассивным с линейной зависимостью между системным АД и мозговым кровотоком в широком диапазоне значений давления. Даже относительно небольшая степень системного снижения АД может вызвать значительный риск гипоперфузии и ишемии [12]. Кроме того, после АИС наблюдается также нарушение вазомоторного тонуса [13]. Следовательно, обсуждалось, влияет ли изменение системного давления на тяжесть инсульта, функциональную нетрудоспособность или смерть.
Ранее опубликованные данные показывают, что острая вариабельность артериального давления в первые часы после поступления в отделение неотложной помощи связана с повышенным риском смерти через 90 дней [14]. Известно, что как очень высокое, так и очень низкое исходное артериальное давление являются предикторами неблагоприятных исходов при ПИС [15, 16]. С учетом опубликованных руководств, рекомендующих пермиссивную гипертензию на ранних стадиях АИС [17], и многообещающих результатов текущих исследований гемодинамической аугментации при АИС, осторожный подход к лечению гипертензии при АИС является актуальным [18].
Известно, что как очень высокое, так и очень низкое исходное артериальное давление являются предикторами неблагоприятных исходов при ПИС [15, 16]. С учетом опубликованных руководств, рекомендующих пермиссивную гипертензию на ранних стадиях АИС [17], и многообещающих результатов текущих исследований гемодинамической аугментации при АИС, осторожный подход к лечению гипертензии при АИС является актуальным [18].
Мы стремились определить, существует ли какая-либо связь между колебаниями систолического (сАД) или диастолического (дАД) артериального давления в течение 24 часов после начала ПИС и тяжестью инсульта, функциональной инвалидностью и смертностью.
Методы
Когорта исследования для этого IRB (институционального наблюдательного совета), одобренного проспективным когортным последующим исследованием, состояла из проспективно зарегистрированных взрослых пациентов, поступающих в нашу академическую неотложную помощь с AIS. Из окончательной когорты были исключены пациенты с началом ПИС более чем за 24 часа до поступления/неопределимое время начала и пациенты с не подлежащими обзору последовательными показателями жизненно важных функций.
Артериальное давление (АД) измеряли неинвазивно с 5-минутными интервалами на протяжении пребывания пациента в отделении неотложной помощи с помощью системы мониторинга пациента Philips M3046A (Philips Medical Systems, Андовер, Массачусетс). В конструкции системы используется осциллометрический метод измерения импульсной амплитуды изменения давления в манжете по мере ее спуска, чтобы разграничить систолическое и диастолическое артериальное давление. Дифференциальное давление за 24 часа, определяемое как разница между максимальным и минимальным давлением, рассчитывалось как для сАД, так и для ДАД.
Помимо обычных демографических данных, для исследуемой когорты были собраны данные о тяжести инсульта по прибытии, инвалидности при выписке из больницы и смерти через 90 дней. Тяжесть инсульта по прибытии измерялась по шкале инсульта Национального института здравоохранения (NIHSS), а инвалидность при выписке измерялась по модифицированной шкале Рэнкина (mRS). Плохой функциональный исход определяли как mRS ≥ 3 при выписке. Смерть через 3 месяца была констатирована по сценарию наблюдения по телефону, государственным свидетельствам о смерти и электронным медицинским записям с предварительного разрешения пациента.
Смерть через 3 месяца была констатирована по сценарию наблюдения по телефону, государственным свидетельствам о смерти и электронным медицинским записям с предварительного разрешения пациента.
JMP 8.0 использовали для анализа с использованием корреляций Спирмена (для тяжести инсульта), критерия Уилкоксона (для инвалидности) и моделей Кокса (для смерти).
Результаты
Демографические данные и характеристики когорты представлены в Таблице 1. Средний возраст когорты, состоящий из 58,7% мужчин, составил 74 года (SD = 15,0). Изучение классификации типа инсульта TOAST выявило необычно высокое количество кардиоэмболических инсультов в нашей когорте (50,3%).
Таблица 1. Демографические данные и характеристики изучаемой когортыПолноразмерная таблица
Среднее количество показателей артериального давления составило 7 с межквартильным диапазоном (IQR) от 4 до 10. Медиана систолического артериального давления по прибытии (исходное сАД) составляла 161 мм рт. ст. (IQR от 144 до 188). мм рт. ст.), а медиана диастолического артериального давления (базовый уровень ДАД) составляла 80 мм рт. ст. (межквартальный интервал от 70 до 90 мм рт. ст.). Медиана разницы диастолического АД составила 27 мм рт. ст. (межквартальный интервал от 16 до 41 мм рт. ст.), а медиана разницы систолического АД — 33 мм рт. ст. (межквартальный интервал от 19 до 53 мм рт. ст.).
ст. (IQR от 144 до 188). мм рт. ст.), а медиана диастолического артериального давления (базовый уровень ДАД) составляла 80 мм рт. ст. (межквартальный интервал от 70 до 90 мм рт. ст.). Медиана разницы диастолического АД составила 27 мм рт. ст. (межквартальный интервал от 16 до 41 мм рт. ст.), а медиана разницы систолического АД — 33 мм рт. ст. (межквартальный интервал от 19 до 53 мм рт. ст.).
Обнаружена статистически значимая связь между исходной артериальной гипертензией и смертностью в возрасте 9 лет.0 дней, при определении исходного уровня артериальной гипертензии как исходного сАД = 170 мм рт.ст. и/или исходного ДАД = 110 мм рт.ст. В общей сложности 41,07% пациентов имели исходную артериальную гипертензию, используя приведенное выше определение. Относительный риск смертности через 90 дней для пациентов с исходной артериальной гипертензией составил 2,05 с 95% доверительным интервалом 1,02-4,10 по сравнению с пациентами с более низким АД ( p = 0,038).
Мы также разделили когорту на пациентов с одним или несколькими эпизодами выраженной гипотензии или без них, используя минимальное измеренное пороговое значение ДАД, равное 70 мм рт. ст. У 65% когорты ДАД < 70 мм рт. ст. какое-то время во время пребывания в отделении неотложной помощи. Когда эту группу сравнивали с теми, у кого ДАД > 70 мм рт. ст., не было, однако, статистических различий в тяжести инсульта, исходах смерти в 90 дней или mRS при выписке.
ст. У 65% когорты ДАД < 70 мм рт. ст. какое-то время во время пребывания в отделении неотложной помощи. Когда эту группу сравнивали с теми, у кого ДАД > 70 мм рт. ст., не было, однако, статистических различий в тяжести инсульта, исходах смерти в 90 дней или mRS при выписке.
Медиана оценки по шкале NIHSS при поступлении составила 6,0 с межквартильным диапазоном от 3,75 до 15,0. У пациентов с более тяжелыми инсультами были выше дифференциальное ДАД ( p = 0,003) и дифференциальное сАД ( p < 0,001) (корреляция Спирмена r = 0,22 и r = 0,26 соответственно). Не было обнаружено связи между исходной артериальной гипертензией и оценкой по шкале NIHSS по прибытии ( p = 0,4734).
Всего у 129 пациентов (68,3%) при выписке из стационара балл по шкале Рэнкина был равен 3 и более (плохой исход). Медиана дифференциала ДАД для оценки по Рэнкину 0–2 составила 22,5 мм рт.мм рт.ст. Медиана дифференциального сАД для оценки по Рэнкину 0–2 составила 26 мм рт. ст., а при оценке по шкале Рэнкина 3 и более — 36 мм рт. ст. Большая разница ДАД ( p = 0,019) или сАД ( p = 0,036) была связана со значительно худшим функциональным исходом при выписке из стационара (табл. 2). Опять же, как и в случае с NIHSS, не было никакой связи между исходной артериальной гипертензией и неблагоприятным исходом ( p = 0,486).
ст., а при оценке по шкале Рэнкина 3 и более — 36 мм рт. ст. Большая разница ДАД ( p = 0,019) или сАД ( p = 0,036) была связана со значительно худшим функциональным исходом при выписке из стационара (табл. 2). Опять же, как и в случае с NIHSS, не было никакой связи между исходной артериальной гипертензией и неблагоприятным исходом ( p = 0,486).
Полноразмерная таблица
Всего за первые 90 дней произошло 40 смертей (21,2%). Те, у кого были большие различия либо в ДАД (90 278 p 90 203 = 0,008), либо в САД (0,007), значительно чаще умирали через 90 дней (таблица 3). Эта связь сохраняла статистическую значимость даже после поправки на тяжесть инсульта.
Таблица 3 Сравнение смертности и АДПолноразмерная таблица
Обсуждение
Большинство гемодинамических показателей, включая систолическое артериальное давление, диастолическое артериальное давление, среднее артериальное давление, пульсовое давление и частоту сердечных сокращений, были связаны с плохим функциональным исходом после инсульта [19]. Как и в более ранних исследованиях, мы также обнаружили, что исходная артериальная гипертензия была связана с более высоким риском смерти через 90 дней после инсульта, хотя она не была связана с тяжестью инсульта при постановке диагноза. Для нашей когорты порогом гипертонии было артериальное давление 170/110 мм рт.ст.
Как и в более ранних исследованиях, мы также обнаружили, что исходная артериальная гипертензия была связана с более высоким риском смерти через 90 дней после инсульта, хотя она не была связана с тяжестью инсульта при постановке диагноза. Для нашей когорты порогом гипертонии было артериальное давление 170/110 мм рт.ст.
В связи с непрекращающейся дискуссией об управлении артериальным давлением в острой стадии ишемического инсульта исследователи попытались установить взаимосвязь между исходами и артериальным давлением. В одном из таких исследований Toyoda et al. в 2009сообщили, что значения систолического артериального давления между 12 и 36 часами после госпитализации были предикторами неврологического ухудшения, но авторы не обнаружили того же для значений артериального давления в течение первых 6 часов [20].
Недавно была выражена озабоченность по поводу связи между более высоким систолическим артериальным давлением до лечения и плохой реканализацией у пациентов, получавших внутривенное введение tPA [21]. Наши собственные исследования 2006 г. показали, что широкие колебания АД в первые 3 ч пребывания в отделении неотложной помощи являются предиктором летальности в течение 3 мес после инсульта [14].
Наши собственные исследования 2006 г. показали, что широкие колебания АД в первые 3 ч пребывания в отделении неотложной помощи являются предиктором летальности в течение 3 мес после инсульта [14].
Это исследование основано на нашей предыдущей работе по артериальному давлению и острому ишемическому инсульту (14, 15), которая является продолжением нашего более раннего исследования. Мы задались вопросом, действительно ли разница АД привела к плохим исходам или, скорее, виновником был эпизод гипотензии во время раннего курса ЭД. Когда мы сравнили гипотензивные и негипотензивные группы, мы обнаружили, что не было различий в исходах смерти или функциональной шкале Рэнкина, предполагая, что колебания АД были независимым предиктором неблагоприятного исхода. Коллаборация VISTA представила аналогичные результаты, подчеркнув, что колебания систолического артериального давления были связаны с худшим исходом после инсульта [22].
Наше исследование также показало, что у пациентов с более тяжелыми инсультами были более сильные колебания артериального давления, но не исходного исходного артериального давления. Это привело к аргументу, что первоначальная тяжесть инсульта привела к худшему исходу. Однако, когда мы сделали поправку на тяжесть инсульта по шкале NIHSS, мы обнаружили, что дифференциал сАД и дифференциал ДАД независимо связаны со смертью через 90 дней.
Это привело к аргументу, что первоначальная тяжесть инсульта привела к худшему исходу. Однако, когда мы сделали поправку на тяжесть инсульта по шкале NIHSS, мы обнаружили, что дифференциал сАД и дифференциал ДАД независимо связаны со смертью через 90 дней.
Гипотензия по сравнению с исходным уровнем, вызывающая региональную гипоперфузию, становится все более понятной концепцией сразу после ишемического инсульта. Результаты настоящего исследования и последующее обсуждение могут натолкнуть на мысль, что вариабельность артериального давления — это плохо, и поэтому следующим логическим шагом является как-то жестко контролировать ее в заданном диапазоне. Здесь следует соблюдать осторожность. Нельзя предполагать, что «исправление» ассоциации приведет к улучшению результата. Это действительно следующий шаг в клиническом исследовании, но он не совсем готов для внедрения в клиническую практику, пока гипотеза не будет окончательно проверена в контролируемом исследовании.
Заключение
Колебания артериального давления в условиях острого ишемического инсульта, по-видимому, оказывают негативное влияние на тяжесть инсульта, функциональный исход и смерть через 90 дней.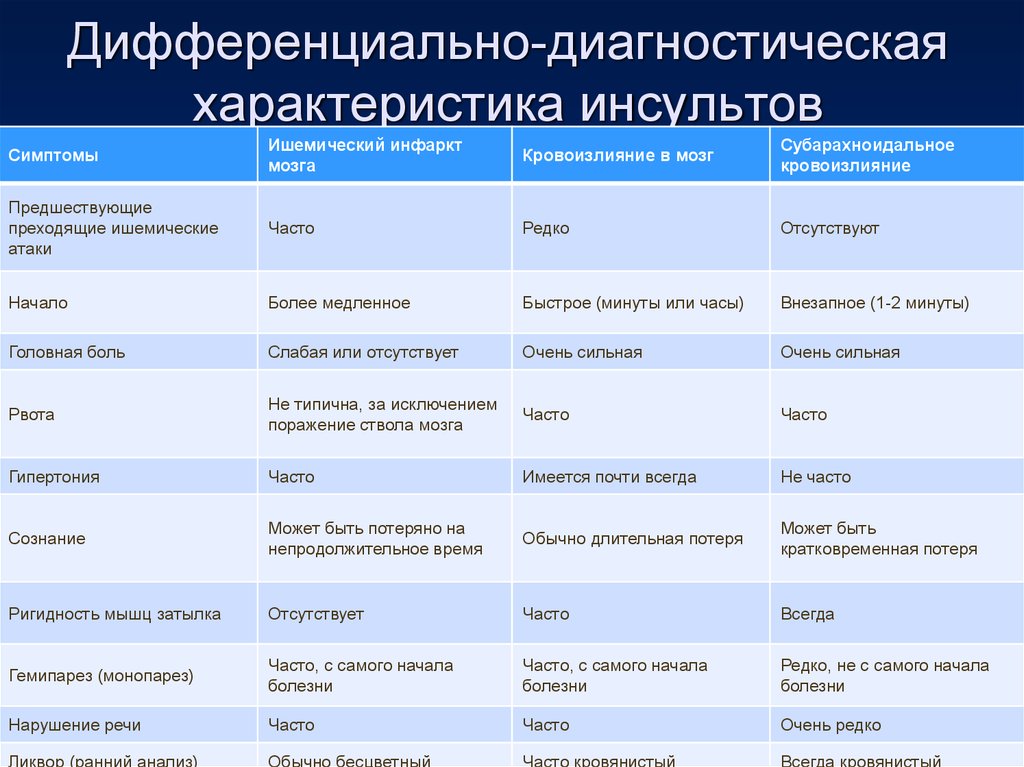 Это исследование, выдвигающее гипотезу, в котором задается вопрос, приведет ли фармакологический контроль этих колебаний артериального давления к улучшению клинических результатов.
Это исследование, выдвигающее гипотезу, в котором задается вопрос, приведет ли фармакологический контроль этих колебаний артериального давления к улучшению клинических результатов.
Согласие пациента
Этот протокол был одобрен Исследовательским комитетом отделения неотложной медицины (выдержка из протокола прилагается). Он также был одобрен Наблюдательным советом клиники Мэйо как протокол 1054-04.
Ссылки
Американская кардиологическая ассоциация: Международная статистика сердечно-сосудистых заболеваний – Статистический бюллетень – Население, 2008 г. Обновление. Доступно на http://www.who.int/whr/2002/en/whr02_en.pdf
Gilmore RM, Miller SJ, Stead LG: Тяжелая гипертензия у пациента отделения неотложной помощи [обзор]. Emerg Med Clin N Am 2005, 23: 1141–1158. 10.1016/j.emc.2005.07.012
Артикул Google ученый
«>Дикер Д., Майя И., Василевский В., Гофман М., Марковиц Д., Бейлин В., Сарид М., Йосефи К.: Вариабельность артериального давления при остром ишемическом инсульте зависит от локализации полушарного инсульта. Blood Press 2006, 15 (3):151–156. 10.1080/08037050600772755
Артикул пабмед Google ученый
Marcheselli S, Cavallini A, Tosi P, Quaglini S, Micieli G: Нарушение повышения артериального давления при остром кардиоэмболическом инсульте. J Hypertens 2006, 24 (9):1849–1856. 10.1097/01.хжх.0000242410.42912.2д
Артикул КАС пабмед Google ученый
«>Jensen MB, Yoo B, Clarke WR, Davis PH, Adams HR Jr: Артериальное давление как независимый прогностический фактор при остром ишемическом инсульте. Can J Neurol Sci 2006, 33 (1):34–38.
Артикул пабмед Google ученый
Zhang Y, Reilly KH, Tong W, Xu T, Chen J, Bazzano LA, Qiao D, Ju Z, Chen CS, He J: Артериальное давление и клинические исходы у пациентов с острым инсультом во Внутренней Монголии, Китай . J Hypertens 2008, 26 (7):1446–1452. 10.1097/HJH.0b013e328300a24a
Артикул КАС пабмед Google ученый
«>Чалмерс Дж., Тодд А., Чепмен Н., Бейлин Л., Дэвис С., Доннан Г., Фроммер М., Хаксли Р., Ленфант С., МакМахон С., Мансия Дж., Мендис С., Уитворт Дж., Занкетти А.: Международное общество Артериальная гипертензия (ИСГ): заявление о снижении артериального давления и профилактике инсульта. J Hypertens 2003, 21 (4):651–663.
Артикул пабмед Google ученый
Meyer JS, Shimazu K, Fukuuchi Y, Ouchi T, Okamoto S, Koto A: Нарушение нейрогенного цереброваскулярного контроля и дисауторегуляции после инсульта. Ход 1973, 4 (2):169–186. 10.1161/01.СТР.4.2.169
Артикул КАС пабмед Google ученый
«>Robinson T, Potter J: Сердечно-легочный и артериальный барорефлекс-опосредованный контроль вазомоторного тонуса предплечья нарушен после острого инсульта. Ход 1997, 28 (12):2357–2362. 10.1161/01.СТР.28.12.2357
Артикул КАС пабмед Google ученый
Stead LG, Gilmore RM, Vedula KC, Weaver AL, Brown RD Jr, Decker WW: Влияние острой вариабельности артериального давления на исход ишемического инсульта. Неврология 2006, 66 (12):1878–1881. 10.1212/01.wnl.0000219628.78513.b5
Артикул КАС пабмед Google ученый
Stead LG, Gilmore RM, Decker WW, Weaver AL, Brown RD Jr: Первичное отделение неотложной помощи как предиктор выживаемости после острого ишемического инсульта.
 Неврология 2005, 65 (8):1179–1183. 10.1212/01.wnl.0000180939.24845.22
Неврология 2005, 65 (8):1179–1183. 10.1212/01.wnl.0000180939.24845.22Артикул пабмед Google ученый
Веммос К.Н., Цивгулис Г., Спенгос К., и др. .: U-образная зависимость между смертностью и артериальным давлением при поступлении у больных с острым инсультом. J Int Med 2004, 255: 257–265. 10.1046/j.1365-2796.2003.01291.x
Артикул КАС Google ученый
Адамс Х.П. младший, дель Зоппо Г., Альбертс М.Дж., Бхатт Д.Л., Брасс Л., Фурлан А., Грабб Р.Л., Хигашида Р.Т., Яух Э.К., Кидвелл С., Лайден П.Д., Моргенштерн Л.Б., Куреши А.И., Розенвассер Р.Х., Скотт П.А. , Wijdicks EF: Рекомендации по раннему лечению взрослых с ишемическим инсультом: рекомендации Совета по инсульту Американской кардиологической ассоциации/Американской ассоциации инсульта, Совета по клинической кардиологии, Совета по сердечно-сосудистой радиологии и интервенционным вмешательствам, а также Совета по атеросклеротическим заболеваниям периферических сосудов и качеству лечения Результаты исследований междисциплинарных рабочих групп: Американская академия неврологии подтверждает ценность этого руководства как учебного пособия для неврологов.
 Ход 2007, 38 (5):1655–1711. 10.1161/STROKEAHA.107.181486
Ход 2007, 38 (5):1655–1711. 10.1161/STROKEAHA.107.181486Артикул пабмед Google ученый
Джейн А.Р., Беллолио М.Ф., Стед Л.Г.: Лечение артериальной гипертензии при остром ишемическом инсульте. Curr Treat Options Neurol 2009, 11 (2):120–125. 10.1007/s11940-009-0015-7
Артикул пабмед Google ученый
Спригг Н., Грей Л.Дж., Бат П.М., Бойсен Г., Де Дейн П.П., Фриис П., Лейс Д., Марттила Р., Олссон Д.Е., О’Нил Д., Рингельштейн Б., Ван дер Санде Д.Дж., Линденстром Э.: Связь между исходом и исходным уровнем артериального давления и другими показателями гемодинамики при остром ишемическом инсульте: данные исследования TAIST. J Hypertens 2006, 24 (7):1413–1417. 10.1097/01.hjh.0000234123.55895.12
Артикул КАС пабмед Google ученый
«>Цивгулис Г., Саккур М., Шарма В.К., Лао А.Ю., Хилл М.Д., Александров А.В.: Связь артериального давления до лечения с реканализацией артерий, вызванной активатором тканевого плазминогена, при остром ишемическом инсульте. Ход 2007, 38 (3):961–966. 10.1161/01.СТР.0000257314.74853.2б
Артикул КАС пабмед Google ученый
Sare GM, Gray LJ, Wardlaw J, Chen C, Bath PM: Опасно ли снижение артериального давления у пациентов со значительным ипсилатеральным стенозом сонных артерий и острым ишемическим инсультом? Промежуточная оценка в исследовании «Эффективность оксида азота при инсульте».
 Мониторинг давления крови 2009, 14 (1):20–25. 10.1097/MBP.0b013e32831e30bd
Мониторинг давления крови 2009, 14 (1):20–25. 10.1097/MBP.0b013e32831e30bdАртикул пабмед Google ученый
Qureshi AI: Острая гипертензивная реакция у пациентов с инсультом: патофизиология и лечение [обзор]. Тираж 2008, 118: 176–187. 10.1161/ОБРАЩЕНИЕHA.107.723874
Артикул пабмед Google ученый
Abboud H, Labreuche J, Plouin F, Amarenco P: Высокое кровяное давление в раннем остром инсульте: признак неблагоприятного исхода? J Hypertens 2006, 24 (2):381–386. 10.1097/01.hjh.0000200516.33194.e3
Артикул КАС пабмед Google ученый
Powers WJ: Острая артериальная гипертензия после инсульта: научная основа для выбора лечения [обзор]. Неврология 1993, 43: 461–467.
Артикул КАС пабмед Google ученый
Wahl M, Schilling L: Регуляция мозгового кровотока – краткий обзор. Acta Neurochir Suppl (Вена) 1993, 59: 3–10.
КАС Google ученый
Toyoda K, Fujimoto S, Kamouchi M, Iida M, Okada Y: Острые уровни артериального давления и неврологические нарушения при различных подтипах ишемического инсульта. Ход 2009.
Google ученый
Скачать ссылки
Информация об авторе
Авторы и организации
Отделение неотложной медицины, Медицинская школа Майо, Рочестер, Миннесота, США Лекшми Вайдьянатан, Рэйчел М Гилмор и Рахул Кашьяп
Кафедра неврологии, Медицинская школа Мэйо, Рочестер, Миннесота, США
Роберт Д. Браун мл. of Emergency Medicine, University of Florida, 1329 SW 16th Street, Gainesville, FL, 32610, USA
Latha Ganti Stead
Authors
- Latha Ganti Stead
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Sailaja Enduri
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- M Fernanda Bellolio
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ануная Р.
 Джайн
ДжайнПосмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Lekshmi Vaidyanathan
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Rachel M Gilmore
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Rahul Kashyap
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Эми Л. Уивер
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Robert D Brown Jr
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Лата Ганти Стед.

 Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314
Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314 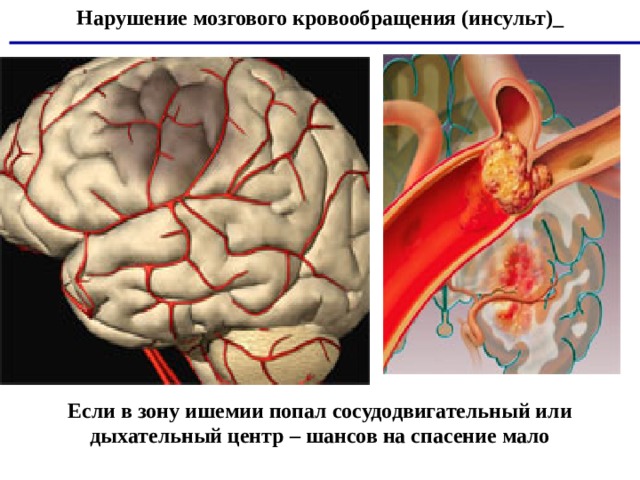 , Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967
, Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967  Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469
Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469 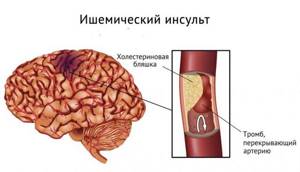 Уивер 3 и
Уивер 3 и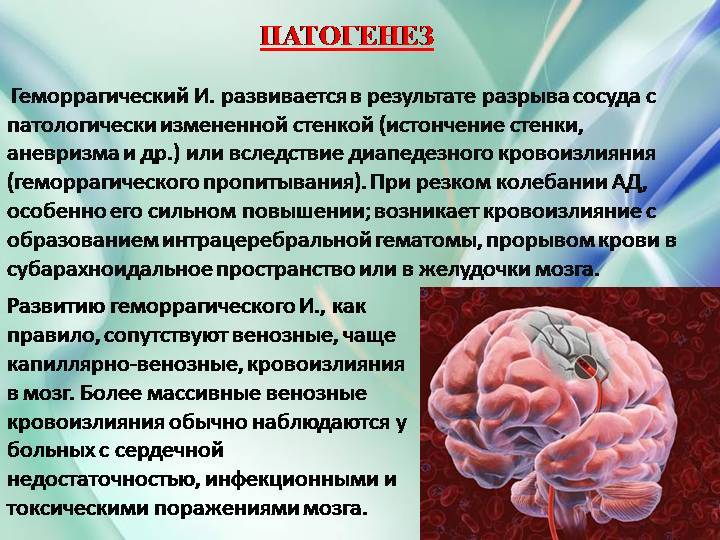 Неврология 2005, 65 (8):1179–1183. 10.1212/01.wnl.0000180939.24845.22
Неврология 2005, 65 (8):1179–1183. 10.1212/01.wnl.0000180939.24845.22 Ход 2007, 38 (5):1655–1711. 10.1161/STROKEAHA.107.181486
Ход 2007, 38 (5):1655–1711. 10.1161/STROKEAHA.107.181486 Мониторинг давления крови 2009, 14 (1):20–25. 10.1097/MBP.0b013e32831e30bd
Мониторинг давления крови 2009, 14 (1):20–25. 10.1097/MBP.0b013e32831e30bd Джайн
Джайн