Болезнь атрофирование мышц: Врач СПбГПМУ рассказала об опыте лечения спинальной мышечной атрофии
почему в России не лечат взрослых со СМА — Такие дела
- СМА
- Контекст
- Как устроено
- 29. 11. 2021
Сложнейшая ситуация с лекарствами для детей со спинальной мышечной атрофией, кажется, начала разрешаться. Это огромная победа родителей, врачей и благотворительных фондов. Только пока эта победа не для всех: взрослые со СМА все еще выброшены из системы помощи
Это огромная победа родителей, врачей и благотворительных фондов. Только пока эта победа не для всех: взрослые со СМА все еще выброшены из системы помощи
Но СМА не исчезает с возрастом, когда ребенок вырастает
А иногда может даже проявиться и в 20, и в 30 лет — в зависимости от типа заболевания.
Причина болезни одинаковая что у взрослых, что у детей — поломка в гене. И взрослые пациенты нуждаются в такой же поддержке, как и дети.
«Взрослые выкинуты из системы оказания медицинской помощи. Мы говорим о людях с профессией, которые могут работать, которые хотят реализовываться в жизни, заводить семью. Они поставлены в ситуацию “выживай как хочешь, ты можешь рассчитывать только на свои силы и силы своей семьи”», — объясняет Ольга Германенко, директор фонда «Семьи СМА».
«Активный человек, несмотря на возможность управлять только мышкой»
Елене Кузьминой 38 лет, она живет в Муроме — «столице праздника День семьи, любви и верности». Елена работает юристом в фонде «Семьи СМА», путешествует и помогает волонтерскому движению. Любит кино, караоке и играть в бочче — игру, похожую на керлинг.
Любит кино, караоке и играть в бочче — игру, похожую на керлинг.
Мама Лены любя называет дочь «ответственной по связям с общественностью»: к ней приходят с просьбами решить проблемы, позвонить-выяснить, что-то организовать. «Я активный человек, занимаюсь всем», — говорит девушка про себя.
Лена передвигается на инвалидной коляске и почти утратила все двигательные функции. Она может только управлять мышкой и печатать сообщения на виртуальной клавиатуре — именно так мы и договорились об интервью.
Когда Лене был год, родители заметили, что девочка, вместо того чтобы развиваться дальше — ходить, бегать, как будто откатывается назад. Сначала ей поставили диагноз «прогрессирующая мышечная атрофия» и только в 1995 году, когда ученые-генетики открыли ген SMN1, стали писать, что у нее СМА.
«Врачи сказали маме, что такие дети долго не живут — максимум три года, “рожайте другого ребенка”. Поначалу мама действительно ждала, когда я начну умирать. Но прошли три года, пять лет… — тянет Лена. — Мы жили обычной жизнью с поправкой на то, что есть какие-то ограничения».
— Мы жили обычной жизнью с поправкой на то, что есть какие-то ограничения».
«Мы» — это сама Лена и Оля, ее младшая сестра. У девочек разница в возрасте два года, у Оли тоже оказалась СМА.
Инженер-строитель по профессии, Татьяна Алексеевна оставила работу через несколько лет после рождения дочерей, чтобы быть рядом с девочками. «Конечно, для меня это был шок, — вспоминает она. — Никакой поддержки от государства не было, пенсии были копеечные. Муж работал один, финансово было очень тяжело, но сказать, что мы голодали, — нет, такого не было. Я шила одежду и на себя, и на детей. Девчонки обе были умные, учились хорошо. Гостей принимали, праздники отмечали, и мы в гости ездили, на пикники».
В начальных классах мама возила Лену в школу. В семь лет она уже не могла ходить и пересела в коляску, но сама писала в тетрадках, могла перекладывать книжки, играть с игрушками. Позже они с сестрой перешли на домашнее обучение: началась «кабинетная» система и возить на занятия обеих девочек маме стало сложно.
После школы Лена поступила в институт и выучилась на юриста. Писала длинные конспекты на лекциях — тогда она еще могла делать это сама.
В 2009 году Оля умерла от воспаления легких. До этого умер отец девочек — онкологическое заболевание.
Лена с мамой остались вдвоем.
Иллюстрация: Наталья Ямщикова для ТД
Постепенно у Лены уходили навыки — и силы. Сейчас она самостоятельно может только дышать, глотать и разговаривать, одним нажатием отвечать на звонки. Если телефон будет лежать на столе, девушка не сможет поднять его к уху.
«Я никогда самостоятельно не одевалась: футболку еще могла сама на руки натянуть, но чтобы полностью одеться — нет, — говорит Лена. — Никогда не готовила и не помню, чтобы сама переворачивалась в кровати. Всегда будила маму, чтобы она меня перевернула».
Женщины живут вдвоем и стараются справляться со всем сами, «особо никого не напрягая». При необходимости помогают родственники: «По сути, меня утром посадить, покормить, и я могу полдня провести за компьютером — мне больше ничего не нужно, — скромно говорит Лена. — Сходить в туалет, пообедать, и снова занимаюсь делами. Вечером — уложить спать».
— Сходить в туалет, пообедать, и снова занимаюсь делами. Вечером — уложить спать».
«Со стороны, наверное, кажется: “Господи, как они там живут?” — добавляет Татьяна Алексеевна. — Но мы живем и живем. По мере сложностей стараемся совместно приспосабливаться. Это просто наша жизнь. Мы не можем какие-то вещи делать — ну, живем другими делами и событиями».
«Делать шаг назад не хочется»
В августе 2019 года в России зарегистрировали первый препарат для пациентов со СМА. Терапия не излечивает СМА полностью, но останавливает развитие болезни и улучшает качество жизни человека.
Лена сразу же начала собирать документы, но получила лекарство только спустя 20 месяцев — через суд. Ей сделали пять инъекций, шестая будет в феврале 2022 года.
Уже после первых доз Лена почувствовала улучшения. Внешне, может быть, и не видно, но дышать ей стало свободнее и легче, появилось больше энергии и выносливости, нет такой разбитости и вялости. Даже окружающие заметили, что ее голос стал звонче и сильнее.
«Были выборы, бюллетени принесли домой. Я подумала: “Как же расписываться, если мне подпись поставить тяжело?” В итоге взяла ручку и три подписи поставила свободно. Улучшение, получается», — бодро говорит Лена.
Получать лекарство пациенты должны постоянно. Каждый незапланированный перерыв — это риск потерять функцию.
Перестать поднимать руку. Или шевелить пальцами
«Конечно, страшно, если вдруг препарат отменят или перестанут закупать, не хотелось бы чувствовать откат. Уже сейчас, зная, как может быть хорошо, делать шаг назад не хочется. Пускай я не буду ходить без опоры, бегать, но если вернется навык письма ручкой — прекрасно! — убеждена Лена. — Смогу печатать на компьютере свободно — вообще шикарно. Поднимать кружку — это значительная победа».
«Нет категорий “детская” и “взрослая” СМА»
Нельзя сказать, что есть какой-то возрастной порог жизни со СМА: болезнь проявляется в разном возрасте и может развиваться с разной скоростью. Люди со СМА могут жить примерно до 65 лет.
Однако после 25 лет количество взрослых пациентов резко сокращается, говорит Ольга Германенко. Это связано не только с естественным течением болезни, но и с уровнем медицинской помощи взрослым пациентам в России. «Взрослых не хотят лечить, они никому не нужны», — с горечью говорит она.
Взрослых пациентов лечат теми же препаратами, воздействующими на генетический механизм заболевания, что и детей (в России от СМА зарегистрированы препараты рисдиплам и нусинерсен. — Прим. ТД). Но поскольку лекарства от СМА изобрели совсем недавно, к их появлению многие взрослые пациенты уже столкнулись с необратимыми последствиями.
Те, кто утратил большую часть функций, прекрасно понимают, что лекарства не помогут им встать с коляски, но хотя бы вернут выносливость и некоторые навыки: держать ложку, наливать себе чай, писать ручкой, печатать на клавиатуре.
Чем быстрее начнется лечение, тем больше у человека шансов на жизнь. Каждый сбереженный мотонейрон — это сохраненная функция.
Главное для людей со СМА — чтобы их состояние перестало ухудшаться. И опросы, которые проводит фонд среди своих подопечных, подтверждают: все это происходит благодаря лечению.
Только добыть терапию не так-то просто.
Иллюстрация: Наталья Ямщикова для ТД
Если детям со СМА начали выдавать лекарства, в том числе благодаря «Кругу добра», то взрослые остаются с носом и вынуждены бороться за лечение месяцами, иногда дольше. Их должны обеспечивать на региональном уровне, подчеркивает Ольга, но местные власти не горят желанием покупать дорогие лекарства.
Многие пациенты вынуждены судиться. Иногда депздравы выдают лекарства и в досудебном порядке. Бывает и наоборот: даже решение суда не гарантирует, что регион закупит пациенту препарат. Где-то людям выдают лекарство в течение месяца-двух после вынесенного решения — и это еще считается быстро. В иных регионах исполнения решения суда приходится добиваться через судебных приставов.
Проблемы с выдачей лекарств есть в каждом российском регионе, подчеркивает Ольга Германенко.
Нет ни одного субъекта, где лекарства от СМА выдавали бы без проблем и задержек
Самый сложный регион, по оценке фонда «Семьи СМА», — Москва. Из 37 пациентов здесь не получает лечение ни один взрослый. Люди несколько раз выходили на пикеты, Минздрав проводил с ними встречи, но конкретных решений так и не было принято. Примерно в такой же ситуации Свердловская область, «которая детей еще более-менее лечила, а вот со взрослыми просто намертво». Тюменская область «гоняет пациентов по кругу, просто выматывая их».
«Если за детей бегают молодые родители, то за взрослых пациентов бегают уже бабушки или в крайнем случае сами пациенты — люди, многие из которых не могут сами себе налить стакан воды. Все происходит через слезы, через боль и безумную борьбу», — говорит Ольга.
По ее мнению, в ситуации со взрослыми пациентами со СМА снова требуется вмешательство федерального центра, как когда-то было с детьми. Необходимо либо переводить всю нозологию на федеральный бюджет, либо заставлять регионы выполнять законы.
Необходимо либо переводить всю нозологию на федеральный бюджет, либо заставлять регионы выполнять законы.
«Бегу наперегонки с мальчиком и понимаю, что не могу»
С Петром Воротынцевым мы встречаемся в ресторане в центре Москвы. Мужчину сопровождает красивая молодая девушка — его жена Барбора. Петру 33 года, он доцент кафедры истории театра и кино и специалист по истории музыкального театра, преподает на историко-филологическом факультете Российского государственного гуманитарного университета.
У него СМА третьего типа, диагноз ему поставили в детстве. По его воспоминаниям, в детстве он выглядел как здоровый человек, «разве что по лестницам чуть медленнее и хуже ходил». Это не мешало Петру выступать на соревнованиях по настольному теннису за школу.
— Проиграл, правда, в первом туре, — смеется Воротынцев. — Победить мне было важно, потому что я очень амбициозный человек. Ведь без желания победить бессмысленно и заниматься чем-либо.
— Теперь понятно, почему вы с таким упорством боретесь за лекарства, — говорю я.
Петр — один из активных участников московских пикетов, которые устраивают взрослые пациенты со СМА, чтобы добиться положенных им лекарств.
«Спорт — это все-таки честный поединок, — возражает Петр. — А [в ситуации с лекарствами] правила не совсем понятны и не прозрачны. Честно говоря, я бы с радостью не занимался этими пикетами. Я по своей природе вообще не гражданский активист. Мне интереснее книжку почитать».
До 20—22 лет, вспоминает Воротынцев, он еще мог сам в метро ездить, хотя было уже тяжело и, как он осознает сейчас, даже рискованно. Потом стали труднее даваться подъемы по лестницам, затем стало сложно вставать. В 2013 году Петр сломал руку, а в 2018-м — ногу. Теперь он передвигается на коляске, но, если есть возможность хотя бы немного пройти с опорой, ходит до последнего.
«Я стараюсь минус обратить в плюс, — говорит Петр. — Когда я пересел в коляску, то стал больше времени проводить сидя и лежа. По итогу у меня появилось гораздо больше времени, я успеваю писать намного больше текстов».
Иллюстрация: Наталья Ямщикова для ТД
Сейчас Петр в основном работает удаленно, и это тоже плюс. Чтобы сходить в институт на две лекции по полтора часа, ему нужен целый день. Много времени уходит на то, чтобы одеться-раздеться, особенно зимой, и подняться на этаж.
— Бытовые заботы в нашей семье, конечно, по большей части на жене. Если жены нет рядом, то очень помогают родители. Я, что называется, хорошо устроился.
— Он нас поддерживает морально, — твердо говорит Барбора. — Это немало.
Петр и Барбора познакомились в 2009 году в Праге — на родине Барборы, на вокальном мастер-классе. «Петя очень хорошо поет, у него потрясающий голос, даже когда он говорит», — рассказывает Барбора с небольшим акцентом.
В тот год ей самой поставили диагноз «рассеянный склероз», и она ощущала себя «самой больной в мире». После знакомства Барбора и Петр общались на расстоянии, по скайпу, а когда девушка окончила консерваторию, то переехала в Москву. Спустя год у пары родился сын Андрюша.
Спустя год у пары родился сын Андрюша.
Во время разговора Петр берет чайник и наливает себе в чашку чай. Барбора подается вперед, чтобы ему помочь, но, помедлив, отступает.
«Да, налить себе чай я могу, — комментирует Петр. — Но главное, что я могу печатать с iPad и компьютера. Функция правой руки, по крайней мере, сохранена. Левая чуть хуже после перелома, но по сравнению с другими пациентами со СМА мне не на что жаловаться. Этот процесс уже необратим без лекарств, это чистая биология и физиология».
«Пока вопрос не решат с детьми, до нас не дойдет»
Заниматься получением лекарства от СМА Петр начал в конце 2020 года. Пандемия, признается Воротынцев, сильно замедлила этот процесс.
«В 2020 году с детьми еще была большая проблема, — добавляет Барбора. — Всем взрослым, в принципе, было понятно, что, пока вопрос не решат с детьми, до нас не дойдет, что правильно».
Читайте также Обычная девочка на коляске
Сначала Петр обратился в поликлинику — и его «отправили по длинному кругу на госпитализацию». Тогда по совету фонда «Семьи СМА» мужчина пошел в Научный центр неврологии. Пройдя длинный путь обследований, он получил заключение комиссии: ему показана патогенетическая терапия СМА.
Тогда по совету фонда «Семьи СМА» мужчина пошел в Научный центр неврологии. Пройдя длинный путь обследований, он получил заключение комиссии: ему показана патогенетическая терапия СМА.
«И тут-то началось самое интересное», — говорит Воротынцев.
Институт отказался выдавать лекарство без решения региональной комиссии в Центре орфанных заболеваний — его власти Москвы создали через неделю после первого пикета взрослых пациентов.
— С конца июля нас начали настойчиво отправлять туда. В итоге люди выходят оттуда с отказами от врачебной комиссии, — поясняет Петр.
— На основании чего врачебная комиссия отказывает, если есть диагноз и показано лечение?
— Мы задавали этот вопрос на встрече главному внештатному неврологу Москвы, — отвечает Петр. — Он сказал, что отказы выносятся на основании электромиографии: в мышцы колют иголки, чтобы проверить импульсы. Если импульсы плохие, то заключение на лечение они выдавать не будут, это нецелесообразно. Но в этом и суть болезни, что импульсы не проходят!
— Главный невролог фактически проявлением болезни аргументирует отказ в лечении, — подхватывает Барбора. — Естественно, результат будет плохим! Даже если руки или ноги плохо работают, есть еще мышцы сердца, дыхание. Это же тоже нужно поддерживать!
— Естественно, результат будет плохим! Даже если руки или ноги плохо работают, есть еще мышцы сердца, дыхание. Это же тоже нужно поддерживать!
Петр намеренно отказывается от госпитализации, потому что понимает, что получит отказ от врачебной комиссии, как и другие пациенты со СМА. С этим решением добиться положительного решения в суде будет невозможно.
«Чиновники готовы делать все. Они говорят: “Мы вам пандусы организуем, но только не лекарства”. Даже собак предложили выгуливать. Это чем-то похоже на то, как родители детьми не занимаются и пытаются их задобрить, машинку хотя бы купить», — шутит Воротынцев.
Петр обратился в суд. Заседание по его делу прошло 17 ноября. Как Петр и ожидал, ему отказали в лечении, потому что у него не было заключения врачебной комиссии из Центра орфанных заболеваний.
Петр надеется благодаря лечению «хотя бы сохраниться в том состоянии, в котором находится сейчас», и прожить как можно дольше со своей семьей. Закончить научные и творческие проекты.
«Смертность человека — эволюционный двигатель прогресса во всех сферах. Страх тебя подстегивает что-то делать здесь и сейчас, не откладывать жизнь до следующего понедельника. Как рассуждают многие обыватели? Если человек не встанет, не пойдет и не будет, как Жан-Клод Ван Дамм, разбивать кирпичи, то чего его и лечить, собственно. Но если человек проживет на семь — десять лет больше, вы представьте, сколько можно успеть за это время!»
Иллюстрация: Наталья Ямщикова для ТД
«После 18 лет — путь в никуда»
Многие пациенты со СМА сталкиваются с проблемами сразу после совершеннолетия, говорит Ольга Германенко. Так случилось с 18-летним Даниилом Дугушкиным из Москвы.
У парня второй тип СМА. Он успел пролечиться полгода, а потом депздрав перестал выдавать ему лекарства: ребенок стал совершеннолетним.
«За время приема лекарства мое состояние улучшилось. Ощущение, как будто руки сильнее стали, сидеть дольше мог. Сейчас мне страшно, что болезнь начнет прогрессировать.
Он немногословный и очень скромный, даже отказался от видеосвязи. Сухо и обыденно перечисляет свой досуг дома: «Встаю поздно, умываюсь, одеваюсь, выпиваю специальный витаминный коктейль вместо завтрака. Потом работаю — у меня есть подработки на фрилансе — или в интернете сижу. Затем обедаю, читаю книги или слушаю аудиокниги. Иногда выхожу гулять или в торговый центр, в кино. Но сейчас пандемия».
Диагноз Даниилу поставили в 2006 году, рассказывает его мама Елена. В год и два месяца мальчик стал опираться на предметы при ходьбе, но сам переворачивался и садился. С семи лет он передвигается на коляске, но некоторые функции у него сохранились. Например, он может сам есть, чистить зубы, пользоваться телефоном или компьютером, даже играть. Несмотря на это, парню нужна постоянная помощь в быту.
«Днем помогает бабушка, пока я на работе, — рассказывает мама Даниила Елена. — Мама у меня уже в возрасте, под 70 лет. Она его поднять не может. Так что в ванную таскаю его я, в туалет тоже, на коляску пересаживаю. В основном все делаю я. Пока я на работе, переношу его на специальную кровать, где он сидит или лежит весь день, а бабушка помогает подниматься и укладываться. Как дальше будет — не знаю. Что заранее думать? Когда он в младшей школе учился, коллега говорила: “Ле-е-ен, а как ты его будешь таскать потом?” Зачем я буду переживать заранее? Ничего, таскаю вон с божьей помощью».
— Мама у меня уже в возрасте, под 70 лет. Она его поднять не может. Так что в ванную таскаю его я, в туалет тоже, на коляску пересаживаю. В основном все делаю я. Пока я на работе, переношу его на специальную кровать, где он сидит или лежит весь день, а бабушка помогает подниматься и укладываться. Как дальше будет — не знаю. Что заранее думать? Когда он в младшей школе учился, коллега говорила: “Ле-е-ен, а как ты его будешь таскать потом?” Зачем я буду переживать заранее? Ничего, таскаю вон с божьей помощью».
Свое совершеннолетие Даниил встретил в апреле в Морозовской больнице. Там прошел консилиум, который постановил , что парень пожизненно нуждается в терапии. Но поликлиника по месту жительства заключение Морозовской больницы не приняла и направила на госпитализацию повторно.
Суд отказал Дугушкиным в препарате из-за непройденной врачебной комиссии.
«Я так пессимистически к этому отношусь, зная наше государство. Не верю, что нам будут что-то выдавать. У меня страхов нет, я вообще реалист по жизни. А вот сын, чувствую, переживает. Он надеялся получить лекарства, постоянно спрашивал: “Мам, как суд?”» — вспоминает Елена.
А вот сын, чувствую, переживает. Он надеялся получить лекарства, постоянно спрашивал: “Мам, как суд?”» — вспоминает Елена.
«Это ловушка психики — думать, что вот сейчас я что-то получу — и все будет идеально, — рассуждает Петр о том, что будет, если ему наконец выдадут лекарства. — Поможет — хорошо. Я стараюсь жить ото дня ко дню. А там, я верю, божественное провидение выведет. Но главное — лекарство принадлежит нам по праву. Мне больше даже за ребят обидно. Несправедливость по отношению к другим ранит меня больше. К несправедливости к себе ты, может быть, до определенной степени привык. А несправедливость к другим становится общей».
* * *
Неизвестно, сколько в России живет взрослых людей со СМА. Общего федерального регистра пациентов нет — только регионы ведут учет. В списках фонда «Семьи СМА» зафиксировано 1,1 тысячи пациентов, из них более 300 — старше 18 лет.
Реальное количество людей со СМА, в том числе и взрослых, намного выше.
Статья подготовлена в партнерстве с подразделением фармацевтических товаров «Янссен» ООО «Джонсон & Джонсон»
ООО «Джонсон & Джонсон», Россия, 121614, Москва, улица Крылатская, дом 17, корпус 2.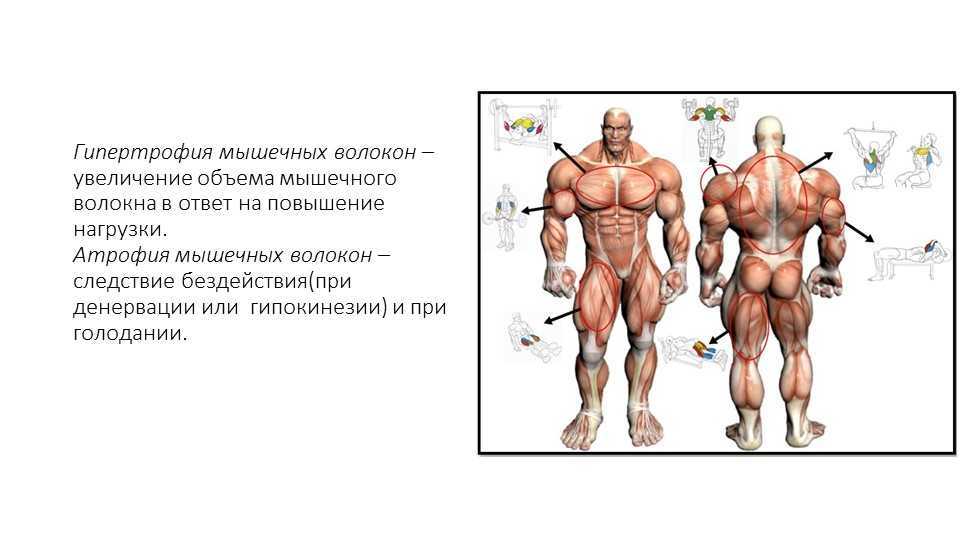
Контактный телефон: 8 (495) 755-83-57; факс: 8 (495) 755-83-58.
CP-278014
Еще больше важных новостей и хороших текстов от нас и наших коллег — в телеграм-канале «Таких дел». Подписывайтесь!
СМА
Почему у людей бывает СМА?
Спинальная мышечная атрофия – это заболевание, при котором повреждается ген SMN1. В результате мутации у человека не вырабатывается белок, который нужен для выживания мотонейронов. Мотонейроны — важная часть спинного мозга человека, от них по длинным нервам идут сигналы к скелетным мышцам организма. Если мотонейрон получает недостаточно белка для своего питания, то он быстро устает. Ему приходится работать и за себя, и «за того парня». Многие мотонейроны просто гибнут от «усталости», — нагрузка на оставшиеся возрастает, и в результате они работают с чудовищной перегрузкой. От усталости они не могут посылать сигналы к скелетным мышцам, благодаря которым человек ходит, сидит, лежит, глотает или дышит. Мышцы остаются без работы, потому что их никто ничего не просит сделать, и постепенно отмирают.
Дефицит важного белка, который не вырабатывает ген SMN1, приводит к атрофии (потере жизнеспособности и уменьшению размера) мышц, и в результате человек постепенно теряет способность ходить, удерживать и управлять собственным телом, самостоятельно сидеть, есть, глотать и дышать. Упрощенный механизм СМА можно увидеть на схеме.
К счастью, у человека есть еще ген SMN2, который дублирует SMN1. Он производит нефункциональный белок и небольшое количество нормального белка, который позволяет мотонейронам человека выживать на очень голодном пайке. В результате человек со СМА сохраняет какую то часть своих двигательных, глотательных и дыхательных функций.
От чего зависит тип СМА и тяжесть болезни?
Если максимально упростить картину, то у человека может быть разное число копий гена SMN2. Теоретически, чем больше у пациента со СМА таких копий, которые вырабатывают маленькое количество нужного мотонейронам белка, тем легче будет протекать заболевание, человек сохранит больше жизненно важных функций и дольше проживет. На практике есть слишком много нюансов, чтобы напрямую связывать тяжесть болезней с числом копий SMN2.
На практике есть слишком много нюансов, чтобы напрямую связывать тяжесть болезней с числом копий SMN2.
При этом у людей признаки СМА появляются в разное время: от первых дней жизни до взрослого возраста.
Существует четыре типа спинальной мышечной атрофии. Чем раньше начинается заболевание, тем тяжелее оно протекает. В 95 % случаев причиной СМА становится делеция (выпадение) участка генетического кода.
По международным стандартам типы СМА различаются несколькими важнейшими признаками:
Болезнь Верднига-Гофманна (СМА 1), возраст дебюта заболевания от 0 до 6 месяцев, максимальная (двигательная) функция у таких детей: сами не могут сидеть. При естественном течении заболевания 92 % этих деток погибает до возраста двух лет.
Болезнь Дубовица (СМА 2). Дебют заболевания происходит с 6 до 18 месяцев. Такие пациенты никогда не могут самостоятельно стоять, они могут самостоятельно сидеть. Продолжительность их жизни может быть больше двух лет
Болезнь Кугельберга-Велендер (СМА 3). Дебют заболевания происходит позже 18 месяцев, такие пациенты развиваются и нормально ходят, но в какой-то момент заболевание начинает прогрессировать. Они перестают самостоятельно передвигаться и садятся. Хотя продолжительность жизни у них тоже сильно ограничена, но они могут прожить несколько десятилетий.
Дебют заболевания происходит позже 18 месяцев, такие пациенты развиваются и нормально ходят, но в какой-то момент заболевание начинает прогрессировать. Они перестают самостоятельно передвигаться и садятся. Хотя продолжительность жизни у них тоже сильно ограничена, но они могут прожить несколько десятилетий.
Четвертый тип мы почти не видим в детской клинике. Такие пациенты дебютируют в подростковом и взрослом возрасте, они могут потерять способность к самостоятельному передвижению. Продолжительность жизни — десятилетия.
Тип СМА | Возраст дебюта заболевания | Максимальная функция | Средняя продолжитель-ность жизни | Типичные проявления |
Тип 1 Болезнь Верднига-Гофманна | 0-6 месяцев | Не сидит | < 2-х лет | Глубокая слабость и гипотония, трудности контроля головы, слабый крик и кашель, трудности с глотанием и выведением мокроты, осложненное течение ОРВИ, развитие дыхательной недостаточности, высокие риски аспирационной пневмонии, очень высокая скорость прогрессирования заболевания |
Тип 2 Болезнь Дубовица | 6-18 месяцев | Не стоит | > 2-х лет | Задержка моторного развития и набора веса, слабый кашель, тремор рук, контрактуры, сколиоз и деформация грудной клетки. |
Тип 3 Болезнь Кугельберга-Веландер | Старше 18 месяцев | Стоит и ходит | Десятилетия | Мышечная слабость различной степени выраженности, крампи (судороги в икроножных мышцах), контрактуры и гипермобильность суставов, потеря способности ходить по мере прогрессирования заболевания |
Тип 4 Поздний тип | В подростковом или взрослом возрасте | Могут потерять способность к самостоятельному передвижению | Десятилетия | Прогрессирующая проксимальная мышечная слабость, снижение сухожильных рефлексов, фасцикуляции |
Чуть более подробно и наглядно об особенностях разных типов СМА можно посмотреть по ссылке
Почему рождается ребенок со СМА?
Спинальная мышечная атрофия — это генетическое заболевание. Каждый сороковой житель планеты — здоровый носитель СМА. Чтобы в семье родился ребенок со СМА, нужно, чтобы такими носителями были оба родителя. В этом случае в 25% случаях ребенок родится здоровым, в 50% случаях он получает мутацию гена SMN1 от папы или от мамы и тоже становится просто носителем, а еще в 25% случаях он наследует мутацию гена SMN1 от обоих родителей и рождается с этой болезнью.
Чтобы в семье родился ребенок со СМА, нужно, чтобы такими носителями были оба родителя. В этом случае в 25% случаях ребенок родится здоровым, в 50% случаях он получает мутацию гена SMN1 от папы или от мамы и тоже становится просто носителем, а еще в 25% случаях он наследует мутацию гена SMN1 от обоих родителей и рождается с этой болезнью.
Отметим, что у здоровых носителей мутации гена SMN1 есть один полноценный ген и один ген с мутацией. Наличие одного полноценного гена достаточно для выработки необходимого количества нормального белка и правильного функционирования мотонейронов. Так что носитель от человека без поломки этого гена отличается лишь потенциальным риском рождения ребенка со СМА.
Более наглядно это показано на схеме
К сожалению, в реальности генетические особенности человека срабатывают не по математическому принципу.
Кандидат медицинских наук, ведущий врач-генетик ООО «Центра Генетики и Репродуктивной Медицины «Генетико» Наталья Ветрова описывает реальную практику появления детей со СМА в семьях, где есть два носителя:
«В семье могут быть все здоровыми, могут быть все носителями, могут быть все больными, могут через один.
Закон 25-50-25 действует на очень больших числах. В реальных семьях люди с мутацией гена SMN1 не могут иметь такое большое потомство, чтобы было распределение так, как у нас на картинке».
Кто и как ставит диагноз «Спинальная мышечная атрофия»
Поставить клинический диагноз СМА врач может после неврологического осмотра пациента с проверкой рефлексов и мышечного тонуса. Еще нужно провести внешний осмотр пациента и сделать биохимический тест.
После этого человек должен пройти еще несколько тестов. Генетическое исследование должно подтвердить или опровергнуть первоначальный клинический диагноз.
Тесты также нужны для уточнения прогноза заболевания и уточнения носительства мутаций гена SMN1 у родителей ребенка.
Подробнее о назначении каждого теста можно узнать, посмотрев на изображение.
Лучший тест на сегодня — MLPA. Он подтверждает причину СМА в 95 % случаев. Для оставшихся 5 % нужно тест секвенирование гена SMN1 (он нужен, если первый тест не подтвердил диагноз, а у пациента есть клинические проявления СМА).
Еще один тест, который может назначить врач, это панель «Нервно-мышечные заболевания» (НМЗ). Он нужен в случае, когда ни MPLA ни секвенирование не смогли найти причину клинических проявлений, которые позволяют врачу заподозрить СМА или другое нервно — мышечное заболевание.
СМА и беременность
Если в семье уже есть ребенок со СМА или один из будущих родителей — носитель или пациент со СМА, необходимо заранее провести несколько тестов .
Если два основных генетических исследования (MPLA и секвенирование) показывают, что второй родитель тоже носитель мутации гена SMN1, нужно решить, каким образом запланировать и провести беременность, чтобы минимизировать риск появления ребенка со СМА.
Если супружеская пара выбирает естественный путь для зачатия, то она должна пройти пренатальную инвазивную диагностику после десятой недели беременности. Для этого прокалывают живот и делают забор материала у плода. В современных условиях процедура достаточно безопасна и для будущей мамы, и для плода. Существует минимальный риск выкидыша, но он гораздо ниже, чем вероятность рождения ребенка со СМА.
Существует минимальный риск выкидыша, но он гораздо ниже, чем вероятность рождения ребенка со СМА.
Если супруги предпочитают ЭКО, то они могут пойти двумя путями:
или из нескольких зародышей отобрать здорового, или воспользоваться услугами донора — неносителя СМА. В этом случае донора нужно дополнительно исследовать на наличие мутации в гене SMN1.
При отборе эмбрионов риск возможного повреждения каждого эмбриона стремится к нулю. Отобранный здоровый эмбрион замораживают и подсаживают в матку.
Более подробно о беременности при СМА можно узнать, посмотрев запись вебинара Натальи Ветровой.
Проиграть видео
Патогенетическая терапия при СМА
В настоящее время в мире есть два уже одобренных препарата для лечения СМА — Нусинерсен (Спинраза) и AVXS -101 (Золгенсма). Ожидается, что в ближайшее время на рынке появится третий препарат RG7916 (Рисдиплам).
Нусинерсен предназначен для пожизненного приема, в случае с Золгенсма речь идет об однократной дозе, но оба этих препарата работают неодинаково. Один решает проблему мышечной слабости, другой — препарат, который модифицирует генные клетки в целом.
Один решает проблему мышечной слабости, другой — препарат, который модифицирует генные клетки в целом.
Главная задача этих препаратов — восполнить дефицит белка из-за не работающего гена SMN1. О проведенных клинических испытаниях препаратов и о последних новостях лекарственной терапии при СМА можно прочитать в разделе Клинические исследования и лекарства.
Краткий обзор о принципах работы патогенетической терапии при СМА можно прочитать по ссылке.
Эта статья для медицинских работников. Мы не рекомендуем пациентам использовать данные из нее самостоятельно. За консультациями необходимо обратится к врачу. Информация, предоставленная в статье, может относиться к лекарственным препаратам, отпускаемым по рецепту.
Спинальная мышечная атрофия Информационный бюллетень
Что такое спинальная мышечная атрофия?
Что вызывает СМА?
Как наследуется?
Какие существуют типы СМА?
Как диагностируется СМА?
Существуют ли методы лечения СМА?
Каков прогноз?
Какие исследования проводятся?
Где я могу получить дополнительную информацию?
Что такое спинальная мышечная атрофия?
Спинальная мышечная атрофия (СМА) это группа наследственных заболеваний, которые постепенно разрушают моторные нейроны — нервные клетки в стволе головного мозга и спинном мозге, которые контролируют основную активность скелетных мышц, такую как речь, ходьба, дыхание и глотание, приводит к мышечной слабости и атрофии. Моторные нейроны контролируют движения рук, ног, груди, лица, горла и языка. При нарушении передачи сигналов между двигательными нейронами и мышцами мышцы постепенно ослабевают, начинают истощаться и появляются подергивания (называемые 9).0017 фасцикуляции) .
Моторные нейроны контролируют движения рук, ног, груди, лица, горла и языка. При нарушении передачи сигналов между двигательными нейронами и мышцами мышцы постепенно ослабевают, начинают истощаться и появляются подергивания (называемые 9).0017 фасцикуляции) .
top
Что вызывает СМА?
Наиболее распространенная форма СМА вызывается дефектами в обеих копиях гена выживающего двигательного нейрона 1 (SMN1) на хромосоме 5q. Этот ген продуцирует белок двигательных нейронов выживания (SMN), который поддерживает здоровье и нормальную функцию двигательных нейронов. У людей со СМА недостаточный уровень белка SMN, что приводит к потере двигательных нейронов в спинном мозге, вызывая слабость и истощение скелетных мышц. Эта слабость часто более выражена в мышцах туловища и верхней части ног и рук, чем в мышцах кистей и стоп.
Существует много типов спинальной мышечной атрофии, вызванных изменениями в одних и тех же генах. Менее распространенные формы СМА вызываются мутациями в других генах, включая ген VAPB, расположенный на 20-й хромосоме, ген DYNC1h2 на 14-й хромосоме, ген BICD2 на 9-й хромосоме и ген UBA1 на Х-хромосоме. Типы различаются по возрасту начала и выраженности мышечной слабости; однако между типами есть совпадение.
Типы различаются по возрасту начала и выраженности мышечной слабости; однако между типами есть совпадение.
top
Как наследуется?
За исключением редких случаев, вызванных мутациями в гене UBA1, СМА наследуется в0017 аутосомно-рецессивный , что означает, что у пораженного человека есть два мутировавших гена, часто наследуемых по одному от каждого родителя. Те, у кого только один мутировавший ген, являются носителями болезни без каких-либо симптомов. Аутосомно-рецессивные заболевания могут поражать более одного человека в одном поколении (братьев, сестер или двоюродных братьев).
top
Какие существуют типы SMA?
Существует широкий спектр нарушений, наблюдаемых при СМА, вызванных дефектами гена SMN1, от начала до рождения с затрудненным дыханием при рождении до легкой слабости у взрослых. Соответственно, эту наиболее распространенную форму СМА можно разделить на четыре типа в зависимости от достигнутого наивысшего моторного уровня.
- СМА I типа, также называемая болезнью Верднига-Гоффмана или СМА с инфантильным началом , обычно проявляется в возрасте до 6 месяцев. Наиболее тяжело пораженные дети (СМА типа 0 или IA) имеют ограниченные движения даже внутриутробно и рождаются с контрактурами и затрудненным дыханием, при этом смерть наступает в первый год жизни без лечения. Симптомы СМА I типа включают гипотонию (снижение мышечного тонуса), снижение подвижности конечностей, отсутствие сухожильных рефлексов, фасцикуляции, затруднения при глотании и кормлении, а также нарушение дыхания. У этих детей также развивается сколиоз (искривление позвоночника) или другие скелетные аномалии по мере взросления. Без какого-либо лечения пораженные дети никогда не сидят и не стоят, и подавляющее большинство обычно умирает от дыхательной недостаточности в возрасте до 2 лет. Дети со СМА типа I теперь живут дольше и могут достигать более высоких двигательных навыков, таких как сидение и даже ходьба, благодаря более активной клинической помощи и новому доступному лечению, модифицирующему заболевание.

- Дети с СМА типа II, промежуточной формой , обычно проявляют свои первые симптомы в возрасте от 6 до 18 месяцев, хотя у некоторых они могут проявиться раньше. Они могут сидеть без поддержки, но не могут стоять или ходить без посторонней помощи, а некоторые могут со временем потерять способность самостоятельно сидеть без лечения. У них могут быть проблемы с дыханием, включая гиповентиляцию во сне. Прогрессирование заболевания вариабельно без лечения. Ожидаемая продолжительность жизни сокращается, но большинство людей доживает до подросткового или юношеского возраста. Благодаря лечению, модифицирующему заболевание, и активной клинической помощи дети со СМА II типа улучшили двигательные исходы.
- У детей с СМА типа III (болезнь Кугельберга-Веландера) симптомы развиваются после 18 месяцев, и они могут ходить самостоятельно. Сначала они испытывают трудности при ходьбе и беге, подъеме по ступенькам или вставании со стула. Чаще всего первыми поражаются проксимальные мышцы ног, при этом наблюдается тремор рук.
 Осложнения включают сколиоз и контрактуры суставов — хроническое укорочение мышц или сухожилий вокруг суставов, вызванное аномальным мышечным тонусом и слабостью, что препятствует свободному движению суставов. Люди со СМА типа III могут быть склонны к респираторным инфекциям, но при осторожном обращении большинство из них имеют нормальную продолжительность жизни. Лечение, модифицирующее заболевание, может улучшить результаты.
Осложнения включают сколиоз и контрактуры суставов — хроническое укорочение мышц или сухожилий вокруг суставов, вызванное аномальным мышечным тонусом и слабостью, что препятствует свободному движению суставов. Люди со СМА типа III могут быть склонны к респираторным инфекциям, но при осторожном обращении большинство из них имеют нормальную продолжительность жизни. Лечение, модифицирующее заболевание, может улучшить результаты. - У лиц со СМА типа IV симптомы развиваются после 21 года, с легкой или умеренной слабостью проксимальных мышц и другими симптомами.
top
Как диагностируется СМА?
Доступен анализ крови для поиска делеций или мутаций гена SMN1. Этот тест выявляет не менее 95 процентов СМА типов I, II и III, а также может выявить, является ли человек носителем дефектного гена, который может быть передан детям. Если ген SMN1 не является аномальным или анамнез и результаты обследования не типичны для СМА, другие диагностические тесты могут включать электромиографию (которая регистрирует электрическую активность мышц во время сокращения и в состоянии покоя), исследование скорости нервной проводимости (которое измеряют способность нерва посылать электрический сигнал), биопсию мышц (используется для диагностики многих нервно-мышечных расстройств) и другие анализы крови.
top
Существуют ли методы лечения СМА?
Полного излечения от СМА не существует. Лечение заключается в управлении симптомами и предотвращении осложнений.
В декабре 2016 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило нусинерсен (Спинраза™) в качестве первого препарата, одобренного для лечения детей и взрослых со СМА. Препарат вводят путем инъекции в жидкость, окружающую спинной мозг. Он предназначен для увеличения производства полноразмерного белка SMN, который имеет решающее значение для поддержания двигательных нейронов. Польза лучше всего задокументирована у младенцев и детей, особенно при раннем начале. Несколько других методов лечения находятся на поздних стадиях разработки и могут стать доступными для пострадавших людей в ближайшем будущем.
В мае 2019 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило генную терапию онасемногеном абепаровек-ксиои (Zolgensma™) для детей в возрасте до 2 лет с инфантильной СМА. Безопасный вирус доставляет полностью функциональный ген SMN человека к целевым двигательным нейронам, что, в свою очередь, улучшает движение и функцию мышц, а также повышает выживаемость. В августе 2020 года FDA одобрило пероральный препарат рисдиплам (Еврисди) для лечения пациентов в возрасте двух месяцев и старше со СМА.
Безопасный вирус доставляет полностью функциональный ген SMN человека к целевым двигательным нейронам, что, в свою очередь, улучшает движение и функцию мышц, а также повышает выживаемость. В августе 2020 года FDA одобрило пероральный препарат рисдиплам (Еврисди) для лечения пациентов в возрасте двух месяцев и старше со СМА.
Физиотерапия, трудотерапия и реабилитация могут помочь улучшить осанку, предотвратить неподвижность суставов и замедлить мышечную слабость и атрофию. Упражнения на растяжку и укрепление могут помочь уменьшить контрактуры, увеличить диапазон движений и поддерживать нормальное кровообращение. Некоторым людям требуется дополнительная терапия для устранения проблем с речью и глотанием. Вспомогательные устройства, такие как опоры или скобы, ортопедические стельки, синтезаторы речи и инвалидные коляски, могут помочь улучшить функциональную независимость.
Правильное питание и калории необходимы для поддержания веса и силы при избегании длительного голодания. Людям, которые не могут жевать или глотать, может потребоваться введение зонда для кормления. Неинвазивная вентиляция ночью может улучшить дыхание во время сна, а некоторым людям также может потребоваться вспомогательная вентиляция днем из-за слабости мышц шеи, горла и грудной клетки.
Людям, которые не могут жевать или глотать, может потребоваться введение зонда для кормления. Неинвазивная вентиляция ночью может улучшить дыхание во время сна, а некоторым людям также может потребоваться вспомогательная вентиляция днем из-за слабости мышц шеи, горла и грудной клетки.
наверх
Каков прогноз?
Прогноз зависит от типа СМА. Некоторые формы СМА без лечения приводят к летальному исходу.
Люди со СМА могут казаться стабильными в течение длительного времени, но без лечения нельзя ожидать улучшения.
top
Какие исследования проводятся?
Национальный институт неврологических расстройств и инсульта (NINDS), входящий в состав Национальных институтов здравоохранения (NIH), проводит фундаментальные, трансляционные и клинические исследования СМА в лабораториях NIH, а также поддерживает исследования посредством грантов для крупных медицинских учреждений. учреждений по всей стране.
Клеточные и молекулярные исследования направлены на понимание механизмов, вызывающих дегенерацию двигательных нейронов.
Ученые проанализировали ткани человека и разработали широкий спектр модельных систем на животных и клетках для изучения болезненных процессов и ускорения тестирования потенциальных методов лечения. Среди этих усилий:
- Было показано, что генная терапия и специальные лекарства останавливают разрушение двигательных нейронов и замедляют прогрессирование заболевания на моделях мышей и у людей со СМА. NINDS поддерживает исследования, направленные на разработку этих методов и создание условий для клинических испытаний на пациентах. Клинические испытания генной терапии при СМА продолжаются.
- Модели СМА на животных представляют собой важные инструменты для открытия и разработки новых методов лечения СМА. Ученые разработали модели рыбок данио, мышей и свиней, в том числе модели менее тяжелых типов СМА 2 и 3, которые могут значительно помочь в определении новых терапевтических мишеней и потенциальных методов лечения.
Ученые, поддерживаемые NIH, собрали продольные данные о досимптомных или недавно диагностированных детях со СМА типов 1, 2 или 3 и их здоровых братьях и сестрах. Целью данного исследования является консультирование и информирование родителей о возможных возможностях проведения клинических испытаний.
Целью данного исследования является консультирование и информирование родителей о возможных возможностях проведения клинических испытаний.
NINDS создала сеть клинических испытаний NeuroNext (NINDS Network for Excellence in Neuroscience Clinical Trials) для содействия быстрой разработке и проведению испытаний неврологических расстройств, поражающих взрослых и/или детей. Среди своих целей сеть предназначена для разработки испытаний на ранней стадии, направленных на выявление биомаркеров — обычно физических признаков или веществ в крови или других жидкостях организма, которые можно измерить для определения наличия и тяжести заболевания — и тестирования перспективных, появляющиеся терапии. Один из проектов заключался в том, чтобы определить биомаркеры СМА и понять причину и механизмы, лежащие в основе заболевания. Данные естественной истории, полученные в ходе этого исследования, привели к решению об одобрении нусинерсена. Знания, полученные в ходе этого исследования, позволили улучшить дизайн дополнительных клинических испытаний СМА.
Где я могу получить дополнительную информацию?
Для получения дополнительной информации о неврологических расстройствах или исследовательских программах, финансируемых Национальным институтом неврологических расстройств и инсульта, обращайтесь в Сеть ресурсов и информации о мозге (BRAIN) Института по телефону:
BRAIN
P.O. Box 5801
Bethesda, MD 20824
800-352-9424
Информация также доступна в следующих организациях:
Cure SMA
925 Busse Road
Elk Grove Village, IL 60007
847-367-7620
800-886-1762
Фонд мускулистого атрофии спинала
126 Восточная 56-я улица
30-й этаж
Нью-Йорк, Нью-Йорк 10022
646-253-71003
New York, NY 10022
646-253-71003.
877-386-3762
Ассоциация мышечной дистрофии
161 N. Clarke,
Suite 3550
Чикаго, IL 60601
800-572-1717
«Spinal Muscular Atrophy.
Публикация NIH № 19-NS-5597
Back to Spinal Muscular Atrophy Information Page
See a list of all NINDS disorders
Publicaciones en Español
Atrofia Muscular Espinal
Prepared by:
Office of Communications and Public Liaison
National Institute of Neurological Disorders and Stroke
National Institutes of Health
Bethesda, MD 20892
Медицинские материалы NINDS предоставляются только в информационных целях и не обязательно отражают одобрение или официальную позицию Национального института неврологических расстройств и Инсульт или любое другое федеральное агентство. Рекомендации по лечению или уходу за отдельным пациентом должны быть получены путем консультации с врачом, который осматривал этого пациента или знаком с историей болезни этого пациента.
Вся информация, подготовленная NINDS, находится в открытом доступе и может быть свободно скопирована. Приветствуется кредит NINDS или NIH.
Приветствуется кредит NINDS или NIH.
Атрофия и усталость скелетных мышц, вызванные заболеванием
1. Acuña MJ, Pessina P, Olguin H, et al. Восстановление мышечной силы в дистрофических мышцах с помощью ангиотензина-1-7 посредством ингибирования передачи сигналов TGF-b. Хум Мол Жене. 2014;23(5):1237–49. [PubMed] [Google Scholar]
2. Агтен А., Маес К., Смудер А., Пауэрс С.К., Декрамер М., Гаян-Рамирез Г. Н. Ацетилцистеин защищает диафрагму крыс от снижения сократимости, связанного с управляемой механической вентиляцией легких. Крит Уход Мед. 2011;39(4): 777–82. [PubMed] [Google Scholar]
3. Альберг К., Экман Т., Гастон-Йоханссон Ф., Мок В. Оценка и лечение усталости, связанной с раком, у взрослых. Ланцет. 2003;362(9384):640–50. [PubMed] [Google Scholar]
4. Alloatti G, Penna C, Mariano F, Camussi G. Роль NO и PAF в нарушении сократимости скелетных мышц, вызванном TNF-альфа. Am J Physiol Regul Integr Comp Physiol. 2000;279(6):R2156–63. [PubMed] [Google Scholar]
5. Андреев Х.Дж., Норман А.Р., Оутс Дж., Каннингем Д. Почему пациенты с потерей веса имеют худшие результаты при химиотерапии злокачественных новообразований желудочно-кишечного тракта? Евр Джей Рак. 1998;34(4):503–9. [PubMed] [Google Scholar]
Андреев Х.Дж., Норман А.Р., Оутс Дж., Каннингем Д. Почему пациенты с потерей веса имеют худшие результаты при химиотерапии злокачественных новообразований желудочно-кишечного тракта? Евр Джей Рак. 1998;34(4):503–9. [PubMed] [Google Scholar]
6. Argiles JM, Busquets S, Stemmler B, Lopez-Soriano FJ. Раковая кахексия: понимание молекулярной основы. Нат Рев Рак. 2014;14(11):754–62. [PubMed] [Google Scholar]
7. Argiles JM, Busquets S, Stemmler B, Lopez-Soriano FJ. Кахексия и саркопения: механизмы и потенциальные цели вмешательства. Курр Опин Фармакол. 2015;22:100–6. [PubMed] [Google Scholar]
8. Барсевик А., Фрост М., Цвиндерман А., Холл П., Хальярд М. Я так устал: биологические и генетические механизмы усталости, связанной с раком. Качество жизни Res. 2010;19(10): 1419–27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Berger JR, Pocoski J, Preblick R, Boklage S. Усталость, предвещающая рассеянный склероз. Рассеянный склероз (Houndmills, Basingstoke, England) 2013;19(11):1526–32. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
10. Betters JL, Criswell DS, Shanely RA, et al. Тролокс ослабляет вызванную механической вентиляцией дисфункцию диафрагмы и протеолиз. Am J Respir Crit Care Med. 2004;170(11):1179–84. [PubMed] [Google Scholar]
11. Bolton CF, Breuer AC. Критическая полинейропатия. Мышечный нерв. 1999;22(3):419–24. [PubMed] [Google Scholar]
12. Bower JE. Механизмы усталости, связанные с раком, факторы риска и методы лечения. Nat Rev Clin Oncol. 2014;11(10):597–609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Бруэра Э. Азбука паллиативной помощи. Анорексия, кахексия и питание. Британский медицинский журнал. 1997;315(7117):1219–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Каллахан Л.А., Супински Г.С. Сепсис-индуцированная миопатия. Крит Уход Мед. 2009; 37 (10 дополнений): S354–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Cantor JB, Ashman T, Gordon W, et al. Усталость после черепно-мозговой травмы и ее влияние на участие и качество жизни. Журнал реабилитации после травм головы. 2008;23(1):41–51. [PubMed] [Google Scholar]
Журнал реабилитации после травм головы. 2008;23(1):41–51. [PubMed] [Google Scholar]
16. Capuron L, Miller AH. Иммунная система к передаче сигналов мозга: нейропсихофармакологические последствия. Фармакол Тер. 2011;130(2):226–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Chaudhuri A, Behan PO. Усталость при неврологических расстройствах. Ланцет. 2004;363(1474-547; 9413): 978–88. [PubMed] [Google Scholar]
18. Chen JL, Walton KL, Winbanks CE, et al. Повышенная экспрессия активинов способствует атрофии мышц и кахексии. FASEB J. 2014; 28(4):1711–23. [PubMed] [Google Scholar]
19. Кларк Ю.Ю., Уолд Л.Е., Салача Л.А., Маккарти Д.О. Убихинол снижает атрофию мышц, но не утомляемость у мышей с опухолями. Биол Рез Нурс. 2015;17(3):321–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Culp PA, Choi D, Zhang Y, et al. Антитела к рецептору TWEAK ингибируют рост опухоли человека за счет двойного механизма. Клин Рак Рез. 2010;16(2):497–508. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
21. Curt GA, Breitbart W, Cella D, et al. Влияние усталости, связанной с раком, на жизнь пациентов: новые результаты Коалиции по вопросам усталости. Онколог. 2000;5(5):353–60. [PubMed] [Google Scholar]
22. Dantzer R, Heijnen CJ, Kavelaars A, Laye S, Capuron L. Нейроиммунная основа утомления. Тенденции в нейронауках. 2014;37(1):39–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Dasta JF, McLaughlin TP, Mody SH, Piech CT. Суточная стоимость дня отделения интенсивной терапии: вклад ИВЛ. Крит Уход Мед. 2005;33(6):1266–71. [PubMed] [Академия Google]
24. Де Бликер Дж.Л., Мейре В.И., Деклерк В., Ван Акен Э.Х. Иммунолокализация фактора некроза опухоли-альфа и его рецепторов при воспалительных миопатиях. Нервно-мышечное расстройство. 1999;9(4):239–46. [PubMed] [Google Scholar]
25. De Jonghe B, Sharshar T, Lefaucheur JP, et al. Парез, приобретенный в отделении интенсивной терапии: проспективное многоцентровое исследование. ДЖАМА. 2002; 288(22):2859–67. [PubMed] [Google Scholar]
ДЖАМА. 2002; 288(22):2859–67. [PubMed] [Google Scholar]
26. Dewys WD, Begg C, Lavin PT, et al. Прогностический эффект потери веса перед химиотерапией у онкологических больных. Восточная кооперативная онкологическая группа. Am J Med. 1980;69(4):491–7. [PubMed] [Google Scholar]
27. Добрякова Е., Генова Х.М., ДеЛука Дж., Уайли Г.Р. Гипотеза дисбаланса дофамина об усталости при рассеянном склерозе и других неврологических расстройствах. Границы в неврологии. 2015;6:52. Журнальная статья. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Dvorak HF. Опухоли: незаживающие раны. Сходства между образованием стромы опухоли и заживлением ран. N Engl J Med. 1986;315(26):1650–9. [PubMed] [Академия Google]
29. Элберс Р.Г., Ритберг М.Б., Веген Э.Е. и др. Анкеты самоотчетов об усталости при рассеянном склерозе, болезни Паркинсона и инсульте: систематический обзор свойств измерений. Исследование качества жизни: международный журнал качества жизни, аспектов лечения, ухода и реабилитации. 2012;21(6):925–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2012;21(6):925–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Эскандар Н., Апостолакос М.Дж. Отлучение от ИВЛ. Крит Уход Клин. 2007;23(2):263–74, х. [PubMed] [Академия Google]
31. Эстебан А., Алия И., Ибанез Дж., Бенито С., Тобин М.Дж. Режимы искусственной вентиляции легких и отлучения от груди. Национальный обзор испанских больниц. Испанская совместная группа по легочной недостаточности. Грудь. 1994;106(4):1188–93. [PubMed] [Google Scholar]
32. Esteban A, Frutos F, Tobin MJ, et al. Сравнение четырех методов отлучения больных от ИВЛ. Испанская совместная группа по легочной недостаточности. N Engl J Med. 1995;332(6):345–50. [PubMed] [Google Scholar]
33. Fearon K, Strasser F, Anker SD, et al. Определение и классификация раковой кахексии: международный консенсус. Ланцет Онкол. 2011;12(5):489–95. [PubMed] [Google Scholar]
34. Фирон К.С., Glass DJ, Guttridge DC. Раковая кахексия: медиаторы, сигнальные и метаболические пути. Клеточный метаб. 2012;16(2):153–66. [PubMed] [Google Scholar]
2012;16(2):153–66. [PubMed] [Google Scholar]
35. Феррейра Л.Ф., Мойлан Дж.С., Гиллиам Л.А., Смит Дж.Д., Николова-Каракашян М., Рейд М.Б. Сфингомиелиназа стимулирует передачу сигналов окислителей, ослабляя скелетные мышцы и вызывая утомление. Am J Physiol Cell Physiol. 2010;299(3):C552–60. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Ferreira LF, Moylan JS, Stasko S, Smith JD, Campbell KS, Reid MB. Сфингомиелиназа снижает силу и чувствительность к кальцию сократительного аппарата в мышечных волокнах диафрагмы мышей. J Appl Physiol (1985) 2012;112(9):1538–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Finfer S, Chittock DR, Su SY, et al. Интенсивный контроль уровня глюкозы в сравнении с традиционным контролем у пациентов в критическом состоянии. N Engl J Med. 2009;360(13):1283–97. [PubMed] [Google Scholar]
38. Финстерер Дж., Махджуб С.З. Усталость у здоровых и больных людей. Американский журнал хосписов и паллиативной помощи. 2014;31(5):562–75. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
39. Фиск Дж. Д., Понтефракт А., Ритво П. Г., Арчибальд С. Дж., Мюррей Т. Дж. Влияние усталости на больных рассеянным склерозом. Канадский журнал неврологических наук. Канадский журнал неврологических наук. 1994;21(0317-1671; 1):9–14. [PubMed] [Google Scholar]
40. Griffiths RD, Palmer TE, Helliwell T, MacLennan P, MacMillan RR. Влияние пассивного растяжения на истощение мышц у критически больных. Питание. 1995;11(5):428–32. [PubMed] [Google Scholar]
41. Ханкен К., Элинг П., Хильдебрандт Х. Репрезентация воспалительных сигналов в головном мозге — модель субъективной усталости при рассеянном склерозе. Границы в неврологии. 2014;5:264. Журнальная статья. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Хардин Б.Дж., Кэмпбелл К.С., Смит Д.Д. и соавт. TNF-альфа действует через TNFR1 и мышечные оксиданты, подавляя миофибриллярную силу в скелетных мышцах мышей. J Appl Physiol (1985) 2008;104(3):694–9. [PubMed] [Google Scholar]
43. Хеллиуэлл П.С., Джексон С. Связь между слабостью и атрофией мышц при ревматоидном артрите. Энн Реум Дис. 1994;53(11):726–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хеллиуэлл П.С., Джексон С. Связь между слабостью и атрофией мышц при ревматоидном артрите. Энн Реум Дис. 1994;53(11):726–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Hermans G, Van den Berghe G. Клинический обзор: отделение интенсивной терапии приобрело слабость. Критический уход. 2015;19:274. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Hermans G, Wilmer A, Meersseman W, et al. Влияние интенсивной инсулинотерапии на нервно-мышечные осложнения и зависимость от вентилятора в отделении интенсивной терапии. Am J Respir Crit Care Med. 2007;175(5):480–9. [PubMed] [Google Scholar]
46. Herridge MS, Tansey CM, Matte A, et al. Функциональная инвалидность через 5 лет после острого респираторного дистресс-синдрома. N Engl J Med. 2011;364(14):1293–304. [PubMed] [Академия Google]
47. Хофман М., Райан Дж.Л., Фигероа-Мозли К.Д., Жан-Пьер П., Морроу Г.Р. Усталость, связанная с раком: масштаб проблемы. Онколог. 2007; 12 (Приложение 1): 4–10. [PubMed] [Google Scholar]
48. Johnston AJ, Murphy KT, Jenkinson L, et al. Нацеливание на Fn14 предотвращает вызванную раком кахексию и продлевает выживаемость. Клетка. 2015;162(6):1365–78. [PubMed] [Google Scholar]
Johnston AJ, Murphy KT, Jenkinson L, et al. Нацеливание на Fn14 предотвращает вызванную раком кахексию и продлевает выживаемость. Клетка. 2015;162(6):1365–78. [PubMed] [Google Scholar]
49. Klenner FR. Усталость, нормальная и патологическая, особенно при миастении и рассеянном склерозе. Южная медицина и хирургия. 1949;111(9):273–7. [PubMed] [Google Scholar]
50. Клюгер Б.М., Крупп Л.Б., Енока Р.М. Усталость и утомляемость при неврологических заболеваниях: предложение по единой таксономии. Неврология. 2013;80(4):409–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Kress JP, Hall JB. Слабость, приобретенная в отделении интенсивной терапии, и восстановление после критического заболевания. N Engl J Med. 2014;370(17):1626–35. [PubMed] [Google Scholar]
52. Krupp LB, Alvarez LA, LaRocca NG, Scheinberg LC. Усталость при рассеянном склерозе. Архив неврологии. 1988;45(0003-9942; 4):435–7. [PubMed] [Google Scholar]
53. Lee SJ. Регуляция мышечной массы миостатином. Annu Rev Cell Dev Biol. 2004; 20:61–86. [PubMed] [Google Scholar]
Annu Rev Cell Dev Biol. 2004; 20:61–86. [PubMed] [Google Scholar]
54. Levine S, Nguyen T, Kaiser LR, et al. Ремоделирование диафрагмы человека, связанное с хронической обструктивной болезнью легких: клинические последствия. Am J Respir Crit Care Med. 2003;168(6):706–13. [PubMed] [Google Scholar]
55. Li X, Moody MR, Engel D, et al. Кардиоспецифическая избыточная экспрессия фактора некроза опухоли-альфа вызывает окислительный стресс и сократительную дисфункцию в диафрагме мыши. Тираж. 2000;102(14):1690–6. [PubMed] [Google Scholar]
56. Li YP, Atkins CM, Sweatt JD, Reid MB. Митохондрии опосредуют передачу сигналов фактора некроза опухоли-альфа/NF-kappaB в мышечных трубках скелетных мышц. Антиоксидный окислительно-восстановительный сигнал. 1999;1(1):97–104. [PubMed] [Google Scholar]
57. Маес К., Тестельманс Д., Пауэрс С., Декрамер М., Гаян-Рамирес Г. Лейпептин ингибирует индуцированную вентилятором дисфункцию диафрагмы у крыс. Am J Respir Crit Care Med. 2007;175(11):1134–1138. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
58. McClung JM, Kavazis AN, Whidden MA, et al. Введение антиоксидантов ослабляет атрофию мышц диафрагмы крыс, вызванную механической вентиляцией, независимо от передачи сигналов протеинкиназы B (PKB Akt). Дж. Физиол. 2007; 585 (часть 1): 203–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. МакКонвилл Дж. Ф., Кресс Дж. П. Отлучение пациентов от аппарата ИВЛ. N Engl J Med. 2012;367(23):2233–9. [PubMed] [Google Scholar]
60. McPherron AC, Lee SJ. Двойная мускулатура у крупного рогатого скота из-за мутаций в гене миостатина. Proc Natl Acad Sci U S A. 1997;94(23):12457–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Morales MG, Abrigo J, Meneses C, et al. Ось Ang-(1-7)/Mas-1 ослабляет экспрессию и передачу сигналов TGF-бета1, индуцированную AngII, в скелетных мышцах мышей. Clin Sci (Лондон) 2014;127(4):251–64. [PubMed] [Академия Google]
62. Моррис Г., Берк М., Галецки П., Уолдер К., Мэйс М. Нейро-иммунная патофизиология центральной и периферической усталости при системных иммунно-воспалительных и нейроиммунных заболеваниях. Молекулярная нейробиология. 2016;53(2):1195–1219. [PubMed] [Google Scholar]
Молекулярная нейробиология. 2016;53(2):1195–1219. [PubMed] [Google Scholar]
63. Moylan JS, Smith JD, Horrell EM, et al. Нейтральная сфингомиелиназа-3 опосредует стимулированную TNF оксидантную активность в скелетных мышцах. Редокс Биол. 2014;2:910–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Мерфи К.Т., Аллен А.М., Чи А., Наим Т., Линч Г.С. Нарушение ренин-ангиотензиновой системы мышц у мышей AT-/- 1a усиливает мышечную функцию, несмотря на снижение мышечной массы, но ставит под угрозу восстановление после травмы. Am J Physiol. 2012;303(3):R321–31. [PubMed] [Академия Google]
65. Мерфи К.Т., Чи А., Глисон Б.Г. и др. Направленное антителами ингибирование миостатина увеличивает мышечную массу и функцию у мышей с опухолями. Am J Physiol. 2011;301:R716–R26. [PubMed] [Google Scholar]
66. Мерфи К.Т., Чи А., Триу Дж., Наим Т., Линч Г.С. Ингибирование ренин-ангиотензиновой системы улучшает физиологические исходы у мышей с легкой или тяжелой раковой кахексией. Международный журнал рака. 2013;133(5):1234–46. [PubMed] [Google Scholar]
Международный журнал рака. 2013;133(5):1234–46. [PubMed] [Google Scholar]
67. Murphy KT, Koopman R, Naim T, et al. Направленное антителами ингибирование миостатина у 21-месячных мышей раскрывает новые роли передачи сигналов миостатина в структуре и функции скелетных мышц. FASEB J. 2010;24(11):4433–42. [PubMed] [Академия Google]
68. Нельсон В.Б., Смудер А.Дж., Хадсон М.Б., Талберт Э.Е., Пауэрс С.К. Перекрестные помехи между протеолитическими системами кальпаина и каспазы-3 в диафрагме при длительной искусственной вентиляции легких. Крит Уход Мед. 2012; 40(6):1857–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Norden DM, Bicer S, Clark Y, et al. Рост опухоли усиливает нейровоспаление, утомляемость и депрессивно-подобное поведение до изменения мышечной функции. Мозг Behav Immun. 2015;43:76–85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Парри С.М., Берни С., Грейнджер С.Л., Купман Р., Эль-Ансари Д., Денехи Л. Электрическая стимуляция мышц в условиях интенсивной терапии: систематический обзор. Крит Уход Мед. 2013;41(10):2406–18. [PubMed] [Google Scholar]
Крит Уход Мед. 2013;41(10):2406–18. [PubMed] [Google Scholar]
71. Powers SK, Hudson MB, Nelson WB, et al. Митохондриально-направленные антиоксиданты защищают от слабости диафрагмы, вызванной искусственной вентиляцией легких. Крит Уход Мед. 2011;39(7):1749–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Powers SK, Kavazis AN, DeRuisseau KC. Механизмы атрофии бездействия мышц: роль окислительного стресса. Am J Physiol Regul Integr Comp Physiol. 2005; 288(2):R337–44. [PubMed] [Академия Google]
73. Пауэрс С.К., Кавазис А.Н., Левин С. Длительная искусственная вентиляция легких изменяет структуру и функцию диафрагмы. Крит Уход Мед. 2009; 37 (10 дополнений): S347–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Powers SK, Kavazis AN, McClung JM. Окислительный стресс и мышечная атрофия. J Appl Physiol. 2007;102(6):2389–97. [PubMed] [Google Scholar]
75. Пауэрс С.К., Смудер А.Дж., Крисвелл Д.С. Механистические связи между окислительным стрессом и мышечной атрофией. Антиоксидный окислительно-восстановительный сигнал. 2011;15(9): 2519–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Антиоксидный окислительно-восстановительный сигнал. 2011;15(9): 2519–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Powers SK, Wiggs MP, Sollanek KJ, Smuder AJ. Дисфункция диафрагмы, вызванная вентилятором: причина и следствие. Am J Physiol Regul Integr Comp Physiol. 2013;305(5):R464–77. [PubMed] [Google Scholar]
77. Puppa MJ, Murphy EA, Fayad R, Hand GA, Carson JA. Кахектическая реакция скелетных мышц на новый приступ низкочастотной стимуляции. J Appl Physiol (1985) 2014;116(8):1078–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Путучери З.А., Равал Дж., Макфейл М. и соавт. Острая атрофия скелетных мышц при критических состояниях. ДЖАМА. 2013;310(15):1591–600. [PubMed] [Google Scholar]
79. Reid MB, Lannergren J, Westerblad H. Слабость дыхательных мышц и мышц конечностей, вызванная фактором некроза опухоли-альфа: вовлечение мышечных миофиламентов. Am J Respir Crit Care Med. 2002;166(4):479–84. [PubMed] [Google Scholar]
80. Резк Б.М., Йошида Т., Семпрун-Прието Л., Хигаси Ю., Суханов С., Делафонтен П. Инфузия ангиотензина II вызывает выраженную атрофию скелетных мышц диафрагмы. ПЛОС Один. 2012;7(1):e30276. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Резк Б.М., Йошида Т., Семпрун-Прието Л., Хигаси Ю., Суханов С., Делафонтен П. Инфузия ангиотензина II вызывает выраженную атрофию скелетных мышц диафрагмы. ПЛОС Один. 2012;7(1):e30276. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Ryall JG, Plant DR, Gregorevic P, Sillence MN, Lynch GS. b 2 Введение -агониста восстанавливает атрофию мышц и улучшает мышечную функцию у старых крыс. Дж. Физиол. 2004; 555 (часть 1): 175–88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Shanely RA, Van Gammeren D, Deruisseau KC, et al. Механическая вентиляция угнетает синтез белка в диафрагме крыс. Am J Respir Crit Care Med. 2004;170(9):994–9. [PubMed] [Google Scholar]
83. Smith IJ, Godinez GL, Singh BK, et al. Ингибирование передачи сигналов янус-киназы во время контролируемой механической вентиляции предотвращает дисфункцию диафрагмы, вызванную вентиляцией. FASEB J. 2014; 28(7):2790–803. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Смудер А. Дж., Нельсон В.Б., Хадсон М.Б., Кавазис А.Н., Пауэрс С.К. Ингибирование убиквитин-протеасомного пути не защищает от вызванного вентиляцией ускоренного протеолиза или атрофии диафрагмы. Анестезиология. 2014;121(1):115–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж., Нельсон В.Б., Хадсон М.Б., Кавазис А.Н., Пауэрс С.К. Ингибирование убиквитин-протеасомного пути не защищает от вызванного вентиляцией ускоренного протеолиза или атрофии диафрагмы. Анестезиология. 2014;121(1):115–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Стаско С.А., Хардин Б.Дж., Смит Д.Д., Мойлан Д.С., Рейд М.Б. Сигналы TNF через синтазу оксида азота нейронального типа и активные формы кислорода снижают удельную силу скелетных мышц. J Appl Physiol (1985) 2013;114(11):1629–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Steens A, de Vries A, Hemmen J, et al. Усталость, воспринимаемая больными рассеянным склерозом, связана с мышечной усталостью. Нейрореабилитация и восстановление нервной системы. 2012;26(1):48–57. [PubMed] [Google Scholar]
87. Stewart GD, Skipworth RJ, Fearon KC. Раковая кахексия и усталость. Клин Мед. 2006;6(2):140–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Supinski G, Stofan D, Callahan LA, Nethery D, Nosek TM, DiMarco A. Пероксинитрит вызывает сократительную дисфункцию и перекисное окисление липидов в диафрагме. J Appl Physiol (1985) 1999;87(2):783–91. [PubMed] [Google Scholar]
Пероксинитрит вызывает сократительную дисфункцию и перекисное окисление липидов в диафрагме. J Appl Physiol (1985) 1999;87(2):783–91. [PubMed] [Google Scholar]
89. Szentesi P, Bekedam MA, van Beek-Harmsen BJ, et al. Депрессия силовой продукции и активности АТФазы в различных типах скелетных мышечных волокон человека у больных хронической сердечной недостаточностью. J Appl Physiol (1985) 2005;99(6):2189–95. [PubMed] [Google Scholar]
90. Tajrishi MM, Zheng TS, Burkly LC, Kumar A. Путь TWEAK-Fn14: мощный регулятор биологии скелетных мышц в норме и при патологии. Cytokine Growth Factor Rev. 2014;25(2):215–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Ван ден Берге Г., Шунхейдт К., Бекс П., Бруйнинкс Ф., Воутерс П.Дж. Инсулинотерапия защищает центральную и периферическую нервную систему пациентов интенсивной терапии. Неврология. 2005;64(8):1348–53. [PubMed] [Google Scholar]
92. Вассилакопулос Т., Петроф Б.Дж. Вентиляционно-индуцированная дисфункция диафрагмы. Am J Respir Crit Care Med. 2004;169(3):336–41. [PubMed] [Google Scholar]
Am J Respir Crit Care Med. 2004;169(3):336–41. [PubMed] [Google Scholar]
93. Уидден М.А., Смудер А.Дж., Ву М., Хадсон М.Б., Нельсон В.Б., Пауэрс С.К. Окислительный стресс необходим для активации протеаз в диафрагме, вызванной механической вентиляцией. J Appl Physiol. 2010;108(5):1376–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Wilcox PG, Wakai Y, Walley KR, Cooper DJ, Road J. Фактор некроза опухоли альфа снижает сократительную способность диафрагмы in vivo у собак. Am J Respir Crit Care Med. 1994; 150 (5 часть 1): 1368–73. [PubMed] [Google Scholar]
95. Wolkorte R, Heersema DJ, Zijdewind I. Мышечная утомляемость во время длительного отведения указательного пальца и оценки депрессии связаны с воспринимаемой усталостью у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом. Нейрореабилитация и восстановление нервной системы. 2015;29(8): 796–802. [PubMed] [Google Scholar]
96. Волкорте Р., Хеерсема Д.Дж., Зейдевинд И. Снижение производительности двух задач у пациентов с рассеянным склерозом еще больше снижается из-за мышечной усталости.


 Закон 25-50-25 действует на очень больших числах. В реальных семьях люди с мутацией гена SMN1 не могут иметь такое большое потомство, чтобы было распределение так, как у нас на картинке».
Закон 25-50-25 действует на очень больших числах. В реальных семьях люди с мутацией гена SMN1 не могут иметь такое большое потомство, чтобы было распределение так, как у нас на картинке».
 Осложнения включают сколиоз и контрактуры суставов — хроническое укорочение мышц или сухожилий вокруг суставов, вызванное аномальным мышечным тонусом и слабостью, что препятствует свободному движению суставов. Люди со СМА типа III могут быть склонны к респираторным инфекциям, но при осторожном обращении большинство из них имеют нормальную продолжительность жизни. Лечение, модифицирующее заболевание, может улучшить результаты.
Осложнения включают сколиоз и контрактуры суставов — хроническое укорочение мышц или сухожилий вокруг суставов, вызванное аномальным мышечным тонусом и слабостью, что препятствует свободному движению суставов. Люди со СМА типа III могут быть склонны к респираторным инфекциям, но при осторожном обращении большинство из них имеют нормальную продолжительность жизни. Лечение, модифицирующее заболевание, может улучшить результаты.