Бинодальная болезнь сердца: Що таке бінодальна хвороба серця? – довідник Омега-Київ
Инструменты
Изолированный гликогеноз сердца
| Dublin Core | PKP метаданные | Метаданные этого документа | |
| 1. | Название | Название документа | Изолированный гликогеноз сердца |
| 2. | Создатель | Автор, учреждение | С. М. Комиссарова; ГУ Республиканский научно-практический центр «Кардиология»; Беларусь |
| 2. | Создатель | Автор, учреждение | Н. М. Ринейская; ГУ Республиканский научно-практический центр «Кардиология»; Беларусь |
| 2. | Создатель | Автор, учреждение | Н. Н. Чакова; ГНУ «Институт генетики и цитологии НАН Беларуси»; Беларусь Н. Чакова; ГНУ «Институт генетики и цитологии НАН Беларуси»; Беларусь |
| 2. | Создатель | Автор, учреждение | С. С. Ниязова; ГНУ «Институт генетики и цитологии НАН Беларуси»; Беларусь |
| 2. | Создатель | Автор, учреждение | Л. И. Плащинская; ГУ Республиканский научно-практический центр «Кардиология»; Беларусь |
| 3. | Предмет | Дисциплины | |
| 3. | Предмет | Предметы | синдром PRKAG2; изолированный гликогеноз сердца; синдром WPW; мутации; бинодальная болезнь |
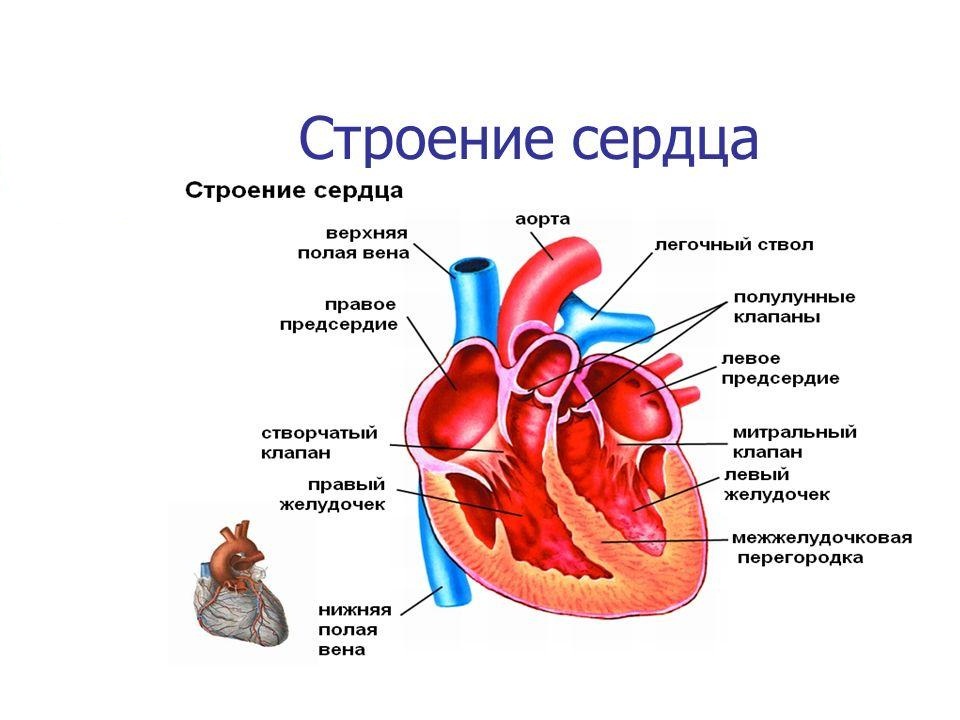
| 4. | Описание | Аннотация | Изолированный гликогеноз сердца (синдром PRKAG2) является одной из форм гликогеноза, основным клиническим проявлением которого является гипертрофия левого желудочка, фенотипически сходная с гипертрофической кардиомиопатией, в сочетании с предвозбуждением желудочков и нарушениями проводимости. Представлен обзор сведений литературы и клиническое наблюдение двух пациентов из одной семьи с мутацией с.905С>А (p.Arg302Gln) гена PRKAG2, ассоциированной с синдромом Вольфа-Паркинсона-Уайта и ранним развитием нарушений проводимости, потребовавших имплантации электрокардиостимулятора. Обсуждены вопросы диагностики и стратегии лечения заболевания. |
| 5. | Издатель | Организатор, город | «SILICEA-POLIGRAF» LLC |
| 6. | Вспомоществователь | Спонсоры | |
| 7. | Дата | (ДД-ММ-ГГГГ) | 02.11.2019 |
8. | Тип | Тип исследования или жанр | Рецензированная статья |
| 8. | Тип | Тип | |
| 9. | Формат | Формат файла | PDF (Rus) |
| 10. | Идентификатор | Универсальный идентификатор, URI | https://russjcardiol.elpub.ru/jour/article/view/3386 |
| 10. | Идентификатор | Digital Object Identifier | https://doi.org/10.15829/1560-4071-2019-10-110-117 |
| 11. | Источник | Журнал/конференция, том., №. (год) | Российский кардиологический журнал; № 10 (2019) |
12. | Язык | Russian=ru, English=en | ru |
| 13. | Связь | Дополнительные файлы | |
| 14. | Покрытие | Пространственно-временной охват, методика исследования | |
| 15. | Права | Права и разрешения | Авторы, публикующие статьи в данном журнале, соглашаются на следующее:
|
Изолированный гликогеноз сердца | Комиссарова
1. Yavari A, Bellahcene M, Bucchi A, et al. Mammalian y2 AMPK regulates intrinsic heart rate. Nat Commun. 2017;8:1258. doi:10.1038/s41467-017-01342-5.
2. Banankhah P, Fishbein GA, Dota A, et al. Cardiac manifestations of PRKAG2 mutation. BMC Med Genet. 2018;19:1. doi:10.1186/s12881-017-0512-6.
3. Zaha VYL. Amp-activated protein kinase regulation and biological actions in the heart. Circulation Research. 2012;111:800-14. doi:10.1161/CIRCRESAHA.111.255505.
4. Habets DD, Coumans WA, Voshol PJ, et al. AMPK-mediated increase in myocardial long-chain fatty acid uptake critically depends on sarcolemmal CD36. Biochem Biophys Res Commun. 2007;355:204-10. doi:10.1016/j.bbrc.2007.01.141.
Biochem Biophys Res Commun. 2007;355:204-10. doi:10.1016/j.bbrc.2007.01.141.
5. Calore M. The PRKAG2 gene and hypertrophic cardiomyopathy: an energetically imbalanced relationship. Am J Physiol Heart Circ Physiol. 2017;313:h348-h350. doi:10.1152/ajpheart.00316.2017.
6. Gollob MH. Glycogen storage disease as a unifying mechanism of disease in the PRKAG2 cardiac syndrome. Biochem Soc Trans. 2003;31:228-31.
7. Tan HL, van der Wal AC, Campian ME, et al. Nodoventricular accessory pathways in PRKAG2-dependent familial preexcitation syndrome reveal a disorder in cardiac development. Circ Arrhythm Electrophysiol 2008;1:276-81. doi:10.1161/CIRCEP.108.782862.
8. Govindan M, Ward D, Behr E. A rare connection: fasciculoventricular pathway in PRKAG2 disease. J Cardiovasc Electrophysiol 2010;21:329-32. doi:10.1111/j.1540-8167.2009.01578.x.
9. Sternick EB, Oliva A, Gerken LM, et al. Clinical, electrocardiographic, and electrophysiologic characteristics of patients with a fasciculoventricular pathway: the role of PRKAG2 mutation. Heart Rhythm 2011;8:58-64. doi:10.1016/j.hrthm.2010.09.081.
Heart Rhythm 2011;8:58-64. doi:10.1016/j.hrthm.2010.09.081.
10. Fabris E, Brun F, Porto AG, et al. Cardiac hypertrophy, accessory pathway, and conduction system disease in an adolescent: the PRKAG2 cardiac syndrome. J Am Coll Cardiol 2013;62:e17. doi:10.1016/j.jacc.2013.02.099.
11. Murphy RT, Mogensen J, McGarry K, et al. Adenosine monophosphate-activated protein kinase disease mimicks hypertrophic cardiomyopathy and Wolff- Parkinson-White syndrome: Natural history. J Am Coll Cardiol. 2005;45:922-30. doi: 10.1016/j.jacc.2004.11.053.
12. Arad M, Maron BJ, Gorham JM, et al. Glycogen storage diseases presenting as hypertrophic cardiomyopathy. N Engl J Med. 2005;352:362-72. doi:10.1056/NEJMoa033349.
13. Porto AG, Brun F, Severini GM, et al. Clinical Spectrum of PRKAG2 Syndrome. Circ Arrhythm Electrophysiol. 2016;9:e003121. doi:10.1161/CIRCEP.115.003121e003121.
14. Zhang LP, Hui B, Gao BR. High risk of sudden death associated with a PRKAG2-related familial Wolff-Parkinson-White syndrome. J Electrocardiol 2011;44:483-6. doi:10.1016/j.jelectrocard.2010.02.009.
J Electrocardiol 2011;44:483-6. doi:10.1016/j.jelectrocard.2010.02.009.
15. Bayrak F, Komurcu-Bayrak E, Mutlu B, et al. Ventricular pre-excitation and cardiac hypertrophy mimicking hypertrophic cardiomyopathy in a Turkish family with a novel PRKAG2 mutation. Eur J Heart Fail 2006;8:712-5. doi:10.1016/j.ejheart.2006.03.006.
16. Liu Y, Bai R, Wang L, et al. Identification of a novel de novo mutation associated with PRKAG2 cardiac syndrome and early onset of heart failure. PLoS One 2013;8:e64603. doi:10.1371/journal.pone.0064603.
17. Burwinkel B, Scott JW, Buhrer C, et al. Fatal congenital heart glycogenosis caused by a recurrent activating R531Q mutation in the gamma 2-subunit of AMP-activated protein kinase (PRKAG2), not by phosphorylase kinase deficiency. Am J Hum Genet. 2005;76:1034-49. doi:10.1086/430840.
18. Sri A, Daubeney P, Prasad S, et al. A Case Series on Cardiac and Skeletal Involvement in Two Families with PRKAG2 Mutations. Case Reports in Pediatrics. 2019. Article ID 7640140, 7 pages. doi:10.1155/2019/7640140.
Article ID 7640140, 7 pages. doi:10.1155/2019/7640140.
19. Zhang BL, Xu RL, Zhang J, et al. Identification and functional analysis of a novel PRKAG2 mutation responsible for chinese PRKAG2 cardiac syndrome reveal an important role of non-cbs domains in regulating the AMPK pathway. J Cardiol. 2013;62:241-8. doi:10.1016/j.jjcc.2013.04.010.
20. Sternick EB, Oliva A, Magalhaes LP, et al. Familial pseudo-Wolff-Parkinson-White syndrome. J Cardiovasc Electrophysiol. 2006;17:724-32. doi:10.1111/j.1540-8167.2006.00485.x.
21. Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35:2733-79. doi:10.1093/eurheartj/ehu284.
22. Folmes KD, Chan AY, Koonen DP, et al. Distinct early signaling events resulting from the expression of the PRKAG2 R302Q mutant of AMPK contribute to increased myocardial glycogen. Circ Cardiovasc Genet. 2009:457-66. doi:10.1161/CIRCGENETICS.108.834564.
Circ Cardiovasc Genet. 2009:457-66. doi:10.1161/CIRCGENETICS.108.834564.
23. Sidhu JS, Rajawat YS, Rami TG, et al. Transgenic mouse model of ventricular preexcitation and atrioventricular reentrant tachycardia induced by an AMP- activated protein kinase loss-of-function mutation responsible for Wolff-Parkinson-White syndrome. Circulation. 2005;111:21-9. doi:10.1161/01.CIR.0000151291.32974.D5.
24. Boucek D, Jirikowic J, Taylor M. Natural history of Danon disease. Genet Med. 2011;13:563-8. doi:10.1097/GIM.0b013e31820ad795.
25. Weidemann F, Niemann M, Warnock DG, et al. The Fabry cardiomyopathy: Models for the cardiologist. Annu Rev Med. 2011;62:59-67. doi:10.1146/annurev-med-090910-085119.
Теория критического перехода показывает мерцание в сердце перед мерцательной аритмией — Мерцательная аритмия, поражающая до 4% пациентов старше 65 лет, относится к наиболее распространенным сердечным заболеваниям. Эпизоды мерцательной аритмии, которые медицинские работники описывают как «нерегулярно нерегулярный» сердечный ритм, по-прежнему трудно предсказать.
 Бимодальное распределение сердечных состояний и мерцание сердечных состояний перед началом мерцательной аритмии. ПРЕДОСТАВЛЕНИЕ: Ю Вай Лью
Бимодальное распределение сердечных состояний и мерцание сердечных состояний перед началом мерцательной аритмии. ПРЕДОСТАВЛЕНИЕ: Ю Вай ЛьюМеждународная группа исследователей под руководством Буна Леонга Лана из Университета Монаш в Малайзии предложила способ определения состояния сердца и изучила динамику состояния перед изменением сердечного ритма с нормального синусового на ритм ФП. наоборот. Работа, опубликованная в Chaos издательством AIP Publishing и основанная на теории критического перехода, направлена на раннее предупреждение для людей с пароксизмальной фибрилляцией предсердий с потенциальными последствиями для будущих носимых устройств.
Документ указывает путь к лучшему скринингу пароксизмальной фибрилляции предсердий и может привести к более успешным вмешательствам, когда эпизод фибрилляции предсердий начался.
«Мерцание состояния сердца может служить ранним предупреждением о начале пароксизмальной фибрилляции предсердий для пациентов, которые носят устройство, которое может точно измерять сердечные сокращения для контроля состояния их сердца», — сказал Лан. «Это раннее предупреждение было бы полезно, если бы было лекарство, которое пациент мог бы принять, чтобы предотвратить начало заболевания».
«Это раннее предупреждение было бы полезно, если бы было лекарство, которое пациент мог бы принять, чтобы предотвратить начало заболевания».
Неясно, как следует определять состояние сердца, используя только данные временного ряда электрокардиограммы. Лан сказал, что их определение состояния сердца, основанное на изменениях между последовательными интервалами между ударами, было вдохновлено его предыдущей работой. Он и его коллега ранее обнаружили, что распределение изменений интервала ударов может очень хорошо отличить людей с устойчивой мерцательной аритмией от здоровых.
Их новый подход показывает, что состояние сердца колеблется между почти нормальным состоянием и состоянием, близким к мерцательной аритмии, что приводит к бимодальному распределению состояний перед началом или прекращением мерцательной аритмии.
Другие предположили, что динамическим переходам во множестве различных областей от климата до фондовых рынков и медицины предшествует критическое замедление по мере достижения критической точки. При критическом замедлении скорость восстановления даже от небольшого возмущения приближается к нулю.
При критическом замедлении скорость восстановления даже от небольшого возмущения приближается к нулю.
Лан и его коллеги обнаружили, что критическое замедление не предшествовало возникновению мерцательной аритмии.
Лан оптимистично настроен, их метод определения состояния сложной системы может быть адаптирован для изучения критического перехода при других хронических эпизодических заболеваниях, таких как эпилептический припадок, астма и язва, а также других сложных систем, таких как система электроснабжения или климатическая система.
В настоящее время он и его группа изучают изменения в состоянии мозга перед эпилептическими припадками, используя свой подход.
###
Для получения дополнительной информации:
Ларри Фрум
[email protected]
301-209-3090
Название статьи
Мерцание сердечного ритма перед началом и прекращением мерцательной аритмии Автор
s
3 90 Автор Леонг Лан, Ю Вай Лью, Микито Тода, Сурая Хани Камсани
Принадлежность автора
Университет Монаша, Малайзия, Женский университет Нара, Национальный институт сердца Малайзии
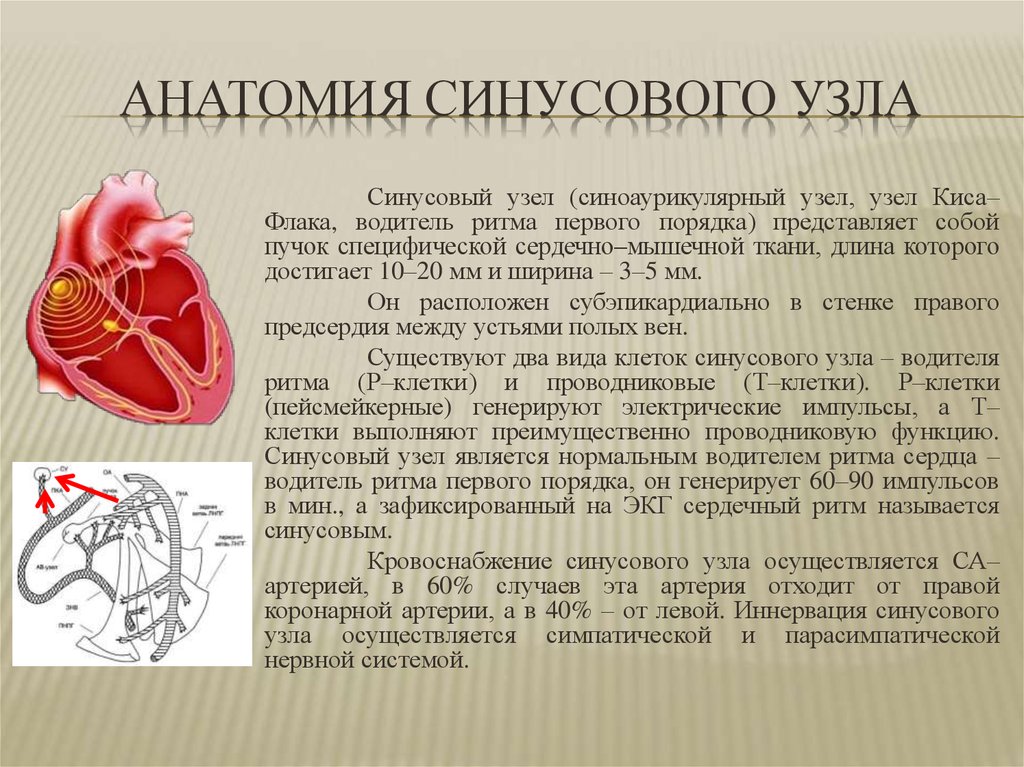
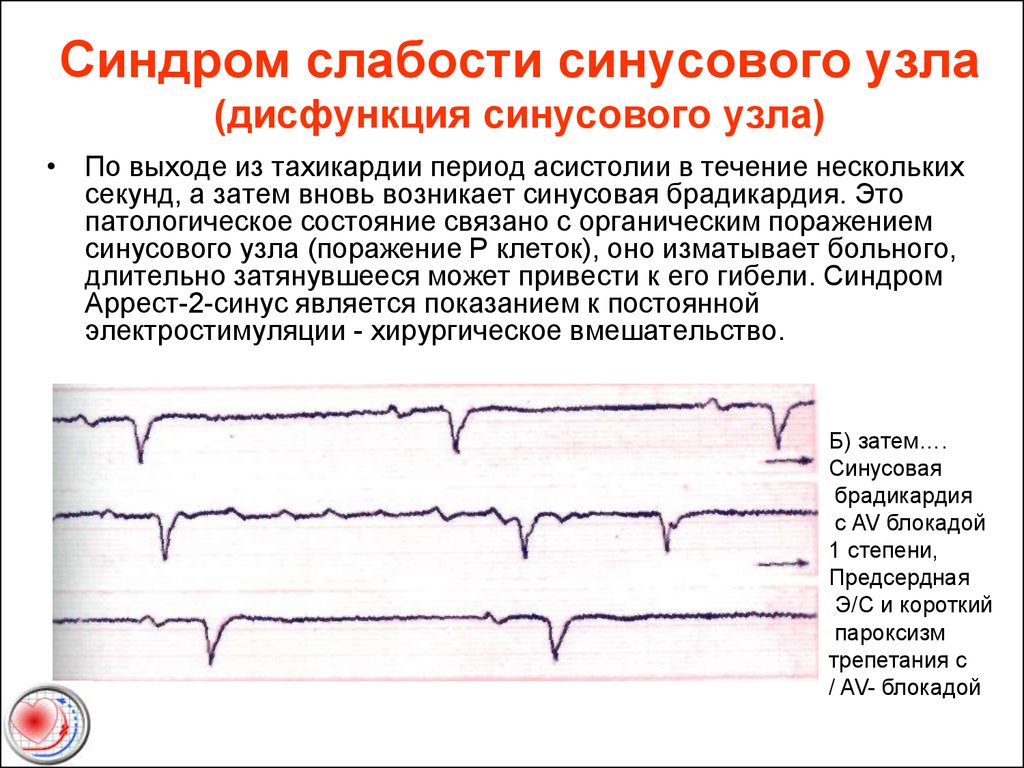
Синдром слабости синусового узла: MedlinePlus Genetics
Описание
Синдром слабости синусового узла (также известный как дисфункция синусового узла) представляет собой группу связанных заболеваний сердца, которые могут влиять на то, как сердце бьется. «Больной синус» относится к синоатриальному (СА) узлу, который представляет собой область специализированных клеток в сердце, функционирующую как естественный водитель ритма. Узел SA генерирует электрические импульсы, которые запускают каждое сердцебиение. Эти сигналы проходят от узла SA к остальной части сердца, сигнализируя сердечной (сердечной) мышце сокращаться и перекачивать кровь. У людей с синдромом слабости синусового узла СА-узел не функционирует нормально. В некоторых случаях он не дает правильных сигналов для запуска регулярного сердцебиения. В других аномалии нарушают электрические импульсы и не позволяют им достичь остальной части сердца.
«Больной синус» относится к синоатриальному (СА) узлу, который представляет собой область специализированных клеток в сердце, функционирующую как естественный водитель ритма. Узел SA генерирует электрические импульсы, которые запускают каждое сердцебиение. Эти сигналы проходят от узла SA к остальной части сердца, сигнализируя сердечной (сердечной) мышце сокращаться и перекачивать кровь. У людей с синдромом слабости синусового узла СА-узел не функционирует нормально. В некоторых случаях он не дает правильных сигналов для запуска регулярного сердцебиения. В других аномалии нарушают электрические импульсы и не позволяют им достичь остальной части сердца.
Синдром слабости синусового узла имеет тенденцию вызывать слишком медленное сердцебиение (брадикардия), хотя иногда оно бывает слишком быстрым (тахикардия). В некоторых случаях сердцебиение быстро переключается со слишком быстрого на слишком медленное, состояние, известное как синдром тахикардии-брадикардии. Симптомы, связанные с ненормальным сердцебиением, могут включать головокружение, предобморочное состояние, обмороки (синкопе), ощущение трепетания или сердцебиения в груди (сердцебиение), спутанность сознания или проблемы с памятью. Во время физических упражнений многие пострадавшие испытывают боль в груди, затрудненное дыхание или чрезмерную усталость (усталость). После появления симптомов синдрома слабости синусового узла они обычно со временем ухудшаются. Однако некоторые люди с этим заболеванием никогда не испытывают связанных с этим проблем со здоровьем.
Во время физических упражнений многие пострадавшие испытывают боль в груди, затрудненное дыхание или чрезмерную усталость (усталость). После появления симптомов синдрома слабости синусового узла они обычно со временем ухудшаются. Однако некоторые люди с этим заболеванием никогда не испытывают связанных с этим проблем со здоровьем.
Синдром слабости синусового узла чаще всего возникает у пожилых людей, хотя его можно диагностировать у людей любого возраста. Это состояние увеличивает риск возникновения нескольких опасных для жизни проблем с сердцем и кровеносными сосудами. К ним относятся нарушения сердечного ритма, называемые мерцательной аритмией, сердечная недостаточность, остановка сердца и инсульт.
Частота
Синдром слабости синусового узла встречается у 1 из 600 пациентов с сердечными заболеваниями старше 65 лет. Частота этого состояния увеличивается с возрастом.
Причины
Синдром слабости синусового узла может быть результатом генетических факторов или факторов окружающей среды.
Генетические изменения являются редкой причиной синдрома слабости синусового узла. Было обнаружено, что мутации в двух генах, SCN5A и HCN4 , вызывают заболевание в небольшом числе семей. Эти гены предоставляют инструкции для создания белков, называемых ионными каналами, которые транспортируют положительно заряженные атомы (ионы) в клетки сердца, включая клетки, составляющие узел SA. Поток этих ионов необходим для создания электрических импульсов, которые запускают каждое сердцебиение и координируют сокращение сердечной мышцы. Мутации в этих генах уменьшают поток ионов, что изменяет способность узла SA создавать и распространять электрические сигналы. Эти изменения приводят к аномальному сердцебиению и другим симптомам синдрома слабости синусового узла.
Конкретная вариация в другом гене, MYH6 , по-видимому, увеличивает риск развития синдрома слабости синусового узла. Белок, полученный из гена MYH6 , является частью более крупного белка, называемого миозином, который генерирует механическую силу, необходимую для сокращения сердечной мышцы. Исследователи полагают, что вариация гена MYH6 изменяет структуру миозина, что может влиять на сокращение сердечной мышцы и повышать вероятность развития аномального сердцебиения.
Исследователи полагают, что вариация гена MYH6 изменяет структуру миозина, что может влиять на сокращение сердечной мышцы и повышать вероятность развития аномального сердцебиения.
Чаще синдром слабости синусового узла вызывается другими факторами, которые изменяют структуру или функцию СА-узла. К ним относятся различные сердечные заболевания, другие расстройства, такие как мышечная дистрофия, аномальное воспаление или нехватка кислорода (гипоксия). Некоторые лекарства, такие как препараты для лечения аномального сердечного ритма или высокого кровяного давления, также могут нарушать функцию узла SA. Одной из наиболее частых причин синдрома слабости синусового узла у детей является травма СА-узла, например повреждение, возникающее во время операции на сердце.
У пожилых людей синдром слабости синусового узла часто связан с возрастными изменениями в сердце. Со временем СА-узел может затвердеть и развиться рубцовое повреждение (фиброз), что препятствует его нормальной работе.
Наследование
В большинстве случаев синдром слабости синусового узла не передается по наследству. Они описываются как спорадические, что означает, что они возникают у людей, у которых в семье не было этого расстройства.
Когда синдром слабости синусового узла возникает в результате мутаций в гене HCN4 , имеет аутосомно-доминантный тип наследования. Аутосомно-доминантное наследование означает, что одной копии измененного гена в каждой клетке достаточно, чтобы вызвать заболевание. В большинстве случаев у пострадавшего есть один из родителей с этим заболеванием.
Когда синдром слабости синусового узла вызывается мутациями в гене SCN5A , он наследуется по аутосомно-рецессивному типу. Аутосомно-рецессивное наследование означает, что обе копии гена в каждой клетке имеют мутации. Каждый из родителей человека с аутосомно-рецессивным заболеванием несет по одной копии мутировавшего гена, но обычно у них нет признаков и симптомов заболевания.
Другие названия этого состояния
- Болезнь синусового узла
- Дисфункция синусового узла
- SND
- SSS
Дополнительная информация и ресурсы
Информация о генетическом тестировании
- Реестр генетического тестирования: синдром слабости синусового узла 1, аутосомно-рецессивный
- Реестр генетического тестирования: синдром слабости синусового узла 2, аутосомно-доминантный
- Реестр генетического тестирования: синдром слабости синусового узла 3, предрасположенность к
Информационный центр генетических и редких заболеваний
- Болезнь синусового узла и близорукость
Ресурсы поддержки пациентов и защиты интересов
- Информационный поиск по болезни
- Национальная организация редких заболеваний (NORD)
Научные исследования от ClinicalTrials.
 gov
gov- ClinicalTrials.gov
Каталог генов и болезней от OMIM
- СИНДРОМ СЛАБОГО СИНУСОВОГО СИНУСА 1
- СИНДРОМ СЛАБОГО СИНУСОВОГО СИНУСА 2
- СИНДРОМ СЛАБОГО СИНУСОВОГО СИНУСА 3, ЧУВСТВИТЕЛЬНОСТЬ К
Научные статьи в PubMed
- PubMed
Ссылки
- Адан В., Краун Л.А. Диагностика и лечение синдрома слабости синусового узла. Ам Фам Врач. 2003 г., 15 апреля; 67(8):1725-32. Цитата в PubMed
- Бенсон Д.В., Ван Д.В., Даймент М., Книланс Т.К., Фиш Ф.А., Стрипер М.Дж., Родс Т.Х., Джордж А.Л. младший. Врожденный синдром слабости синусового узла, вызванный рецессивными мутациями в ген сердечного натриевого канала (SCN5A). Джей Клин Инвест. 2003 Октябрь; 112 (7): 1019-28. дои: 10.1172/JCI18062. Цитирование в PubMed или бесплатная статья в PubMed Central
- Ден Хоэд М., Эйгельсхайм М., Эско Т.
 , Брундель Б.Дж., Пил Д.С., Эванс Д.М., Нолте И.М.,
Сегре А.В., Холм Х., Хэндсакер Р.Е., Вестра Х.Дж., Джонсон Т., Исаакс А., Ян Дж., Лундби А.,
Чжао Дж. Х., Ким Й. Дж., Го М. Дж., Альмгрен П., Бочуд М., Буше Г., Корнелис М. С., Гудбьяртссон
Д., Хэдли Д., Ван дер Харст П., Хейворд К., Ден Хейер М., Игл В., Джексон А.У., Куталик
З., Луан Дж., Кемп Дж. П., Кристианссон К., Ладенвалл С., Лоренцон М., Монтассер М. Э.,
Нджажу О.Т., О’Рейли П.Ф., Падманабхан С., Сент-Пуркейн Б., Ранкинен Т., Сало П., Танака
Т., Тимпсон Н.Дж., Витарт В., Уэйт Л., Уилер В., Чжан В., Дрейсма Х.Х., Фейтоса М.Ф.,
Керр К.Ф., Линд П.А., Михайлов Э., Онланд-Морет Н.К., Сонг С., Уидон М.Н., Се В., Йенго Л.,
Абшер Д., Альберт С.М., Алонсо А., Аркинг Д.Е., де Баккер П.И., Балкау Б., Барлассина С.,
Бенальо П., Бис Д.К., Буатиа-Наджи Н., Браге С., Чанок С.Дж., Чайнс П.С., Чанг М.,
Дарбар Д., Дина С., Дорр М., Эллиотт П., Феликс С.Б., Фишер К., Фуксбергер С., де Геус
Э.Дж., Гойетт П., Гуднасон В., Харрис Т.Б., Хартикайнен А.
, Брундель Б.Дж., Пил Д.С., Эванс Д.М., Нолте И.М.,
Сегре А.В., Холм Х., Хэндсакер Р.Е., Вестра Х.Дж., Джонсон Т., Исаакс А., Ян Дж., Лундби А.,
Чжао Дж. Х., Ким Й. Дж., Го М. Дж., Альмгрен П., Бочуд М., Буше Г., Корнелис М. С., Гудбьяртссон
Д., Хэдли Д., Ван дер Харст П., Хейворд К., Ден Хейер М., Игл В., Джексон А.У., Куталик
З., Луан Дж., Кемп Дж. П., Кристианссон К., Ладенвалл С., Лоренцон М., Монтассер М. Э.,
Нджажу О.Т., О’Рейли П.Ф., Падманабхан С., Сент-Пуркейн Б., Ранкинен Т., Сало П., Танака
Т., Тимпсон Н.Дж., Витарт В., Уэйт Л., Уилер В., Чжан В., Дрейсма Х.Х., Фейтоса М.Ф.,
Керр К.Ф., Линд П.А., Михайлов Э., Онланд-Морет Н.К., Сонг С., Уидон М.Н., Се В., Йенго Л.,
Абшер Д., Альберт С.М., Алонсо А., Аркинг Д.Е., де Баккер П.И., Балкау Б., Барлассина С.,
Бенальо П., Бис Д.К., Буатиа-Наджи Н., Браге С., Чанок С.Дж., Чайнс П.С., Чанг М.,
Дарбар Д., Дина С., Дорр М., Эллиотт П., Феликс С.Б., Фишер К., Фуксбергер С., де Геус
Э.Дж., Гойетт П., Гуднасон В., Харрис Т.Б., Хартикайнен А. Л., Хавулинна А.С., Хекберт С.Р.,
Хикс А.А., Хофман А., Холевейн С., Хугстра-Берендс Ф., Хоттенга Дж.Дж., Дженсен М.К.,
Йоханссон А., Юнттила Дж., Кааб С., Канон Б., Кеткар С., Хоу К.Т., Ноулз Дж.В., Кунер
А.С., Корс Дж.А., Кумари М., Милани Л., Лайхо П., Лакатта Э.Г., Лангенберг С., Леусинк М.,
Лю Ю., Лубен Р.Н., Лунетта К.Л., Линч С.Н., Маркус М.Р., Маркес-Видаль П., Матео Лич И.,
McArdle WL, McCarroll SA, Medland SE, Miller KA, Montgomery GW, Morrison AC,
Мюллер-Нурасид М., Наварро П., Нелис М., О’Коннелл Дж. Р., О’Доннелл С. Дж., Онг К. К., Ньюман
AB, Peters A, Polasek O, Pouta A, Pramstaller PP, Psaty BM, Rao DC, Ring SM,
Россин Э.Дж., Рудан Д., Санна С., Скотт Р.А., Сехми Дж.С., Шарп С., Шин Дж.Т., Синглтон А.Б.,
Смит А.В., Соранзо Н., Спектор Т.Д., Стюарт С., Стрингхэм Х.М., Тарасов К.В.,
Uitterlinden AG, Vandenput L, Hwang SJ, Whitfield JB, Wijmenga C, Wild SH,
Виллемсен Г., Уилсон Дж. Ф., Виттеман Дж. К., Вонг А., Вонг К., Джамшиди Ю., Зиттинг П., Бур
JM, Boomsma DI, Borecki IB, van Duijn CM, Ekelund U, Forouhi NG, Froguel P,
Хингорани А.
Л., Хавулинна А.С., Хекберт С.Р.,
Хикс А.А., Хофман А., Холевейн С., Хугстра-Берендс Ф., Хоттенга Дж.Дж., Дженсен М.К.,
Йоханссон А., Юнттила Дж., Кааб С., Канон Б., Кеткар С., Хоу К.Т., Ноулз Дж.В., Кунер
А.С., Корс Дж.А., Кумари М., Милани Л., Лайхо П., Лакатта Э.Г., Лангенберг С., Леусинк М.,
Лю Ю., Лубен Р.Н., Лунетта К.Л., Линч С.Н., Маркус М.Р., Маркес-Видаль П., Матео Лич И.,
McArdle WL, McCarroll SA, Medland SE, Miller KA, Montgomery GW, Morrison AC,
Мюллер-Нурасид М., Наварро П., Нелис М., О’Коннелл Дж. Р., О’Доннелл С. Дж., Онг К. К., Ньюман
AB, Peters A, Polasek O, Pouta A, Pramstaller PP, Psaty BM, Rao DC, Ring SM,
Россин Э.Дж., Рудан Д., Санна С., Скотт Р.А., Сехми Дж.С., Шарп С., Шин Дж.Т., Синглтон А.Б.,
Смит А.В., Соранзо Н., Спектор Т.Д., Стюарт С., Стрингхэм Х.М., Тарасов К.В.,
Uitterlinden AG, Vandenput L, Hwang SJ, Whitfield JB, Wijmenga C, Wild SH,
Виллемсен Г., Уилсон Дж. Ф., Виттеман Дж. К., Вонг А., Вонг К., Джамшиди Ю., Зиттинг П., Бур
JM, Boomsma DI, Borecki IB, van Duijn CM, Ekelund U, Forouhi NG, Froguel P,
Хингорани А. , Ингельссон Э., Кивимаки М., Кронмал Р.А., Кух Д., Линд Л., Мартин Н.Г.,
Оостра Б.А., Педерсен Н.Л., Квертермус Т., Роттер Дж.И., ван дер Шоу Ю.Т., Вершурен
ВМ, Уокер М., Альбанес Д., Арнар Д.О., Ассимс Т.Л., Бандинелли С., Бёнке М., де Бур
Р.А., Бушар С., Колфилд В.Л., Чемберс Дж.К., Курхан Г., Кузи Д., Эрикссон Дж., Ферруччи
Л., ван Гилст В.Х., Глориозо Н., де Грааф Дж., Груп Л., Гилленстен Ю., Сюэ В.К., Ху Ф.Б.,
Huikuri HV, Hunter DJ, Iribarren C, Isomaa B, Jarvelin MR, Jula A, Kahonen M,
Кименей Л.А., ван дер Клау М.М., Кунер Дж.С., Крафт П., Яковьелло Л., Лехтимаки Т.,
Локки М.Л., Митчелл Б.Д., Навис Г., Ниеминен М.С., Олссон С., Поултер Н.Р., Ци Л.,
Райтакари ОТ, Римм ЭБ, Риу ДД, Рицци Ф, Рудан И, Саломаа В, Север ПС, Шилдс
Д.С., Шульдинер А.Р., Синисало Дж., Стэнтон А.В., Столк Р.П., Страчан Д.П., Тардиф Дж.К.,
Thorsteinsdottir U, Tuomilehto J, van Veldhuisen DJ, Virtamo J, Viikari J,
Vollenweider P, Waeber G, Widen E, Cho YS, Olsen JV, Visscher PM, Willer C,
Франке Л; Глобальный консорциум BPgen; Консорциум CARDIOGRAM, Erdmann J, Thompson JR;
Консорциум PR GWAS, Pfeufer A; Консорциум QRS GWAS, Sotoodehnia N; QT-IGC
Консорциум, Ньютон-Че С; Консорциум CHARGE-AF, Ellinor PT, Stricker BH,
Метспалу А.
, Ингельссон Э., Кивимаки М., Кронмал Р.А., Кух Д., Линд Л., Мартин Н.Г.,
Оостра Б.А., Педерсен Н.Л., Квертермус Т., Роттер Дж.И., ван дер Шоу Ю.Т., Вершурен
ВМ, Уокер М., Альбанес Д., Арнар Д.О., Ассимс Т.Л., Бандинелли С., Бёнке М., де Бур
Р.А., Бушар С., Колфилд В.Л., Чемберс Дж.К., Курхан Г., Кузи Д., Эрикссон Дж., Ферруччи
Л., ван Гилст В.Х., Глориозо Н., де Грааф Дж., Груп Л., Гилленстен Ю., Сюэ В.К., Ху Ф.Б.,
Huikuri HV, Hunter DJ, Iribarren C, Isomaa B, Jarvelin MR, Jula A, Kahonen M,
Кименей Л.А., ван дер Клау М.М., Кунер Дж.С., Крафт П., Яковьелло Л., Лехтимаки Т.,
Локки М.Л., Митчелл Б.Д., Навис Г., Ниеминен М.С., Олссон С., Поултер Н.Р., Ци Л.,
Райтакари ОТ, Римм ЭБ, Риу ДД, Рицци Ф, Рудан И, Саломаа В, Север ПС, Шилдс
Д.С., Шульдинер А.Р., Синисало Дж., Стэнтон А.В., Столк Р.П., Страчан Д.П., Тардиф Дж.К.,
Thorsteinsdottir U, Tuomilehto J, van Veldhuisen DJ, Virtamo J, Viikari J,
Vollenweider P, Waeber G, Widen E, Cho YS, Olsen JV, Visscher PM, Willer C,
Франке Л; Глобальный консорциум BPgen; Консорциум CARDIOGRAM, Erdmann J, Thompson JR;
Консорциум PR GWAS, Pfeufer A; Консорциум QRS GWAS, Sotoodehnia N; QT-IGC
Консорциум, Ньютон-Че С; Консорциум CHARGE-AF, Ellinor PT, Stricker BH,
Метспалу А. , Перола М., Бекманн Дж.С., Смит Г.Д., Стефанссон К., Уэрхэм Н.Дж., Манро П.Б.,
Sibon OC, Milan DJ, Snieder H, Samani NJ, Loos RJ. Идентификация сердца
частотно-ассоциированные локусы и их влияние на сердечную проводимость и ритм
расстройства. Нат Жене. 2013 июнь;45(6):621-31. doi: 10.1038/ng.2610. Epub, апрель 2013 г.
14. Цитирование в PubMed или бесплатная статья в PubMed Central
, Перола М., Бекманн Дж.С., Смит Г.Д., Стефанссон К., Уэрхэм Н.Дж., Манро П.Б.,
Sibon OC, Milan DJ, Snieder H, Samani NJ, Loos RJ. Идентификация сердца
частотно-ассоциированные локусы и их влияние на сердечную проводимость и ритм
расстройства. Нат Жене. 2013 июнь;45(6):621-31. doi: 10.1038/ng.2610. Epub, апрель 2013 г.
14. Цитирование в PubMed или бесплатная статья в PubMed Central - Добжински Х., Бойетт М.Р., Андерсон Р.Х. Новые сведения об активности кардиостимулятора: содействие пониманию синдрома слабости синусового узла. Тираж. 2007 апрель 10;115(14):1921-32. doi: 10.1161/РАСПИСАНИЕAHA.106.616011. Нет реферата доступный. Цитата в PubMed
- Холм Х., Гудбьяртссон Д.Ф., Сулем П., Массон Г., Хельгадоттир Х.Т., Занон К., Магнуссон
OT, Helgason A, Saemundsdottir J, Gylfason A, Stefansdottir H, Gretarsdottir S,
Матиассон С.Э., Торгейрссон Г.М., Йонасдоттир А., Сигурдссон А., Стефанссон Х., Верге
Т., Рафнар Т., Кимени Л.А., Парвез Б., Мухаммад Р.




 , Брундель Б.Дж., Пил Д.С., Эванс Д.М., Нолте И.М.,
Сегре А.В., Холм Х., Хэндсакер Р.Е., Вестра Х.Дж., Джонсон Т., Исаакс А., Ян Дж., Лундби А.,
Чжао Дж. Х., Ким Й. Дж., Го М. Дж., Альмгрен П., Бочуд М., Буше Г., Корнелис М. С., Гудбьяртссон
Д., Хэдли Д., Ван дер Харст П., Хейворд К., Ден Хейер М., Игл В., Джексон А.У., Куталик
З., Луан Дж., Кемп Дж. П., Кристианссон К., Ладенвалл С., Лоренцон М., Монтассер М. Э.,
Нджажу О.Т., О’Рейли П.Ф., Падманабхан С., Сент-Пуркейн Б., Ранкинен Т., Сало П., Танака
Т., Тимпсон Н.Дж., Витарт В., Уэйт Л., Уилер В., Чжан В., Дрейсма Х.Х., Фейтоса М.Ф.,
Керр К.Ф., Линд П.А., Михайлов Э., Онланд-Морет Н.К., Сонг С., Уидон М.Н., Се В., Йенго Л.,
Абшер Д., Альберт С.М., Алонсо А., Аркинг Д.Е., де Баккер П.И., Балкау Б., Барлассина С.,
Бенальо П., Бис Д.К., Буатиа-Наджи Н., Браге С., Чанок С.Дж., Чайнс П.С., Чанг М.,
Дарбар Д., Дина С., Дорр М., Эллиотт П., Феликс С.Б., Фишер К., Фуксбергер С., де Геус
Э.Дж., Гойетт П., Гуднасон В., Харрис Т.Б., Хартикайнен А.
, Брундель Б.Дж., Пил Д.С., Эванс Д.М., Нолте И.М.,
Сегре А.В., Холм Х., Хэндсакер Р.Е., Вестра Х.Дж., Джонсон Т., Исаакс А., Ян Дж., Лундби А.,
Чжао Дж. Х., Ким Й. Дж., Го М. Дж., Альмгрен П., Бочуд М., Буше Г., Корнелис М. С., Гудбьяртссон
Д., Хэдли Д., Ван дер Харст П., Хейворд К., Ден Хейер М., Игл В., Джексон А.У., Куталик
З., Луан Дж., Кемп Дж. П., Кристианссон К., Ладенвалл С., Лоренцон М., Монтассер М. Э.,
Нджажу О.Т., О’Рейли П.Ф., Падманабхан С., Сент-Пуркейн Б., Ранкинен Т., Сало П., Танака
Т., Тимпсон Н.Дж., Витарт В., Уэйт Л., Уилер В., Чжан В., Дрейсма Х.Х., Фейтоса М.Ф.,
Керр К.Ф., Линд П.А., Михайлов Э., Онланд-Морет Н.К., Сонг С., Уидон М.Н., Се В., Йенго Л.,
Абшер Д., Альберт С.М., Алонсо А., Аркинг Д.Е., де Баккер П.И., Балкау Б., Барлассина С.,
Бенальо П., Бис Д.К., Буатиа-Наджи Н., Браге С., Чанок С.Дж., Чайнс П.С., Чанг М.,
Дарбар Д., Дина С., Дорр М., Эллиотт П., Феликс С.Б., Фишер К., Фуксбергер С., де Геус
Э.Дж., Гойетт П., Гуднасон В., Харрис Т.Б., Хартикайнен А. Л., Хавулинна А.С., Хекберт С.Р.,
Хикс А.А., Хофман А., Холевейн С., Хугстра-Берендс Ф., Хоттенга Дж.Дж., Дженсен М.К.,
Йоханссон А., Юнттила Дж., Кааб С., Канон Б., Кеткар С., Хоу К.Т., Ноулз Дж.В., Кунер
А.С., Корс Дж.А., Кумари М., Милани Л., Лайхо П., Лакатта Э.Г., Лангенберг С., Леусинк М.,
Лю Ю., Лубен Р.Н., Лунетта К.Л., Линч С.Н., Маркус М.Р., Маркес-Видаль П., Матео Лич И.,
McArdle WL, McCarroll SA, Medland SE, Miller KA, Montgomery GW, Morrison AC,
Мюллер-Нурасид М., Наварро П., Нелис М., О’Коннелл Дж. Р., О’Доннелл С. Дж., Онг К. К., Ньюман
AB, Peters A, Polasek O, Pouta A, Pramstaller PP, Psaty BM, Rao DC, Ring SM,
Россин Э.Дж., Рудан Д., Санна С., Скотт Р.А., Сехми Дж.С., Шарп С., Шин Дж.Т., Синглтон А.Б.,
Смит А.В., Соранзо Н., Спектор Т.Д., Стюарт С., Стрингхэм Х.М., Тарасов К.В.,
Uitterlinden AG, Vandenput L, Hwang SJ, Whitfield JB, Wijmenga C, Wild SH,
Виллемсен Г., Уилсон Дж. Ф., Виттеман Дж. К., Вонг А., Вонг К., Джамшиди Ю., Зиттинг П., Бур
JM, Boomsma DI, Borecki IB, van Duijn CM, Ekelund U, Forouhi NG, Froguel P,
Хингорани А.
Л., Хавулинна А.С., Хекберт С.Р.,
Хикс А.А., Хофман А., Холевейн С., Хугстра-Берендс Ф., Хоттенга Дж.Дж., Дженсен М.К.,
Йоханссон А., Юнттила Дж., Кааб С., Канон Б., Кеткар С., Хоу К.Т., Ноулз Дж.В., Кунер
А.С., Корс Дж.А., Кумари М., Милани Л., Лайхо П., Лакатта Э.Г., Лангенберг С., Леусинк М.,
Лю Ю., Лубен Р.Н., Лунетта К.Л., Линч С.Н., Маркус М.Р., Маркес-Видаль П., Матео Лич И.,
McArdle WL, McCarroll SA, Medland SE, Miller KA, Montgomery GW, Morrison AC,
Мюллер-Нурасид М., Наварро П., Нелис М., О’Коннелл Дж. Р., О’Доннелл С. Дж., Онг К. К., Ньюман
AB, Peters A, Polasek O, Pouta A, Pramstaller PP, Psaty BM, Rao DC, Ring SM,
Россин Э.Дж., Рудан Д., Санна С., Скотт Р.А., Сехми Дж.С., Шарп С., Шин Дж.Т., Синглтон А.Б.,
Смит А.В., Соранзо Н., Спектор Т.Д., Стюарт С., Стрингхэм Х.М., Тарасов К.В.,
Uitterlinden AG, Vandenput L, Hwang SJ, Whitfield JB, Wijmenga C, Wild SH,
Виллемсен Г., Уилсон Дж. Ф., Виттеман Дж. К., Вонг А., Вонг К., Джамшиди Ю., Зиттинг П., Бур
JM, Boomsma DI, Borecki IB, van Duijn CM, Ekelund U, Forouhi NG, Froguel P,
Хингорани А. , Ингельссон Э., Кивимаки М., Кронмал Р.А., Кух Д., Линд Л., Мартин Н.Г.,
Оостра Б.А., Педерсен Н.Л., Квертермус Т., Роттер Дж.И., ван дер Шоу Ю.Т., Вершурен
ВМ, Уокер М., Альбанес Д., Арнар Д.О., Ассимс Т.Л., Бандинелли С., Бёнке М., де Бур
Р.А., Бушар С., Колфилд В.Л., Чемберс Дж.К., Курхан Г., Кузи Д., Эрикссон Дж., Ферруччи
Л., ван Гилст В.Х., Глориозо Н., де Грааф Дж., Груп Л., Гилленстен Ю., Сюэ В.К., Ху Ф.Б.,
Huikuri HV, Hunter DJ, Iribarren C, Isomaa B, Jarvelin MR, Jula A, Kahonen M,
Кименей Л.А., ван дер Клау М.М., Кунер Дж.С., Крафт П., Яковьелло Л., Лехтимаки Т.,
Локки М.Л., Митчелл Б.Д., Навис Г., Ниеминен М.С., Олссон С., Поултер Н.Р., Ци Л.,
Райтакари ОТ, Римм ЭБ, Риу ДД, Рицци Ф, Рудан И, Саломаа В, Север ПС, Шилдс
Д.С., Шульдинер А.Р., Синисало Дж., Стэнтон А.В., Столк Р.П., Страчан Д.П., Тардиф Дж.К.,
Thorsteinsdottir U, Tuomilehto J, van Veldhuisen DJ, Virtamo J, Viikari J,
Vollenweider P, Waeber G, Widen E, Cho YS, Olsen JV, Visscher PM, Willer C,
Франке Л; Глобальный консорциум BPgen; Консорциум CARDIOGRAM, Erdmann J, Thompson JR;
Консорциум PR GWAS, Pfeufer A; Консорциум QRS GWAS, Sotoodehnia N; QT-IGC
Консорциум, Ньютон-Че С; Консорциум CHARGE-AF, Ellinor PT, Stricker BH,
Метспалу А.
, Ингельссон Э., Кивимаки М., Кронмал Р.А., Кух Д., Линд Л., Мартин Н.Г.,
Оостра Б.А., Педерсен Н.Л., Квертермус Т., Роттер Дж.И., ван дер Шоу Ю.Т., Вершурен
ВМ, Уокер М., Альбанес Д., Арнар Д.О., Ассимс Т.Л., Бандинелли С., Бёнке М., де Бур
Р.А., Бушар С., Колфилд В.Л., Чемберс Дж.К., Курхан Г., Кузи Д., Эрикссон Дж., Ферруччи
Л., ван Гилст В.Х., Глориозо Н., де Грааф Дж., Груп Л., Гилленстен Ю., Сюэ В.К., Ху Ф.Б.,
Huikuri HV, Hunter DJ, Iribarren C, Isomaa B, Jarvelin MR, Jula A, Kahonen M,
Кименей Л.А., ван дер Клау М.М., Кунер Дж.С., Крафт П., Яковьелло Л., Лехтимаки Т.,
Локки М.Л., Митчелл Б.Д., Навис Г., Ниеминен М.С., Олссон С., Поултер Н.Р., Ци Л.,
Райтакари ОТ, Римм ЭБ, Риу ДД, Рицци Ф, Рудан И, Саломаа В, Север ПС, Шилдс
Д.С., Шульдинер А.Р., Синисало Дж., Стэнтон А.В., Столк Р.П., Страчан Д.П., Тардиф Дж.К.,
Thorsteinsdottir U, Tuomilehto J, van Veldhuisen DJ, Virtamo J, Viikari J,
Vollenweider P, Waeber G, Widen E, Cho YS, Olsen JV, Visscher PM, Willer C,
Франке Л; Глобальный консорциум BPgen; Консорциум CARDIOGRAM, Erdmann J, Thompson JR;
Консорциум PR GWAS, Pfeufer A; Консорциум QRS GWAS, Sotoodehnia N; QT-IGC
Консорциум, Ньютон-Че С; Консорциум CHARGE-AF, Ellinor PT, Stricker BH,
Метспалу А. , Перола М., Бекманн Дж.С., Смит Г.Д., Стефанссон К., Уэрхэм Н.Дж., Манро П.Б.,
Sibon OC, Milan DJ, Snieder H, Samani NJ, Loos RJ. Идентификация сердца
частотно-ассоциированные локусы и их влияние на сердечную проводимость и ритм
расстройства. Нат Жене. 2013 июнь;45(6):621-31. doi: 10.1038/ng.2610. Epub, апрель 2013 г.
14. Цитирование в PubMed или бесплатная статья в PubMed Central
, Перола М., Бекманн Дж.С., Смит Г.Д., Стефанссон К., Уэрхэм Н.Дж., Манро П.Б.,
Sibon OC, Milan DJ, Snieder H, Samani NJ, Loos RJ. Идентификация сердца
частотно-ассоциированные локусы и их влияние на сердечную проводимость и ритм
расстройства. Нат Жене. 2013 июнь;45(6):621-31. doi: 10.1038/ng.2610. Epub, апрель 2013 г.
14. Цитирование в PubMed или бесплатная статья в PubMed Central