Атрофирование мышц: Атрофия мышц — Калининская ЦРБ
Массаж при артрофии мышц в Иваново платный прием, цены на услуги в лечебно-диагностическом центре «Миленарис»
Атрофия мышц – это истончение их волокон с одновременным уменьшением объема самой мышечной ткани. Она может замещаться соединительной тканью – а она не имеет способности к сокращению.Заболевание чаще всего наблюдается у пожилых людей. Это связано с процессами старения и замедлением обменных процессов во всех тканях, отсутствием физической нагрузки. Кроме того, атрофию могут спровоцировать и такие факторы:
- нарушение баланса гормонов – например, при проблемах с щитовидной или поджелудочной железами, надпочечниками;
- болезни органов ЖКТ;
- патологии соединительной ткани;
- поражение периферических нервов.
Важным фактором является и наследственность. Атрофию могут спровоцировать заболевания, передающиеся от родителей детям. Также привести к атрофии мышц может и сам образ жизни человека – если он не получает достаточное количество витаминов и микроэлементов, злоупотребляет алкогольными напитками, гиподинамия.
Записаться на прием
Чтобы записаться на прием к массажисту ЛДЦ Миленарис в Иваново, позвоните нам по телефонам +7 (4932) 93 62 62, +7 (4932) 93 02 22 или заполните форму-заявку на сайте. Выберите наиболее подходящее время для визита и день, который вам подходит. Мы внесем ваши данные в график специалиста – и он будет вас ждать в указанное время. Никаких очередей или напрасного ожидания у кабинета.Симптомы
Болезнь важно распознать на раннем этапе, чтобы своевременно подтвердить ее при помощи диагностических методов. Поэтому, вас должны насторожить следующие признаки:- вы быстро устаете;
- после физический нагрузки наблюдается слабость в мышцах;
- мышцы уменьшаются в объеме;
- вам трудно выполнять физическую работу.
Симптоматика не появляется резко и сразу, она постепенно нарастает. Поэтому, патологию часто диагностируют спустя годы после того, как были замечены ее первые симптомы.
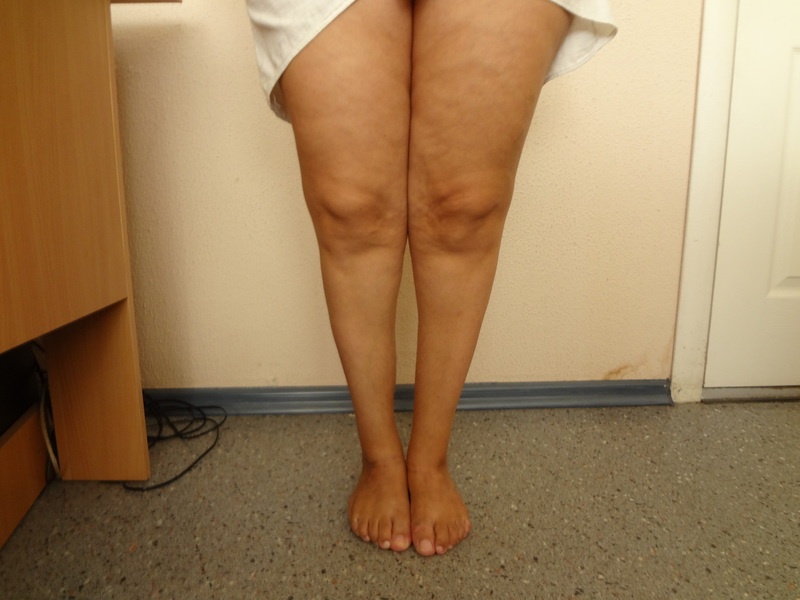 Однако, уже на ранней стадии мышечная ткань сокращается, мышцы уменьшаются в объеме – и это заметно.
Однако, уже на ранней стадии мышечная ткань сокращается, мышцы уменьшаются в объеме – и это заметно.Если болезнь вовремя не распознать, то это приводит к невозможности быстро передвигаться, делать какую-либо работу. Одной из наиболее опасных форм является атрофия сердечной мышцы. При ней жалуются на неконтролируемое учащение или замедление биения, приступы жара, онемение пальцев, одышку.
Методы диагностики
Методы диагностики данного заболевания заключаются в проведении генетических тестов, а также нейрофизиологических исследованиях. Комплексно обследование позволяет определить происхождение и характер заболевания.Один из методов диагностики – электромиография. Она позволяет определить скорость распространения импульса по нервам и мышцам. Если скорость проведения импульса в норме, но мышечная реакция слабая, можно заподозрить заболевание. Для постановки точного диагноза применяют генетическое тестирование. Оно позволяет выявить мутацию, из-за которой и появляется заболевание.
Еще одним методом является биопсия мышцы. В этом случае исследуют содержание некоторых ферментов – их может быть повышенное количество.
Методы лечения
Его назначают только после точной постановки диагноза. Если атрофия является сопровождающим признаком другого заболевания, то после его лечения атрофические изменения начнут исчезать сами по себе. Поэтому точная диагностика необходима, чтобы понять природу и причину болезни.Если же требуется лечение именно мышечной атрофии, то для этого используют ряд медикаментов, физиотерапевтические процедуры, лечебную физкультуру и массаж.
Массаж при лечении атрофии должен быть мягким. В тех местах, где чувствуется сопротивление, выполняют общий массаж, в который входит и простукивание. В местах, где иннервация сохраняется, потребуется глубокое поглаживание, поперечное и продольное, массажист разминает мышцы, стимулирует их. Также уделяют внимание и суставам – их поглаживают и растирают. Длительность массажа – примерно 10-15 минут.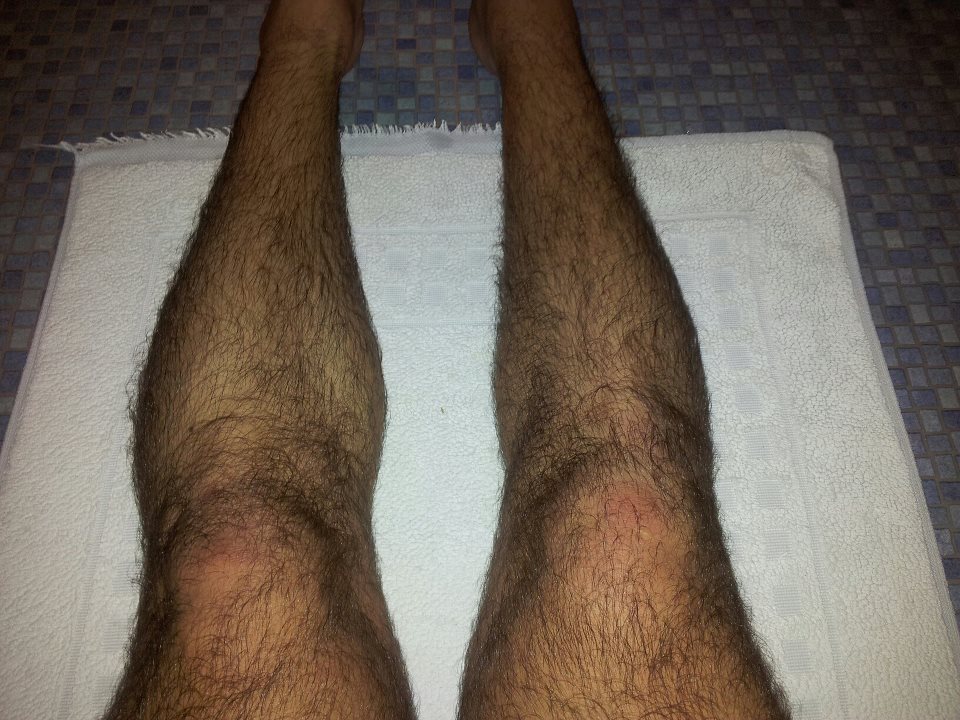
В качестве препаратов могут быть назначены противовоспалительные, обезболивающие. В индивидуальном порядке разрабатывается комплекс упражнений, назначается лечебные массаж. Все это поможет замедлить прогрессирование заболевания.
Запишитесь на примем ЛДЦ Миленарис в Иваново, чтобы вовремя диагностировать болезнь и получить схему эффективного лечения. Выберите подходящий вам день и время – позвоните нам для записи. Никаких очередей и длительного ожидания. Мы поможем вам вернуть здоровье и хорошее самочувствие.
Посмотреть еще: Массаж при радикулите Массаж при остеохондрозе
Лечебная физкультура как компонент физической абилитации при болезни Шарко–Мари–Тута | Шнайдер
1. Попелянский Я.Ю. Болезни периферической нервной системы. Руководство для врачей. М.: МЕДпресс-информ, 2009.
2. Вельтищев Ю.Е. Наследственные болезни нервной системы. М.: Медицина, 1998; с. 301–327.
3. Глущенко Е.В. Клинико-генетическая характеристика наследственной нейропатии Шарко–Мари–Тута (на примере Красноярского края): Автореф. дис. … канд. мед. наук. Красноярск, 2011.
4. Левин О.С. Полинейропатии. Клиническое руководство. М.: МИА, 2005; с. 358–383.
5. Гончарова С.И., Шнайдер Н.А. Наследственная невропатия Шарко–Мари–Тута: возможности нефармакологического лечения. Физиотерапия, бальнеология и реабилитация 2013;6:13–9.
6. Шнайдер Н. А. Абилитация людей, страдающих наследственной нейропатией Шарко–Мари–Тута. Avaible at: http://klinika.krasgmu.ru/main.php 12/10/2012.
А. Абилитация людей, страдающих наследственной нейропатией Шарко–Мари–Тута. Avaible at: http://klinika.krasgmu.ru/main.php 12/10/2012.7. Bier D. Habilitation therapy for Alzheimer`s and dementia care. Avaible at: http://psychcentral.com 29/09/2013.
8. Епифанов В. А. Медицинская реабилитация. Руководство для врачей. М.: МЕД-пресс-информ, 2005.
9. Шнайдер Н.А., Гончарова С.И. Физиотерапия болезни Шарко–Мари–Тута. Нервно-мышечные болезни 2013;4:18–23.
10. Van Der Dolder P. Physiotherapy and CMT. 2008; Vol. 6: 30–33. Avaible at: http:// www.cmtausa.org./journal/07/2011.
11. Oatis С. Physical therapy and rehabilitation of the CMT patient. Conservative management of the functional manifestations of Charcot–Marie–Tooth disease. CMT Facts I. Special report 1993;2/1:7–10. Avaible at: http://www.cmtausa.org./ journal /2011/07.
12. Grandis M., Shy M.E. Current Therapy for CMT. CMT Facts VI. Special Report. 2008;6:28–30. Avaible at: http://www.cmtausa.org./journal/2011/07.
13. Young Р., De Jonghe Р., Stögbauer F., Butterfass-Bahloul T. Treatment for Charcot– Marie–Tooth disease. Cochrane Database Syst Rev 2008 Jan 23;(1):CD006052.
14. Коган О.Г., Найдин В.Л. Медицинская реабилитация в неврологии и нейрохирургии. Руководство для врачей. М.: Медицина, 1998; с. 302.
15. Петров К. Б., Иванчин Д. М. Медицинская гимнастика при парезах стопы. Avaible at: www.medcentre.com.ua/2012.
Б., Иванчин Д. М. Медицинская гимнастика при парезах стопы. Avaible at: www.medcentre.com.ua/2012.
16. Шнайдер Н.А., Глущенко Е.В., Бахтина Е.А. Что такое болезнь Шарко-Мари–Тута? Методическое пособие для людей с болезнью Шарко–Мари– Тута. Красно ярск, 2009; с. 12.
17. Impairment & disability profiles of neuromuscular diseases: hereditary motor sensory neuropathy. The Department of Physical Medicine and Rehabilitation at the University of California, Davis. CMT Facts II. A CMTA Special Report 1995;2/1:22–3. Avaible at: http://www.cmtausa.org./ journal /2011/07.
18. Ямщикова Н.А. Лечебная физкультура при невральной амиотрофии. Avaible at: http://www.fizkultura-vsem.ru/2012.
19. Eagle М. Physiotherapy for neuromuscular disorders. Recent standards in diagnosis, Treatment and medical care for some rare neuromuscular diseases. Proceedings of the International scientific-practical conference. May 21–23, 2009. Kharkiv, Ukraine. С. 15–16.
20. Dufek J.S., Neumann E.S., Hawkins M.C., O`Toole В. Functional and dynamic response characteristics of a custom composite ankle foot orthoses for Charcot–Marie–Tooth patients. Avaible at: http://www.gaitposture.com 19/08/2013.
21. El Mhandi L., Pichot V., Calmels P. et al. Exercise training improves autonomic profiles in patients with Charcot–Marie–Tooth disease. Muscle Nerve 2011;44(5):732–6.
22. Chetlin R.D. Exercise and activity training for patients with CMT: Application of the exercise is medicine model. National CMT Resource Center. Avaible at: http://help4cmt.com 11/30/2011.
National CMT Resource Center. Avaible at: http://help4cmt.com 11/30/2011.
Лечение атрофия мышц в Москве. Клиника «Ист Клиник». Атрофия мышц конечностей
Как перестать ходить по врачам и аптекам и получить реальную помощь?
- Экспертный уровень специалистов — у нас консультируют врачи с опытом более 25 лет.
- Командное мнение — врачи нескольких специальностей сотрудничают между собой для достижения лучшего результата.
- Консультация длится столько, сколько надо — чтобы детально разобраться в ситуации.
Запишитесь на первичный приём и узнаете:
- Какова причина вашего заболевания, точный диагноз и стадия процесса.
- Что вам подходит для лечения, а какие процедуры противопоказаны.
- Что делать дома — упражнения, питание и многое другое.
- А также сразу пройдите первый лечебную процедуру.
В зависимости от стадии заболевания мы выбираем один или несколько методов лечения:
Остеопатия
Мягкая техника работы с позвоночником, суставами, мышцами, связками, внутренними органами. Устраняет болевой синдром, запускает процесс самовосстановления.
Лечебный массаж, остеопатия, мануальная терапия
Помогает костям и суставам занять правильное физиологичное положение, снимает боли и спазмы, расслабляет мышцы.
Иглоукалывание
Работа по биологически активным точкам. Действует на пораженную область и организм в целом. Устраняет причину болезни и убирает симптомы.
Кроме того по показаниям применяются: тейпирование, фармакопунктура, стельки ФормТотикс, ЛФК с инструктором и другие методы. Выбор процедур зависит от текущего состояния, в комплексе они действуют быстрее и дают более стойкий результат.
Выбор процедур зависит от текущего состояния, в комплексе они действуют быстрее и дают более стойкий результат.
прием остеопата
Атрофия мышц
С чем связана спинальная атрофия и мышц ног, лица, руки, спины, бедра, жевательной, ягодичной, сердечной мышцы причины симптомы. Лечение. Симптомы. Как восстановить. У ребенка и взрослого. Заболевание.
Для атрофии мышц характерно постепенное развитие. В начале уменьшается объем мышечной массы, далее идет процесс перерождения мышечных волокон: они становятся очень тонкими, а в некоторых ситуациях их количество начинает сокращаться до полного исчезновения. Различают первичную атрофию мышц, так называемую, простую, и вторичную (второе название неврогенная).
С развитием в организме человека атрофии мышц мышечная ткань начинает деформироваться, уменьшаться в размерах. Она замещается на соединительную ткань, которая не предназначена для того, чтобы выполнять двигательную функцию. Больной начинает терять мышечную силу, его мышечный тонус снижается. От этого страдает двигательная активность: она либо сильно ограничена, либо полностью пропадает.
Атрофия жевательных мышц ног, лица, симптомы, причины. Атрофия мышц бедра у ребенка. Заболевание.
Причина атрофии кроется в травме нервных стволов или в инфекционных процессах, затрагивающих двигательные клетки спинного мозга, таких как полиомиелит и ему подобны заболевания.
В редких случаях данная патология связана с наследственностью,во время которой идет медленное поражение дистальных отделов конечностей. Доктора уверят, что характер этого процесса — доброкачественный.
Этапы лечения
На выбор метода лечения существенное влияние оказывает несколько факторов, среди которых возрастная категория пациента и в какой форме протекает заболевание. Большое внимание уделяют лечению заболевания, из-за которого развилась мышечная атрофия. Лечение основано на приеме медикаментозных препаратов, прохождении назначенных физиопроцедур, применении лечебного массажа, электролечения, гимнастики. При выполнении всех рекомендаций в большинстве случаев удается сохранить утрачиваемую двигательную способность и притормозить развитие атрофии мышц.
При выполнении всех рекомендаций в большинстве случаев удается сохранить утрачиваемую двигательную способность и притормозить развитие атрофии мышц.
Интересное
дорсалгия грудного отдела
полиартроз симптомы и лечение
бурсит плечевого сустава симптомы и лечение
Анализы на коронавирус
Лечение нейропатии в Поликлинике Белгорода
Нейропатией называют заболевание нерва, поражающего спинной мозг. Нейропатия делится на: сенсорную и моторную.
При моторной нейропатии пациенты ощущают повышенную слабость, замедление рефлекторной деятельности, атрофирование мышц.
При сенсорной нейропатии больные теряют ощущение движения. Они перестают воспринимать боль, температуру, у них нарушается координация движений.
Причины проявления заболевания
Причинами появления данного недуга могут быть:
- артрит;
- сахарный диабет;
- печёночная или почечная недостаточность;
- опухоли.
Классификация заболевания
По классификации нейропатия делится на:
- алкогольную;
- ишемическую;
- диабетическую;
- посттравматическую.
Лечение нейропатии в Белгороде
Лечение нейропатиив в Белгороде начинается с осмотра пациента и сдачи анализов. Основные меры лечения направлены на устранение причин заболевания. Как правило, лечение данного недуга проходит успешно. Для этого специалисты назначают: витаминную терапию, лечат новообразования, эндокринные заболевания, сахарный диабет. То есть, лечат основные причины проявления нейропатии. Если же нейропатия связанна с наследственностью, то здесь применяется патогенетическая терапия.
Приступая к лечению нейропатии в Белгороде, врач внимательно изучает историю болезни пациента. Именно это помогает на приеме врачу неврологу в постановке точного диагноза. Если вы хотите избавиться от болезни раз и навсегда, обращайтесь в нашу частную поликлинику. Мы гарантируем своим пациентам индивидуальный подход, эффективные методы лечения и высокий сервис обслуживания. В нашей поликлинике в Белгороде имеется всё необходимое ля быстрой диагностики заболеваний. У нас имеется современное оборудование, высококвалифицированные специалисты с большим стажем работы. Ни в коем случае не занимайтесь самолечением. Это только усугубит ситуацию.
В нашей поликлинике в Белгороде имеется всё необходимое ля быстрой диагностики заболеваний. У нас имеется современное оборудование, высококвалифицированные специалисты с большим стажем работы. Ни в коем случае не занимайтесь самолечением. Это только усугубит ситуацию.
Как развивается атрофия мышечной ткани при сахарном диабете и ожирении: исследование Nature Metabolism | Новости
В работе, опубликованной сотрудниками университета Монаша, раскрываются новые особенности метаболизма печени и нарушений, связанных с ожирением и сахарным диабетом 2 типа, которые приводят к повышению уровня глюкозы и атрофии мышечной ткани (саркопении). Работа опубликована в журнале Nature Metabolism.
Данные были получены как при помощи экспериментальных работ в лаборатории, так и на основании проведенных клинических испытаний. Коллаборация ученых определила, что метаболизм печени, а точнее – аминокислоты аланина, изменяется у людей с сахарным диабетом 2 типа и ожирением.
При помощи таргетного сайленсинга ферментов (аланинаминотрансферазы, АЛТ), ответственных за катаболизм аланина в клетках печени, возможны обратные изменения уровня сахара и мышечной массы путем белкового синтеза. Механизм, лежащий в основе связи между измененным метаболизмом печени и силой и размерами мышц, опосредован повышенным уровнем таких гормонов как кортизол и глюкагон. Они усиливают взаимодействие между аминокислотами, печенью и скелетными мышцами, приводя к саркопении.
«На фоне метаболической дисфункции и связанных с ней осложнений, из вида зачастую упускается ожирение, также вносящее весомый вклад в развитие мышечной атрофии. Эти процессы напрямую влияют на качество жизни и смертность и являются социально-экономическим бременем для здравоохранения. Тот факт, что мышечная атрофия и сахарный диабет были связаны, известно уже давно, но только сейчас стало появляться понимание как это происходит», – комментирует работу один из ведущих авторов исследования, доктор Роуз. «Нами было показано, что печень является критически важным элементом в метаболизме белков».
«Нами было показано, что печень является критически важным элементом в метаболизме белков».
Источник: http://dx.doi.org/10.1038/s42255-021-00369-9 // https://www.nature.com/articles/s42255-021-00369-9
Лечение спинальной мышечной атрофии в Германии, клиника Вивантес
Генетика и неврология – одни из наиболее сложных отраслей медицины. Заболевания, относящиеся одновременно к обеим отраслям, встречаются во врачебной практике относительно редко, а их лечение требует не только привлечения исключительно квалифицированных врачей, но также серьезной ресурсной базы.
Одним из таких заболеваний является спинальная мышечная атрофия (СМА) – патология, которая сопровождается тяжелыми деформациями и значительно снижающая качество жизни человека.
На базе клиники «Вивантес» лечение спинальной мышечной атрофии проводится специалистами высшей категории. Мы проводим исследования с применением новейшего оборудования экспертного класса для всесторонней диагностики этого заболевания. Лечение патологического процесса осуществляется согласно инновационным методикам медикаментозной терапии, в тяжелых случаях проводятся ортопедические операции различной степени сложности. Хирургическим путем также устраняются сопутствующие патологии СМА.
Что такое спинальная мышечная атрофия
Спинальная мышечная атрофия (спинальная амиотрофия или СМА) – патологический процесс генетической природы, обусловленный дегенеративными нарушениями, которые затрагивают моторные нейроны спинного мозга и ствола спинного мозга. Данное заболевание относится к разряду врожденных и считается одной из основных причин смертности среди детей до 5 лет.
Спинальная амиотрофия – редкая патология, согласно статистическим данным, она регистрируется примерно 1 раз на 6000-10000 случаев. Механизм возникновения болезни обусловлен дегенеративными нарушениями в передних рогах спинного мозга. В результате этого происходят нарушения иннервации и нейротрофики мышечных структур спины. Это приводит к атрофии тканей мышечного корсета, что влечет за собой возникновение тяжелых деформаций.
Это приводит к атрофии тканей мышечного корсета, что влечет за собой возникновение тяжелых деформаций.
Как было сказано ранее, спинальная мышечная атрофия – врожденная патология, в большинстве случаев она проявляется у детей младенческого возраста. Но в некоторых случаях заболевание дебютирует во взрослом возрасте, при этом отмечается менее стремительное прогрессирование и более легкое течение. Однако при отсутствии адекватного лечения развитие болезни приводит к тяжелым последствиям и инвалидизации независимо от того, в каком возрасте она проявилась.
Симптомы и диагностика спинальной мышечной атрофии
Клиническая картина спинальной мышечной атрофии варьируется в зависимости о того, в каком возрасте дебютировала болезнь. Наиболее тяжелая симптоматика развивается у младенцев, чем и обусловлена высокая вероятность летального исхода.
Особенности клинической картины спинальной амиотрофии у младенцев:
- заметное отставание в развитии двигательной активности;
- ребенок не пытается перевернуться в положенное время;
- минимальная активность верхних конечностей;
- в дальнейшем ребенок не садится и не ползает в положенное согласно нормам развития время;
- отмечается значительное отставание в развитии мелкой моторики;
- в наиболее тяжелых случаях отмечается атрофия мускулатуры, ответственной за сосание, глотание, дыхание.
Возникновение патологического процесса во взрослом возрасте протекает с более легкой симптоматикой:
- атрофия начинается с мышечных структур стоп и голени, постепенно поднимаясь;
- большинство пациентов отмечают выраженную слабость в ногах, систематические судороги;
- возникает тремор различной степени интенсивности, а также фасцикуляции;
- затем происходит атрофия мышечных структур туловища, верхние конечности поражаются в последнюю очередь;
- наиболее тяжелым признаком становятся нарушения работы мышц, ответственных за дыхание.
Главная особенность спинальной мышечной атрофии заключается в том, что эта болезнь быстро приводит к инвалидизации, а состояние пациента постоянно ухудшается.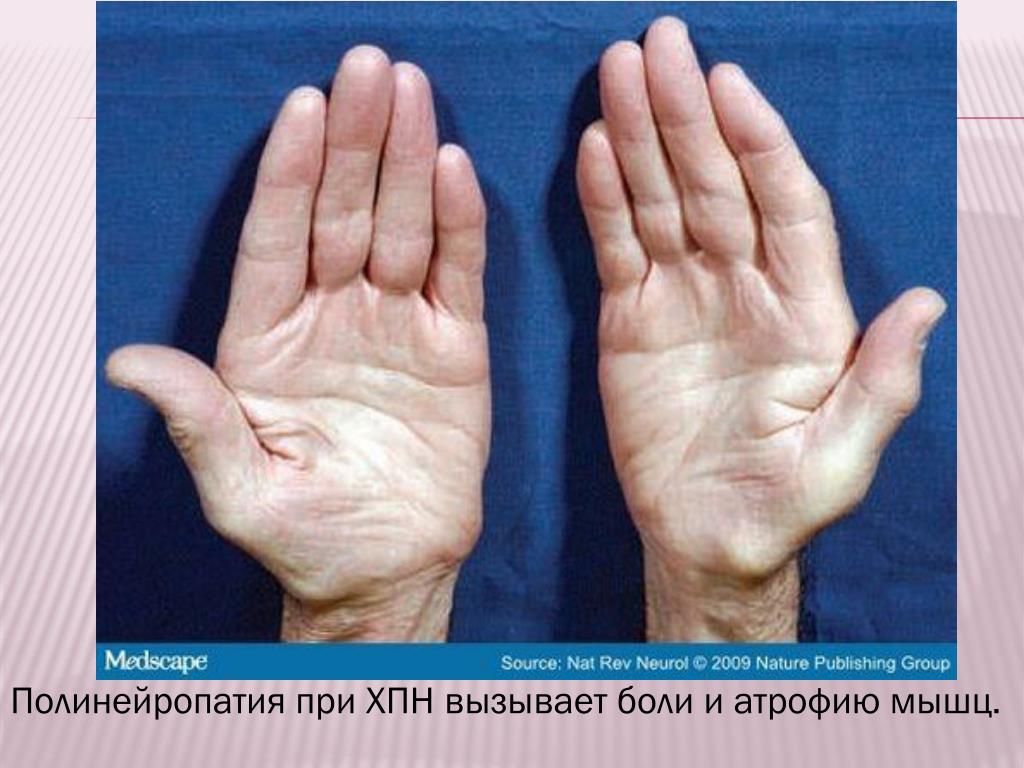 В рамках диагностики врачи нашей клиники обращают внимание на любые тревожные признаки, проводят общий осмотр, сложную дифференциацию, составляют анамнез жизни.
В рамках диагностики врачи нашей клиники обращают внимание на любые тревожные признаки, проводят общий осмотр, сложную дифференциацию, составляют анамнез жизни.
Затем проводится ряд лабораторных и аппаратных исследований, в числе которых особенно актуальны следующие:
- общеклинические анализы крови и мочи;
- биохимия крови;
- игольчатая электромиография;
- биопсия мышечных тканей;
- спирометрия;
- генетические исследования.
Лечение спинальной мышечной атрофии
Тактика лечения в отношении каждого пациента составляется нашими специалистами индивидуально. При этом учитывают особенности течения и скорость прогрессирования заболевания, результаты диагностики, возраст и целый ряд других факторов. Для достижения приемлемых результатов лечение должно быть комплексным, совмещать не только медикаментозную терапию и хирургические вмешательства, но также ЛФК, массажи, респираторную поддержку.
Консервативное
Консервативная терапия спинальной амиотрофии направлена на поддержание пациента и замедление развития заболевания, ведь специфическое лечение отсутствует. В этих целях могут применяться препараты таких групп:
- метаболические медикаменты для улучшения обменных процессов в организме, в частности мотонейронах и мышцах;
- вальпроаты и агонисты бета-адренергических рецепторов для поддержания выживаемости моторных нейронов;
- ингибиторы протонной помпы и прокинетики при поражении мускулатуры органов ЖКТ;
- гормональные средства при развитии эндокринных осложнений.
Хирургическое
Методы хирургического лечения всецело зависят от особенностей прогрессирования болезни и возникших осложнений. Операции в нашей клинике проводятся одними из лучших хирургов Германии, предполагают применение высокотехнологичного оборудования. При скелетных деформациях наши специалисты выполняют сложные ортопедические вмешательства. При поражениях дыхательной системы наиболее частое вмешательство – трахеостомия.
Реабилитация
Реабилитация при диагностированной спинальной мышечной атрофии – это постоянный процесс, направленный на поддержание здоровья пациента. Наши врачи разрабатывают индивидуальные реабилитационные программы, включая в них массажные практики, дозированные занятия лечебной физкультурой, применяют методы для компенсации кислородной недостаточности.
Доктора
- Инсульт и сосудистые заболевания головного мозга
- Неврологическая реабилитация
- Рассеянный склероз
- Нейроиммунология
- Нейроинтенсивная терапия
- Эпилепсия
- Дифференциальная диагностика неэпилептических пароксизмов
- Длительный ЭЭГ — видеомониторинг
- Медицинская и немедицинская помощь при пароксизмах и осложнениях, связанных с эпилепсией
- Член Британской Медицинской Ассоциации
- Инструктор и член Европейской Академии по изучению Эпилепсии (EUREPA)
- Член Комиссии по психобиологии и Международной Лиги по борьбе с Эпилепсией (ILAE)
- Психоорганический синдром, Всемирная Федерация Обществ Биологической Психиатрии (WFSBP)
- Видеоконсультация
- Признанный международный эксперт в области болезни Паркинсона, дистонии и тремор
- Нейромускулярные заболевания
- Рассеянный склероз
- Лечение с использованием бутолотоксина (дистония, спастика)
- Лечение глубокой стимуляцией мозга
- Автор более 70 научных публикаций, явялется членом международных экспертных советов
- Всемирно признанный специалист в области инсульта, заболеваний периферической нервной системы и клинической электрофизиологии
- Автор свыше 40 оригинальных публикаций
- Совет директоров Берлинского сообщества по предотвращению инсульта (BSA)
- Член совета директоров Берлинского центра исследований инсульта (CSB)
- Гендерная медицина
- Психоонкология
- Биполярные аффективные расстройства
- Неврологическая реабилитация после инсульта, полученных черепно-мозговых травм и повреждений спинного мозга
- Реабилитационная терапия при болезни Паркинсона и дистонии
- Ботулинотерапия
- Лечение спастичности
- Неврологическая реабилитация с помощью интратекальной баклофеновой терапии и глубокой мозговой стимуляции
- Автор более 90 научных публикаций, член нескольких экспертных комиссий
Синдром менеджера
Лечение синдрома менеджера — «сидячего» образа жизни — в Коломне.

Сидячий образ жизни или гиподинамия.
В двадцать первом веке всё больше людей проводит основную часть жизни в сидячем положении. Офисная работа, время в пробке, в свободное время нахождение перед телевизором или компьютером. Нарушения в работе сердечнососудистой системы, боли в суставах, ожирение и многие другие болезни связаны именно с сидячим образом жизни. В последствии это приводит к развитию гиподинамии.
Гиподинамия (гипокинезия) — это длительное ограничение двигательной активности, в частности, без нагрузки на нижние конечности (ходьба, бег, прыжки и пр.). Заболевание наблюдается у людей с длительным постельным режимом, у надолго прервавших тренировки спортсменов (по причине болезни, травмы), у космонавтов во время полётов, у инвалидов (после ампутации нижних конечностей, ДЦП, параличей и пр.) и у людей, ведущих малоподвижный образ жизни (офисные работники и др.).
Вследствие малоподвижности нарушается деятельность многих органов и их систем, страдает крово- и лимфообращение, появляются сбои в работе обменных процессов и т.п. Это влечёт за собой детренированность и нарушения в функциональных системах, гомеостазе.
Гипокинезия уменьшает поток нервных импульсов на вегетативные функции большинства органов и систем. Понижается венозное давление, мышцы ослабевают, ухудшается обмен веществ, что влечёт за собой большие изменения в течении восстановительных процессов. Ухудшаются главные параметры работы мышц: сократимость, способность поддерживать длительную активность, ограничивается объем движений в суставах и пр. Ограничение движения тормозит процессы регенерации тканей, ухудшает снабжение тканей кислородом, ведёт к изменениям в сердечной мышце и атрофии мышц нижних конечностей в послеоперационном периоде и при некоторых заболеваниях у пациентов, лечившихся стационарно. По данным исследований доказано, что нет такого органа или системы, работа которых не ухудшалась бы при ограничении физической активности.
Главным условием реабилитации на начальном этапе является постепенность введения нагрузок. Нагрузки подбираются строго индивидуально и должны соответствовать функциональному состоянию организма, полу и возрасту пациента. В последствии под наблюдением врача и контролем инструкторов нагрузка постепенно увеличивается, меняется её темп, ритм, усилие и другие параметры. Данные мероприятия направлены на укрепление всего опорно-двигательного аппарата, улучшение кровообращения в мышцах и органах, улучшение психо-эмоционального состояния.
Нагрузки подбираются строго индивидуально и должны соответствовать функциональному состоянию организма, полу и возрасту пациента. В последствии под наблюдением врача и контролем инструкторов нагрузка постепенно увеличивается, меняется её темп, ритм, усилие и другие параметры. Данные мероприятия направлены на укрепление всего опорно-двигательного аппарата, улучшение кровообращения в мышцах и органах, улучшение психо-эмоционального состояния.
Важно понимать, что лучшая профилактика гиподинамии — это движение. Разнообразные физические нагрузки и упражнения способствуют укреплению мышечной системы, опорно-двигательного аппарата и всего организма в целом. Будут к месту пешие прогулки, бег, плавание, занятия в фитнес-зале, даже обычная ежедневная зарядка положительным образом скажется на вашем состоянии.
Мышечная атрофия: причины, симптомы и лечение
Термин «мышечная атрофия» относится к потере мышечной ткани. Атрофированные мышцы кажутся меньше нормальных. Отсутствие физической активности из-за травмы или болезни, плохого питания, генетики и определенных заболеваний может способствовать атрофии мышц.
Атрофия мышц может возникнуть после длительного бездействия. Если мышца не получает никакой пользы, тело в конечном итоге разрушает ее, чтобы сохранить энергию.
Атрофия мышц, развивающаяся из-за бездействия, может возникнуть, если человек остается неподвижным, пока он выздоравливает после болезни или травмы.Регулярные упражнения и физиотерапия могут обратить вспять эту форму мышечной атрофии.
Люди могут лечить мышечную атрофию, изменив образ жизни, попробовав физиотерапию или сделав операцию.
В этой статье мы рассмотрим некоторые другие причины, симптомы и методы лечения атрофии мышц.
Многие факторы могут вызвать атрофию мышц, в том числе:
Плохое питание
Плохое питание может вызвать множество заболеваний, включая атрофию мышц.
В частности, Международный фонд остеопороза предупреждает, что диета с низким содержанием постного белка, фруктов и овощей может привести к снижению мышечной массы.
Атрофия мышц, связанная с неправильным питанием, может развиться в результате заболеваний, которые ухудшают способность организма усваивать питательные вещества, например:
Кахексия — это сложное метаболическое состояние, которое вызывает сильную потерю веса и атрофию мышц. Кахексия может развиваться как симптом другого основного заболевания, такого как рак, ВИЧ или рассеянный склероз (РС).
Люди с кахексией могут испытывать значительную потерю аппетита или непреднамеренную потерю веса, несмотря на потребление большого количества калорий.
Возраст
С возрастом в организме человека вырабатывается меньше белков, способствующих росту мышц. Это сокращение доступного белка вызывает сокращение мышечных клеток, что приводит к состоянию, называемому саркопенией.
Согласно отчету Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), саркопения поражает до трети людей в возрасте 60 лет и старше.
Помимо снижения мышечной массы, саркопения может вызывать следующие симптомы:
- слабость или хрупкость
- плохой баланс
- трудности при движении
- снижение выносливости
потеря мышечной массы может быть неизбежным результатом естественного процесс старения. Однако это может увеличить риск травм и негативно повлиять на общее качество жизни человека.
Генетика
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое вызывает потерю двигательных нервных клеток и мышечную атрофию.
Существует несколько различных типов SMA, которые попадают в следующие категории:
- SMA, сцепленная с хромосомой 5 : Эти типы SMA возникают из-за мутации в генах SMN1 на хромосоме 5. Мутации приводят к дефицит белка выживания мотонейрона.
 СМА обычно развивается в детстве, но может развиться в любой момент жизни.
СМА обычно развивается в детстве, но может развиться в любой момент жизни. - SMA не связана с хромосомой 5
Мышечная дистрофия относится к группе прогрессирующих состояний, которые вызывают потерю мышечной массы и слабость.
Мышечная дистрофия возникает, когда один из генов, участвующих в производстве белка, мутирует. Человек может унаследовать генетические мутации, но многие из них возникают естественным образом по мере развития эмбриона.
Медицинские условия
Поделиться на PinterestАтрофированные мышцы меньше здоровых.Изображение предоставлено: OpenStax, 2016.
Заболевания и хронические состояния, которые могут способствовать атрофии мышц, включают:
- Боковой амиотрофический склероз (БАС) : БАС, также называемый болезнью Лу Герига, включает несколько типов, которые повреждают двигательные нервные клетки, которые повреждают двигательные нервные клетки. контролировать мышцы.
- MS : Это хроническое заболевание возникает, когда иммунная система организма атакует центральную нервную систему, вызывая опасное воспаление нервных волокон.
- Артрит : Артрит относится к воспалению суставов, которое вызывает боль и скованность. Артрит может серьезно ограничить подвижность человека, что может привести к неиспользованию мышц и атрофии.
- Миозит : Термин «миозит» означает воспаление мышц. Это состояние вызывает мышечную слабость и боль.У людей может развиться миозит после вирусной инфекции или как побочный эффект аутоиммунного заболевания.
- Полиомиелит : это инфекционное заболевание поражает нервную систему. Это вызывает симптомы гриппа и может привести к необратимому параличу.
Неврологические проблемы
Травма или состояние могут повредить нервы, контролирующие мышцы, что приведет к состоянию, называемому нейрогенной мышечной атрофией.
Когда это развивается, мышцы перестают сокращаться, потому что они больше не получают сигналы от нерва.
Симптомы мышечной атрофии сильно различаются в зависимости от причины и степени потери мышечной массы.
В дополнение к уменьшению мышечной массы симптомы мышечной атрофии включают:
- , когда одна рука или нога заметно меньше других,
- испытывает слабость в одной конечности или обычно
- испытывает трудности с равновесием
- остается неактивным в течение расширенный период
Методы лечения атрофии мышц различаются в зависимости от степени потери мышечной массы и наличия каких-либо сопутствующих заболеваний.
Лечение основного состояния, вызывающего атрофию мышц, может помочь замедлить прогрессирование потери мышц.
К лечению атрофии мышц относятся:
Физическая терапия
Поделиться на Pinterest Физическая терапия может помочь улучшить подвижность людей с атрофией мышц.Физическая терапия включает выполнение определенных упражнений на растяжку и упражнения с целью предотвращения неподвижности. Физическая терапия предлагает следующие преимущества людям с атрофией мышц:
- предотвращение неподвижности
- увеличение мышечной силы
- улучшение кровообращения
- уменьшение спастичности, вызывающей непрерывное сокращение мышц
Функциональная электрическая стимуляция
Функциональная электрическая стимуляция (FES ) — еще одно эффективное средство от мышечной атрофии.Он включает использование электрических импульсов для стимуляции сокращения пораженных мышц.
Во время FES обученный техник прикрепляет электроды к атрофированной конечности. Электроды пропускают электрический ток, который вызывает движение конечности.
Сфокусированная ультразвуковая терапия
Этот метод доставляет лучи ультразвуковой энергии к определенным участкам тела. Лучи стимулируют сокращение атрофированной мышечной ткани.
Эта новая технология находится в стадии разработки и еще не вошла в стадию клинических испытаний.
Хирургия
Хирургические процедуры могут улучшить функцию мышц у людей, атрофия которых связана с неврологическими состояниями, травмами или недоеданием.
Атрофия мышц, или истощение мышц, характеризуется значительным укорочением мышечных волокон и потерей общей мышечной массы.
Несколько факторов могут способствовать атрофии мышц, например:
- длительное пребывание в неподвижности из-за болезни или травмы
- возраст
- недоедание
- генетика
- неврологические проблемы
- определенные заболевания, такие как артрит, миозит , ALS и MS
Варианты лечения будут зависеть от каждого отдельного случая, но они могут включать физиотерапию, диетическое вмешательство или хирургическое вмешательство.
Атрофия мышц — обзор
22.2.3 Атрофия
Атрофия мышц может быть вызвана как физиологическими, так и болезненными состояниями. Исследования показали, что активация E3 ubiquitin ligases MuRF1 и MAFbx играет важную роль в атрофии мышц (Bodine et al., 2001; Gomes et al., 2001). Убиквитинлигазы Е3 являются важной частью протеасомного пути, который отвечает за деградацию белка в клетках. В клетках белки, предназначенные для деградации протеасом, маркируются убиквитинлигазами.Выбор субстрата для деградации белка зависит от убиквитинлигазы E3. Было показано, что MuRF1 и MAFbx воздействуют на специфические для мышц белки для деградации в различных условиях, включая неиспользование мышц, иммобилизацию, денервацию и лечение стероидами (McElhinny et al., 2002; Clarke et al., 2007; Tintignac et al., 2005; Lagirand -Cantaloube et al., 2008). MuRF1 и MAFbx регулируются факторами транскрипции FOXO (Sandri et al., 2004, 2006; Stitt et al., 2004). Активность FOXO регулируется сигнализацией инсулина и факторов роста.Исследования показали, что инсулин и IGF активируют передачу сигналов PI3K / AKT, что приводит к фосфорилированию FOXO (Biggs et al., 1999; Brunet et al., 1999, 2001; Kops et al.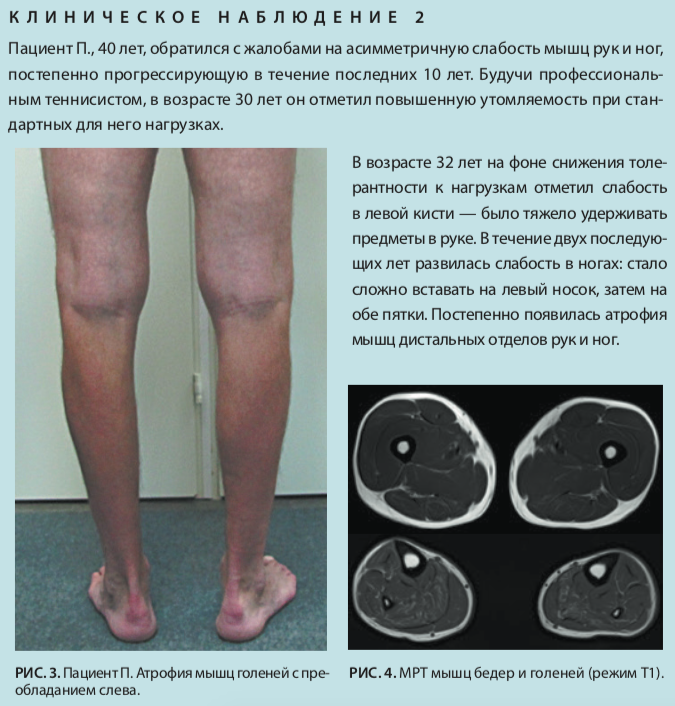 , 1999). Когда FOXO не фосфорилируется, он локализуется в ядрах и активирует нижестоящие мишени транскрипции, такие как MuRF1, MAFbx и другие гены, которые способствуют атрофии мышц. Когда он фосфорилируется, он исключается из ядра, поэтому транскрипционная активность FOXO подавляется, что снижает экспрессию MuRF1 и MAFbx.В дополнение к FOXO, активация передачи сигналов NFκB и p38 MAPK, активируемая воспалительными сигналами и окислительным стрессом, также, как было показано, активирует транскрипцию MuRF1 и / или MAFbx, способствуя атрофии мышц (Brunet et al., 2004; Cai et al., 2004 ; Mastrocola et al., 2008; Powers et al., 2007).
, 1999). Когда FOXO не фосфорилируется, он локализуется в ядрах и активирует нижестоящие мишени транскрипции, такие как MuRF1, MAFbx и другие гены, которые способствуют атрофии мышц. Когда он фосфорилируется, он исключается из ядра, поэтому транскрипционная активность FOXO подавляется, что снижает экспрессию MuRF1 и MAFbx.В дополнение к FOXO, активация передачи сигналов NFκB и p38 MAPK, активируемая воспалительными сигналами и окислительным стрессом, также, как было показано, активирует транскрипцию MuRF1 и / или MAFbx, способствуя атрофии мышц (Brunet et al., 2004; Cai et al., 2004 ; Mastrocola et al., 2008; Powers et al., 2007).
Сообщалось, что помимо протеасомной деградации белков, нерегулируемая активность аутофагии и активация каспазы-3 и кальпаинов также играют важную роль в атрофии скелетных мышц (Salazar et al., 2010; Эннс и Белкастро, 2006 г .; Милан и др., 2015; Nascimbeni et al., 2012). Аутофагия удаляет поврежденные или нежелательные органеллы и белки в клетках. Процесс включает координацию группы генов, связанных с аутофагией, которые кодируют белки, избирательно взаимодействующие с мишенями, образование аутофагосом, слияние с лизосомами и деградацию целевых органелл и белков. Несбалансированная активность аутофагии в клетках связана с истощением мышц и заболеваниями. В то время как базальный уровень активности аутофагии необходим для поддержания здоровья мышц, чрезмерная аутофагия вызывает мышечное истощение.FOXO3 индуцирует экспрессию ряда генов аутофагии, участвующих в различных стадиях процесса, включая LC3b, Gabarapl1, Pi3kIII, Ulk2, Atg12l, Beclin1, Atg4b и Bnip3 (Zhao et al., 2007; Mammucari et al., 2007) . Кроме того, предыдущие исследования показали, что FOXO активирует аутофагию в дополнение к деградации протеасом, которая включает митофагию, специализированную форму аутофагии (Milan et al., 2015; Zhao et al., 2008). Аутофагия в вышедших из употребления скелетных мышцах также может быть активирована с помощью передачи сигналов p38 MAPK (McClung et al. , 2010).
, 2010).
Увеличение количества определенных циркулирующих сигнальных молекул, таких как воспалительные цитокины (например, TNFα, IL1β и IL6), TGFβ и стероиды, может активировать молекулярные пути, которые вызывают атрофию мышц (Bruunsgaard and Pedersen, 2003; Schakman et al., 2012; Spate и Schulze, 2004; Watson et al., 2012; Narola et al., 2013). Также было показано, что оксидативный стресс способствует мышечной атрофии. Было показано, что оба активируют передачу сигналов NFκB и / или MAPK, которые уменьшают дифференцировку миобластов, вызывают апоптоз и увеличивают деградацию белка (Powers et al., 2011; Archuleta et al., 2009; Langen et al., 2012; Хантер и др., 2002; Лу и др., 2012). Кроме того, было показано, что IL6 активирует STAT3 и способствует развитию раковой кахексии и саркопении (Budui et al., 2015; Bonetto et al., 2012; Gilabert et al., 2014). Было показано, что помимо воспалительных цитокинов, передача сигналов TGFβ способствует мышечной атрофии (Narola et al., 2013; Mendias et al., 2012). Было показано, что и TGFβ1, и миостатин активируют smad2 / 3 и приводят к истощению мышц. Мы также недавно сообщили о новом взаимодействии между передачей сигналов TGFβ1 и STAT3, которое способствует более серьезному истощению мышц в условной мышечной модели TGFβ1 на мышах (Guadagnin et al., 2015).
Границы | Атрофия мышц из-за повреждения нервов сопровождается повышенным уровнем синтеза миофибриллярных белков
Введение
Скелетная мышца — самый большой орган человеческого тела, составляющий не менее 40% его массы и содержащий 50–75% всех белков организма (Frontera and Ochala, 2015). Это имеет решающее значение для здоровья и передвижения, а недостаток мышечной массы и силы связан с серьезным снижением независимости, качества жизни и продолжительности жизни (Metter et al., 2002; Wannamethee et al., 2007). Многие клинические состояния сопровождаются потерей мышечной массы, например, рак, ХОБЛ или сердечная недостаточность (Rosenberg, 1997; Al-Majid and McCarthy, 2001; Marquis et al. , 2002; Thomas, 2007). В настоящее время не существует медикаментозного лечения мышечной атрофии, при этом упражнения и обильное потребление белка являются единственными добросовестными вмешательствами для замедления мышечной потери (Sepulveda et al., 2015; Garber, 2016). Однако бывают ситуации с потерей мышечной массы, когда физическая активность недопустима.Например, у пациентов с переломами, у пациентов в критическом состоянии или у пациентов с повреждением нервов. Повреждение периферических нервов — часто встречающееся клиническое состояние, которое может быть вызвано болезнью или травмой (Dyck, 2005). Распространенной моделью для изучения повреждения периферического нерва является хроническое повреждение нерва сужением (Bennett and Xie, 1988). Хроническое сужение нерва сопровождается изнурительными симптомами, такими как невропатическая боль, нарушение двигательной функции и атрофия скелетных мышц (Bennett and Xie, 1988).Несмотря на то, что функция нервов может восстановиться, это часто переживается ухудшающимся воздействием на мышечную ткань. Хотя хроническое сужение нерва хорошо изучено в отношении его последствий для боли у животных, очень мало известно о физиологии мышечного истощения.
, 2002; Thomas, 2007). В настоящее время не существует медикаментозного лечения мышечной атрофии, при этом упражнения и обильное потребление белка являются единственными добросовестными вмешательствами для замедления мышечной потери (Sepulveda et al., 2015; Garber, 2016). Однако бывают ситуации с потерей мышечной массы, когда физическая активность недопустима.Например, у пациентов с переломами, у пациентов в критическом состоянии или у пациентов с повреждением нервов. Повреждение периферических нервов — часто встречающееся клиническое состояние, которое может быть вызвано болезнью или травмой (Dyck, 2005). Распространенной моделью для изучения повреждения периферического нерва является хроническое повреждение нерва сужением (Bennett and Xie, 1988). Хроническое сужение нерва сопровождается изнурительными симптомами, такими как невропатическая боль, нарушение двигательной функции и атрофия скелетных мышц (Bennett and Xie, 1988).Несмотря на то, что функция нервов может восстановиться, это часто переживается ухудшающимся воздействием на мышечную ткань. Хотя хроническое сужение нерва хорошо изучено в отношении его последствий для боли у животных, очень мало известно о физиологии мышечного истощения.
Мышечная масса определяется балансом между синтезом мышечного белка (MPS) и распадом мышечного белка (MPB). Любая сторона баланса может быть нарушена. Следовательно, предполагается, что большинство мышечных атрофий демонстрируют комбинацию снижения MPS и увеличения MPB (McKinnell and Rudnicki, 2004).Тем не менее, индивидуальный вклад снижения MPS может различаться для разных типов атрофий. Например, при атрофии неиспользования у людей снижение показателей МПС, по-видимому, является преобладающей причиной снижения мышечной массы (Wall et al., 2013a, b, 2016). Точно так же сообщалось о снижении MPS при голодании, саркопении, кахексии и других состояниях мышечной атрофии, что указывает на потенциальную пользу вмешательств, которые увеличивают MPS (Emery et al., 1984; Yarasheski et al. , 1993; Hector et al., 2018).При атрофии, вызванной повреждением нервов, ранние исследования предполагали различные эффекты денервации на MPS. В зависимости от момента времени у очень молодых крыс после перерезки нерва было обнаружено как снижение, так и кратковременное повышение показателей МПС (Goldspink, 1976, 1978; Goldspink et al., 1983). Неизвестно, как хроническое сужение нервов у взрослых животных влияет на показатели MPS. Кроме того, предыдущие исследования, в которых использовалось мечение стабильных изотопов с использованием метода непрерывной инфузии с затоплением или примированной дозой, были ограничены периодом оценки MPS в несколько часов, что уменьшало их способность прогнозировать абсолютные изменения мышечной массы (Mitchell et al., 2014; Reid et al., 2014). Однако повторное появление оксида дейтерия (D 2 O) в качестве средства изучения интегрированного MPS in vivo в течение нескольких дней или недель предлагает привлекательное решение этой проблемы (Busch et al., 2006; Wilkinson et al. ., 2014; Дамас и др., 2016).
, 1993; Hector et al., 2018).При атрофии, вызванной повреждением нервов, ранние исследования предполагали различные эффекты денервации на MPS. В зависимости от момента времени у очень молодых крыс после перерезки нерва было обнаружено как снижение, так и кратковременное повышение показателей МПС (Goldspink, 1976, 1978; Goldspink et al., 1983). Неизвестно, как хроническое сужение нервов у взрослых животных влияет на показатели MPS. Кроме того, предыдущие исследования, в которых использовалось мечение стабильных изотопов с использованием метода непрерывной инфузии с затоплением или примированной дозой, были ограничены периодом оценки MPS в несколько часов, что уменьшало их способность прогнозировать абсолютные изменения мышечной массы (Mitchell et al., 2014; Reid et al., 2014). Однако повторное появление оксида дейтерия (D 2 O) в качестве средства изучения интегрированного MPS in vivo в течение нескольких дней или недель предлагает привлекательное решение этой проблемы (Busch et al., 2006; Wilkinson et al. ., 2014; Дамас и др., 2016).
Поэтому мы решили исследовать влияние хронического сужения нерва на МПС. Мы объединили долгосрочные эксперименты с D 2 O-опосредованным индикатором на взрослых крысах с абсолютными изменениями мышечной массы, иммуногистохимическим анализом и данными экспрессии белка.Мы предположили, что сужение нерва приведет к снижению показателей MPS. Однако мы обнаружили, что, несмотря на значительную потерю мышечной массы, атрофия, вызванная повреждением нервов, сопровождается хронически повышенной, а не сниженной скоростью синтеза миофибриллярного белка (MPS).
Материалы и методы
Этическое одобрение и эксперименты на животных
Эксперименты на животных были одобрены местными властями (Landesamt für Gesundheit und Soziales, Берлин, Германия) под номером G 0083/15 и проводились в отделении по уходу за животными Центра молекулярной медицины Макса Дельбрюка (MDC, Берлин).
Модель повреждения нервов
Десять крыс-самцов Sprague-Dawley [Crl: CD (SD), Charles River, Sulzfeld, Germany] в возрасте 20–21 недель содержались в индивидуальных клетках. Животные получали корм из 20 г корма (ssniff Spezialdiäten GmbH, Soest, Германия) (дополнительный рисунок 1), эквивалентный 79 ккал * день -1 для замедления обычно происходящего набора веса. Повреждение нерва было вызвано хроническим сужением седалищного нерва (Sommer, 2013). Крыс анестезировали путем ингаляции изофлураном (~ 2.5%) и лечили инъекцией 4–5 мг карпрофена * кг -1 массы тела для уменьшения послеоперационной боли. Был сделан разрез вдоль бедренной кости, и латеральная широкая мышца бедра была отсоединена от двуглавой мышцы бедра тупым рассечением. Седалищный нерв обнажали выше точки трифуркации, и повреждение сужения было вызвано имплантацией манжеты вокруг нерва. Для дальнейшего уменьшения послеоперационной боли животные получали метамизол в дозе 100 мг * кг -1 .В течение последних 2 недель животных дважды в неделю подвергали электростимуляции для поддержания повреждения нерва и ухудшения восстановления, как было описано ранее (Baptista et al., 2008; Gigo-Benato et al., 2010). Животных вскрывали через 4 недели после операции, в возрасте от 24 до 25 недель. В голодном состоянии животных помещали под глубокую анестезию путем ингаляции изофлурана (~ 3,5%) и собирали TA и длинных разгибателей пальцев (EDL). Мышцы быстро взвешивали и разрезали пополам, причем одну часть немедленно замораживали в жидком азоте, а другую часть погружали в трагакантовую камедь для гистологического анализа и замораживали в изопентане.
Животные получали корм из 20 г корма (ssniff Spezialdiäten GmbH, Soest, Германия) (дополнительный рисунок 1), эквивалентный 79 ккал * день -1 для замедления обычно происходящего набора веса. Повреждение нерва было вызвано хроническим сужением седалищного нерва (Sommer, 2013). Крыс анестезировали путем ингаляции изофлураном (~ 2.5%) и лечили инъекцией 4–5 мг карпрофена * кг -1 массы тела для уменьшения послеоперационной боли. Был сделан разрез вдоль бедренной кости, и латеральная широкая мышца бедра была отсоединена от двуглавой мышцы бедра тупым рассечением. Седалищный нерв обнажали выше точки трифуркации, и повреждение сужения было вызвано имплантацией манжеты вокруг нерва. Для дальнейшего уменьшения послеоперационной боли животные получали метамизол в дозе 100 мг * кг -1 .В течение последних 2 недель животных дважды в неделю подвергали электростимуляции для поддержания повреждения нерва и ухудшения восстановления, как было описано ранее (Baptista et al., 2008; Gigo-Benato et al., 2010). Животных вскрывали через 4 недели после операции, в возрасте от 24 до 25 недель. В голодном состоянии животных помещали под глубокую анестезию путем ингаляции изофлурана (~ 3,5%) и собирали TA и длинных разгибателей пальцев (EDL). Мышцы быстро взвешивали и разрезали пополам, причем одну часть немедленно замораживали в жидком азоте, а другую часть погружали в трагакантовую камедь для гистологического анализа и замораживали в изопентане.
D
2 O Протокол маркировки Мы использовали протокол маркировки, подходящий для обнаружения обогащения дейтерия ( 2 H) аланином миофибриллярной белковой фракции скелетных мышц с помощью ГХ-МС, аналогичный тому, который был опубликован ранее (Busch et al., 2006; Gasier et al. , 2009). Вкратце, через 2 недели после операции животным внутрибрюшинно вводили 0,014 мл * г -1 массы тела D 2 O (99,8% + Atom D, Euriso-Top GmbH Saarbrücken) и 0. 9% NaCl. Эта инъекция праймировала животных и повышала уровень воды в их организме примерно до 2,5% D 2 O. Для поддержания указанной концентрации крысы получали питьевую воду с 4% -ным обогащением 2 H 2 O.
9% NaCl. Эта инъекция праймировала животных и повышала уровень воды в их организме примерно до 2,5% D 2 O. Для поддержания указанной концентрации крысы получали питьевую воду с 4% -ным обогащением 2 H 2 O.
Экстракция миофибриллярного белка
Выделение миофибриллярного белка выполняли, как описано ранее (Burd et al., 2012). Вкратце, 80–120 мг образца мышечной ткани крысиного ТА ( n = 10) взвешивали в пробирке Эппендорфа и хранили на льду.Стандартный буферный раствор добавляли к каждому образцу в количестве 10 мкл * мг -1 и мышечную ткань тщательно гомогенизировали. Ножницы использовали для измельчения ткани перед последующей гомогенизацией пластиковыми пестиками. Чтобы фракционировать осадок, богатый миофибриллярными и другими структурными белками, образец центрифугировали при 700 г в течение 10 минут при 4 ° C. Оставшийся осадок дважды промывали буфером и dH 2 O, супернатант отбрасывали и к осадку добавляли 1 мл 0,3 NaOH для дальнейшей солюбилизации миофибриллярных белков и выделения их из коллагена.Образцы нагревали при 50 ° C в течение 30 мин. Затем образец центрифугировали при 10000 г в течение 5 минут при 4 ° C и супернатант, содержащий миофибриллярный белок, переносили в 4 мл стеклянные флаконы с завинчивающейся крышкой. В каждую стеклянную пробирку добавляли один миллилитр 1M PCA для денатурации оставшихся белков. После центрифугирования супернатант удаляли и осадок дважды промывали 500 мкл 70% EtOH. После удаления EtOH добавляли 1,5 мл 6M HCl для гидролиза образцов в течение ночи при 110 ° C.На следующий день образцы помещали в нагревательный блок (120 ° C) и сушили в атмосфере азота. Для дальнейшей очистки аминокислот образцы перед дериватизацией пропускали через обменную смолу Dowex (смола AG 50W-X8, Bio-Rad). После очистки стеклянные флаконы осторожно встряхивали и помещали в пар азота для сушки перед дериватизацией. Затем образцы, содержащие свободные аминокислоты фракции миофибриллярного белка, были преобразованы в их производные трет-бутилдиметилсилила (TBDMS) путем добавления к образцу 50 мкл N-трет-бутилдиметилсилил-N-метилтрифторацетамида (MTBSTFA) и 50 мкл ацетонитрила. .Затем каждый образец инкубировали в течение 1 ч при 70 ° C. Затем образец переносили во флаконы с хромаколовым колпачком на 2 мл (Thermo Fisher Scientific, Шверте, Германия), подходящие для инъекции методом ГХ-МС.
.Затем каждый образец инкубировали в течение 1 ч при 70 ° C. Затем образец переносили во флаконы с хромаколовым колпачком на 2 мл (Thermo Fisher Scientific, Шверте, Германия), подходящие для инъекции методом ГХ-МС.
Экстракция белков плазмы
Для осаждения белков плазмы 40 мкл хлорной кислоты (20%) добавляли к 360 мкл образца плазмы. После встряхивания свободные аминокислоты отделяли от связанных с белком аминокислот центрифугированием (3500 об / мин, 20 мин, 4 ° C). Осадок собирали и трижды промывали 1 мл хлорной кислоты (2%) перед гидролизом в течение ночи, как описано выше.После гидролиза образцы очищали и обрабатывали для введения ГХ-МС, как описано выше. Значения немеченых образцов использовали в качестве базового контроля для обогащения 2 H аланином, связанным с белками плазмы.
Обогащение свободного аланина в плазме
Образцы плазмы размораживали на льду и к образцу добавляли сухую 5-сульфосалициловую кислоту для депротеинизации, как описано ранее (Trommelen et al., 2016). После встряхивания образец вращали при 1000 г в течение 15 мин.Супернатант собирали, а затем очищали, обрабатывали и измеряли с помощью ГХ-МС, как описано в разделах выше.
Измерение методом ГХМС и анализ обогащения стабильными изотопами
Обогащение аланином определяли методом электронно-ионизационной газовой хроматографии-масс-спектрометрии (ГХ-МС; Agilent 6890N GC / 5973N MSD) с использованием выбранного ионного мониторинга масс 232, 233, 234, 235 и 236 для их немеченого и меченого h3-аланина. . Мы применили стандартные кривые регрессии для оценки линейности масс-спектрометра и для контроля потери индикатора.
Иммуноблоттинг
Примерно 400 мкм образца вырезали из гистологического блока и гомогенизировали в стандартном лизирующем буфере с использованием пестика. Концентрации белка в образцах определяли с использованием набора для анализа бицинхониновой кислоты (BCA) (Thermo Fisher Scientific, Schwerte, Германия). Требуемый объем 40 мкг белка на образец рассчитывали, разделяли на аликвоты и добавляли SDSPP (6 ×) и SDSPP в H 2 O (1 ×) до общего объема 15 мкл. Для разделения белков в каждом образце использовали коммерческие гели SDS (Invitrogen NuPAGE Bis-Tris Gel, Thermo Fisher Scientific, Schwerte, Германия) и электрофорез (130–200 В).Для переноса использовали технику полусухого блоттинга (45 мин при 18 В). Мембраны блокировали TBS-T (4% сухое молоко) в течение 1 ч при комнатной температуре. Затем мембраны инкубировали с первым антителом в TBS-T (4% сухого молока) или BSA в течение ночи (дополнительная фигура 9). На следующий день образцы промывали TBS-T и добавляли второе антитело на 60 мин при комнатной температуре. После отмывки для проявления полос использовали хемилюминесценцию (ECL). Уровни экспрессии интересующих белковых полос непосредственно анализировали с помощью Image Studio Lite (LI-Cor, Lincoln, NE, США).Загрузка и перенос белка контролировали с помощью окрашивания по Понсо (дополнительный рисунок 2).
Требуемый объем 40 мкг белка на образец рассчитывали, разделяли на аликвоты и добавляли SDSPP (6 ×) и SDSPP в H 2 O (1 ×) до общего объема 15 мкл. Для разделения белков в каждом образце использовали коммерческие гели SDS (Invitrogen NuPAGE Bis-Tris Gel, Thermo Fisher Scientific, Schwerte, Германия) и электрофорез (130–200 В).Для переноса использовали технику полусухого блоттинга (45 мин при 18 В). Мембраны блокировали TBS-T (4% сухое молоко) в течение 1 ч при комнатной температуре. Затем мембраны инкубировали с первым антителом в TBS-T (4% сухого молока) или BSA в течение ночи (дополнительная фигура 9). На следующий день образцы промывали TBS-T и добавляли второе антитело на 60 мин при комнатной температуре. После отмывки для проявления полос использовали хемилюминесценцию (ECL). Уровни экспрессии интересующих белковых полос непосредственно анализировали с помощью Image Studio Lite (LI-Cor, Lincoln, NE, США).Загрузка и перенос белка контролировали с помощью окрашивания по Понсо (дополнительный рисунок 2).
Гистохимия и иммунофлуоресценция
Окрашивание АТФазы трихромом и толуидиновым синим по Гомори проводили в соответствии с установленным протоколом (Engel and Cunningham, 1963; Ogilvie and Feeback, 1990). Для распределения типов волокон было измерено столько волокон на срез, сколько четко различимо по окрашиванию толуидиновым синим. Для волокон типа 2 это было примерно 50 на слайд, для гораздо менее распространенных волокон типа 1 — примерно 10.
Для иммунофлуоресцентного окрашивания свежесрезанные криосрезы оставляли на 1 час при комнатной температуре для высыхания, а затем фиксировали в 3,7% параформальдегиде. Затем срезы промывали и блокировали 3% BSA / PBS. После этого срезы инкубировали с антителом против GLUT4 (дополнительная фигура 9), CT-3, -3 / 5; 1: 1000 в PBS (1% BSA) в течение 1 ч при комнатной температуре. Срезы инкубировали с биотином против кроличьего (1: 200) в PBS и стрептавидином-Cy3 (1: 200). Ядра визуализировали с помощью Hoechst (1: 1000 в PBS) перед размещением на предметных стеклах с помощью Aqua Mount (Thermo Fisher Scientific, Schwerte, Германия).
Изображения были получены с использованием конфокального микроскопа Zeiss LSM 700 (Zeiss, Йена, Германия) и соответствующего программного обеспечения производителя Zen 2012. Мозаичные изображения ТА были созданы с помощью микроскопа Leica DFC 420 (Leica Microsystems, Ветцлар, Германия). Количество волокон анализировали путем подсчета каждого волокна на участке.
Анализ состава тела
Состав тела измеряли с помощью анализатора ЯМР во временной области Minispec LF90 II (6,5 мГц, Bruker Optics, США).Крыс помещали в ограничительную трубку и вставляли в прибор, который измерял массу жира, массу без жира и содержание жидкости в животном.
Расчет скорости фракционного синтеза
Скорость синтеза миофибриллярного белкарассчитывалась с использованием метода предшественник-продукт (Wall et al., 2013b).
FSR (% * d − 1) = (ΔMPEmyo / (ΔMPEplasma * t)) * 100
, где FSR — скорость фракционного синтеза миофибриллярных белков, ΔMPE myo — изменение обогащения 2 H аланином, связанным с мышечным белком, ΔMPE плазмы — изменение обогащения 2 H аланином, обнаруженное в плазме и t — время.
Статистика
Статистические тесты применялись в зависимости от количества выборки и группы. Данные представлены в виде точечной диаграммы разброса с линией, указывающей среднее значение, среднее значение ± стандартное отклонение, или плавающих столбцов (от минимального до максимального значения) с линией, обозначающей среднее значение. После проверки нормальности данных применяли тест Стьюдента t или ANOVA с апостериорным тестом Тьюки в зависимости от количества групп. p — Значения ниже 0.05 были признаны значительными.
Результаты
Повреждение нерва вызывает значительную потерю мышц
Мы индуцировали повреждение седалищного нерва у здоровых самцов крыс SD. Мы наблюдали полностью развитый фенотип мышечной атрофии через 28 дней после операции (Рисунки 1A – D). Сразу после операции у животных наблюдались признаки снижения иннервации пораженной задней конечности, как и ожидалось после повреждения периферического нерва (Gigo-Benato et al., 2010). У животных не было симптомов снижения бдительности или повседневной активности.Мышцы, иннервируемые седалищным нервом, потеряли значительную массу: через 28 дней масса ТА уменьшилась на 66%, с 946 до 350 мг (Рисунок 1B), EDL на 50% с 264 до 132 мг (Рисунок 1C). В районе м. soleus (SOL) потеря массы была менее выраженной. Масса мышц снизилась с 252 до 156 мг, что составляет примерно 38% потери мышечной массы (рис. 1D). Поскольку SOL почти полностью состоит из волокон типа 1 (Gregory et al., 2001), это может указывать на преобладающую атрофию волокон типа 2 в связи с неиспользованием, а не на нейрогенную атрофию.Мы проверили это с помощью гистологического анализа.
Сразу после операции у животных наблюдались признаки снижения иннервации пораженной задней конечности, как и ожидалось после повреждения периферического нерва (Gigo-Benato et al., 2010). У животных не было симптомов снижения бдительности или повседневной активности.Мышцы, иннервируемые седалищным нервом, потеряли значительную массу: через 28 дней масса ТА уменьшилась на 66%, с 946 до 350 мг (Рисунок 1B), EDL на 50% с 264 до 132 мг (Рисунок 1C). В районе м. soleus (SOL) потеря массы была менее выраженной. Масса мышц снизилась с 252 до 156 мг, что составляет примерно 38% потери мышечной массы (рис. 1D). Поскольку SOL почти полностью состоит из волокон типа 1 (Gregory et al., 2001), это может указывать на преобладающую атрофию волокон типа 2 в связи с неиспользованием, а не на нейрогенную атрофию.Мы проверили это с помощью гистологического анализа.
РИСУНОК 1. (A) Мозаичное изображение крысы tibialis anterior , окрашенной GLUT4. (B) Повреждение нерва вызывает значительную потерю мышечной массы на длине м. tibialis anterior (TA) ( n = 10), (C) m. длинный разгибатель пальцев (EDL) ( n = 10) и (D) m. soleus (SOL) ( n = 9). ∗ п <0.05, ∗∗ p <0,01, ∗∗∗ p <0,001.
Атрофия волокон и ухудшение состава тела
Гистологический анализ на 28 день после начала повреждения нерва выявил признаки некротической миопатии с регенерирующими волокнами, волокнами с центрально расположенными ядрами, некротическими и атрофическими волокнами (рис. 2А). Диаметр Feret колеблется от 43–51 мкм в здоровых волокнах 1 типа и от 30–37 мкм в поврежденных волокнах 1 типа (рис. 2B).В волокнах типа 2а диаметр Ферета колеблется от 43–53 мкм в здоровой мышце и 28–47 мкм в поврежденной мышце (рис. 2В). Волокна типа 2b варьировались от 52 до 63 мкм в здоровой и от 29 до 43 мкм в поврежденной мышце (рис. 2В). В целом, повреждение нерва вызвало уменьшение диаметра волокна во всех трех типах волокон (рис. 2В). В нашем исследовании волокна типа 2b были затронуты больше всего, их диаметр уменьшился на 41% (± 13%) (рис. 2B). Когда волокна типа 2a и -b были сгруппированы, потеря диаметра волокна была больше, чем у волокон типа 1 (дополнительный рисунок 3).Это подтверждает, что потеря мышечной массы в основном происходит из-за атрофии волокон 2-го типа, и объясняет, почему SOL продемонстрировал наименьшее снижение мышечной массы, состоящий почти исключительно из волокон 1-го типа (Gregory et al., 2001). Подсчитывали общее количество волокон в полном поперечном сечении ТА от контрольной мышцы и мышцы с повреждением нерва. В здоровой мышце мы обнаружили 13980 ± 999 по сравнению с 13270 ± 652 волокнами в поврежденной мышце (рис. 2С). Эти данные указывают на то, что мышечная атрофия была вызвана потерей массы отдельных волокон, а не уменьшением общего количества волокон, и все это соответствовало мышечной атрофии, а не дистрофии.
2В). В целом, повреждение нерва вызвало уменьшение диаметра волокна во всех трех типах волокон (рис. 2В). В нашем исследовании волокна типа 2b были затронуты больше всего, их диаметр уменьшился на 41% (± 13%) (рис. 2B). Когда волокна типа 2a и -b были сгруппированы, потеря диаметра волокна была больше, чем у волокон типа 1 (дополнительный рисунок 3).Это подтверждает, что потеря мышечной массы в основном происходит из-за атрофии волокон 2-го типа, и объясняет, почему SOL продемонстрировал наименьшее снижение мышечной массы, состоящий почти исключительно из волокон 1-го типа (Gregory et al., 2001). Подсчитывали общее количество волокон в полном поперечном сечении ТА от контрольной мышцы и мышцы с повреждением нерва. В здоровой мышце мы обнаружили 13980 ± 999 по сравнению с 13270 ± 652 волокнами в поврежденной мышце (рис. 2С). Эти данные указывают на то, что мышечная атрофия была вызвана потерей массы отдельных волокон, а не уменьшением общего количества волокон, и все это соответствовало мышечной атрофии, а не дистрофии.
РИСУНОК 2. (A) Гистохимический анализ с помощью окрашивания трихромом по Гомори выявляет регенерирующие волокна, центрально расположенные ядра и некроз (верхняя панель). Окрашивание толуидиновым синим показывает специфичность типа волокна (нижняя панель). (B) Количественная оценка диаметра Ферета выявляет выраженную атрофию волокон типа 2b ( n = 5). (C) Нет существенной разницы в количестве мышечных волокон между поврежденной и контрольной мышцами ( n = 3). (D) Уменьшение безжировой массы тела, увеличение массы жира и повышение содержания воды в организме через 28 дней после операции ( n = 8). ∗ p <0,05, ∗∗ p <0,01, ∗∗∗ p <0,001.
Мы спросили, приводит ли атрофия, вызванная седалищным нервом, к общим изменениям в составе тела. С 0 по 28 день после операции мы обнаружили снижение безжировой массы тела на 3,7% (± 1,3%) с 75,4% (± 2,3%) до 71. 7% (± 2,9%) (Рисунок 2D). Снижение процента безжировой массы тела произошло, несмотря на тенденцию к увеличению массы тела ( p = 0,61; дополнительный рисунок 7). Уменьшение безжировой массы тела сопровождалось небольшим увеличением процентного содержания жира в организме (рис. 2D).
7% (± 2,9%) (Рисунок 2D). Снижение процента безжировой массы тела произошло, несмотря на тенденцию к увеличению массы тела ( p = 0,61; дополнительный рисунок 7). Уменьшение безжировой массы тела сопровождалось небольшим увеличением процентного содержания жира в организме (рис. 2D).
Повышенный синтез миофибриллярного белка в атрофической мышце
Оксид дейтерия был введен, а затем добавлен в обычную воду для анализа скорости фракционного синтеза миофибрилл (рис. 3А). Мы подтвердили нашу способность надежно обнаруживать аланин, меченный 2 H, в огромном количестве различных образцов мышц крыс, полученных в результате нескольких вмешательств, в которых использовался D 2 O (рис. 3B).Скорость фракционного синтеза миофибрилл увеличилась в 1,6 раза в поврежденной ноге по сравнению с контрольной ногой после 2 недель лечения D 2 O (от 3,23 ± 0,72 до 2,09 ± 0,26% * день -1 , соответственно) (Рисунок 4 ). Каждое отдельное животное ( n = 10) показало повышенную скорость синтеза мышечного белка в поврежденной ноге по сравнению с контрольной ногой (дополнительный рисунок 4). Насколько нам известно, это первое исследование, показывающее комплексное увеличение MPS в течение длительного периода потери мышечной массы.
РИСУНОК 3. (A) Принципиальная схема протокола маркировки D 2 O у крыс (слева) и мышц (справа). (B) Количественная оценка включения 2 H в m + 1 миофибриллярной фракции аланина в немеченой фоновой мышце ( n, = 4) по сравнению с мышечной, меченной D 2 O ( n = 40). (C) Схематическое изображение протокола исследования. Операция в день 0, начало эксперимента по мечению D 2 O на 14 день и оценка синтеза миофибриллярного белка между 14 и 28 днями. ∗∗∗ p <0,001.
РИСУНОК 4. Скорости фракционного синтеза миофибриллярного белка в ТА с повреждением нерва и контрлатеральном контроле ( n = 10).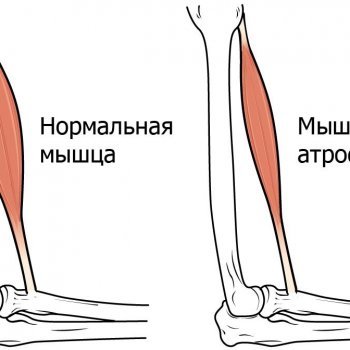 ∗∗∗ p <0,001.
∗∗∗ p <0,001.
Экспрессия ключевых сигнальных белков, регулирующих размер мышц
Протеолиз скелетных мышц частично регулируется убиквитиновым протеасомным путем E3 и его специфическими для мышц лигазами MAFbx и MuRF1 (Bodine et al., 2001). Чтобы исследовать, как ключевые сигнальные белки протеасомного пути регулируются в нашей модели, мы исследовали MAFbx и MuRF1 с помощью Вестерн-блоттинга. Экспрессия MAFbx была увеличена в четыре раза в поврежденной ноге по сравнению с контрольной ногой (от 5,3 ± 1,2 до 1,4 ± 0,4 AU, соответственно) (рис. 5A, верхняя панель). Экспрессия MuRF1 следовала аналогичной схеме ( p <0,0001) (дополнительная фигура 5). Экспрессия белка p70s6k1 увеличилась в 1,4 раза в поврежденной ноге (с 2,4 ± 0,3 до 1,8 ± 0.2 AU) (Рисунок 5A, нижняя панель). Фосфорилированный p70s6k1 не может быть обнаружен (дополнительный рисунок 6). Мы обнаружили корреляцию между экспрессией p70s6k1 и скоростью фракционного синтеза миофибрилл ( r 2 = 0,57) (рис. 6A). Корреляция для p70s6k1 и FSR не зависит от эффекта вмешательства и все еще присутствует, если анализ ограничен контрольной ногой ( r 2 = 0,65) (дополнительный рисунок 8).
РИСУНОК 5. (A) Экспрессия белка MAFbx и p70s6k1 в контралатеральном (ctrl) и поврежденном (Dmg) ТА крысы; репрезентативные изображения клякс ( n = 6). ∗∗ p <0,01, ∗∗∗ p <0,001.
РИСУНОК 6. (A) Корреляция между экспрессией белка p70s6k1 и скоростями фракционного синтеза миофибрилл (FSR) в ТА крысы ( n = 6).
Обсуждение
Наиболее распространенное предположение состоит в том, что в большинстве случаев потери мышечной массы происходит снижение синтеза белка, а также увеличение его распада (McKinnell and Rudnicki, 2004).При атрофии неиспользования и иммобилизации у людей снижение MPS, по-видимому, является преобладающим механизмом, вызывающим потерю мышечной массы (Wall et al. , 2013a; Phillips and McGlory, 2014). Снижение MPS также наблюдалось при атрофии мышц, вызванной диетой, у мужчин с ожирением, раковой кахексии, сепсисе и ожогах (Emery et al., 1984; Sakurai et al., 1995; Lang et al., 2007; Hector et al. ., 2018). В нашем исследовании мы исследовали хронические изменения MPS в ответ на мышечную атрофию, вызванную повреждением нервов. В отличие от сценариев, упомянутых выше, мы обнаружили, что частота MPS увеличивается, а не снижается во время потери мышечной массы, вызванной повреждением нервов (Рисунок 4).Ранние исследования МПС после повреждения нервов дали разные результаты. Сообщалось, что MPS временно увеличивался in vitro и in vivo Buse, Goldspink и другими (Buse et al., 1965; Goldspink, 1976, 1978). Более поздние исследования показали снижение MPS в мышцах, которые подверглись компенсаторному росту с последующей перерезкой нерва (Goldspink et al., 1983). Однако значение этих исследований сильно отличается от наших результатов. Одна из причин заключается в различиях между моделями повреждения нервов: несмотря на то, что было проделано много работы по перерезке нерва, меньше известно о хронических повреждениях сужения нерва, которые использовались в качестве модели в этом исследовании.Фактически, до сих пор ни одно исследование не изучало, как на оборот мышечного белка и MPS влияет повреждение нервного сужения. Кроме того, исследования, обнаружившие увеличение включения индикатора в EDL и SOL после перерезки нерва, были выполнены на молодых крысах (Goldspink, 1976, 1978). Подвергаясь возрастному росту, эти животные все же увеличивали абсолютную массу денервированной мышцы в ходе эксперимента (Goldspink, 1976, 1978). Результатом был замедленный рост и относительная атрофия пораженных мышц по сравнению с контрольными животными, а не абсолютная атрофия.Перед лицом системно анаболической среды повышение скорости MPS может быть менее удивительным. Мы выбрали взрослых взрослых крыс (21–22 недель) и контролировали их потребление пищи, чтобы избежать избыточной массы тела и связанного с этим увеличения мышечной массы (дополнительный рисунок 7).
, 2013a; Phillips and McGlory, 2014). Снижение MPS также наблюдалось при атрофии мышц, вызванной диетой, у мужчин с ожирением, раковой кахексии, сепсисе и ожогах (Emery et al., 1984; Sakurai et al., 1995; Lang et al., 2007; Hector et al. ., 2018). В нашем исследовании мы исследовали хронические изменения MPS в ответ на мышечную атрофию, вызванную повреждением нервов. В отличие от сценариев, упомянутых выше, мы обнаружили, что частота MPS увеличивается, а не снижается во время потери мышечной массы, вызванной повреждением нервов (Рисунок 4).Ранние исследования МПС после повреждения нервов дали разные результаты. Сообщалось, что MPS временно увеличивался in vitro и in vivo Buse, Goldspink и другими (Buse et al., 1965; Goldspink, 1976, 1978). Более поздние исследования показали снижение MPS в мышцах, которые подверглись компенсаторному росту с последующей перерезкой нерва (Goldspink et al., 1983). Однако значение этих исследований сильно отличается от наших результатов. Одна из причин заключается в различиях между моделями повреждения нервов: несмотря на то, что было проделано много работы по перерезке нерва, меньше известно о хронических повреждениях сужения нерва, которые использовались в качестве модели в этом исследовании.Фактически, до сих пор ни одно исследование не изучало, как на оборот мышечного белка и MPS влияет повреждение нервного сужения. Кроме того, исследования, обнаружившие увеличение включения индикатора в EDL и SOL после перерезки нерва, были выполнены на молодых крысах (Goldspink, 1976, 1978). Подвергаясь возрастному росту, эти животные все же увеличивали абсолютную массу денервированной мышцы в ходе эксперимента (Goldspink, 1976, 1978). Результатом был замедленный рост и относительная атрофия пораженных мышц по сравнению с контрольными животными, а не абсолютная атрофия.Перед лицом системно анаболической среды повышение скорости MPS может быть менее удивительным. Мы выбрали взрослых взрослых крыс (21–22 недель) и контролировали их потребление пищи, чтобы избежать избыточной массы тела и связанного с этим увеличения мышечной массы (дополнительный рисунок 7). В течение 4 недель после операции наши животные потеряли 66% TA по сравнению с контрлатеральной контрольной ногой и 50% массы EDL, соответственно (рисунки 1B, C). Несмотря на это значительное уменьшение мышечной массы, мы обнаружили увеличение MPS в TA в 1,6 раза (Рисунок 4).Насколько нам известно, это первое исследование, в котором обнаружено столь выраженное увеличение интегрированного МПС, несмотря на абсолютную атрофию мышцы. Это подтверждает мнение о том, что частота MPS может быть более показательной для ремоделирования мышц и продолжающейся регенерации, чем рост мышц per se (Ochala et al., 2011; Mitchell et al., 2014; Damas et al., 2016).
В течение 4 недель после операции наши животные потеряли 66% TA по сравнению с контрлатеральной контрольной ногой и 50% массы EDL, соответственно (рисунки 1B, C). Несмотря на это значительное уменьшение мышечной массы, мы обнаружили увеличение MPS в TA в 1,6 раза (Рисунок 4).Насколько нам известно, это первое исследование, в котором обнаружено столь выраженное увеличение интегрированного МПС, несмотря на абсолютную атрофию мышцы. Это подтверждает мнение о том, что частота MPS может быть более показательной для ремоделирования мышц и продолжающейся регенерации, чем рост мышц per se (Ochala et al., 2011; Mitchell et al., 2014; Damas et al., 2016).
Время для оценки оборота мышечного белка имеет решающее значение для понимания изменений мышечной массы. Хорошо известно, что изменение оборота мышечного белка в ответ на атрофический стимул динамично и зависит от множества параметров.Например, при атрофии неиспользования мышц большинство изменений в обмене мышечного белка происходит в течение первой недели после начала действия стимула (Wall et al., 2016). Считается, что МПС быстро снижается, что сопровождается быстрой потерей мышечной массы, которая постепенно уменьшается на второй и третьей неделе неиспользования (Wall et al., 2013a, b). Следовательно, оценка синтеза мышечного протеина на более позднем этапе может пропустить важные изменения. Что касается повреждения нервов, то в литературе предполагается довольно стабильная скорость потери мышечной массы (Goldspink, 1976; al-Amood et al., 1991; Ma et al., 2007). Важно отметить, что мышца продолжает терять массу до 3–12 месяцев после повреждения нерва (Wu et al., 2014). Чтобы избежать каких-либо артефактов из-за начальной воспалительной реакции, вызванной операцией, мы решили проанализировать MPS во второй половине нашего вмешательства. Мы использовали D 2 O в качестве индикатора для измерения интегрированного синтеза белка в течение 2 недель (рис. 3C). В отличие от краткосрочного эксперимента с методом постоянной инфузии или заливки, это позволило нам оценить хронические изменения МПС.
Чтобы исследовать изменения в экспрессии белка, которые могут лежать в основе наблюдаемых изменений в обмене белков, мы проанализировали ключевые сигнальные белки для синтеза и распада мышечного белка. Для синтеза мышечного белка мы сосредоточились на p70s6k1, белке, расположенном ниже mTORC1, который, как известно, увеличивает синтез белка при фосфорилировании и играет регулирующую роль в росте мышц (Baar and Esser, 1999; Saxton and Sabatini, 2017). Чтобы получить представление о передаче сигналов, лежащих в основе распада белка, мы проанализировали E3 ubiquitine ligases MAFbx и MuRF1.Это специфические для мышц белки, расположенные ниже FOXO, которые, как было показано, активируются в большинстве атрофических состояний и являются важными регуляторами потери мышечной массы (Bodine et al., 2001; Gomes et al., 2001; Bodine and Baehr, 2014). В нашей модели экспрессия белка p70s6k1 значительно увеличена в ноге с поврежденным нервом по сравнению с контрольной ногой (рис. 5A, нижняя панель). Экспрессия p70s6k1 коррелирует со скоростью фракционного синтеза миофибриллярного белка (рис. 6А). Интересно, что это все еще имеет место, когда уровни экспрессии и синтеза анализируются исключительно в контрольной ветви (дополнительный рисунок 8).Мы попытались проанализировать фосфорилированный p70s6k1, но не смогли обнаружить его ни в поврежденной, ни в контрольной ногах. Мы подтвердили отсутствие фосфорилированного p70s6k1 в наших образцах путем добавления положительных контролей (дополнительный рисунок 6). Отсутствие фосфорилированного p70s6k1 неудивительно, поскольку паттерн экспрессии, по-видимому, временный, и отбор мышечной ткани должен происходить близко к инициированию раннего стимула, чего не было в нашем исследовании (Ogasawara et al., 2013; West et al., 2016). В конце концов, в случае нашей модели атрофии данные по экспрессии белка, кажется, совпадают с данными об обмене белка из экспериментов с индикаторами.
Заключение
Таким образом, мы обнаружили, что потеря мышечной массы, вызванная повреждением нервов, в первую очередь основана на атрофии мышечных волокон, а не на потере мышечных волокон.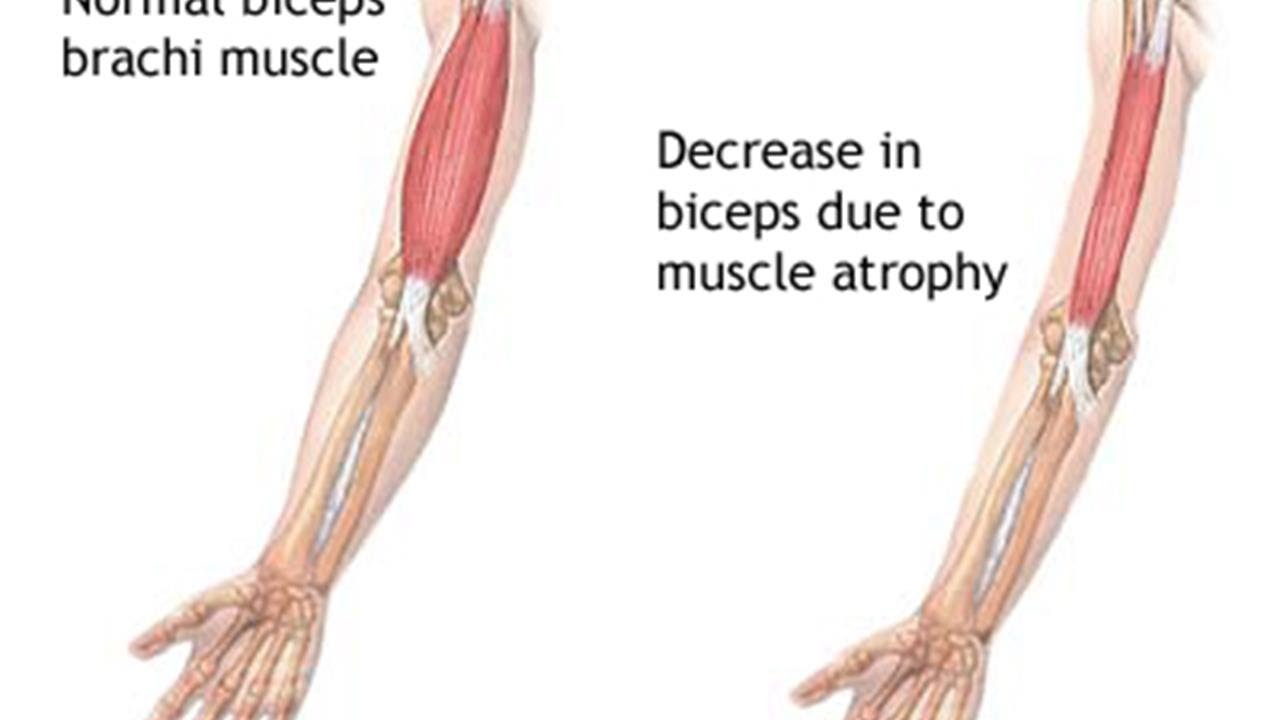 Благодаря сочетанию интеграции метода индикатора D 2 O с анализом абсолютных изменений мышечной массы, мы смогли обнаружить, что в нашей модели мышечной атрофии потеря мышечной массы сопровождается увеличением, а не снижением MPS. тарифы.Эти результаты подтверждают мнение о том, что синтез мышечного белка может отражать ремоделирование мышц и не должен использоваться в качестве косвенного показателя для прогнозирования изменений мышечной массы. В заключение, атрофия мышц, вызванная хроническим повреждением нерва, не связана со снижением показателей MPS.
Благодаря сочетанию интеграции метода индикатора D 2 O с анализом абсолютных изменений мышечной массы, мы смогли обнаружить, что в нашей модели мышечной атрофии потеря мышечной массы сопровождается увеличением, а не снижением MPS. тарифы.Эти результаты подтверждают мнение о том, что синтез мышечного белка может отражать ремоделирование мышц и не должен использоваться в качестве косвенного показателя для прогнозирования изменений мышечной массы. В заключение, атрофия мышц, вызванная хроническим повреждением нерва, не связана со снижением показателей MPS.
Авторские взносы
HL отвечал за дизайн исследования, эксперименты на животных, анализ образцов, интерпретацию данных и написание рукописи.JS, HL и AG подготовили образцы для анализа методом ГХ-МС. LvL участвовал в разработке исследования, интерпретации данных и написании рукописи. SK принимал участие в интерпретации данных. С.С. участвовал в разработке исследования, интерпретации данных и написании рукописи.
Финансирование
Исследование было поддержано Немецким исследовательским фондом (DFG) через Международную исследовательскую учебную группу по мышечным наукам (MyoGrad IGK1631) и грантом SS и HL.Французско-немецкий университет (UFA) поддержал HL посредством финансовой и образовательной поддержки. Взносы стали возможными благодаря финансированию DFG через Берлинско-Бранденбургскую школу регенеративной терапии (BSRT) GSC 203. Анализ состава тела был проведен в Центре фенотипирования Центра молекулярной медицины Макса Дельбрюка.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Адриен Роте, Моник Бергеманн, Шоаиб Афзал и Кристин Засаду за техническую помощь. Мы хотели бы поблагодарить Энди Холверда за полезное обсуждение проекта и разработки протокола маркировки.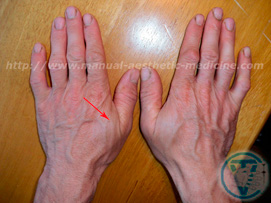 Мы также благодарим Аннет Шюрманн за предоставление нам антитела GLUT4.
Мы также благодарим Аннет Шюрманн за предоставление нам антитела GLUT4.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fphys.2018.01220 / полный # дополнительный материал
Список литературы
аль-Амуд, В. С., Льюис, Д. М., и Шмальбрух, Х. (1991). Влияние хронической электростимуляции на сократительные свойства длительно денервированных скелетных мышц крыс. J. Physiol. 441, 243–256. DOI: 10.1113 / jphysiol.1991.sp018749
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баар К., Эссер К. (1999). Фосфорилирование p70S6k коррелирует с увеличением массы скелетных мышц после упражнений с отягощениями. Am. J. Physiol. Cell Physiol. 276, C120 – C127. DOI: 10.1152 / ajpcell.1999.276.1.C120
CrossRef Полный текст | Google Scholar
Баптиста, А. Ф., Гомеш, Дж. Р., Оливейра, Дж. Т., Сантос, С. М., Ванье-Сантос, М. А., и Мартинес, А. (2008). Высокочастотная и низкочастотная чрескожная электрическая стимуляция нервов задерживает регенерацию седалищного нерва у мыши после повреждения. Дж. Перифер. Nerv. Syst. 13, 71–80. DOI: 10.1111 / j.1529-8027.2008.00160.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беннетт, Г.Дж., Се, Ю.-К. (1988). Периферическая мононевропатия у крыс, которая вызывает расстройства болевых ощущений, подобные тем, которые наблюдаются у человека. Боль 33, 87–107. DOI: 10.1016 / 0304-3959 (88) -6
CrossRef Полный текст | Google Scholar
Бодин, С. К., и Баер, Л. М. (2014). Атрофия скелетных мышц и убиквитин-лигазы E3 MuRF1 и MAFbx / атрогин-1. Am. J. Physiol. Эндокринол. Метаб. 307, E469 – E484. DOI: 10.1152 / ajpendo.00204.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бодин, С.C., Latres, E., Baumhueter, S., Lai, V.K., Nunez, L., Clarke, B.A., et al. (2001). Идентификация убиквитинлигаз, необходимых для атрофии скелетных мышц. Наука 294, 1704–1708. DOI: 10.1126 / science.1065874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бурд, Н. А., Эндрюс, Р. Дж., Уэст, Д. У., Литтл, Дж. П., Кокран, А. Дж., Гектор, А. Дж. И др. (2012). Время, проведенное мышцами при напряжении во время упражнений с отягощениями, стимулирует дифференциальные субфракционные синтетические реакции мышечного белка у мужчин. J. Physiol. 590, 351–362. DOI: 10.1113 / jphysiol.2011.221200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Busch, R., Kim, Y.K., Neese, R.A., Schade-Serin, V., Collins, M., Awada, M., et al. (2006). Измерение скорости белкового обмена с помощью тяжелой воды мечения заменимых аминокислот. Biochim. Биофиз. Acta 1760, 730–744. DOI: 10.1016 / j.bbagen.2005.12.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бусе, м.Дж., Макмастер Дж. И Бьюз Дж. (1965). Влияние денервации и инсулина на синтез белка в изолированной диафрагме крысы. Metab. Clin. Exp. 14, 1220–1232. DOI: 10.1016 / 0026-0495 (65) -2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дамас, Ф., Филлипс, С. М., Либарди, К. А., Вечин, Ф. К., Ликсандрао, М. Е., Джанниг, П. Р. и др. (2016). Вызванные тренировкой с отягощением изменения в синтезе интегрированного миофибриллярного белка связаны с гипертрофией только после ослабления повреждения мышц. J. Physiol. 594, 5209–5222. DOI: 10.1113 / JP272472
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дайк, П. (2005). Периферическая невропатия. Нью-Йорк, Нью-Йорк: Elsevier Inc.
Google Scholar
Эмери П., Эдвардс Р., Ренни М., Сухами Р. и Халлидей Д. (1984). Синтез белка в мышцах измеряется in vivo у кахектических больных раком. Br. Med. J. 289, 584–586. DOI: 10.1136 / bmj.289.6445.584
CrossRef Полный текст | Google Scholar
Энгель, В.К. и Каннингем Г. Г. (1963). Экспресс-исследование мышечной ткани Усовершенствованный метод трихрома для свежезамороженных срезов биопсии. Неврология 13, 919–923. DOI: 10.1212 / WNL.13.11.919
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарбер, К. (2016). Больше не пропадать. Лондон: Издательская группа Nature.
Google Scholar
Гасье, Х. Г., Рихман, С. Э., Виггс, М. П., Превис, С. Ф. и Флуки, Дж. Д. (2009).Сравнение затопляющей дозы 2h3O и фенилаланина для исследования синтеза мышечного белка при острой физической нагрузке у крыс. Am. J. Physiol. Эндокринол. Метаб. 297, E252 – E259. DOI: 10.1152 / ajpendo..2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джиго-Бенато Д., Руссо Т. Л., Геуна С., Домингес Н. Р., Сальвини Т. Ф. и Паризотто Н. А. (2010). Электростимуляция ухудшает раннее функциональное восстановление и усиливает атрофию скелетных мышц после повреждения седалищного нерва у крыс. Мышечный нерв 41, 685–693. DOI: 10.1002 / mus.21549
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Голдспинк, Д. (1976). Влияние денервации на белковый обмен в скелетных мышцах крыс. Biochem. J. 156, 71–80. DOI: 10.1042 / bj1560071
CrossRef Полный текст | Google Scholar
Голдспинк, Д. Ф. (1978). Изменения размера и белкового обмена в подошвенной мышце в ответ на иммобилизацию или денервацию. Лондон: Портленд Пресс Лимитед.
Google Scholar
Голдспинк, Д. Ф., Гарлик, П. Дж., И МакНурлан, М. (1983). Оборот белков измеряется in vivo и in vitro в мышцах, подвергающихся компенсаторному росту и последующей атрофии денервации. Biochem. J. 210, 89–98. DOI: 10.1042 / bj2100089
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гомес, М. Д., Лекер, С. Х., Джаго, Р. Т., Навон, А., и Голдберг, А. Л. (2001). Атрогин-1, мышечно-специфический белок F-бокса, высоко экспрессируемый во время мышечной атрофии. Proc. Nat. Акад. Sci. 98, 14440–14445. DOI: 10.1073 / pnas.251541198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грегори К. М., Ванденборн К. и Дадли Г. А. (2001). Метаболические ферменты и фенотипическую экспрессию среди мышц опорно-двигательного аппарата человека. Мышечный нерв 24, 387–393. DOI: 10.1002 / 1097-4598 (200103) 24: 3 <387 :: AID-MUS1010> 3.0.CO; 2-M
CrossRef Полный текст | Google Scholar
Гектор, А.Дж., МакГлори, К., Дамас, Ф., Мазара, Н., Бейкер, С. К., и Филлипс, С. М. (2018). Выраженное ограничение энергии с повышенным потреблением белка не приводит к изменению протеолиза и снижению синтеза белка скелетных мышц, что смягчается упражнениями с отягощениями. FASEB J. 32, 265–275. DOI: 10.1096 / fj.201700158RR
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланг, К. Х., Фрост, Р. А., и Вэри, Т. К. (2007). Регуляция синтеза мышечного белка при сепсисе и воспалении. Am. J. Physiol. Эндокринол. Метаб. 293, E453 – E459. DOI: 10.1152 / ajpendo.00204.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, Дж., Шен, Дж., Гаррет, Дж. П., Ли, К. А., Ли, З., Эльзаиди, Г. А. и др. (2007). Экспрессия генов миогенных регуляторных факторов, субъединиц никотинового ацетилхолинового рецептора и GAP-43 в скелетных мышцах после денервации на модели крыс. J. Orthop. Res. 25, 1498–1505. DOI: 10.1002 / jor.20414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маркиз, К., Debigaré, R., Lacasse, Y., LeBlanc, P., Jobin, J., Carrier, G., et al. (2002). Площадь поперечного сечения мышц с высокой мышечной массой является лучшим показателем смертности, чем индекс массы тела у пациентов с хронической обструктивной болезнью легких. Am. J. Respir. Крит. Care Med. 166, 809–813. DOI: 10.1164 / rccm.2107031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меттер, Э. Дж., Талбот, Л. А., Шрагер, М., и Конвит, Р. (2002). Сила скелетных мышц как предиктор общей смертности у здоровых мужчин. J. Gerontol. Биол. Sci. Med. Sci. 57, B359 – B365. DOI: 10.1093 / gerona / 57.10.B359
CrossRef Полный текст | Google Scholar
Митчелл, К. Дж., Черчвард-Венн, Т. А., Париз, Г., Беллами, Л., Бейкер, С. К., Смит, К. и др. (2014). Острый посттренировочный синтез миофибриллярного белка не коррелирует с гипертрофией мышц, вызванной силовыми тренировками, у молодых мужчин. PLoS One 9: e89431. DOI: 10.1371 / journal.pone.0089431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Очала, Дж., Gustafson, A.M, Diez, M.L., Renaud, G., Li, M., Aare, S., et al. (2011). Предпочтительная потеря миозина в скелетных мышцах в ответ на механическое молчание в новой модели отделения интенсивной терапии крыс: основные механизмы. J. Physiol. 589, 2007–2026. DOI: 10.1113 / jphysiol.2010.202044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огасавара Р., Кобаяси К., Цутаки А., Ли К., Абэ Т., Фудзита С. и др. (2013). Сигнальный ответ mTOR на упражнения с отягощениями изменяется хроническими тренировками с отягощениями и ослаблением скелетных мышц. J. Appl. Physiol. 114, 934–940. DOI: 10.1152 / japplphysiol.01161.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огилви Р. и Фибак Д. (1990). Метахроматический краситель АТФазный метод для одновременной идентификации волокон скелетных мышц типов I, II A, II B и II C. Stain Technol. 65, 231–241. DOI: 10.3109 / 105202905613
CrossRef Полный текст | Google Scholar
Филлипс, С. М., и МакГлори, К. (2014).Предложение о перекрестных помехах: доминирующим механизмом, вызывающим атрофию неиспользуемых мышц, является снижение синтеза белка. J. Physiol. 592, 5341–5343. DOI: 10.1113 / jphysiol.2014.273615
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рейд М.Б., судья А.Р. и Бодин С.С. (2014). Противоположная точка зрения: доминирующим механизмом, вызывающим атрофию неиспользуемых мышц, является протеолиз. J. Physiol. 592, 5345–5347. DOI: 10.1113 / jphysiol.2014.279406
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сакурай, Ю., Aarsland, A., Herndon, D. N., Chinkes, D. L., Pierre, E., Nguyen, T. T., et al. (1995). Стимуляция синтеза мышечного белка длительным введением инсулина у сильно обгоревших пациентов. Ann. Surg. 222, 283–294. DOI: 10.1097 / 00000658-199509000-00007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зоммер, К. (2013). «Модель нейропатической боли, хроническое сжатие», в энциклопедии боли , , редакторы Г. Ф. Гебхарт и Р. Ф. Шмидт (Гейдельберг: Springer).DOI: 10.1007 / 2F978-3-642-28753-4_2678
CrossRef Полный текст | Google Scholar
Томас, Д. Р. (2007). Потеря массы скелетных мышц при старении: изучение взаимосвязи голодания, саркопении и кахексии. Clin. Nutr. 26, 389–399. DOI: 10.1016 / j.clnu.2007.03.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Троммелен, Дж., Холверда, А. М., Коув, И. У., Лангер, Х., Халсон, С. Л., Ролло, И., и др. (2016). Упражнения с отягощениями увеличивают скорость синтеза мышечного белка после еды. Med. Sci. Спортивные упражнения. 48, 2517–2525. DOI: 10.1249 / MSS.0000000000001045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уолл, Б. Т., Диркс, М. Л., Снейдерс, Т., ван, Дейк Дж. В., Фрич, М., Вердейк, Л. Б. и др. (2016). Кратковременное неиспользование мышц снижает скорость синтеза миофибриллярного белка и вызывает анаболическую устойчивость к потреблению белка. Am. J. Physiol. Эндокринол. Метаб. 310, E137 – E147. DOI: 10.1152 / ajpendo.00227.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стена, Б.Т., Диркс, М. Л., и ван Лун, Л. Дж. (2013a). Атрофия скелетных мышц при кратковременном неиспользовании: последствия для возрастной саркопении. Aging Res. Ред. 12, 898–906. DOI: 10.1016 / j.arr.2013.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уолл, Б. Т., Снейдерс, Т., Зенден, Дж. М., Оттенброс, К. Л., Гийсен, А. П., Вердейк, Л. Б. и др. (2013b). Неиспользование нарушает синтетический ответ мышечного белка на потребление белка у здоровых мужчин. Дж.Clin. Эндокринол. Метаб. 98, 4872–4881. DOI: 10.1210 / jc.2013-2098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ваннамэти С.Г., Шейпер А.Г., Леннон Л. и Уинкап П.Х. (2007). Снижение мышечной массы и повышенное центральное ожирение независимо связаны со смертностью пожилых мужчин. Am. J. Clin. Nutr. 86, 1339–1346. DOI: 10.1093 / ajcn / 86.5.1339
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вест, Д.W., Baehr, L.M., Marcotte, G.R., Chason, C.M., Tolento, L., Gomes, A.V. и др. (2016). Острые упражнения с отягощениями активируют чувствительные и нечувствительные к рапамицину механизмы, которые контролируют трансляционную активность и емкость скелетных мышц. J. Physiol. 594, 453–468. DOI: 10.1113 / JP271365
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уилкинсон, Д. Дж., Франчи, М. В., Брук, М. С., Наричи, М. В., Уильямс, Дж. П., Митчелл, В. К. и др. (2014).Подтверждение применения методов индикатора стабильного изотопа D (2) O для мониторинга ежедневных изменений в синтезе субфракций мышечного белка у людей. Am. J. Physiol. Эндокринол. Метаб. 306, E571 – E579. DOI: 10.1152 / ajpendo.00650.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, P., Chawla, A., Spinner, R.J., Yu, C., Yaszemski, M.J., Windebank, A.J., et al. (2014). Ключевые изменения денервированных мышц и их влияние на регенерацию и реиннервацию. Neural Regen. Res. 9, 1796–1809. DOI: 10.4103 / 1673-5374.143424
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ярашески К. Э., Захвейя Дж. Дж. И Бир Д. М. (1993). Острое влияние упражнений с отягощениями на скорость синтеза мышечного белка у молодых и пожилых мужчин и женщин. Am. J. Physiol. 265, E210 – E214. DOI: 10.1152 / ajpendo.1993.265.2.E210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Механизмы атрофии и гипертрофии мышц: последствия для здоровья и болезней
Баскин, К. К., Виндерс, Б. Р. и Олсон, Э. Н. Мышцы как «посредник» системного метаболизма. Cell Metab. 21 , 237–248 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Sandri, M. et al. PGC-1alpha защищает скелетные мышцы от атрофии, подавляя действие FoxO3 и транскрипцию специфичных для атрофии генов. Proc. Natl Acad. Sci. США 103 , 16260–16265 (2006).
ADS CAS PubMed Статья PubMed Central Google Scholar
Brocca, L. et al. FoxO-зависимые атрогены различаются в зависимости от катаболических состояний и играют ключевую роль в атрофии мышц, вызванной подвешиванием задних конечностей. J. Physiol. 595 , 1143–1158 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Grumati, P. et al. Физические упражнения стимулируют аутофагию в нормальных скелетных мышцах, но вредны для мышц с дефицитом коллагена VI. Аутофагия 7 , 1415–1423 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Лю, Г. Ю. и Сабатини, Д. М. mTOR на стыке питания, роста, старения и болезней. Нат. Rev. Mol. Cell Biol. 21 , 183–203 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Musaro, A. et al. Локальная экспрессия трансгена Igf-1 поддерживает гипертрофию и регенерацию стареющих скелетных мышц. Нат. Genet. 27 , 195–200 (2001).
CAS PubMed Статья PubMed Central Google Scholar
Ascenzi, F. et al.Влияние изоформ IGF-1 на рост мышц и саркопению. Ячейка старения 18 , e12954 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Murgia, M. et al. Ras участвует в зависимой от нервной активности регуляции мышечных генов. Нат. Cell Biol. 2 , 142–147 (2000).
CAS PubMed Статья PubMed Central Google Scholar
Pallafacchina, G., Calabria, E., Serrano, A. L., Kalhovde, J. M. & Schiaffino, S. Зависимый от протеинкиназы B и чувствительный к рапамицину путь контролирует рост скелетных мышц, но не определение типа волокна. Proc. Natl Acad. Sci. США 99 , 9213–9218 (2002).
ADS CAS PubMed Статья PubMed Central Google Scholar
Blaauw, B. et al. Индуцируемая активация Akt увеличивает массу и силу скелетных мышц без активации сателлитных клеток. Faseb J. 23 , 3896–3905 (2009).
CAS PubMed Статья Google Scholar
Bentzinger, C. F. et al. Специфическое для скелетных мышц удаление хищника, но не риктора, вызывает метаболические изменения и приводит к мышечной дистрофии. Cell Metab. 8 , 411–424 (2008).
CAS PubMed Статья Google Scholar
Risson, V. et al. Мышечная инактивация mTOR вызывает метаболические и дистрофиновые дефекты, приводящие к тяжелой миопатии. J. Cell Biol. 187 , 859–874 (2009).
CAS PubMed PubMed Central Статья Google Scholar
You, J. S. et al. Роль хищника в индуцированной механической нагрузкой регуляции передачи сигналов mTOR, синтеза белка и гипертрофии скелетных мышц. FASEB J. 33 , 4021–4034 (2019).
CAS PubMed Статья Google Scholar
Zhang, Q. et al. Недостаток мышечной активности киназы mTOR вызывает раннее начало миопатии и нарушает гомеостаз всего тела. J. Cachexia Sarcopenia Muscle 10 , 35–53 (2019).
PubMed Статья Google Scholar
Castets, P. et al. Устойчивая активация mTORC1 в скелетных мышцах подавляет конститутивную аутофагию и аутофагию, вызванную голоданием, и вызывает тяжелую миопатию с поздним началом. Cell Metab. 17 , 731–744 (2013).
CAS PubMed Статья Google Scholar
Макферрон, А. К., Лоулер, А. М. и Ли, С. Дж. Регулирование массы скелетных мышц у мышей новым членом суперсемейства TGF-бета. Nature 387 , 83–90 (1997).
ADS CAS PubMed Статья Google Scholar
Sartori, R. et al. Факторы транскрипции Smad2 и 3 контролируют мышечную массу в зрелом возрасте. Am. J. Physiol. Cell Physiol. 296 , C1248 – C1257 (2009).
CAS PubMed Статья Google Scholar
Winbanks, C.E. et al. Фоллистатин-опосредованная гипертрофия скелетных мышц регулируется Smad3 и mTOR независимо от миостатина. J. Cell Biol. 197 , 997–1008 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Sartori, R. et al. Передача сигналов BMP контролирует мышечную массу. Нат. Genet. 45 , 1309–1318 (2013).
CAS PubMed Статья Google Scholar
Traore, M. et al. Эмбриональная изоформа CaVbeta1 способствует поддержанию мышечной массы посредством передачи сигналов GDF5 у взрослых мышей. Sci. Пер. Med. 11 , eaaw1131 (2019).
CAS PubMed Статья Google Scholar
Winbanks, C.E. et al. Доставка гена Smad7 предотвращает мышечное истощение, связанное с раковой кахексией у мышей. Sci. Пер. Med. 8 , 348ra398 (2016).
Артикул CAS Google Scholar
Дэви, Дж.R. et al. Комплексный анализ экспрессии мышечной гипертрофии определяет Asb2 как негативный регулятор мышечной массы. JCI Insight 1 , e85477 (2016).
PubMed PubMed Central Статья Google Scholar
Winbanks, C.E. et al. Ось костного морфогенетического белка является положительным регулятором массы скелетных мышц. J. Cell Biol. 203 , 345–357 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Клайн, В. О., Панаро, Ф. Дж., Янг, Х. и Бодин, С. С. Рапамицин подавляет рост и эффекты кленбутерола в отношении сохранения мышц. J. Appl. Physiol. 102 , 740–747 (2007).
CAS PubMed Статья Google Scholar
Goncalves, D. A. et al. Передача сигналов инсулина / IGF1 опосредует эффекты бета2-адренергического агониста на протеостаз и рост мышц. J. Cachexia Sarcopenia Muscle 10 , 455–475 (2019).
PubMed PubMed Central Статья Google Scholar
Benoit, B. et al. Фактор роста фибробластов 19 регулирует массу скелетных мышц и уменьшает мышечное истощение у мышей. Нат. Med. 23 , 990–996 (2017).
CAS PubMed Статья Google Scholar
Ост, Л. Дж., Кустерманн, М., Армани, А., Блаау, Б. и Романелло, В.Фактор роста фибробластов 21 контролирует митофагию и мышечную массу. J. Cachexia Sarcopenia Muscle 10 , 630–642 (2019).
PubMed PubMed Central Статья Google Scholar
Коэн, С., Ли, Д., Чжай, Б., Гайги, С. П. и Голдберг, А. Л. Trim32 снижает передачу сигналов PI3K-Akt-FoxO при мышечной атрофии, способствуя диссоциации плакоглобина-PI3K. J. Cell Biol. 204 , 747–758 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Summermatter, S. et al. Блокада металлотионеинов 1 и 2 увеличивает массу и силу скелетных мышц. Мол. Cell Biol. 37 , e00305-16 (2017).
Wang, G. et al. Метастатический рак способствует кахексии за счет активации ZIP14 в скелетных мышцах. Нат. Med. 24 , 770–781 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Mammucari, C. et al. Митохондриальный унипортер кальция контролирует трофику скелетных мышц in vivo. Cell Rep. 10 , 1269–1279 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Ruas, J. L. et al. Изоформа PGC-1альфа, индуцированная тренировкой с отягощениями, регулирует гипертрофию скелетных мышц. Ячейка 151 , 1319–1331 (2012).
CAS PubMed PubMed Central Статья Google Scholar
White, J. P. et al. Рецептор 56, связанный с G-белком, регулирует гипертрофию мышц, вызванную механической перегрузкой. Proc. Natl Acad. Sci. США 111 , 15756–15761 (2014).
ADS CAS PubMed Статья Google Scholar
Das, S. et al. Цитратлиаза АТФ улучшает функцию митохондрий в скелетных мышцах. Cell Metab. 21 , 868–876 (2015).
CAS PubMed Статья Google Scholar
Cai, X. et al. Альфа-кетоглутарат способствует гипертрофии скелетных мышц и синтезу белка через сигнальные пути Akt / mTOR. Sci. Отчет 6 , 26802 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Lahiri, S. et al. Микробиота кишечника влияет на массу и функцию скелетных мышц у мышей. Sci. Пер. Med. 11 , eaan5662 (2019).
Hunt, L.C. et al. Ключевая роль убиквитинлигазы UBR4 в гипертрофии миофибрилл у дрозофилы и мышей. Cell Rep. 28 , 1268–1281 e1266 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Conte, M. et al. Специфичное для мышц подавление перилипина2 влияет на метаболизм липидов и вызывает гипертрофию миофибрилл. J. Cachexia Sarcopenia Muscle 10 , 95–110 (2019).
PubMed Статья Google Scholar
Bodine, S.C. et al. Идентификация убиквитинлигаз, необходимых для атрофии скелетных мышц. Наука 294 , 1704–1708 (2001).
ADS CAS PubMed Статья Google Scholar
Pankiv, S. et al. p62 / SQSTM1 связывается непосредственно с Atg8 / LC3, облегчая деградацию убиквитинированных белковых агрегатов за счет аутофагии. J. Biol. Chem. 282 , 24131–24145 (2007).
CAS PubMed Статья Google Scholar
Сандри, М. Распад белка при мышечном истощении: роль аутофагии-лизосомы и убиквитин-протеасомы. Внутр. J. Biochem Cell Biol. 45 , 2121–2129 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Коэн, С., Натан, Дж. А. и Голдберг, А. Л. Мышечное истощение при болезни: молекулярные механизмы и перспективные методы лечения. Нат. Rev. Drug Discov. 14 , 58–74 (2015).
CAS PubMed Статья Google Scholar
Cadena, S. M. et al. Скелетные мышцы мышей, нулевых по MuRF1, не защищены в условиях низкой гравитации, что указывает на то, что атрофия происходит с помощью уникальных механизмов в космосе. Sci. Отчетность 9 , 9397 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar
Баер, Л. М., Ферлоу, Дж. Д. и Бодин, С. С. Сохранение мышц в мышцах Нулевых мышей RING finger 1: ответ на синтетические глюкокортикоиды. J. Physiol. 589 , 4759–4776 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Хви, Д. Т., Баер, Л. М., Филп, А., Баар, К. и Бодин, С. С. Поддержание мышечной массы и индуцированный нагрузкой рост в мышцах нулевых мышей RING Finger 1 с возрастом. Ячейка старения 13 , 92–101 (2014).
CAS PubMed Статья PubMed Central Google Scholar
Sandri, M. et al. Сигнальные пути, регулирующие мышечную массу в стареющих скелетных мышцах. Роль пути IGF1-Akt-mTOR-FoxO. Биогеронтология 14 , 303–323 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Cohen, S., Zhai, B., Gygi, S.P. & Goldberg, A.L. Убиквитилирование с помощью Trim32 вызывает сопряженную потерю десмина, Z-полос и тонких нитей при атрофии мышц. J. Cell Biol. 198 , 575–589 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Di Rienzo, M. et al. Для индукции аутофагии в атрофических мышечных клетках требуется активация ULK1 с помощью TRIM32 через незакрепленные цепи полиубиквитина, связанные с K63. Sci. Adv. 5 , eaau8857 (2019).
ADS CAS PubMed PubMed Central Статья Google Scholar
Paul, P. K. et al. Целенаправленное удаление TRAF6 подавляет истощение скелетных мышц у мышей. J. Cell Biol. 191 , 1395–1411 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Paul, P. K. et al. Убиквитинлигаза E3 TRAF6 вмешивается в вызванную голоданием атрофию скелетных мышц посредством множества механизмов. Мол. Cell Biol. 32 , 1248–1259 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Carnio, S.и другие. Нарушение аутофагии в мышцах вызывает дегенерацию нервно-мышечных соединений и преждевременное старение. Cell Rep. 8 , 1509–1521 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Bujak, A. L. et al. AMPK-активация мышечной аутофагии предотвращает гипогликемию и миопатию, вызванные голоданием, во время старения. Cell Metab. 21 , 883–890 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Raben, N. et al. Подавление аутофагии в скелетных мышцах раскрывает накопление убиквитинированных белков и их потенциальную роль в повреждении мышц при болезни Помпе. Гум. Мол. Genet. 17 , 3897–3908 (2008).
CAS PubMed PubMed Central Статья Google Scholar
Немазаный И.И. и др. Дефекты Vps15 в скелетных мышцах приводят к аутофагической вакуолярной миопатии и лизосомной болезни. EMBO Mol. Med. 5 , 870–890 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Fuqua, J. D. et al. ULK2 необходим для деградации убиквитинированных белковых агрегатов и гомеостаза в скелетных мышцах. FASEB J 33 , 11735–12745 (2019).
Ryu, D. et al. Уролитин А вызывает митофагию и увеличивает продолжительность жизни у C.elegans и увеличивает мышечную функцию у грызунов. Нат. Med. 22 , 879–888 (2016).
CAS PubMed Статья Google Scholar
Milan, G. et al. Регулирование аутофагии и убиквитин-протеасомной системы транскрипционной сетью FoxO во время мышечной атрофии. Нат. Commun. 6 , 6670 (2015).
ADS CAS PubMed PubMed Central Статья Google Scholar
Ли Д., Такаяма С. и Голдберг А. Л. ZFAND5 / ZNF216 является активатором протеасомы 26S, который стимулирует общую деградацию белка. Proc. Natl Acad. Sci. США 115 , E9550 – E9559 (2018).
CAS PubMed Статья Google Scholar
VerPlank, J. J. S., Lokireddy, S., Zhao, J. & Goldberg, A. L. 26S протеасомы быстро активируются различными гормонами и физиологическими состояниями, которые повышают цАМФ и вызывают фосфорилирование Rpn6. Proc. Natl Acad. Sci. США 116 , 4228–4237 (2019).
Piccirillo, R. & Goldberg, A. L. АТФаза p97 / VCP имеет решающее значение при атрофии мышц и ускоренной деградации мышечных белков. EMBO J. 31 , 3334–3350 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Wang, C. et al. Метилтрансферазоподобный 21c метилирует и стабилизирует белок теплового шока Hspa8 в миофибриллах I типа у мышей. J. Biol. Chem. 294 , 13718–13728 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Wiederstein, J. L. et al. Метилтрансфераза METTL21C, специфичная для скелетных мышц, триметилирует p97 и регулирует распад белка, связанный с аутофагией. Cell Rep. 23 , 1342–1356 (2018).
CAS PubMed Статья Google Scholar
O’Neill, B.T. et al. Факторы транскрипции FoxO являются критическими регуляторами мышечной атрофии, связанной с диабетом. Диабет 68 , 556–570 (2019).
PubMed Статья CAS Google Scholar
Segales, J. et al. Сестрин предотвращает атрофию вышедших из употребления и стареющих мышц, интегрируя анаболические и катаболические сигналы. Нат. Commun. 11 , 189 (2020).
ADS CAS PubMed PubMed Central Статья Google Scholar
Beharry, A. W. et al. HDAC1 активирует FoxO и является достаточным и необходимым для атрофии скелетных мышц. J. Cell Sci. 127 , 1441–1453 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Бертаджа Э., Колетто Л. и Сандри М. Посттрансляционные модификации контролируют активность FoxO3 во время денервации. Am. J. Physiol. Cell Physiol. 302 , C587 – C596 (2012).
CAS PubMed Статья Google Scholar
Браулт, Дж. Дж., Джесперсен, Дж. Г. и Голдберг, А. Л. Гамма-коактиватор рецептора, активируемого пролифератором пероксисом, гиперэкспрессия 1альфа или 1бета ингибирует деградацию мышечного белка, индукцию убиквитинлигаз и атрофию неиспользования. J. Biol. Chem. 285 , 19460–19471 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Raffaello, A. et al. Фактор транскрипции JunB поддерживает массу скелетных мышц и способствует гипертрофии. J. Cell Biol. 191 , 101–113 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Yin, J. et al. Dkk3-зависимая регуляция транскрипции контролирует возрастную атрофию скелетных мышц. Нат. Commun. 9 , 1752 (2018).
ADS PubMed PubMed Central Статья CAS Google Scholar
Shimizu, N. et al. Перекрестные помехи между рецептором глюкокортикоидов и датчиком питания mTOR в скелетных мышцах. Cell Metab. 13 , 170–182 (2011).
CAS PubMed Статья Google Scholar
Cai, D. et al. Активация IKKbeta / NF-kappaB вызывает тяжелое мышечное истощение у мышей. Cell 119 , 285–298 (2004).
CAS PubMed Статья Google Scholar
Mittal, A. et al. Система TWEAK-Fn14 является критическим регулятором вызванной денервацией атрофии скелетных мышц у мышей. J. Cell Biol. 188 , 833–849 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Bonetto, A. et al. Ингибирование пути JAK / STAT3 блокирует истощение скелетных мышц ниже IL-6 и при экспериментальной кахексии рака. Am. J. Physiol. Эндокринол.Метаб. 303 , E410 – E421 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Ebert, S. M. et al. Вызванная стрессом экспрессия Gadd45a в скелетных мышцах перепрограммирует миоядра и вызывает атрофию мышц. J. Biol. Chem. 287 , 27290–27301 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Gallot, Y. S. et al. PERK регулирует массу скелетных мышц и сократительную функцию у взрослых мышей. FASEB J. 33 , 1946–1962 (2019).
CAS PubMed Статья Google Scholar
Bohnert, K. R. et al. Ось передачи сигналов toll-подобного рецептора / MyD88 / XBP1 опосредует истощение скелетных мышц во время раковой кахексии. Мол. Ячейка Биол . 39 , e00184-19 (2019).
Tezze, C. et al. Связанная с возрастом потеря OPA1 в мышцах влияет на мышечную массу, метаболический гомеостаз, системное воспаление и старение эпителия. Cell Metab. 25 , 1374–1389 e1376 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Favaro, G. et al. DRP1-опосредованная форма митохондрий контролирует гомеостаз кальция и мышечную массу. Нат. Commun. 10 , 2576 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar
Choi, S. et al. Специфическая для скелетных мышц делеция Prmt1 вызывает атрофию мышц за счет нарушения регуляции оси PRMT6-FOXO3. Аутофагия 15 , 1069–1081 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Сегатто, М.и другие. Эпигенетическое нацеливание на белок бромодомена BRD4 противодействует раковой кахексии и продлевает выживаемость. Нат. Commun. 8 , 1707 (2017).
ADS PubMed PubMed Central Статья CAS Google Scholar
Bowman, C.J., Ayer, D. E. и Dynlacht, B. D. Белки Foxk подавляют запуск программ атрофии и аутофагии, вызванных голоданием. Нат. Cell Biol. 16 , 1202–1214 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Sun, L. et al. Длинная некодирующая РНК Atrolnc-1 способствует истощению мышц у мышей с хроническим заболеванием почек. J. Cachexia Sarcopenia Muscle 9 , 962–974 (2018).
PubMed PubMed Central Статья Google Scholar
Kravic, B. et al. В скелетных мышцах млекопитающих фосфорилирование TOMM22 протеинкиназой CSNK2 / CK2 контролирует митофагию. Аутофагия 14 , 311–335 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Pin, F. et al. PDK4 вызывает метаболические изменения и атрофию мышц при раковой кахексии. FASEB J. 33 , 7778–7790 (2019).
CAS PubMed PubMed Central Статья Google Scholar
He, W. A. et al. Опосредованная NF-kappaB нарушение регуляции Pax7 в мышечном микроокружении способствует раковой кахексии. J. Clin. Расследование. 123 , 4821–4835 (2013).
CAS PubMed Статья Google Scholar
Parajuli, P. et al. Активация Twist1 в мышечных клетках-предшественниках вызывает потерю мышечной массы, подобную раковой кахексии. Dev. Ячейка 45 , 712–725 e716 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Madaro, L. et al. Активированная денервацией передача сигналов STAT3-IL-6 в фибро-адипогенных предшественниках способствует атрофии и фиброзу миофибрилл. Нат. Cell Biol. 20 , 917–927 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Zhang, G. et al. Опухоль вызывает истощение мышц у мышей за счет высвобождения внеклеточных Hsp70 и Hsp90. Нат. Commun. 8 , 589 (2017).
ADS PubMed PubMed Central Статья CAS Google Scholar
Ekelund, U. et al. Уменьшает ли физическая активность или даже устраняет вредную связь времени сидения со смертностью? Гармонизированный мета-анализ данных более чем 1 миллиона мужчин и женщин. Ланцет 388 , 1302–1310 (2016).
Артикул Google Scholar
Чакраварти, Э. Ф., Хуберт, Х. Б., Лингала, В. Б. и Фрис, Дж. Ф. Снижение инвалидности и смертности среди стареющих бегунов: 21-летнее продольное исследование. Arch. Междунар. Med. 168 , 1638–1646 (2008).
PubMed PubMed Central Статья Google Scholar
Hall, D. T. et al. Агонист AMPK 5-аминоимидазол-4-карбоксамид рибонуклеотид (AICAR), но не метформин, предотвращает связанное с воспалением кахектическое истощение мышц. EMBO Mol. Med. 10 , e8307 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Mills, K. F. et al. Длительное введение никотинамидмононуклеотида снижает физиологический спад у мышей, связанный с возрастом. Cell Metab. 24 , 795–806 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Wagner, K. R. et al. Испытание фазы I / II MYO-029 у взрослых с мышечной дистрофией. Ann. Neurol. 63 , 561–571 (2008).
CAS PubMed Статья Google Scholar
Golan, T. et al. LY2495655, антитело к антимиостатину, при раке поджелудочной железы: рандомизированное исследование фазы 2. J. Cachexia Sarcopenia Muscle 9 , 871–879 (2018).
PubMed PubMed Central Статья Google Scholar
Porporato, P.E. et al. Ацилированный и неацилированный грелин ухудшают атрофию скелетных мышц у мышей. J. Clin. Расследование. 123 , 611–622 (2013).
CAS PubMed Google Scholar
Garcia, J. M. et al. Анаморелин для пациентов с раковой кахексией: комплексный анализ двух рандомизированных плацебо-контролируемых двойных слепых исследований фазы 2. Ланцет Онкол. 16 , 108–116 (2015).
CAS PubMed Статья Google Scholar
Baraldo, M. et al. Скелетная мышца mTORC1 регулирует стабильность нервно-мышечного соединения. J. Cachexia Sarcopenia Muscle 11 , 208–225 (2019).
Pietrocola, F. et al. Спермидин вызывает аутофагию, ингибируя ацетилтрансферазу EP300. Cell Death Differ. 22 , 509–516 (2015).
CAS PubMed Статья Google Scholar
Koeberl, D. D. et al. Коррекция биохимических нарушений и улучшение мышечной функции в клинических испытаниях фазы I / II кленбутерола при болезни Помпе. Мол. Ther. 26 , 2304–2314 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Adams, V. et al. Опосредованное низкими молекулами химическое подавление MuRF1 / MuRF2 и ослабление дисфункции диафрагмы при хронической сердечной недостаточности. J. Cachexia Sarcopenia Muscle 10 , 1102–1115 (2019).
PubMed PubMed Central Статья Google Scholar
Мышечная атрофия и гипертрофия | Фитнес и здоровье на всю жизнь
Мышечная атрофия — это уменьшение мышечной массы; мышечная гипертрофия — это увеличение мышечной массы за счет увеличения размера мышечных клеток.
ЦЕЛЬ ОБУЧЕНИЯ
К концу этого раздела вы сможете:
- Различия между мышечной атрофией и гипертрофией
Основные выводы
Ключевые моменты
- Атрофия мышц означает уменьшение мышечной массы, ведущее к мышечной слабости или снижению способности создавать силу.
- Атрофия возникает по нескольким причинам, включая болезнь, голод и простое неиспользование.
- Гипертрофия мышц отличается от гиперплазии мышц, которая представляет собой образование новых мышечных клеток.
- Ряд стимулов может вызвать гипертрофию мышечных клеток, включая силовые или анаэробные тренировки.
- Биологические факторы, такие как возраст и питание, могут влиять на гипертрофию мышц.
Глоссарий
атрофия : увядать или истощаться.
дистрофия : истощение тканей тела генетического происхождения или из-за неадекватного или неполноценного питания.
саркопения : Возрастная потеря скелетных мышц, приводящая к слабости. Часто обнаруживается вместе с остеопорозом, потерей костной ткани, которая также связана с процессом старения.
Мышечная атрофия — это снижение мышечной силы из-за уменьшения мышечной массы или количества мышечных волокон. Атрофия может быть частичной или полной, различающейся степенью мышечной слабости.Атрофия мышц часто является результатом таких заболеваний, как рак, СПИД, застойная сердечная недостаточность, хроническая обструктивная болезнь легких, почечная недостаточность и ожоги. Голодание также может привести к атрофии мышц. Простое неиспользование мышц из-за малоподвижного образа жизни или из-за постельного режима также может вызвать атрофию мышц.
Атрофия мышц в некоторой степени типична при старении. Атрофия со временем из-за старения известна как саркопения. Хотя это не совсем ясно, предполагается, что причиной саркопении является сочетание снижения количества сателлитных клеток для регенерации клеток волокон скелетных мышц, а также снижение чувствительности или доступности гормонов, включая факторы роста, которые стимулируют поддерживающие мышцы через регенерация клеток мышечных волокон из клеток-сателлитов.
Потеря мышечной массы не из-за атрофии или саркопении свидетельствует о заболеваниях, которые приводят к структурным дефектам мышц (мышечная дистрофия) или аутоиммунным реакциям, ухудшающим структуру мышц (миопатии).
Гипертрофия мышц — это увеличение размера мышцы за счет увеличения размера составляющих ее клеток. Он отличается от гиперплазии мышц, то есть образования новых мышечных клеток. В зависимости от типа тренировки гипертрофия может происходить из-за увеличения объема саркоплазмы или увеличения сократительных белков.
Ряд стимулов может увеличить объем мышечных клеток, в том числе силовая тренировка или анаэробная тренировка. Эти изменения происходят как адаптивная реакция, которая увеличивает способность создавать силу или противостоять утомлению в анаэробных условиях.
Несколько биологических факторов, таких как возраст и питание, могут влиять на гипертрофию мышц. В период полового созревания у мужчин гипертрофия происходит с повышенной скоростью. Естественная гипертрофия обычно прекращается при полном росте в позднем подростковом возрасте. Достаточное количество аминокислот необходимо для гипертрофии мышц.Поскольку тестостерон является одним из основных гормонов роста организма, в среднем мужчинам легче достичь гипертрофии, чем женщинам. Дополнительный прием тестостерона, как и в случае с анаболическими стероидами, улучшит результаты. Он также считается препаратом для повышения производительности, использование которого может привести к отстранению участников от соревнований или их запрету на участие в соревнованиях. Кроме того, в большинстве стран тестостерон является регулируемым медицинским веществом, поэтому его хранение без рецепта является незаконным.
Нормальные и атрофированные саркомеры: схема расположения волокон в нормальных функциональных саркомерах в сравнении с атрофированными саркомерами после 17-дневного космического полета
Рекомендуемое диагностическое обследование при атрофии
Что такое атрофия мышц?
Атрофия мышц — это не отдельное заболевание, это просто потеря мышечной массы, которая может иметь ряд клинических проявлений и основных причин.Эта сложность может затруднить диагностику основной причины и надлежащее лечение.
Что вызывает атрофию мышц?
Мышечную атрофию можно разделить на три большие категории в зависимости от основной причины атрофии. Атрофия мышц может быть вызвана:
- проблема в нерве, иннервирующем мышцу (нейрогенный),
- повреждение мышечных волокон (миогенное) или
- системное заболевание, вызывающее общую потерю веса.
В каждой категории могут быть определенные заболевания, поражающие нервы, мышцы или массу тела, как указано ниже:
(1) Атрофия мышц лопатки из-за повреждения нерва.
(2) Миопатии
- Тяжелый рабдомиолиз
- Полисахаридная накопительная миопатия (PSSM) — гомозиготы с двумя копиями мутации могут иметь атрофию верхних отделов позвоночника
- Воспалительный миозит — болезнь Лайма
- Иммуно-опосредованный миозит (IMM)
- Окрашенная вакуолярная миопатия
- Болезнь Кушинга
- Миопатия с дефицитом витамина Е
(3) Системное заболевание
- Хронические инфекции
- Дегенеративные заболевания
- Нарушение всасывания
- Хроническая гранулематозная болезнь (саркоидоз)
- Лимфосаркома или другие опухоли
- Многие другие
Как лучше всего найти причину атрофии мышц?
Важно определить причину атрофии мышц, чтобы определить наиболее подходящий план лечения.Во-первых, необходимо собрать подробный анамнез, включая скорость начала, продолжительность, предыдущие эпизоды атрофии или привязанности, аппетит, диету (включая добавление витаминов / минералов), изменения в отношении и частоту лежания. Во-вторых, необходимо провести физический осмотр лошади, чтобы определить, вызвана ли потеря мышечной массы (1) невропатическим, (2) миопатическим или (3) системным заболеванием. Поставив лошадь ровно на ровной поверхности, оцените степень потери мышц сбоку и сзади.В некоторых случаях легкой атрофии легче почувствовать степень атрофии, чем увидеть ее. Следует пройти устный экзамен с осмотром зубов, жевательных мышц и височных мышц. Все группы мышц следует исследовать на предмет тонуса, боли и подергивания. Неврологический осмотр может определить, есть ли слабость или атаксия.
Наконец, некоторые диагностические тесты могут быть подходящими на основе истории болезни, клинических признаков и предполагаемого типа миопатии. Диагностическое дерево атрофии мышц представлено ниже для предложений.
К потенциально полезным диагностическим тестам относятся:
- Ультразвук: помогает определить степень и глубину атрофии очаговых мышц. Сравните левую и правую стороны в одном месте, чтобы оценить степень поражения мышц.
- Электромиография (ЭМГ). Если возможно, это может идентифицировать мышцы с нейрогенной атрофией по наличию положительных острых волн и аномальных электрических потенциалов
- Активность СК и АСТ. Исключить миодегенеративные процессы, такие как IMM или тяжелый рабдомиолиз
- Витамин E в сыворотке — исключить EMND, миопатию, вызванную дефицитом витамина E
- GYS1 генетический тест на PSSM 1 типа.Генетический тест доступен для лошадей с тяжелой хронической атрофией линии верха или сквозняков с генерализованной атрофией
- Тест на подавление АКТГ или дексаметазона при подозрении на потерю мышечной массы, связанную с Кушингом.
- Биопсия мышцы дает информацию о типе, причине и тяжести атрофии на клеточном уровне, а также о вероятности регенерации мышц, как указано ниже.
Как биопсия мышц помогает лошади с атрофией мышц? Какую мышцу следует биопсировать?
Биопсия мышц может отличить нейрогенную и миогенную атрофию, предоставить информацию о степени дегенерации и регенерации мышц, степени фиброза, которая предотвратит атрофию и поможет определить причину.Информация, полученная при биопсии мышц, может направлять и контролировать программы лечения. При отправке биопсии мышцы крайне важно провести биопсию правильной мышцы (мышц) для предполагаемого типа атрофии.
1) При генерализованной атрофии и подозрении на EMND рекомендуется биопсия крестцовой мышцы.
2) При атрофии мышц линии верха и подозрении на иммуноопосредованную миопатию рекомендуется выполнить две биопсии;
а. Биопсия свежей полуперепончатой кости
,00
б. Фиксированные формалином образцы TruCut (размер 14) эпаксиальных мышц.
3) Для оценки атрофии очаговых мышц настоятельно рекомендуется свежая открытая биопсия конкретной пораженной группы мышц.
4) При миопатиях при физической нагрузке и подозрении на атрофию полуперепончатой мышцы, связанную с ПССМ.
От чего зависит, насколько быстро атрофируется мышца?
Некоторые болезненные процессы вызывают очень быструю атрофию мышц. Треть мышечной массы может исчезнуть за день при иммуноопосредованном миозите и окаймленной вакуолярной миопатии. В очень тяжелой форме острый рабдомиолиз может привести к атрофии мышц в течение недели после начала заболевания.Мышечное истощение в течение месяца происходит при миопатии с дефицитом витамина E, EPM и травме нерва. Медленно прогрессирующая атрофия возникает при EMND и системных заболеваниях.
Почему важно определить симметричность мышечной атрофии?
Атрофия мышц может быть очаговой, поражающей только одну мышцу или группу мышц, или распространяться по всему телу лошади. Очаговая атрофия может быть результатом повреждения нерва, обслуживающего эту мышцу, или воспалительной миопатии в этой мышце.Быстрая атрофия, в первую очередь затрагивающая линию верха, характерна для иммуноопосредованного миозита у пород, родственных четверть лошади. Медленное начало атрофии линии верха у этих пород более характерно для гомозиготных PSSM 1 типа. При системных заболеваниях может быть заметной атрофия линии верха, но также должна происходить общая потеря жира в других частях тела. EMND влияет на все мышцы тела, но часто проявляется выраженной атрофией четырехглавой мышцы и смещением веса из-за невозможности исправить коленные суставы.
Как лучше всего лечить атрофию мышц?
Лучший план лечения будет зависеть от основной причины атрофии вашей лошади.В некоторых случаях это может включать пероральное лечение такими лекарствами, как витамин Е, или кортикостероидом при иммуноопосредованных заболеваниях. Чтобы помочь мышцам полностью восстановить свою форму, могут быть показаны дополнительные методы лечения, такие как физиотерапия, терапевтический ультразвук и электрическая стимуляция мышц. Ваш ветеринар назначит лечение в зависимости от первопричины атрофии.
Сможет ли моя лошадь полностью выздороветь?
Мышцы обладают замечательной способностью к регенерации, и многие лошади действительно возвращаются к нормальной мышечной массе и полноценному функционированию, в зависимости от причины.Повреждение нерва может занять до года, чтобы узнать, будет ли он полностью восстановлен, за чем последует восстановление мышечной массы. Иммуноопосредованная атрофия мышц может быть серьезной, но мышечная масса часто возвращается после лечения. В некоторых случаях атрофия может прогрессировать до такой степени, что соединительная ткань заменяет мышечные волокна, и в этом случае прогноз полного восстановления мышечной массы более осторожен. Замена мышечных волокон соединительной тканью часто выявляется при биопсии мышц.
Атрофия мышц и как ее предотвратить
Внутри каждого из нас существует постоянный цикл разрушения и строительства. Старые клетки ломаются и заменяются новыми. Мы видим, что это происходит автоматически с нашей кожей, поскольку пятна, порезы и царапины исчезают в течение нескольких дней или недель. Поврежденные клетки заменяются новыми. Если бы мы увеличили масштаб в каждой ячейке, мы бы увидели тот же процесс в меньшем масштабе. Биомолекулы, такие как белки, разрушаются, и новые белки заменяют старые.
Однако этот же процесс не происходит автоматически в наших мышцах. Физические упражнения, питание и ряд других факторов сильно влияют на цикл обмена мышечных клеток и белков. Как орган, мышца либо увеличивается в массе (гипертрофия), либо теряет массу (атрофия) [1].
Почему возникает атрофия мышц?
Мышечная атрофия может возникать по разным причинам, но всегда имеет один и тот же результат — меньшие и более слабые мышцы. Фактически, каждая мышечная клетка будет сокращаться индивидуально, что в совокупности делает мышцу более слабой.Вот некоторые из причин, по которым может возникнуть атрофия мышц [2]:
- Недостаток физических упражнений.
- Различные заболевания: рак, синдром приобретенного иммунодефицита, хроническая обструктивная болезнь легких, артрит, боковой амиотрофический склероз и многие другие.
- Недоедание
- Хирургия
- Старение
Как видите, мышечная атрофия часто является результатом нагрузки на человеческий организм. Это потому, что организм рассматривает скелетные мышцы как расходный материал во время трудностей.Например, в периоды голодания или недоедания мышечный белок расщепляется, чтобы обеспечить энергией и питательными веществами более важные органы. Часто хирургическое вмешательство может предъявлять аналогичные требования к нашим мышцам. Тело отдает приоритет исцелению, которое требует питания. Чтобы получить энергию и питательные вещества для создания новой ткани, мышечный белок будет метаболизироваться [3].
Атрофия мышц, связанная со старением, может отличаться от других форм атрофии. Это состояние, часто называемое саркопенией, включает потерю массы и качества мышечной ткани.Этот тип потери мышечной массы связан не только с уменьшением размера клеток, но и с уменьшением их количества. При саркопении соединительная ткань и жир часто замещают мышечные клетки и дополнительно подавляют способность мышц сокращаться [4].
Атрофия мышц и наше общее состояние здоровья
Потеря мышечной массы — это проблема не только для тех из нас, кто хочет бегать быстрее и поднимать большие веса. Предотвращение атрофии мышц после операции — одна из основных задач профессиональной и физиотерапии.Атрофия мышц может замедлить восстановление после операции и привести к более длительному пребыванию в больнице, снижению качества жизни и увеличению шансов повторной госпитализации [5].
Мышцы имеют решающее значение для поддержания здорового обмена веществ. Поскольку мышцам требуется очень много энергии, наличие здоровой мышечной массы предотвращает попадание лишних калорий в жировые отложения. Следовательно, атрофия мышц также связана с повышенным риском ожирения и диабета 2 типа [6].
Способы предотвращения атрофии мышц
Для предотвращения атрофии мышц необходимы как физические упражнения, так и правильное питание.Упражнения при игнорировании питания контрпродуктивны. Когда мы тренируемся, наш организм сжигает калории и потребляет больше питательных веществ.
Если мы не дополним нашу диету, чтобы отразить этот возросший спрос, это поставит наши тела в состояние голода. Опять же, когда наши тела находятся на питательных веществах, они метаболизируют мышечный белок для поддержания жизнедеятельности, что приводит к атрофии мышц. Когда мы тренируемся, нам нужно больше калорий и больше питательных веществ, таких как белок, витамины и минералы.
В случае саркопении, связанной со старением, другое питательное вещество, по-видимому, имеет решающее значение для борьбы с потерей мышечной массы — HMB.

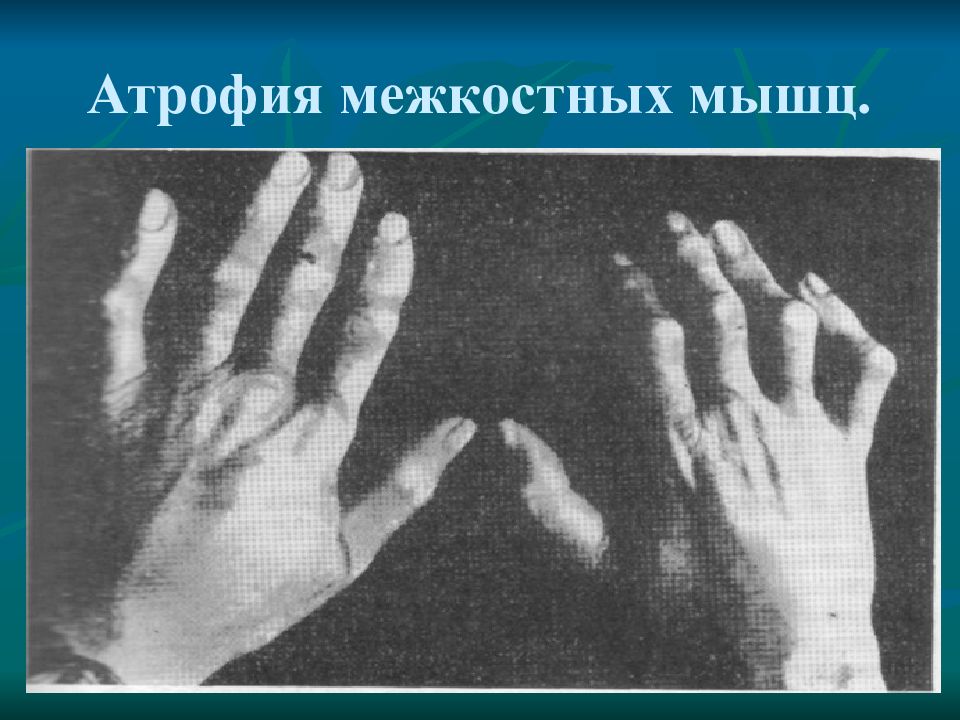 СМА обычно развивается в детстве, но может развиться в любой момент жизни.
СМА обычно развивается в детстве, но может развиться в любой момент жизни.