Тест эймса: Тест Эймса — ЦВТ ХимРар
Тест Эймса | это… Что такое Тест Эймса?
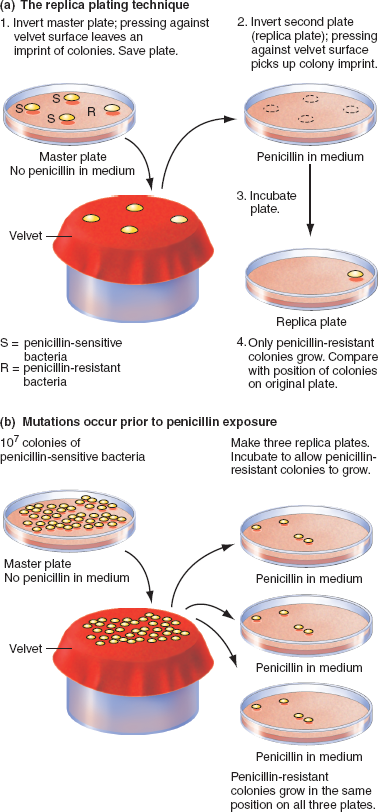
Схема постановки теста Эймса
Ames test или тест Эймса — генетический тест с использованием бактерий Salmonella Typhimurium в качестве тест объекта [1]. Предназначен для оценки мутагенного потенциала химических соединений. Положительный результат в тесте означает, что химическое вещество может обладать канцерогенными свойствами. Так как малигнизация часто связана с повреждением ДНК, тест также используется как экспрессный метод оценки канцерогенного потенциала различных химических соединений, и как дополнение другого аналогичного метода — стандартного теста на грызунах [2]. Методика была описана в ряде работ в начале 1970-х Брюсом Эймсом и его группой в Калифорнийском Университете, Беркли.
Методика постановки теста
В тесте используются некоторые штаммы бактерии Salmonella Typhimurium, которые несут мутации в генах, участвующих в синтезе гистидина (то есть это ауксотрофные мутанты, требующие искусственного внесения гистидина для роста). В тесте изучается возможность предполагаемого мутагена вызывать ревертивную мутацию данного гена, при которой штамм приобретает способность расти на среде, не содержащей гистидин. Предназначенные для тестирования штаммы подобраны таким образом, чтобы содержали обе рамки считывания и точковые мутации в генах ответственных за синтез гистидина, что позволяет обнаруживать мутагены путем воздействия на различные механизмы. Некоторые химические соединения крайне специфичны и поэтому вызывают реверсии только в одном или двух штаммах [3]. Используемые в тесте штаммы также несут мутации в генах, ответственных за синтез липополисахарида, делая клеточные стенки бактерий более проницаемыми, [4]. Кроме того, отсутствие некоторых генов, ответственных за репарационные процессы, делает тест более чувствительным [5]. Ввиду коренных отличий между метаболизмом бактерий и млекопитающих в тесте может быть использована вытяжка из печени крыс для имитации эффекта обмена веществ, так как некоторые соединения, например бенз [а]пирены, не обладают мутагенной активностью, но их производные, которые образуются в процессе метаболизма, приобретают генотоксичность [6].
В тесте изучается возможность предполагаемого мутагена вызывать ревертивную мутацию данного гена, при которой штамм приобретает способность расти на среде, не содержащей гистидин. Предназначенные для тестирования штаммы подобраны таким образом, чтобы содержали обе рамки считывания и точковые мутации в генах ответственных за синтез гистидина, что позволяет обнаруживать мутагены путем воздействия на различные механизмы. Некоторые химические соединения крайне специфичны и поэтому вызывают реверсии только в одном или двух штаммах [3]. Используемые в тесте штаммы также несут мутации в генах, ответственных за синтез липополисахарида, делая клеточные стенки бактерий более проницаемыми, [4]. Кроме того, отсутствие некоторых генов, ответственных за репарационные процессы, делает тест более чувствительным [5]. Ввиду коренных отличий между метаболизмом бактерий и млекопитающих в тесте может быть использована вытяжка из печени крыс для имитации эффекта обмена веществ, так как некоторые соединения, например бенз [а]пирены, не обладают мутагенной активностью, но их производные, которые образуются в процессе метаболизма, приобретают генотоксичность [6].
Бактерии высеваются на агарозную питательную среду в чашки Петри. Среда содержит небольшое количество гистидина. Этого количества гистидина в среде достаточно, чтобы обеспечить жизнедеятельность и рост бактерий в течение некоторого времени и дать возможность успеть за это время мутировать. После исчерпания гистидина, содержавшегося в среде, выживают только ревертантные колонии, которые приобрели способность синтезировать собственный гистидин. Контролем служат бактерии, посеянные на среде, не содержащей исследуемого мутагенного фактора. Инкубация проводится в течение 48 часов. Мутагенный потенциал исследуемого вещества оценивается пропорционально числу обследованных колоний.
Трудности интерпретации результатов
Так как сальмонеллы являются прокариотами, это не идеальная модель для экстраполяции на человека. Первоначальный вариант теста не учитывал метаболиты, которые формируются в печени. В модифицированном варианте теста используется фракция печени S9, которая помогает воссоздать систему более полно и исследовать, способны ли производные исходного вещества давать положительный результат (то есть генотоксичность)[7]. Ряд препаратов, которые содержат нитратные группировки, в действительности не представляющими угрозы здоровью, иногда дают ложно-положительный ответ в тесте Эймса. Нитроглицерин — это пример такого вещества. Он дает положительный результат в тесте Эймса, хотя используется в медицине до сих пор. В тесте Эймса применяются очень высокие концентрации веществ совместно с нитратами, которые способны формировать оксид азота(NO), важную сигнальную молекулу, которая ответственна за ложно-позитивные результаты. Чтобы опровергнуть положительный результат в тесте Эймса необходимы дальнейшие токсикологические исследования. Для преобразования результатов, полученных в тесте Эймса, в интегральный показатель, используется стандартная схема интегральной оценки мутагенного эффекта.
Ряд препаратов, которые содержат нитратные группировки, в действительности не представляющими угрозы здоровью, иногда дают ложно-положительный ответ в тесте Эймса. Нитроглицерин — это пример такого вещества. Он дает положительный результат в тесте Эймса, хотя используется в медицине до сих пор. В тесте Эймса применяются очень высокие концентрации веществ совместно с нитратами, которые способны формировать оксид азота(NO), важную сигнальную молекулу, которая ответственна за ложно-позитивные результаты. Чтобы опровергнуть положительный результат в тесте Эймса необходимы дальнейшие токсикологические исследования. Для преобразования результатов, полученных в тесте Эймса, в интегральный показатель, используется стандартная схема интегральной оценки мутагенного эффекта.
См. также
- Allium test
- Метод доминантных летальных мутаций у Drosophila melanogaster
- Интегральная оценка мутагенного эффекта
Примечания
- ↑ Mortelmans K, Zeiger E
 Res.. — Elsevier B.V., 200. — № 445 (1-2). — С. 29060.
Res.. — Elsevier B.V., 200. — № 445 (1-2). — С. 29060. - ↑ Encyclopedia of Public Health Ames test // Mutat. Res.. — enotes.com, 2002.
- ↑ Nishant G. Chapla, E. G. Gurney, James A. Miller, and H. Bartsch Carcinogens as Frameshift Mutagens: Metabolites and Derivatives of 2-acetylaminofluorene and other Aromatic Amine Carcinogens // PNAS. — 1972. — № 69(11).
- ↑ Bruce N. Ames, Frank D. Lee, and William E. Durston An Improved Bacterial Test System for the Detection and Classification of Mutagens and Carcinogens // PNAS. — 1973. — № 70(3). — С. 782-786.
- ↑ Joyce McCann, Neil E. Spingarn, Joan Kobori, and Bruce N. Ames Detection of Carcinogens as Mutagens: Bacterial Tester Strains with R Factor Plasmids // PNAS. — 1975. — № 72(3). — С. 979-983.
- ↑ Bruce N. Ames, William E. Durston, Edith Yamasaki, and Frank D. Lee Carcinogens are Mutagens: A Simple Test System Combining Liver Homogenates for Activation and Bacteria for Detection // PNAS.
 — 1973. — № 70. — DOI:10.1073/pnas.70.8.2281
— 1973. — № 70. — DOI:10.1073/pnas.70.8.2281 - ↑ Zhengyin, Yan, Gary, Caldwell Optimization in drug discovery: in vitro methods. Chapter «Improvement of the Ames test using human liver S9 preparation». — Methods in pharmacology and toxicology. — Humana Press, 2004.
тест Эймса
Translations
Arabic
اختبار أميس
Armenian
Էյմսի թեստ
Azerbaijani
Ames (Eyms) testi
Basque
Ames test
Bulgarian
Тест на Еймс
Catalan
prova d’Ames
Chinese
埃姆斯实验
Croatian
Amesov test
Czech
test Ames
Danish
Ames’ test
Dutch
Ames-test
English
Ames test
English (US)
Ames test
Estonian
Ames’i katse (test)
Finnish
Ames-testi
French
test de Ames
Georgian
ეიმსის ტესტიGerman
AMES-Test
Greek
δοκιμασία κατά Ames
Hungarian
Ames-teszt
Icelandic
Ames-prófun
Irish
Tástáil Ames
Italian
prova di Ames
Latvian
Ames pārbaude
Lithuanian
Ames testas
Maltese
test ta’ Ames
Norwegian
Ames-prøving
Polish
test Ames’a
Portuguese
teste de Ames
Romanian
test Ames
Russian
тест Эймса
Slovak
Amesov test
Slovenian
Amesov preskus
Spanish
prueba de Ames
Swedish
Ames test
Turkish
Ames testi
Ukrainian
тест Еймса
тест Эймса
Definition
Биотест, разработанный Брюсом Н. Эймсом в 1974, который производится на бактериях для оценки способности конкретных химикатов вызывать мутации.
Эймсом в 1974, который производится на бактериях для оценки способности конкретных химикатов вызывать мутации.
Related terms
Broader:
- тест
Related:
- тест на способность вызывать мутацию
Themes:
- загрязнение
- химия
Group:
- ИССЛЕДОВАНИЯ, НАУКА
Other relations
- UMTHES: AMES-Test
Has close match:
- Ames test
Wikipedia article:
Scope note
Scope note is not available.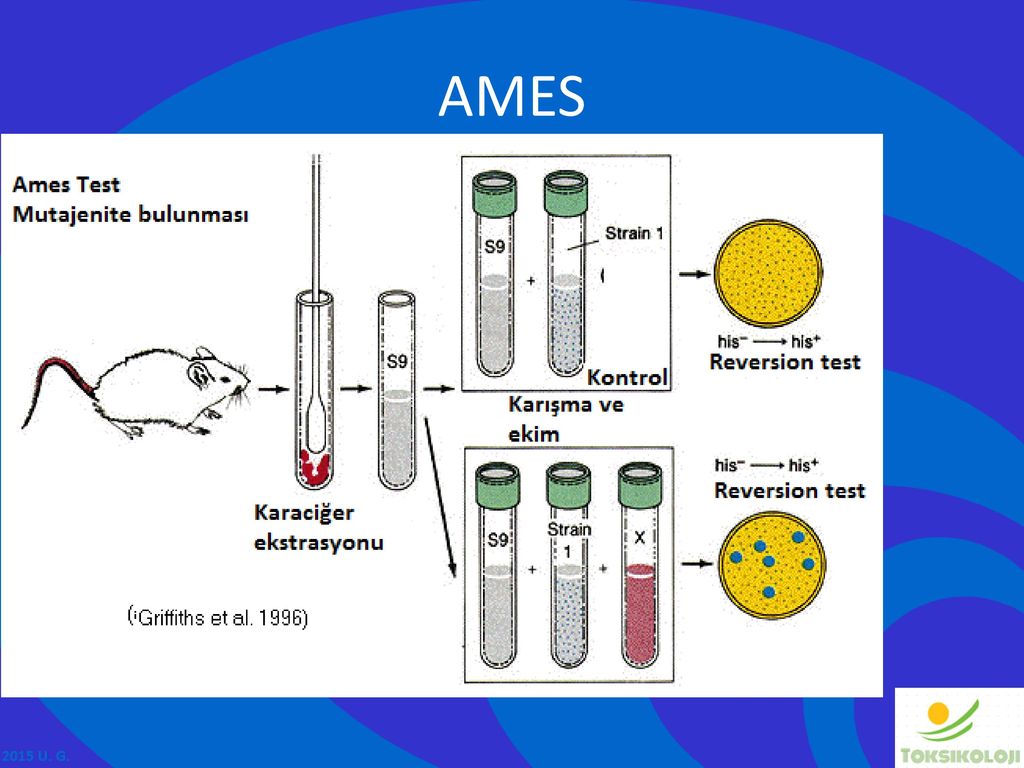
Concept URL: http://www.eionet.europa.eu/gemet/concept/370
Тест Эймса – введение, принцип, процедура, применение и интерпретация
Последнее обновление: Сагар Арьял
Тест Эймса это биологический анализ для оценки мутагенного потенциала химических соединений. Он использует бактерии, чтобы проверить, может ли данное химическое вещество вызывать мутации в ДНК тестируемого организма. Тест был разработан Брюсом Н. Эймсом в 1970-х годах, чтобы определить, является ли мутагеном имеющееся под рукой химическое вещество.
Цель
Определить мутагенную активность химических веществ путем наблюдения за тем, вызывают ли они мутации в образцах бактерий.
Принцип
- В тесте Эймса используются несколько штаммов бактерий ( Salmonella, E.coli ), несущих определенную мутацию.
- Точечные мутации в гистидиновом (Salmonella typhimurium) или триптофановом (Escherichia coli) опероне делают бактерии неспособными производить соответствующую аминокислоту.

- Эти мутации приводят к появлению his- или trp- организмов, которые не могут расти, если не поступает гистидин или триптофан.
- Но культивирование His- Salmonella в среде, содержащей определенные химические вещества, вызывает мутацию в гене, кодирующем гистидин, так что они восстанавливают способность синтезировать гистидин (His+ ). Это означает, что когда происходит мутагенное событие, замены оснований или сдвиги рамки считывания внутри гена могут вызвать реверсию к прототрофии аминокислот. Это обратная мутация.
- Эти ревертированные бактерии затем будут расти в средах с дефицитом гистидина или триптофана соответственно.
Мутагенный потенциал образца оценивается путем воздействия на организмы, нуждающиеся в аминокислотах, различных концентраций химического вещества и выбора события реверсии. Для этой селекции используются среды, в которых отсутствует конкретная аминокислота, что позволяет выживать и расти только тем клеткам, которые подверглись реверсии к прототрофии гистидина/триптофана.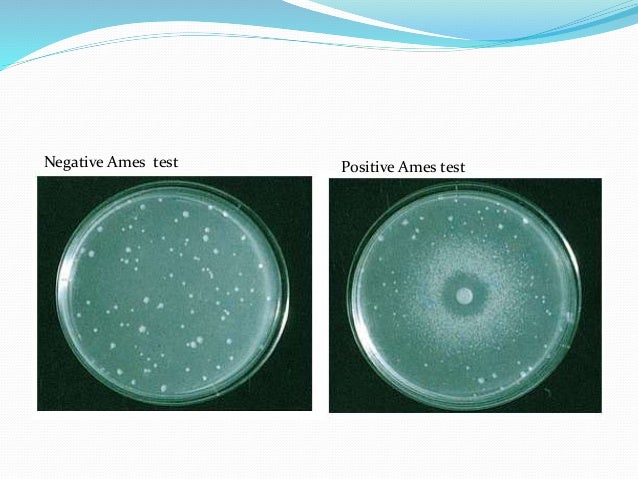 Если тестовый образец вызывает эту реверсию, это мутаген.
Если тестовый образец вызывает эту реверсию, это мутаген.
Метод
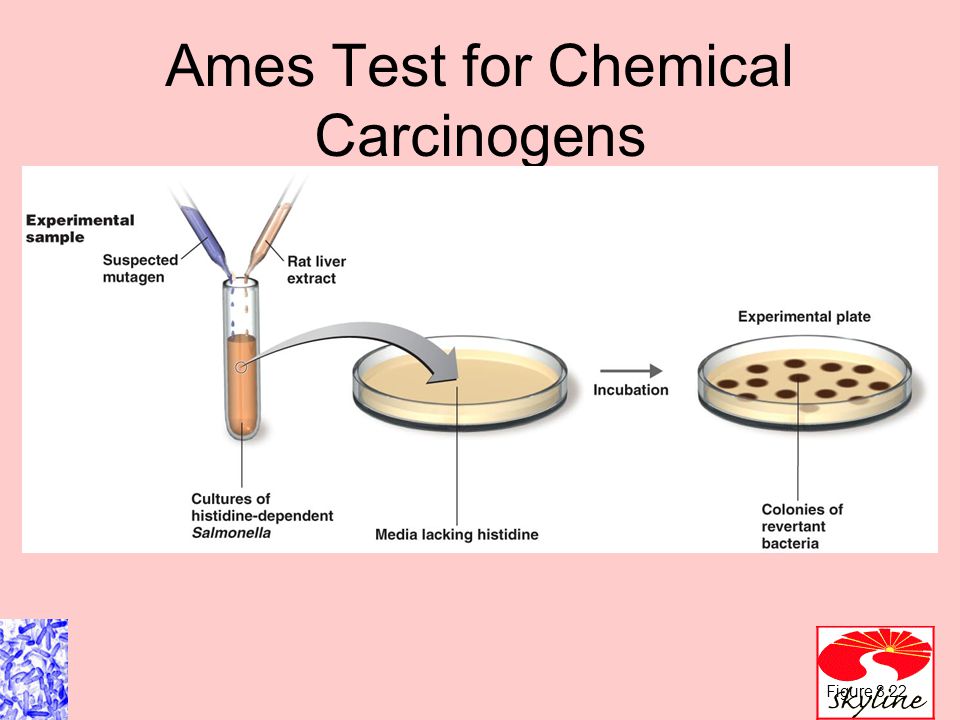
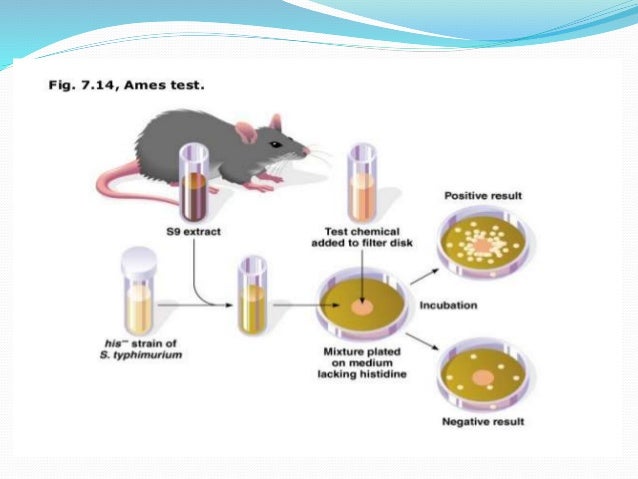
I ) Изолировать ауксотрофный штамм Salmonella Typhimurium на гистидин. (т.е. His-ve)
II) Приготовьте тестовую суспензию his-ve Salmonella Typhimurium в простом буфере с тестируемым химическим веществом (например, 2-аминофлуореном). Также добавьте небольшое количество гистидина.
Примечание: требуется небольшое количество гистидина, чтобы бактерии начали расти. Как только гистидин истощается, только те бактерии, которые мутировали, чтобы получить способность синтезировать гистидин, образуют колонии.
III) Также приготовьте контрольную суспензию His-ve Salmonella Typhimurium, но без тестируемых химикатов.
IV) Инкубируйте суспензии при 37°C в течение 20 минут.
V) Подготовьте две чашки с агаром и распределите суспензию по чашкам с агаром.
VI) Инкубируйте чашки при 37°C в течение 48 часов.
VII) Через 48 часов подсчитывают количество колоний в каждой чашке.
Интерпретация результата
- Мутагенность химических веществ пропорциональна количеству наблюдаемых колоний.
- Если на тестовой пластине имеется большое количество колоний по сравнению с контролем, то такие химические вещества называются мутагенами.
- На контрольной чашке также можно увидеть очень небольшое количество колоний. Это может быть связано со спонтанной точечной мутацией гена, кодирующего гизидин.
Применение
Хотя тест Эймса используется для выявления реверсивных мутаций, присутствующих в штаммах, его также можно использовать для определения мутагенности образцов окружающей среды, таких как лекарства, красители, реагенты, косметика, сточные воды, пестициды и другие вещества, легко растворяющиеся в жидкой суспензии.
Достоинства
- Простой, быстрый и надежный бактериальный анализ.
- Простота и низкая стоимость теста делают его бесценным для скрининга веществ в окружающей среде на предмет возможной канцерогенности.

- Тест Эймса может обнаруживать подходящие мутанты в большой популяции бактерий с высокой чувствительностью.
Ограничения
- Некоторые вещества, вызывающие рак у лабораторных животных (например, диоксин), не дают положительного результата теста Эймса (и наоборот)
- Анализ Эймса состоит из штаммов Salmonella typhimurium , поэтому он не является идеальной моделью для человека.
Ссылки
- https://www.xenometrix.ch/shop/mediafiles/Xeno%20Dateien/Short%20Protocol/Ames/Ames%20MPF%20Penta1%20Short%20Protocol_2.0.pdf
- www.biology- pages.info/A/AmesTest.html
- www.geneticgsa.org/education/pdf/GSA_DeStasio_Ames_Student_Resources.pdf
- https://bio-protocol.org/e2763
Похожие сообщения:
- Агар Salmonella Shigella (SS) – состав, принцип, применение, приготовление и интерпретация результатов
- Тест Видаля – введение, принцип, процедура, интерпретация и ограничения
- Тест на индол – принцип, реагенты, процедура, интерпретация результатов и ограничения
- Ксилозо-лизин-дезоксихолатный (XLD) агар – принцип, применение, состав, приготовление и характеристики колоний
Услуги по тестированию Эймса | Charles River
Вам необходимо быстро оценить мутагенный потенциал химических соединений? Тест Эймса — это быстрый и надежный бактериальный анализ, используемый для оценки потенциальной генотоксичности химического вещества путем измерения его способности вызывать обратные мутации в выбранных локусах нескольких бактериальных штаммов.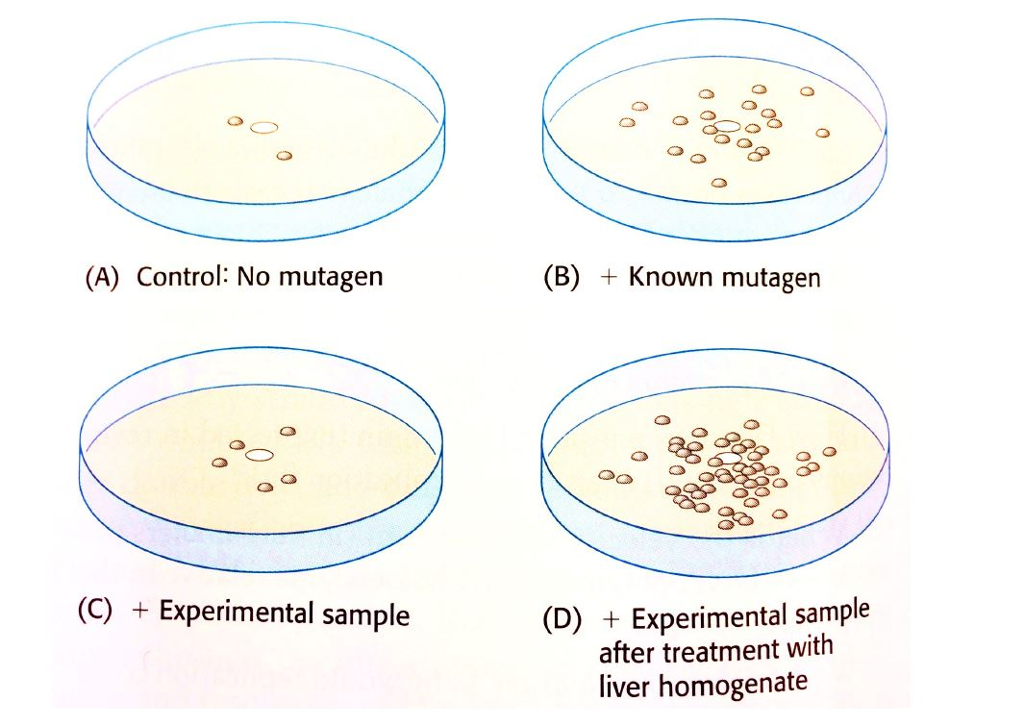
Спросите эксперта
Бактериальный тест на обратную мутацию, широко известный как тест Эймса, выявляет мутации, которые являются причиной многих генетических заболеваний человека и играют важную роль в возникновении и развитии опухолей. Бактериальные штаммы имеют различные мутации, которые инактивируют ген, участвующий в синтезе незаменимой аминокислоты, либо гистидина (сальмонелла), либо триптофана (кишечная палочка), поэтому они могут расти только в культуральной среде, содержащей эту аминокислоту.
Когда бактерии подвергаются воздействию мутагена, происходят мутации, которые могут восстановить/обратить способность бактерий синтезировать аминокислоту и продолжать рост после истощения ограниченного количества аминокислоты в агаре. Соответствующие мутации включают замену отдельных пар оснований или мутации сдвига рамки считывания, вызванные добавлением или удалением участка ДНК.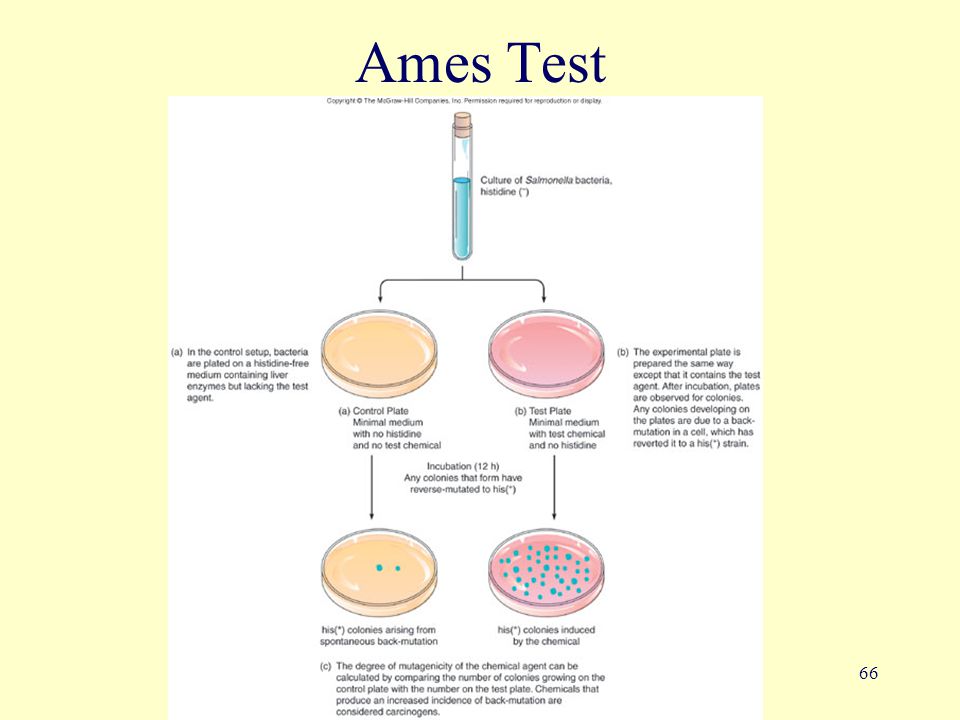
Научный постер EMGS — анализ Эймса
Ученые рассмотрели проблемы, связанные с тестом на обратную мутацию бактерий и OECD TG4711. См. сравнение исторических данных отрицательного контроля из анализа Эймса.
Загрузить плакат
Учитывая важность, придаваемую регулирующими органами результатам теста на бактериальную мутацию, многие компании проверяют свои соединения на микробную генотоксичность на очень ранней стадии разработки. На этом этапе доступность тестовых элементов и ресурсы часто ограничены, поэтому нет необходимости или возможности проводить полный стандартный тест Эймса.
В этих случаях мы можем использовать скрининговые версии теста Эймса, такие как тестирование только при наличии метаболической активации, с использованием сниженного уровня максимальной дозы, меньшего количества повторных чашек (одни чашки на дозу), уменьшая количество исследуемых бактериальных штаммов. (часто используют только TA98 и TA100) или их комбинацию. Преимущество этого подхода заключается в том, что результаты можно напрямую экстраполировать на то, что можно было бы ожидать в последующем тесте GLP.
Преимущество этого подхода заключается в том, что результаты можно напрямую экстраполировать на то, что можно было бы ожидать в последующем тесте GLP.
Недостаток в том, что будут определенные трудности при обнаружении слабых мутагенов или, в случае уменьшения количества штаммов, некоторые мутагены будут упущены. Однако положительного результата теста Эймса достаточно, чтобы классифицировать химическое вещество как мутаген.
Когда проводить тест Эймса- Скрининг соединений
- IND – Вспомогательные исследования
- В составе стандартной батареи ICH S2(R1) (вариант 1 или 2)
- Требования REACH
- Оценка загрязнения
- Требуется, если примесь, продукт разложения или промежуточный продукт процесса были идентифицированы как возможный мутаген во время анализа in silico в соответствии с директивой ICH M7
- Как правило, в каждом анализе используются четыре тестовых штамма Salmonella typhimurium (TA98, TA100, TA1535 и TA1537) и один штамм Escherichia coli (WP2uvrA)
- Доступны другие модели, включая TA97a, TA102 и WP2uvrA (pKM101)
- Каждый тестовый штамм инкубируют в течение 2-3 дней с несколькими уровнями доз тестируемого соединения в присутствии и в отсутствие метаболической активации (S9)
- Положительный исход характеризуется дозозависимым увеличением частоты ревертантов, превышающим штаммоспецифические пределы
Спросите эксперта
- Что такое тест Эймса? Почему это важный тест?
Тест Эймса (т.
 е. анализ обратных мутаций Salmonella typhimurium и/или Escherichia coli), предлагаемый в Charles River, представляет собой бактериальный краткосрочный тест для идентификации канцерогенов, который измеряет мутации в ДНК бактерий.
е. анализ обратных мутаций Salmonella typhimurium и/или Escherichia coli), предлагаемый в Charles River, представляет собой бактериальный краткосрочный тест для идентификации канцерогенов, который измеряет мутации в ДНК бактерий.Тест Эймса используется во всем мире в качестве начального скрининга для определения мутагенного потенциала новых химических веществ и лекарств. Это быстрый, точный и экономичный способ оценки мутагенного потенциала соединения. Тест Эймса используется в фармацевтической и косметической промышленности для проверки мутагенного потенциала лекарственных соединений и косметики соответственно. Его также можно использовать для проверки веществ на возможную канцерогенность.
- Что определяет тест Эймса?
Тест Эймса — это быстрый и надежный бактериальный анализ, используемый для оценки потенциальной генотоксичности химического вещества путем измерения его способности вызывать обратные мутации в выбранных локусах нескольких бактериальных штаммов.

- В чем разница между включением в чашку и методом предварительной инкубации в анализе Эймса?
В методе включения в чашку тестируемый образец смешивается с верхним агаром и бактериями и сразу же высеивается. В методе преинкубации бактериальные штаммы смешивают с тест-объектом в присутствии или в отсутствие S9-mix в течение 20-30 минут при 37 °С (при встряхивании). После этого эту смесь добавляют к верхнему агару и высевают. Метод преинкубации обычно считается наиболее чувствительным методом обнаружения мутагенов, но он также более чувствителен к цитотоксичности.
- Как оцениваются токсические эффекты тестового образца Эймса?
На цитотоксичность тестируемого образца обычно указывает частичное или полное отсутствие бактериальной фоновой лужайки или существенное дозозависимое снижение числа ревертантных колоний по сравнению с более низкими уровнями доз и одновременным контролем носителя, учитывающим исторический контрольный диапазон лаборатории.


 Res.. — Elsevier B.V., 200. — № 445 (1-2). — С. 29060.
Res.. — Elsevier B.V., 200. — № 445 (1-2). — С. 29060. — 1973. — № 70. — DOI:10.1073/pnas.70.8.2281
— 1973. — № 70. — DOI:10.1073/pnas.70.8.2281
 е. анализ обратных мутаций Salmonella typhimurium и/или Escherichia coli), предлагаемый в Charles River, представляет собой бактериальный краткосрочный тест для идентификации канцерогенов, который измеряет мутации в ДНК бактерий.
е. анализ обратных мутаций Salmonella typhimurium и/или Escherichia coli), предлагаемый в Charles River, представляет собой бактериальный краткосрочный тест для идентификации канцерогенов, который измеряет мутации в ДНК бактерий.