Шкала эшворта: Шкала Эшворта — Habilect
Оценка спастики. Модифицированная шкала Ашворса.
Статья о распространенном инструменте оценки спастики у пациентов с ДЦП и другими состояниями, сопровождающимися повышением мышечного тонуса.
Модифицированная шкала Ашворса (Modified Ashworth Scale) является распространенным инструментом оценки спастики у пациентов с церебральными параличами и другими состояниями, сопровождающимися повышением мышечного тонуса. Оригинальная шкала Ашворса была предложена в 1964 году, а модифицированная шкала в 1987 году. Шкала направлена на оценку силы сопротивления мышц к пассивному движению в суставе с переменной скоростью.
Для обследования не требуется специальное оборудование, однако особое внимание следует уделить положению конечности. При обследовании мышц-сгибателей, конечность должна быть в положении максимального сгибания, тогда в течение 1 секунды ее необходимо перевести в положение максимального разгибания. При обследовании мышц-разгибателей конечность должна быть в максимально выпрямленном положении и в течение 1 секунды ее надо максимально пассивно согнуть.
Оценку результатов теста проводят по 5 бальной шкале в диапазоне от 0 — что указывает на отсутствие повышения тонуса, до 4 — что значит, что конечность является ригидной в согнутом или разогнутом положении. Для повышения чувствительности в нижнем диапазоне измерений к модифицированной шкалы Ашворса было добавлено категорию 1+, которая обозначает наличие сопротивления в течение менее чем половины амплитуды движения.
Модифицированная шкала Ashworth (Modified Ashworth Scale for Grading Spasticity)
Бал | Модифицированная шкала Ашворса |
0 | Мышечный тонус не повышен |
1 | Незначительное повышение тонуса мышц, что влечет «захват» с последующим возвращением к нормальному тонусу во время пассивного сгибания или разгибания конечности, или в конце амплитуды движения в суставе. |
1+ | Незначительное повышение тонуса мышц, которое проявляется «захватом» без возврата к нормальному тонусу или сопротивлением при пассивном движении до половины амплитуды движения. |
2 | Более выраженное повышение тонуса мышц при более половине амплитуды движения, однако пораженная часть конечности подвижная и пассивные движения не затруднены |
3 | Существенное повышение тонуса мышц; затруднения пассивных движений |
4 | Ригидное сгибательное или разгибательное положение конечности без любой пассивной подвижности |
Подробную информацию о надежности и валидности шкалы, а также библиографию можно посмотреть здесь.
Краткое обучающее видео (на английском языке) можно посмотреть здесь.
Применение препарата ботулинического токсина типа А (Ботокс) в лечении детского церебрального паралича | Куренков
1. Koman L.A., Mooney J.F. 3rd, Smith B. et al. Management of cerebral palsy with botulinum-A toxin: preliminary investigation. J Pediatr Orthop 1993;13(4):489–95.
2. Graham H.K., Aoki K.R., Autti-Ramo I. et al. Recommendations for the use of botulinum toxin type A in the management of cerebral palsy. Gait Posture 2000;11: 67–79.
3. Heinen F., Molenaers G., Fairhurst C. et al. European consensus table 2006 on botulinum toxin for children with cerebral palsy. Eur J Paediatr Neurol 2006;10(5–6):215–25.
4. Heinen F., Desloovere K., Schroeder A.S. et al. The updated European Consensus 2009 on the use of Botulinum toxin for children with cerebral palsy. Eur J Paediatr Neurol 2010;14(1):45–66.
5. Love S.C., Novak I., Kentish M. et al. Botulinum toxin assessment, intervention and after-care for lower limb spasticity in children with cerebral palsy: international consensus statement.2009/62/9.png) Eur J Neur 2010;17(Suppl 2):9–37.
Eur J Neur 2010;17(Suppl 2):9–37.
6. Bax M., Goldstein M., Rosenbaum P. et al. Proposed definition and classification of cerebral palsy. Dev Med Child Neurol 2005;47(8):571–6.
7. Miller F. Cerebral palsy. New York: Springer Science, 2005. 1055 p.
8. Батышева Т.Т., Быкова О.В., Виноградов А.В. Приверженность семьи к лечению ребенка с неврологической патологией. Журн неврол и психиатр им. С.С. Корсакова 2012;7(2): 56–63.
9. Семенова К.А., Махмудова Н.М. Медицинская реабилитация и социальная адаптация больных детским церебральным параличом. Ташкент: Медицина, 1979. 487 с.
10. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Dev Med Child Neurol 2000;42(12):816–24.
11. Palisano R., Rosenbaum P., Walter S. et al. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol1997;39(4):214–23.
12. Palisano R.J. A collaborative model of service delivery for children with movement disorders: a framework for evidence-based decision making. Phys Ther 2006;86(9): 1295–305.
Phys Ther 2006;86(9): 1295–305.
13. Hanna S.E., Rosenbaum P.L., Bartlett D.J. et al. Stability and decline in gross motor function among children and youth with cerebral palsy aged 2 to 21 years. Dev Med Child Neurol 2009;51(4):295–302.
14. Eliasson A.C., Krumlinde-Sundholm L., Rösblad B. et al. The Manual Ability Classification System (MACS) for children with cerebral palsy: scale development and evidence of validity and reliability. Dev Med Child Neurol 2006;48(7):549–54.
15. Hidecker M.J., Paneth N., Rosenbaum P.L. et al. Developing and validating the Communication Function Classification System for individuals with cerebral palsy. Dev Med Child Neurol 2011;53(8):704–10.
16. Hidecker M.J., Ho N.T., Dodge N. et al. Inter-relationships of functional status in cerebral palsy: analyzing gross motor function, manual ability, and communication function classification systems in children. Dev Med Child Neurol 2012;54(8):737–42.
17. Bohannon R.W., Smith M.B. Interrater reliability of a modified Ashworth scale of muscle spasticity. Phys Ther 1987;67(2): 206–7.
Phys Ther 1987;67(2): 206–7.
18. Boyd R.N., Graham H.K. Objective measurement of clinical findings in the use of Botulinum toxin type A for the management of children with cerebral palsy. Eur J Neurol 1999;6(Suppl. 4):23–35.
19. Gage J.R., Stout J.L. Gait analysis: kinematics, kinetics, electromyography, oxygen consumption and pedobarography. In: The identification and treatment of gait problems in cerebral palsy (Eds. Gage J.R., Schwartz M.H., Koop S.E., Novacheck T.F.). London: Mac Keith Press, 2009. P. 260–284.
20. Leonard J., Graham H.K. Treatment of motor disorders in cerebral palsy with bo tulinum neurotoxin. In book: Botulinum toxin: Therapeutic clinical practice and science (Ed. by J. Jankovic). Philadelphia: Saunders Elsevier, 2009. P. 172–191.
21. Simpson D.M., Gracies J.M., Graham H.K. et al. Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Assessment: Botulinum neurotoxin for the treatment of spasticity (an evidence-based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2008;70(19):1691–8.
Neurology 2008;70(19):1691–8.
22. Delgado M.R., Hirtz D., Aisen M. et al. Practice parameter: pharmacologic treatment of spasticity in children and adolescents with cerebral palsy (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology 2010;74(4):336–43.
23. Hoare B.J., Wallen M.A., Imms C. et al. Botulinum toxin A as an adjunct to treatment in the management of the upper limb in children with spastic cerebral palsy (UPDATE). Cochrane Database Syst Rev 2010; (1):CD003469.
24. Sakzewski L., Ziviani J., Boyd R. Systematic review and meta-analysis of therapeutic management of upper-limb dysfunction in children with congenital hemiplegia. Pediatrics 2009;123(6):1111–22.
25. Артеменко А.Р., Куренков А.Л. Ботулинический токсин: вчера, сегодня, завтра. Нервно-мышечные болезни 2013;2:6–18.
26. Dressler D. Clinical applications of botulinum toxin. Curr Opin Microbiol 2012;15(3):325–36.
Curr Opin Microbiol 2012;15(3):325–36.
27. Burgen A., Dickens F., Zatman L.J. The action of botulinum toxin on the neuromusculat junction. J Phisiol 1949;109:10–24.
28. Grissom J.R. Chemical denervation. In book: Electrodiagnostic medicine, 2nd edition (Eds. D. Dumitru, M.J. Zwarts, A.A. Amato). Philadelphia: Hanley & Belfus, Inc., 2002. P. 479–512.
29. Куренков А.Л., Артеменко А.Р., Никитин С.С., Орлова О.Р. Современные представления о механизмах действия ботулинического токсина типа А. Врач 2009;7:8–12.
30. Giladi N. The mechanism of action of botulinum toxin type A in focal dystonia is most probably through its dual effect on efferent (motor) and afferent pathways at the injected site. J Neurol Sci 1997;152: 132–5.
31. Dressler D., Saberi F.A., Barbosa E.R. Botulinum toxin: mechanisms of action. Arq Neuropsiquiatr 2005;63:180–5.
32. Aoki K.R. Evidence for antinociceptive activity of botulinum toxin type A in pain management. Headache 2003;43 (Suppl. 1): 9–15.
1): 9–15.
33. Aoki K.R. Review of a proposed mechanism for the antinociceptive action of botulinum toxin type A. Neurotoxicology 2005;26 (5):785–93.
34. Durham P.L., Cady R. Insights into the mechanism of onabotulinumtoxinA in chronic migraine. Headache 2011;51 (10):1573–7.
35. Gazerani P., Pedersen N.S., Staahl C. et al. Subcutaneous Botulinum toxin type A reduces capsaicin-induced trigeminal pain and vasomotor reactions in human skin. Pain 2009;141(1–2):60–9.
36. Dolly J.O., O’Connell M.A. Neurotherapeutics to inhibit exocytosis from sensory neurons for the control of chronic pain. Curr Opin Pharmacol 2012;12:100–8.
37. Sutherland D.H., Kaufman K.R., Wyatt M.P. et al. Double-blind study of botulinum toxin injections into the gastrocnemius muscle in patients with cerebral palsy. Gait and Posture 1999;10:1–9.
38. Koman L.A., Mooney J.F. 3rd, Smith B.P. et al. Botulinum toxin type A neuromuscular blockade in the treatment of lower extremity spasticity in cerebral palsy: a randomized, double-blind, placebo-controlled trial. BOTOX Study Group. J Pediatr Orthop 2000;20(1):108–15.
BOTOX Study Group. J Pediatr Orthop 2000;20(1):108–15.
39. Love S.C., Valentine J.P., Blair E.M. et al. The effect of botulinum toxin type A on the functional ability of the child with spastic hemiplegia a randomized controlled trial. Eur J Neurol 2001;8 (Suppl 5): 50–8.
40. Corry I.S., Cosgrove A.P., Duffy C.M. et al. Botulinum toxin A compared with stretching casts in the treatment of spastic equinus: a randomised prospective trial. J Pediatr Orthop 1998;18(3): 304–11.
41. Kirschner J., Berweck S., Mall V. et al. Botulinum toxin treatment in cerebral palsy: evidence for a new treatment option. J Neurol 2001;248(Suppl 1):28–30.
42. Koman L.A., Paterson Smith B., Balkrishnan R. Spasticity associated with cerebral palsy in children: guidelines for the use of botulinum A toxin. Paediatr Drugs 2003;5(1):11–23.
43. Naumann M., Albanese A., Heinen F. Safety and efficacy of botulinum toxin type A following long-term use. Eur J Neurol 2006;13 (Suppl 4):35–40.
44. Howell K., Selber P., Graham H.K., Reddihough D. Botulinum neurotoxin A: an unusual systemic effect. J Paediatr Child Health 2007;43(6):499–501.
Howell K., Selber P., Graham H.K., Reddihough D. Botulinum neurotoxin A: an unusual systemic effect. J Paediatr Child Health 2007;43(6):499–501.
45. Crowner B.E., Brunstrom J.E., Racette B.A. Iatrogenic botulism due to therapeutic botulinum toxin a injection in a pediatric patient. Clin Neuropharmacol 2007;30(5):310–3.
46. Sätilä H.K., Pietikäinen T., Lehtonen-Räty P. et al. Treatment of spastic equinus gait with botulinum toxin A: Does dose matter? Analysis of a clinical cohort. Neuropediatrics 2006;37(6):344–9.
47. Willis A.W., Crowner B., Brunstrom J.E. et al. High dose botulinum toxin A for the treatment of lower extremity hypertonicity in children with cerebral palsy. Dev Med Child Neurol 2007;49(11):818–22.
48. Molenaers G., Schörkhuber V., Fagard K. et al. Long-term use of botulinum toxin type A in children with cerebral palsy: treatment consistency. Eur J Paediatr Neurol 2009;13(5): 421–9.
49. Инструкция по применению лекарственного препарата для лекарственного применения Ботокс 100 ЕД. Регистрационный номер: П №011936/01, 2013.
Регистрационный номер: П №011936/01, 2013.
Связь между баллами по шкале Эшворта и возбудимостью α-мотонейронов у пациентов с постинсультной мышечной спастичностью
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Краткий отчет
Связь между баллами по шкале Эшворта и возбудимостью α-мотонейронов у пациентов с постинсультной мышечной спастичностью
- A M O Bakheit1,
- v A Maynard2,
- J Curnow3,
- N Hudson4,
- S Kodapala4
- 1 49999
- 1 49999
- 1 49999
- 1 499999
- 1 449.

- 3 Департамент медицинской физики, больница Деррифорд, Плимут
- 4 Департамент нейрофизиологии, больница Деррифорда, Плимут
- . Plymouth PL4 7QD, Великобритания; magid.bakheit{at}pcs-tr.swest.nhs.uk
Abstract
История вопроса: Модифицированная шкала Ashworth (MAS) является наиболее широко используемым методом оценки мышечной спастичности в клинической практике и исследованиях. Однако достоверность этой шкалы подвергалась сомнению.
Цели: Сравнить MAS с объективными нейрофизиологическими тестами спастичности.
Методы: MAS регистрировали у пациентов с постинсультной спастичностью мышц нижних конечностей и коррелировали с возбудимостью α-мотонейронов. Последний оценивали, измеряя латентный период рефлекса Гофмана (Н-рефлекс) и отношение амплитуды максимального Н-рефлекса (Н max ) к моторному потенциалу сложного действия камбаловидной мышцы (М макс ).

Результаты: Были проанализированы данные о 24 случайно выбранных пациентах. Пациенты были разделены на две группы в соответствии с их оценкой MAS: 14 имели оценку MAS 1 (группа A) и 10 баллов 2 (группа B). Две группы были сопоставимы по возрасту и полу, но в группе А был более длительный период после инсульта. Латентность H-рефлекса была снижена, а соотношение H max :M max увеличилось в обеих группах. H макс. :M макс. 9Значения соотношения 0094 были выше для группы В, но различия не были статистически значимыми.
Выводы: Существует связь между баллами MAS и возбудимостью альфа-мотонейронов, хотя и нелинейная. Это говорит о том, что MAS измеряет мышечный гипертонус, а не спастичность.
- Шкала Ashworth
- α-мотонейрон
- спастичность
http://dx.doi.org/10.1136/jnnp.74.5.646
Статистика Altmetric.com0081
Запросить разрешения
Если вы хотите повторно использовать часть или всю эту статью, воспользуйтесь приведенной ниже ссылкой, которая приведет вас к службе RightsLink Центра защиты авторских прав.
 Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.- Шкала Эшворта
- α двигательный нейрон
- спастичность
Точная оценка эффективности терапевтических вмешательств, используемых при лечении мышечной спастичности, затруднена из-за отсутствия достоверных и объективных показателей результатов, которые можно было бы легко и просто применять. неоднократно в клинических условиях. Методы, используемые в настоящее время для этой цели, можно разделить на три группы: методы оценки устойчивости к пассивному растяжению мышц, нейрофизиологические тесты и шкалы функциональных результатов. Ни один из этих методов не является полностью удовлетворительным.
Тесты, основанные на оценке устойчивости к пассивному растяжению мышц, включают модифицированную шкалу Эшворта (MAS) 1 и измерение объема движений в суставах с помощью гониометра или системы анализа движений. MAS, вероятно, является наиболее широко используемым тестом для измерения мышечной спастичности в исследованиях и клинической практике.
 Однако этот метод имеет важные ограничения. Гипертонус у пациентов с поражением верхних мотонейронов является результатом сочетания спастичности, тиксотропии и изменений вязкоупругих свойств мышц, что в конечном итоге может привести к развитию фиксированных мышечных контрактур. 2, 3 MAS не позволяет надежно различать эти компоненты гипертонии. Более того, межэкспертная и внутриэкспертная надежность этой шкалы при оценке спастичности нижних конечностей остается сомнительной. 4 Еще одно ограничение MAS заключается в том, что условия испытаний не были стандартизированы. Например, в то время как некоторые клиницисты оценивают мышечный тонус в состоянии покоя без предварительного растяжения мышц, другие 5 рекомендуют несколько раз сгибать и разгибать конечность непосредственно перед фактическим измерением. Это отсутствие стандартизации может привести к ошибкам измерения, поскольку возбудимость рефлекса растяжения в состоянии покоя может отличаться от возбудимости активированной мышцы.
Однако этот метод имеет важные ограничения. Гипертонус у пациентов с поражением верхних мотонейронов является результатом сочетания спастичности, тиксотропии и изменений вязкоупругих свойств мышц, что в конечном итоге может привести к развитию фиксированных мышечных контрактур. 2, 3 MAS не позволяет надежно различать эти компоненты гипертонии. Более того, межэкспертная и внутриэкспертная надежность этой шкалы при оценке спастичности нижних конечностей остается сомнительной. 4 Еще одно ограничение MAS заключается в том, что условия испытаний не были стандартизированы. Например, в то время как некоторые клиницисты оценивают мышечный тонус в состоянии покоя без предварительного растяжения мышц, другие 5 рекомендуют несколько раз сгибать и разгибать конечность непосредственно перед фактическим измерением. Это отсутствие стандартизации может привести к ошибкам измерения, поскольку возбудимость рефлекса растяжения в состоянии покоя может отличаться от возбудимости активированной мышцы. 6
6 Спастичность мышц связана с различными нейрофизиологическими изменениями в сегментарной цепи позвоночника. К ним относятся повышенная возбудимость α-мотонейронов, снижение пресинаптического и реципрокного торможения и снижение фасилитации 1А. 7 Было показано, что степень возбудимости α-мотонейронов, измеренная с помощью рефлекса Гофмана (H-рефлекс), коррелирует с клинически наблюдаемым повышением активности миотатического рефлекса растяжения 8 и позволяет различать спастичность и нормальную мускулатуру тон. 9 И латентность, и отношение максимальной амплитуды H-рефлекса к моторной реакции (т. е. сложному потенциалу двигательного действия) камбаловидной мышцы (отношение H max :M max ) имеют было показано, что они являются надежными показателями возбудимости α-мотонейронов. 10 Однако эти тесты не получили широкого распространения в клинической практике, поскольку требуют много времени, специального оборудования и опыта.
 Тем не менее, они являются ценными объективными инструментами, которые могут быть полезны для проверки других менее надежных исходных показателей мышечной спастичности.
Тем не менее, они являются ценными объективными инструментами, которые могут быть полезны для проверки других менее надежных исходных показателей мышечной спастичности.Хотя большинство ограничений MAS можно преодолеть, 11 его метод оценки тяжести гипертонии остается проблематичным. Это связано с тем, что это зависит от субъективного впечатления исследователя о воспринимаемой степени сопротивления пассивному растяжению мышц. Однако было бы разумно проигнорировать эту слабость, если бы можно было показать, что MAS тесно коррелирует с объективными нейрофизиологическими тестами спастичности. Нашей целью в настоящем исследовании было установить, существует ли такая корреляция.
МЕТОДЫ
В исследовании приняли участие взрослые пациенты с впервые перенесенным ишемическим или геморрагическим инсультом продолжительностью не менее шести месяцев, приведшим к гемиплегии. Пациентов включали в исследование, если они имели клинически определяемое повышение мышечного тонуса и не получали антиспастические препараты.
 Были исключены пациенты с фиксированными мышечными контрактурами в голеностопном суставе. Фиксированная мышечная контрактура считалась присутствующей, если диапазон движения в голеностопном суставе при пассивном растяжении был сильно или полностью ограничен, то есть оценка по шкале MAS равнялась 4 (см. ниже). Оценка мышечного тонуса и нейрофизиологические тесты проводились на одном сеансе. Оценку мышечного тонуса всегда проводили в первую очередь.
Были исключены пациенты с фиксированными мышечными контрактурами в голеностопном суставе. Фиксированная мышечная контрактура считалась присутствующей, если диапазон движения в голеностопном суставе при пассивном растяжении был сильно или полностью ограничен, то есть оценка по шкале MAS равнялась 4 (см. ниже). Оценка мышечного тонуса и нейрофизиологические тесты проводились на одном сеансе. Оценку мышечного тонуса всегда проводили в первую очередь.Исследование было одобрено соответствующим комитетом по этике, и все участники дали свое информированное письменное согласие.
Модифицированная шкала Эшворта
Спастичность икроножных мышц оценивали клинически с помощью MAS. Как показано в таблице 1, шкала измеряет степень мышечного гипертонуса по шестибалльной шкале от 0 до 4 (0, нормальный мышечный тонус; 4, фиксированная мышечная контрактура). Сопротивление пассивному растяжению мышц измеряли в голеностопном суставе нижней конечности с гемиплегией в положении пациента лежа на спине.
 Все тесты проводились одним исследователем, чтобы исключить межэкспертную изменчивость.
Все тесты проводились одним исследователем, чтобы исключить межэкспертную изменчивость.Таблица 1
Модифицированная шкала Эшворта Хилл, Эссекс, Великобритания). Полосовой фильтр был установлен от 3 Гц до 3 кГц. Усиленные сигналы оцифровывались и сохранялись на жестком диске компьютера для последующего расчета соотношения H max :M max и латентности H-рефлекса.
Тест проводился в положении пациента лежа на животе, ноги свисали с края кровати, а голова лежала на подушке. Поверхностные биполярные хлорсеребряные электроды диаметром 5 мм (Nicolet Biomedical, Мэддисон, Висконсин, США) применяли следующим образом:
Электрод стимулирующий (анод): над большеберцовым нервом в подколенной ямке.
Активный электрод : над медиальной головкой икроножной мышцы на полпути между медиальной лодыжкой и надмыщелком большеберцовой кости.

Заземляющий электрод : над латеральной головкой икроножной мышцы между стимулятором и активным электродом.
Электрод сравнения : над местом прикрепления ахиллова сухожилия.
Перед наложением электродов кожу очищали до получения импеданса кожи менее 10 кОм. Большеберцовый нерв стимулировали прямоугольным электрическим импульсом длительностью 1 мс и частотой стимула 1 раз в пять секунд. Процедура стимуляции, описанная Брэддомом и Джонсоном 12 последовал. Первоначально оптимальное положение для стимуляции большеберцового нерва в подколенной ямке определяли путем перемещения стимулирующего электрода до появления видимого сокращения икроножной мышцы. Затем ток постепенно увеличивали до тех пор, пока не регистрировался Н-рефлекс без М-ответа. Отклик с наибольшей амплитудой был выбран как H max , а другие значения были отклонены.
 Затем интенсивность стимула увеличивали с небольшими приращениями до тех пор, пока не был получен максимальный ответ М. H-рефлекс был идентифицирован как трехфазная волна с небольшим начальным положительным отклонением, за которым следует большее отрицательное.
Затем интенсивность стимула увеличивали с небольшими приращениями до тех пор, пока не был получен максимальный ответ М. H-рефлекс был идентифицирован как трехфазная волна с небольшим начальным положительным отклонением, за которым следует большее отрицательное.Максимальные амплитуды Н-рефлекса и М-волны измерялись от пика положительного до пика отрицательного отклонения. Отношение H max к M max рассчитывали путем деления максимальной амплитуды H-рефлекса на амплитуду М-зубца. Латентность Н-рефлекса измеряли от начала стимуляции до начала начального отклонения Н-рефлекса.
РЕЗУЛЬТАТЫ
Двадцать пять последовательных пациентов с инсультом, которые соответствовали критериям включения в исследование, завершили оценку. Пациенты были сгруппированы в соответствии с тяжестью спастичности, измеренной с помощью MAS. Четырнадцать пациентов набрали 1 балл по шкале MAS (группа А) и 10 — 2 балла (группа В). Только один субъект имел 3 балла по шкале MAS и был исключен из дальнейшего анализа.
 Подробная информация о демографических и клинических данных пациентов представлена в таблице 2.
Подробная информация о демографических и клинических данных пациентов представлена в таблице 2.Таблица 2
Демографические и клинические данные пациентов
Средний возраст (диапазон) пациентов в группах А и В составил 62,4 (от 46 до 72) лет и 59,1 (от 46 до 81) лет соответственно. В каждой группе было по восемь человек. У пациентов в группе А средний период от начала инсульта составил 17,2 месяца по сравнению с 10,2 месяца в группе В. Средняя (SD) латентность Н-рефлекса для групп А и В составила 33,2 (2,6) мс и 34,5 (1,8) мс, соответственно. Разница между группами не была статистически значимой ( t = -1,32, df 22, p = 0,2). Анализ отношения H max :M max показал, что средние значения (SD) для группы А составили 0,55 (0,27), а для группы В — 0,58 (0,23). Различия между группами А и В также не были статистически значимыми ( t = -0,32, df 22, p = 0,7).
ОБСУЖДЕНИЕ
Мы решили установить, существует ли корреляция между показателями MAS и возбудимостью α-мотонейрона у субъектов с нелеченой мышечной спастичностью.
 Валидность MAS как клинического инструмента для оценки мышечной спастичности будет повышена, если такая корреляция может быть установлена. Это связано с тем, что повышенная возбудимость α-мотонейронов является важным механизмом мышечной спастичности. 7 В этом исследовании возбудимость α-мотонейрона оценивали путем измерения соотношения H max :M max и латентности H-рефлекса. Чувствительность этих тестов была подтверждена ранее. 7, 13, 14 Hiersemenzel и др. продемонстрировали три стадии адаптационных изменений возбудимости спинномозговых нейронов у пациентов с травмой спинного мозга. 15 Они обнаружили, что, хотя H-рефлекс может быть вызван вскоре после события, H 9Отношение 0093 max :M max достигало своего максимума через 8-24 недели и после этого оставалось стабильным. Поэтому было важно обследовать пациентов по крайней мере через шесть месяцев после начала заболевания, как мы это сделали в настоящем исследовании.
Валидность MAS как клинического инструмента для оценки мышечной спастичности будет повышена, если такая корреляция может быть установлена. Это связано с тем, что повышенная возбудимость α-мотонейронов является важным механизмом мышечной спастичности. 7 В этом исследовании возбудимость α-мотонейрона оценивали путем измерения соотношения H max :M max и латентности H-рефлекса. Чувствительность этих тестов была подтверждена ранее. 7, 13, 14 Hiersemenzel и др. продемонстрировали три стадии адаптационных изменений возбудимости спинномозговых нейронов у пациентов с травмой спинного мозга. 15 Они обнаружили, что, хотя H-рефлекс может быть вызван вскоре после события, H 9Отношение 0093 max :M max достигало своего максимума через 8-24 недели и после этого оставалось стабильным. Поэтому было важно обследовать пациентов по крайней мере через шесть месяцев после начала заболевания, как мы это сделали в настоящем исследовании.
Наши результаты подтверждают увеличение средних значений соотношения H max :M max в случайной выборке пациентов со спастичностью легкой и средней степени тяжести. Однако, как сообщалось ранее, 7 наблюдались заметные различия между людьми с одинаковой степенью гипертонии. Интересно, что H 9Соотношение 0093 max :M max было выше в группе пациентов с 2 баллами по шкале MAS, чем в группе пациентов с 1 баллом. Однако различия между группами не достигли статистической значимости. Исследование также показало снижение латентности Н-рефлекса в обеих группах, что согласуется с наблюдениями других исследователей. 13 Плохую корреляцию между отношением H max :M max и показателями MAS можно объяснить различными факторами, как показано ниже.
Во-первых, было высказано предположение, что зубец F является более чувствительным нейрофизиологическим индикатором спастичности, чем H-рефлекс. 13, 16 Мы не регистрировали у наших пациентов зубец F, и это могло отражать несоответствие между выраженностью мышечной спастичности и измеренной возбудимостью α-мотонейронов.
 Однако это объяснение маловероятно, потому что активность лишь очень небольшого процента популяции α-мотонейронов объясняет возникновение зубца F. 17
Однако это объяснение маловероятно, потому что активность лишь очень небольшого процента популяции α-мотонейронов объясняет возникновение зубца F. 17 Во-вторых, нейрофизиологические механизмы, лежащие в основе спастичности, включают изменения возбудимости интернейронов спинного мозга, а также α-мотонейрона. 7 Следовательно, разумно предположить, что изучение взаимосвязи между изменениями сегментарной цепи позвоночника и спастичностью мышц должно включать регистрацию флексорных рефлексов. Однако недавнее исследование эволюции нейрофизиологических изменений в сегментарной цепи позвоночника 15 показал, что амплитуда сгибательных рефлексов может снижаться по мере развития спастичности. Это ставит под сомнение клиническую ценность измерения амплитуд сгибательных рефлексов в хронической фазе спастичности. Тем не менее изучение корреляции длительно латентных рефлексов со спастичностью остается важным вопросом, требующим решения в будущих исследованиях.

Наконец, плохая корреляция между результатами нейрофизиологических тестов и степенью спастичности также может быть вызвана проблемами, присущими самой САМ. Эта шкала, основанная на субъективном суждении исследователя, измеряет устойчивость к пассивному растяжению мышц. Это сопротивление часто отражает сочетание спастичности, тиксотропии и фиксированных мышечных контрактур. 2, 3 Хотя в этом исследовании мы постарались исключить пациентов с клинически выявляемыми фиксированными контрактурами, невозможно быть уверенным, что изменения в структуре волокон или вязкоупругих свойствах мышц отсутствуют.
Выводы
Наше исследование показало более короткую латентность H-рефлекса и увеличение отношения H max :M max у пациентов с оценкой 1 или 2 по шкале MAS. Однако не удалось подтвердить линейную зависимость между этими переменными. Отсутствие линейной зависимости между MAS и H 9Соотношение 0093 max :M max могло отражать тот факт, что для этого исследования были набраны пациенты только с двумя степенями гипертонии.
 Включение пациентов с не менее чем тремя различными степенями по шкале MAS позволило бы нам сделать более точные выводы. Тем не менее, слабая корреляция между двумя методами предполагает, что MAS является плохой шкалой измерения мышечной спастичности, как определено вышеприведенными нейрофизиологическими тестами.
Включение пациентов с не менее чем тремя различными степенями по шкале MAS позволило бы нам сделать более точные выводы. Тем не менее, слабая корреляция между двумя методами предполагает, что MAS является плохой шкалой измерения мышечной спастичности, как определено вышеприведенными нейрофизиологическими тестами.ССЫЛКИ
- ↵
Боханнон РВ , Смит МБ. Межоценочная надежность модифицированной шкалы Эшворта мышечной спастичности. Phys Ther1987;67:206–7.
- ↵
- ↵
Ваттанасилп W , Ада Л., Кросби Дж. Вклад тиксотропии, спастичности и контрактуры в жесткость голеностопного сустава после инсульта.
 J Neurol Neurosurg Psychiatry2000;69:34–9.
J Neurol Neurosurg Psychiatry2000;69:34–9. - ↵
Хасс Б.М. , Бергстрем Э., Джамус А., и др. . Межэкспертная надежность оригинальной и модифицированной шкалы Эшворта для оценки спастичности у пациентов с травмой спинного мозга. Спинной мозг1996;34:560–4.
- ↵
Hufschmidt A , Mauritz K. Хроническая трансформация мышц при спастичности: периферический вклад в повышение тонуса. J Neurol Neurosurg Psychiatry, 1985; 48:676–85.
- ↵
Ибрагим И.К. , Бергер В., Триппель М., и др. . Индуцированная растяжением электромиографическая активность и крутящий момент спастических мышц локтевого сустава. Дифференциальная модуляция рефлекторной деятельности при пассивных и активных двигательных задачах. Мозг1993;116:971–89.
- ↵
Делвейд П.
 Дж. . Электрофизиологическое тестирование спастических пациентов: его потенциальная польза и ограничения. В: Delwaide PJ, Young RR, ред. Клиническая нейрофизиология спастичности. Вклад в оценку и патофизиологию . Амстердам: Эльзевир, 1985: 185–203.
Дж. . Электрофизиологическое тестирование спастических пациентов: его потенциальная польза и ограничения. В: Delwaide PJ, Young RR, ред. Клиническая нейрофизиология спастичности. Вклад в оценку и патофизиологию . Амстердам: Эльзевир, 1985: 185–203. - ↵
Ongerboer de Visser BW , Bour LJ, Koelman JHTM, и др. . Кумулятивные вибрационные индексы и отношение H/M H-рефлекса камбаловидной мышцы: количественное исследование у контрольных и спастических субъектов. Электроэнцефалогр Клин Нейрофизиол1989;73:162–6.
- ↵
Bour LJ , Ongerboer de Visser BW, Koelman JHTM, и др. . Тесты H-рефлекса Камбаловидной мышцы при спастичности и дистонии: компьютеризированный анализ. J Электромиогр Кинезиол1991;1:9–19.
- ↵
Ангел РВ , Хоффманн ВВ. H-рефлекс у нормальных, спастических и ригидных субъектов.
 Arch Neurol1963;8:591–6.
Arch Neurol1963;8:591–6. - ↵ Pandyan AD , Цена CIM, Curless RH, и др. . Обзор свойств и ограничений шкалы Эшворта и модифицированных шкал Эшворта как меры спастичности. Clin Rehabil1999;13:373–83.
- ↵
Брэддом Р.И. , Джонсон Э.В. Стандартизация H-рефлекса и его диагностическое использование при радикулопатии S1. Arch Phys Med Rehabil1974; 55: 161–6.
- ↵
Joodaki MR , Olyaei GR, Bagheri H. Влияние электрической стимуляции нижней конечности на параметры H-рефлекса и F-волны. Электромиогр Clin Neurophysiol2001;41:21–8.
- ↵
Роше Дж. , Руб К., Ниманн-Делиус Б., и др. . Влияние физиотерапии на амплитуду F-волны при спастичности. Электромиогр Clin Neurophysiol1996;36:509–11.

- ↵
Иерсеменцель Л-П , Курт А., Дитц В. От спинального шока к спастичности. Адаптация нейронов к повреждению спинного мозга. Неврология, 2000; 54:1574–82.
- ↵
Миланов Г.И. . Сравнение методов оценки возбудимости нижних мотонейронов. Can J Neurol Sci1992;19:64–8.
- ↵
Денглер Р. , Коссев А., Вольфарт К., и др. . Зубцы F и размер двигательной единицы. Мышечный нерв 1992;15:1138–42.
Сноски
Читать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Ассессшильд
Стандартизированные оценки для ведения детей с двигательными расстройствами
Авторы оценки: Bohannon & Smith (1987).

Описание оценки
Цель: Оценка гипертонии. В большинстве исследований клинического измерения спастичности и лечения спастического пареза последовательно использовалась модифицированная шкала Эшворта, шкала измерения тонуса или жесткости, которая стала де-факто стандартом критерия. Однако шкала просто измеряет сопротивление пассивным движениям сустава, что не является исключительным показателем спастичности.
Поэтому, если быть более точным, целью MAS является оценка гипертонии.
Гипертонус определяется как аномально повышенное сопротивление движению сустава извне. Это может быть вызвано (1) спастичностью, (2) дистонией, (3) ригидностью (неподвижность сустава) или (4) сочетанием признаков.
Детали оценки
Стремясь повысить надежность MAS, Боханнон и Смит (1987) предложено:
- Провести обследование больного в положении лежа на спине.

- Растяните сустав от положения максимально возможного сгибания до максимально возможного разгибания.
- Стандартизируйте положение рук и конечностей в состоянии покоя перед растяжкой. Однако Боханнон и Смит предоставили инструкции только для локтя. Для целей этой образовательной программы исследователи разработали конкретные пошаговые руководства по процедурам для 2 суставов верхних и 2 нижних конечностей.
- Стандартизируйте время разгибания конечности: используйте продолжительность около одной секунды (считая «тысяча один»).
- Сведите к минимуму повторяющиеся циклы движения. Повторите измерение от 5 до 8 раз и выберите наиболее надежное/последовательное измерение.
Для дальнейшего повышения надежности MAS исследователи этой образовательной программы предлагают разделить доступный диапазон движения на четверти. Повышенный мышечный тонус, сопротивление, захват и освобождение или клонус будут оцениваться в зависимости от местоположения в этих четвертях:
1
Относится к захвату и отпусканию / клонусу ИЛИ минимальному сопротивлению в 4-й четверти доступного диапазона движения.

1+
Относится к захвату и отпусканию / клонусу с последующим минимальным сопротивлением в 3-й четверти доступного диапазона движения.
2 или 3
Относится к увеличению мышечного тонуса, которое начинается в 1-й или 2-й четверти доступного диапазона движения.
Ключевые компоненты надежного измерения тона с помощью MAS включают:
- Понимание определений MAS и точное вычисление четвертей доступного диапазона.
- Сохранение неизменного положения тела и конечностей пациента и стабилизация проксимального сегмента конечности.
- Использование стандартного положения рук для клиницистов.
- Использование постоянной скорости движения в одну секунду для всего доступного диапазона.

- Способность клиницистов распознавать различные проявления мышечного сопротивления.
- Способность клиницистов определять максимальное сгибание, максимальное разгибание и точно определять место, где начинается сопротивление.
- Точная запись всех измерений и расчетов.
- Необходимость практиковать стандартизированный процесс для достижения мастерства и точности — даже для опытных клиницистов.
Система оценок
Простая числовая оценка сопротивления пассивному движению вокруг сустава, измеряемая по шкале от 0 (отсутствие сопротивления) до 4 (неподвижный сустав).
0 Нет повышения мышечного тонуса. Нормальный мышечный тонус. 1 Легкое повышение тонуса, проявляющееся в виде захвата и отпускания или минимального сопротивления в конце диапазона движений при сгибании или разгибании пораженной части.  [4-й КВАРТАЛ]
[4-й КВАРТАЛ]1+ Небольшое повышение тонуса, проявляющееся захватом с последующим минимальным сопротивлением на протяжении всего остального (менее половины) объема движения. [3-я ЧЕТВЕРТЬ] 2 Более выраженное повышение мышечного тонуса в большей части диапазона движений, но пораженные части легко двигаются. [1-й или 2-й КВАРТАЛ] 3 Значительное повышение мышечного тонуса; пассивные движения затруднены. [1-й или 2-й КВАРТАЛ] 4 Пораженная часть ригидна при сгибании или разгибании. Стремясь повысить надежность MAS, Bohannon и Smith (1987) предложили:
- Тестировать пациента в положении лежа на спине.
- Растяните сустав от положения максимально возможного сгибания до максимально возможного разгибания.

- Стандартизируйте положение рук и конечностей в состоянии покоя перед растяжкой. Однако Боханнон и Смит предоставили инструкции только для локтя. Для целей этой образовательной программы исследователи разработали конкретные пошаговые руководства по процедурам для 2 суставов верхних и 2 нижних конечностей.
- Стандартизируйте время разгибания конечности: используйте продолжительность около одной секунды (считая «тысяча один»).
- Сведите к минимуму повторяющиеся циклы движения. Повторите измерение от 5 до 8 раз и выберите наиболее надежное/последовательное измерение.
Для дальнейшего повышения надежности MAS исследователи этой образовательной программы предлагают разделить доступный диапазон движения на четверти. Повышенный мышечный тонус, сопротивление, захват и освобождение или клонус будут оцениваться в зависимости от местоположения в этих четвертях:
1
Относится к захвату и отпусканию / клонусу ИЛИ минимальному сопротивлению в 4-й четверти доступного диапазона движения.

1+
Относится к захвату и отпусканию / клонусу с последующим минимальным сопротивлением в 3-й четверти доступного диапазона движения.
2 или 3
Относится к увеличению мышечного тонуса, которое начинается в 1-й или 2-й четверти доступного диапазона движения.
Ключевые компоненты надежного измерения тона с помощью MAS включают:
- Понимание определений MAS и точное вычисление четвертей доступного диапазона.
- Сохранение неизменного положения тела и конечностей пациента и стабилизация проксимального сегмента конечности.
- Использование стандартного положения рук для клиницистов.
- Использование постоянной скорости движения в одну секунду для всего доступного диапазона.

- Способность клиницистов распознавать различные проявления мышечного сопротивления.
- Способность клиницистов определять максимальное сгибание, максимальное разгибание и точно определять место, где начинается сопротивление.
- Точная запись всех измерений и расчетов.
- Необходимость практиковать стандартизированный процесс для достижения мастерства и точности — даже для опытных клиницистов.
Простая числовая оценка сопротивления пассивному движению вокруг сустава, измеряемая по шкале от 0 (отсутствие сопротивления) до 4 (неподвижный сустав).
> > >0 Нет повышения мышечного тонуса. Нормальный мышечный тонус. 1 Легкое повышение тонуса, проявляющееся в виде захвата и отпускания или минимального сопротивления в конце диапазона движений при сгибании или разгибании пораженной части.  [4-й КВАРТАЛ]
[4-й КВАРТАЛ]1+ Небольшое повышение тонуса, проявляющееся захватом с последующим минимальным сопротивлением на протяжении всего остального (менее половины) объема движения. [3-я ЧЕТВЕРТЬ] 2 Более выраженное повышение мышечного тонуса в большей части диапазона движений, но пораженные части легко двигаются. [1-й или 2-й КВАРТАЛ] 3 Значительное повышение мышечного тонуса; пассивные движения затруднены. [1-й или 2-й КВАРТАЛ] 4 Пораженная часть ригидна при сгибании или разгибании. Разработка оценки
Шкала Эшворта (Ashworth 1964) изначально была разработана для изучения влияния антиспастических препаратов на спастичность у взрослых с рассеянным склерозом.
 Эшворт предложил метод измерения «спастичности» мышц путем ручного перемещения конечности по диапазону движений для пассивного растяжения определенных групп мышц. Первоначальная пятибалльная порядковая шкала оценивала сопротивление, встречающееся во время такого пассивного растяжения мышц, по шкале от 0 (отсутствие сопротивления) до 4 (ригидность).
Эшворт предложил метод измерения «спастичности» мышц путем ручного перемещения конечности по диапазону движений для пассивного растяжения определенных групп мышц. Первоначальная пятибалльная порядковая шкала оценивала сопротивление, встречающееся во время такого пассивного растяжения мышц, по шкале от 0 (отсутствие сопротивления) до 4 (ригидность).Bohannon и Smith (1987) сообщили, что в их предыдущем опыте со шкалой Эшворта многие взрослые пациенты с гемиплегией демонстрировали уровни «спастичности», определяемые градациями в нижней части шкалы Эшворта, и что степень «1» был нескромным. Чтобы сделать шкалу более дискретной, они добавили оценку «1+», чтобы указать сопротивление менее чем на половине движения, и немного изменили определения. Эту новую шкалу обычно называют модифицированной шкалой Эшворта (MAS).
Надежность MAS часто обсуждается. В дополнение к вопросам, касающимся отношения сопротивления движению к спастичности и неточным описаниям различных степеней по шкале, трудно сравнивать оценки надежности различных исследований из-за отсутствия:
- Четко определенного включения/ критерий исключения.

- Специальный протокол для процедуры оценки.
- Зависит от количества использованных оценщиков и их опыта.
- Адекватные размеры выборки.
- Сосредоточьтесь только на определенной группе мышц.
- Надежность результатов зависит от группы мышц.
- Широкий выбор статистических анализов.
- Различное время между повторными испытаниями.
ИССЛЕДОВАНИЯ НАДЕЖНОСТИ MAS У ПЕДИАТРИЧЕСКИХ И ВЗРОСЛЫХ УЧАСТНИКОВ ТАБЛИЦА
Большинство исследований валидности направлены на сопоставление MAS с другими клиническими измерениями спастичности, нейрофизиологическими показателями или биомеханическими показателями или на проверку чувствительности MAS для выявления изменений после лечения. Некоторые исследования не подтверждают достоверность MAS, в то время как другие исследования подтверждают ее.
 И равное количество исследований подтверждает оба вывода (положительные корреляции только для определенных нейрофизиологических или биомеханических показателей или поддержка только определенных групп мышц). Важно отметить, что многие из этих исследований предоставляют мало информации об субъектах, протоколе оценки или других аспектах исследования, что не только затрудняет сравнение, но и затрудняет критическое рассмотрение результатов. Кроме того, многие исследования проводятся с небольшим числом участников или ограничиваются оценками только одной или двух групп мышц. Кроме того, само определение корреляции, классифицируемой как плохая, удовлетворительная, адекватная, хорошая или отличная, варьируется от исследования к исследованию. Наконец, в некоторых исследованиях не удалось понять, что это номинальная или потенциально порядковая шкала, и ее не следует использовать в качестве шкалы интервалов или отношений.
И равное количество исследований подтверждает оба вывода (положительные корреляции только для определенных нейрофизиологических или биомеханических показателей или поддержка только определенных групп мышц). Важно отметить, что многие из этих исследований предоставляют мало информации об субъектах, протоколе оценки или других аспектах исследования, что не только затрудняет сравнение, но и затрудняет критическое рассмотрение результатов. Кроме того, многие исследования проводятся с небольшим числом участников или ограничиваются оценками только одной или двух групп мышц. Кроме того, само определение корреляции, классифицируемой как плохая, удовлетворительная, адекватная, хорошая или отличная, варьируется от исследования к исследованию. Наконец, в некоторых исследованиях не удалось понять, что это номинальная или потенциально порядковая шкала, и ее не следует использовать в качестве шкалы интервалов или отношений.В общем, имеется достаточно доказательств, чтобы заключить, что MAS является достоверным показателем сопротивления пассивному движению.

Для любого исследования с использованием MAS крайне важно, чтобы были четко определены критерии включения и исключения, стандартизированный протокол оценки группы мышц (положение пациента и конечности, количество повторений измерения, скорость и т. д.) используется, а также устанавливаются точные определения различных оценок.
ИССЛЕДОВАНИЯ ДЕЙСТВИТЕЛЬНОСТИ MAS У ПЕДИАТРИЧЕСКИХ И ВЗРОСЛЫХ УЧАСТНИКОВ ТАБЛИЦА
Профи
- Бесплатно.
- Простая рейтинговая шкала.
- Может использоваться для большинства групп мышц.
- Дополнительное оборудование не требуется.
- Используется у детей и взрослых.
- Используется в любых популяциях с гипертонусом.
- Стандартизация техники оценки (положение пациента, положение рук исследователя, скорость и т. д.) и адекватное обучение повышают надежность и достоверность измерений.

Минусы
Такие инструменты, как шкала Эшворта и модифицированная шкала Эшворта, использовались в клинических испытаниях при условии, что они измеряют спастичность. Однако в настоящее время установлено, что эти инструменты оценивают сочетание контрактуры мягких тканей и спастической дистонии в дополнение к самой спастичности.
В описании степеней по шкале Эшворта степень 1 является единственной, описывающей однозначную спастическую реакцию: это «поймал-и-отпусти» или минимальное сопротивление в некотором диапазоне движений. Эти два события типичны для сокращения мышц при растяжении. «Поймай и отпусти» соответствует феномену складного ножа (внезапное исчезновение сопротивления во время растягивающего движения). Постоянное минимальное сопротивление соответствует разрядке двигательных единиц, которая недостаточно синхронна, чтобы создать крутящий момент, который может остановить движение исследователя. Сопротивление из-за пассивной ткани будет увеличиваться по мере движения и не будет оставаться «минимальным».

Описание для степеней от 2 до 4 является чисто субъективным и может охватывать резистентность из-за:
- Контрактуры мышц или суставов.
- Спастическая дистония.
- Сокращение мышц при растяжении (единственное, что действительно является спастичностью).
Таким образом, шкала Эшворта не является специфичной для спастичности. Кроме того, не появляется понятие зависимости от скорости.
Были отмечены дополнительные проблемы:
- Некоторые группы мышц более надежны, чем другие.
- Результаты могут отличаться из-за неправильного положения пациента:
– Трудности в поддержании выравнивания головы и положения противоположных конечностей.
– Трудность стабилизации проксимального отдела конечности. - Размер пациента может повлиять на результаты: (особенно у пациентов с крупными конечностями):
– Неспособность развить достаточную скорость в коленном суставе для стабильного захвата.
– Трудности с адекватной стабилизацией проксимального отдела конечности. - Размер исследователя может повлиять на результаты:
– Невысокому исследователю может быть трудно стабилизироваться, если пациент находится на высокой поверхности.
– Невысокий исследователь может располагать руки в разных местах, чем высокий исследователь, на длинной конечности.
– Высокий врач может испытывать трудности с визуализацией угла сустава из-за необходимости наклоняться. - Сила исследователя может привести к ошибке в измерениях:
– Более сильный исследователь может показать другую скорость в любом суставе, особенно в колене.
– Более слабый исследователь может быть не в состоянии развить скорость, достаточную для захвата крупной конечности. - Отсутствие опыта может повлиять на результаты:
– Страх причинить боль пациенту при преодолении дистонии для достижения полного диапазона движений.
- 1 449.
- 1 499999
- 1 49999
- 1 49999

 » Захват » — это внезапное незначительное повышение мышечного тонуса в любой точке амплитуды движения в суставе.
» Захват » — это внезапное незначительное повышение мышечного тонуса в любой точке амплитуды движения в суставе.

 Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами. Однако этот метод имеет важные ограничения. Гипертонус у пациентов с поражением верхних мотонейронов является результатом сочетания спастичности, тиксотропии и изменений вязкоупругих свойств мышц, что в конечном итоге может привести к развитию фиксированных мышечных контрактур. 2, 3 MAS не позволяет надежно различать эти компоненты гипертонии. Более того, межэкспертная и внутриэкспертная надежность этой шкалы при оценке спастичности нижних конечностей остается сомнительной. 4 Еще одно ограничение MAS заключается в том, что условия испытаний не были стандартизированы. Например, в то время как некоторые клиницисты оценивают мышечный тонус в состоянии покоя без предварительного растяжения мышц, другие 5 рекомендуют несколько раз сгибать и разгибать конечность непосредственно перед фактическим измерением. Это отсутствие стандартизации может привести к ошибкам измерения, поскольку возбудимость рефлекса растяжения в состоянии покоя может отличаться от возбудимости активированной мышцы.
Однако этот метод имеет важные ограничения. Гипертонус у пациентов с поражением верхних мотонейронов является результатом сочетания спастичности, тиксотропии и изменений вязкоупругих свойств мышц, что в конечном итоге может привести к развитию фиксированных мышечных контрактур. 2, 3 MAS не позволяет надежно различать эти компоненты гипертонии. Более того, межэкспертная и внутриэкспертная надежность этой шкалы при оценке спастичности нижних конечностей остается сомнительной. 4 Еще одно ограничение MAS заключается в том, что условия испытаний не были стандартизированы. Например, в то время как некоторые клиницисты оценивают мышечный тонус в состоянии покоя без предварительного растяжения мышц, другие 5 рекомендуют несколько раз сгибать и разгибать конечность непосредственно перед фактическим измерением. Это отсутствие стандартизации может привести к ошибкам измерения, поскольку возбудимость рефлекса растяжения в состоянии покоя может отличаться от возбудимости активированной мышцы. 6
6 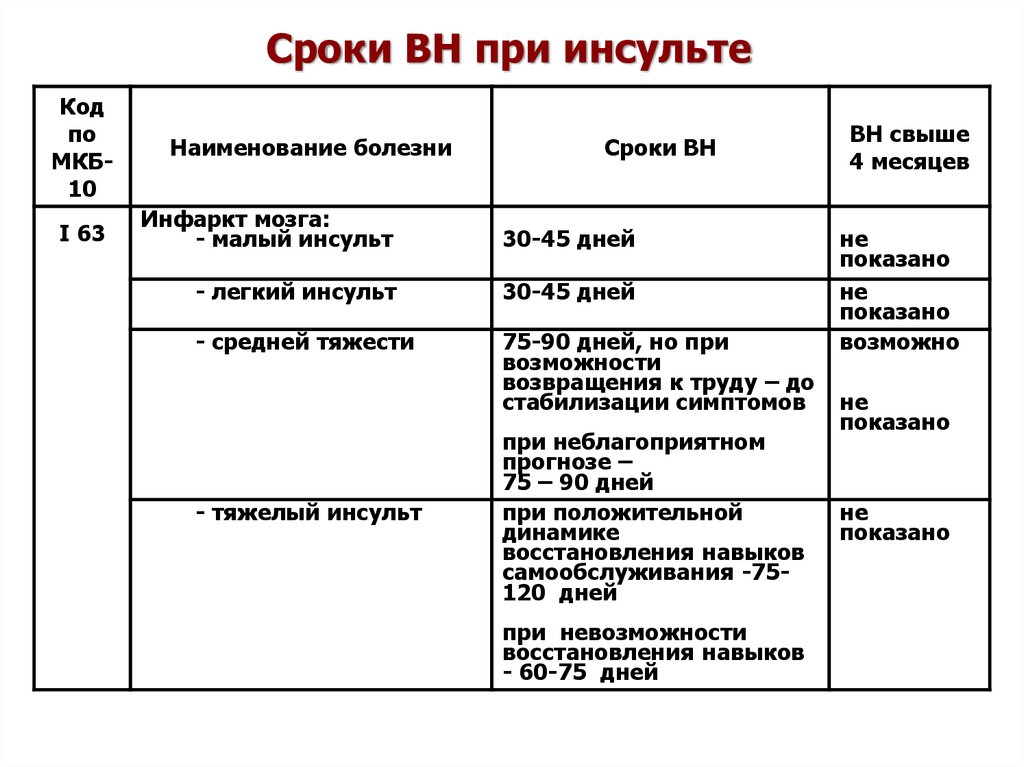 Тем не менее, они являются ценными объективными инструментами, которые могут быть полезны для проверки других менее надежных исходных показателей мышечной спастичности.
Тем не менее, они являются ценными объективными инструментами, которые могут быть полезны для проверки других менее надежных исходных показателей мышечной спастичности. Были исключены пациенты с фиксированными мышечными контрактурами в голеностопном суставе. Фиксированная мышечная контрактура считалась присутствующей, если диапазон движения в голеностопном суставе при пассивном растяжении был сильно или полностью ограничен, то есть оценка по шкале MAS равнялась 4 (см. ниже). Оценка мышечного тонуса и нейрофизиологические тесты проводились на одном сеансе. Оценку мышечного тонуса всегда проводили в первую очередь.
Были исключены пациенты с фиксированными мышечными контрактурами в голеностопном суставе. Фиксированная мышечная контрактура считалась присутствующей, если диапазон движения в голеностопном суставе при пассивном растяжении был сильно или полностью ограничен, то есть оценка по шкале MAS равнялась 4 (см. ниже). Оценка мышечного тонуса и нейрофизиологические тесты проводились на одном сеансе. Оценку мышечного тонуса всегда проводили в первую очередь. Все тесты проводились одним исследователем, чтобы исключить межэкспертную изменчивость.
Все тесты проводились одним исследователем, чтобы исключить межэкспертную изменчивость.
 Затем интенсивность стимула увеличивали с небольшими приращениями до тех пор, пока не был получен максимальный ответ М. H-рефлекс был идентифицирован как трехфазная волна с небольшим начальным положительным отклонением, за которым следует большее отрицательное.
Затем интенсивность стимула увеличивали с небольшими приращениями до тех пор, пока не был получен максимальный ответ М. H-рефлекс был идентифицирован как трехфазная волна с небольшим начальным положительным отклонением, за которым следует большее отрицательное. Подробная информация о демографических и клинических данных пациентов представлена в таблице 2.
Подробная информация о демографических и клинических данных пациентов представлена в таблице 2. Валидность MAS как клинического инструмента для оценки мышечной спастичности будет повышена, если такая корреляция может быть установлена. Это связано с тем, что повышенная возбудимость α-мотонейронов является важным механизмом мышечной спастичности. 7 В этом исследовании возбудимость α-мотонейрона оценивали путем измерения соотношения H max :M max и латентности H-рефлекса. Чувствительность этих тестов была подтверждена ранее. 7, 13, 14 Hiersemenzel и др. продемонстрировали три стадии адаптационных изменений возбудимости спинномозговых нейронов у пациентов с травмой спинного мозга. 15 Они обнаружили, что, хотя H-рефлекс может быть вызван вскоре после события, H 9Отношение 0093 max :M max достигало своего максимума через 8-24 недели и после этого оставалось стабильным. Поэтому было важно обследовать пациентов по крайней мере через шесть месяцев после начала заболевания, как мы это сделали в настоящем исследовании.
Валидность MAS как клинического инструмента для оценки мышечной спастичности будет повышена, если такая корреляция может быть установлена. Это связано с тем, что повышенная возбудимость α-мотонейронов является важным механизмом мышечной спастичности. 7 В этом исследовании возбудимость α-мотонейрона оценивали путем измерения соотношения H max :M max и латентности H-рефлекса. Чувствительность этих тестов была подтверждена ранее. 7, 13, 14 Hiersemenzel и др. продемонстрировали три стадии адаптационных изменений возбудимости спинномозговых нейронов у пациентов с травмой спинного мозга. 15 Они обнаружили, что, хотя H-рефлекс может быть вызван вскоре после события, H 9Отношение 0093 max :M max достигало своего максимума через 8-24 недели и после этого оставалось стабильным. Поэтому было важно обследовать пациентов по крайней мере через шесть месяцев после начала заболевания, как мы это сделали в настоящем исследовании.
 Однако это объяснение маловероятно, потому что активность лишь очень небольшого процента популяции α-мотонейронов объясняет возникновение зубца F. 17
Однако это объяснение маловероятно, потому что активность лишь очень небольшого процента популяции α-мотонейронов объясняет возникновение зубца F. 17 
 Включение пациентов с не менее чем тремя различными степенями по шкале MAS позволило бы нам сделать более точные выводы. Тем не менее, слабая корреляция между двумя методами предполагает, что MAS является плохой шкалой измерения мышечной спастичности, как определено вышеприведенными нейрофизиологическими тестами.
Включение пациентов с не менее чем тремя различными степенями по шкале MAS позволило бы нам сделать более точные выводы. Тем не менее, слабая корреляция между двумя методами предполагает, что MAS является плохой шкалой измерения мышечной спастичности, как определено вышеприведенными нейрофизиологическими тестами.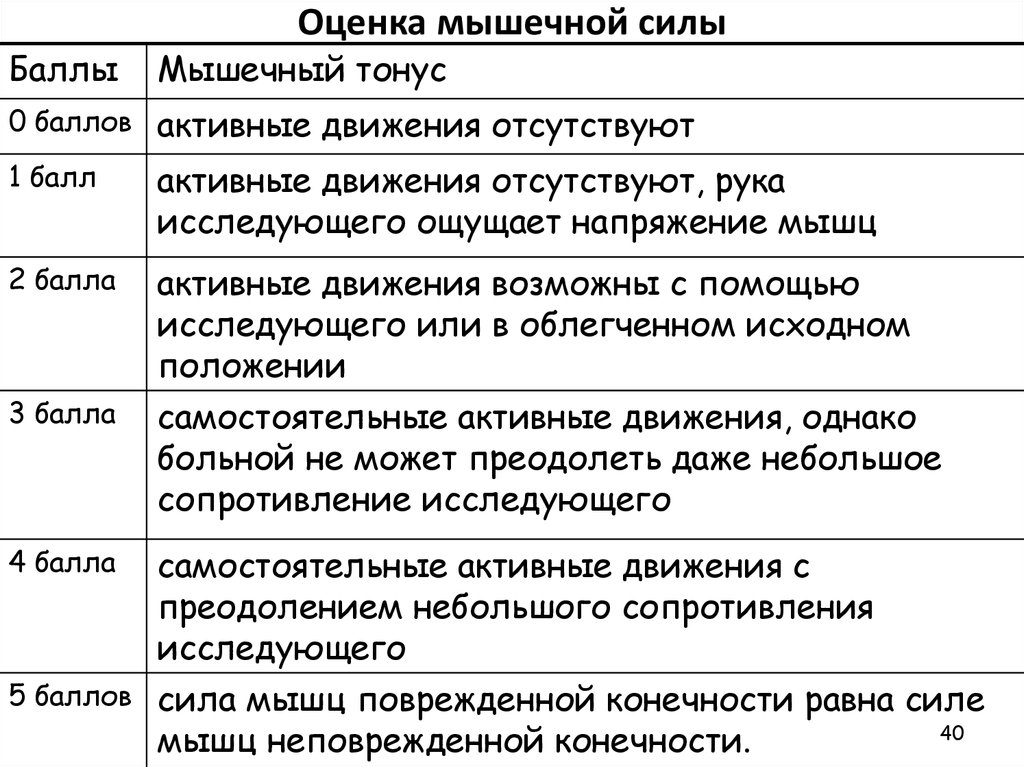 J Neurol Neurosurg Psychiatry2000;69:34–9.
J Neurol Neurosurg Psychiatry2000;69:34–9.  Дж. . Электрофизиологическое тестирование спастических пациентов: его потенциальная польза и ограничения. В: Delwaide PJ, Young RR, ред. Клиническая нейрофизиология спастичности. Вклад в оценку и патофизиологию . Амстердам: Эльзевир, 1985: 185–203.
Дж. . Электрофизиологическое тестирование спастических пациентов: его потенциальная польза и ограничения. В: Delwaide PJ, Young RR, ред. Клиническая нейрофизиология спастичности. Вклад в оценку и патофизиологию . Амстердам: Эльзевир, 1985: 185–203. Arch Neurol1963;8:591–6.
Arch Neurol1963;8:591–6. 



 [4-й КВАРТАЛ]
[4-й КВАРТАЛ]

 [4-й КВАРТАЛ]
[4-й КВАРТАЛ]/032/032_2.jpg) Эшворт предложил метод измерения «спастичности» мышц путем ручного перемещения конечности по диапазону движений для пассивного растяжения определенных групп мышц. Первоначальная пятибалльная порядковая шкала оценивала сопротивление, встречающееся во время такого пассивного растяжения мышц, по шкале от 0 (отсутствие сопротивления) до 4 (ригидность).
Эшворт предложил метод измерения «спастичности» мышц путем ручного перемещения конечности по диапазону движений для пассивного растяжения определенных групп мышц. Первоначальная пятибалльная порядковая шкала оценивала сопротивление, встречающееся во время такого пассивного растяжения мышц, по шкале от 0 (отсутствие сопротивления) до 4 (ригидность).
 И равное количество исследований подтверждает оба вывода (положительные корреляции только для определенных нейрофизиологических или биомеханических показателей или поддержка только определенных групп мышц). Важно отметить, что многие из этих исследований предоставляют мало информации об субъектах, протоколе оценки или других аспектах исследования, что не только затрудняет сравнение, но и затрудняет критическое рассмотрение результатов. Кроме того, многие исследования проводятся с небольшим числом участников или ограничиваются оценками только одной или двух групп мышц. Кроме того, само определение корреляции, классифицируемой как плохая, удовлетворительная, адекватная, хорошая или отличная, варьируется от исследования к исследованию. Наконец, в некоторых исследованиях не удалось понять, что это номинальная или потенциально порядковая шкала, и ее не следует использовать в качестве шкалы интервалов или отношений.
И равное количество исследований подтверждает оба вывода (положительные корреляции только для определенных нейрофизиологических или биомеханических показателей или поддержка только определенных групп мышц). Важно отметить, что многие из этих исследований предоставляют мало информации об субъектах, протоколе оценки или других аспектах исследования, что не только затрудняет сравнение, но и затрудняет критическое рассмотрение результатов. Кроме того, многие исследования проводятся с небольшим числом участников или ограничиваются оценками только одной или двух групп мышц. Кроме того, само определение корреляции, классифицируемой как плохая, удовлетворительная, адекватная, хорошая или отличная, варьируется от исследования к исследованию. Наконец, в некоторых исследованиях не удалось понять, что это номинальная или потенциально порядковая шкала, и ее не следует использовать в качестве шкалы интервалов или отношений.



