Шкала chads2 vasc: Шкала CHA2DS2-VASC (оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий)
RISK OF THROMBOEMBOLIC COMPLICATIONS AND ANTITHROMBOTIC THERAPY IN IN-PATIENTS WITH PERMANENT AND RECURRENT ATRIAL FIBRILLATION IN REAL CLINICAL PRACTICE | Grajfer
1. National guidelines for the diagnosis and treatment of atrial fibrillation. Rational Pharmacother Card 2011; 4 (suppl): 1–80. Russian (Национальные рекомендации по диагностике и лечению фибрилляции предсердий. РФК 2011; 4 (приложение): 1–80.
2. Camm A.J., Kirchhof P., Lip G.Y. et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Europace 2010;12:1360–1420.
3. Fuster V., Rydén L.E., Cannom D.S. et al. 2011 ACCF/AHA/HRS Focused Updates Incorporated Into the ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123:e269–e367.
4. Heeringa J., van der Kuip D.A., Hofman A. et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006;27:949–953.
5. Lloyd-Jones D.M., Wang T.J., Leip E.P. et al Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 2004;110(9):1042–1046.
6. Benjamin E.J., Wolf P.A., D’Agostino R.B. et al Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998; 98(10):946–952.
7. Stewart S., Hart C.L., Hole D.J., McMurray J.J. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002;113(5): 359–64.
Stewart S., Hart C.L., Hole D.J., McMurray J.J. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002;113(5): 359–64.
8. Lip G.Y.H. Stroke in atrial fibrillation: epidemiology and thromboprophylaxis. J Thromb Haemost 2011;9 (Suppl 1): 344–351.
9. Hughes M., Lip G.Y.H., on behalf of the Guideline Development Group for the NICE national clinical guideline for management of atrial fibrillation in primary and secondary care Stroke and thromboembolism in atrial fibrillation: A systematic review of stroke risk factors, risk stratification schema and cost effectiveness data. J Thromb Haemost 2008; 99: 295–304.
10. Dulli D.A., Stanko H., Levine R.L. Atrial fibrillation is associated with severe acute ischemic stroke. Neuroepidemiology 2003;22:118–123.
11. Lin H.J., Wolf P.A., Kelly-Hayes M. et al Stroke severity in atrial fibrillation. The Framingham Study. Stroke 1996;27:1760–1764.
12. Nieuwlaat R., Olsson S.B., Lip G.Y. et al European Heart Survey Investigators. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005;26:2422–2434.
13. Veronique L.R., Alan S.G., Donald M.L.-J. et al. Heart Disease and Stroke Statistics: 2011 Update: A Report From the American Heart Association. Circulation 2011;123;e18–e209.
14. Hart R.G., Halperin J.L. Atrial fibrillation and stroke: concepts and controversies.
15. Wolf P.A., Abbott R.D., Kannel W.B. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:983–988.
16. Gage B.F., Waterman A.D., Shannon W. et al Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001;285:2864–2870.
17. Lip G.Y., Nieuwlaat R., Pisters R. et al Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010;137:263–272.
18. Lip G.Y.H. Can We Predict Stroke in Atrial Fibrillation? Clin Cardiol 2012;35, S1:21–27.
19. Sandhu R.K., Bakal J.A., Ezekowitz J.A., McAlister F.A. Risk stratification schemes, anticoagulation use and outcomes: the risk-treatment paradox in patients with newly diagnosed non-valvular atrial fibrillation. Heart 2011 97(24):2046–2050.
20. Olesen J.B., Torp-Pedersen C., Hansen M.L., Lip G.Y. The value of the CHA2DS2–VASc score for refining stroke risk stratification in patients with atrial fibrillation with a CHADS2 score 0–1: A nationwide cohort study. Thromb Haemost 2012;107(6):1172–1179.
21. Mason P.K.Т, Lake D.E.Т, DiMarco J.P.Т. et al. Impact of the CHA2DS2–VASc Score on Anticoagulation Recommendations for Atrial Fibrillation. The American Journal of Medicine 2012;6(125): 603.e1–603.e6.
22. Olesen J.B., Lip G.Y., Hansen M.L. et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ 2011; 342:d124.
Olesen J.B., Lip G.Y., Hansen M.L. et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ 2011; 342:d124.
23. Taillandier S., Olesen J.B., Clémenty N. et al. Prognosis in Patients with Atrial Fibrillation and CHA(2)DS(2)–VASc Score = 0 in a Community-Based Cohort Study. J Cardiovasc Electrophysiol 2012; 23(7): 708–13.
25. Healey J.S., Connolly S.J., Gold M.R. et al. Subclinical Atrial Fibrillation and the Risk of Stroke. N Engl J Med 2012;366:120–129.
26. Hohnloser S.H., Pajitnev D., Pogue, J. et al. Incidence of Stroke in Paroxysmal Versus Sustained Atrial Fibrillation in Patients Taking Oral Anticoagulation or Combined Antiplatelet Therapy: An ACTIVE W Substudy. JACC 2007; 50(22): 2156 – 2161.
27. Hart R.G., Pearce L.A., Rothbart R.M. et al. Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. Stroke Prevention in Atrial Fibrillation Investigators. J Am Coll Car-diol 2000;35(1):183–187.
28. Andersen L.V., Vestergaard P., Deichgraeber P., et al. Warfarin for the prevention of systemic embolism in patients with non-valvular atrial fibrillation: a meta-analysis. Heart 2008; 94: 1607–1613.
29. Rebrova O. Statistical analysis of medical data. Application software package STATISTICA. Moscow: Mediasfera; 2002. Russian (Реброва. О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиасфера; 2002.
Application software package STATISTICA. Moscow: Mediasfera; 2002. Russian (Реброва. О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиасфера; 2002.
30. Lang T.A., Secic M. How To Report Statistics in Medicine. Annotated Guidelines for Authors, Editors, and Reviewers. Moscow: Prakticheskaya meditsina; 2011. Russian (Ланг Т.А., Сесик М. Как описывать статистику в медицине. Аннотированное руководство для авторов, редакторов и рецензентов. М.: Практическая медицина; 2011).
31. Friberg L., Rosenqvist M., Lip G.Y.H. Evaluation of risk stratification schemes for ischemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J 2012;33:1500–1510.
Шкала CHA2DS2VASc | Онлайн калькулятор
Рейтинг: 5/5 • 3 голоса
Оценить
Шкала CHA2DS2VASc является простым и доступным методом для оценки риска развития инсульта и тромбоэмболических осложнений у пациентов с трепетанием и фибрилляцией предсердий. Шкала является дальнейшим развитием шкалы CHADS2, в которую добавлены дополнительные факторы риска развития инсульта.
РассчитатьОчистить
×Набрано 0 баллов. Ожидаемая частота инсультов за год — 0%.
Рекомендуется прием аспирина 75-325мг в сутки или отсутствие антитромботической терапии
CHA2DS2-VASc это аббревиатура, образованная из начальных букв английских словосочетаний:
- Congestive heart failure – хроническая сердечная недостаточность
- Hypertension – гипертоническая болезнь
- Age – возраст старше 75 лет,
- Diabetes mellitus – сахарный диабет
- Stroke – инсульт/ТИА/системный эмболизм в анамнезе
- Vascular disease – поражение сосудов (инфаркт миокарда в анамнезе, атеросклероз периферических артерий, атеросклероз аорты)
- Age – возраст 65–74 лет
- Sex category – пол (женский)
Оценка риска проводится по следующим таблицам. По имеющимся у пациента с фибрилляцией/трепетанием предсердий факторам риска проводится подсчет баллов.
По имеющимся у пациента с фибрилляцией/трепетанием предсердий факторам риска проводится подсчет баллов.
| Фактор риска | Баллы |
|---|---|
| Инсульт, транзиторная ишемическая атака или артериальная тромбоэмболия в анамнезе | 2 |
| Возраст ≥75 лет | 2 |
| Артериальная гипертензия | 1 |
| Сахарный диабет | 1 |
| Инсульт, транзиторная ишемическая атака или другие эмболические осложнения | 1 |
| Сосудистое заболевание (инфаркт миокарда в анамнезе, периферический атеросклероз, атеросклеротические бляшки в аорте) | 1 |
| Возраст 65-74 года | 1 |
| Женский пол | 1 |
В зависимости от набранных баллов оценивается ожидаемая частота инсультов за год…
| Сумма баллов по шкале CHA2DS2-VASc | Ожидаемая частота инсультов за год |
|---|---|
| 0 | 0.0 % |
| 1 | 1.3 % |
| 2 | 2.2 % |
| 3 | 3.2 % |
| 4 | 4.0 % |
| 5 | 6.7 % |
| 6 | 9.8 % |
| 7 | 9.6 % |
| 8 | 6.7 % |
| 9 | 15.2 % |
И рекомендованная антитромботическая терапия.
| Категория риска | Баллы по шкале CHA2DS2- VASc | Рекомендованная антитромботическая терапия |
|---|---|---|
| 1 “крупный” фактор риска или ≥2 клинически значимых “не крупных” факторов риска | ≥ 2 | Антагонист витамина К (например, варфарин) с целевым МНО 2.5 (2.0-3.0)* |
| 1 клинически значимый “не крупный” фактор риска | 1 | Пероральный антикоагулянт (предпочтительно) или аспирин 75-325 мг в сутки |
| Нет факторов риска | 0 | Аспирин 75-325 мг в сутки или отсутствие антитромботической терапии (предпочтительно) |
Примечание: * при механических протезах клапанов сердца целевое МНО может быть выше.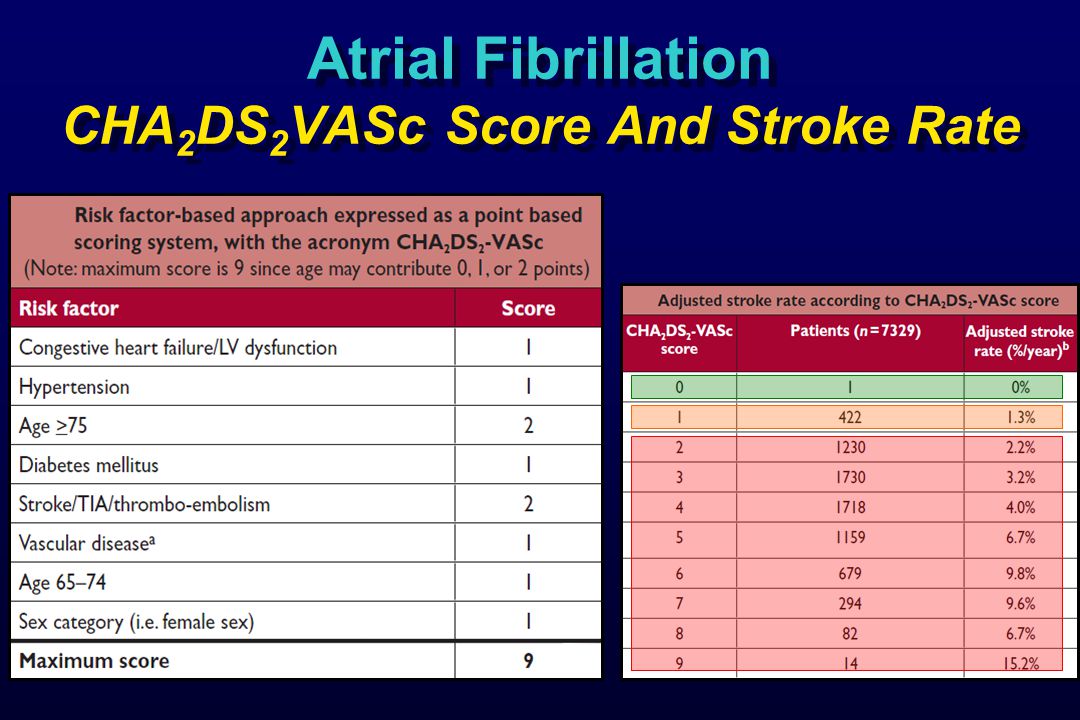
Шкала оценки риска тромбоэмболии CHA2DS2-VASc
Основными факторами развития инсульта являются старческий возраст, артериальная гипертензия (АГ), сердечная недостаточность и сахарный диабет. По этим факторам в 2001 году была разработана шкала CHADS2, где C — хроническая сердечная недостаточность, H — артериальная гипертензия, A — возраст старше 75 лет, D — сахарный диабет , каждый предыдущий фактор оценивается в 1 балл и S — транзиторная ишемическая атака в 2 балла. Индекс шкалы варьирует от 0 до 6 баллов.
За последнее десятилетие стратегия ведения пациентов с фибрилляцией предсердий (ФП) подверглась значительным изменениям. Во-первых, появились новые данные о факторах риска, таких как женский пол, возраст 65-74 года, наличие сердечно-сосудистой патологии, которые ранее были мало изучены. Во-вторых, рандоминизированное исследование показало преимущество пероральных антикоагулянтов (ПА) над ацетилсалициловой кислотой (АСК) для снижения риска инсульта и смертности, даже если у пациента средний уровень риска (по CHADS2 индекс равен 1). В-третьих, применение АСК для профилактики инсульта при ФП было поставлено под сомнение. Три крупных рандомизированных исследования выявили лучшие показатели у новых поколений ПА, по сравнению с варфарином (антагонистом витамина К) с точки зрения эффективности и безопасности.
Но шкала CHADS2 не достаточно оценивает такой фактор риска развития инсульта как возраст пациента, пол и наличие сосудистой патологии. Поэтому была предложена новая шкала CHA2DS2-VASc, включающая дополнительные факторы (VASc) – сосудистые заболевания, возраст 65–74 года и женский пол, каждый из которых оценен по 1 баллу. Если возраст пациента старше 75 лет, то присваивается 2 балла. Индекс CHA2DS2-VASc варьирует от 0 до 9. Пероральные антикоагулянты должны назначаться при неклапанной форме ФП, если у пациента имеется хотя бы один балл по шкале CHA2DS2-VASc.
Euro Heart Survey on AF сравнили CHA2DS2-VASc с 7 другими современными стратификациями риска развития инсульта у 1084 пациента, где CHA2DS2-VASc показал хорошую предсказательную способность.
Какие шкалы должен использовать кардиолог у пациентов с фибрилляцией предсердий? Что нового?. Клиническая фармакология и терапия
Частота фибрилляции предсердий (ФП) у взрослых людей в популяции составляет 2-4% [1]. Она увеличивается с возрастом, в том числе под действием различных сопутствующих заболеваний и факторов риска, таких как артериальная гипертония, сахарный диабет, коронарная болезнь сердца, хроническая болезнь почек, ожирение, употребление алкоголя, курение и т.д. В ближайшие годы можно ожидать дальнейшего роста распространенности ФП не только за счет увеличения продолжительности жизни и постарения населения, но и внедрения новых систем скрининга нарушений ритма с помощью мобильных технологий (смартфонов), позволяющих зарегистрировать малосимптомные или бессимптомные нарушения ритма [2]. Например, в исследовании REHEARSE-AF регистрация ЭКГ в одном отведении с помощью смартфона/ планшета два раза в неделю в течение 12 мес у пациентов в возрасте ≥65 лет привела к увеличению частоты диагностики ФП в 3,9 раза по сравнению с обычной тактикой ведения [3]. Использование подобных устройств для скрининга ФП наиболее обосновано у людей пожилого и старческого возраста, а также пациентов с высоким риском инсульта [4].
ФП ассоциируется более чем с 3-кратным увеличением риска смерти [5] и является одной из основных причин инсульта
(20-30% и 10% случаев ишемического и криптогенного инсульта, соответственно), который характеризуется тяжелым и
рецидивирующим течением и часто приводит к смерти или инвалидизации [1]. ФП сопровождается нарушением функции сердца
и развитием сердечной недостаточности, как со сниженной, так и сохраненной фракцией выброса левого желудочка,
которая наблюдается у 20-30% таких больных и вызывает дополнительное ухудшение прогноза для жизни [6].
Неблагоприятные последствия ФП включают в себя также снижение качества жизни, особенно у женщин [7], когнитивные
расстройства вплоть до деменции [8] и частые госпитализации, ассоциирующиеся с увеличением затрат для системы
здравоохранения [9].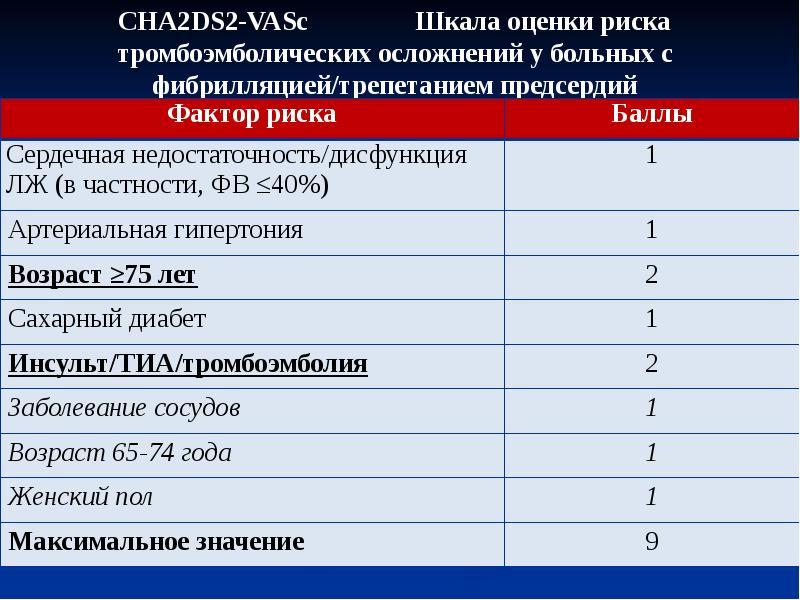 По данным мета-анализа 35 исследований в целом более чем у 300000 больных с ФП частота
госпитализаций составила в среднем 43,7 на 100 пациентов в год, а одним из основных факторов, ассоциировавшихся с
увеличением вероятности поступления в стационар, был пожилой возраст [10].
По данным мета-анализа 35 исследований в целом более чем у 300000 больных с ФП частота
госпитализаций составила в среднем 43,7 на 100 пациентов в год, а одним из основных факторов, ассоциировавшихся с
увеличением вероятности поступления в стационар, был пожилой возраст [10].
Ведение больных с ФП
Современные подходы к обследованию, ведению и лечению больных с ФП подробно описаны в соответствующих рекомендациях Европейского общества кардиологов, которые были подготовлены совместно с Европейской ассоциацией кардиоторакальной хирургии и опубликованы в 2020 г. [11]. В этих рекомендациях содержатся некоторые важные нововведения, в частности предложено использовать структурированную схему обследования пациентов (4S-AF), предполагающую анализ 4 доменов (рис. 1): риск инсульта, выраженность симптомов, тяжесть нагрузки ФП и предрасполагающее состояние (субстрат ФП) [12]. Оценка указанных факторов, в том числе с использованием специальных шкал, таких как CHA2DS2-VASc, HAS-BLED, EHRA, 2MACE и др., имеет прогностическое значение и помогает выбрать оптимальное лечение, цель которого – не только обеспечить адекватный контроль симптомов и улучшить качество жизни, но и предупредить неблагоприятные клинические исходы, в том числе смерть. Необходимо учитывать, что тип ФП (впервые выявленная, пароксизмальная, персистирующая, длительно персистирующая или постоянная) сам по себе не имеет решающего значения для выбора тактики лечения (исключая вопрос о необходимости восстановления синусого ритма), например, для оценки целесообразности применения пероральных антикоагулянтов для профилактики ишемического инсульта.
Рис. 1. Схема структурированного обследования(4S-AF) и алгоритм лечения(АВС) больных с неклапанной ФП
С целью улучшения результатов лечения ФП эксперты Европейского общества кардиологов рекомендовали использовать
алгоритм АВС, где А – Anticoagulation/ Avoid stroke (антикоагуляция для профилактики инсульта), В – Better
symptom management (улучшение контроля симптомов) и C – Cardiovascular and Comorbidity optimization (оптимизация
лечения сердечно-сосудистых и других сопутствующих заболеваний) (рис. 1) [13]. Результаты клинических
исследований показали, что внедрение указанного алгоритма ассоциируется со снижением риска смерти от любых
причин, сердечно-сосудистых событий, комбинированной конечной точки, включающей в себя инсульт, большое
кровотечение и сердечно-сосудистую смерть, а также затрат на лечение [14-16]. D. Pastori и соавт. в
проспективном исследовании у 907 пациентов изучили эффективность лечения в соответствии с алгоритмом АВС в
профилактике сердечно-сосудистых осложнений [17]. В группе из 198 пациентов, получавших оптимальное лечение, в
течение около 3 лет было отмечено достоверное снижение риска любых сердечно-сосудистых событий на 60% (p=0,003)
по сравнению с таковым у больных, у которых по крайней мере один компонент лечения не соответствовал
оптимальному.
1) [13]. Результаты клинических
исследований показали, что внедрение указанного алгоритма ассоциируется со снижением риска смерти от любых
причин, сердечно-сосудистых событий, комбинированной конечной точки, включающей в себя инсульт, большое
кровотечение и сердечно-сосудистую смерть, а также затрат на лечение [14-16]. D. Pastori и соавт. в
проспективном исследовании у 907 пациентов изучили эффективность лечения в соответствии с алгоритмом АВС в
профилактике сердечно-сосудистых осложнений [17]. В группе из 198 пациентов, получавших оптимальное лечение, в
течение около 3 лет было отмечено достоверное снижение риска любых сердечно-сосудистых событий на 60% (p=0,003)
по сравнению с таковым у больных, у которых по крайней мере один компонент лечения не соответствовал
оптимальному.
Антикоагулянтная терапия
Для оценки риска инсульта у больных с ФП и, соответственно, необходимости в применении антикоагулянтов
используют шкалу CHA2DS2-VASc (табл. 1), которая включает в себя хроническую сердечную недостаточность (ХСН),
артериальную гипертонию, возраст ≥75 лет, сахарный диабет, инсульт/транзиторную ишемическую атаку
(ТИА)/системную эмболию в анамнезе, сердечно-сосудистое заболевание, в том числе стенозирующий коронарный
атеросклероз, подтвержденный при ангиографии, перенесенный инфаркт миокарда, атеросклероз периферических артерий
или бляшку в аорте, возраст 65-74 года и женский пол [18]. Необ ходимо отметить, что женский пол скорее
модифицирует общий риск развития инсульта, чем является фактором риска сам по себе [19], так как при отсутствии
дополнительных факторов риска у женщин вероятность развития инсульта такая же низкая как у мужчин с индексом по
шкале CHA2DS2-VASc, равным 0. В то же время при наличии по крайней мере одного дополнительного фактора риска у
женщин вероятность инсульта увеличивается в большей степени, чем у мужчин [20].
| Факторы риска | Определение | Балл |
|---|---|---|
| С | Клинические симптомы ХСН, умеренная и тяжелая систолическая дисфункция левого желудочка (в том числе бессимптомная), гипертрофическая кардиомиопатия | 1 |
| H | Артериальная гипертония (систолическое АД ≥140 мм рт. ст., диастолическое АД ≥90 мм рт. ст) или прием антигипертензивных препаратов (целевое АД при ФП 120-129/<80 мм рт. ст.) | 1 |
| A | Возраст более 75 лет | 2 |
| D | Сахарный диабет 1 и 2 типа (гликемия натощак более 7 ммоль/л или прием сахароснижающих препаратов или инсулинотерапия) | 1 |
| S | Инсульт/ТИА/тромбоэмболии в анамнезе | 2 |
| V | Сердечно-сосудистые заболевания в анамнезе (ангиографически подтвержденная ИБС, перенесенный инфаркт миокарда, клинически значимый периферический атеросклероз, атеросклеротическая бляшка в аорте) | 1 |
| A | Возраст 65-74 года | 1 |
| Sс | Женский пол | 1 |
В последние годы большой интерес у исследователей вызывает изучение роли различных биомаркеров, в том числе
отражающих повреждение миокарда (тропонин), дисфункцию сердца (натрийуретические пептиды), фиброз миокарда
(галектин-3), нарушение функции почек (креатинин, цистатин С), воспаление (С-реактивный белок, цитокины) и
активность коагуляции (Ддимер), которые могут ассоциироваться с патогенезом тромбообразования, клиническими
исходами и эффектами лечения [21]. Предложены шкалы оценки риска инсульта у пациентов с ФП на основании не
только клинических факторов риска, но и некоторых лабораторных
показателей, например, шкала ABC учитывает возраст больного, наличие инсульта/ТИА в анамнезе и уровни
высокочувствительного тропонина и NTproBNP [22]. Применение некоторых новых шкал позволяло улучшить точность
предсказания риска инсульта у пациентов с ФП, хотя практическое значение их возможных преимуществ перед
общепринятой шкалой CHA2DS2-VASc вызывает сомнение, в том числе в связи с необходимостью
дополнительных затрат на определение биомаркеров. Однако нельзя исключить, что последние могут найти применение
для более точной оценки вероятности инсульта у пациентов, у которых риск его расценивается как низкий [23].
Предложены шкалы оценки риска инсульта у пациентов с ФП на основании не
только клинических факторов риска, но и некоторых лабораторных
показателей, например, шкала ABC учитывает возраст больного, наличие инсульта/ТИА в анамнезе и уровни
высокочувствительного тропонина и NTproBNP [22]. Применение некоторых новых шкал позволяло улучшить точность
предсказания риска инсульта у пациентов с ФП, хотя практическое значение их возможных преимуществ перед
общепринятой шкалой CHA2DS2-VASc вызывает сомнение, в том числе в связи с необходимостью
дополнительных затрат на определение биомаркеров. Однако нельзя исключить, что последние могут найти применение
для более точной оценки вероятности инсульта у пациентов, у которых риск его расценивается как низкий [23].
Перед назначением пероральных антикоагулянтов пациентам с ФП необходимо оценить риск развития кровотечений. Для
этого обычно используют шкалу HAS-BLED (табл. 2). Эта шкала сохраняет свое значение несмотря на появление новых
индексов, в том числе учитывающих не только клинические и демографические показатели, но и уровни лабораторных
биомаркеров. Например, индекс по шкале ABC рассчитывается с учетом возраста, кровотечения в анамнезе и
лабораторных биомаркеров, в том числе GDF-15, высокочувствительного тропонина и гемоглобина [24]. В
рекомендациях Европейского общества кардиологов специально подчеркивается, что высокий риск кровотечения при
отсутствии абсолютных противопоказаний не может служить основанием для отказа от антикоагулянтной терапии, так
как «чистая» клиническая польза антикоагуляции даже выше у таких пациентов. Оценка риска геморрагических
осложнений в первую очередь необходима для идентификации пациентов, которые нуждаются в более тщательном
наблюдении (например, каждые 4 недели, а не 4-6 мес) и модификации факторов риска. Некоторые факторы риска
кровотечений (возраст старше 65 лет, кровотечение в анамнезе, почечная заместительная терапия, злокачественные
опухоли, генетические факторы и др. ) являются немодифицируемыми, однако многие другие могут быть устранены или
уменьшены (артериальная гипертония, сопутствующий прием антитромбоцитарных препаратов, злоупотребление
алкоголем, анемия, тромбоцитопения, опасные хобби и т.п.). Следует также учитывать, что изменение профиля риска
кровотечений в динамике имеет большее значение для предсказания больших кровотечений, чем исходное его значение.
В клиническом исследовании было выявлено значительное (в 3,5 раза) увеличение риска большого кровотечения в
течение ближайших 3 мес у пациентов, у которых наблюдалось изменение индекса по шкале HAS-BLED [25].
) являются немодифицируемыми, однако многие другие могут быть устранены или
уменьшены (артериальная гипертония, сопутствующий прием антитромбоцитарных препаратов, злоупотребление
алкоголем, анемия, тромбоцитопения, опасные хобби и т.п.). Следует также учитывать, что изменение профиля риска
кровотечений в динамике имеет большее значение для предсказания больших кровотечений, чем исходное его значение.
В клиническом исследовании было выявлено значительное (в 3,5 раза) увеличение риска большого кровотечения в
течение ближайших 3 мес у пациентов, у которых наблюдалось изменение индекса по шкале HAS-BLED [25].
| Факторы риска | Определение | Балл |
|---|---|---|
| Примечание: *за каждый фактор. НПВП — нестероидные противовоспалительные препараты | ||
| H | Неконтролируемая артериальная гипертония (САД>160 мм рт. ст.) | 1 |
| A | Нарушение функции почек и/или печени (диализ, трансплантация почки, сывороточный креатинин >200 ммоль/л, цирроз, увеличение уровня билирубин более чем в2раза по сравнению с верхней границей нормы, повышение АСТ/АЛТ/щелочной фосфатазы более чем в 3 раза по сравнению с верхней границей нормы | 1* |
| S | Инсульт (перенесенный ишемический или геморрагический инсульт) | 1 |
| B | Кровотечения в анамнезе или предрасположенность к ним (предшествующее большое кровотечение, анемия, тяжелая тромбоцитопения) | 1 |
| L | Лабильное МНО у больных, получающих антагонисты витамина К | 1 |
| E | Пожилой возраст (>65 лет или «хрупкий» пациент) | 1 |
| D | Сопутствующий прием препаратов (антиагреганты и НПВП) и/или алкоголя (запои или более 14 единиц в неделю) | 1* |
Склонность к падениям сама по себе не является независимым фактором риска кровотечения на фоне антикоагулянтной
терапии, однако травма при падении у пожилого пациента, принимающего пероральные антикоагулянты, может привести
к более тяжелому кровотечению, например, внутричерепному. Любопытные данные были получены в одном исследовании,
в котором моделировались эффекты падений у пациентов, получающих пероральные антикоагулянты. Авторы показали,
что пациенты, принимающие варфарин, должны падать примерно 295 раз в год, чтобы угроза серьезного кровотечений
перевесила пользу снижения риска ишемического инсульта [26]. Тем не менее, приведенные данные не отменяют
необходимость профилактики падений с помощью простых мер, таких как использование вспомогательных устройств при
ходьбе, ношение соответствующей обуви, устранение препятствий для пожилого человека в квартире (ковры, лишняя
мебель) и т.д.
Любопытные данные были получены в одном исследовании,
в котором моделировались эффекты падений у пациентов, получающих пероральные антикоагулянты. Авторы показали,
что пациенты, принимающие варфарин, должны падать примерно 295 раз в год, чтобы угроза серьезного кровотечений
перевесила пользу снижения риска ишемического инсульта [26]. Тем не менее, приведенные данные не отменяют
необходимость профилактики падений с помощью простых мер, таких как использование вспомогательных устройств при
ходьбе, ношение соответствующей обуви, устранение препятствий для пожилого человека в квартире (ковры, лишняя
мебель) и т.д.
Показания к назначению пероральных антикоагулянтов в новых рекомендациях Европейского общества кардиологов не
изменились. Их применение необходимо, если значение индекса по шкале CHA2DS2-VASc
составляет по крайней мере 2 у мужчин и 3 у женщин. Это означает, что пероральные антикоагулянты следует
назначать всем больным с ФП (независимо от пола), достигшим возраста 75 лет, и пациентам в возрасте 6574 года
при наличии по крайней мере одного дополнительного фактора риска инсульта, например, артериальной гипертонии или
сахарного диабета, в то время как в более молодом возрасте основанием для антикоагуляции служит наличие по
крайней мере двух факторов риска как у мужчин, так и у женщин (рис. 2). Если индекс по шкале
CHA2DS2-VASc составляет 1 у мужчин или 2 у женщин, то антикоагулянтную терапию считают
возможной, хотя четкие показания к ее назначению в таких случаях в рекомендациях не приводятся. ФП обычно
развивается у людей пожилого и старческого возраста, страдающих различными заболеваниями, поэтому индекс по
шкале CHA2DS2-VASc у большинства больных с этой аритмией превышает указанные значения,
обосновывая применение антикоагулянтов. Кроме того, индекс CHA2DS2-VASc имеет тенденцию к
увеличению как за счет возраста, так и присоединения новых заболеваний, повышающих риск инсульта. Необходимо еще
раз подчеркнуть, что тип ФП (пароксизмальная/персистирующая или постоянная) не имеет значения для решения
вопроса об антикоагулянтной терапии и не учитывается при расчете индекса по шкале
CHA2DS2-VASc.
Необходимо еще
раз подчеркнуть, что тип ФП (пароксизмальная/персистирующая или постоянная) не имеет значения для решения
вопроса об антикоагулянтной терапии и не учитывается при расчете индекса по шкале
CHA2DS2-VASc.
Для профилактики инсульта у пациентов с неклапанной ФП применяют антагонисты витамина К, прежде всего варфарин, или прямые оральные антикоагулянты (ПОАК), в том числе ривароксабан, апиксабан, дабигатрин и эдоксабан (последний не зарегистрирован в Российской Федерации). Комбинированная терапия ацетилсалициловой кислотой и клопидогрелом у таких пациентов по эффективности уступала варфарину и сопровождалась сопоставимым риском кровотечений [27], а монотерапия ацетилсалициловой кислотой оказалась неэффективной и ассоциировалась с более высоким риском ишемического инсульта у пожилых людей с ФП [28]. Таким образом, антитромбоцитарные препараты не следует рассматривать как более безопасную альтернативу пероральным антикоагулянтам у пациентов с ФП, нуждающихся в эффективной профилактике инсульта.
В настоящее время ПОАК считают препаратами первой линии в профилактике инсульта у пациентов с неклапанной ФП
[11]. В регистрационных клинических исследованиях все препараты этой группы по эффективности по крайне мере не
уступали варфарину. Однако при мета-анализе клинических исследований у больных, получавших ПОАК, было выявлено
снижение риска инсульта и системных эмболий на 19% по сравнению с таковым при лечении варфарином, снижение риска
геморрагического инсульта на 51% и риска смерти от любых причин на 10%. Кроме того, при применении ПОАК было
отмечено недостоверное снижение риска больших кровотечений на 14% и статистически значимое снижение риска
внутричерепного кровотечения на 52%, в то время как частота желудочно-кишечных кровотечений увеличилась на 25%
[29]. Эти данные позволяют рассматривать ПОАК в целом как более эффективную и безопасную альтернативу непрямым
антикоагулянтам.
Эти данные позволяют рассматривать ПОАК в целом как более эффективную и безопасную альтернативу непрямым
антикоагулянтам.
В отличие от ПОАК, варфарин может взаимодействовать с различными лекарственными препаратами, которые могут усилить или, наоборот, ослабить его антикоагулянтное действие. При лечении непрямыми антикоагулянтами необходимо регулярно контролировать международное нормализованное отношение (МНО) и при необходимости корректировать их дозы. В целом антагонисты витамина К считают эффективными и относительно безопасными препаратами, если МНО удается поддерживать в терапевтическом диапазоне более 70% времени, хотя добиться этого удается не всегда. Предложена шкала SAMe-TT2R2 (женский пол, возраст менее 60 лет, наличие по крайней мере двух сопутствующих заболеваний, таких как артериальная гипертония, сахарный диабет, ИБС, атеросклероз периферических артерий, сердечная недостаточность, инсульт в анамнезе, заболевание легких и поражение печени или почек, лечение некоторыми препаратами, курение, неевропеоидная раса), которая позволяет выделить пациентов с ФП, у которых труднее обеспечить адекватный антикоагулянтный эффект варфарина [30]. Величина индекса по этой шкале >2 служит дополнительным доводом в пользу выбора ПОАК. Если больному все же приходится назначить варфарин или другой антагонист витамина К (обычно по экономическим причинам), то необходимо принимать дополнительные меры, чтобы повысить эффективность и безопасность терапии, например, более частое мониторирование МНО, повторные консультации и т.п.
Профиль эффективности ПОАК в профилактике инсульта у пациентов с неклапанной ФП подтвержден также в
пострегистрационных исследованиях, результаты которых соответствовали таковым рандомизированных контролируемых
исследований [31-33]. P. Kirchhof и соавт. обобщили результаты применения ривароксабана у 11121 пациента с
неклапанной ФП (средний возраст 70,5±10,5 лет; 42,9% женщин), включенных в исследования, которые проводились в
обычной клинической практике в 47 странах в рамках программы XANTUS (Xarelto for Prevention of Stroke in
Patients With Atrial Fibrillation) [34]. Проспективный дизайн исследований повышает клиническую ценность
полученных данных. Пациентов с ФП, начавших прием ривароксабана, наблюдали в течение 1 года. Частота больших
кровотечений составила в среднем 1,7 на 100-пациентолет, смерти от любых причин – 1,9 на 100 пациентолет,
инсульта и системных эмболий – 1,0 на 100 пациенто-лет. Для сравнения, частота первичной конечной точки,
включавшей в себя инсульт и системные эмболии, в рандомизированном исследовании ROCKET AF, подтвердившем
эффективность ривароксабана в профилактике инсульта у пациентов с неклапанной ФП, составила 1,7 на 100
пациенто-лет [35]. Частота как кровотечений, так и инсульта была низкой во всех странах, принимавших участие в
программе XANTUS, а доля пациентов, продолжавших прием ривароксабана в течение года, равнялась 77,4% (от 66,4% в
странах Восточной Азии до 84,4% в Западной Европе). Высокая приверженность к приему антикоагулянтной терапии
отражает удобство применения ривароксабана, в том числе отсутствие необходимости в титровании дозы и регулярном
мониторировании МНО, низкий риск взаимодействия с другими лекарственными средствами, стабильность
антикоагулянтного эффекта и возможность назначения один раз в день [36].
Проспективный дизайн исследований повышает клиническую ценность
полученных данных. Пациентов с ФП, начавших прием ривароксабана, наблюдали в течение 1 года. Частота больших
кровотечений составила в среднем 1,7 на 100-пациентолет, смерти от любых причин – 1,9 на 100 пациентолет,
инсульта и системных эмболий – 1,0 на 100 пациенто-лет. Для сравнения, частота первичной конечной точки,
включавшей в себя инсульт и системные эмболии, в рандомизированном исследовании ROCKET AF, подтвердившем
эффективность ривароксабана в профилактике инсульта у пациентов с неклапанной ФП, составила 1,7 на 100
пациенто-лет [35]. Частота как кровотечений, так и инсульта была низкой во всех странах, принимавших участие в
программе XANTUS, а доля пациентов, продолжавших прием ривароксабана в течение года, равнялась 77,4% (от 66,4% в
странах Восточной Азии до 84,4% в Западной Европе). Высокая приверженность к приему антикоагулянтной терапии
отражает удобство применения ривароксабана, в том числе отсутствие необходимости в титровании дозы и регулярном
мониторировании МНО, низкий риск взаимодействия с другими лекарственными средствами, стабильность
антикоагулянтного эффекта и возможность назначения один раз в день [36].
Все ПОАК частично выводятся почками – в большей степени дабигатран и в меньшей степени ривароксабан и апиксабан,
поэтому при выборе препарата и его дозы следует учитывать функцию почек. Например, дозу ривароксабана у
пациентов с клиренсом креатинина 1549 мл/мин следует снизить с 20 до 15 мг один раз в день. Чтобы обеспечить
безопасность антикоагулянтной терапии у больных с ФП, необходимо регулярно контролировать функцию почек с
помощью клиренса креатитина, рассчитанного по формуле Кокрофта-Гоулта, так как именно этот показатель
использовался в регистрационных клинических исследованиях. Оценивать функцию почек следует по крайней мере один
раз в год или чаще у пациентов, относящихся к группе риска, например, при наличии исходного снижения функции
почек. У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно рассмотреть применение ПОАК,
которые в меньшей степени выводятся почками (ривароксабан или апиксабан). В практическом руководстве Европейской
ассоциации аритмологов клиренс креатинина рекомендовано измерять каждые 6 мес у больных в возрасте ≥75 лет
(особенно при лечении дабигатраном) и «хрупких» пациентов [37]. Чтобы оценить минимальный интервал определения
клиренса креатинина у пациентов с исходно сниженной функцией почек клиренс креатинина следует разделить на 10.
Например, у пациентов с его значением 40 мл/мин, клиренс креатинина следует измерять по крайней мере каждые 4
мес. Необходимо учитывать, что функция почек может быстро ухудшиться под влиянием различных интеркуррентных
заболеваний, например, инфекций или острой сердечной недостаточности. Соответственно, в таких случаях необходимо
также измерить клиренс креатинина.
У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно рассмотреть применение ПОАК,
которые в меньшей степени выводятся почками (ривароксабан или апиксабан). В практическом руководстве Европейской
ассоциации аритмологов клиренс креатинина рекомендовано измерять каждые 6 мес у больных в возрасте ≥75 лет
(особенно при лечении дабигатраном) и «хрупких» пациентов [37]. Чтобы оценить минимальный интервал определения
клиренса креатинина у пациентов с исходно сниженной функцией почек клиренс креатинина следует разделить на 10.
Например, у пациентов с его значением 40 мл/мин, клиренс креатинина следует измерять по крайней мере каждые 4
мес. Необходимо учитывать, что функция почек может быстро ухудшиться под влиянием различных интеркуррентных
заболеваний, например, инфекций или острой сердечной недостаточности. Соответственно, в таких случаях необходимо
также измерить клиренс креатинина.
ФП примерно в трети случаев сочетается с хронической болезнью почек (ХБП) III-V стадии, т.е. снижением расчетной
скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2, что отражает общность факторов риска двух
состояний, таких как пожилой возраст, артериальная гипертония, сахарный диабет и др. [38]. Более того, примерно
у каждого четвертого пожилого пациента с неклапанной ФП в течение года можно ожидать прогрессирования ХБП.
Например, в исследовании ORBIT-AF II у 6682 пациентов с ФП (медиана возраста 72 года), получавших ПОАК или
варфарин, частота снижения клиренса креатинина более чем на 20% и 30% в течение 1 года после начала наблюдения
составила 23,1% и 10,6%, соответственно [39]. Cочетание неклапанной ФП с ХБП ассоциируется с дополнительным
увеличением риска развития ишемического инсульта, кровотечений и других неблагоприятных исходов. В
регистрационных исследованиях ПОАК более чем у половины пациентов имелись признаки нарушения функции почек. По
данным мета-анализа 4 рандомизированных клинических исследований ROCKET-AF, RE-LY, ARISTOTLE и ENGAGE AF-TIMI
48, в которых изучались ривароксабан, дабигатран, апиксабан и эдоксабан (последний не зарегистрирован в России),
соответственно, при лечении ПОАК у пациентов с ФП и нарушенной функцией почек было отмечено достоверное снижение
относительного риска развития инсульта и системных эмболий на 20% (p<0,01), больших кровотечений на 21%
(р=0,017) и смерти от любых причин на 9% (р=0,031) по сравнению с таковым при применении варфарина [40]. Более
того, «чистая» польза ПОАК, которую оценивали с учетом риска не только инсульта/системных эмболий, но и
кровотечений, возрастала по мере ухудшения функции почек и была выше всего у пациентов с клиренсом креатинина
30-50 мл/мин. В исследовании ROCKET AF прогрессирование ХБП, критерием которого считали снижение клиренса
креатинина более чем на 20% по сравнению с исходным, выявили у 26,3% больных [41]. Ухудшение функции почек
ассоциировалось с увеличением риска смерти от сосудистых причин, комбинированной конечной точки, включавшей в
себя инсульт, системные эмболии, сердечно-сосудистую смерть и инфаркт миокарда, и смерти от любых причин по
сравнению с таковым у таковым у пациентов со стабильной функцией почек. Лечение ривароксабаном по сравнению
варфарином у больных с прогрессирующей ХБП привело к снижению риска инсульта и системных эмболий и не вызывало
увеличения риска больших и клинически значимых небольших кровотечений.
По
данным мета-анализа 4 рандомизированных клинических исследований ROCKET-AF, RE-LY, ARISTOTLE и ENGAGE AF-TIMI
48, в которых изучались ривароксабан, дабигатран, апиксабан и эдоксабан (последний не зарегистрирован в России),
соответственно, при лечении ПОАК у пациентов с ФП и нарушенной функцией почек было отмечено достоверное снижение
относительного риска развития инсульта и системных эмболий на 20% (p<0,01), больших кровотечений на 21%
(р=0,017) и смерти от любых причин на 9% (р=0,031) по сравнению с таковым при применении варфарина [40]. Более
того, «чистая» польза ПОАК, которую оценивали с учетом риска не только инсульта/системных эмболий, но и
кровотечений, возрастала по мере ухудшения функции почек и была выше всего у пациентов с клиренсом креатинина
30-50 мл/мин. В исследовании ROCKET AF прогрессирование ХБП, критерием которого считали снижение клиренса
креатинина более чем на 20% по сравнению с исходным, выявили у 26,3% больных [41]. Ухудшение функции почек
ассоциировалось с увеличением риска смерти от сосудистых причин, комбинированной конечной точки, включавшей в
себя инсульт, системные эмболии, сердечно-сосудистую смерть и инфаркт миокарда, и смерти от любых причин по
сравнению с таковым у таковым у пациентов со стабильной функцией почек. Лечение ривароксабаном по сравнению
варфарином у больных с прогрессирующей ХБП привело к снижению риска инсульта и системных эмболий и не вызывало
увеличения риска больших и клинически значимых небольших кровотечений.
Результаты ретроспективных исследований показали, что лечение ПОАК у пациентов с неклапанной ФП может
сопровождаться улучшением почечных исходов по сравнению с варфарином, в том числе снижением частоты острого
почечного повреждения (ОПП), связанного с развитием нефропатии в результате чрезмерной антикоагуляции и
кровоизлияний в клубочки почек [42]. В ретроспективном исследовании частота ОПП, предположительно
ассоциированного с варфарином, составила 33,0% у больных с ХБП и 16,5% у пациентов с нормальной функцией почек
[43]. При лечении ПОАК можно ожидать снижения риска развития ОПП за счет более предсказуемого антикоагулянтного
действия по сравнению с варфарином. C. Coleman и соавт. проанализировали почечные исходы в ретроспективном
исследовании у 72000 пациентов с ФП, начавших лечение ривароксабаном или варфарином в течение по крайней мере 12
мес [44]. Терапия ривароксабаном ассоциировалась со снижением риска развития ОПП на 19% и ХБП 5 стадии на 18% по
сравнению с варфарином. В другом ретроспективном исследования почечные исходы оценивали у 9769 пациентов с
неклапанной ФП, получавших различные ПОАК или варфарин [45]. Лечение ПОАК в течение 2 лет ассоциировалось с
достоверным снижением риска развития или прогрессирования ХБП, в частности, вероятности снижения СКФ по крайней
мере на 30% (отношение шансов 0,77; 95% ДИ 0,66-0,89; p<0,001) и удвоения сывороточного креатинина (0,62;
0,40-0,95; p=0,03) по сравнению с таковой при лечении варфарином. Улучшение почечного прогноза было выявлено при
применении ривароксабана и дабигатрана, но не апиксабана. Такое преимущество ривароксабана может
свидетельствовать в пользу его применения у пациентов с ухудшающейся функцией почек.
При лечении ПОАК можно ожидать снижения риска развития ОПП за счет более предсказуемого антикоагулянтного
действия по сравнению с варфарином. C. Coleman и соавт. проанализировали почечные исходы в ретроспективном
исследовании у 72000 пациентов с ФП, начавших лечение ривароксабаном или варфарином в течение по крайней мере 12
мес [44]. Терапия ривароксабаном ассоциировалась со снижением риска развития ОПП на 19% и ХБП 5 стадии на 18% по
сравнению с варфарином. В другом ретроспективном исследования почечные исходы оценивали у 9769 пациентов с
неклапанной ФП, получавших различные ПОАК или варфарин [45]. Лечение ПОАК в течение 2 лет ассоциировалось с
достоверным снижением риска развития или прогрессирования ХБП, в частности, вероятности снижения СКФ по крайней
мере на 30% (отношение шансов 0,77; 95% ДИ 0,66-0,89; p<0,001) и удвоения сывороточного креатинина (0,62;
0,40-0,95; p=0,03) по сравнению с таковой при лечении варфарином. Улучшение почечного прогноза было выявлено при
применении ривароксабана и дабигатрана, но не апиксабана. Такое преимущество ривароксабана может
свидетельствовать в пользу его применения у пациентов с ухудшающейся функцией почек.
Улучшение контроля симптомов
Для оценки симптомов (сердцебиение, одышка, утомляемость, дискомфорт в груди и др.) ФП используют шкалу,
предложенную Европейской ассоциацией аритмологов (EHRA) и отражающую влияние проявлений аритмии на обычную
повседневную активность пациентов (табл. 3) [46,47]. Необходимо учитывать, что все указанные симптомы
неспецифичны и могут быть следствием сопутствующих заболеваний, а подтвердить их связь с ФП иногда удается
только ретроспективно. В рекомендациях Европейского общества кардиологов предлагается также оценивать тяжесть
нагрузки ФП, которая отражает ее тип, общую длительность сохранения нарушения ритма при мониторировании ЭКГ,
например, в течение 24 ч, число эпизодов аритмии, их максимальную длительность и т.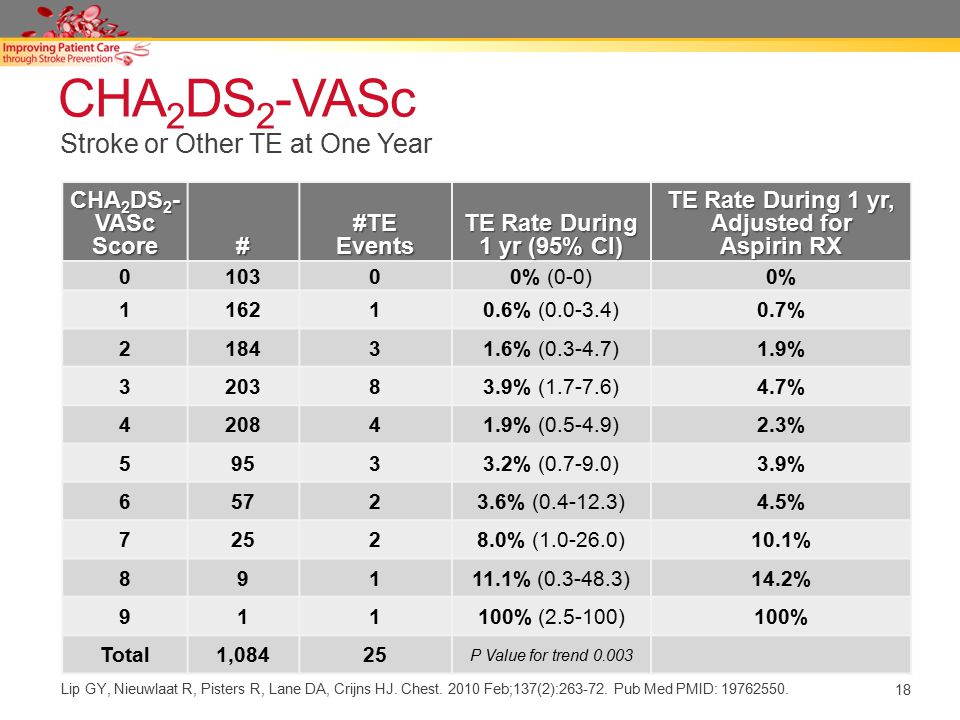 п. [11]. Следует отметить,
что в рекомендациях отсутствуют четкие критерии интепретации полученных данных. В некоторых исследованиях была
выявлена ассоциация между параметрами нагрузки ФП и неблагоприятными клиническими исходами. A. Ganesan и соавт.
при мета-анализе 12 исследований примерно у 100000 больных с непароксизмальной неклапанной ФП выявили увеличение
риска тромбоэмболий и смерти (относительный риск 1,384; p<0,001, и 1,217, p<0,001, соответственно) по
сравнению с таковым у пациентов с пароксизмальной ФП [48]. Нагрузка ФП может оказать определенное влияние на
эффективность контроля ритма у пациентов с ФП [49]. Тем не менее, по мнению экспертов, имеющиеся данные о связи
нагрузки ФП с клиническими исходами недостаточны для того, чтобы придавать им решающее значение при выборе
стратегии лечения.
п. [11]. Следует отметить,
что в рекомендациях отсутствуют четкие критерии интепретации полученных данных. В некоторых исследованиях была
выявлена ассоциация между параметрами нагрузки ФП и неблагоприятными клиническими исходами. A. Ganesan и соавт.
при мета-анализе 12 исследований примерно у 100000 больных с непароксизмальной неклапанной ФП выявили увеличение
риска тромбоэмболий и смерти (относительный риск 1,384; p<0,001, и 1,217, p<0,001, соответственно) по
сравнению с таковым у пациентов с пароксизмальной ФП [48]. Нагрузка ФП может оказать определенное влияние на
эффективность контроля ритма у пациентов с ФП [49]. Тем не менее, по мнению экспертов, имеющиеся данные о связи
нагрузки ФП с клиническими исходами недостаточны для того, чтобы придавать им решающее значение при выборе
стратегии лечения.
| Класс EHRA | Симптомы | Описание |
|---|---|---|
| 1 | Нет | ФН не сопровождается какимилибо симптомами |
| 2а | Легкие | Симптомы ФП не влияют на обычную повседневную активность |
| 2b | Умеренные | Симптомы ФП не влияют на обычная повседневную активность, но вызывают беспокойство у больног |
| 3 | Выраженные | Симптомы ФП нарушают обычную повседневную активность |
| 4 | Инвалидизирующие | Обычная повседневная активность невозможна |
Стратегия контроля частоты сердечных сокращений (ЧСС) у пациентов с неклапанной ФП по эффективности в
профилактике неблагоприятных исходов не уступала стратегии контроля синусового ритма и часто оказывается
достаточной для уменьшения симптомов, особенно у больных пожилого возраста [11]. Результаты исследования RACE II
показали, что более «жесткий» контроль ЧСС, предполагавший снижение ее <80 в минуту в покое и <110 в
минуту при умеренной физической нагрузке, не приводит к снижению суммарного риска клинических исходов [50]. В
связи с этим целевое значение ЧСС в покое при выборе стратегии контроля частоты сердечного ритма может
составлять <110 в минуту, хотя цель терапии может быть пересмотрена при сохранении симптомов или ухудшении
функции левого желудочка [11].
Результаты исследования RACE II
показали, что более «жесткий» контроль ЧСС, предполагавший снижение ее <80 в минуту в покое и <110 в
минуту при умеренной физической нагрузке, не приводит к снижению суммарного риска клинических исходов [50]. В
связи с этим целевое значение ЧСС в покое при выборе стратегии контроля частоты сердечного ритма может
составлять <110 в минуту, хотя цель терапии может быть пересмотрена при сохранении симптомов или ухудшении
функции левого желудочка [11].
Для контроля ЧСС у пациентов с неклапанной ФП обычно применяют b-адреноблокаторы, а также дигоксин, дилтиазем и верапамил или комбинацию этих препаратов, в то время как антиаритмические средства, такие как амиодарон или соталол, лучше назначать для контроля синусового ритма. Лечение обычно начинают с b-адреноблокаторов, хотя при наличии хронической обструктивной болезни легких или бронхиальной астмы очевидны преимущества недигидропиридиновых антагонистов кальция. В то же время последние не следует назначать пациентам с фракцией выброса левого желудочка <40%. При неэффективности комбинированной терапии препаратами, урежающими сердечный ритм, может быть выполнена абляция атриовентрикулярного узла в сочетании с имплантацией искусственного водителя ритма [51].
Как указано выше, стратегия контроля ритма, предполагающая
восстановление и удержание синусового ритма, не улучшает клинические исходы у пациентов с ФП, поэтому первичная
цель ее – уменьшение симптомов и улучшение качества жизни больных. Восста новление синусового ритма не означает
отсутствие необходимости в приеме препаратов, урежающих ЧСС, антикоагуляции и коррекции сердечно-сосудистых
факторов риска. Контроль синусового ритма может препятствовать прогрессированию ФП, т.е. ее переходу в более
устойчивую форму, например, трансформации пароксизмальной ФП в персистирующую или постоянную или персистирующей
ФП в постоянную форму. В американском когортном исследовании у 955 пациентов с недавно выявленной неклапанной ФП
частота прогрессирования аритмии в течение 12 мес на фоне контроля синусового ритма была достоверно ниже, чем на
фоне контроля ЧСС (5,8% и 27,6%, соответственно; p<0,001). Прогрес сирование ФП ассоциировалось также с
пожилым возрастом, наличием персистирующей ФП и инсультом/ТИА в анамнезе [52].
В американском когортном исследовании у 955 пациентов с недавно выявленной неклапанной ФП
частота прогрессирования аритмии в течение 12 мес на фоне контроля синусового ритма была достоверно ниже, чем на
фоне контроля ЧСС (5,8% и 27,6%, соответственно; p<0,001). Прогрес сирование ФП ассоциировалось также с
пожилым возрастом, наличием персистирующей ФП и инсультом/ТИА в анамнезе [52].
- более молодой возраст пациента;
- первый эпизод ФП или короткий анамнез;
- кардиомиопатия, вызванная тахикардией;
- отсутствие выраженной дилатации левого предсердия;
- отсутствие заболевания сердца или сопутствующих заболеваний;
- трудности контроля ЧСС;
- преходящая причина ФП, например, острое заболевание;
- желание пациента.
Методы контроля синусового ритма после его восстановления путем электрической или медикаментозной кардиоверсии у
пациентов с пароксизмальной или персистирующей ФП включают в себя применение антиаритмических препаратов и
катетерную абляцию. Последнюю считают эффективным и безопасным методом, хотя в исследовании CABANA катетерная
абляция не привела к достоверному снижению риска комбинированной конечной точки, включавшей в себя смерть,
инвалидизирующий инсульт, серьезное кровотечение и остановку сердца, по сравнению с медикаментозной терапией, но
сопровождалась значительным улучшением качества жизни [53]. Катетерную абляцию обычно проводят при
неэффективности или плохой переносимости по крайней мере одного антиаритмического препарата I или III класса,
хотя она может рассматриваться и как метод первой линии у пациентов с пароксзимальной ФП или больных с
персистирующей ФП, у которых отсутствуют основные факторы рецидива аритмии после вмешательства (такие как
возраст, дилатация левого предсердия, длительность ФП, нарушение функции почек и др.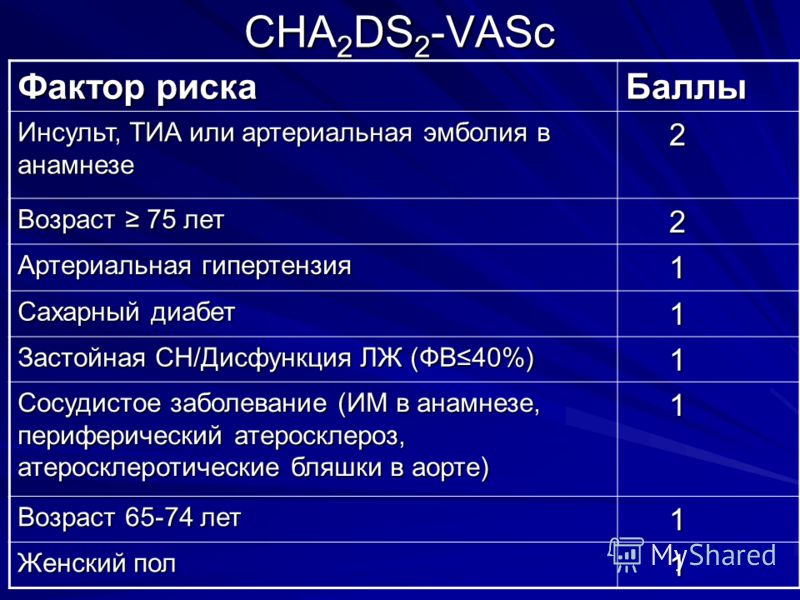 ) [11]. Кроме того,
катетерную абляцию рекомендуют выполнять для восстановления функции левого желудочка у пациентов с
кардиомиопатией, индуцированной тахикардией, и для увеличения выживаемости и снижения частоты госпитализаций у
пациентов с сердечной недостаточностью и сниженной функцией левого желудочка. По крайней мере у трети больных,
перенесших катетерную абляцию, в различные сроки после вмешательства возникают рецидивы ФП. В настоящее время
предложены различные шкалы для оценки риска рецидива аритмии после катетерной абляции, в том числе ALARMEc (тип
аритмии, размер левого предсердия, почечная недостаточность, метаболический синдром и кардиомиопатия), BASE-AF2
(индекс массы тела >28 кг/м2, дилатация левого предсердия >40 мм, ранний рецидив ФП после абляции, длительность
ФП >6 лет и непароксизмальная форма аритмии), APPLE (возраст ≥65 лет, персистирующая ФП, снижение скорости
клубочковой фильтрации <60 мл/мин/1,73 м2, диаметр левого предсердия ≥43 мм и фракция выброса левого
желудочка <50%), CAAP-AF (коронарная болезнь сердца, диаметр левого предсердия, возраст, персистирующая или
длительная ФП, неэффективность антиаритмических препаратов и женский пол), ATLAS (возраст старше 60 лет,
непароксизмальная ФП, дилатация левого предсердия, женский пол и курение), однако ни одна из них не имела
существенных преимуществ перед другими [54]. Моди фи кация различных факторов риска, в том числе курения,
употребления алкоголя, артериальной гипертонии, ожирения и т.д., может способствовать улучшению результатов
катетерной абляции у пациентов с неклапанной ФП.
) [11]. Кроме того,
катетерную абляцию рекомендуют выполнять для восстановления функции левого желудочка у пациентов с
кардиомиопатией, индуцированной тахикардией, и для увеличения выживаемости и снижения частоты госпитализаций у
пациентов с сердечной недостаточностью и сниженной функцией левого желудочка. По крайней мере у трети больных,
перенесших катетерную абляцию, в различные сроки после вмешательства возникают рецидивы ФП. В настоящее время
предложены различные шкалы для оценки риска рецидива аритмии после катетерной абляции, в том числе ALARMEc (тип
аритмии, размер левого предсердия, почечная недостаточность, метаболический синдром и кардиомиопатия), BASE-AF2
(индекс массы тела >28 кг/м2, дилатация левого предсердия >40 мм, ранний рецидив ФП после абляции, длительность
ФП >6 лет и непароксизмальная форма аритмии), APPLE (возраст ≥65 лет, персистирующая ФП, снижение скорости
клубочковой фильтрации <60 мл/мин/1,73 м2, диаметр левого предсердия ≥43 мм и фракция выброса левого
желудочка <50%), CAAP-AF (коронарная болезнь сердца, диаметр левого предсердия, возраст, персистирующая или
длительная ФП, неэффективность антиаритмических препаратов и женский пол), ATLAS (возраст старше 60 лет,
непароксизмальная ФП, дилатация левого предсердия, женский пол и курение), однако ни одна из них не имела
существенных преимуществ перед другими [54]. Моди фи кация различных факторов риска, в том числе курения,
употребления алкоголя, артериальной гипертонии, ожирения и т.д., может способствовать улучшению результатов
катетерной абляции у пациентов с неклапанной ФП.
- Цель антиаритмической терапии – уменьшение симптомов, связанных с ФП.
- Антиаритмическая терапия характеризуется умеренной эффективностью в профилактике рецидивов ФП.

- Антиаритмическая терапия скорее уменьшает число рецидивов аритмии, а не полностью их предупреж дает.
- Если один антиаритмический препарат оказывается неэффективным, то приемлемого клинического эффекта можно добиться с помощью другого препарата.
- Антиаритмическая терапия часто сопровождается аритмогенным эффектом и экстракардиальными побочными явлениями.
- Выбор антиаритмического препарата в первую очередь диктуется безопасностью, а не эффективностью.
Амиодарон остается самым эффективным антиаритмическим препаратом у больных с ФП, в том числе с сердечной недостаточностью и низкой фракцией выброса левого желудочка. В рекомендациях указано, что с учетом экстракардиальной токсичности амиодарона для длительного контроля синусового ритма у пациентов с ФП желательно по возможности применять другие антиаритмические препараты [11]. Тем не менее, как и в предыдущих версиях рекомендаций, другие антиаритмические средства, такие как пропафенон и соталол, рекомендовано использовать только при отсутствии признаков значительного структурного поражения сердца. Соталол может применяться у пациентов с ишемической болезнью сердца под тщательным контролем интервала QT, сывороточных уровней калия, клиренса креатинина и других факторов риска аритмогенного действия. К последним относят пожилой возраст, женский пол, нарушение функции почек и/или печени, коронарную болезнь сердца, гипокалиемию, случаи внезапной смерти у родственников. Анти арит мическую терапию не следует назначать пациентам с постоянной формой ФП, которые получают урежающие ритм препараты, а также больным с выраженными нарушениями проводимости, если им не установлен водитель ритма.
Лечение сердечно-сосудистых и других сопутствующих заболеваний
Сердечно-сосудистые заболевания и факторы риска, с одной стороны, способствуют развитию и рецидированию ФП, а, с
другой стороны, сами могут быть причиной неблагоприятных исходов, в том числе инсульта, инфаркта и смерти.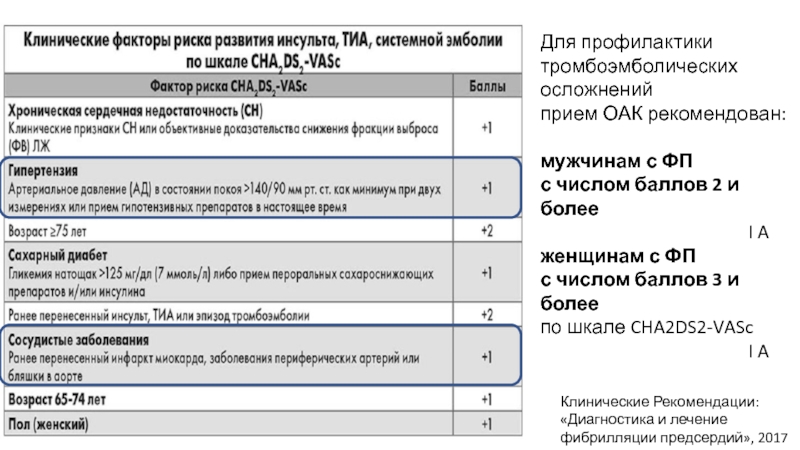 A.
Gómez-Outes и соавт. провели мета-анализ 4 клинических исследований, в которых ПОАК сравнивали с варфарином в
целом у 71683 больных с неклапанной ФП [55]. Во время периода наблюдения умерли 9% из них, а скорректированная
смертность составила 4,72% в год. Доля сердечных причин в структуре общей смертности составила 46%. Основными
факторами риска смерти от любых причин были сердечная недостаточность, постоянная/персистирующая ФП, сахарный
диабет, мужской пол, пожилой возраст и сниженный клиренс креатинина. Сходные данные были получены в одном из
исследований, включенных в мета-анализ, – ROCKET AF, в котором изучался ривароксабан [56]. Приведенные данные
указывают на важность модификации сердечнососудистых факторов риска для улучшения прогноза у больных с
неклапанной ФП.
A.
Gómez-Outes и соавт. провели мета-анализ 4 клинических исследований, в которых ПОАК сравнивали с варфарином в
целом у 71683 больных с неклапанной ФП [55]. Во время периода наблюдения умерли 9% из них, а скорректированная
смертность составила 4,72% в год. Доля сердечных причин в структуре общей смертности составила 46%. Основными
факторами риска смерти от любых причин были сердечная недостаточность, постоянная/персистирующая ФП, сахарный
диабет, мужской пол, пожилой возраст и сниженный клиренс креатинина. Сходные данные были получены в одном из
исследований, включенных в мета-анализ, – ROCKET AF, в котором изучался ривароксабан [56]. Приведенные данные
указывают на важность модификации сердечнососудистых факторов риска для улучшения прогноза у больных с
неклапанной ФП.
Предложены шкалы, позволяющие стратифицировать больных с неклапанной ФП по риску основных сердечно-сосудистых событий, в том числе смертель ного и несмертельного инфаркта миокарда, реваску ляризации коронарных артерий и смерти от сердечно-сосудистых причин. Например, на основании проспективного когортного исследования у 1019 пациентов с ФП разработан индекс 2MACE, который рассчитывается с учетом возраста и наличия метаболического синдрома, застойной сердечной недоста точности и инфаркта миокарда/реваскуляризации коронарных артерий и тромбоэмболий в анамнезе (табл. 4) [57]. Величина индекса 2MACE варьируется от 0 до 7, а его значение ≥3 позволяло с высокой чувствительностью и специфичностью предсказать развитие неблагоприятных исходов у пациентов с неклапанной ФП (отношение рисков 3,92, 95% ДИ 2,41-6,40, p<0,001).
| Акроним | Факторы риска | Балл |
|---|---|---|
| 2М | Инфаркт миокарда/реваскуляризация коронарных артерий в анамнезе | 1 |
| Метаболический синдром | 2 | |
| А | Возраст ≥75 лет | 2 |
| С | Застойная сердечная недостаточность (фракция выброса<40%) | 1 |
| E | Тромбоэмболии | 1 |
Лечение сопутствующих заболеваний и модификация сердечно-сосудистых факторов риска рассматриваются как один из
ключевых компонентов современной стратегии ведения пациентов с ФП [11]. В рандомизированном исследовании RACE 3
более «агрессивное» лечение сопутствующих сердечно-сосудистых заболеваний привело к достоверному увеличению
частоты удержания синусового ритма по сравнению с обычной терапией (75% и 63%, соответственно, р=0,042) [58]. В
некоторых исследованиях изучалось влияние модификации отдельных факторов риска на течение ФП. В
рандомизированном исследовании у 184 пациентов с ФП, перенесших катетерную абляцию, более «агрессивная»
антигипертензивная терапия не вызывала снижение риска развития рецидивов аритмии после вмешательства, но
сопровождалась увеличением частоты эпизодов артериальной гипотонии [59]. В то же время оптимальный контроль
гликемии в течение 12 мес до катетерной абляции ассоциировался со снижением риска развития рецидивов аритмии
[60]. В другом рандомизированном клиническом исследовании абстиненция вызывала снижение частоты эпизодов ФП у
пациентов, регулярно употреблявших алкоголь [61]. С другой стороны, кофеин, вероятно, существенно не влияет на
риск развития ФП, хотя употребление кофе может сопровождаться сердцебиением, не связанным с аритмией [62].
Регулярные умеренные физические нагрузки могут оказать благоприятное влияние на течение ФП, в то время как
интенсивная физическая активность, наоборот, ассоциируется с увеличением риска ее развития [63]. Снижение массы
тела у пациентов с ожирением и ФП вызывало уменьшение симптомов и частоты приступов аритмии [64]. В целом
результаты модификации отдельных факторов риска в клинических исследованиях у пациентов с ФП оказались
неоднозначными. Вероятно, это объясняется тем, что развитие ФП является следствием взаимодействия различных
сердечно-сосудистых и других факторов риска и заболеваний.
В рандомизированном исследовании RACE 3
более «агрессивное» лечение сопутствующих сердечно-сосудистых заболеваний привело к достоверному увеличению
частоты удержания синусового ритма по сравнению с обычной терапией (75% и 63%, соответственно, р=0,042) [58]. В
некоторых исследованиях изучалось влияние модификации отдельных факторов риска на течение ФП. В
рандомизированном исследовании у 184 пациентов с ФП, перенесших катетерную абляцию, более «агрессивная»
антигипертензивная терапия не вызывала снижение риска развития рецидивов аритмии после вмешательства, но
сопровождалась увеличением частоты эпизодов артериальной гипотонии [59]. В то же время оптимальный контроль
гликемии в течение 12 мес до катетерной абляции ассоциировался со снижением риска развития рецидивов аритмии
[60]. В другом рандомизированном клиническом исследовании абстиненция вызывала снижение частоты эпизодов ФП у
пациентов, регулярно употреблявших алкоголь [61]. С другой стороны, кофеин, вероятно, существенно не влияет на
риск развития ФП, хотя употребление кофе может сопровождаться сердцебиением, не связанным с аритмией [62].
Регулярные умеренные физические нагрузки могут оказать благоприятное влияние на течение ФП, в то время как
интенсивная физическая активность, наоборот, ассоциируется с увеличением риска ее развития [63]. Снижение массы
тела у пациентов с ожирением и ФП вызывало уменьшение симптомов и частоты приступов аритмии [64]. В целом
результаты модификации отдельных факторов риска в клинических исследованиях у пациентов с ФП оказались
неоднозначными. Вероятно, это объясняется тем, что развитие ФП является следствием взаимодействия различных
сердечно-сосудистых и других факторов риска и заболеваний.
ФП нередко наблюдается у пациентов с острым и хроническим коронарным синдромом, а примерно у 10-15% больных с ФП
проводятся чрескожные вмешательства на коронарных артериях (ЧКВ) [65]. Лекарственные средства, которые
используются для лечения коронарной болезни сердца, в том числе ингибиторы АПФ, блокаторы рецепторов
ангиотензина II, антагонисты минералокортикоидных рецепторов, статины, могут препятствовать развитию ФП или
оказывают благоприятное влияние на ее течение, в то время как b-адреноблокаторы или недигидропиридиновые
антагонисты кальция широко применяются у больных с ФП для контроля ЧСС. Однако возможность и целесообразность
комбинированной терапии пероральными антикоагулянтами и антитромбоцитарными препаратами у пациентов с коронарной
болезнью сердца и ФП заслуживает отдельного обсуждения, учитывая значительное увеличение риска кровотечения на
фоне такого лечения. В рекомендациях Европейского общества кардиологов указано, что при выборе
антитромботических препаратов и длительности антитромботической терапии у пациентов с неклапанной ФП, перенесших
острый коронарный синдром (ОКС) и/или ЧКВ, необходимо тщательно взвешивать риск ишемического инсульта/системных
эмболий, коронарных ишемических осложнений и кровотечений, связанных с приемом антитромботических препаратов
[11]. В целом терапия двумя антитромботическими препаратами, в том числе ПОАК и ингибитором P2Y12 рецепторов
(предпочительно клопидогрелом), сопровождалась значительным снижением риска кровотечений по сравнению с тройной
антитромботической терапией. Например, в исследование PIONEER AF-PCI были включены 2124 больных с неклапанной
ФП, которым было выполнено стентирование коронарной артерии (в половине случаев по поводу ОКС). Терапия
ривароксабаном в сниженной дозе 15 мг один раз в сутки (у пациентов с нарушенной функцией почек ее снижали до 10
мг/сут) в комбинации с ингибитором P2Y12 рецепторов (преимущественно клопидогрелом) в течение 12 мес
по эффективности в профилактике неблагоприятных исходов, в том числе инфаркта миокарда, инсульта, тромбоза
стента и смерти от сердечно-сосудистых причин, не уступала терапии антагонистом витамина К в комбинации с двумя
антитромбоцитарными препаратами, но сопровождалась значительным снижением риска развития клинически значимых
кровотечений на 41% [66].
Лекарственные средства, которые
используются для лечения коронарной болезни сердца, в том числе ингибиторы АПФ, блокаторы рецепторов
ангиотензина II, антагонисты минералокортикоидных рецепторов, статины, могут препятствовать развитию ФП или
оказывают благоприятное влияние на ее течение, в то время как b-адреноблокаторы или недигидропиридиновые
антагонисты кальция широко применяются у больных с ФП для контроля ЧСС. Однако возможность и целесообразность
комбинированной терапии пероральными антикоагулянтами и антитромбоцитарными препаратами у пациентов с коронарной
болезнью сердца и ФП заслуживает отдельного обсуждения, учитывая значительное увеличение риска кровотечения на
фоне такого лечения. В рекомендациях Европейского общества кардиологов указано, что при выборе
антитромботических препаратов и длительности антитромботической терапии у пациентов с неклапанной ФП, перенесших
острый коронарный синдром (ОКС) и/или ЧКВ, необходимо тщательно взвешивать риск ишемического инсульта/системных
эмболий, коронарных ишемических осложнений и кровотечений, связанных с приемом антитромботических препаратов
[11]. В целом терапия двумя антитромботическими препаратами, в том числе ПОАК и ингибитором P2Y12 рецепторов
(предпочительно клопидогрелом), сопровождалась значительным снижением риска кровотечений по сравнению с тройной
антитромботической терапией. Например, в исследование PIONEER AF-PCI были включены 2124 больных с неклапанной
ФП, которым было выполнено стентирование коронарной артерии (в половине случаев по поводу ОКС). Терапия
ривароксабаном в сниженной дозе 15 мг один раз в сутки (у пациентов с нарушенной функцией почек ее снижали до 10
мг/сут) в комбинации с ингибитором P2Y12 рецепторов (преимущественно клопидогрелом) в течение 12 мес
по эффективности в профилактике неблагоприятных исходов, в том числе инфаркта миокарда, инсульта, тромбоза
стента и смерти от сердечно-сосудистых причин, не уступала терапии антагонистом витамина К в комбинации с двумя
антитромбоцитарными препаратами, но сопровождалась значительным снижением риска развития клинически значимых
кровотечений на 41% [66]. Тем не менее, эксперты Европейского общества кардиологов считают желательным короткий
курс тройной антитромботической терапии пероральным антикоагулянтом, аспирином и клопидогрелом (например, в
течение ≤1 недели) у части пациентов с ФП, перенесших ОКС или ЧКВ, у которых имеется высокий риск ишемических
осложнений [11]. Длительность тройной терапии может быть увеличена до ≤1 мес, если угроза тромбоза стента
перевешивает риск кровотечений. К факторам риска тромботических осложнений относят сахарный диабет, ОКС в
анамнезе, поражение нескольких коронарных артерий, атеросклероз периферических артерий, развитие коронарной
болезни в возрасте до 45 лет или быстрое ее прогрессирование, ХБП 3 стадии [11].
Тем не менее, эксперты Европейского общества кардиологов считают желательным короткий
курс тройной антитромботической терапии пероральным антикоагулянтом, аспирином и клопидогрелом (например, в
течение ≤1 недели) у части пациентов с ФП, перенесших ОКС или ЧКВ, у которых имеется высокий риск ишемических
осложнений [11]. Длительность тройной терапии может быть увеличена до ≤1 мес, если угроза тромбоза стента
перевешивает риск кровотечений. К факторам риска тромботических осложнений относят сахарный диабет, ОКС в
анамнезе, поражение нескольких коронарных артерий, атеросклероз периферических артерий, развитие коронарной
болезни в возрасте до 45 лет или быстрое ее прогрессирование, ХБП 3 стадии [11].
Двойную терапию ПОАК и клопидогрелом после неосложненного стентирования коронарных артерий у пациентов с ОКС обычно продолжают в течение 1 года, а у пациентов со стабильной хронической ИБС, перенесших ЧКВ, – в течение 6 мес. Если в течение указанного срока не было зарегистрировано ишемических осложнений, то в дальнейшем целесообразно проводить монотерапию пероральным антикоагулянтом. Моноте рапия рекомендуется также пациентам с неклапанной ФП и стабильной ИБС.
Доводами в пользу монотерапии пероральными антикоагулянтами являются, с одной стороны, их предполагаемая
эффективность в профилактике сердечнососудистых событий, а, с другой стороны, более низкий риск кровотечений,
который неизбежно увеличивается при присоединении дополнительных антитромботических препаратов. P. Kupó и соавт.
провели мета-анализ 28 рандомизированных клинических исследований, в которых ПОАК сравнивали с антагонистами
витамина К, антитромбоцитарными препаратами и/или плацебо по различным показаниям в целом у 196761 больного
[67]. Лечение ривароксабаном ассоциировалось со снижением относительного риска инфаркта миокарда на 21% по
сравнению с плацебо и на 31% по сравнению с дабигатраном.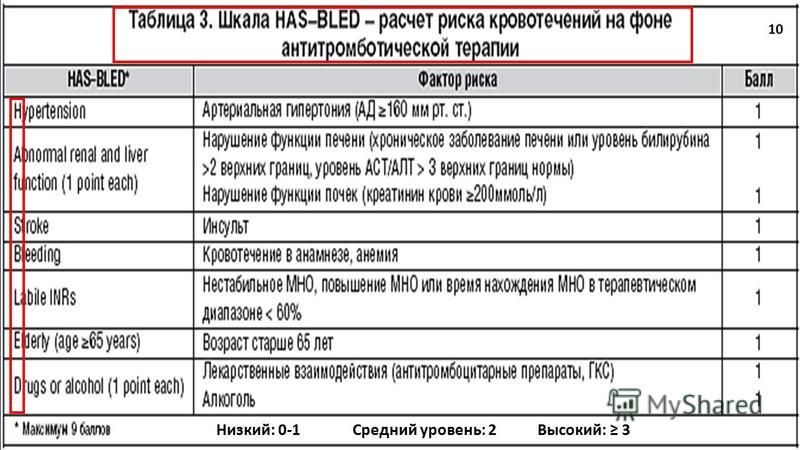 Сходные данные ранее были получены другими авторами.
Например, Y. Loke и соавт. при мета-анализе 27 рандомизированных контролируемых клинических исследований выявили
снижение риска коронарных осложнений при применении ривароксабана по сравнению с таковым при лечении
дабигатраном [68]. При интерпретации полученных данных необходимо учитывать, что они были получены не в прямых
сравнительных исследованиях ПОАК, а показания к их применению включали не только неклапанную ФП, но и другие
состояния.
Сходные данные ранее были получены другими авторами.
Например, Y. Loke и соавт. при мета-анализе 27 рандомизированных контролируемых клинических исследований выявили
снижение риска коронарных осложнений при применении ривароксабана по сравнению с таковым при лечении
дабигатраном [68]. При интерпретации полученных данных необходимо учитывать, что они были получены не в прямых
сравнительных исследованиях ПОАК, а показания к их применению включали не только неклапанную ФП, но и другие
состояния.
Заключение
Современная стратегия лечения больных с неклапанной ФП, которая подробно рассматривается в рекомендациях
Европейского общества кардиологов 2020 г., предполагает антикоагуляцию с целью профилактики инсульта и системных
эмболий, улучшение контроля симптомов ФП путем урежения ЧСС или восстановления и удержания синусового ритма и
оптимальное лечение сердечно-сосудистых и других сопутствующих заболеваний, которые в структуре смертности паци
ентов с ФП занимают даже более важное место, чем ишемический инсульт. Накапливаются данные, демонстрирующие
дополнительные преимущества ПОАК перед непрямыми антикоагулянтами. Например, в мета-анализах рандомизированных
клинических исследованиях показано снижение риска развития инфаркта миокарда/ОКС при лечении ривароксабаном по
срав нению с контролем. В ретроспективных исследованиях лечение ривароксабаном улучшало почечные исходы у
пациентов с неклапанной ФП. Пациентам с ФП следует проводить структурированное обследование, включающее в себя
оценку риска инсульта, выраженности симптомов, тяжести нагрузки ФП (тип аритмии, число и длительность эпизодов и
т.п.) и предрасполагающего состояния. Важное значение имеет использование различных шкал, в том числе
CHA2DS2-VASc (риск инсульта), HAS-BLED (риск кровотечения), EHRA (выраженность симптомов ФП) и 2MACE (риск
сердечно-сосудистых исходов), которые помогают выбрать оптимальное лечение. Для более точной оценки риска
инсульта и кровотечений у пациентов с ФП предложены новые шкалы на основе не только клинических показателей, но
и лабораторных маркеров, однако их потенциальные преимущества перед существующими общепринятыми индексами
нуждаются в подтверждении.
Для более точной оценки риска
инсульта и кровотечений у пациентов с ФП предложены новые шкалы на основе не только клинических показателей, но
и лабораторных маркеров, однако их потенциальные преимущества перед существующими общепринятыми индексами
нуждаются в подтверждении.
Шкала CHA2DS2-VASс | Интернет-издание «Новости медицины и фармации»
Статья опубликована на с. 34
Шкала CHA2DS2-VASc — это простой клинический инструмент для прогнозирования риска ишемического инсульта и системного тромбоэмболизма при фибрилляции предсердий [1]. Она является дальнейшим улучшением шкалы CHADS2, расширяя последнюю путем добавления общеизвестных факторов риска инсульта, что, в свою очередь, может иметь значение в принятии решения о назначении антикоагулянтной терапии. Шкала CHA2DS2-VASc включает дополнительные факторы (VASc) — сосудистые заболевания, возраст 65–74 года и женский пол, каждый из которых оценен по 1 баллу. Если возраст пациента старше 75 лет, то присваивается 2 балла. Индекс CHA2DS2-VASc варьирует от 0 до 9.
Пероральные антикоагулянты должны назначаться при неклапанной форме фибрилляции предсердий, если у пациента имеется хотя бы один балл по шкале CHA2DS2-VASc.
Euro Heart Survey on AF сравнили CHA2DS2-VASc с 7 другими современными стратификациями риска развития инсульта у 1084 пациентов, где CHA2DS2-VASc показала хорошую предсказательную способность.
Bibliography1. Lip G.Y., Nieuwlaat R., Pisters R., Lane D.A., Crijns H.J. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation // Chest. — 2010 Feb. — 137(2). — 263–72.
2. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery, Camm A.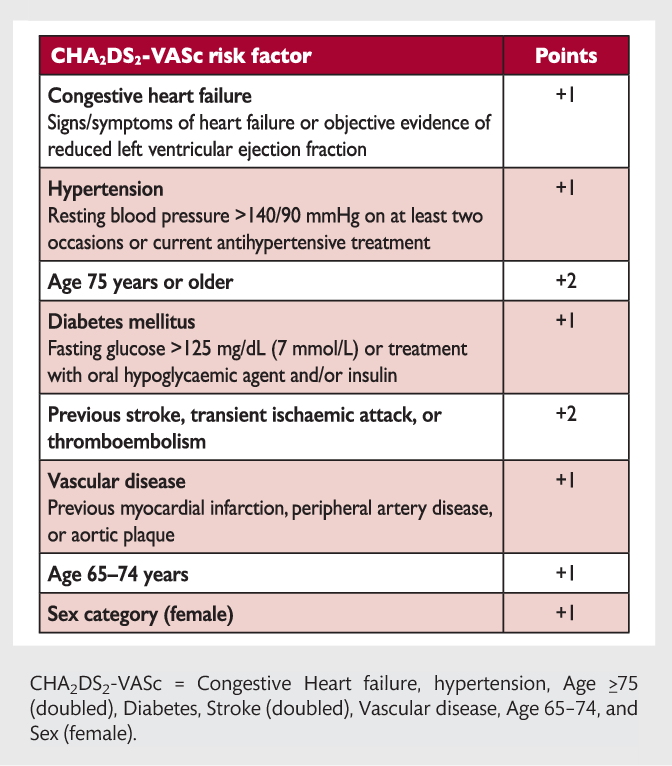 J., Kirchhof P., Lip G.Y., Schotten U., Savelieva I., Ernst S., Van Gelder I.C., Al-Attar N., Hindricks G., Prendergast B., Heidbuchel H., Alfieri O., Angelini A., Atar D., Colonna P., De Caterina R., De Sutter J., Goette A., Gorenek B., Heldal M., Hohloser S.H., Kolh P., Le Heuzey J.Y., Ponikowski P., Rutten F.H.Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC) // Eur. Heart J. — 2010 Oct. — 31(19). — 2369–429.
J., Kirchhof P., Lip G.Y., Schotten U., Savelieva I., Ernst S., Van Gelder I.C., Al-Attar N., Hindricks G., Prendergast B., Heidbuchel H., Alfieri O., Angelini A., Atar D., Colonna P., De Caterina R., De Sutter J., Goette A., Gorenek B., Heldal M., Hohloser S.H., Kolh P., Le Heuzey J.Y., Ponikowski P., Rutten F.H.Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC) // Eur. Heart J. — 2010 Oct. — 31(19). — 2369–429.
3. Van Staa T.P., Setakis E., Di Tanna G.L., Lane D.A., Lip G.Y. A comparison of risk stratification schemes for stroke in 79,884 atrial fibrillation patients in general practice // J. Thromb. Haemost. — 2011 Jan. — 9(1). — 39–48.
4. Lip G.Y., Frison L., Halperin J.L., Lane D.A. Identifying patients at high risk for stroke despite anticoagulation: a comparison of contemporary stroke risk stratification schemes in an anticoagulated atrial fibrillation cohort // Stroke. — 2010 Dec. — 41(12). — 2731–8.
5. Olesen J.B., Lip G.Y., Hansen M.L., Hansen P.R., Tolstrup J.S., Lindhardsen J., Selmer C., Ahlehoff O., Olsen A.M., Gislason G.H., Torp-Pedersen C. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study // BMJ. — 2011, Jan 31. — 342. — 124.
Новая эра антикоагулянтной терапии при неклапанной форме фибрилляции предсердий
Проанализированы результаты исследований эффективности и безопасности новых пероральных антикоагулянтов – дабигатрана этексилата, ривароксабана, апиксабана. Все три антикоагулянта продемонстрировали не меньшую по сравнению с варфарином эффективность и безопасность. Каждый из них превзошел варфарин по безопасности в отношении любых внутричерепных кровотечений. Выбор препарата, не уступающего или даже превосходящего по эффективности варфарин при сопоставимом или меньшем риске кровотечений, позволяет оптимизировать профилактику инсульта у больных неклапанной формой фибрилляции предсердий.
Таблица 1. Оценка риска развития инсульта и системных эмболий у больных неклапанной ФП по шкале CHA2DS2-VASc
Рисунок. Алгоритм выбора антикоагулянтной терапии при фибрилляции предсердий
Таблица 2. Шкала оценки риска кровотечений HAS-BLED
Таблица 3. Краткая характеристика трех новых пероральных прямых антикоагулянтов и обзор ключевых клинических исследований сравнения новых антикоагулянтов с варфарином для профилактики инсульта при неклапанной ФП
Таблица 3. Краткая характеристика трех новых пероральных прямых антикоагулянтов и обзор ключевых клинических исследований сравнения новых антикоагулянтов с варфарином для профилактики инсульта при неклапанной ФП
Обязательным элементом в комплексном лечении фибрилляции предсердий (ФП) является профилактика инсульта и других системных эмболий. Речь прежде всего идет об ишемическом инсульте, поскольку среди всех инсультов у больных с ФП на его долю приходится 92%. На долю геморрагического – только 8% [1].
Дезорганизация электрических процессов и отсутствие механической систолы предсердий приводят к замедлению кровотока в предсердиях, особенно в их ушках, и формированию тромбов. В этой связи ФП ассоциируется с 5-кратным увеличением риска ишемического инсульта [2] и считается основной причиной эмболических инсультов [3]. Каждый третий ишемический инсульт происходит вследствие ФП [4].
Отметим, что ишемические инсульты, возникающие на фоне ФП, отличаются крайне тяжелым течением. У 60% больных они заканчиваются стойкой инвалидизацией, у 20% – смертью [5]. Риск ишемического инсульта практически одинаков при любой форме ФП. Его частота сопоставима у больных с пароксизмальной, персистирующей и постоянной формами, у больных с симптомным и бессимптомным течением ФП [6, 7]./30/30.jpg) Чтобы уменьшить вероятность развития ишемического инсульта и других системных эмболий, у каждого больного, страдающего ФП, врач обязан стратифицировать риск этих грозных осложнений и решить вопрос о целесообразности назначения антикоагулянтной терапии.
Чтобы уменьшить вероятность развития ишемического инсульта и других системных эмболий, у каждого больного, страдающего ФП, врач обязан стратифицировать риск этих грозных осложнений и решить вопрос о целесообразности назначения антикоагулянтной терапии.
Больные с ревматическими клапанными пороками сердца и клапанными протезами относятся к категории крайне высокого риска ишемического инсульта и других системных эмболий на фоне ФП и нуждаются в постоянном приеме варфарина. Новые пероральные антикоагулянты у такой категории больных либо пока не апробированы (ривароксабан, апиксабан), либо не рекомендованы (дабигатрана этексилат). Степень риска ишемического инсульта и других системных эмболий у больных с неклапанной формой ФП увеличивается при наличии ряда факторов, таких как возраст, пол, сопутствующие сердечно-сосудистые заболевания, сахарный диабет.
Существует несколько шкал для стратификации риска инсульта и системных эмболий у больных неклапанной формой ФП. Национальные и европейские рекомендации по лечению ФП рекомендуют шкалу CHA2DS2-VASc, основанную на оценке факторов риска в баллах [8, 9, 10]. Название шкалы представляет собой англоязычную аббревиатуру факторов риска. Расшифровка буквенных обозначений и оценка в баллах каждого составляющего шкалу фактора риска представлены в табл. 1.
За наличие каждого фактора риска больному присваиваются баллы. Сердечная недостаточность со сниженной фракцией выброса, артериальная гипертония, сахарный диабет, наличие сосудистых заболеваний (инфаркт миокарда в анамнезе, заболевания периферических артерий, бляшки в аорте), возраст 65–74 года, женский пол в сочетании с возрастом 65 лет и старше оцениваются в 1 балл дополнительного риска каждый. Инсульт и транзиторные ишемические атаки (ТИА) в анамнезе, возраст 75 лет и старше – наиболее сильные предикторы риска инсульта на фоне ФП, оцениваемые в 2 балла каждый. Алгоритм выбора антикоагулянтной терапии представлен на рисунке.
При оценке риска по шкале CHA2DS2-VASc в 0 баллов (такую оценку получают больные моложе 65 лет, включая женщин, страдающие изолированной формой ФП) риск инсульта близок к нулю [11]. Европейские и российские эксперты полагают, что при оценке риска по шкале CHA2DS2-VASc в 0 баллов правильнее не назначать антитромботическую терапию, поскольку риск инсульта в этом случае намного ниже, чем потенциальный риск кровотечений на фоне антитромботической терапии, в том числе на фоне приема ацетилсалициловой кислоты (АСК).
Европейские и российские эксперты полагают, что при оценке риска по шкале CHA2DS2-VASc в 0 баллов правильнее не назначать антитромботическую терапию, поскольку риск инсульта в этом случае намного ниже, чем потенциальный риск кровотечений на фоне антитромботической терапии, в том числе на фоне приема ацетилсалициловой кислоты (АСК).
Если по шкале CHA2DS2-VASc больной получил ≥ 1 балла, профилактика инсульта и системных эмболий обязательна. Правильнее остановить выбор на пероральных антикоагулянтах, а не на АСК, поскольку их преимущества перед АСК доказаны в многоцентровых контролируемых исследованиях и метаанализах. Пероральные антикоагулянты эффективнее АСК при сопоставимом риске кровотечений. Исследование AVERROES (Apixaban Versus Acetylsalicylic Acid [ASA] to Prevent Stroke in Atrial Fibrillation Patients Who Have Failed or Are Unsuitable for Vitamin K Antagonist Treatment – Сравнение эффективности апиксабана и АСК для профилактики инсульта у пациентов с фибрилляцией предсердий, которые не могут получать антагонисты витамина K), в котором сравнивали эффективность и безопасность нового антикоагулянта, блокатора Xa фактора апиксабана в дозе 5 мг 2 раза в день и АСК в дозе 81–325 мг в день у больных неклапанной формой ФП, было прекращено досрочно в связи с достоверно большей эффективностью апиксабана. Относительный риск тромбоэмболических осложнений на фоне приема апиксабана был на 55% ниже, чем на фоне приема АСК (95% ДИ 0,32–0,62, р
При оценке риска в 2 балла и выше по шкале CHA2DS2-VASc больному назначается пероральный антикоагулянт. В данном случае он не назначается только при наличии серьезных противопоказаний.
Назначая антикоагулянт, врач обязан взвешивать не только риск инсульта, но и риск кровотечений, особенно внутричерепных геморрагий, являющихся самым грозным осложнением антикоагулянтной терапии, ассоциированным с высоким риском смерти [13]. В европейских и национальных рекомендациях по диагностике и лечению ФП для оценки риска кровотечений рекомендовано использовать шкалу HAS-BLED (табл. 2).
2).
Шкалу HAS-BLED следует использовать не для отказа от антикоагулянтной терапии, а для того, чтобы выявить и устранить модифицируемые факторы риска, при высоком риске тромбоэмболических осложнений и кровотечений выбрать эффективный и максимально безопасный антикоагулянт. С появлением новых пероральных антикоагулянтов это стало возможно.
Оценка по шкале HAS-BLED ≥ 3 балла указывает на высокий риск кровотечения и требует особой осторожности и внимания при назначении антитромботической терапии, наблюдения за больными, индивидуального подбора доз, выявления модифицируемых факторов риска и их коррекции. Больным с высоким риском кровотечений приходится назначать антикоагулянты, поскольку риск ишемического инсульта и других системных эмболий у них еще выше. При выборе в качестве антитромботической терапии антагонистов витамина К у таких больных необходимо проводить более жесткий контроль международного нормализованного отношения (МНО) в узком терапевтическом диапазоне 2,0–2,5.
Наиболее изученным антикоагулянтом, относящимся к группе антагонистов витамина К, применяемым для профилактики инсультов и системных эмболий у больных ФП, является варфарин. Зарегистрированный в 1948 г. в США как яд для грызунов, варфарин был разрешен для медицинского применения у людей в 1954 г. [14]. До 2009 г. он оставался самым эффективным антитромботическим препаратом у больных ФП. Опубликованный в 2007 г. метаанализ 29 рандомизированных исследований (18 исследований с участием варфарина), включивших 28 044 больных, показал, что терапия варфарином в терапевтических дозах (МНО от 2,0 до 3,0) по сравнению с плацебо ассоциируется с уменьшением относительного риска (ОР) всех инсультов у больных неклапанной формой ФП на 64% (ишемического инсульта на 67%), в то время как АСК уменьшает риск инсульта лишь на 19% [15]. Отметим, что метаанализ не обнаружил дозозависимого усиления протективного эффекта АСК в отличие от риска кровотечений, который возрастал по мере увеличения дозы АСК.
Двойная антиагрегантная терапия АСК в сочетании с клопидогрелом, продемонстрировавшая в исследовании ACTIVE A (Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events – Исследование клопидогрела и ирбесартана для профилактики сосудистых осложнений при фибрилляции предсердий) снижение ОР развития инсульта, системных эмболий, инфаркта миокарда, сосудистой смерти на 11% по сравнению с АСК + плацебо, также уступает по эффективности варфарину [16, 17]. Нецелесообразно добавлять к варфарину антиагреганты, включая АСК, поскольку комбинированная терапия антагонистами витамина К в сочетании с антиагрегантами не продемонстрировала преимуществ перед монотерапией антагонистами витамина К в целевых дозах (МНО 2,0–3,0). При добавлении к варфарину антиагреганта существенно возрастал риск кровотечений.
Применение антагонистов витамина К, в первую очередь варфарина, сопряжено с определенными проблемами. Прежде всего необходимо постоянно контролировать МНО и корректировать дозы препарата в зависимости от полученных результатов МНО. Дело в том, что метаболизм варфарина осуществляется ферментами системы цитохрома Р450. В связи c этим многие пищевые продукты и лекарства, метаболизирующиеся этими же ферментами, ускоряют или замедляют его метаболизм и соответственно снижают или увеличивают концентрацию препарата в крови. Чувствительность к варфарину зависит от фармакогенетических особенностей конкретного человека, определяемых носительством полиморфизмов гена цитохрома Р 450 2С9 и гена комплекса 1 витамин К эпоксидредуктазы (VKORC1). Еще одна проблема, связанная с приемом варфарина, – необходимость жесткого контроля МНО. Клинические исследования показали, что варфарин способен предупреждать инсульты и другие системные эмболии, только если МНО находится в терапевтическом диапазоне не менее 70% времени приема препарата. Это условие в реальной клинической практике соблюдают крайне редко. Даже в хорошо организованных клинических исследованиях, например в таком, как RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy – Рандомизированная оценка длительной антикоагулянтной терапии), средний процент времени пребывания больных в терапевтическом окне МНО на фоне приема варфарина составил лишь 64% [18].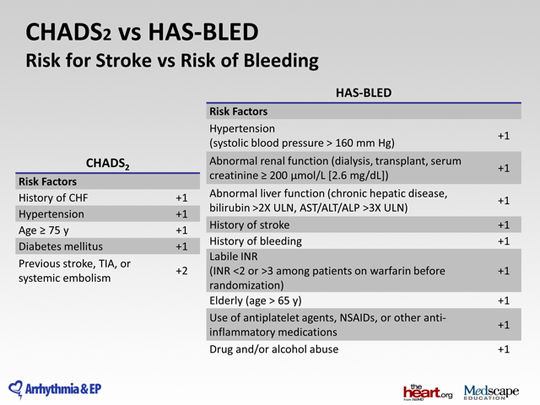 Поэтому необходимо помнить, что в реальной жизни большинство больных, получающих варфарин, недостаточно застрахованы от инсульта и других системных эмболий.
Поэтому необходимо помнить, что в реальной жизни большинство больных, получающих варфарин, недостаточно застрахованы от инсульта и других системных эмболий.
Появление новых пероральных антикоагулянтов открыло новую эру в профилактике инсультов и других системных эмболий у больных неклапанной формой ФП. Среди новых пероральных антикоагулянтов следует выделить две группы препаратов: прямые ингибиторы тромбина, представленные в настоящий момент одним препаратом – дабигатрана этексилатом, и ингибиторы Ха фактора – ривароксабан, апиксабан, эдоксабан, бетриксабан, YM150 и др. Краткая характеристика новых пероральных антикоагулянтов и обзор трех ключевых многоцентровых рандомизированных исследований новых антикоагулянтов в сравнении с варфарином для профилактики инсульта при неклапанной ФП представлены в табл. 3 [10].
Началом новой эры в лечении больных неклапанной формой фибрилляции предсердий можно считать 17 сентября 2009 г., когда J. Connolly и соавт. в The New England Jornal of Medicine опубликовали результаты крупного (с участием 18 113 больных) исследования RE-LY, в ходе которого сравнивались эффективность и безопасность двух доз дабигатрана этексилата и варфарина у больных неклапанной формой ФП [18]. Впервые за 55 лет, прошедшие с момента регистрации варфарина как лекарственного препарата, появилась альтернатива антагонистам витамина К в профилактике инсульта и системных эмболий у больных неклапанной ФП. В дозе 150 мг 2 раза в день дабигатрана этексилат оказался эффективнее варфарина при сопоставимом риске кровотечений. В дозе 110 мг 2 раза в день дабигатрана этексилат был так же эффективен, как варфарин, при меньшем риске кровотечений. Средний процент времени пребывания в терапевтическом окне МНО на фоне приема варфарина в исследовании составил 64%. Частота достижения комбинированной конечной точки (любой инсульт или системные эмболии) на фоне приема варфарина составляла 1,69% в год. В то же время в группе больных, принимавших дабигатрана этексилат в дозе 150 мг 2 раза в день, частота достижения первичной конечной точки была равна 1,11% в год (уменьшение ОР по сравнению с варфарином на 34%, р
Эффективность другого таблетированного антикоагулянта – прямого ингибитора Xa фактора ривароксабана в дозе 20 мг 1 раз в день по сравнению с варфарином изучали в исследовании ROCKET AF (Rivaroxaban-once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation – Исследование однократного перорального приема прямого ингибитора фактора Xa ривароксабана по сравнению с антагонистом витамина K для профилактики инсульта и эмболий при фибрилляции предсердий) [19, 20]. Пациенты с умеренной степенью почечной недостаточности получали 15 мг ривароксабана 1 раз в день. В исследовании участвовало 14 264 больных неклапанной формой ФП. Больные, включенные в исследование ROCKET AF, имели высокий риск инсульта, среднее значение риска по шкале CHADS2 составило 3,5, что существенно превышало средний балл риска ишемического инсульта в исследованиях RE-LY (2,1) и ARISTOTLE (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation – Исследование применения апиксабана для профилактики инсульта и других тромбоэмболических осложнений при фибрилляции предсердий) (2,1). Кроме того, в исследовании ROCKET AF было больше женщин – 38,7% (в исследовании RE-LY – 36,4%, в исследовании ARISTOTLE – 35,5%), а как известно, женский пол является самостоятельным фактором риска ишемического инсульта. Таким образом, сравнивать напрямую результаты трех крупных исследований эффективности новых пероральных антикоагулянтов при неклапанной форме ФП невозможно, поскольку популяции больных, участвовавших в исследованиях, были разными. Во всяком случае в исследовании ROCKET AF больные были однозначно более тяжелыми с множеством сопутствующих заболеваний. Средний процент времени пребывания в терапевтическом окне МНО на фоне приема варфарина в исследовании ROCKET AF составил 55%. Частота достижения комбинированной первичной конечной точки эффективности (любой инсульт или системные эмболии) на фоне приема варфарина в исследовании равнялась 2,4% в год. В то же время в группе больных, принимавших ривароксабан, частота достижения первичной конечной точки эффективности составила 2,1% в год (р
Пациенты с умеренной степенью почечной недостаточности получали 15 мг ривароксабана 1 раз в день. В исследовании участвовало 14 264 больных неклапанной формой ФП. Больные, включенные в исследование ROCKET AF, имели высокий риск инсульта, среднее значение риска по шкале CHADS2 составило 3,5, что существенно превышало средний балл риска ишемического инсульта в исследованиях RE-LY (2,1) и ARISTOTLE (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation – Исследование применения апиксабана для профилактики инсульта и других тромбоэмболических осложнений при фибрилляции предсердий) (2,1). Кроме того, в исследовании ROCKET AF было больше женщин – 38,7% (в исследовании RE-LY – 36,4%, в исследовании ARISTOTLE – 35,5%), а как известно, женский пол является самостоятельным фактором риска ишемического инсульта. Таким образом, сравнивать напрямую результаты трех крупных исследований эффективности новых пероральных антикоагулянтов при неклапанной форме ФП невозможно, поскольку популяции больных, участвовавших в исследованиях, были разными. Во всяком случае в исследовании ROCKET AF больные были однозначно более тяжелыми с множеством сопутствующих заболеваний. Средний процент времени пребывания в терапевтическом окне МНО на фоне приема варфарина в исследовании ROCKET AF составил 55%. Частота достижения комбинированной первичной конечной точки эффективности (любой инсульт или системные эмболии) на фоне приема варфарина в исследовании равнялась 2,4% в год. В то же время в группе больных, принимавших ривароксабан, частота достижения первичной конечной точки эффективности составила 2,1% в год (р
Сравнению эффективности еще одного прямого ингибитора Ха фактора – апиксабана и варфарина у больных неклапанной формой ФП было посвящено исследование ARISTOTLE [22]. В нем участвовал 18 201 больной. Больные в группе апиксабана получали препарат в дозе 5 мг 2 раза в день, у пациентов с умеренной степенью почечной недостаточности доза снижалась до 2,5 мг 2 раза в день.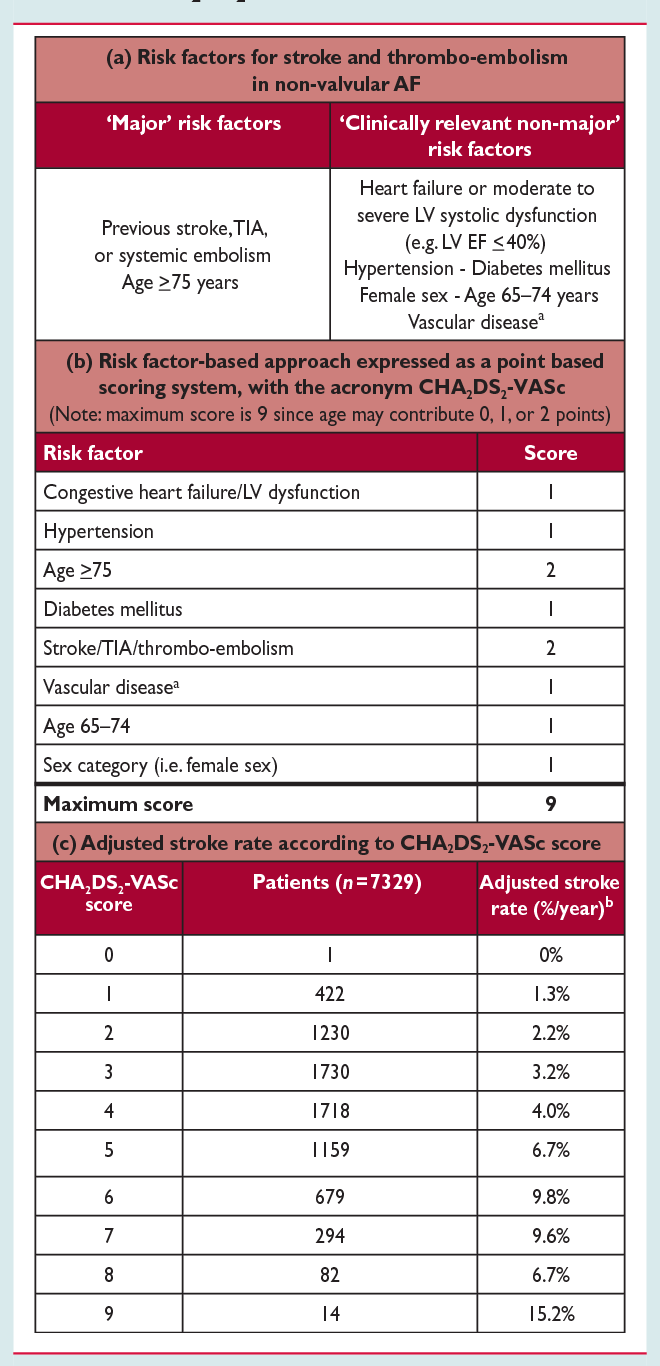 Средний процент времени пребывания в терапевтическом окне МНО в группе варфарина составил 62,2%. Первичная конечная точка эффективности, как и в исследованиях RE-LY и ROCKET AF, была комбинированной – ишемический или геморрагический инсульт или системные эмболии. Апиксабан в этом исследовании оказался эффективнее и безопаснее варфарина. Частота достижения первичной конечной точки в группе апиксабана составила 1,27% в год, в группе варфарина – 1,60% в год (р = 0,01), уменьшение ОР достижения первичной конечной точки в группе апиксабана на 21% в сравнении с варфарином. На фоне терапии апиксабаном было достоверно меньше геморрагических инсультов – 0,24% в год по сравнению с 0,47% в год в группе варфарина (р
Средний процент времени пребывания в терапевтическом окне МНО в группе варфарина составил 62,2%. Первичная конечная точка эффективности, как и в исследованиях RE-LY и ROCKET AF, была комбинированной – ишемический или геморрагический инсульт или системные эмболии. Апиксабан в этом исследовании оказался эффективнее и безопаснее варфарина. Частота достижения первичной конечной точки в группе апиксабана составила 1,27% в год, в группе варфарина – 1,60% в год (р = 0,01), уменьшение ОР достижения первичной конечной точки в группе апиксабана на 21% в сравнении с варфарином. На фоне терапии апиксабаном было достоверно меньше геморрагических инсультов – 0,24% в год по сравнению с 0,47% в год в группе варфарина (р
Все три новых пероральных антикоагулянта продемонстрировали как минимум не меньшую эффективность и безопасность в сравнении с варфарином. Каждый из них превзошел варфарин по безопасности в отношении любых внутричерепных кровотечений, включая геморрагические инсульты. Выбор препарата, не уступающего или даже превосходящего по эффективности варфарин при сопоставимом или меньшем риске кровотечений, позволяет оптимизировать профилактику инсульта у больных неклапанной формой ФП. Новые пероральные антикоагулянты назначаются в фиксированных дозах и не требуют рутинного контроля параметров гемостаза, имеют предсказуемый фармакодинамический эффект, не взаимодействуют с пищевыми продуктами и минимально взаимодействуют с другими препаратами, их действие в отличие от варфарина быстро начинается и прекращается в силу более благоприятного фармакокинетического профиля.
Сегодня новые пероральные антикоагулянты составляют реальную конкуренцию варфарину у больных неклапанной формой ФП. В этой связи актуальным представляется вопрос их применения у больных с неклапанной формой ФП в сочетании с ишемической болезнью сердца (ИБС), особенно такой ее формой, как острый коронарный синдром (ОКС), при котором требуется комбинированная, тройная или двойная антитромботическая терапия. Cведения об эффективности и безопасности применения новых пероральных антикоагулянтов при ИБС немногочисленны и противоречивы. Ривароксабан в дополнение к двойной антиагрегантной терапии, единственный из трех новых пероральных антикоагулянтов, показал преимущество перед плацебо у больных ОКС, большинство из которых имели синусовый ритм. В исследовании ATLAS ACS 2–TIMI 51 (Anti-Xa Therapy to Lower Cardiovascular Events in Addition to Standard Therapy in Subjects with Acute Coronary Syndrome 2–Thrombolysis in Myocardial Infarction 51 – Анти-Xa терапия для снижения риска сердечно-сосудистых осложнений в дополнение к стандартному лечению у пациентов с острым коронарным синдромом 2 – Тромболизис при инфаркте миокарда 51) ривароксабан в низких дозах (2,5 мг и 5 мг 2 раза в день) в дополнение к двойной антиагрегантной терапии по сравнению с плацебо достоверно уменьшал относительный риск развития комбинированной конечной точки, включавшей смерть в связи с сердечно-сосудистыми проблемами, инфаркт миокарда или инсульт у больных с недавно перенесенным ОКС (р = 0,008) [23]. Применение ривароксабана в сочетании с двойной антитромботической терапией в этом исследовании ассоциировалось с повышением риска больших кровотечений, не связанных с коронарным шунтированием, и внутричерепных кровотечений. Доза ривароксабана 2,5 мг 2 раза в день в плане кровотечений оказалась безопаснее дозы 5 мг 2 раза в день, кровотечения на фоне терапии ривароксабаном 2,5 мг 2 раза в день были курабельными, в результате количество смертельных кровотечений (0,1%) на фоне терапии ривароксабаном в меньшей дозе достоверно не отличалось от количества смертельных кровотечений, возникших в группе плацебо (0,2%). В то же время неизвестно, способна ли эта доза ривароксабана снизить риск инсульта у больных ОКС на фоне ФП. Терапия ривароксабаном в низких дозах в дополнение к двойной антиагрегантной терапии у больных ОКС, среди которых преобладали больные без ФП, не влияла на риск инсульта в исследовании ATLAS ACS 2–TIMI 51.
Cведения об эффективности и безопасности применения новых пероральных антикоагулянтов при ИБС немногочисленны и противоречивы. Ривароксабан в дополнение к двойной антиагрегантной терапии, единственный из трех новых пероральных антикоагулянтов, показал преимущество перед плацебо у больных ОКС, большинство из которых имели синусовый ритм. В исследовании ATLAS ACS 2–TIMI 51 (Anti-Xa Therapy to Lower Cardiovascular Events in Addition to Standard Therapy in Subjects with Acute Coronary Syndrome 2–Thrombolysis in Myocardial Infarction 51 – Анти-Xa терапия для снижения риска сердечно-сосудистых осложнений в дополнение к стандартному лечению у пациентов с острым коронарным синдромом 2 – Тромболизис при инфаркте миокарда 51) ривароксабан в низких дозах (2,5 мг и 5 мг 2 раза в день) в дополнение к двойной антиагрегантной терапии по сравнению с плацебо достоверно уменьшал относительный риск развития комбинированной конечной точки, включавшей смерть в связи с сердечно-сосудистыми проблемами, инфаркт миокарда или инсульт у больных с недавно перенесенным ОКС (р = 0,008) [23]. Применение ривароксабана в сочетании с двойной антитромботической терапией в этом исследовании ассоциировалось с повышением риска больших кровотечений, не связанных с коронарным шунтированием, и внутричерепных кровотечений. Доза ривароксабана 2,5 мг 2 раза в день в плане кровотечений оказалась безопаснее дозы 5 мг 2 раза в день, кровотечения на фоне терапии ривароксабаном 2,5 мг 2 раза в день были курабельными, в результате количество смертельных кровотечений (0,1%) на фоне терапии ривароксабаном в меньшей дозе достоверно не отличалось от количества смертельных кровотечений, возникших в группе плацебо (0,2%). В то же время неизвестно, способна ли эта доза ривароксабана снизить риск инсульта у больных ОКС на фоне ФП. Терапия ривароксабаном в низких дозах в дополнение к двойной антиагрегантной терапии у больных ОКС, среди которых преобладали больные без ФП, не влияла на риск инсульта в исследовании ATLAS ACS 2–TIMI 51. Тем не менее в практическом руководстве Европейской ассоциации сердечного ритма по использованию новых пероральных антикоагулянтов у пациентов с фибрилляцией предсердий неклапанной этиологии, опубликованном в 2013 г., сказано, что при наличии показаний к применению новых пероральных антикоагулянтов при ОКС предпочтение следует отдавать ингибиторам Xa фактора, прежде всего ривароксабану, как препарату, показавшему преимущество перед другими новыми пероральными антикоагулянтами по уменьшению риска инфаркта миокарда и других форм ОКС в метаанализе K.Н. Mak 2012 г., включившем 28 рандомизированных контролируемых исследований (138 948 больных) [24, 25].
Тем не менее в практическом руководстве Европейской ассоциации сердечного ритма по использованию новых пероральных антикоагулянтов у пациентов с фибрилляцией предсердий неклапанной этиологии, опубликованном в 2013 г., сказано, что при наличии показаний к применению новых пероральных антикоагулянтов при ОКС предпочтение следует отдавать ингибиторам Xa фактора, прежде всего ривароксабану, как препарату, показавшему преимущество перед другими новыми пероральными антикоагулянтами по уменьшению риска инфаркта миокарда и других форм ОКС в метаанализе K.Н. Mak 2012 г., включившем 28 рандомизированных контролируемых исследований (138 948 больных) [24, 25].
|
|
CHA2DS2-VASc Score Обзор темы — Фибрилляция предсердий
Оценка CHA 2 DS 2 -VASc — это наиболее часто используемый метод для прогнозирования риска тромбоэмболии при фибрилляции предсердий. CHA 2 DS 2 означает ( C онгестивная сердечная недостаточность, H ypertension, A ge (> 65 = 1 балл,> 75 = 2 балла), D iabetes, предыдущий S трок / транзиторная ишемическая атака (2 балла). VASc обозначает сосудистое заболевание (заболевание периферических артерий, перенесенный инфаркт миокарда, атерома аорты), и половая категория (женский пол) также включена в эту систему оценок.
Как указано выше, каждый фактор риска получает 1 балл, за исключением возраста> 75 и инсульта / ТИА, которые получают 2 балла. Пациенты с 2 и более баллами должны получать полную антикоагулянтную терапию варфарином, дабигатраном, ривароксабаном или апиксабаном. Пациентов с 1 баллом можно лечить либо одним аспирином, либо полным антикоагулянтом в зависимости от конкретного человека.
Годовой риск инсульта у пациента обычно увеличивается вместе с баллами по шкале CHA 2 DS 2 -VASc Score; баллы и эквиваленты риска указаны в калькуляторе ниже.
Годовой риск инсульта в соответствии с CHA
2 DS 2 -VASc Score- 1 балл = 1,3%
- 2 балла = 2,2%
- 3 балла = 3,2%
- 4 балла = 4,0%
- 5 баллов = 6,7%
- 6 баллов = 9,8%
- 7 баллов = 9,6% (в исследовании был небольшой размер выборки с этим баллом, что привело к большей вариабельности)
- 8 баллов = 6,7% (в исследовании была очень маленькая выборка)
- 9 баллов = 15.2%
Это отличная информация, которую врачи могут использовать для информирования пациентов о ежегодном риске инсульта. Многие пациенты не решаются начать антикоагулянтную терапию из-за дороговизны и неудобств. Однако после понимания того, что 4% -ный годовой риск инсульта (если показатель CHA 2 DS 2 -VASc равен 4) равен 40% -ному риску в течение 10 лет, пациенты с большей готовностью подчиняются.
Как правило, независимо от приведенной выше системы оценки, если фибрилляция предсердий у пациента вызвана пороком клапанов сердца, то есть тяжелой митральной регургитацией или митральным стенозом, тогда следует использовать антикоагулянтную терапию.
Ссылки:
1. Болезнь сердца Браунвальда: Учебник сердечно-сосудистой медицины
2. Gage BF, et al. Отбор пациентов с фибрилляцией предсердий для стратификации риска инсульта антикоагулянтами у пациентов, принимающих аспирин. Тираж. 2004; doi: 10.1161 / 01.CIR.0000145172.55640.93
3. Сердце Херста, 13-е издание
Оценка CHA₂DS₂-VASc для риска инсульта с фибрилляцией предсердий
Почему вы разработали шкалу CHA₂DS₂-VASc? Был ли клинический опыт вдохновил вас на создание этого инструмента для врачей?
Доступность пероральных антикоагулянтов, не являющихся антагонистами витамина К (NOAC, ранее называвшихся новыми или новыми пероральными антикоагулянтами, привела к серьезным изменениям в сфере профилактики инсульта при фибрилляции предсердий (AF).Клиницисты также лучше понимают, как управлять варфарином, осознавая важность среднего времени в терапевтическом диапазоне (TTR). Также вновь появляются новые данные о недостаточных доказательствах эффективности и безопасности аспирина для профилактики инсульта при ФП. Старая шкала CHADS 2 была разработана для выявления пациентов с «высоким риском» приема варфарина, но многие общие (и важные) факторы риска инсульта при ФП не включены в шкалу CHADS 2 . CHA₂DS₂-VASc был разработан с учетом общих факторов / модификаторов риска инсульта.Многочисленные валидационные исследования показали, что CHA 2 DS 2 -VASc так же хорош (или, возможно, лучше), чем CHADS 2 в прогнозировании пациентов с высоким риском, но CHA 2 DS 2 -VASc, безусловно, лучший при прогнозировании пациентов «низкого риска».
Какие подводные камни, подводные камни и / или советы вы можете дать пользователям теста CHA 2 DS 2 -VASc? Бывают ли случаи, когда оно применялось, интерпретировалось или использовалось ненадлежащим образом?
В более старых руководствах основное внимание уделялось выявлению пациентов с ФП с «высоким риском» инсульта для лечения варфарином; однако многие исследования показали недостаточное использование варфарина среди пациентов с таким «высоким риском».В 2014 г. рекомендации AHA / ACC / HRS рекомендовали использовать шкалу CHA 2 DS 2 -VASc в качестве предпочтительного инструмента оценки риска инсульта.
Как лучше всего подходить к профилактике инсульта при ФП с помощью шкалы CHA 2 DS 2 -VASc?
В 2012 году руководство Европейского общества кардиологов (ESC) рекомендовало изменение клинической практики, чтобы первоначально сосредоточить внимание на выявлении пациентов «действительно низкого риска», которым не нужна антитромботическая терапия.Эти пациенты с низким риском — это пациенты с оценкой CHA 2 DS 2 -VASc, равной 0 (мужчины) или 1 (женщины). Впоследствии следующий шаг — предложить эффективную профилактику инсульта (т. Е. Пероральную антикоагуляцию) тем, у кого ≥1 дополнительный фактор риска инсульта.
Какие рекомендации вы дадите поставщикам медицинских услуг, когда они получат результат оценки CHA 2 DS 2 -VASc? Будете ли вы вносить какие-либо корректировки или обновления в оценку с учетом последних изменений в медицине?
Используйте подход, рекомендованный в рекомендациях ESC или NICE 2012 г. — первый шаг, выявление пациентов с НИЗКИМ РИСКОМ, i.е., оценка CHA₂DS₂-VASc 0 (мужчины) или 1 (женщины), которые не нуждаются в какой-либо антитромботической терапии. Следующим или последующим шагом является предложение эффективной профилактики инсульта всем остальным с 1 или более дополнительными факторами риска инсульта. Согласно рекомендациям NICE, аспирин не следует использовать для профилактики инсульта при ФП — он минимально эффективен, небезопасен и не рентабелен.
Вы нашли коллег, определяющих, кто какой тип антикоагулянта получает, на основе оценки CHA 2 DS 2 -VASc, а не только CHADS 2 ?
Определенно.Показатель CHADS 2 из 0 НЕ является низким риском, и частота инсульта может достигать 3,2% в год при отсутствии лечения (Olesen et al, Thromb Haemostat 2012). Использование CHA₂DS₂-VASc может дополнительно уточнить стратификацию риска инсульта среди пациентов с нулевым баллом по шкале CHADS 2 для выявления тех, кому пероральные антикоагулянты по-прежнему приносят существенную пользу.
Оценка HAS-BLED для серьезного риска кровотечения
Доктор Рон Пистерс
От Создателя
- Почему вы разработали оценку HAS-BLED? Был ли клинический опыт вдохновил вас на создание этого инструмента для врачей?
- Повышение осведомленности о доказательствах того, что пероральные антикоагулянты необходимы подавляющему большинству пациентов с фибрилляцией предсердий (ФП), устаревшие парадигмы отказа от антикоагуляции (например,грамм. риск падения) и отсутствие удобного для пользователя аналога оценки риска инсульта (например, CHA 2 DS 2 -VASc), несмотря на присущий (связанный с антитромботическими препаратами) риск кровотечения, привели нас к разработке шкалы HAS-BLED.
- Какие жемчужины, подводные камни и / или советы вы можете дать пользователям рейтинга HAS-BLED? Бывают ли случаи, когда оно применялось, интерпретировалось или использовалось ненадлежащим образом?
- Самая важная ошибка — это использование HAS-BLED в качестве абсолютного порога для прекращения или отмены антикоагуляции.Имейте в виду, что у подавляющего большинства пациентов с ФП риск инсульта (и связанного с ним исхода) превышает риск кровотечения. Вместо этого HAS-BLED следует использовать в качестве сигнального устройства, которое помогает минимизировать потенциальный риск кровотечения, сигнализируя о факторах риска, которых можно избежать или обратить вспять. Важно отметить, что в качестве хорошего примера функции alarmbell является то, что буква «H» в HAS-BLED (в отличие от эквивалента риска инсульта) не означает наличие гипертонии в анамнезе, а относится к фактическому систолическому артериальному давлению (≥160 мм рт. набирает 1 балл).Таким образом, объясните важность контроля артериального давления и соответственно активно снижайте его, чтобы обратить его вспять как фактор риска большого кровотечения, то есть потерять 1 балл HAS-BLED и снизить риск кровотечения (тогда как риск инсульта остается прежним!).
- Какие рекомендации вы дадите поставщикам медицинских услуг, когда они получат результат оценки HAS-BLED? Будете ли вы вносить какие-либо корректировки или обновления в оценку с учетом последних изменений в медицине?
- Антитромботическое лечение — это не принятие единственного простого решения о применении антитромботических препаратов.Антитромботическое лечение — это постоянный баланс риска (оценка) и коммуникация. HAS-BLED — это простой в использовании инструмент, способный обеспечить и то, и другое, когда речь идет о риске серьезного кровотечения у пациентов с ФП.
О создателе
Рон Пистерс, доктор медицинских наук, врач-кардиолог в Rijnstate Ziekenhuis Arnhem в Нидерландах. Ранее он работал научным сотрудником по клиническим исследованиям, специализируясь на фибрилляции предсердий, под руководством Гарри Дж. Г. М. Крайнса на кафедре кардиологии Маастрихтского университета.Научные интересы доктора Пистерса включают антитромботическое лечение пациентов с фибрилляцией предсердий и оценку индивидуального риска эмболии и кровотечений.
Чтобы просмотреть публикации доктора Рона Пистерса, посетите PubMed
Что такое оценка CHADSVASC? | Консультанты по сердечному ритму
Если вы страдаете фибрилляцией предсердий (AFib), ваш риск инсульта, к сожалению, увеличивается. Кроме того, осложнения от инсульта могут быть особенно проблематичными для пациентов с ФП, поэтому ваш кардиолог захочет принять меры для оценки вашего конкретного риска инсульта.Этот показатель известен как ваш результат по шкале CHADSVASC.
Общие сведения о системе оценки CHADSVASCCHADSVASC — длинная аббревиатура, обозначающая различные факторы, влияющие на риск инсульта как пациента с AFib. В частности, ваша оценка CHADSVASC работает по скользящей шкале от 0 до 10 и состоит из следующих факторов:
- Застойная сердечная недостаточность (один балл)
- Высокое артериальное давление (одна точка)
- Возраст (два балла, если старше 75)
- Диабет (один балл)
- Предыдущий инсульт или сгусток (две точки)
- Заболевание сосудов (один балл)
- Возраст (один балл, если от 65 до 74)
- Пол (одно очко, если женский)
Чем выше ваш балл по шкале CHADSVASC, тем выше статистическая вероятность инсульта.Цель этой оценки — чтобы ваш кардиолог мог определить ваши конкретные факторы риска и дать рекомендации по снижению вашего риска.
Советы, как снизить ваш результатХорошая новость в том, что есть шаги, которые вы можете предпринять, чтобы потенциально снизить свой балл CHADSVASC. Например, если диабет присутствует в вашей семье, но у вас нет этого заболевания, принятие мер по снижению риска диабета может помочь удержать ваш результат от роста, например диета и упражнения. Конечно, есть некоторые аспекты вашего CHADSVASC, которые вы не можете контролировать, например, ваш возраст или пол (женщины с AFib подвержены более высокому риску инсульта).
Или, если вы страдаете от высокого кровяного давления, его контроль — один из лучших шагов, которые вы можете предпринять, чтобы снизить показатель CHADSVASC и риск инсульта. В частности, артериальное давление можно снизить за счет похудания, более частых тренировок, более здорового питания и, возможно, приема лекарств от артериального давления (если это рекомендовано и предписано вашим врачом).
Назначить встречу с намиЕсли у вас есть AFib, но вы еще не получили оценку CHADSVASC от кардиолога, запишитесь на прием к нашей команде в Heart Rhythm Consultants P.А. для начала. Сертифицированный кардиолог-электрофизиолог доктор Дилип Мэтью поможет вам улучшить общее состояние здоровья и самочувствие, контролируя риск инсульта и других проблем со здоровьем, связанных с AFib.
О консультантах по сердечному ритму, П.А.
Опытные электрофизиологи компании Heart Rhythm Consultants, П.А. служили Западной Флориде, включая Сарасоту, Венецию, Тампу, Порт-Шарлотт и Центр Сан-Сити более 15 лет. Наши специализированные кардиологи или врачи EP помогают пациентам управлять нарушениями сердечного ритма, независимо от того, страдают ли они от аритмий, таких как фибрилляция предсердий (AFib), или других нерегулярных сердечных сокращений.Доктор Дилип Дж. Мэтью, доктор Антонио Моретта и доктор Раджеш Малик проводят лечение аритмии, такое как абляция сердца, криоабляция и имплантация кардиостимуляторов или дефибрилляторов. Доктор Мэтью провел около 5000 сложных операций по удалению сердечной недостаточности. Посмотрите наши офисы в Сарасоте и Венеции, Флорида.
Что такое оценка риска инсульта CHADS2 и CHA2DS2-VASc?
5 февраля 2019 г.
Одно из наиболее серьезных последствий фибрилляции предсердий — это в пять раз больший риск развития инсульта по сравнению с пациентами без ФП.Это связано с тем, что AFib может способствовать накоплению и последующему свертыванию крови в сердце. Когда этот сгусток (тромб) выходит за пределы сердца, это называется тромбоэмболией. Если он попадает в мозг, он вызывает инсульт. Одно из первых направлений лечения фибрилляции предсердий включает антикоагулянты или антикоагулянты.
Чтобы лучше понять риск инсульта у пациента, исследователи разработали систему баллов CHADS2, которая оценивает пациентов по шкале от 1 до 6 баллов. Ноль означает самый низкий риск, а 6 — самый высокий.Критерии включают:
- • Застойная сердечная недостаточность (1 балл)
- Высокое артериальное давление (1 балл)
- Возраст> 75 (1 балл)
- Диабет (1 балл)
- Инсульт (2 балла)
Система подсчета баллов CHADS2 прояснила, что даже нулевой балл представляет некоторый риск тромбоэмболического события, если не применялся антикоагулянт. Поэтому была добавлена дополнительная стратификация риска с помощью CHA2DS2-VASc
.- Застойная сердечная недостаточность (1 балл)
- Высокое артериальное давление (1 балл)
- Возраст 65-74 (1 балл) или Возраст 75+ (2 балла)
- Диабет (1 балл)
- Инсульт (2 балла)
- Заболевания сосудов (1 балл)
- Женщины (1 балл)
Эта система оценки представляет собой полезный инструмент для прогнозирования риска инсульта у среднего пациента.Конечно, как и в любой системе, использующей большие данные выборки, будут исключительные обстоятельства, и поэтому результаты должны интерпретироваться индивидуально. Однако ежегодный риск инсульта увеличивается, как и показатель CHA2DS2-VASc. У пациентов с 1 баллом риск инсульта составляет примерно 1,3% ежегодно, в то время как показатель CHA2DS2-VASc, равный 9, предполагает риск инсульта более 15% в год.
Как правило, нулевой балл у мужчин и один балл у женщин представляет низкий риск, что позволяет предположить, что антикоагулянтная терапия может не понадобиться, но ее все же следует рассмотреть.Один балл у мужчин и два у женщин считается низким или умеренным риском, и использование антикоагулянтов остается на усмотрение. Оценка два или выше считается средним или высоким риском, и эти пациенты, если не указано иное, должны получать антикоагулянтный режим.
Одним из важнейших нововведений этой эпохи является механическое устройство защиты от инсульта под названием Watchman. С помощью этой в среднем 30-минутной процедуры пациенты, которые не являются хорошими кандидатами на препараты для разжижения крови, наконец, могут быть защищены от инсульта без необходимости подвергаться риску кровотечения, связанному с этими препаратами.
Понять риск инсульта | Американская кардиологическая ассоциация
Факторы CHA2DS2-VASc, увеличивающие риск инсульта
Изучите историю своего здоровья и ответьте на следующие вопросы.
ВАЖНО: Следите за своей оценкой, записывая числа после каждого вопроса, а затем сравните свой результат с таблицей в конце.
Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}}Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}}Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}}Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}}Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}}Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}}Следующий
{{formCtrl.response.ResponseTitle}}
{{formCtrl.response.NextButtonText}} Пройти тест еще разРезультаты по электронной почте
× самолетик из бумагиСоздано в Sketch.Найдите число, которое соответствует общему количеству очков риска в вашей оценочной карточке.
* Всегда уточняйте у врача оценку риска. Некоторым в руководстве рекомендуются препараты, разжижающие кровь.
0 = Людям с нулевым баллом обычно не нужны «антикоагулянты. » Всегда важно принять это решение вместе со своим врачом.
1 = Людям, набравшим 1 балл, могут потребоваться или не потребоваться «разжижители крови». Ваш врач поможет вам решить, что вам подходит.
2 или более = Руководства рекомендуют «антикоагулянты» людям, набравшим 2 или более баллов. Ваш врач поможет вам решить, что вам подходит.
ПРИМЕЧАНИЕ. Этот инструмент самопроверки не заменяет оценку рисков, которую вам необходимо выполнить вместе с вашим лечащим врачом. Этот инструмент поможет вам увидеть, какие факторы здоровья могут увеличить ваши риски. Чем выше ваш уровень, тем выше риск инсульта.
«Разжижитель крови» — это обычная крачка, используемая для приема антикоагулянтов, снижающих способность крови образовывать сгусток, который может вызвать инсульт.
Вы прошли викторину!
ACCEL: Оценка риска инсульта: CHADS2 по сравнению с CHA2DS2-VASc
22 нояб.2013 г.Новости ACC
|
Согласно экспертному комитету по написанию, человек без факторов риска относится к группе низкого риска, но рекомендуется аспирин 81–325 мг в день. Лицо с одним фактором умеренного риска является кандидатом на терапию варфарином, тогда как пациенту с фактором высокого риска, таким как перенесенный инсульт, следует принимать варфарин.
Около десяти лет назад в поисках удобной схемы стратификации риска Gage et al.интегрированные факторы риска, которые, как было показано, независимо предсказывают риск в двух предыдущих исследованиях: Atrial Fibrillation Investigators (AFI) и Stroke Prevention in Atrial Fibrillation (SPAF). 2 Они создали индекс CHADS 2 , аббревиатура которого основана на факторах и баллах, на которых он основан (Таблица 1), при этом каждый фактор засчитывается как 1 балл, за исключением перенесенного инсульта, который — как самый сильный фактор риска. — получает 2 балла.
После создания системы оценки CHADS 2 они составили Национальный регистр фибрилляции предсердий (NRAF), в который вошли 1733 пациента Medicare в возрасте 65–95 лет, у которых была неревматическая ФП и которые не принимали варфарин при выписке из больницы.Частота инсультов на 100 пациенто-лет увеличивалась в 1,5 раза на каждое увеличение на 1 балл в шкале CHADS 2 . Другими словами, человек без факторов риска и 0 баллов по шкале CHADS 2 все еще имел некоторый риск — ежегодная частота инсультов 1,9 — в то время как человек с каждым фактором риска получил 6 баллов и имел частоту инсультов 18,2.
Что касается уровня риска, оценка 0 по шкале CHADS 2 считается низким риском; 1 или 2, средний риск; а значение выше 2 указывало на высокий риск.0 баллов по шкале CHADS 2 — аналогично пациенту с низким риском по стратификации рекомендаций ACCF / AHA / HRS — не подходит для терапии варфарином из-за риска кровотечения, в то время как оценка 1 может служить основанием для варфарина. В CHADS 2 авторы сказали, что пациенты с высоким риском (2 и более баллов) всегда должны рассматриваться для лечения антикоагулянтами, если нет противопоказаний.
CHA
2 DS 2 -VAScНесмотря на аплодисменты и широкое распространение за его простоту и широкую применимость, некоторые исследователи были обеспокоены тем, что CHADS 2 не учитывает важные факторы риска.Рабочая группа по инсульту при ФП пришла к выводу, что только четыре клинических фактора — предшествующий инсульт / транзиторная ишемическая атака (ТИА), пожилой возраст, гипертония и диабет — были устойчивыми независимыми факторами. 3 Однако другие данные выявили дополнительные переменные, которые предполагают больший риск инсульта или тромбоэмболических событий (ТЭ) у пациентов с ФП.
| ||||||||||||||||
Они также присвоили числовые значения каждому фактору риска и назвали систему балльной оценки CHA 2 DS 2 -VASc с наивысшим баллом 9 (таблица 2). Возраст может составлять 0 (<65 лет), 1 (65–74 года) или 2 балла (> 75 лет). Лица с оценкой 0 относятся к низкому риску, по 1 баллу — к промежуточному риску, а лица с оценкой 2 или более — к высокому риску. Другими словами, женщины уже находятся в группе среднего риска из-за своего пола, даже если у них нет других факторов риска.
По сравнению с другими схемами стратификации риска, CHA 2 DS 2 -VASc с наибольшей вероятностью классифицировал человека из опроса EuroHeart как человека с высоким риском (75.7%) и наименее вероятно отнесут пациента к группе низкого риска (9,2%). 4 Напротив, Framingham обнаружил, что только 10,2% пациентов относятся к группе высокого риска и 48,3% — к группе низкого риска.
| ||||||||||||||||||||||
Какой подход более точен? Lip et al. обнаружили, что пациенты, отнесенные к группе низкого риска по CHA 2 DS 2 -VASc, действительно относились к группе низкого риска (без зарегистрированных TE), тогда как TE встречались у 1,4% пациентов с CHADS низкого риска 2 и 1.8% пациентов с SPAF низкого риска.
Когда CHA 2 DS 2 -VASc сравнивали с другими схемами стратификации риска в качестве предикторов риска TE, категоризация сильно различалась. CHA 2 DS 2 -VASc классифицировал 94,2% как группу высокого риска; в большинстве других схем примерно две трети отнесены к категории высокого риска. Однако из 184 событий TE, которые произошли в популяции пациентов, 181 (98,4%) произошел у пациентов, которые были определены как пациенты с высоким риском в соответствии с CHA 2 DS 2 -VASc.
Данные NCDR
Недавно на ежегодном собрании Национального реестра сердечно-сосудистых данных® (NCDR) Piyaskulkaew et al. продемонстрировали, что пациенты с ФП неоднородны и состоят из пациентов с широким диапазоном риска инсульта в пределах одного и того же балла CHADS 2 . В одноцентровом пилотном исследовании, проведенном в больнице и медицинском центре Св. Иоанна при Государственном университете Уэйна, Детройт, они обнаружили, что пациенты с оценкой 0 по шкале CHADS 2 имеют годовой риск инсульта 1.9% — столько же, сколько ранее сообщал NRAF. При расчете CHA 2 DS 2 -VASc 52,3% имели 1 балл (риск инсульта 1,75%). Оценка 0 по шкале CHADS 2 завышала риск инсульта у 27,3% и занижала риск у 20,5% пациентов.
Руководства ACCF / AHA рекомендуют антикоагулянтную терапию при CHADS. 2 баллов> 2 (риск инсульта 4,0%) и не является обязательным для пациентов с баллом 1. Варфарин не показан строго ни одному из 161 пациента в этом исследовании с CHADS 2 оценка 0 или 1.Расчет CHA 2 DS 2 -VASc, однако, и 61,5% с оценкой> 2 подходят для варфарина (согласно рекомендациям ESC 2010 г.), что приводит к изменению стратегии антикоагуляции более чем у половины исследуемых пациентов на основании их оценка CHADS 2 . (Целевую группу ESC по AF возглавляет доктор медицинских наук А. Джон Камм, и его комитет недавно обновил руководящие принципы. 5 )
Руководства различаются относительно того, какой уровень риска инсульта требует антикоагуляции. Согласно европейским рекомендациям, показатель CHA 2 DS 2 -VASc равен 2, а годовой риск инсульта равен 2.2% требует терапии варфарином. Напротив, североамериканские руководства рекомендуют варфарин или аспирин для оценки 1 балла по шкале CHADS 2 , что соответствует годовому риску инсульта 2,8%.
Какой бы уровень годового риска инсульта ни был выбран в качестве гарантии антикоагуляции, команда NCDR пришла к выводу, что оценка CHA 2 DS 2 -VASc предоставит более точные данные для принятия решения. Авторы заявили, что в случае подтверждения на более крупной североамериканской популяции, анализ NCDR предполагает, что CHA 2 DS 2 -VASc должен заменить CHADS 2 для оценки стратегии антикоагуляции.
После встречи Европейского общества кардиологов 2012 г., Кристоф Леклерк, доктор медицины, доктор философии, профессор кардиологии в больнице Реннского университета, Ренн, Франция, сказал: «Новые рекомендации [ESC] предполагают, что для оценки риска следует использовать CHA 2 DS 2 -VASC лучше, чем CHADS 2 . 5 Но главное сообщение заключается в том, что для пациента с оценкой CHA 2 DS 2 -VASc, равной 0, нет показаний для какой-либо антикоагуляции или какой-либо антитромботической терапии, поэтому ничто не предотвращает эмболию, даже аспирин, что увеличивает риск кровотечения.

 А.Н. Бакулева
А.Н. Бакулева