Причины ишемический инсульт головного мозга: причины, симптомы и лечение всех видов заболеваний в ФНКЦ ФМБА
Сосудистая патология головного мозга — Болезни
Сосудистые заболевания мозга относятся к наиболее серьезным медико-социальным проблемам современности, что обусловлено их значительной долей в структуре заболеваемости, инвалидности и смертности населения. Распространенность цереброваскулярных заболеваний во всех регионах мира так велика, что они в конце XX века вошли в индустриально развитых странах, включая Россию, в число главных причин смертности населения, а в некоторых странах занимают третье и даже второе место.
Среди сосудистых заболеваний мозга наиболее распространенным и тяжелым по своему исходу является инсульт. Ежегодно в мире регистрируется около 6 млн. случаев инсульта — 0,2 % населения земного шара; за это же время, по данным Всемирной организации здравоохранения, от инсульта умирает 4,6 млн. человек, что составляет 9-12 % всей смертности. При этом в последние годы эти случаи мозговых инсультов неуклонно возрастают. В структуре мозговых инсультов ведущее место занимают ишемические нарушения мозгового кровообращения. В большинстве развитых стран мира удельный вес различных типов инсульта составляет: ишемический инсульт — 80-85 %; внутримозговые геморрагии — 10 %; субарахноидальные геморрагии — 5 %.
В структуре мозговых инсультов ведущее место занимают ишемические нарушения мозгового кровообращения. В большинстве развитых стран мира удельный вес различных типов инсульта составляет: ишемический инсульт — 80-85 %; внутримозговые геморрагии — 10 %; субарахноидальные геморрагии — 5 %.
Следует подчеркнуть, что у значительного числа людей острые нарушения мозгового кровообращения развиваются в период творческой активности и профессионального мастерства, т. е. отмечается значительное их «омоложение». Развитие острых нарушений мозгового кровообращения (инсульт) связано с кровоизлиянием в мозг (геморрагический инсульт) или с ишемическим поражением мозга (ишемический инсульт или инфаркт мозга). Различают также транзиторные расстройства мозгового кровообращения, при которых неврологическая симптоматика удерживается не более суток.
Ишемические поражения головного мозга
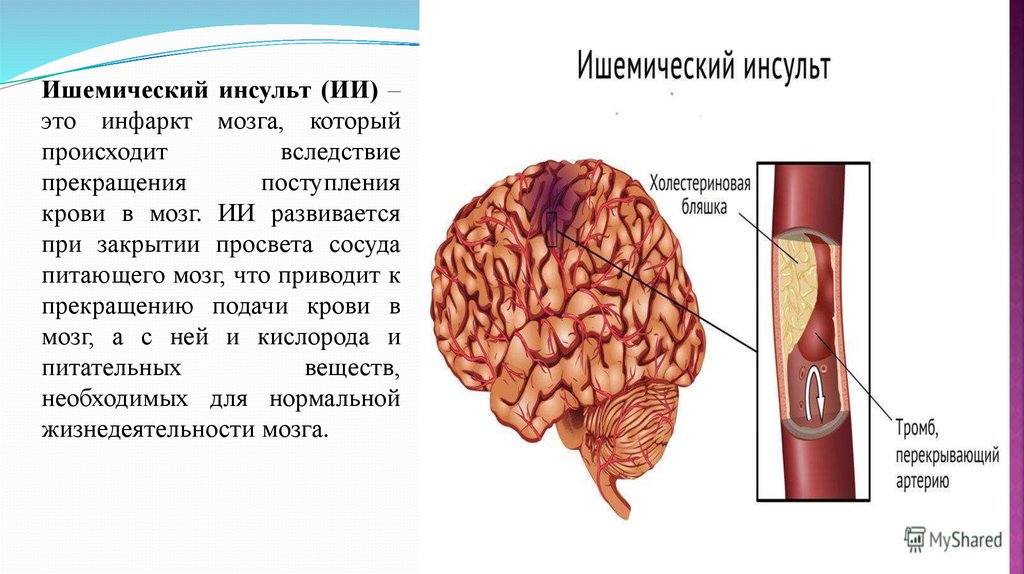
Основной причиной ишемического инсульта является снижение мозгового кровотока вследствие стенозирующих и окклюзивных поражений магистральных сосудов шеи и артерий головного мозга.
В развитии ишемического инсульта (инфаркта мозга) важная роль принадлежит закупорке мозговых сосудов микротромбами, которые образуются вследствие отрыва атеросклеротических бляшек и перемещения их по сосудам.
К основным этиологическим факторам, ведущим к поражению как внечерепных, так и внутричерепных сосудов, относятся атеросклероз, гипертоническая болезнь, ревматизм. Значительно реже причиной нарушения проходимости сонных артерий становятся рубцовые травматические и воспалительные внесосудистые поражения, фиброзно-мышечные дисплазии, возникшие в результате лучевой терапии, а также патологические изгибы сосудов.
 При стенозе артерии эти расстройства могут быть временными,
При стенозе артерии эти расстройства могут быть временными,
Геморрагический инсульт
Чаще всего встречаются внутримозговые кровоизлияния, реже — субарахноидальные, еще реже — субдуральные.
У 60-70 % больных причиной кровоизлияния была артериальная гипертензия, в 20 % случаев — артериальная аневризма и артериовенозная мальформация, в других — разнообразные заболевания на фоне атеросклероза.
Среди причин, которые обусловливают развитие геморрагического инсульта, главное место занимают гипертоническая болезнь и атеросклероз.
Геморрагический инсульт развивается преимущественно остро, часто без предвестников. Он характеризуется внезапной потерей сознания, иногда после одно- или многоразовой рвоты. Лицо больного становится синюшно-красным, пульс напряженным, медленным, дыхание громким, с клокотанием, в скором времени повышается температура тела, голова и глаза часто обращены в сторону. Из очаговых симптомов прежде всего характерны двигательные нарушения в виде парезов и параличей конечностей на стороне, противоположной кровоизлиянию, которые возникают в результате сдавливания гематомой внутренней капсулы или сосудов, питающих ее кровью.
Из очаговых симптомов прежде всего характерны двигательные нарушения в виде парезов и параличей конечностей на стороне, противоположной кровоизлиянию, которые возникают в результате сдавливания гематомой внутренней капсулы или сосудов, питающих ее кровью.
Внутричерепные артериальные аневризмы
Артериальные аневризмы — это ограниченное выпячивание стенки артериального сосуда, имеющее вид тонкостенного мешка, в котором различают дно, среднюю часть и шейку. В стенке аневризмы мышечный слой отсутствует, а в участке дна стенка заметно истончена и может разорваться. Большинство аневризм располагается в артериях основания мозга, преимущественно в сосудах артериального круга большого мозга (Вилизиевого круга). Размеры артериальных аневризм различны — от нескольких миллиметров до гигантских, диаметром свыше 2,5 см.
В течении аневризматической болезни выделяют три периода: догеморрагический, геморрагический и постгеморрагический.
В догеморрагический период, длящийся нередко годами, течение заболевания бывает бессимптомным или проявляются неспецифические транзиторные симптомы (головная боль, иногда мигренеподобного характера, временная диплопия, расстройства функции черепных нервов).
В геморрагический период происходит разрыв аневризмы с внутричерепным кровоизлиянием.
Клиническая картина геморрагического периода в значительной мере определяется размерами и локализацией кровоизлияния, повторными геморрагиями, сопутствующими местными и общими симптомами нарушения мозгового кровообращения.
В постгеморрагический период клинические признаки аневризмы могут исчезать или ослабевает их выраженность, особенно при спонтанном тромбозе аневризмы. Зачастую в постгеморрагический период остаются стойкие общемозговые и очаговые симптомы, а также присоединяются самые разнообразные висцеральные нарушения.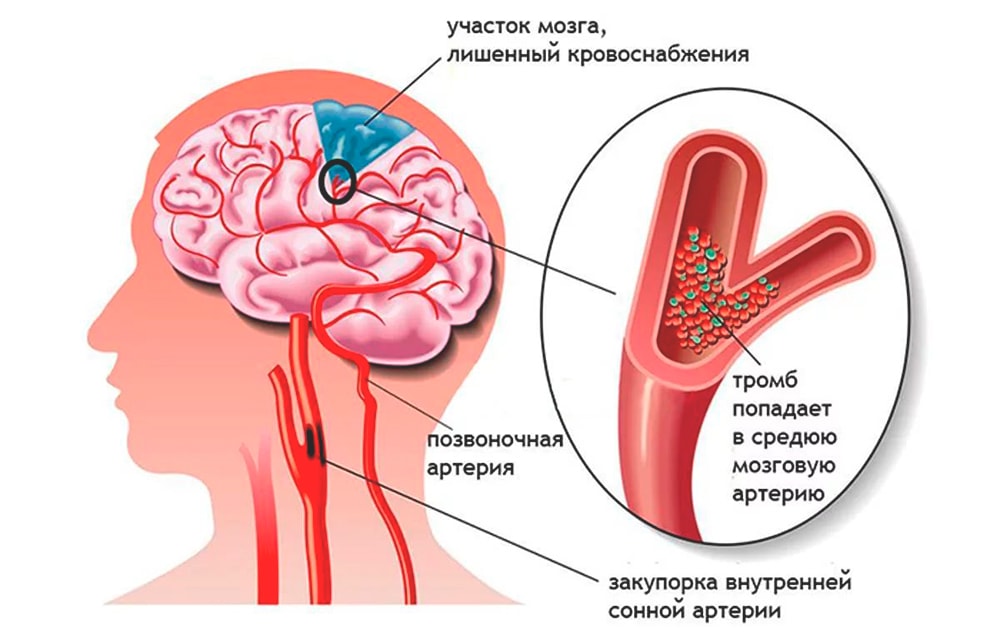
Повторные разрывы артериальных аневризм наблюдаются более чем у половины больных, они могут происходить через несколько месяцев и даже лет.
Артериовенозные мальформации
Артериовенозная аневризма (мальформация) — это врожденный порок мозговых сосудов, при котором происходит непосредственное сбрасывание артериальной крови в венозное русло в обход капиллярной сети. Такие аневризмы состоят из приводящего расширенного артериального сосуда, клубка сосудов, образующих артериовенозный шунт, и одной или нескольких резко расширенных отводящих вен. Стенки клубка сосудов артериовенозной мальформации истончены, и определить их артериальное или венозное происхождение практически невозможно.
Поскольку при артериовенозной мальформации капиллярная сеть отсутствует, часть крови, поступающей в полушария головного мозга, не принимает участия в тканевом обмене, происходит так называемое геморрагическое обкрадывание мозга.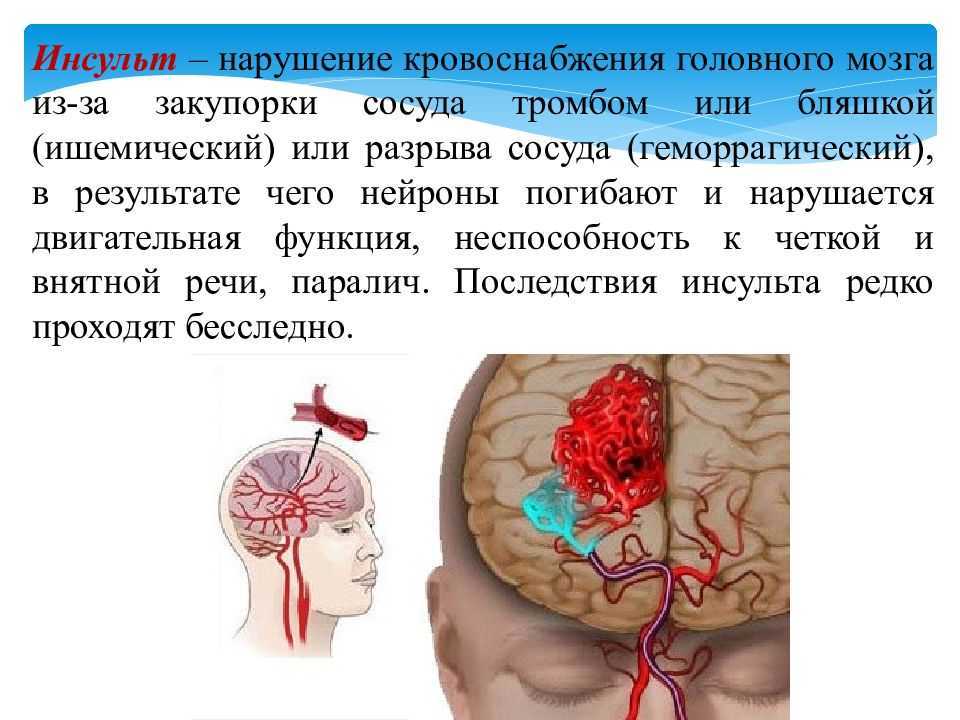
Клиника артериовенозной мальформации разнообразна и зависит от их локализации. Зачастую артериовенозные мальформации клинически проявляются эпилептическими припадками или спонтанными внутричерепными кровоизлияниями.
Догеморрагический период может протекать бессимптомно или обнаруживать себя эпилептическими припадками
Аневризмы сосудов головного мозга различной локализации
Геморрагический период характеризуется разрывом патологически истонченных сосудов и клинически проявляется синдромом субарахноидального, внутримозгового или смешанного кровоизлияния. Необходимо отметить, что при артериовенозной мальформации кровоизлияния происходят раньше (в возрасте 20-30 лет), чем при мешотчатых аневризмах (в 35-50 лет), и значительно реже отмечаются повторные кровотечения в ранние сроки после первого разрыва аневризмы.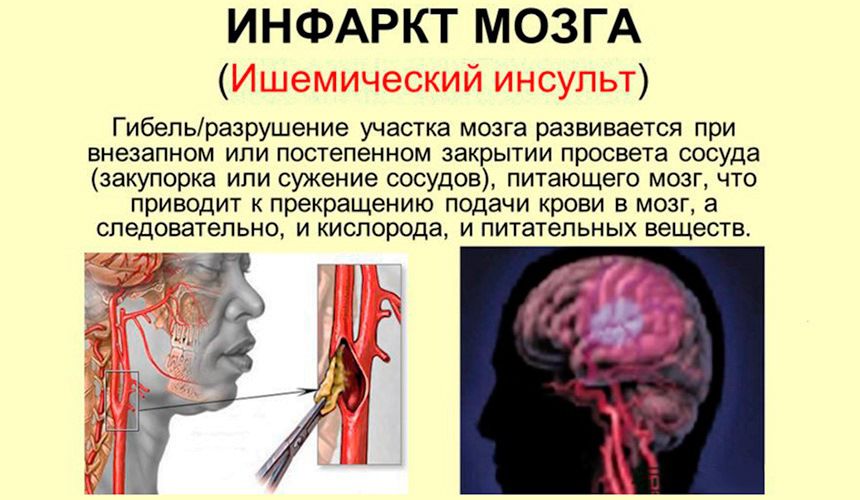
Постгеморрагический период протекает относительно благоприятно. Довольно часто после первого кровоизлияния наступает клиническое выздоровление, рецидивы кровоизлияния наблюдаются через продолжительное время и имеют более доброкачественное течение; случаи смерти вследствие рецидивов наблюдаются относительно редко. Иногда больные жалуются на пульсирующий шум в голове, возможны экзофтальм, пульсация яремных вен, расширение подкожных вен головы, нередко снижается уровень интеллекта.
Каротидно-кавернозное соустье
Среди разнообразных видов патологии сосудов головного мозга часто встречаются каротидно-кавернозные (сонно-пещеристые) соединения (соустья), которые образуются вследствие повреждений внутренней сонной артерии в месте, где она проходит через пещеристый синус.
Причиной повреждения артерии может быть черепно-мозговая травма. Значительно реже такие соединения возникают спонтанно, в результате инфекционного процесса, атеросклероза, аномалии сосудов. Нарушение целостности артерии возникает в местах ее разветвлений или в местах прикрепления к ней соединительнотканных тяжей. Кровь под большим давлением поступает в пещеристый синус и дальше по венам, впадающим в синус, — против тока венозной крови. С течением времени кровообращение все больше смещается в сторону патологического соединения. Через вены, впадающие в синус, происходит ретроградный ток артериальной крови в соответствующие вены глаза. Нарушается венозный отток, в орбите образуется застой. Сам синус заметно растягивается и увеличивается в размерах, черепные нервы (III, IV, VI и первая ветвь V (тройничного нерва) пар, проходящих через него) сдавливаются.
Нарушение целостности артерии возникает в местах ее разветвлений или в местах прикрепления к ней соединительнотканных тяжей. Кровь под большим давлением поступает в пещеристый синус и дальше по венам, впадающим в синус, — против тока венозной крови. С течением времени кровообращение все больше смещается в сторону патологического соединения. Через вены, впадающие в синус, происходит ретроградный ток артериальной крови в соответствующие вены глаза. Нарушается венозный отток, в орбите образуется застой. Сам синус заметно растягивается и увеличивается в размерах, черепные нервы (III, IV, VI и первая ветвь V (тройничного нерва) пар, проходящих через него) сдавливаются.
Для каротидно-кавернозного соединения характерны головная боль, головокружение, синхронный шум пульса в голове, зачастую напоминающий шум поезда, что тяжело переносится больными. Шум выслушивается над орбитой, височным участком и сосцевидным отростком. Он исчезает при пережимании сонной артерии в области шеи на стороне поражения.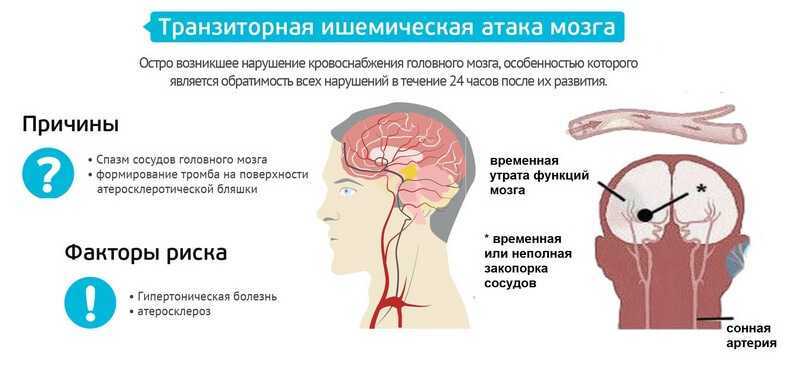 Отмечаются пульсирующий экзофтальм, который достаточно хорошо определяется при пальпации глазного яблока, выраженное расширение вен в области лба и век. Повышается внутриглазное давление, иногда развивается острая глаукома, что может повлечь за собой снижение остроты зрения и слепоту. Из-за поражения глазодвигательных нервов уменьшается объем движений глазного яблока. Нарушения мозгового кровообращения нередко приводят к снижению памяти, трудоспособности и даже к психическим расстройствам.
Отмечаются пульсирующий экзофтальм, который достаточно хорошо определяется при пальпации глазного яблока, выраженное расширение вен в области лба и век. Повышается внутриглазное давление, иногда развивается острая глаукома, что может повлечь за собой снижение остроты зрения и слепоту. Из-за поражения глазодвигательных нервов уменьшается объем движений глазного яблока. Нарушения мозгового кровообращения нередко приводят к снижению памяти, трудоспособности и даже к психическим расстройствам.
Из-за повышения давления в венах, впадающих в пещеристый синус, могут возникать кровотечения из сосудов глазного яблока и носа. При офтальмоскопическом обследовании выявляют расширение вен сетчатки, часто — выраженную их пульсацию, а в некоторых случаях — отек дисков зрительных нервов и даже кровоизлияния на глазном дне.
Диагностика
Для выбора метода лечения, особенно хирургического, места и времени его проведения важную роль играет точная и объективная диагностическая информация.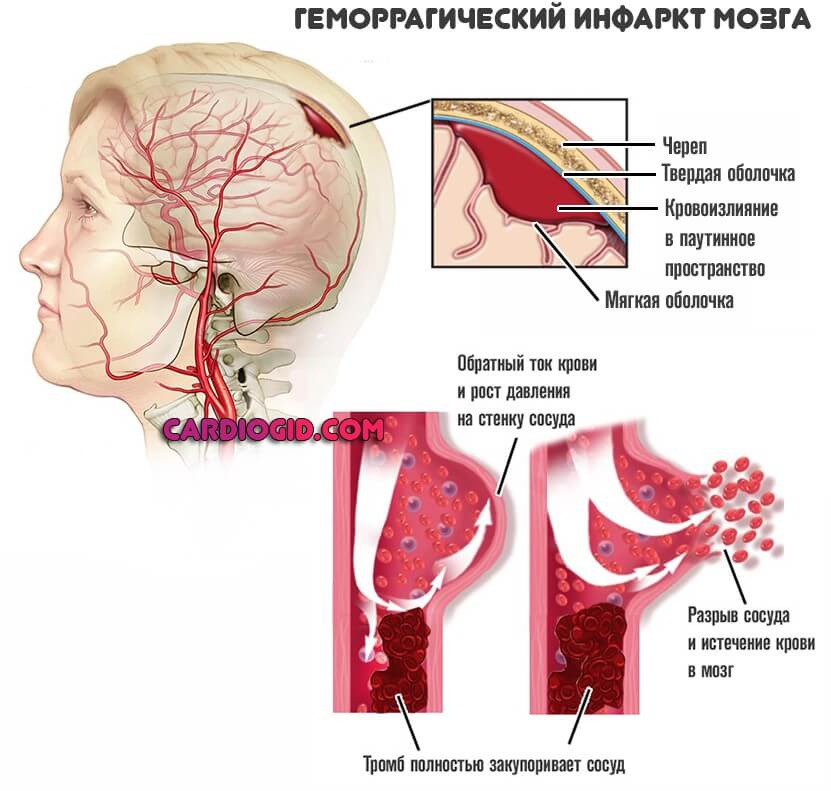 Лечебно-диагностические возможности современной нейрохирургии возрастают быстрыми темпами благодаря новой диагностической аппаратуре. Вместе с тем сохраняют свою актуальность и традиционные диагностические методы.
Лечебно-диагностические возможности современной нейрохирургии возрастают быстрыми темпами благодаря новой диагностической аппаратуре. Вместе с тем сохраняют свою актуальность и традиционные диагностические методы.
Диагностическая люмбальная пункция — информативный метод для определения субарахноидального кровоизлияния, которое нередко имеет место при разрыве внутричерепной аневризмы. С помощью эхоэнцефалографии (ЭхоЭГ) при разрыве аневризмы с образованием гематомы уточняют сторону ее размещения по выраженному (больше 4-6 мм) смещению М-эхо.
Ультразвуковая допплерография позволяет неинвазивно определить линейную скорость и направление тока крови, степень и уровень нарушения кровообращения в магистральных артериях. Дуплексное (двойное) ультразвуковое сканирование дает возможность синхронно определить изменение кровотока и получить изображение самого сосуда, выявить стеноз сонной артерии (меньше 50 %), а также местоположение и структуру атеросклеротической бляшки.
Об изменении мозгового кровотока и тонусе мозговых сосудов можно судить по данным реоэнцефалографии, импедансной реоплетизмографии и телетермографии.
Исследование регионарного мозгового тока крови по клиренсу радиоактивного изотопа (шХе) позволяет определить степень снижения мозгового кровообращения. Компьютерная томография (КТ) позволяет дифференцировать очаговую ишемию мозга от геморрагии. Четко определяются размер и расположение внутричерепной гематомы и очага инфаркта мозга, состояние окружающего мозгового пространства. Магнитно-резонансная томография (МРТ) дает возможность даже без применения контрастного вещества оценить не только анатомические структуры, но и уровень энергетического, ферментативного и метаболического процессов в мозге. Еще большие диагностические возможности имеет неинвазивная ядерно-магнитно-резонансная ангиография, которая позволяет получить ангиограммы в любой проекции и выявить не только аневризмы, но и атеросклеротические бляшки в артериях.
В последнее время применяется ядерно-магнитно-резонансная спектроскопия, которая дает возможность делать заключение о динамике очаговых поражений мозга как в участках необратимых изменений, так и в зоне «ишемической полутени».
Лечение в каждом случае подбирается индивидуально, в зависимости от причины и месторасположения повреждения.
Последствия невмешательства и осложнения
Любые заболевания головного мозга при отсутствии нужного лечения могут привести к серьезным последствиям, вплоть до инвалидности и летального исхода.
Ишемический инсульт | Радиологическая справочная статья
Ишемический инсульт — это эпизод неврологической дисфункции вследствие очагового инфаркта в центральной нервной системе, связанный с артериальным тромбозом, эмболизацией или критической гипоперфузией. В то время как ишемический инсульт формально определяется как включающий инфаркт головного и спинного мозга и сетчатки 1 , в обычном использовании он в основном относится к инфаркту головного мозга, которому посвящена эта статья.
Термин «инсульт» является клиническим определением, тогда как «инфаркт» в основном является патологическим термином 1 . Соединяя эти термины, ишемический инсульт является подтипом инсульта, который требует как клинического неврологического дефицита, так и признаков инфаркта ЦНС (гибель клеток, связанная с ишемией). Доказательства инфаркта могут быть основаны на визуализации, патологии и/или стойких неврологических симптомах, при исключении других причин. Если есть визуальные или патологические признаки инфаркта, но нет характерных клинических симптомов, то это называется «немым инфарктом ЦНС».
Инсульт является второй по частоте причиной заболеваемости во всем мире (после инфаркта миокарда) и ведущей причиной приобретенной инвалидности 2 .
Факторы риска ишемического инсульта в значительной степени отражают факторы риска атеросклероза и включают возраст, пол, семейный анамнез, курение, артериальную гипертензию, гиперхолестеринемию и сахарный диабет.
Ишемический инсульт обычно проявляется быстрым развитием неврологического дефицита, который определяется пораженной областью головного мозга. Симптомы часто развиваются в течение нескольких часов и могут ухудшаться или улучшаться в зависимости от состояния ишемической полутени.
Пораженная сосудистая территория будет определять точные симптомы и клиническое поведение поражения:
- инфаркт передней циркуляторной артерии
- инфаркт передней мозговой артерии
- инфаркт средней мозговой артерии
- лакунарный инфаркт
- полосато-капсулярный инфаркт
- инфаркт задней мозговой артерии
- инфаркт задней мозговой артерии
- инфаркт мозжечка
- инфаркт ствола мозга
Прерывание кровотока по внутричерепной артерии приводит к лишению кислорода и глюкозы в снабжаемой сосудистой территории. Это инициирует каскад событий на клеточном уровне, который, если вовремя не восстановить кровообращение, приведет к гибели клеток, в основном через разжижающий некроз.
Механизм закупорки сосудов важен при проведении терапевтических мероприятий, направленных как на устранение или минимизацию эффектов, так и на предотвращение инфарктов в будущем.
Примеры:
- эмболия
- сердечная эмболия
- мерцательная аритмия
- аневризма желудочка
- эндокардит
- парадоксальная эмболия
- атеросклеротическая эмболия
- жировая эмболия
- воздушная эмболия
- сердечная эмболия
- тромбоз
- перфораторный тромбоз: лакунарный инфаркт
- острый разрыв бляшки с тромбозом над ней
- диссекция артерии
Глобальная церебральная гипоксия (наблюдаемая при утоплении или удушье) обычно рассматривается отдельно.
Во многих учреждениях с активными службами инсульта, которые предоставляют реперфузионную терапию, так называемый код инсульта, направленный на ускорение диагностики и лечения пациентов, будет включать КТ головного мозга без контраста, КТ перфузии и КТ ангиографию.
Старческие ишемические инсульты могут иметь важное значение в ряде клинических и судебно-медицинских учреждений. Как КТ, так и МРТ могут помочь в определении того, когда произошел инсульт, поскольку особенности визуализации развиваются достаточно предсказуемым образом. Существует существенная неоднородность в терминологии, обозначающей время от начала заболевания. Для целей данной статьи используются следующие определения 10 :
- ранний острейший: от 0 до 6 часов
- поздний острейший: от 6 до 24 часов
- острый: от 24 часов до 1 недели
- подострый: от 1 до 3 недель
- хронический: более 3 недель
Приведенное выше определение сверхострого состояния как 0-24 часов и острого состояния как 1-7 дней было подтверждено международным Круглым столом по восстановлению и реабилитации после инсульта 19 . Тем не менее, эта группа определила подострое течение от 1 недели до 6 месяцев (с 3 месяцами, разделяющими раннюю и позднюю подострую фазы), а хроническое течение старше 6 месяцев.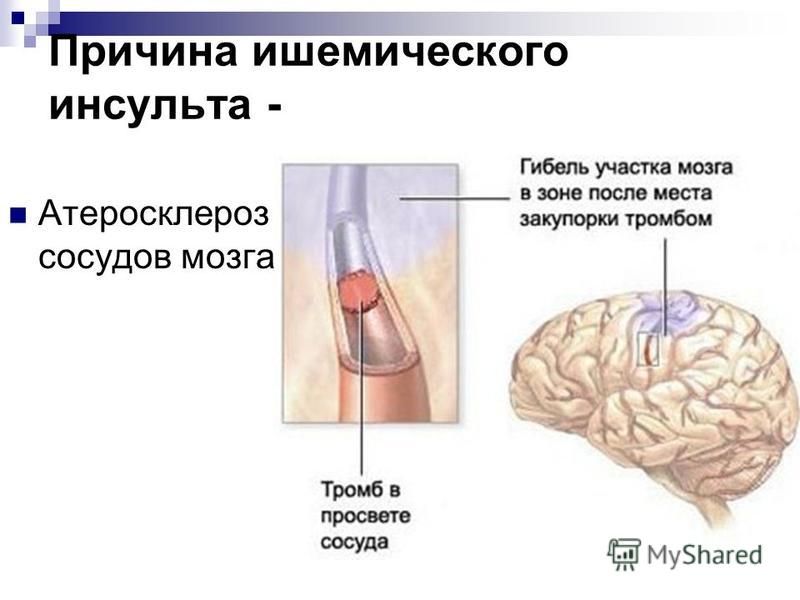
Видео — острый инфаркт
КТ
Бесконтрастная КТ головного мозга остается основным методом визуализации при остром инсульте. Это быстро, недорого и доступно. Однако его основным ограничением является ограниченная чувствительность в острой ситуации. Обнаружение зависит от территории, опыта интерпретирующего рентгенолога и, конечно же, времени сканирования с момента появления симптомов. От того, кровоснабжается ли ткань концевыми артериями (например, лентикулостриарными артериями) или имеет коллатеральное кровоснабжение (большая часть коры головного мозга), будет зависеть скорость развития цитотоксического отека 6 . Например, было показано, что выявляемость инфаркта на территории СМА составляет примерно 60-70% в первые 6 часов 3 , хотя изменения в глубоких ядрах серого вещества (особенно чечевицеобразных ядрах) могут быть видны в течение 1 часа после окклюзии в верхней части тела. до 60% пациентов 6 .
до 60% пациентов 6 .
Цели КТ в острых случаях:
- исключить внутричерепное кровоизлияние, которое предотвратило бы тромболизис
- искать любые «ранние» признаки ишемии
- исключить другие внутричерепные патологии, которые могут имитировать инсульт, такие как опухоль
Бесконтрастная КТ также исторически использовалась для исключения пациентов из тромболизиса на основании степени гипоаттенуации при поступлении. Однако этот критерий был исключен из руководства 18 Американской кардиологической ассоциации 2018 года. Тем не менее, обнаружение больших областей установленного инфаркта на острой неконтрастной КТ продолжает играть важную роль в отборе пациентов и лечении.
Немедленно
Самый ранний видимый КТ-признак — гиперплотный сегмент сосуда, представляющий собой прямую визуализацию внутрисосудистого тромба/эмбола, и поэтому он виден немедленно 7 . Хотя это можно увидеть в любом сосуде, чаще всего это наблюдается в средней мозговой артерии (см.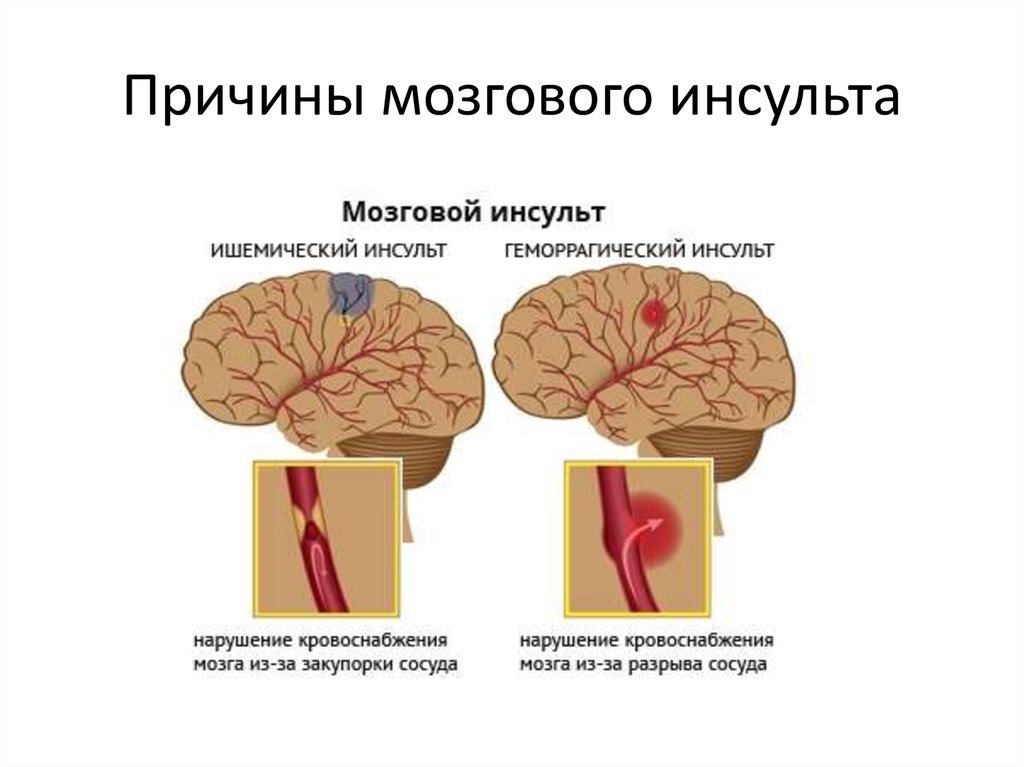 симптом гиперденсивной средней мозговой артерии и точечный признак средней мозговой артерии). Дифференциация этого гиперплотного «обычного» тромбоэмболического очага от кальцифицированного церебрального эмбола может иметь терапевтическое и прогностическое значение.
симптом гиперденсивной средней мозговой артерии и точечный признак средней мозговой артерии). Дифференциация этого гиперплотного «обычного» тромбоэмболического очага от кальцифицированного церебрального эмбола может иметь терапевтическое и прогностическое значение.
Ранний острейший
В течение первых нескольких часов виден ряд признаков в зависимости от места окклюзии и наличия коллатерального кровотока. Ранние признаки включают:
- потерю дифференцировки серо-белого вещества и гипоаттенуацию глубоких ядер:
- чечевицеобразные изменения ядер видны уже через 1 час после окклюзии, видны у 75% пациентов через 3 часа 6
- кортикальная гиподенсивность с ассоциированным паренхиматозным отеком с результирующим сглаживанием извилин
- кора головного мозга с плохим побочным обеспечением (например, островковой лентой) более уязвима 6
Визуализации потери дифференциации серого и белого вещества помогает использование штрихового окна, которое имеет узкую ширину и немного более низкий центр, чем обычное окно мозга (ширина = 8, центр = 32 HU) 18 .
Острый
Гипотонус и отек со временем становятся более заметными, что приводит к значительному масс-эффекту. Это основная причина вторичного повреждения при обширных инфарктах.
Подострый
С течением времени отек начинает спадать, а небольшое количество точечных кровоизлияний в кору (не путать с геморрагической трансформацией) приводит к повышению ослабления коры. Это известно как явление затуманивания КТ 5 . Визуализация инсульта в это время может ввести в заблуждение, поскольку пораженная кора будет выглядеть почти нормально.
Хронический
Еще позже остаточный отек проходит, и начинается глиоз, в конечном итоге проявляющийся в виде области низкой плотности с отрицательным масс-эффектом. Кортикальная минерализация также иногда может выглядеть гиперплотной.
Видео – эволюция инсульта
КТ перфузии
КТ перфузии стала важным инструментом в отборе пациентов для реперфузионной терапии, а также в четырехкратном повышении точности диагностики ишемического инсульта среди неспециалистов по сравнению с обычными неспециалистами.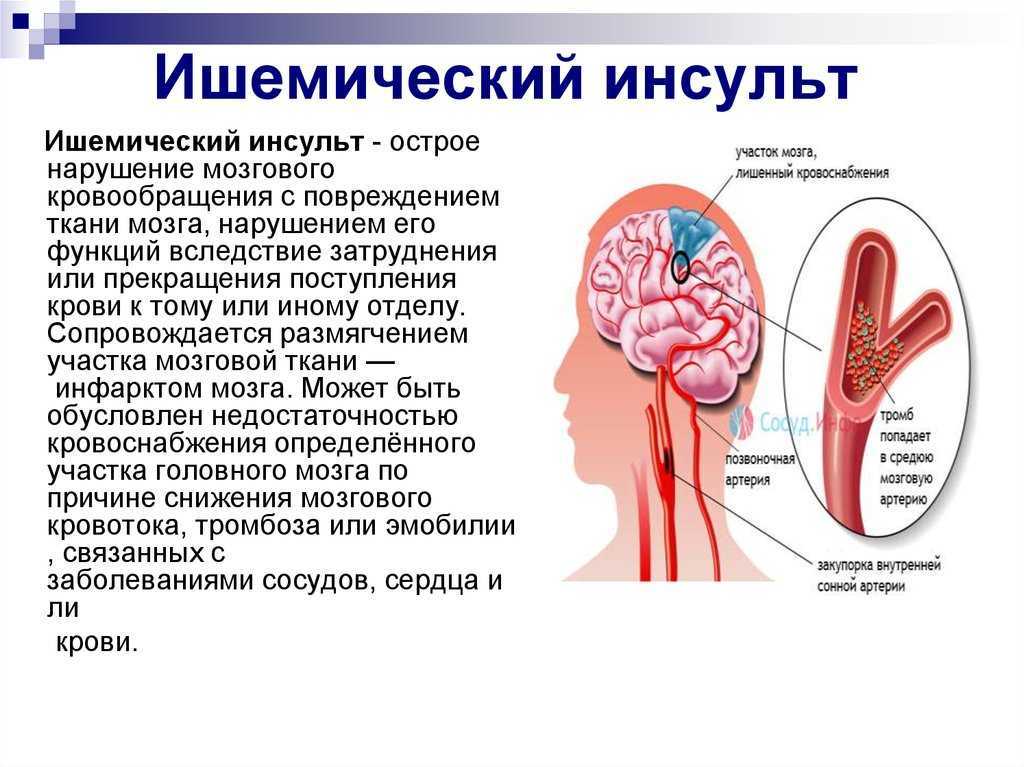 -контрастный КТ 9 .
-контрастный КТ 9 .
Он позволяет идентифицировать как сердцевину инфаркта (та часть, которой суждено никогда не восстановиться независимо от реперфузии), так и окружающую полутень (область, которая, несмотря на ишемию, еще не перешла к инфаркту и потенциально может быть спасена). КТ перфузии также может выявить ранние признаки ассоциированного перекрестного мозжечкового диашиза.
Ключом к интерпретации является понимание ряда параметров перфузии:
- мозговой объем крови (CBV)
- мозговой кровоток (CBF)
- среднее время прохождения (МТТ)
- время до пика (TTP)
Области, которые демонстрируют совпадающие дефекты CBV и MTT, представляют собой неизлечимое ядро инфаркта, тогда как области, которые имеют пролонгированный MTT, но сохраняют CBV, считаются ишемической полутенью 9 .
Эти факторы будут обсуждаться отдельно. См. КТ перфузии.
КТ-ангиография
- может идентифицировать тромб внутри внутричерепного сосуда и может направлять внутриартериальный тромболизис или извлечение сгустка
- оценка состояния сонных и позвоночных артерий шеи
- установление этиологии инсульта (например, атеросклероз, диссекция, перепонка)
- оценить эндоваскулярный доступ и потенциальные ограничения для эндоваскулярного лечения (например, извитость, стеноз)
- может быть необходимо перед тромболизисом в педиатрических случаях инсульта
- в некоторых руководствах только рекомендуется, чтобы детям с артериальным тромбом был полезен тромболизис
- оценка коллатеральных сосудов с помощью однофазной КТА
Многофазная или отсроченная КТ-ангиография
Многофазная или отсроченная КТ-ангиография демонстрирует преимущества либо взамен КТ-перфузии, либо в качестве дополнительного 4-го шага в протоколе КТ при инсульте, поскольку она определяет выбор пациента для эндоваскулярной терапии путем оценки коллатерального кровотока в ишемизированной и пораженной ткани .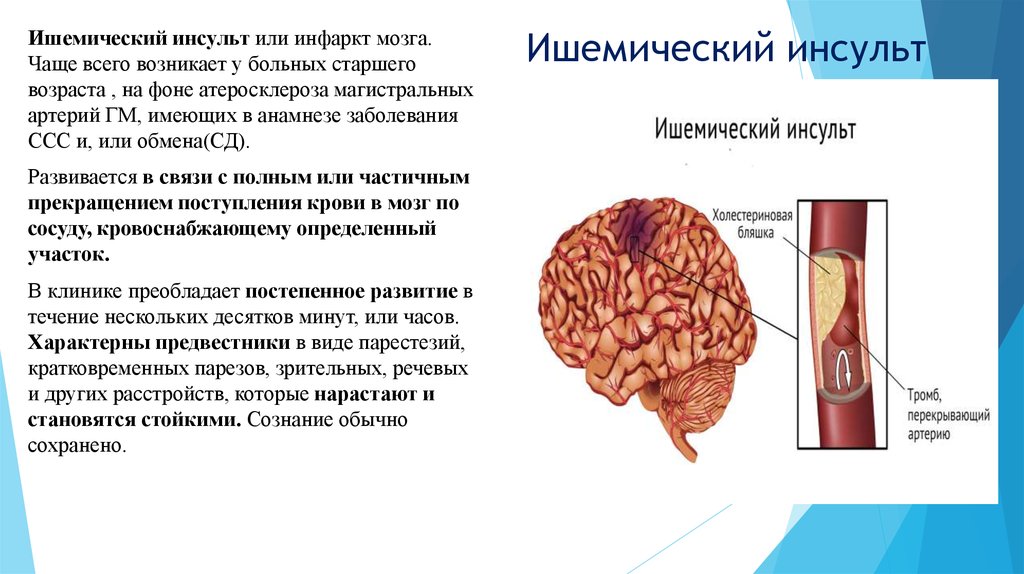
МРТ
МРТ занимает больше времени и менее доступна, чем КТ, но имеет значительно более высокую чувствительность и специфичность в диагностике острого ишемического инфаркта в первые несколько часов после начала.
Ранний острейший
В течение нескольких минут после артериальной окклюзии ДВИ показывает повышенный сигнал и сниженные значения ADC 4,10 . Это хорошо коррелирует с очагом инфаркта (подробное обсуждение DWI и ADC при инсульте см. в диффузионно-взвешенной МРТ при остром инсульте). На этой стадии пораженная паренхима кажется нормальной на других последовательностях, хотя будут обнаружены изменения кровотока (окклюзия на МРА) и может быть обнаружена тромбоэмболия (например, на SWI). Медленный или застойный кровоток в сосудах также может быть обнаружен как потеря нормального кровотока и высокий сигнал на T2/FLAIR и T1 C+ (внутрисосудистое усиление).
Если инфаркт неполный, корковое усиление контраста может наблюдаться уже через 2–4 часа 10 .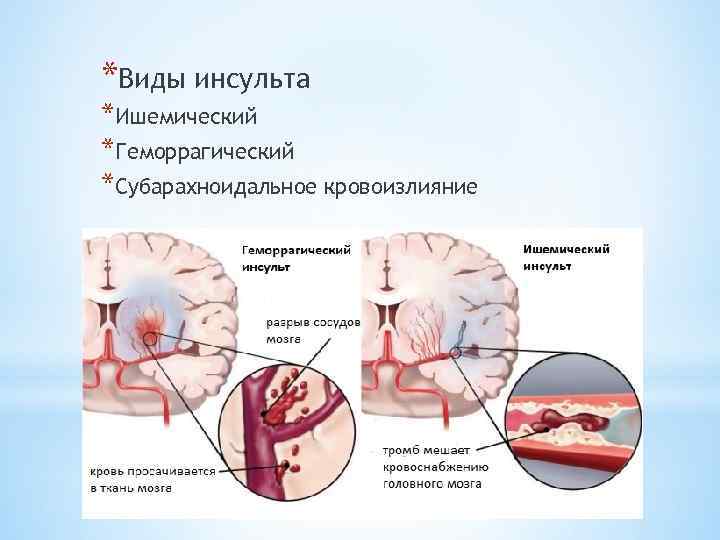
В меньшинстве случаев ДВИ может быть нормальным (для получения более подробной информации см. ДВИ-отрицательный острый ишемический инсульт).
Поздний острейший
Как правило, через 6 часов выявляется высокий сигнал Т2, который вначале легче увидеть на FLAIR, чем на обычном быстром спин-эхо Т2 10 . Это изменение продолжает увеличиваться в течение следующего дня или двух.
Гипоинтенсивность T1 наблюдается только через 16 часов 10 и сохраняется.
Острый
В течение первой недели инфарктная паренхима продолжает демонстрировать высокий сигнал DWI и низкий сигнал ADC, хотя к концу первой недели значения ADC начали увеличиваться. Инфаркт остается гиперинтенсивным на Т2 и FLAIR, при этом сигнал Т2 прогрессивно увеличивается в течение первых 4 дней. T1-сигнал остается низким, хотя некоторый кортикальный собственный высокий T1-сигнал можно увидеть уже через 3 дня после инфаркта 10 . После 5-го дня кора обычно демонстрирует контрастное усиление на T1 C+ 10 .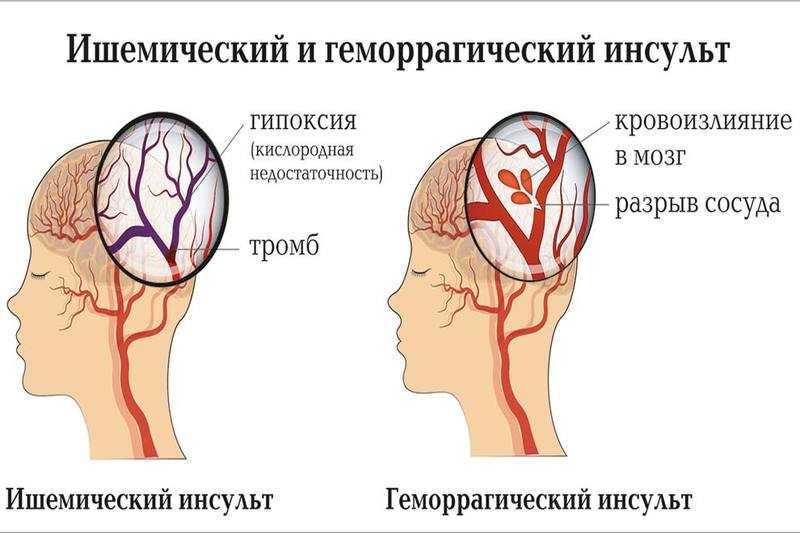 Менее распространенные паттерны усиления включают артериальное усиление, встречающееся примерно в половине случаев инсульта и проявляющееся через 3 дня, и менингеальное усиление, которое встречается нечасто и обычно наблюдается между 2 и 6 днями 10 .
Менее распространенные паттерны усиления включают артериальное усиление, встречающееся примерно в половине случаев инсульта и проявляющееся через 3 дня, и менингеальное усиление, которое встречается нечасто и обычно наблюдается между 2 и 6 днями 10 .
Кровоизлияние, которое лучше всего видно на изображениях, взвешенных по восприимчивости (SWI), не является хорошим индикатором возраста. Хотя чаще всего наблюдается через 12 часов и в течение первых нескольких дней, это может произойти раньше или даже через 5 дней 10 .
Подострый
ADC демонстрирует псевдонормализацию, обычно возникающую между 10-15 днями 10 . Поскольку значения ADC продолжают расти, ткань инфаркта постепенно становится ярче, чем нормальная паренхима. Напротив, ДВИ остается повышенным из-за стойкого высокого сигнала T2/FLAIR (T2 просвечивается), за исключением случаев кровоизлияния (затемнение T2) или кистозной энцефаломаляции 10 . Затуманивание T2 также встречается обычно между 1 и 5 неделями, чаще всего на 2 неделе 10,11 .
Взвешенные последовательности T1 по-прежнему демонстрируют гипоинтенсивность с присущим коре высоким уровнем сигнала T1 из-за ламинарного некроза коры или псевдоламинарного некроза 10 . Корковое усиление обычно присутствует на протяжении всего подострого периода.
Хронический
Сигнал Т1 остается низким при характерном высоком Т1 в коре, если присутствует некроз коры 10 . Сигнал T2 высокий. Корковое контрастное усиление обычно сохраняется в течение 2–4 мес.0005 10 . Важно отметить, что если паренхиматозное усиление сохраняется более 12 недель, следует учитывать наличие основного поражения 10 .
Высокие значения АЦП. Сигнал DWI является переменным, но с течением времени сигнал постепенно уменьшается.
Ультразвуковая транскраниальная допплерография
Транскраниальная допплерография (ТКД) часто описывается как развивающееся приложение ультразвуковой диагностики для диагностики окклюзии внутричерепных сосудов, а также для дифференциации ишемического и геморрагического инсульта. 14 .
14 .
При отрицательном результате КТ на внутримозговое кровоизлияние и клиническом подозрении на окклюзию изолированного сосуда диагностические критерии окклюзии изолированного сосуда следующие: 12 ;
- полное отсутствие доплеровских сигналов цветного потока
- отсутствие импульсно-волновых доплеровских сигналов
- одновременная адекватная визуализация окружающей паренхимы и сосудов
- цветной кровоток и импульсно-волновые допплеровские сигналы должны быть адекватно продемонстрированы в оставшейся части круга Уиллиса 16
Возможен также сонографический мониторинг осложнений ишемического инсульта, в том числе выявление;
- геморрагическая трансформация 16
- среднее смещение 15
- повышенное внутричерепное давление (ВЧД)
- измерение диаметра оболочки зрительного нерва (ДОЗН), обычно используемое в качестве заменителя внутричерепного давления
Неотложная терапия направлена на быстрое применение реперфузионной терапии:
- внутривенный или внутриартериальный тромболизис (например, альтеплаза, тенектеплаза)
- механическая тромбэктомия — ответ оценивается по шкале TICI
Нейрохирургическое вмешательство также может быть проведено в некоторых случаях, чтобы позволить пациентам пережить период максимального отека, путем выполнения декомпрессивной краниэктомии (с дуропластикой или без нее), особенно у молодых пациентов с большими инфарктами СМА или инфарктами задней черепной ямки.