Причина отрыва тромба: Названы основные причины отрыва тромба
Диагностика и лечение заболеваний вен. Все о тромбофлебите
Любая хроническая болезнь, лечение которой не было проведено своевременно влечет за собой осложнения и неприятным последствия. Тромбофлебит – это типичное последствие варикозного расширения вен, которое сопровождается образованием тромбов и напрямую связано с процессом воспаления сосудистой стенки. Появление тромбофлебита сопровождается появлением болевых ощущений.
Варикозное поражение сосудов становится причиной образования тромбов, а в результате их появления происходит нарушение питания окружающих тканей, вследствие развивается воспаление, участок вены краснеет и ощущается боль.
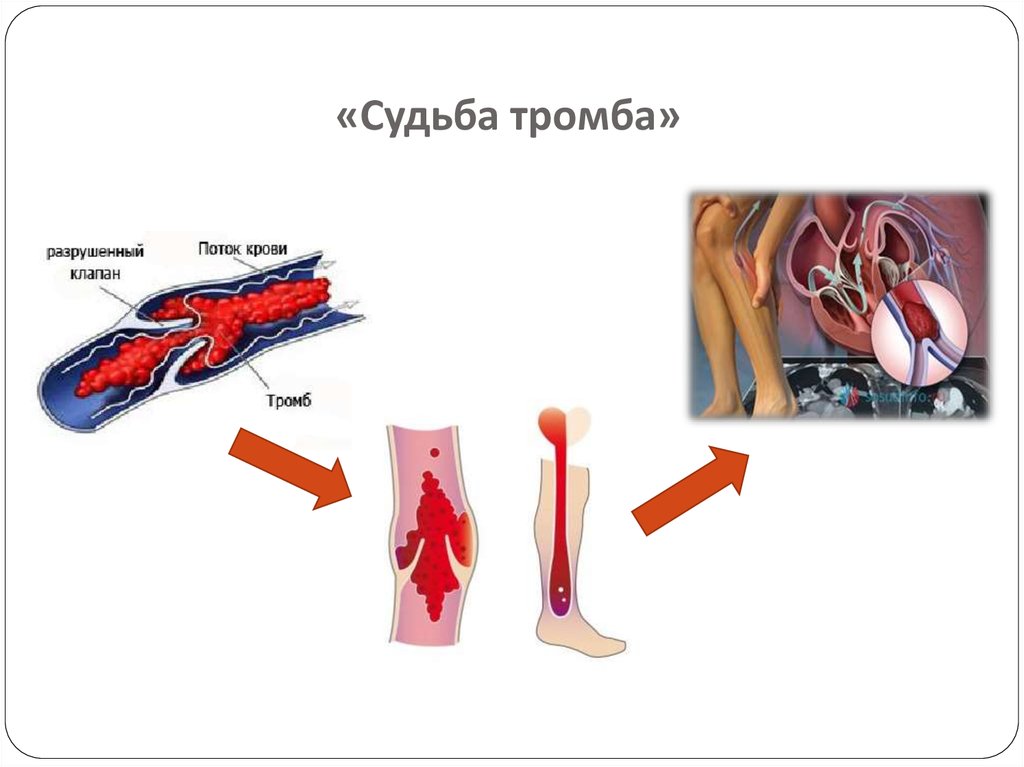
Помимо этого, процесс образования тромбов может распространиться и на другие участки венозной системы, включая глубокие вены. Также возникает поясность отрыва тромба, который по кровеносной системе может попасть в легочную артерию, закупорив ее и привести к летальному исходу.
Как определить тромбофлебит?
Типичными симптомами данного заболевания являются:
- болезненность по ходу вены
- локальные покраснения кожи
- небольшое повышение температуры
- образование уплотнения на участке образования тромбов в венах
Причины тромбофлебита
Поскольку тромбофлебит является осложнение в результате появления варикозного расширения, то чаще всего локализуется в области нижних конечностей, однако при его распространении могут быть поражены и другие участки тела. Причинами его появления могут быть:
Причинами его появления могут быть:
- инфекции, воспаление вен может быть вызвано осложнение таких болезней как грипп, скарлатина, пневмония и даже тонзиллит
- онкологические заболевания
- повреждение сосудов после травм или операций
- гормональный дисбаланс, который может стать причиной изменения состава крови
- недостаток физической активности
Лечение тромбофлебита
На этапе диагностика данного заболевания сначала необходимо обратиться на прием к врачу-флебологу или сосудистому хирургу, который может назначить ультразвуковое дуплексное сканирование вен для получения развернутой клинической картины о состоянии кровеносных сосудов и вен. Далее флеболог установит степень поражения и локализацию заболевания.
На начальной стадии болезни обычно назначается консервативная медикаментозная терапия – противовоспалительные средства, флеботоники (для ускорения кровотока) или физиотерапия.
Также может быть назначено использование компрессионного трикотажа, который помогает улучшить ток крови и не позволяет тромбу перемещаться.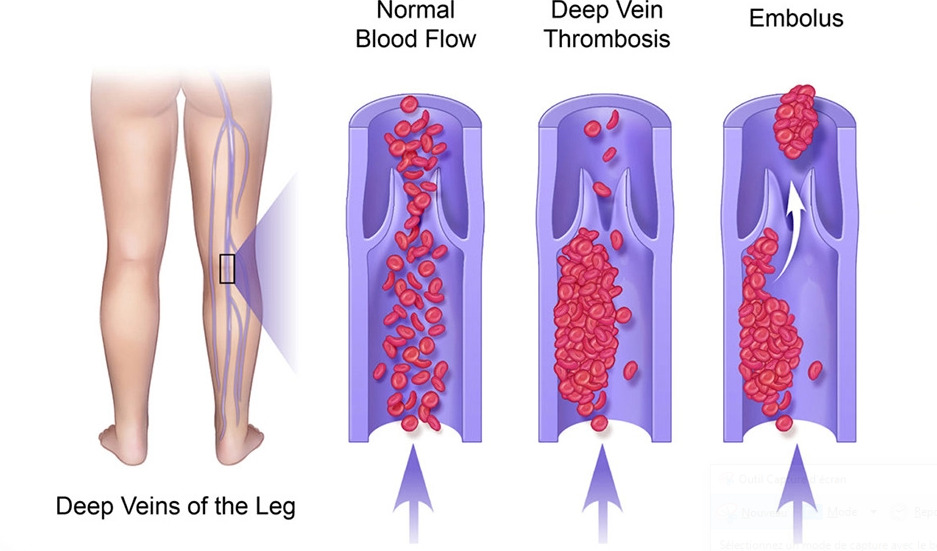
Важно! Приобретение и ношение компрессионных изделий должно быть назначено врачом, так как степень компрессии отличается, а неправильный выбор может снизить эффективность проводимого лечения.
С помощью консервативной терапии снимается воспаление, болевой синдром и рост самого тромба, однако при развитии заболевания или при наличии других осложнений может быть рекомендовано хирургическое лечение. Для предотвращения развития тромбоза глубоких вен необходимо удалить пораженный сосуд.
Для определения тактики эффективного лечения необходимо обращение на прием к врачу-флебологу или сосудистому хирургу.
Позаботьтесь о своем здоровье своевременно!
Атеросклероз, тромбоциты и тромбозы при острой ишемической болезни сердца
1. Бадимон Л., Вилахур Г., Падро Т. Липопротеины, тромбоциты и атеротромбоз. Преподобный Эсп Кардиол 2009 г.; 62: 1161–78 [PubMed] [Google Scholar]
2.
Ибанез Б., Вилахур Г., Бадимон Дж.
Прогрессирование и регресс бляшек при атеротромбозе.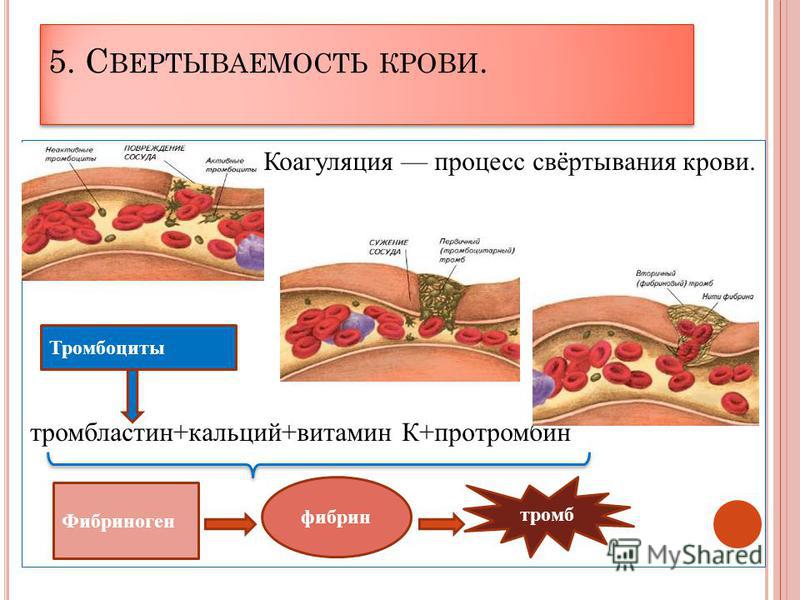 Джей Тромб Хемост
2007 г.; 5 (Приложение 1): 292–99 [PubMed] [Google Scholar]
Джей Тромб Хемост
2007 г.; 5 (Приложение 1): 292–99 [PubMed] [Google Scholar]
3. Табас И., Уильямс К.Дж., Борен Дж. Субэндотелиальная задержка липопротеинов как инициирующий процесс при атеросклерозе: обновление и терапевтические последствия. Тираж 2007 г.; 116: 1832–1844 [PubMed] [Google Scholar]
4. Flood C, Gustafsson M, Pitas RE, et al. Молекулярный механизм изменения связывания протеогликанов при изменении состава ядра и поверхности человеческого аполипопротеина В100, содержащего липопротеины низкой плотности. Артериосклеры Тромб Васк Биол 2004 г.; 24: 564–70 [PubMed] [Google Scholar]
5. Наполи С, Д’Армьенто ФП, Манчини ФП и др. Формирование жировых полос происходит в аортах плода человека и значительно усиливается при гиперхолестеринемии матери. Накопление липопротеинов низкой плотности в интиме и их окисление предшествуют привлечению моноцитов к ранним атеросклеротическим поражениям. Джей Клин Инвест 1997; 100: 2680–90 [бесплатная статья PMC] [PubMed] [Google Scholar]
6.
7. Бадимон Л., Мартинес-Гонсалес Дж., Льоренте-Кортес В. и др. Клеточная биология и липопротеины при атеросклерозе. Курр Мол Мед 2006 г.; 6: 439–56 [PubMed] [Google Scholar]
8. Сима А.В., Станку К.С., Симионеску М. Сосудистый эндотелий при атеросклерозе. Сотовые Ткани Res 2009 г.; 335: 191–203 [PubMed] [Google Scholar]
9. Вебер К., Фраэмохс Л., Дежана Э. Роль соединительных молекул адгезии в сосудистом воспалении. Нат Рев Иммунол 2007 г.; 7: 467–77 [PubMed] [Google Scholar]
10. Swirski FK, Libby P, Aikawa E, et al. Моноциты Ly-6Chi доминируют в ассоциированном с гиперхолестеринемией моноцитозе и дают макрофаги в атеромах. Джей Клин Инвест 2007 г.; 117: 195–205 [бесплатная статья PMC] [PubMed] [Google Scholar]
11.
Бадимон Л., Стори Р.Ф., Вилахур Г.
Обновленная информация о липидах, воспалении и атеротромбозе.
12. Табас И. Апоптоз макрофагов при атеросклерозе: влияние на прогрессирование бляшек и роль стресса эндоплазматического ретикулума. Антиоксидный окислительно-восстановительный сигнал 2009 г.; 11: 2333–39 [бесплатная статья PMC] [PubMed] [Google Scholar]
13. Collot-Teixeira S, Martin J, McDermott-Roe C, et al. CD36 и макрофаги при атеросклерозе. Кардиовасц Рес 2007 г.; 75: 468–77 [PubMed] [Google Scholar]
14. Льоренте-Кортес В., Ройо Т., Отеро-Винас М. и др. Белки, связывающие регуляторный элемент стерола, подавляют экспрессию белка, связанного с рецептором ЛПНП (LRP1), и опосредованное LRP1 агрегированное поглощение ЛПНП макрофагами человека. Кардиовасц Рес 2007 г.; 74: 526–36 [PubMed] [Google Scholar]
15.
Borrell-Pages M, Romero JC, Juan-Babot O, et al.
Активация пути Wnt, миграция клеток и поглощение липидов регулируются белком 5, связанным с рецептором липопротеинов низкой плотности, в макрофагах человека. Европейское сердце J
2011 г.; 32: 2841–50 [PubMed] [Google Scholar]
Европейское сердце J
2011 г.; 32: 2841–50 [PubMed] [Google Scholar]
16. Батт Э., Гамбарян С., Готтферт Н. и др. Связывание актина с человеческим белком LIM и Sh4 регулируется цГМФ- и цАМФ-зависимым фосфорилированием протеинкиназы по серину 146. J Biol Chem 2003 г.; 278: 15601–7 [PubMed] [Google Scholar]
17. Доран А.С., Меллер Н., Макнамара К.А. Роль гладкомышечных клеток в инициации и раннем прогрессировании атеросклероза. Артериосклеры Тромб Васк Биол 2008 г.; 28: 812–19 [бесплатная статья PMC] [PubMed] [Google Scholar]
18. Хан К.И., Кэмпбелл Г.Р., Кэмпбелл Дж.Х. Циркулирующие клетки костного мозга могут способствовать образованию неоинтимы. Джей Васк Рез 2001 г.; 38: 113–19 [PubMed] [Google Scholar]
19. Льоренте-Кортес В., Отеро-Винас М., Камино-Лопес С. и др. Сложные эфиры холестерина агрегированных ЛПНП интернализуются путем избирательного поглощения клетками гладкой мускулатуры сосудов человека. Артериосклеры Тромб Васк Биол 2006 г.; 26: 117–23 [PubMed] [Google Scholar]
20. Льоренте-Кортес В., Косталес П., Бернуэз Дж. и др.
Белок-2, связывающий регуляторный элемент стерола, негативно регулирует транскрипцию белка, связанного с рецептором липопротеинов низкой плотности. Джей Мол Биол
2006 г.; 359: 950–60 [PubMed] [Google Scholar]
Льоренте-Кортес В., Косталес П., Бернуэз Дж. и др.
Белок-2, связывающий регуляторный элемент стерола, негативно регулирует транскрипцию белка, связанного с рецептором липопротеинов низкой плотности. Джей Мол Биол
2006 г.; 359: 950–60 [PubMed] [Google Scholar]
21. Отеро-Винас М., Льоренте-Кортес В., Пенья Э. и др. Агрегированные липопротеины низкой плотности снижают экспрессию и активность металлопротеиназы-9 в клетках гладкой мускулатуры коронарных артерий человека. Атеросклероз 2007 г.; 194: 326–33 [PubMed] [Google Scholar]
22. Падро Т., Пена Э., Гарсия-Аргинцонис М. и др. Липопротеины низкой плотности нарушают миграцию гладкомышечных клеток коронарных сосудов человека и вызывают изменения в протеомном профиле легкой цепи миозина. Кардиовасц Рес 2008 г.; 77: 211–20 [PubMed] [Google Scholar]
23.
Гарсия-Аргинцонис М., Падро Т., Лугано Р. и др.
Липопротеины низкой плотности индуцируют дефосфорилирование, олигомеризацию и субклеточную релокализацию белка теплового шока 27 в гладкомышечных клетках сосудов человека. Артериосклеры Тромб Васк Биол
2010 г.; 30: 1212–1919 гг.[PubMed] [Google Scholar]
Артериосклеры Тромб Васк Биол
2010 г.; 30: 1212–1919 гг.[PubMed] [Google Scholar]
24. Вирмани Р., Колоджи Ф.Д., Берк А.П. и соавт. Уроки внезапной коронарной смерти: комплексная схема морфологической классификации атеросклеротических поражений. Артериосклеры Тромб Васк Биол 2000 г.; 20: 1262–75 [PubMed] [Google Scholar]
25. Морено П.Р., Фальк Э., Паласиос И.Ф. и др. Макрофагальная инфильтрация при острых коронарных синдромах. Последствия разрыва бляшки. Тираж 1994 год; 90: 775–78 [PubMed] [Google Scholar]
26. Спаньоли Л.Г., Мауриелло А., Санджорджи Г. и др. Экстракраниальные тромботически активные каротидные бляшки как фактор риска ишемического инсульта. ДЖАМА 2004 г.; 292: 1845–52 [PubMed] [Google Scholar]
27.
Кубо Т., Иманиши Т., Такарада С. и др.
Оценка морфологии очага поражения при остром инфаркте миокарда: возможности оптической когерентной томографии по сравнению с внутрисосудистым ультразвуковым исследованием и коронарной ангиоскопией. J Am Coll Кардиол
2007 г. ; 50: 933–39 [PubMed] [Google Scholar]
; 50: 933–39 [PubMed] [Google Scholar]
28. Шварц С.М., Галис З.С., Розенфельд М.Е. и соавт. Разрыв бляшек у людей и мышей. Артериосклеры Тромб Васк Биол 2007 г.; 27: 705–13 [PubMed] [Google Scholar]
29. Вилахур Г., Падро Т., Бадимон Л. Атеросклероз и тромбоз: выводы из моделей на крупных животных. J Биомед Биотехнолог 2011 г.; 2011: 907575. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Фустер В., Морено П.Р., Файад З.А. и др. Атеротромбоз и бляшки высокого риска: часть I: развитие концепций. J Am Coll Кардиол 2005 г.; 46: 937–54 [PubMed] [Google Scholar]
31. Стари Х., Бланкенхорн Д., Чендлер А. Определение интимы артерий человека и ее участков, подверженных атеросклерозу. Отчет Комитета по сосудистым поражениям Совета по атеросклерозу Американской кардиологической ассоциации. Тираж 1992; 85: 391–405 [PubMed] [Google Scholar]
32. Гласс К.К., Витцтум Дж.Л. Атеросклероз. дорога впереди. Клетка 2001 г.; 104: 503–16 [PubMed] [Google Scholar]
33. Либби П.
Воспаление при атеросклерозе. Природа
2002 г.; 420: 868–74 [PubMed] [Google Scholar]
Либби П.
Воспаление при атеросклерозе. Природа
2002 г.; 420: 868–74 [PubMed] [Google Scholar]
34. Ханссон ГК. Воспаление, атеросклероз и ишемическая болезнь сердца. N Engl J Med 2005 г.; 352: 1685–95 [PubMed] [Google Scholar]
35. Felton CV, Crook D, Davies MJ, et al. Связь липидного состава и морфологии бляшек со стабильностью аортальных бляшек человека. Артериосклеры Тромб Васк Биол 1997; 17: 1337–45 [PubMed] [Google Scholar]
36. Бадимон Дж. Дж., Леттино М., Тоски В. и др. Местное ингибирование тканевого фактора снижает тромбогенность разрушенных атеросклеротических бляшек человека: влияние ингибитора пути тканевого фактора на тромбогенность бляшек в условиях течения. Тираж 1999 г.; 99: 1780–87 [PubMed] [Google Scholar]
37. Фернандес-Ортис А., Бадимон Дж. Дж., Фальк Э. и др. Характеристика относительной тромбогенности компонентов атеросклеротических бляшек: влияние на последствия разрыва бляшек. J Am Coll Кардиол 1994; 23: 1562–69 [PubMed] [Google Scholar]
38. Камино-Лопес С., Льоренте-Кортес В. и др.
Индукция тканевого фактора агрегированными ЛПНП зависит от экспрессии белка, связанного с рецептором ЛПНП (LRP1), и транслокации Rho A в гладкомышечных клетках сосудов человека. Кардиовасц Рес
2007 г.; 73: 208–16 [PubMed] [Google Scholar]
Камино-Лопес С., Льоренте-Кортес В. и др.
Индукция тканевого фактора агрегированными ЛПНП зависит от экспрессии белка, связанного с рецептором ЛПНП (LRP1), и транслокации Rho A в гладкомышечных клетках сосудов человека. Кардиовасц Рес
2007 г.; 73: 208–16 [PubMed] [Google Scholar]
39. Льоренте-Кортес В., Отеро-Винас М., Камино-Лопес С. и др. Агрегированное поглощение липопротеинов низкой плотности индуцирует прокоагулянтную активность мембранного тканевого фактора и высвобождение микрочастиц в гладкомышечных клетках сосудов человека. Тираж 2004 г.; 110: 452–59[PubMed] [Google Scholar]
40. Тим Т., Хагенсен М.К., Бентзон Дж. Ф. и соавт. От уязвимой бляшки до атеротромбоза. Джей Стажер Мед 2008 г.; 263: 506–16 [PubMed] [Google Scholar]
41. Либби П. Молекулярные основы острых коронарных синдромов. Тираж 1995 год; 91: 2844–50 [PubMed] [Google Scholar]
42.
Уолш К., Смит Р.С., Ким Х.С.
Апоптоз сосудистых клеток при ремоделировании, рестенозе и разрыве бляшки. Цирк Рез
2000 г.; 87: 184–88 [PubMed] [Google Scholar]
Цирк Рез
2000 г.; 87: 184–88 [PubMed] [Google Scholar]
43. Галис З.С., Сухова Г.К., Ларк М.В. и др. Повышенная экспрессия металлопротеиназ матрикса и активность разрушения матрикса в уязвимых областях атеросклеротических бляшек человека. Джей Клин Инвест 1994; 94: 2493–503 [бесплатная статья PMC] [PubMed] [Google Scholar]
44. Шах П.К., Фальк Э., Бадимон Дж.Дж. и др. Макрофаги, происходящие из моноцитов человека, индуцируют разрушение коллагена в фиброзных шапочках атеросклеротических бляшек. Потенциальная роль металлопротеиназ, разлагающих матрикс, и значение разрыва бляшки. Тираж 1995 год; 92: 1565–69 [PubMed] [Google Scholar]
45. Галис З.С., Хатри Дж.Дж. Матриксные металлопротеиназы в ремоделировании сосудов и атерогенезе: хорошие, плохие и уродливые. Цирк Рез 2002 г.; 90: 251–62 [PubMed] [Google Scholar]
46.
Зурейк М., Роберт Л., Курбон Д. и др.
Активность эластазы сыворотки, ингибиторы эластазы сыворотки и возникновение атеросклеротических бляшек сонных артерий: исследование Etude sur le Vieillissement Arteriel (EVA). Тираж
2002 г.; 105: 2638–45 [PubMed] [Google Scholar]
Тираж
2002 г.; 105: 2638–45 [PubMed] [Google Scholar]
47. Гэн Ю.Дж., Либби П. Доказательства апоптоза в запущенной атероме человека. Колокализация с бета-превращающим ферментом интерлейкина-1. Ам Джей Патол 1995 год; 147: 251–66 [бесплатная статья PMC] [PubMed] [Google Scholar]
48. Пастеркамп Г., Шоневельд А.Х., ван дер Валь А.С. и др. Связь геометрии артерий с сужением просвета и гистологическими маркерами уязвимости бляшек: парадокс ремоделирования. J Am Coll Кардиол 1998 год; 32: 655–62 [PubMed] [Google Scholar]
49. Pletcher MJ, Tice JA, Pignone M, et al. Использование показателя кальция в коронарных артериях для прогнозирования событий ишемической болезни сердца: систематический обзор и метаанализ. Arch Intern Med 2004 г.; 164: 1285–92 [PubMed] [Google Scholar]
50.
Sangiorgi G, Rumberger JA, Severson A, et al.
Артериальная кальцификация, а не стеноз просвета, сильно коррелирует с количеством атеросклеротических бляшек у людей: гистологическое исследование 723 сегментов коронарных артерий с использованием недекальцифицирующей методики. J Am Coll Кардиол
1998 год; 31: 126–33 [PubMed] [Google Scholar]
J Am Coll Кардиол
1998 год; 31: 126–33 [PubMed] [Google Scholar]
51. Эхара С., Кобаяши Ю., Йошияма М. и др. Пятнистая кальцификация типична для бляшек у пациентов с острым инфарктом миокарда: внутрисосудистое ультразвуковое исследование. Тираж 2004 г.; 110: 3424–29[PubMed] [Google Scholar]
52. Бекман Дж.А., Ганц Дж., Креагер М.А. и соавт. Взаимосвязь клинических проявлений и кальцификации стеноза коронарных артерий. Артериосклеры Тромб Васк Биол 2001 г.; 21: 1618–22 [PubMed] [Google Scholar]
53. McCarthy MJ, Loftus IM, Thompson MM, et al. Ангиогенез и атеросклеротическая каротидная бляшка: связь между симптоматикой и морфологией бляшки. Джей Васк Сург 1999 г.; 30: 261–68 [PubMed] [Google Scholar]
54. Вирмани Р., Колоджи Ф.Д., Берк А.П. и соавт. Прогрессирование атеросклеротических бляшек и уязвимость к разрыву: ангиогенез как источник внутрибляшечного кровоизлияния. Артериосклеры Тромб Васк Биол 2005 г.; 25: 2054–61 [PubMed] [Google Scholar]
55. Polverini PJ, Cotran PS, Gimbrone MA, Jr, et al.
Активированные макрофаги вызывают пролиферацию сосудов. Природа
1977 год; 269: 804–6 [PubMed] [Google Scholar]
Polverini PJ, Cotran PS, Gimbrone MA, Jr, et al.
Активированные макрофаги вызывают пролиферацию сосудов. Природа
1977 год; 269: 804–6 [PubMed] [Google Scholar]
56. фон Биргелен С., Клинкхарт В., Минц Г.С. и соавт. Распределение бляшек и сосудистое ремоделирование разорвавшихся и неразорвавшихся коронарных бляшек в одном и том же сосуде: внутрисосудистое ультразвуковое исследование in vivo. J Am Coll Кардиол 2001 г.; 37: 1864–70 [PubMed] [Google Scholar]
57. Шенхаген П., Зиада К.М., Кападиа С.Р. и соавт. Степень и направление ремоделирования артерий при стабильных и нестабильных коронарных синдромах: внутрисосудистое ультразвуковое исследование. Тираж 2000 г.; 101: 598–603 [PubMed] [Google Scholar]
58. Хуан-Бабот Х.О., Мартинес-Гонсалес Х., Беррозпе М. и др. Неоваскуляризация коронарных артерий человека при поражениях различной степени тяжести. Преподобный Эсп Кардиол 2003 г.; 56: 978–86 [PubMed] [Google Scholar]
59.
Слевин М., Туру М.М., Ровира Н. и др.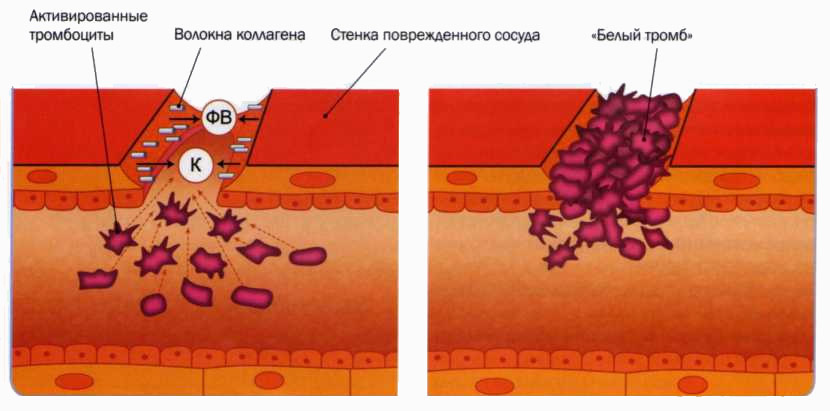 Идентификация «моментального снимка» коэкспрессированных ангиогенных маркеров в сосудах, рассеченных лазером, из нестабильных каротидных бляшек с помощью целевых массивов. Джей Васк Рез
2010 г.; 47: 323–35 [PubMed] [Google Scholar]
Идентификация «моментального снимка» коэкспрессированных ангиогенных маркеров в сосудах, рассеченных лазером, из нестабильных каротидных бляшек с помощью целевых массивов. Джей Васк Рез
2010 г.; 47: 323–35 [PubMed] [Google Scholar]
60. Слевин М., Крупински Дж., Бадимон Л. Контроль ангиогенного переключения при развитии атеросклеротических бляшек: возможные цели для терапевтического вмешательства. J Angiogenes Res 2009 г.; 1: 4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Слевин М., Эласбали А.Б., Мигель Туру М. и др. Выявление дифференциальной экспрессии белка, связанной с развитием нестабильных каротидных бляшек человека. Ам Джей Патол 2006 г.; 168: 1004–21 [бесплатная статья PMC] [PubMed] [Google Scholar]
62. Варнава А.М., Миллс П.Г., Дэвис М.Дж. Взаимосвязь между ремоделированием коронарных артерий и уязвимостью бляшек. Тираж 2002 г.; 105: 939–43 [PubMed] [Google Scholar]
63. Ли Р.Т., Камм Р.Д. Сосудистая механика для кардиолога. J Am Coll Кардиол 1994 год; 23: 1289–95 [PubMed] [Google Scholar]
64. Лори Х.М., Камм Р.Д., Стрингфеллоу Р.Г. и др.
Влияние толщины фиброзной оболочки на пиковое периферическое напряжение в модельных атеросклеротических сосудах. Цирк Рез
1992 год; 71: 850–58 [PubMed] [Google Scholar]
Лори Х.М., Камм Р.Д., Стрингфеллоу Р.Г. и др.
Влияние толщины фиброзной оболочки на пиковое периферическое напряжение в модельных атеросклеротических сосудах. Цирк Рез
1992 год; 71: 850–58 [PubMed] [Google Scholar]
65. Фальк Э., Шах П.К., Фустер В. Разрыв коронарных бляшек. Тираж 1995 год; 92: 657–71 [PubMed] [Google Scholar]
66. Амброуз Дж. А., Винтерс С. Л., Арора Р. Р. и др. Коронароангиографическая морфология при инфаркте миокарда: связь между патогенезом нестабильной стенокардии и инфарктом миокарда. J Am Coll Кардиол 1985 год; 6: 1233–38 [PubMed] [Google Scholar]
67. Хакетт Д., Дэвис Г., Мазери А. Ранее существовавшие коронарные стенозы у пациентов с первым инфарктом миокарда не обязательно были тяжелыми. Европейское сердце J 1988; 9: 1317–23 [PubMed] [Google Scholar]
68. Шах ПК. Механизмы уязвимости и разрыва бляшки. J Am Coll Кардиол 2003 г.; 41: 15S–22S [PubMed] [Google Scholar]
69.
Дэвис М.Дж., Томас А.
Тромбоз и острое поражение коронарных артерий при внезапной сердечной ишемической смерти. N Engl J Med
1984 год; 310: 1137–40 [PubMed] [Google Scholar]
N Engl J Med
1984 год; 310: 1137–40 [PubMed] [Google Scholar]
70. Фальк Э. Разрыв бляшки с ранее существовавшим тяжелым стенозом, провоцирующим коронарный тромбоз. Характеристики коронарных атеросклеротических бляшек, лежащих в основе фатальных окклюзионных тромбов. Бр Сердце J 1983; 50: 127–34 [бесплатная статья PMC] [PubMed] [Google Scholar]
71. Ловетт Дж. К., Ротвелл П. М. Место изъязвления каротидной бляшки в зависимости от направления кровотока: ангиографическое и патологическое исследование. Цереброваскулярный дис 2003 г.; 16: 369–75 [PubMed] [Google Scholar]
72. Фацио Г.П., Редберг Р.Ф., Уинслоу Т. и др. Чреспищеводная эхокардиографически выявляемая атеросклеротическая бляшка в аорте является маркером ишемической болезни сердца. J Am Coll Кардиол 1993 год; 21: 144–50 [PubMed] [Google Scholar]
73.
Коэн А., Цурио С., Бертран Б. и др.
Морфология аортальной бляшки и сосудистые события: последующее исследование пациентов с ишемическим инсультом. Следователи ФАПС. Французское исследование аортальных бляшек при инсульте. Тираж
1997 год; 96: 3838–41 [PubMed] [Google Scholar]
Французское исследование аортальных бляшек при инсульте. Тираж
1997 год; 96: 3838–41 [PubMed] [Google Scholar]
74. Французское исследование аортальных бляшек в группе инсульта Атеросклеротическое поражение дуги аорты как фактор риска повторного ишемического инсульта. N Engl J Med 1996 год; 334: 1216–21 [PubMed] [Google Scholar]
75. Фаджиотто А., Росс Р., Харкер Л. Исследования гиперхолестеринемии у нечеловекообразных приматов. I. Изменения, приводящие к образованию жировых полос. артериосклероз 1984; 4: 323–40 [PubMed] [Google Scholar]
76. Фаджиотто А., Росс Р. Исследования гиперхолестеринемии у нечеловекообразных приматов. II. Преобразование жировых полос в фиброзные бляшки. артериосклероз 1984 год; 4: 341–56 [PubMed] [Google Scholar]
77. Массберг С., Брэнд К., Грунер С. и др. Критическая роль адгезии тромбоцитов в инициировании образования атеросклеротических поражений. J Эксперт Мед 2002 г.; 196: 887–96 [бесплатная статья PMC] [PubMed] [Google Scholar]
78. Нитьянанд С., Панде И., Баджпай В.К. и др.
Тромбоциты при гипертонической болезни. Тромб Res
1993; 72: 447–54 [PubMed] [Google Scholar]
Нитьянанд С., Панде И., Баджпай В.К. и др.
Тромбоциты при гипертонической болезни. Тромб Res
1993; 72: 447–54 [PubMed] [Google Scholar]
79. Бройерсен А., Карпе Ф., Хэмстен А. и др. Алиментарная липемия усиливает мембранную экспрессию Р-селектина тромбоцитов, не влияя на другие маркеры активации тромбоцитов. Атеросклероз 1998 год; 137: 107–13 [PubMed] [Google Scholar]
80. Новак Дж., Мюррей Дж. Дж., Оутс Дж. А. и соавт. Биохимические признаки хронического нарушения функции тромбоцитов и сосудов у здоровых людей, курящих сигареты. Тираж 1987 год; 76: 6–14 [PubMed] [Google Scholar]
81. Мандутяну И., Калб М., Лупу С. и др. Повышенная адгезия диабетических тромбоцитов человека к культивируемым эндотелиальным клеткам клапана. J Submicrosc Цитол Патол 1992 год; 24: 539–47 [PubMed] [Google Scholar]
82. Хо И, Лей К.Ф. Роль тромбоцитов в развитии атеросклероза. Тенденции Cardiovasc Med 2004 г.; 14: 18–22 [PubMed] [Google Scholar]
83.
Huo Y, Schober A, Forlow SB, et al. Циркулирующие активированные тромбоциты усугубляют атеросклероз у мышей с дефицитом аполипопротеина Е. Nat Med
2003 г.; 9: 61–67 [PubMed] [Google Scholar]
Циркулирующие активированные тромбоциты усугубляют атеросклероз у мышей с дефицитом аполипопротеина Е. Nat Med
2003 г.; 9: 61–67 [PubMed] [Google Scholar]
84. Манка Д., Коллинз Р.Г., Лей К. и др. Отсутствие p-селектина, но не молекулы межклеточной адгезии-1, ослабляет неоинтимальный рост после повреждения артерий у мышей с дефицитом аполипопротеина е. Тираж 2001 г.; 103: 1000–5 [PubMed] [Google Scholar]
85. Коллинз Р.Г., Вельджи Р., Гевара Н.В. и соавт. Дефицит P-селектина или молекулы межклеточной адгезии (ICAM)-1 существенно защищает от атеросклероза у мышей с дефицитом аполипопротеина Е. J Эксперт Мед 2000 г.; 191: 189–94 [бесплатная статья PMC] [PubMed] [Google Scholar]
86. Burger PC, Вагнер ДД. Тромбоцитарный Р-селектин способствует развитию атеросклеротического поражения. Кровь 2003 г.; 101: 2661–66 [PubMed] [Google Scholar]
87.
De Meyer GR, Hoylaerts MF, Kockx MM, et al.
Интимальное отложение функционального фактора фон Виллебранда при атерогенезе. Артериосклеры Тромб Васк Биол
1999 г.; 19: 2524–34 [PubMed] [Google Scholar]
Артериосклеры Тромб Васк Биол
1999 г.; 19: 2524–34 [PubMed] [Google Scholar]
88. Бадимон Л., Бадимон Дж., Вилахур Г. и др. Патогенез острых коронарных синдромов и терапевтические последствия. Патофизиол Гемостатический тромб 2002 г.; 32: 225–31 [PubMed] [Google Scholar]
89. Ландри П., Планте И., Уэлле Д.Л. и др. Существование пути микроРНК в безъядерных тромбоцитах. Nat Struct Мол Биол 2009 г.; 16: 961–66 [бесплатная статья PMC] [PubMed] [Google Scholar]
90. Брюхова Х., Меркерова М., Прчал Ю.Т. Аберрантная экспрессия микроРНК при истинной полицитемии. гематологический 2008 г.; 93: 1009–16 [PubMed] [Google Scholar]
91. Эдельштейн Л.С., Брей П.Ф. МикроРНК в продукции и активации тромбоцитов. Кровь; 117: 5289–96 [бесплатная статья PMC] [PubMed] [Google Scholar]
92.
Питцилос С., Хант Дж., Молер Э.Р. и соавт.
Локализация тромбоцитарного фактора 4 в каротидных атеросклеротических бляшках: корреляция с клиническими параметрами. Тромб Хемост
2003 г.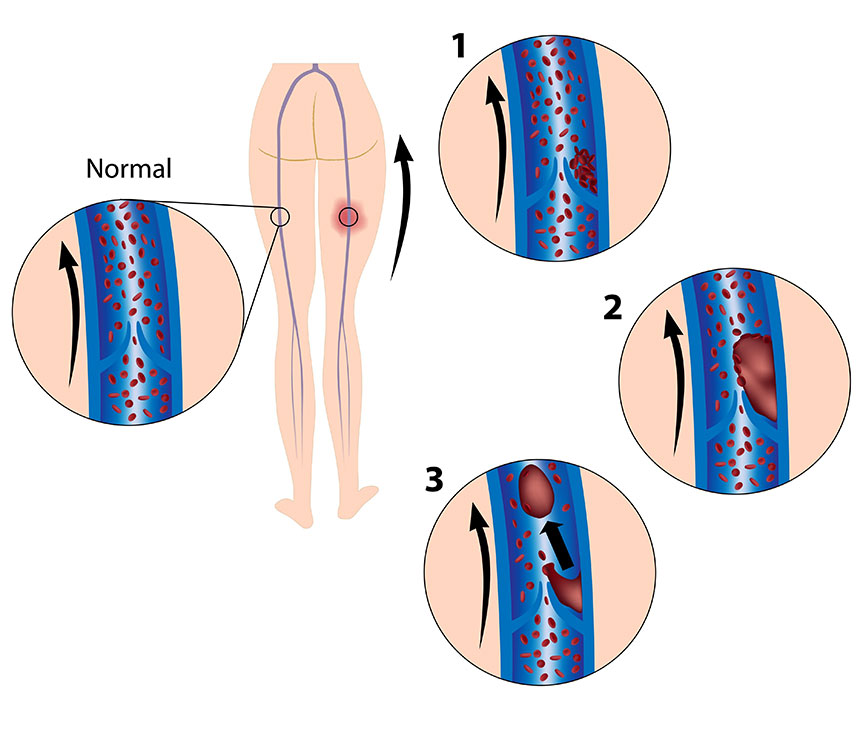 ; 90: 1112–20 [PubMed] [Google Scholar]
; 90: 1112–20 [PubMed] [Google Scholar]
93. Гаваз М. Б.К., Дикфельд Т., Погаца-Мюррей Г. и соавт. Тромбоциты индуцируют изменения хемотаксических и адгезивных свойств эндотелиальных клеток, опосредованные интерлейкин-1-зависимым механизмом. Последствия для атерогенеза. Атеросклероз 2000 г.; 148: 75–85 [PubMed] [Google Scholar]
94. Бавендиек У., Либби П., Килбрайд М. и др. Индукция экспрессии тканевого фактора в эндотелиальных клетках человека с помощью лиганда CD40 опосредована активационным белком 1, ядерным фактором каппа В и Egr-1. J Биол Хим 2002 г.; 277: 25032–39 [PubMed] [Google Scholar]
95. Ramos CL, Huo Y, Jung U, et al. Прямая демонстрация превращения P-селектина и VCAM-1-зависимых мононуклеарных клеток в ранние атеросклеротические поражения у мышей с дефицитом аполипопротеина Е. Цирк Рез 1999 г.; 84: 1237–44 [PubMed] [Google Scholar]
96.
Вебер С., Спрингер Т.А.
Накопление нейтрофилов на активированных поверхностно-адгезивных тромбоцитах в потоке опосредовано взаимодействием Mac-1 с фибриногеном, связанным с alphaIIbbeta3 и стимулируемым фактором, активирующим тромбоциты. Джей Клин Инвест
1997 год; 100: 2085–93 [бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест
1997 год; 100: 2085–93 [бесплатная статья PMC] [PubMed] [Google Scholar]
97. Дьяково Т.Г., Рот С.Дж., Буккола Дж.М. и др. Перекатывание, арест и трансмиграция нейтрофилов через активированные, прикрепленные к поверхности тромбоциты посредством последовательного действия P-селектина и бета-2-интегрина CD11b/CD18. Кровь 1996; 88: 146–57 [PubMed] [Google Scholar]
98. Гаваз М., Стеллос К., Лангер Х.Ф. Тромбоциты модулируют атерогенез и прогрессирование атеросклеротических бляшек посредством взаимодействия с клетками-предшественниками и дендритными клетками. Джей Тромб Хемост 2008 г.; 6: 235–42 [PubMed] [Google Scholar]
99. Мишель Дж. Б., Вирмани Р., Арбустини Э. и др. Внутрибляшечные кровоизлияния как триггер уязвимости бляшек. Европейское сердце J; 32: 1977–1985, 1985a, 1985b, 1985c [бесплатная статья PMC] [PubMed] [Google Scholar]
100.
Чендлер А.Б., Хэнд Р.А.
Фагоцитированные тромбоциты: источник липидов в тромбах и атеросклеротических бляшках человека.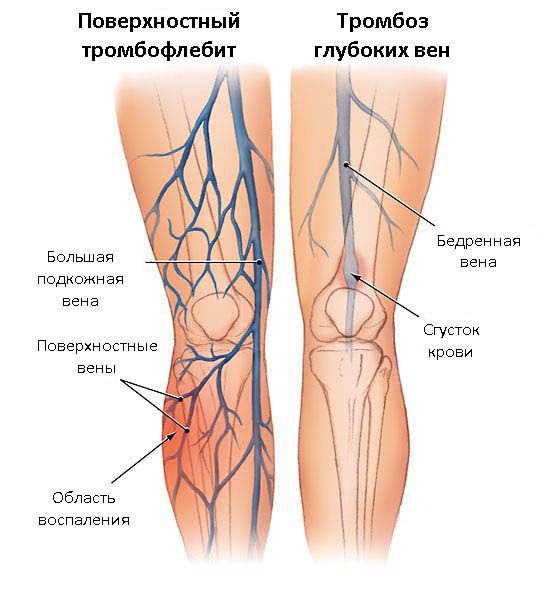 Наука
1961 год; 134: 946–47 [PubMed] [Google Scholar]
Наука
1961 год; 134: 946–47 [PubMed] [Google Scholar]
101. Kockx MM, Cromheeke KM, Knaapen MW, et al. Фагоцитоз и активация макрофагов, ассоциированные с геморрагическими микрососудами при атеросклерозе человека. Артериосклеры Тромб Васк Биол 2003 г.; 23: 440–46 [PubMed] [Google Scholar]
102. Колоджи Ф.Д., Берк А.П., Наказава Г. и соавт. Свободный холестерин в атеросклеротических бляшках: откуда он берется? Карр Опин Липидол 2007 г.; 18: 500–7 [PubMed] [Google Scholar]
103. Бадимон Л., Бадимон Дж. Дж., Вилахур Г. и др. Патогенез острых коронарных синдромов и терапевтические последствия. Патофизиол Гемостатический тромб 2002 г.; 32: 225–31 [PubMed] [Google Scholar]
104. Бадимон Л., Вилахур Г. Коронарная атеротромботическая болезнь: успехи антитромбоцитарной терапии. Преподобный Эсп Кардиол 2008 г.; 61: 501–13 [PubMed] [Google Scholar]
105.
Бадимон Л., Вилахур Г.
Тромбоциты, артериальный тромбоз и церебральная ишемия. Цереброваскулярный дис
2007 г. ; 24
Приложение 1: 30–39[PubMed] [Google Scholar]
; 24
Приложение 1: 30–39[PubMed] [Google Scholar]
106. Сингбартл К., Форлоу С.Б., Лей К. Тромбоцитарный, но не эндотелиальный, Р-селектин имеет решающее значение для опосредованной нейтрофилами острой постишемической почечной недостаточности. ФАСЭБ Ж 2001 г.; 15: 2337–44 [PubMed] [Google Scholar]
107. Лахав Дж., Юрк К., Хесс О. и др. Устойчивое лигирование интегрина включает внеклеточные свободные сульфгидрилы и ферментативно катализируемый дисульфидный обмен. Кровь 2002 г.; 100: 2472–78 [PubMed] [Google Scholar]
108. фон Хундельсхаузен П., Вебер К.С., Хуо Ю. и др. Отложение RANTES тромбоцитами вызывает остановку моноцитов на воспаленном и атеросклеротическом эндотелии. Тираж 2001 г.; 103: 1772–77 [PubMed] [Google Scholar]
109. Тоски В., Галло Р., Леттино М. и др. Тканевой фактор модулирует тромбогенность атеросклеротических бляшек человека. Тираж 1997 год; 95: 594–99 [PubMed] [Google Scholar]
110.
Hoylaerts M, Rijken DC, Lijnen HR, et al.
Кинетика активации плазминогена тканевым активатором плазминогена человека. Роль фибрина. J Биол Хим
1982 год; 257: 2912–19 [PubMed] [Google Scholar]
Роль фибрина. J Биол Хим
1982 год; 257: 2912–19 [PubMed] [Google Scholar]
111. Осенде Дж.И., Бадимон Дж.Дж., Фустер В. и др. Тромбогенность крови у больных сахарным диабетом 2 типа связана с гликемическим контролем. J Am Coll Кардиол 2001 г.; 38: 1307–12 [PubMed] [Google Scholar]
112. Симс П.Дж., Файони Э.М., Видмер Т. и др. Белки комплемента C5b-9 вызывают высвобождение мембранных везикул с поверхности тромбоцитов, которые обогащены мембранным рецептором фактора свертывания Va и проявляют протромбиназную активность. J Биол Хим 1988 год; 263: 18205–12 [PubMed] [Google Scholar]
113. Мюллер И., Клоке А., Алекс М. и др. Внутрисосудистый тканевой фактор инициирует коагуляцию через циркулирующие микровезикулы и тромбоциты. Фасеб Дж. 2003 г.; 17: 476–78 [PubMed] [Google Scholar]
114.
Леруайер А.С., Изобе Х., Лесеш Г. и соавт.
Клеточное происхождение и тромбогенная активность микрочастиц, выделенных из атеросклеротических бляшек человека. J Am Coll Кардиол
2007 г. ; 49: 772–77 [PubMed] [Google Scholar]
; 49: 772–77 [PubMed] [Google Scholar]
115. Форлоу С.Б., Макэвер Р.П., Ноллерт М.Ю. Лейкоцитарно-лейкоцитарные взаимодействия, опосредованные микрочастицами тромбоцитов в потоке. Кровь 2000 г.; 95: 1317–23 [PubMed] [Google Scholar]
116. Mause SF, von Hundeshausen P, Zernecke A, et al. Микрочастицы тромбоцитов: трансцеллюлярная система доставки RANTES, способствующая рекрутированию моноцитов на эндотелии. Артериосклеры Тромб Васк Биол 2005 г.; 25: 1512–18 [PubMed] [Google Scholar]
117. Элиассон М., Асплунд К., Эврин П.Е. Регулярная физическая активность в свободное время предсказывает высокую активность тканевого активатора плазминогена: исследование MONICA в Северной Швеции. Int J Эпидемиол 1996 год; 25: 1182–88 [PubMed] [Google Scholar]
118. Ван Гал Л.Ф., Уотерс М.А., Де Леув И.Х. Положительное влияние умеренной потери веса на сердечно-сосудистые факторы риска. Int J Obes Relat Metab Disord 1997 год; 21 (Приложение 1): S5–9 [PubMed] [Google Scholar]
119. де Лоргерил М., Сален П., Мартин Дж. Л. и соавт.
Средиземноморская диета, традиционные факторы риска и частота сердечно-сосудистых осложнений после инфаркта миокарда: окончательный отчет Lyon Diet Heart Study. Тираж
1999; 99: 779–85 [PubMed] [Google Scholar]
де Лоргерил М., Сален П., Мартин Дж. Л. и соавт.
Средиземноморская диета, традиционные факторы риска и частота сердечно-сосудистых осложнений после инфаркта миокарда: окончательный отчет Lyon Diet Heart Study. Тираж
1999; 99: 779–85 [PubMed] [Google Scholar]
120. Лакост Л., Хунг Дж., Лам Д.Ю. Острые и отсроченные антитромботические эффекты алкоголя у человека. Ам Джей Кардиол 2001 г.; 87: 82–85 [PubMed] [Google Scholar]
121. Элиассон М., Асплунд К., Эврин П.Е. и соавт. Взаимосвязь курения сигарет и нюхательного табака с плазменным фибриногеном, фибринолитическими переменными и сывороточным инсулином. Исследование MONICA в Северной Швеции. Атеросклероз 1995 год; 113: 41–53 [PubMed] [Google Scholar]
122. Джерн С., Эрикссон Э., Тенгборн Л. и др. Изменения коагуляции и фибринолиза плазмы в ответ на психическое напряжение. Тромб Хемост 1989; 62: 767–71 [PubMed] [Google Scholar]
123.
Кристенсен С.Д., Вюрц М., Гроув Э.Л. и др.
Современное использование ингибиторов гликопротеина IIb/IIIa. Тромб Хемост
2012 г.; 107: 215–24 [PubMed] [Google Scholar]
Тромб Хемост
2012 г.; 107: 215–24 [PubMed] [Google Scholar]
124. Хохтл Т., Фархан С., Войта Дж. и др. Новые антикоагулянты при острых коронарных синдромах. Сердце 2011 г.; 97: 244–52 [PubMed] [Google Scholar]
Узнайте о различиях и сходствах
И эмболии, и аневризмы имеют схожие названия и могут влиять на кровоток в головном мозге, но на этом сходство заканчивается. Эмболия блокирует кровоток из-за тромба, а аневризма возникает, когда артерия разрывается или перекручивается, вызывая кровотечение.
Узнайте, как могут возникнуть эти два состояния, как они связаны и чего ожидать, если одно из них произойдет с вами.
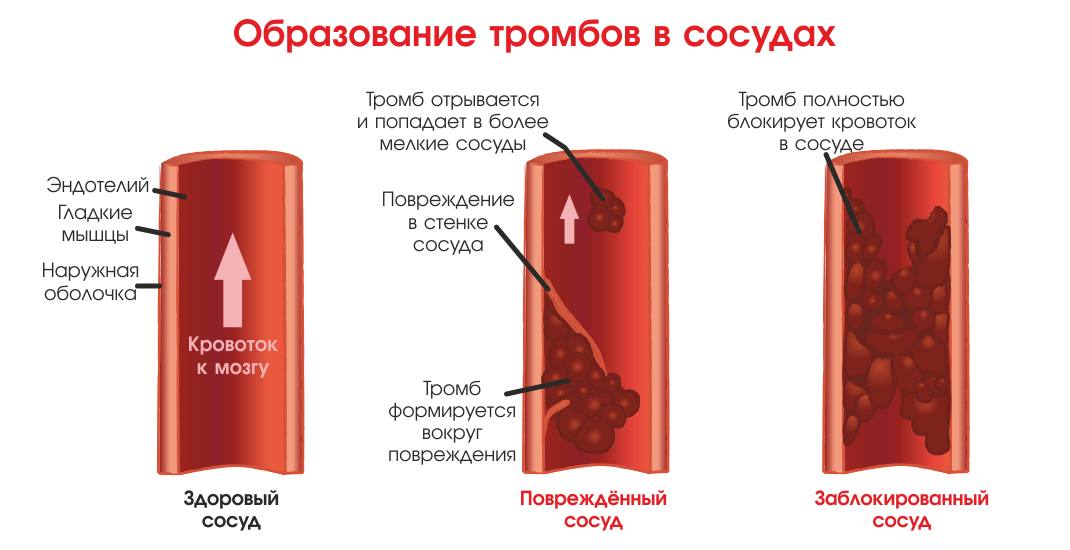
Эмболия представляет собой группу частиц или сгустков, которые отрываются от стенки кровеносного сосуда и перемещаются по телу. Обычно он состоит из слипшихся клеток крови, жира или холестерина.
Когда эти сгустки впервые образуются и все еще прикреплены к стенке сосуда, они называются тромбами. Когда тромб отрывается и начинает двигаться по телу, он называется эмболом. Вы также можете услышать, как врач называет оторвавшийся и перемещающийся по телу тромб тромбоэмболией.
Вы также можете услышать, как врач называет оторвавшийся и перемещающийся по телу тромб тромбоэмболией.
По мере продвижения эмбол может застревать в других сосудах, перекрывая жизненно важный кровоток где-то в теле. Когда сгустки или эмболы перемещаются и застревают, это приводит к еще одному изменению названия в зависимости от проблемы, которую вызывает сгусток. К ним относятся:
- Легочная эмболия. Легочная эмболия — это эмбол, блокирующий легочную артерию в легком.
- Ишемический инсульт. Ишемический инсульт случается, когда эмбол попадает в мозг.
- Инфаркт миокарда. Инфаркт миокарда или сердечный приступ — это когда эмболы застревают в артериях, питающих сердце кровью.
- Тромбоз глубоких вен. Тромбоз глубоких вен возникает, когда в глубоких венах, обычно в ногах, образуется большой тромб. Эти сгустки могут нанести серьезный ущерб, если они вырвутся на свободу и попадут в такие органы, как легкие, сердце или мозг.

Аневризма – это ослабление или повреждение стенки артерии. Эти слабые места могут раздуваться, как воздушный шар, и в конце концов лопнуть. Это часто происходит из-за высокого кровяного давления или атеросклероза, которые вызывают ослабление стенок артерий.
При разрыве аневризмы возникает внутреннее кровотечение, требующее неотложной медицинской помощи. Это может произойти в областях тела, включая:
- головной мозг
- сердце
- селезенка
- легкие
- аорта
- ноги
Когда аневризмы называются другими именами, они могут возникать в разных частях тела. Примеры включают:
- Аневризма брюшной аорты. Аневризма брюшной аорты — это когда часть вашей аорты, которая находится в брюшной полости, протекает или разрывается. Поскольку аорта несет кровь к большей части вашего тела, разрыв может быстро вызвать массивное кровотечение, которое может привести к летальному исходу. Это может произойти без предупреждающих симптомов.

- Геморрагический инсульт. Геморрагический инсульт возникает при кровоизлиянии в головной мозг, прерывающем приток крови к тканям головного мозга.
Сгустки крови являются корнем как аневризм, так и эмболий в той или иной форме. Аневризма может быть вызвана бляшкой или тромбом, который образуется в кровеносном сосуде, ослабляя стенку сосуда и приводя к разрыву. Эмболии также являются результатом сгустков или тромбов, которые оторвались от стенки сосуда и прошли через тело.
Оба состояния приводят к одному и тому же эффекту — нарушению кровотока. Когда это происходит в жизненно важном органе, таком как мозг или сердце, эффект может быть смертельным.
Эти органы нуждаются в постоянном кровоснабжении, а мозговая ткань может начать отмирать всего через 5 минут без притока крови. Если ткань мозга повреждена, ее невозможно восстановить.
То же самое и с сердцем. Практически сразу после остановки кровотока сердечная ткань начинает отмирать и не может восстановиться. Объем общего повреждения сердца зависит от того, сколько ткани было поражено до восстановления кровотока.
Практически сразу после остановки кровотока сердечная ткань начинает отмирать и не может восстановиться. Объем общего повреждения сердца зависит от того, сколько ткани было поражено до восстановления кровотока.
Симптомы как аневризм, так и эмболий зависят от пораженной части тела. Общие симптомы включают:
- потерю сознания
- головокружение
- спутанность сознания
- учащенное сердцебиение
- кровотечение
- одышку
- остановку сердца 9 900 . При аневризме сосуд может лопнуть, вызывая внутреннее кровотечение. Это, в свою очередь, препятствует попаданию крови к органам. При эмболии кровоток блокируется частицей, застрявшей в сосуде.
- Высокое кровяное давление
- Высокий холестерин
- Курение
- Ожирение
- Беременность
- ИСТОРИЯ СЕРСКОГО БЕЗОПАСНОСТИ ИЛИ СЕРСИЯ
Еще одно различие заключается в том, как лечат эти состояния. Если вы склонны к образованию тромбов, вам могут прописать лекарства, которые разжижают кровь, чтобы предотвратить образование тромбов. В случае больших эмболов можно вводить сильные разжижители крови, такие как активатор тканевого плазминогена (tPA), для быстрого растворения сгустка.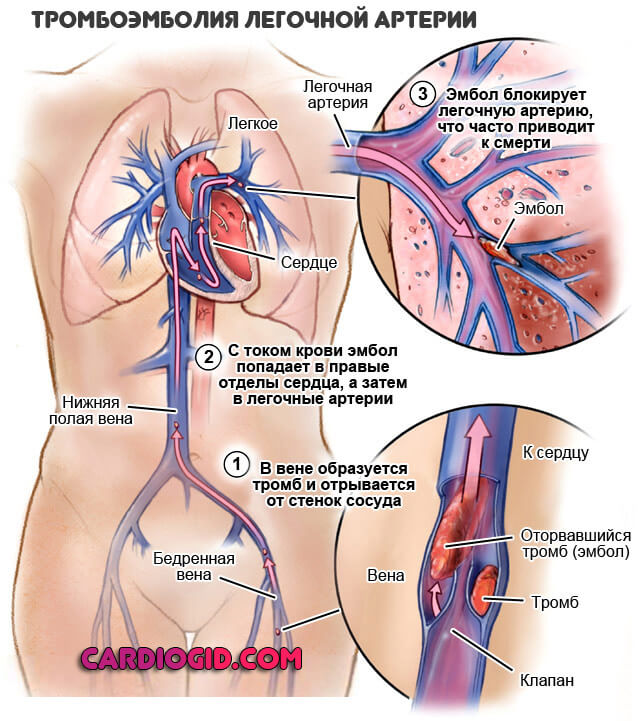
Аневризмы и эмболии нарушают кровоток. В то время как причина различна, факторы риска подобны.
Факторы риска, общие как для аневризмы, так и для эмболии, включают:
- боль в пораженной области, например, боль в груди или головная боль
- одышка
- головокружение
Если у вас есть эти симптомы, не ждите, чтобы действовать. Если вы потеряете сознание или у вас случится остановка сердца, окружающие должны позвонить по номеру 911 и начать сердечно-легочную реанимацию (СЛР).
И аневризмы, и эмболии блокируют кровоток в той или иной части тела.