Патогенез инсульта ишемического: Этиология, патогенез, клиническая диагностика, дифференциальная диагностика и лечение острых нарушений мозгового кровообращения
Транзисторная ишемическая атака > Реабилитационный центр
Ввиду того, что симптомы наблюдаются в течение достаточно короткого времени, больные часто не придают им значения и не обращаются за помощью – регистрация ТИА из-за этого представляется неполной.
Между тем своевременное распознавание транзиторных ишемических атак имеет очень большую важность, поскольку оно даёт возможность оказывать пациенту эффективную медицинскую помощь, которая направлена на предотвращение развития грубых речевых, двигательных и прочих расстройств, которые зависят от локализации поражения, а также на вторичную профилактику инсульта.
Транзисторная ишемическая атака (ТИА) представляет собой вариант преходящего нарушения мозгового кровообращения. Традиционно транзиторную ишемическую атаку определяют как острое нарушение мозгового кровообращения, сопровождающееся кратковременным нарушением функций мозга в форме общемозговой и/или очаговой симптоматики. Впоследствии происходит полный регресс симптомов, а при нейровизуализации отсутствуют признаки инфаркта головного мозга. Также следует помнить о том, что транзиторная ишемическая атака – это критическое состояние, которое до исчезновения симптомов клинически неотличимо от инфаркта.
Также следует помнить о том, что транзиторная ишемическая атака – это критическое состояние, которое до исчезновения симптомов клинически неотличимо от инфаркта.
Известно, что в течение первых двух суток после ТИА риск инсульта увеличивается на 4-10%, а в последующие 3 месяца на 10-20%. Если имеет место стеноз экстракраниального отдела сонной артерии, который превышает 70% её диаметра, риск возникновения инсульта в течение первых двух лет после ТИА достигает 28%. Исходя из этого, транзиторную ишемическую атаку можно считать одним из предикторов инсульта. Как правило, после ТИА развивается атеротромботический инсульт (50% случаев) реже – лакунарный (20%), кардиоэмболический (10%) или геморрагический (20%).
Факторы риска
Самыми значимыми факторами риска возникновения транзиторной ишемической атаки считают:
- Артериальную гипертензию;
- Сахарный диабет;
- Гиперхолестеринемию;
- Избыточное потребление алкоголя;
- Курение;
- Малоподвижный образ жизни;
- Избыточный вес.

К самым частым этиологическим факторам транзиторной ишемической атаки относятся:
- Кардиогенная эмболия;
- Атеросклероз позвоночной или сонной артерии, а также крупных ветвей их бассейна, который вызывает артерио-артериальную эмболию;
- Симптомный каротидный стеноз более чем 50% просвета артерии, вызывающий гемодинамическую недостаточность;
- Коагулопатия;
- Аномалии развития (удвоение, перегиб, аплазия или гипоплазия) позвоночной или сонной артерий;
- Ангиопатии, которые вызваны сахарным диабетом, артериальной гипертензией или прочими причинами;
- Диссекция позвоночной или сонной артерии;
- Экстравазальная компрессия позвоночных артерий, осуществляемая патологически изменёнными шейными позвонками;
- Употребление симпатомиметиков.
Реже ТИА может быть обусловлена васкулитом (в том числе специфическим), антифосфолипидным синдромом, заболеваниями крови, мигренью, венозным тромбозом, приёмом оральных контрацептивов либо иными причинами.
Патогенез
К развитию ТИА приводит острое, но обратимое (без возникновения очага инфаркта) критическое понижение кровоснабжения участка мозга в бассейне определённой артерии. Ключевым моментом патогенеза нарушения является именно обратимость локальной ишемии мозга, которая развивается на функциональном пороге ишемии (при снижении церебральной перфузии до 18-22 мл на 100 г/мин).
Преходящее уменьшение кровотока в области дистальнее зоны окклюзии артерии и возникновение ишемии в очагах мозговой ткани, соответствующих пораженным артериям, вызывает появление обратимой очаговой симптоматики. Если церебральная перфузия была восстановлена, клинически имеет место регресс очаговой симптоматики с последующим завершением эпизода транзиторной ишемической атаки. Если перфузия падает и дальше, ниже порога необратимых изменений, наступает инфаркт мозга.
Механизмы развития ТИА по своей сути аналогичны патогенезу ишемического инсульта. Исход инфаркта мозга или ТИА зависит от скорости развития патологического процесса, локализации очага поражения, реологических свойств крови и состояния коллатерального кровообращения.
Симптомы
Клинически транзиторная ишемическая атака проявляется симптомами ишемии мозга, которые зависят от локализации нарушения. К примеру:
- Утрата зрения на оба глаза/один глаз;
- Нарушение чувствительности в ноге и/или в руки и/или мышцах лица;
- Нарушение координации движений и/или равновесия;
- Эпилептические приступы;
- Нарушения речи;
- Нарушения памяти, поведения;
- Психомоторное возбуждение;
- Утрата сознания.
Средняя продолжительность одного эпизода ТИА составляет 8-14 минут, большинство таких атак разрешается в течение одного часа или же ранее. По данным статистического исследования длительность симптоматических проявлений ТИА до 1-го часа отмечают у 43.5% пациентов, 1-3 часа у 45.7%, более трёх часов у 10.9%.
Диагностика
В каротидном бассейне ТИА возникают в 4 раза чаще, чем в вертебробазилярном. Как правило, диагноз ТИА ставят ретроспективно, поскольку к моменту осмотра пациента неврологом симптомы самопроизвольно регрессируют. Исходя из этого, необходимо знание клинических проявлений ТИА врачами самых разных профилей.
Исходя из этого, необходимо знание клинических проявлений ТИА врачами самых разных профилей.
Транзиторные ишемические атаки могут, как развиваться однократно, так и повторяться достаточно часто. Подтверждение этого диагноза базируется на:
- Определении этиологии ТИА при помощи дуплексного сканирования сосудов головного мозга и шеи и/или эхокардиографии. При необходимости проводят ангиографическое исследование;
- Оценке клинической картины;
- Исключении инфаркта головного мозга с использованием методов нейровизуализации. Этот этап необходим даже при полном регрессе симптоматических проявлений.
Основными задачами диагностики транзиторных ишемических атак являются:
- Исключение инфаркта в первые три часа после развития ТИА;
- Исключение прочих заболеваний, которые имеют клиническую картину, сходную с ТИА;
- Выяснение этиологии ТИА (дифференцировка неэмболических и эмболических атак, а также ТИА при вертебральном и каротидном стенозе) – это необходимо для своевременного начала целенаправленной профилактики инфаркта.

Проведение МРТ или КТ головы показано всем пациентам с подозрением на ТИА. В случае если пациент госпитализирован в течение 1-6 часов после атаки, при помощи МРТ или КТ следует исключить инфаркт мозга, а также опухоль головного мозга или субдуральную гематому.
Дуплексное сканирование применяют для оценки кровотока в церебральных сосудах исходя из количественных и качественных аудиовизуальных характеристик. Сканирование даёт возможность на основе прямых эхографических признаков определять различного рода патологические сосудистые процессы, в том числе васкулиты, атеросклероз, ангиопатии, аневризмы, сосудистые аномалии и т. д.
Среди достоинств метода возможность определить ранние доклинические признаки наличия заболевания и оценить изменения гемодинамики в реальном времени, с выявлением функциональных, а не только органических, нарушений кровотока.
КТ-ангиография или магнитно-резонансная ангиография показаны в случае, если дуплексное сканирование не дало надёжного результата. Каротидная ангиография представляет собой стандартную процедуру диагностики, проводимую перед каротидной эндартерэктомии. Также эта процедура показана пациентам с ТИА в случае, если МРТ и дуплексное сканирование дают противоречивые результаты или не могут быть проведены.
Каротидная ангиография представляет собой стандартную процедуру диагностики, проводимую перед каротидной эндартерэктомии. Также эта процедура показана пациентам с ТИА в случае, если МРТ и дуплексное сканирование дают противоречивые результаты или не могут быть проведены.
Эхокардиография показана при наличии подозрения на кардиоэмболиоческую ТИА, если данные анамнеза или клинического осмотра указывают на возможное наличие кардиологической патологии, если возраст пациента более 45-и лет или если результаты обследования сосудов головного мозга, шеи, а также показателей крови не позволили выявить причину ТИА.
Проведение электроэнцефалографии показано пациентам, для лечения которых необходимо провести дифференциальную диагностику эпилептического приступа и ТИА. Помимо этого план обследования при транзиторной ишемической атаки обычно включает в себя общий анализ крови, ЭКГ, определение электролитов плазмы крови, гематокрита, креатинина, протромбирового времени, вязкости крови, осмолярности сыворотки, международного нормализованного отношения, агрегации эритроцитов и тромбоцитов, липидов крови, глюкозы и антифосфолипидных антител.
Госпитализация
До завершения эпизода основные принципы ведения пациентов с ТИА аналогичны тактике ведения больного, поражённого инфарктом мозга. В случае если связанная с ТИА симптоматика сохраняется в течение нескольких часов и пациент обращается за помощью, его следует госпитализировать в специализированное отделение для больных с острыми нарушениями мозгового кровообращения по экстренным показаниям – для дифференциальной диагностики ТИА с ишемическим инсультом.
Это также касается пациентов, которые впервые в жизни перенесли ТИА, если с регресса симптомов прошло не более 2-х суток. Если имеет место более длительный промежуток с момента исчезновения симптомов, пациенту проводя лечение и обследование в амбулаторных условиях. Обследование включает в себя МРТ головы, ЭхоКГ, дуплексное сканирование и ЭКГ.
Повторная транзиторная ишемическая атака, которая возникла в течение 12-и часов с начала амбулаторного обследования, является причиной для смены тактики ведения и показанием к экстренной госпитализации. Также экстренной госпитализации подлежат пациенты с «крещендо» ТИА – транзиторной ишемической атакой продолжительностью более часа.
Также экстренной госпитализации подлежат пациенты с «крещендо» ТИА – транзиторной ишемической атакой продолжительностью более часа.
Помимо этого следует госпитализировать пациентов с:
- Симптомным каротидным стенозом более чем 50% просвета артерии, который выявлен на этапе проведения амбулаторного исследования;
- Заболеванием сердца, которое может являться источником кардиогенной эмболии;
- Признаками гиперкоагуляции с тромбоэмболией артерии в анамнезе;
- Изменениями коагулограммы;
- Тромбозами вен.
На протяжении срока пребывания пациента в стационаре основными диагностическими задачами являются установление этиологии ТИА, исключение инфаркта мозга и дифференциальная диагностика.
Последующее лечение
После окончания ТИА основные усилия врачей и пациента должны быть направлены на профилактику рецидивов острых нарушений мозгового кровообращения. При ТИА некардиоэмболической природы препаратами выбора считают антиагреганты, при кардиогенных эмболиях – антикоагулянты и/либо антиагреганты. Основным методом диагностики рецидивных острых нарушений мозгового кровообращения при ТИА некардиоэмболической природы считают длительную ежедневную терапию с использованием антиагрегантов.
Основным методом диагностики рецидивных острых нарушений мозгового кровообращения при ТИА некардиоэмболической природы считают длительную ежедневную терапию с использованием антиагрегантов.
При наличии симптомных каротидных стенозов более чем 50% просвета артерии для профилактики инсульта необходимо срочно провести каротидную эндартерэктомию. В ряде случае при каротидных стенозах более чем 70% просвета артерии возможно выполнение эндоваскулярных операций – стентирования позвоночной или сонной артерии и баллонной ангиопластики.
Также смотрите другие статьи по данной тематике:
- Инсульт молодеет с каждым годом
- Калий и магний
- Лечение гипертонии для профилактики инсульта
Для получения профессиональной консультации по вопросам реабилитации после инсульта
в Германии
Звоните нам по телефону: +49 228 972 723 72
или пишите на Email здесь
Хирургическое лечение и профилактика ишемии головного мозга экстрараниального генеза
4.
«Хирургическая профилактика ишемического инсульта у пациентов с заболеваниями магистральных артерий головы и шеи»
Введение
Сосудистые заболевания головного мозга – актуальная медицинская и социальная проблема. Ежегодно в мире переносят инсульт более 6 миллионов человек, из них 400-450 тысяч регистрируется только в России. Инсульт является абсолютно лидирующей причиной инвалидизации населения. Из всех острых нарушений мозгового кровообращения 70% составляет ишемический инсульт. В экономически развитых странах несколько десятилетий тому назад наблюдалась аналогичная ситуация, но вследствие осуществления в государственном масштабе профилактических мер против атеросклероза в этих странах ситуация коренным образом изменилась – смертность от сердечно-сосудистых причин сократилась в 2 раза и более, резко возросла средняя продолжительность жизни населения.
В популяционных исследованиях около 50% ишемических эпизодов, как постоянных, так и временных, являются тромботическими или эмболическими осложнениями атеросклероза артерий большого и среднего калибра, около 25% связано с заболеваниями внутричерепных сосудов малого диаметра, около 20% — с эмболией из сердца, и оставшиеся 5% эпизодов связаны с более редкими причинами (диссекция артерии, артериит, заболевания крови, приводящие к гиперкоагуляционому синдрому, и др.
Патогенез атеротромботического инсульта.
Атероматозные бляшки поражают главным образом крупные (дуга аорты) и средние артерии, особенно в местах их деления (бифуркация общей сонной артерии), извитости (сифон внутренней сонной артерии (ВСА) или слияния (основная артерия (ОА). Внутричерепные артерии (дистальнее виллизиева круга) страдают от атеросклероза крайне редко, в связи с этим окклюзии этих артерий возникают из-за эмболии чаще, чем из-за локального тромбоза на месте атероматозной бляшки. Такое распределение атеросклеротических бляшек, вероятно, определяется местами гемодинамического напряжения и травмы эндотелия, пограничными зонами разделения потока и застоя крови и турбулентностью, что может вызвать тромбообразование, само по себе ведущее к прогрессированию атероматозного поражения.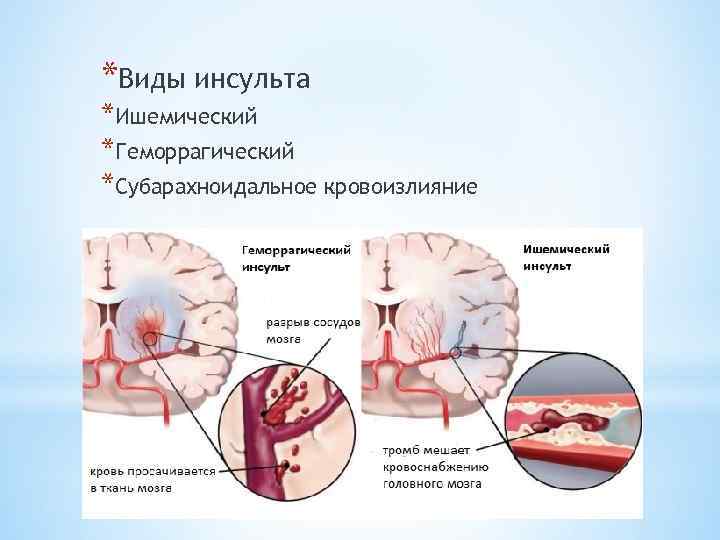 С ранних стадий своего формирования бляшки осложняются адгезией, активацией и агрегацией тромбоцитов, при этом запускается коагуляция и пристеночный тромбоз. Атеротромботическая бляшка может расти и закупоривать просвет артерии, затем тромб в просвете артерии распространяется проксимально или дистально, тромб может подвергаться лизису посредством фибринолитических механизмов сосудистой стенки и крови. Тромб, или его часть, могут стать эмболом, приводя к закупорке дистальных артерий. Таким образом, эмболы состоят из комбинации холестерина, тромбоцитарных агрегатов и фибрина. В зависимости от состава, размера, плотности и возраста эмболы могут быть лизированы, фрагментированы или по-прежнему закупоривать дистальную артерию и, возможно, запускать локальный антеро- и ретроградный тромбоз. Вероятно, характер и скорость локального кровотока определяют в некоторой степени судьбу эмболов. Возникнет ли при этом инфаркт мозга или нет, зависит от адекватности коллатерального кровотока.
С ранних стадий своего формирования бляшки осложняются адгезией, активацией и агрегацией тромбоцитов, при этом запускается коагуляция и пристеночный тромбоз. Атеротромботическая бляшка может расти и закупоривать просвет артерии, затем тромб в просвете артерии распространяется проксимально или дистально, тромб может подвергаться лизису посредством фибринолитических механизмов сосудистой стенки и крови. Тромб, или его часть, могут стать эмболом, приводя к закупорке дистальных артерий. Таким образом, эмболы состоят из комбинации холестерина, тромбоцитарных агрегатов и фибрина. В зависимости от состава, размера, плотности и возраста эмболы могут быть лизированы, фрагментированы или по-прежнему закупоривать дистальную артерию и, возможно, запускать локальный антеро- и ретроградный тромбоз. Вероятно, характер и скорость локального кровотока определяют в некоторой степени судьбу эмболов. Возникнет ли при этом инфаркт мозга или нет, зависит от адекватности коллатерального кровотока.
Эмболы переносятся в мозг или глаз по путям нормального артериального кровоснабжения, которое само по себе различно у разных людей. Так, эмбол, образовавшийся в ВСА, обычно попадает в глаз или передние две трети полушария мозга, но может попасть в затылочную долю через заднюю соединительную артерию (ЗСоА). Эмболы могут оказываться в более необычных местах (так, при тяжелом поражении позвоночных артерий (ПА) и низком кровотоке в ОА эмбол, образовавшийся в ВСА, может достигнуть ОА через вилизиев круг). Эмбол может оказаться в противоположном полушарии, достигнув последнее через переднюю соединительную артерию (ПСоА). Возможны и другие «экзотические» варианты миграции эмболов. Наконец, ишемический инсульт на стороне закупоренной ВСА может стать следствием замедленного тока крови в зоне ее кровоснабжения или в пограничной зоне, особенно если коллатеральное кровоснабжение недостаточно.
Так, эмбол, образовавшийся в ВСА, обычно попадает в глаз или передние две трети полушария мозга, но может попасть в затылочную долю через заднюю соединительную артерию (ЗСоА). Эмболы могут оказываться в более необычных местах (так, при тяжелом поражении позвоночных артерий (ПА) и низком кровотоке в ОА эмбол, образовавшийся в ВСА, может достигнуть ОА через вилизиев круг). Эмбол может оказаться в противоположном полушарии, достигнув последнее через переднюю соединительную артерию (ПСоА). Возможны и другие «экзотические» варианты миграции эмболов. Наконец, ишемический инсульт на стороне закупоренной ВСА может стать следствием замедленного тока крови в зоне ее кровоснабжения или в пограничной зоне, особенно если коллатеральное кровоснабжение недостаточно.
Атеросклеротическое поражение артерий может и не давать явной клинической симптоматики, обусловливая, тем не менее, несомненную опасность развития церебральных ишемических эпизодов в будущем. Согласно этим клиническим особенностям пациентов с атеросклерозом магистральных артерий головы условно делят на симптомных и асимптомных соответственно.
Каротидная эндартерэктомия или медикаментозная профилактика?
Первая успешная эндартерэктомия была выполнена в США в 1953 году. В последующие десятилетия показания к выполнению каротиднеой эндартерэктомии (СЕА) неуклонно расширялись, количество выполняемых операций стремительно росло. К примеру в 1985 году показания для выполнения СЕА в США были следующими:
1. полушарные ТИА
2. преходящая монокулярная слепота
3. вертебробазилярная недостаточность
4. общая гипоперфузия
5. инсульт с минимальным остаточным дефицитом
6. поражение или комбинация поражений, предрасполагающие к инсульту
Последнее показание было, конечно, эвфемизмом для асимптомных каротидных стенозов. Нестенотические, но тяжело изъязвленные бляшки в области каротидной бифуркации как у симптомных, так и у асимптомных больных, многими ведущими хирургами также рассматривались в качестве подходящего показания для хирургического лечения. В то время обследование практически каждого пациента- кандидата на выполнение СЕА включало традиционную ангиографию, но не были выработаны стандарты для измерения процентов сужения ни диаметра.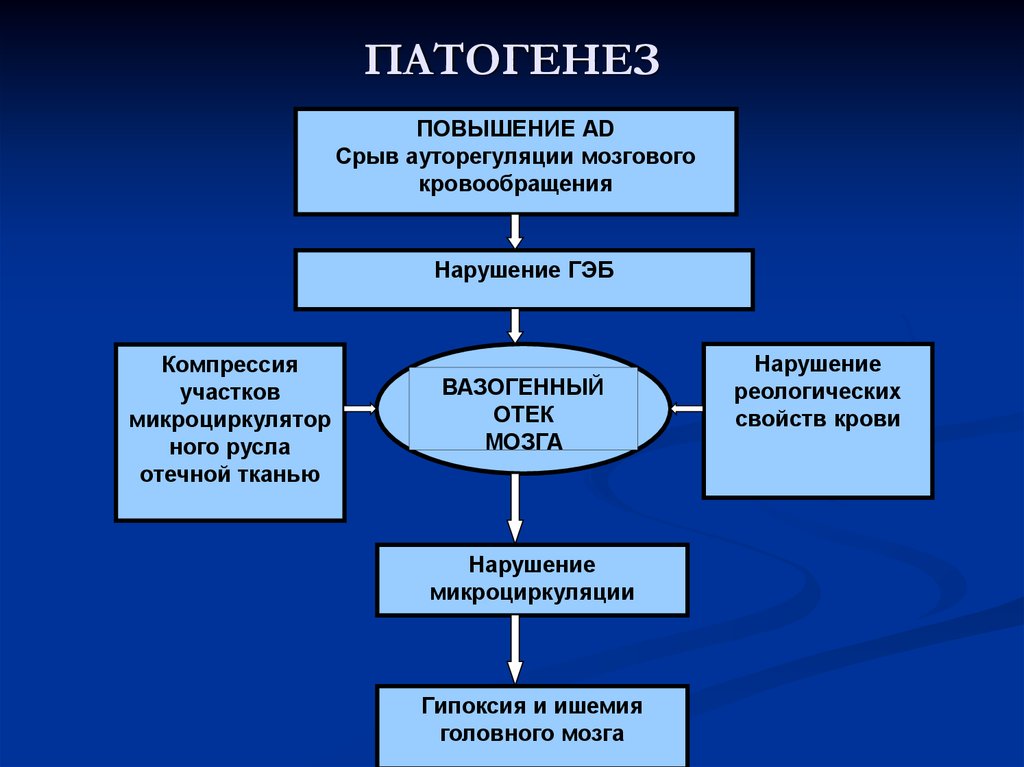 Было широко распространено убеждение, что 50%-ное сужение диаметра приводило к гемодинамически, и, соответственно, клинически значимому эффекту, предрасполагающему к развитию инсульта, таким образом, подлежащему хирургическому удалению. В дополнение, большинство хирургов, если не все, принимали предпосылку, что риск интраоперационной гипотензии в присутствии каротидного стеноза являлся особенно опасной комбинацией. В результате, асимптомное каротидное поражение рассматривалось и профилактически устранялось у пациентов, подлежащих хирургическому вмешательству на сердце или брюшной аорте. С этими показаниями, к 1985 году, СЕА стала наиболее частой операцией на периферических сосудах, выполняемой в США: более 107000 СЕА было выполнено в нефедеральных медицинских центрах в этот год. В 60-х годах прошлого века нейрохирурги НИИ СП им Н. В. Склифосовского активно занимались проблемой диагностики и оперативного лечения стенотических поражений магистральных артерий головы.
Было широко распространено убеждение, что 50%-ное сужение диаметра приводило к гемодинамически, и, соответственно, клинически значимому эффекту, предрасполагающему к развитию инсульта, таким образом, подлежащему хирургическому удалению. В дополнение, большинство хирургов, если не все, принимали предпосылку, что риск интраоперационной гипотензии в присутствии каротидного стеноза являлся особенно опасной комбинацией. В результате, асимптомное каротидное поражение рассматривалось и профилактически устранялось у пациентов, подлежащих хирургическому вмешательству на сердце или брюшной аорте. С этими показаниями, к 1985 году, СЕА стала наиболее частой операцией на периферических сосудах, выполняемой в США: более 107000 СЕА было выполнено в нефедеральных медицинских центрах в этот год. В 60-х годах прошлого века нейрохирурги НИИ СП им Н. В. Склифосовского активно занимались проблемой диагностики и оперативного лечения стенотических поражений магистральных артерий головы.
Это огромное и стойко расширяющееся количество операций не ускользнуло от внимания многих лидирующих неврологов. Стали появляться статьи об эффективности и безопасности каротидных операций вообще и у асимптомных пациентов в частности. Несколько значимых сообщений выявили потенциальные изъяны в презентациях, которые подкрепляли общепринятые показания для СЕА. Важной публикацией по этой теме стал обзор Brott and Thalinger о всех СЕА, выполненных в Cincinnati, Ohio в 1984 году. Они выявили неожиданно высокий уровень операционной заболеваемости и смертности (9,5%) и утверждали, что такие результаты хирургического лечения вероятно являются типичными по всей стране, а если так, то есть ли какое либо преимущество у СЕА вообще? Подобные сомнения привели к дизайну, инициации и в конце-концов выполнению нескольких рандомизированных проспективных клинических исследований, направленных на сравнение результатов СЕА и лучшего на тот момент медикаментозного лечения симптомных и асимптомных пациентов. Семь больших исследований, проведенных в Северной Америке и Европе включили три, посвященных симптомным пациентам и четыре – асимптомным.
Стали появляться статьи об эффективности и безопасности каротидных операций вообще и у асимптомных пациентов в частности. Несколько значимых сообщений выявили потенциальные изъяны в презентациях, которые подкрепляли общепринятые показания для СЕА. Важной публикацией по этой теме стал обзор Brott and Thalinger о всех СЕА, выполненных в Cincinnati, Ohio в 1984 году. Они выявили неожиданно высокий уровень операционной заболеваемости и смертности (9,5%) и утверждали, что такие результаты хирургического лечения вероятно являются типичными по всей стране, а если так, то есть ли какое либо преимущество у СЕА вообще? Подобные сомнения привели к дизайну, инициации и в конце-концов выполнению нескольких рандомизированных проспективных клинических исследований, направленных на сравнение результатов СЕА и лучшего на тот момент медикаментозного лечения симптомных и асимптомных пациентов. Семь больших исследований, проведенных в Северной Америке и Европе включили три, посвященных симптомным пациентам и четыре – асимптомным. Все исследования были мультицентровыми, проспективными и рандомизированными, однако, имели различные критерии включения и исключения пациентов, различные методы измерения степени стеноза и различные методы доклада результатов. Вопреки этим различиям, выявлено стойкое соответствие в важных исходах всех симптомных исследований и трех из четырех асимптомных исследований.
Все исследования были мультицентровыми, проспективными и рандомизированными, однако, имели различные критерии включения и исключения пациентов, различные методы измерения степени стеноза и различные методы доклада результатов. Вопреки этим различиям, выявлено стойкое соответствие в важных исходах всех симптомных исследований и трех из четырех асимптомных исследований.
Сравнению эффективности консервативной и хирургической профилактик ишемического инсульта у больных с симптомными каротидными стенозами посвящены крупные мультицентровые рандомизированные проспективные исследования: North American Symptomatic Carotid Endarterectomy Trial (NASCET) и European Carotid Surgery Trial (ECST) и др. В упомянутых исследованиях сравнивалась эффективность изолированной консервативной профилактики с комбинацией «хирургическая профилактика + консервативная профилактика» у пациентов с различными степенями каротидного стеноза.
Так как количественные показатели повреждения каротидной зоны стали основным фактором отбора пациентов для оперативного лечения, то, прежде чем перейти к краткому описанию исследований и их результатов, очень важно обсудить методы измерения степени стеноза. Американский метод существенно отличается от европейского метода. Американский метод используется с Extracranial Arterial Occlusive Disease Study в 1950-х, продолжал использоваться в Veterans Administration (VA) Asymptomatic Trial, NASCET, and Asymptomatic Carotid Atherosclerosis Trial (ACAS).
Американский метод существенно отличается от европейского метода. Американский метод используется с Extracranial Arterial Occlusive Disease Study в 1950-х, продолжал использоваться в Veterans Administration (VA) Asymptomatic Trial, NASCET, and Asymptomatic Carotid Atherosclerosis Trial (ACAS).
Метод предполагает измерение диаметра просвета в месте наибольшего стеноза (A) при ангиографии и сравнение с диаметром ВСА, дистальнее стеноза, в месте, где стенки ВСА становятся параллельными (B).
степени стеноза по европейской методике предполагает представление гипотетических границ луковицы ВСА, диаметр которой (C) в норме больше просвета ВСА. Степень стеноза вычисляется по формуле:
(1 – A/C)x100
Разница в цифрах одного и того же стеноза наиболее выражена при малых степенях стеноза и становится минимальной при тяжелых стенозах.
Эта разница представлена в таблице:
Рандомизированные исследования, посвященные профилактике ишемического инсульта у симптомных больных.
NASCET
Исследование было задумано с целью проверки гипотезы, согласно которой симптомные пациенты (с полушарными или монокулярными ТИА или предшествующими легкими инсультами) с ипсилатеральным каротидным стенозом (30-99% по методике NASCET) испытают меньше смертельных и несмертельных инсультов после СЕА и медикаментозного лечения, чем пациенты после изолированного медикаментозного лечения. Было запланировано включить в исследование 3000 пациентов и наблюдать их течение 5 лет. Пациенты были разделены на группу тяжелых (70-99%) и умеренных (30-69%) стенозов.
В группе пациентов с тяжелыми стенозами исследование закончилось досрочно: кумулятивный двухлетний риск любого ипсилатерального инсульта в медикаментозной группе составил 26%, а в хирургической группе – 9% (включая периоперационный хирургический риск инсульта). Абсолютное снижение риска составило 17% и относительное снижение риска составило 65%. Риск смертности соответственно в группах составил 12% и 5%. Относительная редукция риска смертности составила 58%.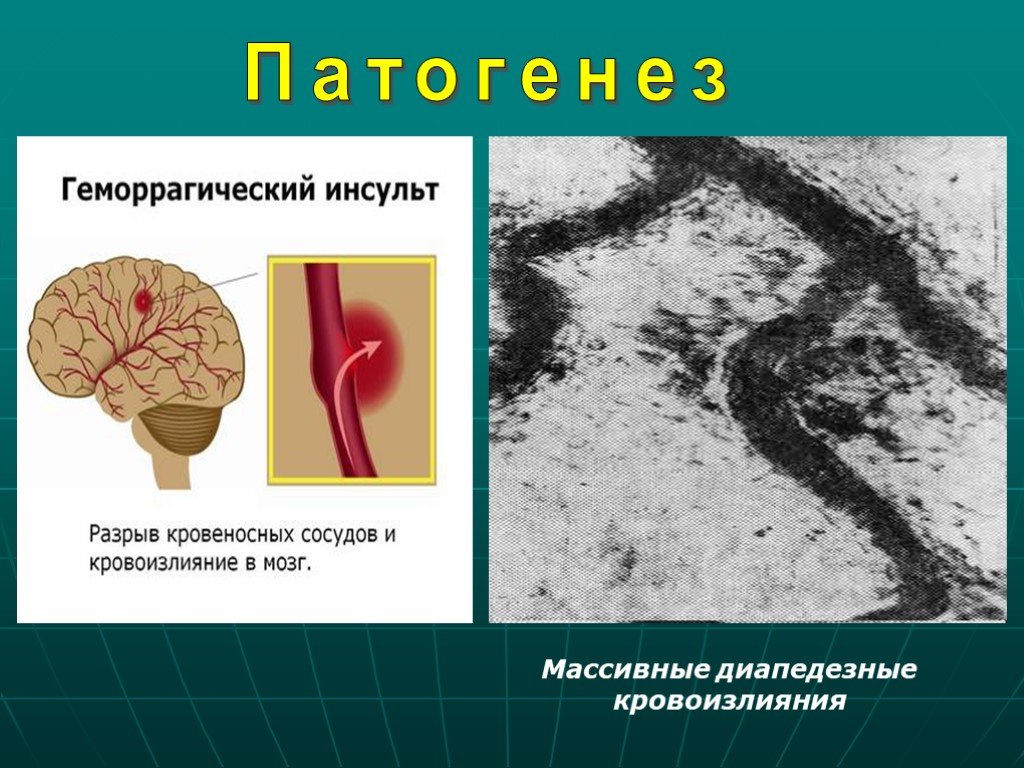
Эффект каротидной эндартерэктомии на уменьшение риска инсульта или смерти по результатам NASCET
Пациенты с умеренными стенозами (50-69%) продемонстрировали небольшое, но статистически значимое преимущество СЕА, в то время как пациенты с малыми стенозами (30-49%) не выявили преимуществ СЕА.
Такое подавляющее преимущество в группе тяжелых стенозов стало возможным благодаря относительному низкому риску операции. Так, 30-дневный показатель «смерть+инсульт» составил 5,8%. Также было отмечено, что риск развития инсульта в медикаментозной группе выше при увеличении степени стеноза на каждые 10% с 70 до 99. затем было отмечено, что ретинальные ТИА имеют менее плачевный прогноз, чем полушарные в медикаментозной контрольной группе. Так вероятность развития инсульта в течение 2-х лет в группе «ретинальных» пациентов составил 17%, а в группе «полушарных» — 44%.
Также было отмечено, что наличие контралатеральной окклюзии значительно ухудшало прогноз пациентов в медикаментозной группе. При двухлетнем наблюдении 54,6% таких пациентов в медикаментозной группе перенесли инсульт или умерли, а в хирургической группе аналогичный показатель составил всего 20%. Пациенты, включенные в исследование с ТИА в анамнезе, но у которых при КТ головного мозга были выявлены инфаркты, демонстрировали повышенный риск развития ипсилатерального инсульта за время наблюдения (26% против 13%). В последующих публикациях исследователи NASCET отметили, что наличие изъязвления бляшки при ангиографии серьезно осложняет прогноз. Так двухлетний риск развития инсульта у «медикаментозных» больных с изъязвленной бляшкой увеличивался с 26,3% до 73,2% при увеличении степени стеноза с 70% до 99%. Интересно, что риск у пациентов без изъязвления составил 21,3% вне зависимости от степени стеноза. Кроме того, операционный риск у пациентов с и без изъязвления значительно не изменялся.
При двухлетнем наблюдении 54,6% таких пациентов в медикаментозной группе перенесли инсульт или умерли, а в хирургической группе аналогичный показатель составил всего 20%. Пациенты, включенные в исследование с ТИА в анамнезе, но у которых при КТ головного мозга были выявлены инфаркты, демонстрировали повышенный риск развития ипсилатерального инсульта за время наблюдения (26% против 13%). В последующих публикациях исследователи NASCET отметили, что наличие изъязвления бляшки при ангиографии серьезно осложняет прогноз. Так двухлетний риск развития инсульта у «медикаментозных» больных с изъязвленной бляшкой увеличивался с 26,3% до 73,2% при увеличении степени стеноза с 70% до 99%. Интересно, что риск у пациентов без изъязвления составил 21,3% вне зависимости от степени стеноза. Кроме того, операционный риск у пациентов с и без изъязвления значительно не изменялся.
В феврале 1998 года исследователи NASCET доложили результаты по категории пациентов с умеренными стенозами. Из доклада стало ясно, что пациентов с 50-69% стенозами предпочтительней подвергать СЕА (по результатам 5-тилетнего наблюдения). Однако, разница, хоть и статистически значимая, не была так драматически велика, как в группе тяжелых стенозов. Кроме того, хирургический риск в этой группе был выше и составил 6,7%.
Однако, разница, хоть и статистически значимая, не была так драматически велика, как в группе тяжелых стенозов. Кроме того, хирургический риск в этой группе был выше и составил 6,7%.
ECST
Начатое в 1981 году, рандомизированное проспективное исследование проводилось под покровительством Medical Research Council of GB. Пациенты были разделены на три категории стенозов: 0-29%, 30-69% и 70-99%, измеренных по европейской методике.
В целом трехлетний риск инсульта у пациентов с тяжелым стенозом (70-99%) составил 21,9% у пациентов, получавших медикаментозную терапию, и 12,3% у пациентов после СЕА. Абсолютное снижение риска инсульта составило 9,6%, а относительное снижение 56%.
Трехлетний риск развития инсульта в группе медикаментозной профилактики у пациентов с тяжелыми каротидными стенозами:
В 1991 году исследователи доложили свои предварительные результаты, совпадающие с американскими. В группе малых стенозов риск развития инсульта был небольшим, и пациентам было рекомендовано медикаментозное лечение. В группе тяжелых стенозов, вопреки 30-тидневному хирургическому риску в 7,5%, отмечалось шестикратное уменьшение риска развития инсульта при применении хирургического метода лечения. Для 778 пациентов, рандомизированных в группе тяжелых стенозов, СЕА практически устранила риск ипсилатерального инсульта в сроки наблюдения. Таблица детализирует средний ежегодный риск ипсилатерального ишемического инсульта, следующего за успешной СЕА.
В группе тяжелых стенозов, вопреки 30-тидневному хирургическому риску в 7,5%, отмечалось шестикратное уменьшение риска развития инсульта при применении хирургического метода лечения. Для 778 пациентов, рандомизированных в группе тяжелых стенозов, СЕА практически устранила риск ипсилатерального инсульта в сроки наблюдения. Таблица детализирует средний ежегодный риск ипсилатерального ишемического инсульта, следующего за успешной СЕА.
В 1996 году европейские исследователи доложили результаты наблюдения за группой с умеренными стенозами. Не выявлено значимого преимущества хирургического метода лечения. Однако, не следует забывать о значимой разнице между методиками измерения степени стеноза между Европой и США.
Таким образом, оба исследования, различаясь в тактических деталях, оказались едины в стратегических выводах: при выраженных симптомных стенозах хирургическая профилактика ишемического инсульта имеет несомненные (р
В NASCET была выявлена четкая связь между количеством факторов риска и показателем поздних инсультов в группе пациентов, леченных консервативно.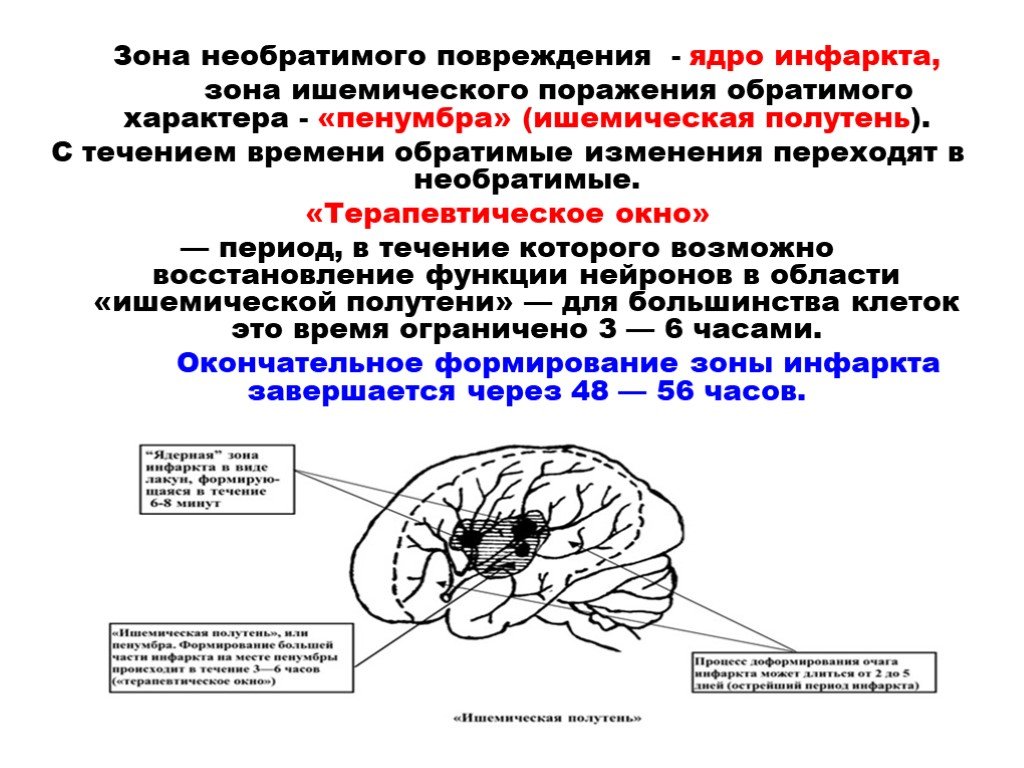 Схожая, но менее выраженная связь была продемонстрирована и при асимптомных артериях.
Схожая, но менее выраженная связь была продемонстрирована и при асимптомных артериях.
ACST
ACST – более современное (и на сегодняшний день самое крупное) рандомизированное исследование, посвященное выбору метода профилактики ишемического инсульта у асимптомных больных. Оно было инициировано и проведено под руководством Medical Research Council и UK Stroke Association. 3120 пациентов с каротидными стенозами ≥60% были рандомизированы в хирургичекую группу (50% СЕА были выполнены в течение 1 месяца, 88% — в течение 1 года) и медикаментозную группу. Средний срок наблюдения составил 3.4 года. Критериями исключения стали: высокий риск хирургического вмешательства, ранее выполненная ипсилатеральная СЕА, подозрение на сердечную эмболию. Пятилетний уровень риска инсульта (включая периоперационный инсульт) составил 6.4% в хирургической группе и 11.8% в медикаментозной группе. Уровень риска фатального или инвалидизирующего инсульта: 3.5% и 6.1% соответственно. Уровень риска фатального инсульта: 2.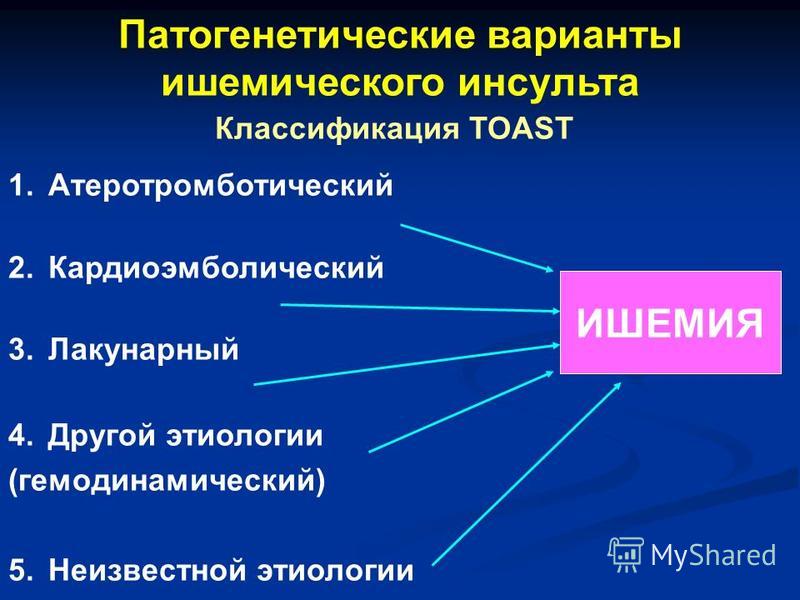 1% и 4.2% соответственно. Выявлено также две особенности: преимущества хирургической профилактики были более выражены у мужчин; не было выявлено статистически значимого преимущества хирургического метода профилактики у пациентов старше 75 лет.
1% и 4.2% соответственно. Выявлено также две особенности: преимущества хирургической профилактики были более выражены у мужчин; не было выявлено статистически значимого преимущества хирургического метода профилактики у пациентов старше 75 лет.
Таким образом, результаты ACAS и ACST выявили значимое (хотя и менее выраженное, чем у симптомных пациентов) преимущество хирургической профилактики у пациентов с асимптомными каротидными стенозами 60-99%.
Характер атеросклеротической бляшки также является значимым фактором: гетерогенные, гипоэхогенные бляшки увеличивают риск развития инсульта у пациента.
Патологическая извитость магистральных артерий головы.
Острая и хроническая недостаточность кровообращения головного мозга может быть обусловлена не только атеросклеротическими стенозами, но и наличием перегибов и петель внутренних сонных и(или) позвоночных артерий.
По данным паталогоанатомических исследований выраженная извитость сонных артерий обнаружена у 30% больных, умерших от ишемического инсульта
1. Извитость сонной или позвоночной артерии с нарушением тока крови и симптомами острого или хронического нарушения мозгового кровообращения в соответствующем сосудистом бассейне считается патологической
Извитость сонной или позвоночной артерии с нарушением тока крови и симптомами острого или хронического нарушения мозгового кровообращения в соответствующем сосудистом бассейне считается патологической
2. Форма удлинения
— Извитость — имеются изгибы артерий C и S-образной формы
— Кинкинг — имеются перегибы удлиненных артерий под острым углом (ангуляция)
— Койлинг – имеется удлинение артерий в виде петель и спиралей.
3. Характеристика изгибов
— Без уменьшения просвета
— С сужением просвета в месте изгиба
— С образованием перегородок
Изменение хода артерии приводит к заметным гидродинамическим и гемодинамическим нарушениям:
1. В изгибе локальное давление крови на срезе артерии минимально на внутренней стенке изгиба, прогрессивно увеличивается и достигает максимума на наружной стенке изгиба артерии.
2. Обратно пропорционально локальному давлению изменяется и локальная скорость потоков крови (минимальная у наружного и максимальная у внутреннего радиуса).
3. За счет разницы давления (у наружного и у внутреннего радиуса) возникают стабильные вторичные потоки поперечной циркуляции крови и встречной, имеющие характер завихрения.
4. Резкое внезапное увеличение давления (особенно при гипертоническом кризе) может приводить к гидродинамической закупорке в области изгиба.
5. Суммарные потери энергии при извитости артерии значительны и, соответственно, увеличиваются при эшелонированных извитостях ( так называемые S или Z-образные извитости ).
Заключение.
Таким образом, на сегодняшний день, каротидная эндартерэктомия показана больные с каротидными стенозами 70-99%.
1. асимптомные больные с каротидными стенозами 60-99%
2. симптомные больные со стенозом внутренней сонной артерии более 50%, извитостью позвоночных артерий, патологической извитостью сонных артерий.
Показания к оперативному лечению патологической извитости брахиоцефальных и позвоночных артерий:
1. ишемический инсульт или ТИА в бассейне извитой артерии;
2. ХНМК при отсутствии эффекта консервативной терапии и снижении качества жизни пациента;
ХНМК при отсутствии эффекта консервативной терапии и снижении качества жизни пациента;
3. асимптомные извитости при наличии очаговых изменений на КТ головного мозга;
4. стеноз > 60% в месте перегиба артерии и петлеобразовании.
5. Перепад скорости кровотока в зоне извитости в 2 и более раза по данным доплерографии.
Показания к проведению операции экстра-интракраниального микроанастомоза (ЭИКМА):
1. Окклюзия сонной артерии с клиникой истощения церебрального перфузионного резерва и декомпенсации коллатерального кровообращения, проявляющейся транзиторными ишемическими атаками в бассейне окклюзированной внутренней сонной артерии.
2. Гемодинамически значимый стеноз средней мозговой артерии и тандемные стенозы.
3. Как первый этап хирургического лечения перед КЭАЭ при окклюзии контрлатеральной сонной аретерии.
Показания для реконструкции позвоночной артерии.
1. Пациентам с симптомами нестабильной гемодинамики в вертебро-базиллярном бассейне:
— При стенозе доминантной позвоночной артерии более 75%.
— При стенозирующем процессе той же степени стеноза обеих позвоночных артерий.
— При сегментарной окклюзии второго сегмента позвоночной артерии при наличии гипоплазии другой .
2. Пациентам с клиникой стволовой дисциркуляции тромбоэмболического генеза, при которой выявлен источник эмболии из позвоночной артерии.
3. При значительно влияющей на вертебральный кровоток экстравазальной компрессии (шейное ребро, аномалия Киммерли, унковертебральный артроз и другие спондилогенные причины).
Методика проведения операции каротидной эндартерэктомии.
На настоящий момент существует два основных метода проведения каротидной эндартерэктомии:
1. Классическая каротидная эндартерэктомия с возможным использованием боковой расширяющей ангиопластики заплатой.
2. Эверзионная каротидная эндартерэктомия.
Использование той или иной методики зачастую зависит от личных пристрастий оперирующего хирурга, но в некоторых условиях каждый из методов имеет свои преимущества и является наиболее предпочтительным в конкретной клинической ситуации.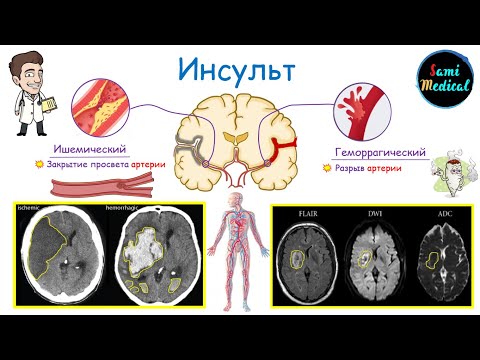
Классическая каротидная эндартерэктомия чаще всего выполняется при:
1. При локализации атеросклеротической бляшки в общей сонной артерии, ее бифуркации и в устье внутренней сонной артерии без пролонгации бляшки на проксимальную и среднюю треть внутренней сонной артерии.
2. В случае достаточного диаметра внутренней сонной артерии (4-5 мм), иначе, без использования расширяющей заплаты высока вероятность возникновения послеоперационного рестеноза внутренней сонной аретрии, что наиболее актуально у женщин.
3. При высоком расположении бифуркации общей сонной артерии.
4. Во время проведения классической каротидной эндартерэктомии не требуется проведение артериолиза по задней поверхности каротидной группы и удаления каротидного тельца, что значительно снижает продолжительность операции и риск повреждения сосудов, находящихся за внутренней и общей сонной артериями – восходящая глоточная и артерия каротидного тельца.
Эверзионная каротидная эндартерэктомия предпочтительна:
1. При наличии сопутствующей патологической извитости внутренне сонной артерии, когда одновременно с каротидной эндартерэктомией возможно выполнить редрессацию внутренней сонной артерии с ее реимплантацией в «прежнее» устье или новое устье на общей сонной артерии.
При наличии сопутствующей патологической извитости внутренне сонной артерии, когда одновременно с каротидной эндартерэктомией возможно выполнить редрессацию внутренней сонной артерии с ее реимплантацией в «прежнее» устье или новое устье на общей сонной артерии.
2. В случае пролонгированной атеросклеротичесокй бляшки, с ее распространением выше устья внутренней сонной артерии.
3. При «узкой» внутренней сонной артерии (диаметр менее 3-4 мм) и высоком риске использования расширяющей боковой заплаты (нагноение заплаты у пациентов с сахарным диабетом).
Условия проведения операции каротидной эндартерэктомии.
Большая часть операций выполняется под многокомпонентным эндотрахеальным наркозом, который значительно повышает устойчивость организма к гипоксии, так же с этой целью используется умеренная контролируемая артериальная гипертензия. После пережатия каротид, артериальное давление поднимается в среднем на 20 мм. Рт. Ст. и равняется приблизительно 140-160/90 мм рт ст.
Системная гепаринизация предохраняет от тромбообразования в пережатых артериях и уменьшает интраоперационную эмболию. Количество гепарина вводится из расчета 100 Ед/кг веса больного.
Количество гепарина вводится из расчета 100 Ед/кг веса больного.
Схема операции классической каротидной эндаретрэктомии.
Положение пациента на спине с поворотом головы в противоположную от операции сторону. Линия разреза проецируется по переднему краю кивательной мышцы, начинается от сосцевидного отростка и заканчивается на 1-2 см дистальнее яремной вырезки.
Рассекается послойно кожа, подкожная фасция, подкожная мышца.
На пути доступа может встретиться наружная яремная вена, которая перевязывается и пересекается. Мобилизируется передний край кивательной мышцы и он отводится латерально ранорасширителем Андерсона-Эдсона. По мере продвижения вглубь раны латеральная бранша ранорасширителя также вводится глубже, однако медиальную браншу не следует углублять и перемещать, что может вызвать повреждение хрящей гортани.
Сразу под кивательной мышцей расположена внутренняя яремная вена с отходящей от нее общей лицевой веной – ключом к бифуркации общей сонной артерии. Общая лицевая вена пересекается и прошивается, после чего внутренняя яремная вена становится мобильной и легко отводится кнаружи. В этот момент необходимо провести системную гепаринизацию и приступить к скелетированию сонных артерий. Легче всего начать с нижнего угла раны, где расположена Общая сонная артерия.
Общая лицевая вена пересекается и прошивается, после чего внутренняя яремная вена становится мобильной и легко отводится кнаружи. В этот момент необходимо провести системную гепаринизацию и приступить к скелетированию сонных артерий. Легче всего начать с нижнего угла раны, где расположена Общая сонная артерия.
Вскрывается влагалище сонной артерии и выполняется диссекция в продольном направлении, что является безопасным. При приближении к бифуркации ОСА необходимо работать препаровальными ножницами в продольном направлении, дабы не воздействовать грубо артериальную стенку и не вызвать интраоперационную микроэмболию с поверхности нестабильной атеросклеротической бляшки. По мере выделения артерий общая сонная, внутренняя сонная, наружная сонная и верхняя щитовидная артерии берутся на держалки из тонкой тесьмы. Визуально определяются границы распространения атеросклеротической бляшки, внутреннюю сонную артерию необходимо скелетировать дистально на 1 см от верхней границы атеросклеротической бляшки.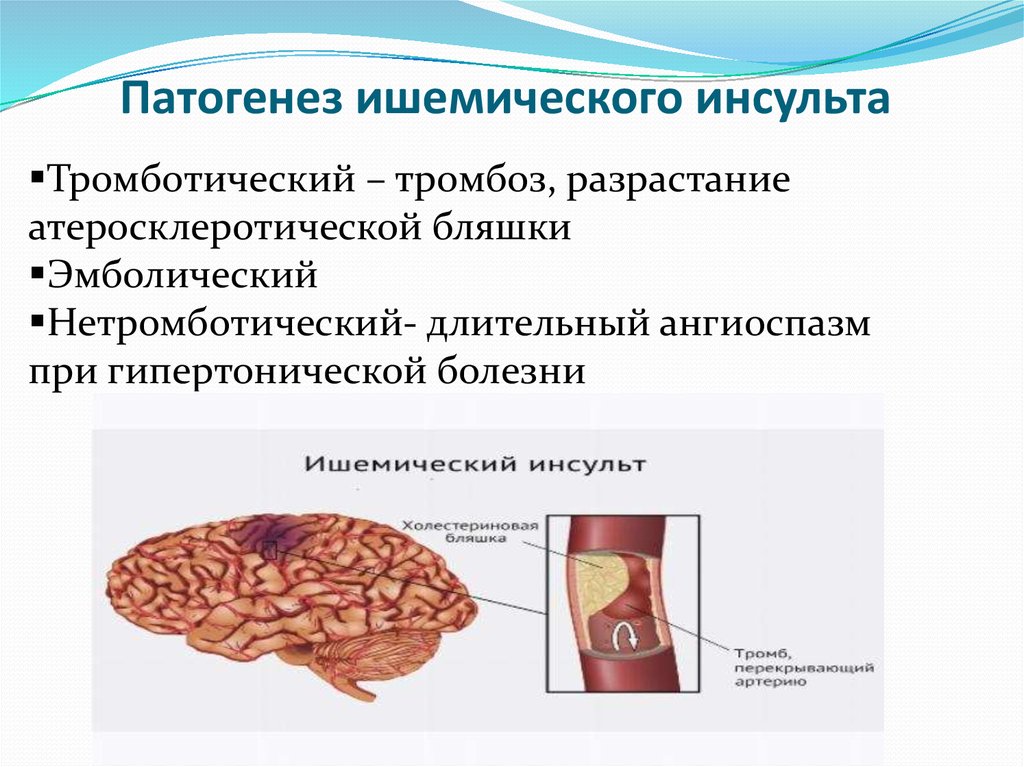
Далее проводится проба с пережатием внутренней наружной и общей сонной артерий, во время которой регистрируется кровоток по гомолатеральной средней мозговой артерии методом транскраниальной допплерографии. Если скорость кровотока на уменьшается более чем на 60% от исходной и не становится менее 20 см/сек, то возможно выполнение операции без временного внутрипросветного шунтирования. В противном случае используется шунт. Последовательно пережимаются верхняя щитовидная, внутренняя сонная, общая сонная и наружная сонная артерии. Проводится линейная артериотомия начиная от общей сонной артерии, в области бифуркации до луковицы внутренней сонной артерии.
Визуализируется атеросклеротическая бляшка, определяются ее границы и она отслаивается от неизмененной артериальной стенки. Последовательно производится ее отделение сначала в проксимальных отделах, из устья верхней щитовидной артерии, из наружно сонной и наконец из внутренней сонной артерии, бляшка в ней «сходит на нет». Удаляются остатки интимы, холестерина и кальция, артерия промывается растворами.
Удаляются остатки интимы, холестерина и кальция, артерия промывается растворами.
После приступают к наложению непрерывного обвивного шва нитью «Пролен 6-0». Во время ушивания внутренней сонной артерии необходимо отступать от края разреза 0.7-1 мм и каждый последующий вкол иглы осуществлять через 1 мм, по мере приближения к общей сонной артерии можно более «грубо захватывать» в шов артериальную стенку, т.к. диаметр общей сонной артерии достаточно велик и рестеноз в этом месте бывает редко.
После того, как артериотомное отверстие практически полностью ушито, необходимо промыть просвет артерии, проверить ретроградный кровоток из внутренней и наружной сонных артерий, ортоградный кровоток из общей сонной артерии, для удаления тромбов и остатков интимы.
Снова накладывают зажимы на артерии и заканчивают сосудистый шов.
Контролируют методом транскраниальной допплерографии скорость кровотока по гомолатеральной средней мозговой артерии. Снимаю зажимы в следующем порядке. Сначала с верхней щитовидной артерии, затем с наружной сонной артерии, далее с общей сонной артерии (возможные тромботические и атероматозные массы попадают в бассейн наружной сонной артерии) и в конце снимают зажим с внутренней сонной артерии.
Сначала с верхней щитовидной артерии, затем с наружной сонной артерии, далее с общей сонной артерии (возможные тромботические и атероматозные массы попадают в бассейн наружной сонной артерии) и в конце снимают зажим с внутренней сонной артерии.
Операцию заканчивают последовательным ушиванием соудистого влагалища, подкожной мышцы и клетчатки, кожи.
Для контроля кровотечения оставляют дренаж Редона в межмышечном пространстве.
Статья подготовлена с использованием материалов методических рекомендаций (№ 44) ДЗ г. Москва 2008
«Хирургическая профилактика нарушений мозгового кровообращения экстракраниального генеза».
Составители В.В. Крылов, Е.И. Гусев, В.Л. Леменев, А.В. Воробьев, О.Ю. Нахабин и др.
Рамка вокруг текста
Почему стоит выбрать именно нас:
- мы предложим самый оптимальный способ лечения;
- у нас есть большой опыт лечения основных нейрохирургических заболеваний;
- у нас вежливый и внимательный персонал;
- получите квалифицированную консультацию по вашей проблеме.

Добро пожаловать в издательство Bentham Science
Journals Impacting Science
Current Neuropharmacology
Импакт-фактор: 7,708
5-летний импакт-фактор: 9,589
Подписаться
Текущая медицинская химия
Импакт-фактор: 4,740
5-летний импакт-фактор: 5,046
Подписаться
Текущая генная терапия
Импакт-фактор: 3,956
5-летний импакт-фактор: 3,492
Подписаться
Предыдущий Следующий
Подробнее >>
Новые журналы
Current Social Sciences
ISSN (для печати): 2772-316X
ISSN (в сети): 2772-3178
Current Probiotics
ISSN: 2666-6502 (в сети)
Foods
ISSN: 2666-8637 (онлайн)
ISSN: 2666-8629 (печать)
Current Forensic Science
ISSN: 2666-4852 (онлайн)
ISSN: 2606-4852 (онлайн)
ISSN: 2666-9498 (онлайн)
ISSN: 2666-948X (печать)
Предыдущая Следующая
Подробнее >>
Новые книги
Расширенное практическое руководство по физической химии
68108-911-9
Передовые методы аналитической химии
eISBN: 978-981-5050-23-3, 2022
ISBN: 978-981-5050-24-0
Достижения в области производственных технологий и технологии производства
eISBN: 978-981-5039-77-1, 2022
ISBN: 978-981-5039-78-8
Предыдущий Следующий
Подробнее >>
Предметы и темы
- Противоинфекционные средства и инфекционные заболевания
- Биохимия
- Биотехнология
- Рак и онкология
- Кардиология и сердечно-сосудистые науки
- Химия
- Клинические испытания и нормативные вопросы
- Компьютерные и информационные науки
- Дизайн лекарств и открытие
- Эндокринология
- Машиностроение
- Пищевая наука и питание и диетология
- Генетика и геномика
- Гематология
- Визуализация
- Иммунология, воспаление и аллергия
- Неврология
- Пульмонология
- Регенеративная медицина
- Стволовые клетки
Последние тенденции
- Тип нити и плотность стежка, подходящие для швов школьной формы Ганы
Статья Пейшенс Данкуа Монни и ее коллег опубликована в журнале Current Materials Science, том 14, выпуск 2, 2021 г.

- Белки SARS-CoV-2: полезны ли они в качестве мишеней для COVID-19Лекарства и вакцины?
Статья Мохаммеда Элимама Ахамеда Мохаммеда и его коллег опубликована в Current Molecular Medicine, Volume 22, Issue 1, 2022
- Быстро меняющийся состав глобальных поставок уличных наркотиков и его влияние на группы высокого риска заражения COVID-19
Статья Тома Брауна и его коллег опубликована в Current Psychopharmacology, Volume 10, Issue 2, 2021
- Механизм действия хлорохина/гидроксихлорохина при инфекции Covid-19
Статья Альберто Боретти и его коллег опубликована в Coronaviruses, Volume 2, Issue 6, 2021
Просмотреть другие статьи
© Издательство Bentham Science Publishers, 2022 | Политика конфиденциальности
Эндотелиальная дисфункция и воспаление при ишемическом инсульте Патогенез
Инсульт является гетерогенным заболеванием и входит в широкую категорию ишемии головного мозга и ее подтипов
существенно различаются по своей этиологии.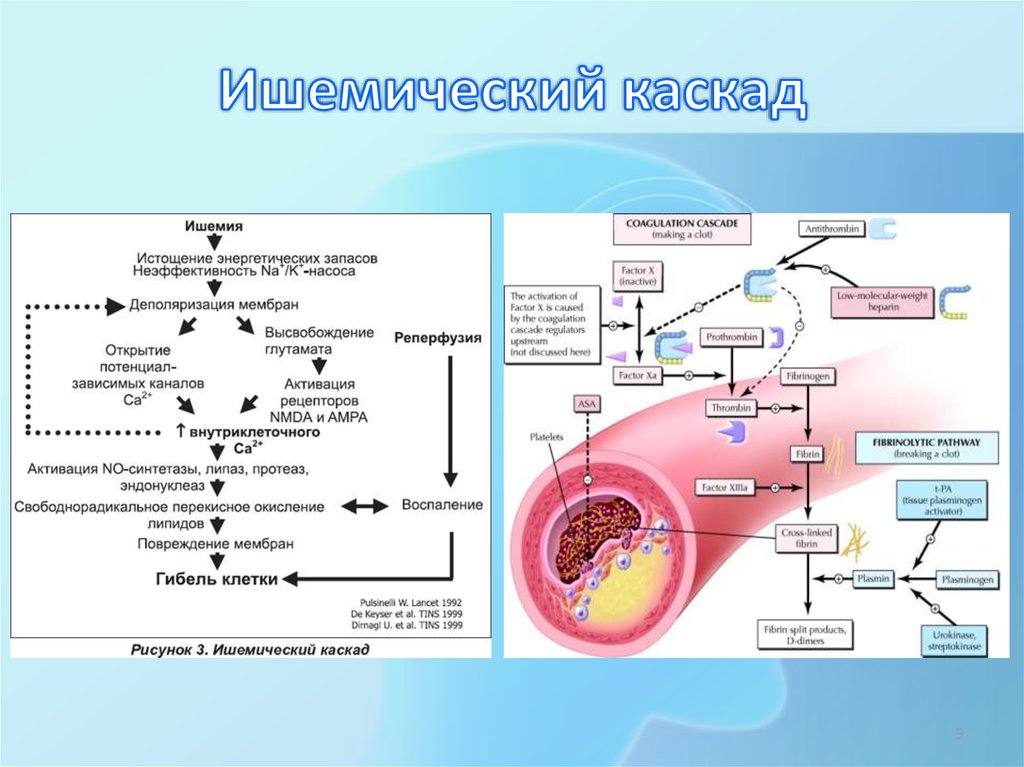
Эндотелий может регулировать сосудистый гомеостаз, модулируя процессы расширения и сужения сосудов. вырабатывая и секретируя цитокины и химические медиаторы, а воспаление представляет собой одну из самых важные факторы, которые способствуют изменению структуры и функции сосудов за счет нарушения регуляции этого тонкого баланса.
Эндотелиальная дисфункция представляет собой основную детерминанту сосудистого повреждения, которая может быть идентифицирована при всех различных заболеваниях. клинические подтипы инсульта, и недавно он был признан интересным детерминантом цереброваскулярной риск. Весь спектр воспалительных процессов, вероятно, действует согласованно, и цитокины играют важную роль. медиаторы инсульта, вызывая иммунологические/воспалительные реакции, которые способствуют прогрессированию инфаркта головного мозга а также тяжести заболевания и исхода.
Результаты недавних исследований, а также текущих и будущих исследований позволят охарактеризовать эти сложные механизмы. лучше и, наконец, приведет к инновационным терапевтическим стратегиям, которые могут изменить естественную историю этого заболевания.
серьезное и инвалидизирующее заболевание.
лучше и, наконец, приведет к инновационным терапевтическим стратегиям, которые могут изменить естественную историю этого заболевания.
серьезное и инвалидизирующее заболевание.
Ключевые слова: Эндотелий, воспаление, ишемия, инсульт, сосуды, цитокины.
[1]
Раджендран П., Ренгараджан Т., Тангавел Дж., и др. Эндотелий сосудов и болезни человека. Международная ассоциация биологических наук, 2013 г.; 9(10): 1057-69.
[http://dx.doi.org/10.7150/ijbs.7502] [PMID: 24250251]
[2]
Park JB, Charbonneau F, Schiffrin EL. Корреляция эндотелиальной функции крупных и мелких артерий при гипертонической болезни человека. Дж. Гипертенс, 2001 г.; 19(3): 415-20.
[http://dx.doi.org/10.1097/00004872-200103000-00009] [PMID: 11288811]
[3]
Шиффрин ЭЛ. Критический обзор роли эндотелиальных факторов в патогенезе артериальной гипертензии. J Cardiovasc Pharmacol 2001; 38 (Приложение 2): S3-6.
[http://dx.doi.org/10.1097/00005344-200111002-00002] [PMID: 11811373]
[4]
Валентийн К.М., Эйкенбум Дж. Тела Вейбеля-Палада: окно в болезнь фон Виллебранда. Дж. Тромб Хемост, 2013 г.; 11(4): 581-92.
[http://dx.doi.org/10.1111/jth.12160] [PMID: 23398618]
[5]
Питер Л. Ридкер Пол М., Мазери А. Воспаление и атеросклероз. Тираж 2002 г.; 105: 1135-43.
[6]
Korantzopoulos P, Letsas KP, Tse G, Fragakis N, Goudis CA, Liu T. Воспаление и мерцательная аритмия: всесторонний обзор. Дж Аритм 2018; 34(4): 394-401.
[http://dx.doi.org/10.1002/joa3.12077] [PMID: 30167010]
[7]
Пинто А., Туттоломондо А., Касуччо А., и др. . Иммуновоспалительные предикторы инсульта при последующем наблюдении у пациентов с хронической неклапанной фибрилляцией предсердий (NVAF) Clin Sci Lond Engl 2009; 116: 781-9.
[8]
Рапарелли В., Пастори Д., Пиньятаро С.Ф., и др. Соавторы исследования ARAPACIS. Основные неблагоприятные сердечно-сосудистые события при неклапанной фибрилляции предсердий с хронической обструктивной болезнью легких: исследование ARAPACIS. Стажер Emerg Med 2018; 13(5): 651-60.
Стажер Emerg Med 2018; 13(5): 651-60.
[http://dx.doi.org/10.1007/s11739-018-1835-9] [PMID: 29582316]
[9]
Gülke E, Gelderblom M, Magnus T. Сигналы опасности при инсульте и их роль на активацию микроглии после ишемии. The Adv Neurol Disord 2018; 11.
[10]
Yang Y, Liu H, Zhang H, и др. st2/il-33-зависимый ответ микроглии ограничивает острую ишемическую травму головного мозга. Дж. Нейроски, 2017 г.; 37(18): 4692-704.
[http://dx.doi.org/10.1523/JNEUROSCI.3233-16.2017] [PMID: 28389473]
[11]
Дэвид С., Кронер А. Репертуар реакций микроглии и макрофагов после травмы спинного мозга. Nat Rev Neurosci 2011; 12(7): 388-99.
[http://dx.doi.org/10.1038/nrn3053] [PMID: 21673720]
[12]
Перего С., Фумагалли С., Де Симони М.-Г. Временная картина экспрессии и колокализация маркеров фенотипа микроглии/макрофагов после ишемического повреждения головного мозга у мышей. J нейровоспаление 2011; 8: 174.
[http://dx.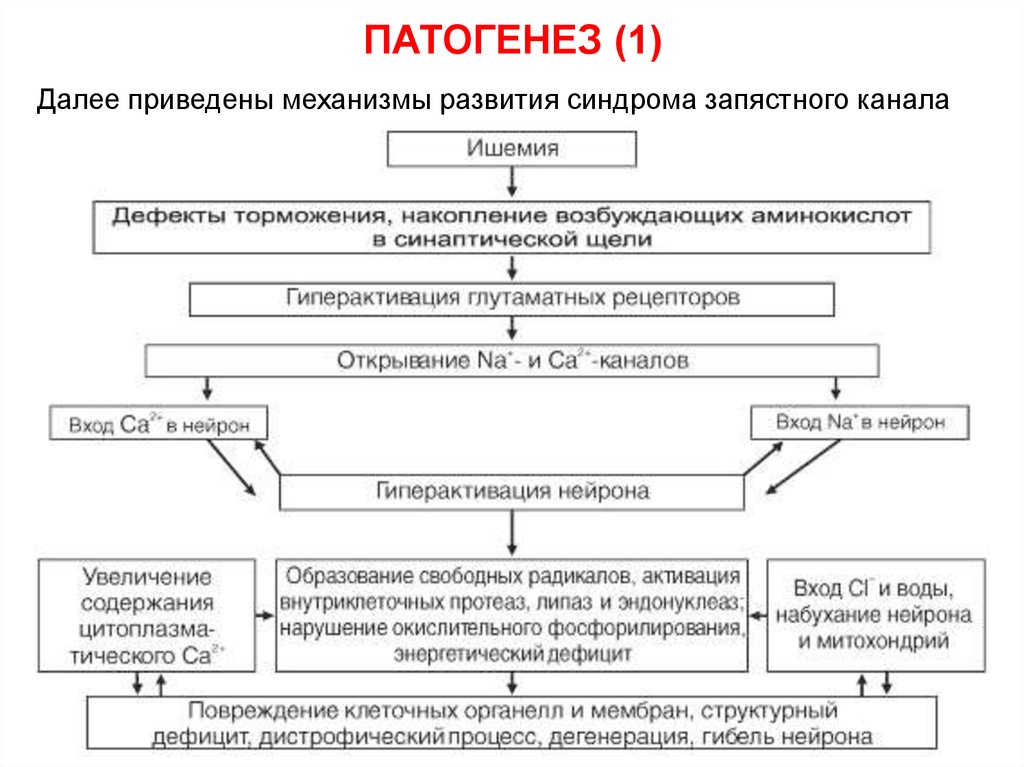 doi.org/10.1186/1742-2094-8-174] [PMID: 22152337]
doi.org/10.1186/1742-2094-8-174] [PMID: 22152337]
[13]
Ludewig P, Sedlacik J, Gelderblom M, et al . Молекула 1 адгезии клеток, родственная карциноэмбриональному антигену, ингибирует опосредованное ММР-9 нарушение гематоэнцефалического барьера в мышиной модели ишемического инсульта. Цирк Рез 2013; 113(8): 1013-22.
[http://dx.doi.org/10.1161/CIRCRESAHA.113.301207] [PMID: 23780386]
[14]
Роселл А., Куадрадо Э., Ортега-Азнар А., Эрнандес-Гильямон М., Ло Э.Х., Монтанер J. MMP-9-положительная нейтрофильная инфильтрация связана с нарушением гематоэнцефалического барьера и деградацией коллагена IV типа базальной мембраны во время геморрагической трансформации после ишемического инсульта у человека. Инсульт 2008; 39(4): 1121-6.
[http://dx.doi.org/10.1161/STROKEAHA.107.500868] [PMID: 18323498]
[15]
Гарсия-Бонилья Л., Мур Дж. М., Ракчуми Г., и др. Индуцируемая синтаза оксида азота в нейтрофилах и эндотелии способствует ишемическому повреждению головного мозга у мышей.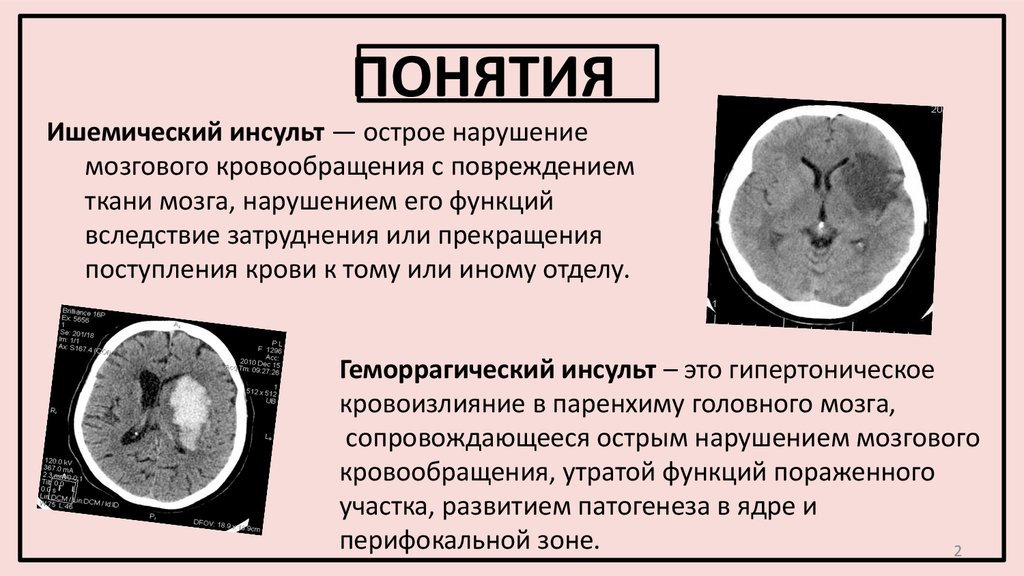 Дж Иммунол 2014; 193(5): 2531-7.
Дж Иммунол 2014; 193(5): 2531-7.
[http://dx.doi.org/10.4049/jimmunol.1400918] [PMID: 25038255]
[16]
Доусон Д.А., Рютцлер К.А., Карлос Т.М., Кочанек П.М., Халленбек Дж.М. Полиморфноядерные лейкоциты и микроциркуляторная перфузия при остром инсульте в SHR. Кейо Дж. Мед, 1996; 45(3): 248-52.
[http://dx.doi.org/10.2302/kjm.45.248] [PMID: 8897768]
[17]
Куартеро М.И., Бальестерос I, Морага А., и др. Нейтрофилы N2, новые участники воспаления головного мозга после инсульта: модуляция агонистом PPARγ розиглитазоном. Инсульт 2013; 44(12): 3498-508.
[http://dx.doi.org/10.1161/STROKEAHA.113.002470]. к постишемическому повреждению головного мозга, способствуя активации нейтрофилов через CSF3. Дж. Нейроски, 2015 г.; 35(44): 14783-93.
[http://dx.doi.org/10.1523/JNEUROSCI.2980-15.2015] [PMID: 26538649]
[19]
Shichita T, Sugiyama Y, Ooboshi H, et al. Ключевая роль церебральных интерлейкин-17-продуцирующих клеток gammadeltaT в отсроченной фазе ишемического повреждения головного мозга. Нацмед 2009; 15(8): 946-50.
Нацмед 2009; 15(8): 946-50.
[http://dx.doi.org/10.1038/nm.1999] [PMID: 19648929]
[20]
Gelderblom M, Weymar A, Bernreuther C, et al. Нейтрализация оси IL-17 уменьшает инвазию нейтрофилов и защищает от ишемического инсульта. Кровь 2012; 120(18): 3793-802.
[http://dx.doi.org/10.1182/blood-2012-02-412726] [PMID: 22976954]
[21]
Liesz A, Zhou W, Mracskó É, et al. Ингибирование переноса лимфоцитов защищает мозг от вредного нейровоспаления после инсульта. Мозг 2011; 134 (часть 3): 704-20.
[http://dx.doi.org/10.1093/brain/awr008] [PMID: 21354973]
[22]
Сакагучи С., Мияра М., Константино С.М., Хафлер Д.А. Регуляторные Т-клетки FOXP3+ в иммунной системе человека. Nat Rev Immunol 2010; 10(7): 490-500.
[http://dx.doi.org/10.1038/nri2785] [PMID: 20559327]
[23]
Liesz A, Suri-Payer E, Veltkamp C, et al. Регуляторные Т-клетки являются ключевыми церебропротективными иммуномодуляторами при остром экспериментальном инсульте. Нацмед 2009; 15(2): 192-9.
Нацмед 2009; 15(2): 192-9.
[http://dx.doi.org/10.1038/nm.1927] [PMID: 19169263]
[24]
Liesz A, Zhou W, Na S-Y, et al. Повышение уровня регуляторных Т-клеток ограничивает нейровоспаление при необратимом кортикальном инсульте. Дж. Нейроски, 2013 г.; 33(44): 17350-62.
[http://dx.doi.org/10.1523/JNEUROSCI.4901-12.2013] [PMID: 24174668]
[25]
Ito M, Komai K, Mise-Omata S, et al. Регуляторные Т-клетки головного мозга подавляют астроглиоз и потенцируют неврологическое восстановление. Природа 2019; 565 (7738): 246-50.
[http://dx.doi.org/10.1038/s41586-018-0824-5] [PMID: 30602786]
[26]
Xu X, Li M, Jiang Y. Парадоксальная роль регуляторных Т-клеток при ишемическом инсульте. журнал ScientificWorldJournal 2013; 2013: 174373.
[http://dx.doi.org/10.1155/2013/174373] [PMID: 24288462]
[27]
Туттоломондо А., Пекораро Р., Касуччо А., и др. Периферическая частота CD4+ CD28- клеток при остром ишемическом инсульте: взаимосвязь с маркерами подтипа и тяжести инсульта.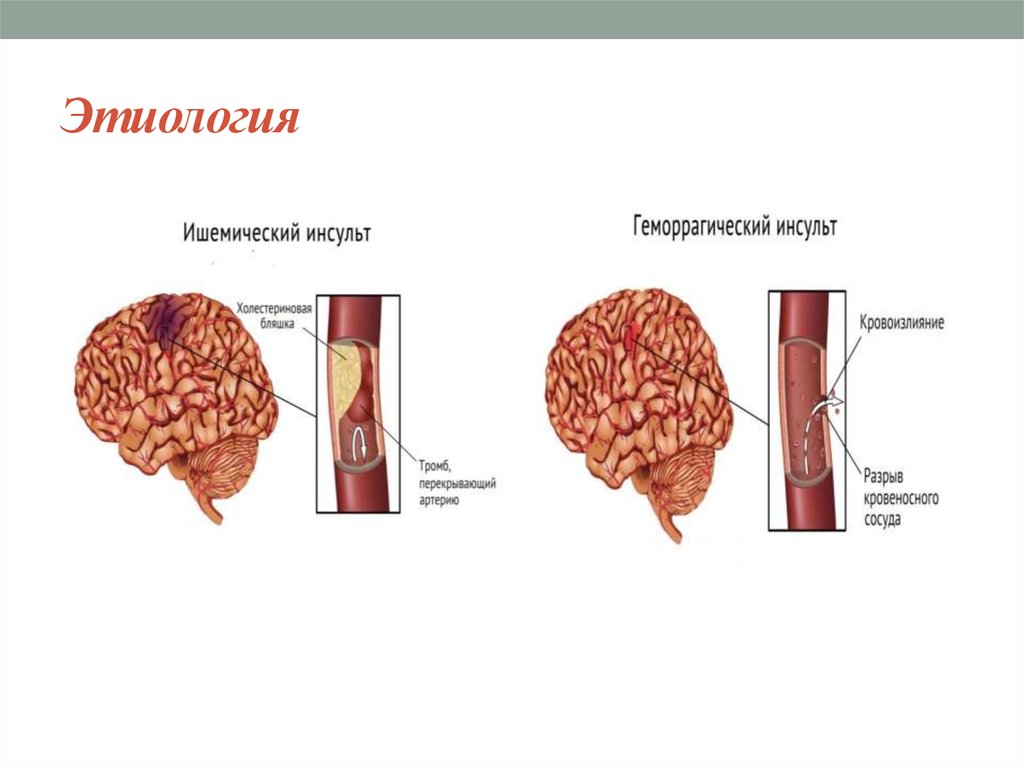 Медицина (Балтимор) 2015; 94(20): e813.
Медицина (Балтимор) 2015; 94(20): e813.
[http://dx.doi.org/10.1097/MD.0000000000000813] [PMID: 25997053]
[28]
Winek K, Engel O, Koduah P, et al. Истощение культивируемой кишечной микробиоты в результате предварительного лечения антибиотиками широкого спектра действия ухудшает исход после инсульта у мышей. Инсульт 2016; 47(5): 1354-63.
[http://dx.doi.org/10.1161/STROKEAHA.115.011800] [PMID: 27056982]
[29]
Benakis C, Brea D, Caballero S, et al. Комменсальная микробиота влияет на исход ишемического инсульта, регулируя кишечные γδ Т-клетки. Нацмед 2016; 22(5): 516-23.
[http://dx.doi.org/10.1038/nm.4068] [PMID: 27019327]
[30]
Ямаширо К., Танака Р., Урабе Т., и др. Дисбактериоз кишечника связан с нарушением обмена веществ и системным воспалением у пациентов с ишемическим инсультом. ПЛоС Один 2017; 12(2): e0171521.
[http://dx.doi.org/10.1371/journal.pone.0171521] [PMID: 28166278]
[31]
Yin J, Liao S-X, He Y, и др. Дисбиоз кишечной микробиоты со сниженным уровнем триметиламин-н-оксида у больных с атеросклеротическим инсультом крупных артерий или транзиторной ишемической атакой. Ассоциация J Am Heart 2015; 4(11): e002699.
Дисбиоз кишечной микробиоты со сниженным уровнем триметиламин-н-оксида у больных с атеросклеротическим инсультом крупных артерий или транзиторной ишемической атакой. Ассоциация J Am Heart 2015; 4(11): e002699.
[http://dx.doi.org/10.1161/JAHA.115.002699] [PMID: 26597155]
[32]
Ji W, Zhu Y, Kan P, et al. Анализ кишечных микробных сообществ больных инфарктом и ишемией головного мозга на основе технологии высокопроизводительного секвенирования и анализа метаболизма глюкозы и липидов. Мол Мед Реп 2017; 16(4): 5413-7.
[http://dx.doi.org/10.3892/mmr.2017.7227] [PMID: 28849032]
[33]
Vamanu E. Дополнительная функциональная стратегия для модуляции микробиоты кишечника человека. Курр Фарм Дез 2018; 24(35): 4144-9.http://www.eurekaselect.com/165801/article
[34]
Yu E, Hsu H-Y, Huang C-Y, Hwang LC. Воспалительные биомаркеры и риск атеросклеротических сердечно-сосудистых заболеваний. Open Med (Войны) 2018; 13: 208-13.
[http://dx.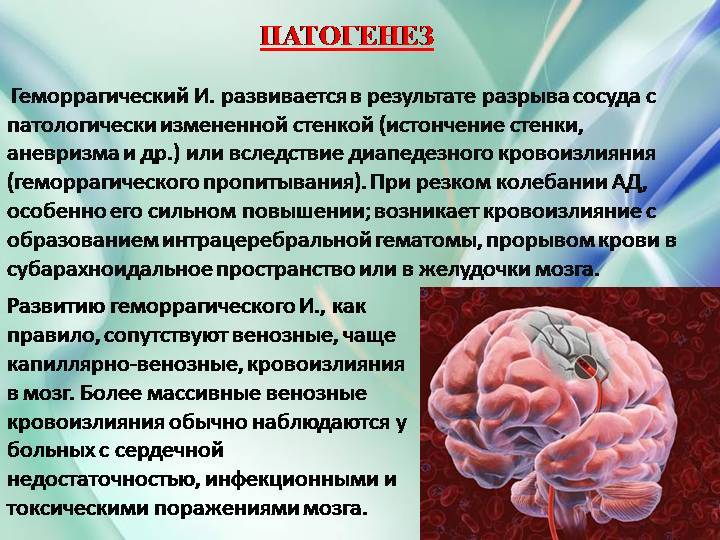 doi.org/10.1515/med-2018-0032] [PMID: 29845121]
doi.org/10.1515/med-2018-0032] [PMID: 29845121]
[35]
Шривастава А.К., Сингх Х.В., Райзада А., Сингх С.К. С-реактивный белок, воспаление и ишемическая болезнь сердца. Сердце Египта J 2015; 67: 89-97.
[http://dx.doi.org/10.1016/j.ehj.2014.11.005]
[36]
Kamath DY, Xavier D, Sigamani A, Pais P. Высокочувствительный креативный белок (hsCRP) и сердечно-сосудистые заболевания Болезнь: индийский взгляд. Индийская J Med Res 2015; 142(3): 261-8.
[http://dx.doi.org/10.4103/0971-5916.166582] [PMID: 26458341]
[37]
Ladenvall C, Jood K, Blomstrand C, Nilsson S, Jern C, Ladenvall P. Концентрация С-реактивного белка в сыворотке и генотип в зависимости от подтипа ишемического инсульта. Инсульт 2006; 37(8): 2018-23.
[http://dx.doi.org/10.1161/01.STR.0000231872.86071.68] [PMID: 16809555]
[38]
Piccardi B, Giralt D, Bustamante A, et al. Маркеры воспаления и эндотелиальной дисфункции крови при кардиоэмболическом инсульте: систематический обзор и метаанализ Biomark Biochem Indic Expo Response Susceptibility Chem 22: 200-9.
[http://dx.doi.org/10.1080/1354750X.2017.1286689]
[39]
Kuhlmann CRW, Librizzi L, Closhen D, et al. Механизмы нарушения гематоэнцефалического барьера, вызванного креативным белком. Инсульт 2009; 40(4): 1458-66.
[http://dx.doi.org/10.1161/STROKEAHA.108.535930] [PMID: 19246692]
[40]
Welsh P, Barber M, Langhorne P, Rumley A, Lowe GDO, Stott DJ. Ассоциации воспалительных и гемостатических биомаркеров с неблагоприятным исходом острого ишемического инсульта. Цереброваскулярная дис 2009; 27(3): 247-53.
[http://dx.doi.org/10.1159/000196823] [PMID: 19176958]
[41]
Idicula TT, Brogger J, Naess H, Waje-Andreassen U, Thomassen L. Прием С-реактивного белка после острого ишемического инсульта связана с тяжестью инсульта и смертностью: «Исследование инсульта в Бергене». БМК Нейрол 2009; 9: 18.
[http://dx.doi.org/10.1186/1471-2377-9-18] [PMID: 19400931]
[42]
Мацуо Р., Аго Т., Хата Дж., и др. . Исследователи регистра инсультов в Фукуоке. С-реактивный белок плазмы и клинические исходы после острого ишемического инсульта: проспективное обсервационное исследование. ПЛоС Один 2016; 11(6): e0156790.
Исследователи регистра инсультов в Фукуоке. С-реактивный белок плазмы и клинические исходы после острого ишемического инсульта: проспективное обсервационное исследование. ПЛоС Один 2016; 11(6): e0156790.
[http://dx.doi.org/10.1371/journal.pone.0156790] [PMID: 27258004]
[43]
Liu T, Clark RK, McDonnell PC, et al. Экспрессия фактора некроза опухоли-альфа в ишемизированных нейронах. Инсульт 1994 г.; 25(7): 1481-8.
[http://dx.doi.org/10.1161/01.STR.25.7.1481] [PMID: 8023366]
[44]
Розенберг Г.А., Эстрада Э.Ю., Денкофф Дж.Э., Стетлер-Стивенсон В.Г. Желатиназа В, индуцированная фактором некроза опухоли-альфа, вызывает замедленное открытие гематоэнцефалического барьера: расширенное терапевтическое окно. Мозг Res 1995; 703 (1-2): 151-5.
[http://dx.doi.org/10.1016/0006-8993(95)01089-0] [PMID: 8719627]
[45]
Розенберг Г.А., Навратил М., Бароне Ф., Фейерштейн Г. Протеолитический каскад повышение ферментов при очаговой ишемии головного мозга у крыс. J Cereb Blood Flow Metab 1996; 16(3): 360-6.
J Cereb Blood Flow Metab 1996; 16(3): 360-6.
[http://dx.doi.org/10.1097/00004647-199605000-00002] [PMID: 8621740]
[46]
Selmaj KW, Raine CS. Фактор некроза опухоли опосредует повреждение миелина и олигодендроцитов in vitro. Энн Нейрол 1988; 23(4): 339-46.
[http://dx.doi.org/10.1002/ana.410230405] [PMID: 3132891]
[47]
Selmaj KW, Farooq M, Norton WT, Raine CS, Brosnan CF. Пролиферация астроцитов in vitro в ответ на цитокины. Основная роль фактора некроза опухоли. Дж. Иммунол 1990; 144(1): 129-35.
[PMID: 2104886]
[48]
Stellwagen D, Beattie EC, Seo JY, Malenka RC. Дифференциальная регуляция транспорта рецепторов AMPA и GABA с помощью фактора некроза опухоли-альфа. Дж. Нейроски, 2005 г.; 25(12): 3219-28.
[http://dx.doi.org/10.1523/JNEUROSCI.4486-04.2005] [PMID: 15788779]
[49]
Weber C, Erl W, Pietsch A, Ströbel M, Ziegler-Heitbrock HW, Weber ПК. Антиоксиданты ингибируют адгезию моноцитов, подавляя мобилизацию ядерного фактора каппа В и индукцию молекулы адгезии сосудистых клеток-1 в эндотелиальных клетках, стимулированных к образованию радикалов. Артериосклеротический тромб 1994; 14(10): 1665-73.
Артериосклеротический тромб 1994; 14(10): 1665-73.
[http://dx.doi.org/10.1161/01.ATV.14.10.1665] [PMID: 7522548]
[50]
Barone FC, Arvin B, White RF, и др. Фактор некроза опухоли-альфа. Медиатор очагового ишемического поражения головного мозга. Инсульт 1997 г.; 28(6): 1233-44.
[http://dx.doi.org/10.1161/01.STR.28.6.1233] [PMID: 9183357]
[51]
Tuttolomondo A, Di Sciacca R, Di Raimondo D, et al. Уровни воспалительных и тромботических/фибринолитических маркеров в плазме крови при остром ишемическом инсульте: взаимосвязь с подтипом TOAST, исходом и местом инфаркта. J Нейроиммунол 2009; 215(1-2): 84-9.
[http://dx.doi.org/10.1016/j.jneuroim.2009.06.019] [PMID: 19695716]
[52]
Ridker PM, Everett BM, Pradhan A, et al. Исследователи CIRT Низкие дозы метотрексата для профилактики атеросклеротических явлений. N Engl J Med 2019; 380(8): 752-62.
[http://dx.doi.org/10.1056/NEJMoa1809798] [PMID: 30415610]
[53]
Tardif J-C, Kouz S, Waters DD, et al. Эффективность и безопасность низких доз колхицина после инфаркта миокарда. N Engl J Med 2019; 381(26): 2497-505.
Эффективность и безопасность низких доз колхицина после инфаркта миокарда. N Engl J Med 2019; 381(26): 2497-505.
[http://dx.doi.org/10.1056/NEJMoa1912388] [PMID: 31733140]
[54]
Ridker PM, Everett BM, Thuren T, et al. CANTOS Trial Group Противовоспалительная терапия канакинумабом при атеросклеротическом заболевании. N Engl J Med 2017; 377(12): 1119-31.
[http://dx.doi.org/10.1056/NEJMoa1707914] [PMID: 28845751]
[55]
Tobinick E, Kim NM, Reyzin G, Rodriguez-Romanacce H, DePuy V. Избирательное ингибирование TNF при хронических инсульт и черепно-мозговая травма: обсервационное исследование с участием 629последовательных пациентов, получавших периспинальный этанерцепт. Препараты ЦНС 2012; 26(12): 1051-70.
[http://dx.doi.org/10.1007/s40263-012-0013-2] [PMID: 23100196]
[56]
Sumbria RK, Boado RJ, Pardridge WM. Защита мозга от инсульта с помощью внутривенного слитого белка рецептор-приманка TNFα и троянский конь. J Cereb Blood Flow Metab 2012; 32(10): 1933-8.
J Cereb Blood Flow Metab 2012; 32(10): 1933-8.
[http://dx.doi.org/10.1038/jcbfm.2012.97] [PMID: 22714051]
[57]
Smith CJ, Hulme S, Vail A, et al. SCIL-STROKE (подкожный антагонист рецептора интерлейкина-1 при ишемическом инсульте): рандомизированное контролируемое исследование фазы 2. Инсульт 2018; 49(5): 1210-6.
[http://dx.doi.org/10.1161/STROKEAHA.118.020750] [PMID: 29567761]
[58]
Elrayess MA, Webb KE, Flavell DM, et al. Новый функциональный полиморфизм гена PECAM-1 (53G>A) связан с прогрессированием атеросклероза в исследованиях LOCAT и REGRESS. Атеросклероз 2003; 168(1): 131-8.
[http://dx.doi.org/10.1016/S0021-9150(03)00089-3] [PMID: 12732396]
[59]
Эльрайесс М.А., Талмуд П.Дж. Молекула адгезии эндотелиальных клеток тромбоцитов-1 (PECAM-1) и ишемическая болезнь сердца. Indian J Med Res 2005; 121(2): 77-9.
[PMID: 15756038]
[60]
Вэй Ю-С, Лан Ю, Лю Ю-Г, Мэн Л-К, Сюй К-К, Се Х-Ю. Полиморфизм гена молекулы адгезии тромбоцитарно-эндотелиальных клеток-1 и его растворимый уровень связаны с ишемическим инсультом. ДНК-клеточная биология, 2009 г.; 28(3): 151-8.
Полиморфизм гена молекулы адгезии тромбоцитарно-эндотелиальных клеток-1 и его растворимый уровень связаны с ишемическим инсультом. ДНК-клеточная биология, 2009 г.; 28(3): 151-8.
[http://dx.doi.org/10.1089/dna.2008.0817] [PMID: 19183069]
[61]
Castellanos M, Castillo J, García MM, et al. Опосредованное воспалением повреждение при прогрессирующих лакунарных инфарктах: потенциальная терапевтическая цель. Инсульт 2002; 33(4): 982-7.
[http://dx.doi.org/10.1161/hs0402.105339] [PMID: 11935048]
[62]
Wiseman S, Marlborough F, Doubal F, Webb DJ, Wardlaw J. Маркеры свертывания крови, фибринолиз, эндотелиальная дисфункция и воспаление при лакунарном инсульте по сравнению с нелакунарным инсультом: систематический обзор и метаанализ. Цереброваск Дис 2014; 37(1): 64-75.
[http://dx.doi.org/10.1159/000356789] [PMID: 24401164]
[63]
Арба Ф., Джаннини А., Пиккарди Б., и др. Заболевание мелких сосудов и биомаркеры эндотелиальной дисфункции после ишемического инсульта.2008/28/3.png) Европейский удар J 2019; 4(2): 119-26.
Европейский удар J 2019; 4(2): 119-26.
[http://dx.doi.org/10.1177/2396987318805905] [PMID: 31259260]
[64]
Bongers TN, de Maat MPM, van Goor M-LPJ, и др. Высокие уровни фактора фон Виллебранда увеличивают риск первого ишемического инсульта: влияние ADAMTS13, воспаление и генетическая изменчивость. Инсульт 2006; 37(11): 2672-7.
[http://dx.doi.org/10.1161/01.STR.0000244767.39962.f7] [PMID: 169
]
[65]
Hanson E, Jood K, Karlsson S, Nilsson S, Blomstrand C, Jern C. Плазменные уровни фактора фон Виллебранда в этиологических подтипах ишемического инсульта. Дж. Тромб Хемост, 2011 г.; 9(2): 275-81.
[http://dx.doi.org/10.1111/j.1538-7836.2010.04134.x] [PMID: 21054779]
[66]
Oz F, Elitok A, Bilge AK, Mercanoglu F, Oflaz H Взаимосвязь между опосредованной кровотоком дилатацией плечевой артерии, толщиной комплекса интима-медиа сонных артерий и резервом коронарного кровотока у пациентов с ишемической болезнью сердца. Кардиол Рез 2012; 3(5): 214-21.
Кардиол Рез 2012; 3(5): 214-21.
[http://dx.doi.org/10.4021/cr219w] [PMID: 28348690]
[67]
Halcox JPJ, Donald AE, Ellins E, et al. Функция эндотелия предсказывает прогрессирование толщины комплекса интима-медиа сонных артерий. Тираж 2009 г.; 119(7): 1005-12.
[http://dx.doi.org/10.1161/CIRCULATIONAHA.108.765701] [PMID: 19204308]
[68]
Yeboah J, Crouse JR, Bluemke DA, et al. Эндотелиальная дисфункция связана с образованием левого желудочка (по оценке с помощью МРТ) у взрослых (MESA). Дж. Хам Гипертенс, 2011 г.; 25(1): 25-31.
[http://dx.doi.org/10.1038/jhh.2010.25] [PMID: 20237502]
[69]
Санчети С., Шах П., Пхалгун Д.С. Корреляция эндотелиальной дисфункции, измеренной по вазодилатации, опосредованной потоком, с тяжестью ишемической болезни сердца. Индийское сердце J 2018; 70(5): 622-6.
[http://dx.doi.org/10.1016/j.ihj.2018.01.008] [PMID: 30392498]
[70]
Green DJ, Jones H, Thijssen D, Cable NT, Atkinson G. Flowmediated дилатация и предсказание сердечно-сосудистых событий: имеет ли значение оксид азота? Гипертенс Даллас Текс 2011; 57: 363-9.
Flowmediated дилатация и предсказание сердечно-сосудистых событий: имеет ли значение оксид азота? Гипертенс Даллас Текс 2011; 57: 363-9.
[http://dx.doi.org/10.1161/HYPERTENSIONAHA.110.167015]
[71]
Инаба Ю., Чен Дж.А., Бергманн С.Р. Прогнозирование будущих сердечно-сосудистых исходов с помощью опосредованной потоком вазодилатации плечевой артерии: метаанализ. Int J Cardiovasc Imaging 2010; 26(6): 631-40.
[http://dx.doi.org/10.1007/s10554-010-9616-1] [PMID: 20339920]
[72]
Сантос-Гарсия Д., Бланко М., Серена Дж., и др. Расширение плечевого артериального потока при остром ишемическом инсульте. Евро Джей Нейрол 2009; 16(6): 684-90.
[http://dx.doi.org/10.1111/j.1468-1331.2009.02564.x] [PMID: 19236459]
[73]
Сантос-Гарсия Д., Бланко М., Серена Дж., Родригес-Яньес М., Лейра Р., Кастильо Дж. Нарушенная дилатация плечевого потока, опосредованная потоком, является предиктором нового сосудистого события после инсульта. Цереброваск Дис 2011; 32(2): 155-62.
Цереброваск Дис 2011; 32(2): 155-62.
[http://dx.doi.org/10.1159/000328651] [PMID: 21778713]
[74]
Рубинштейн Р., Кувин Дж.Т., Соффлер М., и др. Оценка функции эндотелия с помощью неинвазивной тонометрии периферических артерий позволяет прогнозировать поздние сердечно-сосудистые нежелательные явления. Европейское сердце J 2010; 31(9): 1142-8.
[http://dx.doi.org/10.1093/eurheartj/ehq010] [PMID: 20181680]
[75]
Tuttolomondo A, Casuccio A, Della Corte V, et al. Функция эндотелия и индексы жесткости артерий у пациентов с острым ишемическим инсультом: связь с подтипом TOAST. Атеросклероз 2017; 256: 94-9.
[http://dx.doi.org/10.1016/j.atherosclerosis.2016.10.044] [PMID: 27817840]
[76]
Bellien J, Favre J, Iacob M, et al. Жесткость артерий регулируется оксидом азота и эндотелиальным гиперполяризующим фактором во время изменений кровотока у человека. Гипертония 2010; 55(3): 674-80.
[http://dx.2008/41/3.png) doi.org/10.1161/HYPERTENSIONAHA.109.142190] [PMID: 20083732]
doi.org/10.1161/HYPERTENSIONAHA.109.142190] [PMID: 20083732]
[77]
Mancia G, Laurent S, Agabiti-Rosei E, et al. Европейское общество гипертонии. Переоценка европейских рекомендаций по лечению гипертензии: документ Целевой группы Европейского общества гипертонии. Дж. Гипертенс, 2009 г.; 27(11): 2121-58.
[http://dx.doi.org/10.1097/HJH.0b013e328333146d] [PMID: 19838131]
[78]
Бонарджи ВВС. Доступные методы и клиническое применение. артериальная жесткость: прогностический маркер ишемической болезни сердца. Front Cardiovasc Med 2018; 5: 64,
[http://dx.doi.org/10.3389/fcvm.2018.00064] [PMID: 29951487]
[79]
Scandale G, Dimitrov G, Recchia M, et al. Артериальная жесткость и 5-летняя смертность у пациентов с заболеванием периферических артерий. J Hum Hypertens 2019; 34: 505-44.
[http://dx.doi.org/10.1038/s41371-019-0254-3] [PMID: 31548619]
[80]
Туттоломондо А., Ди Раймондо Д., Ди Шакка Р. , и др. Артериальная жесткость и ишемический инсульт у пациентов с метаболическим синдромом и без него. Атеросклероз 2012; 225(1): 216-9.
, и др. Артериальная жесткость и ишемический инсульт у пациентов с метаболическим синдромом и без него. Атеросклероз 2012; 225(1): 216-9.
[http://dx.doi.org/10.1016/j.atherosclerosis.2012.08.027] [PMID: 23031362]
[81]
Dimitriadis K, Tsioufis C, Kasiakogias A, et al. Жесткость артерий является независимым предиктором инсульта у пациентов с эссенциальной гипертензией: данные 8-летнего исследования в Греции. Дж Гипертенс 2017; 36.
[82]
Таддей С., Бруно Р.М. Эндотелиальная дисфункция при артериальной гипертензии: достижения и открытые вопросы. Дж Гипертенс 2016; 34(8): 1492-3.
[http://dx.doi.org/10.1097/HJH.0000000000001001] [PMID: 27355996]
[83]
Джин Д. Ганц Питер. Роль эндотелиальной дисфункции в развитии атеросклероза. Тираж 2004 г.; 109: III-27- III-32.
[84]
Kinlay S, Ganz P. Связь между эндотелиальной дисфункцией и острым коронарным синдромом: последствия для терапии. Am J Cardiol 2000; 86(8В): 10J-3.
[http://dx.doi.org/10.1016/S0002-9149(00)01334-5] [PMID: 11081444]
[85]
Туттоломондо А., Майда С., Пинто А. Синдром диабетической стопы: Иммунный -воспалительные признаки как возможные кардиоваскулярные маркеры при сахарном диабете. Мир J Ортоп 2015; 6(1): 62-76.
[http://dx.doi.org/10.5312/wjo.v6.i1.62] [PMID: 25621212]
[86]
Вонг В.В., Петта С., Хириарт Дж.Б., и др. Критерии достоверности для диагностики жировой дистрофии печени по параметру контролируемого ослабления на основе М-зонда. J Гепатол 2017; 67(3): 577-84.
[http://dx.doi.org/10.1016/j.jhep.2017.05.005] [PMID: 28506907]
[87]
Violi F, Corazza GR, Caldwell SH, et al. PRO-LIVER Collaborators Влияние тромбоза портальной вены на цирроз печени: Итальянский регистр венозных тромботических событий. Стажер Emerg Med 2016; 11(8): 1059-66.
[http://dx.doi.org/10.1007/s11739-016-1416-8] [PMID: 27026379]
[88]
Туттоломондо А. , Пинто А., Коррао С., и др. Иммуновоспалительные и тромботические/фибринолитические переменные, связанные с диагнозом острого ишемического инсульта. Атеросклероз 2009; 203(2): 503-8.
, Пинто А., Коррао С., и др. Иммуновоспалительные и тромботические/фибринолитические переменные, связанные с диагнозом острого ишемического инсульта. Атеросклероз 2009; 203(2): 503-8.
[http://dx.doi.org/10.1016/j.atherosclerosis.2008.06.030] [PMID: 18715563]
[89]
Albanese A, Tuttolomondo A, Anile C, et al. Спонтанные хронические субдуральные гематомы у молодых людей с дефицитом фактора свертывания крови XIII. Отчет о трех случаях. Дж. Нейрохирург, 2005 г.; 102(6): 1130-2.
[http://dx.doi.org/10.3171/jns.2005.102.6.1130] [PMID: 16028774]
[90]
Di Raimondo D, Tuttolomondo A, Buttà C, et al. Метаболические и противовоспалительные эффекты домашней программы аэробных физических упражнений. Международная клиническая практика 2013 г.; 67(12): 1247-53.
[http://dx.doi.org/10.1111/ijcp.12269] [PMID: 24246205]
[91]
Tuttolomondo A, Maida C, Pinto A. Синдром диабетической стопы как возможный сердечно-сосудистый маркер у пациентов с диабетом .




