Паркинсона болезнь лечение: Болезнь Паркинсона — Лечение в многопрофильной семейной клинике «К медицина»
Хирургические методы лечения болезни Паркинсона | Токарев
1. Шток В.Н., Левин О.С., Федорова Н.В. Экстрапирамидные расстройства. М.: МИА, 2002:235.
2. Bucy P.C. Surgical relief of tremor at rest. Ann. Surg. 1945;122:933–941.
3. Putnam T.J. Relief from unilateral paralysis agitans by section of the pyramidal tract. Arch. Neurol. Psychiatry. 1938;40:1049– 1050.
4. Abel T.J., Walch T., Howard M.A .III. Russell Meyers (1905–1999): pioneer of functional and ultrasonic neurosurgery. J. Neurosurg. 2016;125:1589–1595. https://doi.org/10.3171/2015.9.JNS142811
5. Speelman J.D., Bosch D.A. Resurgence of functional neurosurgery for Parkinson’s disease: A historical perspective. Movement Disorders. 1998;13(3):582–588. https://doi.org/10.1002/mds.870130336
6. Spiegel E.A., Wycis H.T. Pallidothalamotomy in chorea. Arch. Neurol. Psychiatry. 1950;64:295–296.
7. Spiegel E.A., Wycis H.T., Thur C. The stereoencephalotome (model III of our stereotaxic apparatus for operations on the human brain). J. Neurosurg. 1951;8:452–453.
J. Neurosurg. 1951;8:452–453.
8. Cooper I.S. Anterior choroidal artery ligation for involuntary movements. Science. 1953;118:193.
9. Bravo G.J., Cooper I.S. A clinical and radiological correlation of the lesions produced by chemopallidectomy and thalamectomy. J. Neurol. Neurosurg. Psychiatry. 1959;22:1–10.
10. Connolly B.S., Lang A.E. Pharmacological treatment of Parkinson disease: a review. JAMA. 2014;311:1670–1683. https://doi.org/10.1001/jama.2014.3654
11. Defer G.L., Widner H., Marié R.M., Rémy P., Levivier M. Core assessment program for surgical interventional therapies in Parkinson’s disease (CAPSIT-PD). Mov. Disord. 1999;14:572–84. https://doi.org/10.1002/1531-8257(199907)14:43.0.co;2-c
12. Экстрапирамидные расстройства вчера, сегодня, завтра. [Сб. ст]. Под ред. проф. О.С. Левина. 2-е изд. М., 2015:408.
13. Ахметжанов В.К., Шашкин Ч.С., Джамантаева Б.Д. Болезнь Паркинсона. Патофизиология экстрапирамидной системы. Современные представления о причинах возникновения и патогенезе паркинсонизма. Нейрохирургия и неврология Казахстана. 2016;2(43):44–51.
Нейрохирургия и неврология Казахстана. 2016;2(43):44–51.
14. Schuurman P.R., Bosch D.A., Bossuyt P.M.M., Bonsel G.J., Someren E.J.W., Rob Bie M.A., et al. A comparison of continuous thalamic stimulation and thalamotomy for suppression of severe tremor. N. Engl. J. Med. 2000;342:461–468. https://doi.org/10.1056/NEJM200002173420703
15. Bergman H., Wichmann T., DeLong M.R. Reversal of experimental parkinsonism by lesions of the subthalamic nucleus. Science. 1990;249:1436–1438.
16. Aziz T.Z., Peggs D., Sambrook M.A., Crossman A.R. Lesion of the subthalamic nucleus for the alleviation of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced parkinsonism in the primate. Mov. Disord. 1991;6:288–292. https://doi.org/10.1159/000064599
17. Alvarez L., Macias R., Pavón N., López G., RodríguezOroz M.C., Rodríguez R. et al. Therapeutic efficacy of unilateral subthalamotomy in Parkinson’s disease: results in 89 patients followed for up to 36 months. J. Neurol. Neurosurg.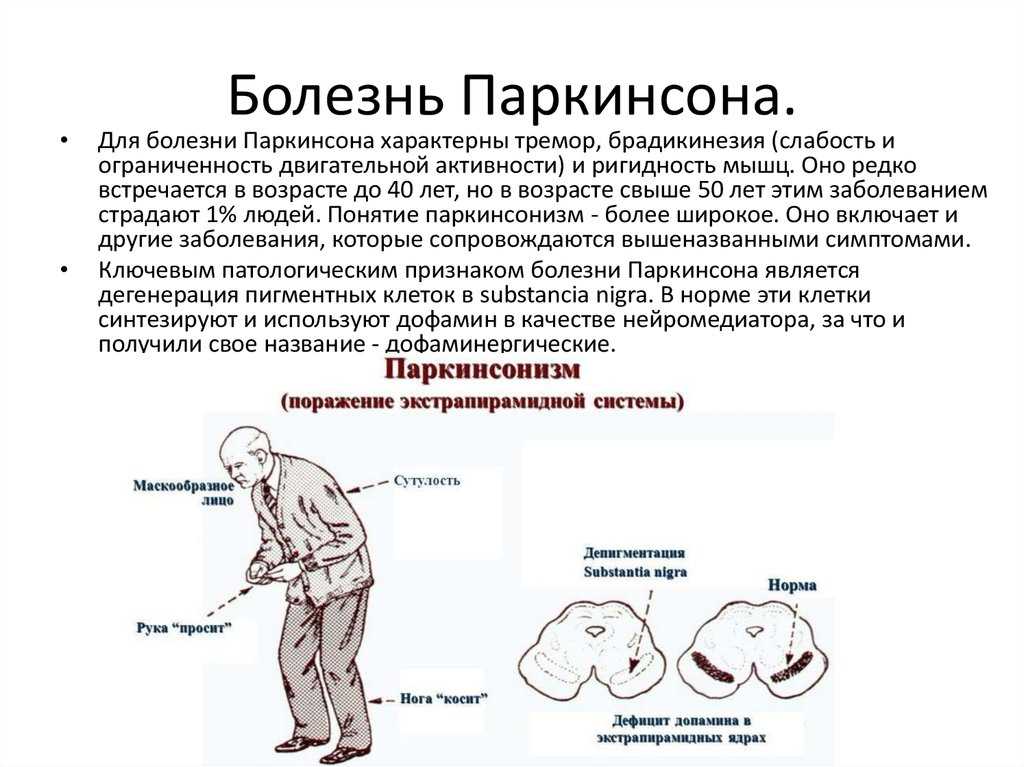 Psychiatry. 2009;80(9):979–85. https://dx.doi.org/10.1136/jnnp.2008.154948
Psychiatry. 2009;80(9):979–85. https://dx.doi.org/10.1136/jnnp.2008.154948
18. Vitek J.L., Bakay R.A., Freeman A., Evatt M., Green J., McDonald W. et al. Randomized trial of pallidotomy versus medical therapy for Parkinson’s disease. Ann. Neurol. 2003;53:558– 569. https://doi.org/10.1002/ana.10517
19. Eskandar E.N., Shinobu L.A., Penney J.B., Jr., Cosgrove G.R., Counihan T.J. Stereotactic pallidotomy performed without using microelectrode guidance in patients with Parkinson’s disease: surgical technique and 2-year results. J. Neurosurg. 2000;92:375– 383. https://doi.org/10.1159/000068960
20. Shannon K.M., Penn R.D., Kroin J.S., Adler C.H., Janko K.A., York M. et al. Stereotactic pallidotomy for the treatment of Parkinson’s disease. Efficacy and adverse effects at 6 months in 26 patients. Neurology. 1998;50:434–438. https://doi.org/10.1212/wnl.50.2.434
21. Rand R.W. Role of Cryosurgery and MRI for Parkinson’s Disease. Stereotact. Funct. Neurosurg. 1995;65(1–4):18–22. https://doi.org/10.1159/000098891
https://doi.org/10.1159/000098891
22. Koller W.C., Pahwa R., Lyons K.E., Albanese A. Surgical treatment of Parkinson’s disease. J. Neurol. Sci. 1999;167(1):1–10. https://doi.org/10.1016/S0022-510X(99)00139-2
23. Moosa S., Martínez-Fernández R., Elias W.J., Alamo M.D., Eisenberg H.M., Fishman P.S. The Role of High-Intensity Focused Ultrasound as a Symptomatic Treatment for Parkinson’s Disease. Mov. Disord. 2019;34(9):1243–1251. https://doi.org/10.1002/mds.27779. Epub 2019 Jul 10.
24. Ito H., Yamamoto K., Fukutake S., Odo T., Yamaguchi T., Taira T. Magnetic resonance imaging-guided focused ultrasound bilateral thalamotomy for essential tremor: A case report. Neurol. Clin. Neurosci. 2020;8(6):1–3. https://doi.org/10.1111/ncn3.12438
25. Alvarez L., Macias R., Pavon N., López G., RodríguezOroz M.C., Rodríguez R. et al. Therapeutic efficacy of unilateral subthalamotomy in Parkinson’s disease: results in 89 patients followed for up to 36 months. J. Neurol. Neurosurg. Psychiatry. 2009;80:979–985. https://doi.org/10.1136/jnnp.2008.154948
2009;80:979–985. https://doi.org/10.1136/jnnp.2008.154948
26. Krack P., Martinez-Fernandez R., Del Alamo M., Obeso J.A. Current applications and limitations of surgical treatments for movement disorders. Mov. Disord. 2017;32:36–52. https://doi.org/10.1002/mds.26890
27. Niranjan A., Lunsford L.D., Kano H. Leksell Radiosurgery for Movement Disorders. Leksell Radiosurgery. Prog. Neurol. Surg. Basel, Karger, 2019;34:279–288. https://doi.org/10.1159/000493075
28. Duma C.M. Movement disorder radiosurgery — planning, physics and complication avoidance. Prog. Neurol. Surg. 2007;20:249–266. https://doi.org/10.1159/000100168
29. Young R.F., Li F., Vermeulen S., Clayton D.A., Hesselgesser R.D. Gamma Knife pallidotomy for treatment of Parkinson’s disease: long term results, clinical study. Transl. Cancer Res. 2014;3:342–350. https://doi.org/10.3978/j.issn.2218-676X.2014.08.04
30. Cooper I.S. A Cryogenic Method for Physiologic Inhibition and Production of Lesions in the Brain.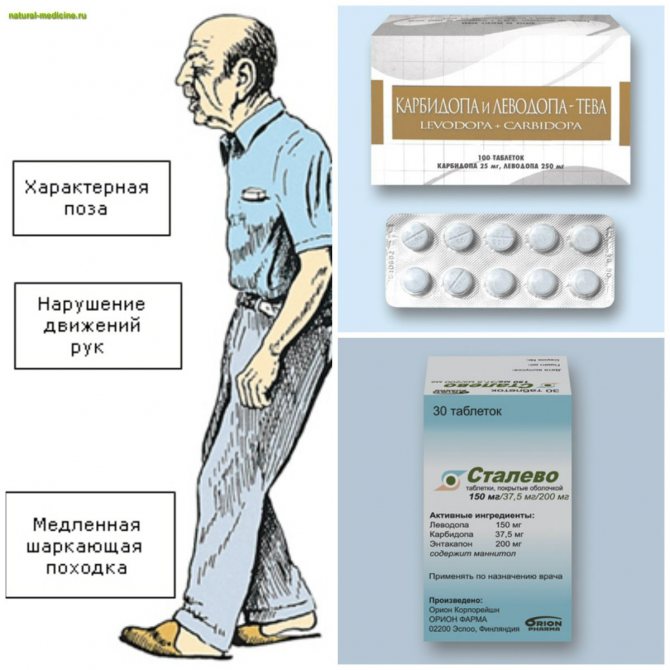 J. Neurosurg. 1962;19:853– 8. https://doi.org/10.3171/jns.1962.19.10.0853
J. Neurosurg. 1962;19:853– 8. https://doi.org/10.3171/jns.1962.19.10.0853
31. Кандель Э.И. Функциональная и стереотаксическая нейрохирургия. М.: Медицина, 1981:368 с.
32. Charles A., Fager M.D. Use of the Radio-Frequency Electrode in Stereotactic Surgery of Parkinson’s Disease. Surgical Clinics of North America. 1965;45(3):705–713. https://doi.org/10.1016/s0039-6109(16)37593-4
33. Watkins E.S. Heat Gains in Brain During Electrocoagulative Lesions. J. Neurosurg. 1965;23(3):319–28. https://doi.org/10.3171/jns.1965.23.3.0319
34. Schreglmann S.R., Krauss J.K., Chang J.W., Bhatia K.P., Kägi G. Functional Lesional Neurosurgery for Tremor: A Systematic Review and Meta-Analysis. J. Neurol. Neurosurg. Psychiatry. 2018;89(7):717–726. https://doi.org/10.1136/jnnp-2017-316302. Epub 2018 Jan 11.
35. Ohye C., Higuchi Y., Shibazaki T., Hashimoto T., Koyama T., Hirai T. et al. Gamma Knife thalamotomy for Parkinson disease and essential tremor: a prospective multicenter study. Neurosurgery. 2012;70:526–536. https://doi.org/10.1227/NEU.0b013e3182350893
Neurosurgery. 2012;70:526–536. https://doi.org/10.1227/NEU.0b013e3182350893
36. Young R.F., Jacques S., Mark R., Kopyov O., Copcutt B., Posewitz A. et al. Gamma Knife thalamotomy for treatment of tremor: long-term results. J. Neurosurg. 2000;93(Suppl.3):128–135. https://doi.org/10.3171/jns.2000.93.supplement
37. Kooshkabadi A., Lunsford L.D., Tonetti D., Flickinger J.C., Kondziolka D. Gamma Knife thalamotomy for tremor in the magnetic resonance imaging era. J. Neurosurg .2013;118:713–718. https://doi.org/10.3171/2013.1.JNS121111
38. Niranjan A., Kondziolka D., Baser S., Heyman R., Lunsford L.D. Functional outcomes after Gamma Knife thalamotomy for essential tremor and MS-related tremor. Neurology. 2000;55:443–446. https://doi.org/10.1212/wnl.55.3.443
39. Campbell A.M., Glover J., Chiang V.L., Gerrard J., Yu J.B. Gamma Knife stereotactic radiosurgical thalamotomy for intractable tremor: a systematic review of the literature. Radiother. Oncol. 2015;114:296–301. https://doi. org/10.1016/j.radonc.2015.01.013
org/10.1016/j.radonc.2015.01.013
40. Okun M.S., Stover N.P., Subramanian T., Gearing M., Wainer B.H., Holder C.A. et al. Complications of gamma knife surgery for Parkinson disease. Arch. Neurol. 2001;58:1995– 2002. https://doi.org/10.1001/archneur.58.12.1995
41. Witjas T., Carron R., Krack P., Eusebio A., Vaugoyeau M., Hariz M. et al. A prospective single-blind study of Gamma Knife thalamotomy for tremor. Neurology. 2015;85:1562–1568. https://doi.org/10.1212/WNL.0000000000002087
42. Moser D. MR-guided focused ultrasound technique in functional neurosurgery: targeting accuracy. J. Ther. Ultrasound. 2013;1:3. https://doi.org/10.1186/2050-5736-1-3
43. Christian E., Yu C., Apuzzo M.L. Focused ultrasound: relevant history and prospects for the addition of mechanical energy to the neurosurgical armamentarium. World Neurosurg. 2014;82:354– 365. https://doi.org/10.1016/j.wneu.2014.06.021
44. Fry W.J., Mosberg Jr.W.H., Barnard J.W., Fry F.J. Production of focal destructive lesions in the central nervous system with ultrasound. J. Neurosurg. 1954;11:471–478. https://doi.org/10.3171/jns.1954.11.5.0471
J. Neurosurg. 1954;11:471–478. https://doi.org/10.3171/jns.1954.11.5.0471
45. Jagannathan J., Sanghvi N.T., Crum L.A., Yen C.-P., Medel R., Dumont A.S. et al. High-intensity focused ultrasound surgery of the brain: part 1 — a historical perspective with modern applications. Neurosurgery 2009;64:201–210;discussion,210–211. https://doi.org/10.1227/01.NEU.0000336766.18197.8E
46. Gallay M.N., Moser D., Jeanmonod D. Safety and accuracy of incisionless transcranial MR-guided focused ultrasound functional neurosurgery: single-center experience with 253 targets in 180 treatments. J. Neurosurg. 2018;May 1. https://doi.org/10.3171/2017.12.JNS172054
47. Bond A.E., Shah B.B., Huss D.S., Dallapiazza R.F., Warren A., Harrison M.B. et al. Safety and efficacy of focused ultrasound thalamotomy for patients with medication-refractory, tremordominant Parkinson disease: a randomized clinical trial. JAMA Neurol. 2017;74:1412–1418. https://doi.org/10.1001/jamaneurol.2017.3098
48. Jung N. Y., Rachmilevitch I., Sibiger O., Amar T., Zadicario E., Chang J.W. Factors Related to Successful Energy Transmission of Focused Ultrasound through a Skull: A Study in Human Cadavers and Its Comparison with Clinical Experiences. J. Korean Neurosurg. Soc. 2019;62(6):712–722. https://doi.org/10.3340/jkns.2018.0226
Y., Rachmilevitch I., Sibiger O., Amar T., Zadicario E., Chang J.W. Factors Related to Successful Energy Transmission of Focused Ultrasound through a Skull: A Study in Human Cadavers and Its Comparison with Clinical Experiences. J. Korean Neurosurg. Soc. 2019;62(6):712–722. https://doi.org/10.3340/jkns.2018.0226
49. Mazerolle E.L., Seasonsa G.M., Warwaruk-Rogers R., Romo P., Nordal R., Sevick R.J. et al. Focused ultrasound resolves persistent radiosurgery related change in a patient with tremor. Radiology Case Reports. 2019;14(10):1233–1236. https://doi.org/10.1016/j.radcr.2019.07.010
50. Залялова З.А. Глубокая стимуляция головного мозга. Каким образом она контролирует движения при болезни Паркинсона? Нейрохирургия. 2019;21(3):93–99. https://doi.org/10.17650/1683-3295-2019-21-3-93-99
51. Benazzouz A., Hallett M. Mechanism of Action of Deep Brain Stimulation. Neurology. 2000;55(12Suppl.6):S13–6. PMID: 11188968.
52. Томский А.А., Бриль Е.В., Гамалея А.А., Федорова Н.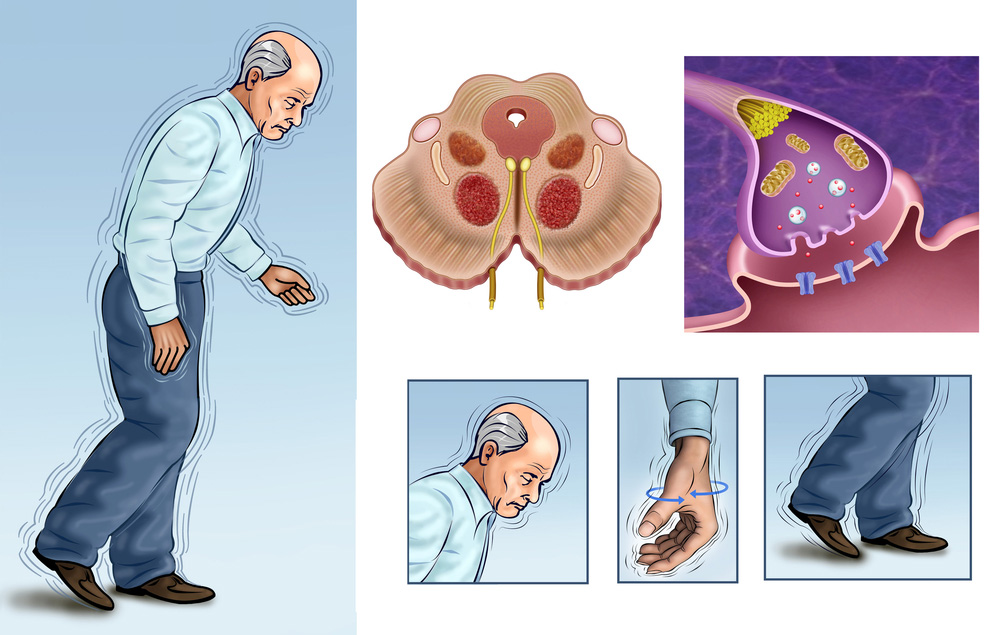 В., Левин О.С. Функциональная нейрохирургия при болезни Паркинсона в России. Анналы клинической и экспериментальной неврологии. 2019;13(4):10–15. https://doi.org/10.25692/ACEN.2019.4.2
В., Левин О.С. Функциональная нейрохирургия при болезни Паркинсона в России. Анналы клинической и экспериментальной неврологии. 2019;13(4):10–15. https://doi.org/10.25692/ACEN.2019.4.2
53. Follett K.A., Weaver F.M., Stern M., Kwan Hur, Harris C.L., Luo P. et al. Pallidal versus subthalamic deep-brain stimulation for Parkinson’s disease. N Engl J. Med. 2010;362:2077–2091. https://doi.org/10.1056/NEJMoa0907083
54. Voon V., Kubu C., Krack P., Houeto J.-L., Tröster A.I. Deep brain stimulation: Neuropsychological and neuropsychiatric issues. Mov. Disord. 2006;21Suppl.14:S305 — 27. https://doi.org/10.1002/mds.20963
55. Vendette M., Gagnon J.-F., Decary A., Massicotte-Marquez J., Postuma R.B., Doyon J. et al. REM sleep behavior disorder predicts cognitive impairment in Parkinson’s disease without dementia. Neurology. 2007;69(19):1843–9. https://doi.org/10.1212/01.wnl.0000278114.14096.74
56. Charles P.D., Dolhun R.M., Gill C.E., Davisa T.L., Blitonc M.J., Tramontanad M.G. et al. Deep brain stimulation in early Parkinson’s disease: Enrollment experience from a pilot trial. Parkinsonism & Related Disorders. 2012;18(3):268–273. https://doi.org/10.1016/j.parkreldis.2011.11.001
et al. Deep brain stimulation in early Parkinson’s disease: Enrollment experience from a pilot trial. Parkinsonism & Related Disorders. 2012;18(3):268–273. https://doi.org/10.1016/j.parkreldis.2011.11.001
57. Schuepbach W.M., Rau J., Knudsen K., Volkmann J., Krack P., Timmermann L. еt. al. EARLYSTIM Study Group. Neurostimulation for Parkinson’s disease with early motor complications. The New England Journal of Medicine. 2013;368(7):610–22. https://doi.org/10.1056/NEJMoa1205158
58. Lhommée E., Wojtecki L., Czernecki V., Witt K., Maier F., Tonder L. et al. EARLYSTIM study group. Behavioural outcomes of subthalamic stimulation and medical therapy versus medical therapy alone for Parkinson’s disease with early motor complications (EARLYSTIM trial): secondary analysis of an open-label randomised trial. The Lancet Neurology. 2018;17(3):223–31. https://doi.org/10.1016/S1474-4422(18)30035-8
59. Greb E. Can DBS in Early Parkinson’s Disease Reduce Disease Progression? Medscape. 2020;Jul 09. https://www.medscape.com/viewarticle/933676#vp_1
2020;Jul 09. https://www.medscape.com/viewarticle/933676#vp_1
60. Бриль Е.В. Ранняя нейростимуляция подкорковых структур головного мозга при болезни Паркинсона. Споры продолжаются. Бюллетень Национального общества по изучению болезни Паркинсона и расстройств движений. 2020;3:13–15. https://doi.org/10.24412/2226-079X-2020-12236
3.3. Хирургическое лечение болезни Паркинсона \ КонсультантПлюс
3.3. Хирургическое лечение болезни Паркинсона
Нейрохирургическое лечение болезни Паркинсона включает деструктивные операции и стимуляцию подкорковых структур головного мозга (DBS).
В качестве основных мишеней для DBS рассматривают субталамическое ядро (STN), внутренний сегмент бледного шара (GPi) и вентральное промежуточное ядро таламуса (VIM). Основным преимуществом DBS перед другими операциями является возможность проведения одномоментных двусторонних вмешательств.
— Рекомендуется односторонняя таламотомия или односторонняя стимуляция VIM у пациентов с дрожательной формой БП для уменьшения тремора, преимущественно контралатерального [561 — 563].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 2).
Комментарии: Вариантами таламотомии могут быть стереотаксическая радиочастотная, радиохирургическая и с использованием фокусированного ультразвука. Обе процедуры — деструкция VIM (таламотомия) или стимуляция позволяет почти полностью подавить контралатеральный тремор, вызывает уменьшение мышечной ригидности без влияния на брадикинезию. Обе процедуры могут оказывать неблагоприятное воздействие на речь (левосторонние и двусторонние процедуры примерно в 3 раза чаще вызывают затруднения речи), вызывать атаксию [562]. Стимуляция VIM может вызывать парестезии в контралатеральных конечностях и лице. Радиохирургическая таламотомия может быть рассмотрена у пациентов с коагулопатиями, характеризуется отсроченным эффектом лечения (3 — 9 месяцев). Двусторонние таламотомии имеют высокий риск преходящих и стойких неврологических осложнений. При двустороннем треморе может быть использована двусторонняя стимуляция VIM.
— Рекомендуется односторонняя паллидотомия у пациентов с БП для уменьшения дискинезий и моторных флуктуаций [564 — 566].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарии: Односторонняя паллидотомия может оказывать неблагоприятное воздействие на речь. Двусторонние паллидотомии имеют высокий риск преходящих и стойких неврологических осложнений.
— Рекомендуется DBS подкорковых структур (STN или GPi) у пациентов с БП при наличии лекарственных дискинезий и/или моторных флуктуаций, не поддающихся адекватной медикаментозной коррекции [567 — 581].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарии: Стимуляция STN и GPi обладает сопоставимой эффективностью в отношении уменьшения выраженности моторных симптомов и качества жизни, а также влияния на психические функции (тревогу и депрессию). Различий в долгосрочной эффективности при стимуляции обеих мишеней в отношении двигательных симптомов не выявлено. Стимуляция GPi приводит к уменьшению лекарственных дискинезий, тогда как стимуляция STN в большей степени позволяет снизить эквивалентную суточную дозу препарата допа и ее производные. Стимуляция STN может быть связана с умеренным снижением подкорково-лобных когнитивных функций у некоторой части больных. В отношении нежелательных явлений недостаточно данных чтобы рекомендовать конкретную мишень, в связи с чем выбор той или иной мишени должен осуществляться с учетом технических возможностей выполнения, когнитивного статуса пациента, необходимости уменьшение дозы препаратов допа и ее производных. У пациентов с дрожательной формой БП и хорошим ответом на допа и ее производные целесообразно рассматривать стимуляцию STN.
Стимуляция GPi приводит к уменьшению лекарственных дискинезий, тогда как стимуляция STN в большей степени позволяет снизить эквивалентную суточную дозу препарата допа и ее производные. Стимуляция STN может быть связана с умеренным снижением подкорково-лобных когнитивных функций у некоторой части больных. В отношении нежелательных явлений недостаточно данных чтобы рекомендовать конкретную мишень, в связи с чем выбор той или иной мишени должен осуществляться с учетом технических возможностей выполнения, когнитивного статуса пациента, необходимости уменьшение дозы препаратов допа и ее производных. У пациентов с дрожательной формой БП и хорошим ответом на допа и ее производные целесообразно рассматривать стимуляцию STN.
— Рекомендуется при отборе больных для DBS STN и GPi у пациентов с БП учитывать эффективность препаратов допа и ее производных, возраст, длительность заболевания, которые определяют эффективность операции [582 — 598].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии: При отборе пациентов на DBS должна быть проведена проба с препаратом допа и ее производные. Провокационную пробу с использованием обычной утренней дозы препарата допа и ее производные следует проводить после 12-часового перерыва в приеме противопаркинсонических препаратов. Если пациент не переносит такой промежуток, рекомендовано определить максимально допустимую продолжительность отмены и сохранить этот период для всех последующих оценок. Рекомендуется назначать 120% от обычной утренней дозы препарата допа и ее производные, при необходимости могут использоваться более высокие дозы в 150% и 200% утренней дозы. Оценка должна включать шкалу UPDRS III часть. Разница между состоянием включения и выключения должна быть не менее 33 — 50%. Улучшение > 50% может быть связано с большей общей пользой для большинства пациентов. Важно оценивать аксиальные симптомы (такие как ходьба, застывания и нарушения равновесия) независимо от процентного улучшения общего балла. Сохранение аксиальных симптомов в состоянии включения является предиктором плохого прогноза.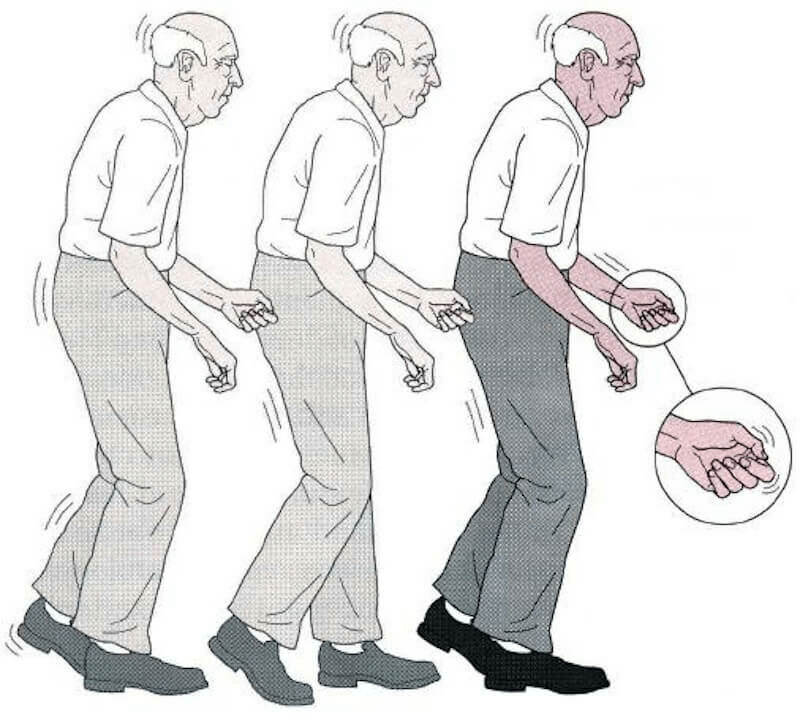
Более молодые пациенты с более короткой продолжительностью заболевания могут иметь большее улучшение, чем пожилые пациенты с более длительной продолжительностью заболевания. Возраст не должен быть основным фактором исключения при отборе на DBS. Пациенты с длительностью заболевания менее 4 лет не должны рассматриваться как кандидаты на DBS, кроме ситуаций, когда мишенью является инвалидизирующий тремор.
— Не рекомендуется проведения DBS при выраженной депрессии и тревоги, наличие выраженных когнитивных нарушений, деменции (MMSE 24 баллов) у пациентов с БП в связи с высоким риском развитием психических осложнений [598 — 601].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Лекарства и процедуры | Болезнь Паркинсона
Поиск тем, статей, видео, исследований и т. д.
Нажмите Enter для поиска или ESC для закрытия
Вы ищете:
- ${результат.
 термин}
термин}
Домашняя страница
Лекарства и методы лечения
Пожертвовать
О болезни Паркинсона
В то время как доступные методы лечения могут лечить некоторые симптомы, люди с болезнью Паркинсона срочно нуждаются в более эффективных методах лечения, чтобы улучшить качество жизни и замедлить или остановить прогрессирование заболевания.
Для моторных симптомов
Помогает лечить тремор, скованность и медлительность.
Читать далее
Для немоторных симптомов
Помощь в лечении симптомов — например, запора, деменции, депрессии, галлюцинаций, боли, сексуальной дисфункции и проблем со сном, — которые могут возникать на протяжении всего заболевания.

Читать далее
Глубокая стимуляция мозга
Несмотря на инвазивность, эта хирургическая терапия может уменьшить симптомы, уменьшить потребность в лекарствах и уменьшить побочные эффекты, такие как дискинезия, которые могут сопровождать медикаментозное лечение.
Читать далее
Сфокусированный ультразвук
Фокусированное ультразвуковое исследование — это неинвазивная хирургическая процедура при моторных симптомах или дискинезии Паркинсона, которые не поддаются медикаментозному лечению. Для некоторых людей сфокусированный ультразвук может быть альтернативой операции по глубокой стимуляции мозга.
Методы лечения в разработке
Список избранных методов лечения, находящихся на стадии тестирования (те, которые в настоящее время или ранее финансируются Фондом Майкла Дж. Фокса) для замедления или остановки прогрессирования болезни Паркинсона или для лечения симптомов.

Читать далее
Все доступные лекарства и методы лечения направлены на облегчение симптомов и улучшение качества жизни. Самой большой неудовлетворенной потребностью пациентов остается терапия, модифицирующая заболевание, — терапия, которая останавливает или замедляет прогрессирование заболевания. Фонд исследований болезни Паркинсона Майкла Дж. Фокса (MJFF) поддерживает исследования, направленные на ускорение лечения, а для тех, кто сегодня живет с болезнью Паркинсона, разрабатывает улучшенные методы лечения двигательных симптомов и расширенные варианты лечения немоторных симптомов.
Современные методы лечения подбираются с учетом уникальных симптомов каждого человека; не существует универсального подхода к лечению болезни Паркинсона. Чаще всего люди начинают медикаментозную терапию, когда симптомы мешают им делать то, что они хотят или должны делать. Глубокая стимуляция мозга может быть вариантом, когда лекарства не работают так же хорошо, или когда люди испытывают побочные эффекты, такие как дискинезия.
Упражнения также могут помочь справиться с симптомами болезни Паркинсона, и некоторые ранние исследования показывают, что они могут помочь защитить мозг. Вместе с врачом и физиотерапевтом разработайте безопасный и приятный режим упражнений.
Решение о том, когда и какое лечение следует начать, лучше всего принимать вместе с лечащим врачом. При выборе терапии учитывайте свои симптомы и то, как они мешают вашей жизни, а также потенциальные преимущества, побочные эффекты и затраты. Ваш врач также примет во внимание ваш возраст и другие заболевания и лекарства, помимо болезни Паркинсона.
Специалист по двигательным расстройствам — невролог с дополнительной подготовкой по болезни Паркинсона — может располагать информацией о последних методах лечения и исследованиях. Регулярное посещение специалиста по двигательным расстройствам для лечения болезни Паркинсона или хотя бы раз в год может помочь оптимизировать схему лечения.
Мы используем файлы cookie, чтобы обеспечить вам максимальное удобство.
Болезнь Паркинсона: причины, симптомы, диагностика, лечение
Медицинское заключение Кэрол ДерСаркисян, доктора медицинских наук, 17 января 2022 г.
Болезнь Паркинсона — это заболевание головного мозга, которое со временем ухудшается. Это вызывает гибель нервных клеток в части мозга, называемой черной субстанцией. Эта часть мозга важна для управления движением. Вот почему люди с болезнью Паркинсона часто трясутся или демонстрируют другие ненормальные движения. Лечение может помочь с симптомами, но нет никакого способа замедлить или обратить вспять это состояние.
Никто точно не знает, почему человек заболевает болезнью Паркинсона. Вероятно, это связано с целым рядом факторов, включая гены и воздействие определенных токсинов. Обычно нет никакого способа предсказать, кто получит это или почему. Паркинсон редко передается по наследству.
Болезнью Паркинсона болеют как мужчины, так и женщины. У мужчин встречается в 1,5 раза чаще. Это также чаще встречается у пожилых людей. Только около 4 из каждых 100 случаев случаются у людей в возрасте до 50 лет. Каждый год около 60 000 человек в США узнают, что у них болезнь Паркинсона. Около 1 миллиона человек в США и 10 миллионов человек во всем мире страдают этим заболеванием.
Четыре основных симптома болезни Паркинсона связаны с движением:
- Тремор или дрожание рук, рук, ног, челюсти или головы
- Скованность рук, ног и туловища
- Замедленные движения координация
У людей с болезнью Паркинсона также могут быть:
- Депрессия или другие эмоциональные изменения
- Проблемы с жеванием, глотанием или речью
- Проблемы со сном
- Запор
Болезнь Паркинсона — прогрессирующее заболевание. Это означает, что ваши симптомы обычно ухудшаются со временем. Симптомы болезни Паркинсона также сильно различаются от одного человека к другому. Скорость ухудшения состояния и степень его тяжести также могут сильно различаться. Ранние симптомы можно легко игнорировать или игнорировать. Они могут начаться на одной стороне вашего тела, а на другой стороне появятся позже.
Симптомы болезни Паркинсона также сильно различаются от одного человека к другому. Скорость ухудшения состояния и степень его тяжести также могут сильно различаться. Ранние симптомы можно легко игнорировать или игнорировать. Они могут начаться на одной стороне вашего тела, а на другой стороне появятся позже.
Поначалу врачам может быть трудно определить, есть ли у вас болезнь Паркинсона. Это отчасти потому, что симптомы сильно различаются. Другие расстройства также могут выглядеть аналогично. Для него нет единого теста. Ваш врач может назначить визуализирующие тесты, чтобы исключить другие состояния. Они также будут задавать вопросы о симптомах, лекарствах и воздействии токсинов.
Болезнь Паркинсона поражает нервные клетки мозга, вырабатывающие химическое вещество под названием дофамин. В результате уровень химического вещества падает. Врачи обычно начинают лечение с леводопы (L-допы). Ваш мозг превращает его в дофамин. Но это может вызвать у вас тошноту, поэтому вы, вероятно, будете принимать его с другим лекарством под названием карбидопа, чтобы контролировать эти побочные эффекты. Комбинированный препарат называется карбидопа-леводопа (Паркопа, Ритари, Синемет).
Комбинированный препарат называется карбидопа-леводопа (Паркопа, Ритари, Синемет).
Ваш врач может дать вам один из этих препаратов отдельно или с другим препаратом:
- Агонисты дофамина: Они действуют как дофамин, но не повышают его уровень в мозге. Вы можете принимать их с любым препаратом, содержащим леводопа. Вы можете попробовать прамипексол (Mirapex) или ропинирол (Requip).
- COMT Ингибиторы: Они продлевают действие леводопы. Вы можете получить энтакапон (Комтан) или толкапон (Тасмар).
- Ингибиторы МАО-В: Препятствуют расщеплению леводопы в мозгу. Вы можете получить селегилин (Элдеприл, Зелапар) или разагилин (Азилект).
Врач также может дать вам лекарство от тремора, сопровождающего болезнь Паркинсона. Эти лекарства называются антихолинергическими, и они тормозят химическое вещество в вашем мозгу, которое контролирует движение. Вы можете принять бензтропина мезилат (Когентин) или тригексифенидил (Артан).
Если лекарство не работает достаточно хорошо, врач может предложить глубокую стимуляцию мозга (DBS). При DBS врач имплантирует электроды глубоко в мозг. Подключенное к ним устройство подает электрические импульсы. Эти импульсы могут помочь контролировать тремор, вызванный болезнью Паркинсона.
В прошлом врачи иногда использовали другие операции, чтобы повредить мозг, чтобы облегчить двигательные симптомы. Но они редко используют эти операции сейчас.
Физиотерапия может научить вас упражнениям для улучшения силы и равновесия, а также поможет вам оставаться независимым. Трудотерапия показывает вам новые способы решения повседневных задач. Логопедия может помочь при невнятной или нечеткой речи.
Употребление здоровой пищи поможет вам чувствовать себя лучше. Это также может помочь при некоторых симптомах болезни Паркинсона, таких как запор. Регулярные физические упражнения также повысят силу, гибкость и равновесие. Попросите своего врача порекомендовать физиотерапевта или программу упражнений.
Наряду с вашим обычным медицинским обслуживанием эти подходы могут помочь с настроением, энергией и самочувствием в течение дня: консультант или группа поддержки. Ваш врач может знать о местных ресурсах. Есть также много организаций, занимающихся болезнью Паркинсона, в том числе Американская ассоциация болезни Паркинсона, Фонд Майкла Дж. Фокса для исследований болезни Паркинсона и Фонд Паркинсона.
IMAGES PROVIDED BY:
- Getty
- Getty
- Getty
- Getty
- Getty
- Getty
- Getty
- Getty
- Getty
- Science Source
- Getty
- Getty
- Getty
- Getty
ИСТОЧНИКИ:
Кливлендская клиника: «Болезнь Паркинсона: обзор», «Логопедия при болезни Паркинсона».
Национальный институт неврологических расстройств и инсульта: «Информационная страница болезни Паркинсона», «Болезнь Паркинсона: надежда через исследования».

 термин}
термин}