Паркинсона болезнь кратко: Болезнь Паркинсона – причины возникновения, признаки и симптомы, лечение болезни Паркинсона
Болезнь Паркинсона: симптомы и лечение
Что это такое?
Из-за этого нарушается регуляция движений и мышечного тонуса, что проявляется характерным тремором (дрожью), общей скованностью и нарушением позы и движений. Впервые это заболевание описал английский врач Джеймс Паркинсон в 1817 году в своем «Эссе о дрожательном параличе».
Болезнью Паркинсона (паркинсонизмом) заболевает примерно каждый сотый человек, перешагнувший шестидесятилетний рубеж, причем у мужчин оно встречается чаще, чем у женщин. Что интересно, курильщики практически не подвержены этой болезни, а любители молока, наоборот, сильнее рискуют заболеть ей; механизмы этих явлений до конца не выяснены.
Эта болезнь вызывает дрожь в руках, общую скованность и, как следствие, проблемы с ходьбой и другими движениями, а также часто осложняется другими заболеваниями, которые рано или поздно приводят к смерти больного. Жертвами паркинсонизма стали такие известные личности, как боксер Мохаммед Али, политик Ясер Арафат и Папа Римский Иоанн Павел II.
Отчего это бывает?
Сейчас известно, что болезнь Паркинсона возникает из-за нарушения выработки дофамина — одного из нейромедиаторов (веществ, служащих для передачи импульсов в головном мозге). Это ведет к нарушению функций клеток в отделах мозга, отвечающих за движения человека. Предрасположенность к этому заболеванию может передаваться по наследству. Столкнувшись с симптомами болезни Паркинсона, надо учитывать, что некоторые из них могут быть вызваны и другими причинами, например энцефалитом, избыточным приемом лекарственных препаратов, атеросклерозом сосудов головного мозга, отравлением нейротоксическими веществами.
Что происходит?
Появление первых симптомов заболевания обычно остается незамеченным. Часто родственники и друзья человека впервые обращают внимание на уменьшение выразительности лица, замедленность движений, особенно при одевании, еде и ходьбе. Впоследствии и сам человек отмечает уменьшение ловкости рук, особенно при выполнении тонких движений. Возникают нарушение письма, трудности при чистке зубов, бритье и т д. Мимика человека скудеет, он реже мигает, лицо становится маскообразным. Нарушается речь. Характерно, что человек, не способный самостоятельно ходить, зачастую легко взбегает по лестнице, может танцевать, кататься на лыжах. Медленное передвижение может внезапно смениться быстрым бегом, который больной не в силах преодолеть, пока не упадет или не встретит препятствие. Значительно затруднены повороты в постели, проблемой становится вставание с кресла или стула. Из-за нарушения подвижности мышц глотки глотательные движения становятся более редкими, что вызывает развитие слюнотечения. Последнее может быть столь интенсивным, что человек вынужден постоянно пользоваться платком или полотенцем.
Часто родственники и друзья человека впервые обращают внимание на уменьшение выразительности лица, замедленность движений, особенно при одевании, еде и ходьбе. Впоследствии и сам человек отмечает уменьшение ловкости рук, особенно при выполнении тонких движений. Возникают нарушение письма, трудности при чистке зубов, бритье и т д. Мимика человека скудеет, он реже мигает, лицо становится маскообразным. Нарушается речь. Характерно, что человек, не способный самостоятельно ходить, зачастую легко взбегает по лестнице, может танцевать, кататься на лыжах. Медленное передвижение может внезапно смениться быстрым бегом, который больной не в силах преодолеть, пока не упадет или не встретит препятствие. Значительно затруднены повороты в постели, проблемой становится вставание с кресла или стула. Из-за нарушения подвижности мышц глотки глотательные движения становятся более редкими, что вызывает развитие слюнотечения. Последнее может быть столь интенсивным, что человек вынужден постоянно пользоваться платком или полотенцем.
Диагностика
При этом заболевании крайне важно как можно раньше начать лечение, поэтому при первом появлении симптомов необходимо обратиться к невропатологу. Для диагностики болезни Паркинсона человека направляют на электромиографию, которая позволяет определить причину тремора и исключить мышечные заболевания, а для диагностики нарушений деятельности мозга проводят электроэнцефалографию.
Лечение
Основным препаратом, замедляющим развитие этого заболевания, в настоящее время является леводопа (леводофа), но его применение вызывает целый ряд побочных эффектов. Существунт еще несколько групп препаратов, более или менее эффективных при паркинсонизме; их используют вместе с леводопой (реже без нее) в составе комплексной терапии. Вселяет надежду то, что в последние годы активно проводятся исследования возможностей хирургического лечения болезни Паркинсона путем пересадки больному человеку клеток, вырабатывающих дофамин.
Источники
- Tucker HR., Mahoney E., Akhtar K., Kao TJ., Mamone G., Mikkilineni S., Ravi M., Watkins H., Terrelonge DL., Martin C., Unger K., Kim G., Fiber K., Gupta M., Indajang J., Kochman EM., Sachs N., Feustel P., Molho ES., Pilitsis JG., Shin DS. Motor Thalamic Deep Brain Stimulation Alters Cortical Activity and Shows Therapeutic Utility for Treatment of Parkinson’s Disease Symptoms in a Rat Model. // Neuroscience — 2021 — Vol460 — NNULL — p.88-106; PMID:33631218
- Cotterell P. Parkinson’s disease: symptoms, treatment options and nursing care. // Nurs Stand — 2018 — Vol33 — N7 — p.53-58; PMID:30198239
Болезнь Паркинсона — причины, симптомы, диагностика и лечение
Болезнь Паркинсона — медленно прогрессирующее дегенеративное заболевание центральной нервной системы, основными проявлениями которого являются такие двигательные нарушения, как гипокинезия, ригидность мышц, тремор покоя, постуральные расстройства.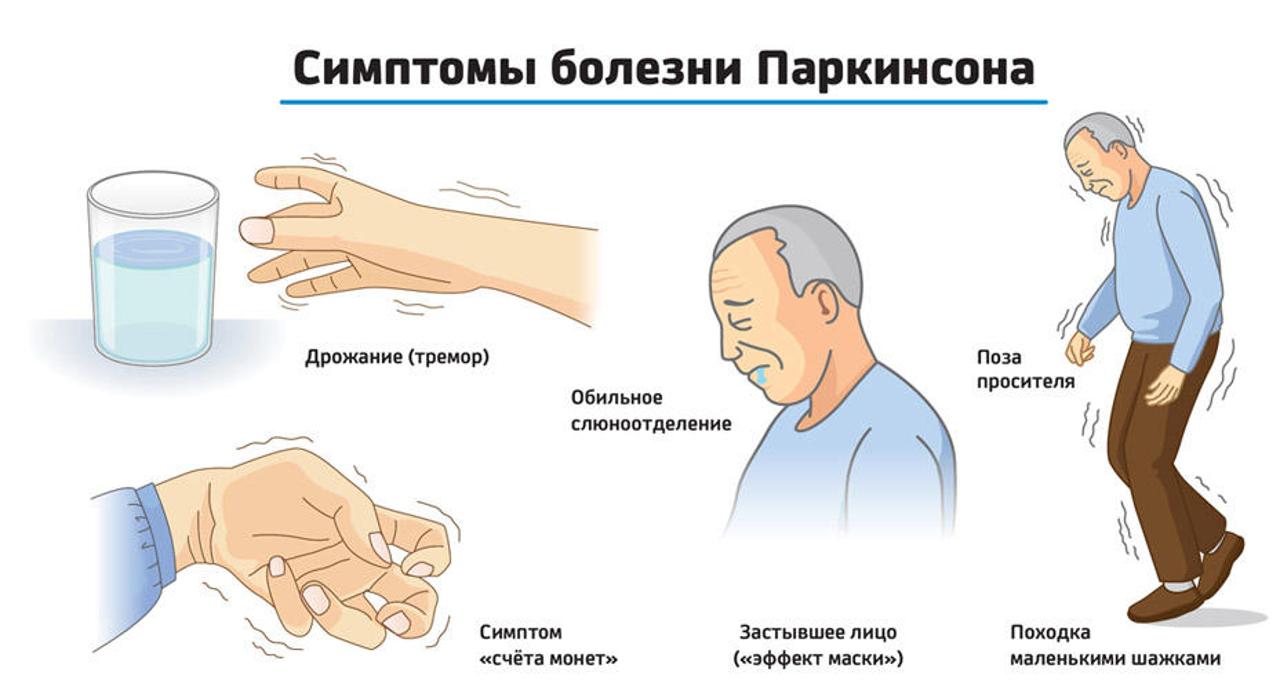 Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства. Различают истинный паркинсонизм (болезнь Паркинсона) и синдром паркинсонизма, который может сопровождать многие неврологические заболевания (ЧМТ, опухоли головного мозга, инсульты, энцефалиты и пр.). При подозрении на болезнь Паркинсона пациенту необходимо пройти электроэнцефалографию, реоэнцефалографию, МРТ головного мозга.
Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства. Различают истинный паркинсонизм (болезнь Паркинсона) и синдром паркинсонизма, который может сопровождать многие неврологические заболевания (ЧМТ, опухоли головного мозга, инсульты, энцефалиты и пр.). При подозрении на болезнь Паркинсона пациенту необходимо пройти электроэнцефалографию, реоэнцефалографию, МРТ головного мозга.
Общие сведения
Болезнь Паркинсона — медленно прогрессирующее дегенеративное заболевание центральной нервной системы, основными проявлениями которого являются такие двигательные нарушения, как гипокинезия, ригидность мышц, тремор покоя, постуральные расстройства. Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства.
Классификация болезни Паркинсона
Классификация болезни Паркинсона основывается на возрасте начала болезни:
Также известны различные классификации синдрома паркинсонизма:
- дрожательные
- дрожательно-ригидные
- ригидно-дрожательные
- акинетико-ригидные
- смешанные
Однако данные классификации болезни Паркинсона и синдрома паркинсонизма не считаются безупречными. Поэтому на сегодня общепринятого подхода в этом вопросе не существует.
Поэтому на сегодня общепринятого подхода в этом вопросе не существует.
Этиология и патогенез болезни Паркинсона
Современной медициной достигнут определенный прогресс в понимании молекулярных и биохимических механизмов болезни Паркинсона. Не смотря на это, остается неизвестной истинная этиология спорадических форм этого заболевания. Большое значение имеют генетическая предрасположенность и факторы внешней среды. Сочетание и взаимодействие этих двух факторов инициируют процесс дегенерации в пигментсодержащих, а впоследствии и других нейронах ствола головного мозга. Такой процесс, однажды возникнув, становится необратимым и начинает экспансивное распространение по всему мозгу. Более других белковых субстанций нервной системы наибольшему разрушению подвергается альфа-синуклеин. На клеточном уровне механизм этого процесса выглядит как недостаточность дыхательных функций митохондрий, а также окислительный стресс — основная причина апоптоза нейронов. Однако в патогенезе болезни Паркинсона принимают участие и другие факторы, функции которых остаются не раскрытыми до сих пор.
Клиническая картина болезни Паркинсона
Существует тетрада двигательных симптомов болезни Паркинсона: тремор, ригидность, гипокинезия, нарушения постуральной регуляции. Тремор — самый очевидный и легковыявляемый симптом. Наиболее типичен для паркинсонизма тремор покоя, однако возможны и другие виды тремора, например: постуральный тремор или интенционный тремор. Мышечная ригидность может быть малозаметной на начальных стадиях, чаще при дрожательной форме болезни Паркинсона, но очевидной при выраженном синдроме паркинсонизма. Большое значение имеет ранее выявление минимальной асимметрии тонуса в конечностях, так как асимметрия симптомов — характерный признак всех стадий болезни Паркинсона.
Гипокинезия является облигатным симптомом паркинсонизма любой этиологии. На начальных стадиях болезни Паркинсона выявление гипокинезии может затруднено, поэтому прибегают к демонстративным приемам (например, быстро сжать и разжать кулак). Ранние проявления гипокинезии можно наблюдать в элементарных действиях, направленных на самообслуживание (бритье, чистка зубов, застегивание мелких пуговиц и др.
Постуральные нарушения при болезни Паркинсона проявляются довольно рано (например, ассиметрия вытянутых вперед рук). Однако чаще всего они привлекают внимание врачей уже в дезадаптационной своей стадии (III стадия). Объяснением этому может служить тот факт, что постуральные нарушения в сравнении с другими симптомами болезни Паркинсона менее специфичны для нее.
Кроме вышеупомянутых основных проявлений паркинсонизма, болезни Паркинсона сопутствуют и другие симптомы, которые в некоторых случаях могут выходить на первый план клинической картины. Причем степень дезадаптации пациента в таких случаях ничуть не меньше. Перечислим только некоторые из них: слюнотечение, дизартрия и/или дисфагия, запор, деменция, депрессия, нарушения сна, дизурические расстройства, синдром беспокойных ног и другие.
Различают пять стадий болезни Паркинсона, каждая из которых отражает степень тяжести заболевания. Наибольшее распространение получила классификация, предложенная в 1967 году Хеном и Яром:
- 0 стадия — двигательные проявления отсутствуют
- I стадия — односторонние проявления заболевания
- II стадия — двусторонние симптомы без постуральных нарушений
- III стадия — умеренная постуральная неустойчивость, но пациент не нуждается в посторонней помощи
- IV стадия — значительная утрата двигательной активности, но пациент в состоянии стоять и передвигаться без поддержки
- V стадия — в отсутствие посторонней помощи пациент прикован к креслу или постели
Диагноз болезни Паркинсона
Клиническая диагностика болезни Паркинсона проходит в три этапа.
1-ый этап
Распознавание синдрома паркинсонизма и его синдромальная дифференциация от своих неврологических и психопатологических синдромов, так или иначе схожих с истинным паркинсонизмом. Истинный паркинсонизм — это гипокинезия в сочетании с одним из следующих симптомов: тремор покоя (4-6 Гц), мышечная ригидность, постуральная неустойчивость, не связанная с первичными вестибулярными, зрительными и мозжечковыми нарушениями.
Истинный паркинсонизм — это гипокинезия в сочетании с одним из следующих симптомов: тремор покоя (4-6 Гц), мышечная ригидность, постуральная неустойчивость, не связанная с первичными вестибулярными, зрительными и мозжечковыми нарушениями.
2-ой этап
Исключение иных заболеваний, которые могут проявляться синдромом паркинсонизма. Существует несколько критериев исключения болезни Паркинсона:
- окулогирные кризы
- терапия нейролептиками перед дебютом заболевания
- наличие в анамнезе повторных инсультов со ступенеобразным прогрессированием симптомов паркинсонизма, достоверный энцефалит или повторные ЧМТ
- продолжительная ремиссия
- исключительно односторонние проявления в течение более 3 лет
- мозжечковые симптомы
- надъядерный паралич взора
- ранее яркое проявление деменции
- ранее яркое проявление вегетативной недостаточности
- симптом Бабинского
- опухоль головного мозга или открытая гидроцефалия
- неэффективность больших доз леводопы
- интоксикация МФТП
3-й этап
Выявление симптомов, подтверждающих болезнь Паркинсона. Для этого необходимо наличие как минимум трех из нижеперечисленных критериев:
Для этого необходимо наличие как минимум трех из нижеперечисленных критериев:
- односторонние проявления в дебюте болезни
- наличие тремора покоя
- асимметрия симптомов (с большей степенью выраженности на стороне тела, с которой началось заболевание)
- 70-100%-реакция на терапию леводопой
- прогрессирующее течение заболевания
- эффективность леводопы в течение 5 лет и более
- продолжительность заболевания 10 лет и более
Для обследования пациентов с подозрением на болезнь Паркинсона применяют реоэнцефалографию, ЭЭГ, методы нейровизуализации: КТ головного мозга и МРТ.
Дифференциальный диагноз
Болезнь Паркинсона необходимо дифференцировать от всех заболеваний, которые сопровождаются синдромом паркинсонизма: вторичный паркинсонизм, псевдопаркинсонизм, «паркинсонизм плюс». Около 80% случаев синдрома паркинсонизма приходится на болезнь Паркинсона.
Около 80% случаев синдрома паркинсонизма приходится на болезнь Паркинсона.
Следует помнить об определенных клинических особенностях паркинсонизма, которые должны вызывать сомнения в диагнозе болезнь Паркинсона, например: неэффективность леводопы, отсутствие тремора, симметричность двигательных нарушений, ранние проявления признаков периферической вегетативной недостаточности.
Лечение болезни Паркинсона
Пути лечения болезни Паркинсона существенно различаются на ранних и поздних стадиях заболевания, поэтому их стоит рассматривать раздельно.
Лечение болезни Паркинсона на ранних стадиях.
Ранее диагностирование болезни Паркинсона не всегда означает незамедлительное начало какой-либо лекарственной терапии. Для определения сроков начала лекарственного лечения необходимо учитывать тяжесть заболевания, продолжительность заболевания, темп его прогрессирования, любые сопутствующие заболевания, а также «личные факторы» (профессиональное, социальное и семейное положение пациента, психическое состояние, особенности личности и т. д.). Цель такой терапии — восстановление (достаточный регресс) нарушенных функций посредством минимально возможных доз.
д.). Цель такой терапии — восстановление (достаточный регресс) нарушенных функций посредством минимально возможных доз.
Лекарственная терапия на ранней стадии болезни Паркинсона подразумевает использование препаратов, увеличивающих синтез дофамина в мозге, стимулирующих его выброс и блокирующих обратное его поглощение, угнетающих распад дофамина, стимулирующих дофаминовые рецепторы и препятствующие гибели нейронов. К таким препаратам относятся амантадин, селективные ингибиторы МАО-В (селегилин и др.), агонисты дофаминовых рецепторов (пирибедил, прамипексол и др.). Допускается применение вышеуказанных препаратов как в виде монотерапии (чаще), так и в различных комбинациях.
Вышеперечисленные препараты значительно уступают по эффективности препаратам леводопы, однако для лечения болезни Паркинсона на ранних стадиях они вполне подходят. Теоретически на ранних стадиях болезни Паркинсона агонисты дофаминовых рецепторов способны отсрочить назначение леводопы, а на поздних стадиях — снизить ее дозу. Однако не в их пользу говорит большое количество побочных эффектов (язва желудка, ортостатическая гипотензия, психические нарушения, эритромелалгия, ретроперитонеальный фиброз и др.) и способность снижать чувствительность постсинаптических дофаминовых рецепторов.
Однако не в их пользу говорит большое количество побочных эффектов (язва желудка, ортостатическая гипотензия, психические нарушения, эритромелалгия, ретроперитонеальный фиброз и др.) и способность снижать чувствительность постсинаптических дофаминовых рецепторов.
Четкие критерии, определяющие оптимальное время начала лечения препаратами леводопы, отсутствуют. Тем не менее, следует учитывать возраст пациента (по возможности после 60-70 лет), избегать раннего назначения леводопы, при подборе дозы ориентироваться на «откликаемость» пациента на препарат, улучшений в его профессиональной и социальной деятельности.
Лечение болезни Паркинсона на поздних стадиях.
В независимости от характера течения болезни Паркинсона обязательно происходит постепенная трансформация клинической картины заболевания. Со временем прогрессируют уже присутствующие нарушения и появляются новые, большинство из которых с трудом поддается терапии, оказывая тем самым сильное стрессорное воздействие на пациента. Кроме этого, меняется привычный эффект от леводопы — снижается эффективность препарата, нарастают лекарственные дискинезии (как результат гиперчувствительности дофаминовых рецепторов).
Кроме этого, меняется привычный эффект от леводопы — снижается эффективность препарата, нарастают лекарственные дискинезии (как результат гиперчувствительности дофаминовых рецепторов).
Снижение эффективности терапии проявляется снижением срока лечебного действия каждой лозы леводопы. Формируется феномен «включения-выключения», единственным способом борьбы с которым становится постепенное повышение дозы леводопы, а это в свою очередь запускает порочный круг, порождающий новые проблемы, бороться с которыми становится все тяжелее. Реальная помощь в данном случае может быть оказана двумя способами: назначением дополнительной дозы леводопы в целях сокращения интервалов между приемами; добавлением в схему лечения ингибитора КОМТ и переводом пациента на терапию комбинированным препаратом леводопы и энтакапона.
Побочные эффекты терапии леводопой. Одно из проявлений снижения порога чувствительности к некоторым побочным эффектам — тенденция к появлению оральных (или иных) гиперкинезов на фоне симптомов гиперкинезии. Таким образом, в клинической картине болезни Паркинсона парадоксальным образом сочетаются симптомы избытка дофамина (оральные гиперкинезы) и его дефицита (гипокинезия). Снижение дозы леводопы в такой ситуации дает только временное устранение гиперкинеза, через некоторое время он появляется вновь. Ортостатическая артериальная гипотензия при болезни Паркинсона проявляется обычно относительно резким снижением артериального давления вскоре после приема леводопы. Таким побочным эффектом обладают и леводопа, и агонисты дофаминовых рецепторов, поэтому после определения причины побочного эффекта необходимо уменьшить дозу соответствующего препарата.
Таким образом, в клинической картине болезни Паркинсона парадоксальным образом сочетаются симптомы избытка дофамина (оральные гиперкинезы) и его дефицита (гипокинезия). Снижение дозы леводопы в такой ситуации дает только временное устранение гиперкинеза, через некоторое время он появляется вновь. Ортостатическая артериальная гипотензия при болезни Паркинсона проявляется обычно относительно резким снижением артериального давления вскоре после приема леводопы. Таким побочным эффектом обладают и леводопа, и агонисты дофаминовых рецепторов, поэтому после определения причины побочного эффекта необходимо уменьшить дозу соответствующего препарата.
Психические нарушения при болезни Паркинсона могут проявляться в виде депрессии, тревоги, апатии, зрительных галлюцинаций, ажитации. Кроме того, типично появление запоминающихся, ярких сновидений. Со временем все вышеперечисленные нарушения прогрессируют и рано или поздно проявляются и в состоянии бодрствования. Терапию таких психических нарушений необходимо проводить совместно с психиатром. Иногда достаточно избавить пациента от тревоги и страха, так как именно они провоцируют более грубые психические нарушения. Большинство лекарственных дискинезий проявляется на пике действия препарата. Наиболее надежный способ их устранения — уменьшение разовой дозы леводопы с сохранением суточной дозы препарата. Поэтому дробный прием малых доз леводопы — наилучший способ предотвращения дискинезий такого типа.
Иногда достаточно избавить пациента от тревоги и страха, так как именно они провоцируют более грубые психические нарушения. Большинство лекарственных дискинезий проявляется на пике действия препарата. Наиболее надежный способ их устранения — уменьшение разовой дозы леводопы с сохранением суточной дозы препарата. Поэтому дробный прием малых доз леводопы — наилучший способ предотвращения дискинезий такого типа.
В терминальной стадии болезни Паркинсона основные сложности связаны с кахексией, утратой способности к стоянию, ходьбе и самообслуживанию. В это время необходимо проведение целого комплекса реабилитационных мероприятий, направленных на обеспечение оптимальных условий для повседневной бытовой деятельности пациента. Следует помнить, что на поздних стадиях болезнь Паркинсона становится тяжелым бременем не только для самого пациента, но и для его семьи, членам которой может потребоваться не только терапевтическая, но иногда и специализированная помощь.
Хирургическое лечение болезни Паркинсона заключается в проведении стереотаксической деструкции вентролатерального ядра таламуса и субталамического ядра, а также глубокой стимуляции мозга.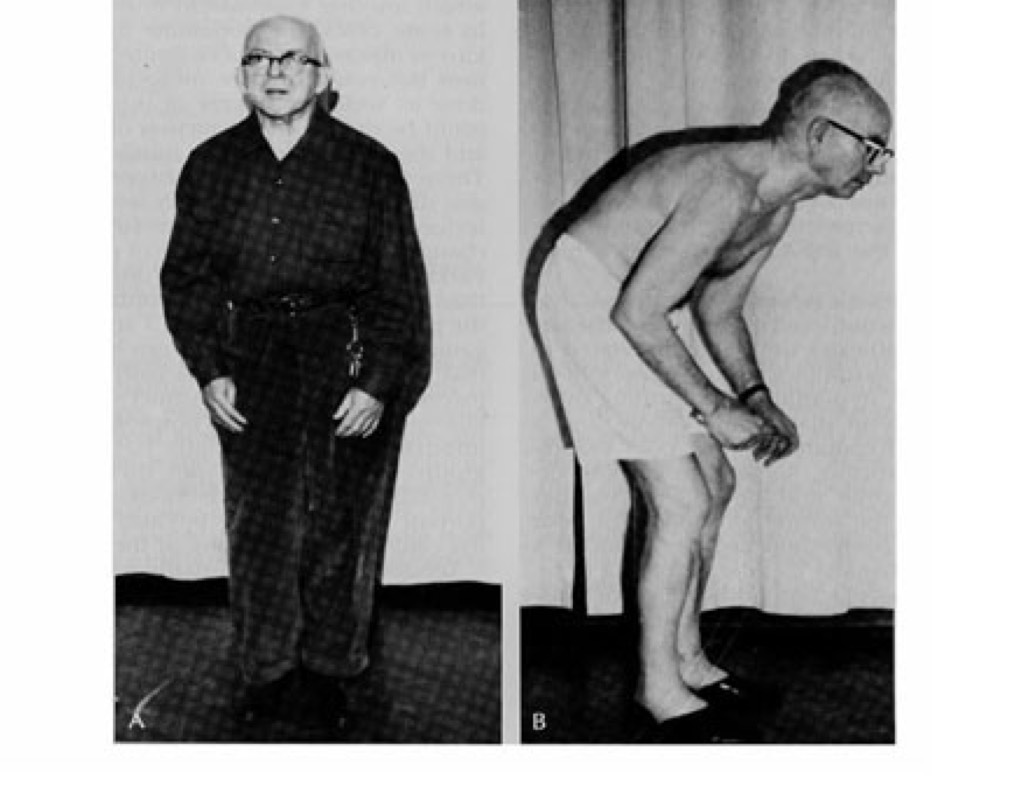 В случае выраженного акинетико-ригидного синдрома рекомендована паллидотомия, а также глубокая электростимуляция бледного шара и субталамического ядра.
В случае выраженного акинетико-ригидного синдрома рекомендована паллидотомия, а также глубокая электростимуляция бледного шара и субталамического ядра.
Прогноз
Для болезни Паркинсона характерно неуклонное нарастание выраженной симптоматики. В 25% случаев в течение первых пяти лет заболевания наступает инвалидизации или смерть. У 89% пациентов, переживших 15 лет течения болезни Паркинсона, неизбежно наступает тяжелая степень инвалидности или смерть. Отмечено снижение уровня смертности пациентов с болезнью Паркинсона в связи с началом применения леводопы, а также рост продолжительности жизни.
Сергей Иллариошкин: «По самым скромным подсчетам, около 35 млн людей в мире страдают болезнью Альцгеймера и болезнью Паркинсона»
Журнал «Ремедиум» №12, 2019г.
Неуклонное старение населения – глобальный вызов, стоящий перед системами здравоохранения многих стран мира из-за возросшего риска развития многих тяжелых нейродегенеративных заболеваний, включая болезнь Альцгеймера (БА) и болезнь Паркинсона (БП).
Насколько опасны эти расстройства, как совершенствуется их диагностика и на чем строится современная терапия? Эти и другие вопросы мы задали Сергею Иллариошкину, заместителю директора по научной работе, руководителю отдела исследований мозга ФГБНУ «Научный центр неврологии», члену-корреспонденту РАН, профессору, д.м.н.
- Сергей Николаевич, БА и БП – две наиболее часто встречающиеся нейродегенеративные патологии, угрожающие людям пожилого и старческого возраста. Что объединяет эти заболевания и каковы основные отличия – в патогенезе, механизме возникновения?
– Речь идет о представителях возраст-зависимых заболеваний, в ряду которых БА стоит на первом месте по распространенности, а БП – на втором. Как и многие другие возрастные патологии, они ассоциированы со старением человека, по мере которого в клетках организма происходят определенные изменения.
К примеру, в нейронах начинают накапливаться белковые агрегаты, которые клетка не может растворить и вывести безопасным образом. Накопление таких труднорастворимых белков в нейронах, а затем и в паренхиме мозга объединяет данные заболевания в общую группу церебральных протеинопатий. Это общий механизм развития нейродегенеративных заболеваний, методы лечения которых в значительной степени направлены на борьбу с патологическими скоплениями аномально скрученных белков. При этом данные заболевания различаются как видами накапливаемых белков, так и структурами мозга, которые затрагиваются.
Накопление таких труднорастворимых белков в нейронах, а затем и в паренхиме мозга объединяет данные заболевания в общую группу церебральных протеинопатий. Это общий механизм развития нейродегенеративных заболеваний, методы лечения которых в значительной степени направлены на борьбу с патологическими скоплениями аномально скрученных белков. При этом данные заболевания различаются как видами накапливаемых белков, так и структурами мозга, которые затрагиваются.
В случае БА происходит накопление белков – бета-амилоидов в участках, связанных с памятью. Основным звеном патогенеза БП является формирование нейротоксических агрегатов белка альфа-синуклеина, которые концентрируются в структурах мозга, отвечающих за двигательные системы. Поэтому различается и клиническая картина данных заболеваний.
У людей, страдающих БА, нарушается память и происходит нарастание других когнитивных расстройств, вплоть до деменции, тогда как у пациентов с БП наблюдаются характерные двигательные расстройства, связанные с нарушением самообслуживания, ходьбы. Это если совсем кратко.
Это если совсем кратко.
- Насколько велико бремя этих заболеваний?
– По самым скромным подсчетам, порядка 35 млн людей в мире страдают суммарно БА и БП, причем в пожилом возрасте доля заболевших существенно увеличивается. Среди людей в возрасте более 70 лет этот показатель составляет 3–5%, тогда как в возрастной группе старше 80 лет уже половина людей страдает либо БА, либо БП.
- Болезнь Альцгеймера – это один из самых распространенных типов деменции. Чем обусловлен основной риск развития данного заболевания?
– Таких факторов несколько, один из них – генетический. Гены, связанные с повышенным риском развития заболевания, сегодня хорошо известны, их можно выявить с помощью тестирования и предопределить возможное начало заболевания. Следующий фактор – женский пол, который более подвержен развитию БА. Кроме того, БА часто болеют люди, которые не имеют высокой интеллектуальной, когнитивной, а также физической нагрузки. И наконец, сам по себе пожилой возраст – это тоже фактор риска.
И наконец, сам по себе пожилой возраст – это тоже фактор риска.
- В какой степени болезнь провоцирует курение?
– Опосредованно, прямой связи нет. Более того, есть данные, что БП у курильщиков развивается достоверно реже.
- Сотрудники Медицинской школы Университета Вашингтона установили связь между качеством сна (короткая фаза глубокого сна) и развитием БА. Согласно результатам проведенного исследования, регулярное недосыпание приводит к повышению уровня тау-белков в мозге и тем самым способствует возникновению БА. Согласны ли Вы с этим утверждением?
– Это одна из теорий, которая сейчас развивается, поскольку интерес в изучении БА сместился от бета-амилоида к тау-протеину. Это второй патологический белок, который накапливается в мозге при БА, разрушая клеточную мембрану нейрона. Поэтому любые новые аспекты метаболизма, касающиеся тау-белка, особенности его действия и вопросы обезвреживания создаваемых им устойчивых химических комплексов в нейронах вызывают большой интерес со стороны ученых. Опубликованы результаты работ, в которых исследовалось функционирование лимфатической системы мозга во сне и ее роль в развитии БА. Несмотря на полученные положительные результаты, говорить о том, что какие‑то структуры сна являются доказанным фактором риска БА, как, например, гены, пока еще рано. Но определенная связь между качеством сна и возникновением БА существует, сегодня этот вопрос активно изучается. Вообще, качественный сон важен для человека: для нормального функционирования его организма, хорошего самочувствия и для укрепления иммунной системы. Это просто один из десятков или даже сотен факторов, которые вносят свой вклад в развитие БА, являющейся многофакторным заболеванием.
Опубликованы результаты работ, в которых исследовалось функционирование лимфатической системы мозга во сне и ее роль в развитии БА. Несмотря на полученные положительные результаты, говорить о том, что какие‑то структуры сна являются доказанным фактором риска БА, как, например, гены, пока еще рано. Но определенная связь между качеством сна и возникновением БА существует, сегодня этот вопрос активно изучается. Вообще, качественный сон важен для человека: для нормального функционирования его организма, хорошего самочувствия и для укрепления иммунной системы. Это просто один из десятков или даже сотен факторов, которые вносят свой вклад в развитие БА, являющейся многофакторным заболеванием.
- Как правило, БА страдают пожилые люди и лица старческого возраста. Встречается ли ранняя форма болезни? С какого возраста начинают снижаться когнитивные функции?
– Ранние формы БА встречаются, но довольно редко. Доказано, что примерно в 10% случаев болезнь носит наследственный характер (связана с патологией трех основных генов).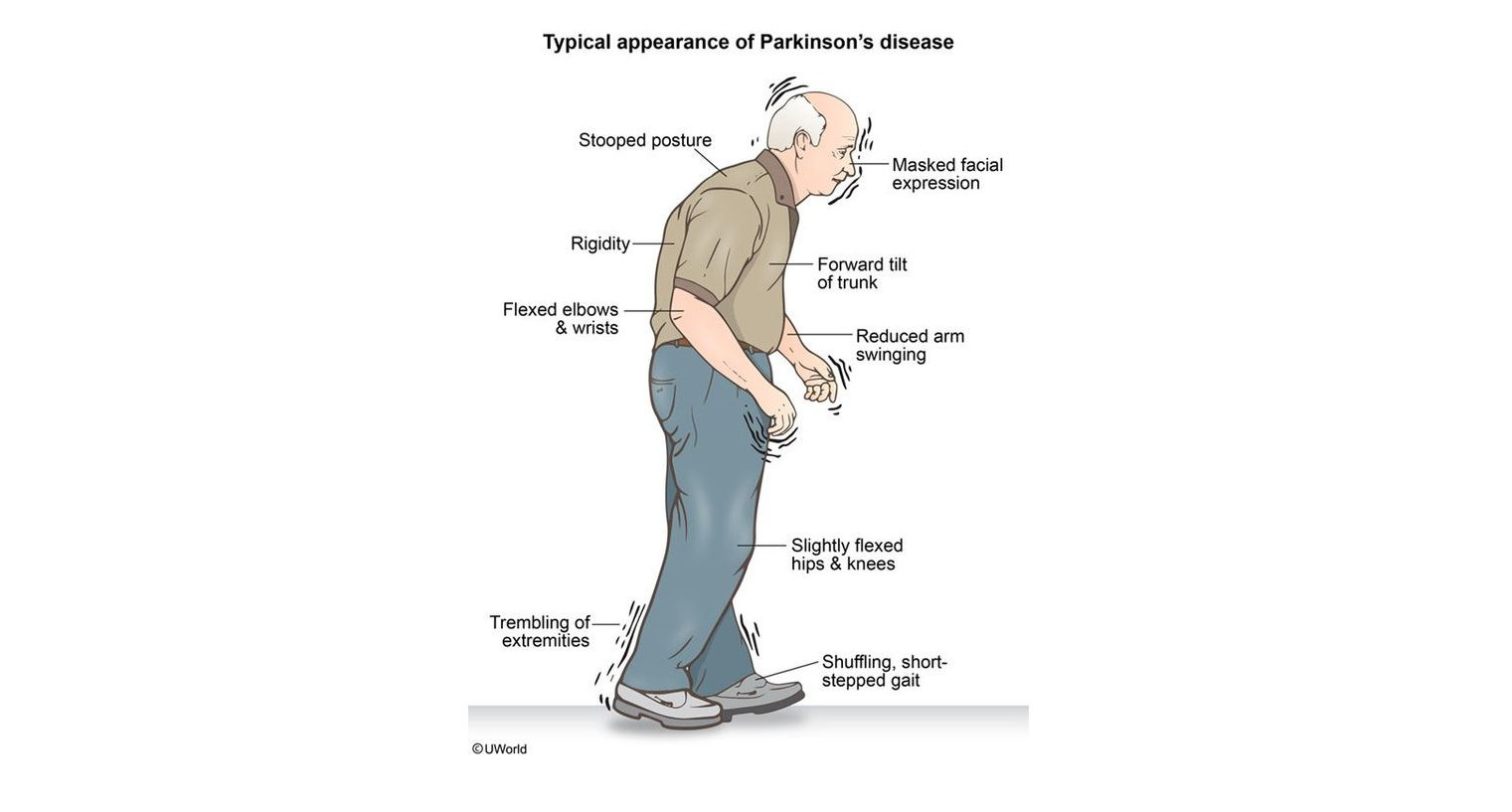 Данная форма заболевания может возникнуть довольно рано, даже в 45 лет, тогда как обычно БА развивается у лиц старше 60–65 лет.
Данная форма заболевания может возникнуть довольно рано, даже в 45 лет, тогда как обычно БА развивается у лиц старше 60–65 лет.
- Каковы первые признаки развития заболевания?
– В первую очередь это снижение памяти. Человек становится забывчивым, начинает терять навыки в профессиональной деятельности, требующие запоминания. При этом привычные виды трудовой деятельности довольно долго сохраняются. Кроме того, больной перестает усваивать новый материал, становится необучаем. В ряде случаев это могут быть отдельные эпизоды, наступает дезориентация в пространстве и во времени.
- БА неизлечима и в ряде стран даже внесена в список заболеваний, при которых допустима эвтаназия. Но борьба с ним активно ведется, причем главная ставка делается на раннее выявление заболевания. В какой степени своевременно проведенные диагностика и адекватное лечение позволяют затормозить заболевание?
– Общая парадигма современной медицины заключается в максимально раннем выявлении любого заболевания и своевременном проведении лечения. В этом смысле БА ничем не отличается, например, от рака. Чем раньше мы диагностируем болезнь, тем лучше будет результат.
В этом смысле БА ничем не отличается, например, от рака. Чем раньше мы диагностируем болезнь, тем лучше будет результат.
- В какой степени БА поддается современной фармакотерапии?
– На сегодняшний день все средства для лечения БА симптоматические, позволяющие только на некоторое время несколько улучшить функцию памяти, немного снизить темпы развития патологического процесса, притормозить его нарастание буквально на несколько лет. Главная проблема состоит в отсутствии ЛС, позволяющих остановить прогрессирование когнитивного дефицита, вмешаться в развитие процесса, даже если диагноз установлен на максимально ранней или доклинической стадии.
В мире проводятся исследовательские работы, направленные на поиск новых, более эффективных подходов к лечению БА, но пока они не дали сколь‑либо значимых результатов. В частности, не увенчалась успехом реализация идеи по созданию антител к бета-амилоиду или тау-протеину, способных «вымывать» эти патологические белки из мозга.
К сожалению, за последние 20 лет только один новый препарат для лечения БА был внедрен в клиническую практику.
- В чем заключается тактика лечения пациентов, страдающих БА?
– Она включает назначение препаратов, которые частично воздействуют на нарушенный обмен нейротрансмиттеров, т. е. передатчиков импульса в головном мозге. Мы улучшаем ацетилхолинергическую передачу с помощью ЛС, влияющих на обмен ацетилхолина. Кроме того, назначаем препараты, которые являются антагонистами глутаматных рецепторов. Вот, собственно, и все, чем врачи сегодня располагают – всего двумя группами ЛС.
- Какие меры, помимо назначения фармакотерапии, способны затормозить развитие БА?
– Любые виды интеллектуальной когнитивной деятельности – доказанные и очень сильные факторы, снижающие риск в развитии БА. Это может быть изучение иностранных языков либо сам род деятельности человека, позволяющий ему каждый день получать умственную нагрузку. Мозг надо максимально нагружать, тогда он будет лучше работать. Его можно сравнить с машиной: если ее оставить в гараже и долго не пользоваться, то она от этого лучше не сохранится. То же самое касается и мозга. Поэтому высокий уровень образования – серьезный фактор антириска развития БА.
Мозг надо максимально нагружать, тогда он будет лучше работать. Его можно сравнить с машиной: если ее оставить в гараже и долго не пользоваться, то она от этого лучше не сохранится. То же самое касается и мозга. Поэтому высокий уровень образования – серьезный фактор антириска развития БА.
Что касается физической нагрузки, то она также важна, но роль ее не столь значительна.
- Если вернуться к БП, то насколько высока распространенность в нашей стране паркинсонизма и других экстрапирамидных расстройств движения?
– Как и во всем мире, примерно 1 случай на 120 000 населения.
- Как Вы оцениваете утверждение исследователей из Университета Джонса Хопкинса о том, что БП начинается в желудочно-кишечном тракте (формируется белок альфа-синуклеин)?
– Это известная точка зрения, связанная с немоторными проявлениями БП: нарушением работы ЖКТ, с другими вегетативными расстройствами.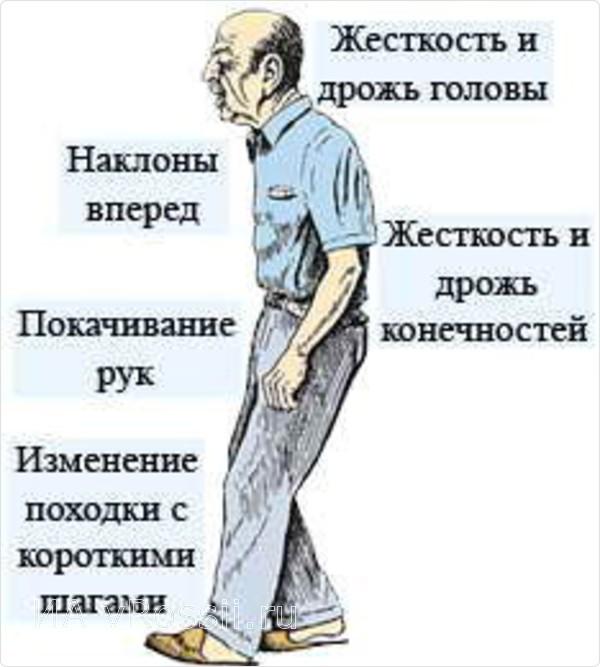 Есть предположение, что БП начинается на периферии. Сегодня даже стали известны нейротоксины, которые могут запускать этот процесс. На данном уровне происходит взаимодействие определенных патологических агентов с белками в нейронах вегетативных сплетений кишечника. Запускается процесс образования патологического альфа-синуклеина – белка, который сворачивается аномальным образом.
Есть предположение, что БП начинается на периферии. Сегодня даже стали известны нейротоксины, которые могут запускать этот процесс. На данном уровне происходит взаимодействие определенных патологических агентов с белками в нейронах вегетативных сплетений кишечника. Запускается процесс образования патологического альфа-синуклеина – белка, который сворачивается аномальным образом.
Затем происходит нейрональный транспорт этих молекул по волокнам блуждающего нерва вверх в головной мозг, что приводит к развитию патологического процесса в ЦНС.
Не все случаи БП могут быть объяснены таким патогенезом, но многие из них укладываются в эту схему. В настоящее время проводится много исследований с целью выяснить, что происходит с альфа-синуклеином в периферических нейронах и в вегетативной нервной системе, а также в коже, в ЖКТ, в слюнной железе. Кстати, практикующие врачи сегодня успешно выявляют БП с помощью биопсии слюнной железы. Цитологическое исследование биопсийного материала позволяет обнаружить патологические скопления альфа-синуклеина.
- Каковы первые признаки болезни?
– Это запоры, нарушение моторики ЖКТ, снижение обоняния – признаки, которые появляются намного раньше, чем изменения двигательной фазы. У пациентов также отмечаются ухудшение настроения, депрессия, боли в мышцах, нарушение поведения в фазе быстрого сна. Человек, переживая сновидения, вдруг начинает активно размахивать руками, сбивать предметы – это очень характерный ранний доклинический симптом.
Потом уже возникают двигательные нарушения – малоподвижность, изменение почерка, подвижности рук, нарушения ходьбы, сгорбленность, тремор конечностей (но этим страдают не все пациенты).
- На какой стадии болезни больной обычно обращается к врачу?
– На 1–2‑й стадии, когда БП проявляется двигательными нарушениями. До их появления больной может обратиться к врачу по поводу запоров или, например, болевого синдрома. Но как правило, на этой доклинической премоторной стадии диагноз БП еще не ставится. Это сложная и почти невозможная задача – при отсутствии двигательных нарушений заподозрить БП на основе столь неспецифических симптомов. Но как только появляются выраженные двигательные нарушения, пациент сразу попадает к неврологу. В развернутой стадии заболевания диагностика несложна.
Это сложная и почти невозможная задача – при отсутствии двигательных нарушений заподозрить БП на основе столь неспецифических симптомов. Но как только появляются выраженные двигательные нарушения, пациент сразу попадает к неврологу. В развернутой стадии заболевания диагностика несложна.
- Если все‑таки говорить о выявлении болезни на ранней стадии, какими должны быть действия врача?
– В данном случае ему необходимо иметь определенный опыт и точно следовать четко сформулированным диагностическим критериям.
- Какие диагностические методы используются при постановке диагноза БП?
– Диагноз БП остается преимущественно клиническим. Процесс диагностического поиска включает в себя несколько этапов. Также применяются дополнительные лабораторно-инструментальные методы, но они не дают 100%-ной точности. Проводятся МРТ-исследования, применяются определенные режимы позитронно-эмиссионной томографии. Все это помогает установить диагноз при подозрении на БП.
Все это помогает установить диагноз при подозрении на БП.
- Вы говорили о проблемах лечения БА. А какова ситуация с БП?
– Остановить патологический процесс невозможно и в том и в другом случае. Но для лечения БП возможностей симптоматической помощи несопоставимо больше.
Это и хирургическое лечение, и введение ЛС в виде помп под кожу или даже сразу в 12‑перстную кишку, а также прием препаратов различных групп, воздействующих на разные нейромедиаторы. Более успешен и поиск инновационных методов для лечения БП. Каждые два года у нас появляется какое‑то новое ЛС или регистрируется новый путь введения препаратов, применяющихся в клинической практике.
- На каких группах ЛС базируется фармакотерапия?
– Нашим пациентам доступен довольно широкий круг препаратов, относящийся к 7 фармакотерапевтическим группам. Это и леводопа – непосредственный предшественник дофамина и агонисты дофаминовых рецепторов, ингибиторы ферментов метаболизма дофамина, ингибиторы рецепторов глутамата, амантадины. Появляются и новые группы препаратов, т. е. картина довольно пестрая.
Появляются и новые группы препаратов, т. е. картина довольно пестрая.
- Насколько быстро передовые западные разработки попадают в Россию?
– Довольно быстро. В нашей стране применяются практически все использующиеся за рубежом виды лечения. Например, сейчас регистрируется и скоро появится в России помпа как система для подкожной дозированной доставки дофаминового агониста апоморфина.
- Какие советы Вы бы дали людям, страдающим БП? Каких жизненных правил им нужно придерживаться?
– Сегодня во многих регионах открыты и функционируют специализированные кабинеты и центры БП. Больному лучше наблюдаться в каком‑то одном центре, у конкретного специалиста, делать это регулярно и ни в коем случае не заниматься самолечением.
Важно отметить, что при БП схема лечения подбирается очень долго, иногда врачи ее меняют и переводят пациента с одной на другую. В связи с тем, что специалист выстраивает долговременную, многолетнюю стратегию лечения, пациенту нужно набраться сил и терпения.
Наряду с проведением фармакотерапии, врач рекомендует пациентам специальные книги-пособия, из которых те узнают о том, как им следует питаться, какие формы физической активности показаны, как правильно принимать препарат.
Также велика роль регулярных физических упражнений, которые препятствуют прогрессированию БП. Это своего рода 8‑я группа ЛС, поскольку физическая активность сопровождается выделением различных пептидных защитных факторов роста в головном мозге. Информацию о необходимых комплексах упражнений (в первую очередь это ходьба, а также некоторые виды упражнений на координацию движений и поддержание равновесия, повышающие эластичность мышц и т. д.) тоже можно найти в пособиях. И конечно, очень важно понимание пациентом, что его болезнь курабельная. Да, ее нельзя излечить, но при соответствующей терапии и выполнении ряда жизненных правил можно очень долго поддерживать приемлемое качество жизни – годы и даже десятилетия. Надо настроиться на серьезную работу вместе с врачом и по возможности сохранять позитивный настрой.
- Каковы перспективы повышения эффективности терапии БП?
– Они связаны с введением новых лекарственных препаратов, дальнейшим изучением патогенеза болезни, внедрением клеточной терапии, которая пока еще находится в стадии разработки. Свою лепту смогут внести работы по нейротрансплантации и по поиску биомаркеров болезни, которые сегодня проводятся. И наконец, для того, чтобы существенно повысить уровень терапии, необходима максимальная персонификация лечения с составлением профиля пациента – генетического и молекулярного.
- Сергей Николаевич, уже несколько лет Вы возглавляете Национальное общество по изучению БП и расстройств движений. Расскажите, пожалуйста, о его функциях и задачах.
– Общество создано 10 лет назад, сегодня оно представлено во всех регионах России. Его главная цель – распространение знаний о БП и других двигательных расстройствах среди врачей. Среди ключевых задач общества – изучение эпидемиологических особенностей заболевания в долгосрочной перспективе, поддержка научных программ, выпуск бюллетеней, ведение сайта, на котором представлена вся имеющаяся информация. Один раз в 3 года мы проводим Национальный конгресс по БП, поддерживаем деятельность пациентских организаций в регионах, работу, направленную на борьбу с орфанными заболеваниями, связанными с двигательными расстройствами. Взаимодействуем с международными организациями в данной области, участвуем в международных программах по ряду исследований.
Один раз в 3 года мы проводим Национальный конгресс по БП, поддерживаем деятельность пациентских организаций в регионах, работу, направленную на борьбу с орфанными заболеваниями, связанными с двигательными расстройствами. Взаимодействуем с международными организациями в данной области, участвуем в международных программах по ряду исследований.
Беседовала Ирина Широкова,
«Ремедиум»
Болезнь Паркинсона – не приговор — 25.01.2019: информационно-познавательный сайт
Кто-то называет эту болезнь загадочной, кто-то страшной, а некоторые узнал о ней, только из новостей о легендарном боксере Мухаммеде Али, который долгие годы страдал этим недугом. В международной классификации болезней она имеет код G20. С того времени как ее описал английский врач Джеймс Паркинсон прошло 200 лет, однако вопросы лечения болезни Паркинсона актуальны по сей день.
Чингиз Шашкин, нейрохирург, медицинский директор клиники StandardNeuro, руководитель общественного объединения «Общество двигательных расстройств – Евразия», один из немногих в Казахстане, кто занимается исследованием и лечением болезни Паркинсона. В интервью порталу El.kz Чингиз Сакаевич рассказал об основных причинах возникновения болезни и как современная медицина может помочь пациентам с этим диагнозом.
В интервью порталу El.kz Чингиз Сакаевич рассказал об основных причинах возникновения болезни и как современная медицина может помочь пациентам с этим диагнозом.
— Чингиз Сакаевич, для того чтобы составить общую картину темы нашего разговора, необходимо пояснить, какие заболевания относятся к нейрохирургическим?
— Нейрохирургия довольно обширная наука, это раздел медицины, который занимается хирургическим лечением неврологических болезней. Основное направление нейрохирургии, это заболевания головного, спинного мозга и периферических нервов, которые можно оперировать. Первое что приходит в голову это травматические повреждения головного мозга, то есть травмы: сотрясения и различные гематомы, переломы черепа, переломы позвоночника с повреждениями спинного мозга. Также нейрохирургия занимается отдельным большим направлением – опухолями головного мозга. Доброкачественные и злокачественные образования, которые лечатся хирургическим путем и основная тактика лечения – удаление опухоли. Еще одно широкое направление нейрохирургии – заболевания позвоночника, которые вызывают неврологические нарушения: грыжи межпозвоночных дисков, различные дистрофические болезни позвоночника, которые оказывают давление на спинной мозг и спинно-мозговые корешки. Нейрохирургия занимается лечением эпилепсии, это тоже большое направление. Есть такая сложная форма эпилепсии фармакорезистентная, то есть устойчивая к медикаментам, и при такой форме лекарства не помогают пациенту. В таких случаях на помощь приходит нейрохирургия, мы можем выявить очаг заболевания и удалить его, после чего эпилепсия проходит.
Еще одно широкое направление нейрохирургии – заболевания позвоночника, которые вызывают неврологические нарушения: грыжи межпозвоночных дисков, различные дистрофические болезни позвоночника, которые оказывают давление на спинной мозг и спинно-мозговые корешки. Нейрохирургия занимается лечением эпилепсии, это тоже большое направление. Есть такая сложная форма эпилепсии фармакорезистентная, то есть устойчивая к медикаментам, и при такой форме лекарства не помогают пациенту. В таких случаях на помощь приходит нейрохирургия, мы можем выявить очаг заболевания и удалить его, после чего эпилепсия проходит.
Чингиз Шашкин.
И есть новое для Казахстана направление – функциональная нейрохирургия, она занимается лечением функциональных расстройств нервной системы, которые не проявляются структурными изменениями головного мозга. Один из ярких примеров такого заболевания, это, то чем я сейчас занимаюсь – болезнь Паркинсона и различные дистонии, которые проявляются в виде двигательных расстройств, тремора, нарушения движения и т. д. И сегодня мы можем воздействовать на головной мозг для того чтобы лечить основные симптомы этих болезней. Также функциональная нейрохирургия занимается лечением хронической боли, а именно хронических болевых синдромов вследствие поражений и повреждений нервных тканей, мы также можем их лечить хирургически — прерывать болевые импульсы, тем самым избавлять человека от боли. Еще этот раздел нейрохирургии занимается хирургическим лечением спастических состояний. Пример спастики – детский церебральный паралич. И если продолжать тему детских заболеваний, есть отдельное направление детская нейрохирургия, это лечение врождённых пороков центральной нервной системы, таких как врожденная гидроцефалия, очень частая патология у детей, когда в силу разных причин у них развивается водянка головного мозга, также лечение врожденного нарушения развития позвоночника и спинного мозга у детей. Вот такие вопросы, если говорить кратко решает нейрохирургия. На самом деле сфера ее деятельности очень широкая.
д. И сегодня мы можем воздействовать на головной мозг для того чтобы лечить основные симптомы этих болезней. Также функциональная нейрохирургия занимается лечением хронической боли, а именно хронических болевых синдромов вследствие поражений и повреждений нервных тканей, мы также можем их лечить хирургически — прерывать болевые импульсы, тем самым избавлять человека от боли. Еще этот раздел нейрохирургии занимается хирургическим лечением спастических состояний. Пример спастики – детский церебральный паралич. И если продолжать тему детских заболеваний, есть отдельное направление детская нейрохирургия, это лечение врождённых пороков центральной нервной системы, таких как врожденная гидроцефалия, очень частая патология у детей, когда в силу разных причин у них развивается водянка головного мозга, также лечение врожденного нарушения развития позвоночника и спинного мозга у детей. Вот такие вопросы, если говорить кратко решает нейрохирургия. На самом деле сфера ее деятельности очень широкая.
— Вы давно занимаетесь исследованиями и лечением болезни Паркинсона. Насколько часто это заболевание встречается в Казахстане и какова природа его возникновения?
— Болезнь Паркинсона в Казахстане абсолютно неизученное заболевание. Мы, к сожалению, сейчас не знаем, сколько в стране находится реальных пациентов с этим недугом и не знаем, почему она появляется у нас. Но если брать мировой опыт и экстраполировать определенные статистические мировые данные, например, России, там давно проводились все эти исследования, то мы можем предполагать, что в Казахстане с болезнью Паркинсона живет порядка 25-30 тысяч человек. На самом деле это очень часто встречающееся нейродвигательное заболевание, оно идет на втором месте после болезни Альцгеймера. Болезнь Паркинсона – это мультифакториальное заболевание, то есть множество разных факторов влияет на развитие данного недуга, но основной – токсический фактор. Некие токсические вещества воздействуют на головной мозг и в нем отмирают клетки черной субстанции. Одни из этих изученных веществ, некоторые пестициды, которые используются в сельском хозяйстве, а мы все являемся потребителями сельскохозяйственной продукции, а люди живущие в селах, с водой даже могут потреблять эти токсины, и, следовательно, они уже в зоне риска. Получается, что заболеть может любой человек. Конечно, болезнь Паркинсона чаще появляется у людей старше 60 лет, но, к сожалению, мы замечаем, что эта болезнь с каждым годом молодеет. Самому молодому человеку из моей практики, который заболел болезнью Паркинсона, было всего 25 лет, это редкие случаи, но мы их стали выявлять все чаще. Когда заболевают люди в молодом возрасте здесь одна из основных причин все-таки генетический фактор, то есть человек несет в себе определённую поломку генов и заболевает. Именно сейчас в Казахстане, мы активно изучаем вопрос генетической предрасположенности к этой болезни. Но опять же отмечу, что можно заболеть ею абсолютно не имея генетической предрасположенности, в силу других причин, которые я уже перечислил.
Одни из этих изученных веществ, некоторые пестициды, которые используются в сельском хозяйстве, а мы все являемся потребителями сельскохозяйственной продукции, а люди живущие в селах, с водой даже могут потреблять эти токсины, и, следовательно, они уже в зоне риска. Получается, что заболеть может любой человек. Конечно, болезнь Паркинсона чаще появляется у людей старше 60 лет, но, к сожалению, мы замечаем, что эта болезнь с каждым годом молодеет. Самому молодому человеку из моей практики, который заболел болезнью Паркинсона, было всего 25 лет, это редкие случаи, но мы их стали выявлять все чаще. Когда заболевают люди в молодом возрасте здесь одна из основных причин все-таки генетический фактор, то есть человек несет в себе определённую поломку генов и заболевает. Именно сейчас в Казахстане, мы активно изучаем вопрос генетической предрасположенности к этой болезни. Но опять же отмечу, что можно заболеть ею абсолютно не имея генетической предрасположенности, в силу других причин, которые я уже перечислил. Например, очень много людей заболевают болезнью Паркинсона после перенесённых сильных стрессов.
Например, очень много людей заболевают болезнью Паркинсона после перенесённых сильных стрессов.
На данный момент эта болезнь в мире неизлечима, но с помощью правильного медикаментозного, своевременного хирургического вмешательства, и реабилитации, мы можем достигнуть хороших результатов. Так как эта болезнь не фатальная и пациенты именно от нее не умирают, они умирают от осложнений болезни, и если не допускать этих осложнений, то люди могут долго вести полноценную жизнь. Но у нас мало специалистов, которые могут правильно диагностировать болезнь Паркинсона, так как у нее нет определенных маркеров, нет анализов по которым можно ее выявить и сразу поставить диагноз. Болезнь выявляется только клинически, то есть определенная совокупность симптомов дает нам возможность ставить диагноз, который ставится только в динамике болезни, в течение длительного наблюдения за пациентом. Ведь помимо самой болезни Паркинсона, существуют и другие паркинсонизмы, недуги которые протекают как болезнь Паркинсона, но ею не являются. Они имеют гораздо сложное течение, плохо поддаются лечению в отличии от болезни Паркинсона. Поэтому из всех паркинсонизмов самый благоприятный прогноз именно у болезни Паркинсона, которая встречается в 80% случаев. И сегодня мы, врачи нейрохирурги, ставим перед собой задачу не определить причину возникновения болезни Паркинсона, а ставим задачу как ее решить, то есть поставить правильный диагноз, назначить лечение, чтобы пациент максимально долго чувствовал себя хорошо и сохранил нормальное качество жизни.
Они имеют гораздо сложное течение, плохо поддаются лечению в отличии от болезни Паркинсона. Поэтому из всех паркинсонизмов самый благоприятный прогноз именно у болезни Паркинсона, которая встречается в 80% случаев. И сегодня мы, врачи нейрохирурги, ставим перед собой задачу не определить причину возникновения болезни Паркинсона, а ставим задачу как ее решить, то есть поставить правильный диагноз, назначить лечение, чтобы пациент максимально долго чувствовал себя хорошо и сохранил нормальное качество жизни.
— Какие первые основные симптомы болезни Паркинсона, сигнализирующие, что следует обратиться к врачу?
— Подчеркну, что первые признаки болезни Паркинсона — не тремор (непроизвольное дрожание рук), как было принято считать. Первым признаком является замедленность движения, но мы этот этап болезни называем фазой двигательных расстройств. Но есть симптомы, позволяющие заподозрить болезнь Паркинсона, еще раньше, до этой фазы. Исследования показывают, что пациенты, которые заболели болезнью Паркинсона, до того как начали испытывать проблемы с движениями, имели другие нарушения, такие «звоночки», которым просто не придали особого значения. Первые «звоночки» это нарушение фазы быстрого сна. Когда человек спит, в норме он полностью отключается, нервная система отключает спинной мозг и спящий не двигается, даже если ему снятся сны будто он двигается, но эти движения он не повторяет в реале. При болезни Паркинсона, к сожалению, эти связи пропадают, и человек повторяет все движения, которые ему снятся. Поэтому сейчас есть исследования, которые говорят, что эти признаки можно использовать как биомаркер болезни. Следующий важный симптом – нарушение обоняния, то есть когда человек перестает различать запахи. И третий свойственный симптом для больных Паркинсоном – нарушение пищеварения. В первую очередь это запоры, человек не может нормально сходить в туалет, это говорит о нарушении иннервации кишечника, его работа замедляется. Все это основные общие предикторы болезни Паркинсона. Но обычно люди начинают обращать внимание, уже со стадии замедленности движения, когда человеку не ловко управлять рукой, например, тяжело стало писать, или посуда выскакивает из рук, или при ходьбе человек перестает размахивать руками, либо есть еще один симптом, мы его называем маскообразное лицо, когда у человека пропадает мимика, какие бы эмоции он не испытывал, у него всегда одно и тоже выражение лица.
Первые «звоночки» это нарушение фазы быстрого сна. Когда человек спит, в норме он полностью отключается, нервная система отключает спинной мозг и спящий не двигается, даже если ему снятся сны будто он двигается, но эти движения он не повторяет в реале. При болезни Паркинсона, к сожалению, эти связи пропадают, и человек повторяет все движения, которые ему снятся. Поэтому сейчас есть исследования, которые говорят, что эти признаки можно использовать как биомаркер болезни. Следующий важный симптом – нарушение обоняния, то есть когда человек перестает различать запахи. И третий свойственный симптом для больных Паркинсоном – нарушение пищеварения. В первую очередь это запоры, человек не может нормально сходить в туалет, это говорит о нарушении иннервации кишечника, его работа замедляется. Все это основные общие предикторы болезни Паркинсона. Но обычно люди начинают обращать внимание, уже со стадии замедленности движения, когда человеку не ловко управлять рукой, например, тяжело стало писать, или посуда выскакивает из рук, или при ходьбе человек перестает размахивать руками, либо есть еще один симптом, мы его называем маскообразное лицо, когда у человека пропадает мимика, какие бы эмоции он не испытывал, у него всегда одно и тоже выражение лица. В последующем все симптомы прогрессируют и человек испытывает еще больший дискомфорт, далее подключается уже тремор пораженных конечностей и это состояние переходит на другую сторону тела. И если не лечить это состояние, то пациент может испытывать колоссальные проблемы, он не может ни работать, ни общаться, это и называется ухудшение качества жизни. На этом этапе важно правильно поставить диагноз и назначить лечение. Конечно, в этом случае на помощь приходят медикаменты, современная фармакология имеет ряд доказавших свою эффективность препаратов, которые могут принимать пациенты с диагнозом болезнь Паркинсона и долго чувствовать себя здоровыми. Природа болезни в том, что в головном мозге не хватает дофамина, — это главный нейромедиатор, который регулирует все наши движения. Его можно стимулировать и восполнить препаратом, точно так же как восполняют инсулин при сахарном диабете. Мы назначаем такой препарат, и человек долгие годы чувствует себя нормально. Этот период мы называем «медовым месяцем» он длится в среднем от 5 до 15 лет.
В последующем все симптомы прогрессируют и человек испытывает еще больший дискомфорт, далее подключается уже тремор пораженных конечностей и это состояние переходит на другую сторону тела. И если не лечить это состояние, то пациент может испытывать колоссальные проблемы, он не может ни работать, ни общаться, это и называется ухудшение качества жизни. На этом этапе важно правильно поставить диагноз и назначить лечение. Конечно, в этом случае на помощь приходят медикаменты, современная фармакология имеет ряд доказавших свою эффективность препаратов, которые могут принимать пациенты с диагнозом болезнь Паркинсона и долго чувствовать себя здоровыми. Природа болезни в том, что в головном мозге не хватает дофамина, — это главный нейромедиатор, который регулирует все наши движения. Его можно стимулировать и восполнить препаратом, точно так же как восполняют инсулин при сахарном диабете. Мы назначаем такой препарат, и человек долгие годы чувствует себя нормально. Этот период мы называем «медовым месяцем» он длится в среднем от 5 до 15 лет. Но, к сожалению дальше болезнь прогрессирует, ведь не зря ее называют медленно прогрессирующей болезнью. Состояние человека ухудшается, и он вынужден принимать все больше и больше медикаментов и тогда появляются различные побочные эффекты медикаментозной терапии. У человека наблюдаются моторные флюктуации, это значит, таблетки уже помогают периодически, так как нервные рецепторы их уже не воспринимают. Из-за больших доз лекарств у пациента появляются дополнительные болезненные симптомы, которые порой более мучительные, чем само заболевание. Появляется ряд других проблем не связанных с двигательными нарушениями, это могут быть пищеварительные, урологические отклонения. К тому же присоединяются психологические проблемы: ухудшается память, появляется тревога, падает настроение, появляется апатия, все это приводит к депрессиям, что также влияет на качество жизни. И тогда мы применяем другие методы лечения. Что касается не моторных патологий, мы стараемся реабилитировать человека, проводим психологические тренинги, используем методики физической активности.
Но, к сожалению дальше болезнь прогрессирует, ведь не зря ее называют медленно прогрессирующей болезнью. Состояние человека ухудшается, и он вынужден принимать все больше и больше медикаментов и тогда появляются различные побочные эффекты медикаментозной терапии. У человека наблюдаются моторные флюктуации, это значит, таблетки уже помогают периодически, так как нервные рецепторы их уже не воспринимают. Из-за больших доз лекарств у пациента появляются дополнительные болезненные симптомы, которые порой более мучительные, чем само заболевание. Появляется ряд других проблем не связанных с двигательными нарушениями, это могут быть пищеварительные, урологические отклонения. К тому же присоединяются психологические проблемы: ухудшается память, появляется тревога, падает настроение, появляется апатия, все это приводит к депрессиям, что также влияет на качество жизни. И тогда мы применяем другие методы лечения. Что касается не моторных патологий, мы стараемся реабилитировать человека, проводим психологические тренинги, используем методики физической активности. Также у пациентов появляются проблемы с дыханием, так как мышцы скованны, что приводит к поверхностному дыханию, страдает голос, все это исправляется специальными упражнениями.
Также у пациентов появляются проблемы с дыханием, так как мышцы скованны, что приводит к поверхностному дыханию, страдает голос, все это исправляется специальными упражнениями.
— Когда врачи прибегают к хирургическому вмешательству?
— Когда уже у человека появляются сильные двигательные расстройства тремор и другие, на помощь приходит хирургическое лечение. Новые технологии, и методики, которые были придуманы еще в 20 веке, позволяют нам изменить работу нервной системы больного и настроить ее на адаптацию головного мозга на недостаток дофамина. Это называется глубинная стимуляция головного мозга, когда в него в определенные участки имплантируются специальные электроды, которые участвуют в активации нормального движения. Электроды подсоединены к стимулятору, который тоже внедряется в организм и генерирует электрические сигналы, как если бы они шли от мозга. Электрический ток изменяет работу нервной системы, и тем самым некоторые симптомы болезни уходят, так лечатся симптомы. Но сама болезнь, повторюсь, остается неизлечимой, но с помощью стимуляторов мы можем контролировать ее. Эффективность такого метода довольно высокая по результатам многих зарубежных исследований она составляет 70-80%. На сегодняшний день метод глубинной нейростимуляции является одним из самых продвинутых и доказавших свою эффективность. Есть много других методик лечения болезни Паркинсона, но они пока не доказали своей эффективности.
Но сама болезнь, повторюсь, остается неизлечимой, но с помощью стимуляторов мы можем контролировать ее. Эффективность такого метода довольно высокая по результатам многих зарубежных исследований она составляет 70-80%. На сегодняшний день метод глубинной нейростимуляции является одним из самых продвинутых и доказавших свою эффективность. Есть много других методик лечения болезни Паркинсона, но они пока не доказали своей эффективности.
Операция по внедрению нейростимулятора пациенту с болезнью Паркинсона.
Многие пациенты после операции по нейростимуляции возвращаются к своей работе, они становятся самостоятельными и не нуждаются в посторонней поддержке, выходят в общество. Ведь в стране 30 тысяч паркинсоников, но вы их не увидите на улице, потому что в силу своего тяжелого состояния они сидят дома в четырех стенах и не выходят в общество, чувствуя себя неполноценными. Конечно, не все пациенты требуют такого вмешательства, у каждого свои показания.
— Сколько человек в Казахстане вы уже прооперировали, используя этот метод?
— С 2013 года, когда в Национальном нейрохирургическом центре началась программа хирургического лечения двигательных расстройств с помощью нейромодуляции, мы прооперировали больше двухсот человек. Так как нейростимуляция является дорогостоящим методом лечения, благодаря политике возмещения бесплатной гарантированной медицинской помощи, операции были сделаны за счет государства. И многие пациенты нам так и говорили, что мы им подарили дополнительные годы жизни, ведь было немало пациентов, испытывающих из-за болезни такую сильную депрессию, что были готовы закончить жизнь суицидом. Эти операции мы провели в Национальном центре нейрохирургии в Астане, в котором я работал до 2018 года. На его базе мы запустили метод нейростимуляции, но сейчас он успешно применяется и в других клиниках. Сейчас моя главная миссия, распространить этот метод лечения среди населения, а так как самые густонаселенные регионы у нас южные, поэтому я уехал на юг, и в Алматы хочу продвигать это направление. Не юге страны пациенты мало осведомлены о таких способах лечения, я и мои коллеги сейчас активно проводим информирование как людей так и врачей. В 2017 году для этого мы специально организовали общественное объединение «Общество двигательных расстройств – Евразия». Мы хотим чтобы казахстанцы знали, что болезнь Паркинсона – не является приговором для пациента, ее можно контролировать с помощью правильного лечения. Если те три основных столпа правильно и вовремя применять: первое – медикаментозная терапия, второе – реабилитация, третье – хирургическое вмешательство, то и качество жизни и здоровье пациента останется на высоком уровне.
Не юге страны пациенты мало осведомлены о таких способах лечения, я и мои коллеги сейчас активно проводим информирование как людей так и врачей. В 2017 году для этого мы специально организовали общественное объединение «Общество двигательных расстройств – Евразия». Мы хотим чтобы казахстанцы знали, что болезнь Паркинсона – не является приговором для пациента, ее можно контролировать с помощью правильного лечения. Если те три основных столпа правильно и вовремя применять: первое – медикаментозная терапия, второе – реабилитация, третье – хирургическое вмешательство, то и качество жизни и здоровье пациента останется на высоком уровне.
— Какой средний возраст пациентов получивших лечение методом нейростимуляции?
— Средний возраст этих людей — 55 лет. Самое обидное, то, что болезнь диагностируется у довольно молодых работоспособных людей, которые находятся на пике своей карьеры. 55 лет — самый продуктивный возраст, это умудренный опытом человек и в какой-то момент он, можно сказать, выходит из строя из-за этой болезни. Поэтому еще одна большая роль лечения – возвращение квалифицированных специалистов обратно к труду. За рубежом проведены такие исследования, которые позволяют нам с этической стороны делать эти операции в более раннем возрасте и на ранней стадии заболевания, когда пациенты еще не получили инвалидность, когда они еще ведут активную социальную жизнь. Если сейчас мы добьемся ранней диагностики болезни Паркинсона, достаточной информированности населения, о методах ее лечения включая врачей, тогда мы добьемся большего экономического эффекта для государства. 30 тысяч человек для нашего небольшого по численности населения Казахстана это достаточно большая цифра. При этом каждый год количество заболевших увеличивается примерно на 1200 человек.
Поэтому еще одна большая роль лечения – возвращение квалифицированных специалистов обратно к труду. За рубежом проведены такие исследования, которые позволяют нам с этической стороны делать эти операции в более раннем возрасте и на ранней стадии заболевания, когда пациенты еще не получили инвалидность, когда они еще ведут активную социальную жизнь. Если сейчас мы добьемся ранней диагностики болезни Паркинсона, достаточной информированности населения, о методах ее лечения включая врачей, тогда мы добьемся большего экономического эффекта для государства. 30 тысяч человек для нашего небольшого по численности населения Казахстана это достаточно большая цифра. При этом каждый год количество заболевших увеличивается примерно на 1200 человек.
— Есть ли такая статистика по заболевшим, это больше люди интеллектуального труда или физического?
— Специально мы таких исследований не проводили, очень интересно было бы их провести. Но на самом деле этой болезнью в одинаковой степени страдают люди, как умственного труда, так и физического.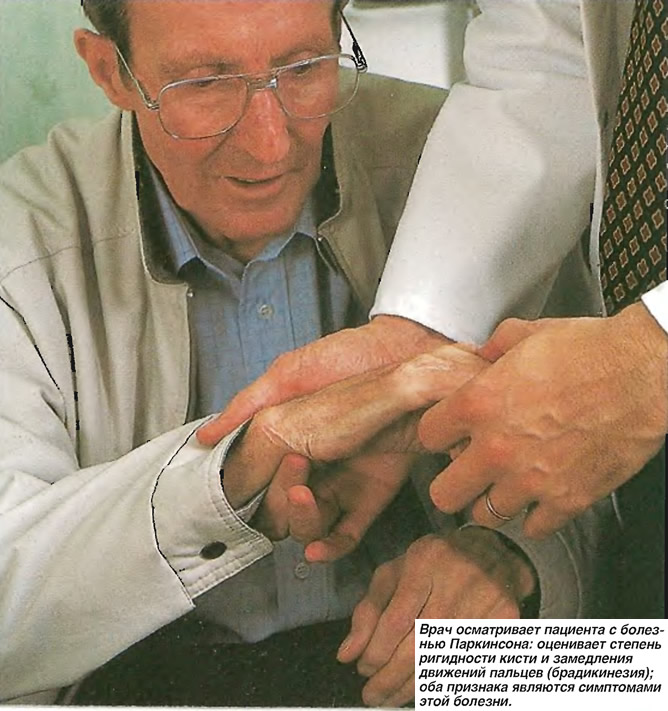 Нужно понимать, что профессиональная, деятельность не самый важный фактор развития болезни Паркинсона. Но уже доказано, что пациенты, которые часто получали травмы головы, у них развивается эта болезнь. Поэтому можно сказать, что представители некоторых спортивных единоборств находятся в группе риска.
Нужно понимать, что профессиональная, деятельность не самый важный фактор развития болезни Паркинсона. Но уже доказано, что пациенты, которые часто получали травмы головы, у них развивается эта болезнь. Поэтому можно сказать, что представители некоторых спортивных единоборств находятся в группе риска.
— Существуют ли рекомендации по профилактике болезни Паркинсона?
— Прежде всего, это, конечно же, активность, физическая и умственная. Это является главным фактором предотвращающим развитие нейродвигательных заболеваний, как болезни Паркинсона, так и Альцгеймера. Люди, которые более активны в физическом и умственном плане, они болеют меньше и это доказанный факт. Еще один важный фактор – питание. Доказано что некоторые продукты, чаще вызывают эту болезнь. Например, люди, которые много употребляют молочных продуктов, чаще болеют болезнью Паркинсона, чем остальные. Но сказать: не пейте молоко, и не ешьте творог, было бы неправильно. Но я в этом случае посоветую употреблять в первую очередь качественные молочные продукты, тогда эти риски будут нивелированы. Также доказано, что люди, которые пьют кофе и курят табак, они менее подвержены болезни Паркинсона. Конечно, я не могу рекомендовать всем курить сигареты и пить много кофе, но такой факт существует. Важно употреблять в пищу проверенные продукты, прошедшие санитарную проверку не подверженные химической обработке, потому что пестициды, которые активно применяют в сельском хозяйстве способны попадать в продукцию, тем самым вызывая болезнь. И в общем, нужно следить за своим рационом, чтобы он был сбалансирован, вредные жиры заменять полезными, есть больше овощей и фруктов, потому что общее состояние организма также влияет на восприимчивость к этой болезни.
Также доказано, что люди, которые пьют кофе и курят табак, они менее подвержены болезни Паркинсона. Конечно, я не могу рекомендовать всем курить сигареты и пить много кофе, но такой факт существует. Важно употреблять в пищу проверенные продукты, прошедшие санитарную проверку не подверженные химической обработке, потому что пестициды, которые активно применяют в сельском хозяйстве способны попадать в продукцию, тем самым вызывая болезнь. И в общем, нужно следить за своим рационом, чтобы он был сбалансирован, вредные жиры заменять полезными, есть больше овощей и фруктов, потому что общее состояние организма также влияет на восприимчивость к этой болезни.
Чингиз Сакаевич, спасибо за содержательное интервью!
Болезнь Фара — сигнал для невролога и сложность постановки диагноза
Неврологические симптомы разного рода, например, экстрапирамидные нарушения (ригидность, тремор, гиперкинезы), эпилептические припадки, деменция, юный возраст, гипопаратиреоз — все это является сигналом для специалистов к постановке диагноза редкого заболевания «болезнь Фара».
Болезнь Фара — это редкое нейродегенеративное заболевание, связанное с неатеросклеротическим обызвествления коры полушарий мозга, базальных ганглиев и зубчатых ядер мозжечка, вследствие отложения солей кальция и железа в стенки мелких артерий и артериол, а также в вещество головного мозга.
Этиология и патогенез. Этиология болезни Фара окончательно не установлена. Главным патогенетическим механизмом является нарушение кальций-фосфорного обмена. Основной причиной, которая может привести к данному нарушению обмена считается первичный (аутоиммунный) или послеоперационный эндокринный аденоматоз щитовидной или паращитовидных желез. Другим возможным механизмом называют хронический респираторный алкалоз, что приводит к электролитных нарушений (в виде гиперкальциемии, гипонатриемии), и как следствие приводит к гипоксии головного мозга. Существует мнение о генетические механизмы нарушения обмена кальция при болезни Фара, ассоциированных с определенным локусом хромосомы 14q.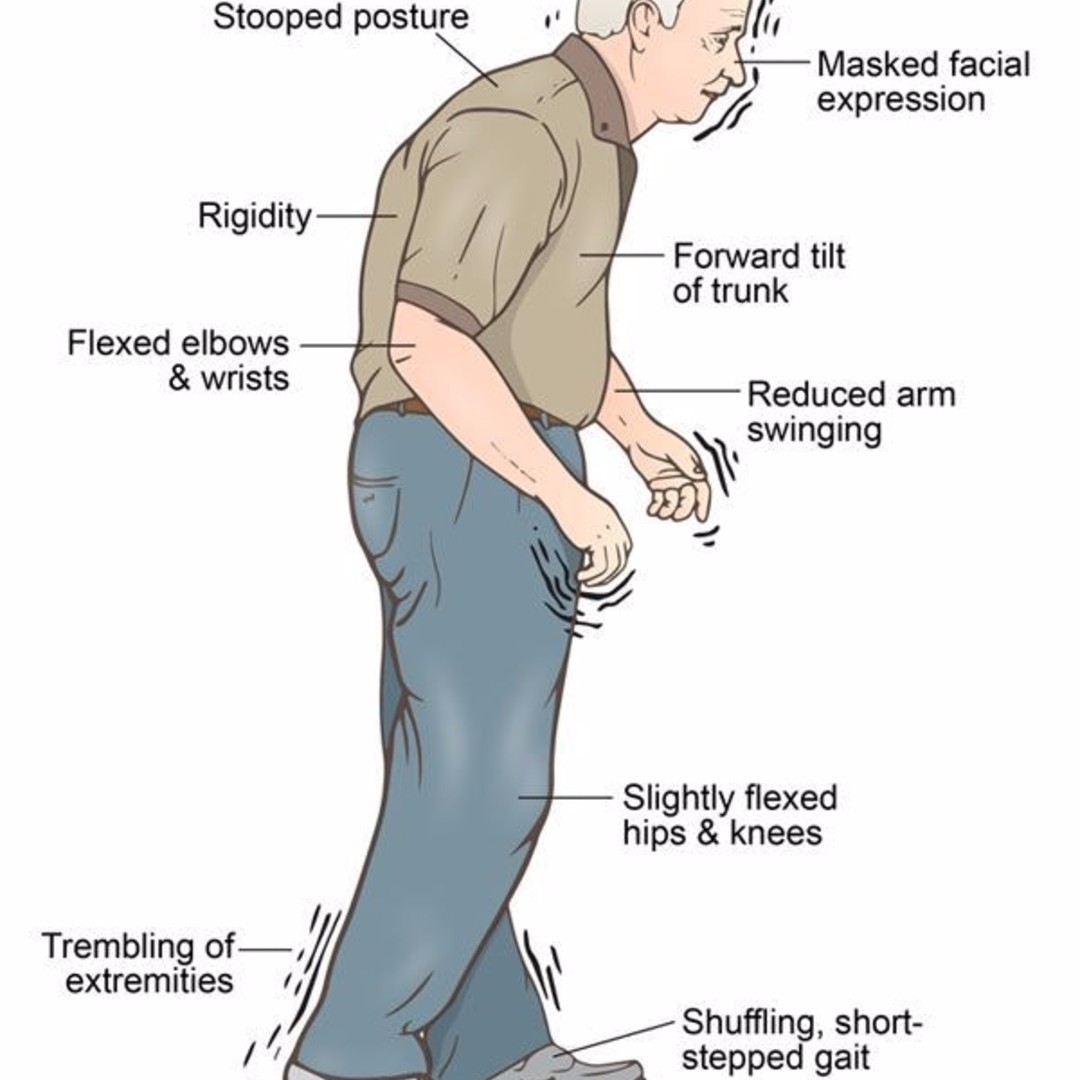 Однако взаимосвязь гипотиреоза с локусом 11-й хромосомы, псевдогипопаратиреоза — 20-й, а синдрома Дауна — 21-й исключает возможность того, что за накопление кальция и других минералов в головном мозге отвечает только один ген.
Однако взаимосвязь гипотиреоза с локусом 11-й хромосомы, псевдогипопаратиреоза — 20-й, а синдрома Дауна — 21-й исключает возможность того, что за накопление кальция и других минералов в головном мозге отвечает только один ген.
Спорадические случаи обызвествления мозговых структур обнаруживают у больных гипопаратиреозом, у детей с болезнью Дауна, лейкоэнцефалиты. Также спорадические случаи обызвествления мозговых структур могут наблюдаться после введения в субарахноидальное пространство метотрексата, после облучения черепа, отравления угарным газом, свинцом, при хронической интоксикации витамином D. Случаи кальцификации подкорковых структур описаны у лиц, перенесших краснуху, у больных СПИДом. Кальцификаты в базальных ганглиях нередко оказываются у лиц пожилого возраста, поэтому на практике чаще встречается случайное сочетание болезни Паркинсона и кальцификации базальных ганглиев, чем болезнь Фара. Поскольку целый ряд расстройств сопровождается двусторонним кальцификацией подкорковых структур, лучше использовать термин, отражающий анатомическую локализацию, например «стриопаллидозубчатый», «стриопаллидарный» или «мозжечковой кальциноз».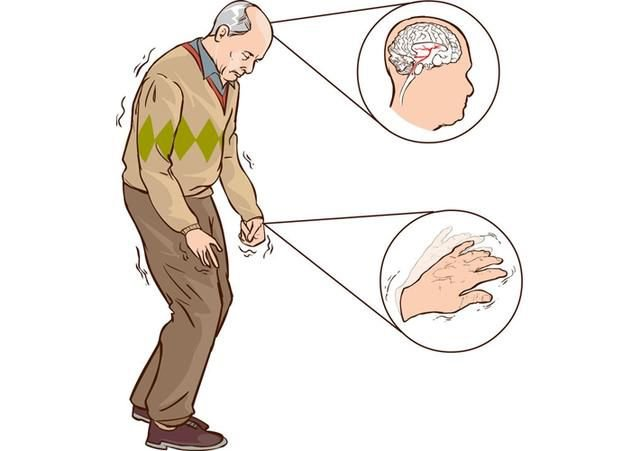
При болезни Фара кальцификация встречается во всех участках мозга, но преобладает в области базальных ганглиев. Описано, что поражаются обычно артерии среднего и мелкого диаметра и капилляры, но редко встречаются и кальцинированные вены. По ходу сосудов в прилегающей мозговой ткани обнаруживают россыпь мелких обособленных конгломератов кальция. По данным A. Gusеo и соавт., Кальцинаты состоят из тонких нитей размером 140-400 мкм. В образцах тканей обнаруживаются также следы мукополисахаридов, алюминия, мышьяка, кобальта, меди, молибдена, железа, свинца, марганца, магния, фосфора, серебра и цинка.
Клиническая картина заболевания разнообразна и не коррелирует с морфологическими данными. Болезнь Фара часто протекает бессимптомно. По данным ряда авторов, прижизненно эта болезнь проявляется лишь в 1-2% случаев. Так, H. Goldscheider и соавт., Проведя КТ головного мозга в 8000 больных, обнаружили кальцификацию базальных ганглиев в 19 и только в 6 из них были клинические симптомы болезни.
Неврологическими симптомами являются разного рода экстрапирамидные расстройства (ригидность, тремор, гиперкинезы), преходящие или стойкие пирамидные знаки, эпилептические припадки, деменция. К наиболее распространенным проявлений болезни Фара принадлежат двигательные нарушения, половина которых представлена паркинсонизмом, в других случаях наблюдаются гиперкинезы (хорея, тремор, дистония, атетоз, орофациальная дискинезия).
Когнитивные расстройства является вторым по распространенности синдромом, за ним следуют мозжечковые симптомы и нарушения речи. Нередко наблюдается сочетание различных клинических единиц, например гипокинеза, когнитивных нарушений и церебеллярных симптомов.
Другие неврологические микросимптомы включают пирамидные нарушения, психиатрические расстройства, нарушение походки и чувствительности, а также боль. По мнению большинства авторов, неврологические расстройства лишь косвенно связанные с локализацией и размерами ячеек. Нередко отмечаются проявления гиперпаратиреоз или гипопаратиреоз: локальные судороги, тетанические судороги, боли в дистальных отделах конечностей, положительные симптомы Хвостека и Труссо. Заболевание поражает людей любого возраста, но чаще всего лиц молодого и среднего возраста (20-30 лет). Условно выделяют три группы больных: лиц молодого возраста с признаками церебрального кальциноза, пациентов с гипопаратиреозом и пожилых больных с относительно невыраженной кальцификацией.
Нередко отмечаются проявления гиперпаратиреоз или гипопаратиреоз: локальные судороги, тетанические судороги, боли в дистальных отделах конечностей, положительные симптомы Хвостека и Труссо. Заболевание поражает людей любого возраста, но чаще всего лиц молодого и среднего возраста (20-30 лет). Условно выделяют три группы больных: лиц молодого возраста с признаками церебрального кальциноза, пациентов с гипопаратиреозом и пожилых больных с относительно невыраженной кальцификацией.
Диагностика и лечение. Диагноз подтверждается нейровизуализационнымы методиками после исключения нарушений обмена кальция и пороков развития. При проведении рентгенографии черепа, компьютерной томографии у пациентов с болезнью Фара в головном мозге наблюдаются множественные массивные симметричные очаги обызвествления подкорковых ганглиев (чаще бледного шара) и колена внутренней капсулы (рентгенологический синдром Фара).
Несмотря на широкую доступность КТ или МРТ и частые случайные находки отложений кальция в подкорковых ядрах у бессимптомных пациентов, болезнь Фара (двусторонний стриопаллидозубчатый кальциноз) остается редким заболеванием. Если паркинсонизм сочетается с деменцией и мозжечковые симптомами, то КТ головного мозга остается важнейшим диагностическим инструментом, поскольку вышеописанное заболевание часто сопровождается вышеупомянутыми нарушениями. Главной проблемой в дифференциальной диагностике остается гипопаратиреоз. Определение кальция и паратгормона сыворотки помогает отличить гипопаратиреоз от двустороннего стриопаллидозубчатого кальциноза, если при томографии визуализируется двусторонняя кальцификация стриопаллидозубчатых структур.
Если паркинсонизм сочетается с деменцией и мозжечковые симптомами, то КТ головного мозга остается важнейшим диагностическим инструментом, поскольку вышеописанное заболевание часто сопровождается вышеупомянутыми нарушениями. Главной проблемой в дифференциальной диагностике остается гипопаратиреоз. Определение кальция и паратгормона сыворотки помогает отличить гипопаратиреоз от двустороннего стриопаллидозубчатого кальциноза, если при томографии визуализируется двусторонняя кальцификация стриопаллидозубчатых структур.
Дифференциальная диагностика болезни Фара часто проводится с паразитарных поражением нервной системы (токсоплазмоз, эхинококкоз, цистицеркоз). В этих случаях диагностическую ценность представляют эпидемиологический анамнез и специфические серологические реакции крови и спинномозговой жидкости. Реже заболевание дифференцируют с туберозным склерозом Бурневиля, при котором встречаются характерные изменения кожи.
Терапия носит симптоматический характер и, как правило, направлена на улучшение кальций-фосфорного обмена; при наличии симптомов паркинсонизма лучше использовать препараты леводопы (мадопар, синемет, наком), чем дофаминовые агонисты. В качестве патогенетического лечения показано назначение антиоксидантов, мозговых метаболитов, влияние на электролитный состав крови.
В качестве патогенетического лечения показано назначение антиоксидантов, мозговых метаболитов, влияние на электролитный состав крови.
Неврология в Нижнем Новгороде | Больница ПОМЦ
Осмотр (консультация) врача-физиотерапевта (первичный)
740.00 ₽
Осмотр (консультация) врача-физиотерапевта (повторный)
360.00 ₽
Электрофорез лекарственных препаратов при различных заболеваниях
360.00 ₽
Дарсонвализация при различных заболеваниях
360.00 ₽
Франклинизация
390.00 ₽
Ультрафиолетовое облучение при различных заболеваниях
180.00 ₽
Воздействие низкоинтенсивным лазерным излучением при различных заболеваниях
360.00 ₽
Воздействие магнитными полями при различных заболеваниях
360.00 ₽
Ультрафонофорез лекарственный при разных патологиях
370.00 ₽
Аэрозольтерапия
250.00 ₽
Массаж волосистой части головы
250.00 ₽
Массаж лица
250.00 ₽
Массаж шеи
250.00 ₽
Массаж при заболеваниях позвоночника (воротниковая зона 1,5 ед. )
)
390.00 ₽
Массаж рук (верхней конечности 1,5 ед.)
360.00 ₽
Массаж рук ( верхней конечности, надплечья и области лопатки 2 ед.)
450.00 ₽
Массаж рук ( плечевого сустава 1 ед.)
250.00 ₽
Массаж рук (локтевого сустава 1 ед.)
250.00 ₽
Массаж рук (лучезапястного сустава 1 ед.)
250.00 ₽
Массаж рук (кисти и предплечья 1 ед.)
250.00 ₽
Массаж грудной клетки (2,5 ед)
590.00 ₽
Массаж при заболеваниях позвоночника (спины 1,5 ед.)
360.00 ₽
Массаж при заболеваниях позвоночника (спины и поясницы 2 ед.)
450.00 ₽
Массаж живота
250.00 ₽
Массаж при заболеваниях позвоночника (пояснично-крестцовой области 1 ед.)
270.00 ₽
Массаж при заболеваниях позвоночника (шейно-грудного отдела позвоночника 2 ед.)
500.00 ₽
Массаж при заболеваниях позвоночника (области позвоночника 2,5 ед.)
670.00 ₽
Массаж ног ( нижней конечности 1,5 ед.)
360.00 ₽
Массаж ног (нижней конечности и поясницы 2 ед. )
)
500.00 ₽
Массаж ног (тазобедренного сустава 1 ед.)
250.00 ₽
Массаж ног (коленного сустава 1 ед.)
250.00 ₽
Массаж ног (голеностопного сустава 1 ед.)
250.00 ₽
Массаж ног (стопы и голени 1 ед.)
250.00 ₽
Общий массаж ( 6ед.)
1400.00 ₽
Ванны газовые (кислородные, углекислые, азотные)
370.00 ₽
Прием (осмотр, консультация) врача-рефлексотерапевта первичный
480.00 ₽
Прием (осмотр, консультация) врача-рефлексотерапевта повторный
250.00 ₽
Рефлексотерапия при различных заболеваниях
540.00 ₽
Комплекс «Антитабак» (3 процедуры)
3480.00 ₽
Чрескожная электронейростимуляция при различных заболеваниях
450.00 ₽
Лечебная физкультура при различных заболеваниях
310.00 ₽
Индивидуальное занятие лечебной физкультурой при различных заболеваниях
530.00 ₽
Лечебная физкультура с использованием тренажера
180.00 ₽
Электроимпульсная терапия при различных заболеваниях
370. 00 ₽
00 ₽
Многофункциональная электростимуляция скелетных мышц
560.00 ₽
Тренировка с биологической обратной связью при различных заболеваниях
370.00 ₽
Воздействие парафином при различных заболеваниях
370.00 ₽
Гирудотерапия (одна пиявка)
400.00 ₽
Вакуумное воздействие
275.00 ₽
Аэровоздействие
270.00 ₽
Блокада корешковая, суставная
420.00 ₽
Блокада эпидуральная
530.00 ₽
Люмбальная пункция
530.00 ₽
Блокада паровертебральная
370.00 ₽
Блокада лицевого нерва
320.00 ₽
Блокада тройничного нерва
320.00 ₽
Блокада канала нерва
320.00 ₽
Блокада заушная затылочная
210.00 ₽
Консультация психотерапевта
1790.00 ₽
Курс индивидуальной краткосрочной психотерапии
17960.00 ₽
Групповой тренинг
7560.00 ₽
Курс аутогенной тренировки
3520.00 ₽
Введение препарата ботулинического токсина типа А ( Ксеомин 100ЕД)
18170.00 ₽
Введение препарата ботулинического токсина типа А (Ксеомин, Ботокс, 100ЕД, Диспорт 500ЕД, без стоимости препарата)
1890.00 ₽
Консультация на дому для определения реабилитационного потенциала
1890.00 ₽
«Стационар на дому»
3520.00 ₽
Первичное обследование логопеда
1050.00 ₽
Индивидуальное коррекционное занятие с логопедом
900.00 ₽
Оценка результатов занятий логопеда с формированием заключения
1260.00 ₽
Индивидуальное коррекционное занятие с обучением родственников
1210.00 ₽
Первичное обследование психолога
1050.00 ₽
Оценка результатов занятий психолога с формированием заключения
1260.00 ₽
Индивидуальное занятие с психологом
900.00 ₽
Консультация врача-психиатра первичная
1420.00 ₽
Консультация врача-психиатра повторная
950.00 ₽
Консультация врача- сомнолога-эпилептолога первичная
1420.00 ₽
Консультация врача- сомнолога-эпилептолога повторная
950.00 ₽
Занятие с эрготерапевтом
1000.00 ₽
Консультация врача-невролога альголога первичная
1420.00 ₽
Консультация врача-невролога альголога повторная
1210.00 ₽
Консультация врача-невролога паркинсонолога первичная
1420.00 ₽
Консультация невролога — паркинсонолога повторная
1210.00 ₽
Консультация невролога-ботулинотерапевта
1680.00 ₽
Консультация заведующего отделением КБ 2, специалиста к.м.н., первичная
1420.00 ₽
Консультация заведующего отделением КБ 2, специалиста к.м.н., повторная
1210.00 ₽
Консультация врача-невролога КБ№2 первичная
1210.00 ₽
Консультация врача-невролога КБ№2 повторная
950.00 ₽
Консультация врача-нейрохирурга КБ№2 первичная
1210.00 ₽
Консультация врача-нейрохирурга КБ№2 повторная
950.00 ₽
Консультация врача-невролога реабилитолога
1680.00 ₽
Консультация врача- нейроофтальмолога
1370.00 ₽
Заболевания центральной и периферической нервной системы
Нервная система человека анатомически делится на две части: центральную (ЦНС) и периферическую (ПНС). Это сложная структура, которая пронизывает все органы и ткани нашего тела. Именно благодаря ей возможна саморегуляция всех жизненных функций организма, а также восприятие, хранение и обработка полученной информации. Нервные импульсы позволяют нам ощущать и воспринимать окружающий мир во все его многогранности. Однако из-за сложности и хрупкости строения нервной системы травмы, повреждения и заболевания (в том числе и генетические) могут нарушить ее слаженную работу.
Наиболее распространенные заболевания нервной системы:
- Острые патологии, затрагивающие сосуды головного мозга. К ним относятся инсульт, дисциркуляторная энцефалопатия, внутримозговые кровоизлияния, внутричерепные артериальные аневризмы и т.д.
- Последствия черепно-мозговых травм
- Инфекционные заболевания ЦНС: менингиты, энцефалиты, абсцесс головного мозга, полиомиелит и другие
- Рассеянный склероз
- Эпилепсия
- Возрастные заболевания нервной системы – болезнь Паркинсона и болезнь Альцгеймера
- Остеохондроз позвоночника
- Генетические и наследуемые заболевания нервной системы. К этой группе принято относить такие патологии, как синдром Лея, синдром Туретта, спинальную мышечную атрофию, болезни Хантингтона и Баттена и т.д.
- Различные нарушения в работе периферической нервной системы: невралгии, невриты, люмбалгии и другие.
Симптомы заболеваний нервной системы
Из-за многообразия форм и видов неврологических расстройств, выделить общие симптомы бывает сложно, однако существует ряд наиболее часто встречающихся признаков, которые могут свидетельствовать о развитии заболевания нервной системы. К ним относятся:
- Нарушения сна – бессонница
- Повышенная тревожность и раздражительность
- Пониженная работоспособность, вялость, сонливость
- Проблемы с запоминанием, снижение внимательности
- Возникновение навязчивых мыслей и фобий
- Нервные тики, непроизвольное сокращение мышц
- Головные боли, мигрени, боли в конечностях
- Частые перепады артериального давления
- Нарушения обоняния, вкусовые отклонения, проблемы со зрением
Лечение заболеваний нервной системы в санатории
При нарушениях в работе центральной или периферической нервной системы, в зависимости от индивидуальных показаний и противопоказаний, пациенту могут быть назначены различные процедуры. Чаще всего в программу лечения заболеваний нервной системы входит бальнеотерапия, водо- и грязелечение, различные виды ручного и аппаратного массажа, физиотерапия. Кроме того, во время отдыха в санатории намного легче придерживаться ежедневного графика активности и сна, соблюдать диету и другие предписания лечащего врача.
Время выполнения скрипта: 0.0027 сек.
Болезнь Паркинсона (БП) Mayfield Brain & Spine Цинциннати, Огайо
Обзор
Болезнь Паркинсона (БП) — это прогрессирующее заболевание, поражающее нервные клетки головного мозга, отвечающие за движения тела. Когда нейроны, продуцирующие дофамин, умирают, возникают такие симптомы, как тремор, медлительность, жесткость и проблемы с балансом. Лечение направлено на уменьшение симптомов для обеспечения более активного образа жизни и включает прием лекарств, диету, упражнения и операции по глубокой стимуляции мозга.
Нервная система и дофамин
Чтобы понять болезнь Паркинсона, полезно понять, как работают нейроны и как БП влияет на мозг (см. Анатомия мозга).
Нервные клетки или нейроны отвечают за отправку и получение нервных импульсов или сообщений между телом и мозгом. Попробуйте представить себе электропроводку в вашем доме. Электрическая цепь состоит из множества проводов, соединенных таким образом, что при включении выключателя зажигается лампочка.Точно так же возбужденный нейрон будет передавать свою энергию соседним нейронам.
Нейроны имеют клеточное тело с ветвящимися ветвями, называемыми дендритами, которые действуют как антенны и принимают сообщения. Аксоны несут сообщения от тела клетки. Импульсы проходят от нейрона к нейрону, от аксона одной клетки к дендритам другой, пересекая крошечный промежуток между двумя нервными клетками, называемый синапсом. Химические посланники, называемые нейротрансмиттерами, позволяют электрическому импульсу преодолевать разрыв.
Нейроны разговаривают друг с другом следующим образом (рис.1):
Рис. 1. Нейроны общаются друг с другом через крошечный промежуток, называемый синапсом. Входящие сообщения от центра изображения передаются в аксон, где нервная клетка стимулируется высвобождать нейротрансмиттеры в синапс. Соседние рецепторы нервных клеток улавливают эти химические посланники и эффективно передают сообщение следующей нервной клетке.
- Входящие сообщения от дендритов передаются к концу аксона, где мешочки, содержащие нейротрансмиттеры (дофамин), открываются в синапс.
- Молекулы дофамина проходят через синапс и попадают в специальные рецепторы принимающей клетки.
- Эта клетка стимулируется передать сообщение.
- После того, как сообщение передано, рецепторы высвобождают молекулы дофамина обратно в синапс, где избыток дофамина «поглощается» или рециркулируется в высвобождающем нейроне.
- Химические вещества, называемые MAO-B и COMT, расщепляют любой оставшийся дофамин, так что область синапсов становится «чистой» и готовой к следующему сообщению.
Что такое болезнь Паркинсона?
Болезнь Паркинсона (БП) — дегенеративное прогрессирующее заболевание, поражающее нервные клетки в глубоких частях мозга, называемых базальными ганглиями и черной субстанцией. Нервные клетки в черной субстанции производят нейромедиатор дофамин и отвечают за передачу сообщений, которые планируют и контролируют движения тела. По неизвестным пока причинам у некоторых людей нервные клетки черной субстанции, продуцирующие дофамин, начинают отмирать.Когда теряется 80 процентов дофамина, возникают такие симптомы болезни Паркинсона, как тремор, замедленность движений, скованность и проблемы с балансом.
Движение тела контролируется сложной цепочкой решений с участием взаимосвязанных групп нервных клеток, называемых ганглиями. Информация поступает в центральную область мозга, называемую полосатым телом, которая работает с черной субстанцией, посылая импульсы назад и вперед от спинного мозга к головному мозгу. Базальные ганглии и мозжечок отвечают за плавное и плавное движение (рис.2).
Рисунок 2. Поперечный разрез мозга. Импульс движения тела начинается в моторной коре головного мозга. Базальные ганглии отвечают за активацию и ингибирование определенных цепей или петель обратной связи.Эти импульсы передаются от нейрона к нейрону, быстро перемещаясь от головного мозга к спинному мозгу и, наконец, к мышцам. Когда дофаминовые рецепторы в полосатом теле не стимулируются должным образом, части базальных ганглиев либо недостаточно, либо чрезмерно стимулируются.В частности, субталамическое ядро (STN) становится сверхактивным и действует как тормоз на внутреннем бледном шаре (GPi), вызывая остановку движения и жесткость. Когда GPi чрезмерно стимулируется, он оказывает чрезмерно ингибирующее действие на таламус, что, в свою очередь, снижает выход таламуса и вызывает тремор (рис. 3).
Рис. 3. При чрезмерной или недостаточной стимуляции базальных ганглиев возникают симптомы тремора, ригидности и замедленности движений.Действию дофамина противостоит другой нейротрансмиттер, называемый ацетилхолином.При БП нервные клетки, вырабатывающие дофамин, умирают. Симптомы БП в виде тремора и скованности возникают, когда нервные клетки срабатывают и не хватает дофамина для передачи сообщений. Высокий уровень глутамата, другого нейромедиатора, также появляется при БП, поскольку организм пытается компенсировать недостаток дофамина.
Какие симптомы?
Симптомы болезни Паркинсона варьируются от человека к человеку, как и скорость прогрессирования. Человек, страдающий болезнью Паркинсона, может испытывать некоторые из этих более общих «отличительных» симптомов:
- Брадикинезия — замедленность движений, нарушение ловкости, снижение моргания, слюни, невыразительное лицо.
- Тремор в покое — непроизвольное дрожание, которое уменьшается при целенаправленном движении. Обычно начинается на одной стороне тела, обычно на руке.
- Жесткость — жесткость, вызванная непроизвольным повышением мышечного тонуса.
- Постуральная нестабильность — чувство неуравновешенности. Пациенты часто компенсируют это за счет понижения центра тяжести, что приводит к сутулости.
Другие симптомы, которые могут возникнуть или не появиться:
Замерзание или застревание на месте
Шаркающая походка или волочение одной ноги
Наклонная поза
Маленький, сжатый почерк
Проблемы со сном, бессонница
Апатия, депрессия
Пониженная громкость голоса или тремор при разговоре
Затруднения при глотании
Запор
Когнитивные нарушения
Каковы причины?
Причина болезни Паркинсона в значительной степени неизвестна.В настоящее время ученые исследуют роль генетики, факторов окружающей среды и естественного процесса старения в гибели клеток и болезни Паркинсона.
Существуют также вторичные формы БП, которые вызваны такими лекарствами, как галоперидол (лекарство, используемое для лечения спутанности сознания и галлюцинаций), резерпин (ингредиент некоторых антигипертензионных препаратов) и метоклопрамид (лекарство от тошноты).
Кто пострадал?
Более 1,5 миллиона американцев имеют PD.Обычно это происходит у мужчин и женщин в возрасте около 60 лет. Раннее начало болезни Паркинсона возникает в возрасте около 40 лет.
Как ставится диагноз?
Поскольку другие состояния и лекарства имитируют симптомы болезни Паркинсона, важно получить точный диагноз от врача. Ни один тест не может подтвердить диагноз БП, потому что симптомы варьируются от человека к человеку. Для постановки диагноза должно быть достаточно тщательного анамнеза и физического осмотра. Другие состояния, которые имеют симптомы, похожие на симптомы болезни Паркинсона, включают болезнь Паркинсона, эссенциальный тремор, прогрессирующий надъядерный паралич, мультисистемную атрофию, дистонию и гидроцефалию с нормальным давлением.
Какие методы лечения доступны?
Многие пациенты с болезнью Паркинсона ведут активный образ жизни и имеют нормальную продолжительность жизни. Поддержание здорового образа жизни за счет сбалансированного питания и физической активности способствует общему здоровью и благополучию. С болезнью Паркинсона можно справиться с помощью самолечения, лекарств и хирургического вмешательства.
Уход за собой
Физические упражнения так же важны, как и лекарства при лечении БП. Это помогает поддерживать гибкость и улучшает баланс и диапазон движений.Пациенты могут захотеть присоединиться к группе поддержки и продолжить увлекательные занятия, чтобы улучшить качество своей жизни. Не менее важно здоровье и благополучие членов семьи и лиц, осуществляющих уход, которые также борются с болезнью Паркинсона. Дополнительные указания см. В разделе «Как справиться с болезнью Паркинсона».
Вот несколько практических советов, которые могут использовать пациенты:
- Упражнение для поддержания силы и гибкости. Придерживайтесь здорового питания. Проконсультируйтесь с врачом перед тем, как начать новую диету или план упражнений.
- Не переусердствуйте с физическими нагрузками; знайте свои пределы и оставайтесь в них.
- Уберите коврики и низко расположенные препятствия с дорожек внутри и снаружи дома.
- Замените одежду со сложными застежками на одежду, которую можно легко надеть, например спортивные штаны, толстовки или брюки с эластичным поясом.
- Напольное покрытие в ванной комнате может стать скользким и опасным при намокании. Подумайте о том, чтобы заменить его ковровым покрытием от стены до стены.
- Преувеличивайте подъем ног и размахивание руками. На каждом шагу представляйте, что вы переступаете через бревно.
- Ешьте очень маленькие кусочки, тщательно пережевывайте и осторожно глотайте.
- Сделайте вдох, прежде чем начать говорить, и делайте паузу между каждыми несколькими словами или даже между каждым словом.
- Вместо того, чтобы писать от руки, используйте компьютер.
Лекарства
Существует несколько типов лекарств, используемых для лечения болезни Паркинсона.Эти лекарства можно использовать по отдельности или в комбинации друг с другом, в зависимости от того, являются ли ваши симптомы легкими или выраженными.
- Сохраняет дофамин в головном мозге, блокируя расщепляющее действие МАО-B. Эти препараты — селегилин (Элдеприл, Зелапар) и разагилин (Азилект), которые также обладают нейропротективным действием и могут замедлять прогрессирование заболевания.
- Блокирует действие нейротрансмиттера глутамата, что способствует увеличению высвобождения дофамина.Этот препарат — амантадин (Симметрел).
- Ввести агенты, имитирующие дофамин и связывающиеся с рецепторами в синапсе нейрона. Эти препараты включают прамипексол (Мирапекс), ропинирол (Реквип) и апоморфин (Апокин).
- Заменить недостающий дофамин в головном мозге. Препарат леводопа помогает при двигательных проблемах, таких как тремор, скованность, медлительность и ходьба. Леводопа сочетается с карбидопой (синемет), чтобы уменьшить побочные эффекты тошноты и гарантировать, что леводопа превращается в дофамин в головном мозге, а не в кишечнике или крови.
- Оптимизируйте доставку леводопы в мозг, блокируя СОМТ, который расщепляет дофамин в пищеварительной системе, обеспечивая стабильное поступление левадопы в кровоток. Эти препараты включают толкапон (Тасмар) и энтакапон (Комтан).
- Снижает активность нейромедиатора ацетилхолина. Эти препараты уменьшают тремор и включают тригексифенидил (артан) и бензтропин (когентин).
По прошествии некоторого времени при приеме лекарств пациенты могут заметить, что каждая доза прекращается до того, как можно будет принять следующую дозу (эффект истощения) или беспорядочные колебания эффекта дозы (эффект включения-выключения).Лекарства от болезни Паркинсона могут вызывать дискинезию, которая представляет собой непроизвольные подергивания или покачивания, которые обычно возникают при максимальной дозировке и вызваны перегрузкой дофамина. Иногда дискинезия может быть более неприятной, чем симптомы Паркинсона.
Новый метод приема лекарств — это насос , который подает гель карбидопы / леводопы (Duopa) непосредственно в кишечник. Требуется хирургическое вмешательство для создания небольшого отверстия (стомы) в желудке, через которое трубка подсоединяется к переносному насосу, который можно носить на поясе.Он предназначен для непрерывной доставки лекарства понемногу, чтобы улучшить абсорбцию и сократить время простоя. Duopa похож на инсулиновые помпы, используемые диабетиками.
Хирургия
Когда лекарства не справляются с симптомами из-за сильных колебаний «включено-выключено», недостаточной эффективности или невыносимых побочных эффектов, следует рассмотреть возможность хирургического вмешательства. Другие хирургические процедуры включают паллидотомию и таламотомию. выполняются для нацеливания на определенные ганглии для разрушения или стимуляции.
Рисунок 4. Обзор глубинного стимулятора мозга (DBS). Электроды вводятся глубоко в мозг через небольшие отверстия в черепе. Электроды подсоединяются удлинительным проводом к аккумуляторному стимулятору, помещенному под кожу груди. Поскольку левая часть мозга контролирует правую часть тела, и наоборот, DBS обычно выполняется на обеих сторонах мозга.Пациент может включать и выключать стимулятор с помощью портативного контроллера.
- Глубокая стимуляция мозга (DBS) — это хирургическая процедура по имплантации устройства, похожего на кардиостимулятор, которое посылает электрические сигналы в области мозга, отвечающие за движения тела. Электроды помещаются в определенную область мозга (обычно в субталамическое ядро) в зависимости от симптомов, которые лечат. Электроды размещаются как на левой, так и на правой стороне мозга через небольшие отверстия, сделанные в верхней части черепа. Электроды соединяются длинными удлинительными проводами, которые проходят под кожей и вниз по шее к аккумуляторному стимулятору под кожей грудной клетки (рис.4). При включении стимулятор посылает электрические импульсы, чтобы блокировать ошибочные нервные сигналы, вызывающие тремор, ригидность и другие симптомы.
- Настройки стимулятора программируются и могут регулироваться по мере изменения симптомов со временем. DBS улучшает симптомы вялости, тремора и ригидности. Большинство людей могут уменьшить количество принимаемых лекарств и уменьшить побочные эффекты, включая дискинезии. Кроме того, DBS не повреждает ткани мозга. Таким образом, если в будущем будут разработаны более эффективные методы лечения, процедура DBS может быть отменена.
- Другие хирургические процедуры включают паллидотомию и таламотомию, которые затрагивают определенные области мозга. Но вместо стимуляции используется высокочастотный энергетический ток, чтобы навсегда разрушить клетки. Эти процедуры необратимы и используются только в особых случаях, когда DBS неосуществима.
Пациенты с тяжелой депрессией, запущенной деменцией или нестабильным заболеванием не могут быть кандидатами на операцию.Кроме того, пациенты, у которых есть симптомы, похожие на БП, но которым был поставлен диагноз другого заболевания, например, множественная системная атрофия, прогрессирующий надъядерный паралич или кортикальная базальная дегенерация, не должны рассматривать операцию.
Клинические испытания
Клинические испытания — это научные исследования, в ходе которых новые методы лечения — лекарства, средства диагностики, процедуры и другие методы лечения — тестируются на людях, чтобы убедиться, что они безопасны и эффективны. Постоянно проводятся исследования по повышению уровня медицинского обслуживания.Информацию о текущих клинических испытаниях, включая право на участие, протокол и места проведения, можно найти в Интернете. Исследования могут спонсироваться Национальными институтами здравоохранения (см. Clinicaltrials.gov), а также частными промышленными и фармацевтическими компаниями (см. Centerwatch.com).
Источники и ссылки
Если у вас есть какие-либо вопросы, позвоните в Mayfield Brain & Spine по телефону 513-221-1100 или 800-325-7787.
Ссылки
Фонд Паркинсона www.parkinson.org
Американская ассоциация борьбы с болезнью Паркинсона apdaparkinson.org
Общество по борьбе с болезнями, связанными с движением motiondisorders.org
Фонд Майкла Дж. Фокса MichaeljFox.org
аксон : длинный отросток нервной клетки (нейрона), который переносит нервные импульсы от тела клетки к другим нервным клеткам.
ацетилхолин : нейромедиатор, позволяющий передавать сообщения от нейрона к нейрону через синапс; выпущен холинергическими нервами.
базальные ганглии : масса тел нервных клеток (серое вещество), расположенная глубоко в белом веществе головного мозга. Имеет связи с областями, которые подсознательно контролируют движение.
брадикинезия : замедленность движений, нарушение ловкости, снижение моргания, слюнотечение, невыразительное лицо.
дендрит : «руки» нервной клетки, которые соединяются с аксонами для передачи импульсов к телу клетки.
дофамин : нейромедиатор, который позволяет передавать сообщения от нейрона к нейрону через синапс.
дистония : двигательное расстройство, которое вызывает устойчивое сокращение мышц, вызывающее повторяющиеся движения или неправильные позы. Спазмы часто можно контролировать с помощью сенсорных уловок, чтобы подавить движение.
эссенциальный тремор : непроизвольный ритмический тремор кистей и кистей рук. Тремор возникает как в покое, так и при целенаправленном движении.Также влияет на голову движением «нет-нет»; часто наследственное состояние.
globus pallidus interna (GPi) : ядра в головном мозге, регулирующие мышечный тонус; часть базальных ганглиев.
глутамат : нейромедиатор, который позволяет передавать сообщения от нейрона к нейрону через синапс.
micrographia : маленький почерк при болезни Паркинсона.
нейрон : основная единица нервной системы, состоящая из тела клетки, дендритов и аксона; также называется нервной клеткой.
нейромедиатор : химическое вещество, которое позволяет передавать электрические импульсы от одной нервной клетки к другой через синапсы.
прогрессирующий надъядерный паралич : дегенеративное неврологическое заболевание, которое вызывает двигательные нарушения, подобные болезни Паркинсона. Заметным симптомом является потеря способности двигать глазами, чтобы смотреть вниз.
полосатое тело (corpus striatum) : часть базальных ганглиев, участвующих в подсознательной регуляции движений.
черная субстанция : группа клеток головного мозга, в которых вырабатывается дофамин.
субталамическое ядро (STN) : группа клеток ниже таламуса, которая связана с базальными ганглиями.
синапс : крошечный промежуток между двумя нервными клетками; по которому проходят импульсы путем высвобождения нейромедиаторов.
таламус : ретрансляционная станция для всех сенсорных сообщений, поступающих в мозг; часть базальных ганглиев.
обновлено> 4.2018
рассмотрено> Джорджем Мэндибуром, MD и Морин Гартнер, RN
Сертифицированная медицинская информация Mayfield материалов написаны и разработаны клиникой Mayfield Clinic. Мы соблюдаем стандарт HONcode в отношении достоверной информации о здоровье. Эта информация не предназначена для замены медицинских рекомендаций вашего поставщика медицинских услуг.
Болезнь Паркинсона: симптомы, причины, диагностика, лечение
Болезнь Паркинсона — это болезнь, поражающая часть вашего мозга, которая контролирует ваши движения.Это может происходить так медленно, что вы сначала даже не замечаете этого. Но со временем то, что начинается с небольшой дрожи в руке, может повлиять на то, как вы ходите, говорите, спите и думаете.
У вас больше шансов получить его, когда вам 60 лет и старше. Это также возможно, когда вы будете моложе, но это случается не так часто.
Нет лекарства от болезни Паркинсона, но вы можете получить лечение и поддержку, чтобы помочь справиться с симптомами.
Что делает болезнь Паркинсона с мозгом?
Глубоко в вашем мозгу есть область, называемая черной субстанцией, которая находится в базальных ганглиях.Некоторые из его клеток вырабатывают дофамин — химическое вещество, которое передает сообщения в ваш мозг. Когда вам нужно почесать зуд или ударить по мячу, дофамин быстро передает сигнал нервной клетке, которая контролирует это движение.
Когда эта система работает хорошо, ваше тело движется плавно и равномерно. Но когда у вас болезнь Паркинсона, клетки вашей черной субстанции начинают умирать. Заменить их невозможно, поэтому уровень дофамина падает, и вы не можете отправлять столько сообщений, чтобы контролировать плавные движения тела.
Продолжение
Вначале вы не заметите ничего другого. Но по мере того, как умирает все больше и больше клеток, вы достигаете переломного момента, когда у вас появляются симптомы.
Этого может не произойти, пока не исчезнет 80% клеток, поэтому у вас может быть болезнь Паркинсона довольно долго, прежде чем вы это заметите.
Как болезнь Паркинсона влияет на организм?
Все характерные симптомы связаны с тем, как вы двигаетесь. Обычно вы замечаете такие проблемы, как:
Жесткие мышцы .Это может произойти практически на любой части вашего тела. Иногда врачи принимают раннюю болезнь Паркинсона за артрит.
Медленные движения . Вы можете обнаружить, что даже простые действия, такие как застегивание рубашки, занимают гораздо больше времени, чем обычно.
Тремор . Ваши руки, руки, ноги, губы, челюсть или язык дрожат, когда вы ими не пользуетесь.
Проблемы с ходьбой и равновесием . Вы можете заметить, что ваши руки не так свободно раскачиваются, когда вы идете. Или вы не можете делать длинные шаги, поэтому вам придется вместо этого перетасовать.
Болезнь Паркинсона также может вызывать ряд других проблем, от депрессии до проблем с мочевым пузырем и отыгрывания снов. Может пройти некоторое время, прежде чем начнутся аномальные движения.
Что вызывает болезнь Паркинсона?
Врачи не понимают, почему все эти клетки мозга начинают умирать. Они думают, что это смесь ваших генов и чего-то в окружающей среде, но причина непростая.
У кого-то может быть изменение в гене, связанном с болезнью Паркинсона, но он никогда не заболеет. Такое часто случается.И группа людей могла работать бок о бок в месте с химическими веществами, связанными с болезнью Паркинсона, но лишь немногие из них остались с ней.
Это сложная головоломка, и ученые до сих пор пытаются сложить все части воедино.
Как мой врач проверит это?
Нет ни одного теста на болезнь Паркинсона. Во многом это основано на ваших симптомах и истории болезни, но на то, чтобы понять это, может потребоваться некоторое время. Частью этого процесса является исключение других состояний, похожих на болезнь Паркинсона.Докотор может провести сканирование DaT, которое ищет дофамин в головном мозге. Это может помочь в диагностике.
Поскольку не существует единого теста, очень важно сразу же обратиться к врачу, который знает о нем много. Легко упустить.
Продолжение
Если она у вас есть, ваш врач может использовать так называемую шкалу Хоэна и Яра, чтобы сказать вам, на какой стадии заболевания вы находитесь. Она оценивает степень тяжести ваших симптомов от 1 до 5, где 5 — самое серьезное.
Этап поможет вам лучше понять, где проявляются ваши симптомы, и чего ожидать по мере обострения болезни.Но имейте в виду, что некоторым людям может потребоваться до 20 лет, чтобы перейти от легких симптомов к более серьезным. Для других изменение происходит намного быстрее.
Как лечится болезнь Паркинсона?
Все дело в управлении симптомами. Лекарства от болезни Паркинсона часто помогают при треморе, ригидности мышц и замедленных движениях. Ваш врач может также порекомендовать физиотерапию, трудотерапию и логопедию в зависимости от того, как это влияет на вас. А в некоторых случаях может потребоваться операция.
Как болезнь повлияет на мою жизнь?
Большинство людей с болезнью Паркинсона живут нормальной или почти нормальной продолжительностью жизни, но болезнь может изменить их жизнь.
Продолжение
У некоторых людей лечение сдерживает симптомы, и в большинстве случаев они легкие. Для других болезнь намного серьезнее и действительно ограничивает ваши возможности.
По мере того, как ситуация ухудшается, становится все труднее и труднее выполнять повседневные дела, такие как вставание с постели, вождение автомобиля или поход на работу. Даже письмо может показаться сложной задачей. А на более поздних стадиях это может вызвать слабоумие.
Несмотря на то, что болезнь Паркинсона может иметь большое влияние на вашу жизнь, при правильном лечении и помощи вашей медицинской бригады вы все равно можете получать удовольствие от того, что любите.Очень важно обратиться за поддержкой к семье и друзьям. Научиться жить с болезнью Паркинсона означает убедиться, что вы получаете необходимую поддержку.
Болезнь Паркинсона | Определение, причины, симптомы и лечение
Болезнь Паркинсона , также называемая первичным паркинсонизмом , возбужденным параличом или идиопатическим паркинсонизмом , дегенеративным неврологическим расстройством, которое характеризуется началом тремора, ригидности мышц, медленностью движений (брадикинезия) и сутулой осанкой. (постуральная нестабильность).Заболевание было впервые описано в 1817 году британским врачом Джеймсом Паркинсоном в его «Эссе о дрожащем параличе». Болезнь Паркинсона — это первичная форма паркинсонизма, группа хронических заболеваний, при которых наблюдается прогрессирующая потеря двигательной функции из-за дегенерации нейронов в области мозга, контролирующей движение. Болезнь Паркинсона отличается от других типов паркинсонизма, потому что она идиопатическая, то есть возникает при отсутствии идентифицируемой причины.
Британская викторина
44 вопроса из самых популярных викторин «Британника» о здоровье и медицине
Что вы знаете об анатомии человека? Как насчет медицинских условий? Мозг? Вам нужно будет много знать, чтобы ответить на 44 самых сложных вопроса из самых популярных викторин Britannica о здоровье и медицине.
Факторы риска
Считается, что в большинстве случаев болезнь Паркинсона возникает в результате сочетания генетической предрасположенности и определенных факторов окружающей среды, таких как воздействие пестицидов или определенных растворителей, включая трихлорэтилен. Хотя болезнь Паркинсона редко передается по наследству, люди, у которых есть родственники первой степени родства с этой болезнью, подвергаются повышенному риску. Кроме того, мутации в гене PRKN , который кодирует белок, известный как паркин, были связаны с ранним началом (до 40 лет) болезнью Паркинсона и с некоторыми случаями позднего начала (после 50 лет) болезни Паркинсона.Мутации в нескольких других генах связаны с ненаследственными формами болезни.
Начало и симптомы
Болезнь Паркинсона возникает обычно в возрасте от 60 до 70 лет, хотя примерно в 5-10% случаев она возникает в возрасте до 40 лет. Заболеваемость паркинсонизмом во всем мире оценивается примерно в 160 человек. 100 000 человек, от 16 до 19 новых случаев на 100 000 человек ежегодно. Мужчины страдают немного сильнее, чем женщины, и явных расовых различий нет.Болезнь Паркинсона часто начинается с легкого тремора большого и указательного пальцев, иногда называемого «катанием таблетки», и медленно прогрессирует в течение 10–20 лет. На поздних стадиях заболевания часто наблюдается потеря мимики, снижение скорости глотания, что приводит к слюнотечению, тяжелой депрессии, слабоумию и параличу.
Невропатология
У пациентов с болезнью Паркинсона было отмечено заметное снижение уровня дофамина, нейромедиатора, который играет важную роль в подавлении нервных импульсов в головном мозге.Это снижение, которое происходит в основном в области мозга, называемой черной субстанцией, было связано с потерей так называемых дофаминергических нейронов, которые обычно синтезируют и используют дофамин для связи с другими нейронами в частях мозга, которые регулируют двигательную функцию. Причина снижения уровня дофамина неясна. Белок, известный как альфа-синуклеин, по-видимому, участвует в дегенерации нейронов. Альфа-синуклеин вырабатывается дофаминергическими нейронами и расщепляется другими белками, такими как паркин и нейрозин.Дефекты любого из белков, расщепляющих альфа-синуклеин, могут привести к его накоплению, в результате чего в черной субстанции образуются отложения, называемые тельцами Леви. Однако были идентифицированы другие механизмы, влияющие на накопление альфа-синуклеина, и неясно, являются ли тельца Леви причиной или возникают в результате заболевания. Другие находки у людей, страдающих болезнью Паркинсона, включают митохондриальную дисфункцию, приводящую к увеличению выработки свободных радикалов, вызывающих значительный ущерб клеткам мозга, и повышенную чувствительность иммунной системы и нейронов к молекулам, называемым цитокинами, которые стимулируют воспаление.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасЛечение
Наиболее эффективным средством лечения болезни Паркинсона является введение метаболического предшественника дофамина, известного как леводопа (l-допа). Леводопа проникает через гематоэнцефалический барьер (физиологический барьер, блокирующий проникновение больших молекул в центральную нервную систему) через специальные транспортные белки и превращается в дофамин в головном мозге, прежде всего в области, содержащей черную субстанцию.Несмотря на то, что первоначально леводопа полезна для достижения значительной ремиссии симптомов, она часто эффективна только в течение 5-10 лет, а серьезные побочные эффекты, включая неконтролируемые движения, галлюцинации, постоянную тошноту и рвоту, а также изменения в поведении и настроении, часто сопровождают лечение. Совместное лечение препаратом под названием карбидопа, который ингибирует фермент, расщепляющий леводопу до пересечения гематоэнцефалического барьера, позволяет более высоким концентрациям леводопы достигать головного мозга. Таким образом, комбинированная терапия леводопа-карбидопа позволяет вводить более низкие дозы леводопы, тем самым уменьшая побочные эффекты.Эта комбинированная терапия позволила многим пациентам жить достаточно нормальной жизнью. Препарат, известный как энтакапон, который замедляет метаболизм леводопы, можно назначать с леводопой и карбидопой.
Другие препараты, используемые для облегчения симптомов болезни Паркинсона, включают средства, стимулирующие выработку дофамина в головном мозге, такие как перголид и бромокриптин, и средства, замедляющие разложение дофамина, такие как селегилин. Кроме того, противовирусное средство амантадин может уменьшить некоторые симптомы заболевания.
В некоторых случаях для облегчения запущенных симптомов может потребоваться операция. Например, хирургическая процедура, известная как глубокая стимуляция мозга (DBS), позволила уменьшить непроизвольные движения, улучшить изнурительные проблемы с походкой и медленностью движений, а также снизить дозы лекарств. В DBS электрод имплантируется в мозг и присоединяется с помощью проволочного вывода к нейростимулятору, вставленному под кожу, обычно около ключицы. Нейростимулятор посылает на электрод электрические сигналы.Эти сигналы работают, нарушая физиологические импульсы, вызывающие нарушение движения.
Стимуляция спинного мозга, экспериментальная терапия, также показала некоторую пользу в улучшении движений у пациентов с болезнью Паркинсона. В этой терапии электроды имплантируются в эпидуральное пространство вдоль спинного мозга. При включении устройство излучает электрические импульсы с частотой, которая стимулирует спинной мозг и потенциально улучшает связь между спинным мозгом и областями мозга, которые контролируют двигательную активность.В клиническом исследовании с участием небольшого числа пациентов с болезнью Паркинсона стимуляция спинного мозга уменьшала количество эпизодов замерзания (случаев, когда люди внезапно не могут двигаться) и улучшала способность стоять, длину шага и скорость ходьбы.
The Editors of Encyclopaedia Britannica Эта статья была недавно отредактирована и обновлена Барбарой А. Шрайбер.Узнайте больше в этих связанных статьях Britannica:
паркинсонизм
… болезнь, описанная Паркинсоном, называемая болезнь Паркинсона , является наиболее распространенной формой. Болезнь Паркинсона также называется первичным паркинсонизмом, возбужденным параличом или идиопатическим паркинсонизмом, что означает, что у болезни нет идентифицируемой причины. Это отличает его от вторичного паркинсонизма, группы заболеваний, очень похожих по природе на Болезнь Паркинсона , но которые…
Болезнь человека: болезнь Паркинсона
Болезнь Паркинсона — это двигательное расстройство, характеризующееся началом ритмического тремора «катания таблетки», ригидностью мышц, затруднением и замедлением движений и сутулостью.По мере прогрессирования заболевания лицо больного становится невыразительным, скорость глотания снижается,…
Заболевание нервной системы: болезнь Паркинсона
Болезнь Паркинсона — прогрессирующее заболевание, вызванное дегенерацией клеток черной субстанции и голубого пятна (оба пигментированных ядра в стволе мозга) и их связей с базальными ганглиями.Базальные ганглии — это ядерные образования, расположенные над стволом мозга…
Болезнь Паркинсона — Physiopedia
Болезнь Паркинсона (БП) — нейродегенеративное заболевание, которое в пожилом возрасте чаще всего проявляется генерализованным замедлением движений (брадикинезия) и, по крайней мере, одним другим симптомом тремора в покое или ригидности. К другим сопутствующим признакам относятся потеря обоняния, дисфункция сна, расстройства настроения, избыточное слюноотделение, запор и чрезмерные периодические движения конечностями во сне (расстройство быстрого сна).БП — это заболевание базальных ганглиев, которые состоят из многих других ядер. Стриатум получает возбуждающие и тормозящие сигналы от нескольких частей коры. Ключевой патологией является потеря дофаминергических нейронов, которая приводит к симптомам [1] . Это второе по распространенности нейродегенеративное состояние в мире после болезни Альцгеймера.
Это 3-минутное видео дает обзор PD
[2]
Болезнь Паркинсона была описана 3000 лет назад в индийских и китайских лекарствах, в основном на растительной основе, однако Джеймс Паркинсон был первым, кто описал ее в западной медицине в своем эссе 1817 года как Дрожащий паралич.
Заболевание вызвано медленным разрушением нервных клеток головного мозга, которые вырабатывают дофамин. Дофамин — это естественное вещество, обнаруженное в мозге, которое играет важную роль в нашем мозге и организме, передавая сообщения и, следовательно, взаимодействуя с различными системами.
Причина частичных разрядов связана с
- Использование пестицидов, гербицидов и близость к промышленным предприятиям.
- После инъекции 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP) (Случайная находка).Это химическое вещество накапливается в митохондриях.
- Окисление и образование свободных радикалов, вызывающих повреждение ядер таламуса.
- Гены, риск БП у братьев и сестер увеличивается, если один из членов семьи страдает заболеванием. Эти случаи также имеют тенденцию возникать намного раньше в жизни.
- Измененная функция альфа-синуклеина может играть роль в этиологии БП. Текущие исследования сосредоточены на предотвращении распространения и агрегации альфа-синуклеина [1]
- Болезнь Паркинсона чаще всего возникает после 50 лет и является одним из наиболее распространенных расстройств нервной системы у стареющего населения.
- PD влияет на 1-2 человека на 1000 в любое время. По оценкам, от семи до 10 миллионов человек во всем мире живут с болезнью Паркинсона. [3]
- Распространенность увеличивается с возрастом и поражает 1% населения старше 60 лет.
- От 5% до 10% пациентов имеют генетическую предрасположенность.
- Заболеваемость и распространенность БП увеличиваются с возрастом
- Заболевание чаще встречается у мужчин, чем у женщин [1] .
- В Великобритании распространенность болезни Паркинсона составляет 145 519, а в 2018 г. заболеваемость составила 18 461. [3]
Межпрофессиональный менеджмент [править | править источник]
PD — одно из самых распространенных двигательных расстройств во всем мире. Расстройство неизлечимо и прогрессирует. Состояние может проявляться двигательными нарушениями и различными психиатрическими и вегетативными проблемами. Почти каждый орган поражен этим заболеванием, и по мере прогрессирования болезни лечение может быть затруднено. Межпрофессиональный командный подход — лучший способ справиться с расстройством [1] .
Некоторые немоторные аспекты (проблемы со сном, плохое настроение, запор и потеря обоняния) возникают за несколько лет до развития наблюдаемых двигательных симптомов. Физиотерапевты чаще всего участвуют в средних стадиях заболевания, когда нарушается баланс и подвижность, но может быть полезно, если они смогут оценить и проконсультировать людей вскоре после постановки диагноза, чтобы поддерживать активность и предотвращать проблемы.
Помимо врачей, медсестры, фармацевты, социальные работники и физиотерапевты играют жизненно важную роль в ежедневном ведении этих пациентов.Болезнь Паркинсона создает сложности для медицинского и социального персонала, помогающего отдельным лицам и тем, кто страдает от болезни (опекунам, членам семьи, друзьям). Управление этими сложными проблемами является сложной задачей из-за различных комбинаций моторных (движения) и немоторных симптомов, возникающих на протяжении всего состояния.
Общие моторные симптомы, требующие лечения [edit | править источник]
- Тремор — заметный и ранний симптом БП (не всегда присутствует и не является необходимым признаком для диагностики).
- Медлительность, или брадикинезия, основная особенность БП.
- Жесткость — третья важная особенность при осмотре.
- Сочетание брадикинезии и ригидности приводит к некоторым другим характерным особенностям БП, таким как микрография.
- Четвертый характерный признак БП — нарушение походки, хотя обычно это проявление поздно. Согнутая осанка, атаксия, уменьшение размаха рук, festination, march-a-petits-pas, камптокормия, ретропульсия и повороты en bloc — популярные термины для описания походки при БП.Нарушение походки не является ранним признаком болезни Паркинсона, но часто описывается, поскольку его легко распознать и затруднить диагностику на более поздних стадиях [1] .
Проблемы с устранением [править | править источник]
Скорость прогрессирования заболевания можно предсказать на основании следующего: [1]
- Мужчины, у которых наблюдается нестабильность осанки, затрудненная походка.
- Пациенты с старшим возрастом в начале болезни, слабоумием и отсутствием реакции на традиционные дофаминергические препараты, как правило, имеют раннюю госпитализацию в дома престарелых и снижение выживаемости.
- У людей с только тремором при первичном обращении обычно наблюдается длительное доброкачественное течение.
- У лиц, у которых заболевание диагностировано в более старшем возрасте в сочетании с гипокинезией / ригидностью, болезнь прогрессирует гораздо быстрее.
Расстройство: приводит к инвалидности большинства пациентов в течение десяти лет; уровень смертности в три раза выше, чем у обычного населения.
Болезнь Паркинсона еще не излечима (лечение может улучшить симптомы, но качество жизни часто низкое) [1] .На исследования по поиску лекарства тратится много финансовых и других ресурсов.
Информацию о болезни Паркинсона можно найти на следующих веб-сайтах:
США
Великобритания
Европа
Европейская ассоциация болезни Паркинсона [edit | править источник]
Европейская ассоциация болезни Паркинсона (EPDA) является зонтичной организацией в Европе. Они представляют 45 организаций-членов и защищают права и потребности более чем одной.2 миллиона человек с болезнью Паркинсона и их семьи.
Цель EPDA — дать возможность всем людям с болезнью Паркинсона в Европе жить полноценной жизнью, поддерживая при этом поиск лекарства.
Группа представила в Европейском парламенте согласованное заявление о европейских стандартах лечения болезни Паркинсона в ноябре 2011 года. Этот документ определяет, каким должно быть оптимальное лечение болезни Паркинсона и из чего должна состоять качественная помощь. Этот документ разработан не только экспертами в области болезни Паркинсона, но и включает голос людей с болезнью Паркинсона.В дополнение к этому они создали несколько удивительных ресурсов, чтобы познакомить людей с этим заболеванием.
Великобритания Паркинсона [править | править источник]
Веб-сайт Паркинсона в Великобритании содержит много информации о болезни Паркинсона и лечении этого состояния. Местные группы поддержки также доступны через компанию Parkinson’s UK и являются отличным ресурсом для людей с болезнью Паркинсона и паркинсонизмом. Часто группы упражнений также предоставляются через эти группы.
Move4Parkinson’s [править | править источник]
Move4Parkinson’s была основана Маргарет Малларни, у которой в 2004 году была диагностирована болезнь Паркинсона.Сайт посвящен обучению, расширению прав и возможностей и вдохновению людей с болезнью Паркинсона и их семей или лиц, осуществляющих уход (сообщества с болезнью Паркинсона), на получение знаний и навыков, необходимых для улучшения качества их жизни. Маргарет рекомендует Основу пяти элементов, основываясь на своем личном опыте:
Национальный институт неврологических расстройств и инсульта [редактировать | править источник]
Национальный институт неврологических расстройств и инсульта (NINDS) предоставляет список американских организаций:
Виартис [править | править источник]
Виартис — независимый, некоммерческий и самофинансируемый медицинский исследователь, специализирующийся на болезни Паркинсона.Viartis не является частью какой-либо другой компании, университета или организации и не имеет религиозных или политических убеждений. Они выбирают статьи исключительно на основании их медицинского значения или потенциального интереса, и вы можете зарегистрироваться для бесплатного получения информации. На сайте есть ссылки на ряд международных организаций.
Конференция Паркинсона, 2009 [править | править источник]
В сентябре 2009 года SPRING (исследовательская группа Общества болезни Паркинсона) провела конференцию о влиянии физических упражнений на болезнь Паркинсона.Бхану Рамасвами входила в состав оргкомитета в своей шляпе руководителя проекта AGILE / ACPIN Parkinson вместе с Вики Гудвин, которую также пригласили рассказать о своем исследовании. На конференции были изучены известные аспекты, а также проблемы, которые еще предстоит открыть, о пользе физических упражнений для людей с болезнью Паркинсона. Вклады поступали от приглашенных участников со всего мира в надежде внести предложения о новом сотрудничестве в области исследований для продвижения физических упражнений как важного компонента терапии болезни Паркинсона.
Информация о Генеральной конференции доступна через веб-сайт
Ниже представлены видеоролики двух основных презентаций конференции:
Связанные страницы в Physiopedia [править | править источник]
Источники [править | править источник]
Патофизиология болезни Паркинсона
Болезнь Паркинсона и потеря нейронов
Болезнь Паркинсона в первую очередь связана с постепенной потерей клеток черной субстанции головного мозга.Эта область отвечает за производство дофамина. Дофамин — это химический мессенджер, который передает сигналы между двумя областями мозга для координации деятельности. Например, он соединяет черную субстанцию и полосатое тело, чтобы регулировать мышечную активность.
При дефиците дофамина в полосатом теле нервные клетки в этой области бесконтрольно «загораются». Это оставляет человека неспособным направлять или контролировать движения. Это приводит к появлению первых симптомов болезни Паркинсона.По мере прогрессирования болезни дегенерируют и другие области мозга и нервной системы, вызывая более глубокое двигательное расстройство.
Точная причина потери клеток неизвестна. Возможные причины включают как генетические факторы, так и факторы окружающей среды.
Генетические факторы, повышающие риск болезни Паркинсона
Обнаружены определенные гены, которые могут быть связаны с болезнью Паркинсона. По крайней мере, 15-20% пациентов с болезнью Паркинсона имеют близких родственников с симптомами паркинсонизма.Причиной болезни Паркинсона может быть несколько генетических факторов. Кроме того, генетические факторы также могут сочетаться с факторами окружающей среды.
болезнь Паркинсона наблюдается в раннем возрасте у людей с мутациями в генах паркина, PINK1, LRRK2, DJ-1 и глюкоцереброзидазы, среди прочих. На данный момент идентифицировано как минимум девять генетических мутаций, повышающих риск развития болезни Паркинсона.
Национальный институт исследования генома человека (NHGRI) и Национальный институт неврологических заболеваний и инсульта (NINDS) определили ген на хромосоме 4, называемый геном альфа-синкулеина, который в некоторых семьях связан с болезнью Паркинсона.Однако этот мутировавший или измененный ген может составлять лишь небольшую часть от общего числа случаев болезни Паркинсона, но он связан со значительной долей семейной болезни Паркинсона с началом в возрасте до 60 лет.
Альфа-синкулеин является основным компонентом телец Леви, которые обнаруживаются в клетках всех пациентов с болезнью Паркинсона. У пациентов с мутированным геном альфа-синкулеина образуется измененный белковый продукт. Этот белок накапливается в клетке и привлекает другие белки, чтобы сформировать отложение, которое приводит к повреждению нейрона.
Свободные радикалы
Это нестабильные молекулы, образующиеся в ходе обычных химических реакций в организме. Когда они взаимодействуют с другими молекулами, они могут повреждать ткани, такие как нейроны.
Старение
С возрастом количество нейронов, продуцирующих дофамин, снижается, что приводит к преждевременной потере дофамина.
Экологические токсины
Некоторые токсины, такие как запрещенные наркотики, загрязненные химическим веществом под названием МРТР, могут вызывать тяжелые симптомы, похожие на симптомы болезни Паркинсона.Было обнаружено, что как только МФТФ проникает в мозг, он начинает убивать клетки мозга.
Возможные токсины могут включать пестициды и гербициды, используемые в сельском хозяйстве, токсины, выделяемые промышленными предприятиями, и загрязнение воздуха, связанное с дорожным движением.
Другие токсины и воздействия, связанные с болезнью Паркинсона, включают:
- марганцевая пыль
- сероуглерод
- сильное отравление оксидом углерода (CO)
К ним также относятся инсектициды перметрин и бета-гексахлорциклогексан (бета-ГХГ), гербициды паракват и 2,4-дихлорфеноксиуксусная кислота и фунгицид манеб.
В 2009 году Министерство по делам ветеранов США добавило болезнь Паркинсона к списку заболеваний, которые, возможно, связаны с воздействием агента Orange.
Дополнительная литература
Замерзание походки при болезни Паркинсона: патофизиология, факторы риска и методы лечения | Трансляционная нейродегенерация
Giladi N, Nieuwboer A. Понимание и лечение замерзания походки при паркинсонизме, предложенное рабочее определение и подготовка сцены. Mov Disord. 2008; 23 (Приложение 2): S423–5.
PubMed Статья Google Scholar
Блум Б. Р., Хаусдорф Дж. М., Виссер Дж. Э., Гилади Н. Фолс и остановка походки при болезни Паркинсона: обзор двух взаимосвязанных эпизодических явлений. Mov Disord. 2004. 19 (8): 871–84.
PubMed PubMed Central Статья Google Scholar
Шаафсма Дж. Д., Балаш Ю., Гуревич Т., Бартельс А. Л., Хаусдорф Дж. М., Гилади Н.Характеристика замораживания подтипов походки и реакции каждого на леводопа при болезни Паркинсона. Eur J Neurol. 2003. 10 (4): 391–8.
CAS PubMed Статья Google Scholar
Окума Й., Сильва де Лима А.Л., Фукае Дж., Блум Б.Р., Снейдерс А.Х. Перспективное исследование падений в связи с застыванием походки и колебаниями реакции при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2018; 46: 30–5.
PubMed Статья Google Scholar
Walton CC, Shine JM, Hall JM, O’Callaghan C, Mowszowski L, Gilat M, Szeto JY, Naismith SL, Lewis SJ. Основное влияние замерзания походки на качество жизни при болезни Паркинсона. J Neurol. 2015; 262 (1): 108–15.
CAS PubMed Статья Google Scholar
Nutt JG, Bloem BR, Giladi N, Hallett M, Horak FB, Nieuwboer A. Замораживание походки: продвижение к загадочному клиническому феномену. Lancet Neurol. 2011; 10 (8): 734–44.
PubMed Статья Google Scholar
Мори С. Интеграция позы и передвижения у кошек с острой децеребрацией и у бодрствующих, свободно передвигающихся кошек. Prog Neurobiol. 1987. 28 (2): 161–95.
CAS PubMed Статья Google Scholar
Снайдерс А.Х., Такакусаки К., Дебу Б., Лозано А.М., Кришна В., Фасано А., Азиз Т.З., Папа С.М., Фактор С.А., Халлетт М. Физиология замерзания походки.Энн Нейрол. 2016; 80 (5): 644–59.
PubMed Статья Google Scholar
Брукс В.Б., Стоуни С.Д. Младший. Моторные механизмы: роль пирамидальной системы в управлении моторикой. Annu Rev Physiol. 1971; 33: 337–92.
CAS PubMed Статья Google Scholar
Такакусаки К. Нейрофизиология походки: от спинного мозга к лобной доле. Mov Disord.2013. 28 (11): 1483–91.
PubMed Статья Google Scholar
Nieuwboer A, Giladi N. Характеристика замирания походки при болезни Паркинсона: модели эпизодического феномена. Mov Disord. 2013. 28 (11): 1509–19.
PubMed Статья Google Scholar
Плотник М., Гилади Н., Хаусдорф Дж. М.. Является ли застывание походки при болезни Паркинсона результатом множественных нарушений походки? Последствия для лечения.Parkinsons Dis. 2012; 2012: 459321.
PubMed PubMed Central Google Scholar
Льюис С.Дж., Баркер Р.А. Патофизиологическая модель замирания походки при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2009. 15 (5): 333–8.
PubMed Статья Google Scholar
Vandenbossche J, Deroost N, Soetens E, Coomans D, Spildooren J, Vercruysse S, Nieuwboer A, Kerckhofs E.Замерзание походки при болезни Паркинсона: нарушения автоматизма и контроля. Front Hum Neurosci. 2012; 6: 356.
PubMed Google Scholar
Jacobs JV, Nutt JG, Carlson-Kuhta P, Stephens M, Horak FB. Дрожание в коленях при застывании походки представляет собой множественные упреждающие изменения позы. Exp Neurol. 2009. 215 (2): 334–41.
PubMed Статья Google Scholar
Ким Р., Ли Дж., Ким Х. Дж., Ким А., Чан М, Чон Б., Кан УДж. Бета-амилоид в спинномозговой жидкости42 и риск замерзания походки на ранних стадиях болезни Паркинсона. Неврология. 2019; 92 (1): e40–7.
CAS PubMed Статья Google Scholar
Kim R, Lee J, Kim Y, Kim A, Jang M, Kim HJ, Jeon B, Kang UJ, Fahn S. Пресинаптическое стриатальное дофаминергическое истощение предсказывает более позднее развитие застывания походки при болезни Паркинсона de novo. : анализ когорты PPMI.Паркинсонизм, связанный с разладом. 2018; 51: 49–54.
PubMed Статья Google Scholar
Эгоетц Мартенс К.А., Лукасик Е.Л., Георгиадес М.Дж., Гилат М., Холл Д.М., Уолтон С.К., Льюис С.Дж. Прогнозирование начала замирания походки: продольное исследование. Mov Disord. 2018; 33 (1): 128–35.
PubMed Статья Google Scholar
Герман Т., Шема-Ширацки С., Арье Л., Гилади Н., Хаусдорф Дж. М..Симптомы депрессии могут повышать риск развития остановки походки в будущем у пациентов с болезнью Паркинсона: результаты 5-летнего проспективного исследования. Паркинсонизм, связанный с разладом. 2018; 60: 98–104.
Гилади Н., Макдермотт М.П., Фан С., Прзедборски С., Янкович Дж., Стерн М., Таннер С., Исследование Паркинсона G. Замораживание походки при БП: перспективная оценка в когорте DATATOP. Неврология. 2001. 56 (12): 1712–21.
CAS PubMed Статья Google Scholar
Forsaa EB, Larsen JP, Wentzel-Larsen T, Alves G. 12-летнее популяционное исследование замерзания походки при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2015; 21 (3): 254–8.
CAS PubMed Статья Google Scholar
Чжан Х, Инь Х, Оуян З., Чен Дж, Чжоу С., Чжан Ц., Пан Х, Ван С., Ян Дж., Фэн Й и др. Проспективное исследование остановки походки на ранних стадиях болезни Паркинсона у китайских пациентов. Медицина. 2016; 95 (26): e4056.
PubMed PubMed Central Статья Google Scholar
Ou R, Wei Q, Cao B, Song W, Hou Y, Liu H, Yuan X, Zhao B, Wu Y, Shang H. Предикторы остановки походки у китайских пациентов с болезнью Паркинсона. Brain Behav. 2018; 8 (3): e00931.
PubMed PubMed Central Статья Google Scholar
Banks SJ, Bayram E, Shan G, LaBelle DR, Bluett B.Немоторные предикторы застывания походки при болезни Паркинсона. Поза походки. 2019; 68: 311–6.
PubMed Статья Google Scholar
Джалдетти Р., Ригби А., Гринбаум Л., Райнер Дж., Лорбербойм М. Может ли ранняя визуализация транспортера дофамина служить предиктором прогрессирования болезни Паркинсона и поздних двигательных осложнений? J Neurol Sci. 2018; 390: 255–60.
CAS PubMed Статья Google Scholar
Chung SJ, Lee YH, Yoo HS, Oh JS, Kim JS, Ye BS, Sohn YH, Lee PH. Гиперинтенсивность белого вещества как предиктор остановки походки при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2019; 66: 105–9.
PubMed Статья Google Scholar
Махт М., Кауснер Ю., Моллер Дж. К., Стиасны-Колстер К., Эггерт К. М., Крюгер Х. П., Элгринг Х. Предикторы замерзания при болезни Паркинсона: обследование 6620 пациентов. Mov Disord. 2007. 22 (7): 953–6.
PubMed Статья Google Scholar
Шульман Л.М. Есть ли связь между эстрогеном и болезнью Паркинсона? Паркинсонизм, связанный с разладом. 2002. 8 (5): 289–95.
PubMed Статья Google Scholar
Wilson RS, Yu L, Lamar M, Schneider JA, Boyle PA, Bennett DA. Образовательно-познавательный резерв в пожилом возрасте. Неврология. 2019; 92 (10): e1041–50.
PubMed PubMed Central Статья Google Scholar
Perez-Lloret S, Negre-Pages L, Damier P, Delval A, Derkinderen P, Destee A, Meissner WG, Schelosky L, Tison F, Rascol O. Распространенность, детерминанты и влияние на качество жизни отморожения походки при болезни Паркинсона. JAMA Neurol. 2014. 71 (7): 884–90.
PubMed Статья PubMed Central Google Scholar
Osaki Y, Morita Y, Miyamoto Y, Furuta K, Furuya H. Замерзание походки — ранний клинический признак прогрессирующего надъядерного паралича. Neurol Clin Neurosci. 2017; 5 (3): 86–90.
PubMed PubMed Central Статья Google Scholar
Гилади Н., Тревес Т.А., Саймон Е.С., Шабтай Х., Орлов Ю., Кандинов Б., Палеаку Д., Корчин А.Д. Замерзание походки у пациентов с запущенной болезнью Паркинсона. J Neural Transm (Вена). 2001. 108 (1): 53–61.
CAS Статья Google Scholar
Гилади Н., МакМахон Д., Прзедборски С., Фластер Е., Гиллори С., Костич В., Фан С. Моторные блоки при болезни Паркинсона. Неврология. 1992. 42 (2): 333–33.
CAS PubMed Статья PubMed Central Google Scholar
Гарсия-Руис П.Дж., Дель Валь Дж., Фернандес И.М., Херранц А. Какие факторы влияют на двигательные осложнения при болезни Паркинсона?: 10-летнее проспективное исследование.Clin Neuropharmacol. 2012; 35 (1): 1–5.
PubMed Статья PubMed Central Google Scholar
Льюис С.Дж., Шайн Дж. М.. Следующий шаг: обычный нейронный механизм остановки походки. Невролог. 2016; 22 (1): 72–82.
PubMed Статья PubMed Central Google Scholar
Магринелли Ф, Пичелли А., Токко П., Федерико А., Ронкари Л., Смания Н., Занетт Дж., Тамбурин С.Патофизиология двигательной дисфункции при болезни Паркинсона как обоснование медикаментозного лечения и реабилитации. Parkinsons Dis. 2016; 2016: 9832839.
PubMed PubMed Central Google Scholar
Розенберг-Кац К., Герман Т., Якоб И., Гилади Н., Хендлер Т., Хаусдорф Дж. М.. Атрофия серого вещества различает моторные подтипы болезни Паркинсона. Неврология. 2013. 80 (16): 1476–84.
PubMed PubMed Central Статья Google Scholar
Zuo LJ, Piao YS, Li LX, Yu SY, Guo P, Hu Y, Lian TH, Wang RD, Yu QJ, Jin Z и др. Фенотип постуральной нестабильности / трудности походки при болезни Паркинсона: отношение к когнитивным нарушениям и механизму, связывающему патологические белки и нейротрансмиттеры. Научный отчет 2017; 7: 44872.
CAS PubMed PubMed Central Статья Google Scholar
Obeso JA, Rodriguez-Oroz M, Marin C, Alonso F, Zamarbide I, Lanciego JL, Rodriguez-Diaz M.Происхождение двигательных колебаний при болезни Паркинсона: важность дофаминергической иннервации и контуров базальных ганглиев. Неврология. 2004; 62 (1 приложение 1): S17–30.
CAS PubMed Статья PubMed Central Google Scholar
Schlenstedt C, Muthuraman M, Witt K, Weisser B, Fasano A, Deuschl G. Контроль осанки и остановка походки при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2016; 24: 107–12.
PubMed Статья Google Scholar
Дункан Р.П., Ледди А.Л., Кавано Д.Т., Диббл Л.Е., Эллис Т.Д., Форд МП, Форман КБ, Эрхарт GM. Баланс различий у людей с болезнью Паркинсона с застыванием походки и без него. Поза походки. 2015; 42 (3): 306–9.
PubMed Статья Google Scholar
Моррис М.Э., Янсек Р., Гална Б. Фестация походки и замораживание при болезни Паркинсона: патогенез и реабилитация. Mov Disord. 2008; 23 (Приложение 2): S451–60.
PubMed Статья PubMed Central Google Scholar
Bekkers EMJ, Dijkstra BW, Heremans E, Verschueren SMP, Bloem BR, Nieuwboer A. Баланс между двумя: связаны ли застывание походки и постуральная нестабильность при болезни Паркинсона? Neurosci Biobehav Rev.2018; 94: 113–25.
CAS PubMed Статья PubMed Central Google Scholar
Walton CC, Mowszowski L, Gilat M, Hall JM, O’Callaghan C, Muller AJ, Georgiades M, Szeto JYY, Ehgoetz Martens KA, Shine JM, et al.Когнитивная тренировка для остановки походки при болезни Паркинсона: рандомизированное контролируемое исследование. NPJ Parkinsons Dis. 2018; 4:15.
PubMed PubMed Central Статья Google Scholar
Эгоец Мартенс К.А., Холл Дж. М., Георгедес М. Дж., Гилат М., Уолтон С. К., Матар Е., Льюис С. Дж. Дж., Шайн Дж. М.. Функциональная сетевая характеристика неоднородности стопы при походке. Мозг. 2018; 141 (4): 1145–60.
PubMed Статья PubMed Central Google Scholar
Alibiglou L, Videnovic A, Planetta PJ, Vaillancourt DE, MacKinnon CD. Подсознательная недостаточность инициации походки при расстройстве поведения во сне с быстрым движением глаз: предвестник застывания походки? Mov Disord. 2016; 31 (11): 1711–9.
PubMed PubMed Central Статья Google Scholar
Эгётц Мартенс К.А., Матар Э., Холл Дж. М., Филлипс Дж., Сзето Дж. Й.Y., Гуэль А., Грюнштейн Р. Р., Холлидей Г. М., Льюис С. Д. Дж. Незначительные нарушения походки и равновесия возникают при идиопатическом расстройстве поведения во сне, связанном с быстрым движением глаз.Mov Disord. 2019; 34 (9): 1374–80.
PubMed Статья PubMed Central Google Scholar
Херши Л.А., Лихтер Д.Г. Замораживание походки при БП имеет коррелят быстрого сна: дважды проклят с общей патофизиологией? Неврология. 2013. 81 (12): 1026–7.
PubMed Статья PubMed Central Google Scholar
Лю Y, Zhu XY, Zhang XJ, Kuo SH, Ondo WG, Wu YC.Клинические особенности болезни Паркинсона с нарушением поведения во сне с быстрым движением глаз и без него. Перевод Neurodegener. 2017; 6: 35.
PubMed PubMed Central Статья Google Scholar
Риккарди Л., Эбрео М., Грациози А., Барбуто М., Сорбера С., Морганте Л., Морганте Ф. Речь и походка при болезни Паркинсона: когда важен ритм. Паркинсонизм, связанный с разладом. 2016; 32: 42–7.
PubMed Статья Google Scholar
Arena JE, Cerquetti D, Rossi M, Chaves H, Rollan C, Dossi DE, Merello M. Влияние сверхинтенсивности МРТ белого вещества на острую l-допа-реакцию у пациентов с болезнью Паркинсона. Паркинсонизм, связанный с разладом. 2016; 24: 126–8.
CAS PubMed Статья Google Scholar
Котагал В., Альбин Р.Л., Мюллер М.Л., Коппе Р.А., Фрей К.А., Бонен Н.И. Модифицируемые факторы риска сердечно-сосудистых заболеваний и нарушения осевой моторики при болезни Паркинсона.Неврология. 2014. 82 (17): 1514–20.
PubMed PubMed Central Статья Google Scholar
Фаган А.М., Минтун М.А., Мах Р.Х., Ли С.И., Денс С.С., Шах А.Р., ЛаРосса Г.Н., Спиннер М.Л., Кланк В.Е., Матис К.А. и др. Обратная связь между нагрузкой на амилоид при визуализации in vivo и цереброспинальной жидкостью Abeta42 у людей. Энн Нейрол. 2006. 59 (3): 512–9.
CAS PubMed Статья Google Scholar
Келер П.Дж., Ноннекес Дж., Блум Б.Р. Замораживание походки перед введением леводопы. Lancet Neurol. 2019. https://doi.org/10.1016/S1474-4422(19)30091-2.
Nonnekes J, Snijders AH, Nutt JG, Deuschl G, Giladi N, Bloem BR. Замерзание походки: практический подход к ведению. Lancet Neurol. 2015; 14 (7): 768–78.
PubMed Статья Google Scholar
Cossu G, Ricchi V, Pilleri M, Mancini F, Murgia D, Ricchieri G, Mereu A, Melis M, Antonini A.Леводопа-карбидопа интраджунальный гель при запущенной болезни Паркинсона с «замораживанием» походки «на». Neurol Sci. 2015; 36 (9): 1683–6.
PubMed Статья Google Scholar
Rascol O, Brooks DJ, Korczyn AD, De Deyn PP, Clarke CE, Lang AE. Пятилетнее исследование частоты дискинезии у пациентов с ранней стадией болезни Паркинсона, получавших ропинирол или леводопу. N Engl J Med. 2000. 342 (20): 1484–91.
CAS PubMed Статья Google Scholar
Nieuwboer A, Rochester L, Herman T., Vandenberghe W., Emil GE, Thomaes T., Giladi N. Надежность нового опросника по замораживанию походки: согласие между пациентами с болезнью Паркинсона и их опекунами. Поза походки. 2009. 30 (4): 459–63.
PubMed Статья Google Scholar
Fietzek UM, Zwosta J, Schroeteler FE, Ziegler K, Ceballos-Baumann AO. Леводопа изменяет тяжесть замерзания при болезни Паркинсона.Паркинсонизм, связанный с разладом. 2013. 19 (10): 894–6.
PubMed Статья Google Scholar
Nyholm D, Lewander T, Johansson A, Lewitt PA, Lundqvist C, Aquilonius SM. Энтеральная инфузия леводопы / карбидопы при запущенной болезни Паркинсона: длительное воздействие. Clin Neuropharmacol. 2008. 31 (2): 63–73.
CAS PubMed Статья Google Scholar
Devos D, французская DSG.Профиль пациента, показания, эффективность и безопасность инфузии леводопы двенадцатиперстной кишки при запущенной болезни Паркинсона. Mov Disord. 2009. 24 (7): 993–1000.
PubMed Статья Google Scholar
Zibetti M, Angrisano S, Dematteis F, Artusi CA, Romagnolo A, Merola A, Lopiano L. Влияние кишечной инфузии леводопы на замерзание походки при болезни Паркинсона. J Neurol Sci. 2018; 385: 105–8.
CAS PubMed Статья Google Scholar
Валльдеориола Ф, Грандас Ф, Сантос-Гарсия Д., Риджидор I, Каталонский М.Ю., Арбело Дж. М., Пуэнте V, Мир П., Парра Дж. С.. Долгосрочная эффективность кишечного геля леводопа-карбидопа у 177 испанских пациентов с запущенной болезнью Паркинсона. Neurodegener Dis Manag. 2016; 6 (4): 289–98.
PubMed Статья Google Scholar
Sensi M, Preda F, Trevisani L, Contini E, Gragnaniello D, Capone JG, Sette E, Golfre-Andreasi N, Tugnoli V, Tola MR, et al.Возникающие вопросы по критериям выбора инфузионной терапии леводопа карбидопа: соображения относительно исходов 28 последовательных пациентов. J Neural Transm (Вена). 2014; 121 (6): 633–42.
CAS Статья Google Scholar
Vijiaratnam N, Hewer S, Varley S, Paul E, Bertram KL, Lee W, Ligtermoet M, Williams DR. Кишечный гель леводопа-карбидопа: назо-тощеечная фаза — избыточное правило? Intern Med J. 2018; 48 (4): 469–71.
CAS PubMed Статья Google Scholar
Чанг ФК, Цуй Д.С., Махант Н., Вулф Н., Ким С.Д., Ха А.Д., Друри М., Гриффит Дж. М., Фунг В.С. Кишечный гель леводопа-карбидопа на 24 часа может уменьшить количество падений и «неотзывчивого» замораживания походки при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2015; 21 (3): 317–20.
PubMed Статья Google Scholar
Кано О, Икеда К., Киедзука Т., Ивамото К., Ито Х., Кавасе И, Сато Р., Фудзиока Т., Араки Ю., Баба С. и др.Благоприятное влияние прамипексола на двигательную функцию и депрессию при болезни Паркинсона. Neuropsychiatr Dis Treat. 2008. 4 (4): 707–10.
CAS PubMed Google Scholar
Икеда К., Хираяма Т., Такадзава Т., Кавабе К., Ивасаки Ю. Трансдермальный пластырь с ротиготином ослабляет замерзание походки у пациентов с болезнью Паркинсона: открытое сравнительное исследование трех агонистов дофаминовых рецепторов спорыньи. Intern Med (Токио, Япония).2016; 55 (19): 2765–9.
CAS Статья Google Scholar
Vaamonde Gamo J, Cabello JP, Gallardo Alcaniz MJ, Flores Barragan JM, Carrasco Garcia de Leon S, Ibanez Alonso RE. Замораживание походки, не отвечающее на дофаминергическую стимуляцию, у пациентов с тяжелым паркинсонизмом. Неврология (Барселона, Испания). 2010. 25 (1): 27–31.
CAS Статья Google Scholar
Иидзима М., Митома Х, Учияма С., Китагава К. Долгосрочный мониторинг походки с использованием носимого устройства в повседневной жизни пациентов с болезнью Паркинсона: эффективность селегилина гидрохлорида при нарушении походки. Фронт Neurol. 2017; 8: 542.
PubMed PubMed Central Статья Google Scholar
Rascol O, Brooks DJ, Melamed E, Oertel W, Poewe W, Stocchi F, Tolosa E, group Ls. Разагилин в качестве дополнения к леводопе у пациентов с болезнью Паркинсона и двигательными флуктуациями (LARGO, Длительный эффект дополнительной терапии с применением разагилина один раз в день, исследование): рандомизированное двойное слепое исследование в параллельных группах.Ланцет. 2005; 365 (9463): 947–54.
CAS PubMed Статья Google Scholar
Cibulcik F, Benetin J, Kurca E, Grofik M, Dvorak M, Richter D, Donath V, Kothaj J, Minar M, Valkovic P. Влияние разагилина на замерзание походки при болезни Паркинсона — открытое этикетка, многоцентровое исследование. Биомед Пап Мед Fac Univ Palacky Olomouc Czech Repub. 2016; 160 (4): 549–52.
PubMed Статья Google Scholar
Рахими Ф., Робертс А.С., Джог М. Паттерны и предикторы замедления улучшения походки после терапии разагилином: пилотное исследование. Clin Neurol Neurosurg. 2016; 150: 117–24.
PubMed Статья Google Scholar
Моро С., Дельваль А., Дефевр Л., Дюжарден К., Дюамель А., Петит Г., Вийом I, Корвол Дж. К., Брефель-Курбон С., Ори-Магне Ф. и др. Метилфенидат при гипокинезии походки и обморожении у пациентов с болезнью Паркинсона, подвергающихся субталамической стимуляции: многоцентровое параллельное рандомизированное плацебо-контролируемое исследование.Lancet Neurol. 2012. 11 (7): 589–96.
CAS PubMed Статья Google Scholar
Девос Д., Кристковяк П., Клемент Ф, Дюжарден К., Коттенцин О., Вокье Н., Ажеббар К., Тилеманс Б., Кроумова М., Дюамель А. и др. Улучшение походки хроническим приемом высоких доз метилфенидата у пациентов с запущенной болезнью Паркинсона. J Neurol Neurosurg Psychiatry. 2007. 78 (5): 470–5.
CAS PubMed Статья Google Scholar
Поллак Л, Доброневский Ю, Прохоров Т, Бахункер С, Рабей Ж.М. Низкая доза метилфенидата улучшает замораживание при запущенной болезни Паркинсона в состоянии «выключено». J Neural Transm Suppl. 2007. 72: 145–8.
CAS Статья Google Scholar
Espay AJ, Dwivedi AK, Payne M, Gaines L, Vaughan JE, Maddux BN, Slevin JT, Gartner M, Sahay A, Revilla FJ, et al. Метилфенидат для нарушения походки при болезни Паркинсона: рандомизированное клиническое исследование.Неврология. 2011. 76 (14): 1256–62.
CAS PubMed PubMed Central Статья Google Scholar
Мацуура К., Кадзикава Х., Табеи К.И., Сато М., Кида Х., Накамура Н., Томимото Х. Эффективность истрадефиллина для лечения нарушений походки и сонливости у пациентов с болезнью Паркинсона. Neurosci Lett. 2018; 662: 158–61.
CAS PubMed Статья Google Scholar
Iijima M, Orimo S, Terashi H, Suzuki M, Hayashi A, Shimura H, Mitoma H, Kitagawa K, Okuma Y. Эффективность истрадефиллина при нарушениях походки с замораживанием походки при болезни Паркинсона: одноручное, открытое , проспективное, многоцентровое исследование. Эксперт Opin Pharmacother. 2019; 20 (11): 1405–11.
CAS PubMed Статья Google Scholar
Такахаши М, Табу Х, Одзаки А, Хамано Т, Такэшима Т, группа рупий. Антидепрессанты при депрессии, апатии и нестабильности походки при болезни Паркинсона: многоцентровое рандомизированное исследование.Intern Med (Токио, Япония). 2018; 58 (3): 361–8.
Fukada K, Endo T, Yokoe M, Hamasaki T., Hazama T., Sakoda S. Совместное введение L-трео-3,4-дигидроксифенилсерина (L-DOPS) с энтакапоном улучшает застывание походки при болезни Паркинсона . Мед-гипотезы. 2013; 80 (2): 209–12.
CAS PubMed Статья Google Scholar
Tohgi H, Abe T., Takahashi S. Влияние L-трео-3,4-дигидроксифенилсерина на общую концентрацию норадреналина и дофамина в спинномозговой жидкости и застывшую походку у пациентов с паркинсонизмом.J Neural Transm Park Dis Dement Sect. 1993. 5 (1): 27–34.
CAS PubMed Статья Google Scholar
Malkani R, Zadikoff C, Melen O, Videnovic A, Borushko E, Simuni T. Амантадин для замораживания походки у пациентов с болезнью Паркинсона. Clin Neuropharmacol. 2012; 35 (6): 266–8.
CAS PubMed PubMed Central Статья Google Scholar
Ли Дж.Й., О С, Ким Дж. М., Ким Дж. С., О Е, Ким Х. Т., Чон Б. С., Чо Дж. У. Внутривенное введение амантадина при остановке походки при болезни Паркинсона: рандомизированное контролируемое исследование. J Neurol. 2013. 260 (12): 3030–8.
CAS PubMed Статья Google Scholar
Ким Й.Е., Юн Дж.Й., Чон Б.С. Влияние внутривенного амантадина на устойчивое к дофаминергическим препаратам замораживание походки. Паркинсонизм, связанный с разладом. 2011; 17 (6): 491–2.
PubMed Статья Google Scholar
Ким Е, Юн Джи, Ян ХД, Ким ХД, Гу Н, Юн Ш, Чо Джи, Чон Б. Внутривенное введение амантадина для остановки походки, резистентной к дофаминергической терапии: рандомизированное двойное слепое плацебо-контролируемое перекрестное клиническое испытание. PLoS One. 2012; 7 (11): e48890.
CAS PubMed Статья Google Scholar
Jankovic J. Атомоксетин для замораживания походки при болезни Паркинсона. J Neurol Sci. 2009. 284 (1-2): 177–8.
CAS PubMed Статья Google Scholar
Ревуэльта Дж. Дж., Эмбри А., Вяз Дж. Дж., Грегори С., Деламбо А., Каутц С., Хинсон В. К.. Пилотное исследование атомоксетина у пациентов с болезнью Паркинсона и замораживанием походки, не реагирующим на допа. Перевод Neurodegener. 2015; 4: 24.
PubMed Статья CAS Google Scholar
Литвиненко И.В., Одинак М.М., Могильная В.И., Емелин А.А. Эффективность и безопасность галантамина (ремила) при лечении деменции у пациентов с болезнью Паркинсона (открытое контролируемое исследование).Ж. Неврол Психиатр Им С. С. Корсакова. 2007. 107 (12): 25–33.
CAS PubMed Google Scholar
Henderson EJ, Lord SR, Brodie MA, Gaunt DM, Lawrence AD, Close JC, Whone AL, Ben-Shlomo Y. Ривастигмин для стабильности походки у пациентов с болезнью Паркинсона (ReSPonD): рандомизированный, двойной слепое плацебо-контролируемое исследование фазы 2. Lancet Neurol. 2016; 15 (3): 249–58.
CAS PubMed Статья Google Scholar
Гуревич Т., Перец С., Мур О., Вейцманн Н., Гилади Н. Влияние инъекции ботулинического токсина типа а в икроножные мышцы на замерзание походки при болезни Паркинсона: двойное слепое плацебо-контролируемое пилотное исследование. Mov Disord. 2007. 22 (6): 880–3.
PubMed Статья Google Scholar
Wieler M, Camicioli R, Jones CA, Martin WR. Инъекции ботулинического токсина не улучшают застывание походки при болезни Паркинсона. Неврология.2005. 65 (4): 626–8.
CAS PubMed Статья Google Scholar
Гилади Н., Гуревич Т., Шабтай Н., Палеаку Д., Саймон Э.С. Влияние инъекций ботулинического токсина в икроножные мышцы на замерзание походки при паркинсонизме: пилотное исследование. J Neurol. 2001. 248 (7): 572–6.
CAS PubMed Статья Google Scholar
Вастик М, Хок П, Хлустик П, Отруба П, Тудос З, Кановский П.Лечение ботулиническим токсином замедления походки у пациентов с болезнью Паркинсона, что отражено в функциональной магнитно-резонансной томографии движения ног. Neuro Endocrinol Lett. 2016; 37 (2): 147–53.
CAS PubMed Google Scholar
Fernandez HH, Lannon MC, Trieschmann ME, Friedman JH. Ботулинический токсин типа B для замораживания походки при болезни Паркинсона. Med Sci Monit. 2004. 10 (7): Cr282–4.
PubMed Google Scholar
Amboni M, Stocchi F, Abbruzzese G, Morgante L, Onofrj M, Ruggieri S, Tinazzi M, Zappia M, Attar M, Colombo D и др. Распространенность и связанные с этим особенности замораживания походки при болезни Паркинсона: исследование DEEP FOG. Паркинсонизм, связанный с разладом. 2015; 21 (6): 644–9.
CAS PubMed Статья Google Scholar
Espay AJ, Fasano A, van Nuenen BF, Payne MM, Snijders AH, Bloem BR. «Включенное» состояние замирания походки при болезни Паркинсона: парадоксальное осложнение, вызванное леводопой.Неврология. 2012; 78 (7): 454–7.
CAS PubMed PubMed Central Статья Google Scholar
Olanow CW, Kieburtz K, Odin P, Espay AJ, Standaert DG, Fernandez HH, Vanagunas A, Othman AA, Widnell KL, Robieson WZ, et al. Непрерывная интраджунальная инфузия кишечного геля леводопа-карбидопа для пациентов с поздней стадией болезни Паркинсона: рандомизированное контролируемое двойное слепое исследование с двойной фиксацией. Lancet Neurol. 2014; 13 (2): 141–14.
CAS PubMed Статья Google Scholar
Fernandez HH, Standaert DG, Hauser RA, Lang AE, Fung VS, Klostermann F, Lew MF, Odin P, Steiger M, Yakupov EZ, et al. Кишечный гель леводопа-карбидопа на поздних стадиях болезни Паркинсона: окончательные 12-месячные открытые результаты. Mov Disord. 2015; 30 (4): 500–9.
CAS PubMed Статья Google Scholar
Serrao M, Ranavolo A, Conte C, Davassi C, Mari S, Fasano A, Chini G, Coppola G, Draicchio F, Pierelli F. Влияние 24-часового непрерывного лечения ротиготином на стационарную и нестационарную локомоцию у пациентов de novo с болезнью Паркинсона в открытом неконтролируемом исследовании. J Neurol. 2015; 262 (11): 2539–47.
CAS PubMed Статья Google Scholar
Ондо В., Хантер С., Альмагер М., Ганчер С., Янкович Дж. Эффективность и переносимость нового сублингвального препарата апоморфина у пациентов с флуктуирующей болезнью Паркинсона.Clin Neuropharmacol. 1999; 22 (1): 1–4.
CAS PubMed Статья Google Scholar
Бродский М.А., Парк Б.С., Натт Дж. Влияние агониста дофамина на фармакодинамику леводопы при болезни Паркинсона. Arch Neurol. 2010. 67 (1): 27–32.
PubMed PubMed Central Статья Google Scholar
Шоулсон И., Оукс Д., Фан С., Ланг А., Лэнгстон Дж. У., Левитт П., Оланов К. В., Пенни Дж. Б., Таннер С., Кибурц К. и др.Влияние длительного приема депренила (селегилина) на лечение леводопой болезни Паркинсона: рандомизированное плацебо-контролируемое расширение антиоксидантной терапии депренилом и токоферолом в испытании паркинсонизма. Энн Нейрол. 2002. 51 (5): 604–12.
CAS PubMed Статья Google Scholar
Zhang Z, Wang J, Chen S, Liu C, Zhang B, Peng R, Sun S, Sun X, Zhao G, Qu Q и др. Эффективность и безопасность разагилина у китайских пациентов с ранней стадией болезни Паркинсона: рандомизированное двойное слепое параллельное плацебо-контролируемое исследование с фиксированными дозами.Перевод Neurodegener. 2018; 7:32.
PubMed PubMed Central Статья CAS Google Scholar
Zhang Z, Shao M, Chen S, Liu C, Peng R, Li Y, Wang J, Zhu S, Qu Q, Zhang X и др. Дополнительный разагилин для лечения болезни Паркинсона с двигательными колебаниями: рандомизированное двойное слепое исследование, проведенное в Китае. Перевод Neurodegener. 2018; 7: 14.
PubMed PubMed Central Статья CAS Google Scholar
Стерн М.Б., Марек К.Л., Фридман Дж., Хаузер Р.А., Левитт П.А., Тарси Д., Оланов К.В. Двойное слепое рандомизированное контролируемое исследование разагилина в качестве монотерапии у пациентов с ранней стадией болезни Паркинсона. Mov Disord. 2004. 19 (8): 916–23.
PubMed Статья Google Scholar
Китагава М., Хузен Х., Таширо К. Влияние кофеина на замедление походки при болезни Паркинсона. Mov Disord. 2007. 22 (5): 710–2.
PubMed Статья Google Scholar
ЛеВитт П.А., Гуттман М., Тетруд Дж. В., Туите П.Дж., Мори А., Чайкин П., Суссман Н.М., Группа USS. Антагонист аденозиновых рецепторов A2A истрадефиллин (KW-6002) сокращает время «отдыха» при болезни Паркинсона: двойное слепое рандомизированное многоцентровое клиническое исследование (6002-US-005). Энн Нейрол. 2008. 63 (3): 295–302.
CAS PubMed Статья Google Scholar
Бонен Н.И., Фрей К.А., Студенски С., Котагал В., Коппе Р.А., Константин Г.М., Скотт П.Дж., Альбин Р.Л., Мюллер М.Л.Экстра-нигральные патологические состояния распространены при болезни Паркинсона с застыванием походки: исследование in vivo с помощью позитронно-эмиссионной томографии. Mov Disord. 2014. 29 (9): 1118–24.
CAS PubMed PubMed Central Статья Google Scholar
Pinto de Souza C, Hamani C, Oliveira Souza C, Lopez Contreras WO, Dos Santos Ghilardi MG, Cury RG, Reis Barbosa E, Jacobsen Teixeira M, Talamoni Fonoff E. Стимуляция спинного мозга улучшает походку у пациентов с Болезнь Паркинсона ранее лечили с помощью глубокой стимуляции мозга.Mov Disord. 2017; 32 (2): 278–82.
PubMed Статья Google Scholar
Самотус О., Паррент А., Джог М. Терапия стимуляцией спинного мозга при дисфункции походки у пациентов с запущенной болезнью Паркинсона. Mov Disord. 2018; 33 (5): 783–92.
Jacobs JV, Lou JS, Kraakevik JA, Horak FB. Дополнительная моторная зона способствует определению времени упреждающей корректировки позы во время начала шага у участников с болезнью Паркинсона и без нее.Неврология. 2009. 164 (2): 877–85.
CAS PubMed PubMed Central Статья Google Scholar
Takakusaki K, Habaguchi T., Ohtinata-Sugimoto J, Saitoh K, Sakamoto T. Отводящие базальные ганглии в центры ствола мозга, контролирующие постуральный мышечный тонус и движение: новая концепция для понимания двигательных нарушений при дисфункции базальных ганглиев. Неврология. 2003. 119 (1): 293–308.
CAS PubMed Статья Google Scholar
Такакусаки К. Функциональная нейроанатомия для контроля осанки и походки. J Mov Disord. 2017; 10 (1): 1–17.
PubMed PubMed Central Статья Google Scholar
Брудзинский С.М., Ву М., Могенсон Г.Дж. Снижение двигательной активности крыс в результате изменений синаптической передачи нейронов в мезэнцефалической локомоторной области. Может J Physiol Pharmacol. 1993. 71 (5-6): 394-406.
CAS PubMed Статья Google Scholar
de Lima-Pardini AC, Coelho DB, Souza CP, Souza CO, Ghilardi M, Garcia T, Voos M, Milosevic M, Hamani C, Teixeira LA и др. Влияние стимуляции спинного мозга на контроль осанки у пациентов с болезнью Паркинсона с застывшей походкой. Элиф. 2018; 7. https://doi.org/10.7554/eLife.37727.
Fonoff ET, de Lima-Pardini AC, Coelho DB, Monaco BA, Machado B, Pinto de Souza C, Dos Santos Ghilardi MG, Hamani C. Стимуляция спинного мозга для остановки походки: от скамьи к постели.Фронт Neurol. 2019; 10: 905.
PubMed Статья Google Scholar
Schlenstedt C, Shalash A, Muthuraman M, Falk D, Witt K, Deuschl G. Влияние высокочастотной субталамической нейростимуляции на походку и остановку походки при болезни Паркинсона: систематический обзор и метаанализ. Eur J Neurol. 2017; 24 (1): 18–26.
CAS PubMed Статья Google Scholar
Zibetti M, Merola A, Rizzi L, Ricchi V, Angrisano S, Azzaro C, Artusi CA, Arduino N, Marchisio A, Lanotte M и др. Более девяти лет непрерывной стимуляции глубокого мозга субталамического ядра при болезни Паркинсона. Mov Disord. 2011. 26 (13): 2327–34.
PubMed Статья Google Scholar
Rizzone MG, Fasano A, Daniele A, Zibetti M, Merola A, Rizzi L, Piano C, Piccininni C, Romito LM, Lopiano L, et al. Отдаленный исход DBS субталамического ядра при болезни Паркинсона: от продвинутой фазы к поздней стадии болезни? Паркинсонизм, связанный с разладом.2014. 20 (4): 376–81.
CAS PubMed Статья Google Scholar
Li J, Zhang Y, Li Y. Долгосрочное наблюдение за двусторонней стимуляцией субталамического ядра у пациентов с китайской болезнью Паркинсона. Br J Neurosurg. 2015; 29 (3): 329–33.
CAS PubMed Статья Google Scholar
Краузе М., Фогель В., Майер П., Клосс М., Тронье В. Хроническое ингибирование субталамического ядра при болезни Паркинсона.J Neurol Sci. 2004. 219 (1-2): 119–24.
CAS PubMed Статья Google Scholar
Дэвис Дж. Т., Лайонс К. Э., Пахва Р. Заморозка походки после двусторонней стимуляции субталамического ядра при болезни Паркинсона. Clin Neurol Neurosurg. 2006. 108 (5): 461–4.
PubMed Статья Google Scholar
Krack P, Batir A, Van Blercom N, Chabardes S, Fraix V, Ardouin C, Koudsie A, Limousin PD, Benazzouz A, LeBas JF, et al.Пятилетнее наблюдение за двусторонней стимуляцией субталамического ядра при запущенной болезни Паркинсона. N Engl J Med. 2003. 349 (20): 1925–34.
CAS PubMed Статья Google Scholar
Visser-Vandewalle V, van der Linden C, Temel Y, Celik H, Ackermans L, Spincemaille G, Caemaert J. Долгосрочные эффекты двусторонней стимуляции субталамического ядра при запущенной болезни Паркинсона: четырехлетнее наблюдение до учебы. Паркинсонизм, связанный с разладом.2005. 11 (3): 157–65.
PubMed Статья Google Scholar
Ferraye MU, Debu B, Fraix V, Xie-Brustolin J, Chabardes S, Krack P, Benabid AL, Pollak P. Влияние стимуляции субталамического ядра и леводопы на замерзание походки при болезни Паркинсона. Неврология. 2008. 70 (16 Pt 2): 1431–7.
CAS PubMed Статья Google Scholar
Niu L, Ji LY, Li JM, Zhao DS, Huang G, Liu WP, Qu Y, Ma LT, Ji XT.Влияние двусторонней стимуляции глубокого мозга субталамического ядра на остановку походки при болезни Паркинсона. J Int Med Res. 2012. 40 (3): 1108–13.
CAS PubMed Статья Google Scholar
Vercruysse S, Vandenberghe W, Munks L, Nuttin B, Devos H, Nieuwboer A. Эффекты глубокой стимуляции мозга субталамического ядра на остановку походки при болезни Паркинсона: проспективное контролируемое исследование. J Neurol Neurosurg Psychiatry.2014; 85 (8): 871–7.
CAS PubMed Статья Google Scholar
Адамс К., Кип М., Мартин К., МакВикер Дж., Кумар Р. Острая индукция устойчивого к леводопе замораживания походки при имплантации электрода в субталамическое ядро. Паркинсонизм, связанный с разладом. 2011. 17 (6): 488–90.
PubMed Статья Google Scholar
van Nuenen BF, Esselink RA, Munneke M, Speelman JD, van Laar T., Bloem BR.Ухудшение послеоперационной походки после двусторонней стимуляции субталамического ядра при болезни Паркинсона. Mov Disord. 2008. 23 (16): 2404–6.
PubMed Статья Google Scholar
Флери В., Поллак П., Гир Дж., Томмази Дж., Ромито Л., Комбескюр С., Бардинет Е., Шабардес С., Момджиан С., Крайник А. и др. Субталамическая стимуляция может подавлять благотворное влияние леводопы на акинезию и походку. Mov Disord. 2016; 31 (9): 1389–97.
CAS PubMed Статья Google Scholar
Kim R, Kim HJ, Kim A, Kim Y, Kim AR, Shin CW, Paek SH, Jeon B. Депрессия может негативно повлиять на изменение походки после стимуляции субталамического ядра при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2017; 44: 133–6.
PubMed Статья Google Scholar
Моро С., Дефевр Л., Дестее А, Блейз С., Клемент Ф., Блатт Дж. Л., Кристковяк П., Девос Д.Влияние частоты STN-DBS на застывание походки при запущенной болезни Паркинсона. Неврология. 2008. 71 (2): 80–4.
CAS PubMed Статья Google Scholar
Xie T, Vigil J, MacCracken E, Gasparaitis A, Young J, Kang W., Bernard J, Warnke P, Kang UJ. Низкочастотная стимуляция STN-DBS снижает аспирацию и замирание походки у пациентов с БП. Неврология. 2015; 84 (4): 415–20.
PubMed Статья Google Scholar
Xie T, Bloom L, Padmanaban M, Bertacchi B, Kang W, MacCracken E, Dachman A, Vigil J, Satzer D, Zadikoff C и др. Долгосрочный эффект низкочастотной стимуляции STN на дисфагию, застывание походки и другие двигательные симптомы при БП. J Neurol Neurosurg Psychiatry. 2018; 89 (9): 989–94.
PubMed Статья Google Scholar
Фиббс Ф.Т., Арбогаст П.Г., Дэвис Т.Л. Влияние частоты 60 Гц на походку при болезни Паркинсона с глубокой стимуляцией субталамического ядра мозга.Нейромодуляция. 2014; 17 (8): 717–20 обсуждение 720.
PubMed Статья Google Scholar
Сидиропулос К., Уолш Р., Миней С., Пун Ю.Й., Фаллис М., Моро Э. Низкочастотная стимуляция глубокого мозга субталамического ядра при осевых симптомах на поздних стадиях болезни Паркинсона. J Neurol. 2013. 260 (9): 2306–11.
CAS PubMed Статья Google Scholar
Xie T, Padmanaban M, Bloom L, MacCracken E, Bertacchi B, Dachman A, Warnke P. Эффект низкочастотной и высокочастотной стимуляции на остановку походки и другие осевые симптомы у пациентов с болезнью Паркинсона с двусторонним STN DBS: мини-обзор. Перевод Neurodegener. 2017; 6: 13.
PubMed PubMed Central Статья Google Scholar
Xie T, Kang UJ. Комментарии к недавней статье о низкочастотной глубокой стимуляции мозга при болезни Паркинсона.Mov Disord. 2017; 32 (1): 176.
PubMed Статья Google Scholar
Chen S, Gao G, Feng T, Zhang J, Отделение функциональной нейрохирургии Китайской медицинской ассоциации, отделение функциональной нейрохирургии G, Отделение неврологии Китайской медицинской ассоциации, D, расстройства движения G, Отделение нейрохирургов Китайской ассоциации врачей, отделение функциональной нейрохирургии. C, Китайская ассоциация врачей, отделение неврологов отделения болезни Паркинсона, специалист по двигательным расстройствам C и др.Консенсус китайских экспертов по программированию глубокой стимуляции мозга для пациентов с болезнью Паркинсона. Перевод Neurodegener. 2018; 7: 11.
CAS PubMed PubMed Central Статья Google Scholar
Mestre TA, Sidiropoulos C, Hamani C, Poon YY, Lozano AM, Lang AE, Moro E. Длительная двойная слепая односторонняя стимуляция педункулопонтинной области при болезни Паркинсона. Mov Disord. 2016; 31 (10): 1570–4.
PubMed Статья Google Scholar
Теватасан В., Дебу Б., Азиз Т., Блум Б.Р., Блахак С., Бутсон С., Чернецки В., Фолтини Т., Фракс В., Грабли Д. и др. Стимуляция глубокого мозгового ядра педункулопонтического ядра при болезни Паркинсона: клинический обзор. Mov Disord. 2018; 33 (1): 10–20.
PubMed Статья Google Scholar
Велтер М.Л., Демейн А., Эвенчик С., Чернецки В., Лау Б., Эль-Хелу А., Белайд Х., Ельник Дж., Франсуа С., Бардине Е. и др. PPNa-DBS при нарушениях походки и равновесия при болезни Паркинсона: двойное слепое рандомизированное исследование.J Neurol. 2015; 262 (6): 1515–25.
PubMed Статья Google Scholar
Thevathasan W, Cole MH, Graepel CL, Hyam JA, Jenkinson N, Brittain JS, Coyne TJ, Silburn PA, Aziz T.Z, Kerr G, et al. Пространственно-временной анализ остановки движения и влияния стимуляции педункулопонтинного ядра. Мозг. 2012; 135 (Pt 5): 1446–54.
PubMed PubMed Central Статья Google Scholar
Thevathasan W, Coyne TJ, Hyam JA, Kerr G, Jenkinson N, Aziz TZ, Silburn PA. Стимуляция педункулопонтического ядра улучшает замирание походки при болезни Паркинсона. Нейрохирургия. 2011; 69 (6): 1248–53 Discussion 1254.
PubMed Статья Google Scholar
Моро Э., Хамани К., Пун Ю.Й., Аль-Хайралла Т., Достровский Д.О., Хатчисон В.Д., Лосано А.М.. Односторонняя стимуляция педункулопонтина улучшает падение при болезни Паркинсона. Мозг.2010. 133 (Pt 1): 215–24.
PubMed Статья Google Scholar
Феррей М.Ю., Дебу Б., Фраикс В., Гетц Л., Ардуэн С., Ельник Дж., Генри-Лагранж С., Сеньор Е., Пиаллат Б., Крак П. и др. Влияние стимуляции области педункулопонтического ядра на нарушения походки при болезни Паркинсона. Мозг. 2010. 133 (Pt 1): 205–14.
CAS PubMed Статья Google Scholar
Thevathasan W, Pogosyan A, Hyam JA, Jenkinson N, Foltynie T, Limousin P, Bogdanovic M, Zrinzo L, Green AL, Aziz TZ, et al. Альфа-колебания в педункулопонтиальном ядре коррелируют с характеристиками походки при паркинсонизме. Мозг. 2012; 135 (Pt 1): 148–60.
PubMed PubMed Central Статья Google Scholar
Weiss D, Walach M, Meisner C, Fritz M, Scholten M, Breit S, Plewnia C, Bender B, Gharabaghi A, Wachter T. и др.Негральная стимуляция при резистентном нарушении осевой моторики при болезни Паркинсона? Рандомизированное контролируемое исследование. Мозг. 2013; 136 (Pt 7): 2098–108.
PubMed PubMed Central Статья Google Scholar
Valldeoriola F, Munoz E, Rumia J, Roldan P, Camara A, Compta Y, Marti MJ, Tolosa E. Одновременная низкочастотная глубокая стимуляция сетчатой части черной субстанции и высокочастотная стимуляция субталамическое ядро для лечения зависания от леводопы замораживания походки при болезни Паркинсона: пилотное исследование.Паркинсонизм, связанный с разладом. 2019; 60: 153–7.
PubMed Статья Google Scholar
Фарранд А.К., Хелке К.Л., Грегори Р.А., Гуз М., Хинсон В.К., Богер Х.А. Стимуляция блуждающего нерва улучшает передвижение и популяцию нейронов в модели болезни Паркинсона. Мозговая стимуляция. 2017; 10 (6): 1045–54.
PubMed PubMed Central Статья Google Scholar
Мондал Б., Чоудхури С., Саймон Б., Бейкер М. Р., Кумар Х. Неинвазивная стимуляция блуждающего нерва улучшает походку и уменьшает ее застывание при болезни Паркинсона. Mov Disord. 2019; 34 (6): 917–8.
PubMed Статья Google Scholar
Ким Ю.В., Шин И.С., Мун Х.И., Ли С.К., Юн С.Ю. Эффекты неинвазивной стимуляции мозга на остановку походки при паркинсонизме: систематический обзор с метаанализом. Паркинсонизм, связанный с разладом.2019; 64: 82–9.
PubMed Статья PubMed Central Google Scholar
Ми Т.М., Гарг С., Ба Ф, Лю А.П., Ву Т, Гао Л.Л., Дэн XJ, Чан П., МакКаун MJ. Высокочастотная rTMS в дополнительной моторной области улучшает остановку походки при болезни Паркинсона: рандомизированное контролируемое исследование. Паркинсонизм, связанный с разладом. 2019; 68: 85–90.
PubMed Статья PubMed Central Google Scholar
Ким С.Дж., Пэнг Ш., Кан С.И. Стимуляция дополнительной моторной области по сравнению с моторной корой головного мозга для остановки походки при болезни Паркинсона. J Clin Neurol. 2018. 14 (3): 320–6.
PubMed PubMed Central Статья Google Scholar
Валентино Ф, Косентино Дж., Бригина Ф, Поцци Н. Г., Сандрини Дж., Фиерро Б., Саветтьери Дж., Д’Амелио М., Паккетти С. Транскраниальная стимуляция постоянным током для лечения отморожения походки: перекрестный изучение.Mov Disord. 2014; 29 (8): 1064–9.
PubMed Статья PubMed Central Google Scholar
Даган М., Херман Т., Харрисон Р., Чжоу Дж., Гилади Н., Руффини Дж., Поместье В, Хаусдорф Дж. М.. Многонаправленная транскраниальная стимуляция постоянным током для остановки походки при болезни Паркинсона. Mov Disord. 2018; 33 (4): 642–6.
PubMed PubMed Central Статья Google Scholar
Лу К., Амундсен Хаффмастер С.Л., Туите П.Дж., Маккиннон, компакт-диск. Влияние анодной tDCS на дополнительную моторную область на начало походки при болезни Паркинсона с застыванием походки: пилотное исследование. J Neurol. 2018; 265 (9): 2023–32.
PubMed PubMed Central Статья Google Scholar
Nieuwboer A, Kwakkel G, Rochester L, Jones D, van Wegen E, Willems AM, Chavret F, Hetherington V, Baker K, Lim I. Тренировка на дому улучшает подвижность, связанную с походкой, при болезни Паркинсона. : СПАСЕНИЕ испытание.J Neurol Neurosurg Psychiatry. 2007. 78 (2): 134–40.
CAS Статья Google Scholar
Бартел С., Ноннекес Дж., Ван Хелверт М., Хаан Р., Янссен А., Дельвал А., Вирдестейн В., Дебу Б., ван Везель Р., Блум Б.Р. и др. Лазерная обувь: новое амбулаторное устройство для облегчения замерзания походки при болезни Паркинсона. Неврология. 2018; 90 (2): e164–71.
PubMed Статья PubMed Central Google Scholar
МакКэндлесс П.Дж., Эванс Б.Дж., Янссен Дж., Селф Дж., Черчилль А., Ричардс Дж. Эффект трех сигнальных устройств для людей с болезнью Паркинсона с затруднениями в начале походки. Поза походки. 2016; 44: 7–11.
PubMed Статья PubMed Central Google Scholar
Чжао Ю., Ноннекес Дж., Сторкен Э.Дж., Янссен С., ван Веген Е.Е., Блум Б.Р., Доррестейн Л.Д., ван Вугт Дж. П., Хейда Т., ван Везель Р.Дж.. Возможность внешних ритмических сигналов с помощью Google Glass для улучшения походки у людей с болезнью Паркинсона.J Neurol. 2016; 263 (6): 1156–65.
PubMed PubMed Central Статья Google Scholar
Суини Д., Куинлан Л. Р., Браун П., Ричардсон М., Мескелл П., Лэйгин Г. Технологический обзор носимых сигнальных устройств, направленных на остановку походки при болезни Паркинсона. Датчики (Базель). 2019; 19 (6). https://doi.org/10.3390/s1
77.Frazzitta G, Maestri R, Uccellini D, Bertotti G, Abelli P. Реабилитационное лечение походки у пациентов с болезнью Паркинсона с замерзанием: сравнение двух протоколов физиотерапии с использованием визуальных и слуховых сигналов с тренировкой на беговой дорожке или без нее. .Mov Disord. 2009. 24 (8): 1139–43.
PubMed PubMed Central Статья Google Scholar
Cheng FY, Yang YR, Wu YR, Cheng SJ, Wang RY. Влияние тренировки на ходьбу по кривой на ходьбу по кривой и остановку походки у людей с болезнью Паркинсона: рандомизированное контролируемое исследование. Паркинсонизм, связанный с разладом. 2017; 43: 20–6.
PubMed Статья Google Scholar
Lo AC, Chang VC, Gianfrancesco MA, Friedman JH, Patterson TS, Benedicto DF. Уменьшение замедления походки при болезни Паркинсона за счет повторяющихся тренировок на беговой дорожке с помощью роботов: экспериментальное исследование. J Neuroeng Rehabil. 2010; 7: 51.
PubMed Статья Google Scholar
Барбе М.Т., Цепуран Ф., Амарелл М., Шенау Э., Тиммерманн Л. Долгосрочный эффект ходьбы на беговой дорожке с роботом снижает замерзание походки у пациентов с болезнью Паркинсона: пилотное исследование.J Neurol. 2013; 260 (1): 296–8.
PubMed Статья Google Scholar
Pilleri M, Weis L, Zabeo L, Koutsikos K, Biundo R, Facchini S, Rossi S, Masiero S, Antonini A. Наземный робот-тренажер походки для лечения резистентного к лекарствам замораживания походки при болезни Паркинсона болезнь. J Neurol Sci. 2015; 355 (1-2): 75–8.
PubMed Статья Google Scholar
Zhu Z, Yin M, Cui L, Zhang Y, Hou W., Li Y, Zhao H. Тренировка с водными препятствиями улучшает остановку походки у пациентов с болезнью Паркинсона: рандомизированное контролируемое исследование. Clin Rehabil. 2018; 32 (1): 29–36.
PubMed Статья Google Scholar
Santos L, Fernandez-Rio J, Winge K, Barragan-Perez B, Rodriguez-Perez V, Gonzalez-Diez V, Blanco-Traba M, Suman OE, Philip Gabel C, Rodriguez-Gomez J. Effects контролируемых тренировок по слабой линии при нестабильности осанки, остановке походки и эффективности падений у людей с болезнью Паркинсона.Disabil Rehabil. 2017; 39 (16): 1573–80.
PubMed Статья PubMed Central Google Scholar
Stummer C, Dibilio V, Overeem S, Weerdesteyn V, Bloem BR, Nonnekes J. Велосипед: новое вспомогательное устройство для пациентов с болезнью Паркинсона с застывшей походкой? Паркинсонизм, связанный с разладом. 2015; 21 (7): 755–7.
PubMed Статья PubMed Central Google Scholar
Агоста Ф., Гатти Р., Сарассо Е., Волонте М.А., Кану Е., Мани А., Сарро Л., Копетти М., Каттрисс Е., Керкхофс Е. и др. Пластичность мозга при болезни Паркинсона с застыванием походки, вызванным тренировкой по наблюдению за действиями. J Neurol. 2017; 264 (1): 88–101.
PubMed Статья PubMed Central Google Scholar
Pelosin E, Avanzino L, Bove M, Stramesi P, Nieuwboer A, Abbruzzese G. Наблюдение за действием улучшает застывание походки у пациентов с болезнью Паркинсона.Neurorehabil Neural Repair. 2010. 24 (8): 746–52.
PubMed Статья PubMed Central Google Scholar
Косентино С., Баччини М., Путцолу М., Ристори Д., Аванзино Л., Пелозин Е. Эффективность физиотерапии при замораживании походки при болезни Паркинсона: систематический обзор и метаанализы. Mov Disord. 2019. https://doi.org/10.1002/mds.27936.
Депрессия при болезни Паркинсона: потеря дофамина и норадреналиновая иннервация в лимбической системе | Мозг
Аннотация
Причина высокой частоты депрессии и тревоги при болезни Паркинсона плохо изучена.Дегенерация систем нейромедиаторов, отличных от дофамина, может играть определенную роль в возникновении этих аффективных расстройств. Мы использовали [ 11 C] RTI-32 PET, in vivo маркер связывания переносчиков дофамина и норадреналина, чтобы локализовать различия между депрессивными и не депрессивными пациентами. Мы изучили восемь и 12 пациентов с болезнью Паркинсона с депрессией в анамнезе и без нее, соответствующих возрасту, продолжительности заболевания и дозам противопаркинсонических препаратов.Когорта депрессивной болезни Паркинсона имела более низкое связывание [ 11 C] RTI-32, чем случаи недепрессивной болезни Паркинсона в голубом пятне и в нескольких областях лимбической системы, включая переднюю поясную часть коры, таламус, миндалевидное тело и вентральную часть. полосатое тело. Исследовательский анализ показал, что тяжесть тревоги у пациентов с болезнью Паркинсона обратно коррелировала со связыванием [ 11 C] RTI-32 в большинстве этих областей, а апатия обратно коррелировала со связыванием [ 11 C] RTI-32 в брюшное полосатое тело.Эти результаты предполагают, что депрессия и тревога при болезни Паркинсона могут быть связаны со специфической потерей дофамина и иннервации норадреналина в лимбической системе.
Введение
Частота депрессии при болезни Паркинсона составляет ~ 40% (Brown and Jahanshahi, 1995; Cummings and Masterman, 1999). Частота тяжелой депрессии в два раза выше, чем у других пациентов с такой же инвалидностью (Rodin and Voshart, 1986). Естественная история депрессии при болезни Паркинсона не параллельна развитию физических симптомов, предполагая, что это независимый процесс, который может затронуть уязвимых пациентов (Brown and Jahanshahi, 1995).Однако патофизиология депрессии при болезни Паркинсона остается неясной. Некоторые авторы построили модели, включающие несколько факторов (Brown and Jahanshahi, 1995), тогда как другие постулируют, что нейрохимические аномалии могут объяснять депрессию при болезни Паркинсона (Cummings and Masterman, 1999). В то время как широко распространенный дефицит дофамина является основным признаком болезни Паркинсона, другие системы нейротрансмиттеров дегенерируют или изменяются в результате дегенеративного процесса, например, норадренергические и серотонинергические ядра ствола мозга (Halliday et al ., 1990). Несколько исследований предполагают участие этих нейромедиаторов в патогенезе депрессии при болезни Паркинсона, но четкой закономерности не выявлено (Brown and Jahanshahi, 1995; Tom and Cummings, 1998).
Мы использовали [ 11 C] RTI-32 PET для изучения роли катехоламинергической нейротрансмиссии в патофизиологии депрессии при болезни Паркинсона. [ 11 C] RTI-32 связывается с аналогичным наномолярным сродством с мембранными переносчиками дофамина (DAT) и норадреналина (NAT), но с гораздо более низким сродством к переносчику серотонина (Carroll et al ., 1995). Мы сравнили связывание этого индикатора у пациентов с депрессией и недепрессивной болезнью Паркинсона, которые имели одинаковый возраст, тяжесть заболевания и дозы противопаркинсонических препаратов.
Объекты и методы
Субъектов
Двадцать пациентов в возрасте 58,5 ± 7,9 лет были набраны из клиник двигательных расстройств в Лондоне (таблица 1). Все они соответствовали критериям банка мозга UK PDS для предполагаемой диагностики идиопатической болезни Паркинсона (Hughes et al ., 1992). Длительность заболевания варьировала от 0,5 до 9,0 лет, а стадия Хоэна и Яра — от 1 до 3,5. Пациенты были разделены на две группы в зависимости от наличия ( n = 8) или отсутствия ( n = 12) эпизодов большой депрессии на основании критериев DSM-IV. Пациенты с болезнью Паркинсона, у которых в личном анамнезе была большая депрессия, которая произошла до начала болезни Паркинсона, или минимальная оценка психического Паркинсона <24 (Mahieux et al ., 1995), были исключены.Все испытуемые дали информированное письменное согласие, и исследование было одобрено комитетами по этике исследований Медицинской школы Имперского колледжа (Хаммерсмит) и Института неврологии. Разрешение на использование радиоактивных индикаторов было получено от Консультативного комитета Администрации радиоактивных веществ (Великобритания).
Таблица 1Характеристики пациента с болезнью Паркинсона
| Пациент / пол . | Возраст . | Длительность заболевания . | УПДРС-3 . | BDI . | Апатия . | Беспокойство . | л-допа экв. (мг) . | Прочие лекарства . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 / М | 54 | 5,0 | 15.0 | 12 | 19 | 28 | 400,0 | |||||||||
| 2 / F | 65 | 2,0 | 48,0 | 29 | 46 | 917 917 917 917 930,0 / M | 70 | 2,0 | 30,0 | 20 | 29 | 60 | 300,0 | |||
| 4 / F | 50 | 3,5 | 20.0 | 19 | 44 | 46 | 500,0 | |||||||||
| 5 / M | 41 | 0,5 | 18,0 | 15 | 21 | 917 917 917 917 917 917 917 917 / M | 61 | 1,5 | 19,0 | 16 | 13 | 72 | 0 | |||
| 7 / M | 57 | 5,0 | 29.0 | 30 | 22 | 71 | 1780,0 | Каберголин 5 мг, энтакапон 600 мг | ||||||||
| 8 / F | 54 | 5,0 | 15,0 | 917 917 12 917 | ||||||||||||
| Среднее значение | 56,5 | 3,1 | 24,3 | 19,1 | 18,8 | 50,3 | 526,3 | |||||||||
| (SD)0) | (1,8) | (11,2) | (7,0) | (7,3) | (16,6) | (573,4) | ||||||||||
| 9 / M | 67 | 65 3,0 | 7 | 10 | 37 | 400,0 | ||||||||||
| 10 / M | 64 | 8,0 | 28,0 | 4 | 5 | 917 917 933 | 917 917 933 | 917 610 Entap11 / Факс | 61 | 6.0 | 14,0 | 3 | 8 | 32 | 300,0 | |
| 12 / M | 57 | 4,0 | 15,0 | 6 | 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 | |||||||||||
| 13 / M | 68 | 2,0 | 22,0 | 3 | 9 | 30 | 350,0 | Каберголин 3 мг | ||||||||
| 14 / F | 417.0 | 21,0 | 10 | 9 | 30 | 240,0 | ||||||||||
| 15 / M | 52 | 7,0 | 36,0 | 4 | 81765 0 | |||||||||||
| 16 / M | 58 | 2,5 | 24,0 | 3 | 6 | 34 | 700,0 | Каберголин 1 мг | ||||||||
| 17 / M | 917.0 | 26,5 | 9 | 10 | 27 | 350,0 | ||||||||||
| 18 / M | 70 | 8,0 | 26,0 | Ent1765 3 | 917 917 917 917 917 917 917 917 917 мг | |||||||||||
| 19 / F | 45 | 3,0 | 15,0 | 6 | 22 | 25 | 400,0 | |||||||||
| 20 / M | 639 2170 | 22,0 | 8 | 5 | 46 | 400,0 | ||||||||||
| Среднее значение | 59,8 | 4, | 23,3 | 5,5 | 7 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 (SD) | (7,2) | (2,6) | (6,7) | (2,5) | (2,7) | (8,7) | (257,8) |
| 917 Пациент секс . | Возраст . | Длительность заболевания . | УПДРС-3 . | BDI . | Апатия . | Беспокойство . | л-допа экв. (мг) . | Прочие лекарства . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 / М | 54 | 5,0 | 15.0 | 12 | 19 | 28 | 400,0 | |||||||||
| 2 / F | 65 | 2,0 | 48,0 | 29 | 46 | 917 917 917 917 930,0 / M | 70 | 2,0 | 30,0 | 20 | 29 | 60 | 300,0 | |||
| 4 / F | 50 | 3,5 | 20.0 | 19 | 44 | 46 | 500,0 | |||||||||
| 5 / M | 41 | 0,5 | 18,0 | 15 | 21 | 917 917 917 917 917 917 917 917 / M | 61 | 1,5 | 19,0 | 16 | 13 | 72 | 0 | |||
| 7 / M | 57 | 5,0 | 29.0 | 30 | 22 | 71 | 1780,0 | Каберголин 5 мг, энтакапон 600 мг | ||||||||
| 8 / F | 54 | 5,0 | 15,0 | 917 917 12 917 | ||||||||||||
| Среднее значение | 56,5 | 3,1 | 24,3 | 19,1 | 18,8 | 50,3 | 526,3 | |||||||||
| (SD)0) | (1,8) | (11,2) | (7,0) | (7,3) | (16,6) | (573,4) | ||||||||||
| 9 / M | 67 | 65 3,0 | 7 | 10 | 37 | 400,0 | ||||||||||
| 10 / M | 64 | 8,0 | 28,0 | 4 | 5 | 917 917 933 | 917 917 933 | 917 610 Entap11 / Факс | 61 | 6.0 | 14,0 | 3 | 8 | 32 | 300,0 | |
| 12 / M | 57 | 4,0 | 15,0 | 6 | 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 | |||||||||||
| 13 / M | 68 | 2,0 | 22,0 | 3 | 9 | 30 | 350,0 | Каберголин 3 мг | ||||||||
| 14 / F | 417.0 | 21,0 | 10 | 9 | 30 | 240,0 | ||||||||||
| 15 / M | 52 | 7,0 | 36,0 | 4 | 81765 0 | |||||||||||
| 16 / M | 58 | 2,5 | 24,0 | 3 | 6 | 34 | 700,0 | Каберголин 1 мг | ||||||||
| 17 / M | 917.0 | 26,5 | 9 | 10 | 27 | 350,0 | ||||||||||
| 18 / M | 70 | 8,0 | 26,0 | Ent1765 3 | 917 917 917 917 917 917 917 917 917 мг | |||||||||||
| 19 / F | 45 | 3,0 | 15,0 | 6 | 22 | 25 | 400,0 | |||||||||
| 20 / M | 639 2170 | 22,0 | 8 | 5 | 46 | 400,0 | ||||||||||
| Среднее значение | 59,8 | 4, | 23,3 | 5,5 | 7 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 (SD) | (7,2) | (2,6) | (6,7) | (2,5) | (2,7) | (8,7) | (257,8) |
| Пациент / пол . | Возраст . | Длительность заболевания . | УПДРС-3 . | BDI . | Апатия . | Беспокойство . | л-допа экв. (мг) . | Прочие лекарства . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 / М | 54 | 5,0 | 15.0 | 12 | 19 | 28 | 400,0 | |||||||||
| 2 / F | 65 | 2,0 | 48,0 | 29 | 46 | 917 917 917 917 930,0 / M | 70 | 2,0 | 30,0 | 20 | 29 | 60 | 300,0 | |||
| 4 / F | 50 | 3,5 | 20.0 | 19 | 44 | 46 | 500,0 | |||||||||
| 5 / M | 41 | 0,5 | 18,0 | 15 | 21 | 917 917 917 917 917 917 917 917 / M | 61 | 1,5 | 19,0 | 16 | 13 | 72 | 0 | |||
| 7 / M | 57 | 5,0 | 29.0 | 30 | 22 | 71 | 1780,0 | Каберголин 5 мг, энтакапон 600 мг | ||||||||
| 8 / F | 54 | 5,0 | 15,0 | 917 917 12 917 | ||||||||||||
| Среднее значение | 56,5 | 3,1 | 24,3 | 19,1 | 18,8 | 50,3 | 526,3 | |||||||||
| (SD)0) | (1,8) | (11,2) | (7,0) | (7,3) | (16,6) | (573,4) | ||||||||||
| 9 / M | 67 | 65 3,0 | 7 | 10 | 37 | 400,0 | ||||||||||
| 10 / M | 64 | 8,0 | 28,0 | 4 | 5 | 917 917 933 | 917 917 933 | 917 610 Entap11 / Факс | 61 | 6.0 | 14,0 | 3 | 8 | 32 | 300,0 | |
| 12 / M | 57 | 4,0 | 15,0 | 6 | 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 | |||||||||||
| 13 / M | 68 | 2,0 | 22,0 | 3 | 9 | 30 | 350,0 | Каберголин 3 мг | ||||||||
| 14 / F | 417.0 | 21,0 | 10 | 9 | 30 | 240,0 | ||||||||||
| 15 / M | 52 | 7,0 | 36,0 | 4 | 81765 0 | |||||||||||
| 16 / M | 58 | 2,5 | 24,0 | 3 | 6 | 34 | 700,0 | Каберголин 1 мг | ||||||||
| 17 / M | 917.0 | 26,5 | 9 | 10 | 27 | 350,0 | ||||||||||
| 18 / M | 70 | 8,0 | 26,0 | Ent1765 3 | 917 917 917 917 917 917 917 917 917 мг | |||||||||||
| 19 / F | 45 | 3,0 | 15,0 | 6 | 22 | 25 | 400,0 | |||||||||
| 20 / M | 639 2170 | 22,0 | 8 | 5 | 46 | 400,0 | ||||||||||
| Среднее значение | 59,8 | 4, | 23,3 | 5,5 | 7 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 (SD) | (7,2) | (2,6) | (6,7) | (2,5) | (2,7) | (8,7) | (257,8) |
| 917 Пациент секс . | Возраст . | Длительность заболевания . | УПДРС-3 . | BDI . | Апатия . | Беспокойство . | л-допа экв. (мг) . | Прочие лекарства . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 / М | 54 | 5,0 | 15.0 | 12 | 19 | 28 | 400,0 | |||||||||
| 2 / F | 65 | 2,0 | 48,0 | 29 | 46 | 917 917 917 917 930,0 / M | 70 | 2,0 | 30,0 | 20 | 29 | 60 | 300,0 | |||
| 4 / F | 50 | 3,5 | 20.0 | 19 | 44 | 46 | 500,0 | |||||||||
| 5 / M | 41 | 0,5 | 18,0 | 15 | 21 | 917 917 917 917 917 917 917 917 / M | 61 | 1,5 | 19,0 | 16 | 13 | 72 | 0 | |||
| 7 / M | 57 | 5,0 | 29.0 | 30 | 22 | 71 | 1780,0 | Каберголин 5 мг, энтакапон 600 мг | ||||||||
| 8 / F | 54 | 5,0 | 15,0 | 917 917 12 917 | ||||||||||||
| Среднее значение | 56,5 | 3,1 | 24,3 | 19,1 | 18,8 | 50,3 | 526,3 | |||||||||
| (SD)0) | (1,8) | (11,2) | (7,0) | (7,3) | (16,6) | (573,4) | ||||||||||
| 9 / M | 67 | 65 3,0 | 7 | 10 | 37 | 400,0 | ||||||||||
| 10 / M | 64 | 8,0 | 28,0 | 4 | 5 | 917 917 933 | 917 917 933 | 917 610 Entap11 / Факс | 61 | 6.0 | 14,0 | 3 | 8 | 32 | 300,0 | |
| 12 / M | 57 | 4,0 | 15,0 | 6 | 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 | |||||||||||
| 13 / M | 68 | 2,0 | 22,0 | 3 | 9 | 30 | 350,0 | Каберголин 3 мг | ||||||||
| 14 / F | 417.0 | 21,0 | 10 | 9 | 30 | 240,0 | ||||||||||
| 15 / M | 52 | 7,0 | 36,0 | 4 | 81765 0 | |||||||||||
| 16 / M | 58 | 2,5 | 24,0 | 3 | 6 | 34 | 700,0 | Каберголин 1 мг | ||||||||
| 17 / M | 917.0 | 26,5 | 9 | 10 | 27 | 350,0 | ||||||||||
| 18 / M | 70 | 8,0 | 26,0 | Ent1765 3 | 917 917 917 917 917 917 917 917 917 мг | |||||||||||
| 19 / F | 45 | 3,0 | 15,0 | 6 | 22 | 25 | 400,0 | |||||||||
| 20 / M | 639 2170 | 22,0 | 8 | 5 | 46 | 400,0 | ||||||||||
| Среднее | 59,8 | 4, | 23,3 | 5,5 | 7 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 917 (SD) | (7,2) | (2,6) | (6,7) | (2,5) | (2,7) | (8,7) | (257,8) |
Все обследования прошли пока пациенты с депрессией не принимали антидепрессанты в течение как минимум 3 месяцев.В день исследования ПЭТ всем пациентам проводилось психоневрологическое обследование. Опросник депрессии Бека (BDI) использовался для количественной оценки тяжести депрессии (Beck et al ., 1961). Показатели апатии и тревожности измерялись с помощью Шкалы оценки апатии (Marin et al ., 1991) и Государственной оценки тревожности (Spielberger et al ., 1970) соответственно.
Депрессивные и недепрессивные группы пациентов с болезнью Паркинсона были сопоставлены по возрасту и тяжести заболевания, измеренным с использованием Унифицированной шкалы оценки болезни Паркинсона (UPDRS) -3 балла «без» лечения (таблица 1).Мы также обследовали семь здоровых людей, сопоставимых по возрасту с пациентами (55,8 ± 13,6 года). Ни у одного из этих контролей не было никаких признаков или истории неврологического расстройства или депрессии.
Получение изображения
ПЭТвыполняли на томографе ECAT966 HR ++ (CTI-Siemens, Knoxville) с измеренной коррекцией затухания и рассеяния [разрешение: 4 мм FWHM (полная ширина на полувысоте)]. Пациенты отменили все дофаминергические препараты за день до исследования ПЭТ, чтобы ограничить взаимодействие между дофаминергическими препаратами и поглощением индикаторов.Субъектам внутривенно вводили в среднем 222,7 ± 20,6 МБк [ 11 C] RTI-32 с удельной радиоактивностью 24 419,2 ± 6806,2 МБк / ммоль, и было выполнено 90-минутное получение данных в 3D-режиме. Каждому субъекту была сделана МРТ с использованием системы Picker 1 T, включая трехмерную объемную съемку, взвешенную по T1, чтобы обеспечить совместную регистрацию.
Анализ изображений
Кинетику кривых временной активности мозга [ 11 C] RTI-32 моделировали с использованием упрощенного подхода к компартментам эталонной ткани для получения параметрического изображения потенциала связывания (BP) (Gunn et al ., 1997). Радиоактивность мозжечка использовалась в качестве неспецифического тканевого эталона (Guttman et al ., 1997; Meyer et al ., 2001). Кроме того, было создано интегрированное (ADD) изображение путем суммирования временных рядов сканирований поглощения [ 11 C] RTI-32, собранных через 0–90 минут после введения индикатора.
Мы провели два анализа изображений, один с использованием априори размещенных областей интереса (ROI), а другой с использованием статистического параметрического картирования на основе вокселей (SPM99, Wellcome Department of Cognitive Neurology, Лондон).
ROI
МРТ каждого субъекта регистрировали совместно с соответствующим изображением ADD (Woods et al ., 1993). Области интереса отслеживались на каждом МРТ и переносились на изображение [ 11 C] RTI-32 BP. Это были следующие области: хвостовая часть, скорлупа, черная субстанция, таламус, миндалина, передняя поясная кора (CingA, области Бродмана 24–32), орбитофронтальная кора (OF, области 11/47) и дорсолатеральная префронтальная кора (DLPF, области 10/45 /). 46). Эти регионы были выбраны потому, что они получают многочисленные моноаминергические проекции или из-за их причастности к депрессии (Drevets, 1998; Mayberg et al ., 1990; Ring и др. ., 1994).
Анализ SPM99
Изображение ADD каждого объекта было преобразовано в стандартное стереотаксическое пространство с использованием специального шаблона. Изображения BP были преобразованы с применением параметров преобразования, используемых для соответствующих изображений ADD. Эти нормализованные изображения АД использовались для сравнений по вокселям.
Статистический анализ
Мы сравнили клинические показатели депрессивной и недепрессивной болезни Паркинсона, используя непарный тест Стьюдента t .Значения АД, полученные из различных областей интереса у контрольных, депрессивных и недепрессивных пациентов с болезнью Паркинсона, были усреднены по обоим полушариям и сравнивались с использованием двухфакторного дисперсионного анализа (ANOVA; апостериорный тест Fisher’s PLSD ). Кроме того, мы выполнили воксельное сравнение SPM99 между контрольной группой и всеми пациентами с болезнью Паркинсона, а также между депрессивными и недепрессивными пациентами с болезнью Паркинсона. Эти сравнения были основаны на двустороннем непарном тесте t и a priori , ограниченном интересующим объемом, который включал полосатое тело, таламус и миндалевидное тело в обоих полушариях и среднем мозге.Это маскирование (коррекция небольшого объема; Worsley et al ., 1996) резко снижает количество статистических сравнений по вокселям, и порог P <0,01 (с кластерной коррекцией при P <0,05) был выбран с учетом статистической значимости. Наконец, мы использовали SPM99 для изучения взаимосвязи между клиническими показателями депрессии, апатии и тревоги и значениями АД у пациентов с болезнью Паркинсона ( n = 20). Был проведен анализ корреляции вокселей за вокселями между отдельными оценками и изображениями АД, причем этот анализ был ограничен объемом, указанным выше.Эти корреляции были исследовательскими, со статистическим порогом значимости, установленным на уровне P <0,05.
Результаты
Клинические данные
Не было статистической разницы между депрессивными и недепрессивными группами болезни Паркинсона в отношении возраста, продолжительности заболевания, доз противопаркинсонических препаратов (эквиваленты l-допа) и показателей «выкл» по шкале UPDRS-3. Когорта пациентов с депрессией имела более высокие баллы, чем пациенты без депрессии, по BDI [ t (18) = 6.21, P <0,0001], апатия [ t (18) = 4,37, P = 0,0004] и тревога [ t (18) = 3,17, P = 0,005].
ПЭТ: анализ рентабельности инвестиций
ANOVA, проведенный на значениях АД, выявил значительный эффект как группы [контроль, депрессивная болезнь Паркинсона и недепрессивная болезнь Паркинсона, F (2,26) = 18,6, P <0,0001] и ROI [ F (9,26) = 409,1, P <0.0001] и взаимодействие между группой и ROI ( F = 15,7, P <0,0001) (Таблица 2). Post hoc анализ показал, что контрольная группа имела более высокие значения АД, чем обе группы пациентов с болезнью Паркинсона в хвостатом теле, скорлупе, брюшном полосатом теле и черной субстанции (таблица 2). Кроме того, контрольная группа имела более высокие значения, чем депрессивная болезнь Паркинсона в CingA и таламусе, а недепрессивная болезнь Паркинсона имела более высокие значения АД, чем депрессивная болезнь Паркинсона в таламусе, CingA, миндалевидном теле и голубом пятне (таблица 2).
Таблица 2Результаты, полученные с анализом исследуемых регионов
| Регион . | Объем (мм 3 ) . | Органы управления . | Болезнь Паркинсона в депрессии . | Болезнь Паркинсона без депрессии . | Post hoc Fisher’s PLSD . | . | . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
. | . | . | . | . | Контроль / депрессия . | Контроль / без депрессии . | Депрессия / не депрессия . | ||||||||||
| Хвостатый | 3468 | 2.42 (0,47) | 1,65 (0,37) | 1,66 (0,39) | 0,001 | <0,001 | — | ||||||||||
| Путамен | 5744 | 2,79 (0,49) | 179171,3173 0,37)<0,001 | <0,001 | — | ||||||||||||
| Вентральное полосатое тело | 2040 | 2,05 (0,38) | 1,12 (0,37) | 1,37 (0,37) | <0,001 | 001 | — | ||||||||||
| SN | 1476 | 0,56 (0,11) | 0,29 (0,18) | 0,35 (0,21) | 0,006 | 0,02 | — | 0,09 (0,14) | 0,20 (0,12) | ||||||||
| Coeruleus | 512 | 0,22 (0,09) | 0,11 (0,1176) (0,11) | 0,04 | |||||||||||||
| Таламус | 4492 | 0,46 (0,07) | 0,25 (0,17) | 0,37 (0,09) | 0,002 — 9174 9174 | Миндалевидное тело | 1696 | 0,26 (0,07) | 0,15 (0,18) | 0,28 (0,10) | 0,03 | ||||||
| CingA | 1217292, (0,07) | 0,01 (0,12) | 0,15 (0,10) | 0,002 | — | 0,005 | |||||||||||
| OF | 6596 | 0,02 (0,03) | ) -01766 (017,03) 0,10) | ||||||||||||||
| DLPF | 5876 | 0,05 (0,07) | 0,09 (0,16) | 0,06 (0,11) | 0,06 (0,11) | 9174 9174 9174 9174 9174 9174 9174 9173 9174 9174 9173 9174 9174 9173 9174 9174 . | Объем (мм 3 ) . | Органы управления . | Болезнь Паркинсона в депрессии . | Болезнь Паркинсона без депрессии . | Post hoc Fisher’s PLSD . | . | . | ||||
. | . | . | . | . | Контроль / депрессия . | Контроль / без депрессии . | Депрессия / не депрессия . | ||||||||||
| Хвостатый | 3468 | 2,42 (0,47) | 1,65 (0,37) | 1,66 (0,39) | 0,001 | <0,001 | — | 9179 (0,49) | 1,33 (0,22) | 1,49 (0,37) | <0,001 | <0,001 | — | ||||
| Вентральное полосатое тело | 2040 | 2,05 (0,38) | 917 917 (0,38) 917 1,37 (0,37)<0,001 | <0,001 | — | ||||||||||||
| SN | 1476 | 0,56 (0,11) | 0,29 (0,18) | 0,35 (0,21) | —0,05 | ||||||||||||
| Средний мозг | 1440 | 0.12 (0,07) | 0,09 (0,14) | 0,20 (0,12) | |||||||||||||
| Coeruleus | 512 | 0,22 (0,09) | 0,11 (0,1174) 9176 | 0,04 | |||||||||||||
| Таламус | 4492 | 0,46 (0,07) | 0,25 (0,17) | 0,37 (0,09) | 0,002 | — | 17917 917 917 917 917 917 965 9176 917 917 917 965 9176 917 917 917 917 917 917 965a 0.26 (0,07)0,15 (0,18) | 0,28 (0,10) | 0,03 | ||||||||
| CingA | 12 292 | 0,18 (0,07) | 0,01 (017) 017 (017) 017 (017) | 0,002 | — | 0,005 | |||||||||||
| OF | 6596 | 0,02 (0,03) | –0,03 (0,12) | 0,07 (0,10) | P | 917 917 917 917 917 917 9170.05 (0,07) | 0,09 (0,16) | 0,06 (0,11) | |||||||||
Результаты, полученные с анализом областей интереса
| Регион . | Объем (мм 3 ) . | Органы управления . | Болезнь Паркинсона в депрессии . | Болезнь Паркинсона без депрессии . | Post hoc Fisher’s PLSD . | . | . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
. | . | . | . | . | Контроль / депрессия . | Контроль / без депрессии . | Депрессия / не депрессия . | ||||||||||
| Хвостатый | 3468 | 2,42 (0,47) | 1,65 (0,37) | 1,66 (0,39) | 0,001 | <0,001 | — | 76 | 9176 | 7 0,49) | 1,33 (0,22) | 1,49 (0,37) | <0,001 | <0,001 | — | ||
| Вентральное полосатое тело | 2040 | 2,05 (0,38) | 12 (0,37) | 1,37 (0,37) | <0,001 | <0,001 | — | ||||||||||
| SN | 1476 | 0,56 (0,11) | 0,29 (0,18) | 9176 0,31760,02 | — | ||||||||||||
| Средний мозг | 1440 | 0,12 (0,07) | 0,09 (0,14) | 0,20 (0,12) | 22 (0,09) | 0,11 (0,16) | 0,24 (0,11) | 0,04 | |||||||||
| Таламус | 4492 | 0,46 (0,07) | 0,25 (0,19) | 0,25 (0,19) 9177) | 0,002 | — | 0,04 | ||||||||||
| Миндалевидное тело | 1696 | 0,26 (0,07) | 0,15 (0,18) | 0,28 (0,10) | 965 9172 917 917 966 9176 917 917 966 9176 9176 917 917 917 917 91790.18 (0,07) | 0,01 (0,12) | 0,15 (0,10) | 0,002 | — | 0,005 | |||||||
| OF | 6596 | 0,02 (0,03) | ) -01766 (017,03) 0,10) | ||||||||||||||
| DLPF | 5876 | 0,05 (0,07) | 0,09 (0,16) | 0,06 (0,11) | 0,06 (0,11) | 9174 9174 9174 9174 9174 9174 9174 9173 9174 9174 9173 9174 9174 9173 9174 9174 . | Объем (мм 3 ) . | Органы управления . | Болезнь Паркинсона в депрессии . | Болезнь Паркинсона без депрессии . | Post hoc Fisher’s PLSD . | . | . | ||||
. | . | . | . | . | Контроль / депрессия . | Контроль / без депрессии . | Депрессия / не депрессия . | ||||||||||
| Хвостатый | 3468 | 2,42 (0,47) | 1,65 (0,37) | 1,66 (0,39) | 0,001 | <0,001 | — | 9179 (0,49) | 1,33 (0,22) | 1,49 (0,37) | <0,001 | <0,001 | — | ||||
| Вентральное полосатое тело | 2040 | 2,05 (0,38) | 917 917 (0,38) 917 1,37 (0,37)<0,001 | <0,001 | — | ||||||||||||
| SN | 1476 | 0,56 (0,11) | 0,29 (0,18) | 0,35 (0,21) | —0,05 | ||||||||||||
| Средний мозг | 1440 | 0.12 (0,07) | 0,09 (0,14) | 0,20 (0,12) | |||||||||||||
| Coeruleus | 512 | 0,22 (0,09) | 0,11 (0,1174) 9176 | 0,04 | |||||||||||||
| Таламус | 4492 | 0,46 (0,07) | 0,25 (0,17) | 0,37 (0,09) | 0,002 | — | 17917 917 917 917 917 917 965 9176 917 917 917 965 9176 917 917 917 917 917 917 965a 0.26 (0,07)0,15 (0,18) | 0,28 (0,10) | 0,03 | ||||||||
| CingA | 12 292 | 0,18 (0,07) | 0,01 (017) 017 (017) 017 (017) | 0,002 | — | 0,005 | |||||||||||
| OF | 6596 | 0,02 (0,03) | –0,03 (0,12) | 0,07 (0,10) | P | 917 917 917 917 917 917 9170.05 (0,07) | 0,09 (0,16) | 0,06 (0,11) | |||||||||
ПЭТ: анализ SPM99
Контроль против болезни Паркинсона
Контрольная группа имела более высокие значения АД, чем вся группа с болезнью Паркинсона, в скорлупе, хвостатом, брюшном полосатом теле и черной субстанции с обеих сторон (рис. 1, таблица 3).
Рис. 1
Области со сниженным связыванием [ 11 C] RTI-32 во всей группе пациентов с БП по сравнению с контролем ( P <0.001, исправлено на ( P <0,05). Вверху: вид из стекла, полученный с помощью SPM99. Внизу: наложение на МРТ, показывающее потерю двустороннего связывания в полосатом теле и susbtantia nigra пациентов.
Рис. 1
Области со сниженным связыванием [ 11 C] RTI-32 во всей группе пациентов с БП по сравнению с контролем ( P <0,001, скорректировано на ( P <0,05). : изображение в стекле, полученное с помощью SPM 99. Вниз: наложение на МРТ, показывающее потерю двустороннего связывания в полосатом теле и Susbtantia nigra пациентов.
Таблица 3SPM99: контрольная группа по сравнению с пациентами с болезнью Паркинсона
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | ||
|---|---|---|---|---|---|
| Путамен R | 28, −6, 12 | 7.08 | 1104 | ||
| Путамен L | −26, −8, 10 | 6,56 | 1135 | ||
| Хвостатый R | 14, 12, 20 | 4,126 | 917 917 917 65 80−10, 20, 4 | 4.71 | 953 |
| Вентральное полосатое тело R | 20, 14, 0 | 4.37 | 100 | ||
| Вентральное полосатое тело L − 917, | 94.40 | 181 | |||
| Черная субстанция R | 8, −16, 0 | 6,30 | 107 | ||
| Черная субстанция L | −6, −16, 0 | 173 | 173 |
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | |||
|---|---|---|---|---|---|---|
| Путамен R | 28, −6, 12 | 7,08 | 1104 | |||
| Путамен L | −26, −8, 10 | 33 6.56 | 14, 12, 20 | 4,12 | 803 | |
| Хвостатое L | −10, 20, 4 | 4,71 | 953 | |||
| Вентральное полосатое тело R | 917 916 917 917 917100 | |||||
| Вентральное полосатое тело L | −20, 12, 0 | 4,40 | 181 | |||
| Черная субстанция R | 8, −16, 065 | 61733 | Черная субстанция L | −6, −16, 0 | 4.83 | 100 |
SPM99: контроль по сравнению с пациентами с болезнью Паркинсона
| Область . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | |||
|---|---|---|---|---|---|---|
| Путамен R | 28, −6, 12 | 7,08 | 1104 | |||
| Путамен L | −26, −8, 10 | 33 6.56 | 14, 12, 20 | 4.12 | 803 | |
| Хвостатое L | −10, 20, 4 | 4,71 | 953 | |||
| Вентральное полосатое тело R | 20, 14, 0 | 4,37 | Центральное полосатое тело L | −20, 12, 0 | 4,40 | 181 |
| Черная субстанция R | 8, −16, 0 | 6,30 | 107 | |||
| Черное вещество1665 L − | 917 , 04.83 | 100 |
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | ||
|---|---|---|---|---|---|
| Путамен R | 28, −6, 12 | 7,08 | 1104 | ||
| Путамен L | −26, −8, 10 | 6.56 | 1135 | ||
| Хвостатый R | 14, 12, 20 | 4,12 | 803 | ||
| Хвостатый L | −10, 20, 4 | 4,71 | 9176 917 917 917 917 917 917 917 6 917 917 917 620, 14, 0 | 4,37 | 100 |
| Вентральное полосатое тело L | −20, 12, 0 | 4,40 | 181 | ||
| Черная субстанция R 917 966, | 9176.30 | 107 | |||
| Черная субстанция L | −6, −16, 0 | 4,83 | 100 |
Сравнение недепрессивной и депрессивной болезни Паркинсона
У пациентов с недепрессивной болезнью Паркинсона ( P, <0,01, кластерная коррекция на P <0,05) значения АД были значительно выше, чем у пациентов с депрессивной болезнью Паркинсона в следующих регионах: голубое пятно с обеих сторон, срединный таламус с двух сторон, нижний таламус с двух сторон, левое брюшное полосатое тело и правая миндалина (рис.2, таблица 4).
Рис. 2
Области, где наблюдается значительное снижение ( P <0,01) связывания [ 11 C] RTI-32 у пациентов с депрессией по сравнению с пациентами с БП без депрессии. Области, видимые в стекле, показаны на МРТ наложенными: ( A ) locus ceruleus; ( B ) медиальный таламус; ( C ) левое вентральное полосатое тело; ( D ) правая миндалина.
Рис.2
Регионы, где наблюдается значительное сокращение ( P <0.01) связывания [ 11 C] RTI-32 у пациентов с депрессией по сравнению с пациентами с PD без депрессии. Области, видимые в стекле, показаны на МРТ наложенными: ( A ) locus ceruleus; ( B ) медиальный таламус; ( C ) левое вентральное полосатое тело; ( D ) правая миндалина.
Таблица 4SPM99: недепрессивная и депрессивная болезнь Паркинсона
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | ||
|---|---|---|---|---|---|
| Locus coeruleus L | −6, −32, −28 | 3.50 | 267 | ||
| Locus coeruleus R | 6, −34, −30 | 3Thalamus R | 16, −12, 16 | 3.10 | 532 |
| Таламус L | −16, −22, 14 | 2,68 | 454 | ||
| Вентральное полосатое тело L | −16, 10, 2 | 171 | |||
| 30, −6, −24 | 2,60 | 229 |
| Область . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Locus coeruleus L | −6, −32, −28 | 3.50 | 267 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Locus coeruleus R | 6, −34, −30 | 3Таламус R | 16, −12, 16 | 3,10 | 532 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таламус L | −16, −22, 14 | 2.68 | 454 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вентральное полосатое тело L | −16, 10, 2 | 2,68 | 480 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Миндалевидное тело R | 30, −6, −24 | 9176 9176 9176 9249 2,60 917 2,60 917 Таблица 4
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Locus coeruleus L | −6, −32, −28 | 3.50 | 267 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Locus coeruleus R | 6, −34, −30 | 3Таламус R | 16, −12, 16 | 3,10 | 532 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таламус L | −16, −22, 14 | 2.68 | 454 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вентральное полосатое тело L | −16, 10, 2 | 2,68 | 480 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Миндалевидное тело R | 30, −6, −24 | 9176 9176 9176 9249 245 9169 2,60 917 224 9172
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | Вокселы ( n ) . | ||
|---|---|---|---|---|---|
| Locus coeruleus L | −6, −32, −28 | 3.50 | 267 | ||
| Locus coeruleus R | 6, −34, −30 | 3Таламус R | 16, −12, 16 | 3,10 | 532 |
| Таламус L | −16, −22, 14 | 2,68 | 454 | ||
| Lentral, полосатая 10, 2 | 2.68 | 480 | |||
| Миндалевидное тело R | 30, −6, −24 | 2,60 | 229 |
Взаимосвязь между оценками депрессии и значениями АД у пациентов с болезнью Паркинсона
Мы обнаружили отрицательную корреляцию между оценкой BDI и АД в левом вентральном полосатом теле ( Z = 3,12, P = 0,001, нескорректированное, x = –18, y = 10, z = 4).Оценка апатии отрицательно коррелировала со значениями АД в вентральном полосатом теле с обеих сторон (таблица 5, рис. 3). Оценка тревожности отрицательно коррелировала со значениями АД в левом вентральном полосатом теле, левом хвостатом теле, левом голубом пятне, левой нижней таламической области и с обеих сторон в миндалине и медиальном таламусе (таблица 6, рис. 4).
Рис. 3
Связывание [ 11 C] RTI-32 в вентральном полосатом теле имеет обратную корреляцию ( P <0.05) с апатией у всей группы пациентов.
Рис. 3
Связывание [ 11 C] RTI-32 в вентральном полосатом теле обратно коррелирует ( P <0,05) с апатией во всей группе пациентов.
Рис. 4
Области, в которых тревожность обратно коррелирована ( P <0,05) со связыванием [ 11 C] RTI-32. Слева: стекло SPM99. Справа: наложение на МРТ, показывающее голубое пятно (сагиттальный вид), левое вентральное полосатое тело и левую и правую миндалины (коронарное изображение), а также медиальный таламус с двух сторон и левое вентральное полосатое тело (осевое изображение).
Рис. 4
Области, в которых тревожность обратно коррелирована ( P <0,05) со связыванием [ 11 C] RTI-32. Слева: стекло SPM99. Справа: наложение на МРТ, показывающее голубое пятно (сагиттальный вид), левое вентральное полосатое тело и левую и правую миндалины (коронарное изображение), а также медиальный таламус с двух сторон и левое вентральное полосатое тело (осевое изображение).
Таблица 5Регионы, в которых АД отрицательно коррелирует с апатией
| Регион . | Координаты ( x , y, z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −20, 6, 4 | 2,37 | 0,009 | 96 |
| Вентральное полосатое тело R | 16, 14, 0 | 2.02 | 0,022 | 50 |
| Регион . | Координаты ( x , y, z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −20, 6, 4 | 2.37 | 0,009 | 96 |
| Вентральное полосатое тело R | 16, 14, 0 | 2,02 | 0,022 | 50 |
, в которых наблюдается отрицательная связь между BP
| Регион . | Координаты ( x , y, z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −20, 6, 4 | 2,37 | 0,009 | 96 |
| Вентральное полосатое тело R | 16, 14, 0 | 0 | |
| Регион . | Координаты ( x , y, z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −20, 6, 4 | 2,37 | 0,009 | 96 |
| Вентральное полосатое тело R | 16, 14, 0 | 16, 14, 0 |
Регионы, в которых АД отрицательно коррелирует с тревогой
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −18, 10, 8 | 2,72 | 0,003 | 292 |
| Хвостатое L | −12, 14, 14 | 2.34 | 0,010 | 55 |
| Locus coeruleus L | −6, −30, −18 | 2,70 | 0,003 | 131 |
| Таламус R 917 −10, 161765 | 16 | 0,005 | 365 | |
| Таламус L | −6, −8, 12 | 2.38 | 0,009 | 292 |
| Миндалевидное тело R | −10 922 −10 922 917 922 0.01834 | |||
| Миндалевидное тело L | −24, 4, −14 | 2,06 | 0,020 | 47 |
| Область . | Координаты ( x , y , z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −18, 10, 8 | 2,72 | 0,003 | 292 |
| Хвостатое L | −12, 14, 14 | 2,3 | ||
| Locus coeruleus L | −6, −30, −18 | 2,70 | 0,003 | 131 |
| Таламус R | 16, −10, 16 | 2,55 | ||
| Таламус L | −6, −8, 12 | 2.38 | 0,009 | 292 |
| Миндалевидное тело | −22, 0, −10 | 2,10 | 0,018 | 34 |
| Миндалевидное тело L | −24 −24−242,0 | 0,020 | 47 |
Регионы, в которых АД отрицательно коррелирует с тревогой
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −18, 10, 8 | 2,72 | 0,003 | 292 |
| Хвостатое L | −12, 14, 14 | 2,3 | ||
| Locus coeruleus L | −6, −30, −18 | 2.70 | 0,003 | 131 |
| Таламус R | 16, −10, 16 | 2,55 | 0,005 | 365 |
| Таламус L | −6 9178 2,3 0,009 | 292 | ||
| Миндалевидное тело R | −22, 0, −10 | 2,10 | 0,018 | 34 |
| Миндалевидное тело L | −24, 417696 914,9140 | 47 |
| Регион . | Координаты ( x , y , z ) . | Z — оценка . | P -значение . | Вокселы ( n ) . |
|---|---|---|---|---|
| Вентральное полосатое тело L | −18, 10, 8 | 2.72 | 0,003 | 292 |
| Хвостатое L | −12, 14, 14 | 2.34 | 0,010 | 55 |
| Голубой локус L | −301770 −60,003 | 131 | ||
| Таламус R | 16, −10, 16 | 2,55 | 0,005 | 365 |
| Таламус L | −666 966 917 917 9179 2.3 .009 | 292 | ||
| Миндалевидное тело R | −22, 0, −10 | 2,10 | 0,018 | 34 |
| Миндалевидное тело L | −24, 420 9176 9176 916 | −24, 420 9176 91447 |
Обсуждение
Депрессия у пациентов с болезнью Паркинсона связана со снижением связывания [ 11 C] RTI-32 в нескольких лимбических областях. Кроме того, существует обратная зависимость между связыванием [ 11 C] RTI-32 в этих областях и тяжестью тревожных расстройств и расстройств настроения у этих пациентов.
Эти аномалии кажутся специфичными для депрессии при болезни Паркинсона, поскольку мы сравнивали пациентов с депрессией и недепрессивной болезнью Паркинсона по демографии и опорно-двигательной недостаточности, включая возраст, продолжительность заболевания, оценку «выключения» моторики UPDRS и дозы противопаркинсонических препаратов. Соответственно, мы не обнаружили различий между двумя группами пациентов по поглощению [ 11 C] RTI-32 в полосатом теле или черной субстанции.
Различия между депрессивной и недепрессивной болезнью Паркинсона наблюдались с использованием как анализа ROI, так и SPM на основе вокселей.Небольшие различия в результатах, полученных с использованием этих подходов, объясняются методическими соображениями. Например, CingA не был включен в сравнение замаскированных SPM, чтобы ограничить анализ подкорковыми областями и областями ствола мозга и получить статистическую мощность.
Снижение АД [ 11 C] RTI-32 отражает потерю катехоламинергической иннервации в соответствующих областях мозга. [ 11 C] RTI-32 связывается в основном с DAT в полосатом теле (Carroll et al ., 1995; Wilson et al. ., 1996), и связывание этого индикатора заметно снижается в скорлупе пациентов с болезнью Паркинсона (Guttman et al ., 1997). Мы также обнаружили снижение связывания [ 11 C] RTI-32 в черной субстанции пациентов с болезнью Паркинсона. Таким образом, можно продемонстрировать потерю функции дофаминергических клеток непосредственно в черной субстанции (Rakshi et al ., 1999), поскольку DAT присутствует на дендритах дофаминергических нейронов (Nirenberg et al ., 1996).
[ 11 C] RTI-32 обладает наномолярным сродством к NAT, тогда как он имеет низкое сродство к переносчику серотонина (Carroll et al ., 1995). Следовательно, часть снижения связывания [ 11 C] RTI-32, наблюдаемая у пациентов с депрессией Паркинсона, может быть связана с потерей норадренергических окончаний. Это подтверждается открытием, что связывание [ 11 C] RTI-32 было снижено в голубом локусе и в таламусе. Кроме того, голубое пятно посылает норадренергические проекции в лобную кору, миндалину и вентральное полосатое тело (Ressler and Nemeroff, 1999).В целом это предполагает, что уменьшение связывания [ 11 C] RTI-32, наблюдаемое у пациентов с депрессивной болезнью Паркинсона, соответствует потере проекций как дофамина, так и норадреналина. Альтернативно, подавление связывания DAT и NAT может быть вторичным по отношению к снижению высвобождения эндогенного лиганда в этих синапсах (Metzger et al ., 2002). Тем не менее, у пациентов с болезнью Паркинсона мы подозреваем, что потеря катехоламинергических окончаний (Paulus and Jellinger, 1991) играет гораздо более доминирующую роль в снижении связывания [ 11 C] RTI-32, наблюдаемом в этом исследовании, чем любая фармакодинамическая регуляция плотность транспортера на остальных мембранах.
Взаимодействия дофамина с лимбической системой, вероятно, вызывают стресс и депрессию (Cabib and Puglisi-Allegra, 1996). Сообщалось, что при болезни Паркинсона пессимизм, измеренный с использованием шкалы избегания вреда, коррелировал с [ 18 F] поглощением допа в правом хвостатом ядре (Kaasinen et al ., 2001). Колебания настроения могут происходить независимо от двигательных колебаний (Maricle et al ., 1995), подразумевая вовлечение вентральных, а не дорсальных контуров головного мозга, и часто улучшаются противопаркинсоническими препаратами (Czernecki et al ., 2002). Пациенты с паркинсонизмом и большой депрессией не чувствуют эйфории после приема метилфенидата, высвобождающего дофамин. Это приписывают дегенерации дофаминергической иннервации лимбической системы (Cantello et al ., 1989).
Роль норадреналина при аффективных расстройствах широко задокументирована (Ressler and Nemeroff, 1999; Sullivan et al ., 1999). Утрата пигментированных нейронов была обнаружена в голубом пятне жертв самоубийства (Arango et al ., 1996), а уровень NAT снижается посмертно в голубом пятне у пациентов с большой депрессией (Klimek et al ., 1997). Дегенерация голубого пятна, происходящая при болезни Паркинсона (Paulus and Jellinger, 1991), может играть роль в изменениях настроения у этих пациентов (Zweig et al ., 1993). Это подтверждается здесь более низким связыванием [ 11 C] RTI-32, обнаруженным в голубом пятне депрессии по сравнению с пациентами без депрессии. Кроме того, отрицательная корреляция, обнаруженная между связыванием locus coeruleus [ 11 C] RTI-32 и тяжестью тревоги при болезни Паркинсона, подтверждает прямую роль норадреналина в патофизиологии тревоги при болезни Паркинсона.
Поразительно, что снижение катехоламинергической иннервации у пациентов с депрессивной болезнью Паркинсона происходит в областях, которые, как считается, составляют эмоциональные контуры мозга. В самом деле, миндалевидное тело, медиодорсальный таламус, вентральное полосатое тело и CingA принадлежат лимбической системе и участвуют в качестве дисфункциональных областей в расстройствах настроения (Drevets, 1998).
Миндалевидное тело — ключевая структура эмоциональной обработки человека (LeDoux, 2000). Функциональные нарушения миндалевидного тела коррелируют с тяжестью эндогенной депрессии (Drevets, 1998), а миндалевидное тело опосредует обработку страха и тревогу (LeDoux, 2000).Миндалевидное тело соединяется с голубым пятном и получает норадренергическую и дофаминергическую иннервацию (Fallon et al ., 1978; Fudge and Emiliano, 2003), которая уменьшается при болезни Паркинсона (Moore, 2003). Кроме того, в посмертном исследовании сообщалось, что у пациентов с болезнью Паркинсона наблюдается уменьшение объема миндалины до 20% и что эта структура содержит тельца Леви (Harding et al ., 2002). В нашем исследовании связывание [ 11 C] RTI-32 было значительно снижено в правой миндалине пациентов с депрессивной болезнью Паркинсона, а оценка тревожности отрицательно коррелировала с двусторонним связыванием миндалины [ 11 C] RTI-32.Потеря норадреналина и дофамина в миндалине, вероятно, играет роль в возникновении аффективных симптомов при болезни Паркинсона.
Миндалевидное тело имеет связи с CingA (LeDoux, 2000), где с помощью анализа ROI мы обнаружили уменьшение связывания [ 11 C] RTI-32 у пациентов с депрессией по сравнению с пациентами с болезнью Паркинсона без депрессии. CingA является частью лимбической системы и участвует во многих когнитивных и эмоциональных процессах (Paus et al ., 1993; Drevets, 1998).Кроме того, CingA получает сильную дофаминергическую и норадренергическую иннервацию (Williams и Goldman-Rakic, 1993). Два исследования ПЭТ выявили гипометаболизм CingA, связанный с депрессией при болезни Паркинсона (Ring et al ., 1994; Mentis et al ., 2002). Наши результаты предполагают, что такая дисфункция CingA при депрессивной болезни Паркинсона может быть связана со специфической потерей катехоламинергических проекций.
Норадренергические проекции таламуса нацелены на медиальное и интраламинарное субъядра (Oke et al ., 1997), где мы обнаружили значительную потерю связывания [ 11 C] RTI-32 у пациентов с депрессией по сравнению с пациентами с болезнью Паркинсона без депрессии. Роль таламуса при депрессии неясна. Однако недавнее исследование показало, что депрессия и тревога, вызванные α-метилпаратирозином, ингибитором тирозингидроксилазы, были связаны с заметным снижением метаболизма глюкозы в таламусе (Bremner et al ., 2003). Роль таламуса в аффективных расстройствах может быть связана с его участием в возбуждении.Действительно, тревога связана с изменениями бдительности, которые связаны с теми же таламо-корковыми взаимодействиями, которые находятся под контролем норадренергической иннервации, происходящей из голубого пятна (Ressler and Nemeroff, 1999; David Johnson, 2003). Соответственно, корреляция между тревогой и связыванием [ 11 C] RTI-32 в таламусе у этих пациентов предполагает, что нарушение норадренергической модуляции таламической активности играет роль в возникновении тревоги при болезни Паркинсона.
Наконец, пациенты с депрессивной болезнью Паркинсона показали относительное снижение связывания [ 11 C] RTI-32 в вентральном полосатом теле, которое участвует в эмоциональной обработке через свои связи с лобными лимбическими областями (Nakano, 2000). Дофаминергическая система в вентральном полосатом теле меньше поражена, чем дорсальные области при болезни Паркинсона (Kish et al ., 1988), но получает большую часть норадренергических афферентов полосатого тела (Nicola and Malenka, 1998). У пациентов с депрессией, не страдающей паркинсонизмом, исследование однофотонной эмиссионной компьютерной томографии (ОФЭКТ) с использованием [ 123 I] β-CIT показало увеличение поглощения индикатора в полосатом теле по сравнению с контролем (Laasonen-Balk et al ., 1999). Однако [ 123 I] β-CIT также связывается с переносчиком серотонина (Carroll et al ., 1995), и повышенное поглощение может отражать активацию переносчика серотонина при депрессии. Напротив, недавнее исследование сообщило об уменьшении связывания [ 11 C] RTI-32 в вентральном полосатом теле у пациентов с депрессией (Meyer et al ., 2001). В соответствии с этим результатом мы обнаружили снижение связывания [ 11 C] RTI-32 в левом вентральном полосатом теле у пациентов с депрессивной болезнью Паркинсона.Интересно, что мы обнаружили, что связывание [ 11 C] RTI-32 в вентральном полосатом теле обратно коррелировало со степенью апатии и выраженностью депрессии у пациентов. Похоже, что дофаминергическая и норадренергическая иннервация вентрального полосатого тела участвует как в эндогенной депрессии, так и в депрессии, вызванной болезнью Паркинсона, и может, в частности, играть роль в апатии, которая является основным признаком депрессии. Интересно, что лечение l-допа может улучшить мотивацию у некоторых пациентов с болезнью Паркинсона (Czernecki et al ., 2002).
В заключение, наши результаты предполагают, что депрессия при болезни Паркинсона связана со специфической потерей дофамина и норадреналина иннервацией корковых и подкорковых компонентов лимбической системы. Эти результаты могут помочь в понимании функциональной анатомии депрессии при болезни Паркинсона и иметь терапевтическое значение.
Эти результаты можно заменить в более общем контексте взаимосвязи между старением, депрессией и катехоламинами.Вкратце, снижение катехоламинергической иннервации, которое происходит в корковых лимбических структурах, может участвовать в потере когнитивных способностей, таких как гибкость, внимание или управляющие функции, что, как известно, происходит с возрастом (Nieoullon, 2002). Точно так же считается, что повышенная тревожность, обнаруживаемая у пожилых людей, может быть связана с потерей дофаминергической и норадренергической иннервации, особенно в миндалевидном теле (Gareri et al ., 2002). Поэтому некоторые авторы предположили, что преддепрессивные и преддементные состояния, которые иногда наблюдаются при старении, имеют общую патофизиологию с болезнью Паркинсона (Gareri et al ., 2002).
P.R. было поддержано грантами Fondation pour la Recherche Médicale и Association France-Parkinson. Доктор медицины был поддержан Обществом болезни Паркинсона, Великобритания.
Список литературы
Аранго В., Андервуд, доктор медицины, Манн Дж. Дж. Меньшее количество пигментированных нейронов голубого пятна у жертв суицида: предварительные результаты.
Biol Psychiatry
1996
;39
:112
–20.Beck AT, Ward CH, Mendelson M, Mock J, Erbaugh J.Инвентарь для измерения депрессии.
Arch Gen Psychiatry
1961
;4
:561
–71.Bremner JD, Vythilingam M, Ng CK, Vermetten E, Nazeer A, Oren DA, et al. Региональные метаболические корреляты в мозге депрессивных симптомов, вызванных альфа-метилпаратирозином: последствия для нервной системы депрессии.
J Am Med Assoc
2003
;289
:3125
–34.Браун Р., Джаханшахи М. Депрессия при болезни Паркинсона: психосоциальная точка зрения.В: Weiner WJ, Lang AE, редакторы. Поведенческая неврология двигательных нарушений. Vol. 65. Нью-Йорк: Raven Press;
1995
. п. 61–84.Cabib S, Puglisi-Allegra S. Стресс, депрессия и мезолимбическая дофаминовая система.
Psychopharmacology (Berl)
1996
;128
:331
–42.Cantello R, Aguggia M, Gilli M, Delsedime M, Chiardo Cutin I, Riccio A и др. Большая депрессия при болезни Паркинсона и реакция настроения на внутривенное введение метилфенидата: возможная роль «гедонического» дофаминового синапса.
J Neurol Neurosurg Psychiatry
1989
;52
:724
–31.Carroll FI, Scheffel U, Dannals RF, Boja JW, Kuhar MJ. Разработка агентов визуализации для переносчика дофамина.
Med Res Rev.
1995
;15
:419
–44.Каммингс Дж. Л., Мастерман ДЛ. Депрессия у пациентов с болезнью Паркинсона.
Int J Geriatr Psychiatry
1999
;14
.Czernecki V, Pillon B, Houeto JL, Pochon JB, Леви Р., Дюбуа Б.Мотивация, вознаграждение и болезнь Паркинсона: влияние допатерапии.
Neuropsychologia
2002
;40
:2257
–67.Дэвид Джонсон Дж. Норадренергический контроль познания: глобальное затухание и функция прерывания.
Med Hypotheses
2003
;60
:689
–92.Древец WC. Функциональные нейровизуализационные исследования депрессии: анатомия меланхолии.
Annu Rev Med
1998
;49
:341
–61.Fallon JH, Koziell DA, Moore RY. Катехоламиновая иннервация базального отдела переднего мозга. II. Миндалевидное тело, надрагинальная кора и энторинальная кора.
J Comp Neurol
1978
;180
:509
–32.Fudge JL, Эмилиано AB. Расширенная миндалина и дофаминовая система: еще один фрагмент дофаминовой головоломки.
J Neuropsychiatry Clin Neurosci
2003
;15
:306
–16.Gareri P, De Fazio P, De Sarro G.Нейрофармакология депрессии при старении и возрастных изменений.
Aging Res. Ред.
2002
;1
:113
–134.Ганн Р.Н., Ламмерстма А.А., Хьюм С.П., Каннингем В.Дж. Параметрическая визуализация связывания лиганд-рецептор в ПЭТ с использованием упрощенной модели референсной области.
Neuroimage
1997
;6
:279
–287.Guttman M, Burkholder J, Kish SJ, Hussey D, Wilson A, DaSilva J, et al. [ 11 C] Исследования с использованием ПЭТ RTI-32 переносчика дофамина при ранней дофа-наивной болезни Паркинсона: значение для симптоматического порога.
Неврология
1997
;48
:1578
–83.Халлидей Г.М., Ли Ю.В., Блумбергс П.С., Джон Т.Х., Коттон Р.Г., Хоу П.Р. Невропатология иммуногистохимически идентифицированных нейронов ствола мозга при болезни Паркинсона.
Ann Neurol
1990
;27
:373
–85.Хардинг AJ, Стимсон E, Хендерсон JM, Холлидей GM. Клинические корреляты избирательной патологии миндалины больных болезнью Паркинсона.
Мозг
2002
;125
:2431
–45.Хьюз А.Дж., Дэниел С.Е., Килфорд Л., Лис А.Дж. Точность клинического диагноза идиопатической болезни Паркинсона: клинико-патологическое исследование 100 случаев.
J Neurol Neurosurg Psychiatry
1992
;55
:181
–4.Kaasinen V, Nurmi E, Bergman J, Eskola O, Solin O, Sonninen P, et al. Особенности личности и дофаминергическая функция мозга при болезни Паркинсона.
Proc Natl Acad Sci USA
2001
;98
:13272
–7.Киш SJ, Shannak K, Hornykiewicz O. Неравномерный характер потери дофамина в полосатом теле у пациентов с идиопатической болезнью Паркинсона.
N Engl J Med
1988
;318
:876
–80.Klimek V, Stockmeier C, Overholser J, Meltzer HY, Kalka S, Dilley G, et al. Снижение уровней переносчиков норадреналина в голубом пятне при большой депрессии.
J Neurosci
1997
;17
:8451
–8.Лаасонен-Балк Т., Куикка Дж., Виинамаки Х., Хуссо-Саастамойнен М., Лехтонен Дж., Тиихонен Дж. Плотность переносчиков дофамина в полосатом теле при большой депрессии.
Psychopharmacology (Berl)
1999
;144
:282
–5.LeDoux JE. Эмоциональные контуры мозга.
Annu Rev Neurosci
2000
;23
:155
–84.Mahieux F, Michelet D, Manifacier MJ, Boller F, Fermarian J, Guillard A.Мини-психическое исследование Паркинсона — первое валидационное исследование нового прикроватного теста, разработанного для болезни Паркинсона.
Behav Neurol
1995
;8
:15
–22.Марикл Р.А., Натт Дж. Г., Валентайн Р. Дж., Картер Дж. Х. Взаимосвязь «доза-реакция» леводопы с настроением и тревожностью при флуктуирующей болезни Паркинсона: двойное слепое плацебо-контролируемое исследование.
Неврология
1995
;45
:1757
–60.Марин RS, Беджицкий ЖК, Фиринджогуллари С.Надежность и валидность шкалы оценки апатии.
Psychiatry Res
1991
;38
:143
–62.Mayberg HS, Starkstein SE, Sadzot B, Preziosi T, Andrezejewski PL, Dannals RF, et al. Селективный гипометаболизм в нижней лобной доле у пациентов с депрессией и болезнью Паркинсона.
Ann Neurol
1990
;28
:57
–64.Mentis MJ, McIntosh AR, Perrine K, Dhawan V, Berlin B, Feigin A, et al.Взаимосвязь между метаболическими паттернами, которые коррелируют с мнемоническими, зрительно-пространственными и эмоциональными симптомами при болезни Паркинсона.
Am J Psychiatry
2002
;159
:746
–54.Мецгер Р.Р., Браун Дж.М., Сандовал В., Рау К.С., Элван М.А., Миллер Г.В. и др. Ингибирующее действие резерпина на функцию переносчика дофамина.
евро J Pharmacol
2002
;456
:39
–43.Мейер Дж. Х., Крюгер С., Уилсон А. А., Кристенсен Б. К., Гулдинг В. С., Шаффер А. и др.Снижение связывающего потенциала переносчика дофамина в полосатом теле во время депрессии.
Нейроотчет
2001
;12
:4121
–5.Мур Р.Я. Организация дофаминовых систем среднего мозга и патофизиология болезни Паркинсона.
Расстройство, связанное с паркинсонизмом
2003
;9
Дополнение 2:S65
–71.Накано К. Нервные цепи и топографическая организация базальных ганглиев и связанных с ними областей.
Brain Dev
2000
;22
Прил. 1:S5
–16.Никола С.М., ЖК Маленка. Модуляция синаптической передачи дофамином и норадреналином в вентральном, но не дорсальном полосатом теле.
J Neurophysiol
1998
;79
:1768
–76.Nieoullon A. Допамин и регуляция познания и внимания.
Прог Нейробиол
2002
;67
:53
–83.Ниренберг М.Дж., Воан Р.А., Уль Г.Р., Кухар М.Дж., Пикель В.М. Переносчик дофамина локализован на дендритных и аксональных плазматических мембранах нигростриатных дофаминергических нейронов.
J Neurosci
1996
;16
:436
–47.Оке А.Ф., Карвер Л.А., Гувион С.М., Адамс Р.Н. Трехмерное картирование норадреналина и серотонина в таламусе человека.
Brain Res
1997
;763
:69
–78.Paulus W, Jellinger K. Невропатологические основы различных клинических подгрупп болезни Паркинсона.
J Neuropathol Exp Neurol
1991
;50
:743
–55.Паус Т., Петридес М., Эванс А.С., Мейер Э. Роль передней поясной коры человека в контроле глазодвигательных, мануальных и речевых реакций: исследование позитронно-эмиссионной томографии.
J Neurophysiol
1993
;70
:453
–469.Ракши Дж. С., Уэма Т., Ито К., Бейли Д. Л., Морриш П. К., Эшбернер Дж. И др. Дофаминергическая функция лобной части, среднего мозга и полосатого тела на ранних и поздних стадиях болезни Паркинсона: исследование 3D [ 18 F] Dopa-PET.
Мозг
1999
;122
:1637
–50.Ressler KJ, Nemeroff CB. Роль норадреналина в патофизиологии и лечении расстройств настроения.
Biol Psychiatry
1999
;46
:1219
–33.Ring HA, Bench CJ, Trimble MR, Brooks DJ, Frackowiak RS, Dolan RJ. Депрессия при болезни Паркинсона. Исследование эмиссии позитронов.
Br J Psychiatry
1994
;165
:333
–9.Родин Г., Вошарт К. Депрессия у больных соматическими заболеваниями: обзор.
Am J Psychiatry
1986
;143
:696
–705.Spielberger C, Gorsuch RL, Lushene RE. Пособие по инвентаризации государственных черт. Пало-Альто (Калифорния): Пресса психологов-консультантов;
1970
.Салливан Дж. М., Коплан Дж. Д., Кент Дж. М., Горман Дж. М.. Норадренергическая система при патологической тревоге: фокус на панике, имеющий отношение к генерализованной тревоге и фобиям.
Biol Psychiatry
1999
;46
:1205
–18.Talairach J, Tournoux P. Копланарный стереотаксический атлас человеческого мозга. Штутгарт: Тиме;
1988
.Том Т, Каммингс Дж. Депрессия при болезни Паркинсона. Фармакологическая характеристика и лечение.
Лекарства старения
1998
;12
:55
–74.Уильямс С.М., Гольдман-Ракич П.С. Характеристика дофаминергической иннервации лобной коры приматов с использованием допамин-специфических антител.
Cereb Cortex
1993
;3
:199
–222.Wilson AA, DaSilva JN, Houle S. Оценка in vivo меченных [ 11 C] — и [ 18 F] аналогов кокаина в качестве потенциальных лигандов переносчиков дофамина для позитронно-эмиссионной томографии.
Nucl Med Biol
1996
;23
:141
–6.Woods RP, Mazziotta JC, Cherry SR. Регистрация МРТ – ПЭТ с автоматическим алгоритмом.
J Comput Assist Tomogr
1993
;17
:536
–46.Уорсли К.Дж., Марретт С., Нилин П., Вандал А.С., Фристон К.Дж., Эванс А.С. Единый статистический подход для определения значимых сигналов в изображениях активации мозга.
Hum Brain Mapp
1996
;4
:58
–73.Цвейг Р.М., Кардилло Дж. Э., Коэн М., Гиере С., Хедрин Дж. Голубое пятно и деменция при болезни Паркинсона.
Неврология
1993
;43
:986
–91.Заметки автора
1CNRS-CEA URA2210, Госпитальер Фредерик Жолио, CHU Henri Mondor et Faculté de Médecine Paris 12, Франция 2 Медицинский факультет, Больница Хаммерсмит, Центр клинических наук Имперского колледжа и Отделение неврологии и 3 Институт неврологии, Куин-сквер, Лондон, UK
© Автор (2005).Опубликовано Oxford University Press от имени Гарантов Мозга. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
. .