Отрыв тромба: Кардиолог назвал три простых способа предотвратить отрыв тромба
Причины возникновения тромбоза и воспаление тромба
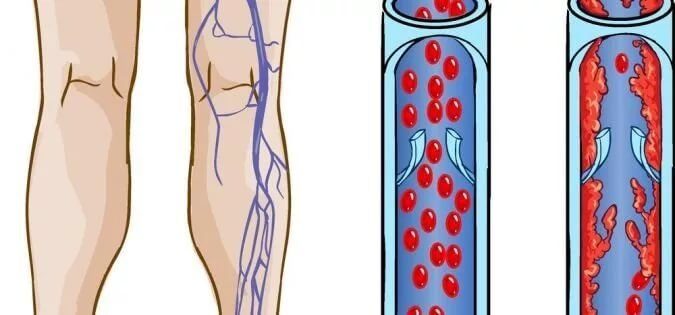
Тромбофлебитом называется воспаление тромба, находящегося в просвете венозного сосуда. Болезнь представляет собой порочный круг: воспаление вены способствует увеличению тромба, а процессы, происходящие внутри тромба, усиливают воспаление.
Основная причина возникновения тромбоза вен – это варикозная венозная болезнь. Существуют и другие факторы, способные вызвать полную или частичную закупорку венозного сосуда. Все они могут вызвать опасные для жизни осложнения, которые сложно лечить. Лучше всего, зная возможные причины заболевания, их предупредить.
Если страдает вена из числа поверхностных, тромбофлебит называется поверхностным. При закупорке глубокой вены, тромбофлебит будет иметь название глубокого. Зачастую процесс начинается с поверхностных сосудов, а потом переходит в систему глубоких вен.
Оба вида заболевания, независимо от причины тромбофлебита нижних конечностей, осложняются хронической венозной недостаточностью. Она, прогрессируя, проявляется потемнением кожи, отеками, плохо заживающими трофическими язвами. Самое опасное осложнение – отрыв тромба с последующим попаданием его в систему легочной артерии или в мозговые сосуды. Но если лечение тромбоза и тромбофлебита было начато вовремя и с учетом причины заболевания, таких последствий можно избежать.
Она, прогрессируя, проявляется потемнением кожи, отеками, плохо заживающими трофическими язвами. Самое опасное осложнение – отрыв тромба с последующим попаданием его в систему легочной артерии или в мозговые сосуды. Но если лечение тромбоза и тромбофлебита было начато вовремя и с учетом причины заболевания, таких последствий можно избежать.
Причины патологии
Врачи называют следующие причины возникновения тромбофлебита. Это:
- Варикозная болезнь вен нижних конечностей, при которой в расширенных участках настолько замедлен кровоток, что возникают все условия для тромбообразования. На эту причину приходится 70% всех поверхностных тромбофлебитов.
- Травма венозной стенки. Поверхностно расположенные вены могут быть травмированы при ударе, трении осколками костей, падении. Также травмой считается их пункция и катетеризация, что проводится также и на ногах. В ответ на травму стенки активируются ее компоненты, которые вызывают образование тромба в поврежденном участке.

- Длительная иммобилизация, особенно вызванная необходимостью консолидации перелома. В то время, как глубокие вены продолжают обеспечивать отток от конечностей, поверхностные частично сдавливаются гипсом, в них замедляется кровоток, и в результате образуется тромб.
- Состояние после лечения варикозной болезни склеротерапией.
- Хроническое бессимптомное носительство бактерий, когда они находятся в кровотоке и могут воспалять имеющиеся тромбы.
- Болезни свертывания.
- Повышение концентрации эстрогена в крови.
- Васкулиты, в том числе волчаночный.
- Рак поджелудочной железы, легких, желудка, вызывающий мигрирующий тромбофлебит.
- Повышение уровня гомоцистеина в крови.
- Болезни печени, при которых в крови снижается уровень гепарина.
- Гомоцистинурия.
- Антифосфолипидный синдром.
В качестве основной причины тромбоза глубоких вен нижних конечностей называют варикозную болезнь. Это состояние развивается как осложнение поверхностного тромбофлебита, когда тромб растет в направлении коммуникантных вен (соединяющих поверхностную систему с глубокой), и, разрушая их клапаны, пробивается внутрь глубоких вен.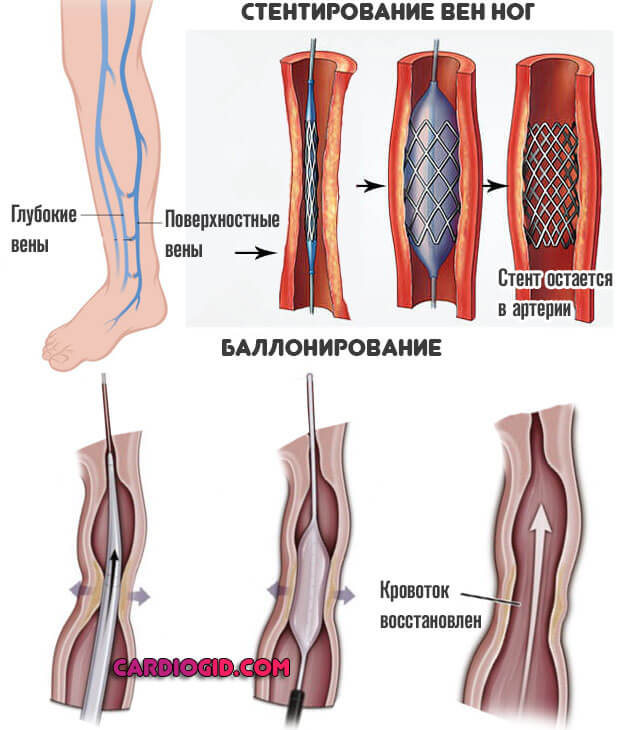
При курении, приеме противозачаточных средств, ожирении, а также аномалиях сосудистой стенки риск тромбофлебита повышается в несколько раз.
Видеоэндоскопические методы коррекции хронической венозной недостаточности в Новосибирске – цены в клинике ДКБ
Размер:
A
A
A
Цвет: CCC
Изображения Вкл.Выкл.
Обычная версия сайта
AA
Юридическим лицамЗаписаться на приемВопрос доктору
ЧУЗ «Клиническая больница«РЖД-Медицина» г. Новосибирск»
многопрофильное медицинское учреждение
RUS | EN
- org/Breadcrumb» itemref=»bx_breadcrumb_1″>
Главная страница
- Список заболеваний
- Видеоэндоскопические методы коррекции хронической венозной недостаточности
В отделении проводится обследование и лечение у больных с острыми тромбозами вен нижних и верхних конечностей. При этом выявляется причина возникновения данного осложнения. Важной задачей обследования является выяснение потенциальной возможности осложнения данного тромбоза развитием тромбоэмболии легочной артерии – крайне опасного осложнения, часто являющего причиной смерти пациента. Для этого используется высокоинформативные методы ультразвуковых исследований, компьютерная томография с контрастированием сосудистой системы легочной артерии. При угрозе тромбоэмболического осложнения применяются хирургические методы удаления опасных на эмболию тромбов, блокирования венозного сегмента, содержащего тромботические массы, а также малотравматичный и надежный метод профилактики тромбоэмболии легочной артерии – имплантация кава-фильтра.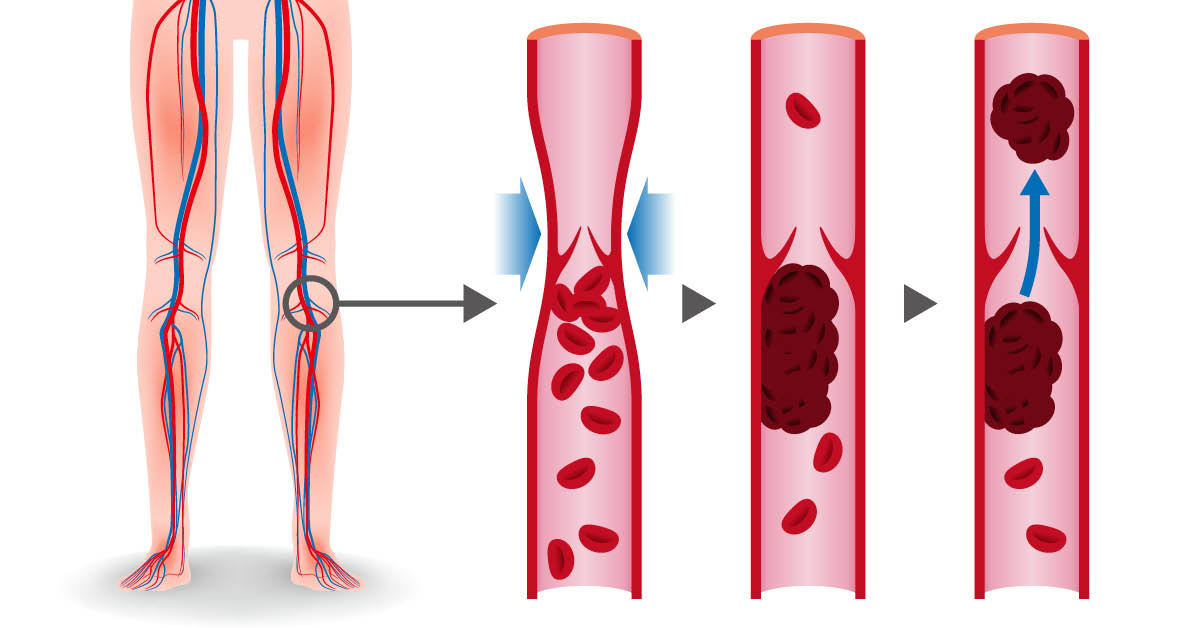
Момент выполнения видеоэндоскопической операции – диссекции коммуникантных вен голени у больного с тяжелой хронической венозной недостаточностью нижней конечности.
ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ (ТЭЛА)
Тромбоэмболия – отрыв и перемещение током крови фрагментов тромба, образовавшегося на стенке сосуда или в полости сердца. При тромбоэмболии из полости левого предсердия или желудочка сердца, а также со стенки аорты фрагменты тромба могут попасть в жизненноважные сосуды – артерии головного мозга, артерии почек, кишечника, конечностей, что может привести к тяжелому нарушению кровообращения в пораженном органе с развитием инсульта, инфаркта почки, кишечника, гангрене конечности.
Тромбоэмболия легочной артерии (ТЭЛА) – осложнение венозного тромбоза. При этом тромботические массы, оторвавшиеся от стенки вены (например, бедренной или подвздошной вены) попадают в легочную артерию, вызывая при массивной закупорке последней острое нарушение кровообращения в легких с развитием шока, инфаркта легкого, а нередко приводя и к смертельному исходу.
|
Рентгенконтрастная ангиограмма. В просвете нижней полой вены виден слабо фиксированный к стенкам вены тромб (указан стрелкой). Больному угрожает отрыв тромба и миграция его в легочную артерию (тромбоэмболия легочной артерии) | |
|
Комньютерная томография органов грудной клетки с контрастированием у больного тромбэмболией легочной артерии. Стрелкой указан тромб в просвете основного ствола легочной артерии. |
Наиболее частая сосудистая патология среди пациентов отделения сердечно-сосудистой хирургии – варикозная болезнь нижних конечностей. Для хирургического лечения этого заболевания с успехом применяются методы микрофлебэктомии. При этом подкожные варикозно измененные вены удаляются из микроразрезов или проколов кожи, вследствие чего после операции не остается грубых рубцов.
|
Типичный вид у больного при варикозной болезни нижних конечностей. |
|
Вид ноги у больной варикозной болезнью сразу после операции методом микрофлебэктомии (нет разрезов кожи и швов). |
У больных с тяжелыми формами хронической венозной недостаточности на почве варикозной болезни или посттромбофлебитического синдрома применяются щадящие хирургические методики операций на венозной системе в виде видеоэндоскопической диссекции коммуникантных вен голени. Использование специального инструментария и видеоконтроля за ходом операции посредством волоконной оптики позволяют избегать обширных разрезов тканей голени, характерных для этих операций.
Все отделения
- Нейрохирургический центр
- Диагностическое неврологическое подразделение
- Нейрореанимационное отделение
- Нейрохирургическое отделение
- Отделение реабилитации
- Центр хирургической гастроэнтерологии
- Гастроэнтерологическое отделение
- Хирургическое отделение №1
- Хирургическое отделение №2
- Центр общей врачебной практики Медклуб
- Выездная помощь
- Женское здоровье
- Педиатрическое отделение
- Пластическая хирургия
- Терапевтическое отделение
- Лабораторная служба
- Бактериологическая лаборатория
- Клинико-диагностическая лаборатория
- Цитологическая лаборатория
- Центр восстановительного лечения
- Отделение реабилитации
- Физиотерапевтическое отделение
- Кардиоцентр
- Кабинет рентгенхирургических методов лечения
- Кардиологическое отделение
- Отделение реанимации и интенсивной терапии
- Отделение сложных нарушений ритма (Сосудистая хирургия)
- Сомнологический кабинет
- Урологический центр
- Андрология
- Психотерапевтическое отделение.
 Консультативная амбулаторная психотерапевтическая помощь» (в составе лечебно-оздоровительного центра «Гармония»)
Консультативная амбулаторная психотерапевтическая помощь» (в составе лечебно-оздоровительного центра «Гармония») - Консультативная амбулаторная психотерапевтическая помощь
- Лечебно-оздоровительный центр «Гармония» (Психотерапевтическое отделение)
- Стоматологическая поликлиника
- Терапевтическая стоматология
- Хирургическая стоматология
- Эстетическая стоматология
- Имплантология
- Ортопедия
- Пародонтология
- Центр микрохирургии глаза
- Кабинет лазерного лечения
- Офтальмологическое отделение
- Центр диагностики зрения
- Диагностический центр
- Консультативное отделение
- Отделение ультразвуковой диагностики
- Отделение функциональной диагностики
- Рентгеновское отделение (Томографический центр)
- Телемедицина
- Рентгенологическое отделение
- Поликлиника №2
- Диагностика
- Комиссии
- Поликлиника №1
- Диагностика
- Комиссии
- 1-е и 2-е неврологические отделения
- Гинекологическое отделение
- Кабинет врача — клинического фармаколога
- Линейные амбулатории
- Онкология
- Отделение анестезиологии и реанимации
- Ксенонотерапия
- Отоларингологическое отделение
- Приемное отделение
- Пункты предрейсового медицинского осмотра
- Терапевтическое отделение
- Пульмонология
- Травматологическое отделение
- Эндокринологическое отделение
- Эндоскопическое отделение
Для заказа звонка введите свой номер телефона и удобное для Вас время.
Ваш телефон:
Дата звонка:
Время звонка:
Ближайшее время
Новый взгляд на механизмы образования тромбоза: фокус на воспаление
Венозная тромбоэмболия (ВТЭ) представляет собой ведущую причину глобальной смертности. Самые последние клинические исследования были сосредоточены на снижении смертности пациентов с использованием расширенных гемодинамических параметров в качестве инструментов стратификации риска, а затем расширенных вмешательств, выходящих за рамки использования системной антикоагулянтной терапии, со смешанными результатами. 1,2 В настоящее время ясно, что следует оценивать долгосрочные последствия остаточного легочного тромбоза и тромбозов у пациентов с острой легочной эмболией (ТЭЛА). Детерминанты развития тромба и рассасывания тромба до конца не изучены. Предполагается, что в сосудистых руслах, таких как инфраренальная аорта, образование тромбов стабилизирует ослабленную стенку аневризмы, которая могла пережить расслоение.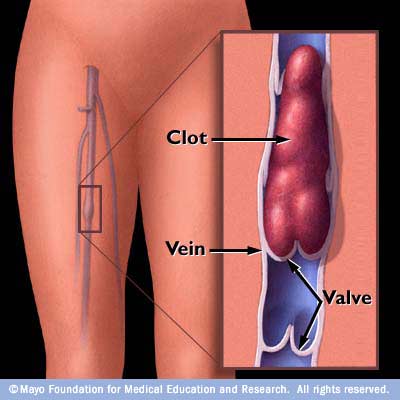 3,4 Однако ложе легочных сосудов, по-видимому, плохо реагирует на наличие остаточного тромбоза. 5,6 Чрезмерный гемостатический ответ приводит к образованию венозных тромбов, препятствующих кровотоку и потенциально вызывающих острые и хронические симптомы, а также острую ТЭЛА, которая может быть фатальной.
3,4 Однако ложе легочных сосудов, по-видимому, плохо реагирует на наличие остаточного тромбоза. 5,6 Чрезмерный гемостатический ответ приводит к образованию венозных тромбов, препятствующих кровотоку и потенциально вызывающих острые и хронические симптомы, а также острую ТЭЛА, которая может быть фатальной.
С тех пор, как Рудольф Вирхов опубликовал свой проницательный трактат в 1856 году, о ВТЭ стало известно огромное количество информации.0013 эмболия и тромбоз , Вирхов признал, что тромбоз легочной артерии возникает в основном из-за венозных тромботических событий в нижних конечностях, заявив в 1859 году, что «отслоение больших или меньших фрагментов от конца размягчающегося тромба, которые переносятся током крови и загоняемой в отдаленные сосуды, вызывает очень частый процесс, которому я дал название «эмболия». флебит вызывает образование тромба, так что коагуляция является основным последствием венозного воспаления». 8 Его теория не объясняла болезнь полностью, но время и исследования показали, что профессор Крювелье был более прав, чем предполагалось.
Ни René Laennec, ни Cruveilhier не считали, что ТЭЛА возникает в венах нижних конечностей или таза, поскольку оба полагали, что тромбы возникают в первую очередь в легочных артериях, и многие придерживались этой точки зрения еще до работы Вирхова. В связи с этим исследованием Вирхов описал факторы, способствующие венозному тромбозу. Впоследствии появилось больше теорий и открытий.
Что мы знаем о механизмах образования тромбов в 2020 году и их значении для клинического ведения? Клинические факторы риска, такие как хирургическое вмешательство, травма, острое заболевание, рак, возраст и ожирение, трансформируются в факторы риска ВТЭ на основе одной или нескольких триад Вирхова. Осведомленность об этих рисках позволяет принимать основанные на фактических данных решения о профилактике ВТЭ. Эта статья посвящена особенностям гиперкоагуляции и венозного повреждения/воспаления, которые делают эти клинические факторы риска важными. Был идентифицирован ряд генетических и приобретенных факторов риска ВТЭ, которые изменяют кровоток, активируют эндотелий и изменяют активность факторов свертывания крови.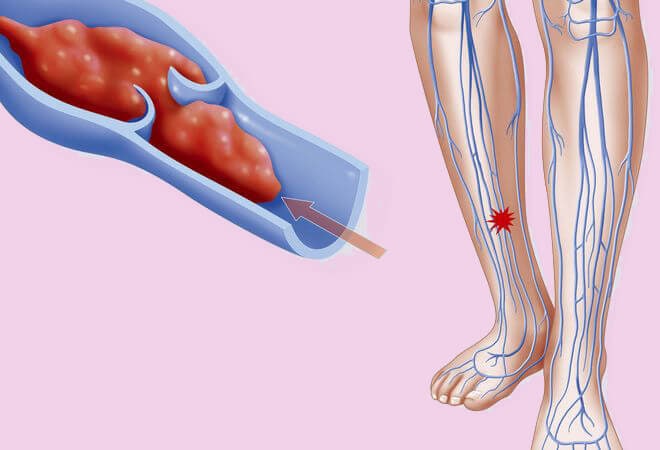 9
9
ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ
Наследственность играет очевидную роль в предрасположенности к острой ВТЭ. Наиболее важными генетическими факторами риска ВТЭ являются дефицит протеина С, протеина S и антитромбина. 10,11 Эти явления редки в общей популяции, но повышают риск ВТЭ у больных в 10 раз. Менее тромбогенная группа генетических аномалий, включающая группу крови, отличную от O (повышенный уровень фактора VIII), лейденскую мутацию фактора V, мутацию 20210A гена протромбина и гамма-вариант фибриногена 10034T, увеличивает риск ВТЭ в 2–5 раз. Эти генетические варианты присутствуют у небольшого процента населения в виде «мутаций с усилением функции», которые увеличивают риск венозного тромбоза. 11 Однонуклеотидные полиморфизмы (SNP), которые обычно представляют собой варианты с одним основанием в кодирующих и некодирующих последовательностях ДНК, в конечном итоге вызывают функциональные различия в белках, которые регулируют гемостаз и тромбоз. 12 Примеры включают SNP в генах, кодирующих тромбоцитарный гликопротеин 6, антитромбин III ( SERPINC1 ) и фактор свертывания крови XI. 12 Клинические последствия определения наличия таких мутаций в общей популяции неясны и противоречивы. В определенных условиях, при наличии приобретенных и наследственных аберраций усиления функции при тромбозах, таких как наличие антифосфолипидных антител, тестирование является важным шагом в выборе адекватной антикоагулянтной терапии. 13,14
12 Примеры включают SNP в генах, кодирующих тромбоцитарный гликопротеин 6, антитромбин III ( SERPINC1 ) и фактор свертывания крови XI. 12 Клинические последствия определения наличия таких мутаций в общей популяции неясны и противоречивы. В определенных условиях, при наличии приобретенных и наследственных аберраций усиления функции при тромбозах, таких как наличие антифосфолипидных антител, тестирование является важным шагом в выборе адекватной антикоагулянтной терапии. 13,14
ПРОМЕЖУТОЧНЫЙ МЕТАБОЛИЗМ
Метаболический синдром (абдоминальное ожирение, нарушение метаболизма глюкозы, дислипидемия и гипертония) связан с прокоагулянтной и гипофибринолитической средой и, таким образом, повышенным риском сосудистых заболеваний и венозных тромботических явлений. 15 Адипоциты секретируют воспалительные цитокины (адипокины). Недавно Stewart и соавт. продемонстрировали связь между метаболическим синдромом и давлением в легочной артерии у пациентов с субмассивной ТЭЛА на момент постановки диагноза и после катетерной терапии.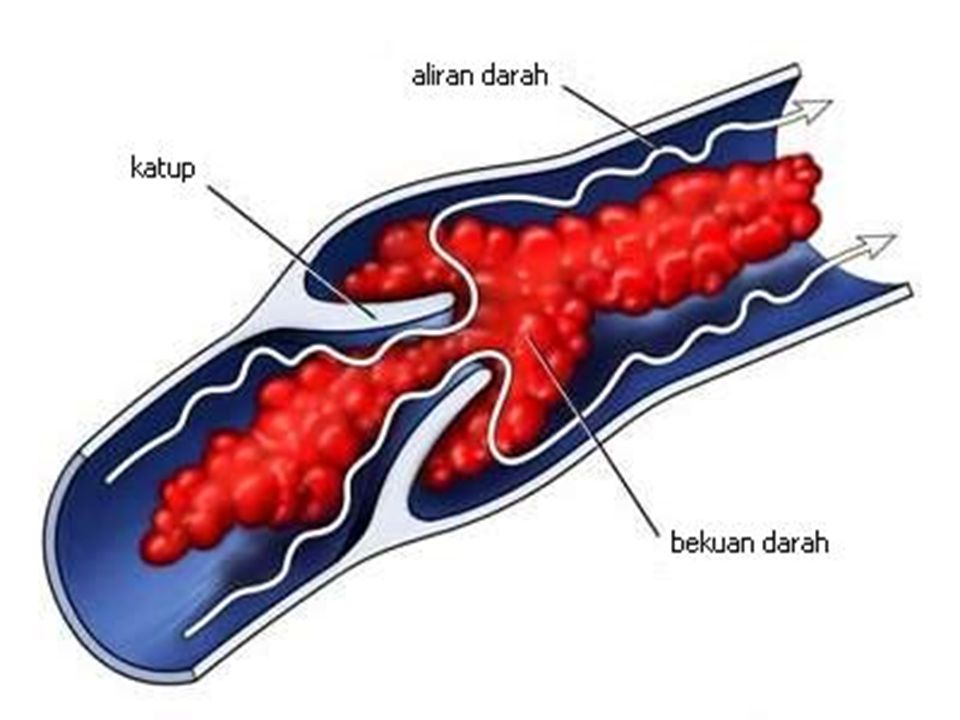 16 Это исследование является предупреждением о том, что работа врача во время лечения далека от завершения. Пристальное внимание к биохимическим и клиническим параметрам, участвующим в формировании и рассасывании тромбов, может повлиять на долгосрочные результаты лечения пациентов. Липопротеин(а) [Lp(a)] имеет домены Крингла, которые напоминают домены плазминогена, необходимые для связывания фибрина, хотя ясно, что мы знаем меньше о роли Lp(a) в ВТЭ. 17,18 Метаанализы предполагают, что Lp(a) связан с повышенным риском ВТЭ, 19 , но другие исследования были менее убедительными; возможно, риск ВТЭ увеличивается при наличии дополнительных факторов риска. 20 Для решения этого вопроса было бы полезно провести более крупные когортные исследования. Поскольку терапия антисмысловыми олигонуклеотидами продемонстрировала эффективность в снижении концентрации Lp(a) в крови, 21 большее внимание, вероятно, будет направлено на понимание молекулярных и биохимических явлений, вызываемых этим воспалительным, тромбогенным и вазоактивным липопротеином.
16 Это исследование является предупреждением о том, что работа врача во время лечения далека от завершения. Пристальное внимание к биохимическим и клиническим параметрам, участвующим в формировании и рассасывании тромбов, может повлиять на долгосрочные результаты лечения пациентов. Липопротеин(а) [Lp(a)] имеет домены Крингла, которые напоминают домены плазминогена, необходимые для связывания фибрина, хотя ясно, что мы знаем меньше о роли Lp(a) в ВТЭ. 17,18 Метаанализы предполагают, что Lp(a) связан с повышенным риском ВТЭ, 19 , но другие исследования были менее убедительными; возможно, риск ВТЭ увеличивается при наличии дополнительных факторов риска. 20 Для решения этого вопроса было бы полезно провести более крупные когортные исследования. Поскольку терапия антисмысловыми олигонуклеотидами продемонстрировала эффективность в снижении концентрации Lp(a) в крови, 21 большее внимание, вероятно, будет направлено на понимание молекулярных и биохимических явлений, вызываемых этим воспалительным, тромбогенным и вазоактивным липопротеином.
ВОСПАЛЕНИЕ И ТРОМБОЗ
Взаимодействие между врожденной иммунной системой и тромбозом важно для образования и рассасывания тромба (рис. 1). 22 Хотя исследование, основанное на гипотезах, с использованием рандомизированных контролируемых испытаний является эталоном для доказательства эффективности новых терапевтических средств, это последний шаг в исследовательском исследовании, который не может быть достигнут без усилий наших коллег, занимающихся фундаментальными научными исследованиями. Использование животных моделей тромботических заболеваний позволило перенести наблюдения в исследовательской лаборатории на людей. Врачам напоминают о динамической роли между воспалением и тромбозом при лечении состояний, включая диабет, сепсис, ожирение, заболевания кишечника, острый респираторный дистресс-синдром и рак, а также во время хирургических процедур. Тремя важными клетками, которые являются потенциальными мишенями для опосредования «иммунотромбоза», являются лейкоциты, тромбоциты и эндотелий сосудов. 23-28 Когда эндотелиальные клетки воспаляются и плотные соединения разъединяются в результате внутриклеточного фосфорилирования, субэндотелиальный тканевой фактор (TF) высвобождается, активируя внешний коагуляционный каскад (рис. 2). Активированные эндотелиальные клетки и тромбоциты также высвобождают тельца Вейбеля-Палада, содержащие фактор фон Виллебранда и CD62 (P-селектин), которые способствуют рекрутированию тромбоцитов и лейкоцитов соответственно. 29,30 Лейкоциты также высвобождают цитокины, в том числе интерлейкин-1В (ИЛ-1В) и ИЛ-6, механизмы действия которых были изучены на животных моделях. 31-33 Таким образом, существует четкая связь между ВТЭ и воспалением. 34-37
23-28 Когда эндотелиальные клетки воспаляются и плотные соединения разъединяются в результате внутриклеточного фосфорилирования, субэндотелиальный тканевой фактор (TF) высвобождается, активируя внешний коагуляционный каскад (рис. 2). Активированные эндотелиальные клетки и тромбоциты также высвобождают тельца Вейбеля-Палада, содержащие фактор фон Виллебранда и CD62 (P-селектин), которые способствуют рекрутированию тромбоцитов и лейкоцитов соответственно. 29,30 Лейкоциты также высвобождают цитокины, в том числе интерлейкин-1В (ИЛ-1В) и ИЛ-6, механизмы действия которых были изучены на животных моделях. 31-33 Таким образом, существует четкая связь между ВТЭ и воспалением. 34-37
Рисунок 1. Цитокиновая и хемокиновая регуляция ВТЭ. Панель A: образование тромбов является результатом взаимодействия между эндотелиальными клетками, лейкоцитами и тромбоцитами, регулируемого цитокинами и хемокинами. Во-первых, IL-6 и IL-17 индуцируют активацию эндотелиальных клеток за счет увеличения экспрессии молекул адгезии (VCAM-1, ICAM-1 и P-селектин). Кроме того, эндотелиальные клетки секретируют CXCL2 и CCL2, способствуя привлечению нейтрофилов и моноцитов. Было обнаружено, что IL-10 ингибирует рекрутирование нейтрофилов. Взаимодействие P-селектин/PSGL-1 и вовлечение CXCR2/CXCL1 взаимодействуют, вызывая интегрин-зависимую остановку β2 в нейтрофилах и НЕТоз. Затем интерферон (IFN)-γ, секретируемый естественными клетками-киллерами (NK), и IL-17 способствуют образованию NET и вызывают венозный тромбоз. Параллельно Ил-17 и Ил-9регулируют активацию и агрегацию тромбоцитов посредством экспрессии CD61 и P-селектина. CCL2-рекрутированные моноциты/макрофаги секретируют IL-1B, который также способствует агрегации тромбоцитов. Панель B: Разрешение тромбов, характеризующееся фибринолизом, коллагенолизом и неоваскуляризацией, регулируется фактором некроза опухоли (TNF)-α и IFN-γ. TNF-α увеличивает экспрессию MMP-2/MMP-9 и активатора урокиназы плазминогена (uPA), что приводит к коллагенолизу и фибринолизу соответственно. Напротив, IFN-γ, продуцируемый эффекторными Т-клетками памяти, играет пагубную роль в рассасывании тромбов, подавляя коллагенолиз и неоваскуляризацию.
Кроме того, эндотелиальные клетки секретируют CXCL2 и CCL2, способствуя привлечению нейтрофилов и моноцитов. Было обнаружено, что IL-10 ингибирует рекрутирование нейтрофилов. Взаимодействие P-селектин/PSGL-1 и вовлечение CXCR2/CXCL1 взаимодействуют, вызывая интегрин-зависимую остановку β2 в нейтрофилах и НЕТоз. Затем интерферон (IFN)-γ, секретируемый естественными клетками-киллерами (NK), и IL-17 способствуют образованию NET и вызывают венозный тромбоз. Параллельно Ил-17 и Ил-9регулируют активацию и агрегацию тромбоцитов посредством экспрессии CD61 и P-селектина. CCL2-рекрутированные моноциты/макрофаги секретируют IL-1B, который также способствует агрегации тромбоцитов. Панель B: Разрешение тромбов, характеризующееся фибринолизом, коллагенолизом и неоваскуляризацией, регулируется фактором некроза опухоли (TNF)-α и IFN-γ. TNF-α увеличивает экспрессию MMP-2/MMP-9 и активатора урокиназы плазминогена (uPA), что приводит к коллагенолизу и фибринолизу соответственно. Напротив, IFN-γ, продуцируемый эффекторными Т-клетками памяти, играет пагубную роль в рассасывании тромбов, подавляя коллагенолиз и неоваскуляризацию. В конечном счете, неконтролируемое воспаление приводит к хронизации ВТЭ частично через TGF-B и IL-6. TGF-B, секретируемый тромбоцитами, передает сигналы через TGF-B RI, способствуя эндотелиальной дисфункции и последующему отложению коллагена. Предполагается, что IL-6, высвобождаемый активированными эндотелиальными клетками, оказывает профибротическое действие после тромбоза глубоких вен посредством активации CCL2. Последний вызывает рекрутирование моноцитов и секрецию CCL2, что приводит к отложению коллагена. Воспроизведено с разрешения Najem MY, Couturaud F, Lemarie CA. Цитокиновая и хемокиновая регуляция венозной тромбоэмболии. Джей Тромб Хемост. 2020;18:1009-1019. doi: 10.1111/jth.14759
В конечном счете, неконтролируемое воспаление приводит к хронизации ВТЭ частично через TGF-B и IL-6. TGF-B, секретируемый тромбоцитами, передает сигналы через TGF-B RI, способствуя эндотелиальной дисфункции и последующему отложению коллагена. Предполагается, что IL-6, высвобождаемый активированными эндотелиальными клетками, оказывает профибротическое действие после тромбоза глубоких вен посредством активации CCL2. Последний вызывает рекрутирование моноцитов и секрецию CCL2, что приводит к отложению коллагена. Воспроизведено с разрешения Najem MY, Couturaud F, Lemarie CA. Цитокиновая и хемокиновая регуляция венозной тромбоэмболии. Джей Тромб Хемост. 2020;18:1009-1019. doi: 10.1111/jth.14759
Рис. 2. Интерфейс и взаимосвязь между коагуляцией и воспалением, процесс на примере инфекции SARS-CoV-2 — «иммунотромбоз».
Хотя более подробное обсуждение выходит за рамки этой статьи, следует упомянуть, что недавняя пандемия COVID-19 ясно продемонстрировала наличие тромбоза in situ (т.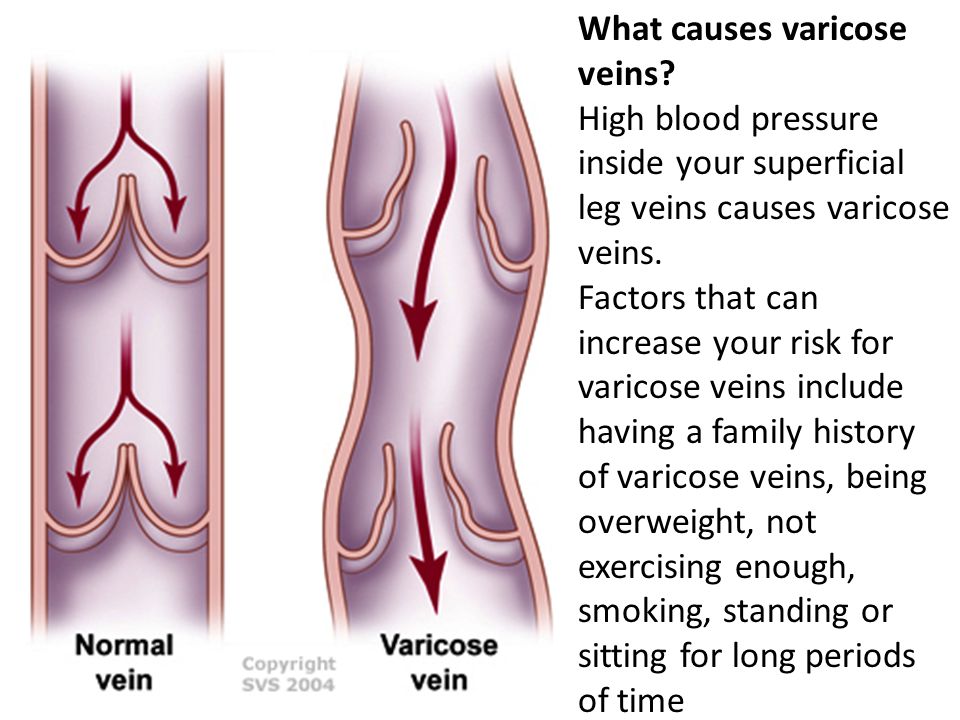 е. тромбоза без необходимости эмболии), что делает случай Ясно, что иммунотромботический феномен и рецептор IL-6 являются рациональной терапевтической мишенью для гуманизированного антитела тоцилизумаба. 38 Другим интересным наблюдением у пациентов, инфицированных коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2), является наличие нейтрофильных внеклеточных ловушек (NET). 39 NET представляют собой волокна внеклеточной ДНК, экструдированные из нейтрофилов, образующиеся в ответ на инфекцию, что позволяет нейтрофилам «ловить» и уничтожать вторгшиеся микроорганизмы. Тем не менее, НЭО являются характерной чертой пациентов с положительным результатом теста на ампликон COVID-19 и пациентов, инфицированных другим вирусом гриппа B с одноцепочечной РНК. 40-48 НЭО, по-видимому, участвуют в активации тромбоцитов, активации внешнего и внутреннего каскадов свертывания и ингибировании антитромбина III. 49,50
е. тромбоза без необходимости эмболии), что делает случай Ясно, что иммунотромботический феномен и рецептор IL-6 являются рациональной терапевтической мишенью для гуманизированного антитела тоцилизумаба. 38 Другим интересным наблюдением у пациентов, инфицированных коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2), является наличие нейтрофильных внеклеточных ловушек (NET). 39 NET представляют собой волокна внеклеточной ДНК, экструдированные из нейтрофилов, образующиеся в ответ на инфекцию, что позволяет нейтрофилам «ловить» и уничтожать вторгшиеся микроорганизмы. Тем не менее, НЭО являются характерной чертой пациентов с положительным результатом теста на ампликон COVID-19 и пациентов, инфицированных другим вирусом гриппа B с одноцепочечной РНК. 40-48 НЭО, по-видимому, участвуют в активации тромбоцитов, активации внешнего и внутреннего каскадов свертывания и ингибировании антитромбина III. 49,50
ТРОМБОЗ, СВЯЗАННЫЙ С РАКОМ
Считается, что основным механизмом образования фибрина, лежащим в основе тромбоза, связанного с раком, является активация экспрессии TF в раковых клетках и мембранных везикулах, происходящих из раковых клеток.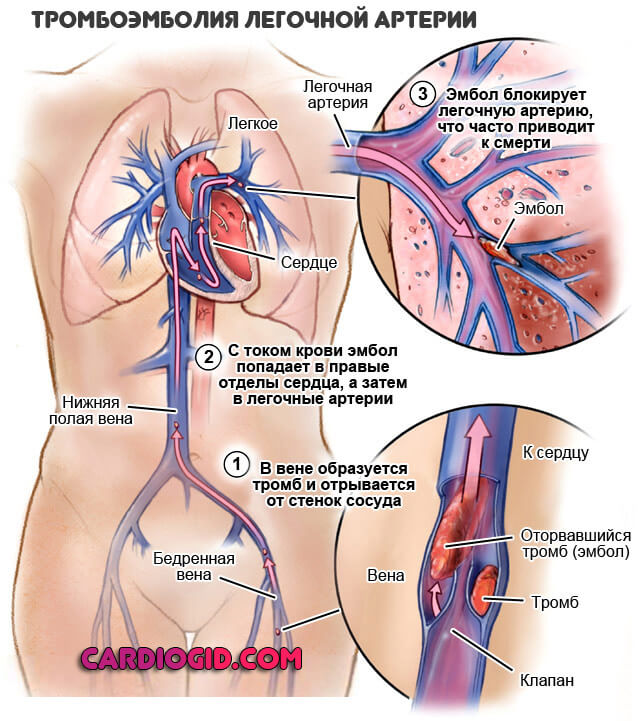 51 Хотя подробное обсуждение выходит за рамки этой статьи, представляется вероятным, что путь TF/фактор VIIa является основным инициатором образования фибрина у больных раком. 52,53 Раковые клетки экспрессируют ТФ на своей плазматической мембране и выделяют микрочастицы прокоагулянта, содержащие ТФ, в кровоток. Более того, коагуляция, запускаемая полифосфатом/фактором XII, была продемонстрирована при тромбозах, связанных с раком предстательной железы. 54 Было показано, что опухоли выделяют молекулы, в том числе аденозинтрифосфат, которые активируют рецептор тромбоцитов P2Y12, а медиаторы тромбоцитарного происхождения также регулируют рост опухоли. 55,56
51 Хотя подробное обсуждение выходит за рамки этой статьи, представляется вероятным, что путь TF/фактор VIIa является основным инициатором образования фибрина у больных раком. 52,53 Раковые клетки экспрессируют ТФ на своей плазматической мембране и выделяют микрочастицы прокоагулянта, содержащие ТФ, в кровоток. Более того, коагуляция, запускаемая полифосфатом/фактором XII, была продемонстрирована при тромбозах, связанных с раком предстательной железы. 54 Было показано, что опухоли выделяют молекулы, в том числе аденозинтрифосфат, которые активируют рецептор тромбоцитов P2Y12, а медиаторы тромбоцитарного происхождения также регулируют рост опухоли. 55,56
БУДУЩИЕ ТЕРАПЕВТИЧЕСКИЕ ЦЕЛИ ДЛЯ РАЗРЕШЕНИЯ ТРОМБА
Ясно, что у многих пациентов с остаточной ТЭЛА сохраняются симптомы, и, по мнению авторов, извлечение сгустка и/или ускорение раннего рассасывания тромба у тщательно отобранных пациентов равносильно предотвращению опосредованного тромбом легочного кровотечения. ремоделирования артерий и сосудистой дисфункции. Клиницисты и фундаментальные ученые должны предпринять согласованные усилия, чтобы очертить пути передачи сигнала в клетках, которые регулируют образование и рассасывание тромбов. В состав тромба входят фибрин, эритроциты, тромбоциты и лейкоциты. Небольшое исследование показало, что длительный и текущий прием аспирина не изменяет перегрузку правого желудочка или тромбоэмболию легочной артерии с использованием шкалы Qanadli для тромбообразования легочной артерии [9].0003 57 , но воздействие на другие пути в тромбоцитах может улучшить рассасывание тромба при определенных условиях. В мышиной модели ВТЭ в качестве критической детерминанты рассасывания тромба была предложена эндотелиальная, но не тромбоцитарно-трансформирующая передача сигналов фактора роста-В1. 58 Было показано, что венозный тромб секретирует матриксные металлопротеиназы (ММР), которые могут реконструировать вены, а активированные тромбоцитарные ММР обнаруживаются в извлеченном тромбе и в циркулирующей крови у пациентов с острыми тромботическими событиями.
ремоделирования артерий и сосудистой дисфункции. Клиницисты и фундаментальные ученые должны предпринять согласованные усилия, чтобы очертить пути передачи сигнала в клетках, которые регулируют образование и рассасывание тромбов. В состав тромба входят фибрин, эритроциты, тромбоциты и лейкоциты. Небольшое исследование показало, что длительный и текущий прием аспирина не изменяет перегрузку правого желудочка или тромбоэмболию легочной артерии с использованием шкалы Qanadli для тромбообразования легочной артерии [9].0003 57 , но воздействие на другие пути в тромбоцитах может улучшить рассасывание тромба при определенных условиях. В мышиной модели ВТЭ в качестве критической детерминанты рассасывания тромба была предложена эндотелиальная, но не тромбоцитарно-трансформирующая передача сигналов фактора роста-В1. 58 Было показано, что венозный тромб секретирует матриксные металлопротеиназы (ММР), которые могут реконструировать вены, а активированные тромбоцитарные ММР обнаруживаются в извлеченном тромбе и в циркулирующей крови у пациентов с острыми тромботическими событиями. 59,60 Эритроциты, подобно тромбоцитам и эндотелию сосудов, продуцируют оксид азота (NO), обладающий противовоспалительными, антитромботическими и антипролиферативными свойствами. 61 NO, полученный из эритроцитов, может изменять тонус сосудов и регулировать тромбоз в различных сосудистых руслах. 62 При повышении гематокрита время кровотечения сокращается. 63 Таким образом, эритроциты также могут склонить чашу весов в сторону тромбоза при определенных состояниях, таких как истинная полицитемия и, возможно, даже при длительном внутрисосудистом истощении.
59,60 Эритроциты, подобно тромбоцитам и эндотелию сосудов, продуцируют оксид азота (NO), обладающий противовоспалительными, антитромботическими и антипролиферативными свойствами. 61 NO, полученный из эритроцитов, может изменять тонус сосудов и регулировать тромбоз в различных сосудистых руслах. 62 При повышении гематокрита время кровотечения сокращается. 63 Таким образом, эритроциты также могут склонить чашу весов в сторону тромбоза при определенных состояниях, таких как истинная полицитемия и, возможно, даже при длительном внутрисосудистом истощении.
ЗАКЛЮЧЕНИЕ
Хотя существует критическая связь между воспалением и тромбозом, сложные взаимодействия, динамика и специфическое происхождение различных цитокинов и хемокинов, участвующих в развитии ВТЭ, остаются неясными. Становится все более очевидным, как и в случае с артериальной стороной сердечно-сосудистых заболеваний, неразрешенное воспаление при остром тромбозе может иметь решающее значение в развитии острого и хронического венозного тромбоза. Будущее захватывающее, но остается много вопросов.
Будущее захватывающее, но остается много вопросов.
1. Secemsky E, Chang Y, Jain CC, et al. Современное ведение и исходы у пациентов с массивной и субмассивной тромбоэмболией легочной артерии. Am J Med. 2018;131:1506-1709.e0. doi: 10.1016/j.amjmed.2018.07.035
2. Chaudhury P, Gadre SK, Schneider E, et al. Влияние наличия междисциплинарной группы реагирования на легочную эмболию на лечение и исходы. Ам Джей Кардиол. 2019;124:1465-1469. doi: 10.1016/j.amjcard.2019.07.043
3. Piechota-Polanczyk A, Jozkowicz A, Nowak W, et al. Аневризма брюшной аорты и внутрипросветный тромб: современные представления о развитии и лечении. Front Cardiovasc Med. 2015;2:19. doi: 10.3389/fcvm.2015.00019
4. Косилка WR, Quiñones WJ, Gambhir SS. Влияние внутрипросветного тромба на напряжение стенки аневризмы брюшной аорты. J Vasc Surg. 1997; 26:602-608. doi: 10.1016/s0741-5214(97)70058-2
5. Hosokawa K, Ishibashi-Ueda H, Kishi T, et al. Гистопатологическое множественное реканализованное поражение является критическим элементом исхода после легочной тромбоэндартерэктомии.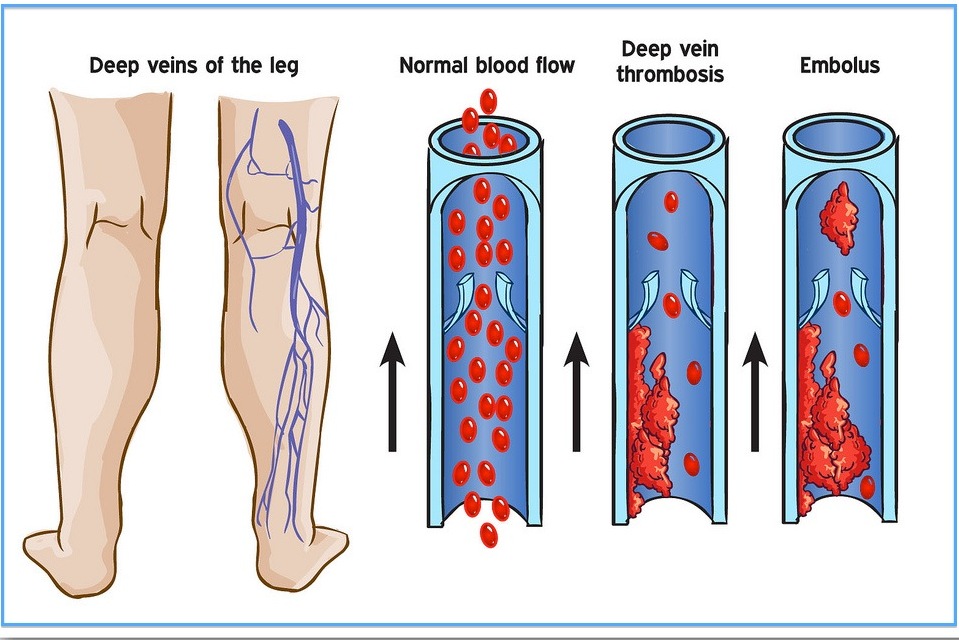 Int Heart J. 2011; 52:377-381. doi: 10.1536/ihj.52.377
Int Heart J. 2011; 52:377-381. doi: 10.1536/ihj.52.377
6. Kim NH, Lang IM. Факторы риска хронической тромбоэмболической легочной гипертензии. Европейское дыхание, ред. 2012; 21:27–31. дои: 10.1183/09059180.00009111
7. Моленаар Дж.К. [Из библиотеки Нидерландского медицинского журнала. Рудольф Вирхов: Die Cellularpathologie in ihrer Begrundung auf physiologische und pathologische Gewebelehre; 1858] [Статья на голландском языке]. Нед Тайдшр Генескд. 2003;147:2236-2244.
8. Сакута М. [Сто книг, которые создали неврологию (35) — Cruveilhier J «Anatomie Pathologique du Corps Humain» (1829-1842)] [Статья на японском языке]. Мозговой нерв. 2009;61:1354-1355.
9. Макман Н. Новые взгляды на механизмы венозного тромбоза. Джей Клин Инвест. 2012;122:2331-2336. дои: 10.1172/JCI60229
10. Липе Б., Орнштейн Д.Л. Дефицит природных антикоагулянтов, протеина С, протеина S и антитромбина. Тираж. 2011;124:e365-368. doi: 10.1161/CIRCULATIONAHA.111.044412
11. Lane DA, Mannucci PM, Bauer KA, et al. Наследственная тромбофилия: часть 1. Тромб гемостаз. 1996;76:651-662.
Lane DA, Mannucci PM, Bauer KA, et al. Наследственная тромбофилия: часть 1. Тромб гемостаз. 1996;76:651-662.
12. Мранж П.Е., Сухон П., Трегуэ Д.А. Генетика венозных тромбозов: обновление 2015 г. Thromb Haemost. 2015;114:910-919. doi: 10.1160/Th25-05-0410
13. Sebastiani GD, Iuliano A, Cantarini L, Galeazzi M. Генетические аспекты антифосфолипидного синдрома: обновление. Аутоиммунная версия, 2016; 15:433-439.. doi: 10.1016/j.autrev.2016.01.005
14. Pengo V, Denas G, Zoppellaro G, et al. Сравнение ривароксабана и варфарина у пациентов с высоким риском антифосфолипидного синдрома. Кровь. 2018;132:1365-1371. doi: 10.1182/blood-2018-04-848333
15. Ageno W, Prandoni P, Romualdi E, et al. Метаболический синдром и риск венозного тромбоза: исследование случай-контроль. Джей Тромб Хемост. 2006; 4:1914-1918. doi: 10.1111/j.1538-7836.2006.02132.x
16. Stewart LK, Beam DM, Casciani T, et al. Влияние метаболического синдрома на среднее давление в легочной артерии у пациентов с острой легочной эмболией, получавших катетерный тромболизис. Int J Кардиол. 2020;302:138-142. doi: 10.1016/j.ijcard.2019.12.043
Int J Кардиол. 2020;302:138-142. doi: 10.1016/j.ijcard.2019.12.043
17. Chiva-Blanch G, Badimon L. Взаимосвязи между липопротеинами и воспалением: роль микровезикул. Дж. Клин Мед. 2019;8:2059. doi: 10.3390/jcm8122059
18. Hervio L, Durlach V, Girard-Globa A, Anglés-Cano E. Множественное связывание с идентичной связью: механизм, объясняющий влияние липопротеина (а) на фибринолиз. Биохимия. 1995; 34:13353-13358. doi: 10.1021/bi00041a011
19. Dentali F, Gessi V, Marcucci R, et al. Липопротеин (а) как фактор риска венозной тромбоэмболии: систематический обзор и метаанализ литературы. Семин Тромб Гемост. 2017;43:614-620. дои: 10.1055/s-0036-1598002
20. Кунуцор С.К., Макикаллио Т.Х., Кауханен Дж. и др. Липопротеин(а) не связан с риском венозной тромбоэмболии. Scand Cardiovasc J. 2019; 53:125-132. doi: 10.1080/14017431.2019.1612087
21. Tsimikas S, Karwatowska-Prokopczuk E, Gouni-Berthold I, et al. Снижение липопротеина(а) у лиц с сердечно-сосудистыми заболеваниями. N Engl J Med. 2020;382:244-255. doi: 10.1056/NEJMoa1905239
N Engl J Med. 2020;382:244-255. doi: 10.1056/NEJMoa1905239
22. Najem MY, Couturaud F, Lemarie CA. Цитокиновая и хемокиновая регуляция венозной тромбоэмболии. Джей Тромб Хемост. 2020;18:1009-1019. doi: 10.1111/jth.14759
23. Agnelli G. Профилактика венозной тромбоэмболии у хирургических больных. Тираж. 2004;110(24 приложение 1):IV4-12. doi: 10.1161/01.CIR.0000150639.98514.6c
24. Monn MF, Hui X, Lau BD, et al. Инфекция и венозная тромбоэмболия у пациентов, перенесших колоректальные операции: какова взаимосвязь? Расстройство прямой кишки. 2014;57:497-505. doi: 10.1097/DCR.0000000000000054
25. Леви М., Шульц М., ван дер Полл Т. Сепсис и тромбоз. Семин Тромб Гемост. 2013;39: 559-566. doi: 10.1055/s-0033-1343894
26. Lentz SR. Тромбоз на фоне ожирения или воспалительного заболевания кишечника. Кровь. 2016;128:2388-2394. doi: 10.1182/blood-2016-05-716720
27. Buller HR, van Doormaal FF, van Sluis GL, Kamphuisen PW. Рак и тромбоз: от молекулярных механизмов к клиническим проявлениям.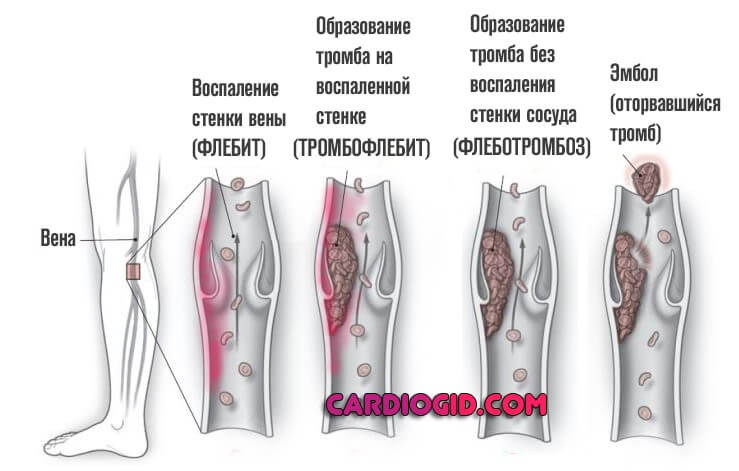 Джей Тромб Хемост. 2007;5 приложение 1:246-254. doi: 10.1111/j.1538-7836.2007.02497.xx
Джей Тромб Хемост. 2007;5 приложение 1:246-254. doi: 10.1111/j.1538-7836.2007.02497.xx
28. Jackson SP, Darbousset R, Schoenwaelder SM. Тромбовоспаление: проблемы терапевтического воздействия на коагуляцию и другие механизмы защиты хозяина. Кровь. 2019;133:906-918. doi: 10.1182/blood-2018-11-882993
29. Morrell CN, Matsushita K, Chiles K, et al. Регуляция экзоцитоза гранул тромбоцитов путем S-нитрозилирования. Proc Natl Acad Sci U S A. 2005; 102:3782-3787. doi: 10.1073/pnas.0408310102
30. Matsushita K, Morrell CN, Cambien B, et al. Оксид азота регулирует экзоцитоз путем S-нитрозилирования фактора, чувствительного к N-этилмалеимиду. Клетка. 2003; 115:139-150. doi: 10.1016/s0092-8674(03)00803-1
31. Бранчфорд Б.Р., Карпентер С.Л. Роль воспаления при венозной тромбоэмболии. Фронт Педиатр. 2018;6:142. дои: 10.3389/fped.2018.00142
32. Будник И., Брилл А. Иммунные факторы в инициации тромбоза глубоких вен. Тренды Иммунол. 2018;39:610-623. doi: 10.1016/j.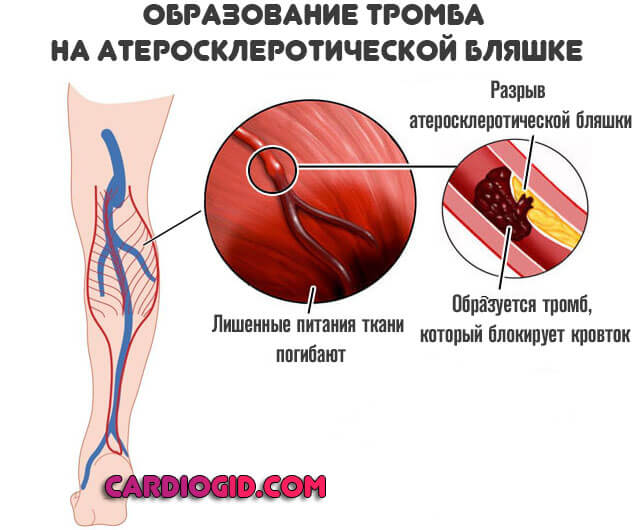 it.2018.04.010
it.2018.04.010
33. Сагазаде А., Хафизи С., Резаи Н. Воспаление при венозной тромбоэмболии: причина или следствие? Int Immunopharmacol. 2015;28:655-665. doi: 10.1016/j.intimp.2015.07.044
34. Folsom AR, Lutsey PL, Astor BC, Cushman M. C-реактивный белок и венозная тромбоэмболия. Проспективное исследование когорты ARIC. Тромб Хемост. 2009 г.;102:615-619. doi: 10.1160/TH09-04-0274
35. Gao Q, Zhang P, Wang W, et al. Корреляционный анализ полиморфизма фактора некроза опухоли-альфа-308G/A и риска венозной тромбоэмболии: метаанализ. Флебология. 2016;31:625-631. doi: 10.1177/0268355515607405
36. Mosevoll KA, Johansen S, Wendelbo O, et al. Цитокины, молекулы адгезии и матриксные металлопротеазы как предрасполагающие, диагностические и прогностические факторы венозного тромбоза. Front Med (Лозанна). 2018;5:147. дои: 10.3389/fmed.2018.00147
37. Пенн М.С., Тополь Э.Дж. Тканевой фактор, возникающая связь между воспалением, тромбозом и ремоделированием сосудов.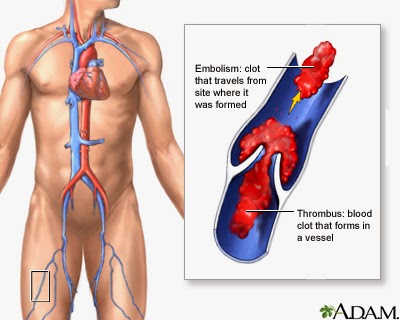 Цирк рез. 2001;89:1-2. doi: 10.1161/hh2301.093825
Цирк рез. 2001;89:1-2. doi: 10.1161/hh2301.093825
38. Xu X, Han M, Li T, et al. Эффективное лечение тяжелых пациентов с COVID-19 тоцилизумабом. Proc Natl Acad Sci U S A. 2020; 117:10970-10975. doi: 10.1073/pnas.2005615117
39. Zuo Y, Yalavarthi S, Shi H, et al. Нейтрофильные внеклеточные ловушки при COVID-19. Взгляд JCI. 2020;5:138999. doi: 10.1172/jci.insight.138999
40. Klok FA, Kruip MJ, van der Meer NJM, et al. Частота тромботических осложнений у пациентов в критическом состоянии с COVID-19 в отделении интенсивной терапии. Рез. Тромб. 2020;191:145-147. doi: 10.1016/j.thromres.2020.04.013
41. Poissy J, Goutay J, Caplan M, et al. Легочная эмболия у пациентов с COVID-19: осведомленность о повышенной распространенности. Тираж. Опубликовано в сети 24 апреля 2020 г. doi: 10.1161/CIRCULATIONAHA.120.047430
42. Zeng F, Huang Y, Guo Y, et al. Ассоциация маркеров воспаления с тяжестью течения COVID-19: метаанализ. Int J Infect Dis. 2020;96:467-474. doi: 10.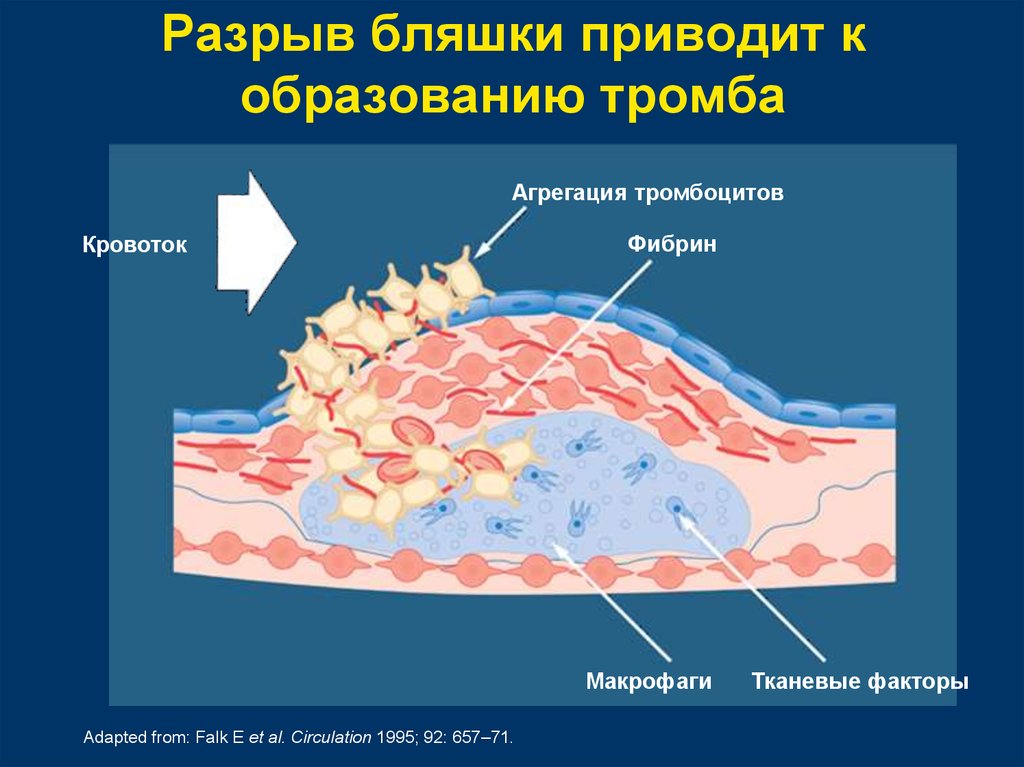 1016/j.ijid.2020.05.055
1016/j.ijid.2020.05.055
43. Long AT, Kenne E, Jung R, et al. Новый взгляд на контактную систему: интерфейс между воспалением, коагуляцией и врожденным иммунитетом. Джей Тромб Хемост. 2016;14:427-437.
44. Фукс Т.А., Брилл А., Вагнер Д.Д. Влияние нейтрофильной внеклеточной ловушки (НВЛ) на тромбоз глубоких вен. Артериосклеры Тромб Васк Биол. 2012;32:1777-1783. doi: 10.1161/ATVBAHA.111.242859
45. Fuchs TA, Brill A, Duerschmied D, et al. Ловушки внеклеточной ДНК способствуют тромбозу. Proc Natl Acad Sci U S A. 2010;107:15880-15885. doi: 10.1073/pnas.1005743107
46. Engelmann B, Massberg S. Тромбоз как внутрисосудистый эффектор врожденного иммунитета. Нат Рев Иммунол. 2013;13:34-45. doi: 10.1038/nri3345
47. Semple JW, Freedman J. Тромбоциты и врожденный иммунитет. Cell Mol Life Sci. 2010;67:499-511. doi: 10.1007/s00018-009-0205-1
48. Купенова М., Коркри Х.А., Витцева О. и соавт. Роль тромбоцитов в опосредовании ответа на гриппозную инфекцию человека. Нац коммун. 2019;10:1780. doi: 10.1038/s41467-019-09607-x
Нац коммун. 2019;10:1780. doi: 10.1038/s41467-019-09607-x
49. Noubouossie DF, Whelihan MW, Yu YB, et al. Активация коагуляции in vitro ДНК нейтрофилов человека и гистоновыми белками, но не нейтрофильными внеклеточными ловушками. Кровь. 2017;129:1021-1029. doi: 10.1182/blood-2016-06-722298
50. Thalin C, Hisada Y, Lundstrom S, et al. Нейтрофильные внеклеточные ловушки: злодеи и мишени при артериальных, венозных и онкологических тромбозах. Артериосклеры Тромб Васк Биол. 2019;39:1724-1738. doi: 10.1161/ATVBAHA.119.312463
51. Фаланга А., Маркетти М., Виньоли А. Коагуляция и рак: биологические и клинические аспекты. Джей Тромб Хемост. 2013;11:223-233. doi: 10.1111/jth.12075
52. Geddings JE, Mackman N. Положительные микрочастицы тканевого фактора опухоли и венозный тромбоз у онкологических больных. Кровь. 2013;122:1873-1880. doi: 10.1182/blood-2013-04-460139
53. van den Berg YW, Osanto S, Reitsma PH, Versteeg HH. Взаимосвязь между тканевым фактором и прогрессированием рака: взгляд со скамейки и у постели больного.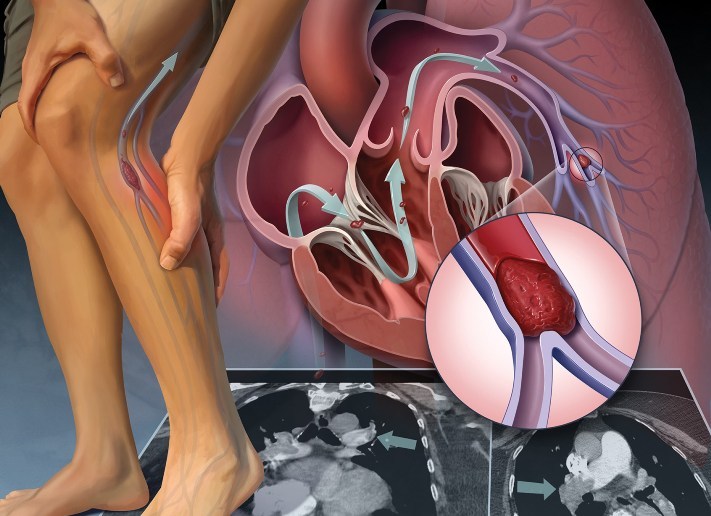 Кровь. 2012;119:924-932. doi: 10.1182/blood-2011-06-317685
Кровь. 2012;119:924-932. doi: 10.1182/blood-2011-06-317685
54. Никель К.Ф., Ронквист Г., Лангер Ф. и соавт. Путь полифосфат-фактора XII управляет коагуляцией при тромбозе, связанном с раком предстательной железы. Кровь. 2015;126:1379-1389. doi: 10.1182/blood-2015-01-622811
55. Cho MS, Noh K, Haemmerle M, et al. Роль рецепторов АДФ на тромбоцитах в развитии рака яичников. Кровь. 2017;130:1235-1242. doi: 10.1182/blood-2017-02-769893
56. Lee EC, Cameron SJ. Рак и тромботический риск: парадигма тромбоцитов. Front Cardiovasc Med. 2017;4:67. doi: 10.3389/fcvm.2017.00067
57. Van Galen J, Pava L, Wright C, et al. Влияние ингибиторов тромбоцитов на тромбоэмболию у пациентов с острой тромбоэмболией легочной артерии. Тромбоциты. Опубликовано в сети 6 марта 2020 г. doi: 10.1080/09537104.2020.1732329
58. Bochenek ML, Leidinger C, Rosinus NS, et al. Активированная эндотелиальная передача сигналов TGF-бета1 способствует неразрешению венозных тромбов у мышей через эндотелин-1: возможная роль в развитии хронической тромбоэмболической легочной гипертензии.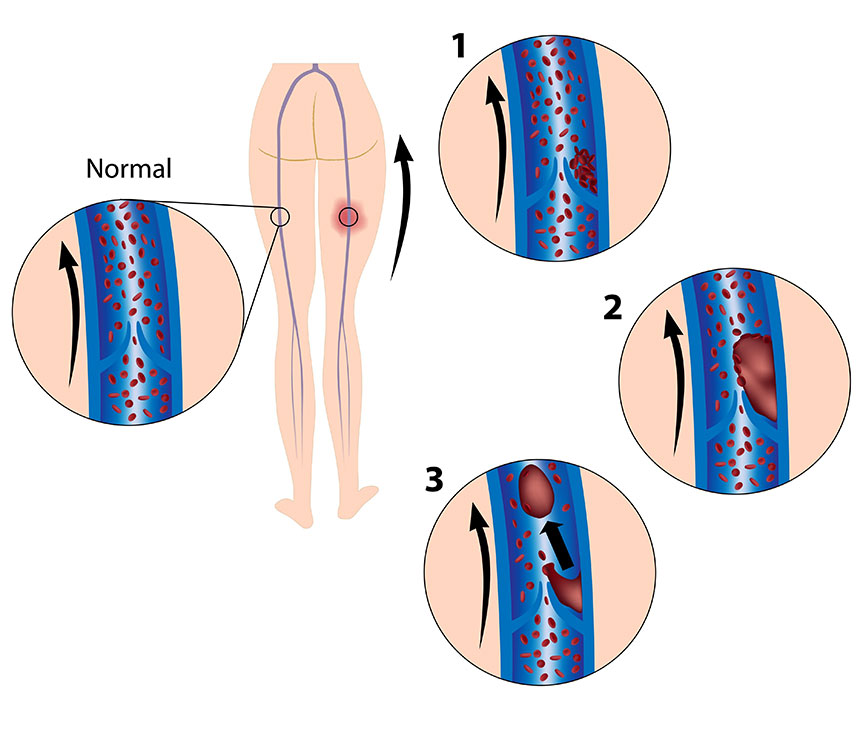 Цирк рез. 2020;126:162-181. doi: 10.1161/CIRCRESAHA.119.315259
Цирк рез. 2020;126:162-181. doi: 10.1161/CIRCRESAHA.119.315259
59. Deatrick KB, Eliason JL, Lynch EM, et al. Ремоделирование стенки вены после тромбоза глубоких вен включает матриксные металлопротеиназы и поздний фиброз в мышиной модели. J Vasc Surg. 2005;42:140-148. doi: 10.1016/j.jvs.2005.04.014
60. Schmidt RA, Morrell CN, Ling FS, et al. Фенотип тромбоцитов у пациентов с инфарктом миокарда с подъемом сегмента ST отличается от инфаркта миокарда без подъема сегмента ST. Перевод рез. 2018;195:1-12. doi: 10.1016/j.trsl.2017.11.006
61. Gladwin MT. Как эритроциты перерабатывают оксид азота: доказательства нитритной гипотезы. Тираж. 2017; 135:177-179. doi: 10.1161/CIRCULATIONAHA.116.024752
62. Bailey DM, Rasmussen P, Overgaard M, et al. Обмен нитритов и S-нитрозогемоглобина в мозговом и бедренном кровообращении человека: связь с базальным кровотоком и реакцией кровотока на гипоксию. Тираж. 2017; 135:166-176. doi: 10.1161/РАСПИСАНИЕAHA.116.024226
63. Спивак Ю.Л. Истинная полицитемия: мифы, механизмы и лечение. Кровь. 2002; 100:4272-4290. doi: 10.1182/blood-2001-12-0349
Спивак Ю.Л. Истинная полицитемия: мифы, механизмы и лечение. Кровь. 2002; 100:4272-4290. doi: 10.1182/blood-2001-12-0349
Скотт Дж. Кэмерон, доктор медицинских наук,
Заместитель начальника отдела исследований
Отделение сосудистой медицины
Кафедра сердечно-сосудистой медицины
Фонд Кливлендской клиники
Кливленд, Огайо
[email protected]
Раскрытие информации: нет.
Виктор Ф. Тапсон, доктор медицины
Директор отдела венозной тромбоэмболии и
Исследование легочных сосудистых заболеваний
Директор по клиническим исследованиям, Институт легких женской гильдии
Заместитель директора, пульмонологическая реанимация
Медицинский центр Cedars-Sinai
Лос-Анджелес, Калифорния
[email protected]
Раскрытие информации: Финансирование исследований (учреждению) от Bayer, Bristol-Myers Daiichi, Squibb, Janssen, Penumbra; консультационные / консультативные советы для Arena, Bayer, Bristol-Myers Squibb, Inari Medical, Janssen, Penumbra.
Лечение экссудативной отслойки сетчатки у пациента с тромботической тромбоцитопенической пурпурой — Полный текст — Офтальмологические клинические случаи 2016, Vol. 7, № 1
Цель: Представлен случай односторонней экссудативной отслойки сетчатки у больного с тромботической тромбоцитопенической пурпурой (ТТП) без сопутствующей артериальной гипертензии, успешно пролеченного плазмаферезом. История болезни: 46-летняя женщина с ТТП в анамнезе поступила с односторонней экссудативной отслойкой сетчатки. Биологическая и рентгенологическая оценка исключили другие причины экссудативной отслойки сетчатки, в том числе артериальную гипертензию. Произведен плазмаферез с последующим быстрым улучшением остроты зрения и полным исчезновением серозной отслойки. Заключение: Экссудативная односторонняя отслойка сетчатки является редким осложнением ТТП и успешно лечится плазмаферезом.
Введение
Тромботическая тромбоцитопеническая пурпура (ТТП) — редкая, но опасная для жизни тромботическая микроангиопатия (2,9 случая на миллион в год), которая может поражать несколько органов.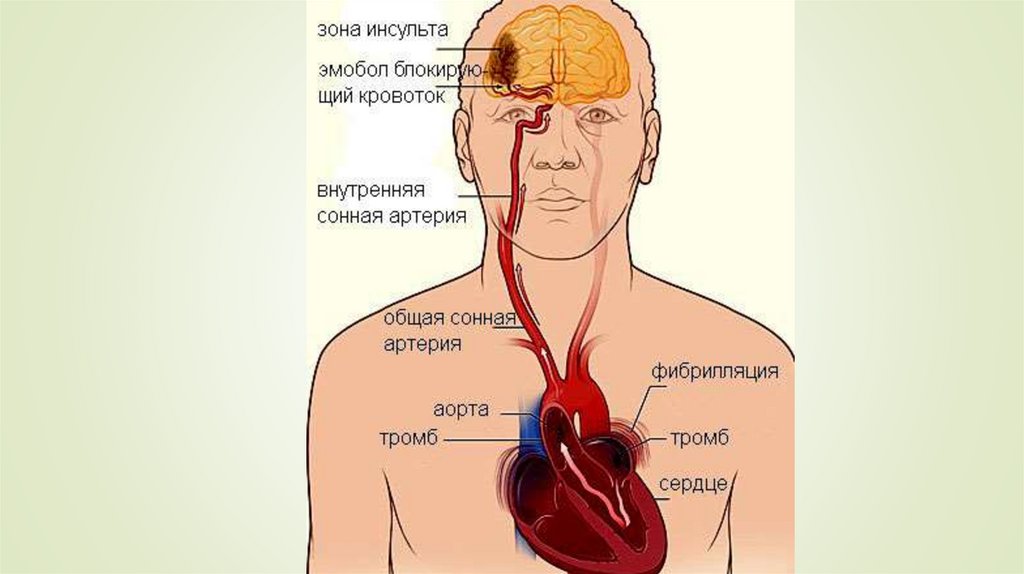 Клинические особенности ТТП обусловлены повторяющимися эпизодами микроангиопатической гемолитической анемии и тромбоцитопении. ТТП вызывается образованием тромбов в микроциркуляторном русле вследствие ингибирования дезинтегрина и металлопротеазы доменом 13 тромбоспондина I типа (ADAMTS13) [1]. Эти тромбы состоят из тромбоцитов и ультракрупных мультимеров фактора фон Виллебранда (ULVWF). Эти мультимеры VWF индуцируют агрегацию тромбоцитов и, как правило, расщепляются ADAMTS13. Приобретенная ТТП связана с тяжелым дефицитом расщепления фактора Виллебранда, вызванным аутоантителами IgG, которые ингибируют ADAMTS13, что приводит к чрезмерной агрегации тромбоцитов.
Клинические особенности ТТП обусловлены повторяющимися эпизодами микроангиопатической гемолитической анемии и тромбоцитопении. ТТП вызывается образованием тромбов в микроциркуляторном русле вследствие ингибирования дезинтегрина и металлопротеазы доменом 13 тромбоспондина I типа (ADAMTS13) [1]. Эти тромбы состоят из тромбоцитов и ультракрупных мультимеров фактора фон Виллебранда (ULVWF). Эти мультимеры VWF индуцируют агрегацию тромбоцитов и, как правило, расщепляются ADAMTS13. Приобретенная ТТП связана с тяжелым дефицитом расщепления фактора Виллебранда, вызванным аутоантителами IgG, которые ингибируют ADAMTS13, что приводит к чрезмерной агрегации тромбоцитов.
Экссудативная отслойка сетчатки — редкое глазное осложнение у пациентов с ТТП. Большинство случаев являются двусторонними и связаны с артериальной гипертензией. Здесь мы сообщаем о случае односторонней экссудативной отслойки сетчатки без сопутствующей гипертензии, успешно вылеченной с помощью плазмафереза.
История болезни
46-летняя женщина из Северной Африки обратилась с внезапной потерей зрения. В анамнезе у нее была ТТП, диагностированная 8 лет назад, и тяжелая левая амблиопия с детства (неизвестной этиологии).
В анамнезе у нее была ТТП, диагностированная 8 лет назад, и тяжелая левая амблиопия с детства (неизвестной этиологии).
Первоначальное офтальмологическое обследование показало, что острота зрения ограничена движением рук в правом глазу и светоощущением в левом глазу. Осмотр переднего отрезка глаза с помощью щелевой лампы и внутриглазное давление в норме. При осмотре глазного дна выявлена экссудативная отслойка заднего полюса сетчатки правого глаза без увеита и папиллярного отека (рис. 1а). Сосуды сетчатки в норме. На левом глазу при осмотре глазного дна обнаружены рубцы хориоретинита и атрофия зрительного нерва. Спектральная оптическая когерентная томография (СД-ОКТ) подтвердила экссудативную отслойку сетчатки с интраретинальными кистами на правом глазу (рис. 1б) и хориоидальную атрофию на левом глазу. Флуоресцентная и индоцианиновая ангиография выявила замедление хориоидальной перфузии (рис. 2).
Рис. 1
a Глазное дно правого глаза при первичном осмотре: экссудативная отслойка сетчатки.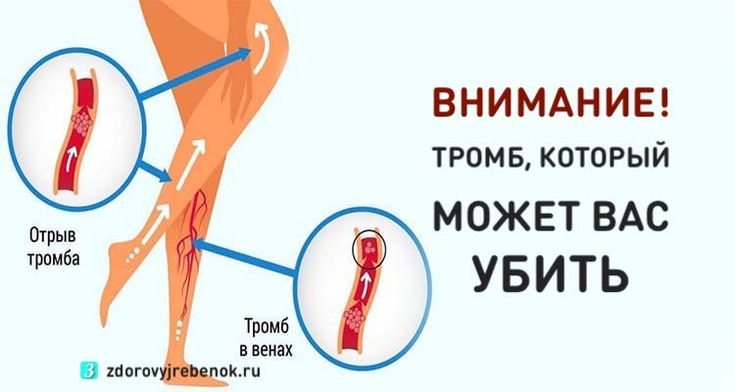 b SD-OCT правого глаза при первичном осмотре. Скан SD-OCT, показывающий экссудативную отслойку сетчатки, содержащую некоторые гиперрефлексивные мембранные структуры (звездочка).
b SD-OCT правого глаза при первичном осмотре. Скан SD-OCT, показывающий экссудативную отслойку сетчатки, содержащую некоторые гиперрефлексивные мембранные структуры (звездочка).
Рис. 2
Ангиография с индоцианином зеленым, показывающая нерегулярную перфузию сосудистой оболочки.
При постановке диагноза лабораторные исследования показали тромбоцитопению с количеством тромбоцитов 30 000/мкл с легкой анемией; уровень гемоглобина был 10 г/дл. Уровень лактатдегидрогеназы был повышен (2,961 МЕ/л). Активность ADAMTS13 была неопределяемой (<5% от нормальной активности) с положительными антителами против ADAMTS13. Уровни креатинина сыворотки и ферментов печени были в норме. Тест на β-ХГЧ отрицательный, артериальное давление в норме. У нее не было неврологических или дерматологических симптомов.
Следовательно, данная экссудативная отслойка сетчатки должна была быть осложнением ТТП. Проведено плазмообменное лечение (ежедневный плазмаферез и дополнительная обработка кортикостероидами через 2 недели после начала плазмафереза). Через несколько часов после первого плазмафереза к пациентке начало возвращаться зрение, а через 2 дня после первого плазмафереза отмечено повышение остроты зрения до 20/32 на правом глазу. На глазном дне и SD-OCT обнаружено полное исчезновение экссудативной отслойки сетчатки (рис. 3а, б). Однако имелись последствия ишемии с отеком пигментированного эпителия сетчатки (рис. 3в).
Через несколько часов после первого плазмафереза к пациентке начало возвращаться зрение, а через 2 дня после первого плазмафереза отмечено повышение остроты зрения до 20/32 на правом глазу. На глазном дне и SD-OCT обнаружено полное исчезновение экссудативной отслойки сетчатки (рис. 3а, б). Однако имелись последствия ишемии с отеком пигментированного эпителия сетчатки (рис. 3в).
Рис. 3
a Глазное дно правого глаза через 2 дня после замены плазмафереза, демонстрирующее исчезновение отслойки сетчатки. b SD-OCT правого глаза через 2 дня после замены плазмафереза подтверждает полное исчезновение отслойки сетчатки. c Продолжение ишемии ( b ) с набуханием пигментного эпителия (звездочка) на снимках SD-OCT после плазмафереза.
Обсуждение
Экссудативная отслойка сетчатки — редкое, но зарегистрированное осложнение ТТП. Однако до сих пор у большинства пациентов была двусторонняя экссудативная отслойка сетчатки. Единственный описанный случай односторонней экссудативной отслойки сетчатки был связан с разрывом пигментного эпителия сетчатки [2]. У нашего пациента одностороннее поражение можно объяснить существовавшей ранее атрофией хориоидеи в левом глазу.
У нашего пациента одностороннее поражение можно объяснить существовавшей ранее атрофией хориоидеи в левом глазу.
Экссудативная отслойка сетчатки при ТТП обычно связана с артериальной гипертензией. У нашего пациента артериальное давление было нормальным, других признаков гипертонической ретинопатии не было. Сообщалось только о 3 других случаях, не связанных с артериальной гипертензией [2,3,4]. Однако в 2 из 3 случаев присутствовали другие факторы риска экссудативной отслойки сетчатки, такие как послеродовой контекст [3] или разрыв пигментного эпителия сетчатки [2]. Это говорит о том, что гипертония, вероятно, играет важную роль в развитии экссудативной отслойки сетчатки при ТТП, но другие факторы еще предстоит идентифицировать.
Предполагается, что экссудативная отслойка сетчатки при ТТП обусловлена нарушением наружного гематоэнцефалического барьера сетчатки и ишемией хориоидеи. Микротромбы образуются в результате агрегации тромбоцитов, что приводит к окклюзии сосудов, что может происходить в хориоидальной сети.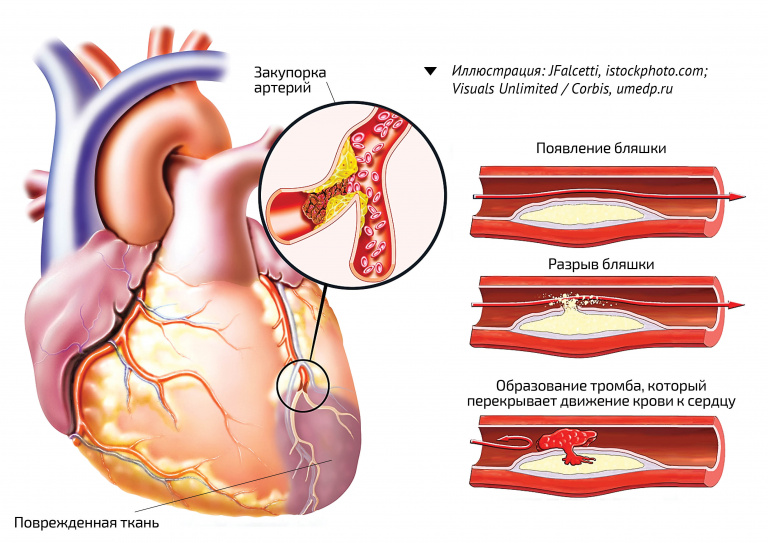 Избыточная агрегация тромбоцитов, опосредованная мультимерами УЛВВФ, обусловлена недостаточностью протеолитического действия металлопротеиназы ADAMTS13 [5]. Уровень активности ADAMTS13 в плазме составляет <5% при острой ТТП [6], как и у нашего пациента.
Избыточная агрегация тромбоцитов, опосредованная мультимерами УЛВВФ, обусловлена недостаточностью протеолитического действия металлопротеиназы ADAMTS13 [5]. Уровень активности ADAMTS13 в плазме составляет <5% при острой ТТП [6], как и у нашего пациента.
При экссудативной отслойке сетчатки, вызванной ТТП, основным методом лечения является плазмаферез [7]. Эффективность плазмафереза по сравнению с инфузией плазмы была подтверждена в рандомизированном исследовании [8], и предполагается, что пациентам с высокими титрами антител требуется плазмаферез для обеспечения нормального уровня протеазы ADAMTS13 и удаления ингибирующих антител (анти-ADAMTS13). Это позволяет расщеплять мультимеры ULVWF и снижает чрезмерную агрегацию тромбоцитов.
Хотя плазмаферез значительно снизил смертность от ТТП, это все еще потенциально летальное заболевание [9].]; поэтому необходимо избегать любой терапевтической задержки. Экссудативная отслойка сетчатки может быть первым проявлением ТТП, и об этом должны знать офтальмологи.
Заявление об этике
У авторов нет этических конфликтов, о которых следует сообщать.
Заявление о раскрытии информации
Авторы заявляют об отсутствии конфликта интересов.
Эта статья находится под лицензией Creative Commons Attribution-NonCommercial 4.0 International License (CC BY-NC). Использование и распространение в коммерческих целях требует письменного разрешения. Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений.


 Консультативная амбулаторная психотерапевтическая помощь» (в составе лечебно-оздоровительного центра «Гармония»)
Консультативная амбулаторная психотерапевтическая помощь» (в составе лечебно-оздоровительного центра «Гармония»)