Оценка боли по ваш: Визуально-аналоговая шкала для боли в анестезиологии и реаниматологии
Оценка боли в суставах у подростков с ювенильным артритом | Шелепина
1. <div><p>Боль и аналгезия. Рук. для практикующих)врачей. Под ред. А. А Бунятян., Е. Л. Насонова., В. В. Никода. М., ООО “Литтерра ”, 2004, 16-9, 30-2, 38-43, 45-8.</p><p>М. Л. Кукушкин, Н. К. Хитров. Общая патология боли. Рук. для врачей М., Медицина, 2004, 58-61, 106-7.</p><p>В. Л. Голубев. Боль-междисциплинарная проблема. РМЖ, 2008, 1382-4368, 3-6.</p><p>J. A. Hunfeld, J. Passchier. Боль и оценка степени боли у детей. РМЖ, 1997, 5, 7, 419-24.</p><p>А. Б. Данилов. Страдание и хроническая боль. РМЖ, 2008, 7-10.</p><p>Г. М. Дюкова. Лечение хронических болевых синдромов и депрессии. Справочник поликлинического врача, 12, 2007, 54-8.</p><p>W. A. Katz. Musculoskeletal pain and its socioeconomic implications. Clin. Rheum., 2002, l 21, suppl, 1, 2-5.
 </p><p>P. N. Malleson, D. A. Cabral, RossE. Petty, Predictors of pain in children with established Juvenile Rheumatoid Arthritis. Arthritis Rheum., 2004, 51, 2, 15, 222-7.</p><p>Consolaro, R. Vitale, A. Pistorio et al. Physicians’ and parents‘ ratings of inactive disease are frequent — by discordant in Juvenile Idiopathic Arthritis. J. Rheamtol., 2007, 34, 4, 1773-77.</p><p>Н. Г. Правдюк. Клинико-инструментальная характеристика дорсопатий у лиц молодого возраста. Автореф. дисс к. м. н., М., 2007.</p><p>Н. С. Крыжановская. Особенности клинико-психологических взаимоотношений при ревматоидном артрите. Автореф. дисс к. м. н. М., 2000.</p></div><br />
</p><p>P. N. Malleson, D. A. Cabral, RossE. Petty, Predictors of pain in children with established Juvenile Rheumatoid Arthritis. Arthritis Rheum., 2004, 51, 2, 15, 222-7.</p><p>Consolaro, R. Vitale, A. Pistorio et al. Physicians’ and parents‘ ratings of inactive disease are frequent — by discordant in Juvenile Idiopathic Arthritis. J. Rheamtol., 2007, 34, 4, 1773-77.</p><p>Н. Г. Правдюк. Клинико-инструментальная характеристика дорсопатий у лиц молодого возраста. Автореф. дисс к. м. н., М., 2007.</p><p>Н. С. Крыжановская. Особенности клинико-психологических взаимоотношений при ревматоидном артрите. Автореф. дисс к. м. н. М., 2000.</p></div><br />СРАВНИТЕЛЬНАЯ ОЦЕНКА БОЛИ И КАЧЕСТВА ЖИЗНИ У ПАЦИЕНТОВ ПОСЛЕ ОТКРЫТОЙ И ВИДЕОАССИСТИРОВАННОЙ ЛОБЭКТОМИИ ПО ПОВОДУ РАКА ЛЕГКОГО | Юрин
 Климиашвили А. Д., Веденина И. В. Болевой синдром и его лечение в хирургической клинике // РМЖ. ‒ 2013. ‒ № 15. ‒ С. 821.
Климиашвили А. Д., Веденина И. В. Болевой синдром и его лечение в хирургической клинике // РМЖ. ‒ 2013. ‒ № 15. ‒ С. 821.2. Логвиненко В. В., Шень Н. П., Ляшенко А. Н. и др. О связи психотипа личности, послеоперационной боли и качества течения ближайшего послеоперационного периода в травматологии и ортопедии // Регионарная анестезия и лечение острой боли. ‒ 2013. ‒ № 2. ‒ С. 23‒27.
3. Новик А. А. Ионова Т. И. Руководство по исследованию качества жизни в медицине. ‒ М.: ОЛМА Медиагрупп, 2007. – 314 с.
4. Решетняк В. К., Кукушкин М. Л. Современные представления о физиологической и патологической боли // Патогенез. ‒ 2015. ‒ Т. 13, № 1. ‒ С. 4‒17.
5. Сахапова Г. Ф., Герасимова Л. П., Кабирова М. Ф. Оценка стоматологического статуса и качества жизни пациентов с множественной миеломой в зависимости от длительности основного заболевания // Медицинский вестник Башкортостана. ‒ 2011. – № 5. ‒ С. 59‒61.
П., Кабирова М. Ф. Оценка стоматологического статуса и качества жизни пациентов с множественной миеломой в зависимости от длительности основного заболевания // Медицинский вестник Башкортостана. ‒ 2011. – № 5. ‒ С. 59‒61.
6. Тимербаев В. Х., Лесник В. Ю., Генов П. Г. Хронический болевой синдром после операций на грудной клетке // Регионарная анестезия и лечение острой боли. ‒ 2014. ‒ Т. 7, № 1. – С. 14‒20.
7. Шишкова Ю. А., Мотовилин О. Г., Суркова Е. В. и др. Качество жизни при сахарном диабете: определение понятия, современные подходы к оценке, инструменты для исследования // Сахарный диабет. ‒ 2011. ‒ № 3. ‒ С. 70‒75.
8. Штевнина Ю. И., Швырёв С. Л., Зарубина Т. В. Технология автоматизированной оценки качества жизни больных онкологического профиля в ходе стационарного лечения // Врач и информационные технологии. ‒ 2011. ‒ № 1. ‒ С. 65‒73.
‒ 2011. ‒ № 1. ‒ С. 65‒73.
9. Aaronson N. K., Ahmedzai S., Bergman B. et al. The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology // J. Natl. Cancer Inst. – 1993. – Vol. 85 (5). ‒ P. 365‒376.
10. Aitken R. C. Measurement of feelings using visual analogue scales // Proceedings of the Royal Society of Medicine. ‒ 1969. ‒ Vol. 62. ‒ P. 989–993.
11. Benedetti F., Vighetti S., Ricco C. et al. Neurophysiologic assessment of nerve impairment in posterolateral and muscle-sparing thoracotomy // J. Thorac. Cardiovasc. Surg. ‒ 1998. ‒ Vol. 115 (4). ‒ P. 841–847.
12. Bendixen M., Jorgensen O. D., Kronborg C. Postoperative pain and quality of life after lobectomy via video-assisted thoracoscopic surgery or anterolateral thoracotomy for early stage lung cancer: a randomised controlled trial // Lancet Oncol. ‒ 2016. ‒ Vol. 17 (6). ‒ P. 836‒844.
D., Kronborg C. Postoperative pain and quality of life after lobectomy via video-assisted thoracoscopic surgery or anterolateral thoracotomy for early stage lung cancer: a randomised controlled trial // Lancet Oncol. ‒ 2016. ‒ Vol. 17 (6). ‒ P. 836‒844.
13. Bergman B., Aaronson N. K., Ahmedzai S. et al. The EORTC QLQ-LC13: a modular supplement to the EORTC Core Quality of Life Questionnaire (QLQ-C30) for use in lung cancer clinical trials. EORTC Study Group on Quality of Life // Eur. J. Cancer. ‒ 1994. ‒ Vol. 30A (5). ‒ P. 635‒642.
14. Bieri D., Reeve R. A., Champion G. D. et al. The Faces Pain Scale for the self-assessment of the severity of pain experienced by children: development, initial validation, and preliminary investigation for ratio scale properties // Pain. – 1990. – Vol. 41 (2). – P. 139‒150.
15. Fayers P., Aaronson N. K., Bjordal K. et al. EORTC QLQ-C30 Scoring Manual (Third edition) / Brussels: EORTC Quality of Life Group, 2001. – P. 86.
Fayers P., Aaronson N. K., Bjordal K. et al. EORTC QLQ-C30 Scoring Manual (Third edition) / Brussels: EORTC Quality of Life Group, 2001. – P. 86.
16. Fayers P. M. Interpreting quality of life data: population-based reference data for the EORTC QLQ-C30 // Eur. J. Cancer. – 2001. – Vol. 37 (11). – P. 1331‒1334.
17. Frank A. J., Moll J. M., Hort J. F. A comparison of three ways of measuring pain. // Rheumatol. Rehabil. ‒ 1982. ‒ Vol. 21 (4). – P. 211‒217.
18. Guastella V., Mick G., Soriano C. et al. A prospective study of neuropathic pain induced by thoracotomy: Incidence, clinical description and diagnosis // Pain. – 2011. – Vol. 152 (1). ‒ P. 74–81.
19. Hicks C. L., von Baeyer C.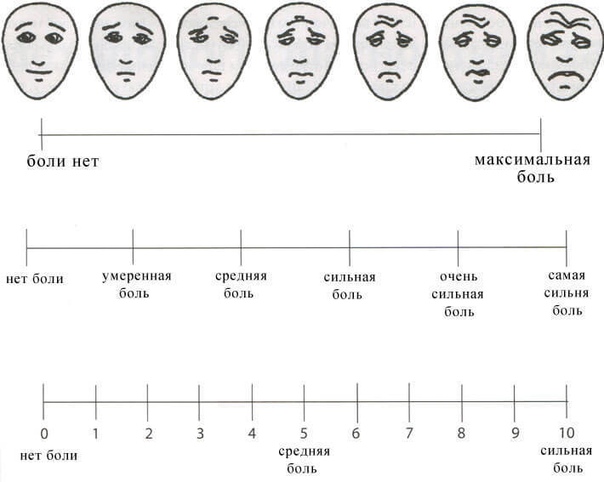 L., Spafford P. A. The Faces Pain Scale-Revised: toward a common metric in pediatric pain measurement // Pain. ‒ 2001. ‒ Vol. 93 (2). ‒ P. 173‒183.
L., Spafford P. A. The Faces Pain Scale-Revised: toward a common metric in pediatric pain measurement // Pain. ‒ 2001. ‒ Vol. 93 (2). ‒ P. 173‒183.
21. Kampe S., Geismann B., Weinreich G. et al. The influence of type of anesthesia, perioperative pain, and preoperative health status on chronic pain six months after thoracotomy ‒ a prospective cohort study // Pain Med. – 2016. – Vol. 0. – P. 1‒6. doi: 10.1093/pm/pnw230.
22. King M. T. The interpretation of scores from the EORTC quality of life questionnaire QLQ-C30 / Quality of Life Research, 1996. – Vol. 5. – P. 555‒567.
23. Landreneau R. , Mack M., Hazelrigg S. et al. Prevalence of chronic pain after pulmonary resection by thoracotomy or video-assisted thoracic surgery // J. Thorac. Cardiovasc. Surg. ‒ 1994. ‒ Vol. 107 (4). ‒ P. 1079‒1085.
, Mack M., Hazelrigg S. et al. Prevalence of chronic pain after pulmonary resection by thoracotomy or video-assisted thoracic surgery // J. Thorac. Cardiovasc. Surg. ‒ 1994. ‒ Vol. 107 (4). ‒ P. 1079‒1085.
24. Maguire M., Latter J., Mahajan R. et al. A study exploring the role of intercostal nerve damage in chronic pain after thoracic surgery // Eur. J. Cardiothorac. Surg. ‒ 2006. ‒ Vol. 29 (6). – P. 873–879.
25. Melzack R. The McGill Pain Questionnaire: major properties and scoring methods // Pain. ‒ 1975. ‒ Vol. 1 (3). – P. 277‒299.
26. Miyazaki T., Sakai T., Tsuchiya T. et al. Assessment and follow-up of intercostal nerve damage after video-assisted thoracic surgery // Eur. J. Cardiothorac. Surg. ‒ 2011. ‒ Vol. 39 (6). ‒ P. 1033‒1039.
 Ohnhaus E. E., Adler R. Methodological problems in the measurement of pain: a comparison between the verbal rating scale and the visual analogue scale // Pain. ‒ 1975. ‒ Vol. 1 (4). ‒ P. 379‒384.
Ohnhaus E. E., Adler R. Methodological problems in the measurement of pain: a comparison between the verbal rating scale and the visual analogue scale // Pain. ‒ 1975. ‒ Vol. 1 (4). ‒ P. 379‒384.28. Rizk N. P., Ghanie A., Hsu M. et al. A prospective trial comparing pain and quality of life measures after anatomic lung resection using thoracoscopy or thoracotomy // Ann Thorac Surg. – 2014. – Vol. 98 (4). – P. 1160‒1166.
29. Rogers M., Henderson L., Mahajan R. et. al. Preliminary the neurophysiological assessment of intercostal nerve injury thoracotomy // Eur. J. Cardiothorac Surg. ‒ 2002. ‒ Vol. 21 (2). – P. 298–301.
30. Snoek F. J. Quality of life: A closer look at measuring patients’ well-being // diabetes spectrum. – 2000. – № 13. – P. 24–28.
31. Walker S. R., Rosser R. M. Quality of Life: Assessment and Application / CMR Workshop, Lancaster, England: MTP Press Ltd. 1987.
Walker S. R., Rosser R. M. Quality of Life: Assessment and Application / CMR Workshop, Lancaster, England: MTP Press Ltd. 1987.
32. Ware J. E., Kosinski M. SF-36 Physical and Mental Health Summary Scales: A Manual for Users of Version 1, Second edition // Lincoln, RI: QualityMetric. ‒ 2001. – P. 237
Влияние гендерных различий на интенсивность острого болевого синдрома после септопластики*
Исследован острый болевой синдром в раннем периоде после септопластики хрящевого отдела перегородки носа. Показано, что интенсивность боли у женщин достоверно выше, чем у мужчин (p < 0,01). Установлено, что гендерный признак можно использовать как предиктор интенсивности боли при септопластике.
Рис. 1. Шкалы оценки интенсивности боли: ВАШ (А), ЦРШ (Б), ВШМ (В)
Рис.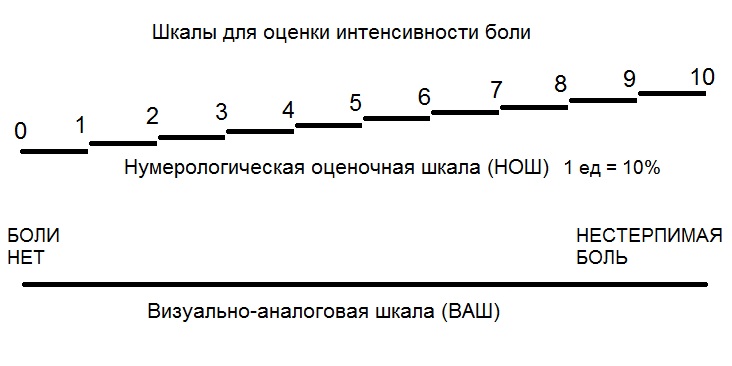 2. Интенсивность острого болевого синдрома у пациентов обоего пола после септопластики в раннем постоперационном периоде, согласно средним значениям трех шкал
2. Интенсивность острого болевого синдрома у пациентов обоего пола после септопластики в раннем постоперационном периоде, согласно средним значениям трех шкал
Рис. 3. Интенсивность острого болевого синдрома у пациентов обоего пола по шкалам ВАШ (А), ЦРШ (Б), ВШМ (В)
Средние значения боли в подгруппах по разным шкалам, мм
Рис. 4. Линейная регрессия сравнения результатов по ВАШ, ВШМ и ЦРШ у мужчин (А, Б) и женщин (В, Г)
Введение
Вопросы диагностики болевого синдрома активно изучались в таких областях медицины, как абдоминальная хирургия, травматология, ортопедия [1–5]. В последнее время назрела необходимость изучения данного аспекта в оториноларингологии, в частности хирургии полости носа [6–10].
Интенсивность болевого синдрома у пациентов различна.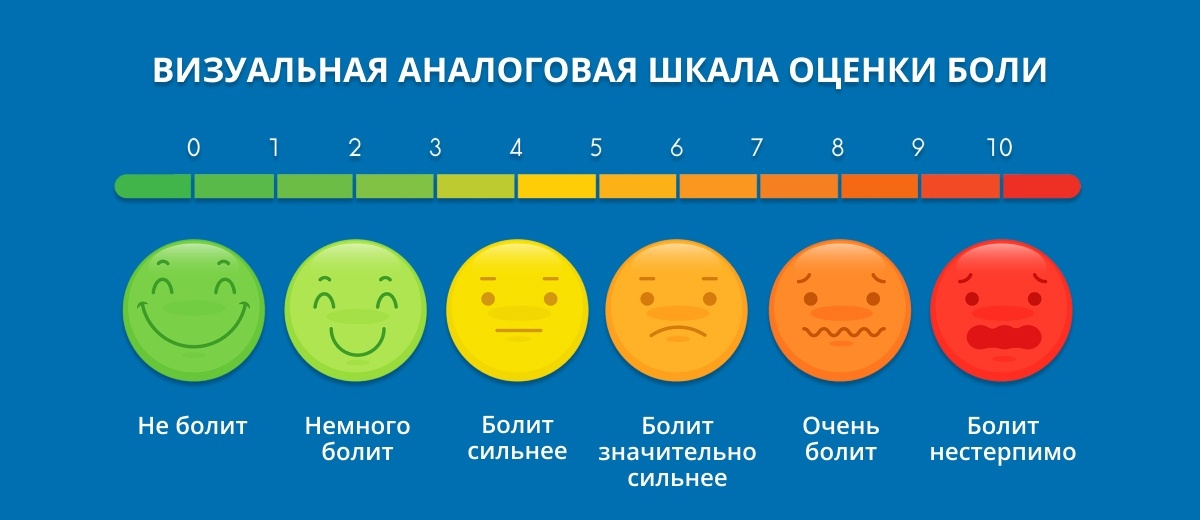 Она зависит от множества факторов и нередко носит субъективный характер [11]. К факторам, предопределяющим отношение человека к боли, можно отнести возраст, социокультурные особенности, пол [12, 13].
Она зависит от множества факторов и нередко носит субъективный характер [11]. К факторам, предопределяющим отношение человека к боли, можно отнести возраст, социокультурные особенности, пол [12, 13].
Как известно, женщины по сравнению с мужчинами более чувствительны к болезненным стимулам и воспринимают боль намного серьезнее и чаще [13]. Принимая во внимание фактор пола, объективно оценить «среднюю» боль в группе пациентов обоего пола достаточно сложно. Однако индивидуальная оценка боли конкретным пациентом важнее, чем совокупная оценка болевых ощущений несколькими больными.
Стандартными методами измерения выраженности боли являются аналоговые шкалы – визуальная аналоговая (ВАШ) [8, 14, 15], цифровая рейтинговая (ЦРШ) [16–18], Мак-Гилла [19, 20] и др. Используется также шкала Лайкерта для оценки назальных симптомов (образование корок, кровотечение, чихание, секреция, заложенность носа, боль) [21]. В ринологии для оценки интенсивности боли, степени дискомфорта во время передней тампонады носа применяют в основном ВАШ [10, 22], иногда ЦРШ [23].
Однако попытки использовать другие модификации аналоговых шкал с целью лучшей диагностики острой боли после септопластики практически не предпринимаются.
Трудно переоценить значение диагностики интенсивности испытываемой пациентами боли после септопластики. Так, пациентам с показателем боли по ВАШ от 0 до 29 баллов рекомендуется применять один из препаратов, включенный в так называемую анальгетическую лестницу (например, нестероидные противовоспалительные препараты). Пациентам с уровнем боли по ВАШ от 30 до 59 баллов назначают от одного до двух анальгетиков из перечня «лестницы», а именно слабые опиоиды (трамадол, кодеин, дигидрокодеин). При боли от 60 до 100 баллов по ВАШ рекомендуют три обезболивающих препарата из «лестницы» – сильные опиоиды (морфин, фентанил, бупренорфин, метадон) [24]. В клинической практике оценка анальгетической эффективности такой терапии также имеет значение.
На современном этапе изучения болевого синдрома в оториноларингологии отсутствуют какие-либо полноценные данные о распределении пациентов по интенсивности боли, недостаточно сравнительных данных в отношении фактора пола при септопластике.
Целью нашего исследования стало выявление особенностей распределения по интенсивности острого болевого синдрома у мужчин и женщин после септопластики.
Материал и методы
Острый болевой синдром изучали у пациентов с искривлением перегородки носа после проведенной септопластики. Было прооперировано 46 мужчин в возрасте от 16 до 44 лет и 36 женщин от 20 до 37 лет. Септопластику проводили под местной аппликационной анестезией 2%-ным раствором лидокаина и инфильтрационной анестезией 5%-ным раствором прокаина. В исследовании участвовали только те пациенты, которым проводилась пластика исключительно хрящевого отдела перегородки носа. Известно, что размер операционного поля и заинтересованность вегетативных структур в хрящевом отделе при данном виде хирургического вмешательства влияют на интенсивность послеоперационного болевого синдрома [25].
После операции выполняли переднюю тампонаду носа марлевыми тампонами, пропитанными антибактериальной мазью Левомеколь.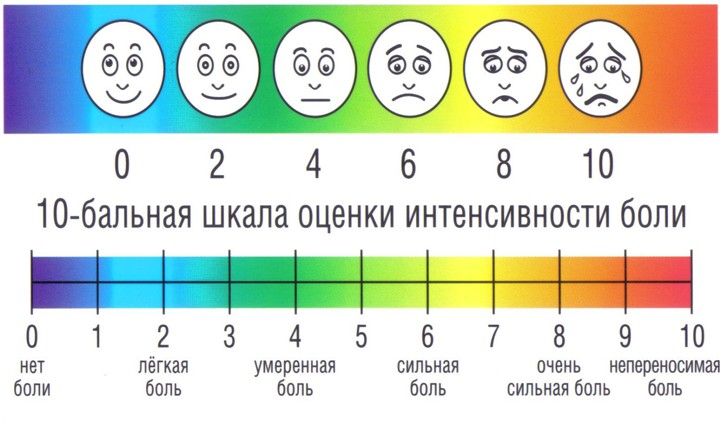
Выраженность болевого синдрома оценивали по трем аналоговым шкалам (ВАШ [8], ЦРШ [26] и вербальной шкале-«молнии» (ВШМ)) (рис. 1). Интенсивность боли фиксировалась пациентами через два часа после окончания хирургического вмешательства и измерялась в миллиметрах [6]. Были использованы варианты шкал [27] в собственной модификации (рис. 1). В зависимости от результатов оценки боли пациенты были разделены на подгруппы – со слабой болью (ее отсутствием) (0–25 мм), болью средней силы (26–50 мм), сильной болью (51–75 мм) и очень сильной болью (76–100 мм). Предложенная нами ВШМ в отличие от распространенных аналоговых шкал не имеет прямолинейной направленности и содержит расширенный набор вербальных характеристик боли (рис. 1). Результаты по ВШМ сравнивали с таковыми по ВАШ и ЦРШ: оценивали средние значения по шкалам в подгруппах по интенсивности болевого синдрома по Стьюденту, а также линейную регрессию этих результатов.
Результаты
Исходя из средних значений аналоговых шкал, спустя два часа после септопластики боль отсутствовала или была незначительной у 39,1% мужчин, болевой синдром средней интенсивности наблюдался у 39,1%, сильная боль – у 21,7%. Очень сильной боли не зафиксировано ни в одном случае (рис. 2).
Очень сильной боли не зафиксировано ни в одном случае (рис. 2).
Среди женщин сильную боль отмечали 8,3%, сильный болевой синдром – 33,3%, боль в области носа средней силы – 47,2%. В отличие от мужчин только 11,1% женщин не испытали боли или она была очень слабой в первые часы после операции (рис. 2).
При сравнении распределения пациентов обоего пола по выраженности острого болевого синдрома, согласно результатам оценки по отдельным шкалам, достоверных различий не выявлено. Так, слабую боль или ее отсутствие по ВАШ, ЦРШ и ВШМ отмечали 43,5, 47,8 и 43,5% мужчин соответственно (рис. 3), боль средней интенсивности – 34,8, 30,4 и 26,1%, сильную боль – 17,4, 21,7 и 26,1%, очень сильную – 4,3, 0 и 4,4% мужчин. Слабую боль или ее отсутствие по ВАШ, ЦРШ и ВШМ испытывали 25,0, 22,2 и 11,1% женщин соответственно, болевой синдром средней степени выраженности – 36,1, 41,7 и 44,4%, сильный болевой синдром – 30,6, 27,8 и 30,6% женщин (рис. 3). В отличие от мужчин большинство женщин жаловались на очень сильную боль. Так, по ВАШ и ЦРШ очень сильная боль имела место в 8,3% случаев, по ВШМ – в 13,9%.
Так, по ВАШ и ЦРШ очень сильная боль имела место в 8,3% случаев, по ВШМ – в 13,9%.
При распределении обеих групп на подгруппы по критерию интенсивности боли оказалось, что у женщин в подгруппе с минимальной болью (ее отсутствием) средние результаты по ЦРШ достоверно выше значений по ВШМ (20,0 ± 5,7 мм против 14,25 ± 10,2 мм) (р
Анализ линейной регрессии данных по шкалам показал, что у мужчин величина достоверности аппроксимации между ВАШ и ВШМ – 0,84 (рис. 4А), между ЦРШ и ВШМ – 0,85 (рис. 4Б), у женщин – 0,83 и 0,81 соответственно (рис. 4 (В, Г)). Чувствительность по ВШМ среди женщин составила 80%, специфичность – 82%, среди мужчин – 83 и 93% соответственно.
Результаты и обсуждение
У пациентов обеих групп использовались марлевые тампоны для передней тампонады полости носа. Носовые тампоны, устанавливаемые после септопластики, теоретически снижают риск послеоперационных осложнений, таких как кровотечения, гематомы, формирование синехий. Тем не менее доказательств, демонстрирующих явные преимущества носовых тампонов после септопластики, немного [28]. Послеоперационная тампонада полости носа обычно вызывает дискомфорт, боль, инфекционные осложнения, а также заложенность носа, которые могут ухудшить другие, как правило сопутствующие искривлению перегородки носа, состояния, такие как обструктивное апноэ сна. Дополнительным теоретическим риском, связанным с тампонадой носа, является смещение тампона, а также последующая аспирация.
Тем не менее доказательств, демонстрирующих явные преимущества носовых тампонов после септопластики, немного [28]. Послеоперационная тампонада полости носа обычно вызывает дискомфорт, боль, инфекционные осложнения, а также заложенность носа, которые могут ухудшить другие, как правило сопутствующие искривлению перегородки носа, состояния, такие как обструктивное апноэ сна. Дополнительным теоретическим риском, связанным с тампонадой носа, является смещение тампона, а также последующая аспирация.
В рандомизированном контролируемом исследовании сравнивали транссептальные лоскутные швы и носовые тампоны: у пациентов, которым накладывали швы, отмечалось значительно меньше послеоперационных симптомов, включая боль и дискомфорт [29]. Кроме того, систематический обзор семи рандомизированных контролируемых исследований с участием 869 пациентов, в которых сравнивали септальные швы и переднюю тампонаду носа, показал, что интенсивность боли в носу и головной боли значительно ниже в группе септальных швов. В то же время послеоперационные осложнения, в том числе кровотечения, гематома перегородки носа, образование синехий, перфорация и местные инфекционные осложнения, существенно не отличались между двумя группами [22]. На основании этих данных можно сделать вывод, что септальные швы способны свести к нулю необходимость в передней тампонаде носа после септопластики и тем самым помочь избежать боли и дискомфорта, а также снизить послеоперационные риски [30].
В то же время послеоперационные осложнения, в том числе кровотечения, гематома перегородки носа, образование синехий, перфорация и местные инфекционные осложнения, существенно не отличались между двумя группами [22]. На основании этих данных можно сделать вывод, что септальные швы способны свести к нулю необходимость в передней тампонаде носа после септопластики и тем самым помочь избежать боли и дискомфорта, а также снизить послеоперационные риски [30].
В нашем исследовании каких-либо осложнений на фоне тампонады (три дня) не зарегистрировано. Однако не исключено, что выраженность болевого синдрома была также обусловлена наличием тампонов в полости носа.
Большинство мужчин распределилось в подгруппы с минимальной и средней болью, женщин – со средней и сильной. Результаты оценки боли в среднем по подгруппам составили: у мужчин со слабой болью – 14,03 ± 8,7 мм, со средней болью – 38,03 ± 8,5 мм, у женщин со средней интенсивностью боли – 36,2 ± 8,99 мм, с сильной – 58,9 ± 12,8 мм.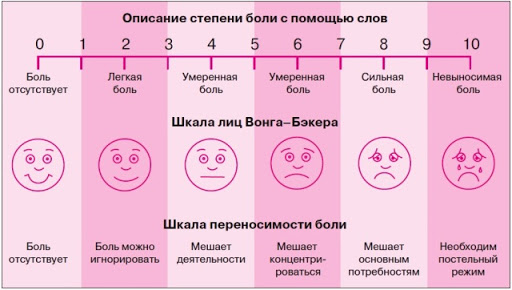
В исследованиях D. Malki и соавт., а также I. Cukurova и соавт. выраженность боли по десятибалльной шкале при передней тампонаде носа в первый день после септопластики составила 2,2 и 4,8 соответственно [31, 32]. Авторы использовали ВАШ. Тем не менее в названных исследованиях не выявлено статистически значимой разницы в интенсивности боли при сравнении передней тампонады носа, септальных швов и сплинтов.
M.S. Awan и M. Iqbal [33] сравнивали интенсивность боли при тампонаде носа и септальных швах. При оценке боли сразу после операции не сообщалось о значении вероятности. Тем не менее авторы сделали вывод, что тампонада носа была связана с более сильной болью (7,32 из десяти).
J.A. Cook и соавт., а также M.M. Ardehali [34, 35] продемонстрировали, что передняя тампонада носа вызывает болевой синдром интенсивностью 5,0 и 4,8 (из десяти), что соответствует в нашем исследовании 50 и 48 мм соответственно.
В трех исследованиях интенсивность боли в первый день после септопластики при передней тампонаде носа составила 5,9, 6,09 и 4,1 соответственно [28, 36, 37].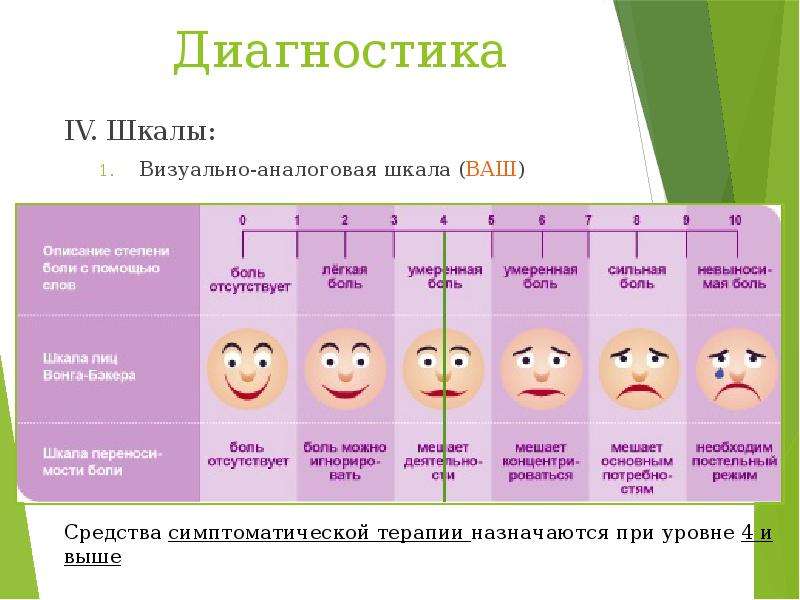
Практически во всех исследованиях авторы приходят к выводу, что тампонада носа вызывает сильный болевой синдром по сравнению с септальными швами или сплинтами [38].
При тампонаде полости носа после септопластики с помощью тампонов M.S. Yilmaz и соавт. [39] отмечали у пациентов интенсивность боли, равную 6,0 ± 2,21 условных единиц (из десяти), что соответствует 60 мм в нашем исследовании.
По данным A.K. Amin и соавт., в первый день после септопластики болевой синдром у пациентов с силиконовыми тампонами составил 27,0 ± 9,52 пункта из 100 [40].
Во всех исследованиях средние значения оценки боли существенно не отличались от данных нашего исследования.
Оценивая два ряда данных (в нашем случае результаты аналоговых шкал боли), использовать метод линейной регрессии для установления корреляции между двумя параметрами можно лишь тогда, когда данные удовлетворяют определенным условиям. Во-первых, точечный график одного параметра относительно другого показывает тенденцию к линейной зависимости параметров.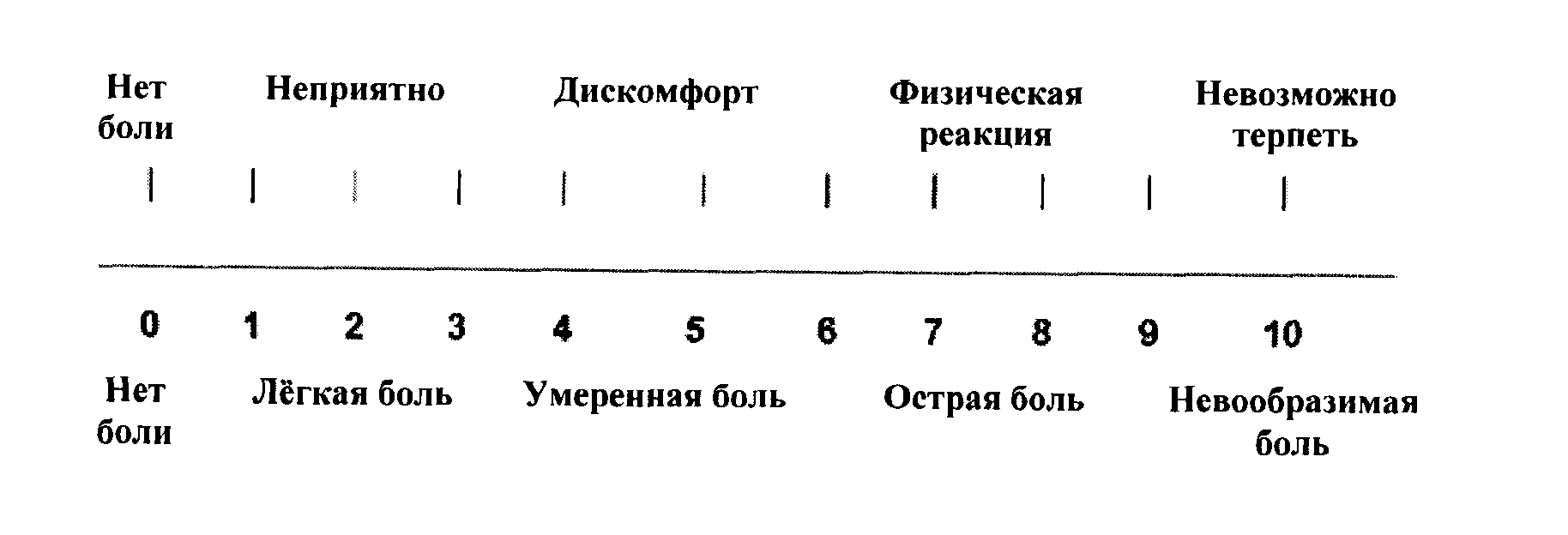 Во-вторых, разброс значений параметров относительно прямой регрессии равномерен по всей прямой. В-третьих, разность наблюдаемых и рассчитанных из регрессии величин имеет нормальное распределение. Наши данные соответствовали названным условиям [41].
Во-вторых, разброс значений параметров относительно прямой регрессии равномерен по всей прямой. В-третьих, разность наблюдаемых и рассчитанных из регрессии величин имеет нормальное распределение. Наши данные соответствовали названным условиям [41].
Интересно, что в нашем исследовании у женщин зарегистрирована более сильная боль по ЦРШ при слабой и сильной боли. По этой же шкале мужчины не испытывали очень сильной боли, в то время как по остальным шкалам такие ощущения были. Эти результаты подтверждаются данными M.A. Ferreira-Valente и соавт. Авторы, исследуя болевую чувствительность посредством холода, установили, что ЦРШ более чувствительна и специфична по отношению к полу, чем ВАШ и вербальная шкала [42]. Для женщин и мужчин вербальная оценка боли «больно, но терпимо» не означает одинаковый уровень боли. Это подтверждено в исследовании J.F.M. van Dijk и соавт. [43]: в отличие от мужчин женщины демонстрировали более высокие показатели боли по ЦРШ. Женщин, отметивших цифры 5, 6 и 7 на ЦРШ как «больно, но терпимо», было значительно больше, чем мужчин.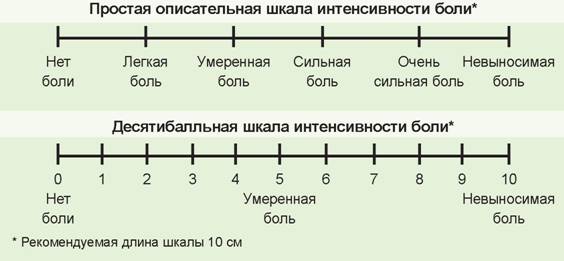 Женщины считали промежуточные оценки на ЦРШ как «терпимую боль». По мнению авторов, это следует учитывать при назначении лечения.
Женщины считали промежуточные оценки на ЦРШ как «терпимую боль». По мнению авторов, это следует учитывать при назначении лечения.
Гендерный фактор в аналгезии рассматривается в качестве предиктора боли. В ряде исследований выявлена положительная корреляция между женским полом и послеоперационным болевым синдромом [12, 44–46], а также между женским полом и количеством применяемого анальгетика в постоперационном периоде [11, 44]. Однако в исследовании Y.Y. Chia и соавт. продемонстрирована негативная связь между фактором пола и обезболиванием [47]. В то же время в трех исследованиях не установлено существенной корреляции между фактором пола и послеоперационной болью [48–50] и в одном – между фактором пола и потребностью в аналгезии [51].
По мнению H.Y. Ip и соавт., фактор пола не является предиктором послеоперационной боли, как принято считать [52]. L. Li и соавт. также не обнаружили статистически значимых различий между послеоперационной болью у женщин и мужчин [53]./7_u.jpg) Вместе с тем L. Gagliese и соавт. выявили более высокий статистически значимый уровень послеоперационной боли у пациенток, получавших пациент-контролируемую аналгезию [46]. J.D. Greenspan и соавт., а также K.J. Berkley исследовали это несоответствие как более сложное явление, проанализировав уровень боли, связанный с гендерными отличиями, вместе с анатомическими и гормональными различиями [54, 55]. Они пришли к выводу, что различия в болевой чувствительности невозможно точно предсказать.
Вместе с тем L. Gagliese и соавт. выявили более высокий статистически значимый уровень послеоперационной боли у пациенток, получавших пациент-контролируемую аналгезию [46]. J.D. Greenspan и соавт., а также K.J. Berkley исследовали это несоответствие как более сложное явление, проанализировав уровень боли, связанный с гендерными отличиями, вместе с анатомическими и гормональными различиями [54, 55]. Они пришли к выводу, что различия в болевой чувствительности невозможно точно предсказать.
Согласно нашим данным, при выполнении септопластики хрящевого отдела у женщин более сильное восприятие боли и она интенсивнее, чем у мужчин. Но эти сведения вряд ли стоит учитывать, если септопластика проводится в костном отделе. Дело в том, что в этой области расположен диффузный вегетативный ганглий Зазыбина, при интраоперационной заинтересованности которого возникают различные реакции со стороны вегетативной нервной системы [25]. Это предположение подтвердил G.S. Özler, исследовав группы с искривлением хрящевого и костного отделов перегородки носа. Пациенты обеих групп перенесли септопластику. Пациенты после септопластики в костном отделе на первый, третий и седьмой дни после операции испытывали более сильные болевые ощущения по сравнению с теми, кому проводили септопластику только в хрящевом отделе [7].
Пациенты обеих групп перенесли септопластику. Пациенты после септопластики в костном отделе на первый, третий и седьмой дни после операции испытывали более сильные болевые ощущения по сравнению с теми, кому проводили септопластику только в хрящевом отделе [7].
Очевидно, что фактор пола не может выступать самостоятельно в качестве предиктора послеоперационной боли или планирования постоперационной аналгезии. Данные о восприятии боли и потреблении болеутоляющих средств среди женщин и мужчин остаются предварительными, а возраст может служить фактором, затрудняющим прогнозирование болевых реакций. Механизм гендерных различий в болевом аспекте трудно уловим [56]. Существует ряд доказательств, что генетика влияет на межличностные различия в клинических и экспериментальных болевых реакциях [57]. Генетические механизмы также могут быть связаны с различными процессами социализации для мужчин и женщин, влияющими на телесный опыт и готовность к коммуникации в стрессовых ситуациях [46], колебания гормонов [58], нейромедиаторов, которые в свою очередь могут влиять на восприятие боли пациентом. При этом не исключены и фармакокинетические различия [57].
При этом не исключены и фармакокинетические различия [57].
Итак, существует ли корреляция между фактором пола и количеством применяемого анальгетика в постоперационном периоде? Каков характер боли при выполнении септопластики на протяжении перегородки носа? Зависит ли болевой синдром от пола пациента и типа тампонады? Ряд вопросов обезболивания в ринологии остается открытым.
Заключение
Результаты проведенного исследования показали, что интенсивность острого постоперационного болевого синдрома в раннем периоде после септопластики хрящевого отдела перегородки носа у женщин достоверно выше, чем у мужчин. Это позволяет рассматривать фактор пола как предиктор интенсивности боли при данном виде хирургического вмешательства и проводить соответствующее обезболивание. Применять ВАШ и ВШМ для диагностики интенсивности острой боли у пациентов после септопластики можно без ограничений независимо от пола. При использовании ЦРШ у пациентов после септопластики необходимо учитывать, что по этой шкале женщины отмечают более сильную боль, чем по ВАШ и ВШМ.
* Публикация подготовлена при поддержке Программы повышения конкурентоспособности РУДН «5–100».
Терапия боли (обезболивание)
Принципы лечения боли
1.Через рот (по возможности избегать инъекционные форма анальгетика).
2.По времени (прием анальгетика по графику, не дожидаясь появления боли).
3.По восходящей (согласно лестнице ВОЗ, назначение анальгетика производится от слабого к сильному, учитывая силу болевого синдрома.
4. Индивидуальный подбор дозы.
5. Внимание к деталям (назначение сопутствующих препаратов).
Лестница обезболивания ВОЗ
1 ступень- боль слабой интенсивности — ненаркотические анальгетики
Анальгин
Парацетамол
НПВС (ибупрофен, диклофенак, кетопрофен, кеторолак)
2 ступень – умеренная боль — слабые опиоиды
Трамадол
3 ступень – сильная боль — сильные опиоиды
Морфин
Омнопон
Бупренорфин
Фентанил
Что делать, если требуется наркотический анальгетик?
1. Пациент/доверенное лицо идет в поликлинику по месту фактического пребывания.
Пациент/доверенное лицо идет в поликлинику по месту фактического пребывания.
2. Медицинский работник осматривает пациента, выписывает рецепт (назначение наркотических средств осуществляется медицинским работником самостоятельно либо по решению врачебной комиссии, в случае принятия руководителем медицинской организации решения о необходимости согласования назначения с врачебной комиссией, рекомендаций онколога областного учреждения не требуется – Приказ № 1175н от 20.12.2012).
3.Списки пациентов поликлиникой передаются в ближайшую аптеку, имеющую лицензию на осуществление деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров.
4.Пациент или его представитель с рецептом, справкой — прикреплением и документом удостоверяющим личность, обращается в аптечное учреждение, имеющую лицензию на осуществление деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, к которому прикреплена медицинская организация, выписавшая рецепт.
5.Получение лекарственного средства в аптеке.
Внимание! При выраженном болевом синдроме, который не купируется обезболивающим средством, обезболивание осуществляется выездной бригадой скорой медицинской помощи (Приказ Минздрава России от 20.06.2013 № 388 н о порядке оказания скорой медицинской помощи).
Внимание! При невозможности адекватного подбора обезболивания в амбулаторных условиях его подбор в стационарных условиях осуществляется в отделении паллиативной помощи на базе ГОБУЗ «Областной клинический онкологический диспансер».
Кто направляет в отделение паллиативной помощи?
— врач онколог при наличии гистологического подтверждения злокачественного образования;
— врачебная комиссия медицинской организации, в которой проводится наблюдение и лечение пациента при отсутствии гистологического подтверждения онкологического заболевания;
— врач — терапевт или врач общей практики при наличии заключения врача — онколога об инкурабельности заболевания и необходимости обезболивающей терапии.
Отделение паллиативной помощи обеспечивается лекарственными средствами для обезболивания, имеет возможность выписки рецепта на наркотические и психотропные средства. Выдача на руки лекарственных препаратов на срок до 5 дней после выписки пациента из отделения осуществляется по решению руководителя медицинской организации.
Куда обратиться, если возникли трудности с назначением обезболивающего?
В рабочее дневное время для получения анальгезирующей терапии граждане могут обращаться в амбулаторно поликлинические учреждения Новгородской области. В ночное время, выходные и праздничные дни обезболивающая терапия доступна через скорую медицинскую помощь.
Контактные телефоны министерства здравоохранения Новгородской области:
(8 8162) 732-475 (по выписке рецепта) (только в рабочее время)
(8 8162) 732-511 (по отпуску из аптеки) (только в рабочее время)
Телефон главного внештатного специалиста по паллиативной помощи Новгородской области:
(8-8162)- 987-020
В нерабочее время обращаться по телефону:
(8-8162)-64-10-89 (центр медицины катастроф ГОБУЗ «НОКБ»)
Телефон «горячей линии» Минздрава РФ:
8-800-200-03-89
Нормативно-правовые акты, регламентирующие назначение наркотических средств
1. Постановление Правительства РФ от 30.06.1998г № 681 «Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ»
Постановление Правительства РФ от 30.06.1998г № 681 «Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ»
2. Приказ Министерства здравоохранения РФ от 20.12.2012 №1175 н (в редакции приказа Минздрава России от 02.12.2013 №886н )«Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения»
Список аптек
Кабинет головной боли (цефалголог) | Ставропольская краевая клиническая больница
Пациентам
Полезные ресурсы
Практические рекомендации по купированию головной боли и уменьшению количества приступов мигрени
Медицинский прибор Cefaly
Головная боль напряжения
Кластерная (пучковая) головная боль
Мигрень
Хроническая ежедневная головная боль
Лекарства, вызывающие головную боль
Видео и аудио
Кабинет головной боли заработал на Ставрополье
«Актуальное интервью». Лечение головной боли.
Лечение головной боли.
Головная боль: причины, диагностика, лечение. Интервью в эфире радио «Комсомольская правда».
Мнение доктора
Правильно ли вы пьёте таблетки?
О боли
Прибор Cefaly
Мигребот
Загадочная аура
Головная боль
Гипническая головная боль
Великие люди, страдающие мигренью
Абузусная головная боль
Головная боль или мигрень?
Прямо сейчас вы можете проверить, не является ли ваша головная боль мигренью.
Ответьте «да» или «нет» на следующие 3 вопроса. За последние 3 месяца сопровождалась ли ваша головная боль следующими симптомами:
- Тошнотой или рвотой
- Непереносимостью света и звуков
- Ограничивала ли головная боль вашу работоспособность учёбу или повседневные дела как минимум на один день?
Если вы ответили «да» как минимум на два вопроса, то с вероятностью 93% у вас может быть мигрень.
Что нужно знать врачу?
Независимо от того, имеется ли у Вас мигрень, другая первичная головная боль, или головная боль является проявлением какого-либо заболевания, врачу необходимо получить следующую информацию:
- Когда Ваши головные боли стали беспокоить Вас или оказывать существенное влияние на Вашу жизнь? (с подросткового возраста, после беременности, с прошлого лета, со вчерашнего дня?)
- Как часто возникают головные боли и как часто головная боль интенсивна настолько, что нарушает Вашу повседневную активность? Простейший дневник или календарь головной боли, который можно найти в соответствующем разделе информации для пациентов, несет незаменимые данные для врача.
 Попробуйте вести дневник в течение месяца до визита к врачу, затем принесите его на прием.
Попробуйте вести дневник в течение месяца до визита к врачу, затем принесите его на прием. - Каков характер Вашей головной боли? (типичная продолжительность приступа, характер боли – пульсирующий, сжимающий, стреляющий, локализация боли, другие симптомы — тошнота, повышенная чувствительность к свету, звукам, покраснение глаза, заложенность носа и др).
- За последнее время изменились ли характер и частота Вашей головной боли? Если да, то какие изменения произошли?
- Какие лекарственные средства Вы пробовали использовать как для снятия головной боли, так и для профилактики её возникновения? Ваша оценка эффективности предыдущего лечения. Какие лекарственные средства от головной боли Вы используете в настоящее время?
- Какие дополнительные исследования Вы проходили по поводу головной боли (компьютерная томография, магнитно-резонансная томография, ангиография и др)?
- Какие лекарственные средства от головной боли Вы используете в настоящее время? Как часто Вы принимаете средства от головной боли?
- Имеются ли у Вас другие хронические заболевания? Если да, то какие лекарственные средства Вы принимаете по поводу этого заболевания?
Анкеты, опросники, дневники
Оценка качества жизни при мигрени
Заполнить онлайн
Скачать
Оценка влияния мигрени на повседневную активность (MIDAS)
Заполнить онлайн
Скачать
Оценка влияния головной боли (HIT-6)
Заполнить онлайн
Скачать
Оценка терапии приступов мигрени
Заполнить онлайн
Скачать
Ответ на лечение головной боли (HART)
Заполнить онлайн
Скачать
Лидский опросник зависимости
Заполнить онлайн
Скачать
Время, потерянное из-за головной боли
Заполнить онлайн
Скачать
Анкета для оценки сопутствующих симптомов
Заполнить онлайн
Скачать
Госпитальная Шкала Тревоги и Депрессии (HADS)
Заполнить онлайн (оценка уровня тревоги)
Заполнить онлайн (оценка уровня депрессии)
Скачать
Дневник головной боли
Заполнить онлайн
Скачать
Дневник сопутствующих симптомов
Заполнить онлайн
Скачать
Нарушение качества жизни и функциональное состояние пациентов с неосложненным синдромом гипермобильности суставов
АБСТРАКТ
ВВЕДЕНИЕ
Проведение оценки функционального состояния и влияния состояния здоровья на качество жизни (quality of life, QoL), а также определение взаимосвязи между болью, функциональным состоянием и качеством жизни у пациентов с неосложненным синдромом гипермобильности суставов (ГМС).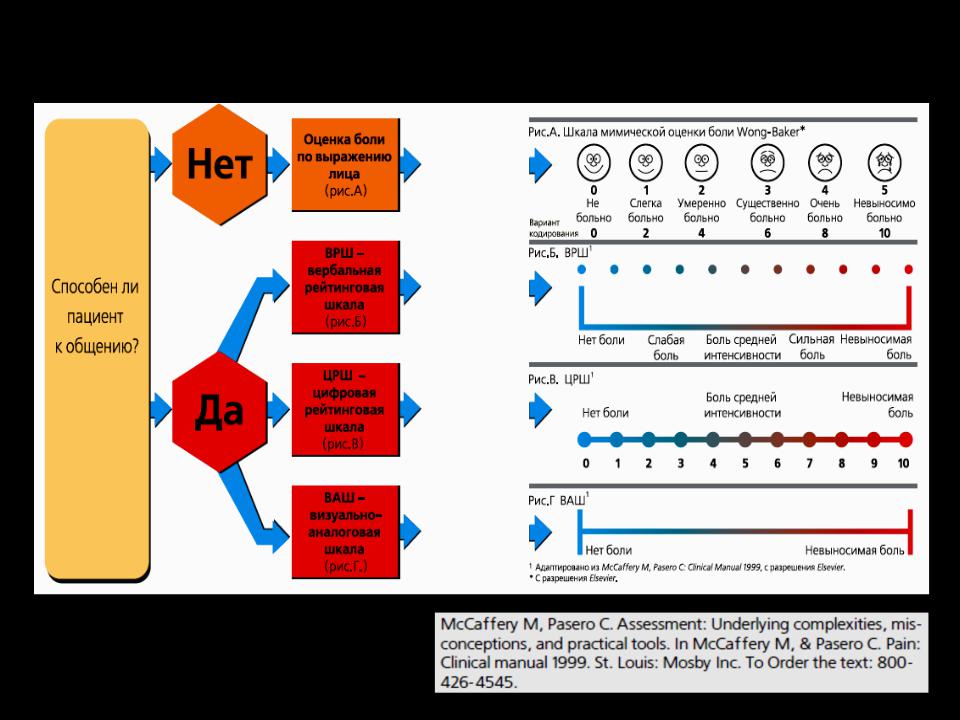
метод
В исследовании участвовали 36 пациентов и 31 здоровый доброволец в качестве контрольной группы. Производилась оценка демографических показателей, после чего пациенты проходили обследование на выявление неосложненного синдрома ГМС с применением шкалы Бэйтона и критериев Брайтона.
Оценка боли производилась по визуальной аналоговой шкале (ВАШ: 0–10 см). Функциональное состояние и качество жизни определялись по Стэнфордской анкете состояния здоровья (HAQ) и Ноттингемскому профилю здоровья (NHP) соответственно.
результат
Средний возраст участников исследования составлял 29,94 ± 6,04 года в группе пациентов и 30,16 ± 5,64 года в контрольной группе.
При сравнении двух групп наблюдались значительные различия результатов оценки по шкале HAQ. Также отмечалось значительное снижение качества жизни в группе пациентов по всем показателям NHP за исключением социальной изоляции. Отмечалась положительная корреляция между результатами оценки по шкале Бэйтона и результатами оценки эмоциональной реакции по NHP. Также мы выявили прямую корреляцию между результатами оценки по HAQ и визуальной аналоговой шкале боли (ВАШ), оценки боли по NHP и оценки физической мобильности по NHP в группе пациентов. По остальным параметрам корреляция не определялась.
Также отмечалось значительное снижение качества жизни в группе пациентов по всем показателям NHP за исключением социальной изоляции. Отмечалась положительная корреляция между результатами оценки по шкале Бэйтона и результатами оценки эмоциональной реакции по NHP. Также мы выявили прямую корреляцию между результатами оценки по HAQ и визуальной аналоговой шкале боли (ВАШ), оценки боли по NHP и оценки физической мобильности по NHP в группе пациентов. По остальным параметрам корреляция не определялась.
заключение
Данное исследование показало, что функциональное состояние и качество жизни значительно нарушаются у пациентов с неосложненным синдромом ГМС в сравнении со здоровыми добровольцами контрольной группы.
У пациентов с неосложненным синдромом ГМС следует производить оценку функционального состояния и качества жизни, а также оценку боли.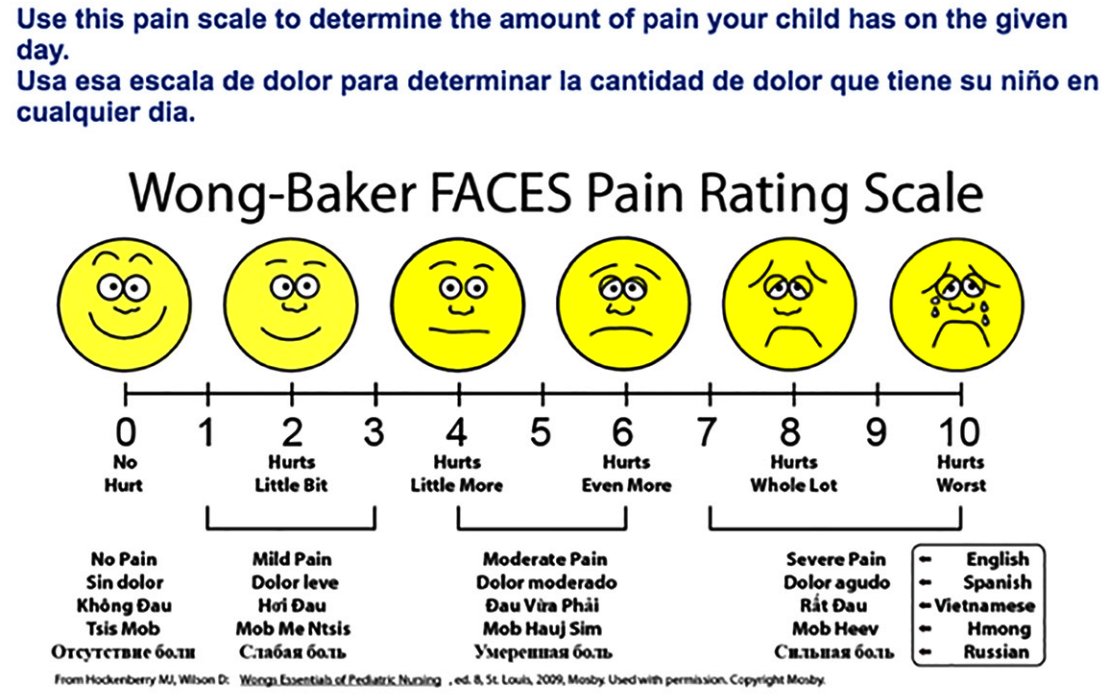 Кроме того, доброкачественный характер заболевания, традиционно приписываемый неосложненному синдрому ГМС, можно поставить под сомнение.
Кроме того, доброкачественный характер заболевания, традиционно приписываемый неосложненному синдрому ГМС, можно поставить под сомнение.
Оценка боли по ваш расшифровка. Измерение и контроль боли
… объективизация боли – одна из трудноразрешимых проблем в клинической практике врачей различных специальностей.
В настоящее время для оценки наличия, степени, и локализации боли в клинике используются (1) психологические , (2) психофизиологические и (3) нейрофизиологические методы. Большинство из них основаны на субъективной оценке своих ощущений самим пациентом.
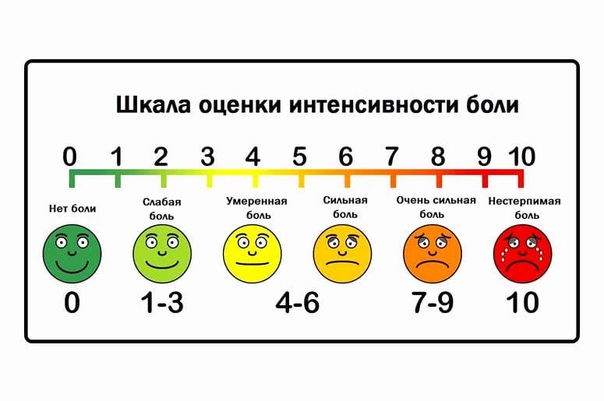
Наиболее простыми способами количественной характеристики боли являются ранговая шкала (Bonica J.J., 1990).
Числовая ранговая шкала состоит из последовательного ряда чисел от 0 до 10. Пациентам предлагается оценить свои болевые ощущения цифрами от 0 (нет боли) до 10 (максимально возможная боль). Пациенты легко обучаются пользованию этой шкалой. Шкала проста, наглядна и удобна при заполнении и может быть использована достаточно часто во время лечения. Это позволяет получить информацию о динамике боли: сопоставляя предыдущие и последующие показатели болевых ощущений, можно судить об эффективности проводимого лечения.
Шкала проста, наглядна и удобна при заполнении и может быть использована достаточно часто во время лечения. Это позволяет получить информацию о динамике боли: сопоставляя предыдущие и последующие показатели болевых ощущений, можно судить об эффективности проводимого лечения.
Вербальная ранговая шкала состоит из набора слов, характеризующих интенсивность болевых ощущений. Слова выстраиваются в ряд, отражающий степень нарастания боли, и последовательно нумеруются от меньшей тяжести к большей. Чаще всего используется следующий ряд дескрипторов: боли нет (0), слабая боль (1), умеренная боль (2), сильная боль (3), очень сильная (4) и нестерпимая (невыносимая) боль (5). Пациент выбирает слово, наиболее точно соответствующее его ощущениям. Шкала проста в использовании, адекватно отражает интенсивность боли у пациента и может быть использована для контроля за эффективностью обезболивания. Данные вербальной ранговой шкалы хорошо сопоставляются с результатами измерений интенсивности боли при помощи других шкал.
Визуальная аналоговая шкала (ВАШ) представляет собой прямую линию длиной 10 см, начало которой соответствует отсутствию боли – «боли нет». Конечная точка на шкале отражает мучительную невыносимую боль – «нестерпимая боль». Линия может быть как горизонтальной, так и вертикальной. Пациенту предлагается сделать на этой линии отметку, соответствующую интенсивности испытываемых им данный момент болей. Расстояние между началом линии («нет болей») и сделанной больным отметкой измеряют в сантиметрах и округляют до целого. Каждый сантиметр на визуальной аналоговой шкале соответствует 1 баллу. Как правило, все пациенты, в том числе и дети старше 5 лет, легко усваивают визуальную аналоговую шкалу и правильно пользуются ею.
Визуальная аналоговая шкала является достаточно чувствительным методом для количественной оценки боли, и данные, полученные при помощи ВАШ, хорошо коррелируют с другими методами измерения интенсивности боли.
Мак-Гилловский болевой опросник (McGill Pain Questionnaire). Боль является сложным, многомерным чувством, в котором одновременно отражена интенсивность боли, ее сенсорная и эмоциональная составляющая, поэтому при использовании одномерных ранговых шкал врач оценивает боль только количественно, не учитывая качественные особенности боли. В начале 70-х годов XX века Р. Мелзак разработал Мак-Гилловский болевой опросник, в котором все слова (дескрипторы), описывающие качественные особенности боли, разделены на 20 подклассов (Melzack R., 1975). Мак-Гилловский болевой опросник переведен на многие языки мира и доказал свою высокую эффективность в многомерной оценке боли.
Боль является сложным, многомерным чувством, в котором одновременно отражена интенсивность боли, ее сенсорная и эмоциональная составляющая, поэтому при использовании одномерных ранговых шкал врач оценивает боль только количественно, не учитывая качественные особенности боли. В начале 70-х годов XX века Р. Мелзак разработал Мак-Гилловский болевой опросник, в котором все слова (дескрипторы), описывающие качественные особенности боли, разделены на 20 подклассов (Melzack R., 1975). Мак-Гилловский болевой опросник переведен на многие языки мира и доказал свою высокую эффективность в многомерной оценке боли.
В нашей стране существует несколько версий опросника на русском языке, но наиболее удачным является вариант, подготовленный сотрудниками Российского государственного медицинского университета, МГУ им. М.В. Ломоносова и ЦИТО им. Н.Н. Приорова (Кузьменко В.В. и др., 1986), который приведен ниже.
МАК-ГИЛЛОВСКИЙ БОЛЕВОЙ ОПРОСНИК
Прочитайте, пожалуйста, все слова-определения и отметьте только те из них, которые наиболее точно характеризуют Вашу боль. Можно отметить только по одному слову в любом из 20 столбцов (строк), но не обязательно в каждом столбце (строке).
Можно отметить только по одному слову в любом из 20 столбцов (строк), но не обязательно в каждом столбце (строке).
Какими словами Вы можете описать свою боль? (сенсорная шкала)
(1) 1. пульсирующая, 2. схватывающая, 3. дергающая, 4. стягивающая, 5. колотящая, 6. долбящая.
(2) подобна: 1. электрическому разряду, 2. удару тока, 3. выстрелу.
(3) 1. колющая, 2. впивающаяся, 3 буравящая, 4. сверлящая, 5. пробивающая.
(4) 1. острая, 2. режущая, 3. полосующая.
(5) 1. давящая, 2. сжимающая, 3. щемящая, 4. стискивающая, 5. раздавливающая.
(6) 1. тянущая, 2. выкручивающая, 3. вырывающая.
(7) 1. горячая, 2. жгучая, 3. ошпаривающая, 4. палящая.
(8) 1. зудящая, 2. щиплющая, 3. разъедающая, 4. жалящая.
(9) 1. тупая, 2. ноющая, 3. мозжащая, 4. ломящая, 5. раскалывающая.
(10) 1. распирающая, 2. растягивающая, 3. раздирающая, 4. разрывающая.
(11) 1. разлитая, 2. распространяющаяся, 3. проникающая, 4. пронизывающая.
проникающая, 4. пронизывающая.
(12) 1. царапающая, 2. саднящая, 3. дерущая, 4. пилящая, 5. грызущая.
(13) 1. немая, 2. сводящая, 3. леденящая.
Какое чувство вызывает боль, какое воздействие оказывает на психику? (аффективная шкала)
(14) 1. утомляет, 2. изматывает.
(15) вызывает чувство: 1. тошноты, 2. удушья.
(16) вызывает чувство: 1. тревоги, 2. страха, 3. ужаса.
(17) 1. угнетает, 2. раздражает, 3. злит, 4. приводит в ярость, 5. приводит в отчаяние.
(18) 1. обессиливает, 2. ослепляет.
(19) 1. боль-помеха, 2. боль-досада, 3. боль-страдание, 4. боль-мучение, 5. боль-пытка.
Как Вы оцениваете свою боль? (эвалюативная шкала)
(20) 1. слабая, 2. умеренная, 3. сильная, 4. сильнейшая, 5. невыносимая.
Каждый подкласс составили слова, сходные по своему смысловому значению, но различающиеся по интенсивности передаваемого ими болевого ощущения. Подклассы образовали три основных класса: сенсорную шкалу, аффективную шкалу и эвалюативную (оценочную) шкалу. Дескрипторы сенсорной шкалы (1 – 13-й подклассы) характеризуют боль в терминах механического или термического воздействия, изменения пространственных или временных параметров. Аффективная шкала (14 – 19 подклассы) отражает эмоциональную сторону боли в терминах напряжения, страха, гнева или вегетативных проявлений. Эвалюативная шкала (20-й подкласс) состоит из 5 слов, выражающих субъективную оценку интенсивности боли пациентом.
Дескрипторы сенсорной шкалы (1 – 13-й подклассы) характеризуют боль в терминах механического или термического воздействия, изменения пространственных или временных параметров. Аффективная шкала (14 – 19 подклассы) отражает эмоциональную сторону боли в терминах напряжения, страха, гнева или вегетативных проявлений. Эвалюативная шкала (20-й подкласс) состоит из 5 слов, выражающих субъективную оценку интенсивности боли пациентом.
При заполнении опросника пациент выбирает слова, соответствующие его ощущениям в данный момент, в любом из 20 подклассов (не обязательно в каждом, но только одно слово в подклассе). Каждое выбранное слово имеет числовой показатель, соответствующий порядковому номеру слова в подклассе. Подсчет сводится к определению двух показателей: (1) индекса числа выбранных дескрипторов
, который представляет собой сумму выбранных слов, и (2) рангового индекса боли
– сумма порядковых номеров дескрипторов в субклассах. Оба показателя могут быть подсчитаны для сенсорной и аффективной шкал отдельно или вместе. Эвалюативная шкала по своей сути представляет вербальную ранговую шкалу, в которой выбранное слово соответствует определенному рангу. Полученные данные заносятся в таблицу и могут быть представлены в виде диаграммы.
Эвалюативная шкала по своей сути представляет вербальную ранговую шкалу, в которой выбранное слово соответствует определенному рангу. Полученные данные заносятся в таблицу и могут быть представлены в виде диаграммы.
Мак-Гилловский опросник позволяет охарактеризовать в динамике не только интенсивность боли, но и ее сенсорный и эмоциональный компоненты , что может быть использовано в дифференциальной диагностике заболеваний.
Возрастной фактор при оценке боли у детей . Дети в возрасте 8 лет и старше могут использоваться теми же визуально-аналоговые шкалами для оценки силы боли, что и взрослые, — такая шкала наносится на линейку, которую следует располагать горизонтально.
Для детей от 3 до 8 лет
при самооценке силы боли можно пользоваться либо мимическими шкалами (лица на фотографиях или рисунках выстроены в ряд, в котором постепенно усиливается мимика дистресса) или шкалы с цветовой аналогией (линейки с нарастающей яркостью красного цвета, обозначающего силу боли). Сообщалось о высокой степени сходства по параметрам силы боли, полученным с применением шкалы фотографических портретов и шкалы цветовой аналогии у детей в возрасте от 3 до 7 лет после операции.
Сообщалось о высокой степени сходства по параметрам силы боли, полученным с применением шкалы фотографических портретов и шкалы цветовой аналогии у детей в возрасте от 3 до 7 лет после операции.
Использование шкал наблюдения за поведением ребенка является основным методом оценки боли у новорожденных, грудных детей и у детей в возрасте от 1 до 4-х лет , а также у детей с нарушениями развития . В таких шкалах боль оценивается по выражению лица, двигательным реакциям со стороны конечностей и туловища, вербальным реакциям или по сочетанию поведенческих и вегетативных изменений. В некоторых подобных методиках термин «дистресс» отражает не только боль, но и страх, а также тревогу. Поведенческие шкалы могут преуменьшить интенсивность продолжительных болей, если сравнивать их результаты с методиками самооценки.
Во время проведения хирургических операций и в условиях интенсивной терапии целесообразно документировать физиологические реакции на боль, хотя эти реакции могут быть неспецифичными. Например, тахикардия может вызываться не только болью, но и гиповолемией или гипоксемией. Следовательно, (!!! ) трудно бывает оценить силу боли у новорожденных, грудных детей и у детей в возрасте от 1 до 4-х лет, а также у детей со значительными нарушениями развития
. Если клиническая картина не позволяет сделать определенных выводов, следует прибегнуть к применению мер, нивелирующих стресс, к которым относятся создание комфорта, питание и анальгезия, при этом по эффекту можно судить о причине дистресса.
Например, тахикардия может вызываться не только болью, но и гиповолемией или гипоксемией. Следовательно, (!!! ) трудно бывает оценить силу боли у новорожденных, грудных детей и у детей в возрасте от 1 до 4-х лет, а также у детей со значительными нарушениями развития
. Если клиническая картина не позволяет сделать определенных выводов, следует прибегнуть к применению мер, нивелирующих стресс, к которым относятся создание комфорта, питание и анальгезия, при этом по эффекту можно судить о причине дистресса.
Количественная оценка болевой чувствительности относится к интегративным показателям, отражающим общее состояние организма и его реакцию на физиологические или психоэмоциональные нагрузки, поэтому измерение порогов боли является весьма полезным методом в комплексном обследовании пациентов. За порог болевой чувствительности принимают то минимальное значение стимула, которое испытуемым воспринимается как болевое ощущение.
Порог болевой чувствительности определяется с помощью инструментальных методов, в которых в качестве раздражителей используются различные механические, термические или электрические стимулы (Василенко А. М., 1997). Порог болевой чувствительности выражается в (1) единицах силы стимула
при использовании методов с нарастающей его интенсивностью, либо в (2) единицах времени
при действии раздражителя с постоянной силой. Например, при измерении болевой чувствительности с помощью тензоалгометра, обеспечивающее постепенное увеличение давления на кожу, болевой порог выражается в единицах отношения силы давления к площади наконечника (кг/см2). При термоалгометрии с постоянной температурой термода порог болевой чувствительности выражается в секундах – время от начала воздействия до появления болевых ощущений.
М., 1997). Порог болевой чувствительности выражается в (1) единицах силы стимула
при использовании методов с нарастающей его интенсивностью, либо в (2) единицах времени
при действии раздражителя с постоянной силой. Например, при измерении болевой чувствительности с помощью тензоалгометра, обеспечивающее постепенное увеличение давления на кожу, болевой порог выражается в единицах отношения силы давления к площади наконечника (кг/см2). При термоалгометрии с постоянной температурой термода порог болевой чувствительности выражается в секундах – время от начала воздействия до появления болевых ощущений.
С помощью методов количественной оценки болевой чувствительности удается (1) обнаружить зоны гипералгезии при патологии внутренних органов, (2) триггерные точки при миофасциальных болевых синдромах, (3) контролировать эффективность действия анальгетиков, а в некоторых случаях (например, при психогенных болевых синдромах) (4) определять терапевтическую тактику.
Электрофизиологические методы . Для оценки болевой чувствительности пациентов и контроля эффективности обезболивания в клинических исследованиях используются также электрофизиологические методы. Наибольшее распространение получила методика регистрации ноцицептивного рефлекса отдергивания, или RIII-рефлекса.
Для оценки болевой чувствительности пациентов и контроля эффективности обезболивания в клинических исследованиях используются также электрофизиологические методы. Наибольшее распространение получила методика регистрации ноцицептивного рефлекса отдергивания, или RIII-рефлекса.
Ноцицептивный рефлекс отдергивания (НРО), или ноцицептивный флексорный рефлекс является типичным защитным рефлексом. впервые данный тип защитных рефлексов, возникающих как у животных, так и у человека в ответ на болевое раздражение, в 1910 году был описан Шеррингтоном и с 1960 года используется в клинике для объективизации боли (Kugekberg E. et al., 1960). Чаще всего регистрируют НРО в ответ на электростимуляцию n. suralis или плантарной поверхности стопы (Вейн А.М.,2001; Skljarevski V., Ramadan N.M., 2002). Вместе с тем НРО может регистрироваться при болевой стимуляции пальцев рук (Гнездилова А.В. и др., 1998) и даже при гетеросегментарном раздражении (Сыровегина А.В. и др., 2000).
При регистрации НРО выделяют два компонента в ЭМГ-активности – RII- и RIII-ответы. RII-ответ имеет латентный период 40 – 60 мс и его появление связывают с активацией толстых низкопороговых Аβ-волокон, в то время как RIII-ответ возникает с латентным периодом 90 – 130 мс при интенсивности раздражения, превышающей порог возбуждения тонких Аδ-волокон. Считается, что НРО является полисинаптическим, рефлекторная дуга которого замыкается на уровне спинного мозга.
RII-ответ имеет латентный период 40 – 60 мс и его появление связывают с активацией толстых низкопороговых Аβ-волокон, в то время как RIII-ответ возникает с латентным периодом 90 – 130 мс при интенсивности раздражения, превышающей порог возбуждения тонких Аδ-волокон. Считается, что НРО является полисинаптическим, рефлекторная дуга которого замыкается на уровне спинного мозга.
Однако существуют данные, указывающие на возможность вовлечения супраспинальных структур в механизмы возникновения НРО. Прямым подтверждением этого является исследования, в которых сравнивались особенности изменения НРО у интактных и спинальных крыс (Gozariu M. et al., 1997; Weng H.R., Schouenborg J., 2000). В первом исследовании авторы установили, что у интактных крыс сохранность супраспинальных механизмов контроля боли противодействует развитию увеличения амплитуды НРО в условиях длительной болевой стимуляции, в отличие от спинальных животных. Во второй работе приводятся доказательства увеличения тормозных реакций НРО при гетеротопических ноцицептивных стимулах в условиях спинализации животных.
Понимание факта вовлечения супраспинальных структур мозга в формирование НРО не только расширяет диагностические возможности метода, но и позволяет использовать его в клинике для объективной оценки выраженности болевого синдрома не только при гомотопической стимуляции, но и при гетеросегментарном болевом раздражении.
Метод экстероцептивной супрессии произвольной мышечной активности в m. masseter . Для изучения механизмов развития головных и лицевых болей в клинике также используется метод экстероцептивной супрессии произвольной мышечной активности в m. masseter (Вейн А.М. и др., 1999; Andersen O.K. et al., 1998; Godaux E., Desmendt J.E., 1975; Hansen P.O. et al., 1999). Данный метод по существу является разновидностью ноцицептивного рефлекса отдергивания.
Установлено, что периоральная электрическая стимуляция вызывает в тонической ЭМГ-активности жевательных мышц два последовательных периода торможения, обозначаемых как ES1 и ES2 (exteroceptive suppression). Ранний период торможения (ES1) возникает с латентностью 10 -15 мс, поздний (ES2) – имеет латентный период 25 – 55 мс.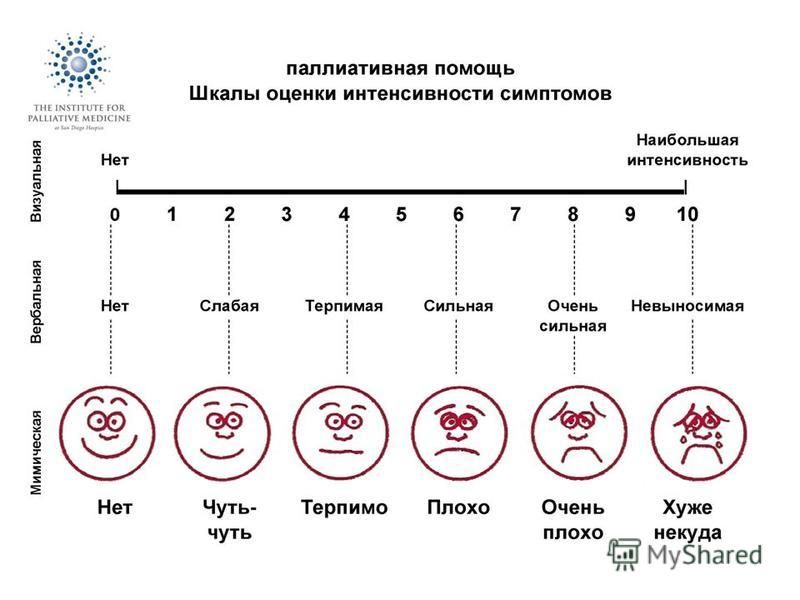 Степень экстероцептивной супрессии в жевательных мышцах усиливается при гомотопической ноцицептивной активности в тригеминальных афферентах, что используется в клинике для количественной оценки боли у пациентов с головными и лицевыми болями.
Степень экстероцептивной супрессии в жевательных мышцах усиливается при гомотопической ноцицептивной активности в тригеминальных афферентах, что используется в клинике для количественной оценки боли у пациентов с головными и лицевыми болями.
Точные механизмы развития ES1 и ES2 неизвестны. Считается, что ES1 связан с олигосинаптической активацией тригеминальными афферентами интернейронов ядер тригеминального комплекса, оказывающих тормозное влияние на мотонейроны жевательных мышц, в то время как ES2 опосредуется полисинаптической рефлекторной дугой, вовлекающей нейроны медуллярной части спинального тригеминального ядра (Ongerboer de Visser et al., 1990). Вместе с тем существуют данные, свидетельствующие о том, что ES2 может регистрироваться при гетеротопической болевой стимуляции, а электрическая стимуляция пальцев рук редуцирует ES2 в жевательных мышцах (Кукушкин М.Л. и др., 2003). Это позволяет предположить, что механизмы развития ES2 боле сложны и реализуются с участием супраспинальных центров через спино-кортико-спинальную возвратную петлю.
Метод регистрации соматосенсорных вызванных потенциалов . На протяжении последних двух десятилетий для измерения клинической и экспериментальной боли у человека широко применяется метод регистрации соматосенсорных вызванных потенциалов (ССВП). По данной проблеме имеется обширный исследовательский материал, обобщенный в ряде обзорных статей (Зенков Л.Р., Ронкин М.А., 1991; Bromm B., 1985; Chen A.C.N., 1993). Считается, что ранние компоненты ССВП (N65-P120) отражают интенсивность физического стимула, используемого для вызова болевого ощущения, в то время как амплитуда поздних компонентов ССВП (N140-P300) коррелирует с субъективным восприятием боли.
Мнение о том, что амплитуда поздних компонентов ССВП может отражать субъективное восприятие боли, было сформировано на основании исследований, в которых показан позиивная связь между снижением амплитуды компонентов N140-P300 ССВП и введением различных анальгетиков. Вместе с тем, хорошо известна вариабельность амплитуды позних омпонентов ССВП, которая зависит от ряда психологических факторов, таких как внимание, память, эмоциональное состояние (Костандов Э. А., Захарова Н.Н., 1992), которые в значительной степени могут изменяться не только анальгетиками, но и самой процедурой исследования. Кроме того, последние публикации по данной проблеме (Сыровегин А.В. и др., 2000; Zaslansky R. et al., 1996) свидетельствуют о низкой связи субъективного болевого восприятия и амплитуды поздних компонентов ССВП.
А., Захарова Н.Н., 1992), которые в значительной степени могут изменяться не только анальгетиками, но и самой процедурой исследования. Кроме того, последние публикации по данной проблеме (Сыровегин А.В. и др., 2000; Zaslansky R. et al., 1996) свидетельствуют о низкой связи субъективного болевого восприятия и амплитуды поздних компонентов ССВП.
!!! Наиболее надежным среди электрофизиологических методов контроля величины субъективного болевого ощущения остается ноцицептивный рефлекс отдергивания (НРО).
Функциональное картирование нейрональной активности мозговых структур . В последнее время в клиническую практику все шире внедряются методы функционального картирования нейрональной активности мозговых структур при острой и хронической боли (Coghill R.C., et al., 2000; Rainville P. et al., 2000). Наиболее известными из них являются: (1) позитронно-эмиссионная томография
и метод (2) функционального магнитного резонанса
. Все методы функционального картирования основаны на регистрации в структурах мозга локальной гемодинамической реакции, которая имеет положительную корреляционную связь с электрической активностью популяций нейронов.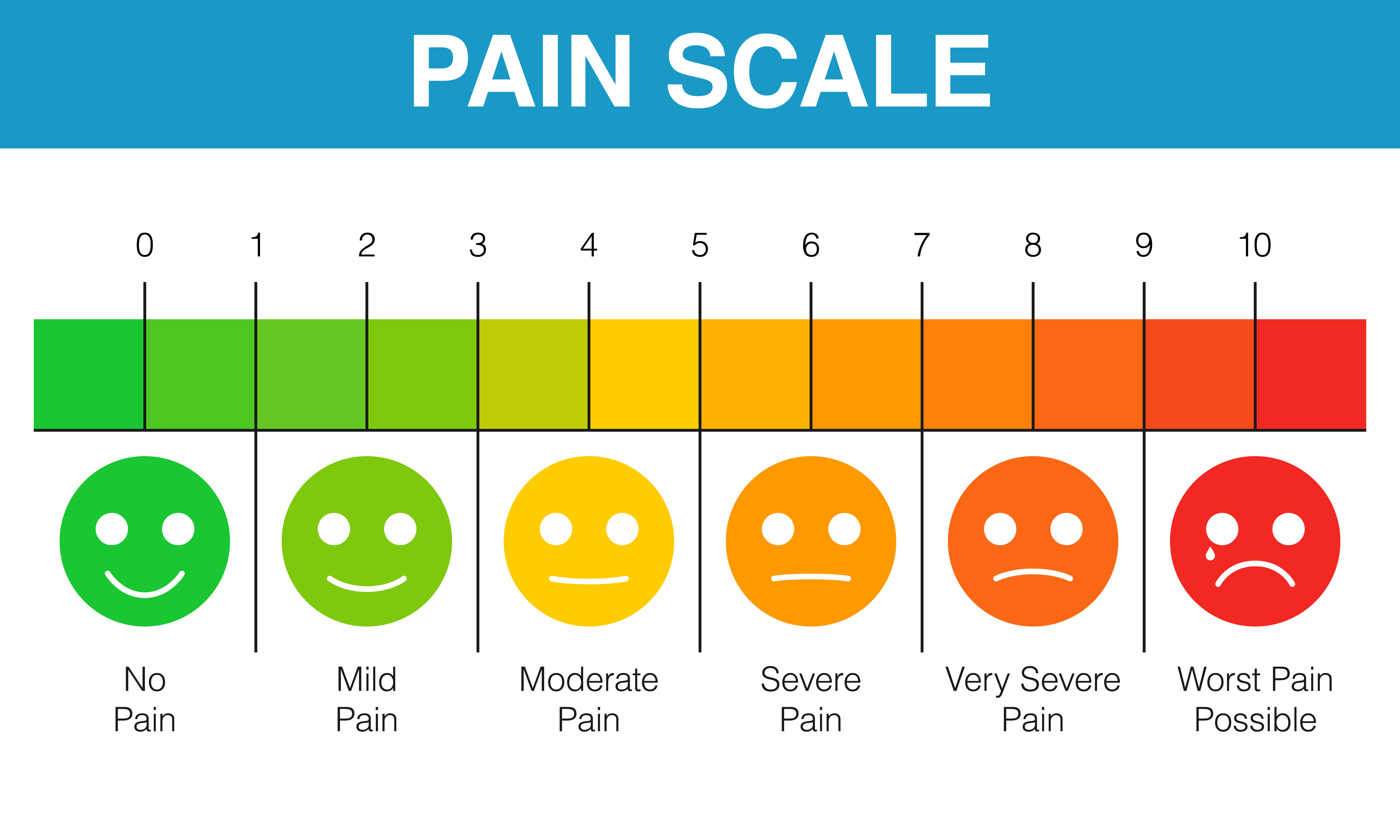
С помощью методов функционального картирования удается визуализировать в трехмерных пространственных координатах (миллиметры у человека и микрометры у животных) изменение активности нейронов в ответ на предъявляемые ноцицептивные (болевые) воздействия, что позволяет изучать нейро-физиологические и нейро-психологические механизмы боли.
Литература : 1. Руководство для врачей «Общая патология боли» М.Л. Кукушкин, Н.К. Хитров; Москва, «Медицина»; 2004. 2. «Применение анальгетиков при лечении боли у детей» Редактор Элэстер Дж. Вуд, Чарльз Верде, Иавиль Ф. Сетна (Детская больница, г. Бостон, Гарвардская школа медицины, г. Бостон, США, 2002).
Шкала Oucher
Шкала Эланда (Eland Body Tool)
Шкала рук (Hand scale)
Poker Chip tool
Пошаговое руководство ВОЗ по применению и интерпретации шкалы для оценки боли
Для оценки боли применяются специальные шкалы. Чтобы использовать их эффективно, нужно подбирать шкалы в зависимости от возраста ребенка. Для новорожденных, детей до 3-х лет, от 3-х до 7-лет, для подростков разработаны разные инструменты. Шкалы могут применять как врачи и медсестры, так и родители детей.
Для новорожденных, детей до 3-х лет, от 3-х до 7-лет, для подростков разработаны разные инструменты. Шкалы могут применять как врачи и медсестры, так и родители детей.
При оценке боли учитываются невербальные знаки со стороны пациента, уровень его развития и интеллекта. При заполнении шкалы у вербальных пациентов старше 3-х лет нужно ориентироваться на то, что ребенок говорит о своей боли. Однако стоит помнить, что если ребенок не говорит о боли, это не значит, что ее нет. Возможно он боится последствий, например, уколов, или наоборот, считает, что отрицание боли – проявление силы и храбрости.
Дети чуть постарше могут описывать интенсивность своей боли и локализовать ее. Если это ребенок в возрасте 1,5-2 лет, он может не употреблять слово «боль», используя близкие ему слова-определения (например, «бо-бо»). Дети старше 8 лет способны описывать боль в контексте своего опыта, а подростки – подробно рассказывать о причинах боли и детально описывать свои болевые ощущения.
Всегда необходимо спрашивать о боли не только ребенка, но и тех, кто находится рядом, видит ребенка каждый день и может оценить его состояние в динамике.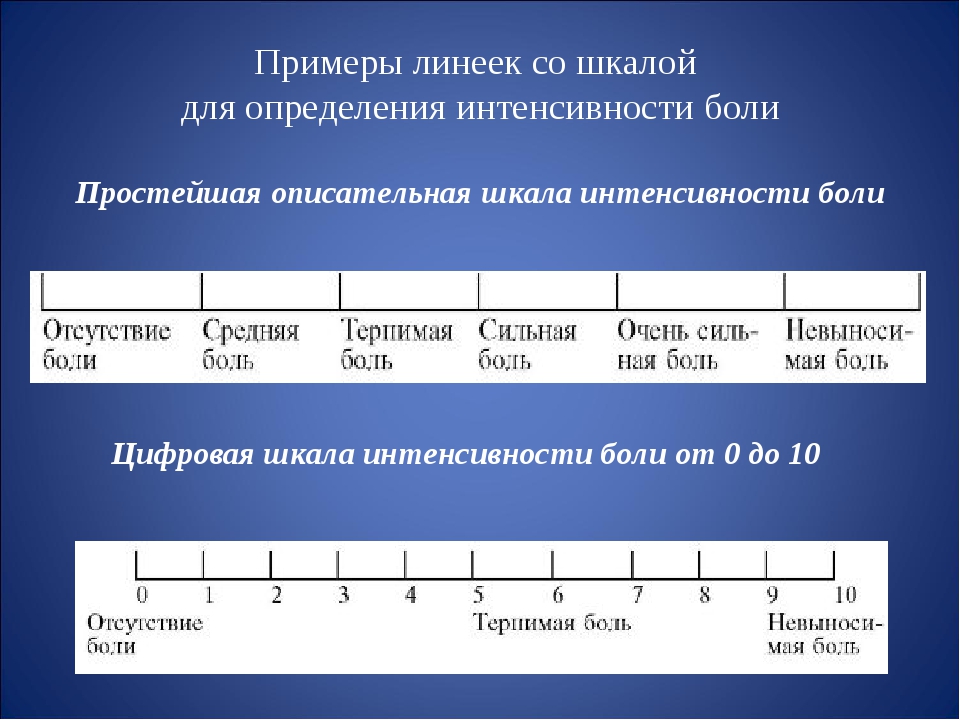 Мамы и папы, опекуны, няни или медсестры могут дать действительно важную информацию: ел ли сегодня ребенок, отказывался ли он от питья, разговаривает ли он сегодня, как можно оценить его позу и насколько она для него естественна.
Мамы и папы, опекуны, няни или медсестры могут дать действительно важную информацию: ел ли сегодня ребенок, отказывался ли он от питья, разговаривает ли он сегодня, как можно оценить его позу и насколько она для него естественна.
При заполнении шкалы необходимо не только , но и обязательно выявить причину боли, чтобы по возможности устранить ее и обезболить ребенка.
Важно сказать, что идеальных шкал для оценки боли нет. Они не всегда дают нам объективную ситуацию, и относиться к ним нужно как к ориентировочным методикам. Но несмотря на это, нужно их обязательно использовать, так как это дает возможность оценки интенсивности боли.
Важно
Нужно выбрать одну методику для пациента и применять ее постоянно.
NIPS – Neonatal Infant Pain ScaleИ спользуют для оценки боли у детей в возрасте до 1 года.
Шкалу могут заполнить родители, ориентируясь на выражение лица ребенка, на плач, дыхание, положение верхних и нижних конечностей, состояние сознания. Сумма баллов выше трех означает наличие боли.
Сумма баллов выше трех означает наличие боли.
Эта поведенческая шкала применяется для детей в возрасте до 3 лет. Она учитывает выражение лица ребенка, положение или подвижность ног, характер крика и то, насколько ребенок поддается успокоению. Боль оценивается по десятибалльной шкале. Чем выше оценка, тем сильнее боль, и тем хуже себя чувствует ребенок.
Источник: БФ «Детский паллиатив»
Шкала Вонга-Бейкера (Face scale)Используется для детей в возрасте от 3 до 7 лет . При работе с этой рейтинговой шкалой ребенку необходимо выбрать одно из нарисованных лиц, которое соответствует его самочувствию. Иногда, используя эту шкалу, ребенок может больше ориентироваться на свои эмоции, чем на боль. 0 – счастлив, нет боли, 5 – плачет, несчастен, испытывает нестерпимую боль. Поэтому эта шкала не всегда бывает адекватна для оценки боли.
Шкала OucherАналог предыдущей шкалы – десятибалльная
шкала Oucher , на которой представлены фотографии лиц детей с нарастающей болью и без нее.
Источник: www.oucher.org
Шкала Эланда (Eland body tool)Также для детей этого возраста применяется цветная шкала Эланда (Eland body tool ). Интенсивность боли ребенок определяет с помощью цвета: сильная боль – красный цвет, умеренная боль – оранжевый, слабая боль – желтый. Также шкала позволяет определить локализацию боли.
Шкала рук (Hand scale)Пятибалльная шкала, которая показывает колебания боли при помощи одной руки. Сжатая в кулак рука означает отсутствие боли, полностью раскрытая ладонь – нестерпимую боль. Применяется для детей старше 3 лет.
Poker Chip toolВ некоторых странах согласно ВОЗ для оценки боли у детей 3-12 лет
используется шкала с фишками для покера (Poker Chip tool ). Однако ее использование требует уверенности, что у ребенка развит навык сортировки по размеру. Среди недостатков – необходимость мытья фишек
после каждого использования, риск потери фишек и ограниченное число вариантов ответа от 0 (отсутствие боли) до 4 – сильная боль. Шкала доступна с переводом на английский, арабский, испанский и тайский языки. При ее использовании будьте уверены, что ваш лечащий врач тоже может пользоваться этой шкалой.
Шкала доступна с переводом на английский, арабский, испанский и тайский языки. При ее использовании будьте уверены, что ваш лечащий врач тоже может пользоваться этой шкалой.
Подходит для детей старше 7 лет, которые понимают значение цифр. На вертикальной шкале с изображением цифр от 0 до 10 ребенок должен подвинуть полоску вверх или вниз (или показать пальцем) на ту высоту шкалы, с которой он ассоциирует свои болевые ощущения. Аналог такой шкалы – нумерологическая оценочная шкала (НОШ).
Шкала тактильной и визуальной оценки боли (Touch Visual Pain – TVP scale)Была создана для ВИЧ-инфицированных детей с мультиорганной патологией. При оценке боли используются прикосновения к ребенку и наблюдение за ним. Боль оценивается по десятибалльной шкале: 0 – нет боли, 10 – нестерпимая боль.
8547 0
Самый простой и распространенный способ заключается в регистрации интенсивности боли с помощью ранговых шкал.
Существует числовая ранговая шкала (ЧРШ), состоящая из последовательного ряда чисел от 1 до 5 или до 10.
Пациент должен выбрать число, отражающее интенсивность испытываемой боли.
Вербальная ранговая шкала (ВРШ) содержит набор слов-дескрипторов боли, отражающих степень нарастания боли, последовательно нумерующиеся от меньшей тяжести к большей: нет (0), слабая боль (\), умеренная боль (2), сильная боль (3), очень сильная боль (4), нестерпимая (невыносимая) боль (5). Визуальная аналоговая шкала (ВАШ) представляет собой прямую линию длиной 100 мм с нанесенными на нее миллиметровыми юлениями или без них. Начальная точка линии означает отсутствие боли, конечная — невыносимую боль.
От пациента требуется отметить уровень боли точкой на предлагаемой прямой. Для пациентов, которые испытывают трудности с абстрагированием и представлением боли в виде цифры или точки на прямой, можно использовать лицевую (мимическую шкалу боли). Варианты перечисленных шкал, наиболее часто используемых в клинической практике приведены на рис 1.
Рис. 1. Шкалы для оценки боли
Простота и высокая чувствительность методов ранговой шкальной оценки делают их очень полезными, а иногда и незаменимыми в клинической практике, но они имеют и ряд недостатков. Математический анализ результатов основан на маловероятном предположении, что каждый ранг является равной психологической единицей измерения.
Боль оценивается однозначно — по интенсивности, как простое ощущение, различающееся только количественно, тогда как она имеет качественные отличия. Аналоговые, числовые и вербальные шкалы дают единую, обобщенную оценку, которая отражает почти совсем не изученный процесс интеграции многомерного болевого опыта.
Для многомерной оценки боли R.Melzack и W.S.Torgerson (1971) предложили опросник, получивший название «Мак-Гилловский болевой опросник» (McGill Pain Questionnaire). Известен также метод многомерной семантической дескрипции боли, в основу которого положен расширенный Мак-Гилловский опросник (Melzack R. , 1975).
, 1975).
Расширенный опросник содержит 78 слов-дескрипторов боли, введенных в 20 подклассов (субшкал) по принципу смыслового значения и образуюших три главных класса (шкалы): сенсорный, аффективный и эвалюативный.
Результаты опроса могут служить критерием психического состояния больных. Многочисленными исследованиями проверена адекватность метода для оценки боли, обезболивания и диагностики, в настоящее время он стал стандартным методом обследования за рубежом.
В нашей стране проделана аналогичная работа. В.В. Кузьменко, В.А. Фокин, Э.Р. Маттис и соавторы (1986), взяв за основу Мак-Гилловский опросник, разработали оригинальный опросник на русском языке и предложили методику анализа его результатов. В этом опроснике каждый подкласс составляют слова, сходные по своему смысловому значению, но различающиеся по интенсивности передаваемого ими болевого ощущения (таблица 3).
Таблица 3. Мак-Гилловский болевой опросник
| Какими словами Вы можете описать свою боль? (сенсорная шкала) | ||
1. 1. Пульсирующая 2. Схватывающая 3. Дергающая 4. Стегающая 5. Колотящая 6. Долбящая | 2. Подобная 1. Электрическому разряду, 2. Удару тока, 3. Выстрелу | 3. 1. Колющая 2. Впивающаяся 3. Буравящая 4. Сверлящая 5. Пробиваюшая |
| 4. 1. Острая 2. Режущая 3. Полосующая | 5. 1. Давящая 2. Сжимающая 3. Щемящая 4. Стискивающая 5. Раздавливающая | 6. 1. Тянущая 2. Выкручивающая 3. Вырывающая |
| 7. 1. Горячая 2. Жгущая 3. Ошпаривающая 4. Палящая | 8. 1. Зудящая 2. Щиплющая 3. Разъедающая 4. Жалящая | 9. 1 Тупая 2. Ноющая 3. Мозжащая 4. Ломящая 5. Раскалывающая |
| 10. 1. Распирающая 2. Растягивающая 3. Раздирающая 4. Разрывающая | 11. 1. Разлитая 2. Распространяющаяся 3. Проникающая 4. Пронизывающая | 12. 1. Царапающая 2. Саднящая 3. Дерущая 4. Пилящая 5. Грызущая |
| | 13. 1. Немая 2. Сводящая 3. Леденящая | |
| Какие чувства вызывает боль, какое воздействие оказывает на психику? (аффективная шкала) | ||
| 14. 1. Утомляет 2. Изматывает | 15. Вызывает 1. Чувство тошноты 2. Удушья | 16. Вызывает чувство 1. Тревоги 2. Страха 3. Ужаса |
| 17. 1. Угнетает 2. Раздражает 3. Злит 4. Приводит в ярость 5. Приводит в отчаяние | 18. 1. Обессиливает 2. Ослепляет | 19. 1. Боль — помеха 2. Боль — досада 3. Боль — страдание 4. Боль — мучение 5. Боль — пытка |
| Как Вы оцениваете свою боль? (эвалюативная шкала) | ||
| | 20. 1. Слабая 2. Умеренная 3. Сильная 4. Сильнейшая 5. Невыносимая | |
Подклассы образуют три основных класса (шкалы): сенсорную, аффективную и эвалюативную (оценочную). Дескрипторы сенсорной шкалы (1-13 подклассы) характеризуют боль в терминах механического или термического воздействия, изменения пространственных или временных параметров. Аффективная шкала (14-19 подклассы) отражает эмоциональную сторону боли в терминах напряжения, страха, гнева или вегетативных проявлений.
Эвалюативная шкала (20 подкласс) состоит из пяти слов, выражающих субъективную оценку интенсивности боли пациентом, и представляет собой вариант вербальной ранговой шкалы. При заполнении опросника пациент выбирает слова, соответствующие его ощущениям в данный момент, в любом из 20 подклассов (не обязательно в каждом, но только одно слово в подклассе).
Каждое выбранное слово имеет числовой показатель, соответствующий порядковому номеру слова в подклассе.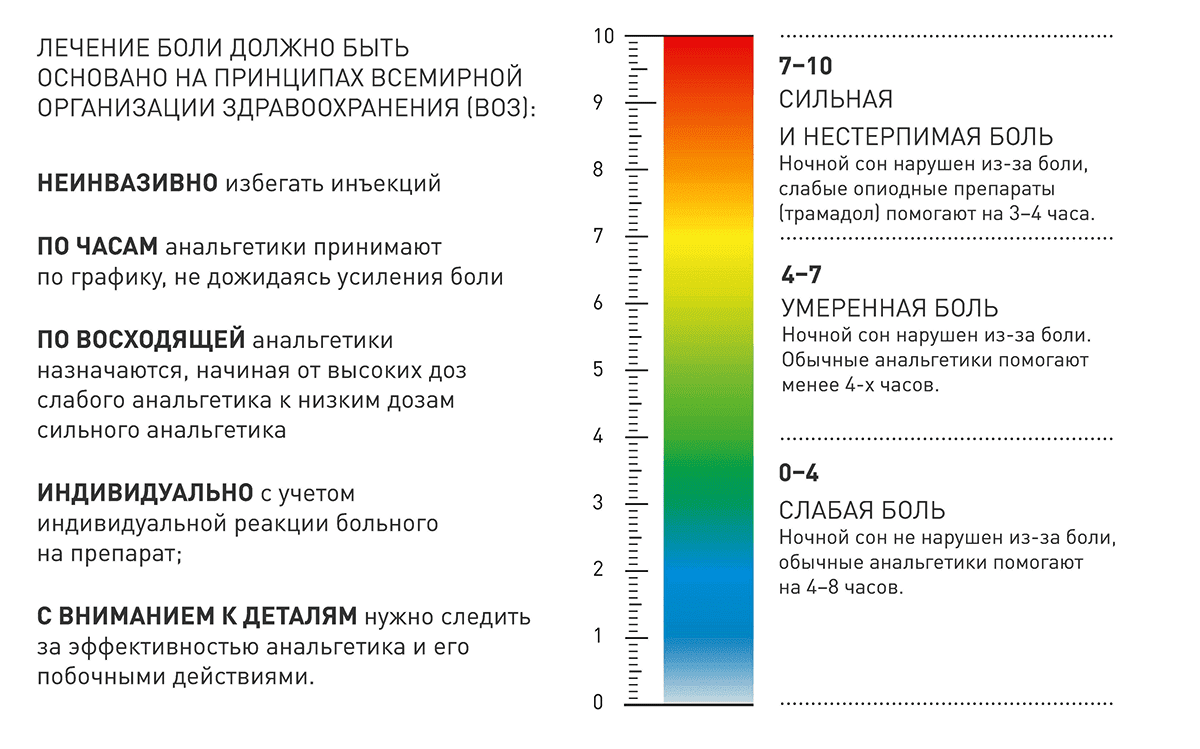 Подсчет сводится к определению двух показателей: индекса числа выбранных дескрипторов (ИЧВД), который представляет собой количество (сумму) выбранных слов, и рангового индекса боли (РИБ), являющегося суммой порядковых номеров дескрипторов в субклассах. Оба показателя подсчитываются для сенсорной и аффективной шкал раздельно и вместе (суммарный индекс).
Подсчет сводится к определению двух показателей: индекса числа выбранных дескрипторов (ИЧВД), который представляет собой количество (сумму) выбранных слов, и рангового индекса боли (РИБ), являющегося суммой порядковых номеров дескрипторов в субклассах. Оба показателя подсчитываются для сенсорной и аффективной шкал раздельно и вместе (суммарный индекс).
По определению международной ассоциации по изучению боли «болевой порог (ПБ) — это минимальное болевое ощущение, которое можно осознать». Информативной характеристикой является также уровень болевой толерантности (порог переносимости боли — ППБ), определяемый как «наибольший уровень боли, который можно выдержать».
Название метода количественного исследования болевой чувствительности образуется от названия используемого в нем алгогенного стимула: механоальгометрия, термоальгометрия, электроальгометрия.
Чаще всего в качестве механического воздействия используют давление и тогда метод называется тензоальгометрией (долориметрией) При тензоальгометрии ПБ выражается в единицах силы давления отнесенных к единице площади (кг/см2). В зависимости от локализации измерений используют сменные насадки: в области головы и дистальных отделов конечностей диаметром 1,5 мм, а в области массивных скелетных мышц — 5 мм.
В зависимости от локализации измерений используют сменные насадки: в области головы и дистальных отделов конечностей диаметром 1,5 мм, а в области массивных скелетных мышц — 5 мм.
Тензоальгометрия осуществляется путем плавного или ступенчатого увеличения давления на тестируемую область тела. Болевое ощущение возникает в тот момент, когда сила давления достигает значений, достаточных для возбуждения Аб -механорецепторов и С-полимодальных ноцицепторов.
Определение ПБ и ППБ может дать важную клиническую информацию. Снижение ПБ указывает на наличие аллодинии, а снижение ППБ является признаком гиперестезии (гипералгезии). Периферическая сенситизация ноцицепторов сопровождается как аллодинией, так и гипералгезией, а центральная сенситизация проявляется преимущественно гипералгезией без сопутствующей аллодинии.
Р.Г. Есин, О.Р. Есин, Г.Д. Ахмадеева, Г.В. Салихова
Для оценки выраженности болевого синдрома, а также эффективности его устранения использовали так называемые ранговые шкалы .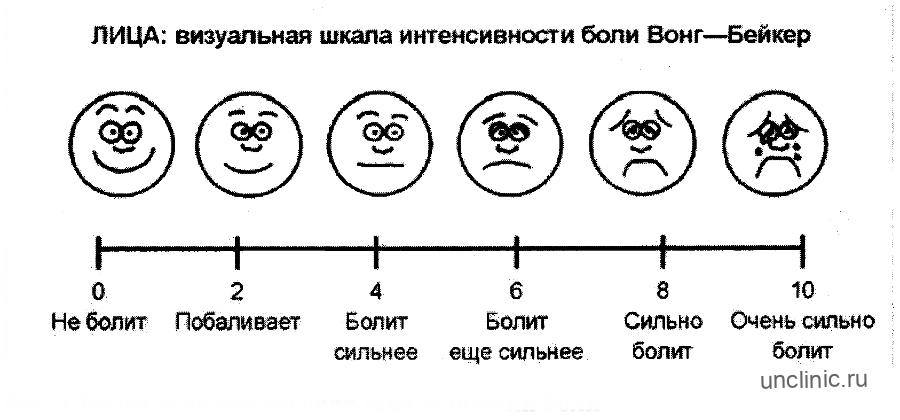 Визуально-аналоговая шкала (ВАШ) представляет собой отрезок прямой линии длиной 10 см, начало и окончание, которой отражают отсутствие боли и крайний предел ее ощущения (рис. 2.15).
Визуально-аналоговая шкала (ВАШ) представляет собой отрезок прямой линии длиной 10 см, начало и окончание, которой отражают отсутствие боли и крайний предел ее ощущения (рис. 2.15).
Пациенту предлагали отметить отрезок прямой, величина которого приблизительно соответствовала интенсивности испытываемых им болевых ощущений. Измерив, отмеченный участок определяли условную интенсивность боли в баллах (соответственно длине в см). Вербальная ранговая шкала — та же ВАШ, но с оценочными показателями боли, расположенными вдоль прямой: слабая, умеренная, сильная и т.д. Числовая оценочная шкала представляет собой тот же отрезок прямой с нанесенными на него цифрами от 0 до 10. Наиболее объективными считаются оценки боли, полученные при помощи горизонтально расположенных шкал. Они хорошо коррелируют с оценкой болевых ощущений и более точно отражают их динамику.
Качественные характеристики болевого синдрома мы получали при помощи МсGill болевого опросника (183). Данный тест включает 102 параметра боли, распределенных, по трем основным группам. Первая группа (88 описательных выражений) ассоциируется с характером болевых ощущений, вторая (5 описательных выражений) — с интенсивностью боли и третья (9 показателей) — с продолжительностью боли. Параметры первой группы распределены по 4 классам и 20 подклассам. Первый класс — параметры сенсорных характеристик (боль «пульсирующая, стреляющая, жгучая» и т.д.).
Первая группа (88 описательных выражений) ассоциируется с характером болевых ощущений, вторая (5 описательных выражений) — с интенсивностью боли и третья (9 показателей) — с продолжительностью боли. Параметры первой группы распределены по 4 классам и 20 подклассам. Первый класс — параметры сенсорных характеристик (боль «пульсирующая, стреляющая, жгучая» и т.д.).
Рис. 2.15. Визуальные шкалы субъективной оценки боли
Второй класс — параметры аффективных характеристик (боль «утомляющая, ужасающая, выматывающая» и т.д.), третий класс -оценивающие параметры (боль «вызывающая раздражение, страдание, невыносимая» и т.д.), четвертый — смешанные сенсорно-аффективные параметры (боль «назойливая, мучительная, истязающая» и т.д.). Каждый показатель в подклассе расположен согласно своему ранговому значению и имеет весовое математическое выражение (первый = 1, второй = 2 и т.д.). При последующем анализе учитывались число и ранговое положение выбранных параметров по каждому классу.
Количественная оценка болевых ощущений проводилась с помощью долориметра (Креймер А. Я., 1966). Принцип работы долориметра основан на измерении величины давления, при котором в исследуемой точке возникает боль. Измерение величины давления регистрируется при помощи штока с резиновым наконечником, связанного с пружинным механизмом. На плоской поверхности штока нанесена шкала, градуированная на 30 делений с шагом в 0,3 кг/см. Величина смещения штока регистрируется при помощи фиксирующего кольца.
Данные алгезиметрии выражаются в абсолютных единицах — кг/см. За норму принималась степень болезненности 9,2±0,4 кг/см и более, определенная у 30 практически здоровых людей. Для стандартизации показателей коэффициент болезненности (КБ), который показывает отношение нормальных алгезиметрических показателей к соответствующим показателям в исследуемых точках. В норме он равен одной относительной единице. Тест применялся и в процессе лечения для определения эффективности выбранного метода лечения.
Описываемый подход позволил, осуществлять объективную дифференциальную диагностику и на основании результатов комплексной диагностики подбиралась индивидуальная схема лечения и реабилитации в послеоперационном периоде.
Боль – это всегда неприятное ощущение. Но ее интенсивность может быть разной: она зависит от того, какая болезнь развилась, и какой болевой порог имеет человек.
Чтобы врач мог понять, как именно болит – нестерпимо или более-менее умеренно– придуманы так называемые шкалы боли. С их помощью вы можете не только описать свою боль на данный момент, но и сказать, что изменилось с назначением лечения.
Визуальная аналоговая шкала
Это та шкала, которой чаще всего пользуются анестезиологи и онкологи. Она представляет собой возможность оценить интенсивность боли – без всяких подсказок.
Визуальная аналоговая шкала представляет собой линию длиной 10 см, нарисованную на чистом листе бумаги – без клеточек. 0 см – это «боли нет», самая правая точка (10 см) – «боль самая нестерпимая, которая вот-вот приведет к гибели». Линия может быть как горизонтальной, так и вертикальной.
Линия может быть как горизонтальной, так и вертикальной.
Пациент должен поставить точку там, где, как он чувствует, располагается его боль. Врач берет линейку и смотрит, на какой отметке находится точка пациента:
- 0-1 см – боль крайне слабая;
- от 2 до 4 см – слабая;
- от 4 до 6 см – умеренная;
- от 6 до 8 см – очень сильная;
- 8-10 баллов – нестерпимая.
При оценке боли врач не только смотрит на эту точку, а и на все поведение человека. Если человека можно отвлечь вопросами, если он спокойно прошел по кабинету до выхода, возможно, он завышает степень боли. Поэтому ему можно предложить повторно оценить свою боль – по той же шкале. А если это женщина, то попросить сравнить с болью при родах (она оценивается в 8 баллов для каждой женщины). Если она говорит: «Вы что, рожать было вдвое больнее», то стоит оценить ее боль в 4-5 баллов.
Модифицированная визуальная аналоговая шкала
Суть оценки боли – такая же, как и в предыдущем случае. Единственное отличие этой шкалы – в цветовой маркировке, на фоне которой и нарисована линия. Цвет идет градиентом: от зеленого, который начинается от 0, к 4 см сменяется желтым, а к 8 см – красным.
Единственное отличие этой шкалы – в цветовой маркировке, на фоне которой и нарисована линия. Цвет идет градиентом: от зеленого, который начинается от 0, к 4 см сменяется желтым, а к 8 см – красным.
Вербальная ранговая шкала
Она очень напоминает визуальную аналоговую шкалу: так же линия длиной в 10 см, которую можно прочертить при пациенте самостоятельно. Но отличие есть: каждые 2 см следует надпись:
- на 0 см – боли нет;
- на 2 см – слабая боль;
- на отметке 4 см – умеренная боль;
- на 6 см – сильная;
- на 8 см – очень сильная;
- в конечной точке – невыносимая боль.
В этом случае человеку уже легче сориентироваться, и он ставит точку, исходя из того, с каким эпитетом у него больше всего ассоциируется собственное состояние.
Положительные стороны этого метода оценки боли в том, что с ее помощью можно оценивать и острый, и хронический болевой синдром. Кроме того, шкалу можно применять у детей, начиная от младших школьников, а также людей с начальными степенями .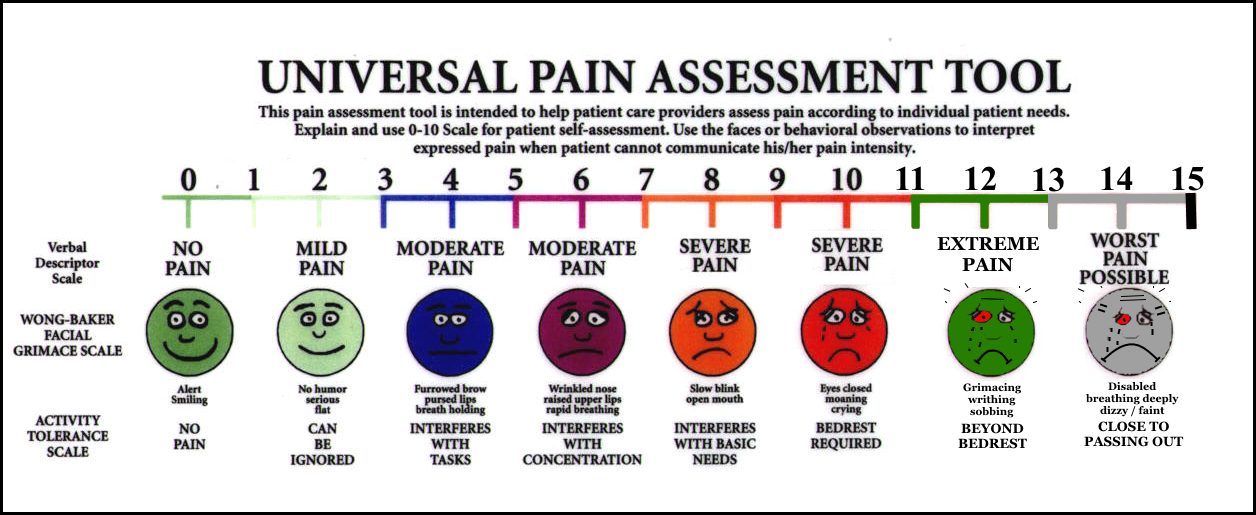
Шкала боли «в лицах» (лицевая)
Эта шкала может применяться для определения интенсивности боли у людей в глубокой деменции. Она состоит из 7 рисунков лиц с эмоциями, каждая из которых схематично передает силу болевого синдрома. Расположены они по нарастанию боли.
Почему именно рисунки, да еще и такие примитивные? Потому, что с таких рисунков эмоцию легче считать и труднее неверно истолковать, чем с произведения искусства или фотографии.
Перед тем, как человек укажет лицо, отображающее соответствующую степень боли, ему нужно объяснить картинку. Врач говорит: «Смотри, у первого человека ничего не болит, дальше показаны люди, которые чувствуют боль – с каждым разом все сильнее. Самый правый человек ужасно мучается от боли. Покажи мне, какую боль чувствуешь ты». После этого человек указывает или обводит нужное лицо.
Модифицированная лицевая шкала
Она состоит из 6 лиц, каждое из которых изображает эмоцию, соответствующую описанию боли по вербальной ранговой шкале. Она также используется для оценки интенсивности болевого синдрома при деменции и тоже проводится после короткого вступительного слова.
Она также используется для оценки интенсивности болевого синдрома при деменции и тоже проводится после короткого вступительного слова.
Шкала, которую используют для лежачих и потерявших речь больных
Реаниматологи применяют шкалу CPOT, которая позволяет им, не разговаривая с пациентом, оценить степень его боли. Они учитывают 4 параметра:
- Напряжение мышц рук.
- Выражение лица.
- Попытки говорить или сопротивление дыхательному аппарату.
- Двигательные реакции.
Каждый параметр оценивается от 0 до 2 баллов, после чего баллы суммируются.
Трактовка такая:
0-2 балла – боли нет;
3-4 балла – слабая боль;
5-6 баллов – умеренная боль;
7-8 баллов – боль сильная;
9-10 – очень сильная боль.
Наиболее полная оценка боли – опросник Мак-Гилла
Благодаря этому опроснику (анкете) можно оценить три основные системы формирования и проведения боли:
- нервные волокна, которые проводят непосредственно болевые ощущения;
- структуры, которые есть и в спинном, и головном мозге: ретикулярная формация и лимбическая система;
- отделы в коре головного мозга, которые занимаются оценкой и уже конечной интерпретацией боли.

Поэтому анкета условно разделена на 4 группы:
- для определения сенсорных характеристик боли;
- для оценки того, какие боль затрагивает эмоциональные компоненты;
- для оценки того, как боль оценивается головным мозгом;
- группа слов, которые направлены на оценку сразу всех критериев.
Физически опросник выглядит как 20 граф, в каждой из которых расположено от 1 до 5 эпитетов, расположенных по порядку – в соответствии с интенсивностью боли. Человеку нужно обвести столько из них, сколько поможет ему точно описать свои ощущения.
Оценка болевого индекса производится по тому, сколько слов было использовано для описания боли по каждому из 4 параметров. Также важно, какие порядковые номера применялись для оценки в каждом аспекте. И, наконец, суммируются порядковые номера выбранных эпитетов, вычисляется их среднеарифметическая величина.
Для чего нужны шкалы боли
Шкалами боли пользуются не все врачи. Их применяют, в основном, анестезиологи-реаниматологи, терапевты и онкологи. Иногда с ними сталкиваются врачи и других специальностей, когда речь идет о хронических больных.
Иногда с ними сталкиваются врачи и других специальностей, когда речь идет о хронических больных.
В зависимости от того, как оценена боль, будет назначаться обезболивающее средство:
- При слабой боли – это ненаркотическое обезболивающее: «Ибупрофен», «Анальгин», «Диклофенак», «Парацетамол».
- При умеренной – 2 ненаркотических анальгетика, имеющих несколько разные точки приложения, или комбинация из слабого наркотического средства и ненаркотического анальгетика.
- Сильная боль требует назначения сильного наркотического и ненаркотического анальгетиков. Часто приходится прибегать и к дополнительным методам: блокадам нервных путей, алкоголизации (введении этанола) в нервные окончания, которые являются причиной хронической сильной боли.
Любой из указанных препаратов имеет массу побочных эффектов. Поэтому в интересах пациента – максимально объективно оценивать собственную боль, а при ее изменениях – сообщать об этом врачу. Вот уже если врач никак не реагирует – то его нужно менять на другого специалиста.
Что такое шкала боли?
Шкала боли — это инструмент оценки, который измеряет уровень боли. Люди могут использовать шкалу боли, чтобы самостоятельно сообщать медицинским работникам подробные отчеты о своей боли. Шкалы боли помогают поставщикам медицинских услуг лучше понять тип боли, уровень боли и продолжительность боли у человека. Это дает врачам важную информацию, позволяющую поставить точный диагноз, составить план лечения и оценить эффективность лечения.
Шкалы боли делятся на две основные категории: одномерные и многомерные.Используются несколько типов как одномерных, так и многомерных шкал боли.
- Одномерные шкалы боли
Одномерные шкалы боли используются для оценки интенсивности боли. Числовые оценочные шкалы, визуальные аналоговые шкалы и категориальные шкалы являются примерами одномерных шкал боли: - Числовая оценочная шкала
Этот тип шкалы боли включает использование чисел для оценки интенсивности боли. Чаще всего используется диапазон от 0 до 10. Ноль соответствует «без боли», а десять соответствует «наихудшей возможной боли».”
Чаще всего используется диапазон от 0 до 10. Ноль соответствует «без боли», а десять соответствует «наихудшей возможной боли».” - Визуальная аналоговая шкала
Этот тип шкалы боли обычно представляет собой 10-сантиметровую прямую линию. Конечные точки на каждой стороне линии определяют два крайних предела: отсутствие боли и сильная боль. Люди ставят «х» на линию, чтобы обозначить уровень их боли. Затем врач измеряет, где на линии стоит «x», чтобы определить оценку боли. - Категориальная шкала
Категориальная шкала боли использует вербальные или визуальные дескрипторы для людей, чтобы сообщить свой уровень боли. - В вербальной шкале интенсивности боли используются прилагательные, такие как «легкая», «умеренная», «тяжелая», «дискомфортная», «тревожная» и мучительная »для описания уровней боли. Люди выбирают прилагательное, которое лучше всего соответствует интенсивности их боли.
- Визуальная шкала интенсивности боли показывает лица с различным выражением, от лица с широкой улыбкой до лица, наполненного слезами.
 Эти весы от боли особенно полезны для детей.
Эти весы от боли особенно полезны для детей.
Многомерные шкалы боли не так широко используются, как одномерные шкалы боли; однако они предоставляют ценную информацию.Инструменты первоначальной оценки боли, краткие описания боли и опросник Макгилла являются примерами многомерных шкал боли:
- Инструмент начальной оценки боли
Инструмент начальной оценки боли использует бумажную диаграмму, показывающую человеческое тело. Люди отмечают место боли на диаграмме и отвечают на ряд вопросов, касающихся характеристик боли, выражений боли и ее влияния на повседневную жизнь. - Краткая инвентаризация боли
Краткая инвентаризация боли — это быстрый и простой инструмент для определения интенсивности боли.В нем используются вопросы, чтобы ответить на несколько аспектов боли, которую вы почувствовали за последние 24 часа. - Опросник МакГилла
Опросник МакГилла боли — широко используемая многомерная шкала боли. Это помогает оценить боль человека на основе набора прилагательных. Люди присваивают каждому прилагательному числовую оценку, чтобы указать, как это слово представляет их боль.
Это помогает оценить боль человека на основе набора прилагательных. Люди присваивают каждому прилагательному числовую оценку, чтобы указать, как это слово представляет их боль.
Боль многогранна и проявляется у каждого человека по-разному. Шкалы боли — это эффективный инструмент, который помогает людям четко сообщать о своей боли медицинским работникам.
Оценка боли в ED, включая использование шкал боли (таких как OSBD, FLACC, VRS, NRS, CRS и Oucher)
Агентство политики и исследований в области здравоохранения. 1b. Управление острой болью у младенцев, детей и подростков: Оперативные процедуры. 2015. http://www.ncbi.nlm.nih.gov/books/NBK52135/. По состоянию на 24 марта 2015 г.
Пробст Б., Лион Э., Леонард Д., Эспозито Т. Факторы, влияющие на оценку отделения неотложной помощи и лечение боли у детей.Педиатр Emerg Care. 2005; 21: 298–305.
Артикул PubMed Google Scholar

http://www.modernmedicine.com/sites/default/files/images/Resource-Centers/Children%27s%20Hospital%20of%20Eastern%20Ontario%20Pain%20Scale%20%28CHEOPS%29.pdf, доступ осуществлен 26 марта. / 15.
http://www.cincinnatichildrens.org/assets/0/78/176/4711/4717/4213d844-3558-4c76-a342-84a9f377420c.pdf, дата обращения 26.03.2015.
•• Фон Брайер С., Спрагуд Л. Систематический обзор наблюдательных (поведенческих) показателей боли у детей и подростков в возрасте от 3 до 18 лет. Боль. 2007; 127: 140–50. Обширный обзор 20 различных поведенческих (а не собственных отчетов –) шкал боли у детей 3 – 18 лет. Рекомендует CHEOPS или FLACC для оценки боли во время медицинских процедур или других кратковременных болезненных событий, таких как венепункция.
Мальвия С., Вопель-Льюис Т., Берк С., Меркель С., Тейт А. Пересмотренный инструмент наблюдения FLACC: повышенная надежность и достоверность для оценки боли у детей с когнитивными нарушениями. Педиатр Анест. 2006. 16: 258–65.
Педиатр Анест. 2006. 16: 258–65.
Артикул Google Scholar
Вопель-Льюис Т., Занотти Дж., Даммайер Дж., Меркель С. Надежность и достоверность поведенческого инструмента «лицо, ноги, активность, крик, утешение» при оценке острой боли у тяжелобольных пациентов.Am J Crit Care. 2010; 19: 55–61.
Артикул PubMed Google Scholar
Бабл Ф, Креллин Д., Ченг Дж., Салливан Т., О’Салливан Р., Хатчинсон А. Использование шкалы лица, ног, активности, плача и утешения для оценки процедурной боли и дистресса у маленьких детей . Педиатр Emerg Care. 2012; 28: 1281–6.
Артикул PubMed Google Scholar
Биджур П., Латимер С., Галлахер Дж.Валидация устно вводимой числовой шкалы оценки острой боли для использования в отделении неотложной помощи. Acad Emerg Med. 2003. 10 (4): 390–2.
Артикул PubMed Google Scholar

Фон Брайер К. Самооценка интенсивности боли детьми: выбор шкалы, ограничения интерпретации. Pain Res Manag. 2006. 11 (3): 157–62.
Артикул Google Scholar
Бейли Б., Дауст Р., Дойон-Троттье Э., Дофин-Пьер С., Гравел Дж. Валидация и свойства вербальной числовой шкалы у детей с острой болью. Боль. 2010. 149 (2): 216–21.
Артикул PubMed Google Scholar
Voepel-Lewis T, Burke C, Jeffreys N, Malviya S, Tait A. Переводятся ли баллы от 0 до 10 в клинически значимые измерения боли у детей? Anesth Analg. 2011; 112 (2): 415–21.
Артикул PubMed Google Scholar
Bailey B, Bergeron S, Gravel J, Daoust R. Сравнение четырех шкал боли у детей с острой болью в животе в педиатрическом отделении неотложной помощи. Ann Emerg Med. 2007. 50 (4): 379–383.
Артикул PubMed Google Scholar

Тодд К. Х., Фанк Дж. П. Минимальная клинически важная разница в оценках боли, назначенных врачом. Acad Emerg Med. 1996. 3 (2): 142–6.
CAS Статья PubMed Google Scholar
• Цзе Д.С., Хиршфельд Г., фон Байер К.Л., Буллох Б., Даян П.С. Клинически значимые различия в острой боли, измеренные по шкалам самооценки боли у детей. Acad Emerg Med. 2015; 22: 1–8. Подтверждает действие цветовой аналоговой шкалы и FPS — R в условиях педиатрической неотложной помощи детям 7 лет и старше. Подтверждает, что другие шкалы боли, вероятно, лучше подходят для детей младшего возраста в этой ситуации.
Bulloch B, Tenenbein M. Валидация двух шкал боли для использования в педиатрическом отделении неотложной помощи. Педиатрия. 2002; 110: e33.
Артикул PubMed Google Scholar
МакКонахей Т. , Брайсон М., Буллок Б. Определение легкой, умеренной и сильной боли с помощью цветовой аналоговой шкалы для детей, обращающихся в педиатрическое отделение неотложной помощи. Acad Emerg Med. 2006; 13: 341–4.
, Брайсон М., Буллок Б. Определение легкой, умеренной и сильной боли с помощью цветовой аналоговой шкалы для детей, обращающихся в педиатрическое отделение неотложной помощи. Acad Emerg Med. 2006; 13: 341–4.
Артикул PubMed Google Scholar
Fogel JF, Gerkensmeyer JE, Joyce A, Schade J. Надежность и достоверность лиц и шкал дескрипторов слов для измерения процедурной боли. J Pediatr Nurs. 1996. 11 (6): 368–74.
Артикул Google Scholar
• Томлинсон Д., фон Брайер С., Стинсон Дж., Сунг Л. Систематический обзор шкал лиц для самооценки интенсивности боли у детей. Педиатрия. 2010; e1168–98. Систематически анализирует наиболее распространенных шкал боли у детей и четко объясняет сильные и слабые стороны каждой из них.Поддерживает использование шкалы Вонга — Бейкера в клинической практике.

deTovar C, von Baeyer C, Wood C, Alibeu, JP, Houfani M, Arvieux C. Послеоперационный самоотчет о боли у детей: согласие между шкалами, реакция на анальгетик и предпочтение шкалы лиц и шкалы визуальная аналоговая шкала. Pain Res Manag. 2010. 15 (3): 163–68.
Шкала боли Ли Дж. В: Мейс С., Дюшарм Дж., Мерфи М., редакторы. Обезболивание и седация: Управление отделением неотложной помощи.Нью-Йорк: Макгроу-Хилл; 2006. с. 64–72.
Google Scholar
Портер Р., Чейф Р., Магфорд Г., Ньюхук Л., Фьюри А. Плохой доступ к своевременным вмешательствам по уменьшению боли для педиатрических пациентов с надмыщелковыми переломами. Педиатр Emerg Care. 2013. 29 (7): 796–800.
Артикул PubMed Google Scholar
Кирхер Дж., Дрендель А., Ньютон А., Дулай С., Вандермейер Б., Али С.Педиатрическая скелетно-мышечная боль в отделении неотложной помощи.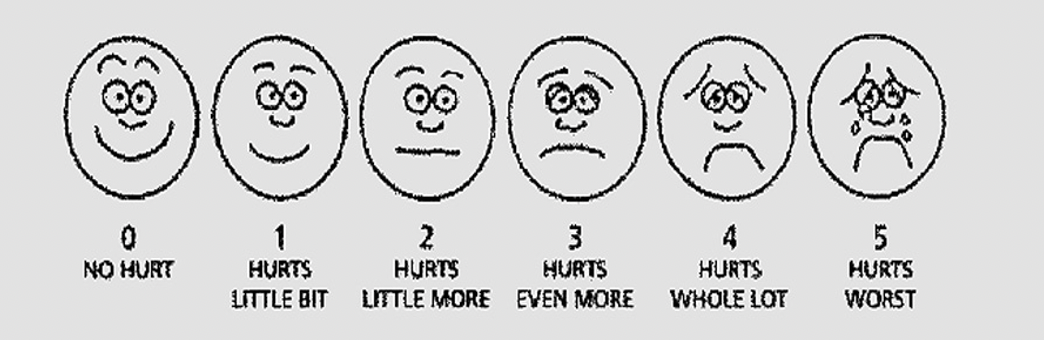 Обзор медицинской карты вариаций практики. Может J Emerg Med. 2014. 16 (6): 449–57.
Обзор медицинской карты вариаций практики. Может J Emerg Med. 2014. 16 (6): 449–57.
Google Scholar
Drendel AL, Brousseau DC, Gorelick MH. Оценка боли у педиатрических пациентов в отделении неотложной помощи. Педиатрия. 2006. 117 (5): 1511–8.
Артикул PubMed Google Scholar
Вэн Ю.М., Чанг Ю.С., Лин Ю.Дж.Сортировочные шкалы боли не могут предсказать обезболивание педиатрических пациентов с переломом длинных костей. Am J Emerg Med. 2010; 28: 412–7.
Артикул PubMed Google Scholar
Каплан С.П., Сисон С., Платт С. Улучшает ли шкала боли оценку боли в педиатрическом отделении неотложной помощи? Педиатр Emerg Care. 2008. 24 (9): 605–8.
Артикул PubMed Google Scholar
Kellogg KM, Fairbanks RJ, O’Connor AB, Davis CO, Shah MN.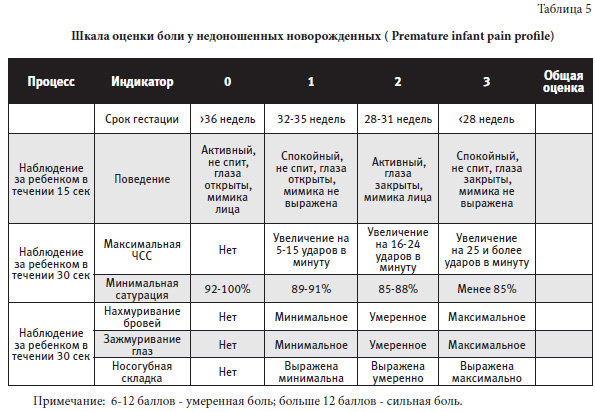 Ассоциация документации по оценке боли и использования анальгетиков в педиатрическом отделении неотложной помощи. Педиатр Emerg Care. 2012. 28 (12): 1287–92.
Ассоциация документации по оценке боли и использования анальгетиков в педиатрическом отделении неотложной помощи. Педиатр Emerg Care. 2012. 28 (12): 1287–92.
Артикул PubMed Google Scholar
Петрак Е.М., Кристофер Н.С., Кривински Дж. Обезболивание в отделении неотложной помощи: модели использования анальгетиков. Педиатрия. 1997. 99 (5): 711–4.
CAS Статья PubMed Google Scholar
Крокер П.Дж., Хиггинботэм Э., Кинг Б.Т., Тейлор Д., Миллинг Т.Дж. Комплексный протокол обезболивания снижает память о боли у детей при выписке из педиатрической реанимации. Am J Emerg Med. 2012; 30: 861–71.
Артикул PubMed Google Scholar
Корвин Д. Д., Кесслер Д. О., Ауэрбах М., Лян А., Кристинссон Г. Вмешательство для улучшения обезболивания в педиатрическом отделении неотложной помощи. Педиатр Emerg Care. 2012. 28 (6): 524–8.
Педиатр Emerg Care. 2012. 28 (6): 524–8.
Артикул PubMed Google Scholar
Vila H, Smith RA, Augstinyiak MJ, Nagi P, Soto RG, Ross TW, Cantor AB, Strickland J, Miguel R. Эффективность и безопасность до и после внедрения стандартов лечения боли в масштабах больницы: безопасность пациента подвергается риску из-за лечения, основанного исключительно на оценках? Anesth Analg. 2005; 101: 471–80.
Артикул Google Scholar
Совместная комиссия. Безопасное использование опиоидов в больницах. Чикаго: Совместная комиссия, 2012 г. http://www.jointcommission.org/assets/1/18/SEA_49_opioids_8_2_12_final.pdf.
Локк Р., Стефано М., Костер А., Тейлор Б., Гринспен Дж. Оптимизация удовлетворенности пациентов / опекунов за счет качества связи в отделении неотложной помощи. Педиатр Emerg Care. 2011; 27: 1016–21.
Артикул PubMed Google Scholar

Magaret N, Clark TA, Warden CR, Magnusson AR, Hedges J. Удовлетворенность пациентов в отделении неотложной помощи — опрос педиатрических пациентов и их родителей. Acad Emerg Med. 2002. 9 (12): 1379–88.
PubMed Google Scholar
Byczkowski T, Fitzgerald M, Kennebeck S, Vaughn L, Myers K, Kachelmeyer A, Timm N. Полный обзор удовлетворенности родителей посещениями педиатрической службы неотложной помощи. Ann Emerg Med. 2013; 62 (4): 340–50.
Артикул PubMed Google Scholar
Voepel-Lewis T, Piscotty RJ, Annis A, Kalisch B. Эмпирический обзор, подтверждающий применение модели «оценка боли как социальная транзакция» в педиатрии. J Управление симптомами боли. 2012. 44 (3): 446–57.
Артикул Google Scholar
Неправильно ли мы измеряем боль? Некоторые эксперты говорят «да»
Сидя на терапевтическом столе, с вытянутыми ногами и обернутым вокруг каждого колена пакетом льда, я рассказал своему любезному физиотерапевту Джеффу все о моей истории боли в коленях. Я вспомнил февральский забег, который вызвал боль, вспомнил предыдущие занятия физкультурой и составил список методов лечения, которые я пробовал. Я сказал ему, что оба колена болят, но редко одновременно, и потчевал его своим путешествием по кроссовкам с арочной опорой и коленным ортезам в аптеке.
Я вспомнил февральский забег, который вызвал боль, вспомнил предыдущие занятия физкультурой и составил список методов лечения, которые я пробовал. Я сказал ему, что оба колена болят, но редко одновременно, и потчевал его своим путешествием по кроссовкам с арочной опорой и коленным ортезам в аптеке.
Но когда Джефф спросил меня о самой боли, я сказал меньше. По шкале от 1 до 10, боль достигла… девяти? Семерка? Я не был уверен, было ли оно тусклым или острым, или и тем, и другим, или ни того, ни другого. Все, что я действительно знал, это то, что мои колени болят сильнее, чем должны были бы быть суставы 31-летнего ребенка.
Как человек, которому нравится не что иное, как перестановка слов на странице, и который всегда будет защищать использование предложения вместо эмодзи, я чувствовал, что язык подвел меня.
В конце концов, я просто посмотрел на Джеффа и пожал плечами.
Боль — самая частая причина, по которой люди обращаются в систему здравоохранения. Это также частный, субъективный опыт, который, как известно, трудно передать. На протяжении десятилетий врачи в первую очередь оценивали боль, прося пациентов оценить интенсивность боли по числовой шкале и описать свои ощущения словами.
Это также частный, субъективный опыт, который, как известно, трудно передать. На протяжении десятилетий врачи в первую очередь оценивали боль, прося пациентов оценить интенсивность боли по числовой шкале и описать свои ощущения словами.
Тот факт, что эти методы оценки не очень эффективны, особенно для молодых пациентов, сталкивающихся с языковыми барьерами или неграмотностью, хорошо задокументирован в исследованиях и широко признан экспертами. Менее ясно то, почему мы все еще полагаемся на них. Некоторые исследователи сомневаются, что мы сможем добиться большего, пока у нас не будет достаточно продвинутых технологий для непосредственного измерения боли, но Чарльз Джонассент, клинический психолог и профессор Медицинской школы Университета Питтсбурга, считает, что мы просто застряли в модели ожидания.Ранее в этом году Джонассент и его коллеги представили приложение, которое позволяет пациентам буквально по-новому увидеть свою боль.
«Мы так долго просили пациентов использовать шкалу от 1 до 10 или описывать свою боль, что я думаю, что может быть трудно представить что-то другое, — говорит Джонассент, — но нет причин, по которым мы не можем отойти от эти же утомленные идеи ».
Болевые точки
Боль является основной жалобой более чем на 80% обращений к врачу. Эта цифра составляет по меньшей мере 116 миллионов американцев, страдающих хронической болью в течение длительного времени, иногда вызванной такими хроническими заболеваниями, как фибромиалгия, артрит, болезнь Лайма и рассеянный склероз.Он также включает в себя всю краткосрочную (или острую) боль — сломанные лодыжки, разрывы крестообразных связок, выводящие из строя боли в животе — которые ежедневно приводят пациентов в отделения первичной медицинской помощи, отделения неотложной помощи и центры неотложной помощи.
Исследования показывают, что в большинстве случаев попытки передать боль — это двусторонняя борьба. В исследованиях и врачи, и пациенты описывали обсуждение боли как трудное, разочаровывающее и требующее много времени. В одном исследовании 76 процентов врачей определили плохое общение и оценку боли как самый большой барьер на пути к успешному лечению боли.Эксперты даже считают, что опиоидный кризис, по крайней мере частично, связан с плохой коммуникацией с болью.
Еще в 1996 году Американское общество боли начало кампанию «Боль как пятый жизненно важный признак» с целью сделать оценку боли стандартной мерой самочувствия пациента во время каждого посещения врача. Инициатива была дальновидной, но рекомендуемый метод оценки боли — от 0 до 10 — был более похожим.
История весов и слов
Боль может проявляться физическими симптомами, такими как синяки и отеки, из которых врачи могут извлечь диагностическую информацию.Но поскольку внешние признаки могут быть обманчивыми, а некоторая боль вызывает только невидимый хаос, врачи также полагаются на самооценку, то есть на то, что пациенты говорят о своей боли. По словам Аманды К. Уильямс, медицинского психолога из Университетского колледжа Лондона, изучающей боль, это не всегда было нормой. Еще в 1950-х и 1960-х годах врачи в клинических испытаниях обезболивающих измеряли боль в интересах пациентов, без их участия. «Контекст, в котором просто спрашивают о боли, имеет большое значение», — говорит Уильямс. «Клиницисты склонны не учитывать боль пациентов, особенно сильную боль, особенно у женщин, этнических меньшинств, очень молодых и очень старых, среди других групп».
«Клиницисты склонны не учитывать боль пациентов, особенно сильную боль, особенно у женщин, этнических меньшинств, очень молодых и очень старых, среди других групп».
Сегодня врачи обычно просят пациентов самостоятельно сообщать о своей боли двумя способами.
Во-первых, они просят пациентов оценить свою боль по какой-то одномерной шкале. Самая известная — это повсеместная шкала от 0 до 10, где числовые оценки соответствуют легкой (от 1 до 3), умеренной (от 4 до 6) или сильной (от 7 до 10) боли.Существуют также нечисловые шкалы: шкалы слов могут варьироваться от «без боли» до «наихудшей боли», в то время как визуальные аналоговые шкалы используют символы или изображения.
Врачи могут неформально собирать рейтинги по шкале, но они также могут использовать стандартные инструменты оценки, большинство из которых существуют уже давно. Шкала оценки боли при лицах Вонг-Бейкера с ее последовательностью от счастливых до грустных мультяшных лиц висит в кабинете каждого педиатра с начала 1980-х годов. Краткий опросник с множеством шкал, краткий опросник боли, был создан для взрослых онкологических больных в 1983 году.
Краткий опросник с множеством шкал, краткий опросник боли, был создан для взрослых онкологических больных в 1983 году.
Шкалы боли призваны быстро и просто измерить интенсивность боли. Но они дают информацию без объективного смысла; на рейтинги влияют различные факторы, в том числе то, насколько пациенты чувствительны к боли и насколько вероятно, что они приведут к катастрофе или минимизируют свои страдания. И, сводя сложный внутренний опыт к одному значению, эти шкалы часто дают эффект, противоположный запланированному, сбивая пациентов с толку и задерживая постановку правильного диагноза.
«Дети младшего возраста обычно выбирают смайлик только потому, что он им нравится, — говорит Уильямс, — даже когда им очень больно».
Весы также не являются надежным способом измерения относительных изменений боли одного и того же человека с течением времени. «У меня есть пациенты, — говорит Джонассент, — которые, когда они в больнице проходят лечение от боли, я спрашиваю:« Что у вас болит? », И они говорят:« О, это восьмерка », и затем, после еще одной дозы обезболивающего, они все равно скажут, что это восьмерка, и мы почти попадаем в процесс, когда эти оценки боли становятся автоматическими. ”
”
Во-вторых, врачи часто просят пациентов описать, как они чувствуют боль. Язык боли был систематизирован в 1970 году с введением опросника Макгилла о боли, но исследования показывают, что такие слова, как тупой, острый, раскалывающий, рвущий и пульсирующий, на самом деле не так уж и полезны. В одном исследовании 1992 года пациенты пытались сопоставить разные типы боли с наиболее подходящим прилагательным и в итоге выбрали в среднем 10 типов боли на прилагательное.
Даже имея богатый и подвижный словарный запас, может быть трудно описать боль с удовлетворительными нюансами или точностью.В своем эссе 1926 года «О болезни» Вирджиния Вульф известна тем, что в литературе мало описаний боли: «У самой простой школьницы, когда она влюбляется, есть Шекспир или Китс, которые высказывают свое мнение за нее; но позвольте пациенту попытаться описать врачу головную боль, и язык сразу высохнет ».
В то время как оценка боли может быть разочаровывающей и непродуктивной для любого, кто страдает серповидно-клеточной анемией, этот процесс непропорционально сильно затронул пациентов из малообеспеченных сообществ.
Недостатки описания боли особенно ярко проявляются у детей, а также у пациентов с низкой грамотностью или не говорящих на том же языке, что и их врачи. Хотя перевод может показаться очевидным способом преодоления языкового разрыва, исследования показывают, что болевые слова в некоторой степени зависят от культуры. Одно исследование 2016 года, посвященное скелетно-мышечной боли, показало, что у непальских пациентов нет сопоставимого слова для обозначения «болящий», основного дескриптора боли в США
. Однако в конечном итоге врачи могут даже не принимать во внимание описания пациентов.«Я чувствую, что разговариваю с десятками врачей, медсестер и фельдшеров, — говорит Джонассент, — что медработники не заботятся о том, как вы чувствуете боль. Они просто хотят знать, нужно ли вам какое-либо обезболивающее или есть более серьезная проблема, которую необходимо решить. Сказать врачу, что боль ноющая, а не жжение, обычно не помогает, потому что эти дескрипторы не были тесно связаны с какими-либо медицинскими результатами. Так что для провайдеров это часто «кого это волнует».”’
Так что для провайдеров это часто «кого это волнует».”’
Обновления сенсорного экрана
Доступны более новые инструменты оценки боли, в том числе ряд приложений, например Catch My Pain. Но большинство из них по-прежнему используют те же методы, что и их предшественники, написанные ручкой и бумагой — весы и болевые слова, с обновлением сенсорного экрана.
«С большинством этих приложений, — говорит Уильямс, — они либо выглядят как старые бумажно-карандашные штуки, и их просто перенесли на экран, разработанный клиницистами без особой технической помощи, либо они очень увлекательные и удобные для пользователя, но им не хватает клинической полезности и смысла.”
Jonassaint не видит смысла переупаковывать старые концепции. Вот почему он вместе с командой врачей, программистов и ученых из Университета Питтсбурга, Университета Карнеги-Меллона и Университета Дьюка разработал Painimation, приложение, которое переводит боль в абстрактные анимации.
Работа Йонассента по коммуникации с болью является ответвлением его основного клинического направления — серповидно-клеточной анемии, генетического заболевания с хронической болью в качестве отличительного симптома. По словам Джонассента, пациенты с серповидно-клеточной структурой являются примером воздействия неравенства в сфере здравоохранения.Он заметил, что, хотя оценка боли может быть разочаровывающей и непродуктивной для любого, кто страдает серповидно-клеточной анемией, этот процесс непропорционально затронул пациентов из малообеспеченных общин. Поэтому Джонассент и его команда решили создать инструмент оценки, который мог бы использовать любой пациент, независимо от его возраста, родного языка, уровня грамотности или комфорта, подающего жалобу врачам.
По словам Джонассента, пациенты с серповидно-клеточной структурой являются примером воздействия неравенства в сфере здравоохранения.Он заметил, что, хотя оценка боли может быть разочаровывающей и непродуктивной для любого, кто страдает серповидно-клеточной анемией, этот процесс непропорционально затронул пациентов из малообеспеченных общин. Поэтому Джонассент и его команда решили создать инструмент оценки, который мог бы использовать любой пациент, независимо от его возраста, родного языка, уровня грамотности или комфорта, подающего жалобу врачам.
Они представили пробную версию Painimation в июне, после тестирования приложения в исследовании с участием 170 пациентов в клинике боли Медицинского центра Университета Питтсбурга.Результаты исследования были опубликованы в августе в журнале Journal of Medical Internet Research .
Вот как работает Painimation: с помощью iPad вы отмечаете место боли на трехмерном манекене.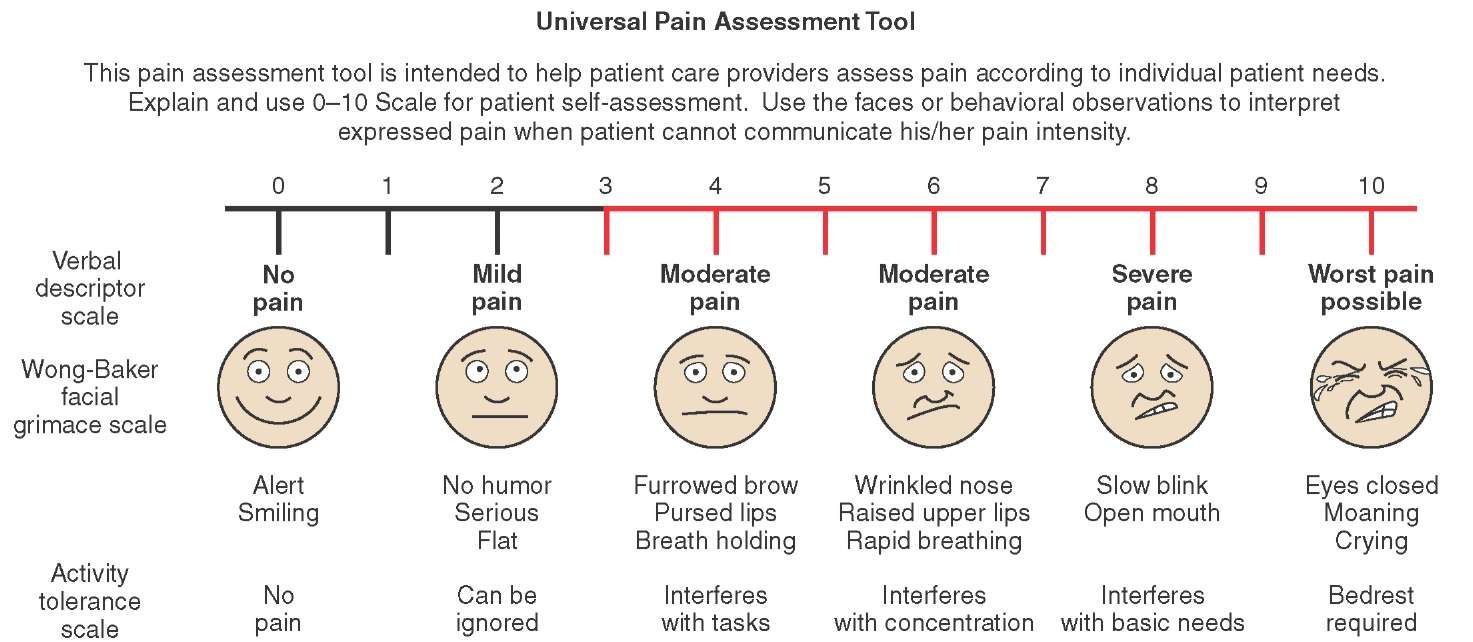 Затем вы просматриваете восемь анимаций («болеутоляющих») и выбираете ту, которая лучше всего соответствует вашим ощущениям от боли. Все они напоминают лоу-фай графику из музыкальных клипов 80-х — или, может быть, рудиментарные заставки Windows — и каждый представляет различное болевое ощущение (стук, стрельба, пульсация, покалывание, спазмы, жжение, колющие боли, электризация).Затем, чтобы анимация выглядела максимально похожей на вашу боль, вы используете скользящую шкалу для увеличения или уменьшения ее скорости, насыщенности цвета, фокуса и размера. Приложение позволяет пользователям создавать до пяти анимаций для каждой жалобы на боль. Ответы содержат информацию о местоположении, процентном отношении покрытия тела, сенсорных свойствах и уровне интенсивности от 1 до 100 для каждой анимации.
Затем вы просматриваете восемь анимаций («болеутоляющих») и выбираете ту, которая лучше всего соответствует вашим ощущениям от боли. Все они напоминают лоу-фай графику из музыкальных клипов 80-х — или, может быть, рудиментарные заставки Windows — и каждый представляет различное болевое ощущение (стук, стрельба, пульсация, покалывание, спазмы, жжение, колющие боли, электризация).Затем, чтобы анимация выглядела максимально похожей на вашу боль, вы используете скользящую шкалу для увеличения или уменьшения ее скорости, насыщенности цвета, фокуса и размера. Приложение позволяет пользователям создавать до пяти анимаций для каждой жалобы на боль. Ответы содержат информацию о местоположении, процентном отношении покрытия тела, сенсорных свойствах и уровне интенсивности от 1 до 100 для каждой анимации.
На данный момент Painimation — это инструмент исследования, и он не будет пробиваться в экзаменационные кабинеты «какое-то время», — говорит Джонассент.Его команда в настоящее время изучает Painimation, проводя сенсорное тестирование пациентов с панкреатитом и серповидноклеточной анемией, а также некоторых пациентов, у которых в анамнезе не диагностирована боль. Засунув руки в ведро со льдом или получив укол булавкой, они используют Painimation, чтобы описать возникающие ощущения.
Засунув руки в ведро со льдом или получив укол булавкой, они используют Painimation, чтобы описать возникающие ощущения.
Нетрудно понять, как метод Painimation может помочь пациентам, которые по той или иной причине имеют ограниченные возможности говорить о боли.Но для взрослых, которые более свободно говорят на языке боли, помогает ли Painimation передать боль или она просто наталкивается на одни и те же стены под другим углом?
Никто не может сказать наверняка, но возможно, что анимация инстинктивно задействует переживание головной боли, защемления нерва или вывиха сустава таким образом, что числа и слова, рожденные в логическом узле мозга, просто не могут. «Анимации такие абстрактные, — говорит Джонассент, — и для некоторых из них вы можете подумать: Что это должно быть? Но пациенты все равно их выбирают и говорят: «Ага, вот и моя боль.’”
Должен ли каждый сказать: «Это моя боль прямо здесь»? Другими словами, как команда Йонассента может узнать, что восемь созданных ими картинок боли являются универсальными репрезентациями боли? Уильямс не уверен, что смогут..gif)
«Для некоторых анимаций Painimation мне потребовалось много времени, чтобы получить их; Я бы не выбрала «острый», чтобы выразить острую боль », — говорит она. «Еще одна хитрость — это использование цвета. Красный часто используется для обозначения более сильной боли, а синий — для более слабой, но у многих людей с невропатической болью будет боль «холодного» типа.Так что для тех, чья боль становится холоднее по мере того, как становится сильнее, они действительно борются с красным, потому что он означает тепло — не в каждой культуре, а во многих. Поэтому нам нужно быть очень осторожными с обобщениями ».
Фундаментально несовершенный
В своем нынешнем виде приложение представляет собой раннюю версию того, что могло бы стать действительно хорошим, но все еще принципиально несовершенным инструментом оценки боли. В лучшем случае это в конечном итоге вышибет из воды существующие несовершенные инструменты. Чтобы добиться этого, команде Йонассента необходимо будет устранить многочисленные ограничения. Например, Painimation в настоящее время ограничена зрячими пациентами, проблема, для которой Джонассент видит потенциальное решение: «Я думаю, что мы могли бы начать использовать элементы, которые люди могут трогать и обрабатывать, что-то, что обеспечивает тактильную обратную связь для имитации болевых ощущений».
Например, Painimation в настоящее время ограничена зрячими пациентами, проблема, для которой Джонассент видит потенциальное решение: «Я думаю, что мы могли бы начать использовать элементы, которые люди могут трогать и обрабатывать, что-то, что обеспечивает тактильную обратную связь для имитации болевых ощущений».
Помимо ограничений с потенциальными исправлениями, кроются более серьезные недостатки, как указывали другие исследователи боли, которые, тем не менее, признают сложность и креативность Painimation, особенно по сравнению с другими приложениями на рынке.
Уильямс говорит, что она могла видеть, как Painimation понравится разочарованным пациентам с хронической болью, но она все еще задается вопросом, насколько это может улучшить вторую половину коммуникации боли — интерпретацию. По ее словам, в экспериментах, в которых пациенты рисовали головную боль, им нравилась художественная отдача, но рисунки не улучшали диагноз. «Точное понимание того, что такое боль, на самом деле не является главной проблемой для клинициста», — говорит Уильямс, объясняя, что врачам и медсестрам все еще необходимо установить взаимопонимание с пациентами и понимать другие факторы, такие как уровень их тревожности и личностные черты, которые влияют как на физический, так и на эмоциональный опыт жизни с болью.
Шагая по тротуару, хромая на чередующиеся ноги, я мог думать только об одном: как я объясню свою боль кому-то другому.
И хотя Боб Джемисон, клинический психолог и профессор Гарвардской медицинской школы, который разработал приложение для снятия боли в смартфоне, говорит, что Painimation обещает врачам знать, что испытывают отдельные пациенты, он все же считает, что мы в конечном итоге ждем настоящий прорыв.
«Есть надежда, что будущие оценки, такие как сканирование мозга с помощью фМРТ, будут достаточно сложными, чтобы можно было объективно определить боль», — говорит он.«Между тем, боль остается тем, о чем говорят люди, и способы передачи этого опыта, на мой взгляд, останутся далеко не идеальными».
Конечно, есть степени «ниже идеала», и Йонассен стремится добиться успехов в области неидеального. По его мнению, нам не нужно устранять субъективность в оценках боли, чтобы добиться улучшений. Мы можем многое сделать с помощью уже имеющихся передовых технологий, таких как виртуальная и дополненная реальность и методы машинного обучения.
Сам Йонассен не обязательно рассматривает Painimation как инструмент, который заново изобретает общение с болью. Он просто надеется, что это заставит врачей и пациентов пересмотреть то, как их учили думать и говорить о боли. «Нашим самым большим препятствием на пути к успеху в привлечении людей к Painimation, — говорит он, — является то, что она бросает вызов статус-кво. Но статус-кво — это именно то, от чего нам нужно избавиться ».
На прошлой неделе, менее чем на середине вечерней пробежки, у меня заболело колено.Когда другой последовал его примеру, я решил отправиться домой. Пока я шел по тротуару, хромая на чередующиеся ноги, я мог думать только об одном: как я объясню свою боль кому-то другому.
Это была не просто тупая или резкая боль. Это не было похоже на шестерку или хмурое лицо. Боль в коленях была, если цитировать несколько исследовательских работ, «многогранным сенсорным опытом». Вспомнив о Painimation, я попытался воплотить мою боль в абстрактные анимации. Однако передо мной не было реальных болевых ощущений, поэтому я стал фристайлом.Я визуализировал движущуюся, похожую на паутину массу, парящую над каждым коленом, почти как приближающийся фронт шторма, заполненный нечеткими точками и лозами. Я мог видеть массы в красных, синих или нейтральных тонах; цвет не имел значения.
Однако передо мной не было реальных болевых ощущений, поэтому я стал фристайлом.Я визуализировал движущуюся, похожую на паутину массу, парящую над каждым коленом, почти как приближающийся фронт шторма, заполненный нечеткими точками и лозами. Я мог видеть массы в красных, синих или нейтральных тонах; цвет не имел значения.
Я могу представить себе, как могла бы работать будущая усовершенствованная версия Painimation: когда наступает боль, я пролистываю расширенную библиотеку анимаций, комбинирую и настраиваю их по мере необходимости и накладываю все на фотографию своего колена ( спасибо, В.Р.), что дает клинически подтвержденную картину боли.
Может быть, не так уж и сложно найти правильные слова: «Ага, вот и моя боль».
Оценка боли: обзор имеющихся инструментов
Медицинским работникам, занимающимся лечением боли, необходимы объективные меры, учитывающие как эмоциональные, так и сенсорные аспекты переживания боли пациентом. Это далеко не простая задача.
Боль по своей сути субъективна и может рассматриваться как эмоциональная реакция на личный опыт. Фактически, эмоциональные страдания — важный и, возможно, недооцененный аспект постоянной боли. 1 В то же время боль вездесуща и знакома каждому, и остается одной из наиболее частых причин, по которой американцы обращаются к системе здравоохранения. 2
Острую боль, как правило, проще определить количественно, чем хроническую боль. Мониторинг времени до реакции на различные уровни вредной стимуляции в экспериментальных условиях может обеспечить объективную оценку как для людей, так и для животных. Однако при хронической боли ядовитый раздражитель часто отсутствует.Обычно он измеряется либо на основе самоотчета пациента, либо на основе наблюдения за его поведением, что может привести к ненадежным результатам. 3
Текущие показатели боли
Регулярная оценка боли — важная часть терапии хронической боли. Идеальный инструмент для оценки боли должен давать числовую оценку или другой объективный показатель, быть простым в применении, понятным пациентам и давать воспроизводимые результаты с хорошей специфичностью и чувствительностью. Существует ряд клинически протестированных и утвержденных шкал боли (щелкните здесь, чтобы просмотреть полный список). 4-28
Существует ряд клинически протестированных и утвержденных шкал боли (щелкните здесь, чтобы просмотреть полный список). 4-28
Среди наиболее часто используемых шкал боли в США — визуальная аналоговая шкала (ВАШ). 29 При использовании ВАШ пациенту показывают линию 100 мм и просят указать на область линии, которая описывает его или ее боль, причем левый конец шкалы означает «без боли», а правый конец — « худшая боль, которую только можно вообразить ». Самая известная педиатрическая шкала боли — это шкала ЛИЦ Вонга-Бейкера, в которой ребенку показывают 6 лиц — от улыбающегося счастливого лица до сильно плачущего лица — и спрашивают, какое лицо лучше всего отражает его или ее текущий уровень боли. 20
Боль проявляется множеством способов (функциональные ограничения, эмоциональные симптомы, физические ощущения и поведенческие изменения), и клиницист должен тщательно выбирать инструмент оценки боли, который наиболее точно соответствует симптомам и состоянию пациента. Это само по себе может вызвать путаницу, поскольку шкалы боли не являются взаимозаменяемыми — оценка 10 по одной шкале может не соответствовать той же оценке по другой. Более того, шкалы боли могут не только измерять интенсивность боли, но и учитывать аспекты, которые меняются с течением времени, включая функциональные ограничения, эмоциональные соображения и поведение.
Это само по себе может вызвать путаницу, поскольку шкалы боли не являются взаимозаменяемыми — оценка 10 по одной шкале может не соответствовать той же оценке по другой. Более того, шкалы боли могут не только измерять интенсивность боли, но и учитывать аспекты, которые меняются с течением времени, включая функциональные ограничения, эмоциональные соображения и поведение.
Для определения этих показателей шкалы боли основываются на отчете пациента, медицинского работника или, в некоторых случаях, родителей, члена семьи или опекуна. Самостоятельные отчеты могут или не могут быть последовательными с течением времени, но были подтверждены во многих исследованиях оценки боли.
Язык боли имеет решающее значение для ее надежной оценки. Пациенту может быть легче уловить и классифицировать более длинные и полные описания боли, чем дескрипторы боли, такие как «умеренная боль» или «боль, которая усиливается.”
Также может быть клинически значимым оценивать боль не с точки зрения интенсивности боли, а скорее с точки зрения того, насколько и каким образом эта боль мешает функционированию. Например, пациенту с хронической болью может быть важнее иметь возможность комфортно сидеть в кино, чем потерять 1 балл по числовой шкале оценок. Шкалы боли могут также игнорировать эмоциональные компоненты боли и симптомы психического расстройства, такие как депрессия, беспокойство и стресс.
Например, пациенту с хронической болью может быть важнее иметь возможность комфортно сидеть в кино, чем потерять 1 балл по числовой шкале оценок. Шкалы боли могут также игнорировать эмоциональные компоненты боли и симптомы психического расстройства, такие как депрессия, беспокойство и стресс.
Несмотря на похвальные усилия по разработке показателей, которые точно и последовательно измеряют уровень боли с течением времени, ни один из множества доступных инструментов не справляется с этой задачей идеально.По этой причине 15 лет назад была разработана комбинированная шкала боли в поликлинике штата Индиана (IPCPS), чтобы предложить широту охвата, необходимую некоторым пациентам с хронической болью, простоту, необходимую для беспокойной клинической практики, и универсальность, позволяющую охватить широкий круг пациентов.
Новые шкалы оценки
IPCPS состоит из комбинированной шкалы боли, комбинированной функциональной шкалы, комбинированной шкалы депрессии и комбинированной шкалы тревожности (см. Таблицы 1-4). Новые инструменты оценки, разработанные авторами, пытаются учесть весь спектр болевых ощущений и могут предоставить более точный способ оценки и документирования хронической боли.
Таблицы 1-4). Новые инструменты оценки, разработанные авторами, пытаются учесть весь спектр болевых ощущений и могут предоставить более точный способ оценки и документирования хронической боли.
Загрузить таблицу 1 PDF
Загрузить таблицу 2 PDF
Загрузить таблицу 3 PDF
Загрузить таблицу 4 PDF
Как IPCPS измеряет интенсивность боли
IPCPS оценивает интенсивность боли по известной 11-балльной шкале, где 0 означает «нет боли», а 10 «наихудшая из возможных болей». Однако более заметными, чем цифры на шкале, являются четкие определения различных состояний боли. С этими добавленными описаниями и примерами пациенты, страдающие болью, смогут лучше контекстуализировать и оценивать свои собственные переживания интенсивности боли.
Первичный отчет заполняется пациентом без помощи медицинского персонала. Во время приема врач просматривает заполненную форму вместе с пациентом (и любыми сопровождающими лицами). Все могут задавать вопросы. После некоторого обсуждения и разъяснений пациент может лучше понять оценку интенсивности боли и может пересмотреть свой исходный отчет, чтобы исключить ненужные ошибки или неуместно высокие или низкие баллы.
Поскольку интенсивность боли может колебаться у пациентов с хронической болью, для клиницистов важно часто и последовательно оценивать боль с помощью IPCPS.
Как IPCPS включает функциональное нарушение
Хроническая боль мешает функционированию и может, в свою очередь, влиять на самочувствие, независимость и способность пациента вести нормальную повседневную жизнь. Одним из стандартных показателей функции была мера функциональной независимости (FIM), анкета из 18 пунктов, описывающая 13 двигательных функций (включая прием пищи, уход и купание) и 5 когнитивных функций (включая выражение, социальное взаимодействие и память), которые пациенты оценивают индивидуально по шкале от 0 до 7. 30 Чем выше оценка, тем более независимым является пациент при выполнении этой задачи. Шкала FIM требует, чтобы врач был обучен ее использованию и наблюдал за пациентом, когда он или она выполняет определенные задачи.
IPCPS использует модифицированную шкалу FIM, что позволяет ему хорошо работать в широком диапазоне условий и оставаться в соответствии с частью IPCPS по интенсивности боли. Шкала FIM была изменена с исходной шкалы от 0 до 7 на 11-балльную шкалу, где 0 означает «безупречное функционирование», а 10 «полная инвалидность».«Пациентам также разрешается сообщать о своих оценках самостоятельно, а не давать оценку их работе специалисту в области здравоохранения. Как и в случае шкалы интенсивности боли, каждое число описывается словами, чтобы пациент мог контекстуализировать свои функциональные ограничения.
Как IPCPS объединяет депрессию и тревогу
Стыд, вина, унижение, смущение и психическое поражение классифицируются как «застенчивые эмоции» и значительно чаще встречаются у пациентов с хронической болью, чем у пациентов контрольной группы. 31 Такие застенчивые эмоции увеличивают интенсивность боли, а психическое поражение в значительной степени связано с инвалидностью. 31 Катастрофизация также может усугубить состояние хронической боли. 32
Между тем пациенты с хронической болью, которых просят количественно оценить их внутренние переживания, могут переоценить свои депрессивные симптомы. 33 Помимо пунктов, связанных с депрессией и тревогой в шкалах оценки боли, существуют проверенные инструменты оценки, которые можно использовать для конкретного измерения этих симптомов.Однако эти рейтинговые системы иногда бывают сложными или требуют специально обученного клинициста для проведения теста. 34
Представление оценок депрессии и тревожности в формате VAS позволяет часто оценивать пациента в течение определенного периода времени, что позволяет получить ряд оценок, которые могут дать представление о прогрессировании симптоматики, боли и результатах лечения. 35 Поскольку баллы по ВАШ являются числовыми, они позволяют избежать грамотных, языковых или культурных барьеров, которые могут возникнуть, когда врачи пытаются заставить пациентов описать свое душевное состояние. 36 В целом, тесты VAS просты, легки в администрировании, быстрые, недорогие и практичные для реальных клиник с разнообразными группами пациентов. 37
Команда поликлиники Индианы стремилась установить метрику для эмоционального компонента рейтинговой шкалы, чтобы она могла точно классифицировать депрессию и тревогу таким образом, чтобы пациент мог правильно и объективно самостоятельно сообщать о своем эмоциональном статусе. Хотя тревога и депрессия являются состояниями психического здоровья, которые могут повлиять на боль, для них требуются отдельные шкалы, поскольку они представляют собой принципиально разные состояния.
Важно понимать, что для постановки диагноза большого депрессивного расстройства (БДР) не требуется, чтобы пациент чувствовал себя подавленным. Ангедония вместе с другими симптомами, такими как усталость и снижение концентрации внимания, достаточны для диагноза БДР. По этой причине в анкету была добавлена «радость жизни», чтобы помочь лучше идентифицировать пациентов, страдающих некоторой степенью ангедонии.
Использование IPCPS на практике
IPCPS состоит из 4 тестовых инструментов схожей конструкции, каждый из которых предлагает как словесные описания, так и числовые оценки для пациентов.Основываясь на опыте работы в поликлинике Индианы за последние 15 лет, наиболее полезно назначать все 4 теста пациентам с комплексной и хронической болью, даже тем, кто не выглядит особенно подавленным или не демонстрирует заметных степеней функциональных нарушений. Хотя на первый взгляд эти инструменты могут показаться многословными, они становятся привычными для пациента после первых нескольких использований. Затем пациенты могут оценить эти четыре аспекта своей жизни (интенсивность боли, функции, депрессия и беспокойство) за считанные минуты.Текстовые описания различных оценок могут также служить трамплином для более глубокого обсуждения опыта пациента.
Необходимы дальнейшие исследования для валидации IPCPS и сравнения его с более известными шкалами боли (все шкалы доступны для загрузки)
Инструмент мониторинга зависимости от хронической боли
Риски и преимущества долгосрочной опиоидной терапии для лечения хронической боли могут со временем меняться. Личный или семейный анамнез зависимости является обычным постоянным риском, связанным с потенциальным злоупотреблением и зависимостью, в то время как психосоциальные проблемы, а также сопутствующие соматические и психические состояния могут быть динамическими факторами. 38
Инструмент скрининга риска зависимости (STAR) был разработан для оценки потенциально аберрантного поведения у пациентов, начинающих длительную опиоидную терапию. 39 STAR предназначен для использования до начала длительного лечения опиоидами и учитывает различные психосоциальные факторы, а также другие риски, связанные с психоактивными веществами. 39 Некоторые вопросы в исходной версии STAR ограничивают постоянную оценку психосоциальных факторов. Также отсутствуют другие важные вопросы, относящиеся к более серьезным отклонениям в поведении. 40
Таким образом, с разрешения разработчиков STAR, поликлиника Индианы в Индианаполисе создала модифицированную версию для учета потенциальных изменений, которые могут произойти в ходе длительной опиоидной терапии, а также незаконного поведения. Версия STAR-IPC содержит в общей сложности 15 вопросов, ее легко набрать, и ее заполнение занимает менее 5 минут (таблица 5). При использовании в сочетании с другими стратегиями управления рисками он может помочь выявить потенциальные риски, рекомендовать изменения в уровне практики мониторинга или оправдать направление к специалистам по лечению зависимости или полное прекращение употребления опиоидов.
Загрузить таблицу 5 PDF
У версии STAR-IPC есть несколько ограничений. Он не предназначен для использования в качестве детектора лжи и не должен использоваться без дополнительных стратегий мониторинга, таких как проверка на наркотики, общение с другими поставщиками медицинских услуг и родственниками пациента, проверка медицинских записей и PDMP. Пересмотренная версия не прошла валидацию и требует дополнительных исследований. Его можно улучшить, добавив вопрос об использовании бензодиазепинов.
Благодарности: Автор благодарит Джо Энн ЛеКуанг и Скотта де Лонга из LeQ Medical в Англтоне, штат Техас, которые помогли с редактированием и вычиткой этой рукописи. Автор также благодарен Терезе Холл, О.Т., за ее решающий вклад в разработку шкал, представленных в этой статье. Адам Гофф, BA, проанализировал доступные шкалы депрессии и тревоги с соответствующей библиографией. Критика Брюса Дурелла, доктора медицины, и Линды Прокай, штат Пенсильвания, помогла в формировании весов.Он также благодарит Пола Адамса за помощь в редактировании и Джона Видельмана за презентабельность весов.
Последнее обновление: 29 апреля 2019 г.
Оценка рисков: безопасные инструменты для назначения опиоидов
Шкала поведенческой боли (BPS) для оценки боли у интубированных пациентов
Почему вы разработали шкалу поведенческой боли? Был ли конкретный клинический опыт или встреча с пациентом, которые вдохновили вас на создание этого инструмента для врачей?
Я решил создать этот клинический инструмент, потому что медсестры в моем отделении интенсивной терапии (ОИТ) жаловались на отсутствие медицинского интереса к боли у седативных невербальных пациентов.Таким образом, мы начали с инструмента для оценки боли (или ноцицепции) у этих пациентов.
Какие жемчужины, подводные камни и / или советы вы можете дать пользователям шкалы поведенческой боли? Известны ли вам случаи, когда оно применялось, интерпретировалось или использовалось ненадлежащим образом?
BPS следует использовать в покое и во время ядовитого раздражителя, например эндотрахеальное отсасывание, поворот, мобилизация.
Чтобы быть уверенным, что оценка BPS проводится разными оценщиками, все описание пунктов должно быть легко доступно, например.грамм. на панели, присутствующей в каждой палате интенсивной терапии.
Бесполезно оценивать боль слишком часто, т.е. ежечасно. Обычно достаточно оценивать боль один раз за смену (8 часов) плюс каждый раз при смене анальгезии.
Какие рекомендации вы дадите врачам после того, как они применили шкалу поведенческой боли? Будете ли вы вносить какие-либо корректировки или обновления в оценку на основе новых данных или изменений в практике?
Крайне важно наладить диалог между врачами и медсестрами в отделении интенсивной терапии о боли и седативном действии, чтобы написать местный протокол, описывающий, какие клинические инструменты следует использовать для оценки, цели, которых нужно достичь для оптимального обезболивания и седации, выбор препараты, доступные в отделении интенсивной терапии, и алгоритм корректировки доз в соответствии с результатами этой оценки.
Есть ли другие предстоящие исследования, которые вам особенно интересны?
Более количественный подход к оценке ноцицепции у невербальных пациентов интенсивной терапии может быть достигнут с помощью анализа изменений размера зрачка в ответ на стандартизированную ядовитую стимуляцию. Эта количественная пупиллометрия представляет собой инфракрасный видеопупиллометр, оборудованный тетаническим стимулятором.
(PDF) Оценка послеоперационной боли на основе числовых оценок — не одно и то же для пациентов и профессионалов: перекрестное исследование
Цель: Цель этого систематического обзора заключалась в синтезе наилучших доступных доказательств, касающихся измерительных свойств инструментов многомерной оценки боли, используемых для оценки послеоперационной боли у взрослых.Вступление: Боль — частое и плохо контролируемое явление у пациентов в послеоперационный период. В настоящее время послеоперационная боль обычно оценивается с помощью инструментов оценки, которые измеряют одно измерение боли, а именно интенсивность боли, что приводит к неадекватному управлению послеоперационной болью. Важно понимать сложную природу боли, учитывая все аспекты для оптимального послеоперационного обезболивания. Отсутствуют систематические, надежные доказательства в отношении наиболее психометрически надежного и достоверного инструмента многомерной оценки боли для взрослых послеоперационных пациентов.Критерии включения: В этом систематическом обзоре для включения были рассмотрены все типы исследований. Рассматривались исследования, если они оценивали измерительные свойства инструмента многомерной оценки боли у взрослых послеоперационных пациентов в течение двух недель после операции. Результаты включали измерение по крайней мере одного из психометрических свойств, включая надежность, валидность и отзывчивость. Методы: Была предпринята трехэтапная стратегия поиска, включая поиск в базах данных MEDLINE, Embase, Cochrane Trials (CENTRAL) и CINAHL, проведенный в октябре 2019 года.Мы также провели поиск по работе с диссертациями в International, ProQuest Dissertations and Theses, MedNar и ClinicalTrials.gov, чтобы найти неопубликованные исследования. Название и выдержки из исследований были проверены двумя независимыми рецензентами на предмет критериев включения / исключения. Методологическое качество потенциальных исследований было независимо оценено тремя рецензентами с использованием контрольного списка COSMIN. Полученные результаты: В обзор были включены семнадцать исследований, включающих пять многомерных инструментов оценки послеоперационной боли: Пересмотренный вопросник Американского общества по оценке боли, Краткая инвентаризация боли, Houston Pain Outcomes Instrument, McGill Pain Questionnaire, and the Quality Improvement in Postoperative Pain Management Postoperative Pain Questionnaire.Двумя наиболее часто используемыми инструментами были Краткая инвентаризация боли и Пересмотренный вопросник по оценке исходов боли Американского общества боли, каждый из которых оценивался в шести исследованиях. Включенные исследования в основном сообщали о надежности внутренней согласованности, при этом четыре из пяти выявленных инструментов продемонстрировали высокие значения альфа Кронбаха в диапазоне от 0,72 до 0,92. Тем не менее, Houston Pain Outcomes Instrument продемонстрировал смешанные результаты: восемь из девяти подшкал имели надежность от умеренной до высокой, в то время как ожидания относительно подшкалы боли имели низкую надежность (α = 0.003). Выводы: Этот обзор предоставляет очень необходимую информацию о текущих инструментах, используемых во многих клинических, образовательных и исследовательских учреждениях. Из пяти инструментов, включенных в этот обзор, Краткая инвентаризация боли продемонстрировала убедительные доказательства психометрической валидности и рекомендуется для использования при оценке послеоперационной боли. Дальнейшая психометрическая валидация инструментов многомерной послеоперационной оценки боли с акцентом на отзывчивость и ошибку измерения необходима для точной оценки минимальной клинически значимой разницы в результатах послеоперационной боли.
Оценка боли в соответствии с Международной классификацией боли при травмах спинного мозга у пациентов с травмой спинного мозга, направленных в многопрофильный центр боли
Целью этого исследования было классифицировать ретроспективный набор данных пациентов с травмой спинного мозга и хронической болью, которые были направлены к мультидисциплинарный центр боли по классификации ISCIP. Кроме того, были изучены связи между типами боли при травме спинного мозга и демографическими или связанными с заболеванием переменными.
Полезность классификации ISCIP
С клинической точки зрения авторов, используя неврологический и болевой анамнез пациента, клиническое неврологическое обследование, шкалу ASIA и рисунок боли пациента, можно было определить типы и подтипы боли в большинстве зарегистрированных мест боли при первом посещении, даже у сложных хронических пациентов с длительной инвалидностью и болями после ТСМ.Только у 8% пациентов тип боли оставался неизвестным. Это означает, что для очень небольшого числа пациентов было необходимо дальнейшее диагностическое обследование. Поэтому, на наш взгляд, применение классификации ISCIP является простым в использовании и с учетом высокой частоты классифицируемых типов боли в течение первого визита. Это может помочь немедленно предоставить подходящие доступные варианты лечения и сэкономить затраты на обширное дифференциальное обследование или неправильное лечение. По сравнению с предыдущей доступной классификацией боли для боли при травме спинного мозга Международной ассоциации по изучению боли (IASP) 30 , классификация ISCIP имеет то преимущество, что классифицирует любой тип боли, связанный или не связанный с травмой спинного мозга.В многопрофильном центре боли полезно решать все проблемы, связанные с болью, с использованием одной классификации. Например, переход от «выше уровня нейропатической боли» к «другой нейропатической боли» дает возможность кодировать состояния нейропатической боли ниже уровня повреждения, которые не связаны с SCI, такие как полинейропатия или дополнительные травматические поражения нервов. Кроме того, возможность кодировать отдельные синдромы ненейропатической боли, такие как «фибромиалгия», под «другой болью» является преимуществом.Мы предполагаем, что тщательное использование пунктов классификации ISCIP приведет к более индивидуальному подходу к долгосрочному ведению пациентов с их болевым состоянием. Хотя надежность использования классификации ISCIP минимально подготовленными клиницистами, использующими подход клинической виньетки, оценивается как умеренная 8 , на этом этапе, по нашему опыту, можно встретить использование классификации в клинических условиях.
Социально-демографические данные
Что касается среднего возраста, наша когорта сопоставима с литературой пациентов с хронической болью 31, 32 и аналогичных 12 или старше 13 по сравнению с другими когортами SCI.В основном, в популяции с хронической болью больше женщин, 31, 32 , что не отражает нашу группу пациентов. Распределение по полу в нашей когорте (74% мужчин) аналогично распределению по полу в Швейцарии (72% мужчин). 15 Напротив, несколько больше мужчин были затронуты в других когортах SCI (83%, 13 ; 88%, 12 ).
Данные, связанные с болью
Предполагается, что серьезность проблем с болью выше в нашей популяции по сравнению с людьми с ТСМ.Действительно, данные популяционного обследования населения Швейцарского когортного исследования травм спинного мозга (SwiSCI) с травматической или нетравматической травмой спинного мозга сообщили о сильной боли (> 6 баллов по NRS) менее чем у 30% участников. 15 В когорте пациентов с травмой спинного мозга 58% сообщили о сильной и мучительной боли через 5 лет после травмы спинного мозга. 13 Для сравнения, о сильной боли сообщили все пациенты, кроме трех в нашей выборке (95%), со средней интенсивностью боли NRS 8,2. Таким образом, можно сделать вывод, что только пациенты, которые больше не могут справляться со своей болью с помощью своего терапевта, направляются в многопрофильный центр лечения боли.Распределение наивысшей интенсивности боли для висцеральной боли, за которой следует аналогичная интенсивность боли на уровне и ниже уровня SCI и более низкая интенсивность для скелетно-мышечной боли в нашей когорте, аналогично тому, о котором сообщалось ранее. 13
Хроничность боли, тяжесть боли, сопутствующие психические расстройства и качество жизни
В нашей когорте SCI распространенность более высоких стадий хронической боли согласно MPSS сравнима с таковой при хронической нераковой боли. 32 Что касается взаимосвязи между интенсивностью боли и вмешательством в деятельность, исследованную с помощью GCPS, наша популяция пациентов была хуже, чем в предыдущих исследованиях пациентов с болью при ТСМ. В нашей группе две трети пациентов показали самую высокую степень выраженности боли по сравнению с 16,4%. 13 Более того, согласно нашим результатам, 45% пациентов с неконтролируемой невропатической болью, не связанной с ТСМ, отметили, что их заболевание серьезно или крайне мешает их повседневной деятельности. 31
Согласно HADS, наша когорта показала признаки тревоги и депрессии, что согласуется с пациентами с хронической нераковой болью. 33 Кроме того, у пациентов с неконтролируемой нейропатической болью в клинике боли депрессия была зарегистрирована у 53%, а тревога — у 43%, 31 сопоставимо с нашей когортой (53 и 56%). У пациентов с болью в области спинного мозга была обнаружена худшая оценка настроения по сравнению с пациентами без боли. 13
Оценка качества жизни, связанного со здоровьем, была низкой для физических и психических расстройств, что аналогично оценке пациентов с хронической болью без ТСМ. 32 Точно так же 50% пациентов с неконтролируемой невропатической болью оценили свое общее состояние здоровья как плохое или очень плохое. 31
В соответствии с предыдущим обзором, значимая корреляция была обнаружена между более высокими уровнями депрессии (HADS-D) и более высокой интенсивностью боли, оцененной по шкале боли GCPS. 3 Кроме того, была выявлена связь между интенсивностью боли (GCPS) и психическим здоровьем (психическая подшкала SF-12), но отсутствовала связь между интенсивностью боли и физическим здоровьем (физическая подшкала SF-12).Действительно, боль оказывает широкое влияние на физическое, когнитивное, эмоциональное и социальное функционирование людей с травмой спинного мозга. 34, 35 Столкнувшись с трудностями лечения боли, боль является источником огромного психологического стресса у людей с травмой спинного мозга. 36
Следовательно, в центре боли лечились в основном пациенты с сильным воздействием боли, высоким уровнем депрессии / тревоги, низким уровнем качества жизни и высокой хронификацией. Таким образом, наши пациенты с болью в области травмы спинного мозга имеют такие же или даже худшие психосоциальные параметры, чем пациенты с хронической нераковой болью и неконтролируемой нейропатической болью. 31, 32
Типы боли
Более половины наших пациентов сообщили о более чем одном типе боли. Множественные участки боли были обнаружены у одной трети пациентов с хронической болью, 37 , что ниже, чем в нашей популяции. Наличие двух или более проблем с болью, как правило, разного типа, часто встречается у людей с травмой спинного мозга. 38
Недавнее исследование обнаружило боль на уровне у 54%, боль ниже уровня у 66% и боль на уровне и ниже у 20% пациентов с ТСМ. 39 Вопреки нашему исследованию, боль ниже уровня сообщалась чаще, чем боль на уровне, что может быть объяснено различным определением типов боли. Было обнаружено одно исследование, которое сообщило о результатах в соответствии с классификацией ISCIP 90 пациентов с ТСМ в течение первого года после травмы. 12 Они обнаружили, что общая распространенность боли составляет около 80%. Как и в нашем исследовании, скелетно-мышечная боль была наиболее распространенным типом боли, за ней следовала боль на уровне SCI и боль ниже уровня SCI, тогда как распространенность висцеральной боли составляла от 0 до 3%.Хотя невозможно напрямую сравнить наши результаты с исследованиями распространенности, распределение типов и подтипов боли соответствовало предыдущим исследованиям. 12, 13 В отличие от предыдущих исследований, 12 мы обнаружили некоторую взаимосвязь между характеристиками травм и типами боли. Пациенты с полными поражениями значительно чаще сообщали о невропатической боли на уровне, чем пациенты с неполными поражениями. Пациенты с параплегией чаще испытывали боль на уровне, тогда как пациенты с тетраплегией чаще сообщали о боли ниже уровня; последний аспект уже был описан. 13 В соответствии с предыдущими исследованиями интенсивность боли не была связана с характеристиками травмы или демографическими переменными. 2, 10
Дескрипторы боли
Дескрипторы качества боли более или менее соответствовали предыдущим исследованиям, хотя использовались другие анкеты. 12, 39 В нашем исследовании как боль на уровне, так и боль ниже уровня сообщалось как жжение (60 и 71%), но стрельба почти всегда происходила при боли на уровне (43 против 7%).Другое исследование показало, что горячее горение (60%), колющие удары (58%) и стрельба (55%) являются дескрипторами невропатической боли, но без разницы между острым и нижним уровнем боли. 12
Текущее лечение
При входе пациенты сообщали о лекарствах, которые они получали от боли, прежде чем обращаться в центр боли. В основном они сообщали об анальгетиках от ноцицептивной боли и противоэпилептических средствах от нейропатической боли. Действительно, фармакологическое лечение невропатической боли остается в центре внимания.Тем не менее, руководство по фармакологическому лечению нейропатической боли рекомендует препараты первого ряда (например, габапентин / прегабалин — противоэпилептические средства, трициклические антидепрессанты или местный лидокаин) в качестве начального лечения и препараты второго ряда (трамадол или сильнодействующие опиоиды). 40, 41 Тем не менее, анальгетики также назначались пациентам с невропатической болью (26%). Похоже, что есть некоторые расхождения между практикой и рекомендациями, которые могут быть выражением общих трудностей в лечении боли после травмы спинного мозга.Из-за ретроспективного дизайна нашего исследования более подробная информация о предыдущих лекарствах и других типах текущего или предшествующего лечения, таких как физиотерапия, интервенционная или психологическая терапия, была недоступна. Следовательно, невозможно было оценить предыдущие методы лечения и то, каким образом применение классификации ISCIP могло изменить лечение и его эффективность.
Настоящее исследование имеет некоторые ограничения.

 Попробуйте вести дневник в течение месяца до визита к врачу, затем принесите его на прием.
Попробуйте вести дневник в течение месяца до визита к врачу, затем принесите его на прием.
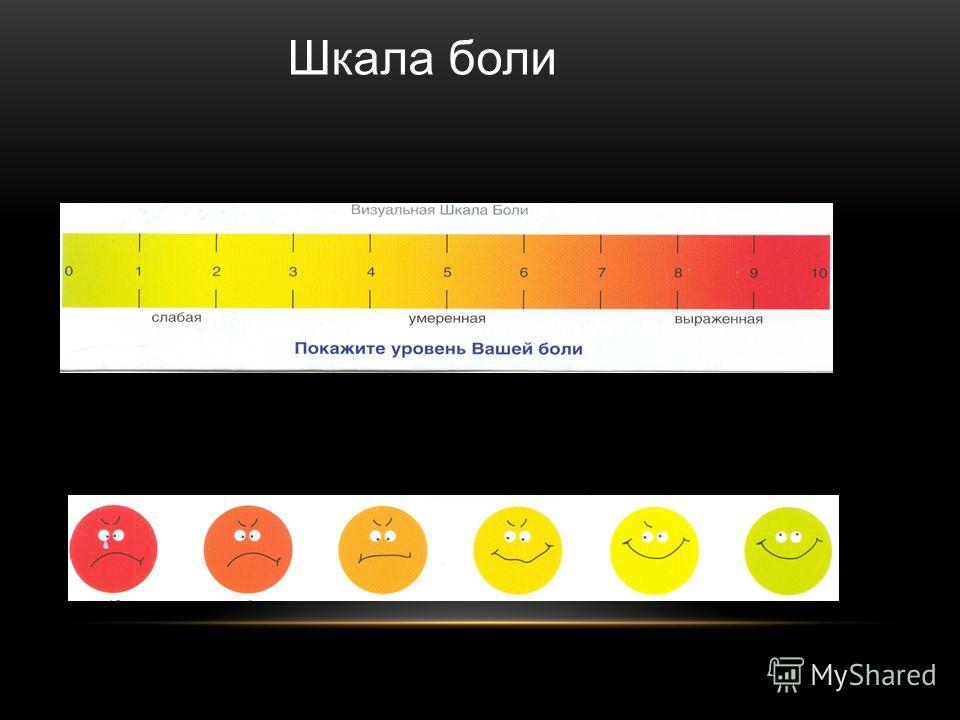 Чаще всего используется диапазон от 0 до 10. Ноль соответствует «без боли», а десять соответствует «наихудшей возможной боли».”
Чаще всего используется диапазон от 0 до 10. Ноль соответствует «без боли», а десять соответствует «наихудшей возможной боли».” Эти весы от боли особенно полезны для детей.
Эти весы от боли особенно полезны для детей. Это помогает оценить боль человека на основе набора прилагательных. Люди присваивают каждому прилагательному числовую оценку, чтобы указать, как это слово представляет их боль.
Это помогает оценить боль человека на основе набора прилагательных. Люди присваивают каждому прилагательному числовую оценку, чтобы указать, как это слово представляет их боль.