Новое в лечении паркинсона 2021: Здоровье: Наука и техника: Lenta.ru
Практические аспекты назначения противопаркинсонических препаратов. Место амантадинов в лечении болезни Паркинсона | Титова
1. Dorsey E.R., Elbaz A., Nichols E., Abd-Allah F., Abdelalim A., Adsuar J.C. et al. Global, Regional, and National Burden of Parkinson’s Disease, 1990–2016: a Systematic Analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2018;17(11):939–953. doi: 10.1016/S14744422(18)30295-3.
2. Gibb W.R., Lees A.J. The Relevance of the Lewy Body to the Pathogenesis of Idiopathic Parkinson’s Disease. J Neurol Neurosurg Psychiatry. 1988;51(6):745–752. doi: 10.1136/jnnp.51.6.745.
3. Postuma R.B., Berg D., Stern M., Poewe W., Olanow C.W., Oertel W. et al. MDS Clinical Diagnostic Criteria for Parkinson’s Disease. Mov Disorders. 2015;30(12):1591–1601. doi: 10.1002/mds.26424.
4. Grosset D., Taurah L., Burn D.J., MacMahon D., Forbes A., Turner K. et al. A multicentre longitudinal observational study of changes in self reported health status in people with Parkinson’s disease left untreated at diagnosis. J Neurol Neurosurg Psychiatry. 2007;78(5):465–469. doi: 10.1136/jnnp.2006.098327.
J Neurol Neurosurg Psychiatry. 2007;78(5):465–469. doi: 10.1136/jnnp.2006.098327.
5. Grosset D. Clinical diagnosis of parkinsonism and tremor. In: Okun M., Grosset K., Fernandez H., Grosset D. (eds.) Parkinson’s Disease: Clinican’s Desk Reference. Boca Raton, Florida: CRC Press; 2009. p. 176.
6. Clarke C.E., Davies P. Systematic Review of Acute Levodopa and Apomorphine Challenge Tests in the Diagnosis of Idiopathic Parkinson’s Disease. J Neurol Neurosurg Psychiatry. 2000;69(5):590–594. doi: 10.1136/jnnp.69.5.590.
7. Fox S.H., Katzenschlager R., Lim S.Y., Barton B., de Bie R.M.A., Seppi K. et al. International Parkinson and movement disorder society evidencebased medicine review: Update on treatments for the motor symptoms of Parkinson’s disease. Mov Disord. 2018;33(8):1248–1266. doi: 10.1002/mds.27372.
8. Ferreira J.J., Katzenschlager R., Bloem B.R., Bonuccelli U., Burn D., Deuschl G. et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20(1):5–15. doi: 10.1111/j.1468-1331.2012.03866.x.
Eur J Neurol. 2013;20(1):5–15. doi: 10.1111/j.1468-1331.2012.03866.x.
9. Parkinson Study Group. A Controlled Trial of Rasagiline in Early Parkinson Disease: The TEMPO Study. Arch Neurol. 2002;59(12):1937–1943. doi: 10.1001/archneur.59.12.1937.
10. Olanow C.W., Rascol O., Hauser R., Feigin P.D., Jankovic J., Lang A. et al. A Double-Blind, Delayed-Start Trial of Rasagiline in Parkinson’s Disease. N Engд J Med. 2009;361(13):1268–1278. doi: 10.1056/NEJMoa0809335.
11. Rascol O., Brooks D.J., Korczyn A.D., De Deyn P.P., Clarke C.E., Lang A.E. A Five-Year Study of the Incidence of Dyskinesia in Patients With Early Parkinson’s Disease Who Were Treated With Ropinirole or Levodopa. New Engд J Med. 2000;342(20):1484–1491. doi: 10.1056/NEJM200005183422004.
12. Holloway R.G., Shoulson I., Fahn S., Kieburtz K., Lang A., Marek K. et al. Pramipexole vs Levodopa as Initial Treatment for Parkinson Disease: A 4-year Randomized Controlled Trial. Arch Neurol. 2004;61(7):1044–1053. doi: 10. 1001/archneur.61.7.1044.
1001/archneur.61.7.1044.
13. Holloway R., Marek K., Biglan K., Dick A., Fahn S., Julian-Baros E. et al. Long-term Effect of Initiating Pramipexole vs Levodopa in Early Parkinson Disease. Arch Neurol. 2009;66(5):563–570. doi: 10.1001/archneur.66.1.nct90001.
14. Garcia-Ruiz P.J., Martinez Castrillo J.C., Alonso-Canovas A., Herranz Barcenas A., Vela L., Sanchez Alonso P. et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014;85(8):840-844. doi: 10.1136/jnnp-2013-306787.
15. Шипилова Н.Н., Титова Н.В., Кокаева З.Г., Федосова А.С., Климов Е.А., Катунина Е.А. Клинико-генетическое исследование импульсивнокомпульсивных расстройств у больных с болезнью Паркинсона. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(10):4–9. doi: 10.17116/jnevro20181181014.
16. Rabinak C.A., Nirenberg M.J. Dopamine agonist withdrawal syndrome in Parkinson disease. Arch Neurol. 2010;67(1):58–63. doi: 10.1001/archneurol.2009.294.
doi: 10.1001/archneurol.2009.294.
17. Danielczyk W. Twenty-five years of amantadine therapy in Parkinson’s disease. J Neural Transm Suppl. 1995;46:399–405. Available at: https://ncbi.nlm.nih.gov/pubmed/8821075.
18. Stoof J.C., Booij J., Drukarch B. Amantadine as N-methyl-D-aspartic acid receptor antagonist: new possibilities for therapeutic applications? Clin Neurol Neurosurg. 1992;94:4–6. doi: 10.1016/0303-8467(92)90006-o.
19. Butzer J.F., Silver D.E., Sahs A.L. Amantadine in Parkinson’s disease. A double-blind, placebo-controlled, crossover study with long-term follow-up. Neurology. 1975;25(7):603–606. doi: 10.1212/wnl.25.7.603.
20. Parkes J.D., Baxter R.C., Marsden C.D., Rees J.E. Comparative trial of benzhexol, amantadine, and levodopa in the treatment of Parkinson’s disease. J Neurol Neurosurg Psychiatry. 1974;37(4):422–426. doi: 10.1136/jnnp.37.4.422.
21. Катунина Е.А., Авакян Г.Н., Титова Н.В., Бездольный Ю.Н., Малыхина Е.А. Леводопа – от создания к новым разработкам. Журнал неврологии и психиатрии им. С.С. Корсакова. 2010;110(4):97–103. Режим доступа: https://mediasphera.ru/issues/zhurnal-nevrologii-i-psikhiatrii-im-s-s-korsakova/2010/4/031997-72982010418.
Журнал неврологии и психиатрии им. С.С. Корсакова. 2010;110(4):97–103. Режим доступа: https://mediasphera.ru/issues/zhurnal-nevrologii-i-psikhiatrii-im-s-s-korsakova/2010/4/031997-72982010418.
22. Deleu D., Northway M.G., Hanssens Y. Clinical Pharmacokinetic and Pharmacodynamic Properties of Drugs Used in the Treatment of Parkinson’s Disease. Clin Pharmacokinet. 2002;41(4):261–309. doi: 10.2165/00003088-200241040-00003.
23. Rajput A.H. Levodopa Prolongs Life Expectancy and Is Non-Toxic to Substantia Nigra. Parkinsonism Relat Disord. 2001;8(2):95–100. doi: 10.1016/s1353-8020(01)00023-2.
24. Левин О.С. Лечение болезни Паркинсона на ранней стадии. В мире лекарств: Клиническая фармакология и фармакотерапия. 2001;1:41–47.
25. Titova N., Levin O., Katunina E., Ray Chaudhuri K. ‘Levodopa Phobia’: A Review of a Not Uncommon and Consequential Phenomenon. NPJ Parkinsons Dis. 2018;4:31. doi: 10.1038/s41531-018-0067-z.
26. Ku S., Glass G.A. Age of Parkinson’s Disease Onset as a Predictor for the Development of Dyskinesia. Mov Disord. 2010;25(9):1177–1182. doi: 10.1002/mds.23068.
Mov Disord. 2010;25(9):1177–1182. doi: 10.1002/mds.23068.
27. Fahn S., Oakes D., Shoulson I., Kieburtz K., Rudolph A., Lang A. et al. Levodopa and the Progression of Parkinson’s Disease. N Engl J Med. 2004;351(24):2498–2508. doi: 10.1056/NEJMoa033447.
28. Fahn S., Isgreen W.P. Long-term evaluation of amantadine and levodopa combination in parkinsonism by double-blind crossover analyses. Neurology. 1975;25(8):695–700. doi: 10.1212/wnl.25.8.695.
29. Tomlinson C.L., Stowe R., Patel S., Rick C., Gray R., Clarke C.E. Systematic review of levodopa dose equivalency reporting in Parkinson’s disease. Mov Disord. 2010;25(15):2649–2653. doi: 10.1002/mds.23429.
30. Aquino C.C., Fox S.H. Clinical spectrum of levodopa-induced complications. Mov Disord. 2015;30(1):80–89. doi: 10.1002/mds.26125.
31. Stocchi F., Antonini A., Barone P., Tinazzi M., Zappia M., Onofrj M. et al. Early DEtection of wEaring off in Parkinson disease: the DEEP study. Parkinsonism Relat Disord. 2014;20(2):204–211. doi: 10.1016/j.parkreldis.2013.10.027.
doi: 10.1016/j.parkreldis.2013.10.027.
32. Chou K.L., Stacy M., Simuni T., Miyasaki J., Oertel W.H., Sethi K. et al. The spectrum of «off» in Parkinson’s disease: What have we learned over 40 years? Parkinsonism Relat Disord. 2018;51:9–16. doi: 10.1016/j.parkreldis.2018.02.001.
33. Stowe R., Ives N., Clarke C.E., Deane K., van Hilten, Wheatley K. et al. Evaluation of the efficacy and safety of adjuvant treatment to levodopa therapy in Parkinson’s disease patients with motor complications. Cochrane Database Syst Rev. 2010;(7):CD007166. doi: 10.1002/14651858.CD007166.pub2.
34. Nutt J.G., Woodward W.R., Hammerstad J.P., Carter J.H., Anderson J.L. The «on-off» phenomenon in Parkinson’s disease. Relation to levodopa absorption and transport. N Engl J Med. 1984;310(8):483–488. doi: 10.1056/NEJM198402233100802.
35. Leenders K.L., Poewe W.H., Palmer A.J., Brenton D.P., Frackowiak R.S. Inhibition of L-[18F]fluorodopa uptake into human brain by amino acids demonstrated by positron emission tomography. Ann Neurol. 1986;20(2):258–262. doi: 10.1002/ana.410200212.
Ann Neurol. 1986;20(2):258–262. doi: 10.1002/ana.410200212.
36. Baruzzi A., Contin M., Riva R., Procaccianti G., Albani F., Tonello C. et al. Influence of meal ingestion time on pharmacokinetics of orally administered levodopa in parkinsonian patients. Clin Neuropharmacol. 1987;10(6):527–537. doi: 10.1097/00002826-198712000-00004.
37. Катунина Е.А., Титова Н.В. Леводопа-индуцированные дискинезии при болезни Паркинсона: патогенез, клиника, подходы к лечению. Фарматека. 2014;(10–3):58–69. Режим доступа: https:/elibrary.ru/item.asp?id=22374467.
38. Schrag A., Quinn N. Dyskinesias and motor fluctuations in Parkinson’s disease. A community-based study. Brain. 2000;123(11):2297–2305. doi: 10.1093/brain/123.11.2297.
39. Ahlskog J.E., Muenter M.D. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature. Mov Disord. 2001;16(3):448–458. doi: 10.1002/mds.1090.
40. Chase T.N., Engber T.M., Mouradian M.M. Contribution of dopaminergic and glutamatergic mechanisms to the pathogenesis of motor response complications in Parkinson’s disease. Adv Neurol. 1996;69:497–501. Available at: https://www.ncbi.nlm.nih.gov/pubmed/8615171.
Adv Neurol. 1996;69:497–501. Available at: https://www.ncbi.nlm.nih.gov/pubmed/8615171.
41. Blanchet P.J., Konitsiotis S., Chase T.N. Amantadine reduces levodopainduced dyskinesias in parkinsonian monkeys. Mov Disord. 1998;13(5):798–802. doi: 10.1002/mds.870130507.
42. Thomas A., Iacono D., Luciano A.L., Armellino K., Di Iorio A., Onofrj M. Duration of amantadine benefit on dyskinesia of severe Parkinson’s disease. J Neurol Neurosurg Psychiatry. 2004;75(1):141–143. Available at: https://ncbi.nlm.nih.gov/pubmed/14707325.
43. Wolf E., Seppi K., Katzenschlager R., Hochschorner G., Ransmayr G., Schwingenschuh P. et al. Long-term antidyskinetic efficacy of amantadine in Parkinson’s disease. Mov Disord. 2010;25(10):1357–1363. doi: 10.1002/mds.23034.
44. Rajput A.H., Rajput A., Lang A.E., Kumar R., Uitti R.J., Galvez-Jimenez N. New use for an old drug: amantadine benefits levodopa-induced dyskinesia. Mov Disord. 1998;13(5):851. doi: 10.1002/mds.870130520.
45. Luginger E. , Wenning G.K., Bösch S., Poewe W. Beneficial effects of amantadine on L-dopa-induced dyskinesias in Parkinson’s disease. Mov Disord. 2000;15(5):873–878. doi: 10.1002/1531-8257(200009)15:5<873::aidmds1017>3.0.co;2-i.
, Wenning G.K., Bösch S., Poewe W. Beneficial effects of amantadine on L-dopa-induced dyskinesias in Parkinson’s disease. Mov Disord. 2000;15(5):873–878. doi: 10.1002/1531-8257(200009)15:5<873::aidmds1017>3.0.co;2-i.
46. Snow B.J., Macdonald L., Mcauley D., Wallis W. The effect of amantadine on levodopa-induced dyskinesias in Parkinson’s disease: a double-blind, placebo-controlled study. Clin Neuropharmacol. 2000;23(2):82–85. doi: 10.1097/00002826-200003000-00004.
47. Da Silva-Junior F.P., Braga-Neto P., Sueli Monte F., de Bruin V.M. Amantadine reduces the duration of levodopa-induced dyskinesia: a randomized, double-blind, placebo-controlled study. Parkinsonism Relat Disord. 2005;11(7):449–452. doi: 10.1016/j.parkreldis.2005.05.008.
48. Sawada H., Oeda T., Kuno S., Nomoto M., Yamamoto K., Yamamoto M. et al. Amantadine for dyskinesias in Parkinson’s disease: a randomized controlled trial. PLoS One. 2010;5(12):e15298. doi: 10.1371/journal.pone.0015298.
49. Goetz C. G., Stebbins G.T., Chung K.A., Hauser R.A., Miyasaki J.M., Nicholas A.P. et al. Which dyskinesia scale best detects treatment response? Mov Disord. 2013;28(3):341–346. doi: 10.1002/mds.25321.
G., Stebbins G.T., Chung K.A., Hauser R.A., Miyasaki J.M., Nicholas A.P. et al. Which dyskinesia scale best detects treatment response? Mov Disord. 2013;28(3):341–346. doi: 10.1002/mds.25321.
50. Verhagen Metman L., Del Dotto P., van den Munckhof P., Fang J., Mouradian M.M., Chase T.N. Amantadine as treatment for dyskinesias and motor fluctuations in Parkinson’s disease. Neurology. 1998;50(5):13231326. doi: 10.1212/wnl.50.5.1323.
51. Metman L.V., Del Dotto P., LePoole K., Konitsiotis S., Fang J., Chase T.N. Amantadine for levodopa-induced dyskinesias: a 1-year follow-up study. Arch Neurol. 1999;56(11):1383–1386. doi: 10.1001/archneur.56.11.1383.
52. Pahwa R., Tanner C.M., Hauser R.A., Isaacson S.H., Nausieda P.A., Truong D.D. et al. ADS-5102 (Amantadine) Extended-Release Capsules for Levodopa-Induced Dyskinesia in Parkinson Disease (EASE LID Study): A Randomized Clinical Trial. JAMA Neurol. 2017;74(8):941–949. doi: 10.1001/jamaneurol.2017.0943.
53. Růzicka E., Streitová H. , Jech R., Kanovský P., Roth J., Rektorová I. et al. Amantadine infusion in treatment of motor fluctuations and dyskinesias in Parkinson’s disease. J Neural Transm (Vienna). 2000;107(11):1297–1306. doi: 10.1007/s007020070019.
, Jech R., Kanovský P., Roth J., Rektorová I. et al. Amantadine infusion in treatment of motor fluctuations and dyskinesias in Parkinson’s disease. J Neural Transm (Vienna). 2000;107(11):1297–1306. doi: 10.1007/s007020070019.
54. Del Dotto P., Pavese N., Gambaccini G., Bernardini S., Metman L.V., Chase T.N., Bonuccelli U. Intravenous amantadine improves levadopainduced dyskinesias: an acute double-blind placebo-controlled study. Mov Disord. 2001;16(3):515–520. doi: 10.1002/mds.1112.
55. Левин О.С. Острые декомпенсации при болезни Паркинсона. Эффективная фармакотерапия. Неврология и психиатрия. 2011;(17):22–29. Режим доступа: https://elibrary.ru/item.asp?id=21651334.
56. Martinez-Martin P., Catalan M.J., Benito-Leon J., Moreno A.O., Zamarbide I., Cubo E. et al. Impact of fatigue in Parkinson’s disease: the Fatigue Impact Scale for Daily Use (D-FIS). Qual Life Res. 2006;15(4):597–606. doi: 10.1007/s11136-005-4181-0.
57. Ory-Magne F., Corvol J.C., Azulay J.P., Bonnet A. M., Brefel-Courbon C., Damier P. et al. Withdrawing amantadine in dyskinetic patients with Parkinson disease: the AMANDYSK trial. Neurology. 2014;82(4):300–307. doi: 10.1212/WNL.0000000000000050.
M., Brefel-Courbon C., Damier P. et al. Withdrawing amantadine in dyskinetic patients with Parkinson disease: the AMANDYSK trial. Neurology. 2014;82(4):300–307. doi: 10.1212/WNL.0000000000000050.
58. Taus C., Giuliani G., Pucci E., D’Amico R., Solari A. Amantadine for fatigue in multiple sclerosis. Cochrane Database Syst Rev. 2003;(2):CD002818. doi: 10.1002/14651858.CD002818.
59. Uitti R.J., Rajput A.H., Ahlskog J.E., Offord K.P., Schroeder D.R., Ho M.M. et al. Amantadine treatment is an independent predictor of improved survival in Parkinson’s disease. Neurology. 1996;46(6):1551–1556. doi: 10.1212/wnl.46.6.1551.
60. Inzelberg R., Bonuccelli U., Schechtman E., Miniowich A., Strugatsky R., Ceravolo R. et al. Association between amantadine and the onset of dementia in Parkinson’s disease. Mov Disord. 2006;21(9):1375–1379. doi: 10.1002/mds.20968.
Радиохирургическое лечение резистентного к медикаментозной терапии тремора при болезни Паркинсона | Иванов
1. Armstrong M. J., Okun M.S. Diagnosis and treatment of parkinson disease: a review. JAMA 2020;323(6):548–60. DOI: 10.1001/jama.2019.22360.
J., Okun M.S. Diagnosis and treatment of parkinson disease: a review. JAMA 2020;323(6):548–60. DOI: 10.1001/jama.2019.22360.
2. Aquino C.C., Fox S.H. Clinical spectrum of levodopa-induced complications. Mov Disord 2015;30(1):80–9. DOI: 10.1002/mds.26125.
3. Schuepbach W.M., Rau J., Knudsen K. et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med 2013;368(7):610–22. DOI: 10.1056/NEJMoa1205158.
4. Williams A., Gill S., Varma T. et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised, openlabel trial. Lancet Neurol 2010;9(6):581–91. DOI: 10.1016/S1474-4422(10)70093-4.
5. Mitchell K.T., Ostrem J.L. Surgical treatment of parkinson disease. Neurol Clin 2020;38(2):293–307. DOI: 10.1016/j.ncl.2020.01.001.
6. Голанов А.В., Костюченко В.В., Яхина М.В. и др. Стереотаксическая радиохирургия с использованием установок «Гамма-нож» моделей С и Perfexion в центре «Гамма-нож» (Москва). Медицинский алфавит 2014;1–2(8):51–6.
Медицинский алфавит 2014;1–2(8):51–6.
7. Токарев А.С., Крылов В.В., Рак В.А. и др. Первый опыт радиохирургического лечения пациентов с интракраниальной патологией на аппарате «Гамма-нож» в НИИ скорой помощи им. Н.В. Склифосовского. Русский медицинский журнал 2017;(16):1204.
8. Hoehn M., Yahr M. Parkinsonism: onset, progression and mortality. Neurology 1967;17(5):427–42. DOI: 10.1212/wnl.17.5.427.
9. Schwab R.S., England A.C. Projection technique for evaluating surgery in Parkinson’s disease. In: Third symposium on Parkinson’s disease. Ed. by J.F. Gillingham, I.M.L. Donaldson. Edinburgh, Livingstone, 1969. Pp. 152–157.
10. Fahn S., Tolosa E., Marin C. Clinical rating scale for tremor. In: Parkinson’s disease and movement disorders. Ed. by J. Jankovic, E. Tolosa. Baltimore: Williams & Wilkins, 1993. Pp. 225–234.
11. Witjas T., Carron R., Krack P. et al. A prospective single-blind study of Gamma Knife thalamotomy for tremor. Neurology 2015;85(18):1562–8. DOI: 10. 1212/WNL.0000000000002087.
1212/WNL.0000000000002087.
12. Ohye C. From selective thalamotomy with microrecording to gamma thalamotomy for movement disorders. Stereotact Funct Neurosurg 2006;84(4):155–61. DOI: 10.1159/000094954.
13. Ohye C., Higuchi Y., Shibazaki T. et al. Gamma Knife thalamotomy for Parkinson disease and essential tremor: a prospective multicenter study. Neurosurgery 2012;70(3):526–35. DOI: 10.1227/NEU.0b013e3182350893.
14. Laitinen L.V., Bergenheim A.T., Hariz M.I. Leksell’s posteroventral pallidotomy in the treatment of Parkinson’s disease. J Neurosurg 1992;76(1):53–61. DOI: 10.3171/jns.1992.76.1.0053.
15. Witjas-Slucki T. Surgical treatments for tremors. Rev Neurol (Paris) 2018;174(9):615–20. DOI: 10.1016/j.neurol.2018.07.004.
16. Kooshkabadi A., Lunsford L.D., Tonetti D. et al. Gamma Knife thalamotomy for tremor in the magnetic resonance imaging era. J Neurosurg 2013;118(4):713–8. DOI: 10.3171/2013.1.JNS121111.
17. Higuchi Y., Matsuda S., Serizawa T. Gamma Knife radiosurgery in movement disorders: indications and limitations. Mov Disord 2017;32(1):28–35. DOI: 10.1002/mds.26625.
Mov Disord 2017;32(1):28–35. DOI: 10.1002/mds.26625.
18. Schreglmann S.R., Krauss J.K., Chang J.W. et al. Functional lesional neurosurgery for tremor: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry 2018;89(7):717–26. DOI: 10.1136/jnnp-2017-316302.
19. Raju S.S., Niranjan A., Monaco E.A. et al. Stereotactic radiosurgery for intractable tremor-dominant parkinson disease: a retrospective analysis. Stereotact Funct Neurosurg 2017;95:291–7. DOI: 10.1159/000479236.
20. Niranjan A., Raju S., Kooshkabadi A. et al. Stereotactic radiosurgery for essential tremor: retrospective analysis of a 19-year experience. Mov Disord 2017;32(5):769–77. DOI: 10.1002/mds.26925.
21. Томский А.А. Хирургическое лечение паркинсонизма методом хронической электростимуляции области субталамического ядра. Автореф. дис. … канд. мед. наук. М., 2004. 28 с. Доступно по: https://www.elibrary.ru/item.asp?id=15808405.
22. Martínez-Moreno N.E., Sahgal A., De Salles A. et al. Stereotactic radiosurgery for tremor: systematic review. J Neurosurg 2018 Feb 1:1–12. DOI: 10.3171/2017.8.JNS17749.
Stereotactic radiosurgery for tremor: systematic review. J Neurosurg 2018 Feb 1:1–12. DOI: 10.3171/2017.8.JNS17749.
23. Philipsson J., Sjöberg R.L., Yelnik J. et al. Acute severe depression induced by stimulation of the right globus pallidus internus. Neurocase 2017;23(1):84–7. DOI: 10.1080/13554794.2017.1284243.
24. Liang Low H., Sayer F.T., Honey C.R. Pathological crying caused by highfrequency stimulation in the region of the caudal internal capsule. Arch Neurol 2008;65(2):264–6. DOI: 10.1001/archneurol.2007.53.
25. Lim S.Y., Hodaie M., Fallis M. et al. Gamma knife thalamotomy for disabling tremor: a blinded evaluation. Arch Neurol 2010;67(5):584–8. DOI: 10.1001/archneurol.2010.69.
26. Okun M.S., Stover N.P., Subramanian T. et al. Complications of Gamma Knife surgery for Parkinson disease. Arch Neurol 2001;58(12):1995–2002. DOI: 10.1001/archneur.58.12.1995.
27. Niranjan A., Raju S.S., Monaco E.A. et al. Is Staged bilateral thalamic radiosurgery an option for otherwise surgically ineligible patients with medically refractory bilateral tremor? J Neurosurg 2018;128(2):617–26. DOI: 10.3171/2016.11.JNS162044.
DOI: 10.3171/2016.11.JNS162044.
28. Ohye C., Shibazaki T., Ishihara J., Zhang J. Evaluation of gamma thalamotomy for parkinsonian and other tremors: survival of neurons adjacent to the thalamic lesion after gamma thalamotomy. J Neurosurg 2000;93(suppl 3):120–127. DOI: 10.3171/jns.2000.93.supplement.
Ученые создали нанотело, которое может лечить болезнь Паркинсона. Изображение предоставлено: Андрей Онуфриенко / Getty Images,
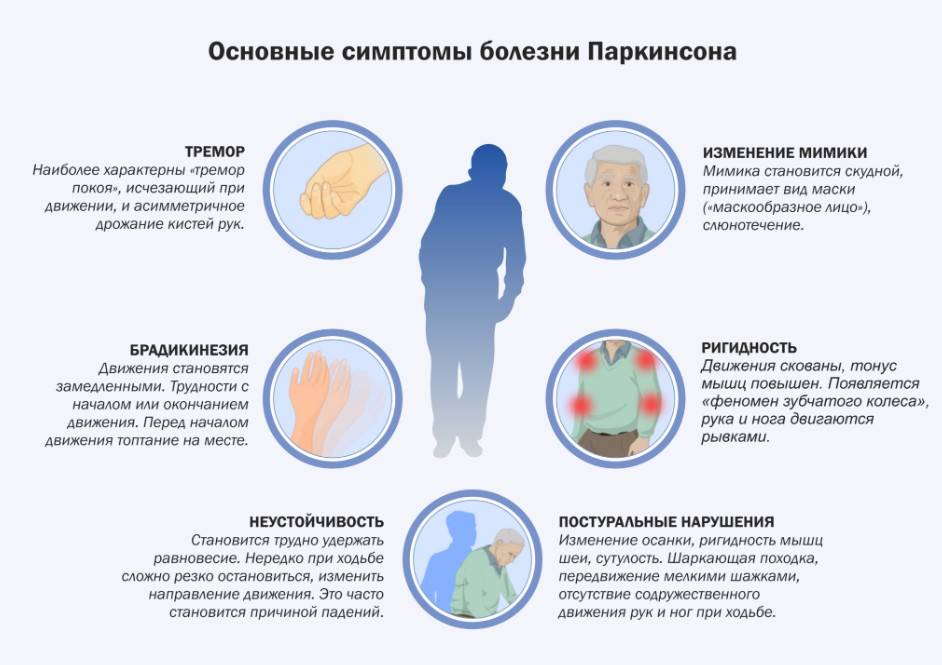
- Болезнь Паркинсона — это прогрессирующее нейродегенеративное заболевание, распространенность которого увеличивается во всем мире.
- В настоящее время нет лекарства от состояния, которое вызывает тремор, мышечную слабость и изменения настроения.
- Теперь ученые разработали нанотело, которое может распутывать деформированные белки в мозге, вызывающие многие симптомы болезни Паркинсона.
- Это открытие может стать ключом к изучению болезни и разработке новых методов лечения.

Болезнью Паркинсона (БП) страдают не менее 8,5 миллионов человек во всем мире, большинство из них старше 60 лет. По данным Всемирной организации здравоохранения (ВОЗ), за последние 25 лет это число увеличилось более чем вдвое.
Диагностика на ранних стадиях затруднена, так как многие симптомы могут указывать на другие заболевания, поэтому эти цифры почти наверняка занижены.
Общие симптомы включают тремор, ригидность мышц и замедленность движений. Некоторые люди также испытывают боль, тревогу и депрессию.
В настоящее время не существует лекарства от БП, хотя существующие методы лечения могут помочь справиться с симптомами и улучшить качество жизни.
За появление симптомов отвечает ряд факторов, таких как низкий уровень дофамина, низкий уровень норадреналина и скопления белка под названием альфа-синуклеин в головном мозге.
Эти скопления образуют структурное ядро телец Леви, которые вызывают потерю нервных клеток, что приводит к изменениям в движении, мышлении, поведении и настроении, которые являются основными симптомами БП.
Теперь ученые из Университета Джона Хопкинса генетически сконструировали нанотело, которое воздействует на скопления альфа-синуклеина в мозге и дестабилизирует их. Исследование может привести к новым методам лечения болезни Паркинсона.
Они сообщают о своих выводах в Nature Communications .
Нанотела, или однодоменные антитела, представляют собой наименьший фрагмент антитела, обладающий связывающей способностью. Они очень стабильны и могут проникать в ткани.
Доктор Мелита Петросян, невролог и директор Центра двигательных расстройств в Медицинском центре Провиденс Сент-Джонс в Санта-Монике, Калифорния, сообщила Medical News Today :
«По сравнению с традиционным антителом нанотело составляет около 90 % меньше и, следовательно, лучше проникает в клетку. Это важно, потому что большая часть патологии альфа-синуклеина обнаруживается внутриклеточно — внутри клеток головного мозга — поэтому ожидается, что нанотела будут более эффективны против болезни Паркинсона, чем традиционные антитела».
В ходе этого исследования исследователи генетически модифицировали нанотело, которое могло проникать сквозь прочную оболочку клеток головного мозга. Удалив дисульфидные связи в нанотеле, они обеспечили его стабильность внутри клеток мозга, позволив ему связываться с скоплениями альфа-синуклеина.
Преимущество этого нанотела, названного PFFNB2, заключается в том, что оно связывается только с скоплениями альфа-синуклеина, вызывающими симптомы болезни Паркинсона.
Он не связывается с отдельными молекулами альфа-синуклеина, который, по мнению исследователей, играет важную роль в передаче нервных импульсов.
Сначала исследователи протестировали нанотело на ткани мозга мыши in vitro. Они обнаружили, что PFFNB2 может связываться с агрегатами альфа-синуклеина, но не может предотвратить образование скоплений.
Дальнейшие эксперименты показали, что нанотело может связываться с уже сформированными фибриллами альфа-синуклеина и разрушать их, дестабилизируя деформированные белки.
Затем исследователи проверили это на живых мышах и обнаружили, что нанотело предотвращает распространение альфа-синуклеина в кору головного мозга. Кора является самой большой частью мозга и отвечает за большинство высших функций мозга.
Доктор Петросян объяснил для MNT , что «результаты показали, что они были способны целенаправленно воздействовать на предварительно сформированные фибриллы альфа-синуклеина в клеточных и мышиных моделях, что они были способны уменьшать слипание (агрегацию) альфа-синуклеина в клеточных моделях, и они смогли уменьшить патологию альфа-синуклеина в мышиных моделях».
Доктор Сяобо Мао, ведущий исследователь и доцент кафедры неврологии Университета Джона Хопкинса, отмечает следующее о клиническом потенциале этого открытия:
«Успех PFFNB2 в связывании вредных скоплений альфа-синуклеина во все более сложных средах указывает на то, что нанотело может стать ключом к помощи ученым в изучении этих заболеваний и, в конечном итоге, в разработке новых методов лечения».
По мнению авторов, эти результаты могут стать большим шагом вперед в поиске эффективных методов лечения болезни Паркинсона и связанных с ней расстройств. «Мы ожидаем, что эти агенты, связанные с PFFNB, имеют большие перспективы в качестве потенциальной терапевтической стратегии против патогенеза, связанного с [альфа-синуклеином]», — пишут они.
Доктор Петросян согласился. «Если эти результаты подтвердятся в клинических испытаниях на людях, весьма вероятно, что эти нанотела станут очень важным компонентом лечения БП и ДТЛ [деменции с тельцами Леви], наряду с выбором образа жизни, таким как физические упражнения и здоровое питание», — сказала она. сказал нам.
«Я надеюсь, что исследователи смогут в ближайшее время организовать клинические испытания на людях, но нам нужно будет убедиться в безопасности, переносимости и эффективности на людях, прежде чем нанотела смогут стать доступными для населения в целом», — добавила она.
Лекарственная терапия болезни Паркинсона в процессе клинических испытаний: обновление 2022 г.

Обзор
. 2022;12(4):1073-1082.
doi: 10.3233/JPD-229002.
Кевин Макфартинг 1 , Гэри Рафалофф 2 , Марко Баптиста 3 , Лия Мурсалин 4 , Рози Фуэст 4 , Ричард К. Уайз 4 , Саймон Р. В. Стотт 4
Принадлежности
- 1 Адвокат по исследованиям Паркинсона, Оксфорд, Великобритания.
- 2 Защитник исследований болезни Паркинсона, Мальборо, Нью-Джерси, США.

- 3 Фонд Майкла Дж. Фокса, Grand CentralStation, Нью-Йорк, штат Нью-Йорк, США.
- 4 Лечение болезни Паркинсона, Лондон, Великобритания.
- PMID: 35527571
- PMCID: PMC9198738
- DOI: 10.3233/JPD-229002
Бесплатная статья ЧВК
Обзор
Кевин Макфартинг и др. Дж. Паркинсон Дис. 2022.
Бесплатная статья ЧВК
. 2022;12(4):1073-1082.
2022;12(4):1073-1082.
doi: 10.3233/JPD-229002.
Авторы
Кевин Макфартинг 1 , Гэри Рафалофф 2 , Марко Баптиста 3 , Лия Мурсалин 4 , Рози Фуэст 4 , Ричард К. Уайз 4 , Саймон Р. В. Стотт 4
Принадлежности
- 2 Защитник исследований болезни Паркинсона, Мальборо, Нью-Джерси, США.
- 3 Фонд Майкла Дж.
 Фокса, Grand CentralStation, Нью-Йорк, штат Нью-Йорк, США.
Фокса, Grand CentralStation, Нью-Йорк, штат Нью-Йорк, США. - 4 Лечение болезни Паркинсона, Лондон, Великобритания.
- PMID: 35527571
- PMCID: PMC9198738
- DOI: 10.3233/JPD-229002
Абстрактный
Задний план: По мере того, как международное сообщество боролось с продолжающейся пандемией COVID-19, в 2021 году продолжался значительный прогресс в разработке новых лекарственных средств для лечения нейродегенеративного состояния болезни Паркинсона (БП). Этот прогресс включал как «симптоматическое лечение» ( ST — улучшает/ослабляет симптомы состояния) и «лечение, модифицирующее болезнь» (DMT — попытки отсрочить/замедлить прогрессирование путем воздействия на лежащие в основе биологии болезни Паркинсона), которые могут быть дополнительно классифицированы на основе их механизмов действия и класса препарата.
Этот прогресс включал как «симптоматическое лечение» ( ST — улучшает/ослабляет симптомы состояния) и «лечение, модифицирующее болезнь» (DMT — попытки отсрочить/замедлить прогрессирование путем воздействия на лежащие в основе биологии болезни Паркинсона), которые могут быть дополнительно классифицированы на основе их механизмов действия и класса препарата.
Задача: В этом отчете продолжаются предыдущие усилия по предоставлению обзора фармакологических методов лечения — как ST, так и DMT — в клинических испытаниях БП в 2021–2022 годах с целью повышения осведомленности и вовлечения в процесс клинических испытаний. Мы также надеемся стимулировать сотрудничество между всеми заинтересованными сторонами, включая промышленность, научные круги, правозащитные организации и, что наиболее важно, сообщество пациентов.
Методы: Мы провели обзор клинических испытаний лекарственной терапии БП с использованием данных испытаний, полученных из реестров ClinicalTrials. gov и Всемирной организации здравоохранения (ВОЗ), и провели анализ исследований, которые были активны по состоянию на 31 января 2022 года. Мы также оценили активные проекты по разработке лекарств, которые завершили одну клиническую фазу, но еще не приступили к следующей.
gov и Всемирной организации здравоохранения (ВОЗ), и провели анализ исследований, которые были активны по состоянию на 31 января 2022 года. Мы также оценили активные проекты по разработке лекарств, которые завершили одну клиническую фазу, но еще не приступили к следующей.
Результаты: Всего за период анализа на веб-сайте ClinicalTrials.gov было зарегистрировано 147 клинических испытаний как активных. Из этих испытаний 91 (62%) изучали ST, а 56 (38%) были сосредоточены на DMT. Приблизительно 1/3 исследований (34,7%; 51 испытание) находились в фазе 1, тогда как более половины испытаний находились в фазе 2 (50,3%; 74 испытания). Только 15% (22 испытания) исследований находились в Фазе 3, из которых только 3 испытания оценивали DMT. Новые терапевтические средства (42%) были наиболее распространенным типом агентов, тестируемых на всех этапах испытаний, за ними следовали повторно используемые агенты (34%) и измененные составы (20%).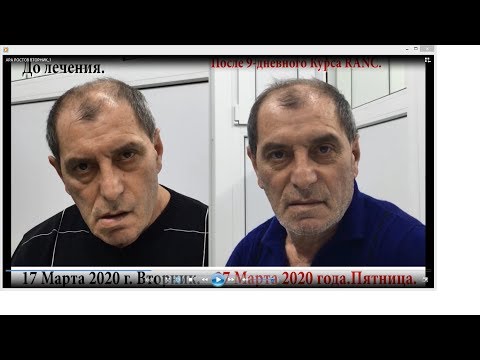
Заключение: Несмотря на значительные глобальные проблемы со здоровьем, в 2021 году продолжалась разработка новых лекарственных препаратов для лечения болезни Паркинсона. Надеемся, что с переходом к постпандемическому миру, в котором COVID-19 лучше контролируется, мы увидим увеличение числа клинических испытаний. сосредоточены на разработке лекарств от БП. Необходимость в дополнительных исследованиях фазы 3 для DMT остается острой.
Ключевые слова: Клинические испытания; болезнь Паркинсона; модификация болезни; генная терапия; иммунотерапия; воспаление; нейропротекция; исследования.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рис. 1
Схема с изложением данных…
Рис. 1
Схема сбора и анализа данных.
рисунок 1Схема сбора и анализа данных.
Рис. 2
Схема всего…
Рис. 2
Схема всех препаратов, находящихся в активных клинических испытаниях при БП,…
Рис. 2 Схема всех препаратов, находящихся в активных клинических испытаниях при БП, зарегистрированных на сайте Clinicaltrials.
Рис. 3
Круговая диаграмма…
Рис. 3
Круговая диаграмма препаратов в активных испытаниях фазы 1 для ПД,…
Рис. 3Круговая диаграмма препаратов, участвующих в активных исследованиях фазы 1 для лечения БП, зарегистрированных на сайте ClinicalTrials.gov по состоянию на 31 января st 2022.
Рис. 4
Круговая диаграмма…
Рис. 4
Круговая диаграмма препаратов в активных исследованиях фазы 2 для PD,…
Рис. 4
4 Круговая диаграмма препаратов, участвующих в активных исследованиях фазы 2 для лечения БП, зарегистрированных на сайте ClinicalTrials.gov по состоянию на 31 января st 2022.
Рис. 5
Круговая диаграмма…
Рис. 5
Круговая диаграмма препаратов, участвующих в активных испытаниях Фазы 3 для ПД,…
Рис. 5Круговая диаграмма препаратов, находящихся в активной фазе 3 испытаний при БП, зарегистрированных на сайте ClinicalTrials.gov по состоянию на 31 января st
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Лекарственная терапия болезни Паркинсона в процессе клинических испытаний: обновление 2021 г.

McFarthing K, Rafaloff G, Baptista MAS, Wyse RK, Stott SRW. МакФартинг К. и др. Дж. Паркинсон Дис. 2021;11(3):891-903. doi: 10.3233/JPD-219006. Дж. Паркинсон Дис. 2021. PMID: 34151864 Бесплатная статья ЧВК. Рассмотрение.
Лекарственная терапия болезни Паркинсона в процессе клинических испытаний: 2020 г.
Макфартинг К., Бафф С., Рафалофф Г., Домини Т., Уайз Р.К., Стотт С.Р.В. МакФартинг К. и др. Дж. Паркинсон Дис. 2020;10(3):757-774. DOI: 10.3233/JPD-202128. Дж. Паркинсон Дис. 2020. PMID: 32741777 Бесплатная статья ЧВК. Рассмотрение.
Будущее Cochrane Neonatal.
Солл РФ, Овельман С., Макгуайр В. Солл РФ и др. Ранний Хам Дев. 2020 ноябрь;150:105191. doi: 10.
 1016/j.earlhumdev.2020.105191. Epub 2020 12 сентября.
Ранний Хам Дев. 2020.
PMID: 33036834
1016/j.earlhumdev.2020.105191. Epub 2020 12 сентября.
Ранний Хам Дев. 2020.
PMID: 33036834Модификация болезни при болезни Паркинсона.
Хенчклифф К., Северт В.Л. Хенчклифф С. и др. Наркотики Старение. 2011 1 августа; 28 (8): 605-15. дои: 10.2165/11591320-000000000-00000. Наркотики Старение. 2011. PMID: 21812497 Рассмотрение.
Роль корзинных испытаний в разработке лекарств от нейродегенеративных заболеваний.
Каммингс Дж., Монтес А., Камбой С., Качо Дж.Ф. Каммингс Дж. и др. Alzheimers Res Ther. 2022 25 мая; 14(1):73. doi: 10.1186/s13195-022-01015-6. Alzheimers Res Ther. 2022. PMID: 35614479 Бесплатная статья ЧВК. Рассмотрение.
Посмотреть все похожие статьи
Цитируется
Прецизионная медицина для болезни Паркинсона: проблема подтипирования.

Фрейзер М., Фиске Б.К., Шерер Т.Б. Фрейзер М. и соавт. Front Aging Neurosci. 2022 1 декабря; 14:1064057. doi: 10.3389/fnagi.2022.1064057. Электронная коллекция 2022. Front Aging Neurosci. 2022. PMID: 36533178 Бесплатная статья ЧВК.
Системы доставки белков и генов для нейродегенеративных заболеваний: где мы находимся сегодня?
Сиафака П.И., Окур М.Е., Эрим П.Д., Чаглар Э.Ш., Озгенч Э., Гюндогду Э., Кепрюлю Р.П., Карантас И.Д., Устундаг Окур Н. Сиафака П.И. и др. Фармацевтика. 2022 10 ноября; 14 (11): 2425. doi: 10.3390/фармацевтика14112425. Фармацевтика. 2022. PMID: 36365243 Бесплатная статья ЧВК. Рассмотрение.
Определение неизвестных для клеточной терапии болезни Паркинсона.
Лейн Э.
 Л., Лелос М.Дж.
Лейн Э.Л. и др.
Dis Model Mech. 2022 1 октября; 15 (10): dmm049543. doi: 10.1242/dmm.049543. Epub 2022 27 сентября.
Dis Model Mech. 2022.
PMID: 36165848
Бесплатная статья ЧВК.
Л., Лелос М.Дж.
Лейн Э.Л. и др.
Dis Model Mech. 2022 1 октября; 15 (10): dmm049543. doi: 10.1242/dmm.049543. Epub 2022 27 сентября.
Dis Model Mech. 2022.
PMID: 36165848
Бесплатная статья ЧВК.
использованная литература
- ВОЗ рекомендует революционную вакцину против малярии для детей из групп риска, http://www.who.int/news/item/06-10-2021-who-recommends-groundbreaking-ma…
- Эсрик ЭБ, Леманн Л.Э., Биффи А., Ачебе М., Брендель С., Чукулеску М.Ф., Дейли Х., Маккиннон Б., Моррис Э., Федерико А., Абрисс Д., Бордман К., Хеллади Р., Шоу К., Негре Х., Негре О., Никифоров С. , Ritz J, Pai SY, London WB, Dansereau C, Heeney MM, Armant M, Manis JP, Williams DA (2021)Посттранскрипционное генетическое молчание BCL11A для лечения серповидноклеточной анемии.
 N Engl J Med 384 (3), 205–215.
—
ЧВК
—
пабмед
N Engl J Med 384 (3), 205–215.
—
ЧВК
—
пабмед
- Эсрик ЭБ, Леманн Л.Э., Биффи А., Ачебе М., Брендель С., Чукулеску М.Ф., Дейли Х., Маккиннон Б., Моррис Э., Федерико А., Абрисс Д., Бордман К., Хеллади Р., Шоу К., Негре Х., Негре О., Никифоров С. , Ritz J, Pai SY, London WB, Dansereau C, Heeney MM, Armant M, Manis JP, Williams DA (2021)Посттранскрипционное генетическое молчание BCL11A для лечения серповидноклеточной анемии.
- Andrieux-Meyer I, Tan SS, Thanprasertsuk S, Salvadori N, Menétrey C, Simon F, Cressey TR, Said HRHM, Hassan MRA, Omar H, Tee HP, Chan WK, Kumar S, Thongsawat S, Thetket K, Avihingsanon A, Khemnark S, Yerly S, Ngo-Giang-Huong N, Siva S, Swanson A, Goyal V, Bompart F, Pécoul B, Murad S (2021)Эффективность и безопасность равидасвира плюс софосбувир у пациентов с хроническим гепатитом Инфекция без цирроза или с компенсированным цирроз печени (STORM-C-1): промежуточный анализ двухэтапного открытого многоцентрового одногруппового исследования фазы 2/3.

- Andrieux-Meyer I, Tan SS, Thanprasertsuk S, Salvadori N, Menétrey C, Simon F, Cressey TR, Said HRHM, Hassan MRA, Omar H, Tee HP, Chan WK, Kumar S, Thongsawat S, Thetket K, Avihingsanon A, Khemnark S, Yerly S, Ngo-Giang-Huong N, Siva S, Swanson A, Goyal V, Bompart F, Pécoul B, Murad S (2021)Эффективность и безопасность равидасвира плюс софосбувир у пациентов с хроническим гепатитом Инфекция без цирроза или с компенсированным цирроз печени (STORM-C-1): промежуточный анализ двухэтапного открытого многоцентрового одногруппового исследования фазы 2/3.



 Фокса, Grand CentralStation, Нью-Йорк, штат Нью-Йорк, США.
Фокса, Grand CentralStation, Нью-Йорк, штат Нью-Йорк, США.
 1016/j.earlhumdev.2020.105191. Epub 2020 12 сентября.
Ранний Хам Дев. 2020.
PMID: 33036834
1016/j.earlhumdev.2020.105191. Epub 2020 12 сентября.
Ранний Хам Дев. 2020.
PMID: 33036834
 Л., Лелос М.Дж.
Лейн Э.Л. и др.
Dis Model Mech. 2022 1 октября; 15 (10): dmm049543. doi: 10.1242/dmm.049543. Epub 2022 27 сентября.
Dis Model Mech. 2022.
PMID: 36165848
Бесплатная статья ЧВК.
Л., Лелос М.Дж.
Лейн Э.Л. и др.
Dis Model Mech. 2022 1 октября; 15 (10): dmm049543. doi: 10.1242/dmm.049543. Epub 2022 27 сентября.
Dis Model Mech. 2022.
PMID: 36165848
Бесплатная статья ЧВК. N Engl J Med 384 (3), 205–215.
—
ЧВК
—
пабмед
N Engl J Med 384 (3), 205–215.
—
ЧВК
—
пабмед