Новое в лечении болезни паркинсона: Здоровье: Наука и техника: Lenta.ru
Новые методы лечения болезни Паркинсона в 2021
Что такое болезнь Паркинсона? Каковы последние утвержденные методы лечения болезни Паркинсона? Какие существуют экспериментальные методы лечения болезни Паркинсона?/a> Почему стоит обратиться к лечению болезни Паркинсона на everybody.org?
Что такое болезнь Паркинсона?
Болезнь Паркинсона (БП) — прогрессирующее заболевание головного мозга, вызывающее дрожь и ригидность мышц, а также замедляющее движение. Она развивается, когда нейроны (клетки мозга) в определенной части мозга перестают работать должным образом и со временем теряются. Эти нейроны производят важное химическое вещество, называемое допамином. Допамин используется мозгом для отправки сообщений через области мозга, чтобы помочь контролировать движение. В конце концов, мозг не может произвести достаточно допамина, чтобы контролировать движение должным образом.1,2
Есть ли лекарство от болезни Паркинсона?
В настоящее время нет лекарства от болезни Паркинсона. Существующие методы лечения направлены на то, чтобы помочь пациентам справиться с симптомами.
Существующие методы лечения направлены на то, чтобы помочь пациентам справиться с симптомами.
Какие новейшие одобренные методы лечения болезни Паркинсона?
Несколько лекарств было одобрено для лечения болезни Паркинсона. Вот некоторые из доступных лекарств от болезни Паркинсона:
Nuplazid (pimavanserin)3,4
Nuplazid (pimavanserin) — это первый препарат, одобренный для лечения галлюцинаций и бреда, связанных с психозом при болезни Паркинсона.
ПрепаратNuplazid (pimavanserin) был одобрен для лечения пациентов с галлюцинациями и бредом, связанными с психозом при болезни Паркинсона, Управлением по контролю за продуктами и лекарствами (FDA) (США) 29 апреля 2016 года. 3 декабря 2020 года Управление по контролю за продуктами и лекарствами США (FDA) одобрило обновление информации о назначении препарата Nuplazid (pimavanserin), которое позволит пациентам с болезнью Паркинсона, испытывающим трудности с глотанием, легче принимать лекарство.
Ongentys (opicapone)5,6
Ongentys (opicapone) — это лекарственный препарат, используемый для лечения болезни Паркинсона. Он показан для лечения взрослых пациентов с болезнью Паркинсона. Он используется в качестве дополнения к levodopa/ ингибиторам декарбоксилазы ДОФА (DDCI) (другим препаратам для лечения болезни Паркинсона) у пациентов, которые испытывают колебания в контроле своего состояния.
Opicapone был одобрен для лечения пациентов с болезнью Паркинсона в качестве дополнения к levodopa/ ингибиторам ДОФА-декарбоксилазы (DDCI) у пациентов, испытывающих колебания в контроле своего состояния, Европейским агентством по лекарственным средствам (EMA) 24 июня 2016 года и Управлением по контролю за продуктами и лекарствами (FDA) 24 апреля 2020 года.
Nourianz/Nouriast (istradefylline)7,8,9
Nourianz/Nouriast (istradefylline) — это лекарственный препарат, используемый для лечения эпизодов «выключения» у пациентов с болезнью Паркинсона. Эпизоды «выключения» при болезни Паркинсона приводят к усилению симптомов болезни Паркинсона, таких как тремор и трудности при ходьбе, и возникают из-за низкого уровня дофамина между приемами карбидопы/levodopa, они могут быть непредсказуемыми и со временем проявляться все чаще.
Эпизоды «выключения» при болезни Паркинсона приводят к усилению симптомов болезни Паркинсона, таких как тремор и трудности при ходьбе, и возникают из-за низкого уровня дофамина между приемами карбидопы/levodopa, они могут быть непредсказуемыми и со временем проявляться все чаще.
Nourianz/Nouriast (istradefylline) была одобрена Управлением по контролю за продуктами и лекарствами (FDA), США, 27 августа 2019 года и Агентством по фармацевтике и медицинским устройствам (PMDA), Япония, в июне 2013 года.
Inbrija (levodopa) 10,11,12
Inbrija (levodopa) — это ароматическая аминокислота, предназначенная для лечения болезни Паркинсона. Она используется для лечения симптомов в периоды «простоя» (когда пациенту труднее передвигаться), которые возникают, когда пациент принимает обычное лечение комбинацией карбидопы и levodopa. Он не заменяет обычную терапию карбидопой/levodopa .
Inbrija (levodopa) был одобрен для прерывистого лечения эпизодов OFF у пациентов с болезнью Паркинсона, получающих регулярное лечение карбидопой/levodopa , Управлением по контролю за продуктами и лекарствами (FDA), США, 21 декабря 2018 года и Европейским агентством по лекарственным средствам (EMA), Европа, 19 сентября 2019 года.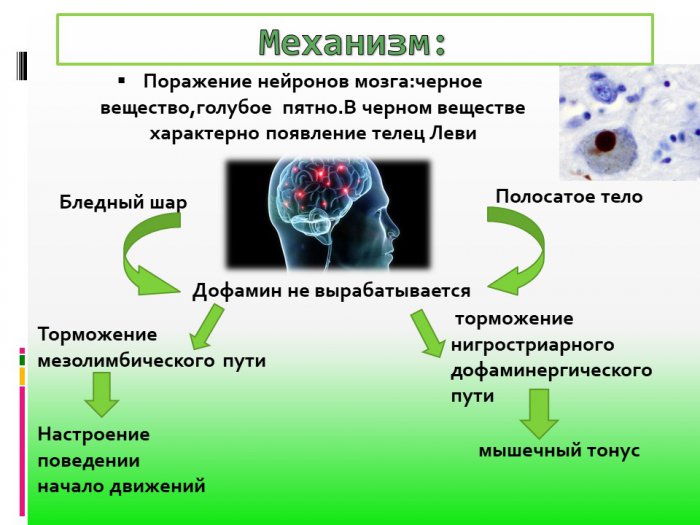
Nuplazid 34 мг (pimavanserin)
Nourianz/Nouriast (istradefylline)
Ongentys (opicapone)
Inbrija (levodopa)
Посмотреть все
Какие существуют экспериментальные методы лечения болезни Паркинсона?
В настоящее время проводится несколько клинических испытаний для лечения моторных и немоторных симптомов, а также лечение, направленное на предотвращение, замедление или прекращение общего прогрессирования болезни Паркинсона.
Полный список экспериментальных методов лечения болезни Паркинсона можно найти на сайте организации Майкла Джей Фокса здесь.
Почему стоит обращаться за лечением болезни Паркинсона на everybody.org?
everybody.org зарегистрирован в Гааге в Министерстве здравоохранения Нидерландов (регистрационный номер 6730 BEM) как независимый посредник по лекарственным средствам. Мы помогли пациентам из более чем 85 стран получить доступ к тысячам лекарств, в том числе. При наличии рецепта от лечащего врача вы можете рассчитывать на то, что наша команда экспертов безопасно и легально поможет вам получить доступ к новому препарату для лечения болезни Паркинсона. Если вы или ваш знакомый хотите получить доступ к лекарству, которое еще не одобрено в регионе проживания, мы можем оказать вам поддержку. Свяжитесь с нами для получения дополнительной информации.
Ссылки:
- Ema.europa.eu
- Паркинсонс.орг.uk
- Wayback.archive-it.org
- Parkinsonsnewstoday.com
- Ema.europa.eu
- Drugs.com
- Accessdata.fda.gov
- Фда.
 гов
гов - Pubmed.ncbi.nlm.nih.gov
- Accessdata.fda.gov
- Parkinsonsnewstoday.com
- Parkinsonsnewstoday.com
- Nuplazid (pimavanserin)- Thesocialmedwork.com
- Nourianz/Nouriast (istradefylline)- Thesocialmedwork.com
- Ogentys (opicapone) — Thesocialmedwork.com
- Inbrija (levodopa) — Thesocialmedwork.com
Отказ от ответственности: Эта статья не предназначена для того, чтобы повлиять на лечение, предоставляемое вашим лечащим врачом. Пожалуйста, не вносите изменения в свое лечение без предварительной консультации с вашим лечащим врачом. Эта статья не предназначена для диагностики или лечения заболеваний или для влияния на варианты лечения. everybody.org старается как можно тщательнее собирать и обновлять информацию на этой странице. Однако everyone.org не гарантирует правильность и полноту информации, представленной на этой странице.
Новый препарат для борьбы с болезнью Паркинсона тестируют петербургские ученые
Петербургские ученые тестируют новый препарат для борьбы с болезнью Паркинсона.
Отмечается, что болезнь по-прежнему остается загадкой для врачей и ученых. Однако сейчас может помочь медикаментозное лечение болезни. Новый препарат, который испытывают в Петербурге, помогает уменьшить тремор в конечностях и компенсировать другие нарушения. Надежды врачей в борьбе с недугом связаны с развитием высоких технологий, которые позволят заниматься лечением на генном уровне.
«В настоящее время идет активная разработка таргетной терапии. Такой, узконаправленной на конкретную мутацию гена. Эти препараты исследуются, в мире проводятся исследования. Есть шанс на то, что мы получим их через определенное количество лет для использования в рутинной практике», – рассказала телеканалу «Санкт-Петербург» доцент кафедры неврологии Первого Санкт-Петербургского государственного медицинского университета имени Павлова Алла Тимофеева.
По данным статистики, сегодня в мире зарегистрировано около 10 миллионов людей с болезнью Паркинсона. Примерно 250 тысяч из них — жители России.
Примерно 250 тысяч из них — жители России.
Фото и видео: телеканал «Санкт-Петербург»
Репортаж Ещё
В Петербурге воссоединили братьев, воспитывавшихся в разных детских домах Донбасса
Накануне на прямой линии обсуждали усыновление сирот из Донбасса. По словам губернатора, два месяца назад Петербург принял первых 11 детей-сирот и детей, оставшихся без попечения родителей в возрасте от 10 до 15 лет. В процессе усыновления делают все возможное, чтобы братьев и сестер не разлучали, оставляя в одной семье. Историю воссоединения рассказывает телеканал «Санкт-Петербург».
11 декабря 15:34
Три тяжелые операции: С чем приходится сталкиваться врачам в работе
В последние годы особое внимание город уделяет системе здравоохранения, что позволяет закупать новую технику, проводить современные операции. В Петербурге как о чуде говорят о рождении уникальной тройни в роддоме №10. Один случай на 200 миллионов. В Центре Алмазова спасли жизни девочки, родившейся с патологией пищевода. Что стоит за работа врачей? Какие истории жизни?
Один случай на 200 миллионов. В Центре Алмазова спасли жизни девочки, родившейся с патологией пищевода. Что стоит за работа врачей? Какие истории жизни?
11 декабря 14:35
В театре «На Литейном» представили спектакль «Мудрецы»
В преддверие 200-летия со дня рождения Александра Островского, в театре «На Литейном» представили спектакль «Мудрецы» в постановке Сергея Морозова. В центре сюжета – профессиональные игроки, готовые пожертвовать всем, ради амбициозной цели.
11 декабря 11:43
В Антарктиде соберут урожай арбузов, выращенный благодаря петербургским ученым
Каких-то четыре-пять месяцев и на станции «Восток» в Антарктиде созреют арбузы. Технологию придумали в Петербурге. Ученые Агрофизического НИИ уже без малого век создают идеальные условия для растений. Даже зона вечной мерзлоты или космическое пространство могут стать плодородными. Ученые доступно объясняют принцип подхода – «и на на камнях растут деревья» – то есть в природе все уже придумано.
Ученые доступно объясняют принцип подхода – «и на на камнях растут деревья» – то есть в природе все уже придумано.
10 декабря 21:10
Движение по Витебской развязке откроется в конце 2024 года
В Петербурге продолжается строительство Витебской развязки. На пересечении Благодатной и Кубинской улиц уже почти готов один из четырех съездов. Развязка станет одной из важных частей Восточного диаметра, проезд по которому значительно сэкономит время автомобилистов и снизит нагрузку на дорожную сеть города.
10 декабря 20:43
Достижения в лечении болезни Паркинсона — практическая неврология
Болезнь Паркинсона (БП) — одно из наиболее распространенных неврологических расстройств, которым, по прогнозам, к 2040 г. пострадают не менее 12 миллионов человек во всем мире. срочность в лечении. Несмотря на препятствия, созданные пандемией COVID-19 для исследовательского сообщества, с 2021 по 2022 год было проведено 147 активных клинических испытаний, 62% из которых изучали симптоматическое лечение, а остальные изучали потенциальную терапию, модифицирующую заболевание (DMT). 2 С 1960-х годов леводопа остается основным средством лечения БП с недавними достижениями в новых механизмах доставки, включая ингаляционные и непрерывные инфузии леводопы. В обзоре клинических испытаний ПД с 2021 по 2022 год 42,2% вмешательств были новыми, а 34% были перепрофилированными агентами.
2 С 1960-х годов леводопа остается основным средством лечения БП с недавними достижениями в новых механизмах доставки, включая ингаляционные и непрерывные инфузии леводопы. В обзоре клинических испытаний ПД с 2021 по 2022 год 42,2% вмешательств были новыми, а 34% были перепрофилированными агентами.
Двигательные флуктуации и дискинезии часто возникают у людей, живущих с БП, по мере прогрессирования заболевания. Среднее время развития дискинезии составляет 5,81 года с момента постановки диагноза, 3 , и исследование показывает, что 95% людей с БП будут испытывать двигательные флуктуации к 10 годам. 4 Следовательно, существует огромная потребность в улучшенных методах лечения этих двигательных симптомов. 5 В этом обзоре мы обсуждаем новые методы лечения моторных симптомов БП, которые стали доступны за последние 5 лет (таблица).
Нажмите, чтобы увеличить
Фармакологическая терапия
Леводопа для ингаляций
Дофаминергическая терапия является первоочередной терапией двигательных симптомов при БП. 6 Эти препараты включают леводопу, ингибиторы моноаминоксидазы, агонисты дофамина (ДА) или их комбинацию. Леводопа была доступна в пероральных формах и энтеральной суспензии. Недавние исследования были сосредоточены на новых методах доставки лекарств, которые обходят кишечник, чтобы устранить двигательные колебания и потенциально избежать взаимодействия пищи с лекарством, которое может нарушить абсорбцию.
В 2018 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило ингаляционный порошок леводопы для лечения периодов «выключения» при пероральной терапии карбидопой/леводопой. В 3-й фазе, рандомизированном, многоцентровом, двойном слепом, плацебо-контролируемом исследовании, участники в возрасте от 30 до 85 лет, которые испытывали не менее 2 часов времени «выключения», получали 60 или 84 мг ингаляционной леводопы или плацебо. 7 Это исследование подтвердило безопасность и эффективность обеих доз и достигло первичной конечной точки улучшения двигательных показателей Объединенной шкалы оценки болезни Паркинсона Общества двигательных расстройств (MDS-UPDRS) через 30 минут после приема по сравнению с приемом до приема. Доза 84 мг привела к снижению оценки MDS-UPDRS примерно на 4 балла по сравнению с плацебо. Никаких существенных изменений по сравнению с плацебо через 20 минут не наблюдалось, несмотря на надежду на более быстрый переход в состояние ВКЛ при легочной ингаляции. Кроме того, не было никакой разницы в общем ежедневном времени выключения на основе дневников участников. Было высказано предположение, что ограничение использования ингалятора (в среднем 2 раза в день) и запрет на использование первой дневной дозы могли уменьшить влияние на время выключения. Побочные эффекты включали кашель, инфекции верхних дыхательных путей, обесцвеченную мокроту и тошноту. Ингаляции леводопы могут быть стратегией спасения, когда у людей возникают двигательные флуктуации.
7 Это исследование подтвердило безопасность и эффективность обеих доз и достигло первичной конечной точки улучшения двигательных показателей Объединенной шкалы оценки болезни Паркинсона Общества двигательных расстройств (MDS-UPDRS) через 30 минут после приема по сравнению с приемом до приема. Доза 84 мг привела к снижению оценки MDS-UPDRS примерно на 4 балла по сравнению с плацебо. Никаких существенных изменений по сравнению с плацебо через 20 минут не наблюдалось, несмотря на надежду на более быстрый переход в состояние ВКЛ при легочной ингаляции. Кроме того, не было никакой разницы в общем ежедневном времени выключения на основе дневников участников. Было высказано предположение, что ограничение использования ингалятора (в среднем 2 раза в день) и запрет на использование первой дневной дозы могли уменьшить влияние на время выключения. Побочные эффекты включали кашель, инфекции верхних дыхательных путей, обесцвеченную мокроту и тошноту. Ингаляции леводопы могут быть стратегией спасения, когда у людей возникают двигательные флуктуации.
Таблетки леводопы с риской
Учитывая важность точного дозирования лекарств при болезни Паркинсона, в 2021 году стали доступны новые таблетки карбидопы/леводопы с риской. Каждая таблетка состоит из 4 сегментированных фракций, которые можно разламывать и принимать по отдельности, каждая из которых содержит карбидопу/леводопу 6,25/25 мг для точной дозировки. Планшет имеет глубокие насечки, чтобы упростить его разделение и точную настройку.
Апоморфин сублингвально
Апоморфин — мощный неэрголиновый агонист дофамина, доступный в виде подкожных инъекций с 2004 г. и используемый в качестве неотложной терапии при эпизодах выключения. Инъекция сопряжена с некоторыми проблемами при использовании, включая сбор лекарства, необходимость инъекции, требование контролируемого титрования дозы, побочные эффекты, включая тошноту и гипотензию, а также реакции в месте инъекции. В рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 109 участников в 32 центрах разница в моторных баллах по MDS-UPDRS, часть 3, от приема до дозы до 30 минут после приема была значительно больше при применении сублингвальной пленки с апоморфином по сравнению с плацебо. 8 Значительная разница в моторных баллах наблюдалась через 15 минут после введения дозы, и эта разница сохранялась до 90 минут. Также были достигнуты вторичные конечные точки, включая шкалы общего клинического впечатления об изменении (CGIC). У большинства участников наблюдалось улучшение симптомов в течение 10–20 минут после приема препарата, а дневники участников показали полный ответ «ВКЛ» почти в 80% пролеченных эпизодов «ВЫКЛ». 8 Побочные эффекты возникали у 31% (17/54) участников и чаще всего представляли собой явления со стороны ротоглотки легкой и средней степени тяжести (например, эритема слизистой оболочки полости рта, сухость во рту, глосодиния, отек губ, отек ротоглотки или раздражение горла), что привело к прекращению терапии в 9участники. В мае 2020 года FDA одобрило сублингвальный прием апоморфина для быстрого обращения вспять времени «выключения», 8 , сделав доступной еще одну спасательную терапию.
8 Значительная разница в моторных баллах наблюдалась через 15 минут после введения дозы, и эта разница сохранялась до 90 минут. Также были достигнуты вторичные конечные точки, включая шкалы общего клинического впечатления об изменении (CGIC). У большинства участников наблюдалось улучшение симптомов в течение 10–20 минут после приема препарата, а дневники участников показали полный ответ «ВКЛ» почти в 80% пролеченных эпизодов «ВЫКЛ». 8 Побочные эффекты возникали у 31% (17/54) участников и чаще всего представляли собой явления со стороны ротоглотки легкой и средней степени тяжести (например, эритема слизистой оболочки полости рта, сухость во рту, глосодиния, отек губ, отек ротоглотки или раздражение горла), что привело к прекращению терапии в 9участники. В мае 2020 года FDA одобрило сублингвальный прием апоморфина для быстрого обращения вспять времени «выключения», 8 , сделав доступной еще одну спасательную терапию.
Сафинамид
Дополнительные методы лечения, такие как ингибиторы моноаминоксидазы В (МАО-В) с агонистами допамина или терапия леводопой, могут помочь справиться с двигательными флуктуациями. Сафинамид представляет собой пероральный селективный обратимый ингибитор МАО-В, который принимают один раз в день. FDA одобрило сафинамид для дополнительного лечения двигательных флюктуаций в 2017 году. В клиническом исследовании с параллельными группами 669участники с двигательными флуктуациями, получавшие стабильные схемы леводопы и другие фармакотерапевтические препараты для лечения БП, были случайным образом распределены для получения сафинамида в дозе 50 или 100 мг/сут или плацебо в течение 24 недель. 9 Сафинамид значительно увеличивал ежедневное время действия без беспокоящей дискинезии (1,37 ± 2,745 часа и 1,36 ± 2,625 часа соответственно при дозах 50 или 100 мг/день по сравнению с 0,97 ± 2,375 часа при приеме плацебо). 9 При применении сафинамида по сравнению с плацебо наблюдалось значительное снижение времени ежедневного выключения, времени выключения после первой утренней дозы леводопы и показателей MDS-UPDRS, часть 3, во время действия. 9 В ходе 18-месячного плацебо-контролируемого расширения первоначального исследования было отмечено снижение средних показателей шкалы оценки общей дискинезии на 31% и 27% при приеме сафинамида в дозе 50 или 100 мг/день соответственно; однако среднее значение по методу наименьших квадратов не было значительным.
Сафинамид представляет собой пероральный селективный обратимый ингибитор МАО-В, который принимают один раз в день. FDA одобрило сафинамид для дополнительного лечения двигательных флюктуаций в 2017 году. В клиническом исследовании с параллельными группами 669участники с двигательными флуктуациями, получавшие стабильные схемы леводопы и другие фармакотерапевтические препараты для лечения БП, были случайным образом распределены для получения сафинамида в дозе 50 или 100 мг/сут или плацебо в течение 24 недель. 9 Сафинамид значительно увеличивал ежедневное время действия без беспокоящей дискинезии (1,37 ± 2,745 часа и 1,36 ± 2,625 часа соответственно при дозах 50 или 100 мг/день по сравнению с 0,97 ± 2,375 часа при приеме плацебо). 9 При применении сафинамида по сравнению с плацебо наблюдалось значительное снижение времени ежедневного выключения, времени выключения после первой утренней дозы леводопы и показателей MDS-UPDRS, часть 3, во время действия. 9 В ходе 18-месячного плацебо-контролируемого расширения первоначального исследования было отмечено снижение средних показателей шкалы оценки общей дискинезии на 31% и 27% при приеме сафинамида в дозе 50 или 100 мг/день соответственно; однако среднее значение по методу наименьших квадратов не было значительным. Преимущества сафинамида в дозе 100 мг/сутки по сравнению с плацебо оставались значительными, что измерялось временем действия без беспокоящей дискинезии, ежедневным временем выключения, баллом MDS-UPDRS, часть 3, и некоторыми аспектами качества жизни. 10 Еще одно двойное слепое 24-недельное исследование в параллельных группах на 549участники, получавшие стабильные дозы леводопы, получавшие сафинамид в дозе 50 или 100 мг/день по сравнению с плацебо, также продемонстрировали преимущество сафинамида по сравнению с плацебо (увеличение времени действия без дискинезии или «хорошее время действия») на 1,42 часа против 0,57 часа по данным участников. дневники. 11
Преимущества сафинамида в дозе 100 мг/сутки по сравнению с плацебо оставались значительными, что измерялось временем действия без беспокоящей дискинезии, ежедневным временем выключения, баллом MDS-UPDRS, часть 3, и некоторыми аспектами качества жизни. 10 Еще одно двойное слепое 24-недельное исследование в параллельных группах на 549участники, получавшие стабильные дозы леводопы, получавшие сафинамид в дозе 50 или 100 мг/день по сравнению с плацебо, также продемонстрировали преимущество сафинамида по сравнению с плацебо (увеличение времени действия без дискинезии или «хорошее время действия») на 1,42 часа против 0,57 часа по данным участников. дневники. 11
Опикапон
Ингибиторы катехол-О-метилтрансферазы (КОМТ) используются в сочетании с терапией леводопой для увеличения продолжительности действия леводопы за счет предотвращения периферической деградации. Ингибиторы СОМТ толкапон и энтакапон были доступны в течение некоторого времени, но толкапон больше не используется широко из-за риска тяжелой и фатальной гепатотоксичности. Энтакапон ограничен необходимостью принимать его несколько раз в день, что дает ограниченную пользу примерно на 0,6 часа больше времени включения в день. 12 Опикапон был одобрен в 2020 г., имеет более низкую гепатотоксичность, чем толкапон, и принимается перорально один раз в день. В 2 рандомизированных двойных слепых исследованиях с параллельными группами, сравнивающих опикапон с плацебо и энтакапоном, соответственно, улучшение по сравнению с исходным уровнем абсолютного времени выключения наблюдалось при приеме опикапона в дозе 50 мг/сут. Среднее улучшение абсолютного времени выключения по сравнению с исходным уровнем составило -60,8 минуты (95% ДИ: 97,2) для опикапона по сравнению с -24,4 минуты для плацебо ( P = 0,0015). Опикапон не уступал энтакапону (–26,2 мин времени бездействия, 95% ДИ: -63,8, 11,4; P = 0,0051). 13 В другом исследовании среднее по методу наименьших квадратов изменение времени выключения при приеме опикапона в дозе 50 мг/сут по сравнению с плацебо составило -118,8±13,8 минут против -64,5±14,4 минут на основе 24-часовых дневников участников, которые заполнялись за 3 дня до запланированных посещений.
Энтакапон ограничен необходимостью принимать его несколько раз в день, что дает ограниченную пользу примерно на 0,6 часа больше времени включения в день. 12 Опикапон был одобрен в 2020 г., имеет более низкую гепатотоксичность, чем толкапон, и принимается перорально один раз в день. В 2 рандомизированных двойных слепых исследованиях с параллельными группами, сравнивающих опикапон с плацебо и энтакапоном, соответственно, улучшение по сравнению с исходным уровнем абсолютного времени выключения наблюдалось при приеме опикапона в дозе 50 мг/сут. Среднее улучшение абсолютного времени выключения по сравнению с исходным уровнем составило -60,8 минуты (95% ДИ: 97,2) для опикапона по сравнению с -24,4 минуты для плацебо ( P = 0,0015). Опикапон не уступал энтакапону (–26,2 мин времени бездействия, 95% ДИ: -63,8, 11,4; P = 0,0051). 13 В другом исследовании среднее по методу наименьших квадратов изменение времени выключения при приеме опикапона в дозе 50 мг/сут по сравнению с плацебо составило -118,8±13,8 минут против -64,5±14,4 минут на основе 24-часовых дневников участников, которые заполнялись за 3 дня до запланированных посещений. 14 Сокращение времени «выключения» сохранялось в течение 1 года открытого расширенного исследования. 14
14 Сокращение времени «выключения» сохранялось в течение 1 года открытого расширенного исследования. 14
Амантадин пролонгированного действия
Амантадин является антагонистом N -метил-D-аспартатных рецепторов (NMDAR), одобренным для использования при БП с 19 лет.73 для лечения леводопа-индуцированной дискинезии. Препараты с немедленным высвобождением требуют частого дозирования и имеют плохую переносимость при более высоких дозах. В 2017 году была одобрена форма амантадина с отсроченным/пролонгированным высвобождением (DR/ER), которую принимают один раз в день (перед сном). Во 2-й фазе 3 рандомизированных, двойных слепых, плацебо-контролируемых 25-недельных и 12-недельных исследований амантадин в дозе 274 мг DR/ER по сравнению с плацебо привел к среднему улучшению на 15,9 ± 1,6 балла против 8,0 ± 1,6 балла в унифицированном рейтинге дискинезии. шкале (UDysRS) в 1 исследовании и 20,7±2,2 балла против 6,3±2,1 балла в другом. 15,16 В объединенном анализе наблюдалось общее с поправкой на плацебо сокращение времени «ВЫКЛ» на 1 час по сравнению с исходным уровнем. 17,18 Эти результаты подтверждают одобрение DR/ER амантадина в качестве дополнительного лечения эпизодов OFF. Другой амантадин гидрохлорид ER был одобрен в 2018 году для лечения леводопа-индуцированных дискинезий (таблица).
15,16 В объединенном анализе наблюдалось общее с поправкой на плацебо сокращение времени «ВЫКЛ» на 1 час по сравнению с исходным уровнем. 17,18 Эти результаты подтверждают одобрение DR/ER амантадина в качестве дополнительного лечения эпизодов OFF. Другой амантадин гидрохлорид ER был одобрен в 2018 году для лечения леводопа-индуцированных дискинезий (таблица).
Истрадефиллин
Истрадефиллин — антагонист аденозиновых рецепторов A2A, одобренный в 2019 году для дополнительного лечения БП с целью уменьшения двигательных флуктуаций. Было проведено 8 рандомизированных двойных слепых плацебо-контролируемых исследований истрадефиллина при БП. Объединенный анализ данных от 2719участники показали, что у тех, кто получал истрадефиллин (20 мг, n = 848; 40 мг, n = 879) по сравнению с плацебо (n = 992), было статистически значимое, хотя и умеренное, снижение по сравнению с исходным уровнем времени ежедневного выключения на -0,38 и -0,45 часа. , соответственно, и увеличение времени включения на 0,40 и 0,33 часа без беспокоящей дискинезии соответственно. 19 Хотя истрадефиллин первоначально не был одобрен FDA на основании части этих испытаний, рассмотренных в 2008 году, дополнительные данные испытаний и анализы привели к окончательному одобрению. 20-22
, соответственно, и увеличение времени включения на 0,40 и 0,33 часа без беспокоящей дискинезии соответственно. 19 Хотя истрадефиллин первоначально не был одобрен FDA на основании части этих испытаний, рассмотренных в 2008 году, дополнительные данные испытаний и анализы привели к окончательному одобрению. 20-22
Процедурное лечение
Фокусированное ультразвуковое исследование
Высокоинтенсивное сфокусированное ультразвуковое исследование (ФУЗ) под магнитно-резонансным контролем, нацеленное на таламус, было одобрено в 2018 году для лечения тремор-доминантной БП. ФУЗ, нацеленный на внутренний бледный шар (GPi) для брадикинезии, ригидности и дискинезии, был одобрен в 2021 году. Существует богатая история хирургического лечения этих целей при БП. В настоящее время обе процедуры одобрены для одностороннего нацеливания только из соображений безопасности (например, при дизартрии или падениях). Процедура выполняется за один сеанс, во время которого ультразвуковые волны высокой интенсивности проходят через череп, чтобы создать термическое поражение в целевой структуре. После односторонней FUS-таламотомии при БП с преобладанием тремора у 23 человек наблюдалось полное прекращение тремора покоя и действия, а у остальных 3 участников — 90% улучшение тремора. 23 Долгосрочные результаты 26 пациентов, прошедших FUS-таламотомию и наблюдаемых в течение до 5 лет (медиана 36 месяцев; 7 участников наблюдались в течение 5 лет), выявили стойкое улучшение тремора по сравнению с исходным уровнем. Однако у 1 участника был полный рецидив тремора, а у 5 других — частичный возврат тремора в течение этого 5-летнего периода. 22 Было отмечено заметное улучшение качества жизни через 6 месяцев и 1 год лечения, хотя авторы этого исследования отметили улучшение общего PDQ39баллы — мера качества жизни — не были статистически значимыми по сравнению с исходным уровнем в более поздние моменты времени, потенциально связанные с прогрессированием заболевания. 23 Предварительные результаты открытого исследования безопасности и осуществимости FUS-паллидотомии выявили в основном легкие и преходящие побочные эффекты, связанные с процедурой.
После односторонней FUS-таламотомии при БП с преобладанием тремора у 23 человек наблюдалось полное прекращение тремора покоя и действия, а у остальных 3 участников — 90% улучшение тремора. 23 Долгосрочные результаты 26 пациентов, прошедших FUS-таламотомию и наблюдаемых в течение до 5 лет (медиана 36 месяцев; 7 участников наблюдались в течение 5 лет), выявили стойкое улучшение тремора по сравнению с исходным уровнем. Однако у 1 участника был полный рецидив тремора, а у 5 других — частичный возврат тремора в течение этого 5-летнего периода. 22 Было отмечено заметное улучшение качества жизни через 6 месяцев и 1 год лечения, хотя авторы этого исследования отметили улучшение общего PDQ39баллы — мера качества жизни — не были статистически значимыми по сравнению с исходным уровнем в более поздние моменты времени, потенциально связанные с прогрессированием заболевания. 23 Предварительные результаты открытого исследования безопасности и осуществимости FUS-паллидотомии выявили в основном легкие и преходящие побочные эффекты, связанные с процедурой.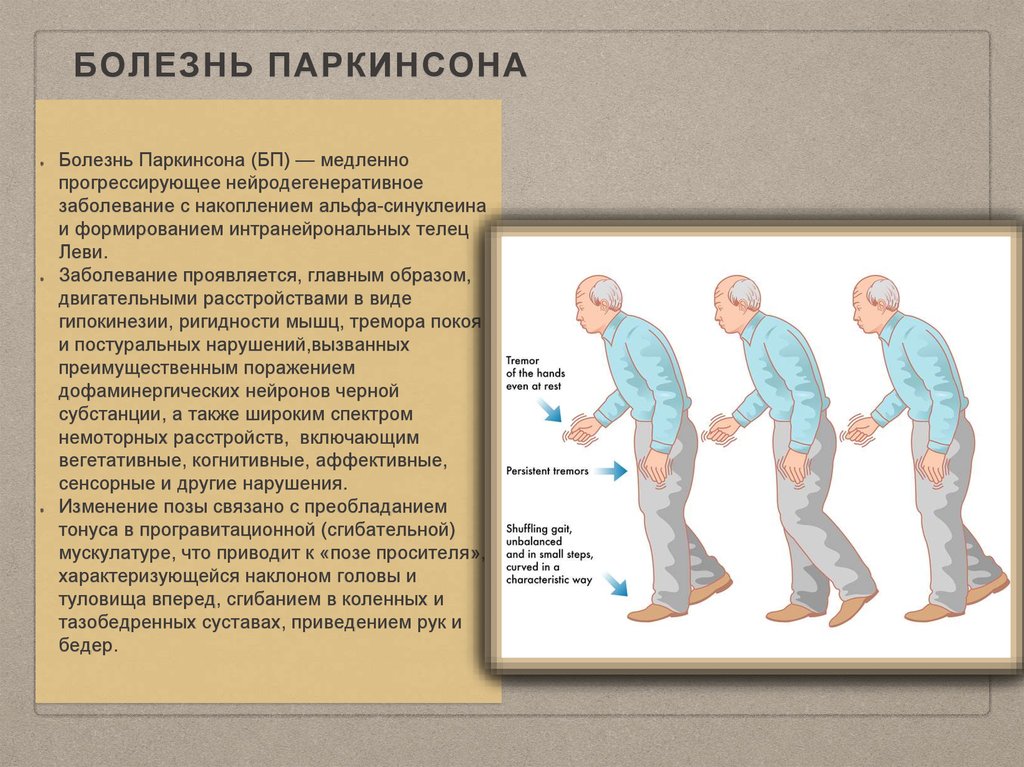 По шкале UDysRS улучшение наблюдалось через 3 месяца и до 12 месяцев по сравнению с исходным уровнем. Кроме того, улучшение было отмечено на обработанной стороне по оценке MDS-UPDRS, часть 3, через 3 месяца и до 1 года. FUS привлекателен тем, что не требует разрезов и не требует программирования или замены батареи. Тем не менее, он представляет собой создание структурного повреждения, предлагает только одностороннее лечение симптомов и не имеет возможности направлять и изменять терапию в зависимости от ответа.
По шкале UDysRS улучшение наблюдалось через 3 месяца и до 12 месяцев по сравнению с исходным уровнем. Кроме того, улучшение было отмечено на обработанной стороне по оценке MDS-UPDRS, часть 3, через 3 месяца и до 1 года. FUS привлекателен тем, что не требует разрезов и не требует программирования или замены батареи. Тем не менее, он представляет собой создание структурного повреждения, предлагает только одностороннее лечение симптомов и не имеет возможности направлять и изменять терапию в зависимости от ответа.
Направленная глубокая стимуляция мозга
Недавно разработанные направленные отведения для глубокой стимуляции мозга (DBS) состоят из 2 средних колец, разделенных на трети, всего 8 контактов по сравнению с 4 круговыми кольцами в обычных электродах. Направленная стимуляция может использоваться для формирования электрического поля вдали от областей, где стимуляция может вызвать нежелательные эффекты. 24 В недавнем исследовании у 90% участников, получавших направленную стимуляцию, было более широкое терапевтическое окно, чем у тех, кто подвергался всенаправленной стимуляции субталамических ядер (STN)-DBS, хотя двигательные результаты в 2 группах были схожими. 25 Есть надежда, что направленная стимуляция может предложить более целенаправленное программирование для устранения конкретных симптомов, предотвращения стимуляции близлежащих структур или уменьшения необходимой амплитуды для достижения определенного эффекта. 25 Сегментированные электроды представляют собой ценную альтернативу для программирования при управлении стимуляцией в горизонтальной плоскости, но дают ограниченный эффект при неоптимальном расположении отведений по вертикальной оси. Есть 3 производителя, которые предлагают системы направленных отведений DBS, 1 который позволяет дистанционно программировать, а другой состоит из направленного электрода с новыми сенсорными возможностями для обнаружения сигналов мозга, которые могут коррелировать с симптомами и лечением. Сенсорная технология дает надежду на индивидуализированную стимуляцию, основанную на физиологии человека в будущем. Кроме того, большинство систем DBS имеют один общий источник тока для всех контактов; однако новые технологии в некоторых случаях позволяют осуществлять независимое управление током.
25 Есть надежда, что направленная стимуляция может предложить более целенаправленное программирование для устранения конкретных симптомов, предотвращения стимуляции близлежащих структур или уменьшения необходимой амплитуды для достижения определенного эффекта. 25 Сегментированные электроды представляют собой ценную альтернативу для программирования при управлении стимуляцией в горизонтальной плоскости, но дают ограниченный эффект при неоптимальном расположении отведений по вертикальной оси. Есть 3 производителя, которые предлагают системы направленных отведений DBS, 1 который позволяет дистанционно программировать, а другой состоит из направленного электрода с новыми сенсорными возможностями для обнаружения сигналов мозга, которые могут коррелировать с симптомами и лечением. Сенсорная технология дает надежду на индивидуализированную стимуляцию, основанную на физиологии человека в будущем. Кроме того, большинство систем DBS имеют один общий источник тока для всех контактов; однако новые технологии в некоторых случаях позволяют осуществлять независимое управление током. При независимом контроле тока возможна более точная стимуляция между 2 и более активными контактами. С момента появления DBS достижения также включали новые стратегии программирования, включая замкнутый цикл и адаптивное программирование, при которых параметры стимуляции автоматически изменяются в зависимости от клинического состояния человека; однако в настоящее время они используются только в исследованиях. В настоящее время проводятся международные многоцентровые клинические испытания адаптивной стимуляции. a
При независимом контроле тока возможна более точная стимуляция между 2 и более активными контактами. С момента появления DBS достижения также включали новые стратегии программирования, включая замкнутый цикл и адаптивное программирование, при которых параметры стимуляции автоматически изменяются в зависимости от клинического состояния человека; однако в настоящее время они используются только в исследованиях. В настоящее время проводятся международные многоцентровые клинические испытания адаптивной стимуляции. a
Будущие направления
Инновации в передовых методах лечения болезни Паркинсона включают новые составы леводопы для непрерывного введения посредством подкожной инфузии в качестве альтернативы хирургическому размещению энтерального зонда. Непрерывное подкожное введение фоскарбидопы/фослеводопы (предшественников карбидопы/леводопы) продемонстрировало увеличение времени включения без неприятных дискинезий по сравнению с пероральным введением карбидопы/леводопы с немедленным высвобождением в исследовании фазы 3. Точно так же непрерывное подкожное введение карбидопы/леводопы в дозе до 720 мг от общей дозы леводопы в течение 16- или 24-часовых периодов в день оценивается в исследовании фазы 3. b В фазе 3 исследования новая пероральная форма леводопы ER, вводимая в среднем 3 раза в день, улучшала время «хорошего действия» по сравнению с карбидопой/леводопой с немедленным высвобождением, вводимых в среднем 5 раз в день, на 0,53 часа ( P = 0,0194). 26 В многоцентровом двойном слепом плацебо-контролируемом исследовании помпы для инфузий апоморфина c наблюдалось среднее сокращение ежедневного времени выключения на 2,47 часа при использовании апоморфина, доставляемого помпой, по сравнению со снижением на 0,58 часа при использовании помповой помпы. поставил плацебо, поддерживая повторное представление в FDA в 2021 году для возможного одобрения. 27
Точно так же непрерывное подкожное введение карбидопы/леводопы в дозе до 720 мг от общей дозы леводопы в течение 16- или 24-часовых периодов в день оценивается в исследовании фазы 3. b В фазе 3 исследования новая пероральная форма леводопы ER, вводимая в среднем 3 раза в день, улучшала время «хорошего действия» по сравнению с карбидопой/леводопой с немедленным высвобождением, вводимых в среднем 5 раз в день, на 0,53 часа ( P = 0,0194). 26 В многоцентровом двойном слепом плацебо-контролируемом исследовании помпы для инфузий апоморфина c наблюдалось среднее сокращение ежедневного времени выключения на 2,47 часа при использовании апоморфина, доставляемого помпой, по сравнению со снижением на 0,58 часа при использовании помповой помпы. поставил плацебо, поддерживая повторное представление в FDA в 2021 году для возможного одобрения. 27
Исследовательские методы лечения, нацеленные на патологический признак накопления α-синуклеина, включали низкомолекулярные ингибиторы накопления α-синуклеина, пассивную иммунизацию моноклональными антителами и активную иммунизацию иммуногенными пептидами, индуцирующими антитела к α-синуклеину. Ингибиторы C-Abelson kinase (c-Abl) были изучены на предмет потенциальных нейропротекторных эффектов, при этом некоторые неутешительные результаты для нилотиниба объясняются плохим проникновением в центральную нервную систему, и изучаются новые кандидаты.
Ингибиторы C-Abelson kinase (c-Abl) были изучены на предмет потенциальных нейропротекторных эффектов, при этом некоторые неутешительные результаты для нилотиниба объясняются плохим проникновением в центральную нервную систему, и изучаются новые кандидаты.
Хотя многие из этих изначально многообещающих направлений не нашли успеха в более крупных испытаниях, каждый извлеченный урок приближает нас к разгадке окончательной стратегии, которая приведет к значимой терапии и модификации болезни при болезни Паркинсона. Противовоспалительные подходы, микробиом кишечника и геноспецифическая терапия являются дополнительными областями продолжающихся исследований. Вполне вероятно, что в будущем наш терапевтический арсенал продолжит расширяться, и мы будем изучать индивидуальные предикторы для наилучших стратегий для реализации.
a Адаптивный алгоритм DBS для персонализированной терапии болезни Паркинсона (ADAPT-PD) (NCT04547712)
b Клиническое исследование прогрессирующей болезни Паркинсона, изучающее долгосрочную безопасность ND0612, вводимого в виде непрерывной подкожной инфузии (NCT02726386)
9 c Клиническое исследование 90 Испытание подкожной инфузии апоморфина у пациентов с прогрессирующей болезнью Паркинсона (TOLEDO) (NCT02006121)
1. Dorsey ER, Sherer T, Okun MS, Bloem BR. Появляющиеся доказательства пандемии Паркинсона. J Паркинсон Дис . 2018 2018;8(s1):S3-S8.
Dorsey ER, Sherer T, Okun MS, Bloem BR. Появляющиеся доказательства пандемии Паркинсона. J Паркинсон Дис . 2018 2018;8(s1):S3-S8.
2. McFarthing K, Rafaloff G, Baptista M, et al. Лекарственная терапия болезни Паркинсона в процессе клинических испытаний: обновление 2022 г. Дж Паркинсон Дис. 2022;12(4):1073-1082.
3. Eusebi P, Romoli M, Paoletti FP, Tambasco N, Calabresi P, Parnetti L. Факторы риска леводопа-индуцированной дискинезии при болезни Паркинсона: результаты когорты PPMI. NPJ Паркинсон Дис . 2018;4:33.
4. Лопес И.С., Руис П.Дж., Дель Посо С.В., Бернардос В.С. Двигательные осложнения при болезни Паркинсона: десятилетнее наблюдение. Мов Беспорядок. 2010;25(16):2735-2739.
5. Цилия Р., Акпалу А., Сарфо Ф.С. и соавт. Современная эра болезни Паркинсона до леводопы: взгляд на двигательные осложнения в странах Африки к югу от Сахары. Мозг . 2014; 137 (часть 10): 2731-2742.
6. Pringsheim T, Day GS, Smith DB, et al. Дофаминергическая терапия моторных симптомов на ранних стадиях болезни Паркинсона. Краткое изложение практических рекомендаций: отчет подкомитета по рекомендациям AAN. Неврология . 2021;97(20):942-957.
Дофаминергическая терапия моторных симптомов на ранних стадиях болезни Паркинсона. Краткое изложение практических рекомендаций: отчет подкомитета по рекомендациям AAN. Неврология . 2021;97(20):942-957.
7. LeWitt PA, Hauser RA, Pahwa R, et al. Безопасность и эффективность CVT-301 (ингаляционный порошок леводопы) в отношении двигательной функции в периоды выключения у пациентов с болезнью Паркинсона: рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы 3 [опубликованное исправление содержится в Lancet Neurol . 2019 март;18(3):e2]. Ланцет Нейрол . 2019;18(2):145-154. doi:10.1016/S1474-4422(18)30405-8
8. Olanow CW, Factor SA, Espay AJ, et al. Сублингвальная пленка с апоморфином для эпизодов болезни Паркинсона: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3. Ланцет Нейрол. 2020;19(2):135-144.
9. Borgohain R, Szasz J, Stanzione P, et al. Рандомизированное исследование добавления сафинамида к леводопе при болезни Паркинсона с моторными флюктуациями. Мов Беспорядок . 2014;29(2):229-237.
Мов Беспорядок . 2014;29(2):229-237.
10. Borgohain R, Szasz J, Stanzione P, et al. Двухлетнее рандомизированное контролируемое исследование сафинамида в качестве дополнения к леводопе при средней и поздней стадии болезни Паркинсона. Мов Беспорядок. 2014;29(10):1273-1280.
11. Schapira AH, Fox SH, Hauser RA, et al. Оценка безопасности и эффективности сафинамида в качестве дополнения к леводопе у пациентов с болезнью Паркинсона и двигательными флюктуациями: рандомизированное клиническое исследование. ДЖАМА Нейрол. 2017;74(2):216-224.
12. Stowe R, Ives N, Clarke CE, et al. Метаанализ сравнительной эффективности и безопасности адъювантной терапии леводопой при болезни Паркинсона на более поздних стадиях. Мов Беспорядок . 2011;26(4):587-598.
13. Ferreira JJ, Lees A, Rocha JF, et al. Опикапон в качестве дополнения к леводопе у пациентов с болезнью Паркинсона и моторными флуктуациями в конце дозы: рандомизированное двойное слепое контролируемое исследование.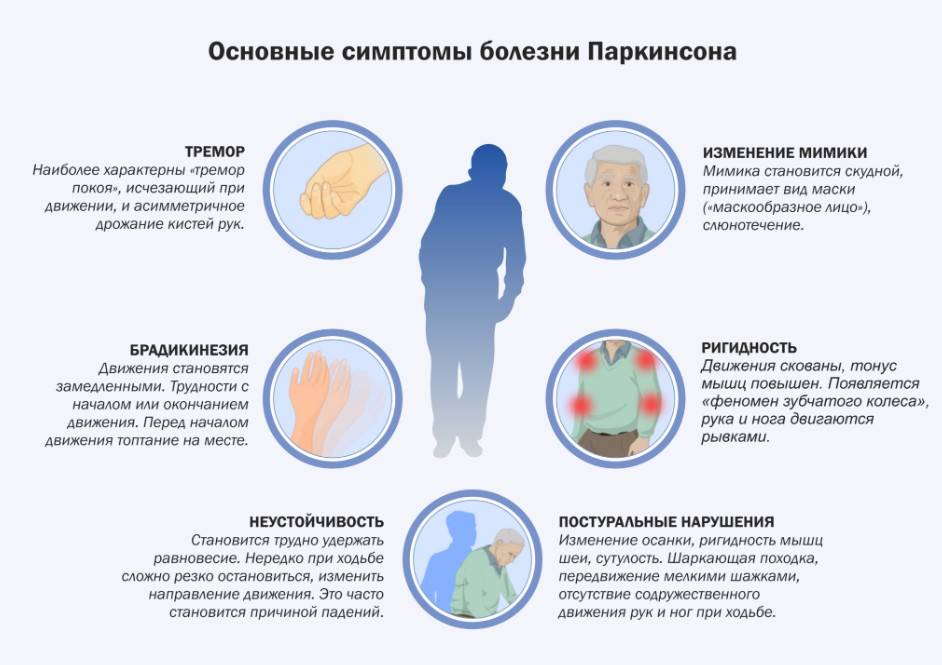 Ланцет Нейрол. 2016;15(2):154-165.
Ланцет Нейрол. 2016;15(2):154-165.
14. Lees AJ, Ferreira J, Rascol O, et al. Опикапон в качестве дополнения к терапии леводопой у пациентов с болезнью Паркинсона и двигательными флюктуациями: рандомизированное клиническое исследование. JAMA Нейрол. 2017;74(2):197-206.
15. Pahwa R, Tanner CM, Hauser RA, et al. Капсулы пролонгированного действия ADS-5102 (амантадин) для леводопа-индуцированной дискинезии при болезни Паркинсона (исследование EASE LID): рандомизированное клиническое исследование. JAMA Нейрол . 2017;74(8):941-949.
16. Эртель В., Эггерт К., Пахва Р. и др. Рандомизированное плацебо-контролируемое исследование капсул с пролонгированным высвобождением ADS-5102 (амантадин) для леводопа-индуцированной дискинезии при болезни Паркинсона (EASE LID 3). Мов Беспорядок . 2017;32(12):1701-1709.
17. Хаузер Р.А., Уолш Р.Р., Пахва Р., Черник Д., Формелла А.Е. Амантадин ER (Гоковри) значительно увеличивает время включения без какой-либо дискинезии: объединенные анализы основных исследований болезни Паркинсона. Передний нейрол . 2021;12:645706.
Передний нейрол . 2021;12:645706.
18. Elmer LW, Juncos JL, Singer C, et al. Объединенный анализ фазы III исследований капсул с пролонгированным высвобождением ADS-5102 (амантадин) для лечения дискинезии при болезни Паркинсона [опубликованное исправление появляется в Препараты ЦНС . 2018 10 апр;:]. Препараты ЦНС . 2018;32(4):387-398. doi:10.1007/s40263-018-0498-4
19. Hauser RA, Hattori N, Fernandez H, et al. Эффективность истрадефиллина, антагониста аденозиновых рецепторов A2A, в качестве дополнительной терапии к леводопе при болезни Паркинсона: объединенный анализ 8 испытаний фазы 2b/3. J Паркинсон Дис . 2021;11(4):1663-1675.
20. Подскальный Г.Д., Бастингс Е.П., Данн В.Х. Заявка номер 022075Orig1s000 краткий обзор. Центр оценки и исследований лекарств. 27 августа 2019 г.. По состоянию на 30 августа 2022 г. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/022075Orig1s000SumR.pdf
взгляд на общие клинические сценарии. Дегенеративный нейрон нервно-мышечной дисс . 2022;12:97-109.
Дегенеративный нейрон нервно-мышечной дисс . 2022;12:97-109.
22. Чен Дж.Ф., Кунья Р.А. Запоздалое одобрение FDA США антагониста рецептора аденозина A2A истрадефиллина для лечения болезни Паркинсона. Пуринергический сигнал . 2020;16(2):167-174.
23. Синай А., Нассар М., Спречер Э., Константинеску М., Заарур М., Шлезингер И. Фокусированная ультразвуковая таламотомия при болезни Паркинсона с доминирующим тремором: отдаленные результаты. J Паркинсон Дис . 2022;12(1):199-206.
24. Patel B, Chiu S, Wong JK, et al. Стратегии программирования глубокой стимуляции мозга: сегментированные лиды, независимые текущие источники и технологии будущего. Expert Rev Med Devices . 2021;18(9):875-891.
25. Шницлер А., Мир П., Бродский М.А. Направленная глубокая стимуляция мозга при болезни Паркинсона: результаты международного перекрестного исследования с рандомизированной двойной слепой первичной конечной точкой. Нейромодуляция . 2022;25(6):817-828.
2022;25(6):817-828.
26. Hauser RA, Espay AJ, LeWitt P, et al. Фаза 3 испытания IPX203 по сравнению с CD-LD IR у пациентов с болезнью Паркинсона с двигательными флуктуациями (RISE-PD) (S16.010). Неврология . 2022; 98 (дополнение 18): 1225.
27. Katzenschlager R, Poewe W, Rascol O, et al. Подкожная инфузия апоморфина у пациентов с болезнью Паркинсона со стойкими двигательными флюктуациями (TOLEDO): многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование. Ланцет Нейрол . 2018;17(9):749-759.
BP получает гонорары за консультации от Medtronic и финансируется за счет премии NIA по развитию карьеры K23AG073575
IM участвовала в исследованиях, финансируемых AbbVie, Boston Scientific, Neuroderm и Revance, и получала гонорары за консультации от Abbvie
Дизайнерские нейроны дают новую надежду на лечение болезни Паркинсона — ScienceDaily
Нейродегенеративные заболевания повреждают и разрушают нейроны, разрушая как психические и физическое здоровье. Болезнь Паркинсона, от которой страдают более 10 миллионов человек во всем мире, не является исключением. Наиболее очевидные симптомы болезни Паркинсона возникают после того, как болезнь повреждает определенный класс нейронов, расположенных в среднем мозге. Эффект заключается в том, чтобы лишить мозг дофамина — ключевого нейротрансмиттера, вырабатываемого пораженными нейронами.
Болезнь Паркинсона, от которой страдают более 10 миллионов человек во всем мире, не является исключением. Наиболее очевидные симптомы болезни Паркинсона возникают после того, как болезнь повреждает определенный класс нейронов, расположенных в среднем мозге. Эффект заключается в том, чтобы лишить мозг дофамина — ключевого нейротрансмиттера, вырабатываемого пораженными нейронами.
В новом исследовании Джеффри Кордауэр и его коллеги описывают процесс превращения ненейрональных клеток в функционирующие нейроны, способные поселиться в мозге, распустить свои волокнистые ответвления по нервной ткани, сформировать синапсы, выделить дофамин и восстановить нарушенные способности. деструкцией дофаминергических клеток при болезни Паркинсона.
Текущее экспериментальное исследование показывает, что одна группа экспериментально созданных клеток обеспечивает оптимальные показатели выживания, роста, нейронной связи и выработки дофамина при имплантации в мозг крыс. Исследование показывает, что результатом таких нервных трансплантатов является эффективное устранение двигательных симптомов, вызванных болезнью Паркинсона.
Заместительная терапия стволовыми клетками представляет собой радикально новую стратегию лечения болезни Паркинсона и других нейродегенеративных заболеваний. Футуристический подход скоро будет проверен в первом в своем роде клиническом испытании на конкретной популяции больных болезнью Паркинсона, несущих мутацию в гене паркина. Испытание будет проводиться в разных местах, в том числе в Неврологическом институте Бэрроу в Фениксе, с Кордауэром в качестве главного исследователя.
Работа поддерживается грантом Фонда Майкла Дж. Фокса.
«Мы очень рады возможности помочь людям, страдающим этой генетической формой болезни Паркинсона, но уроки, извлеченные из этого исследования, также напрямую повлияют на пациентов, страдающих спорадическими или негенетическими формами этого заболевания. — говорит Кордауэр.
реклама
Кордауэр руководит Исследовательским центром нейродегенеративных заболеваний ASU-Banner в Университете штата Аризона и является почетным директором Института биодизайна Шарлин и Дж. Орин Эдсон. Новое исследование подробно описывает экспериментальную подготовку стволовых клеток, подходящих для имплантации, чтобы обратить вспять последствия болезни Паркинсона.
Орин Эдсон. Новое исследование подробно описывает экспериментальную подготовку стволовых клеток, подходящих для имплантации, чтобы обратить вспять последствия болезни Паркинсона.
Исследование опубликовано в текущем выпуске журнала npj Nature Regenerative Medicine.
Новый взгляд на болезнь Паркинсона
Не нужно быть нейробиологом, чтобы идентифицировать нейрон. Такие клетки с их разветвленной сетью аксонов и дендритов мгновенно узнаваемы и не похожи ни на один другой тип клеток в организме. С помощью своих электрических импульсов они тщательно контролируют все, от частоты сердечных сокращений до речи. Нейроны также являются хранилищем наших надежд и тревог, источником нашей индивидуальной идентичности.
Дегенерация и потеря дофаминергических нейронов вызывает физические симптомы ригидности, тремора и постуральной неустойчивости, которые характеризуют болезнь Паркинсона. Дополнительные эффекты болезни Паркинсона могут включать депрессию, тревогу, нарушение памяти, галлюцинации и деменцию.
Из-за старения населения человечество столкнулось с растущим кризисом случаев болезни Паркинсона, и ожидается, что к 2040 году их число превысит 14 миллионов во всем мире. устраняют некоторые двигательные симптомы заболевания и могут вызвать серьезные, часто непереносимые побочные эффекты после 5-10 лет использования.
Не существует лечения, способного обратить вспять болезнь Паркинсона или остановить ее безжалостное развитие. Крайне необходимы дальновидные инновации для решения этой надвигающейся чрезвычайной ситуации.
Многофункциональное мощное оружие против болезни Паркинсона
Несмотря на интуитивную привлекательность простой замены мертвых или поврежденных клеток для лечения нейродегенеративных заболеваний, успешная имплантация жизнеспособных нейронов для восстановления функции требует огромных усилий. Пришлось преодолеть множество технических препятствий, прежде чем исследователи, в том числе Кордауэр, смогли начать добиваться положительных результатов, используя класс клеток, известный как стволовые клетки.
Интерес к стволовым клеткам как привлекательному средству лечения целого ряда заболеваний резко возрос после 2012 года, когда Джон Б. Гердон и Шинья Яманака разделили Нобелевскую премию за прорыв в исследованиях стволовых клеток. Они показали, что зрелые клетки можно перепрограммировать, сделав их «плюрипотентными» или способными дифференцироваться в клетки любого типа в организме.
Эти плюрипотентные стволовые клетки функционально эквивалентны эмбриональным стволовым клеткам, которые процветают во время эмбрионального развития, мигрируют к месту своего жительства и развиваются в клетки сердца, нервов, легких и других типов клеток, что является одним из самых замечательных преобразований в природе.
Нейронная алхимия
Взрослые стволовые клетки бывают двух видов. Один тип можно найти в полностью развитых тканях, таких как костный мозг, печень и кожа. Эти стволовые клетки немногочисленны и обычно развиваются в тип клеток, принадлежащих ткани, из которой они получены.
Второй вид взрослых стволовых клеток (и предмет данного исследования) известен как индуцированные плюрипотентные стволовые клетки (ИПСК). Техника получения ИПСК, используемых в исследовании, состоит из двух этапов. В каком-то смысле клетки вынуждены путешествовать во времени сначала в обратном, а затем в прямом направлении.
Во-первых, взрослые клетки крови обрабатывают специфическими факторами перепрограммирования, которые заставляют их превращаться в эмбриональные стволовые клетки. На втором этапе эти эмбриональные стволовые клетки обрабатывают дополнительными факторами, заставляя их дифференцироваться в желаемые клетки-мишени — нейроны, продуцирующие дофамин.
«Основной вывод, сделанный в настоящей статье, заключается в том, что время, в которое вы даете второй набор факторов, имеет решающее значение», — говорит Кордауэр. «Если вы лечите и культивируете их в течение 17 дней, а затем останавливаете их деление и дифференцируете, это работает лучше всего». 9Нейроны с идеальным слухом длинные дистанции. «Это важно, — говорит Кордауэр, — потому что им придется расти на большие расстояния в большом человеческом мозгу, и теперь мы знаем, что эти клетки способны на это».
«Это важно, — говорит Кордауэр, — потому что им придется расти на большие расстояния в большом человеческом мозгу, и теперь мы знаем, что эти клетки способны на это».
Крысы, которым вводили 17-дневные иПСК, продемонстрировали значительное восстановление моторных симптомов болезни Паркинсона. Исследование также показывает, что этот эффект зависит от дозы. Когда небольшое количество иПСК трансплантировали в мозг животного, восстановление было незначительным, но большой набор клеток приводил к более обильному ветвлению нейронов и полному устранению симптомов болезни Паркинсона.
В первом клиническом испытании терапия иПСК будет применяться к группе пациентов с болезнью Паркинсона, несущих особую генетическую мутацию, известную как мутация Паркина. Такие пациенты страдают типичными симптомами двигательной дисфункции, характерными для общей или идиопатической болезни Паркинсона, но не страдают снижением когнитивных функций или деменцией. Эта группа пациентов представляет собой идеальную испытательную площадку для заместительной клеточной терапии.

 гов
гов