Нейролептики для пожилых людей: Нейролептики пожилым людям | Пансионат для пожилых людей
Эффективность и безопасность применения рисперидона (рисполюкс) у больных деменцией с психотическими и поведенческими расстройствами
Повышение качества и доступности медицинской помощи, совершенствование системы здравоохранения приводят к увеличению продолжительности жизни и соответственно увеличению доли пожилых людей в структуре населения. С ростом продолжительности жизни наблюдается увеличение частоты когнитивных нарушений и деменции. Так, по данным B. Plassman и соавт. [49], распространенность деменции среди лиц старческого возраста колеблется с 5,0% в возрастной группе 71—79 лет до 37,4% в возрасте 90 лет и старше.
Деменцию определяют как приобретенное снижение интеллектуальных функций. Нарушение интеллектуальных функций при деменции характеризуется одновременным расстройством памяти, речи, внимания, праксиса, гнозиса и более тонких функций, например таких, как способность принимать решения, планировать и контролировать свои действия. Деменция ограничивает возможности больного к самообслуживанию, нарушает его бытовую независимость и социальную адаптацию, делает его неспособным к профессиональной деятельности.
Наряду с интеллектуальным дефицитом более чем у 50% больных деменцией наблюдаются психотические симптомы (бред и галлюцинации) и поведенческие нарушения (агрессия, возбуждение, ажитация, раздражительность, нарушения активности, апатия, расторможенность и др.), а также аффективные расстройства (депрессия, тревога, фобия) [44]. Это коррелирует с данными исследования S. Bergh и соавт. [12], в котором установлено, что у 91,7% пациентов имелся по меньшей мере один из симптомов психических и поведенческих расстройств, таких как раздражительность (у 63,5%), ажитация (у 51,0%), расторможенность (у 37,8%) и депрессия, причем бредовые расстройства, ажитация и раздражительность носили стойкий характер и были постоянными.
По мере увеличения продолжительности и тяжести деменции наблюдается повышение частоты связанных с ней психических, поведенческих и невротических расстройств. Так, согласно данным B. Plassman и соавт. [49], распространенность деменции в США среди лиц старше 71 года составляет 13,9%, и 70% из этих больных имеют симптомы психоза в течение 7 лет после постановки диагноза. Отмечено, что в течение каждого следующего года заболевания у пациентов наблюдается прирост суммарного количества галлюцинаторно-бредовых инцидентов: 20,1% в 1-й год, 36,1% во 2-й, 49,5% в 3-й и 51,3% в 4-й [18, 46, 57].
Анализ посвященной проблеме деменции литературы показывает, что наибольшее внимание исследователи уделяют когнитивным расстройствам, и гораздо меньше внимания уделяется психотическим и поведенческим нарушениям, хотя именно эти расстройства ведут к более быстрому развитию когнитивного дефицита, нарушению нормального функционирования и социального поведения, приводя к ухудшению качества жизни и прогноза [46]. Психотические и поведенческие расстройства, а не интеллектуально-мнестическое снижение, часто создают и наибольшие трудности для лиц, осуществляющих уход за больными деменцией, и приводят к росту числа госпитализаций и, соответственно, увеличению стоимости терапии.
Психотические и поведенческие расстройства, а не интеллектуально-мнестическое снижение, часто создают и наибольшие трудности для лиц, осуществляющих уход за больными деменцией, и приводят к росту числа госпитализаций и, соответственно, увеличению стоимости терапии.
Для определения стратегии и тактики терапии всеми специалистами признана необходимость проведения полного диагностического обследования больных деменцией, сопровождающейся психотическими расстройствами. Необходимо определить этиологию синдрома деменции и психических расстройств и исключить какие-либо иные ее причины, например опухолевый генез или развитие лекарственно спровоцированной спутанности сознания.
Целью терапии больных деменцией с психотическими и поведенческими расстройствами являются возможно более полное купирование психопатологической симптоматики, сохранение и по возможности улучшение когнитивных функций. Учитывая, что больные пожилого возраста, как правило, страдают коморбидной соматической патологией и они в большинстве случаев вынуждены принимать комбинированную терапию, а также то, что у пожилых часто нарушены функции печени и почек и, как следствие, снижены уровень лекарственного метаболизма и процессы выведения метаболитов лекарственных средств, при выборе терапии врач в первую очередь должен руководствоваться безопасностью назначаемых препаратов и их комбинаций.
Для терапии некогнитивных расстройств у больных применяют различные группы психотропных препаратов: антипсихотики, антидепрессанты, транквилизаторы, антиконвульсанты и др. С 50-х годов основными средствами для коррекции психозов и поведенческих расстройств при деменции были и остаются нейролептики. Источником восстановления и улучшения когнитивных функций у больных при применении нейролептиков является их способность редуцировать позитивные, негативные и другие симптомы.
В целом ряде исследований [8, 11, 16, 24, 35] установлено, что при купировании позитивной и негативной симптоматики восстанавливаются и улучшаются когнитивные функции. Важным фактором, влияющим на динамику когнитивных функций, является также выраженность возникающих на фоне терапии антипсихотиками экстрапирамидных симптомов, и, как следствие, необходимость использования антихолинергических препаратов.
Антипсихотические препараты первого поколения, или типичные нейролептики, активно применяются у больных на протяжении многих десятилетий. Их недостатком являются те или иные побочные явления, развивающиеся почти у 90% больных [47].
Их недостатком являются те или иные побочные явления, развивающиеся почти у 90% больных [47].
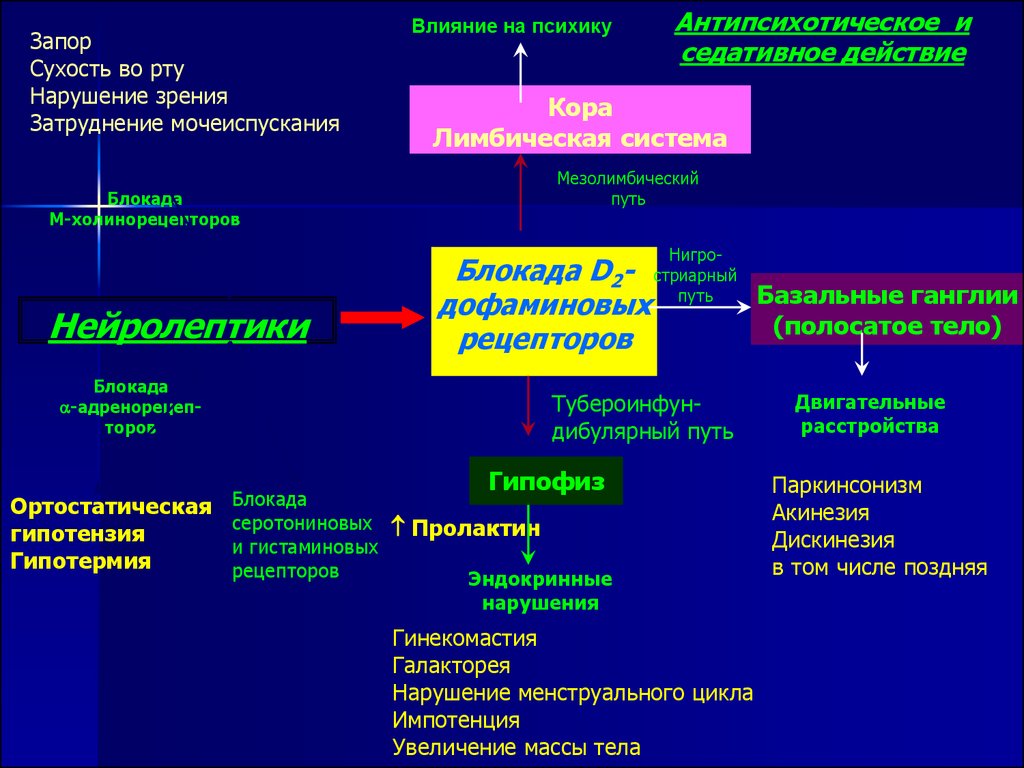
У больных с когнитивными расстройствами и деменцией наиболее нежелательными являются антихолинергические побочные эффекты, способные усугубить нарушения когнитивных функций, на которые сами традиционные антипсихотики действуют мало. Даже относительно непродолжительное применение традиционных антипсихотиков с выраженным холинолитическим действием может сопровождаться нарастанием когнитивных нарушений; безусловно, усугубляет эти расстройства прием корректоров, связанный с экстрапирамидными нарушениями [13, 36, 37, 40, 43, 51, 52, 55, 61]. При применении антипсихотиков могут наблюдаться и другие нежелательные холинолитические эффекты, такие как сухость во рту, тахикардия, нарушения аккомодации, нарушения выделения мочи и задержка мочеиспускания, запор, ортостатическая гипотензия и др. Указанные побочные эффекты осложняют течение основного заболевания, приводя к усилению когнитивных расстройств и аффективных нарушений, что сопровождается утяжелением социальной дезадаптации больных.
Более современной группой препаратов для лечения психотических и поведенческих расстройств являются атипичные нейролептики. Как и типичные антипсихотики, они блокируют D2-рецепторы, способны блокировать серотонинергические рецепторы, такие как 5-HT2, что обусловливает их действие не только на позитивные, но и негативные симптомы, а также на когнитивные функции. Эти препараты имеют более высокую эффективность и безопасность, реже вызывают экстрапирамидные симптомы, такие как паркинсонизм и поздняя дискинезия [57].
Важно подчеркнуть, что применение атипичных антипсихотиков сопровождается меньшим риском возникновения цереброваскулярных нарушений [21, 30, 41].
В этом отношении особый интерес представляют два ретроспективных исследования [23, 33], в которых сопоставлялась частота цереброваскулярных нарушений у пожилых пациентов, получавших атипичные и типичные нейролептики.
В большом числе исследований [1—6, 13, 15, 17, 20, 25, 27—29, 31, 36—40, 42, 43, 50—52, 54—56, 58, 60—62] было установлено, что применение атипичных антипсихотиков улучшает когнитивные функции. Так, рисперидон способствует восстановлению таких когнитивных функций, как зрительная память, праксис, гнозис, вербальное, невербальное и вербально-логическое мышление; амисульприд воздействует на праксис, особенно за счет кинестетического, кинетического и целевого компонентов; кветиапин улучшает вербальное и вербально-логическое мышление, праксис, нейродинамику, произвольную регуляцию деятельности, оланзапин влияет на слухоречевую и зрительную память, несколько отсроченно на праксис; сертиндол улучшает время реакции, рабочую память, исполнительскую функцию (проблемно-решающее поведение).
Одним из наиболее хорошо изученных атипичных нейролептиков является рисперидон. Препарат воздействует главным образом на передачу возбуждения дофаминовыми (D2) и серотониновыми (5-HT2) рецепторами [10].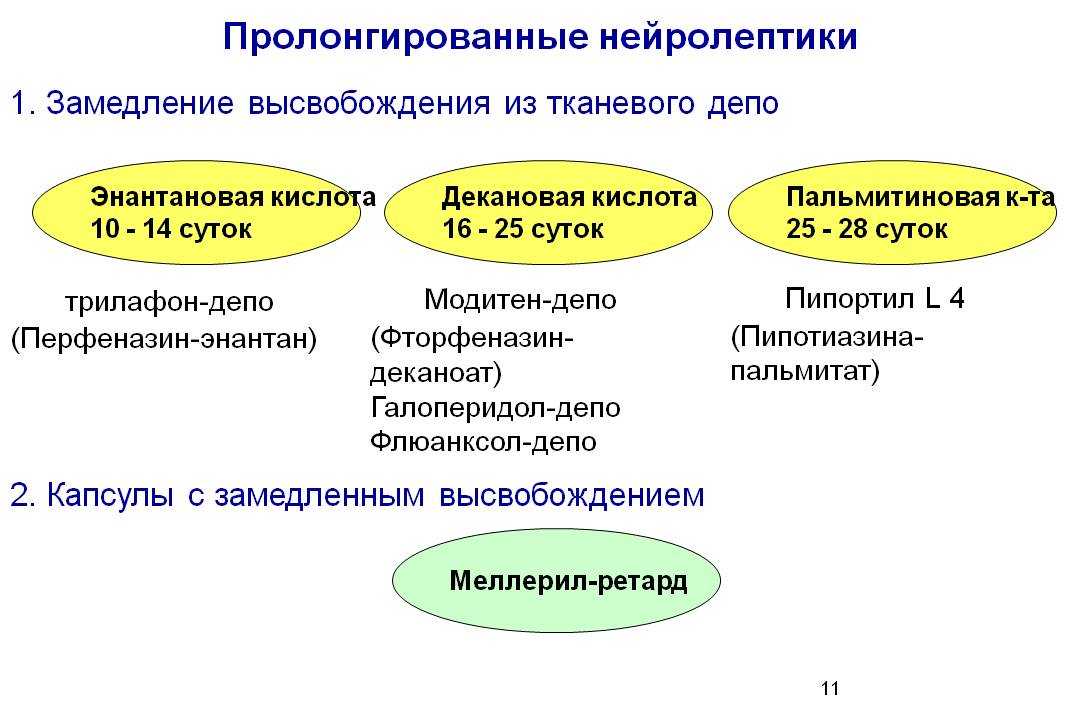 В дозах, не превышающих средние терапевтические, рисперидон не оказывает воздействия на холинергическую систему, во время терапии препаратом крайне редко возникают холинолитические побочные эффекты, а также минимален риск развития седации, это обусловлено низкой тропностью препарата соответственно к М1- и Н1-рецепторам. Установлено, что рисперидон обнаруживает наименьшее сродство с ацетилхолиновыми рецепторами по сравнению с другими атипичными антипсихотиками [26].
В дозах, не превышающих средние терапевтические, рисперидон не оказывает воздействия на холинергическую систему, во время терапии препаратом крайне редко возникают холинолитические побочные эффекты, а также минимален риск развития седации, это обусловлено низкой тропностью препарата соответственно к М1- и Н1-рецепторам. Установлено, что рисперидон обнаруживает наименьшее сродство с ацетилхолиновыми рецепторами по сравнению с другими атипичными антипсихотиками [26].
Эффективность рисперидона при лечении психотических и поведенческих расстройств у больных с деменцией исследовалась с начала 90-х годов, и тем не менее этот вопрос остается недостаточно изученным. В небольшом количестве зарубежных исследований было показано более выраженное действие рисперидона на психотические и поведенческие расстройства в сравнении с плацебо и галоперидолом, но без учета влияния препарата на когнитивный дефицит [14, 19, 34, 59]. В одном из исследований [34] лечили 625 пациентов с болезнью Альцгеймера, сосудистой и смешанной деменцией, причем 95% пациентов страдали тяжелой деменцией с психотическими и поведенческими расстройствами (психоз, агрессия, ажитация и др.
 Был сделан вывод, что терапия малыми дозами рисперидона в сравнении с плацебо приводит к более значительному регрессу всего спектра симптомов психоза, связанных с деменцией [45]. Частота проявлений экстрапирамидных симптомов на фоне приема рисперидона и плацебо существенно не различалась — 23 и 16% соответственно.
Был сделан вывод, что терапия малыми дозами рисперидона в сравнении с плацебо приводит к более значительному регрессу всего спектра симптомов психоза, связанных с деменцией [45]. Частота проявлений экстрапирамидных симптомов на фоне приема рисперидона и плацебо существенно не различалась — 23 и 16% соответственно.В одном из многоцентровых исследований [19], которое продолжалось 13 нед, 344 больных деменцией различной этиологии с нарушениями поведения, ажитацией и агрессивностью были разделены на 3 группы: пациентам 1-й группы назначали рисперидон (в дозе от 0,5 до 4 мг/сут), больным 2-й группы назначали эквивалентные дозы галоперидола, 3-й — плацебо. Было установлено, что на момент окончания исследования средние эффективные дозы рисперидона и галоперидола составляли 1,1 и 1,2 мг/сут соответственно; у достоверно большего числа пациентов на фоне терапии рисперидоном по сравнению с галоперидолом и плацебо наблюдалась редукция выраженности поведенческих и психотических симптомов (на 30% и более по шкале BEHAVE-AD) и агрессии по опроснику CMAI), а также по шкале общего клинического впечатления (CGI). Терапия рисперидоном хорошо переносилась больными, достоверных различий в появлении экстрапирамидных симптомов в группах больных, получавших плацебо (у 11%) и рисперидон (у 15%) установлено не было, тогда как в группе больных, леченных галоперидолом, они встречались достоверно чаще (у 22% больных).
Терапия рисперидоном хорошо переносилась больными, достоверных различий в появлении экстрапирамидных симптомов в группах больных, получавших плацебо (у 11%) и рисперидон (у 15%) установлено не было, тогда как в группе больных, леченных галоперидолом, они встречались достоверно чаще (у 22% больных).
В двойном слепом перекрестном исследовании [59] с участием 120 пациентов с деменцией различного генеза (болезнь Альцгеймера, сосудистая и смешанная деменция) были изучены эффективность и переносимость терапии рисперидоном (0,5—1,5 мг/сут) и галоперидолом в течение 18 нед. При приеме рисперидона в сравнении с галоперидолом у пациентов достигнуто значительно более выраженное улучшение по всем шкалам, применявшимся для оценки купирования психотических симптомов и расстройств поведения — по шкалам BEHAVE-AD-K (корейская версия — BPSD), CGI, опроснику Коен-Мансфилд — Cohen-Mansfield Agitation Inventory (корейская версия — CMAI-K). Рисперидон имел дополнительное преимущество в снижении агрессивности и тревожно-фобических расстройств. Кроме того, было выявлено дополнительное преимущество у рисперидона в отношении купирования агрессивности и тревоги и фобий. Риск антипсихотически-индуцированных экстрапирамидных расстройств на протяжении всего исследования был значительно ниже при использовании рисперидона.
Кроме того, было выявлено дополнительное преимущество у рисперидона в отношении купирования агрессивности и тревоги и фобий. Риск антипсихотически-индуцированных экстрапирамидных расстройств на протяжении всего исследования был значительно ниже при использовании рисперидона.
Только в нескольких исследованиях изучалось влияние рисперидона на психотические и поведенческие расстройства у пациентов с деменцией с учетом воздействия препарата на когнитивный дефицит.
В 8-недельном открытом исследовании [63] у 58 пациентов с болезнью Альцгеймера, средний возраст которых составил 75,7 года, оценивали эффективность рисперидона в дозе 0,25—2,0 мг/сут. Завершили исследование 48 (83%) пациентов. Средняя доза рисперидона в начале и в конце исследования составила 0,6 и 1,0 мг/сут соответственно.
С высокой степенью достоверности была достигнута редукция уровня выраженности почти всех поведенческих и психотических симптомов (по шкале BEHAVE-AD-K), так, например, уменьшились параноидные, бредовые, галлюцинаторные, аффективные симптомы, понизилась агрессивность. Достоверных изменений когнитивных функций (по корейской версии MMSE (Mini-Mental State Examination — краткая шкала оценки психического статуса) [22] отмечено не было. Побочные явления при лечении рисперидоном у большинства больных оценивались как незначительные.
Достоверных изменений когнитивных функций (по корейской версии MMSE (Mini-Mental State Examination — краткая шкала оценки психического статуса) [22] отмечено не было. Побочные явления при лечении рисперидоном у большинства больных оценивались как незначительные.
В открытом 8-недельном исследовании [53] у 34 пациентов с деменцией, средний возраст которых был 76 лет, оценивали эффективность рисперидона в различных дозах — от 0,5 до 2,0 мг/сут. В конце исследования рисперидон в дозе 0,6 мг/сут принимали 18% пациентов, 1,0 мг/сут — 50% и больше 1 мг/сут — 32%. Оценка динамики состояния пациентов по CGI показала, что у 82% больных имело место значительное или очень значительное улучшение. По данным опросника психотического состояния Neuropsychiatric Inventory (NPI), частота и тяжесть бредовых, галлюцинаторных симптомов, ажитации, агрессии и раздражительности достоверно уменьшилась в сравнении с исходным уровнем (p<0,001), но достоверных изменений когнитивных функций по шкале MMSE и другим шкалам отмечено не было. Переносимость рисперидона была оценена как хорошая, не было выявлено клинически значимых экстрапирамидных симптомов, изменений жизненно важных функций и массы тела.
Переносимость рисперидона была оценена как хорошая, не было выявлено клинически значимых экстрапирамидных симптомов, изменений жизненно важных функций и массы тела.
Исследование D. Jeste и соавт. [32] показало, что у пожилых пациентов с шизофренией, осложненной деменцией, традиционные антипсихотики действуют на негативную симптоматику менее эффективно в сравнении с атипичными, в том числе с рисперидоном, при этом атипичные нейролептики лучше влияют на когнитивные функции.
Приведенные данные позволяют считать, что атипичные антипсихотики должны рассматриваться как препараты первой линии терапии у пожилых пациентов с деменцией в сочетании с психотическими и поведенческими расстройствами. При выборе терапевтической стратегии следует руководствоваться принципом использования минимальных доз и проводить дифференцированное назначение лечения в соответствии со спектром психотропной активности препаратов, особенностями их влияния на нейрокогнитивный дефицит и профилем побочных эффектов.
Нам встретилось только одно отечественное исследование [7], посвященное изучению эффективности и безопасности рисперидона у больных деменцией с психотическими и поведенческими расстройствами. Однако в нем не оценивалась динамика изменения когнитивных функций.
Цель настоящей работы — оценка клинической эффективности малых доз рисперидона при лечении больных с психотическими расстройствами и нарушениями поведения при деменции различного генеза, а также оценка его влияния на когнитивные функции у данных пациентов.
Материал и методы
Исследование было проведено в 2010 г. на базе 6-го отделения Санкт-Петербургской городской психиатрической больницы №6. В открытое перспективное плацебо-неконтролируемое исследование были включены 30 женщин с различными клиническими формами деменции. Их возраст колебался от 65 до 89 лет (средний — 77,6±5,7 года).
Распределение больных по диагнозам приведено в табл. 1.
| Таблица1 |
До включения в исследование 8 пациенток получали антипсихотики (хлорпротиксен, галоперидол, тиапридал, кветиапин).
Критериями включения в исследование являлись: клинический диагноз деменции, отсутствие сопутствующей тяжелой или нестабильной соматической патологии (любое состояние, непосредственно угрожающее жизни больного, злокачественные новообразования, острый инфаркт миокарда, нестабильная стенокардия, угрожающие аритмии или неконтролируемая артериальная гипертензия, декомпенсированный сахарный диабет или другие эндокринопатии в стадии декомпенсации, декомпенсированная сердечная, легочная, печеночная или почечная недостаточность; туберкулез, ВИЧ, сифилис).
Продолжительность исследования составляла 4 нед. Больным, включенным в исследование, назначали таблетированный рисполюкс (рисперидон) производства Sandoz—Novartis. Он назначался в дозе от 1 до 2 мг/сут в 1 прием, как правило, на ночь. В процессе лечения рисполюксом исключались другие нейролептики. Допускалось лишь использование транквилизаторов в качестве снотворного средства, антипаркинсонических препаратов при появлении экстрапирамидных симптомов, а также средств для лечения сопутствующих соматических заболеваний.
Клиническое исследование выполнялось в соответствии с правилами GCP по специально разработанному протоколу и с использованием унифицированных индивидуальных карт больных. Психометрическая оценка проводилась по шкалам MMSE [48] и CGI-I (Clinical Global Impression Scale — Improvement) [30]. Она проводилась дважды — до начала терапии и после 4 нед приема препарата. Оценка экстрапирамидных нарушений проводилась по шкале ESRS (Extrapyramidal Symptom Rating Scale). До включения в исследование и после его окончания измеряли массу пациентки и окружность талии.
При обработке данных использовали программу Statistica 8.0.
Результаты и обсуждение
Из 30 включенных в 4-недельное исследование пациенток полностью завершили его 29 человек. Одна пациентка умерла от внезапно развившейся острой сердечной недостаточности, не связанной с антипсихотической терапией, на 5-й день исследования.
При завершении курса терапии больные, получавшие разные дозы препарата, распределились следующим образом: дозировку 1 мг/сут получали 14 (48,2%) больных, 1,5 мг/сут — 12 (41,3%), 2 мг/сут — 3 (10,3%). Средняя суточная доза рисперидона составила 1,31±0,33 мг.
Средняя суточная доза рисперидона составила 1,31±0,33 мг.
К моменту завершения исследования у большинства пациенток отмечалась положительная динамика психического состояния. Средняя оценка по шкале CGI-I статистически достоверно (p<0,01) снизилась с 5,41±0,63 (в начале исследования) до 3,21±0,56 балла (к моменту окончания исследования).
К моменту завершения курса терапии улучшение психического состояния было установлено у 23 (76,6%) больных. В ходе терапии рисперидоном плавно редуцировались бредовые, галлюцинаторные и поведенческие расстройства. Как правило, психотические и поведенческие расстройства купировались в течение первых 2 нед лечения, и в дальнейшем состояние существенно не менялось. У больных редуцировались делириозные расстройства, спутанность сознания, психомоторное возбуждение, склонность к агрессии (уменьшились угрозы расправы и попытки нападения на окружающих их лиц, агрессия на вербальном уровне), расторможенность и конфликтность, нарушения суточного ритма (сократилось количество проблем с засыпанием, частыми пробуждениями и укорочением ночного сна), нарушение активности (уменьшилась бесцельная деятельность, неадекватное поведение в виде излишней общительности с незнакомыми людьми или, наоборот, полной отстраненности от контактов, оголения, складирования предметов в неподходящих для этого местах и т. п.). В ходе терапии рисполюксом отмечено также уменьшение проявлений аффективных расстройств (депрессивное и тревожное настроение, плаксивость). Редукция психотических и поведенческих расстройств у больных сыграла ключевую роль в восстановлении когнитивных функций и, соответственно, в улучшении социального функционирования и качества жизни. Медицинский персонал, принимавший участие в терапии и уходе за больными, отметил, что в процессе терапии рисполюксом у больных упорядочились поведение и активность, улучшилось восприятие как общей информации, так и лечебных рекомендаций, больные стали более сознательными, что коррелирует с данными исследования В.И. Максимова [9]. При общении с окружающими у больных появились приветливость, доброжелательность, значительно снизились трудности в общении, стало легче проводить лечебно-реабилитационный процесс и уход за больными.
п.). В ходе терапии рисполюксом отмечено также уменьшение проявлений аффективных расстройств (депрессивное и тревожное настроение, плаксивость). Редукция психотических и поведенческих расстройств у больных сыграла ключевую роль в восстановлении когнитивных функций и, соответственно, в улучшении социального функционирования и качества жизни. Медицинский персонал, принимавший участие в терапии и уходе за больными, отметил, что в процессе терапии рисполюксом у больных упорядочились поведение и активность, улучшилось восприятие как общей информации, так и лечебных рекомендаций, больные стали более сознательными, что коррелирует с данными исследования В.И. Максимова [9]. При общении с окружающими у больных появились приветливость, доброжелательность, значительно снизились трудности в общении, стало легче проводить лечебно-реабилитационный процесс и уход за больными.
Что касается когнитивных функций, то по шкале MMSE отмечено статистически достоверное (p<0,01) их улучшение (табл. 2).
2).
| Таблица2 |
]]> |
| Таблица3 |
]]> |
| Динамика основных показателей психического и когнитивного статуса. |
]]> |
 Имеющееся улучшение по субшкале «память» было статистически недостоверно (t-критерий 1,8; p=0,083).
Имеющееся улучшение по субшкале «память» было статистически недостоверно (t-критерий 1,8; p=0,083).Экстрапирамидные нарушения, оцениваемые по шкале ESRS, отсутствовали в течение всего времени проведения исследования. Средние показатели массы тела и объема талии за время исследования существенно не изменились.
В заключение можно отметить, что проведенное исследование показало высокую эффективность рисперидона в ходе терапии психотических и поведенческих расстройств у больных деменцией. В течение первых 2 нед у больных редуцировались делириозные расстройства, спутанность сознания, психомоторное возбуждение, склонность к агрессии, расторможенность и конфликтность, что, несомненно, повлияло на восстановление когнитивных функций.
Изучение когнитивного статуса у исследованных больных выявило существенное увеличение общего балла по шкале MMSE. Наиболее выраженным улучшение было по субшкалам «ориентировка во времени», «ориентировка в месте», «восприятие».
Редукция психотических (галлюцинаторно-бредовых), поведенческих и когнитивных расстройств у больных способствовала восстановлению и улучшению социального функционирования и качества жизни.
Улучшение когнитивных функций, по-видимому, имело вторичный характер и было связано с редукцией психотических проявлений. Об этом, по нашему мнению, свидетельствует то, что улучшение по субшкале «память» шкалы MMSE не достигло статистически значимого уровня. Из данных, полученных в ходе проведенного исследования, следует, что при адекватной терапии атипичным антипсихотиком рисполюкс (рисперидон) когнитивные функции у больных деменцией могут улучшаться.
В использованных дозах (1—2 мг/сут) рисполюкс хорошо переносится больными деменцией с психотическими и поведенческими расстройствами. При оценке экстрапирамидных расстройств при помощи шкалы ESRS не было выявлено увеличения частоты побочных эффектов. За время исследования не отмечалось также статистически значимого изменения средней массы тела и объема талии больных.
Прием нейролептиков связан с более высокой смертностью при депрессии | Новости
Ключевые слова / keywords: Антидепрессанты, Антипсихотики, Депрессивные расстройства, Депрессия, Смертность, Antidepressants, Antipsychotics, Depressive disorders, Depression, Mortality
Антидепрессанты из группы селективных ингибиторов обратного захвата серотонина являются препаратами первой линии для лечения депрессии, однако многие люди не реагируют на подобный курс лечения.
Последующие варианты терапии включают переход на другой антидепрессант с последующими различными стратегиями увеличения дозы или количества препаратов, включая антипсихотические средства, такие как арипипразол, кветиапин и оланзапин.
Нейролептики обладают хорошо известными серьезными побочными эффектами, включая более чем 50-процентное повышение риска смертности у пожилых людей с деменцией. Ранее было неизвестно, можно ли экстраполировать эти данные на людей пожилого возраста, использующих новые нейролептики в качестве дополнительного лечения депрессии.
Клинические испытания, которые позволили одобрить применение различных новых нейролептиков для лечения депрессии, обладают небольшой выборкой и слишком короткими интервалами времени, чтобы можно было с уверенностью судить о вреде антипсихотиков для пожилых лиц с депрессией.
Ученые из Университета Рутгерса вместе с коллегами из Колумбийского университета решили исследовать этот вопрос. Результаты исследования были опубликованы в журнале PLOS ONE.
Исследователи провели анализ данных о 39 582 участниках программы Medicaid в возрасте от 25 до 64 лет с 2001 по 2010 год, связанной с Национальным индексом смертности. После периода лечения одним антидепрессантом из-за неэффективности лечения пациентам в исследовании добавляли либо что-то из новых антипсихотиков, либо второй антидепрессант.
В результате было обнаружено относительное увеличение риска смерти на 45% для тех, кто начал принимать новый антипсихотик, что для когорты исследования означало одну дополнительную смерть на каждые 265 человек, принимавших антипсихотик в течение одного года.
«Полученные результаты требуют проверки с помощью рандомизированного контролируемого проспективного исследования. Тем не менее, наше исследование показывает, что врачи должны быть осторожными в назначении антипсихотиков людям, страдающим депрессией, поскольку потенциальные риски для здоровья значительны, а польза довольно скромна», — считают ученые.
Хорошо известно, что большинству антидепрессантов требуется от четырех до шести недель, чтобы обрести полноценную эффективность. Однако, вопреки этикетке лекарств и руководствам по лечению, многие пациенты в Соединенных Штатах начать антипсихотическое лечение депрессии, не завершив предварительно лечение одним антидепрессантом.
Однако, вопреки этикетке лекарств и руководствам по лечению, многие пациенты в Соединенных Штатах начать антипсихотическое лечение депрессии, не завершив предварительно лечение одним антидепрессантом.
Полученные результаты подчеркивают важность рассмотрения новых антипсихотических средств только после того, как будет достоверно установлено отсутствие реакции на менее опасные варианты лечения.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0239206
поле обязательно для заполнения
поле обязательно для заполнения
поле обязательно для заполнения
СпециализацияАкушер-гинекологАллергологГастроэнтерологГематологГепатологДермато-венерологКардиологНеврологНейрохирургИнфекционистОнкологОтоларингологОфтальмологПедиатрПсихиатрПульмонологПроктологРевматологРентгенолог и радиологТерапевт и врач общей практикиУрологФтизиатрХирургЭндокринологДругое
поле обязательно для заполнения
Нажимая на кнопку Подписаться, вы даете согласие на обработку персональных данных
Использование атипичных нейролептиков у пожилых людей: клинический обзор
1. Aarsland D, Larsen JP, Lim NG, Tandberg E. Оланзапин при психозах у пациентов с болезнью Паркинсона с деменцией и без нее. J Нейропсихиатрия Clin Neurosci. 1999;11(3):392–394. [PubMed] [Google Scholar]
Aarsland D, Larsen JP, Lim NG, Tandberg E. Оланзапин при психозах у пациентов с болезнью Паркинсона с деменцией и без нее. J Нейропсихиатрия Clin Neurosci. 1999;11(3):392–394. [PubMed] [Google Scholar]
2. Alexopoulos GS, Streim J, Carpenter D, Docherty JP. Использование нейролептиков у пожилых пациентов. Дж. Клин Психиатрия. 2004; 65 (Приложение 2): 5–99. [PubMed] [Google Scholar]
3. Ashcroft DM, Frischer M, Lockett J, Chapman SR. Варианты назначения атипичных антипсихотических препаратов в первичной медико-санитарной помощи: перекрестное исследование. Фармакоэпидемиол Препарат Саф. 2002;11(4):285–289.. [PubMed] [Google Scholar]
4. Barak Y, Shamir E, Weizman R. Будет ли полезен переход с типичных нейролептиков на рисперидон для пожилых пациентов с шизофренией? Натуралистическое, долгосрочное, ретроспективное, сравнительное исследование. J Clin Psychopharmacol. 2002;22(2):115–120. [PubMed] [Google Scholar]
5. Meltzer HY. Роль серотонина в действии антипсихотических препаратов. Нейропсихофармакология. 1999; 21 (Приложение 2): 106S–115S. [PubMed] [Google Scholar]
Нейропсихофармакология. 1999; 21 (Приложение 2): 106S–115S. [PubMed] [Google Scholar]
6. Shin JY, Choi NK, Jung SY, Lee J, Kwon JS, Park BJ. Риск ишемического инсульта при применении рисперидона, кветиапина и оланзапина у пожилых пациентов: популяционное перекрестное исследование. Дж Психофармакол. 2013;27(7):638–644. [PubMed] [Академия Google]
7. Ray WA, Chung CP, Murray KT, Hall K, Stein CM. Атипичные нейролептики и риск внезапной сердечной смерти. N Engl J Med. 2009;360(3):225–235. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Wetzel H, Wiesner J, Hiemke C, Benkert O. Острый антагонизм дофаминовых D 2 -подобных рецепторов амисульпридом: влияние на секрецию гормонов у здоровых добровольцев. J Psychiatr Res. 1994;28(5):461–473. [PubMed] [Google Scholar]
9. Xiberas X, Martinot JL, Mallet L, et al. In vivo экстрастриарная и полосатая D 2 Блокада дофаминовых рецепторов амисульпридом при шизофрении. J Clin Psychopharmacol. 2001;21(2):207–214. [PubMed] [Google Scholar]
2001;21(2):207–214. [PubMed] [Google Scholar]
10. Гарери П., Де Фацио П., Стило М., Феррери Г., Де Сарро Г. Обычные и атипичные нейролептики у пожилых людей: обзор. Клин по расследованию наркотиков. 2003;23(5):287–322. [PubMed] [Google Scholar]
11. Schoemaker H, Claustre Y, Fage D, et al. Нейрохимические характеристики амисульприда, атипичного допамина D 2 /D 3 9Антагонист рецептора 0018 с пресинаптической и лимбической селективностью. J Pharmacol Exp Ther. 1997; 280(1):83–97. [PubMed] [Google Scholar]
12. Abbas AI, Hedlund PB, Huang XP, Tran TB, Meltzer HY, Roth BL. Амисульприд является мощным антагонистом 5-HT 7 : значение для антидепрессивного действия in vivo. Психофармакология (Берл) 2009;205(1):119–128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Симэн П. Атипичные нейролептики: механизм действия. Can J Психиатрия. 2002;47(1):27–38. [PubMed] [Академия Google]
14. Шталь С.М. Антипсихотическая полипрагмазия, часть 1: терапевтический вариант или маленький грязный секрет? Дж.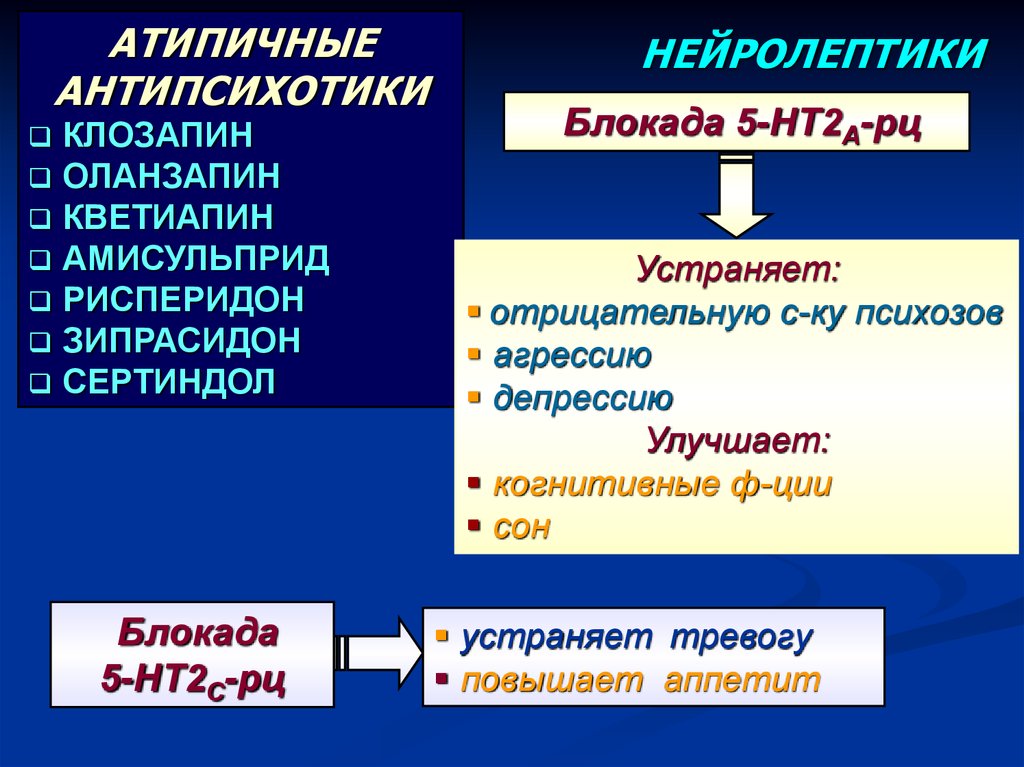 Клин Психиатрия. 1999;60(7):425–426. [PubMed] [Google Scholar]
Клин Психиатрия. 1999;60(7):425–426. [PubMed] [Google Scholar]
15. Гарери П., Де Фацио П., Руссо Э., Марильяно Н., Де Фацио С., Де Сарро Г. Безопасность клозапина у пожилых людей. Экспертное заключение Drug Safe. 2008;7(5):525–538. [PubMed] [Google Scholar]
16. Хан А.Дж., Прескорн С.Х. Изучение токсичности клозапина, зависящей от концентрации: роль терапевтического лекарственного мониторинга. J Psychiatr Pract. 2005;11(5):289–301. [PubMed] [Google Scholar]
17. Deberdt W, Dysken MW, Rappaport SA, et al. Сравнение оланзапина и рисперидона при лечении психозов и связанных с ними поведенческих нарушений у пациентов с деменцией. Am J Гериатр Психиатрия. 2005;13(8):722–730. [PubMed] [Google Scholar]
18. Burke AD, Tariot PN. Атипичные нейролептики у пожилых людей: обзор терапевтических тенденций и клинических результатов. Эксперт Опин Фармаколог. 2009;10(15):2407–2414. [PubMed] [Академия Google]
19. Джесте Д.В., Блейзер Д., Кейси Д. и др. Белая книга ACNP: обновленная информация об использовании антипсихотических препаратов у пожилых людей с деменцией.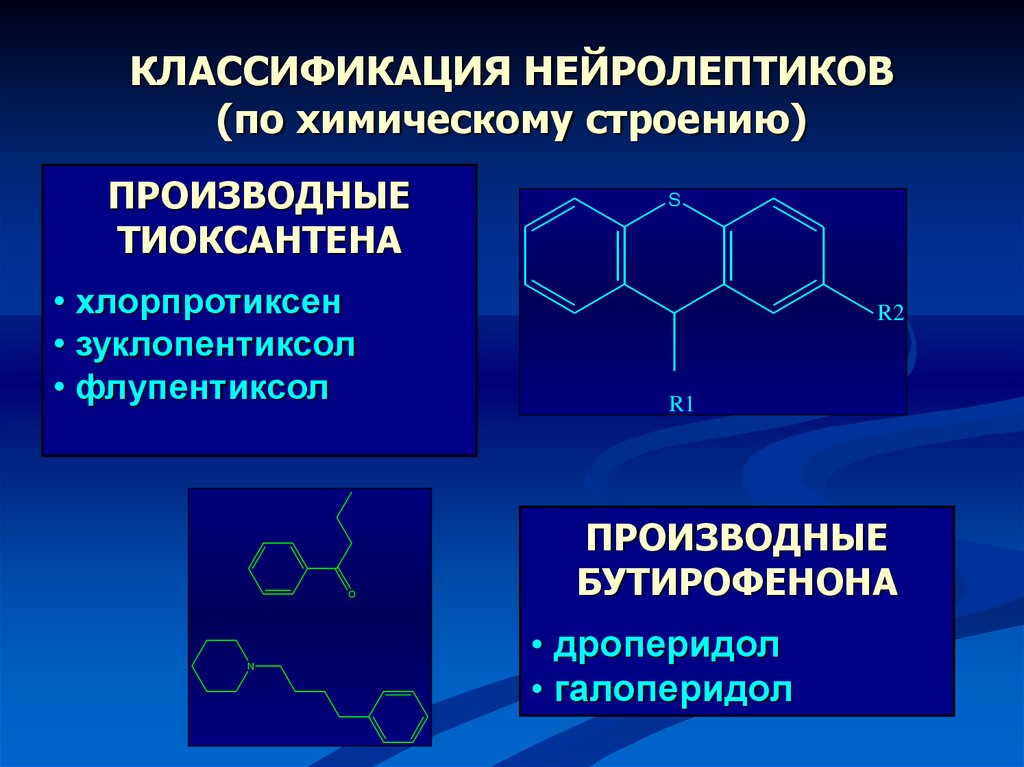 Нейропсихофармакология. 2008;33(5):957–970. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нейропсихофармакология. 2008;33(5):957–970. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Грин Б. Сосредоточьтесь на кветиапине. Curr Med Res Opin. 1999;15(3):145–151. [PubMed] [Google Scholar]
21. Kohen I, Lester PE, Lam S. Нейролептики для пожилых людей: эффективность и безопасность арипипразола. Нейропсихиатр Dis Treat. 2010;6:47–58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Марковиц Дж.С., Браун К.С., Мур Т.Р. Атипичные нейролептики. Часть I: фармакология, фармакокинетика и эффективность. Энн Фармакотер. 1999;33(1):73–85. [PubMed] [Google Scholar]
23. Брук С., Люси Дж. В., Ганн К.П. Внутримышечное введение зипразидона по сравнению с внутримышечным введением галоперидола при лечении острого психоза. Дж. Клин Психиатрия. 2000;61(12):933–941. [PubMed] [Google Scholar]
24. Kech PE, Jr, McElroy SL, Arnold LM. Зипрасидон: новый атипичный нейролептик. Эксперт Опин Фармаколог. 2001;2(6):1033–1042. [PubMed] [Академия Google]
25. Madhusoodanan S, Zaveri D. Использование палиперидона у пожилых людей. Curr Drug Saf. 2010;5(2):149–152. [PubMed] [Google Scholar]
Madhusoodanan S, Zaveri D. Использование палиперидона у пожилых людей. Curr Drug Saf. 2010;5(2):149–152. [PubMed] [Google Scholar]
26. Tauscher J, Kufferle B, Asenbaum S, Tauscher-Wisniewski S, Kasper S. Оккупация полосатого тела дофаминовых рецепторов-2, измеренная с помощью (123 I) йодобензамида, и ОФЭКТ предсказывали возникновение ЭПС у пациентов, получавших атипичные нейролептики и галоперидол. Психофармакология (Берл) 2002;162(1):42–49. [PubMed] [Google Scholar]
27. Шахид М., Уокер Г.Б., Зорн С.Х., Вонг Э.Х. Азенапин: новый психофармакологический агент с уникальной сигнатурой человеческого рецептора. Дж Психофармакол. 2009 г.;23(1):65–73. [PubMed] [Google Scholar]
28. Hermann RC, Yang D, Ettner SL, Marcus SC, Yoon C, Abraham M. Назначение антипсихотических препаратов врачами в США, 1989–1997 гг. Психиатр Серв. 2002;53(4):425–430. [PubMed] [Google Scholar]
29. Jeste DV, Eastham JH, Lohr JB. Лечение поведенческих расстройств и психозов. В: Salzman C, редактор. Клиническая гериатрическая психофармакология. Балтимор, Мэриленд: Уильямс и Уилкинс; 1998. С. 106–149. [Академия Google]
Клиническая гериатрическая психофармакология. Балтимор, Мэриленд: Уильямс и Уилкинс; 1998. С. 106–149. [Академия Google]
30. Trifiro G, Spina E, Brignoli O, Sessa E, Caputi AP, Mazzaglia G. Схема назначения антипсихотических препаратов итальянскими врачами общей практики: популяционное исследование в 1999–2002 гг. Eur J Clin Pharmacol. 2005;61(1):47–53. [PubMed] [Google Scholar]
31. Crismon L, Argo TR, Buckley PF. Шизофрения. В: DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey M, редакторы. Фармакотерапия: патофизиологический подход. 7-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill; 2008. С. 109.9–1123. [Google Scholar]
32. Сингх Д., О’Коннор Д.В. Эффективность и безопасность инъекций рисперидона пролонгированного действия у пожилых людей с шизофренией. Clin Interv Старение. 2009; 4: 351–355. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Davidson M, Harvey PD, Vervarcke J, et al. Долгосрочное многоцентровое открытое исследование рисперидона у пожилых пациентов с психозом. Int J Geriatr Psychiatry. 2000;15(6):506–514. [PubMed] [Google Scholar]
Int J Geriatr Psychiatry. 2000;15(6):506–514. [PubMed] [Google Scholar]
34. Vigen CL, Mack WJ, Keefe RS, et al. Когнитивные эффекты атипичных антипсихотических препаратов у пациентов с болезнью Альцгеймера: результаты исследования CATIE-AD. Am J Психиатрия. 2011;168(8):831–839. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Мадхусуданан С., Синха С., Бреннер Р., Гупта С., Богунович О. Использование оланзапина у пожилых пациентов с психотическими расстройствами: обзор. Энн Клин Психиатрия. 2001;13(4):201–213. [PubMed] [Google Scholar]
36. Соломос К., Гейгер О. Использование оланзапина у пожилых людей: ретроспективный анализ. Can J Психиатрия. 2000;45(2):151–155. [PubMed] [Google Scholar]
37. Madhusoodanan S, Brenner R, Alcantra A. Клинический опыт применения кветиапина у пожилых пациентов с психотическими расстройствами. J Geriatr Psychiatry Neurol. 2000;13(1):28–32. [PubMed] [Академия Google]
38. Кам К.Ю., Джалин А.М., Чой Ю.В. и соавт. Зипразидон ослабляет повреждение головного мозга после очаговой церебральной ишемии, вызванной окклюзией средней артерии у крыс. Прог Нейропсихофармакол Биол Психиатрия. 2012;39(1):69–74. [PubMed] [Google Scholar]
Зипразидон ослабляет повреждение головного мозга после очаговой церебральной ишемии, вызванной окклюзией средней артерии у крыс. Прог Нейропсихофармакол Биол Психиатрия. 2012;39(1):69–74. [PubMed] [Google Scholar]
39. Rado J, Janicak PG. Арипипразол при шизофрении позднего возраста. Clin Interv Старение. 2010;5:253–258. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Pigott TA, Carson WH, Sara AR, et al. Арипипразол для профилактики рецидивов у стабилизированных пациентов с хронической шизофренией: плацебо-контролируемое 26-недельное исследование. Дж. Клин Психиатрия. 2003;64(9): 1048–1056. [PubMed] [Google Scholar]
41. Madhusoodanan S, Brenner R, Gupta S, Reddy H, Bogunovic O. Клинический опыт лечения арипипразолом десяти пожилых пациентов с шизофренией или шизоаффективным расстройством: ретроспективные тематические исследования. Спектр ЦНС. 2004;9(11):862–867. [PubMed] [Google Scholar]
42. Цимос А., Самохвалов В., Крамер М. и соавт. Безопасность и переносимость пероральных таблеток пролонгированного действия палиперидона у пожилых пациентов с шизофренией: двойное слепое плацебо-контролируемое исследование с 6-месячным открытым продлением. Am J Гериатр Психиатрия. 2008;16(1):31–43. [PubMed] [Академия Google]
Am J Гериатр Психиатрия. 2008;16(1):31–43. [PubMed] [Академия Google]
43. Джесте Д.В., Блейзер Д., Кейси Д. и др. Белая книга ACNP: обновленная информация об использовании антипсихотических препаратов у пожилых людей с деменцией. Нейропсихофармакол. 2008;33(5):957–970. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Wolters EC, Berendse HW. Лечение психозов при болезни Паркинсона. Карр Опин Нейрол. 2001;14(4):499–504. [PubMed] [Google Scholar]
45. Tsan JY, Stock EM, Gonzalez JM, et al. Смертность и согласованная с рекомендациями помощь пожилым пациентам с шизофренией: ретроспективное продольное исследование. БМС Мед. 2012;10:147. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Фельмет К., Зисук С., Касков Дж.В. Пожилые больные шизофренией и депрессией: диагностика и лечение. Clin Schizoph Relat Psychoses. 2011;4(4):239–250. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Jeste DV, Maglione JE. Лечение пожилых людей с шизофренией: проблемы и возможности. Шизофр Булл. 2013;39(5):966–968. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Шизофр Булл. 2013;39(5):966–968. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Kuehn BM. Сомнительное назначение антипсихотических препаратов остается распространенным явлением, несмотря на серьезные риски. ДЖАМА. 2010;303(16):1582–1584. [PubMed] [Академия Google]
49. Katz R, Jeste DV, Mintzer JE, Clyde C, Napolitano J, Brecher M. Сравнение рисперидона и плацебо при психозах и нарушениях поведения, связанных с деменцией: рандомизированное двойное слепое исследование. Дж. Клин Психиатрия. 1999;60(2):107–115. [PubMed] [Google Scholar]
50. Lavretsky H, Sultzer D. Структурированное исследование рисперидона для лечения ажитации при деменции. Am J Гериатр Психиатрия. 1998;6(2):127–135. [PubMed] [Google Scholar]
51. Gareri P, Marigliano NM, De Fazio S, et al. Нейролептики и деменция. БМС Гериатр. 2010;10(Приложение 1):A93. [Google Scholar]
52. Dorey JM, Beauchet O, Thomas Antérion C, et al. Поведенческие и психологические симптомы деменции и расстройств биполярного спектра: обзор доказательств связи и последствий лечения. Спектр ЦНС. 2008;13(9):796–803. [PubMed] [Google Scholar]
Спектр ЦНС. 2008;13(9):796–803. [PubMed] [Google Scholar]
53. Maher AR, Theodore G. Резюме сравнительного обзора эффективности использования атипичных нейролептиков не по прямому назначению. J Manag Care Фарм. 2012;18(5 Дополнение B):S1–S20. [PubMed] [Академия Google]
54. Ballard CG, Gauthier S, Cummings JL, et al. Лечение возбуждения и агрессии, связанных с болезнью Альцгеймера. Нат Рев Нейрол. 2009;5(5):245–255. [PubMed] [Google Scholar]
55. Pelland C, Trudel JF. Эффективность и безопасность атипичных нейролептиков при лечении делирия: систематический обзор и критический анализ. Psychol Neuropsychiatr Vieil. 2009;7(2):109–119. Французский. [PubMed] [Google Scholar]
56. Meyers BS, Flint AJ, Rothschild AH, et al. Двойное слепое рандомизированное контролируемое исследование оланзапина плюс сертралин по сравнению с оланзапином плюс плацебо при психотической депрессии: исследование фармакотерапии психотической депрессии (STOP-PD) Arch Gen Psychiatry. 2009 г. ;66(8):838–847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
;66(8):838–847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Alexopoulos GS. Фармакотерапия депрессии позднего возраста. Дж. Клин Психиатрия. 2011;72(1):e04. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Berman RM, Fava M, Thase ME, et al. Аугментация арипипразолом при большом депрессивном расстройстве: двойное слепое плацебо-контролируемое исследование у пациентов с неадекватным ответом на антидепрессанты. Спектр ЦНС. 2009;14(4):197–206. [PubMed] [Google Scholar]
59. Sajatovic M, Coconcea N, Ignacio RV, et al. Терапия арипипразолом у 20 пожилых людей с биполярным расстройством: 12-недельное открытое исследование. Дж. Клин Психиатрия. 2008;69(1): 41–46. [PubMed] [Google Scholar]
60. Саятович М., Калабрезе Дж. Р., Маллен Дж. Кветиапин для лечения биполярной мании у пожилых людей. Биполярное расстройство. 2008;10(6):662–671. [PubMed] [Google Scholar]
61. Васудев А., Томас А. «Биполярное расстройство» у пожилых людей: что в названии? Зрелые. 2010;66(3):231–235. [PubMed] [Google Scholar]
2010;66(3):231–235. [PubMed] [Google Scholar]
62. Азиз Р., Лорберг Б., Тампи Р.Р. Лечение биполярного расстройства позднего возраста. Am J Geriatr Pharmacother. 2006;4(4):347–364. [PubMed] [Академия Google]
63. Новичок Дж. Антипсихотические и метаболические эффекты второго поколения (атипичные): всесторонний обзор литературы. Препараты ЦНС. 2005; 19 (Приложение 1): 1–93. [PubMed] [Google Scholar]
64. Pariente A, Fourrier-Reglat A, Ducruet T, et al. Применение нейролептиков и инфаркт миокарда у пожилых пациентов с леченной деменцией. Arch Intern Med. 2012;172(8):648–653. [PubMed] [Google Scholar]
65. Gill SS, Rochon PA, Herrmann N, et al. Типичные нейролептики и риск ишемического инсульта: популяционное ретроспективное когортное исследование. БМЖ. 2005; 330:445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Гражданская комиссия по правам человека. Предупреждение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в отношении антипсихотических препаратов. Калифорния: Гражданская комиссия по правам человека; 2005. [По состоянию на 05 августа 2014 г.]. Доступно по адресу: http://www.chrint.org/pdfs/US_Food_and_Drug_Administration_Warnings_on_Antipsychotic_Drugs.pdf. [Google Scholar]
Калифорния: Гражданская комиссия по правам человека; 2005. [По состоянию на 05 августа 2014 г.]. Доступно по адресу: http://www.chrint.org/pdfs/US_Food_and_Drug_Administration_Warnings_on_Antipsychotic_Drugs.pdf. [Google Scholar]
67. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) запрашивает предупредительные таблички в выпусках новостей о старых классах антипсихотических препаратов. Силвер-Спринг, Мэриленд: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; 2008. [По состоянию на 31 июля 2014 г.]. [обновлено 16 июня 2008 г.; процитировано 24 июня 2008 г.] Доступно по адресу: www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/2008/ucm116912.хтм. [Google Scholar]
68. Liperoti R, Onder G, Landi F, et al. Смертность от всех причин, связанная с атипичными и традиционными нейролептиками, среди обитателей домов престарелых с деменцией: ретроспективное когортное исследование. Дж. Клин Психиатрия. 2009;70(10):1340–1347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Trifiro G, Gambassi G, Sen EF, et al. Ассоциация внебольничной пневмонии с применением антипсихотических препаратов у пожилых пациентов: вложенное исследование случай-контроль. Энн Интерн Мед. 2010;152(7):418–425. [PubMed] [Академия Google]
70. Липероти Р., Педоне С., Лапане К.Л., Мор В., Бернабей Р., Гамбасси Г. Венозная тромбоэмболия у пожилых пациентов, получавших атипичные и обычные нейролептики. Arch Intern Med. 2005;165(22):2677–2682. [PubMed] [Google Scholar]
71. Kleijer BC, Heerdink ER, Egberts TC, Jansen PA, van Marum RJ. Использование антипсихотических препаратов и риск венозной тромбоэмболии у пожилых пациентов. J Clin Psychopharmacol. 2010;30(5):526–530. [PubMed] [Google Scholar]
72. Zareba W, Lin DA. Нейролептики и удлинение интервала QT. Психиатр К. 2003;74(3):291–306. [PubMed] [Google Scholar]
73. Глассман А.Х., Биггер Дж.Т., мл. Нейролептики: удлинение интервала QTc, пируэтная тахикардия и внезапная смерть. Am J Психиатрия. 2001;158(11):1774–1782. [PubMed] [Google Scholar]
Am J Психиатрия. 2001;158(11):1774–1782. [PubMed] [Google Scholar]
74. Чанг А.К., Чуа С.Е. Влияние семи нейролептиков второго поколения на удлинение скорректированного по Базетту интервала QT при лечении шизофрении: метаанализ. Дж Психофармакол. 2011;25(5):646–666. [PubMed] [Google Scholar]
75. Гарери П., Де Фацио П., Манфреди В.Г., Де Сарро Г. Использование и безопасность нейролептиков при поведенческих расстройствах у пожилых людей с деменцией. J Clin Psychopharmacol. 2014;34(1):109–123. [PubMed] [Google Scholar]
76. Реттенбахер М.А., Хофер А., Кеммлер Г., Флейшхакер В.В. Нейтропения, вызванная антипсихотиками второго поколения: проспективное исследование. Фармакопсихиатрия. 2010;43(2):41–44. [PubMed] [Google Scholar]
77. Li X, Cameron MD. Возможная роль метаболита кветиапина в вызванной кветиапином нейтропении и агранулоцитозе. Хим. Рез. Токсикол. 2012;25(5):1004–1011. [PubMed] [Google Scholar]
78. Барух Ю., Таджер С., Плопски И., Барак Ю. Азенапин для пожилых пациентов с биполярным маниакальным психозом. J Аффективное расстройство. 2013;145(1):130–132. [PubMed] [Академия Google]
Азенапин для пожилых пациентов с биполярным маниакальным психозом. J Аффективное расстройство. 2013;145(1):130–132. [PubMed] [Академия Google]
79. Коррелл CU. От фармакологии рецепторов к улучшению исходов: индивидуализация подбора, дозирования и замены нейролептиков. Европейская психиатрия. 2010; 25 (Приложение 2): S12–S21. [PubMed] [Google Scholar]
80. Ondo WG, Tintner R, Voung KD, Lai D, Ringholz G. Двойное слепое, плацебо-контролируемое, параллельное исследование с принудительным титрованием кветиапина при дофаминергических галлюцинациях при болезни Паркинсона. Мов Беспорядок. 2005;20(8):958–963. [PubMed] [Google Scholar]
81. Pepersack T, Gilles C, Petrovic M, et al. Распространенность ортостатической гипотензии и связь с употреблением наркотиков среди пожилых пациентов. Акта Клин Белг. 2013;68(2):107–112. [PubMed] [Академия Google]
82. Шульман М., Дженнифер Ньоку И., Ману П. Тромботические осложнения лечения нейролептиками. Минерва Мед. 2013;104(2):175–184.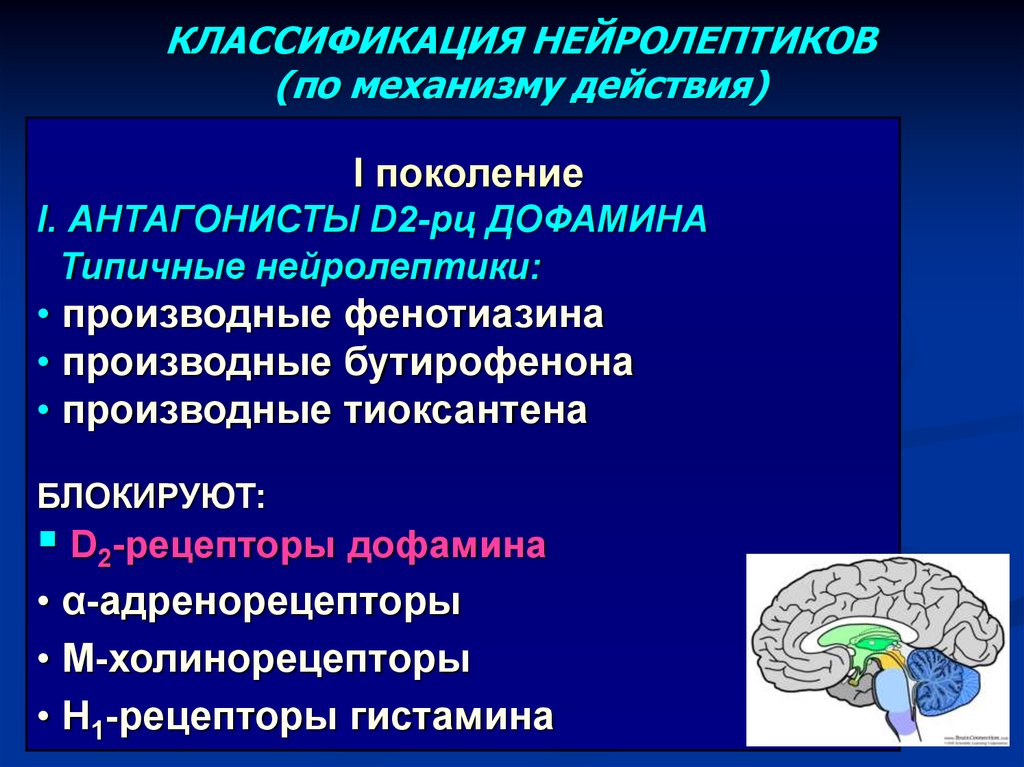 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
Нейролептики для пожилых людей
US Pharm, 2008;33(11):20-22.
Возбуждение и психоз часто встречаются у взрослых с деменцией и связаны с серьезными клиническими последствиями (например, более быстрым снижением когнитивных функций). 1 Несмотря на то, что атипичные нейролептики широко применялись у пожилых людей с деменцией, хотя в основном это было основано на данных более молодых исследований, было доказано, что они вызывают метаболические побочные эффекты, включая увеличение веса, сахарный диабет 2 типа и дислипидемию. . 1,2
Повышенный риск смерти, связанный с атипичными нейролептиками у пожилых пациентов с психозом, связанным с деменцией, также относится к обычным нейролептикам ( ТАБЛИЦА 1 ). Такой вывод подытожен в предупреждении FDA от 16 июня 2008 г., уведомляющем медицинских работников о текущем анализе данных, касающихся этих препаратов. 3 FDA требует от производителей обычных антипсихотических средств добавить В штучной упаковке Предупреждение и Предупреждение к информации о назначении лекарственных средств, касающейся риска смертности у пожилых пациентов, получающих лечение от психоза, связанного с деменцией; эта информация аналогична предупреждениям в штучной упаковке и предупреждениям , добавленным к информации о назначении атипичных нейролептиков в 2005 году.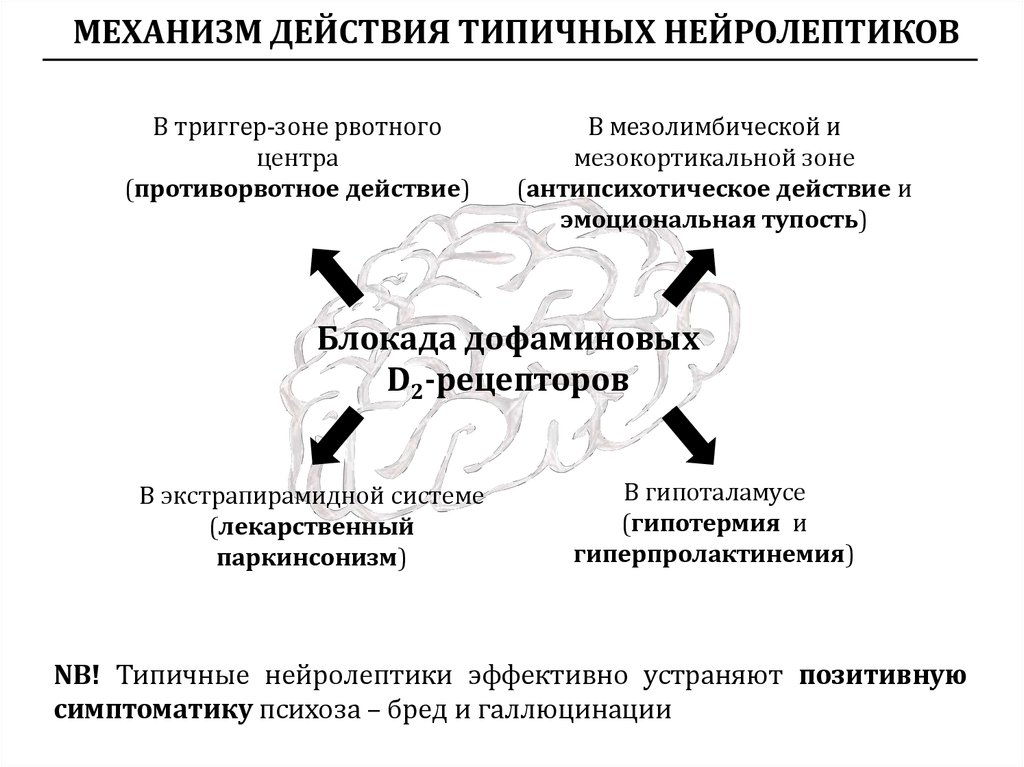 3 Закон о поправках к FDA от 2007 г. 3
3 Закон о поправках к FDA от 2007 г. 3
Недавно были опубликованы результаты двух обсервационных эпидемиологических исследований в Канаде, в которых обсуждался риск смерти у пациентов, получавших традиционные нейролептики. 4,5 Одно исследование показало, что атипичные нейролептики связаны с повышенной смертностью по сравнению с отсутствием применения нейролептиков; традиционное применение нейролептиков продемонстрировало незначительно более высокий риск смерти по сравнению с атипичным применением нейролептиков. В этом конкретном исследовании не сообщалось о причинах смерти. 4 Другое исследование показало, что риск смерти в группе пациентов, получающих обычные нейролептики, сравним или, возможно, превышает риск смерти в группе пациентов, получающих атипичные нейролептики. 5 В этом исследовании причинами смерти с наивысшим относительным риском были болезни сердца и рак. 5
Механизм увеличения смертности, связанной с этими нейролептиками, до конца не ясен, и в методологии каждого исследования были ограничения. 3,6 Однако, учитывая эти данные и другие существующие доказательства, FDA определило, что совокупность доказательств показывает, что традиционные антипсихотики разделяют повышенный риск смерти у гериатрических пациентов с психозом, связанным с деменцией, который наблюдался при атипичных психозах. нейролептики. 3,6 Кроме того, важно, чтобы фармацевты и другие медицинские работники знали о том, что нейролептики, обычные или атипичные, не показаны для лечения психоза, связанного с деменцией. 3 Это не означает, что их нельзя использовать у людей с этим заболеванием; однако это означает, что следует проявлять крайнюю осторожность, когда эти агенты назначаются уязвимым лицам. 6 Оценка риска и пользы антипсихотической лекарственной терапии всегда должна рассматриваться как часть процесса принятия решения. Резюме обновленных вопросов, касающихся использования антипсихотических препаратов у пожилых людей, представлено в ТАБЛИЦА 2.
3,6 Однако, учитывая эти данные и другие существующие доказательства, FDA определило, что совокупность доказательств показывает, что традиционные антипсихотики разделяют повышенный риск смерти у гериатрических пациентов с психозом, связанным с деменцией, который наблюдался при атипичных психозах. нейролептики. 3,6 Кроме того, важно, чтобы фармацевты и другие медицинские работники знали о том, что нейролептики, обычные или атипичные, не показаны для лечения психоза, связанного с деменцией. 3 Это не означает, что их нельзя использовать у людей с этим заболеванием; однако это означает, что следует проявлять крайнюю осторожность, когда эти агенты назначаются уязвимым лицам. 6 Оценка риска и пользы антипсихотической лекарственной терапии всегда должна рассматриваться как часть процесса принятия решения. Резюме обновленных вопросов, касающихся использования антипсихотических препаратов у пожилых людей, представлено в ТАБЛИЦА 2.
Распространенность деменции и связанного с ней возбуждения и психоза
Деменция определяется как глобальное нарушение когнитивных функций, которое возникает при ясной сенсорике (по сравнению со ступором, предполагающим делирий) и является необратимым ; это не болезнь, а скорее синдром. 7 Болезнь Альцгеймера является наиболее распространенным типом деменции. 1 Несмотря на то, что распространенность деменции среди взрослого населения США старше 65 лет колеблется от 5% до 15%, ее влияние будет все более важным во всем мире, поскольку ожидается, что к 2020 году число пациентов с деменцией достигнет 48 миллионов во всем мире. 1,8-11 Чтобы понять значение этой растущей проблемы, фармацевты должны отметить, что до 60% пациентов с деменцией, проживающих в сообществе, имеют поведенческие и психические симптомы, по сравнению с более чем 80% пациентов, проживающих в домах престарелых. 1,12,13
7 Болезнь Альцгеймера является наиболее распространенным типом деменции. 1 Несмотря на то, что распространенность деменции среди взрослого населения США старше 65 лет колеблется от 5% до 15%, ее влияние будет все более важным во всем мире, поскольку ожидается, что к 2020 году число пациентов с деменцией достигнет 48 миллионов во всем мире. 1,8-11 Чтобы понять значение этой растущей проблемы, фармацевты должны отметить, что до 60% пациентов с деменцией, проживающих в сообществе, имеют поведенческие и психические симптомы, по сравнению с более чем 80% пациентов, проживающих в домах престарелых. 1,12,13
Профилактика злоупотребления психотропными средствами у пожилых людей
Нейролептики были названы, вероятно, одной из категорий лекарств, которые чаще всего используются не по назначению в гериатрической популяции. 14 Данные показывают, что более 50% проживающих в домах престарелых получают как минимум одно психотропное лекарство (например, антидепрессант, антипсихотик, седативно-снотворное). 14 По данным Kane et al., предотвращение злоупотребления нейролептиками и другими психотропными средствами у пожилых людей может быть достигнуто путем рассмотрения следующих 14 :
14 По данным Kane et al., предотвращение злоупотребления нейролептиками и другими психотропными средствами у пожилых людей может быть достигнуто путем рассмотрения следующих 14 :
Уточнение симптомов: Этот процесс поможет определить, были ли и какие факторы вызвали ускорение симптомов.
Медицинское обследование: Это должно быть тщательно проведено, поскольку психологические симптомы у пожилых пациентов могут быть вызваны или усугублены медицинскими состояниями. Это защитит от предположения, что симптомы связаны с психическими состояниями, требующими начала терапии психотропными препаратами.
Усердие в выявлении основных причин ажитации и психоза, связанных с деменцией, позволяет клиницисту активно лечить причины с помощью наиболее подходящих фармакологических и немедикаментозных вмешательств. 6
Точный психиатрический диагноз: Этот номер обеспечивает соответствующую терапию психологических симптомов, которые могут проявляться неспецифически у пожилых людей. Консультации с психиатром или психологом со специальной подготовкой и опытом работы с гериатрическими пациентами особенно полезны, когда они доступны. Фармацевты с опытом работы с пожилыми людьми (например, фармацевты-консультанты) или со специальной сертификацией в области гериатрии (например, сертифицированный гериатрический фармацевт [CGP]) могут помочь в адаптации схемы лечения для целенаправленной терапии проблемы, минимизации побочных эффектов и избегать лекарственных взаимодействий. При необходимости, если существует серьезный и неизбежный риск причинения вреда себе или другим, вмешательство антипсихотических препаратов остается полезным, а иногда и необходимым вариантом. 6
Консультации с психиатром или психологом со специальной подготовкой и опытом работы с гериатрическими пациентами особенно полезны, когда они доступны. Фармацевты с опытом работы с пожилыми людьми (например, фармацевты-консультанты) или со специальной сертификацией в области гериатрии (например, сертифицированный гериатрический фармацевт [CGP]) могут помочь в адаптации схемы лечения для целенаправленной терапии проблемы, минимизации побочных эффектов и избегать лекарственных взаимодействий. При необходимости, если существует серьезный и неизбежный риск причинения вреда себе или другим, вмешательство антипсихотических препаратов остается полезным, а иногда и необходимым вариантом. 6
Немедикаментозные вмешательства: Модификация поведения, адаптация к окружающей среде (например, шум, температура, нарушение порядка), групповая терапия, поддерживающая психотерапия и развлекательные мероприятия (например, музыкальная терапия, садоводство), помимо других стратегий, могут быть помогает уменьшить или устранить потребность в фармакологическом вмешательстве.
Учет нюансов между отдельными лекарствами: В связи с наличием широких категорий агентов это необходимо для рационального назначения и адаптации психотропной лекарственной терапии к индивидуальному гериатрическому пациенту.
Начинать с малого, идти медленно и контролировать часто: У пожилых людей начальная доза должна основываться на гериатрических рекомендациях по дозированию с постепенным титрованием и тщательным частым мониторингом.
Текущая оценка для надлежащей корректировки терапии психотропными препаратами необходима: Требуется наблюдение для выявления реакции целевых симптомов на назначенную терапию. Кроме того, в попытке собрать исчерпывающие данные лечащий врач должен учитывать отчеты пациентов и лиц, осуществляющих уход, и объективные наблюдения подготовленных специалистов. Мониторинг распространенных и потенциально инвалидизирующих побочных эффектов психотропных препаратов ( ТАБЛИЦА 3 ) должны быть включены в текущий процесс оценки.
О любых непредвиденных нежелательных явлениях, связанных с антипсихотиками, следует сообщать в программу FDA MedWatch (www.fda.gov/medwatch/report/hcp.htm). 3 Кроме того, фармацевты должны рекомендовать вышеупомянутые соображения и взвесить риски и преимущества антипсихотической лекарственной терапии при лечении поведенческих симптомов, связанных с деменцией.
Заключение
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов определило новые данные, подтверждающие, что обычных нейролептиков имеют общий повышенный риск смерти у пожилых пациентов с психозом, связанным с деменцией, который был задокументирован при применении атипичных нейролептиков . В настоящее время антипсихотические препараты, обычные или атипичные, не показаны для лечения психоза, связанного с деменцией. Хотя антипсихотические препараты могут быть необходимым вариантом при определенных обстоятельствах, рекомендуется проявлять максимальную осторожность при назначении этих препаратов уязвимым лицам. Для оптимального ухода за пожилыми людьми с поведенческими симптомами, связанными с деменцией, рекомендуется комплексный многогранный подход, в то время как поиск более безопасных и эффективных лекарств продолжается.
Для оптимального ухода за пожилыми людьми с поведенческими симптомами, связанными с деменцией, рекомендуется комплексный многогранный подход, в то время как поиск более безопасных и эффективных лекарств продолжается.
ССЫЛКИ
1. Белая книга ACNP : обновленная информация об использовании антипсихотических препаратов у пожилых людей с деменцией. Нейропсихофармакология. 2007:1-14. www.acnp.org/asset.axd?id=40ed5fbf-b74e-444e-a926-49b4c5bc7069. По состоянию на 8 октября 2008 г.
2. Джин Х., Мейер Дж. М., Джесте Д. В. Атипичные нейролептики и нарушение регуляции уровня глюкозы: систематический обзор. Шизоф Рес . 2004;71:195-212.
3. Брошюра FDA Information for Healthcare Professionals. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Центр оценки и исследований лекарств. www.fda.gov/cder/drug/InfoSheets/HCP/antipsychotics_conventional.htm.
По состоянию на 8 октября 2008 г.
4. Гилл С.С., Бронскилл С.Е., Норманд С.Л. Использование антипсихотических препаратов и смертность у пожилых людей с деменцией. Энн Интерн Мед . 2007; 146:775-786.
5. Schneeweiss S, Setoguchi S, Brookhart A. Риск смерти, связанный с использованием обычных и атипичных антипсихотических препаратов среди пожилых пациентов. CMAJ . 2007;176:627-632.
6. Пицци Д.М. Предупреждение о черном ящике добавлено к старым нейролептикам. Новости аптечной практики. август 2008 г.: 4–5.
7. Бласс Дж.П. Деменции, включая болезнь Альцгеймера. В: Hazzard WR, Blass JP, Halter JB, et al. Основы гериатрической медицины и геронтологии . 5-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill, Inc.; 2003:1391-1400.
8. Каплан Х.И., Садок Б.Дж. Краткий обзор психиатрии . Балтимор, Мэриленд: Williams & Wilkins; 1998.
9. Evans DA, Funkenstein H, Albert MS, et al. Распространенность болезни Альцгеймера среди пожилых людей: выше, чем сообщалось ранее. J Am Med Assoc . 1989; 262:2551-2556.
Распространенность болезни Альцгеймера среди пожилых людей: выше, чем сообщалось ранее. J Am Med Assoc . 1989; 262:2551-2556.
10. Лосонци К.Г., Уайт Л.Р., Брок Д.Б. Распространенность и корреляты деменции: обзор последних дней жизни. Представитель общественного здравоохранения . 1998;113:273-280.
11. Ferri CP, Prince M, Brayne C, et al. Глобальная распространенность деменции: консенсусное исследование Delphi. Ланцет . 2005;366:2112-2117.
12. Рэгг Р.Э., Джесте Д.В. Нейролептики и альтернативные методы лечения: лечение поведенческих симптомов и психозов при болезни Альцгеймера и связанных с ней состояниях. Психиатрическая клиника North Am . 1988; 11:195-214.
13. Lyketsos CG, Steinberg M, Tschanz JT, et al. Психические и поведенческие нарушения при деменции: результаты исследования памяти при старении, проведенного в округе Кэш. Am J Психиатрия . 2000;157:708-714.
