Мейо шкала: Шкала комы Мэйо » Медвестник
Второе клиническое исследование 3-й фазы демонстрирует улучшение показателей клинической, эндоскопической и гистологической оценки у пациентов с язвенным колитом на фоне индукционной терапии препаратом РАНВЭК (упадацитиниб)
Главная > Новости отрасли > Второе клиническое исследование 3-й фазы демонстрирует улучшение показателей клинической, эндоскопической и гистологической оценки у пациентов с язвенным колитом на фоне индукционной терапии препаратом РАНВЭК (упадацитиниб)
Второе клиническое исследование 3-й фазы демонстрирует улучшение показателей клинической, эндоскопической и гистологической оценки у пациентов с язвенным колитом на фоне индукционной терапии препаратом РАНВЭК (упадацитиниб)
Москва, Россия, 16 марта 2021 года – Глобальная научно-исследовательская биофармацевтическая компания AbbVie объявила о положительных результатах исследования U-ACCOMPLISH фазы 3, в котором упадацитиниб (45 мг/сут) достиг первичной конечной точки клинической ремиссии (согласно адаптированной шкале Мейо), а также вторичных конечных точек1.
«Мы стремимся улучшить результаты терапии пациентов с язвенным колитом, – сказал Том Хадсон, старший вице-президент по исследованиям и разработкам AbbVie. – Полученные положительные результаты сопоставимы с результатами первого исследования и подчеркивают потенциал упадацитиниба в облегчении симптомов у пациентов, нуждающихся в достижении контроля над заболеванием».
В исследовании U-ACCOMPLISH достигнуты все вторичные конечные точки, включая результаты клинической, эндоскопической и гистологической оценки1. У большего числа пациентов, получавших упадацитиниб, клинический ответ (по адаптированной шкале Мейо) наблюдался на 8 неделе в сравнении с пациентами, получавшими плацебо (74% по сравнению с 25%, p<0,001)1. «Люди, живущие с язвенным колитом среднетяжелой и тяжелой степени, продолжают страдать от бремени заболевания, – сказал Сильвио Данесе, M.D., ведущий исследователь и руководитель Центра воспалительных заболеваний кишечника в Исследовательской клинике Humanitas, Милан, Италия. – Я обрадован положительными результатами двух исследований применения упадацитиниба при язвенном колите. Они подтверждают, что упадацитиниб может стать потенциально новым вариантом лечения для пациентов, страдающих этим заболеванием».
Профиль безопасности упадацитиниба (45 мг) соответствовал результатам, полученным в предшествующем исследовании фазы 3, при этом новых рисков безопасности выявлено не было Полные результаты исследования U-ACCOMPLISH будут представлены на предстоящих специализированных конференциях и опубликованы в рецензируемом журнале. Основные результаты исследования U-ACHIEVE были объявлены в феврале 2021 года и на данный момент оба исследования продолжаются. Использование упадацитиниба при язвенном колите не зарегистрировано на данный момент, его безопасность и эффективность не оценивались регуляторными ведомствами.
Язвенный колит – хроническое системное воспалительное заболевание, сопровождающееся воспалением слизистой оболочки толстой кишки, проявляющееся болью в животе, поносом с кровью, болезненными позывами к дефекации, потерей веса и утомляемостью15-17. Тяжесть симптомов и неконтролируемые обострения заболевания у пациентов с язвенным колитом часто приводят к инвалидности 18.
Об исследовании U—ACCOMPLISH1,9 U-ACCOMPLISH– многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3 для оценки эффективности и безопасности упадацитиниба (45 мг/сут) для индукционной терапии у пациентов с язвенным колитом в сравнении с плацебо. U-ACCOMPLISH – второе исследование фазы 3. Первичной конечной точкой исследования стало достижение клинической ремиссии (по адаптированной шкале Мейо) на 8 неделе.
О программе исследований применения упадацитиниба при язвенном колите9,19,20 В глобальной программе, состоящей из трех основных исследований, применения упадацитиниба при язвенном колите фазы 3 принимает участие более 1 300 пациентов с язвенным колитом среднетяжёлой и тяжелой степени. Данные исследования включают в себя оценку эффективности, безопасности и переносимости препарата. Ключевые показатели эффективности включают клиническую ремиссию согласно адаптированной шкале Мейо, клинический ответ по адаптированной шкале Мейо, эндоскопическое улучшение и эндоскопический ответ.
О препарате РАНВЭК (упадацитиниб) Разработанный компанией AbbVie, препарат РАНВЭК – это селективный обратимый ингибитор Янус киназ, применение которого исследуется для лечения (перорально, один раз в сутки) ряда иммуноопосредованных воспалительных заболеваний1,7-14. На данный момент препарат РАНВЭК одобрен в России для лечения ревматоидного артрита, анкилозирующего спондилита и псориатического артрита. Утвержденная доза препарата РАНВЭК для лечения этих заболеваний составляет 15 мг один раз в сутки22. Продолжаются исследования фазы 3 по оценке эффективности и безопасности применения препарата РАНВЭК для лечения атопического дерматита, аксиального спондилоартрита, болезни Крона, язвенного колита, гигантоклеточного артериита и болезни Такаясу 8-14. Использование РАНВЭК при язвенном колите не одобрено, а его безопасность и эффективность не оценивались регуляторными агентствами.
О роли компании AbbVie в гастроэнтерологии Благодаря надежной программе клинических исследований, AbbVie стремится проводить передовые исследования, чтобы поддерживать важные достижения в области воспалительных заболеваний кишечника (ВЗК), таких как язвенный колит и болезнь Крона. Благодаря инновациям, обучению и адаптации AbbVie стремится избавиться от бремени ВЗК и оказывать значительное влияние на жизнь пациентов с этими заболеваниями. Для получения дополнительной информации о роли AbbVie в гастроэнтерологии воспользуйтесь ссылкой https://www.abbvie.com/our-science/therapeutic-focus-areas/immunology/immunology-focus-areas/gastroenterology.html
Об AbbVie Миссия компании AbbVie — разработка и вывод на рынок инновационной терапии для лечения некоторых из самых тяжелых заболеваний и решение медицинских проблем завтрашнего дня. Мы стремимся оказывать значительное влияние на жизнь людей в ключевых терапевтических областях: иммунология, онкология, неврология, офтальмология, вирусология, женское здоровье и гастроэнтерология, а также с помощью продуктов и услуг подразделения Allergan — эстетическая медицина.
Прогнозные заявления В этом анонсе содержатся или могут содержаться определенные прогнозные заявления для целей закона 1995 года «О реформе судебных разбирательств по частным ценным бумагам». Слова «верить», «ожидать», «предполагать», «планировать» и подобные выражения среди прочего обычно обозначают прогнозные заявления. Эти прогнозные заявления подвержены рискам и неопределенностям, которые могут привести к тому, что фактические результаты будут существенно отличаться от указанных в прогнозных заявлениях. Такие риски и неопределенности включают, но не ограничиваются, неспособность реализовать ожидаемые выгоды от приобретения AbbVie компании Allergan, неспособность быстро и эффективно интегрировать бизнес-процессы Allergan, справиться с конкуренцией со стороны других продуктов, с вопросами, касающимися интеллектуальной собственности, с трудностями в области исследований и разработок, неблагоприятными судебными разбирательствами или действиями с стороны правительства, изменениями в законодательстве и нормативных актах в отношении фармацевтической отрасли, а также влиянием вспышек заболеваний, эпидемий или пандемий в области общественного здравоохранения, таких как COVID-19. Дополнительная информация об экономических, правительственных, технологических и других факторах, которые могут повлиять на AbbVie, изложены в годовом отчете AbbVie по форме 10-K, изложенный в отчетах Комиссии по ценным бумагам и биржам США и обновленный последующими ежеквартальными отчетами по форме 10-Q. AbbVie не принимает на себя никаких обязательств по обновлению каких-либо прогнозных заявлений в результате последующих событий, за исключением случаев, предусмотренных законом. ### За дополнительной информацией, пожалуйста, обращайтесь: Елена Дианова Директор по связям с общественностью AbbVie в России и СНГ Тел.: +7 (919) 767-80-93 ______________________________________
| ||||||||||||||||||||||||||||||||||||
ISSN 2305-2066 (Print)
ISSN 2658-5049 (Online)
Характеристика методов консервативного лечения при повреждениях дистального отдела плечевой кости
Лечение повреждений дистального отдела плечевой кости (ДОПК), несмотря на успехи современной травматологии, остается сложной задачей вследствие высокого удельного веса осложнений, приводящих каждого пятого пациента к инвалидности [9, 10, 13]. В современной практике общепризнанными, широко применяемыми и интенсивно развивающимися являются методы оперативного лечения, в том числе и при переломах костей, образующих локтевой сустав (ЛС) [1–3, 5–14].
Целью работы стал анализ результатов консервативных методов лечения, применяющихся в клинической практике при повреждениях ДОПК.
Материал и методы
Работа основана на ретроспективном анализе проведенного консервативного лечения и его результатов 58 пациентов в возрасте от 22 до 93 лет (средний возраст 54 года), мужчин — 21 (36,2 %), женщин — 37 (63,8 %) (табл. 1). По типу повреждения, согласно классификации группы АО/ASIF [6], переломы распределились следующим образом: 13А2 — 7 пациентов; В1 — 2; В2 — 9; В3 — 2; С1 — 6; С2 — 20 и С3 — 12.
Переломы ДОПК в 54 (93,1 %) случаях имели бытовой характер и в 4 (6,9 %) — производственный. Левая верхняя конечность травмирована у 30 (51,7 %) пациентов и правая — у 28 (48,3 %). По механизму травмы переломы обусловлены прямым падением на ЛС в 84,5 % случаев (49 человек) и падением на кисть вытянутой конечности в 15,5 % случаев (9 человек). В 2 (3,4 %) случаях отмечен перелом ДОПК с задним и задненаружным вывихом предплечья, у 5 (8,6 %) пациентов перелом ДОПК сочетался с переломом лучевой кости в типичном месте, у одной пациентки — с чрезвертельным переломом бедренной кости.
Средняя длительность диспансерного наблюдения составила 57,1 мес. (от 7 мес. до 14 лет) с момента травмы. К концу срока диспансерного наблюдения умерло двое пациентов по причинам, не связанным с перенесенной травмой и проведенным лечением. Оценка результатов консервативного лечения проводилась по шкале клиники Мейо и специально разработанной анкете на основании рентгенологического и клинического исследования, объем активных движений в ЛС — по В.О. Марксу [4, 14].
Результаты и обсуждение
Для аналитического изучения результатов лечения все пациенты в зависимости от метода консервативного лечения были разделены на три группы.
Группа 1. Гипсовая повязка с целью иммобилизации применена у 42 пациентов, средний возраст — 54,8 года (от 21 до 93 лет), при переломах типа 13А2 — 6; В1 — 2; В2 — 6; В3 — 2; С1 — 3; С2 — 15; С3 — 8.
У пациентов данной группы перед наложением гипсовой повязки с целью иммобилизации под внутривенным наркозом или местной инфильтрационной анестезией выполнялась закрытая репозиция перелома ДОПК по стандартной методике.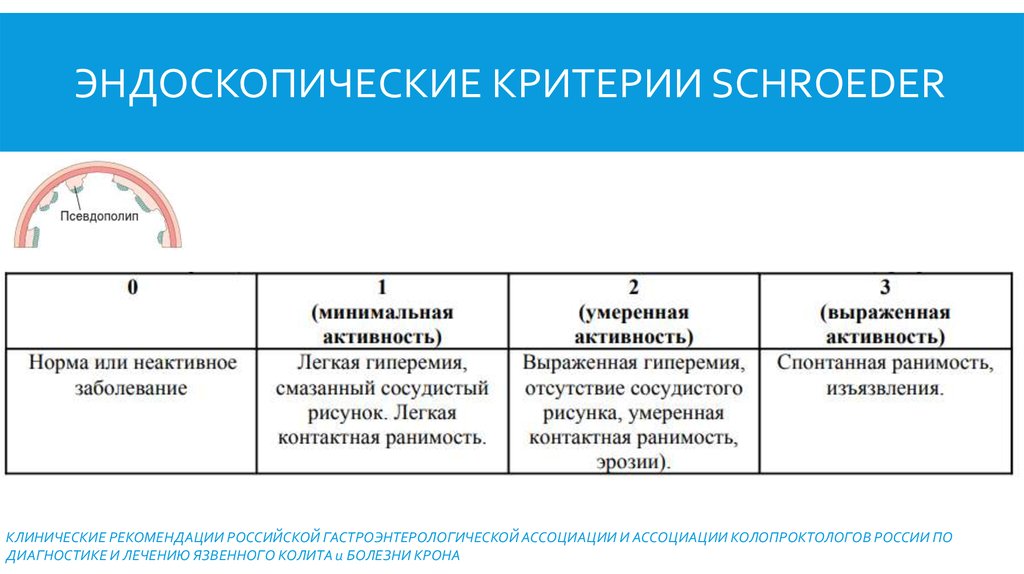 После манипуляций закрытой репозиции накладывалась гипсовая лонгета от верхней трети плеча до головок пястных костей по стандартной методике с целью фиксации двух смежных суставов, выполнялся рентгенологический контроль качества вправления фрагментов перелома. При удовлетворительном расположении фрагментов перелома гипсовая лонгета укреплялась марлевыми бинтами и верхняя конечность фиксировалась под углом 90° на косыночной повязке. В дальнейшем контролировались динамика отека мягких тканей и качество репозиции фрагментов перелома. Через 2 нед. после закрытой репозиции при отсутствии отека мягких тканей и вторичного смещения фрагментов перелома гипсовая лонгета укреплялась циркулярно гипсовыми бинтами и пациент выписывался на амбулаторное лечение.
После манипуляций закрытой репозиции накладывалась гипсовая лонгета от верхней трети плеча до головок пястных костей по стандартной методике с целью фиксации двух смежных суставов, выполнялся рентгенологический контроль качества вправления фрагментов перелома. При удовлетворительном расположении фрагментов перелома гипсовая лонгета укреплялась марлевыми бинтами и верхняя конечность фиксировалась под углом 90° на косыночной повязке. В дальнейшем контролировались динамика отека мягких тканей и качество репозиции фрагментов перелома. Через 2 нед. после закрытой репозиции при отсутствии отека мягких тканей и вторичного смещения фрагментов перелома гипсовая лонгета укреплялась циркулярно гипсовыми бинтами и пациент выписывался на амбулаторное лечение.
После снятия гипсовой иммобилизирующей повязки проводилось рентгенографическое исследование в стандартных проекциях и начинался комплекс мероприятий, направленных на разработку контрактуры ЛС. Средняя длительность гипсовой иммобилизации составила 8,4 нед. (от 2 до 12 нед.). Результаты лечения изучены у всех пациентов в среднем через 53,6 мес. (от 7 мес. до 12 лет) с момента травмы. Осложнения отражены в табл. 2. Одной пациентке при раннем выявлении вторичного смещения фрагментов перелома в гипсовой повязке наложена система скелетного вытяжения. 3 пациентам в различные сроки после консервативного лечения выполнен артролиз ЛС и корригирующая остеотомия ДОПК по поводу сросшегося перелома с неустраненным смещением. Средняя амплитуда активных движений в ЛС составила 54° (от 0 до 120°). Средний балл по шкале клиники Мейо — 59 (от 15 до 100 баллов).
(от 2 до 12 нед.). Результаты лечения изучены у всех пациентов в среднем через 53,6 мес. (от 7 мес. до 12 лет) с момента травмы. Осложнения отражены в табл. 2. Одной пациентке при раннем выявлении вторичного смещения фрагментов перелома в гипсовой повязке наложена система скелетного вытяжения. 3 пациентам в различные сроки после консервативного лечения выполнен артролиз ЛС и корригирующая остеотомия ДОПК по поводу сросшегося перелома с неустраненным смещением. Средняя амплитуда активных движений в ЛС составила 54° (от 0 до 120°). Средний балл по шкале клиники Мейо — 59 (от 15 до 100 баллов).
Группа 2. Скелетное вытяжение применено у 11 пациентов, средний возраст — 52,1 года (от 22 до 84 лет), при переломах типа 13А2 — 1; В2 — 1; С1 — 3; С2 — 3; С3 — 3.
В данной группе пациентов система скелетного вытяжения монтировалась под местной инфильтрационной анестезией по стандартной методике. На 2-е–3-и сут. после манипуляции выполнялся рентгенологический контроль и в зависимости от характера смещения проводилась коррекция системы скелетного вытяжения с повторным рентгенологическим контролем через 2–3 сут. Период пребывания на системе скелетного вытяжения составил у всех пациентов 4 нед., затем накладывалась циркулярная гипсовая повязка в положении сгибания в ЛС под углом 90° от верхней трети плеча до головок пястных костей по стандартной методике с целью фиксации двух смежных суставов, выполнялся рентгенологический контроль и пациент выписывался на амбулаторное лечение. Длительность гипсовой иммобилизации в зависимости от типа перелома составила в среднем 7,3 нед. (от 6 до 10 нед.). Результаты лечения изучены у всех пациентов в среднем через 65,6 мес. (от 18 мес. до 14 лет) с момента травмы. Осложнения показаны в табл. 3. Одному пациенту через 8 мес. после травмы выполнены корригирующая остеотомия ДОПК и металлоостеосинтез пластиной по поводу перелома, сросшегося с неустраненным смещением фрагментов.
Период пребывания на системе скелетного вытяжения составил у всех пациентов 4 нед., затем накладывалась циркулярная гипсовая повязка в положении сгибания в ЛС под углом 90° от верхней трети плеча до головок пястных костей по стандартной методике с целью фиксации двух смежных суставов, выполнялся рентгенологический контроль и пациент выписывался на амбулаторное лечение. Длительность гипсовой иммобилизации в зависимости от типа перелома составила в среднем 7,3 нед. (от 6 до 10 нед.). Результаты лечения изучены у всех пациентов в среднем через 65,6 мес. (от 18 мес. до 14 лет) с момента травмы. Осложнения показаны в табл. 3. Одному пациенту через 8 мес. после травмы выполнены корригирующая остеотомия ДОПК и металлоостеосинтез пластиной по поводу перелома, сросшегося с неустраненным смещением фрагментов.
Средняя амплитуда активных движений в ЛС составила 46,4° (от 0 до 80°). Средний балл по шкале клиники Мейо — 54 (от 15 до 75 баллов).
Группа 3. Чрескожная фиксация спицами применена у 5 пациентов, средний возраст — 45,6 года (от 22 до 74 лет), при переломах типа 13В2 — 2; С2 — 2; С3 — 1. У пациентов данной группы чрескожная фиксация спицами проводилась под внутривенным наркозом или инфильтрационной анестезией после закрытой репозиции фрагментов перелома. Для фиксации в зависимости от типа перелома использовались спицы Илизарова или Киршнера, которые проводились ретроградно через надмыщелки ПК в различных направлениях с целью оптимальной стабилизации фрагментов перелома. После выполнения рентгенологического контроля при удовлетворительном вправлении перелома накладывалась гипсовая лонгета от верхней трети плеча до головок пястных костей по стандартной методике с целью фиксации двух смежных суставов и верхняя конечность фиксировалась под углом 90° на косыночной повязке. В последующем контролировались динамика отека мягких тканей и качество репозиции фрагментов перелома. Через 2 нед. после закрытой репозиции при отсутствии отека мягких тканей и вторичного смещения фрагментов перелома гипсовая лонгета укреплялась циркулярно гипсовыми бинтами и пациент выписывался на амбулаторное лечение.
У пациентов данной группы чрескожная фиксация спицами проводилась под внутривенным наркозом или инфильтрационной анестезией после закрытой репозиции фрагментов перелома. Для фиксации в зависимости от типа перелома использовались спицы Илизарова или Киршнера, которые проводились ретроградно через надмыщелки ПК в различных направлениях с целью оптимальной стабилизации фрагментов перелома. После выполнения рентгенологического контроля при удовлетворительном вправлении перелома накладывалась гипсовая лонгета от верхней трети плеча до головок пястных костей по стандартной методике с целью фиксации двух смежных суставов и верхняя конечность фиксировалась под углом 90° на косыночной повязке. В последующем контролировались динамика отека мягких тканей и качество репозиции фрагментов перелома. Через 2 нед. после закрытой репозиции при отсутствии отека мягких тканей и вторичного смещения фрагментов перелома гипсовая лонгета укреплялась циркулярно гипсовыми бинтами и пациент выписывался на амбулаторное лечение.
Средняя длительность гипсовой иммобилизации составила 9,6 нед. (от 6 до 12 нед.). Результаты лечения изучены у всех пациентов в среднем через 58,6 мес. (от 3,5 до 7 лет) с момента травмы. Осложнения в виде сгибательно-разгибательной контрактуры отмечены у 4 пациентов; остеоартроза ЛС — 1. У 3 пациентов отмечалась боль средней интенсивности при движениях в ЛС. Средняя амплитуда активных движений в ЛС составила 78° (от 40 до 120°). Средний балл по шкале клиники Мейо — 66 (от 30 до 100 баллов).
Средняя длительность диспансерного наблюдения в данной группе составила 56,3 мес. (от 7 до 170 мес.). Изучение функциональных результатов лечения в этой группе пациентов показало, что средняя амплитуда активных движений в ЛС — была 54,7° (от 0 до 120°) и средний балл по шкале клиники Мейо составил 59 (от 15 до 100 баллов).
Таким образом, неблагоприятные результаты консервативного лечения связаны прежде всего с длительной иммобилизацией ЛС в среднем 8,3 нед. (от 2 до 12 нед.), что привело к формированию стойких артрогенных контрактур у 91,4 % пациентов. В связи с тем что 65,5 % пациентов имели полный внутрисуставный перелом и использованные методы стабилизации фрагментов перелома не были достаточно адекватны, сращение перелома с неустраненным смещением фрагментов отмечено в 25,9 % случаев, нарушение костной консолидации — в 3,4% случаев, что потребовало проведения ортопедических операций в 6,9 % случаев.
В связи с тем что 65,5 % пациентов имели полный внутрисуставный перелом и использованные методы стабилизации фрагментов перелома не были достаточно адекватны, сращение перелома с неустраненным смещением фрагментов отмечено в 25,9 % случаев, нарушение костной консолидации — в 3,4% случаев, что потребовало проведения ортопедических операций в 6,9 % случаев.
Совокупность ошибок консервативного лечения в отдаленном периоде обусловила развитие дегенеративно-дистрофических изменений в ЛС у 17,2 % и стойкого болевого синдрома у 56,9 % пациентов, что подтверждает неадекватность проведенного лечения.
Основной причиной длительной иммобилизации ЛС является стремление достичь сращения перелома. Опасения, что ранняя функция ЛС приведет к вторичному смещению фрагментов перелома, связаны с использованием неадекватного метода лечения и приводят к длительной иммобилизации с расчетом на то, что постиммобилизационною контрактуру можно будет разработать физиофункциональными методами. Однако если после травмы ЛС движения начаты в первые сутки, то в ближайшем месяце утрачивается не более 15 % объема движений от исходного, но если движения в ЛС начаты в сроки от 2 до 5 дней после травмы, то у 80–85 % пациентов теряется 30 % и более от исходного объема движений [15].
Таким образом, консервативному лечению должны подвергаться переломы, период иммобилизации которых будет минимальным и достаточным для консолидации. Однако время гистологической дифференцировки костной ткани из мезенхимальных клеток составляет 3–4 нед. Такой период иммобилизации достаточен для сращения перелома, при котором фрагменты соприкасаются друг с другом и смещены незначительно, происходит консолидация первичной костной мозолью. В то же время иммобилизация ЛС в течение 3–4 нед. представляет риск для формирования его контрактуры. Однако при сращении перелома первичной костной мозолью, когда не нарушена конгруэнтность суставной поверхности, нет выраженного повреждения мягких тканей и кровоизлияния в окружающие ЛС структуры, сформировавшуюся в процессе иммобилизации контрактуру можно разработать комплексом физиофункционального лечения. Иммобилизация ЛС на фоне диастаза между фрагментами перелома приводит к образованию вторичной костной мозоли, что обусловливает нарушение конгруэнтности суставной поверхности, деформацию оси ДОПК, образование параартикулярных оссификатов и спаек, нарушение мышечного баланса и в конечном итоге приводит к формированию контрактур и развитию дегенеративно-дистрофических изменений.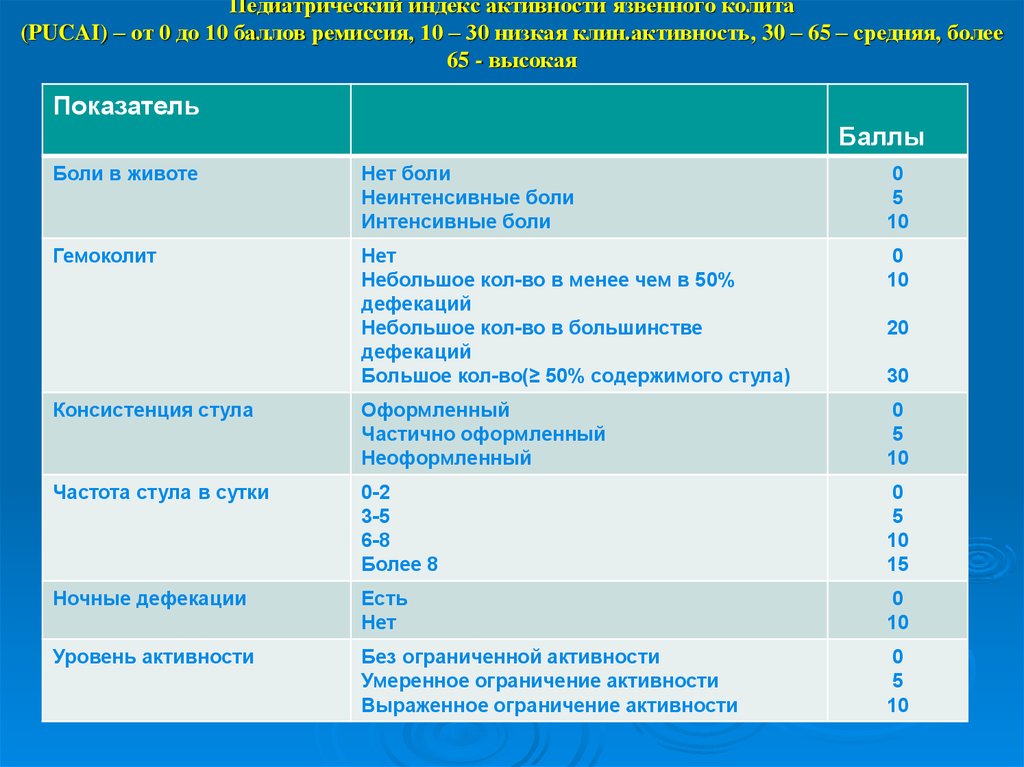
Основной причиной сращения переломов с неустраненным смещением фрагментов и нарушения процесса костной регенерации является неадекватность примененного метода лечения характеру перелома. Если сращение перелома ДОПК первичной костной мозолью невозможно вследствие риска возникновения вторичного смещения и увеличения срока иммобилизации, такой перелом после репозиции должен быть фиксирован любым из доступных методов, а срок иммобилизации является определяющим при выборе метода фиксации. Таким образом, длительность иммобилизации является показателем адекватно проведенной фиксации перелома. То есть если после фиксации перелома нет риска возникновения вторичного смещения фрагментов, пациент начинает движения в ЛС в течение первых суток, а если необходима иммобилизация ЛС, то ее длительность указывает на неадекватность примененного метода лечения характеру перелома вследствие возрастания риска возникновения контрактуры ЛС.
Выводы
Частым осложнением при консервативном лечении повреждений ДОПК является формирование контрактур, которые отмечены у 91,4 % пациентов, что определяет важность данной проблемы и необходимость усовершенствования методов медицинской реабилитации.
Длительная иммобилизация локтевого сустава при повреждениях ДОПК является причиной формирования контрактур и развития дегенеративно-дистрофических осложнений.
При консервативном лечении сращение перелома должно осуществятся на фоне сохранения анатомических взаимоотношений поврежденных структур в течение 3–4 недель иммобилизации.
Bibliography
Артемьев А.А. Малоинвазивные методики в лечении сложных внутрисуставных переломов дистального отдела плечевой кости / А.А. Артемьев, Н.И. Нелин, В.В. Нахаев, М.С. Бесараб, Р.П. Небелас // Мат-лы научно-практической конференции с международным участием «Актуальные вопросы хирургии верхней конечности». — Курган, 2009. — С. 16-17.
Городниченко А.И. Чрескостный остеосинтез переломов дистального отдела плечевой кости / А.И. Городниченко, О.Н. Усков, В.И. Горбатов, А.Н. Минаев, А.Ю. Драгунас // Ортопедия и травматология России. — 2006. — № 2. — С. 83.
Жабин Г.И. Оперативное лечение оскольчатых переломов мыщелка плеча типа С по классификации АО/ASIF / Г. И. Жабин, Шахизи Фуад, С.Ю. Федюнина // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2003. — № 3. — С. 53-57.
И. Жабин, Шахизи Фуад, С.Ю. Федюнина // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2003. — № 3. — С. 53-57.
Маркс В.О. Ортопедическая диагностика: Руководство-справочник / В.О. Маркс. — Минск: Наука и техника, 1978. — 512 с.
Мателенок Е.М. Консервативное лечение пациентов с переломами мыщелка плечевой кости / Е.М. Мателенок, Т.Н. Гращенкова // Ортопед. травматол. — 2002. — № 2. — С. 48-51.
Мюллер М.Е. Руководство по внутреннему остеосинтезу: методика, рекомендованная группой АО (Швейцария) / М.Е. Мюллер, М. Алльговер, Р. Шнайдер, Х. Виллинеггер. — М.: Ad Marginem, 1996. — 750 с.
Сирота Е.Г. Стабильно-функциональный остеосинтез при переломах дистального конца плечевой кости у взрослых / Е.Г. Сирота, И.Г. Саглай, В.А. Ночевкин, Е.С. Чирах, С.Х. Чирах // Ортопед. травматол. — 1997. — № 3. — С. 95-96.
Шевцов В.И. Результаты лечения больных с последствиями повреждений локтевого сустава с применением аппарата Илизарова / В.И. Шевцов, Ю.П. Солдатов, В. Д. Макушин // Материалы научно-практической конференции с международным участием «Актуальные вопросы хирургии верхней конечности». — Курган, 2009. — С. 139-140.
Д. Макушин // Материалы научно-практической конференции с международным участием «Актуальные вопросы хирургии верхней конечности». — Курган, 2009. — С. 139-140.
Дергачов В.В. Лікування переломів дистального епіметафіза плечової кістки стержневими апаратами / В.В. Дергачев: Автореф. дис… канд. мед. наук: 14.01.21 / Інст. пат. хребта та суглобів ім. проф. М.І. Ситенка АМН України. — Харків, 2005. — 15 с.
Носівець Д.С. Сучасні підходи до реабілітації хворих з переломами дистального метаепіфіза плечової кістки (огляд літератури) / Д.С. Носівець, І.В. Бойко, Л.Ю. Науменко // Вісник ортопедії, травматології та протезування. — 2009. — № 1. — С. 71-74.
Попов В.А. Принципи оперативного лікування повних внутрішньосуглобових переломів дистального кінця плечової кістки / В.А. Попов, В.Й. Шуба, А.В. Білоноженко // Вісник ортопедії, травматології та протезування. — 2001. — № 1. — С. 25-28.
Сулима В.С. Переваги хірургічного лікування хворих з внутрішньосуглобовими переломами дистального кінця плечової кістки / В. С. Сулима, В.П. Омельчук, Л.М. Юрійчук, Ю.Д. Валовіна // Вісник ортопедії, травматології та протезування. — 2006. — № 2. — С. 39-42.
С. Сулима, В.П. Омельчук, Л.М. Юрійчук, Ю.Д. Валовіна // Вісник ортопедії, травматології та протезування. — 2006. — № 2. — С. 39-42.
Шуба В.Й. Хірургічне лікування внутрішньосуглобових переломів дистального кінця плечової кістки / В.Й. Шуба: Автореф. дис… канд. мед. наук: 14.01.21 / Інст. травм. та ортопедії АМН України. — Київ, 2004. — 24 с.
Morrey B.F., An K.N. Functional evaluation of the elbow // Morrey B.F. The elbow and its disorders. — Philadelphia: W.B. Saunders, 2000. — Р. 74-83.
Sojbjerg J.O. The Stiff Elbow // Acta Orthop. Scand. — 1996. — № 67(6). — P. 626-631.
Индекс баллов/индекс активности MAPE/заболевания (DAI) для язвенного колита
Когда использовать
Жемчужины/ловушки
Почему используйте
Частота стула
Нормальные
0
1-2 Сталки/день.
+1
3-4 стула в день больше нормы
+2
>4 стула в день больше нормы
+3
Ректальное кровотечение ГМ с видимой кровью И ≥1 ГМ только с кровью.
Видимая кровь с стулом менее чем вдвое меньше, чем в половине времени
+1
Видимая кровь с половиной времени, или более
+2
Проходящая только кровь
+3
Внешний вид слизистой оболочки при Endoscopy
+3.
Нормальное или неактивное заболевание
0
Легкое заболевание (эритема, снижение сосудистого рисунка, легкая рыхлость)
+1
Среднее заболевание (выраженная эритема, отсутствие сосудистого рисунка, рыхлость, эрозии)
+2
Тяжелая заболевание (спонтанное кровотечение, язв)
+3
Рейтинг врача активности заболевания
Нормальный
0
MILD
+1
Модеров
9000 299999999999999999999999000 2
Moderere 9000 9000 2
999999999999999999999999999999000 2
000
99999999999999000 +1
99999
+1
.
+3
Результат:
Пожалуйста, заполните обязательные поля.
Доктор Кеннет В. Шредер
Кеннет В. Шредер, доктор медицинских наук, адъюнкт-профессор медицины, в частности гастроэнтерологии и гепатологии, в клинике Майо. Доктор Шредер занимается эндоскопической диагностикой/лечением заболеваний желудочно-кишечного тракта и воспалительных заболеваний кишечника.
To view Dr. Kenneth W. Schroeder’s publications, visit PubMed
- About the Creator
Dr.
 Kenneth W Шредер
Kenneth W Шредер Вы доктор Кеннет В. Шредер?
- Связанные расчеты
- Авторы контента
Валидность показателей результатов — Отчет о клиническом обзоре: адалимумаб (Хумира)
Книжная полка NCBI. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
Отчет о клиническом обзоре: адалимумаб (Хумира) [Интернет]. Оттава (Онтарио): Канадское агентство по лекарствам и технологиям в области здравоохранения; 2016 Апрель
Отчет о клиническом обзоре: адалимумаб (Хумира) [Интернет].
Показать детали
- Содержание
Критерий поиска
Цель
Обобщить данные, касающиеся надежности, валидности, оценки и минимального клинически значимого различия (MCID) следующих шкал, используемых для оценки изменений активности язвенного колита (ЯК): и измерение результатов в клинических испытаниях:
Система подсчета баллов Мейо
Опросник воспалительных заболеваний кишечника (IBDQ)
Краткая форма (36) Медицинское обследование (SF-36): Исследование результатов лечения
Результаты
Шкала Мейо
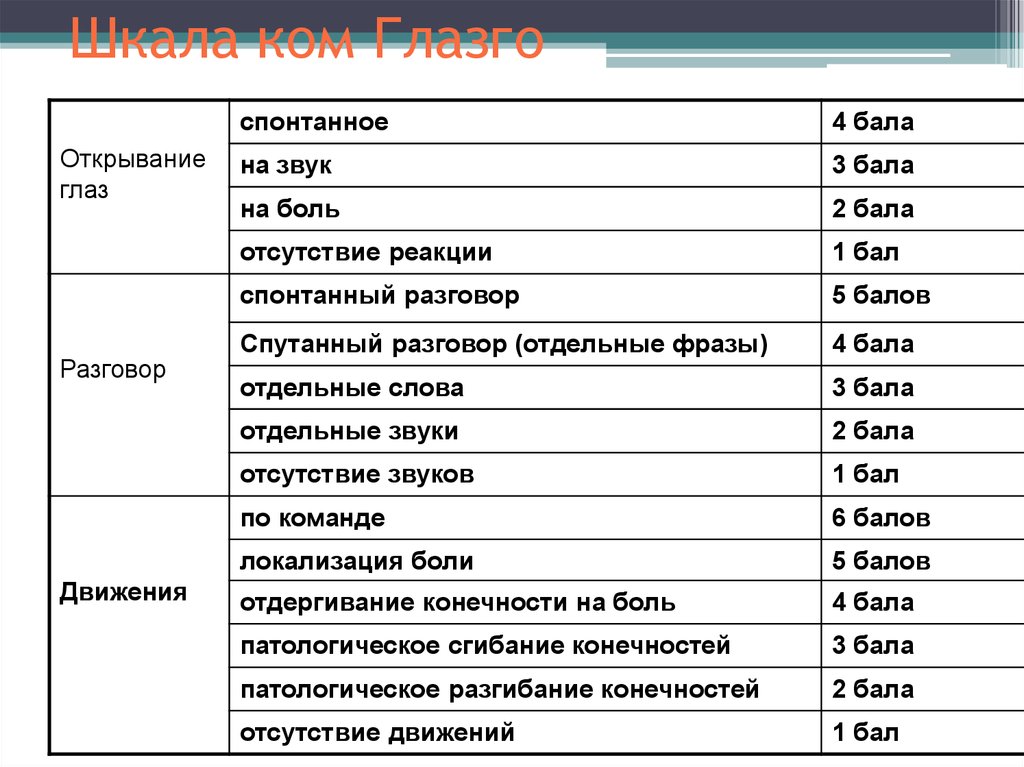
Шкала Мейо является одним из наиболее часто используемых показателей активности заболевания в плацебо-контролируемых исследованиях ЯК.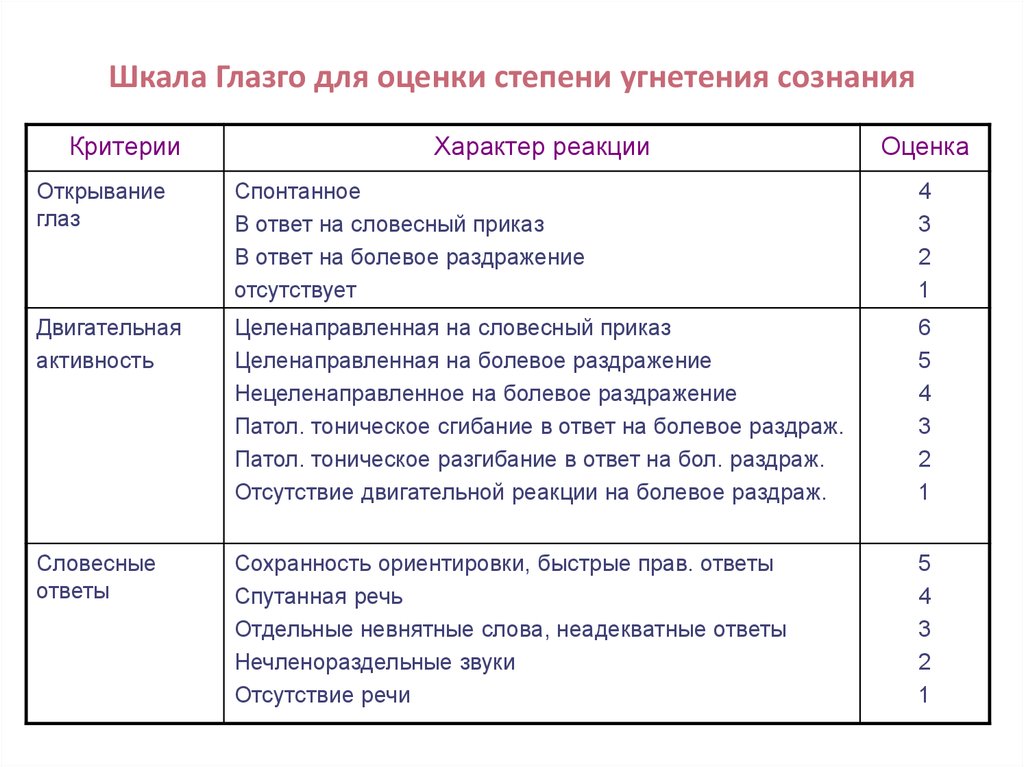 В полной форме он состоит из четырех частей: ректальное кровотечение, частота стула, оценка врача и внешний вид при эндоскопии. Каждая часть оценивается от 0 до 3, что дает общий балл от 0 до 12. Оценка от 3 до 5 баллов указывает на умеренно активное заболевание, оценка от 6 до 10 баллов указывает на умеренно активное заболевание, а оценка от 11 до 12 баллов указывает на тяжелое активное заболевание. Были разработаны и утверждены две сокращенные версии: частичная шкала Мейо, исключающая подшкалу эндоскопии, и неинвазивная шестибалльная шкала, включающая только ректальное кровотечение и частоту стула. 23 Было показано, что шкала Мейо и частичная шкала Мейо коррелируют с оценкой пациентом изменения активности ЯК. 23 Льюис и др. сообщили о снижении ≥ 3 баллов по шкале Мейо и частичной шкале Мейо, что представляет собой клинически значимое изменение. 23 Льюис и др. также рекомендовали определять клиническую ремиссию ЯК по шкале Мейо ≤ 2 баллов. 23
В полной форме он состоит из четырех частей: ректальное кровотечение, частота стула, оценка врача и внешний вид при эндоскопии. Каждая часть оценивается от 0 до 3, что дает общий балл от 0 до 12. Оценка от 3 до 5 баллов указывает на умеренно активное заболевание, оценка от 6 до 10 баллов указывает на умеренно активное заболевание, а оценка от 11 до 12 баллов указывает на тяжелое активное заболевание. Были разработаны и утверждены две сокращенные версии: частичная шкала Мейо, исключающая подшкалу эндоскопии, и неинвазивная шестибалльная шкала, включающая только ректальное кровотечение и частоту стула. 23 Было показано, что шкала Мейо и частичная шкала Мейо коррелируют с оценкой пациентом изменения активности ЯК. 23 Льюис и др. сообщили о снижении ≥ 3 баллов по шкале Мейо и частичной шкале Мейо, что представляет собой клинически значимое изменение. 23 Льюис и др. также рекомендовали определять клиническую ремиссию ЯК по шкале Мейо ≤ 2 баллов. 23
Хотя шкала Мейо является широко признанным показателем активности ЯК и принимается регулирующими органами, включая Министерство здравоохранения Канады и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, она может быть неоптимальной. Куни и др. утверждают, что два компонента шкалы Мейо, общая оценка врача (PGA) и подшкала сигмоидоскопии, являются субъективными и привносят в индекс изменчивость и отсутствие точности. PGA также включает оценку сигмоидоскопии, которая вводит двойной счет некоторых элементов. 24
Куни и др. утверждают, что два компонента шкалы Мейо, общая оценка врача (PGA) и подшкала сигмоидоскопии, являются субъективными и привносят в индекс изменчивость и отсутствие точности. PGA также включает оценку сигмоидоскопии, которая вводит двойной счет некоторых элементов. 24
Опросник по воспалительным заболеваниям кишечника
IBDQ был разработан Guyatt et al. 25 в качестве анкеты, наводимой врачом, и широко используется для оценки качества жизни, связанного со здоровьем (HRQoL), у пациентов с воспалительными заболеваниями кишечника (ВЗК) (ЯК и болезнь Крона). 26 Это основанный на Лайкерте опросник из 32 пунктов, разделенный на четыре измерения: кишечные симптомы (10 пунктов), системные симптомы (5 пунктов), эмоциональная функция (12 пунктов) и социальная функция (5 пунктов). Ответы на каждый вопрос оцениваются по шкале от 1 до 7 (1 — наихудшая ситуация, 7 — наилучшая). Таким образом, общий балл IBDQ колеблется от 32 до 224, причем более высокие баллы представляют лучшее качество жизни. Баллы пациентов в ремиссии обычно колеблются от 170 до 19.0. Увеличение балла IBDQ с 16 до 32 баллов представляет собой верхнюю и нижнюю границы клинически значимого улучшения качества жизни HRQoL у пациентов с болезнью Крона. 21 Информация о том, приводит ли эта корреляция между оценкой и уровнями клинического улучшения непосредственно к ЯК, не была доступна при поиске в литературе для этой сводки.
Баллы пациентов в ремиссии обычно колеблются от 170 до 19.0. Увеличение балла IBDQ с 16 до 32 баллов представляет собой верхнюю и нижнюю границы клинически значимого улучшения качества жизни HRQoL у пациентов с болезнью Крона. 21 Информация о том, приводит ли эта корреляция между оценкой и уровнями клинического улучшения непосредственно к ЯК, не была доступна при поиске в литературе для этой сводки.
Систематический обзор 21 девяти валидационных исследований IBDQ для ЯК показал, что в семи исследованиях IBDQ смог дифференцировать клинически важные различия между пациентами с ремиссией заболевания и пациентами с рецидивом заболевания, демонстрируя значительные различия в счете. 26 IBDQ также может различать изменения в социальном и эмоциональном состоянии пациентов; однако корреляция этого параметра с активностью заболевания не так высока, как корреляция с ремиссией кишечных симптомов. 26 IBDQ также продемонстрировал высокую надежность при повторном тестировании во всех четырех измерениях IBDQ. Шесть исследований оценивали IBDQ на чувствительность к изменениям, и во всех предполагалось, что он является чувствительным инструментом для количественной оценки изменений в HRQoL по сравнению с изменениями клинической активности при ЯК. 26
Шесть исследований оценивали IBDQ на чувствительность к изменениям, и во всех предполагалось, что он является чувствительным инструментом для количественной оценки изменений в HRQoL по сравнению с изменениями клинической активности при ЯК. 26
Краткая форма (36) Health Survey: Medical Outcomes Study
SF-36 — это инструмент общего состояния здоровья, состоящий из 36 пунктов, который широко использовался в клинических испытаниях во многих областях заболеваний. 27 SF-36 состоит из восьми областей здоровья: физическое функционирование, ролевое физическое, телесная боль, общее здоровье, жизненная сила, социальное функционирование, ролевое эмоциональное и психическое здоровье. 28 Для каждой из восьми категорий можно рассчитать балл по подшкале. SF-36 также предоставляет сводку по двум компонентам: сводку по физическим компонентам (PCS) и сводку по психическим компонентам (MCS). Баллы PCS и MCS варьируются от 0 до 100, при этом более высокие баллы указывают на лучшее состояние здоровья. Суммарные шкалы оцениваются с использованием методов, основанных на нормах, с регрессионными весами и константами, полученными из общей популяции США. Шкалы PCS и MCS преобразованы, чтобы иметь среднее значение 50 и стандартное отклонение (SD) 10 для населения США в целом. Таким образом, все баллы выше/ниже 50 считаются выше/ниже среднего для населения США в целом. У пациентов с язвенным колитом или болезнью Крона SF-36 показал хорошую дискриминантную способность и имел удовлетворительную надежность. 29 Хотя надежность была удовлетворительной, авторы все же наблюдали существенные эффекты пола в ролево-физическом и ролево-эмоциональном измерениях, подчеркивая недостаточную чувствительность шкалы для обнаружения небольших изменений в определенных группах пациентов. 29 Для пациентов с ЯК и пациентов с болезнью Крона высокие потолочные эффекты наряду с низкими показателями реактивности (полученными с использованием статистики Гайятта) указывают на некоторые ограничения, связанные со способностью SF-36 обнаруживать ухудшение или улучшение в течение определенного периода времени, особенно в лонгитюдных исследованиях.
Суммарные шкалы оцениваются с использованием методов, основанных на нормах, с регрессионными весами и константами, полученными из общей популяции США. Шкалы PCS и MCS преобразованы, чтобы иметь среднее значение 50 и стандартное отклонение (SD) 10 для населения США в целом. Таким образом, все баллы выше/ниже 50 считаются выше/ниже среднего для населения США в целом. У пациентов с язвенным колитом или болезнью Крона SF-36 показал хорошую дискриминантную способность и имел удовлетворительную надежность. 29 Хотя надежность была удовлетворительной, авторы все же наблюдали существенные эффекты пола в ролево-физическом и ролево-эмоциональном измерениях, подчеркивая недостаточную чувствительность шкалы для обнаружения небольших изменений в определенных группах пациентов. 29 Для пациентов с ЯК и пациентов с болезнью Крона высокие потолочные эффекты наряду с низкими показателями реактивности (полученными с использованием статистики Гайятта) указывают на некоторые ограничения, связанные со способностью SF-36 обнаруживать ухудшение или улучшение в течение определенного периода времени, особенно в лонгитюдных исследованиях. 29
29
MCID для PCS или MCS SF-36 обычно составляет от 2,5 до 5 баллов, 18 – 20 , в то время как при болезни Крона MCID PCS и MCS оцениваются в диапазоне от 1,6 и 7,0 и от 2,3 до 8,7, соответственно, с использованием различных подходов, основанных на распределении и привязке. 17 При НЯК не было выявлено MCID.
Резюме
Шкала Мейо и частичная шкала Мейо являются широко используемыми показателями активности заболевания в плацебо-контролируемых исследованиях ЯК. Оба продемонстрировали корреляцию с оценкой пациентом изменения активности ЯК. Легкая, умеренная и тяжелая активность заболевания обозначается диапазоном баллов от 3 до 5 баллов, от 6 до 10 баллов и от 11 до 12 баллов соответственно. Льюис и др. сообщили, что снижение ≥ 3 баллов по шкале Мейо и частичная оценка по шкале Мейо отражают клинически значимое изменение. 23
IBDQ представляет собой заполняемый врачом опросник из 32 пунктов, используемый для оценки качества жизни HRQoL у пациентов с ВЗК (ЯК и болезнь Крона).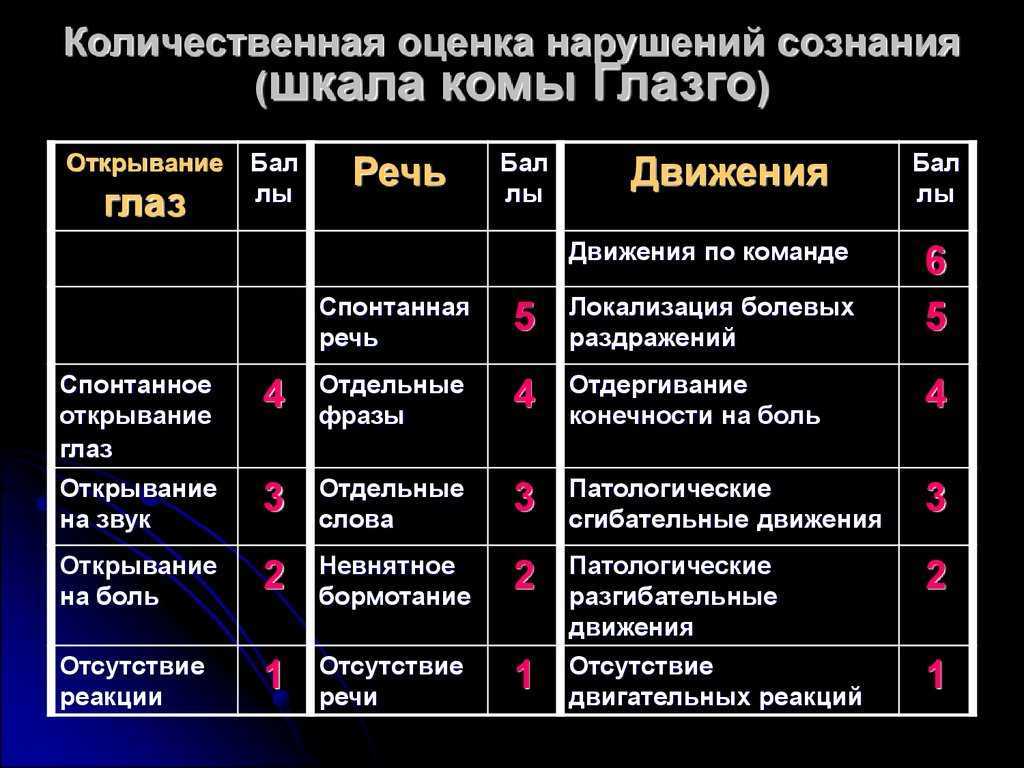 26 Оценивает кишечные и системные симптомы, а также эмоциональные и социальные функции. Ответы на каждый вопрос оцениваются по шкале от 1 до 7, при этом общий балл варьируется от 32 (очень плохое качество жизни HRQoL) до 224 (отличное качество жизни HRQoL). Пациенты в симптоматической ремиссии обычно имеют 170 баллов или больше. Увеличение балла IBDQ с 16 до 32 баллов представляет собой верхнюю и нижнюю границы клинически значимого улучшения качества жизни HRQoL у пациентов с болезнью Крона.
26 Оценивает кишечные и системные симптомы, а также эмоциональные и социальные функции. Ответы на каждый вопрос оцениваются по шкале от 1 до 7, при этом общий балл варьируется от 32 (очень плохое качество жизни HRQoL) до 224 (отличное качество жизни HRQoL). Пациенты в симптоматической ремиссии обычно имеют 170 баллов или больше. Увеличение балла IBDQ с 16 до 32 баллов представляет собой верхнюю и нижнюю границы клинически значимого улучшения качества жизни HRQoL у пациентов с болезнью Крона.
SF-36 — это инструмент общего состояния здоровья, состоящий из 36 пунктов, который широко использовался в клинических испытаниях во многих областях заболеваний, 27 с MCID, как правило, в диапазоне от 2,5 до 5 баллов. 18 – 20 Однако, что касается болезни Крона, оценки MCID для PCS и MCS варьировались от 1,6 до 8,7, в то время как MCID не был идентифицирован при ЯК. Было обнаружено, что SF-36 имеет хорошую дискриминационную способность и удовлетворительную надежность; однако из-за высоких эффектов нижнего и верхнего пределов и низких баллов, полученных для ответа с использованием статистики Гайятта, SF-36 может быть ограничен в своей способности обнаруживать ухудшение или улучшение с течением времени у пациентов с ЯК и болезнью Крона.
Copyright © 2016 Канадское агентство по лекарствам и технологиям в здравоохранении.
Авторские права и другие права на интеллектуальную собственность в этом документе принадлежат CADTH и ее лицензиарам. Эти права защищены Законом Канады об авторском праве и другими национальными и международными законами и соглашениями. Пользователям разрешается делать копии этого документа только в некоммерческих целях при условии, что он не будет изменен при воспроизведении, и будет предоставлена соответствующая ссылка на CADTH и его лицензиаров.
Если не указано иное, эта работа распространяется в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND), копия которой доступна по адресу http://creativecommons.org/ Лицензии/By-NC-ND/4.0/
Идентификатор книжной полки: NBK539018
Содержание



 Вторичные ранжированные конечные точки включали: клинический ответ (согласно адаптированной шкале Мейо), эндоскопическое улучшение и улучшение слизистой, выявленное при гистологическом и эндоскопическом исследовании. Показаны не все ранжированные вторичные конечные точки. Все первичные и ранжированные вторичные конечные точки достигли значений p <0,001 в сравнении с плацебо.
Вторичные ранжированные конечные точки включали: клинический ответ (согласно адаптированной шкале Мейо), эндоскопическое улучшение и улучшение слизистой, выявленное при гистологическом и эндоскопическом исследовании. Показаны не все ранжированные вторичные конечные точки. Все первичные и ранжированные вторичные конечные точки достигли значений p <0,001 в сравнении с плацебо.
 Серьезные нежелательные явления (СНЯ) наблюдались у 3,2% пациентов в группе упадацтиниба и у 4,5% пациентов в группе плацебо1. В обоих группах серьезные инфекции возникали с одинаковой частотой (0,6%) 1. Случаев смерти, перфорации желудочно-кишечного тракта, злокачественных новообразований, серьезных сердечно-сосудистых или тромбоэмболических осложнений в группе упадацитиниба не наблюдалось1. В группе плацебо зарегистрирован один случай венозной тромбоэмболии (тромбоз глубоких вен и тромбоэмболия легочной артерии) и один случай перфорации желудочно-кишечного тракта1.
Серьезные нежелательные явления (СНЯ) наблюдались у 3,2% пациентов в группе упадацтиниба и у 4,5% пациентов в группе плацебо1. В обоих группах серьезные инфекции возникали с одинаковой частотой (0,6%) 1. Случаев смерти, перфорации желудочно-кишечного тракта, злокачественных новообразований, серьезных сердечно-сосудистых или тромбоэмболических осложнений в группе упадацитиниба не наблюдалось1. В группе плацебо зарегистрирован один случай венозной тромбоэмболии (тромбоз глубоких вен и тромбоэмболия легочной артерии) и один случай перфорации желудочно-кишечного тракта1.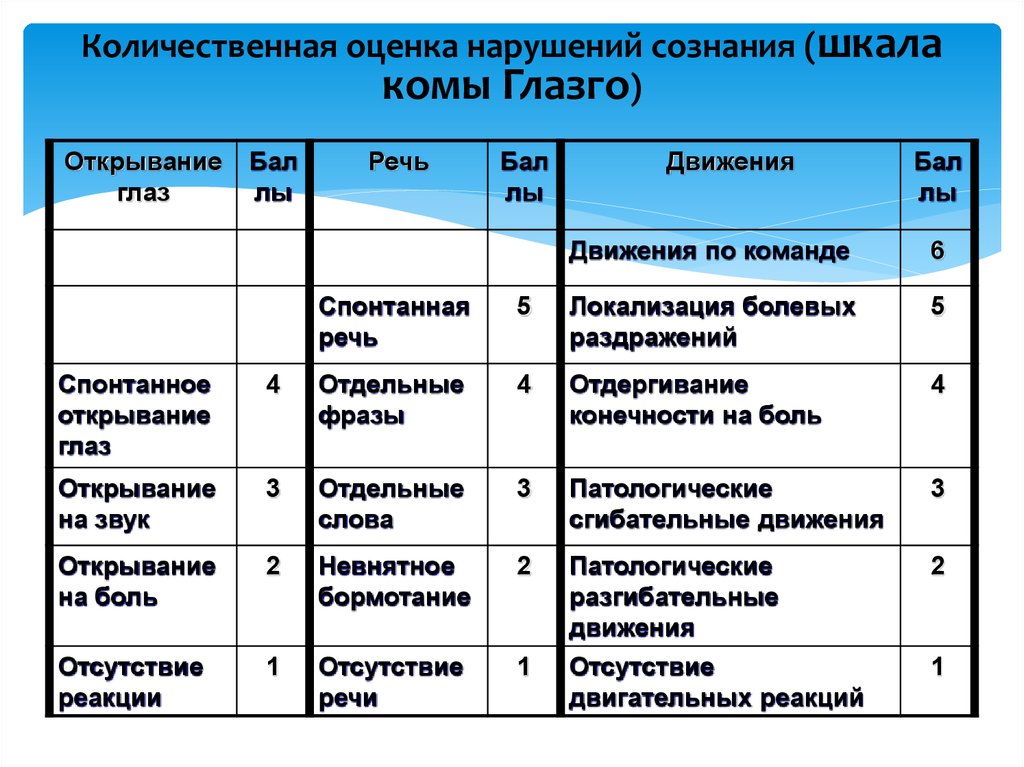


 За дополнительной информацией о компании обращайтесь на сайт www.abbvie.com, www.abbvie.ru, а также к аккаунтам в социальных сетях @abbvie в Twitter, Facebook, Instagram, YouTube.
За дополнительной информацией о компании обращайтесь на сайт www.abbvie.com, www.abbvie.ru, а также к аккаунтам в социальных сетях @abbvie в Twitter, Facebook, Instagram, YouTube.
 EULAR 2019; THU0167.
EULAR 2019; THU0167. Lancet. 2018 Jun 23;391(10139):2503-2512.
Lancet. 2018 Jun 23;391(10139):2503-2512. gov. 2021. Available at: https://clinicaltrials.gov/ct2/show/NCT03104400. Accessed on February 12, 2021.
gov. 2021. Available at: https://clinicaltrials.gov/ct2/show/NCT03104400. Accessed on February 12, 2021. crohnsandcolitis.com.au/site/wp-content/uploads/Deloitte-Access-Economics-Report.pdf. Accessed on February 12, 2021.
crohnsandcolitis.com.au/site/wp-content/uploads/Deloitte-Access-Economics-Report.pdf. Accessed on February 12, 2021.
 Kenneth W Шредер
Kenneth W Шредер