Лечение ишемического инсульта в остром периоде: Ишемический инсульт: современные стратегии лечения
Новые технологии в диагностике и лечении больных в остром периоде инсульта | Котов С.В.
Смертность от неинфекционных заболеваний в России является наивысшей среди всех развитых стран мира. Если в США, Канаде, Австралии этот показатель среди мужчин составляет менее 400 на 100 тыс. в год, то в нашей стране и других странах СНГ – более 900; подобные цифры зарегистрированы лишь в нескольких отсталых странах Африки. При этом в России основной вклад в данный показатель вносит смертность от сердечно-сосудистых заболеваний [1].
Среди причин смерти, по данным, которые привела заместитель министра здравоохранения РФ Т.В. Яковлева, 56,7% занимают сердечно-сосудистые; 14,4% – онкологические заболевания, травмы, отравления и другие внешние причины – 10,7%. Таким образом, вклад других болезней в этот показатель по сравнению с сердечно-сосудистыми заболеваниями незначителен. При этом инсульт занимает второе место, уступая лишь ишемической болезни сердца (ИБС) с инфарктом миокарда.
В структуре инсульта 80% составляет инфаркт мозга. При этом, если при внезапной остановке мозгового кровотока потеря сознания происходит уже через 10 с, биоэлектрическое молчание на ЭЭГ – через 30–40 с, а смерть мозга – через 8–10 мин., то при инсульте процесс необратимого повреждения вещества мозга в ядре ишемии также стремителен, но в зоне ишемической полутени – участке мозга, многократно превышающем по объему область некроза, где нейроны не погибли и могут восстановить жизнедеятельность, растягивается на часы.
Наиболее доступным из современных методов лечения больных с ишемическим инсультом является системная тромболитическая терапия (ТЛТ). Вернер Хаке (W. Hacke) – один из основоположников применения ТЛТ в Европе – отмечает, что системная ТЛТ изучена значительно лучше других методов реваскуляризации. Этот метод наиболее доступен как экономически, так и технически [4, 5, 7].
В настоящее время в сотнях медицинских организаций в России есть все необходимые условия для проведения ТЛТ.
Наиболее эффективным методом, позволяющим снизить временной период поступления больного с инсультом в стационар и тем самым увеличить число больных, которым проводится ТЛТ, является повышение медицинской грамотности населения. Если постоянно информировать население о признаках инсульта и обучать алгоритму действий при этом состоянии, то постепенно все большее число наших пациентов будут попадать в стационар своевременно.
Другой фактор, уменьшающий применение ТЛТ, – распространенные заблуждения, циркулирующие как в медицинском сообществе, так и среди пациентов, об эффективности различных препаратов сосудистого и метаболического действия при ОНМК. До настоящего времени не появилось достаточных доказательств эффективности нейропротективных средств, показавших хорошие результаты в эксперименте. По мнению A. Majid (2014), причина рассогласования экспериментальных и клинических данных заключается в двойственности процессов, протекающих при инсульте. Так, активность клеток микроглии и других, участвующих в воспалительном процессе, действие металлопротеаз, процессы апоптоза и аутофагии могут носить как защитный, так и повреждающий характер в зависимости от срока их воздействия и этапа развития патологического процесса.
Еще одно условие, необходимое для проведения ТЛТ, – доступность нейровизуализации. Когда в 90-е гг. прошлого века эксперты-неврологи говорили, что проведение компьютерной томографии (КТ) является обязательным для каждого больного с ОНМК в момент поступления в стационар, то это положение казалось несбыточной мечтой. Но с каждым годом аппаратов для нейровизуализации становилось все больше, а их разрешающие способности – все выше.
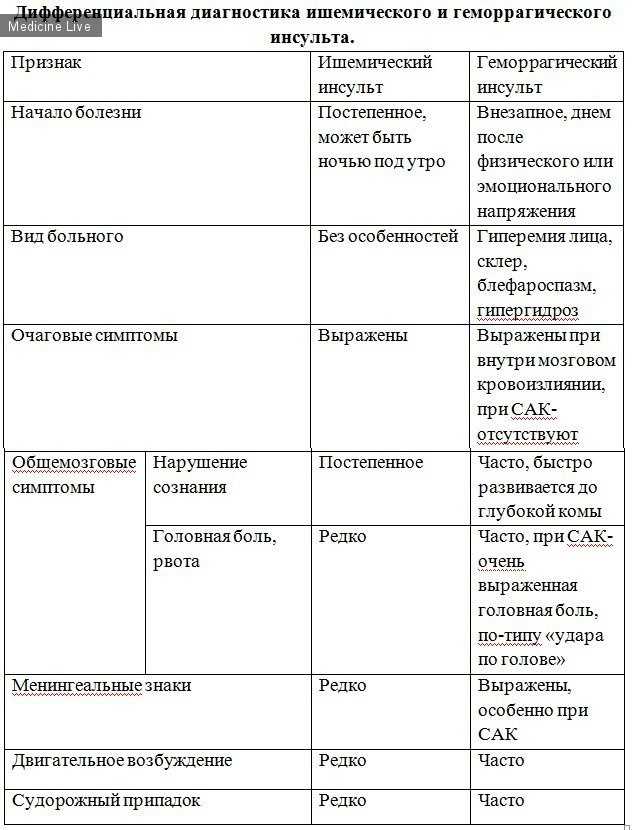
Следует отметить, что по мере развития методов нейровизуализации изменяются задачи, которые эти методы решают. Если вначале основная задача заключалась в определении характера инсульта – ишемический или геморрагический, то в настоящее время нейровизуализация позволяет также установить патогенетический подтип инфаркта мозга, выявить патологию сосуда, приведшего к инсульту, определить тактику лечения. Особенно важно это при преходящих нарушениях мозгового кровообращения, когда симптомов ишемии мозга уже нет, а риск повторного цереброваскулярного события неизмеримо высок.
Если вначале основная задача заключалась в определении характера инсульта – ишемический или геморрагический, то в настоящее время нейровизуализация позволяет также установить патогенетический подтип инфаркта мозга, выявить патологию сосуда, приведшего к инсульту, определить тактику лечения. Особенно важно это при преходящих нарушениях мозгового кровообращения, когда симптомов ишемии мозга уже нет, а риск повторного цереброваскулярного события неизмеримо высок.
Современные протоколы проведения РКТ и магнитно-резонансной томографии (МРТ) позволяют выявлять не только объем и характер очага инсульта, но и показывают, каковы возможности достижения положительного эффекта от ТЛТ. Так, при перфузионной РКТ возможно выявление так называемого феномена «рассогласования» – различие в объеме вещества мозга, где снижены скорость кровотока и объем крови. Эта область «рассогласования» является зоной ишемической полутени, т. е. участком мозга, который потенциально можно спасти от гибели при своевременном вмешательстве (рис.
В настоящее время для лечения больных с ишемическим инсультом все шире стали использоваться интервенционные методы – внутриартериальные рентгеноэндоваскулярные вмешательства. Среди интраартериальных методов лечения выделяют интраартериальный тромболизис, проксимальную аспирационную тромбэктомию, дистальную тромбэктомию и стентирование (рис. 2).
Если первоначально для реканализации в основном использовали интраартериальный тромболизис, а механическое воздействие – лишь для фрагментации тромба, то сейчас все чаще используют тромбоэкстракцию после тромболизиса или без него.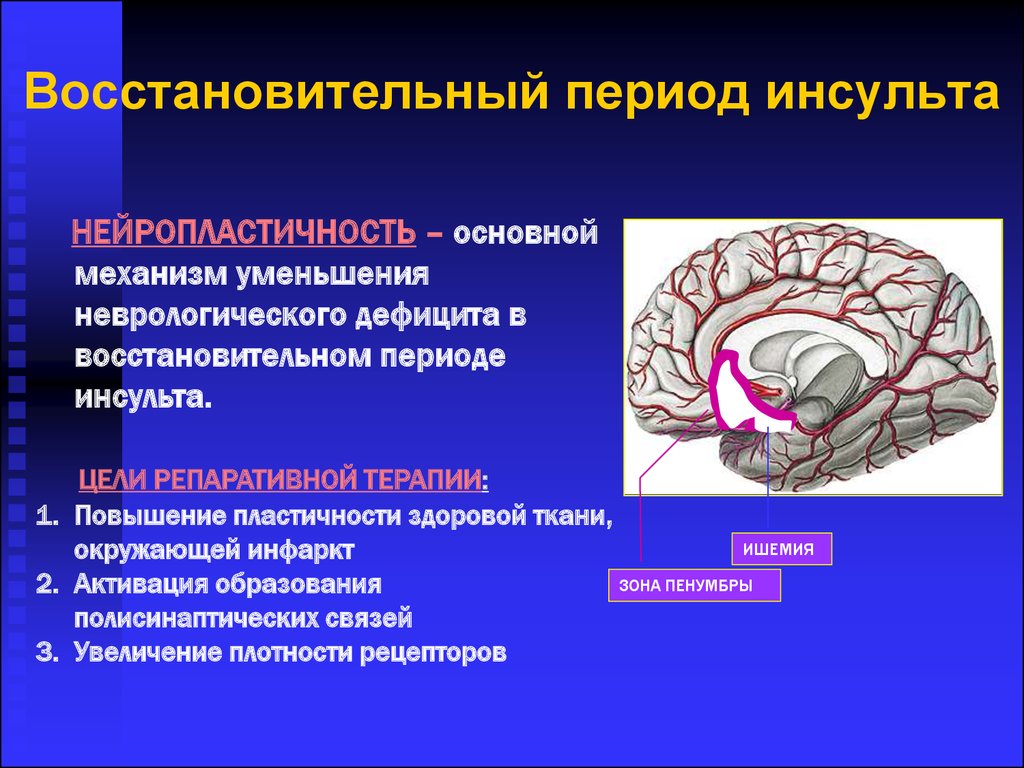
В результате использования интраартериальных методов лечения в ведущих клиниках США и Западной Европы определены условия достижения хорошего результата внутрисосудистого вмешательства:
- минимальный срок от развития инсульта (менее 6 ч). Таким образом, срок лечебного воздействия при ишемическом инсульте вновь несколько увеличивается до 360 мин.;
- тромбоз крупной артерии (внутренняя сонная артерия (ВСА), средняя мозговая артерия (СМА) (сегменты М1 и М2), передняя мозговая артерия (ПМА), основная артерия, позвоночная артерия). При поражении дистальных отделов сосудистых бассейнов этих артерий более эффективна системная ТЛТ;
- наличие «рассогласования» (mismatch) по данным РКТ или МРТ. Если при нейровизуализации феномен «рассогласования» отсутствует, значит зона ишемической полутени не определяется, а следовательно, не имеет смысла проводить какие-либо интервенционные методы;
-
наличие хорошо развитого коллатерального кровотока, являющееся условием поддержания жизнеспособности мозгового вещества в зоне ишемической полутени [6, 16].

Швейцарские исследователи из Бернского университета [A. Galimanis и соавт., 2012] обнаружили, что у пациентов с ишемическим инсультом чаще всего выявляются окклюзии различных отделов СМА, причем более 50% всех случаев – это ствол сосуда, сегменты М1 и М2 (табл. 2).
При анализе результатов лечения этих пациентов во время выступления на Всемирном неврологическом конгрессе в Вене (2013) H. Mattle отметил, что наилучшие показатели были достигнуты у пациентов с окклюзией сегментов М1–4 СМА, в то время как при тромбозах ВСА число лиц, достигших оценки 0–2 балла по модифицированной шкале Рэнкина к 90-му дню после инсульта, было наименьшим (рис. 3). Особенно неблагоприятным был тромбоз терминальных отделов ВСА, когда одновременно блокировались бассейны СМА и ПМА. Очевидно, что для выявления этой локализации атеротромботического процесса необходимы РКТ-ангиография и быстрейшее эндоваскулярное вмешательство.
Была четко прослежена связь со сроком вмешательства – проведение реперфузионных мероприятий в срок до 6 ч позволило получить показатели 0–2 балла к 90-му дню после инсульта по модифицированной шкале Рэнкина у 60% больных.
Из приведенных фактов можно сделать определенные выводы: если системная ТЛТ – это метод лечения больных с ишемическим инсультом, который должен применяться как можно шире во всех медицинских организациях, имеющих необходимое оборудование и, самое главное, подготовленных специалистов, то для проведения внутриартериальных вмешательств требуется определенный отбор пациентов, наличие четких показаний и отсутствие противопоказаний. Неправильно использовать рентгеноэндоваскулярные методы по принципу «вдруг поможет». Однако в основе функционирования сложной многоуровневой системы оказания помощи больным с инфарктом мозга лежит все-таки своевременное попадание пациента в стационар.
Учитывая, что наличие окклюзии крупного экстра- или интракраниального сосуда при инфаркте мозга – важный фактор для предсказания эффективности внутриартериального вмешательства, обоснован интерес к поиску различных признаков такой окклюзии. Обнаружено, что наличие оценки по шкале NIHSS от 8 до 20 баллов в первые 3 ч от момента развития симптомов инсульта с высокой вероятностью свидетельствует о страдании крупного сосуда и может быть аргументом в пользу рентгеноэндоваскулярного вмешательства (рис. 4) [8].
Обнаружено, что наличие оценки по шкале NIHSS от 8 до 20 баллов в первые 3 ч от момента развития симптомов инсульта с высокой вероятностью свидетельствует о страдании крупного сосуда и может быть аргументом в пользу рентгеноэндоваскулярного вмешательства (рис. 4) [8].
Но говоря об интервенционном лечении, следует обращать внимание и на признаки, которые могут предсказывать негативные результаты интраартериального вмешательства при ишемическом инсульте. В настоящее время такие предикторы неблагоприятного исхода сформулированы:
- возраст пациента более 80 лет;
- оценка более 18 баллов по шкале NIHSS;
- наличие крупного инфаркта мозга по данным РКТ-перфузии без феномена «рассогласования», при бесконтрастной РКТ – томограмма оценивается по шкале ASPECTS в 7 или менее баллов, или на МРТ в режиме диффузионно-взвешенного изображения объем очага составляет более 100 см3, что указывает на объем инфаркта мозга более 1/3 бассейна СМА [12, 14];
- гипергликемия в дебюте инсульта всегда является фактором, предрасполагающим к развитию осложнений;
-
наличие сопутствующих факторов риска: артериальная гипертензия, фибрилляция предсердий, сахарный диабет.
 В настоящее время многие исследователи пытаются ранжировать риски интервенционных вмешательств, такими методами являются IScore (Ischemic Stroke Predictive Risk Score), THRIVE Score (Totaled Health Risks in Vascular Events) и др. [9, 19];
В настоящее время многие исследователи пытаются ранжировать риски интервенционных вмешательств, такими методами являются IScore (Ischemic Stroke Predictive Risk Score), THRIVE Score (Totaled Health Risks in Vascular Events) и др. [9, 19];
- наличие явных РКТ или МРТ-признаков геморрагического компонента на исходной томограмме является однозначным противопоказанием к проведению и системной ТЛТ, и внутриартериального вмешательства;
- наконец, если в результате вмешательства не достигнута реканализация, то это также является неблагоприятным прогностическим фактором.
Еще одно направление в лечении больных ишемическим инсультом – нейрохирургическое вмешательство, декомпрессивная трепанация при злокачественном течении, сопровождающемся отеком и дислокацией мозга. Этот метод повышает выживаемость при тяжелом инсульте, но, к сожалению, приводит к увеличению числа больных с инсультом, имеющих оценку по модифицированной шкале Рэнкина 4–5 баллов.
В настоящее время никаких достоверных сведений об эффективности каких-либо методов нейропротекции при инсульте, за исключением гипотермии, не получено.
Проблема лечения больных с геморрагическим инсультом – не столько неврологическая, сколько хирургическая, т. к. никаких лекарственных методов лечения кровоизлияния в мозг нет. Все, чем может помочь невролог – это базисная терапия инсульта. Сейчас во всем мире для лечения больных с внутричерепными кровоизлияниями все шире используются нейрохирургические и эндоваскулярные методы лечения.
В прошлые годы при внутримозговых кровоизлияниях проводились попытки открытого дренирования полости гематомы для уменьшения объемного воздействия и снижения токсического эффекта распада излившейся крови. При этом была показана эффективность нейрохирургического вмешательства при гематомах объемом более 30 см3, особенно при локализации в задней черепной ямке [17]. В настоящее время нейрохирургическая техника ушла по пути прогресса далеко вперед, появились системы навигации, позволяющие точно ориентироваться в полости черепа через миниатюрные фрезевые отверстия, новые доступы (например, супраорбитальный), микрохирургическая техника (рис. 5) [2, 11], гибридные операционные, когда к услугам хирургов имеется не только ангиографическая установка, но и РКТ или МРТ, и многое другое. Это позволило перейти на новый уровень нейрохирургической помощи.
5) [2, 11], гибридные операционные, когда к услугам хирургов имеется не только ангиографическая установка, но и РКТ или МРТ, и многое другое. Это позволило перейти на новый уровень нейрохирургической помощи.
В настоящее время при геморрагическом инсульте ранняя малоинвазивная нейрохирургическая помощь показана пациентам в возрасте 50–69 лет со спонтанными внутримозговыми кровоизлияниями в течение первых 8 ч после возникновения при объеме гематомы 20–50 см3, оценке по шкале комы Глазго 9 или более [2, 21]. Очень важно подчеркнуть, что на исход нейрохирургического вмешательства оказывает влияние как срок проведения – чем раньше, тем лучше, но не позднее первых 8 ч, так и исходный уровень сознания – отсутствие тяжелой комы, свидетельствующей о необратимых процессах в веществе мозга.
Весьма перспективным методом нейромониторинга у больных с внутримозговым кровоизлиянием является ЭЭГ-мониторинг, что позволяет у части больных выявить персистирующий бессудорожный эпилептический статус как причину нарушения сознания. При этом следует отметить, что если у больных с эпилепсией видео-ЭЭГ-мониторинг уже давно показал себя как наиболее эффективный метод диагностики, то у больных с инсультом контроль ЭЭГ пока что не занял соответствующего места, хотя мы знаем об огромном числе различных ЭЭГ-феноменов у таких пациентов. Недаром С. Шорвон (S. Shorvon) заметил, что более половины больных с ОНМК переносят эпилептические припадки, которые не замечаются ни врачами, ни окружающими. Широкое использование ЭЭГ-мониторинга позволит не только выявлять бессудорожный статус, симулирующий атоническую кому при инсульте, но и даст возможность более точно оценивать состояние больного.
При этом следует отметить, что если у больных с эпилепсией видео-ЭЭГ-мониторинг уже давно показал себя как наиболее эффективный метод диагностики, то у больных с инсультом контроль ЭЭГ пока что не занял соответствующего места, хотя мы знаем об огромном числе различных ЭЭГ-феноменов у таких пациентов. Недаром С. Шорвон (S. Shorvon) заметил, что более половины больных с ОНМК переносят эпилептические припадки, которые не замечаются ни врачами, ни окружающими. Широкое использование ЭЭГ-мониторинга позволит не только выявлять бессудорожный статус, симулирующий атоническую кому при инсульте, но и даст возможность более точно оценивать состояние больного.
В отношении субарахноидального кровоизлияния следует отметить, что здесь также на первом месте находится вопрос о выявлении и выключении из кровотока внутричерепных аневризм сосудов основания мозга. В настоящее время есть два метода: нейрохирургический – клипирование аневризмы, и эндоваскулярный – эмболизация полости аневризмы. Оба метода имеют как плюсы, так и минусы, показания и противопоказания, оба активно совершенствуются. Очевидно, что в каждом конкретном случае вопрос о применении того или иного метода должен решаться коллегиально.
Оба метода имеют как плюсы, так и минусы, показания и противопоказания, оба активно совершенствуются. Очевидно, что в каждом конкретном случае вопрос о применении того или иного метода должен решаться коллегиально.
В заключение хотелось бы подчеркнуть, что интервенционные мероприятия при инсульте, которые в последние годы стали широко распространяться, будут постепенно становиться рутиной. По предварительным оценкам, до половины больных с инсультом нуждаются в том или ином методе хирургического или иного высокотехнологического лечения в остром периоде инсульта. Если рассматривать вопросы реабилитации и вторичной профилактики, то таких пациентов окажется еще больше.
Современная концепция нейропротективной терапии в остром периоде ишемического инсульта | Кулеш
1. Самородская И.В., Андреев Е.М., Заратьянц О.В., Косивцова О.В., Какорина Е.П. Показатели смертности населения старше 50 лет от цереброваскулярных болезней за 15-летний период в России и США. Неврология, нейропсихиатрия, психосоматика. 2017;9(2):15–24. doi: 10.14412/2074-2711-2017-2-15-24.
Неврология, нейропсихиатрия, психосоматика. 2017;9(2):15–24. doi: 10.14412/2074-2711-2017-2-15-24.
2. Thomalla G., Simonsen C.Z., Boutitie F., Andersen G., Berthezene Y., Cheng B. et al. WAKE-UP Investigators. MRI-guided thrombolysis for stroke with unknown time of onset. N Engl J Med. 2018;379(7):611–622. doi: 10.1056/NEJMoa1804355.
3. Campbell B.C.V., Ma H., Ringleb P.A., Parsons M.W., Churilov L., Bendszus M. et al. Extending thrombolysis to 4·5-9 h and wake-up stroke using perfusion imaging: a systematic review and meta-analysis of individual patient data. Lancet. 2019;394(10193):139–147. doi: 10.1016/S0140-6736(19)31053-0.
4. Albers G.W., Marks M.P., Kemp S., Christensen S., Tsai J.P., Ortega-Gutierrez S. et al. Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med. 2018;378(8):708–718. doi: 10.1056/NEJMoa1713973.
5. Nogueira R.G., Jadhav A.P., Haussen D.C., Bonafe A., Budzik R.F., Bhuva P. et al. Thrombectomy 6 to 24 Hours after Stroke with a Mismatch between Deficit and Infarct. N Engl J Med. 2018;378(1):11–21. doi: 10.1056/NEJMoa1706442.
N Engl J Med. 2018;378(1):11–21. doi: 10.1056/NEJMoa1706442.
6. Albers G.W. Late Window Paradox. Stroke. 2018;49(3):768–771. doi: 10.1161/STROKEAHA.117.020200.
7. Кулеш А.А., Сыромятникова Л.И., Голосова Ю.А., Шестаков В.В. Опыт проведения тромболитической терапии у больных с острыми нарушениями мозгового кровообращения: эффективность, безопасность, предикторы исхода и геморрагической трансформации. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(7):18–24. doi: 10.17116/jnevro20181187118.
8. Lees K.R., Emberson J., Blackwell L., Bluhmki E., Davis S.M., Donnan G.A. et al. Effects of Alteplase for Acute Stroke on the Distribution of Functional Outcomes: A Pooled Analysis of 9 Trials. Stroke. 2016;47(9):2373–2379. doi: 10.1161/STROKEAHA.116.013644.
9. Кулеш А.А., Шестаков В.В. Сосудистые недементные когнитивные нарушения: диагноз, прогноз, лечение и профилактика. Неврология, нейропсихиатрия, психосоматика. 2017;9(3):68–75. doi: 10.14412/2074-2711-2017-3-68-75.
10. Вербицкая С.В., Парфенов В.А., Решетников В.А., Козлов В.В., Кабаева А.Р. Постинсультные когнитивные нарушения (результаты 5-летнего наблюдения). Неврология, нейропсихиатрия, психосоматика. 2018;10(1):37–42. doi: 10.14412/2074-2711-2018-1-37-42.
11. Rha J.H., Saver J.L. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke. 2007;38(3):967–973. doi: 10.1161/01.STR.0000258112.14918.24.
12. Soares B.P., Tong E., Hom J., Cheng S.C., Brendo J., Boussel L. et al. Reperfusion is a more accurate predictor of follow-up infarct volume than recanalization: a proof of concept using CT in acute ischemic stroke patients. Stroke. 2010;41(1):e34–e40. doi: 10.1161/STROKEAHA.109.568766.
13. Chamorro А. Neuroprotectants in the Era of Reperfusion Therapy. Review. J Stroke. 2018;20(2):197–207. doi: 10.5853/jos.2017.02901.
14. Chamorro А., Blasco J., López A., Amaro S., San Roman L., Llull L. et al. Complete reperfusion is required for maximal benefits of mechanical thrombectomy in stroke patients. Sci Rep. 2017;7(1):11636. doi: 10.1038/s41598-017-11946-y.
Sci Rep. 2017;7(1):11636. doi: 10.1038/s41598-017-11946-y.
15. Hall C.N., Reynell C., Gesslein B., Hamilton N.B., Mishra A., Sutherland B.A. et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 2014;508(7494):55–60. doi: 10.1038/nature13165.
16. Fisher M., Saver J.L. Future directions of acute ischaemic stroke therapy. Lancet Neurol. 2015;14(7):758–767. doi: 10.1016/S1474-4422(15)00054-X.
17. Lo E.H., Moskowitz M.A., Jacobs T.P. Exciting, radical, suicidal: how brain cells die after stroke. Stroke. 2005;36(2):189–192. doi: 10.1161/01.STR.0000153069.96296.fd.
18. O’Collins V.E., Macleod M.R., Donnan G.A., Horky L.L., van der Worp B.H., Howells D.W. 1,026 experimental treatments in acute stroke. Ann Neurol. 2006;59(3):467–477. doi: 10.1002/ana.20741.
19. Xiong X.Y., Liu L., Yang Q.W. Refocusing Neuroprotection in Cerebral Reperfusion Era: New Challenges and Strategies. Front Neurol. 2018;9:249. doi: 10.3389/fneur.2018.00249.
20. Chamorro А., Dirnagl U., Urra X., Planas A.M. Neuroprotection in acute stroke: targeting excitotoxicity, oxidative and nitrosative stress, and inflammation. Lancet Neurol. 2016;15(8):869–881. doi: 10.1016/S1474-4422(16)00114-9.
21. Savitz S.I., Baron J.C., Yenari M.A., Sanossian N., Fisher M. Reconsidering Neuroprotection in the Reperfusion Era. Stroke. 2017;48(12):3413–3419. doi: 10.1161/STROKEAHA.117.017283.
22. Manzanero S., Santro T., Arumugam T.V. Neuronal oxidative stress in acute ischemic stroke: sources and contribution to cell injury. Neurochem Int. 2013;62(5):712–718. doi: 10.1016/j.neuint.2012.11.009.
23. Tsai J.P., Albers G.W. Reperfusion versus recanalization: the winner is. Stroke. 2015;46(6):1433–434. doi: 10.1161/STROKEAHA.115.009268.
24. Rothman S.M., Olney J.W. Glutamate and the pathophysiology of hypoxic–ischemic brain damage. Ann Neurol. 1986;19(2):105–111. doi: 10.1002/ana.410190202.
25. Saver J.L., Starkman S., Eckstein M., Stratton S. J., Pratt F.D., Hamilton S. et al. Prehospital use of magnesium sulfate as neuroprotection in acute stroke. N Engl J Med. 2015;372(6):528–536. doi: 10.1056/NEJMoa1408827.
J., Pratt F.D., Hamilton S. et al. Prehospital use of magnesium sulfate as neuroprotection in acute stroke. N Engl J Med. 2015;372(6):528–536. doi: 10.1056/NEJMoa1408827.
26. Fukuyama N., Takizawa S., Ishida H., Hoshiai K., Shinohara Y., Nakazawa H. Peroxynitrite formation in focal cerebral ischemia-reperfusion in rats occurs predominantly in the peri-infarct region. J Cereb Blood Flow Metab. 1998;18(2):123–129. doi: 10.1097/00004647-199802000-00001.
27. Pacher P., Beckman J.S., Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 2007;87(1):315–424. doi: 10.1152/physrev.00029.2006.
28. Shuaib A., Lees K.R., Lyden P., Grotta J., Davalos A., Davis S.M. et al. NXY- 059 for the treatment of acute ischemic stroke. N Engl J Med. 2007;357(6):562–571. doi: 10.1056/NEJMoa070240.
29. Onetti Y., Dantas A.P., Pérez B., Cugota R., Chamorro A., Planas A.M. et al. Middle cerebral artery remodeling following transient brain ischemia is linked to early postischemic hyperemia: a target of uric acid treatment. Am J Physiol Heart Circ Physiol. 2015;308(8):H862–H874. doi: 10.1152/ajpheart.00001.2015.
Am J Physiol Heart Circ Physiol. 2015;308(8):H862–H874. doi: 10.1152/ajpheart.00001.2015.
30. Llull L., Laredo C., Renú A., Perez B., Vila E., Obach V. et al. Uric acid therapy improves clinical outcome in women with acute ischemic stroke. Stroke. 2015;46(8):2162–2167. doi: 10.1161/STROKEAHA.115.009960.
31. Amaro S., Llull L., Renú A., Laredo C., Perez B., Vila E. et al. Uric acid improves glucose-driven oxidative stress in human ischemic stroke. Ann Neurol. 2015;77(5):775–783. doi: 10.1002/ana.24378.
32. Feng S., Yang Q., Liu M., Li W., Yuan W., Zhang S. et al. Edaravone for acute ischemic stroke. Cochrane Database Syst Rev. 2011;(12):CD007230. doi: 10.1002/14651858.CD007230.pub2.
33. Miyaji Y., Yoshimura S., Sakai N., Yamagami H., Egashira Y., Shirakawa M. et al. Effect of edaravone on favorable outcome in patients with acute cerebral large vessel occlusion: subanalysis of RESCUE-Japan Registry. Neurol Med Chir (Tokyo). 2015;55(3):241–247. doi: 10.2176/nmc.ra. 2014-0219.
2014-0219.
34. Enomoto M., Endo A., Yatsushige H., Fushimi K., Otomo Y. Clinical Effects of Early Edaravone Use in Acute Ischemic Stroke Patients Treated by Endovascular Reperfusion Therapy. Stroke. 2019;50(3):652–658. doi: 10.1161/STROKEAHA.118.023815.
35. Kobayashi S., Fukuma S., Ikenoue T., Fukuhara S., Kobayashi S. Effect of Edaravone on Neurological Symptoms in Real-World Patients With Acute Ischemic Stroke. Stroke. 2019;50(7):1805–1811. doi: 10.1161/STROKEAHA.118.024351.
36. Ejaz S., Emmrich J.V., Sitnikov S.L., Hong Y.T., Sawiak S.J., Fryer T.D. et al. Normobaric hyperoxia markedly reduces brain damage and sensorimotor deficits following brief focal ischaemia. Brain. 2016;139(3):751–764. doi: 10.1093/brain/awv391.
37. Padma M.V., Bhasin A., Bhatia R., Garg A., Singh M.B., Tripathi M., Prasad K. Normobaric oxygen therapy in acute ischemic stroke: a pilot study in Indian patients. Ann Indian Acad Neurol. 2010;13(4):284–288. doi: 0.4103/0972-2327.74203.
38. Singhal A.B., Benner T., Roccatagliata L., Koroshetz W.J., Schaefer P.W., Lo E.H. et al. A pilot study of normobaric oxygen therapy in acute ischemic stroke. Stroke. 2005;36(4):797–802. doi: 10.1161/01.STR.0000158914.66827.2e.
Singhal A.B., Benner T., Roccatagliata L., Koroshetz W.J., Schaefer P.W., Lo E.H. et al. A pilot study of normobaric oxygen therapy in acute ischemic stroke. Stroke. 2005;36(4):797–802. doi: 10.1161/01.STR.0000158914.66827.2e.
39. Landman T.R.J., Schoon Y., Warlé M.C., de Leeuw F-E., Thijssen D.H.J. Remote Ischemic Conditioning as an Additional Treatment for Acute Ischemic Stroke. Stroke. 2019;50(7):1934–1939. doi: 10.1161/STROKEAHA.119.025494.
40. Hess D.C., Blauenfeldt R.A., Andersen G., Hougaard K.D., Hoda M.N., Ding Y., Ji X. Remote ischaemic conditioning-a new paradigm of self-protection in the brain. Nat Rev Neurol. 2015;11(12):698–710. doi: 10.1038/nrneurol.2015.223.
41. Hougaard K.D., Hjort N., Zeidler D., Sørensen L., Nørgaard A., Hansen T.M. et al. Remote ischemic perconditioning as an adjunct therapy to thrombolysis in patients with acute ischemic stroke: a randomized trial. Stroke. 2014;45(1):159–167. doi: 10.1161/STROKEAHA.113.001346.
42. England T. J., Hedstrom A., O’Sullivan S., Donnelly R., Barrett D.A., Sarmad S. et al. RECAST (Remote Ischemic Conditioning After Stroke Trial): a pilot randomized placebo controlled phase II trial in acute ischemic stroke. Stroke. 2017;48(5):1412–1415. doi: 0.1161/STROKEAHA.116.016429.
J., Hedstrom A., O’Sullivan S., Donnelly R., Barrett D.A., Sarmad S. et al. RECAST (Remote Ischemic Conditioning After Stroke Trial): a pilot randomized placebo controlled phase II trial in acute ischemic stroke. Stroke. 2017;48(5):1412–1415. doi: 0.1161/STROKEAHA.116.016429.
43. Meng R., Asmaro K., Meng L., Liu Y., Ma C., Xi C. et al. Upper limb ischemic preconditioning prevents recurrent stroke in intracranial arterial stenosis. Neurology. 2012;79(18):1853–1861. doi: 10.1212/WNL.0b013e318271f76a.
44. Meng R., Ding Y., Asmaro K., Brogan D., Meng L., Sui M. et al. Ischemic conditioning is safe and effective for octo- and nonagenarians in stroke prevention and treatment. Neurotherapeutics. 2015;12:667–677. doi: 10.1007/s13311-015-0358-6.
45. Кулеш А.А., Дробаха В.Е., Шестаков В.В. Церебральная болезнь мелких сосудов: классификация, клинические проявления, диагностика и особенности лечения. Неврология, нейропсихиатрия, психосоматика. 2019;11(3S):4–17. doi: 10.14412/2074-2711-2019-3S-4-17.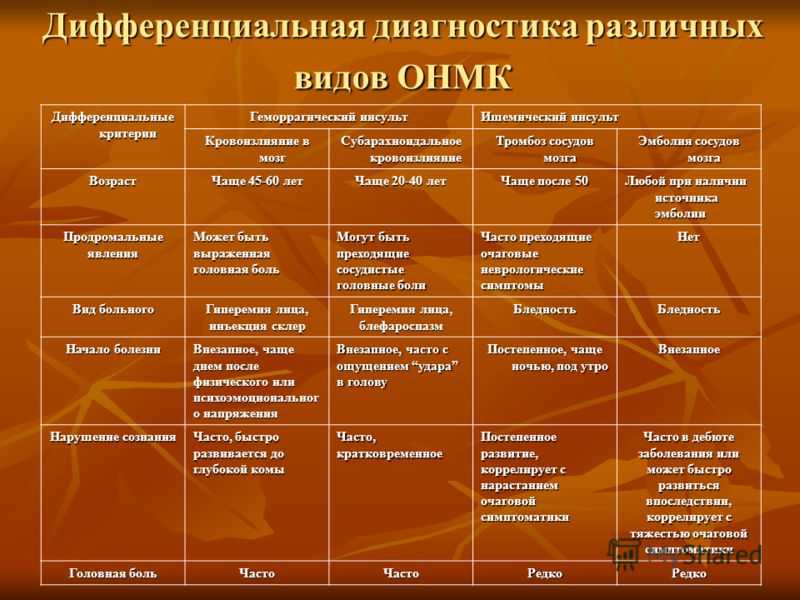
46. Mi T., Yu F., Ji X., Sun Y., Qu D. The interventional effect of remote ischemic preconditioning on cerebral small vessel disease: a pilot randomized clinical trial. Eur Neurol. 2016;76(1–2):28–34. doi: 10.1159/000447536.
47. Wang Y., Meng R., Song H., Liu G., Hua Y., Cui D. et al. Remote ischemic conditioning may improve outcomes of patients with cerebral small-vessel disease. Stroke. 2017;48(11):3064–3072. doi: 0.1161/STROKEAHA.117.017691.
48. Zhao W., Zhang J., Sadowsky M.G., Meng R., Ding Y., Ji X. Remote ischaemic conditioning for preventing and treating ischaemic stroke. Cochrane Database Syst Rev. 2018;7(7):CD012503. doi: 10.1002/14651858.CD012503.pub2.
49. Pico F., Rosso C., Meseguer E., Chadenat M-L., Cattenoy A., Aegerter P. et al. A multicenter, randomized trial on neuroprotection with remote ischemic per-conditioning during acute ischemic stroke: the REmote iSchemic Conditioning in acUtE BRAin INfarction study protocol. Int J Stroke. 2016;11(8):938–943. doi: 10.1177/1747493016660098.
doi: 10.1177/1747493016660098.
50. Kurisu K., Yenari M.A. Therapeutic hypothermia for ischemic stroke; pathophysiology and future promise. Review. Neuropharmacology. 2018;134(B):302–309. doi: 10.1016/j.neuropharm.2017.08.025.
51. Lyden P.D., Allgren R.L., Ng K., Akins P., Meyer B., Al-Sanani F. et al. Intravascular Cooling in the Treatment of Stroke (ICTuS): early clinical experience. J Stroke Cerebrovasc Dis. 2005;14(3):107–114. doi: 10.1016/j.jstrokecerebrovasdis.2005.01.001.
52. Hemmen T.M., Raman R., Guluma K.Z., Meyer B.C., Gomes J.A., Cruz-Flores S. et al. Intravenous thrombolysis plus hypothermia for acute treatment of ischemic stroke (ICTuS-L): final result Results of the ICTuS 2 Trial (Intravascular Cooling in the Treatment of Stroke 2). Therapeutic hypothermia for ischemic stroke; pathophysiology and future promise. Stroke. 2010;41(10):2265–2270. doi: 10.1161/STROKEAHA.110.592295.
53. Bornstein N.M., Saver J.L., Diener H.C., Gorelick P.B., Shuaib A., Solberg Y. et al. Sphenopalatine Ganglion Stimulation to Augment Cerebral Blood Flow. Stroke. 2019;STROKEAHA118024582. doi: 10.1161/STROKEAHA.118.024582.
et al. Sphenopalatine Ganglion Stimulation to Augment Cerebral Blood Flow. Stroke. 2019;STROKEAHA118024582. doi: 10.1161/STROKEAHA.118.024582.
54. Bornstein N.M., Saver J.L., Diener H.C., Gorelick P.B., Shuaib A., Solberg Y. et al. An injectable implant to stimulate the sphenopalatine ganglion for treatment of acute ischaemic stroke up to 24 h from onset (ImpACT 24B): an international, randomised, double-blind, sham controlled, pivotal trial. Lancet. 2019;394(10194):219–229. doi: 10.1016/S0140-6736(19)31192-4.
55. Gutiérrez-Fernández M., Rodríguez-Frutos B., Fuentes B., Vallejo-Cremades M.T., Alvares-Grech J., Expósito-Alcaide M., Díez-Tejedorab E. CDP-choline treatment induces brain plasticity markers expression in experimental animal stroke. Neurochem Int. 2012;60(3):310–317. doi: 10.1016/j.neuint.2011.12.015.
56. Alvarez-Sabín J., Román G.C. The role of citicoline in neuroprotection and neurorepair in ischemic stroke. Brain Sci. 2013;3(3):1395–1414. doi: 10.3390/brainsci3031395.
57. Hurtado O., Cárdenas A., Pradillo, J.M., Morales J.R., Ortego F., Sobrino T. et al. A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimiental stroke. Neurobiol Dis. 2007;26(1):105–111. doi: 10.1016/j.nbd.2006.12.005.
58. Hurtado O., Lizasoain I., Moro M.Á. Neuroprotection and recovery: recent data at the bench on citicoline. Stroke. 2011;42(1):33–35. doi: 10.1161/STROKEAHA.110.597435.
59. Sobrino T., Rodríguez-González R., Blanco M., Brea D., Perez-Mato M., Rodríguez-Yáñez M. et al. CDP-choline treatment increases circulating endotelial progenitor cells in acute ischemic stroke. Neurol Res. 2011;33(6):572–577. doi: 10.1179/016164110X12807570510176.
60. Diederich K., Frauenknecht K., Minnerup J., Schneider B.K., Schmidt A., Altach E. et al. Citicoline enhances neuroregenerative processes after experimental stroke in rats. Stroke. 2012;43(7):1931–1940. doi: 10.1161/STROKEAHA.112.654806.
61. Kuprinski J. , Abudawood M., Matou-Nasri S., Al-Baradie R., Petcu E.B., Justicia C. et al. Citicoline induces angiogenesis improving survival of vascular/human brain microvessel endothelial cells through pathways involving ERK1/2 and insulin receptor substrate-1. Vasc Cell. 2012;4(1):20. doi: 10.1186/2045-824X-4-20.
, Abudawood M., Matou-Nasri S., Al-Baradie R., Petcu E.B., Justicia C. et al. Citicoline induces angiogenesis improving survival of vascular/human brain microvessel endothelial cells through pathways involving ERK1/2 and insulin receptor substrate-1. Vasc Cell. 2012;4(1):20. doi: 10.1186/2045-824X-4-20.
62. Bramanti V., Campisi A., Tomassoni D., Li Volti G., Caccamo D., Gannavó G. et al. Effect of acetylcholine precursors on proliferation and differentiation of astroglial cells in primary cultures. Neurochem Res. 2008;33(12):2601–2608. doi: 10.1007/s11064-008-9829-z.
63. Clark W., Warach S., Pettigrew L., Gammans R.E., Sabounjian L.A. A randomized dose-response trial of citicoline in acute ischemic stroke patients. Neurology. 1997;49(3):671–678. doi: 10.1212/wnl.49.3.671.
64. Clark W., Wechsler L., Sabounjian L., Schwiderski U. A phase III randomized efficacy trial of 2000 mg citicoline in acute ischemic stroke patients. Neurology. 2001;57(9):1595–1602. doi: 10.1212/wnl. 57.9.1595.
57.9.1595.
65. Clark W., Williams B., Selzer K., Zweifler R.M., Sabounjian L.A., Gammans R.E. A Randomized Efficacy Trial of Citicoline in Patients With Acute Ischemic Stroke. Stroke. 1999;30(12):2592–2597. doi: 10.1161/01.str.30.12.2592.
66. Dávalos A., Castillo J., Alvarez-Sabín J., Secades J.J., Mercadal J., López S. et al. Oral citicoline in acute ischemic stroke: an individual patient data pooling analysis of clinical trials. Stroke. 2002;33(12):2850–2857. doi: 10.1161/01.str.0000038691.03334.71.
67. Saver J.L. Citicoline: update on a promising and widely available agent for neuroprotection and neurorepair. Rev Neurol Dis. 2008;5(4):167–177. Available at: https://www.ncbi.nlm.nih.gov/pubmed/19122569.
68. Dávalos A., Alvarez-Sabín J., Castillo J., Diez-Tejedor E., Ferro J., Martínez-Vila E. et al. International Citicoline Trial on acUte Stroke (ICTUS) trial investigators. Citicoline in the treatment of acute ischaemic stroke: an international, randomised, multicentre, placebo-controlled study (ICTUS trial). Lancet. 2012;380(9839):349–357. doi: 10.1016/S0140-6736(12)60813-7.
Lancet. 2012;380(9839):349–357. doi: 10.1016/S0140-6736(12)60813-7.
69. Сергеев Д.В., Домашенко М.А., Пирадов М.А. Фармакологическая нейропротекция при ишемическом инсульте в реальных клинических условиях. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(4):86–91. doi: 10.17116/jnevro20171174186-91.
70. Secades J.J., Alvarez-Sabín J., Castillo J., Diez-Tejedor E., Martinez-Vila E., Rios J., Oudovenko N. Citicoline for Acute Ischemic Stroke: A Systematic Review and Formal Meta-analysis of Randomized, Double-Blind, and Placebo-Controlled Trials. J Stroke Cerebrovasc Dis. 2016;25(8):1984–1996. doi: 10.1016/j.jstrokecerebrovasdis.2016.04.010.
71. Скворцова В.И., Шетова И.М., Какорина Е.П., Камкин Е.Г., Бойко Е.Л., Дашьян В.Г., Крылов В.В. Организация помощи пациентам с инсультом в России. Итоги 10 лет реализации Комплекса мероприятий по совершенствованию медицинской помощи пациентам с острыми нарушениями мозгового кровообращения. Анналы клинической и экспериментальной неврологии. 2018;12(3):5–12. doi: 10.25692/ACEN.2018.3.1.
2018;12(3):5–12. doi: 10.25692/ACEN.2018.3.1.
72. Alvarez-Sabín J., Santamarina E., Maisterra O., Jacas C., Molina C., Quintana M. Long-Term Treatment with Citicoline Prevents Cognitive Decline and Predicts a Better Quality of Life after a First Ischemic Stroke. Int J Mol Sci. 2016;17(3):390. doi: 10.3390/ijms17030390.
Магнитно-резонансная томография при лечении острого ишемического инсульта
1. Исследовательская группа по изучению инсульта Национального института неврологических расстройств и инсульта rt-PA. Тканевый активатор плазминогена при остром ишемическом инсульте. N Engl J Med 1995;333:1581-1587. PMID: 7477192.
2. Hacke W, Kaste M, Bluhmki E, Brozman M, Davalos A, Guidetti D, et al. Тромболизис альтеплазой через 3-4,5 часа после острого ишемического инсульта. N Engl J Med 2008;359:1317-1329. PMID: 18815396.
3. Khatri R, McKinney AM, Swenson B, Janardhan V. Гематоэнцефалический барьер, реперфузионное повреждение и геморрагическая трансформация при остром ишемическом инсульте. Неврология 2012;79:S52-S57. PMID: 23008413.
Khatri R, McKinney AM, Swenson B, Janardhan V. Гематоэнцефалический барьер, реперфузионное повреждение и геморрагическая трансформация при остром ишемическом инсульте. Неврология 2012;79:S52-S57. PMID: 23008413.
4. Baird AE, Warach S. Магнитно-резонансная томография острого инсульта. J Cereb Blood Flow Metab 1998;18:583-609. PMID: 9626183.
5. Campbell BC, Tu HT, Christensen S, Desmond PM, Levi CR, Bladin CF, et al. Оценка реакции на тромболизис при инсульте: валидация 24-часовой мультимодальной магнитно-резонансной томографии. Arch Neurol 2012;69:46-50. PMID: 21911654.
6. Lovblad KO, Laubach HJ, Baird AE, Curtin F, Schlaug G, Edelman RR, et al. Клинический опыт диффузионно-взвешенной МРТ у пациентов с острым инсультом. Am J Neuroradiol 1998;19:1061-1066. PMID: 9672012.
7. Chalela JA, Kang DW, Luby M, Ezzeddine M, Latour LL, Todd JW, et al. Ранние результаты магнитно-резонансной томографии у пациентов, получающих тканевый активатор плазминогена, предсказывают исход: Взгляд на патофизиологию острого инсульта в эпоху тромболизиса. Энн Нейрол 2004;55:105-112. PMID: 14705118.
Chalela JA, Kang DW, Luby M, Ezzeddine M, Latour LL, Todd JW, et al. Ранние результаты магнитно-резонансной томографии у пациентов, получающих тканевый активатор плазминогена, предсказывают исход: Взгляд на патофизиологию острого инсульта в эпоху тромболизиса. Энн Нейрол 2004;55:105-112. PMID: 14705118.
8. Schlaug G, Benfield A, Baird AE, Siewert B, Lovblad KO, Parker RA, et al. Ишемическая полутень: оперативно определяется с помощью диффузионной и перфузионной МРТ. Неврология 1999;53:1528-1537. PMID: 10534263.
9. Thomalla G, Cheng B, Ebinger M, Hao Q, Tourdias T, Wu O, et al. Несоответствие DWI-FLAIR для выявления пациентов с острым ишемическим инсультом в течение 4,5 часов после появления симптомов (PRE-FLAIR): многоцентровое обсервационное исследование. Ланцет Нейрол 2011;10:978-986. PMID: 21978972.
10. Neumann-Haefelin T, Wittsack HJ, Wenserski F, Siebler M, Seitz RJ, Modder U, et al. Диффузионно- и перфузионно-взвешенная МРТ. Область несоответствия DWI/PWI при остром инсульте. Ход 1999;30:1591-1597. PMID: 10436106.
Neumann-Haefelin T, Wittsack HJ, Wenserski F, Siebler M, Seitz RJ, Modder U, et al. Диффузионно- и перфузионно-взвешенная МРТ. Область несоответствия DWI/PWI при остром инсульте. Ход 1999;30:1591-1597. PMID: 10436106.
11. Гибсон Л.М., Уайтли В. Дифференциальный диагноз при подозрении на инсульт: систематический обзор. JR Coll Physicians Edinb 2013;43:114-118. PMID: 23734351.
12. Варах С., Гаа Дж., Зиверт Б., Велопольски П., Эдельман Р.Р. Острый инсульт у человека изучался с помощью планарной диффузионно-взвешенной магнитно-резонансной томографии всего мозга. Энн Нейрол 1995;37:231-241. PMID: 7847864.
13. Силая П.Н., Куттс С.Б., Крол А., Хилл М.Д., Демчук А.М. ВИДЕНИЕ Исследовательская группа. Когда ожидать отрицательных диффузионно-взвешенных изображений при инсульте и транзиторной ишемической атаке. Ход 2008;39:1898-1900. PMID: 18420957.
Ход 2008;39:1898-1900. PMID: 18420957.
14. Балами Дж.С., Чен Р.Л., Бьюкен А.М. Синдромы инсульта и клиническое ведение. QJM 2013;106:607-615. PMID: 23483140.
15. Kallenberg K, Schulz-Schaeffer WJ, Jastrow U, Poser S, Meissner B, Tschampa HJ, et al. Болезнь Крейтцфельдта-Якоба: сравнительный анализ последовательностей МРТ. Am J Neuroradiol 2006; 27:1459-1462. PMID: 16908558.
16. Bergui M, Bradac GB, Oguz KK, Boghi A, Geda C, Gatti G, et al. Прогрессирующая многоочаговая лейкоэнцефалопатия: диффузионно-взвешенная визуализация и патологические корреляции. Нейрорадиология 2004;46:22-25. PMID: 14593446.
17. Kang DW, Chalela JA, Ezzeddine MA, Warach S. Ассоциация паттернов ишемического поражения на ранней диффузионно-взвешенной визуализации с подтипами инсульта TOAST. Arch Neurol 2003;60:1730-1734. PMID: 14676047.
Arch Neurol 2003;60:1730-1734. PMID: 14676047.
18. Lee DK, Kim JS, Kwon SU, Yoo SH, Kang DW. Паттерны поражения и механизм инсульта при атеросклеротическом поражении средней мозговой артерии: исследование ранней диффузионно-взвешенной визуализации. Ход 2005;36:2583-2588. PMID: 16269637.
19. Bang OY. Внутричерепной атеросклероз: современное понимание и перспективы. Дж Ход 2014;16:27-35. PMID: 24741562.
20. Nah HW, Kang DW, Kwon SU, Kim JS. Разнообразие одиночных мелких подкорковых инфарктов в зависимости от локализации инфаркта и заболевания исходной артерии: анализ показателей поражения мелких сосудов и атеросклероза. Ход 2010;41:2822-2827. PMID: 20966406.
21. Чо А.Х., Ким Дж.С., Чон С.Б., Квон Су, Ли Д.Х., Канг Д.В. Механизм множественных инфарктов при множественном мозговом кровообращении на диффузионно-взвешенной визуализации. J Neurol 2007; 254:924-930. PMID: 17401747.
J Neurol 2007; 254:924-930. PMID: 17401747.
22. Jung JM, Kwon SU, Lee JH, Kang DW. Различия в объеме и характере инфаркта между кардиоэмболией и заболеванием внутренней сонной артерии: внимание к степени кардиоэмболического риска и каротидного стеноза. Цереброваск дис 2010;29: 490-496. PMID: 20299789.
23. Cho KH, Lee DH, Kwon SU, Choi CG, Kim SJ, Suh DC, et al. Факторы и исходы, связанные со сроками реканализации после тромболизиса. Cerebrovasc Dis 2012;33:255-261. PMID: 22261742.
24. Чо А.Х., Квон СУ, Ким Дж.С., Канг Д.В. Оценка ранних динамических изменений окклюзии внутричерепных артерий полезна для диагностики этиологии инсульта. J Neurol Sci 2012; 312:127-130. PMID: 21872274.
25. Чо К.Х., Ким Дж.С., Квон СУ, Чо А.Х., Канг Д.В. Значение признака восприимчивости сосудов на Т2*-взвешенном градиентном эхо-визуализации для идентификации подтипов инсульта. Ход 2005;36:2379-2383. PMID: 16224077.
Ход 2005;36:2379-2383. PMID: 16224077.
26. Kim BJ, Sohn H, Sun BJ, Song JK, Kang DW, Kim JS и др. Визуализационные характеристики ишемических инсультов, связанных с открытым овальным окном. Ход 2013;44:3350-3356. PMID: 24072002.
27. Jung JM, Kwon JY, Kim HJ, Kwon SU, Song JK, Kim JS, et al. Бремя ишемического поражения и характеристика атеромы аорты. J Инсульт Цереброваск Dis 2014;23:278-282. PMID: 23498373.
28. Kim YS, Park SS, Bae HJ, Heo JH, Kwon SU, Lee BC, et al. Осведомленность населения об инсульте в Корее: национальный опрос населения. Ход 2012;43:1146-1149. PMID: 22156687.
29. Dirnagl U, Iadecola C, Moskowitz MA. Патобиология ишемического инсульта: комплексный взгляд. Trends Neurosci 1999;22:391-397. PMID: 10441299.
30. Банерджи Р.К., Бэк Л.Х., Бэк М.Р., Чо Ю.И. Анализ физиологического потока при значительных стенозах коронарных артерий человека. Биореология 2003;40:451-476. PMID: 12775911.
Банерджи Р.К., Бэк Л.Х., Бэк М.Р., Чо Ю.И. Анализ физиологического потока при значительных стенозах коронарных артерий человека. Биореология 2003;40:451-476. PMID: 12775911.
31. Tatlisumak T, Strbian D, Abo Ramadan U, Li F. Роль диффузионно- и перфузионно-взвешенной магнитно-резонансной томографии в разработке лекарств для лечения ишемического инсульта: от лаборатории до клиники. Curr Vasc Pharmacol 2004; 2:343-355. PMID: 15320814.
32. Джанг Г.Х., Ким Х.С., Ким С.М., Рю К.В. Принципы и технические аспекты перфузионной магнитно-резонансной томографии. J Корейский Soc Magn Reson Med 2011;15:91-101.
33. Хо С.Х., Сео Дж.Дж., Йим Н.Ю., Чон Г.В., Юн В., Ким Ю.Х. Острый инфаркт головного мозга на модели кролика: перфузионная и диффузионная МРТ. J Korean Soc Magn Reson Med 2003;7:116-123.
34. Чон Х.В., Кан Дж.Х., Ли С.И., Ли Ю.С., Кан М.Дж., Ча Дж.К. Может ли несоответствие диффузии и перфузии на МРТ головного мозга у пациентов с острым ишемическим инсультом предсказать клинический исход? Предварительное исследование сосредоточено на rCBV. J Korean Neurol Assoc 2008; 26:295-300.
Чон Х.В., Кан Дж.Х., Ли С.И., Ли Ю.С., Кан М.Дж., Ча Дж.К. Может ли несоответствие диффузии и перфузии на МРТ головного мозга у пациентов с острым ишемическим инсультом предсказать клинический исход? Предварительное исследование сосредоточено на rCBV. J Korean Neurol Assoc 2008; 26:295-300.
35. Copen WA, Schaefer PW, Wu O. МРТ-визуализация перфузии при остром ишемическом инсульте. Neuroimaging Clin N Am 2011;21:259-283. PMID: 21640299.
36. Albers GW, Thijs VN, Wechsler L, Kemp S, Schlaug G, Skalabrin E, et al. Профили магнитно-резонансной томографии предсказывают клинический ответ на раннюю реперфузию: исследование диффузионной и перфузионной визуализации для понимания эволюции инсульта (DEFUSE). Энн Нейрол 2006;60:508-517. PMID: 17066483.
37. Доннан Г.А., Барон Дж.К., Ма Х., Дэвис С.М. Полутеневой отбор пациентов для испытаний терапии острого инсульта. Ланцет Нейрол 2009;8:261-269. PMID: 19233036.
Ланцет Нейрол 2009;8:261-269. PMID: 19233036.
38. Olivot JM, Mlynash M, Thijs VN, Kemp S, Lansberg MG, Wechsler L, et al. Оптимальный порог Tmax для прогнозирования ткани полутени при остром инсульте. Ход 2009;40:469-475. PMID: 19109547.
39. Nagakane Y, Christensen S, Ogata T, Churilov L, Ma H, Parsons MW, et al. Выход за пределы одного порога перфузии для определения полутени: новое определение вероятностного несоответствия. Инсульт 2012;43:1548-1555. PMID: 22499579.
40. Albers GW, Thijs VN, Wechsler L, Kemp S, Schlaug G, Skalabrin E, et al. Профили магнитно-резонансной томографии предсказывают клинический ответ на раннюю реперфузию: исследование диффузионной и перфузионной визуализации для понимания эволюции инсульта (DEFUSE). Энн Нейрол 2006;60:508-517. PMID: 17066483.
41. Davis SM, Donnan GA, Parsons MW, Levi C, Butcher KS, Peeters A, et al. Эффекты альтеплазы через 3 часа после инсульта в исследовании Echoplanar Imaging Thrombolitic Evaluation Trial (EPITHET): плацебо-контролируемое рандомизированное исследование. Ланцет Нейрол 2008;7:299-309. PMID: 18296121.
Davis SM, Donnan GA, Parsons MW, Levi C, Butcher KS, Peeters A, et al. Эффекты альтеплазы через 3 часа после инсульта в исследовании Echoplanar Imaging Thrombolitic Evaluation Trial (EPITHET): плацебо-контролируемое рандомизированное исследование. Ланцет Нейрол 2008;7:299-309. PMID: 18296121.
42. Hacke W, Albers G, Al-Rawi Y, Bogousslavsky J, Davalos A, Eliasziw M, et al. Испытание десмотеплазы при остром ишемическом инсульте (DIAS): исследование II фазы на основе МРТ с 9-часовым окном тромболизиса острого инсульта с внутривенным введением десмотеплазы. Инсульт 2005;36:66-73. PMID: 15569863.
43. Kimura K, Iguchi Y, Shibazaki K, Kobayashi K, Uemura J, Aoki J, et al. Реканализация между 1 и 24 часами после терапии t-PA является сильным предиктором кровоизлияния в мозг у пациентов с острым ишемическим инсультом. J Neurol Sci 2008; 270:48-52. PMID: 18304581.
44. Фишер М., Адамс Р.Д. Наблюдения за эмболией головного мозга с особым упором на механизм геморрагического инфаркта. J Neuropathol Exp Neurol 1951;10:92-94. PMID: 14804137.
45. Ogata J, Yutani C, Imakita M, Ishibashi-Ueda H, Saku Y, Minematsu K, et al. Геморрагический инфаркт головного мозга без вскрытия окклюзированных артерий при кардиоэмболическом инсульте. Инсульт 1989; 20:876-883. PMID: 2749848.
46. Simard JM, Kent TA, Chen M, Tarasov KV, Gerzanich V. Отек головного мозга при фокальной ишемии: молекулярная патофизиология и теоретические последствия. Ланцет Нейрол 2007;6:258-268. PMID: 17303532.
47. Бургграф Д., Мартенс Х.К., Ягер Г., Хаманн Г.Ф. Рекомбинантный тканевой активатор плазминогена человека защищает базальную пластинку при экспериментальной очаговой ишемии головного мозга. Тромб Хемост 2003;89:1072-1080. PMID: 12783121.
Тромб Хемост 2003;89:1072-1080. PMID: 12783121.
48. Варах С., Латур Л.Л. Доказательства реперфузионного повреждения, усугубленного тромболитической терапией, при фокальной ишемии головного мозга человека с использованием нового визуализирующего маркера раннего нарушения гематоэнцефалического барьера. Ход 2004;35:2659-2661. PMID: 15472105.
49. Hacke W, Kaste M, Fieschi C, von Kummer R, Davalos A, Meier D, et al. Исследователи второго европейско-австралазийского исследования острого инсульта. Рандомизированное двойное слепое плацебо-контролируемое исследование тромболитической терапии внутривенной альтеплазой при остром ишемическом инсульте (ECASS II). Ланцет 1998;352:1245-1251. PMID: 9788453.
50. Альварес-Сабин Дж., Майстерра О., Сантамарина Э., Касе К.С. Факторы, влияющие на геморрагическую трансформацию при ишемическом инсульте. Ланцет Нейрол 2013;12:689-705. PMID: 23726850.
Ланцет Нейрол 2013;12:689-705. PMID: 23726850.
51. Группа по изучению инсульта NINDS t-PA. Внутримозговое кровоизлияние после внутривенной терапии t-PA по поводу ишемического инсульта. Ход 1997;28:2109-2118. PMID: 9368550.
52. Molina CA, Montaner J, Abilleira S, Ibarra B, Romero F, Arenillas JF, et al. Сроки спонтанной реканализации и риск геморрагической трансформации при остром кардиоэмболическом инсульте. Ход 2001;32:1079-1084. PMID: 11340213.
53. Бутчер К., Кристенсен С., Парсонс М., Де Сильва Д.А., Эбингер М., Леви С. и соавт. Посттромболизисное повышение артериального давления связано с геморрагической трансформацией. Инсульт 2010;41:72-77. PMID: 19926841.
54. Selim M, Fink JN, Kumar S, Caplan LR, Horkan C, Chen Y, et al. Предикторы геморрагической трансформации после внутривенного введения рекомбинантного тканевого активатора плазминогена: прогностическое значение исходного кажущегося коэффициента диффузии и диффузионно-взвешенного объема поражения. Инсульт 2002;33:2047-2052. PMID: 12154261.
Инсульт 2002;33:2047-2052. PMID: 12154261.
55. Adams HP Jr, del Zoppo G, Alberts MJ, Bhatt DL, Brass L, Furlan A, et al. Рекомендации по раннему лечению взрослых с ишемическим инсультом: рекомендации Совета по инсульту Американской кардиологической ассоциации/Американской ассоциации инсульта, Совета по клинической кардиологии, Совета по сердечно-сосудистой радиологии и интервенционным вмешательствам, а также результатов исследования атеросклеротических заболеваний периферических сосудов и качества медицинской помощи в междисциплинарной исследовательской работе Группы: Американская академия неврологии подтверждает ценность этого руководства как учебного пособия для неврологов. Инсульт 2007;38:1655-1711. PMID: 17431204.
56. Grotta JC, Chiu D, Lu M, Patel S, Levine SR, Tilley BC, et al. Согласие и вариабельность в интерпретации ранних изменений КТ у пациентов с инсультом, которым была назначена внутривенная терапия rtPA. Ход 1999;30:1528-1533. PMID: 10436095.
Ход 1999;30:1528-1533. PMID: 10436095.
57. Олсоп Д.К., Маковецкая Э., Кумар С., Селим М., Шлауг Г. Заметно сниженный кажущийся объем крови на болюсно-контрастной магнитно-резонансной томографии как предиктор кровотечения после тромболитической терапии острого ишемического инсульта. Ход 2005;36:746-750. PMID: 15746457.
58. Cho AH, Kim JS, Kim SJ, Yun SC, Choi CG, Kim HR, et al. Фокальная гиперинтенсивность восстановления инверсии, ослабленная жидкостью, в острых диффузионно-взвешенных поражениях связана с симптоматическим внутримозговым кровоизлиянием после тромболизиса. Ход 2008;39:3424-3426. PMID: 18772449.
59. Kidwell CS, Saver JL, Villablanca JP, Duckwiler G, Fredieu A, Gough K, et al. Обнаружение микрокровоизлияний с помощью магнитно-резонансной томографии перед тромболизисом: новое применение. Инсульт 2002;33:95-98. PMID: 11779895.
PMID: 11779895.
60. Koennecke HC. Церебральные микрокровоизлияния на МРТ: распространенность, ассоциации и потенциальные клинические последствия. Неврология 2006;66:165-171. PMID: 16434647.
61. Thomalla G, Sobesky J, Kohrmann M, Fiebach JB, Fiehler J, Zaro Weber O, et al. Две истории: геморрагическая трансформация, а не паренхиматозное кровотечение после тромболизиса связано с тяжестью и продолжительностью ишемии: МРТ-исследование пациентов с острым инсультом, получавших внутривенное введение тканевого активатора плазминогена в течение 6 часов. Инсульт 2007;38:313-318. PMID: 17204683.
62. Neumann-Haefelin C, Brinker G, Uhlenkuken U, Pillekamp F, Hossmann KA, Hoehn M. Прогнозирование геморрагической трансформации после тромболитической терапии тромбоэмболии: МРТ головного мозга крыс. Ход 2002;33:1392-1398. PMID: 11988620.
PMID: 11988620.
63. Cho AH, Cho YP, Lee DH, Kwon TW, Kwon SU, Suh DC, et al. Реперфузионное повреждение на магнитно-резонансной томографии после реваскуляризации сонных артерий. Ход 2014;45:602-604. PMID: 24347424.
64. Cho AH, Suh DC, Kim GE, Kim JS, Lee DH, Kwon SU, et al. МРТ свидетельствует о реперфузионном повреждении, связанном с неврологическим дефицитом после процедур реваскуляризации сонных артерий. Eur J Neurol 2009;16:1066-1069. PMID: 19486141.
65. Latour LL, Kang DW, Ezzeddine MA, Chalela JA, Warach S. Раннее нарушение гематоэнцефалического барьера при очаговой ишемии головного мозга человека. Энн Нейрол 2004;56:468-477. PMID: 15389899.
66. Ким Э.Ю., Ким С.С., На Д.Г., Ро Х.Г., Рю Дж.В., Ким Х.К. Гиперинтенсивность борозд на инверсионно-восстановительной визуализации с ослаблением жидкости у пациентов с острым ишемическим инсультом, получавших внутриартериальный тромболизис: йодсодержащие контрастные вещества как возможная причина и связь с геморрагической трансформацией. J Comput Assist Tomogr 2005; 29: 264-269. PMID: 15772550.
J Comput Assist Tomogr 2005; 29: 264-269. PMID: 15772550.
67. Hjort N, Wu O, Ashkanian M, Solling C, Mouridsen K, Christensen S, et al. МРТ-выявление раннего нарушения гематоэнцефалического барьера: усиление паренхимы предсказывает очаговую геморрагическую трансформацию после тромболизиса. Ход 2008;39:1025-1028. PMID: 18258832.
68. Bang OY, Buck BH, Saver JL, Alger JR, Yoon SR, Starkman S, et al. Прогнозирование геморрагической трансформации после реканализации с помощью магнитно-резонансной томографии с Т2*-проницаемостью. Энн Нейрол 2007;62:170-176. PMID: 17683090.
69. Molina CA, Montaner J, Arenillas JF, Ribo M, Rubiera M, Alvarez-Sabin J. Дифференциальный характер реканализации проксимального отдела средней мозговой артерии, вызванной активатором плазминогена, среди подтипов инсульта. Ход 2004;35:486-490. PMID: 14707233.
PMID: 14707233.
70. Kimura K, Iguchi Y, Shibazaki K, Watanabe M, Iwanaga T, Aoki J. Признак восприимчивости сосуда M1 на T2 * как сильный предиктор отсутствия ранней реканализации после IV-t-PA в острый ишемический инсульт. Ход 2009;40:3130-3132. PMID: 19556532.
71. Riedel CH, Jensen U, Rohr A, Tietke M, Alfke K, Ulmer S, et al. Оценка тромба при острой окклюзии средней мозговой артерии с использованием реконструкций тонкослойной компьютерной томографии без усиления. Инсульт 2010;41:1659-1664. PMID: 20595670.
72. Riedel CH, Zimmermann P, Jensen-Kondering U, Stingele R, Deuschl G, Jansen O. Важность размера: успешная реканализация с помощью внутривенного тромболизиса при остром переднем инсульте зависит от длины тромба. Ход 2011;42:1775-1777. PMID: 21474810.
73. Zhu L, Liebeskind DS, Jahan R, Starkman S, Salamon N, Duckwiler G, et al. Ветвление тромба и кривизна сосуда являются важными факторами, определяющими реканализацию ствола средней мозговой артерии с помощью устройств для тромбэктомии Мерси. Инсульт 2012;43:787-792. PMID: 22282888.
Zhu L, Liebeskind DS, Jahan R, Starkman S, Salamon N, Duckwiler G, et al. Ветвление тромба и кривизна сосуда являются важными факторами, определяющими реканализацию ствола средней мозговой артерии с помощью устройств для тромбэктомии Мерси. Инсульт 2012;43:787-792. PMID: 22282888.
74. Канг Д.В., Квон Дж.И., Квон СУ, Ким Дж.С. Пробуждение или инсульт с неясным началом: пробуждаются ли они в мире тромболизисной терапии? Int J Stroke 2012;7:311-320. PMID: 22510216.
75. Thomalla G, Gerloff C. Мы на часах: МРТ как суррогатный маркер возраста поражения при остром ишемическом инсульте. Ход 2010;41:197-198. PMID: 20035067.
76. Burdette JH, Ricci PE, Petitti N, Elster AD. Церебральный инфаркт: изменение интенсивности сигнала во времени на диффузионно-взвешенных МРТ-изображениях. AJR Am J Roentgenol 1998;171:791-795. PMID: 9725318.
PMID: 9725318.
77. Thomalla G, Rossbach P, Rosenkranz M, Siemonsen S, Krutzelmann A, Fiehler J, et al. Отрицательная визуализация инверсионного восстановления с ослаблением жидкости позволяет выявить острый ишемический инсульт через 3 часа или менее. Энн Нейрол 2009;65:724-732. PMID: 19557859.
78. Kim BJ, Kim HJ, Lee DH, Kwon SU, Kim SJ, Kim JS и др. Несоответствие диффузионно-взвешенного изображения и изображения восстановления инверсии с ослаблением жидкости: инсульт с нечетким началом и инсульт с четким началом. Ход 2014;45:450-455. PMID: 24347423.
79. Kang DW, Sohn SI, Hong KS, Yu KH, Hwang YH, Han MK, et al. Реперфузионная терапия при инсульте с неясным началом на основе МРТ-оценки (ВОССТАНОВЛЕНИЕ): проспективное многоцентровое исследование. Ход 2012;43:3278-3283. PMID: 23093613.
80. Dankbaar JW, Hom J, Schneider T, Cheng SC, Lau BC, van der Schaaf I, et al. Возрастные и анатомические значения проницаемости гематоэнцефалического барьера, измеренные с помощью перфузионной КТ у пациентов без инсульта. J Нейрорадиол 2009;36:219-227. PMID: 19251320.
Dankbaar JW, Hom J, Schneider T, Cheng SC, Lau BC, van der Schaaf I, et al. Возрастные и анатомические значения проницаемости гематоэнцефалического барьера, измеренные с помощью перфузионной КТ у пациентов без инсульта. J Нейрорадиол 2009;36:219-227. PMID: 19251320.
81. Galinovic I, Puig J, Neeb L, Guibernau J, Kemmling A, Siemonsen S, et al. Согласие между экспертами, основанное на визуальном представлении и области интереса, при оценке несоответствия восстановления инверсии, взвешенной по диффузии, ослабленной жидкостью и инверсии. Ход 2014;45:1170-1172. PMID: 24558091.
82. Kim BJ, Kim YH, Kim YJ, Ahn SH, Lee DH, Kwon SU, et al. Изображения FLAIR с цветовой кодировкой улучшают достоверность изменений сигнала FLAIR при острых поражениях DWI. Ход 2014;45:2801-2804. PMID: 25082806.
83. Барбер П.А., Чжан Дж. , Демчук А.М., Хилл М.Д., Бьюкен А.М. Почему пациенты с инсультом исключены из терапии ТРА? Анализ пригодности пациентов. Неврология 2001;56:1015-1020. PMID: 11320171.
, Демчук А.М., Хилл М.Д., Бьюкен А.М. Почему пациенты с инсультом исключены из терапии ТРА? Анализ пригодности пациентов. Неврология 2001;56:1015-1020. PMID: 11320171.
84. Nedeltchev K, Schwegler B, Haefeli T, Brekenfeld C, Gralla J, Fischer U, et al. Исход инсульта с легкими или быстро улучшающимися симптомами. Ход 2007;38:2531-2535. PMID: 17673713.
85. Ким Дж.Т., Парк М.С., Ким М.К., Чо К.Х. Малый инсульт с полным несоответствием после острой окклюзии СМА. J Neuroimaging 2011;21:399-402. PMID: 21223430.
86. Breuer L, Blinzler C, Huttner HB, Kiphuth IC, Schwab S, Kohrmann M. Тромболизис вне показаний при остром ишемическом инсульте: частота, клинический исход и безопасность зависят от определения « малый инсульт». Cerebrovasc Dis 2011;32:177-185. PMID: 21849777.
87. Kohrmann M, Nowe T, Huttner HB, Engelhorn T, Struffert T, Kollmar R, et al. Безопасность и исход после тромболизиса у пациентов с инсультом с легкими симптомами. Cerebrovasc Dis 2009; 27:160-166. PMID: 19092237.
Kohrmann M, Nowe T, Huttner HB, Engelhorn T, Struffert T, Kollmar R, et al. Безопасность и исход после тромболизиса у пациентов с инсультом с легкими симптомами. Cerebrovasc Dis 2009; 27:160-166. PMID: 19092237.
88. Kim JT, Yoon GJ, Nam TS, Choi SM, Lee SH, Park MS, et al. Поражение внутренних пограничных зон как предиктор раннего неврологического ухудшения у пациентов с легким инсультом и тяжелой стеноокклюзией артерий. J Neuroimaging 2011;21:173-176. PMID: 20040013.
89. Johnston KC, Wagner DP, Wang XQ, Newman GC, Thijs V, Sen S, et al. Валидация модели острого ишемического инсульта: дает ли диффузионно-взвешенная визуализация объема поражения клинически значимое улучшение в прогнозировании исхода? Ход 2007;38:1820-1825. PMID: 17446421.
90. Parsons MW, Barber PA, Chalk J, Darby DG, Rose S, Desmond PM, et al. Диффузионно- и перфузионно-взвешенный ответ МРТ на тромболизис при инсульте. Энн Нейрол 2002;51:28-37. PMID: 11782981.
Диффузионно- и перфузионно-взвешенный ответ МРТ на тромболизис при инсульте. Энн Нейрол 2002;51:28-37. PMID: 11782981.
91. Lansberg MG, Straka M, Kemp S, Mlynash M, Wechsler LR, Jovin TG, et al. Профиль МРТ и реакция на эндоваскулярную реперфузию после инсульта (DEFUSE 2): проспективное когортное исследование. Ланцет Нейрол 2012;11:860-867. PMID: 22954705.
92. Khatri P, Neff J, Broderick JP, Khoury JC, Carrozzella J, Tomsick T. Конечные точки реваскуляризации в интервенционных исследованиях инсульта: реканализация по сравнению с реперфузией в IMS-I. Ход 2005;36:2400-2403. PMID: 16224088.
93. Исследовательская группа TIMI. Тромболизис при инфаркте миокарда (TIMI). Выводы I фазы. N Engl J Med 1985;312:932-936. PMID: 4038784.
94. Furlan A, Higashida R, Wechsler L, Gent M, Rowley H, Kase C, et al. Внутриартериальная проурокиназа при остром ишемическом инсульте. Исследование PROACT II: рандомизированное контролируемое исследование. Prolyse при острой церебральной тромбоэмболии. ЯМА 1999;282:2003-2011. PMID: 10591382.
Внутриартериальная проурокиназа при остром ишемическом инсульте. Исследование PROACT II: рандомизированное контролируемое исследование. Prolyse при острой церебральной тромбоэмболии. ЯМА 1999;282:2003-2011. PMID: 10591382.
95. Marks MP, Lansberg MG, Mlynash M, Olivot JM, Straka M, Kemp S, et al. Влияние коллатерального кровотока на пациентов, перенесших эндоваскулярную терапию по поводу острого ишемического инсульта. Ход 2014;45:1035-1039. PMID: 24569816.
96. Чо К.Х., Квон С.У., Ли Д.Х., Шим В., Чой С., Ким С.Дж. и др. Ранний рост инфаркта предсказывает долгосрочный клинический исход после тромболизиса. J Neurol Sci 2012;316:99-103. PMID: 22326365.
97. Marks MP, Lansberg MG, Mlynash M, Kemp S, McTaggart R, Zaharchuk G, et al. Корреляция реканализации AOL, реперфузии TIMI и реперфузии TICI с ростом инфаркта и клиническим исходом. J Neurointerv Surg 2013.
J Neurointerv Surg 2013.
98. Singer OC, Sitzer M, du Mesnil de Rochemont R, Neumann-Haefelin T. Практические ограничения МРТ острого инсульта из-за проблем, связанных с пациентом. Неврология 2004;62:1848-1849. PMID: 15159492.
99. Yoo SH, Kwon SU, Lee DH, Kim SJ, Kim JS, Kang DW. Сравнение скрининга МРТ и скрининга КТ плюс МРТ на предмет тромболизиса в течение 3 часов после ишемического инсульта. J Neurol Sci 2010; 294:119-123. PMID: 20441993.
100. Chalela JA, Kidwell CS, Nentwich LM, Luby M, Butman JA, Demchuk AM, et al. Магнитно-резонансная томография и компьютерная томография при неотложной оценке пациентов с подозрением на острый инсульт: проспективное сравнение. Ланцет 2007;369: 293-298. PMID: 17258669.
101. Мерино Дж. Г., Варах С. Визуализация острого инсульта. Nat Rev Neurol 2010;6:560-571. PMID: 20842186.
Nat Rev Neurol 2010;6:560-571. PMID: 20842186.
102. Kang DW, Chalela JA, Dunn W, Warach S. Исследователи пригородного инсультного центра NIH. МРТ-скрининг перед стандартной терапией тканевым активатором плазминогена возможен и безопасен. Инсульт 2005;36:1939-1943. PMID: 16081864.
103. Наэль К., Хан Р., Чоудхари Г., Мешксар А., Виллабланка П., Тай Дж. и др. Шестиминутный протокол магнитно-резонансной томографии для оценки острого ишемического инсульта: расширение границ. Инсульт 2014;45:1985-1991. PMID: 24916906.
Неотложная терапия ишемического инсульта
%PDF-1.7 % 1 0 объект > эндообъект 10 0 объект > эндообъект 2 0 объект > эндообъект 3 0 объект > эндообъект 4 0 объект > транслировать application/pdfdoi:10.1016/j.ncl.2021.08.002



 В настоящее время многие исследователи пытаются ранжировать риски интервенционных вмешательств, такими методами являются IScore (Ischemic Stroke Predictive Risk Score), THRIVE Score (Totaled Health Risks in Vascular Events) и др. [9, 19];
В настоящее время многие исследователи пытаются ранжировать риски интервенционных вмешательств, такими методами являются IScore (Ischemic Stroke Predictive Risk Score), THRIVE Score (Totaled Health Risks in Vascular Events) и др. [9, 19];