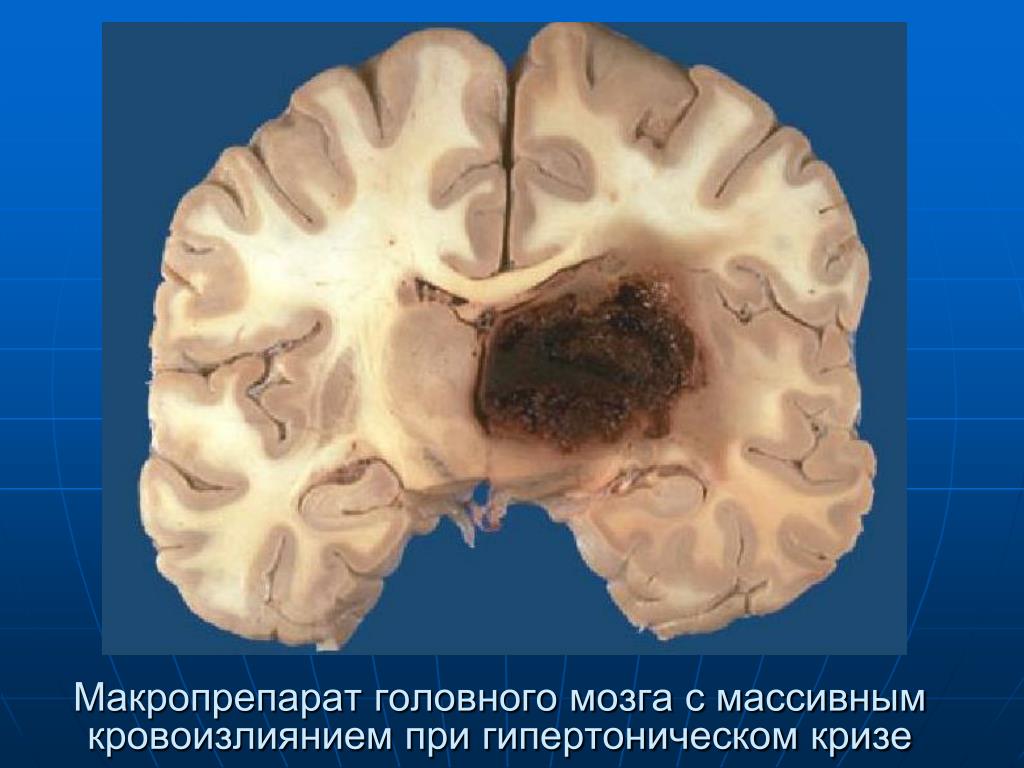
Ишемия инсульт головного мозга: Ишемический инсульт: симптомы, первая помощь
Головной мозг после ишемического инсульта: клинико-гистологическое исследование
Ишемический инсульт (ИИ) занимает 2—3-е место в структуре общей смертности, представляя собой актуальную медико-социальную проблему [1]. Несмотря на постоянный поиск и совершенствование подходов к лечению и реабилитации пациентов, перенесших ИИ, смертность и ивалидизация в результате данного заболевания по-прежнему высока [2]. В связи с этим актуально дальнейшее совершенствование стратегии оказания помощи больным ИИ. В свою очередь успех этой работы зависит от понимания механизмов развития ИИ и восстановления нарушенных функций, о которых можно судить, изучая гистологическую структуру пораженного мозга. Таким образом, исследование гистологических характеристик головного мозга после ИИ является важной задачей не только с точки зрения фундаментальной науки, но и практической неврологии.
В настоящей работе представленны данные исследования косвенных признаков воспаления, апоптоза и нейропластичности, играющих важную роль в развитии ИИ и восстановлении нарушенных вследствие него функций.

Цель работы — анализ гистологических особенностей изменений ткани головного мозга после развития ИИ.
Материал и методы
Проведено проспективное исследование, которое не изменяло плана диагностических и лечебных мероприятий: все пациенты получали объем медицинской помощи в соответствии со стандартом медицинской помощи больным с ИИ при оказании специализированной помощи. Изучены полученные при аутопсии образцы ткани головного мозга 9 больных, умерших вследствие ИИ в бассейне левой средней мозговой артерии в течение 3 сут от момента поступления в стационар. Критерии исключения: нарушение мозгового кровообращения по геморрагическому типу, черепно-мозговая травма, онкологические и аутоиммунные заболевания в анамнезе, аллергические реакции во время пребывания в стационаре. Аутопсийный материал получали в патолого-анатомическом отделении ГКБ № 36 им. Ф.И. Иноземцева Департамента здравоохранения Москвы. Исследование одобрено Межвузовским этическим комитетом.
В каждом случае образцы ткани брали из 3 зон головного мозга: 1) прилежащей непосредственно к очагу некротической ткани; 2) отдаленной от предыдущей на 5—10 см; 3) зоны контралатерального полушария, симметричной очагу И.И. Образцы тканей головного мозга фиксировали в 10% забуференном формалине. После отмывания фиксатора в проточной воде проводили стандартную гистологическую проводку образцов путем обезвоживания в этиловом спирте. Затем кусочки ткани пропитывали парафином и заливали в парафиновые блоки. Срезы толщиной 5 мкм изготавливали на ротационном микротоме Leica RM2125RT (Германия) и растягивали на предметных стеклах с полилизиновым покрытием Vision biosystems plus slides (Великобритания).
Выявление белков p53, нейроспецифической енолазы (NSE), глиофибриллярного кислого белка (GFAP) проводили непрямым иммунопероксидазным иммуногистохимическим методом. Для иммунофенотипирования использовали моноклональные антитела к указанным белкам человека («Vision biosystems novocastra», Великобритания), а также пероксидазную детекционную систему Peroxidase Detection System for Novocastra («Leica Microsystems», Германия), включающую вторичные универсальные биотинилированные антитела и стрептавидинпероксидазный комплекс. Визуализация реакции осуществлялась DAB-хромогеном. Иммуногистохимические реакции проводили согласно протоколам, прилагаемым к используемым антителам. При завершении окрашивания выполняли фоновое контрастирование срезов гематоксилином Майера. Полученные гистологические и иммуногистохимические препараты заключали под покровное стекло и изучали с помощью светового микроскопа Axio Scope A1 («Carl Zeiss», Германия) с использованием цифровой фотокамеры Canon PowerShot, программного обеспечения AxioVision LE («Carl Zeiss», Германия). Контроль специфичности реакции проводили с помощью неиммунной сыворотки, а также антител к виментину («Dako», Дания). Часть срезов окрашивали по методу Ниссля и гематоксилином и эозином.
Визуализация реакции осуществлялась DAB-хромогеном. Иммуногистохимические реакции проводили согласно протоколам, прилагаемым к используемым антителам. При завершении окрашивания выполняли фоновое контрастирование срезов гематоксилином Майера. Полученные гистологические и иммуногистохимические препараты заключали под покровное стекло и изучали с помощью светового микроскопа Axio Scope A1 («Carl Zeiss», Германия) с использованием цифровой фотокамеры Canon PowerShot, программного обеспечения AxioVision LE («Carl Zeiss», Германия). Контроль специфичности реакции проводили с помощью неиммунной сыворотки, а также антител к виментину («Dako», Дания). Часть срезов окрашивали по методу Ниссля и гематоксилином и эозином.
Вариационно-статистическую обработку данных проводили с использованием программы Statistica 6.0. Значимыми считали различия при р<0,05. При проведении корреляционного анализа использовали коэффициент Пирсона для нормальных распределений и коэффициент ранговой корреляции Спирмена для ненормальных распределений.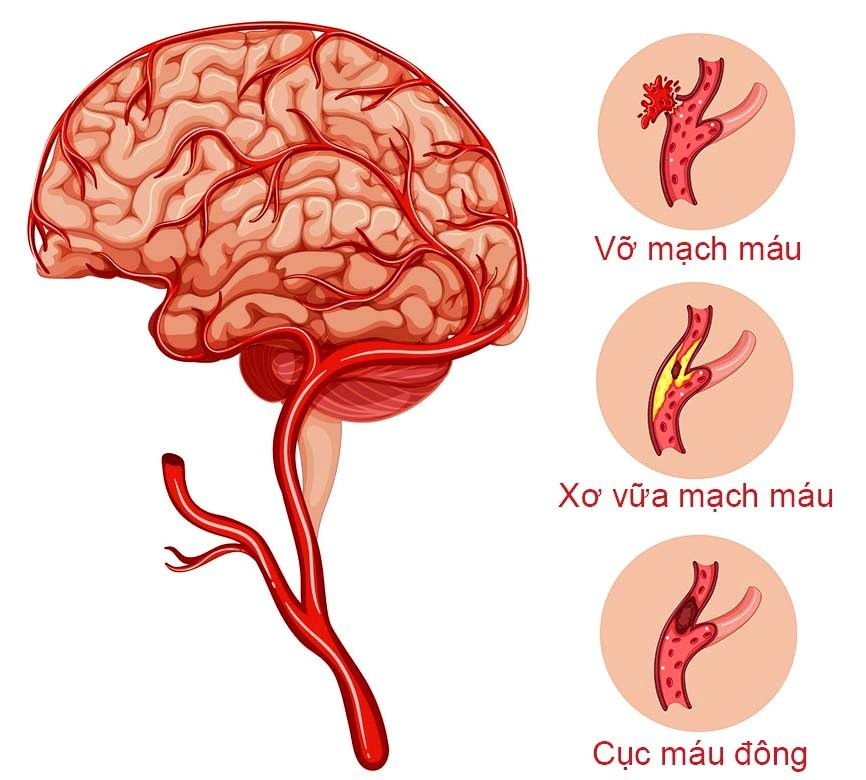
Результаты и обсуждение
Из 948 пациентов, экстренно госпитализированных в неврологический стационар и отделение реанимации в период с 2011 по 2013 г., в результате тромбоэмболии легочной артерии (ТЭЛА) и инфаркта миокарда (ИМ) после перенесенного впервые ИИ в бассейне левой средней мозговой артерии в течение первых 7 сут пребывания в стационаре умерли 9 больных (5 женщин, средний возраст 79±6 лет, и 4 мужчин, средний возраст 67±13 лет; 7 случаев ТЭЛА, 2 — ИМ). Их характеристики удовлетворяли критериям включения в исследование и тела подверглись аутопсии безотносительно данного исследования. По патогенетическому подтипу (в соответствии с критериями TOAST) в 4 случаях имел место кардиоэмболический ИИ, в 3 — ИИ неуточненной этиологии (сочетание нескольких возможных причин) и в 2 — атеротромботический И.И. Состояние при поступлении в стационар у 7 пациентов было тяжелое, у 2 — средней тяжести. Значения по шкале оценки тяжести неврологического дефицита после инсульта Национального института здоровья (NIHSS) [9] на момент поступления составили 14±5 баллов.
При гистологическом исследовании головного мозга с использованием стандартных методик окрашивания гематоксилином и эозином и крезиловым фиолетовым по Нисслю обнаружили снижение общего количества нейронов и глиальных элементов, преимущественно в образцах из перифокального участка (1-я зона). Отмечали диффузное запустение участков коры мозга как в ипсилатеральном, так и контралатеральном полушариях. При этом выраженность изменений в ипсилатеральном полушарии была большей и наиболее выраженной в 1-й зоне, непосредственно прилегающей к очагу некроза. В очаге некроза и прилежащей к нему 1-й зоне наблюдалась лейкоцитарная инфильтрация. Во всех зонах исследования наблюдали признаки изменения регионарного кровотока в виде венозной гиперемии, стаза, агрегации эритроцитов, периваскулярного отека.
У всех пациентов выявили изменения сосудистой стенки артерий, характерные для АГ и атеросклероза. При преобладании в клинической картине АГ наблюдали явления миоэластофиброза, склероза, гиалиноза, нарушения структурной целостности внутренней эластической мембраны, атрофию гладких мышечных волокон, что сопровождалось деформацией формы и уменьшением просвета артерий. При преобладании в клинической картине атеросклероза отмечали фиброз с формированием фиброзных бляшек, гиалиноз, истончение мышечной оболочки артерий, явления вторичного липоидоза. При сочетании АГ и атеросклероза выявили гиалиноз, склероз, уменьшение количества мышечных и эластических волокон.
Во всех зонах исследования обнаружены изменения нейронов в виде гомогенизации и инкрустации цитоплазмы, деформации и сморщивания ядер, кариоцитолиза с образованием клеток-теней, хроматолиза, перемещения ядра на периферию клетки и его набухания, смещения ядрышка к периферии ядра, перицеллюлярного отека. Выраженность указанных изменений достигала максимума в 1-й зоне, где все нейроны подверглись повреждению. В 3-й зоне встречались лишь отдельные участки нервной ткани, где наблюдались вышеописанные изменения. В обоих полушариях были выявлены также признаки саттелитоза и нейронофагии. То, что данные изменения происходят именно в нейронах, было доказано при использовании непрямого иммунопероксидазного иммуногистохимического метода для выявления NSE.
Выраженность указанных изменений достигала максимума в 1-й зоне, где все нейроны подверглись повреждению. В 3-й зоне встречались лишь отдельные участки нервной ткани, где наблюдались вышеописанные изменения. В обоих полушариях были выявлены также признаки саттелитоза и нейронофагии. То, что данные изменения происходят именно в нейронах, было доказано при использовании непрямого иммунопероксидазного иммуногистохимического метода для выявления NSE.
Возможности метода не предполагают количественного определения фермента, однако отдельные нейроны демонстрировали значительно более яркую реакцию NSE (рис. 1). На этом основании можно сделать заключение о более интенсивной экспрессии NSE в нервных клетках. NSE —гликолитический фермент семейства енолаз, участвующий в предпоследнем этапе гликолиза, катализирует отщепление воды от 2-фосфоглицериновой кислоты. В результате образуется фосфоенолпируват — соединение, содержащее макроэргическую фосфатную связь. Усиление метаболической активности нейронов сопровождается увеличением содержания этого фермента в цитоплазме.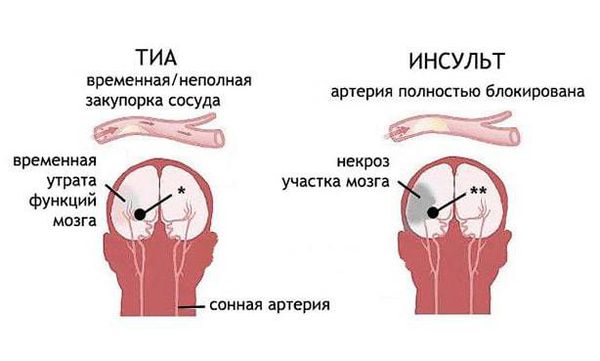
Рис. 1. Разная интенсивность реакции NSE нейронов в зоне 3. М — менее интенсивная, Б — более интенсивная. Реакция на NSE. ×400.
Указанный феномен более интенсивной реакции NSE имел место во 2-й и 3-й зонах исследования, т. е. отмечался как на стороне поражения, так и в контралатеральном полушарии. При этом в 1-й зоне интенсивность реакции NSE уменьшалась в зависимости от близости нейронов к очагу некроза. Полученные данные соответствуют результатам работ исследовательской группы, которая использовала иммунофлюоресцентное окрашивание NSE и при помощи специального программного обеспечения измеряла площадь флюоресцирующих гранул маркера в поле зрения [11]. Авторы сделали заключение, что при острой очаговой ишемии головного мозга в неповрежденных нейронах компенсаторно увеличивается содержание NSE, что свидетельствует об их высокой функциональной активности.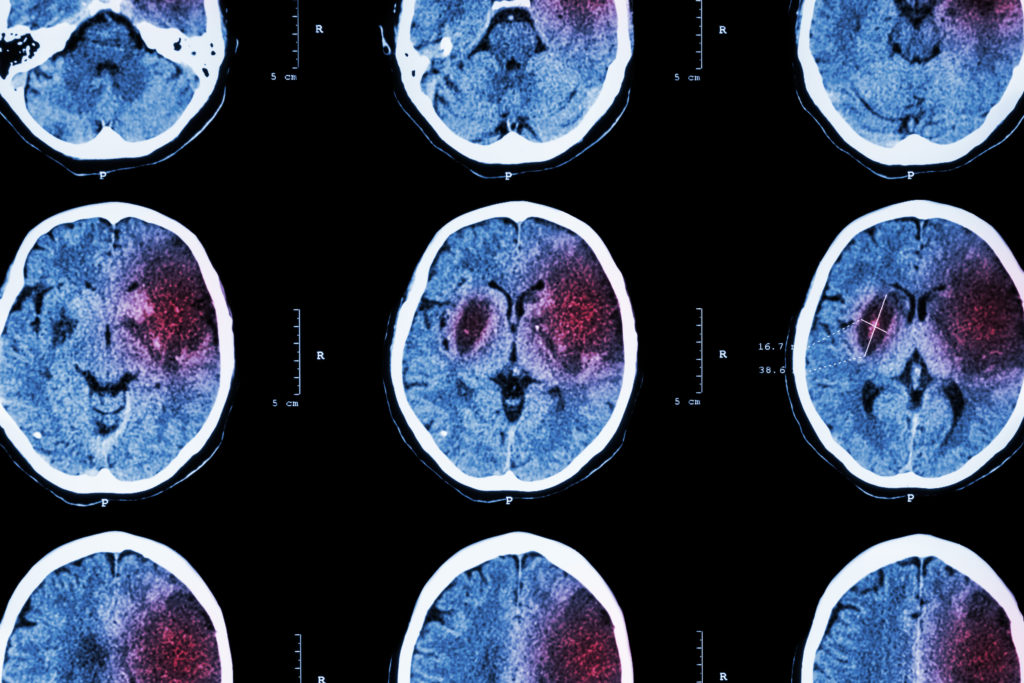
Данная высокая функциональная активность является субстратом для реализации пластических реакций в сохранившихся нейронах, а также перестройки аналогичных по функциям нейронов, ранее не задействованных и расположенных на отдалении от зоны повреждения, что в результате должно приводить к выраженной структурно-функциональной реорганизации работы мозга. При этом известно, что процессы пластичности вовлекают корковый и субкортикальный уровни, включая таламус, базальные ганглии и структуры ствола мозга [12], где должны происходить сходные изменения вне зависимости от локализации очага и характера поражения головного мозга.
Об активации процессов апоптоза нейронов судили по выраженности экспрессии белка р53, который выявляли при помощи непрямого иммунопероксидазного иммуногистохимического метода. Доказательством того, что указанные изменения происходят именно в нейронах, считали реакцию тех же клеток с NSE в дублирующих срезах. Белок р53 является специфическим транскрипционным фактором. Гены, транскрипцию которых стимулирует белок р53, кодируют белки-компоненты апоптотической программы и белки, регулирующие клеточный цикл. Активация белка р53 происходит в ответ на многочисленные стрессовые стимулы, к которым относится гипоксия [13]. Ишемия-реперфузия коры теменной доли крысы увеличивает в нейроцитах концентрацию белка р53 в раннем ишемически-реперфузионном периоде [14].
Гены, транскрипцию которых стимулирует белок р53, кодируют белки-компоненты апоптотической программы и белки, регулирующие клеточный цикл. Активация белка р53 происходит в ответ на многочисленные стрессовые стимулы, к которым относится гипоксия [13]. Ишемия-реперфузия коры теменной доли крысы увеличивает в нейроцитах концентрацию белка р53 в раннем ишемически-реперфузионном периоде [14].
В настоящем исследовании наибольшее количество p53-позитивных нейронов отмечено в 1-й зоне. Во 2-й и 3-й зонах маркированные р53 клетки присутствовали в меньших количествах, однако участки их расположения находились в непосредственной близости с участками расположения нейронов с усиленной реакцией на NSE (рис. 2, 3). На этом основании можно предположить, что экспрессия р53 в отдельных нейронах 2-й и 3-й зон свидетельствует о том, что эти нейроны после структурно-функциональной перестройки нервной ткани оказались не задействованными во вновь образованных связях и подверглись апоптозу.
Рис. 2. Разная интенсивность реакции NSE нейронов в зоне 2. М — менее интенсивная, Б — более интенсивная. Реакция NSE. ×400.
2. Разная интенсивность реакции NSE нейронов в зоне 2. М — менее интенсивная, Б — более интенсивная. Реакция NSE. ×400.
Рис. 3. р53-позитивные нейроны в зоне 2 (указаны стрелками). Реакция р53. ×200.
При реакции GFAP на дублирующих срезах выявили, что нейроны с усиленной реакцией на NSE, а также р53-позитивные нейроны во 2-й и 3-й зонах находятся на приближенном расстоянии к астроцитам по сравнению с другими нейронами этих зон, в которых указанные феномены отсутствовали (рис. 4). Известно, что компенсаторная активация метаболизма части сохранившихся нейронов сопровождается активацией пула астроцитов [15]. Опубликованы данные о том, что процессы обучения и реализации механизмов запоминания сопровождаются повышением числа астроцитов в определенных участках мозга [16]. Aстроциты для снабжения нейронов энергией используют продукт расщепления гликогена — лактат, который проходит через мембрану нейронов с участием специализированных транспортных белков [17]. С учетом вышесказанного можно предположить, что астроциты принимают участие в энергетическом обеспечении нейропластичности и апоптоза после церебральной ишемии.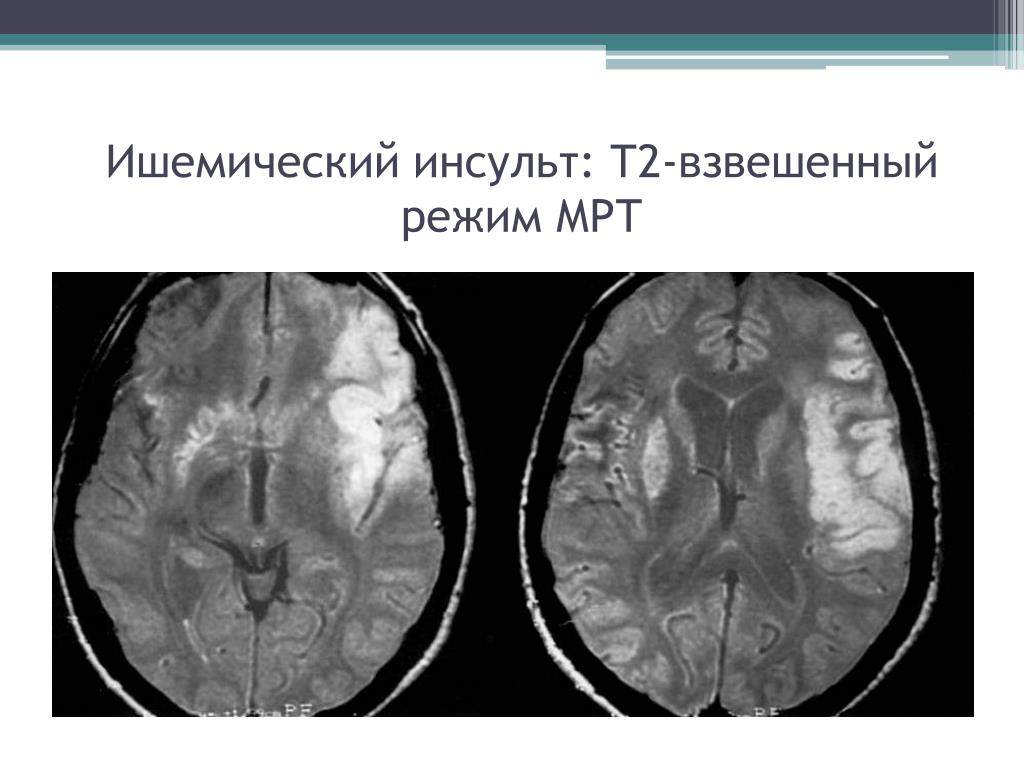
Рис. 4. Сближение нейронов и астроцитов (указаны стрелкой) в зоне 3. Реакция GFAP. ×400.
ВоспалениеПри реакции GFAP выявили деформацию, гипертрофию интра- и перицеллюлярный отек, набухание астроцитов в 1-й зоне. При этом в данной зоне наблюдали увеличение их количества, причем наиболее выраженное скопление астроцитов выявлялось периваскулярно (см. рис. 1). В зонах деструкции мозговой ткани погибшие астроциты были представлены GFAP-позитивными зернистыми массами. Во 2-й зоне также наблюдались незначительные явления интра- и перицеллюлярного отека (см. рис. 2).
Выявили факт наибольшей выраженности лейкоцитарной инфильтрации именно в перифокальной области (1-я зона), где также обнаружили увеличение количества астроцитов. Известно, что астроциты играют ключевую роль в развитии и ограничении воспалительного процесса в ЦНС [18]. Активированные астроциты и микроглия — основные источники цитокинов в ЦНС [19]. В указанной 1-й зоне отмечается также максимальное количество р53 позитивных клеток, что может быть следствием взаимодействия мембранных рецепторов смерти нейронов и глии с соответствующими лигандами на мембране лейкоцитов, что инициирует апоптоз нейронов [6].
В указанной 1-й зоне отмечается также максимальное количество р53 позитивных клеток, что может быть следствием взаимодействия мембранных рецепторов смерти нейронов и глии с соответствующими лигандами на мембране лейкоцитов, что инициирует апоптоз нейронов [6].
ИИ сопровождается выраженными гистологическими изменениями: уменьшением общего количества нейронов и глиоцитов, их пространственным перераспределением, изменением структуры клеток и их функциональной активности. Данные изменения с разной степенью выраженности происходят как в прилежащих к очагу некроза, так и в удаленных от него участках.
Высокая функциональная активность отдельных расположенных на отдалении от зоны повреждения нейронов является субстратом для реализации пластических реакций, что делает особенно актуальным поиск новых стратегий нейропротекторной терапии. Нейроны, не встроившиеся в новую функциональную сеть, элиминируются посредством апоптоза. Астроциты принимают участие в энергетическом обеспечении и регуляции нейропластичности и апоптоза после ИИ.
Авторы заявляют об отсутствии конфликта интересов.
Инсульт — Академия неврологии
Частота мозговых инсультов у лиц старше 50-55 лет увеличивается в 1,8-2 раза в каждом последующем десятилетии жизни. Развитию острых нарушений мозгового кровообращения предшествуют продолжительные и сложные изменения в сердечно-сосудистой системе и системе мозгового кровообращения, связанные с возникновением и прогрессированием различных факторов риска.
Риск повторных инсультов или транзиторных ишемических атак (ТИА) у лиц, выживших после перенесенного острого церебрального события значительно возрастает: частота повторных ишемических инсультов примерно в 15 раз выше, чем впервые возникших у лиц того же возраста. Важнейшим направлением в неврологии является вторичная профилактика ишемического инсульта, направленная на снижение риска возникновения повторных острых церебральных ишемических событий.
Пациент должен быть осведомлен о риске развития инсульта
Практика показывает, что у каждого пациента имеет место «свой» механизм, приводящий к внезапному нарушению кровоснабжения определенного участка ткани мозга, однако, существует одна общая закономерность: инсульт развивается внезапно на фоне длительного существования патологических условий для декомпенсации мозгового кровообращения. [11]
[11]
Между патологическим процессом, создающим условия для острого нарушения мозгового кровообращения, и сосудистой катастрофой всегда происходит событие, которое декомпенсирует гемодинамические и гемостатические резервы. Непосредственной причиной инсульта всегда является гемодинамический криз — острое нарушение системной или местной гемодинамики, приводящее к нарушению функции или повреждению мозга. Но что создает условия для этого явления?
Артериальная гипертензия (АГ) является самым значимым фактором риска развития не только острых нарушений мозгового кровообращения, но и хронической ишемии мозга, признаками которой являются расстройства памяти и других когнитивных (познавательных) функций. Существует положительная взаимосвязь между уровнем артериального давления (АД) и частотой возникновения инсульта, причем риск возрастает при превышении АД по всему диапазону. Кроме этого, следует обращать внимание пациентов на наличие у них других факторов, повышающих риск развития мозгового инсульта.
Первые симптомы недостаточности мозгового кровообращения обнаруживают себя при напряженной умственной работе, особенно в условиях утомления. Со временем такие расстройства наблюдаются все чаще и чаще, и уже не расстройство, а заболевание будет прогрессировать и перейдет в последующие стадии недостаточности мозгового кровообращения. Поэтому у таких пациентов терапия первых признаков недостаточности мозгового кровообращения — важнейший шаг в профилактике развития инсульта. Прежде всего, следует проводить лечение основного заболевания, на фоне которого развилась недостаточность мозгового кровообращения: вегето-сосудистой дистонии, гипертонической болезни, атеросклероза. Но уже на стадии предвестников возможно восстановить нарушенную микроциркуляцию головного мозга, а также защитить и восстановить ткань самого мозга, пострадавшую от недостаточного питания. В этом и заключается основная задача нейропротекции.
Пациент — в группе риска развития инсульта головного мозга, если
• Пациенту более 55 лет
• Имеет избыточный вес
• Ведет малоактивный образ жизни
• Часто испытывает чрезмерные физические нагрузки
• Есть проблемы с алкоголем и курением
• В пищевом рационе — много вредных продуктов (например, содержащих большое количество животных жиров)
• Страдает заболеваниями сердечно-сосудистой системы (мерцательная аритмия, атеросклероз)
• Страдает диабетом
• Часто испытывает головные боли и головокружение, чувствителен к изменениям погоды
• Имеет в анамнезе инсульт или транзиторные ишемические атаки
Гипертония — главный фактор риска сосудистых катастроф
Гипертоническая энцефалопатия (ГЭ) представляет собой медленно прогрессирующее очаговое и диффузное поражение тканей головного мозга, обусловленное хроническим нарушением мозгового кровообращения на фоне длительно существующей неконтролируемой гипертонии.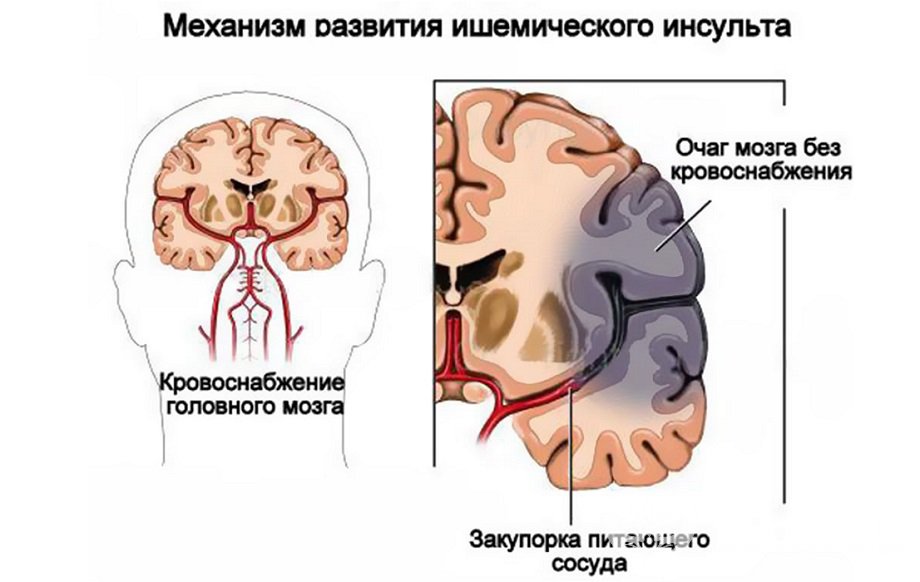
Присоединение атеросклероза мозговых сосудов (при АГ этот процесс происходит рано и ускоренным темпом) и нарушение реологических свойств крови способствует дальнейшему ухудшению кровоснабжения головного мозга, что приводит к прогрессированию ГЭ; в этом случае говорят о дисциркуляторной энцефалопатии смешанного генеза. Часто сочетаемые с АГ сахарный диабет, нарушения липидного обмена и курение также оказывают повреждающее действие на систему кровоснабжения головного мозга.
Гипертоническая энцефалопатия — вариант дисциркуляторной энцефалопатии, формирующий разнообразные неврологические синдромы, угрожающий развитием инсульта и приводящий к сосудистой деменции.
Последствия дисциркуляторной энцефалопатии (ДЭ) весьма многообразны по клинике и особенностям течения:церебрально-сосудистые кризы, транзиторные ишемические атаки (ТИА), инсульты, сочетанные нарушения церебрального и коронарного кровообращения, которые трудно и не всегда эффективно поддаются лечению. Поэтому все большее внимание в последнее время уделяется их профилактике, то есть, ранней диагностике и лечению хронической недостаточности мозгового кровообращения[1,2,3,4,5,6,7,9].
Профилактика развития и прогрессирования ДЭ складывается из нескольких направлений:
• Лечение артериальной гипертонии
• Воздействие на факторы, усугубляющие течение ДЭ: гиперхолестеринемию, повышенную агрегацию тромбоцитов и вязкость крови, сахарный диабет, мерцательную аритмию (если эти заболевания присоединяются), отказ от курения и чрезмерного употребления алкоголя
• Улучшение кровоснабжения головного мозга
• Улучшение метаболизма нервных клеток, находящихся в условиях
ишемии и гипоксии
• Воздействие на структурные изменения тканей мозга — перспективное направление.
По результатам клинических исследований установлена возможность предупреждения инсульта путем коррекции повышенного уровня артериального давления, применения антиагрегантов, нормализации углеводного и липидного обмена. А что, если использовать влияние на патогенетические механизмы развития ишемии мозга? На современном уровне знаний о них это возможно.
От дисциркуляторной энцефалопатии до инсульта путь краток
Структурные изменения мозга при нарушениях циркуляции могут колебаться от изменений в отдельных нейронах, глиоцитах и волокнах белого вещества до инфарктов мозга различной величины и локализации[1,8]. В условиях хронического нарушения кровоснабжения мозга механизмы компенсации постепенно истощаются, энергетическое обеспечение мозга становится недостаточным, в результате сначала развиваются расстройства мозговых функций, а затем и необратимые диффузные морфологические изменения, которые подготавливают мозговую ткань к развитию инсульта.
В условиях хронического нарушения кровоснабжения мозга механизмы компенсации постепенно истощаются, энергетическое обеспечение мозга становится недостаточным, в результате сначала развиваются расстройства мозговых функций, а затем и необратимые диффузные морфологические изменения, которые подготавливают мозговую ткань к развитию инсульта.
Что при этом происходит в очаге ишемического повреждения?
Когда формируется очаг ишемического повреждения, в нем активируются различные сигнальные молекулы, синтезируются регуляторные медиаторы-пептиды (цитокины), концентрируются воспалительные клетки. Одновременно в зоне ишемии возникает дефицит противовоспалительных интерлейкинов и трофических факторов, которые обычно защищают нейроны от травматического, гипоксического, ишемического повреждений, регулируют рост и дифференцировку нейронов[10]. Таким образом, защита мозга ослаблена.
Прежде всего, следует проводить лечение основного заболевания, на фоне которого развилась недостаточность мозгового кровообращения. Но даже эффективная терапия основного заболевания не позволяет добиться регресса уже сформировавшегося когнитивного дефицита в условиях сосудистого поражения мозга. Поэтому в комплексной терапии обосновано применение препаратов, которые защищают и восстанавливают ткань самого мозга, пострадавшую от недостаточного питания.
Но даже эффективная терапия основного заболевания не позволяет добиться регресса уже сформировавшегося когнитивного дефицита в условиях сосудистого поражения мозга. Поэтому в комплексной терапии обосновано применение препаратов, которые защищают и восстанавливают ткань самого мозга, пострадавшую от недостаточного питания.
Литература:
1. Бокарев И.Н. Атеросклероз — проблема современности. Тромбоз, гемостаз и реология.2000; 1: 6–7.
2. Бурцев Е.М. «Дисциркулятормая энцефалопатия (эпидемиология, варианты клинического течения, классификация, лечение)». В кн.: «Проблемы неврологии и нейрохирургии». Сб. научн. трудов. Иваново. 1994; 93–102.
3. Верещагин Н.В. Клиническая неврология на рубеже веков. Клинический вестник (Москва). 1995; 2: 4–5.
4. Виленский Б.С. Инсульт: профилактика, диагностика и лечение, Санкт–Петербург. Фолиант. 2002.
5. Гусев Е.И., Бурд Г.С., Скворцова В.И., Гехт А.Б. Система метаболической терапии больных ишемическим инсультом. В кн. Современные методы диагностики и лечения заболеваний нервной системы.2008/30/2.jpg) Уфа. 1996; 107–118.
Уфа. 1996; 107–118.
6. Гусев Е.И., Скворцова В.И. Современные представления о лечении острого церебрального инсульта. Consilium medicum. 2000; 2: 60–66.
7. Одинак М.М., Вознюк И.А. Новое в терапии при острой и хронической патологии нервной системы (нейрометаболическая терапия при патологии нервной системы). 2001; 62.
8. Чуканова Е.И. Дисциркуляторная энцефалопатия (клиника, диагностика и лечение). Дисс дмн. М. 2004.
9. Фритас Г.Р., Дж.Богуславский. Первичная профилактика инсульта Ж.Неврол. и псих им.Корсакова, Инсульт. 2001; 1: 7–21.
10. Гусев Е.И. Скворцова В.И. Ишемия головного мозга. М Медицина. 2001; 248.
11. Широков Е.А., Симоненко В.Б. Современные представления о роли гемодинамических кризов в этиологии и патогенезе инсульта. Клиническая медицина.2001; 8: 4-7.
Симптомы ишемии головного мозгаДетский церебральный паралич
Ишемия головного мозга — это тип инсульта, возникающий при нарушении притока крови к части головного мозга. Когда это происходит из-за закупорки, это может привести к гибели мозговой ткани, а также к потере определенных функций мозга. Чем дольше сохраняется проблема, тем более разрушительной будет ишемия головного мозга. Атеросклероз является одной из наиболее частых причин ишемии головного мозга. Это может привести к образованию тромбов в мозге или к попаданию в мозг из другого места, например, из артерии. Когда сгусток попадает в мозг, он сразу же начинает вызывать повреждения. Те, у кого диабет, также подвержены риску развития ишемии головного мозга или могут возникнуть в результате эмболии.
Чем дольше сохраняется проблема, тем более разрушительной будет ишемия головного мозга. Атеросклероз является одной из наиболее частых причин ишемии головного мозга. Это может привести к образованию тромбов в мозге или к попаданию в мозг из другого места, например, из артерии. Когда сгусток попадает в мозг, он сразу же начинает вызывать повреждения. Те, у кого диабет, также подвержены риску развития ишемии головного мозга или могут возникнуть в результате эмболии.
Этот тип инсульта может произойти в любое время. Больной может находиться в состоянии покоя, спать или заниматься активной деятельностью. В некоторых случаях человек может потерять сознание во время инсульта. В других случаях они могут оставаться в сознании на протяжении всего эпизода.
Каковы симптомы?
Те, кто страдает от ишемии головного мозга, будут страдать от широкого спектра различных симптомов. Они могут незначительно различаться у разных пациентов, но они, как правило, хорошо совпадают у разных пациентов. Наиболее распространенные симптомы включают потерю подвижности в любой области тела, часто только на одной стороне тела. Пациент также может страдать от слабости, снижения чувствительности или онемения в частях тела или покалывания. У пациента также могут быть проблемы с четкой речью и глотанием, а также потеря памяти и потеря координации. Головокружение, потеря сознания и недержание мочи — другие потенциальные симптомы, которые могут возникнуть у людей, страдающих ишемией головного мозга.
Наиболее распространенные симптомы включают потерю подвижности в любой области тела, часто только на одной стороне тела. Пациент также может страдать от слабости, снижения чувствительности или онемения в частях тела или покалывания. У пациента также могут быть проблемы с четкой речью и глотанием, а также потеря памяти и потеря координации. Головокружение, потеря сознания и недержание мочи — другие потенциальные симптомы, которые могут возникнуть у людей, страдающих ишемией головного мозга.
Даже если у пациента проявляются эти симптомы, врачи должны убедиться, что это не другое состояние, которое может имитировать ишемию головного мозга, например отек мозга. Они будут использовать ряд различных типов тестов, чтобы дать пациенту, включая компьютерную томографию, МРТ, электрокардиограмму, УЗИ и многое другое, чтобы определить точную причину и серьезность проблемы.
Какие варианты лечения доступны?
Врачи могут прописать различные лекарства, которые могут помочь восстановить приток крови к областям мозга. Тем не менее, некоторые лекарства вызывают споры, поскольку они могут вызывать повышенный риск кровотечения. В некоторых случаях операция может быть правильным способом удаления тромбов из головного мозга.
Тем не менее, некоторые лекарства вызывают споры, поскольку они могут вызывать повышенный риск кровотечения. В некоторых случаях операция может быть правильным способом удаления тромбов из головного мозга.
Профилактика ишемии головного мозга
Профилактика инсульта включает, в первую очередь, попытки контролировать факторы риска, которые приводят к состоянию. Некоторые из наиболее распространенных методов профилактики включают принятие активных мер для улучшения общего состояния здоровья, таких как диета, физические упражнения и отказ от курения и употребления алкоголя. Пациентам, у которых возникают трудности с глотанием, может потребоваться внутривенный зонд или зонд для кормления в желудке. В некоторых случаях трудности с глотанием будут временными, но они могут быть и постоянными.
Длительное лечение, как правило, также необходимо тем, кто страдает от ишемии головного мозга. Они включают физиотерапию, логопедию, эрготерапию и другие методы лечения, которые могут помочь предотвратить другие потенциальные осложнения, возникающие в результате ишемии головного мозга. Некоторые из осложнений, которые могут возникнуть после ишемии головного мозга, включают переломы костей в результате падения, необратимую потерю движения, пролежни, возникшие из-за недостатка движения, недоедание и сокращение продолжительности жизни.
Некоторые из осложнений, которые могут возникнуть после ишемии головного мозга, включают переломы костей в результате падения, необратимую потерю движения, пролежни, возникшие из-за недостатка движения, недоедание и сокращение продолжительности жизни.
Инсульт или ишемия головного мозга — это серьезное заболевание, которое может навсегда изменить жизнь человека. Пациенты должны немедленно обратиться за медицинской помощью, когда они опасаются инсульта, чтобы уменьшить вероятность необратимого повреждения.
Источник:
- http://www.tnhealth.org/facts/Brainischemia.htm
Церебральная ишемия | Публикации Экзон
ЦЕРЕВАЛЬНАЯ ИШЕМИЯ
ISBN: 978-0-6450017-9-2
Exon Publications, Брисбен, Австралия
Рышард Плута, доктор медицины, доктор медицинских наук (редактор)
Лаборатория исследований ишемии и нейродегенеративных заболеваний головного мозга, Медицинский научно-исследовательский институт им. Моссаковского, Польская академия наук, Варшава, Польша , который развивается более чем у половины больных после ишемического эпизода. Считается, что основным механизмом являются патологические изменения в гиппокампе, особенно в области СА1, лежащие в основе нарушения эпизодической памяти, что является наиболее ранним и наиболее важным клиническим симптомом постишемической деменции. 13 глав этой книги представляют новую картину ишемической болезни головного мозга, синтезируя последние данные о механизмах заболевания, уходе за пациентами с этим заболеванием и потенциальных терапевтических мишенях. Авторы представляют характеристики церебральной ишемии от беременности и детства через подростковый возраст до зрелого возраста. Первые две главы дают представление об анатомии коры головного мозга и гиппокампа, структур головного мозга, наиболее пораженных после церебральной ишемии. Затем следуют девять глав, в которых представлен всесторонний взгляд на патологические механизмы церебральной ишемии и на то, как глубокое понимание этих патомеханизмов является ключом к открытию и разработке новых методов лечения для помощи пациентам, страдающим церебральной ишемией.
Моссаковского, Польская академия наук, Варшава, Польша , который развивается более чем у половины больных после ишемического эпизода. Считается, что основным механизмом являются патологические изменения в гиппокампе, особенно в области СА1, лежащие в основе нарушения эпизодической памяти, что является наиболее ранним и наиболее важным клиническим симптомом постишемической деменции. 13 глав этой книги представляют новую картину ишемической болезни головного мозга, синтезируя последние данные о механизмах заболевания, уходе за пациентами с этим заболеванием и потенциальных терапевтических мишенях. Авторы представляют характеристики церебральной ишемии от беременности и детства через подростковый возраст до зрелого возраста. Первые две главы дают представление об анатомии коры головного мозга и гиппокампа, структур головного мозга, наиболее пораженных после церебральной ишемии. Затем следуют девять глав, в которых представлен всесторонний взгляд на патологические механизмы церебральной ишемии и на то, как глубокое понимание этих патомеханизмов является ключом к открытию и разработке новых методов лечения для помощи пациентам, страдающим церебральной ишемией. В главе 12 рассказывается о реальном жизненном опыте и проблемах реабилитации пациентов в обществе после церебральной ишемии, а в главе 13 анализируются вариации социальных рисков, включая гендерное неравенство, при реинтеграции пациентов, перенесших ишемический инсульт. Хотя книга предназначена в первую очередь для ученых и клиницистов, содержание книги будет интересно всем тем, кто интересуется церебральной ишемией, в том числе пациентам и лицам, ухаживающим за ними.
В главе 12 рассказывается о реальном жизненном опыте и проблемах реабилитации пациентов в обществе после церебральной ишемии, а в главе 13 анализируются вариации социальных рисков, включая гендерное неравенство, при реинтеграции пациентов, перенесших ишемический инсульт. Хотя книга предназначена в первую очередь для ученых и клиницистов, содержание книги будет интересно всем тем, кто интересуется церебральной ишемией, в том числе пациентам и лицам, ухаживающим за ними.
DOI: https://doi.org/10.36255/exonpublications.cerebralischemia.2021
Опубликовано: 2021-11-06
ПредварительныйПредисловие
Рышард Плута, MD, PHD
Страницы ix-x
Анатомия коры головного мозга
Прадип Чаухан, MBBS, MS, CRM, Ашиш Ратава, MBBS, MS, Кинджал Джетва, MBBS, MS, Симми Мехра, MBBS, MS
Страницы 1-16
PDF HTML XML
Глава 2Анатомия гиппокампа
Прадип Чаухан, MBBS, MS, CRM, Кинджал Джетва, MBBS, MS, Ашиш Ратава, MBBS, MS, Гириш Чаухан, BDS, MDS, Симми Мехра, MBBS, MS
Страницы 17-30
PDF HTML XML
Глава 3Гены, связанные с болезнью Альцгеймера при постишемической нейродегенерации головного мозга
Рышард Плута, MD, PHD, Маржена Уламек-Козиол, MD, PHD
Страницы 31-44
PDF HTML XML
Глава 4 Глава 5Ишемическое поражение головного мозга при гипергомоцистеинемии
Ян Легоцкий, доктор наук, доктор наук, Мария Ковальска, доктор наук, Ева Барановичова, доктор наук, Петра Хниликова, доктор наук, Дагмар Каленска, доктор наук, Питер Каплан, доктор наук
Страницы 61-72
PDF HTML XML
Глава 6Экзосомы в постишемическом мозге
Рышард Плута, MD, PHD, Мирослав Яблонски, MD, PHD
Страницы 73-85
PDF HTML XML
Глава 7Нейровоспаление в постишемическом мозге
Катарина Живанчевич, MPHARM, Дарко Лович, MPHARM, Павле Р. Анджус, доктор медицинских наук, Лидия Раденович, доктор медицинских наук
Анджус, доктор медицинских наук, Лидия Раденович, доктор медицинских наук
Страницы 87-109
PDF HTML XML
Глава 8 Глава 9Роль катепсина В в ишемически-реперфузионном повреждении после инсульта
Бхакта Прасад Гайре, доктор наук, Лалита Субеди, доктор наук, Хиронори Терамото, бакалавр наук, Бингрен Ху, доктор наук
Страницы 131-147
PDF HTML XML
Глава 10 Глава 11Лечение церебральной ишемии: новые терапевтические стратегии на основе экспериментальных исследований инсульта
Сюань Чжэн, MSC, Маттео Хаупт, BSC, Матиас Бер, доктор медицинских наук, Ларс Татенхорст, доктор медицинских наук, Торстен Р. Деппнер, доктор медицинских наук, MSC
Страница 165-185
PDF HTML XML
Глава 12Реабилитация на базе сообщества после инфаркта мозга в Японии: от острой фазы до дома
Шиничиро Маэсима, доктор медицинских наук, Айко Осава, доктор медицинских наук, доктор медицинских наук
Страницы 187-200
PDF HTML XML
Глава 13Понимание изменения социального риска при реинтеграции пациентов, перенесших ишемический инсульт
Катрина Чисек, доктор медицинских наук, Тхи Нгует Кве Нгуен, доктор медицинских наук, Алехандро Гарсия-Рудольф, доктор медицинских наук, Хоан Саури, доктор медицинских наук, Джон Д.