Хроническая мигрирующая эритема афцелиуса липшютца: Diagnostics and treatment of erythema chronicum migrans Aftselius Lipschutz in a female patient with localized scleroderma under the condition of daytime hospital — Butareva
Мигрирующая эритема: кожная манифестация болезни Лайма
Мигрирующая эритема: кожная манифестация болезни ЛаймаСорокина Е.В.
ГОУ ВПО МГУПП НИУВ, Москва
Масюкова С.А.
Государственный институт усовершенствования врачей МО РФ, Москва
Мигрирующая эритема: кожная манифестация болезни Лайма
Журнал: Клиническая дерматология и венерология. 2015;14(6): 8‑14
DOI 10.17116/klinderma20151468-14
Как цитировать
Сорокина Е.В., Масюкова С.А.
Мигрирующая эритема: кожная манифестация болезни Лайма. Клиническая дерматология и венерология. 2015;14(6):8‑14.
Sorokina EV, Masiukova SA. Erythema migrans: the cutaneous manifestation of Lyme disease. Klinicheskaya Dermatologiya i Venerologiya. 2015;14(6):8‑14. (In Russ.).
https://doi.
Авторы:
Сорокина Е.В.
ГОУ ВПО МГУПП НИУВ, Москва
Все авторы (2)
Читать метаданные
Представлены современные данные об этиологии, эпидемиологии, патогенезе, клинических признаках, диагностике и лечении мигрирующей эритемы (МЭ). МЭ является наиболее распространенной клинической презентацией ранней локализованной формы болезни Лайма (БЛ), проявлением инфекции, вызванной Borrelia burgdorferi. Множественные МЭ характерны для ранней диссеминированной стадии. Системные симптомы могут сопровождать развитие МЭ, однако их характер не является специфичным. В большинстве случаев факт клещевой инокуляции остается не замеченным больными. Серологические анализы часто дают ложноотрицательные результаты и не являются обязательными для диагностики. Поэтому диагноз МЭ устанавливают, как правило, на основании клинических проявлений. Однако, несмотря на характерную клиническую картину МЭ, которую считают патогномоничным признаком БЛ, необходимо проводить дифференциальную диагностику с другими фигурными эритемами и дерматозами, характеризующимися эритематозными очагами фигурных очертаний.
Ключевые слова:
мигрирующая эритема
болезнь Лайма
Borrelia burgdorferi
Авторы:
Сорокина Е.В.
ГОУ ВПО МГУПП НИУВ, Москва
Масюкова С.А.
Государственный институт усовершенствования врачей МО РФ, Москва
Закрыть метаданные
В структуре группы фигурных эритем одно из значимых мест занимает мигрирующая эритема Афцелиуса—Липшютца (МЭ), являющаяся патогномоничным признаком Лайм-боррелиоза, широко распространенного трансмиссивного заболевания практически на всех континентах. В Российской Федерации ежегодно количество заболевших клещевыми боррелиозами колеблется от 7 до 9 тыс. [7, 8]. В 2011 г. частота заболеваемости иксодовым клещевым боррелиозом составила 7,02 на 100 тыс. населения [4]. В последние десятилетия отмечается рост частоты тяжелых, хронических, торпидных форм болезни Лайма (БЛ) [7, 8, 24, 45].
В Российской Федерации ежегодно количество заболевших клещевыми боррелиозами колеблется от 7 до 9 тыс. [7, 8]. В 2011 г. частота заболеваемости иксодовым клещевым боррелиозом составила 7,02 на 100 тыс. населения [4]. В последние десятилетия отмечается рост частоты тяжелых, хронических, торпидных форм болезни Лайма (БЛ) [7, 8, 24, 45].
МЭ относится к ранней кожной манифестации БЛ, проявлением воспалительно-аллергической реакции кожи на присасывание клеща, наблюдающейся у 50—80% больных, а при существовании более 4 нед может быть отнесена к хронической. Иксодовый клещевой боррелиоз (БЛ) — природно-очаговое трансмиссивное инфекционное заболевание, которое было впервые описано в Европе, в том числе и в России, еще в конце XIX века [5, 27, 48]. В начале ХХ века (1908) шведский врач-дерматолог Арвид Афзелиус [10] установил взаимосвязь между появлением на коже кольцевидной МЭ («эритема Афзелиуса», «мигрирующий дерматит») и присасыванием клеща. Современное название было дано исследователем Липшютцем в 1913 г.
 На коже в месте его присасывания развивается кольцевидная МЭ. С током лимфы и крови возбудитель попадает во внутренние органы. Под воздействием факторов неспецифической защиты макроорганизма часть боррелий погибает, выделяя эндотоксин, который запускает каскад иммунопатологических реакций [34]. В настоящее время доказана патогенность 3 видов B. burgdorferi sensu lato: B. burgdorferi sensu stricto, B. garinii и B. afzelii. Патогенные для человека виды боррелий комплекса B. burgdorferi sensu lato адаптировались в процессе эволюции к выживанию в различных биологических объектах окружающей среды: в клещах и их «прокормителях» — позвоночных животных, что достигается за счет функционирования различных регуляторных генов, изменяющих уровень экспрессии ряда белков на протяжении жизненного цикла [12, 29, 48]. Боррелии имеют группы антигенов: поверхностные (OspA, OspB, OspD, OspE и OspF), жгутиковый и цитоплазматический.
На коже в месте его присасывания развивается кольцевидная МЭ. С током лимфы и крови возбудитель попадает во внутренние органы. Под воздействием факторов неспецифической защиты макроорганизма часть боррелий погибает, выделяя эндотоксин, который запускает каскад иммунопатологических реакций [34]. В настоящее время доказана патогенность 3 видов B. burgdorferi sensu lato: B. burgdorferi sensu stricto, B. garinii и B. afzelii. Патогенные для человека виды боррелий комплекса B. burgdorferi sensu lato адаптировались в процессе эволюции к выживанию в различных биологических объектах окружающей среды: в клещах и их «прокормителях» — позвоночных животных, что достигается за счет функционирования различных регуляторных генов, изменяющих уровень экспрессии ряда белков на протяжении жизненного цикла [12, 29, 48]. Боррелии имеют группы антигенов: поверхностные (OspA, OspB, OspD, OspE и OspF), жгутиковый и цитоплазматический.
Инкубационный период составляет 3—30 дней (в среднем 7 дней). Способность боррелий к самостоятельным поступательным движениям в тканях находит свое отражение в особенностях местного воспаления. В центре эритемы (в месте первоначального накопления возбудителя) боррелии подвергаются активному воздействию факторов воспаления, они теряют свою подвижность и их количество уменьшается, результатом чего является формирование в центре эритемы зоны просветления. Появление новых колец гиперемии связано с новыми генерациями боррелий и обычно приводит к развитию характерной МЭ.
Патогистологическая картина в ранние сроки развития МЭ (первые 15 сут) характеризуется признаками экссудативно-продуктивного воспаления и представлена субэпидермальными и подроговыми пузырями, характерными для центральных участков эритемы. В эпидермисе отмечается гиперкератоз, гидропическая дистрофия эпителиоцитов базального слоя, редко — койлоцитоз.
Дифференциальную диагностику МЭ необходимо проводить прежде всего с другими фигурными эритемами: кольцевидной центробежной эритемой Дарье, ревматической эритемой Лендорфа—Лейнера, фигурной персистирующей эритемой, нейтрофильной эритемой, эозинофильной кольцевидной эритемой, извилистой ползучей эритемой Гаммела. Проблема дифференциальной диагностики МЭ также обусловлена многообразием неспецифических экзантематозных высыпаний фигурных очертаний, чаще вызванных вирусными инфекциями. Дифференциальный диагноз МЭ в виде гомогенного очага следует проводить с эритемной формой рожистого воспаления, пятнистой формой токсидермии, в том числе с фиксированной эритемой, с реакцией на укусы насекомых, кольцевидной гранулемой, микробной экземой и другими дерматозами, проявляющимися очагами кольцевидной формы.
Проблема дифференциальной диагностики МЭ также обусловлена многообразием неспецифических экзантематозных высыпаний фигурных очертаний, чаще вызванных вирусными инфекциями. Дифференциальный диагноз МЭ в виде гомогенного очага следует проводить с эритемной формой рожистого воспаления, пятнистой формой токсидермии, в том числе с фиксированной эритемой, с реакцией на укусы насекомых, кольцевидной гранулемой, микробной экземой и другими дерматозами, проявляющимися очагами кольцевидной формы.
Прогноз при МЭ обычно благоприятный. МЭ регрессирует спонтанно (как правило, в течение 1—2 мес), но может длительно персистировать от 6 до 12 мес [30]. Терапия Б.Л. наиболее эффективна на ранних стадиях инфекции, благоприятный исход заболевания и выздоровление зависят от своевременности начатого этиотропного лечения. Поэтому М.Э. требует проведения этиотропной терапии. Терапия М.Э., как и других проявлений БЛ, включает назначение антибиотиков. Препаратом первой линии являются доксициклин и цефуроксим, может применяться амоксициллин и эритромицин.

С целью профилактики БЛ применяют вакцины, содержащие антитела против поверхностного липопротеина, А спирохет — OspA (Lymerix), эффективность которых составляет 70—80% [42]. Однако накопились данные о неблагоприятном воздействии вакцинации и наличии поствакцинальных осложнений, обусловленных артритогенным потенциалом липопротеина OspA. В настоящее время исследователи [44] акцентируют внимание на потенциальных антигенах для второй генерации вакцин (OspC, DbpA, OspB, p35, p37, p66).
Несмотря на мощную антибиотикотерапию МЭ с длительным курсом и относительно большими разовыми дозами, формирование хронических форм инфекции наступает у 3,5—30% больных. При лечении хронических форм БЛ эффективность этиотропной терапии снижается и составляет 43,2—48,7% [6].
При изучении патогенеза заболевания у больных Лайм-боррелиозом были получены данные о том, что липопротеины боррелий, в частности OspA, являются потенциальными активаторами воспалительной реакции за счет связывания с CD14 и TLR2 на макрофагах [11]. Активация рецепторов TLR2, TLR6, TLR½, TLR5, TLR9 приводит к секреции провоспалительных цитокинов [46]. Димеры рецепторов TLR2/TLR6, TLR2/TLR1 через распознавание триацилированных липопротеинов, таких как Borrelia burgdorferi OspA, флагеллина, пептидогликанов и зимозана, участвуют в активации ядерного транскрипционного фактора NfkB [25, 28, 35]. J. Salazar и соавт. [36] в ходе исследования периферической крови и аспиратов у пациентов с МЭ также обнаружили высокую экспрессию TLR2, TLR1 и TLR4 на поверхности моноцитов, макрофагов, дендритных клетках. При развитии МЭ продукция флагеллина способствует выраженной экспрессии TLR5 и усилению функциональной активности TLR5 на человеческих кератиноцитах. Выявлено, что мононуклеарные лейкоциты периферической крови по действием Borrelia снижают уровни TLR2 и TLR4 мРНК, в то время как экспрессия соответствующих белков на моноцитах не снижается [22]. В результате проведения экспериментальных работ выявлено, что у мышей, дефицитных по TLR2 или TLR1, отмечались низкие уровни антител к OspA после вакцинации, что указывает на нарушение кооперации и функционирования эффекторов адаптивного иммунитета [17].
Активация рецепторов TLR2, TLR6, TLR½, TLR5, TLR9 приводит к секреции провоспалительных цитокинов [46]. Димеры рецепторов TLR2/TLR6, TLR2/TLR1 через распознавание триацилированных липопротеинов, таких как Borrelia burgdorferi OspA, флагеллина, пептидогликанов и зимозана, участвуют в активации ядерного транскрипционного фактора NfkB [25, 28, 35]. J. Salazar и соавт. [36] в ходе исследования периферической крови и аспиратов у пациентов с МЭ также обнаружили высокую экспрессию TLR2, TLR1 и TLR4 на поверхности моноцитов, макрофагов, дендритных клетках. При развитии МЭ продукция флагеллина способствует выраженной экспрессии TLR5 и усилению функциональной активности TLR5 на человеческих кератиноцитах. Выявлено, что мононуклеарные лейкоциты периферической крови по действием Borrelia снижают уровни TLR2 и TLR4 мРНК, в то время как экспрессия соответствующих белков на моноцитах не снижается [22]. В результате проведения экспериментальных работ выявлено, что у мышей, дефицитных по TLR2 или TLR1, отмечались низкие уровни антител к OspA после вакцинации, что указывает на нарушение кооперации и функционирования эффекторов адаптивного иммунитета [17]. В ходе экспериментальной работы на мышиной модели иксодового клещевого боррелиоза выявлено, что с 14-го дня развития инфекции стимуляция антигеном DbpA увеличивала количество Т-лимфоцитов, несущих TLR2-рецепторы: количество CD4+ увеличивалось в 2,3—7 раз, CD8+ — в 2,2—5,6 раза. В 1-ю неделю после заражения доля CD4+, синтезирующих IFN-γ клеток, увеличивалась в 2,5 раза, но через 14 дней снижалась до нормального уровня. Субпопуляция CD4+ продуцирующих TNF-α увеличивалась на 7-е сутки, однако нормализация их уровня происходила к 30-м суткам. В ходе развития заболевания отмечалось увеличение субпопуляции Тh3, синтезирующих IL-4, и уменьшение субпопуляции Тh2, синтезирующих IFN-γ [3].
В ходе экспериментальной работы на мышиной модели иксодового клещевого боррелиоза выявлено, что с 14-го дня развития инфекции стимуляция антигеном DbpA увеличивала количество Т-лимфоцитов, несущих TLR2-рецепторы: количество CD4+ увеличивалось в 2,3—7 раз, CD8+ — в 2,2—5,6 раза. В 1-ю неделю после заражения доля CD4+, синтезирующих IFN-γ клеток, увеличивалась в 2,5 раза, но через 14 дней снижалась до нормального уровня. Субпопуляция CD4+ продуцирующих TNF-α увеличивалась на 7-е сутки, однако нормализация их уровня происходила к 30-м суткам. В ходе развития заболевания отмечалось увеличение субпопуляции Тh3, синтезирующих IL-4, и уменьшение субпопуляции Тh2, синтезирующих IFN-γ [3].
Получены данные о высокой спонтанной и антиген-стимулированной продукции IL-2, повышении спонтанной и угнетении индуцированной продукции IFN-γ у больных хронической БЛ, при высоком уровне спонтанной продукции IL-4 и индуцированной продукции TGF-β, что свидетельствует о вовлечении в иммунную регуляцию механизмов, ограничивающих функциональную активность Thl-клеток. По мнению авторов [4, 34], полученные данные могут указывать на формирование хронического специфического воспаления по типу гиперчувствительности замедленного типа (ГЗТ), характерного для хронического инфекционного процесса с внутриклеточной локализацией. При Б.Л. развивается Th2-опосредованный иммунный ответ с высоким уровнем продукции IFN-γ. При изучении фагоцитоза у больных БЛ выявили повышение фагоцитарного индекса при острой форме заболевания по сравнению с хронической формой [1]. В ряде исследований показано, что при хроническом течении БЛ отмечаются снижение функциональной активности нейтрофилов по сравнению с группой здоровых лиц, снижение количества CD3+, CD4+, CD22+ клеток, NK-клеток CD16+, на фоне повышения CD8+, сывороточных иммуноглобулинов классов IgG, IgM, IgA, циркулирующих иммунных комплексов (ЦИК). Выявленные нарушения в системе иммунитета у больных хроническим БЛ свидетельствуют, по мнению авторов, о снижении активности механизмов неспецифической резистентности организма, что может создавать условия для длительной персистенции возбудителя.
По мнению авторов [4, 34], полученные данные могут указывать на формирование хронического специфического воспаления по типу гиперчувствительности замедленного типа (ГЗТ), характерного для хронического инфекционного процесса с внутриклеточной локализацией. При Б.Л. развивается Th2-опосредованный иммунный ответ с высоким уровнем продукции IFN-γ. При изучении фагоцитоза у больных БЛ выявили повышение фагоцитарного индекса при острой форме заболевания по сравнению с хронической формой [1]. В ряде исследований показано, что при хроническом течении БЛ отмечаются снижение функциональной активности нейтрофилов по сравнению с группой здоровых лиц, снижение количества CD3+, CD4+, CD22+ клеток, NK-клеток CD16+, на фоне повышения CD8+, сывороточных иммуноглобулинов классов IgG, IgM, IgA, циркулирующих иммунных комплексов (ЦИК). Выявленные нарушения в системе иммунитета у больных хроническим БЛ свидетельствуют, по мнению авторов, о снижении активности механизмов неспецифической резистентности организма, что может создавать условия для длительной персистенции возбудителя. Недостаточность CD22+ клеток и повышение уровня ЦИК создает условия к развитию аутоиммунной патологии [2, 4]. Клетки крови больных персистирующим БЛ высвобождают низкие уровни провоспалительных цитокинов TNF-α и IFN-γ. Однако мнения авторов по этому вопросу неоднозначны. Имеются исследования, в которых приведены противоположные результаты. Липопротеины боррелий, в частности, OspA, являются потенциальными активаторами воспалительной реакции за счет связывания с CD14+ и Toll-подобным рецептором-2 (TLR2) на макрофагах. В результате этого усиливается секреция провоспалительных цитокинов (IL-1b, IL-6, IL-10, IL-12) и TNF-α [22, 36, 46].
Недостаточность CD22+ клеток и повышение уровня ЦИК создает условия к развитию аутоиммунной патологии [2, 4]. Клетки крови больных персистирующим БЛ высвобождают низкие уровни провоспалительных цитокинов TNF-α и IFN-γ. Однако мнения авторов по этому вопросу неоднозначны. Имеются исследования, в которых приведены противоположные результаты. Липопротеины боррелий, в частности, OspA, являются потенциальными активаторами воспалительной реакции за счет связывания с CD14+ и Toll-подобным рецептором-2 (TLR2) на макрофагах. В результате этого усиливается секреция провоспалительных цитокинов (IL-1b, IL-6, IL-10, IL-12) и TNF-α [22, 36, 46].
При изучении влияния B. burgdorferi на моноциты человека показана индукция экспрессии TLRs и продукция про- и противовоспалительных цитокинов (TNF-α, IL-6, IL-10 и IL-1β), эпителиального IL-8, а также IFN-β. В свою очередь TGF-β в комбинации с IL-6 индуцирует синтез провоспалительных цитокинов IL-1β и TNF-α [18, 43]. Предполагают, что OspA B. burgdorferi может участвовать в запуске аутоиммунного воспаления и провоцировать развитие Лайм-артрита через дифференциацию Th-клеток, которые экспрессируют IL-17. В эксперименте на B. burgdorferi-вакцинированных мышах также было показано, что ключевую роль в развитии артрита играет IL-17. Более того, IL-17 может стимулировать фибробласты и синовиоциты к продукции провоспалительных цитокинов, включая IL-6 [21]. Индукция IL-17 в зоне МЭ приводит к уменьшению количества положительных эпидермальных клеток Лангерганса (CD1a), обеспечивающих «захват» боррелий на ранних стадиях инфекции, способствуя тем самым хронизации инфекционного процесса [14]. В развитии Лайм-артрита ведущую роль традиционно ранее приписывали Th2-цитокинам, таким как IFN-γ, однако в ходе недавно проведенных исследований было выявлено, что OspA B. burgdorferi может участвовать в запуске аутоиммунного воспаления и провоцировать развитие артрита через дифференциацию Th-клеток, экспрессирующих IL-17 [26, 38].
burgdorferi может участвовать в запуске аутоиммунного воспаления и провоцировать развитие Лайм-артрита через дифференциацию Th-клеток, которые экспрессируют IL-17. В эксперименте на B. burgdorferi-вакцинированных мышах также было показано, что ключевую роль в развитии артрита играет IL-17. Более того, IL-17 может стимулировать фибробласты и синовиоциты к продукции провоспалительных цитокинов, включая IL-6 [21]. Индукция IL-17 в зоне МЭ приводит к уменьшению количества положительных эпидермальных клеток Лангерганса (CD1a), обеспечивающих «захват» боррелий на ранних стадиях инфекции, способствуя тем самым хронизации инфекционного процесса [14]. В развитии Лайм-артрита ведущую роль традиционно ранее приписывали Th2-цитокинам, таким как IFN-γ, однако в ходе недавно проведенных исследований было выявлено, что OspA B. burgdorferi может участвовать в запуске аутоиммунного воспаления и провоцировать развитие артрита через дифференциацию Th-клеток, экспрессирующих IL-17 [26, 38]. Кроме того, в исследовании показано, что IFN-γ не только не индуцирует синтез анти-OspA антител, но и играет важную роль в супрессии продукции антиборрелиозных антител, что может стать обоснованием разработки высокоэффективных вакцин [32].
Кроме того, в исследовании показано, что IFN-γ не только не индуцирует синтез анти-OspA антител, но и играет важную роль в супрессии продукции антиборрелиозных антител, что может стать обоснованием разработки высокоэффективных вакцин [32].
По субпопуляционному составу лимфоцитов периферической крови при острой и хронической формах БЛ различий не было выявлено [1]. При Лайм-боррелиозе гуморальный иммунитет характеризуется преимущественным синтезом IgG1 и IgG3 субклассов антител, участвующих в активации комплемента и процессе опсонизации боррелий. Продукция иммуноглобулинов подкласса IgG2 незначительна, а IgG4 — отсутствует [8].
Таким образом, на современном этапе МЭ, являясь наиболее распространенной нозологической формой в группе фигурных эритем и патогномоничным признаком ранней стадии часто встречаемого трансмиссивного заболевания — БЛ, характеризуется торпидным хроническим течением и сопровождается нарушениями в системе врожденного и адаптивного иммунитета. Развитие М. Э. при БЛ происходит на фоне недостаточности клеточных и/или гуморальных факторов неспецифической резистентности организма, что определяет необходимость своевременного проведения этиотропной терапии и направленность патогенетической терапии ранней стадии БЛ с целью предотвращения развития тяжелых торпидных форм.
Э. при БЛ происходит на фоне недостаточности клеточных и/или гуморальных факторов неспецифической резистентности организма, что определяет необходимость своевременного проведения этиотропной терапии и направленность патогенетической терапии ранней стадии БЛ с целью предотвращения развития тяжелых торпидных форм.
Конфликт интересов отсутствует.
Мигрирующая эритема — причины, симптомы, диагностика и лечение
Мигрирующая эритема (хроническая мигрирующая эритема Афцелиуса-Липшютца) – кожное проявление первой стадии боррелиозной инфекции. Возникает в месте укуса заражённого боррелиозом клеща при проникновении возбудителя болезни в кожу со слюной насекомого. Отличительной особенностью эритемы является её постоянное увеличение в размерах с одновременным разрешением гиперемии в центре. Патология диагностируется после консультации врача-инфекциониста с учетом данных иммуноферментного анализа венозной крови на антитела к возбудителю. Лечение – антибиотикотерапия, иногда глюкокортикоиды и антигистаминные средства.
Лечение – антибиотикотерапия, иногда глюкокортикоиды и антигистаминные средства.
Общие сведения
Мигрирующая эритема – инфекционный дерматоз, возникающий при укусе клеща, который является передатчиком боррелиоза. Характеризуется высокой скоростью распространения и быстрым изменением границ патологического очага, что обуславливает использование слова «мигрирующая» в названии заболевания. Патология не имеет возрастных, расовых и гендерных особенностей. Природные очаги боррелиоза постоянно расширяются. Совсем недавно эндемичными территориями считались США, Австралия, островная Европа, Приморье и Сибирь, в настоящее время клещ встречается практически повсеместно. 80% случаев заболевания регистрируются летом.
Впервые «мигрирующий дерматит» неясной этиологии был описан А. Афцелиусом в 1908 году. Мигрирующей эритемой заболевание назвал Б. Липшютц в 1913 году. В качестве аллергической реакции кожи при болезни Лайма дерматологи рассматривают мигрирующую эритему, начиная с 70-80х годов прошлого века, после открытия боррелии и составления описания боррелиоза. В настоящее время связь между мигрирующей эритемой и боррелиозом практически не дискутируется, дерматоз считается ранним кожным маркером болезни Лайма. Актуальность проблемы связана с миграцией клещей, большим количеством заражённых боррелиозом особей в популяции, длительным периодом их активного существования (с мая по сентябрь), обитанием в лесных массивах, городских садах, парках и скверах.
В настоящее время связь между мигрирующей эритемой и боррелиозом практически не дискутируется, дерматоз считается ранним кожным маркером болезни Лайма. Актуальность проблемы связана с миграцией клещей, большим количеством заражённых боррелиозом особей в популяции, длительным периодом их активного существования (с мая по сентябрь), обитанием в лесных массивах, городских садах, парках и скверах.
Мигрирующая эритема
Причины мигрирующей эритемы
Возбудитель мигрирующей эритемы – боррелия, переносчиком которой является заражённый иксодовый клещ. Существуют природные очаги его обитания, клещ встречается в лесах, прибрежных зонах и парках, где насекомое обитает на стеблях цветов и трав. Заражение человека происходит в момент укуса, когда со слюной клещ впрыскивает в кровь боррелию. Продолжительность пребывания переносчика на коже не имеет значения, инфекционно-аллергический процесс начинает развиваться сразу после проникновения слюны с возбудителем в кровь пациента. Хозяевами боррелий являются домашние или дикие животные, клещ выступает только в роли пожизненного носителя, становясь переносчиком инфекции после укуса заражённого животного.
Хозяевами боррелий являются домашние или дикие животные, клещ выступает только в роли пожизненного носителя, становясь переносчиком инфекции после укуса заражённого животного.
Укус клеща нарушает целостность кожных покровов. Часть боррелий остаётся в месте внедрения, остальные с током крови и лимфы разносятся ко всем органам и тканям, оседают в лимфатических узлах. Инфекционно-аллергическая эритема является патогномоничным проявлением дебюта болезни Лайма и образуется на коже в первые часы с момента заражения. Вслед за ней через месяц появляется полиорганная симптоматика. Следует отметить тот факт, что в 25% случаев мигрирующая эритема не развивается. Вероятно, это связано с особенностями функционирования иммунной системы организма, силой ответной реакции, количеством проникшего в кожу возбудителя и его вирулентностью.
Боррелия внедряется в кожу, по лимфатическим сосудам проникает в глубокие слои и вызывает воспаление, одновременно сенсибилизируя дерму. В процессе альтерации, экссудации и пролиферации участвуют клетки иммунной и гистиоцитарной системы кожи, лимфоциты и макрофаги. Они связывают боррелии, воспринимая их как чужеродные антигены. Одновременно происходит стимуляция клеточной пролиферации с замещением дефекта ткани в месте укуса клеща.
В процессе альтерации, экссудации и пролиферации участвуют клетки иммунной и гистиоцитарной системы кожи, лимфоциты и макрофаги. Они связывают боррелии, воспринимая их как чужеродные антигены. Одновременно происходит стимуляция клеточной пролиферации с замещением дефекта ткани в месте укуса клеща.
Сама эритема возникает в результате извращённой реакции расширения сосудов кожи, замедления кровотока и увеличения давления плазмы на стенки капилляров. В результате перечисленных процессов «выдавленная» из сосудов часть плазмы пропитывает дерму, которая отекает, приподнимая пятно над окружающей кожей. Вслед за плазмой в дерму мигрируют Т-лимфоциты сосудистого русла, которые контролируют чужеродное внедрение, ликвидируя оставшиеся боррелии. Эритема начинает разрешаться с центра. В зоне первичного повреждения воспаление стихает, а по краям продолжает расти эритематозный вал из Т-лимфоцитов и дермальных клеток. Именно так, центробежно, увеличиваются размеры эритемы.
Симптомы мигрирующей эритемы
Мигрирующая эритема является ключевым признаком, позволяющим установить наличие боррелиоза, поэтому ранняя диагностика этого заболевания чрезвычайно важна. Патологический процесс при возникновении мигрирующей эритемы имеет инкубационный период продолжительностью 32 дня и включает 3 клинические стадии развития: раннюю, диссеминированную и позднюю.
Патологический процесс при возникновении мигрирующей эритемы имеет инкубационный период продолжительностью 32 дня и включает 3 клинические стадии развития: раннюю, диссеминированную и позднюю.
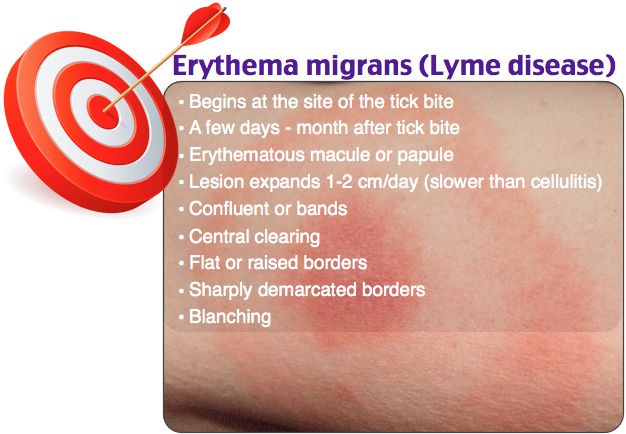
На ранней (местной, локализованной) стадии мигрирующей эритемы на коже появляется ярко-розовое или красное пятно с папулой или макулой в центре (в месте укуса). Пятно немного выпуклое, горячее на ощупь, имеет чёткие границы и быстро растёт. После увеличения до 5 сантиметров начинается разрешение элемента в центральной части, пятно приобретает кольцевидную форму. Возможны неприятные ощущения, реже – зуд, жжение и боль в зоне поражения. Иногда наблюдаются продромальные явления, безжелтушный гепатит и признаки поражения мозговых оболочек. Пятна сохраняются в течение 3-30 дней, а затем начинают шелушиться и «растворяются», оставляя небольшую гиперпигментацию по контуру. При подключении антибактериальной терапии на этом патологический процесс останавливается. При отсутствии лечения или недостаточной терапии наступает вторая стадия.
В диссеминированной стадии мигрирующей эритемы боррелии в большом количестве поступают в кровь из лимфоузлов. Эритема увеличивается в размерах. Происходит дополнительная сенсибилизация организма, отмечается снижение иммунитета. Появляются новые множественные уртикарные высыпания и вторичные кольцевидные элементы, возможна доброкачественная лимфоцитома кожи. Присоединяются температура и головная боль, нарастают слабость и бессонница, выявляются неврологические и кардиальные симптомы. Вторая стадия длится от 6 месяцев до 2 лет. При недостаточном иммунном ответе, некорректно рассчитанной дозе лекарственного препарата, высокой вирулентности и большом количестве боррелий заболевание переходит в третью стадию.
Хроническая (поздняя) стадия мигрирующей эритемы характеризуется развитием акродерматита и хронического Лайм-артрита. Наблюдается симметричное поражение суставов, сопровождающееся отеком, ограничением движений, локальной гиперемией и гипертермией.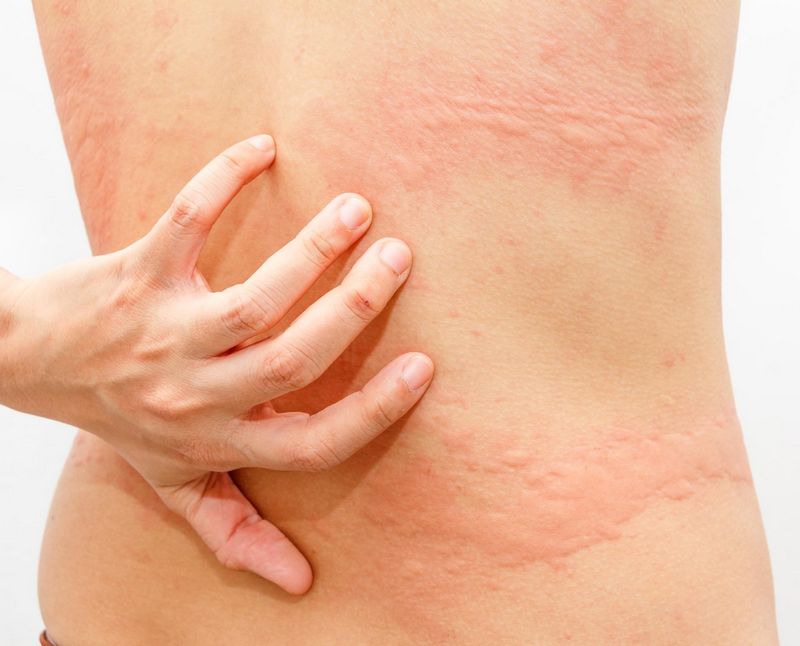 Мигрирующая эритема приобретает фиолетовый оттенок, истончается и атрофируется в центре, через кожу начинают просвечивать сосуды и подлежащие ткани. При этом пятно по-прежнему растёт, увеличиваясь в размерах, но локализуется уже не в месте укуса клеща, а рядом с суставами или на разгибательной поверхности конечностей. Стадия длится годами.
Мигрирующая эритема приобретает фиолетовый оттенок, истончается и атрофируется в центре, через кожу начинают просвечивать сосуды и подлежащие ткани. При этом пятно по-прежнему растёт, увеличиваясь в размерах, но локализуется уже не в месте укуса клеща, а рядом с суставами или на разгибательной поверхности конечностей. Стадия длится годами.
Диагностика мигрирующей эритемы
Быстрота и точность диагностики при мигрирующей эритеме важны для своевременного купирования процесса. Диагноз выставляется коллегиально врачом-дерматологом и врачом-инфекционистом на основании клинической картины и данных анамнеза. Для подтверждения проводят иммуноферментный анализ венозной крови, взятой через 21 день после укуса клеща (раньше антитела не различимы), на антитела к боррелиям. Применяют метод непрямой иммунофлуоресценции (РНИФ), иммуноблоттинг (сочетание электрофореза и ИФА или РИА). Реже используют иммунофлюорометрию и реакцию непрямой агглютинации.
Для исключения менингита и сочетанной инфекции проводят люмбальную пункцию с исследованием спинномозговой жидкости методом ПЦР и ИФА. Патоморфологическая картина неспецифична. Мигрирующую эритему дифференцируют с укусами пчёл и других насекомых, дерматитом, трихофитией, сифилитической розеолой, склеродермией, эритемой Дарье, мигрирующим миазом.
Патоморфологическая картина неспецифична. Мигрирующую эритему дифференцируют с укусами пчёл и других насекомых, дерматитом, трихофитией, сифилитической розеолой, склеродермией, эритемой Дарье, мигрирующим миазом.
Лечение мигрирующей эритемы
Самолечение исключается. Лечение мигрирующей эритемы патогенетическое, проводится врачом-инфекционистом. Необходимость в местной терапии отсутствует. Во время инкубационного периода превентивно в амбулаторных условиях назначают цефалоспорины, антибиотики тетрациклинового и пенициллинового ряда. Аналогичную терапию продолжают на ранней стадии заболевания. Индивидуальную схему приёма антибактериальных препаратов рассчитывают для каждого пациента на килограмм веса. При возникновении осложнений или резистентности к проводимой терапии осуществляют инъекционное введение антибиотиков в сочетании с антигистаминными средствами. В тяжёлых случаях применяют глюкокортикоиды.
После купирования мигрирующей эритемы пациент обязан находиться на диспансерном наблюдении у врача инфекциониста в течение 1,5-3 лет (в зависимости от тяжести патологического процесса), периодически сдавая анализ крови на титр антител к боррелиям.
Профилактика и пргноз мигрирующей эритемы
Специфической профилактики боррелиоза не существует. Летом, в фазу активной жизнедеятельности клещей, нужно минимизировать риск попадания насекомых на кожу: помнить, что клещи живут в траве, использовать репелленты при выезде на природу, одеваться в светлые одежды, максимально закрывающие кожу от насекомых (длинные рукава, брюки с резинками, высокие сапоги, головные уборы), осматривать кожу по возвращении домой.
При укусе клеща не следует дожидаться развития мигрирующей эритемы. Необходимо снять насекомое с кожи, поместить в герметичный сосуд и сдать на анализ в СЭС. Нужно обратиться к инфекционисту, который может сделать инъекцию интерферона или (реже) назначить профилактический курс антибактериальной терапии. После получения результатов анализа решение о дальнейшем ведении пациента принимает специалист. Прогноз при своевременной диагностике и лечении благоприятный.
Вилли Бургдорфер: Болезнь Лайма — PDF Скачать Бесплатно
The Journalof EmergencyMedicine, Vol 14, No 5.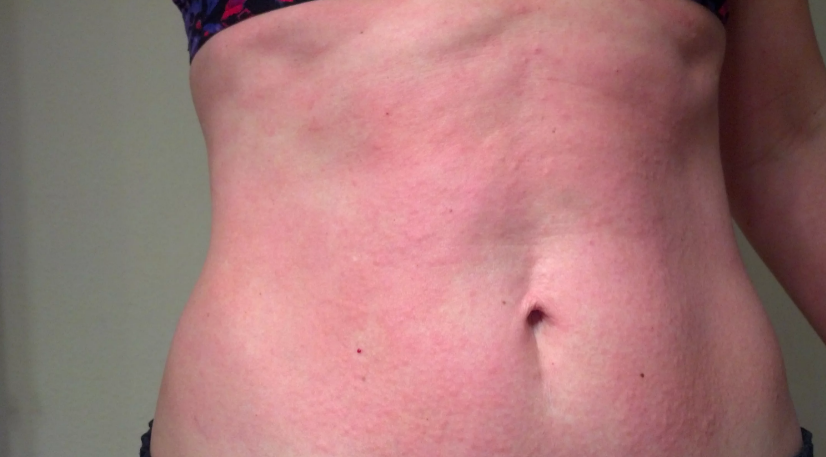 pp 63I-634, 1996 Copyright8 1996ElsevierScienceInc. Отпечатано в США. Все права защищены 0736-4679196 $15.00+ .-Xl ELSEVIER
pp 63I-634, 1996 Copyright8 1996ElsevierScienceInc. Отпечатано в США. Все права защищены 0736-4679196 $15.00+ .-Xl ELSEVIER
PII SO736.4679(%)00143-6
ВИЛЛИ БУРГДОРФЕР: LYME D George Sternbach,
MD, FACEP, 3 Lho 90 Dibble, 30 Lho 9004b and
90*Служба неотложной медицинской помощи, Медицинский центр Стэнфордского университета, Стэнфорд, Калифорния tStanford Health Services, Медицинский центр Стэнфордского университета, Стэнфорд, Калифорния Перепечатка Адрес: д-р Джордж Стернбах, MD, Служба неотложной медицинской помощи, Медицинский центр Стэнфордского университета, Стэнфорд, Калифорния 94305
q Резюме. Задокументированная история мигрирующей эритемы восходит к 1909 году, когда Арвид Афкселиус описал случай этого кожного поражения на встрече дерматологов в Швеции. Он предположил, что сыпь, вероятно, была вызвана укусом клеща. Первоначальное описание Лайм-артрита появилось в 1977 году, и у ряда пациентов, описанных в серии tbii, развилась сыпь, предположительно являющаяся мигрирующей эритемой. Четыре года спустя Бургдорфер обнаружил присутствие спирохет (впоследствии названных Borrelia burg&fleti) в клещах из эндемического очага лаймского артрита и определил, что это возбудитель заболевания. Болезнь Лайма является наиболее распространенной клещевой инфекцией в Соединенных Штатах. Его естественное течение было разделено на три клинические стадии. Инфекция начинается с сыпи и других симптомов и может прогрессировать от нескольких дней до недель до диссеминированной стадии и от месяцев до лет до поздней стадии. Имеется мало информации (за исключением мигрирующей эритемы) о клинических особенностях болезни, характерной для болезни Лайма. Существует ряд эффективных схем лечения антибиотиками, и, хотя острая инфекция обычно хорошо поддается лечению, лечение хронических заболеваний с помощью антибиотиков менее стабильно. Что касается аутибиотической профилактики, то несколько проведенных исследований привели к выводу, что даже в эндемичных районах риск заражения настолько низок, что рутинное назначение лечения после укуса клеща нецелесообразно.
Четыре года спустя Бургдорфер обнаружил присутствие спирохет (впоследствии названных Borrelia burg&fleti) в клещах из эндемического очага лаймского артрита и определил, что это возбудитель заболевания. Болезнь Лайма является наиболее распространенной клещевой инфекцией в Соединенных Штатах. Его естественное течение было разделено на три клинические стадии. Инфекция начинается с сыпи и других симптомов и может прогрессировать от нескольких дней до недель до диссеминированной стадии и от месяцев до лет до поздней стадии. Имеется мало информации (за исключением мигрирующей эритемы) о клинических особенностях болезни, характерной для болезни Лайма. Существует ряд эффективных схем лечения антибиотиками, и, хотя острая инфекция обычно хорошо поддается лечению, лечение хронических заболеваний с помощью антибиотиков менее стабильно. Что касается аутибиотической профилактики, то несколько проведенных исследований привели к выводу, что даже в эндемичных районах риск заражения настолько низок, что рутинное назначение лечения после укуса клеща нецелесообразно. 0 Ключевые слова-Lyme thema migrans
0 Ключевые слова-Lyme thema migrans
болезнь; Лайм-боррелиоз;
Школа медицины сообщила о серии случаев, которые стали известны следующим образом: в ноябре 1975 года мать из Олд-Лайма, штат Коннектикут, сообщила в Департамент здравоохранения штата, что 12 детей из этой небольшой общины в 5000 человек, четверо из которых жили недалеко друг от друга на одной дороге, заболели заболевание, диагностированное как ювенильный ревматоидный артрит. Вторая мать из того же района подала аналогичный отчет, и Стир, научный сотрудник-ревматолог из Йельского университета, отреагировал на это введением системы наблюдения в трех смежных и малонаселенных общинах Коннектикута: Лайме, Олд Лайме и Восточном Хаддаме. В результате был собран 51 случай (39детей и 12 взрослых), у которых моноартикулярный или олигоартикулярный артрит сопровождался разнообразными проявлениями, включая лихорадку, головную боль, утомляемость, миалгию и сыпь. Вскоре стало ясно Steere et al. что, что касается первоначального впечатления о ювенильном ревматоидном артрите, «много проблем с этим диагнозом возникло как по клиническим, так и по эпидемиологическим причинам». Они предложили термин «артрит Лайма» для обозначения ранее неизвестной патологии (1). Перед началом артрита у 13 пациентов развилось красное кольцевидное поражение кожи с частичным просветлением в центре, которое начиналось как эритематозная папула. Хотя пациенты и их врачи предположили, что папула возникла в результате укуса насекомого, только один пациент мог вспомнить, что действительно был укушен клещом в этом месте.
Они предложили термин «артрит Лайма» для обозначения ранее неизвестной патологии (1). Перед началом артрита у 13 пациентов развилось красное кольцевидное поражение кожи с частичным просветлением в центре, которое начиналось как эритематозная папула. Хотя пациенты и их врачи предположили, что папула возникла в результате укуса насекомого, только один пациент мог вспомнить, что действительно был укушен клещом в этом месте.
ery-
ИСТОРИЯ
Первоначальное описание артрита Лайма появилось в 1977 г., когда Steere et al. (1) из Йельского университета Medical Classics координируется George California
Sternbach,
ПОЛУЧЕНО: 19 января 1996 г.; ПРИНЯТО: 18 марта 1996 г. 631
MD, из
Медицинский центр Стэнфордского университета, Стэнфорд,
632 Из-за географической концентрации случаев в густо лесистых, малонаселенных районах и пика заболеваемости в летние месяцы Steere et al. . постулировал, что этот синдром «лучше всего объясняется передачей агента членистоногим-переносчиком». Считалось, что поражение кожи соответствует описанию «хронической мигрирующей эритемы, которая… . . сообщалось в Европе, особенно в Скандинавии, но только недавно в Соединенных Штатах». Хотя переносчик, вызывающий эту сыпь, оспаривался, «считалось, что болезнь передается овечьим клещом Zxodes ricinus» (1). На самом деле история мигрирующей эритемы в Европе датируется 19 октября.09, когда Арвид Афзелиус представил дело Дерматологическому обществу Стокгольма (2,3). Этот случай касался пациента, у которого развилось кожное поражение, которое из-за его распространения на поверхности кожи Афцелиус назвал мигрирующей критемой. Двенадцать лет спустя (к этому времени он столкнулся с шестью случаями) он представил более подробное изложение (3): «Клиническая картина очень характерна. Болезнь начинается с одного (и всегда только одного) довольно маленького круглого пятна. Он распространяется наружу, так что внешняя периферия образует маленькое кольцо шириной от 1 до 2 см. Это кольцо постепенно расширяется, а центр мало-помалу бледнеет, пока не принимает вполне естественный цвет кожи, иногда с легким синюшным оттенком.
Считалось, что поражение кожи соответствует описанию «хронической мигрирующей эритемы, которая… . . сообщалось в Европе, особенно в Скандинавии, но только недавно в Соединенных Штатах». Хотя переносчик, вызывающий эту сыпь, оспаривался, «считалось, что болезнь передается овечьим клещом Zxodes ricinus» (1). На самом деле история мигрирующей эритемы в Европе датируется 19 октября.09, когда Арвид Афзелиус представил дело Дерматологическому обществу Стокгольма (2,3). Этот случай касался пациента, у которого развилось кожное поражение, которое из-за его распространения на поверхности кожи Афцелиус назвал мигрирующей критемой. Двенадцать лет спустя (к этому времени он столкнулся с шестью случаями) он представил более подробное изложение (3): «Клиническая картина очень характерна. Болезнь начинается с одного (и всегда только одного) довольно маленького круглого пятна. Он распространяется наружу, так что внешняя периферия образует маленькое кольцо шириной от 1 до 2 см. Это кольцо постепенно расширяется, а центр мало-помалу бледнеет, пока не принимает вполне естественный цвет кожи, иногда с легким синюшным оттенком. Чем шире кольцо распространяется по периферии, тем бледнее и менее отчетливо оно становится, пока, наконец, через несколько недель или, самое большее, через несколько месяцев оно полностью не исчезнет. Несмотря на относительно короткую продолжительность поражения, к этому времени оно было переименовано в хроническую мигрирующую эритему (4). Связанные процессы, похоже, не были оценены. Один наблюдатель, пишущий в 1920, придерживался мнения, что «болезнь сама по себе не имеет значения и на нее скорее следует смотреть как на уродство» (5). Хотя Афцелиус допускал неуверенность в этиологии, ему казалось вероятным, что процесс «был вызван укусом клеща (Zxodes reduvius) или другого насекомого» (3). Именно это поражение было признано Steere et al. в Йельском университете, как у пациентов с артритом Лайма. Через несколько месяцев после публикации этого описания артрита Лайма Стир позвонил Вилли Бургдорферу в Национальную лабораторию Роки-Маунтин в Гамильтоне, штат Монтана, чтобы узнать о методах оценки клещей на наличие вторично приобретенных микроорганизмов (6).
Чем шире кольцо распространяется по периферии, тем бледнее и менее отчетливо оно становится, пока, наконец, через несколько недель или, самое большее, через несколько месяцев оно полностью не исчезнет. Несмотря на относительно короткую продолжительность поражения, к этому времени оно было переименовано в хроническую мигрирующую эритему (4). Связанные процессы, похоже, не были оценены. Один наблюдатель, пишущий в 1920, придерживался мнения, что «болезнь сама по себе не имеет значения и на нее скорее следует смотреть как на уродство» (5). Хотя Афцелиус допускал неуверенность в этиологии, ему казалось вероятным, что процесс «был вызван укусом клеща (Zxodes reduvius) или другого насекомого» (3). Именно это поражение было признано Steere et al. в Йельском университете, как у пациентов с артритом Лайма. Через несколько месяцев после публикации этого описания артрита Лайма Стир позвонил Вилли Бургдорферу в Национальную лабораторию Роки-Маунтин в Гамильтоне, штат Монтана, чтобы узнать о методах оценки клещей на наличие вторично приобретенных микроорганизмов (6).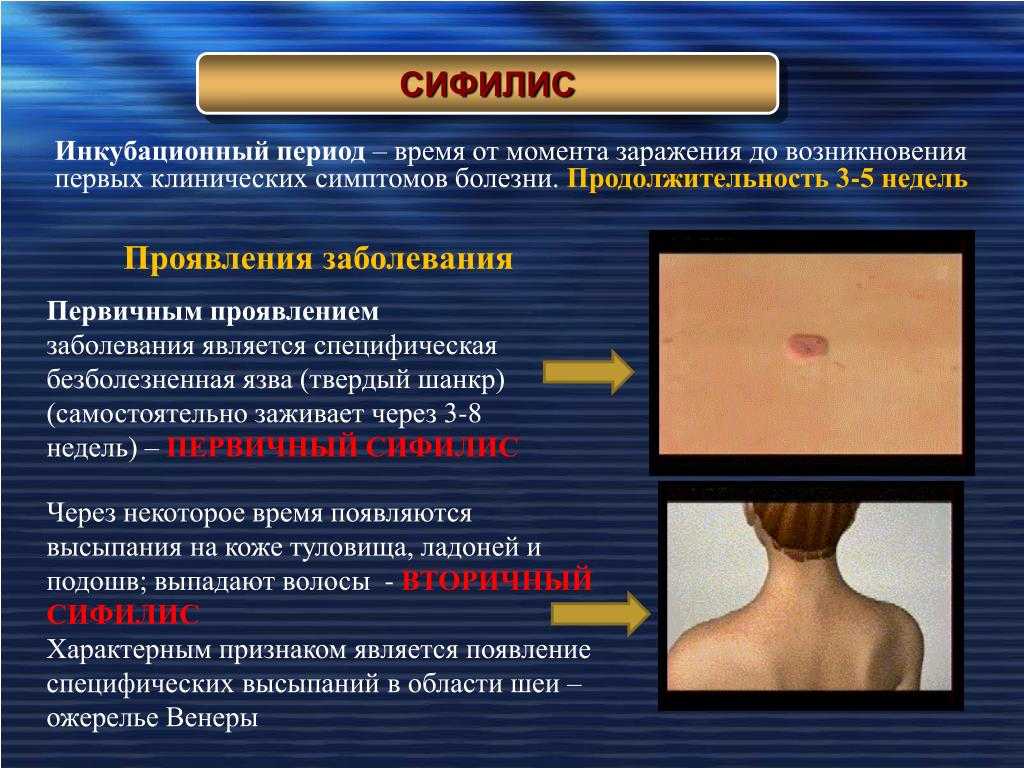 Бургдорфер был авторитетом в области болезней, переносимых клещами, и ему давно была известна гипотеза о том, что хроническая мигрирующая эритема вызывается спирофилией.0003
Бургдорфер был авторитетом в области болезней, переносимых клещами, и ему давно была известна гипотеза о том, что хроническая мигрирующая эритема вызывается спирофилией.0003
Г. Штернбах и Кл. Dibble chete связан с Zxodes ricinus. Эта гипотеза была впервые доведена до его сведения в ходе презентации почти 30 лет назад на собрании Южной медицинской ассоциации (7). В 1981 г. Бургдорфер, который в течение многих лет проводил исследования клещей и их симбиотических эндоцитобиотических бактерий, участвовал в исследованиях, направленных на выделение риккетсий из восточных оленьих клещей (Zxodes dammini), собранных на острове Шелтер, штат Нью-Йорк, в хорошо известном эндемическом очаге. артрита Лайма. Когда он исследовал мазки Гимзы из дивертикулов средней кишки двух таких клещей, он не обнаружил риккетсий, но вместо этого обнаружил наличие «довольно длинных, неправильно закрученных спирохет» (8). В следующем году Burgdorfer et al. сообщили о связи между этой спирохетой и болезнью Лайма (9): Недавно мы выделили из Z. dammini спирохету, которая связывает иммуноглобулины пациентов, выздоравливающих от болезни Лайма. . . . Методом прямой иммунофлюоресценции в образцах сыворотки больных болезнью Лайма было показано наличие антител к этому агенту. Предполагается, что недавно обнаруженная спирохета связана с этиологией болезни Лайма. Окончательное звено к кольцевидному поражению Афцелиуса было сформировано. В честь его первооткрывателя организм впоследствии был назван Borrelia burgdo+ri (10).
dammini спирохету, которая связывает иммуноглобулины пациентов, выздоравливающих от болезни Лайма. . . . Методом прямой иммунофлюоресценции в образцах сыворотки больных болезнью Лайма было показано наличие антител к этому агенту. Предполагается, что недавно обнаруженная спирохета связана с этиологией болезни Лайма. Окончательное звено к кольцевидному поражению Афцелиуса было сформировано. В честь его первооткрывателя организм впоследствии был назван Borrelia burgdo+ri (10).
КОММЕНТАРИЙ Хотя термин «боррелиоз Лайма» официально рекомендован для использования во всем мире ( 1 1 ), термин «болезнь Лайма» по-прежнему широко используется. Это самое распространенное клещевое заболевание в Соединенных Штатах. В период с 1982 по 1992 год было зарегистрировано около 50 000 случаев (12). Кроме того, он распространен в Европе (особенно в Швеции, Германии, Франции, Австрии, России и Швейцарии), и были зарегистрированы случаи в Южной Америке и Южной Африке (13,14). Заболеваемость в Канаде, по-видимому, намного ниже, чем в Соединенных Штатах, и большинство канадских случаев были сгруппированы в районах, граничащих с теми регионами Соединенных Штатов, где болезнь Лайма наиболее распространена, а именно на северо-востоке, в верхней части Среднего Запада (в основном в Миннесоте и Висконсине). ), и побережье Тихого океана ( 12). Естественное течение болезни Лайма, сходной с сифилисом, другой спирохетозной инфекцией, было разделено на три клинические стадии. Инфекция начинается с сыпи в виде мигрирующей эритемы и гриппоподобных симптомов и может прогрессировать через несколько дней или недель до диссеминированной стадии, а через месяцы или годы — до поздней стадии.0003
), и побережье Тихого океана ( 12). Естественное течение болезни Лайма, сходной с сифилисом, другой спирохетозной инфекцией, было разделено на три клинические стадии. Инфекция начинается с сыпи в виде мигрирующей эритемы и гриппоподобных симптомов и может прогрессировать через несколько дней или недель до диссеминированной стадии, а через месяцы или годы — до поздней стадии.0003
Вилли Бургдорфер: Болезнь Лайма Таблица 1. Клинические признаки болезни Лайма Стадия I: Ранняя локализованная инфекция Конституциональные симптомы Мигрирующая эритема Локализованная лимфаденопатия Стадия II: Ранняя диссеминированная инфекция Тяжелые конституциональные симптомы Вторичные мигрирующая эритема Скелетно-мышечные боли Миокардит Атриовентрикулярная блокада Неврит Миелит Генерализованная лимфаденопатия Стадия III Артрит Усталость Хронический энцефалит Хронический атрофический акродерматит
(хроническая) стадия (см. Таблицу 1). Однако не у всех пациентов наблюдается упорядоченное прохождение последовательных стадий. Более того, ни одна из этих особенностей не является специфичной для болезни Лайма. Проявления ранней болезни обычно самокупируются, тогда как проявления поздней стадии могут быть стойкими. Поздние стадии включают суставные и неврологические поражения (15-17). Небольшое количество поздних инфекций демонстрируют характерное кожное поражение, хронический атрофический акродерматит (ACA). Это поражение проявляется в виде голубовато-красных, медленно увеличивающихся узелков или бляшек, обычно начинающихся на разгибательных поверхностях дистальных отделов конечностей. Лабораторная диагностика болезни Лайма остается проблематичной. Хотя микроорганизмы Borrelia burgdor$eri были идентифицированы в образцах биопсии очагов мигрирующей эритемы (IS), такая биопсия нецелесообразна для врачей неотложной помощи и многих других клиницистов. Серологическое исследование имеет очень ограниченную ценность в острых случаях, поскольку уровни IgM не начинают повышаться в течение 2-4 недель после начала инфекции (17).
Более того, ни одна из этих особенностей не является специфичной для болезни Лайма. Проявления ранней болезни обычно самокупируются, тогда как проявления поздней стадии могут быть стойкими. Поздние стадии включают суставные и неврологические поражения (15-17). Небольшое количество поздних инфекций демонстрируют характерное кожное поражение, хронический атрофический акродерматит (ACA). Это поражение проявляется в виде голубовато-красных, медленно увеличивающихся узелков или бляшек, обычно начинающихся на разгибательных поверхностях дистальных отделов конечностей. Лабораторная диагностика болезни Лайма остается проблематичной. Хотя микроорганизмы Borrelia burgdor$eri были идентифицированы в образцах биопсии очагов мигрирующей эритемы (IS), такая биопсия нецелесообразна для врачей неотложной помощи и многих других клиницистов. Серологическое исследование имеет очень ограниченную ценность в острых случаях, поскольку уровни IgM не начинают повышаться в течение 2-4 недель после начала инфекции (17). Иммунологические тесты, такие как иммуноферментный анализ (ELBA) и иммунофлуоресцентный анализ, страдают плохой воспроизводимостью положительных и отрицательных результатов (IO). Однако вестерн-иммуноблоттинг может быть полезен для выявления ложноположительных результатов ИФА (19).). Следовательно, в настоящее время не существует стандартных лабораторных тестов для диагностики болезни Лайма (12), и диагноз лучше всего ставить на основании клинических и эпидемиологических данных. Наиболее отличительной клинической особенностью ранней болезни Лайма является мигрирующая эритема (МЭ), наблюдаемая в 60–80% случаев (20). По описанию Afzelius, это расширяющееся кольцевидное эритематозное поражение, обычно появляющееся через 8-9 дней (диапазон = 2-28 дней) в месте укуса инфицированного клеща. Однако, поскольку заболевание часто передается крошечными нимфальными клещами, их укусы могут не восприниматься как таковые.
Иммунологические тесты, такие как иммуноферментный анализ (ELBA) и иммунофлуоресцентный анализ, страдают плохой воспроизводимостью положительных и отрицательных результатов (IO). Однако вестерн-иммуноблоттинг может быть полезен для выявления ложноположительных результатов ИФА (19).). Следовательно, в настоящее время не существует стандартных лабораторных тестов для диагностики болезни Лайма (12), и диагноз лучше всего ставить на основании клинических и эпидемиологических данных. Наиболее отличительной клинической особенностью ранней болезни Лайма является мигрирующая эритема (МЭ), наблюдаемая в 60–80% случаев (20). По описанию Afzelius, это расширяющееся кольцевидное эритематозное поражение, обычно появляющееся через 8-9 дней (диапазон = 2-28 дней) в месте укуса инфицированного клеща. Однако, поскольку заболевание часто передается крошечными нимфальными клещами, их укусы могут не восприниматься как таковые.
633 Сыпь начинается в виде безболезненного, незудящего эритематозного пятна. Поражение расширяется в течение нескольких дней или недель, приобретая четко очерченную кольцевидную форму, которая с просветлением в центре и сохраняющейся папулой создает целевую конфигурацию. Очаги обычно больше 5 см в диаметре, иногда достигая 50-60 см в диаметре. Страндберг в газете 1920 г. описал случай женщины, у которой развилось поражение, начавшееся на плече. Пять месяцев спустя он распространился «поперек груди, и его с трудом можно было скрыть путем нанесения пудры, когда пациентка была одета в платье с декольте» (5). Поражения обычно исчезают через 3-5 недель после их появления, но могут сохраняться и в течение более длительного времени. Атипичные поражения могут быть корковыми, везикулярными, овальными или треугольными. Могут возникать множественные поражения, при этом такие вторичные высыпания представляют собой гематогенное или лимфатическое распространение инфекции на другие кожные участки. ЭМ может на разных стадиях развития быть ошибочно принята за укусы насекомых или пауков, лекарственную сыпь, дерматофитию, флегмону, контактный дерматит или многоформную эритему.
Поражение расширяется в течение нескольких дней или недель, приобретая четко очерченную кольцевидную форму, которая с просветлением в центре и сохраняющейся папулой создает целевую конфигурацию. Очаги обычно больше 5 см в диаметре, иногда достигая 50-60 см в диаметре. Страндберг в газете 1920 г. описал случай женщины, у которой развилось поражение, начавшееся на плече. Пять месяцев спустя он распространился «поперек груди, и его с трудом можно было скрыть путем нанесения пудры, когда пациентка была одета в платье с декольте» (5). Поражения обычно исчезают через 3-5 недель после их появления, но могут сохраняться и в течение более длительного времени. Атипичные поражения могут быть корковыми, везикулярными, овальными или треугольными. Могут возникать множественные поражения, при этом такие вторичные высыпания представляют собой гематогенное или лимфатическое распространение инфекции на другие кожные участки. ЭМ может на разных стадиях развития быть ошибочно принята за укусы насекомых или пауков, лекарственную сыпь, дерматофитию, флегмону, контактный дерматит или многоформную эритему. В отличие от последнего из них, ЭМ, как правило, не затрагивает ладони и подошвы (2 1). Установление клинического диагноза болезни Лайма важно с нескольких точек зрения. Антибиотикотерапия применялась еще до того, как была установлена этиология синдрома, а введение пенициллина эффективно использовалось для лечения ЭМ и АЦА еще в 1919 г.50-е (22). Кроме того, адекватная ранняя антибактериальная терапия снижает вероятность поздних осложнений (2). Схемы лечения, включающие пенициллин V, амоксициллин, доксициклин, эритромицин, цефуроксим и цефтриаксон, рекомендуются на ранних стадиях болезни Лайма (20, 22, 23), а азитромицин демонстрирует терапевтические перспективы (17). Возможно, большее значение для врача скорой помощи имеет вопрос о том, следует ли профилактически использовать антибиотики после укуса клеща. Этот вопрос рассматривался в трех проспективных исследованиях (24–26). В одном небольшом исследовании пациентов в эндемичных по болезни Лайма районах, которые лечились антибиотиками, риск развития болезни после укуса клеща был примерно равен риску развития реакции на антибиотики (24).
В отличие от последнего из них, ЭМ, как правило, не затрагивает ладони и подошвы (2 1). Установление клинического диагноза болезни Лайма важно с нескольких точек зрения. Антибиотикотерапия применялась еще до того, как была установлена этиология синдрома, а введение пенициллина эффективно использовалось для лечения ЭМ и АЦА еще в 1919 г.50-е (22). Кроме того, адекватная ранняя антибактериальная терапия снижает вероятность поздних осложнений (2). Схемы лечения, включающие пенициллин V, амоксициллин, доксициклин, эритромицин, цефуроксим и цефтриаксон, рекомендуются на ранних стадиях болезни Лайма (20, 22, 23), а азитромицин демонстрирует терапевтические перспективы (17). Возможно, большее значение для врача скорой помощи имеет вопрос о том, следует ли профилактически использовать антибиотики после укуса клеща. Этот вопрос рассматривался в трех проспективных исследованиях (24–26). В одном небольшом исследовании пациентов в эндемичных по болезни Лайма районах, которые лечились антибиотиками, риск развития болезни после укуса клеща был примерно равен риску развития реакции на антибиотики (24). Два других исследования также пришли к выводу, что даже в эндемичных районах риск заражения был настолько низким, что профилактическое лечение антибиотиками после укуса клеща не является оправданным (25, 26). Другие. тем не менее, рекомендовали рассмотреть вопрос о профилактике, если обнаружено, что клещ переполнен кровью (что указывает на длительное время кормления) или если пациент «весьма беспокоен» (20). Хотя острые инфекции обычно поддаются лечению, лечение хронических заболеваний с помощью антибиотиков продемонстрировало гораздо менее стабильный успех (17). Это управление вызвало некоторые разногласия
Два других исследования также пришли к выводу, что даже в эндемичных районах риск заражения был настолько низким, что профилактическое лечение антибиотиками после укуса клеща не является оправданным (25, 26). Другие. тем не менее, рекомендовали рассмотреть вопрос о профилактике, если обнаружено, что клещ переполнен кровью (что указывает на длительное время кормления) или если пациент «весьма беспокоен» (20). Хотя острые инфекции обычно поддаются лечению, лечение хронических заболеваний с помощью антибиотиков продемонстрировало гораздо менее стабильный успех (17). Это управление вызвало некоторые разногласия
634
Г. Штернбах и К.Л. Dibble
об эффективности длительного лечения антибиотиками хронической болезни Лайма (27). Более того, поскольку в некоторых случаях болезнь Лайма сопровождается усталостью, хронической болью и мышечной слабостью, пациенты с этими симптомами могут соответствовать критериям синдрома хронической усталости (19). Хроническая болезнь Лайма может быть гипердиагностирована, часто на основании ложноположительной серологии или истинно положительной серологии, вызванной неактивной перенесенной инфекцией (27,28). Интересно, что мигрирующая эритема, единственный отличительный клинический показатель болезни Лайма, претерпела некоторые изменения в отношении своей номенклатуры за свою историю. Как указано, когда Афцелиус представил свой первоначальный случай в 19 г.09, он применил описательный термин crythema migrans. К 1914 г. использовалось название хроническая мигрирующая эритема (4)) и в статье 1920 г.
Интересно, что мигрирующая эритема, единственный отличительный клинический показатель болезни Лайма, претерпела некоторые изменения в отношении своей номенклатуры за свою историю. Как указано, когда Афцелиус представил свой первоначальный случай в 19 г.09, он применил описательный термин crythema migrans. К 1914 г. использовалось название хроническая мигрирующая эритема (4)) и в статье 1920 г.
указывалось, что поражение «обычно называлось змеевидной эритемой или мигрирующим дерматитом» (5). В своем подробном обсуждении в 1921 г. Афцелиус использовал термин хроническая мигрирующая эритема четыре раза и мигрирующая эритема девять раз (3). Хеллерстрем, впервые связавший кожную сыпь с инфекционным процессом в своем выступлении перед Южной медицинской ассоциацией в 1919 г.48, назвал ее хронической мигрирующей эритемой Афцелиуса (7). Steere и соавт., однако, в своем описании Лайм-артрита 30 лет спустя использовали более простой термин «хроническая мигрирующая эритема» (1). Этот термин оставался предпочтительным до тех пор, пока не было признано, что это не обязательно хроническое поражение (2). Следовательно, предпочтение отдается термину erythema migrans, тем самым восстанавливая первоначальную номенклатуру Афцелиуса 1909 года.
Следовательно, предпочтение отдается термину erythema migrans, тем самым восстанавливая первоначальную номенклатуру Афцелиуса 1909 года.
ССЫЛКИ 1. Steere AC, Malawista SE, Snydman DR, Shope RE, Andiman WA, Ross MR. Стил FM. Лайм артрит. Эпидемия олигоартикулярного артрита у детей и взрослых в трех общинах Коннектикута. Ревмирующий артрит. 1977;20:7-17. 2. Бергер Б.В. Мигрирующая эритема. Клин Дерматол. 1993 год; 11:359-62. 3. Афцелиус А. Хроническая мигрирующая эритема. Акта Дерматовенерол. 1921; 2:120-5. 4. Липшуц Б. Uber eine Seltene erythemform (хроническая мигрирующая эритема). Архив Дерматол Сифил 1914;118349-56. 5. Страндберг Т.И. По поводу необычной формы мигрирующей эритемы, вызванной укусами клещей. Акта Дерматовенерол. 1920 г.; Том. 1. 4227. 6. Бургдорфер В. Как произошло открытие Borrelia burgdorferi. Клин Дерматол 1993; 11:335-8. 7. Хеллерстром С. Хроническая мигрирующая эритема Афцелиуса с менингитом. Саут Мед Дж. 1950;43:330-5. 8. Бургдот-фер В. Открытие спирохеты болезни Лайма и ее связи с клещами-переносчиками. Йельский институт биомедицинских наук. 1984;57:515-20. 9. Буредорфер В. Барбур АГ. Хавес СФ. Бенах Дж.Л. Грюнвалот Э. Да и Дж. П. Болезнь Лайма – переносимый спирохетбисом? Наука: 1982;216:1317-9. 10. Джонсон Р.С., Шмид Г.П., Хайд Ф.В., Штайгервальт А.Г., Бреннер Д.Дж. Боррелия бургдорфери сп. nov.: Этиологический агент болезни Лайма. Инт Сист Бактериал. 1984; 34:496-7. 11. Асбринк Э., Ховмарк А. Классификация, географические вариации и эпидемиология клещевого боррелиоза. Клин Дерматол. 1993; 11:353-7. 12. Майерс С.А., Секстон Д.Дж. Дерматологические проявления заболеваний, передающихся артброподами. Заразить Dis Clin North Am. 1994; 8:689712. 13. Азулай Р.Д., Азулай-Абулафия Л., Содре К.Т., Азулай Д.Р., Азулай М.М. Болезнь Лайма в Рио-де-Жанейро, Бразилия. Int J Дерматол. 1991;30:569-71. 14. Шафранк С.Н., Курбан А.К., Мартоне Г. Болезнь Лайма, приобретенная в Юго-Восточной Африке (письмо). Арка Дерматол. 1990;126:685-6.
Йельский институт биомедицинских наук. 1984;57:515-20. 9. Буредорфер В. Барбур АГ. Хавес СФ. Бенах Дж.Л. Грюнвалот Э. Да и Дж. П. Болезнь Лайма – переносимый спирохетбисом? Наука: 1982;216:1317-9. 10. Джонсон Р.С., Шмид Г.П., Хайд Ф.В., Штайгервальт А.Г., Бреннер Д.Дж. Боррелия бургдорфери сп. nov.: Этиологический агент болезни Лайма. Инт Сист Бактериал. 1984; 34:496-7. 11. Асбринк Э., Ховмарк А. Классификация, географические вариации и эпидемиология клещевого боррелиоза. Клин Дерматол. 1993; 11:353-7. 12. Майерс С.А., Секстон Д.Дж. Дерматологические проявления заболеваний, передающихся артброподами. Заразить Dis Clin North Am. 1994; 8:689712. 13. Азулай Р.Д., Азулай-Абулафия Л., Содре К.Т., Азулай Д.Р., Азулай М.М. Болезнь Лайма в Рио-де-Жанейро, Бразилия. Int J Дерматол. 1991;30:569-71. 14. Шафранк С.Н., Курбан А.К., Мартоне Г. Болезнь Лайма, приобретенная в Юго-Восточной Африке (письмо). Арка Дерматол. 1990;126:685-6.
15. Герцер П. Ревматические проявления при Лайм-боррелиозе. Клин Дерматол. 1993; 11:401-6. 16. Кристоферич В. Неврологические проявления при Лайм-боррелиозе. Клин Дерматол. 1993;11:401-6. 17. Бухштейн С.Р., Гарднер П. Болезнь Лайма. Заразить Dis Clin North Am. 1991;5:103-16. 18. Бергер Б.В., Клемменсен О.Дж., Готлиб Г.Дж. Спирохетезиновые поражения хронической мигрирующей эритемы (письмо). Am J Дерматопатбол. 1982; 4:555-6. 19. Сигал Л.Х. Итоги Пятого Международного конгресса по Лаймскому боррелиозу. Арт Реум. 1994;37:10-4. 20. Ноктон Дж.Дж., Стир А.С. Болезнь Лайма. Adv Int Med. 1995 год; 40:69-117. 21. Бергер Б.В. Хроническая мигрирующая эритема болезни Лайма. Арка Дерматол. 1984; 159:1017-21. 22. Штимстедт Г. Терапевтические аспекты Лайм-боррелиоза. Клин Дерматол. 1993;11:359-62. 23. Вормсер Г.П. Болезнь Лайма: понимание использования противомикробных препаратов для профилактики и лечения в контексте опыта других спирохетозных инфекций. Гора Синай J Med. 1995 год; 62:188-95. 24. Costello CM, Steere AC, Pinkerton RE, Feder HM Jr. Проспективное исследование укусов клещей в эндемичных по болезни Лайма районах.
Клин Дерматол. 1993; 11:401-6. 16. Кристоферич В. Неврологические проявления при Лайм-боррелиозе. Клин Дерматол. 1993;11:401-6. 17. Бухштейн С.Р., Гарднер П. Болезнь Лайма. Заразить Dis Clin North Am. 1991;5:103-16. 18. Бергер Б.В., Клемменсен О.Дж., Готлиб Г.Дж. Спирохетезиновые поражения хронической мигрирующей эритемы (письмо). Am J Дерматопатбол. 1982; 4:555-6. 19. Сигал Л.Х. Итоги Пятого Международного конгресса по Лаймскому боррелиозу. Арт Реум. 1994;37:10-4. 20. Ноктон Дж.Дж., Стир А.С. Болезнь Лайма. Adv Int Med. 1995 год; 40:69-117. 21. Бергер Б.В. Хроническая мигрирующая эритема болезни Лайма. Арка Дерматол. 1984; 159:1017-21. 22. Штимстедт Г. Терапевтические аспекты Лайм-боррелиоза. Клин Дерматол. 1993;11:359-62. 23. Вормсер Г.П. Болезнь Лайма: понимание использования противомикробных препаратов для профилактики и лечения в контексте опыта других спирохетозных инфекций. Гора Синай J Med. 1995 год; 62:188-95. 24. Costello CM, Steere AC, Pinkerton RE, Feder HM Jr. Проспективное исследование укусов клещей в эндемичных по болезни Лайма районах.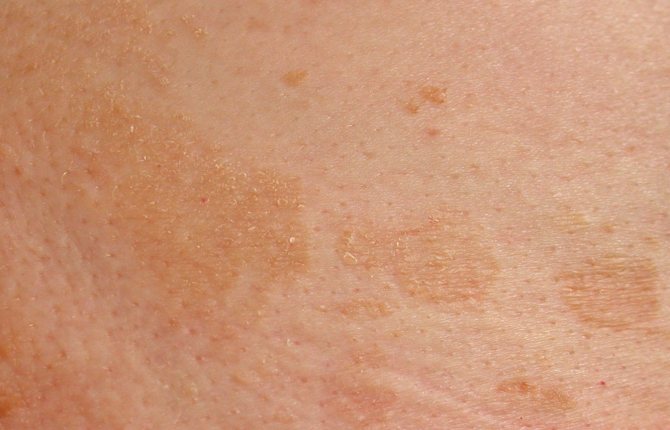 J заразить дис. 1989; 159:136–139. 25. Шапиро Э.Д., Гербер М.А., Холаберд Н.Б., Берг А.Т., Федер Х.М. младший, Белл Г.Л., Рысь П.Н., Персинг Д.Х. Контролируемое испытание противомикробной профилактики болезни Лайма после укусов оленьего клеща. New Engl J Med. 1992;327:1769-73. 26. Агре Ф., Шварц Р. Значение раннего лечения укусов оленьих клещей для профилактики болезни Лайма. АЖДК. 1993 год; 1471945-7. 27. Баринага М. Фурор на конференции по болезни Лайма. Наука. 1992 год; 256:1384-5. 28. Маккензи Р., Штраус С.Е. Синдром хронической усталости. Adv Int Med. 1995;40:119-51.
J заразить дис. 1989; 159:136–139. 25. Шапиро Э.Д., Гербер М.А., Холаберд Н.Б., Берг А.Т., Федер Х.М. младший, Белл Г.Л., Рысь П.Н., Персинг Д.Х. Контролируемое испытание противомикробной профилактики болезни Лайма после укусов оленьего клеща. New Engl J Med. 1992;327:1769-73. 26. Агре Ф., Шварц Р. Значение раннего лечения укусов оленьих клещей для профилактики болезни Лайма. АЖДК. 1993 год; 1471945-7. 27. Баринага М. Фурор на конференции по болезни Лайма. Наука. 1992 год; 256:1384-5. 28. Маккензи Р., Штраус С.Е. Синдром хронической усталости. Adv Int Med. 1995;40:119-51.
Некролитическая мигрирующая эритема (синдром глюкагономы)
Автор: д-р Аманда Окли, дерматолог, больница Вайкато, Гамильтон, Новая Зеландия, 2004 г.
Что такое некролитическая мигрирующая эритема?
Некролитическая мигрирующая эритема представляет собой характерную сыпь, обычно возникающую при синдроме глюкагономы. Синдром глюкагономы обусловлен медленно растущей раковой опухолью, локализованной в альфа-клетках поджелудочной железы. Глюкагонома встречается очень редко и поражает взрослых старше 50 лет. Опухоль выделяет избыточное количество гормона глюкагона.
Глюкагонома встречается очень редко и поражает взрослых старше 50 лет. Опухоль выделяет избыточное количество гормона глюкагона.
Результаты избыточного глюкагона также включают:
- Сахарный диабет
- Потеря веса
- Диарея
- Неврологические и психиатрические симптомы
- Венозный тромбоз (сгустки крови)
- Анемия
- Низкий уровень циркулирующих аминокислот
Другие медицинские состояния могут вызывать подобную сыпь:
- Цирроз печени
- Целиакия
- Муковисцидоз, вызывающий кишечную мальабсорбцию
- Пищевые дефициты аминокислот, цинка и незаменимых жирных кислот
- В редких случаях лечение высокими дозами глюкагона при врожденной гиперинсулинемии (это называется ятрогенной некролитической мигрирующей эритемой)
Как выглядит некролитическая мигрирующая эритема?
Некролитическая мигрирующая эритема может поражать любую локализацию, но чаще всего поражает гениталии и анальную область, ягодицы, пах и голени. Сыпь колеблется по степени тяжести. Сначала появляется кольцеобразная красная область, которая пузырится, эрозирует и покрывается коркой. Это может быть довольно зудящим и болезненным. Когда он заживает, он может оставить после себя коричневый след.
Сыпь колеблется по степени тяжести. Сначала появляется кольцеобразная красная область, которая пузырится, эрозирует и покрывается коркой. Это может быть довольно зудящим и болезненным. Когда он заживает, он может оставить после себя коричневый след.
Это также приводит к воспалению гладкого языка, воспалению во рту, растрескиванию сухих губ и неровностям на ногтях.
Некролитическая мигрирующая эритема
Некролитическая мигрирующая эритема
Некролитическая мигрирующая эритема
Некролитическая мигрирующая эритема
Некролитическая мигрирующая эритема
Некролитическая мигрирующая эритема
Некролитическая мигрирующая эритема похожа на сыпь, возникающую при энтеропатическом акродерматите, который возникает из-за дефицита цинка.
Как возникает некролитическая мигрирующая эритема?
Неизвестно, как возникает сыпь. Это может быть связано с относительным дефицитом цинка, аминокислот или незаменимых жирных кислот, возможно, из-за того, что опухоль уменьшает количество альбумина, который обычно переносит их по всему телу.
Чрезмерное количество глюкагона может усилить воспаление кожи, особенно в местах трения. Он также повышает уровень глюкозы в крови, что в конечном итоге приводит к сахарному диабету. Он разрушает белок и жир, что приводит к потере веса, анемии и низкому уровню аминокислот.
Как диагностируется некролитическая мигрирующая эритема?
Анализы крови могут включать:
- Анализ крови, который может выявить анемию
- Глюкозотолерантный тест для оценки сахарного диабета
- Функция печени, которая может выявить вторичные новообразования в печени
- Уровни глюкагона в сыворотке, которые могут превышать норму в 1000 раз
- Уровни аминокислот, которые могут быть очень низкими
- Уровни сывороточного инсулина, гастрина и вазоактивных интестинальных пептидов, которые могут выявить другие эндокринные нарушения
Биопсия кожи при некролитической мигрирующей эритеме может выявить воспаление и расслоение поверхностных слоев эпидермиса.