Гемоглобин низкий у пожилых людей: Гемоглобин у пожилых людей
Гемоглобин у пожилых людей
Кровь в человеческом теле занимается питанием всего организма. От нее зависит, насколько хорошо органы, ткани, клетки будут насыщаться кислородом и полезными веществами. Чтобы человек был здоровым и чувствовал себя хорошо, все показатели его крови должны быть в норме. Один из основных показателей – гемоглобин.
Гемоглобином называют белок, насыщенный железом. Он образуется в начале формирования эритроцитов – красных кровяных телец. Благодаря гемоглобину организм питается кислородом и избавляется от углекислого газа.
Существуют определенные нормы гемоглобина для разных возрастов. Пониженный гемоглобин, как и повышенный, вреден для здоровья — такие показатели нужно приводить в норму. Расскажем о нормах в пожилом возрасте, рассмотрим подробно вопросы о пониженном и повышенном гемоглобине.
Норма гемоглобина у пожилого человека
Для мужчин норма составляет 125-165 г на 1 литр крови, для женщин – 120-155 г на 1 литр крови.
Пониженный гемоглобин
Низкие показатели гемоглобина часто наблюдаются в разном возрасте – и у молодых, и у пожилых.
Причины и симптомы
Недостаток гемоглобина наблюдается, когда организм теряет его в большом количестве или мало получает.
Основные причины низкого гемоглобина у пожилых людей:
• Однообразное питание. Синтез гемоглобина происходит благодаря продуктам, содержащим железо, витамины группы В, аминокислоты и пищевые кислоты. Если в рационе не хватает этих веществ, у человека понижен уровень гемоглобина. Бедный рацион приводит к недостатку данного белка. По этой же причине низкий гемоглобин возникает у вегетарианцев.
• Внутренние кровотечения способны вызвать дефицит гемоглобина. У женщин могут быть гинекологические кровотечения. У мужчин возможны различные внутренние кровотечения: желудочные, кишечные, почечные, носовые.
• Тяжелая инфекция
• Хронический энтерит
• Длительное применение капельницы
• Чрезмерное увлечение алкоголем
Пониженный уровень гемоглобина связан с различными нарушениями и внутренними проблемами в организме человека.
Если уровень данного белка снижается без явных причин, необходимо обследование у специалистов. Низкий уровень гемоглобина – это симптом таких проблем, поэтому нужно выявить и решать первопричину. Если повышать гемоглобин без выяснения первопричины, он придет в норму лишь на определенное время.
Симптомы пониженного гемоглобина одинаковы для людей любого возраста:
• сухость кожи
• упадок сил и слабость
• быстрая утомляемость
• одышка
• сильное сердцебиение
Анемия – патологическое состояние, которое развивается при снижении гемоглобина менее 110 г на 1 литр.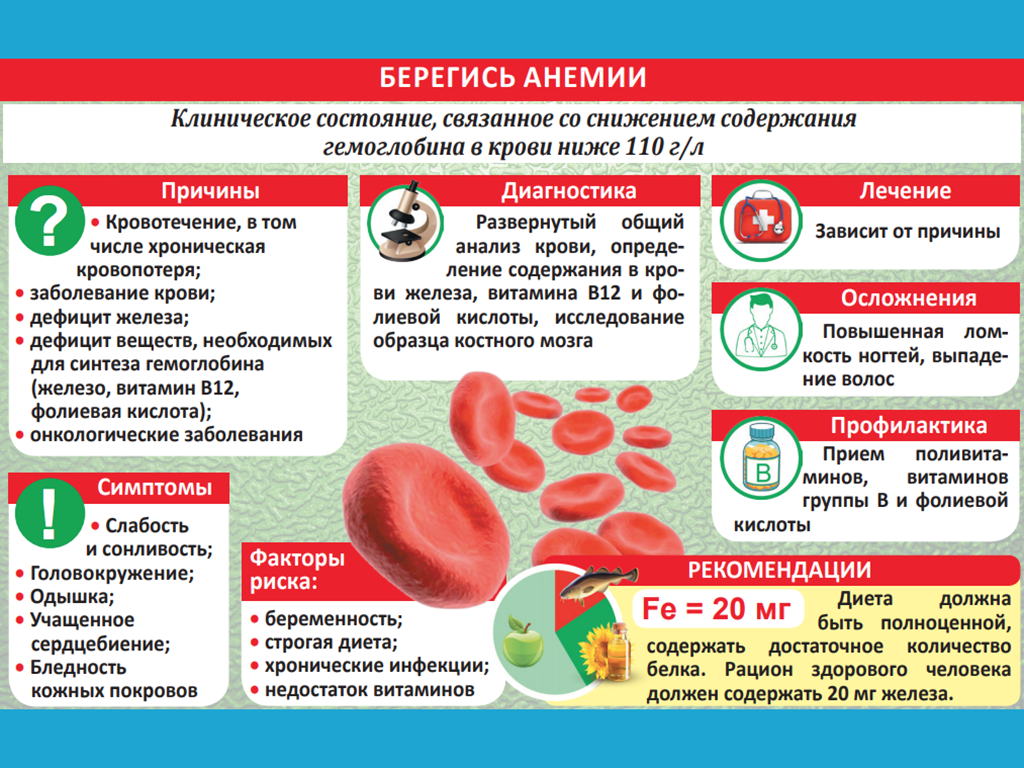 Она наблюдается почти у половины людей старше 60 лет. Развитие анемии никак не связано с возрастными изменениями организма: у здорового пенсионера кровь функционирует так же, как и у человека средних лет.
Она наблюдается почти у половины людей старше 60 лет. Развитие анемии никак не связано с возрастными изменениями организма: у здорового пенсионера кровь функционирует так же, как и у человека средних лет.
На появление анемии влияют болезни: частые опухоли, инфекции, заболевания сердечной, аутоиммунной или эндокринной систем, хронические недуги. Такие проблемы вызывают снижение уровня гемоглобина, а его недостаток еще больше усугубляет ситуацию.
В самом начале развития анемии анализы могут быть нормальными, но анемия уже проявляется в первых признаках. Обратите внимание на эти общие симптомы, характерные для анемии:
• Сухость и побледнение кожи
• Появление болезненных трещинок в уголках рта
• Ощущение жжения и боли на языке
• Ломкость и выпадение волос
В дальнейшем развиваются другие дополнительные признаки анемии:
• Быстрая утомляемость, вялость
• Учащенное дыхание и пульс
• Шум в ушах
• Частые головокружения
• Слабость мышц
• Пятна в глазах
• Трудная концентрация внимания
• Повышенная температура
• Раздражительность
В начале симптомы могут отсутствовать или проявляются только головокружение и вялость. С дальнейшим понижением гемоглобина эти симптомы проявляются сильнее. При большом недостатке гемоглобина у человека путаются мысли, возможны обморочные состояния.
С дальнейшим понижением гемоглобина эти симптомы проявляются сильнее. При большом недостатке гемоглобина у человека путаются мысли, возможны обморочные состояния.
Если человек обнаружил у себя признаки анемии, ему нужно отправиться к врачу для проведения диагностики и последующего лечения. Лечение анемии зависит от ее типа. Выделяют несколько видов болезни. Рассмотрим их по порядку.
Типы анемии
Есть разные виды малокровия. У пожилых людей чаще встречаются четыре вида, которые мы рассматриваем ниже.
• Анемия хронических заболеваний (АХЗ)
Возникает из-за многих болезней: инфекций, аутоиммунных заболеваний, опухолей и других. Анемия проходит нетяжело, является симптомом основного хронического недуга. Лечение проводится путем разрешения основной проблемы. Железосодержащие препараты при АХЗ не помогут.
• Железодефицитная анемия (ЖДА)
Самый популярный тип. Возникает из-за недостатка железа по причине плохого питания или кровопотерь из-за внутренних кровотечений. Характеризуется падением уровня железа и менее насыщенным цветом крови.
Характеризуется падением уровня железа и менее насыщенным цветом крови.
Кровотечения вызывают внутренние болезни: язва желудка или двенадцатиперстной кишки, гастрит, ангиодисплазия кишечника, дивертикулез, рак. На развитие ЖДА также влияют хронические кровотечения мочеполовой системы, нарушение свертываемости крови, язва желудка, колит, болезнь Крона, опухоли и другие.
В лечении применяют железосодержащие препараты. Основными средствами для увеличения гемоглобина являются сульфат железа и глюконат железа. Средства принимают 3-4 раза в день.
Для лучшего усвоения железа рекомендован витамин С. Кальций, кофе, чай и вино препятствуют усвоению железа, поэтому их не стоит смешивать в одном приеме пищи с лекарствами и продуктами, содержащими железо.
• Анемия, вызванная недостатком фолиевой кислоты
Обычно нехватка фолиевой кислоты связана с плохим питанием. Для восполнения ее запасов назначают соответствующие препараты и полезное питание.
• Анемия при недостатке витамина В12
Неврологические признаки проявляются раньше симптомов анемии: сниженная чувствительность, слабость мышц, гипорефлексия.
Причина этой анемии – понижение кишечной всасываемости витамина В12. Недостаток В12 может наблюдаться в следующих случаях: резекция желудка, болезни тонкого кишечника, вегетарианство. Недостаток витамина В12 лечится путем его восполнения с помощью лекарств.
Анемию у пожилых людей можно вылечить, если вовремя начать лечение и соблюдать все врачебные рекомендации.
Малокровие опасно для пожилых людей, может привести к осложнениям и тяжелым последствиям. Из-за недостатка гемоглобина снижается иммунитет, поэтому человек становится уязвимым перед различными вирусами и инфекциями.
Если анемию запустить, может развиться сильный недостаток гемоглобина, что приведет к проблемам со здоровьем. На третьей, тяжелой стадии анемии, у человека развиваются тахикардия, брадикардия, скачет давление, возникают мышечная атония, обморочные состояния. Недостаток гемоглобина приводит к кислородному голоданию мозга, которое может стать причиной развития болезни Альцгеймера.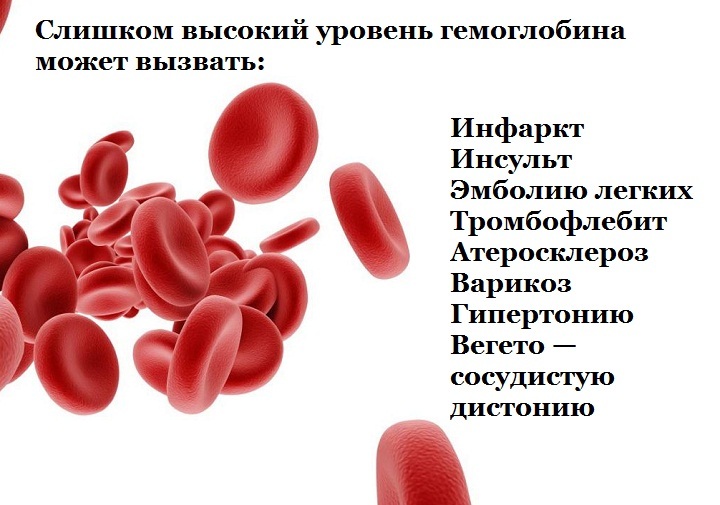
Лечить анемию нужно сразу же, так как у пожилых людей она быстро переходит в хроническое малокровие. У женщин могут развиться опухоли репродуктивной системы, у мужчин – раннее слабоумие. У пожилых мужчин анемия встречается в три раза чаще, чем у женщин. Всем пенсионерам рекомендуется регулярно сдавать анализ крови для проверки и обнаружения проблем в самом начале.
Диагностика
При появлении симптомов анемии следует сделать анализ крови. Этот информативный метод помогает специалисту определить количество эритроцитов, уровень гемоглобина, степень анемии.
Анемия, вызванная недостатком фолиевой кислоты или витамина В12, диагностируется дифференциальным способом.
Исследуют первопричину анемии, обращают внимание на хронические болезни. После подробной диагностики назначают подходящее лечение.
Лечение
Терапия строится по следующему плану:
• Избавление от причины, вызвавшей анемию
• Ведение здорового режима дня и соблюдение полноценного гармоничного рациона
• Регулярный прием железосодержащих средств
• Контроль показателей крови для предупреждения рисков железодефицитной анемии
Лечение пониженного гемоглобина зависит от типа анемии.
При железодефицитной анемии понижается количество ферритина и сывороточного железа в крови, увеличивается железосвязывающая способность крови. При ЖДА снижается количество эритроцитов в крови.
Чтобы избавиться от анемии, нужно лечить первопричину. Для вспомогательного лечения назначают железосодержащие средства.
Для поднятия уровня железа до нормальных показателей в день необходима дозировка 150-300 мг железосодержащего средства 1-2 раза в день. Обычно назначают лекарства на основе сульфата или фумарата железа. Средство лучше принимать во время еды для лучшего усвоения.
Нужно тщательно соблюдать дозировки лекарств, так как препараты с железом могут привести к побочным эффектам: нарушению здоровой работы желудка, тошноте и рвоте, запору, сосудистым воспалениям, аллергии, гипотонии, болям в грудине. Нельзя самому себе назначать лекарства – препараты выписывает лечащий специалист.
Средства для повышения гемоглобина у пожилых должны соответствовать определенным критериям:
• Содержать достаточное количество двухвалентного железа.
• Железо должно хорошо всасываться – для этого в лекарства добавляют специальные компоненты.
• Средства должны быть доступны в цене.
Уровень железа повышают с помощью подходящего питания. В рацион нужно включить продукты, богатые железом, и сочетать их с приемом лекарств.
Анемия из-за дефицита фолиевой кислоты и В12 характеризуется более насыщенным оттенком крови. Эритроциты увеличиваются в размерах. Наблюдается снижение лейкоцитов и тромбоцитов, увеличивается количество железа в сыворотке крови. У человека возникают неврологические и психические нарушения.
Причины этой анемии таковы:
• Гастрит, рак желудка
• Панкреатит, дивертикулез
• Воспаление тонкого кишечника
• Дисбактериоз
• Хронический гепатит
Спровоцировать анемию может неправильное применение лекарств или недостаток важных веществ в организме.
В диагностике применяют анализ костного мозга. Также человека проверяют путем исследования: прописывают курс витамина В12 и наблюдают за состоянием крови пациента. Если человеку становится лучше и показатели крови нормализуются, значит, у него анемия из-за недостатка В12.
Лечение проводится витаминами. Витаминные инъекции делают ежедневно, пока не нормализуются показатели крови. Далее для закрепления результата витамины вводят 1-2 раза в месяц.
Анемия из-за недостатка фолиевой кислоты проявляется реже по следующим причинам:
• Частая алкогольная интоксикация
• Разрушение эритроцитов, онкология, дерматит, энтерит
• Алиментарная недостаточность
• Прием определенных медикаментов
В лечении нужно обратить внимание на первопричину анемии. Если нельзя ее устранить, человека лечат витаминами. Пациенту назначают инъекции фолиевой кислоты или прием таблеток в дозировке 5 мг в сутки.
Чтобы быстро повысить гемоглобин пожилому человеку, назначают подходящие препараты. Средства выписывают разные в зависимости от типа анемии, сопутствующих заболеваний, состояния пожилого. Например, часто выписывают Гемобин. Это средство хорошо подходит пожилым людям, и его единственное противопоказание – индивидуальная непереносимость.
Средства выписывают разные в зависимости от типа анемии, сопутствующих заболеваний, состояния пожилого. Например, часто выписывают Гемобин. Это средство хорошо подходит пожилым людям, и его единственное противопоказание – индивидуальная непереносимость.
Пожилым назначают лекарства в виде таблеток и в жидком виде — для легкого и лучшего усвоения.
Питание и народная медицина при низком гемоглобине
Гемоглобин в организме пожилого человека вырабатывается благодаря продуктам, богатым витамином В, железом, аминокислотами и другими пищевыми кислотами.
Подходящий рацион нужно сочетать с приемом лекарств. В дальнейшем после выздоровления следует придерживаться здорового питания, чтобы поддерживать гемоглобин в норме. Народные рецепты также дают рекомендации по питанию при анемии и предлагают полезные рецепты на основе трав.
Правила питания:
• Дробное питание 5-6 раз в день. Последний прием пищи – не менее чем за 3 часа до отхода ко сну.
• Заменить кофе и чай на травяные чаи, овощные и фруктовые соки.
• Чаще гулять на свежем воздухе, чтобы нормализовать кислородный баланс и стимулировать обновление гемоглобина.
Для повышения уровня гемоглобина нужно ввести в рацион продукты, богатые железом. К ним относятся:
• Мясо, мясные субпродукты, рыба
• Яичные желтки
• Пища из цельнозерновой муки
• Орехи и семечки
• Белые грибы
• Греча, чечевица, фасоль
• Пшеница в зародышах и ростках
• Свекла, морковь, капуста, морская капуста, зелень (петрушка, шпинат, фенхель)
• Чернослив, абрикос, финики, инжир, черная смородина
• Клубника, смородина, гранат, желтые и оранжевые фрукты
• Зелень, приправы
• Отвар из крапивы и ягод шиповника
• Сухофрукты, шоколад, халва, натуральный темный мед
Народные рецепты и полезные рекомендации по питанию:
• Есть супы из ржаных и пшеничных отрубей.
• Употреблять сок из квашеной свеклы – по 200 мл в сутки.
• Отвар или настойка крапивы – употреблять по 20-25 г перед сном.
• Полезно есть морковь, яблоки и петрушку.
• Курага – отличный сухофрукт для повышения гемоглобина. Следует есть без косточек в небольшом количестве каждый день.
• Пить цельное молоко.
Несколько рецептов для повышения гемоглобина:
• Отвар из лугового клевера. Залить головки клевера (10 г) стаканом воды и заварить, процедить через 45 минут. Принимать 3 раза в день по две ст. л.
• Шиповниковый настой. Залить одну ст. л. ягод шиповника одним стаканом кипятка и оставить на несколько часов настаиваться. Можно пить вместо чая трижды в день.
• Овощной сок. Почистить и вымыть свеклу, морковь и черную редьку. Мелко натереть, выжать сок из каждого овоща. Смешать в равных долях и поместить на 3 часа в духовку. Затем принимать средство по одной ст. л. в день.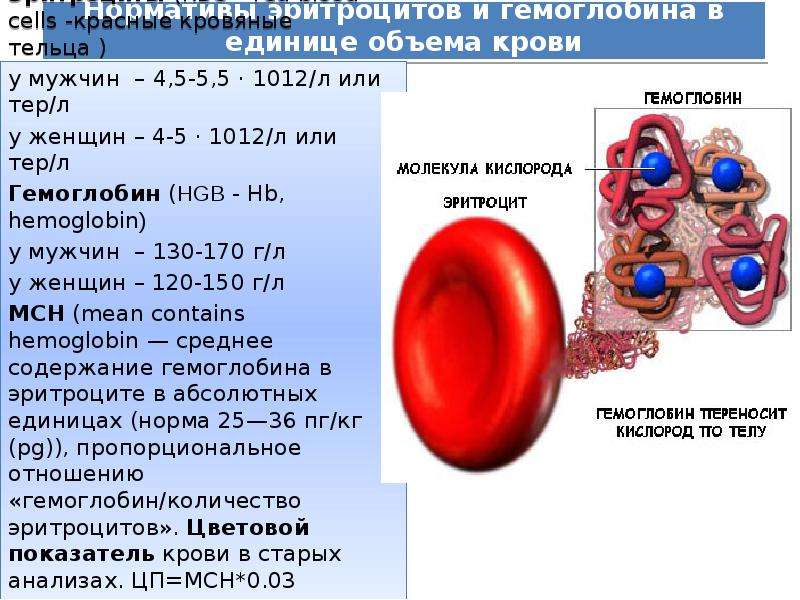
Выбирая народный рецепт, проконсультируйтесь с лечащим врачом. Питаться нужно гармонично и полноценно, обязательно завтракать, обедать и ужинать. Рацион должен быть более калорийным в первой половине дня, а ужинать лучше налегке. Вместе с приемами пищи можно пользоваться подходящими народными средствами, например, чаями или отварами.
Натуральные соки очень полезны для повышения гемоглобина и хорошо усваиваются. При анемии подходят следующие соки:
• Гранатовый. Его немного разводят кипяченой водой. Употребляют три раза в день за полчаса до еды каждый день в течение 2-3 месяцев.
• Березовый. Можно пить в большом количестве – до 4-х стаканов в день. Он будет защищать от утомляемости.
• Свекольный. Рекомендуется ежедневно пить по 100 мл свежего сока на протяжении месяца.
• Морковно-шпинатная смесь. Советуют пить по 100 мл три раза в сутки.
• Сок из листьев одуванчика. Пьют по 50 грамм один раз в день на протяжении долгого времени.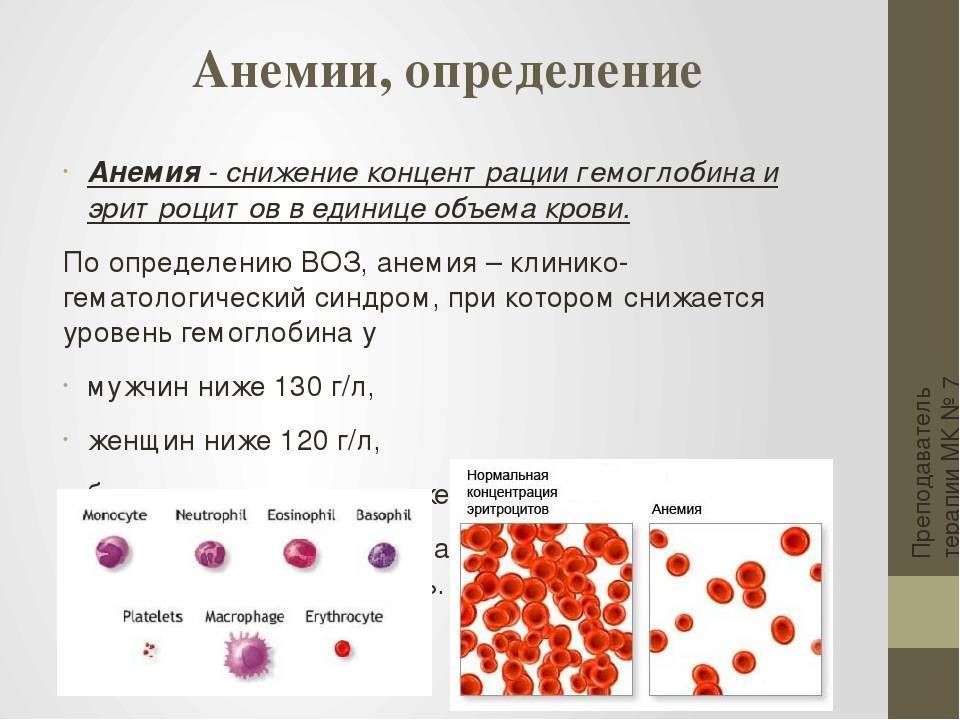
При анемии нельзя голодать, переедать, делать долгие перерывы между едой. Порции должны быть сытными и умеренными.
В пожилых годах не стоит увлекаться интересными системами питания и разнообразными диетами – лучше соблюдать полноценное питание и придерживаться здоровых рекомендаций.
Если у человека потеряны зубы или они в плохом состоянии, это нужно учитывать при приготовлении еды. Пищу надо готовить мягкой, чтобы ее легко было жевать, применять жидкие блюда. Можно пользоваться блендером или теркой для измельчения пищи.
С помощью подходящего питания можно избавиться от анемии на ранней стадии развития. Сочетая питание и народную медицину в течение продолжительного срока, можно нормализовать уровень гемоглобина в короткие сроки. Через месяц рекомендуется сдать анализ на кровь для проверки. Если гемоглобин еще не будет в норме, лечение продолжают.
Как поднять уровень гемоглобина: полезные рекомендации
Нужно вести здоровый образ жизни. К здоровым рекомендациям относятся:
К здоровым рекомендациям относятся:
• Качественное питание – несколько раз в день. Разнообразный здоровый рацион, включающий все полезные витамины и вещества.
• Отказаться от вегетарианства и вредных привычек.
• Вовремя лечить заболевания, поддерживать нормальное состояние при хронических недугах.
В пожилом возрасте нужно быть готовым к длительному лечению по причине состояния здоровья пожилого человека. При грамотном подходе симптомы анемии постепенно уходят, человеку становится лучше.
Повышенный гемоглобин
Высокий уровень гемоглобина наблюдается у людей, которые живут в горах, активно занимаются спортом или тяжелым физическим трудом. Повышенный гемоглобин в этих случаях является компенсацией недостатка кислорода в крови.
Если пожилой человек не относится ни к одной из данных групп, высокий гемоглобин может указывать на следующие проблемы:
• Сердечную недостаточность и другие сердечные болезни
• Врожденный порок сердца, нарушение сердечной работы
• Рак почек или печени
• Эмфизему, легочные заболевания, обструктивный процесс
• Чрезмерное увлечение сигаретами или проживание в загазованном городском районе
• Частое и бесконтрольное употребление мочегонных средств
Повышенный гемоглобин никак не проявляется внешне, определить его можно только по анализу крови.
Чтобы снизить высокий уровень гемоглобина у пожилых людей, нужно поработать со своим рационом. При обнаружении высоких показателей их обязательно нужно приводить в норму с помощью специального питания.
В основе лечебного рациона – снижение животных белков. Продукты, которые рекомендуется включить в рацион людям с низким гемоглобином, нужно исключить людям с высоким. Человеку с высоким гемоглобином запрещены красное мясо и мясные продукты, красные овощи и фрукты.
В рационе должны быть растительные белки (молочные, бобовые), фолиевая кислота (свежие овощи, зелень), полиненасыщенные жирные кислоты (морепродукты, морская рыба).
Пожилым людям нужно вести регулярный контроль за содержанием гемоглобина в своей крови. Нарушение его норм – сигнал о том, что со здоровьем что-то не в порядке. Вовремя начав лечение, можно улучшить свое состояние и предупредить осложнения.
Видео: Анемия: симптомы, причины
youtube.com/embed/mNX2Edl3RWA»/>
Как поднять гемоглобин у пожилых людей
Пониженный гемоглобин на самом деле довольно часто встречается у пожилых людей. В просторечии известная как анемия, она характеризуется низким уровнем гемоглобина в крови, белка, который позволяет переносить кислород по телу. Как поднять гемоглобин пожилому человеку постараемся описать в нашей статье.
Норма гемоглобина у пожилых людей
Анемия в пожилом возрасте — распространенная проблема, не всегда вовремя обнаруживаемая, что удивительно, поскольку для ее диагностики достаточно простого анализа крови.
У взрослых мужчин уровень гемоглобина должен быть выше 14, у женщин — выше 12 г/дл крови. Показатели ниже этих значений указывают на анемию.
В 80% случаев анемия связана с дефицитом железа.
Причины снижения гемоглобина
У пожилых людей анемия может быть связана с хроническим заболеванием, недостаточным питанием или потерей железа.
Пониженный гемоглобин может быть следствием кровотечения, ещё может появиться при дефиците витамина B12, отравлении свинцом и инфекциях. Анемия у пожилых людей часто связана с хроническими заболеваниями почек, печени, ревматологическими заболеваниями, но также встречается и с некоторыми видами рака.
Анемия у пожилых людей часто связана с хроническими заболеваниями почек, печени, ревматологическими заболеваниями, но также встречается и с некоторыми видами рака.
При поиске причин анемии важно оценить объем (размер) эритроцита, который в тестах обозначается аббревиатурой MCV.
Маленький размер клеток крови характерны для железодефицитной анемии. Большой, проявляется при недостатке в организме фолиевой кислоты или витамина B12. Эти формы анемии часто называют дефицитной анемией, которая развивается у пожилых людей.
В случае анемии хронического заболевания, клетки крови нормального размера. Обнаружение этой формы анемии должно побудить врача и пациента провести тесты, исключающие наличие злокачественного новообразования.
Как повысить гемоглобин пожилому человеку
Симптомы анемии широко известны: слабость, головокружение, обмороки, приступы одышки, частое чувство холода, учащенное и нерегулярное сердцебиение, постоянная утомляемость, бледность кожи и слизистых оболочек. Что бы повысить гемоглобин пожилому человеку необходимо установить причину анемии. Во многих случаях анемия у пожилых людей носит комплексный характер по нескольким причинам. Первый: однообразное питание и неправильное питание. Пожилые люди не заботятся о своем меню. Например, из-за плохих зубов отказываются от мясных блюд или из-за перистальтики, метеоризма, диареи, запора не едят овощи и фрукты. Это ошибка! Для образования нормального зрелого эритроцита в организме должно быть достаточно железа, фолиевой кислоты и витамина B12.
Что бы повысить гемоглобин пожилому человеку необходимо установить причину анемии. Во многих случаях анемия у пожилых людей носит комплексный характер по нескольким причинам. Первый: однообразное питание и неправильное питание. Пожилые люди не заботятся о своем меню. Например, из-за плохих зубов отказываются от мясных блюд или из-за перистальтики, метеоризма, диареи, запора не едят овощи и фрукты. Это ошибка! Для образования нормального зрелого эритроцита в организме должно быть достаточно железа, фолиевой кислоты и витамина B12.
При легкой форме анемии есть шанс повысить гемоглобин пожилому человеку без лекарств, но с помощью здоровой диеты, богатой железом, фолиевой кислотой и витамином B12. Не стоит рассчитывать на эффект уже через несколько недель. Пробелы возможно восполнить только в течение 4-6 месяцев.
Как повысить степень усвоения железа из продуктов
Железо содержится в продуктах животного и растительного происхождения. Отличается степенью биодоступности. Гемовое железо животного происхождения усваивается намного лучше (15-20%), чем негемовое железо из растительных продуктов (1-10%). Это связано с наличием множества веществ, ограничивающих всасывание, в том числе фитаты, полифенолы, дубильные вещества, некоторые минералы (кальций, фосфор, цинк, марганец) и клетчатка. Используя соответствующие кулинарные процессы, можно снизить содержание фитатов и, таким образом, улучшить абсорбцию железа.
Это связано с наличием множества веществ, ограничивающих всасывание, в том числе фитаты, полифенолы, дубильные вещества, некоторые минералы (кальций, фосфор, цинк, марганец) и клетчатка. Используя соответствующие кулинарные процессы, можно снизить содержание фитатов и, таким образом, улучшить абсорбцию железа.
Рекомендуется использовать замачивание (например, орехи, натуральные злаки), ферментацию, проращивание бобовых и злаков. Употребление в пищу продуктов, богатых железом, вместе с продуктами, богатыми витамином С (сырые овощи и фрукты), он оказывает наибольшее влияние на увеличение усвоения железа организмом. Доступность этого элемента также улучшают органические кислоты, фолиевая кислота и медь. Стоит добавлять в блюда травы, обладающие антиоксидантными свойствами, такие как орегано, майоран, тимьян, куркума, корица, базилик и перец.
Напитки, употребляемые во время еды, также влияют на усвоение железа из пищи. Крепкий чай, кофе, молоко значительно тормозят усвоение железа. Красное вино содержит полифенолы, которые также затрудняют усвоение железа.
Красное вино содержит полифенолы, которые также затрудняют усвоение железа.
Диагностика и лечение всех видов анемии и снижающих гемоглобин заболеваний в Анапе
Анемия – состояние, при котором уменьшается количество эритроцитов в крови и снижается гемоглобин. В результате развивается кислородное голодание тканей, страдает сердечно-сосудистая система, ослабляется иммунитет, нарушается пищеварение, падет зрение. Дети отстают в развитии. У беременных увеличивается риск выкидыша. В медицинском центре «НеоМед» диагностируют анемию и предрасположенность к ней, выявляют причины низкого гемоглобина и устраняют их.
Общие симптомы
Развитие анемии может протекать незаметно, первые симптомы проявляются только при значительном снижении уровня гемоглобина, при этом у разных людей этот уровень индивидуален. Гемоглобин необходимо держать под контролем, регулярно сдавая анализ крови, а не ждать, когда появятся:
- утомляемость и слабость;
- одышка;
- бледность кожи;
- головокружение;
- шум в ушах;
- расстройства пищеварения;
- снижение иммунитета.

Причины развития анемии
Анемия – не самостоятельное заболевание, а следствие какого-либо патологического процесса в организме. Причины возникновения разные:
- Острые кровопотери – явная причина, которую невозможно не заметить. Уровень гемоглобина может снизиться после травм, оперативных вмешательств, сильных кровотечений, например, маточных или носовых.
- Длительные скрытые кровопотери – протекают незаметно, но опаснее явных, так как могут долго не беспокоить выраженными симптомами и оставаться без лечения. Сюда относят язвы желудка, трещины пищевода, эрозивный гастрит, геморрой. Женщины часто не придают значение обильным менструациям, но такие потери крови тоже ведут к анемии.
- Несбалансированные диеты, голодание, отказ от пищи животного происхождения. Витамины, необходимые для образования эритроцитов, поступают в организм с пищей. Нельзя исключать продукты, богатые железом, медью, витаминами группы В, фолиевой кислотой.
- Нарушение всасываемости микроэлементов.
 Даже при сбалансированном питании может возникнуть анемия по той причине, что вещества не усваиваются из-за особенностей организма, заболеваний, приема определенных лекарственных препаратов.
Даже при сбалансированном питании может возникнуть анемия по той причине, что вещества не усваиваются из-за особенностей организма, заболеваний, приема определенных лекарственных препаратов. - Заболевания, при которых разрушение эритроцитов происходит быстрее, чем образуются новые клетки.
Типы и принципы классификаци
Анемии прежде всего классифицируют по вызывающим их причинам:
- Гипопластические – возникают из-за нарушения кроветворной функции в костном мозге.
- Постгеморрагические – вызванные кровопотерями.
- Гемолитические – низкий гемоглобин по причине усиленного разрушения эритроцитов.
- Дефицитные – возникшие из-за нехватки микроэлементов, необходимых для образования эритроцитов.
Широко распространены анемии хронических заболеваний, при которых может как ухудшиться усвояемость полезных веществ, так и увеличиться расход эритроцитов. Это ревматоидный артрит, гепатит, почечная недостаточность, сахарный диабет, гипотиреоз, туберкулез, болезнь Крона. Практически всегда к анемии приводят злокачественные заболевания.
Практически всегда к анемии приводят злокачественные заболевания.
Дефицитные анемии классифицируют по микроэлементам, нехватка которых приводит к малокровию:
- Железодефицитная – наиболее распространенная форма, диагностируется при дефиците железа.
- В12 дефицитная – встречается в основном у лиц пожилого возраста, возникает при недостатке витамина В12.
- Фолиеводефицитная – возникает на фоне дефицита витамина В9 (фолиевой кислоты).
По степени тяжести различают три степени: легкую, среднюю и тяжелую. Показатели нормы гемоглобина различаются в зависимости от возраста и пола.
Диагностика и методы лечения
Попытки самостоятельной нормализации гемоглобина – огромная ошибка, которая ведет к усугублению ситуации. Можно сколько угодно принимать витамины, но это не устранит причину дефицита микроэлементов, если она лежит в скрытом кровотечении, нарушении всасываемости веществ, злокачественной опухоли. Теряется время, прогрессирует основное заболевание, нанося необратимый вред здоровью.
Низкий гемоглобин – это сигнал к тщательному обследованию желудочно-кишечного тракта, печени, кишечника. В анапском диагностическом центре «НеоМед» проводят комплексное обследование, включающее анализы, УЗИ внутренних органов, эндоскопические исследования желудка, кишечника, матки.
Коррекция анемии назначается сразу же после ее выявления. Определив основной диагноз, выбирают тактику лечения медикаментозными или хирургическими методами.
Низкий гемоглобин у беременных и кормящих женщин
Во время беременности выше всего риск железодефицитной анемии, она грозит даже женщинам без хронических заболеваний, следящим за сбалансированностью рациона. Позаботиться об устранении рисков желательно заранее, так как анемия, резвившаяся до зачатия, грозит плацентарной недостаточностью, гипоплазией, выкидышем.
В период беременности и лактации у женщин расходуется больше железа и других микроэлементов и, если не компенсировать расход, можно получить анемию. Не менее важно восполнять свойственный беременным дефицит фолиевой кислоты. Низкий гемоглобин опасен для ребенка и может стать причиной аномального развития и серьезных осложнений здоровья.
Низкий гемоглобин опасен для ребенка и может стать причиной аномального развития и серьезных осложнений здоровья.
Не затягивайте с диагностикой, если заметили даже легкие симптомы анемии или давно не проверяли гемоглобин. Обратитесь в диагностический центр «НеоМед», чтобы исключить опасные заболевания или вовремя начать лечение.
Городская клиническая больница №31 — Пациентам в помощь. Гематологические заболевания. Часть III. Миелодиспластические синдромы (страница 2)
Страница 2 из 7
Рефрактерная цитопения с однолинейной дисплазией (рефрактерная анемия, рефрактерная нейтропения, рефрактерная тромбоцитопения)
Слово «цитопения» на медицинском языке означает снижение гемоглобина, лейкоцитов или тромбоцитов в крови, а «рефрактерная», или устойчивая, означает, что никакими витаминами, препаратами железа, диетой исправить ситуацию нельзя. Слово «однолинейная» говорит о том, что произошло нарушение взросления одного ростка крови.
Рефрактерная цитопения с однолинейной дисплазией (РЦОД) – это один из видов миелодиспластического синдрома, при котором нарушается созревание клеток одного ростка крови. Если неправильно созревают клетки эритроидного (красного) ростка, то снижается количество гемоглобина. Если изменился лейкоцитарный (белый) росток, то уменьшается количество нейтрофилов. Если расстроен процесс в тромбоцитарном ростке, то в крови не хватает тромбоцитов.
РЦОД – болезнь пожилых людей, средний возраст которых 65-70 лет. Рефрактерная тромбоцитопения и рефрактерная нейтропения встречаются чрезвычайно редко. Чаще всего пожилые люди заболевают рефрактерной анемией, которая составляет 10-20% всех случаев миелодиспластического синдрома. О ней речь и пойдет далее. Поставить диагноз рефрактерной анемии непросто, и обычно до того, как такой больной попадает на прием к гематологу, он длительно лечится у терапевта с диагнозами «идиопатическая анемия», «анемия смешанного генеза» и подобными.
Диагноз
Диагноз «рефрактерная анемия» ставят, если у пациента отсутствует другая причина изменения крови и есть типичные изменения в костном мозге. Больного всесторонне обследуют: делают цитологическое, цитогенетическое и гистологическое исследование костного мозга, другие специальные анализы. Рефрактерная анемия – это диагноз исключения, иначе говоря, его ставят тогда, когда все другие причины снижения гемоглобина исключены.
Лечение
Если гемоглобин пациента снижен незначительно, и он чувствует себя в целом нормально, то с лечением можно повременить. Когда гемоглобин становится ниже порогового (а «порог» у каждого человека свой и зависит от того, как больной ощущает низкий гемоглобин), то врач начинает лечение. Сейчас основным методом лечения рефрактерной анемии является регулярное переливание крови. Иногда пациентам с рефрактерной анемией помогает систематический прием препаратов эритропоэтина. Эритропоэтин — это вещество, которое делает более активными здоровые, незатронутые болезнью клетки красного ростка, что позволяет поддерживать гемоглобин на приемлемом уровне и уменьшить потребность в переливании крови. Если болезнь со временем перешла в острый лейкоз (таких пациентов около 2%), то лечение врач проводит по схемам острых лейкозов. Обычно пациенты с рефрактерной анемией, если своевременно переливать кровь, живут годы и чувствуют себя в целом хорошо.
Гемоглобин — одна из мишеней коронавируса COVID-19
Перевод на русский язык компании Logrus Global: https://logrusglobal.ru
COVID-19: атакует 1-бета-цепь гемоглобина и захватывает порфирин, чтобы ингибировать метаболизм человеческого гема.
14 апреля 2020 г.
Скачать PDF-версию
Авторы: Вэньчжун Лю1,2,*, Хуалань Ли2
1 Факультет информатики и инженерии, Сычуаньский инженерно-технический университет, Цзыгун, 643002, Китай;
2 Факультет медико-биологической и пищевой промышленности, Ибиньский университет, Ибинь, 644000, Китай;
* Адрес для переписки: [email protected].
Конспект
Новая коронавирусная пневмония (COVID-19) представляет собой контагиозную острую респираторную инфекцию, вызванную новым коронавирусом. Этот вирус представляет собой РНК-вирус с позитивной полярностью цепи, имеющий высокую степень гомологии с коронавирусом летучей мыши. В этом исследовании для сравнения биологических ролей некоторых белков нового коронавируса использовали анализ консервативных доменов, гомологическое моделирование и молекулярную стыковку. Результаты показали, что белок ORF8 и поверхностный гликопротеин могут связываться с порфирином. В то же время белки orf1ab, ORF10 и ORF3a могут координированно атаковать гем, находящийся на 1-бета-цепи гемоглобина, что приводит к отщеплению железа с образованием порфирина. В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, становится все меньше и меньше. Клетки легких испытывают чрезвычайно сильное отравление и воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Этот механизм также нарушает нормальный анаболический путь гема в организме человека, что, как ожидается, приводит к развитию заболевания. Согласно валидационному анализу полученных результатов, хлорохин может предотвратить атаку белков orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них, обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
Ключевые слова: новый коронавирус; респираторный дистресс; вид матового стекла изображения легкого; гликопротеин E2; ОRF8; оrf1ab; хлорохин; кровь; диабетический; флуоресцентный резонансный энергоперенос; древний вирус; цитокиновый шторм.
1. Введение
Новая коронавирусная пневмония (COVID-19) — контагиозное острое респираторное инфекционное заболевание. Пациенты с коронавирусной пневмонией страдают от лихорадки с температурой выше 38 градусов с такими симптомами, как сухой кашель, усталость, одышка, затрудненное дыхание, при визуализации легких они имеют вид матового стекла1-3. При морфологическом исследовании образцов тканей можно обнаружить большое количество слизи без явных вирусных включений. Эта пневмония была впервые обнаружена в декабре 2019 года на южнокитайском рынке морепродуктов провинции Хубэй, Китай4. Инфекция имеет высокую контагиозность5,6. Сейчас количество инфицированных людей достигло десятков тысяч по всему миру, и распространение инфекции не ограничено расой и границами. Исследователи провели тесты на выделение вирусов и секвенирование нуклеиновых кислот, чтобы подтвердить, что заболевание было вызвано новым коронавирусом7,8. Отмечено, что нуклеиновая кислота нового коронавируса представляет собой РНК с позитивной полярностью цепи8. Его структурные белки включают: белок-шип (S), белок оболочки (E), мембранный белок (M) и нуклеокапсидный фосфопротеин. Транскрибируемые неструктурные белки включают: orf1ab, ORF3a, ORF6, ORF7a, ORF10 и ORF8. Новый коронавирус высоко гомологичен коронавирусу летучих мышей9,10 и обладает значительной гомологией по отношению к вирусу SARS11,12. Исследователи изучили функцию структурных белков и некоторых неструктурных белков нового коронавируса13,14. Но новый коронавирус обладает целым набором потенциальных геномных характеристик, часть которых в основном является причиной вспышки в человеческой популяции15,16. Например, CoV EIC (белок оболочки коронавируса с функцией ионного канала) участвует в модулировании высвобождения вириона и взаимодействия «CoV — хозяин»17. Шип-белки, белки ORF8 и ORF3a значительно отличаются от белков других известных SARS-подобных коронавирусов, и они могут вызывать более серьезные различия в патогенности и передаче по сравнению с известными для SARS-CoV18. Более ранние исследования показали, что новый коронавирус проникает в эпителиальные клетки с использованием шип-белка, взаимодействующего с рецепторным белком ACE2 человека на поверхности клетки, что и вызывает инфекцию у людей. Однако структурный анализ шип-белка (S) нового коронавируса показывает, что белок S лишь слабо связывается с рецептором ACE2 по сравнению с коронавирусом SARS19. Из-за ограничений существующих экспериментальных методов специфические функции вирусных белков, таких как ORF8 и поверхностный гликопротеин, до сих пор неясны. Механизм патогенности нового коронавируса остается загадочным20.
В литературе21 описаны показатели биохимического исследования 99 пациентов с вызванной новым коронавирусом пневмонией, и в этом отчете отражены аномалии связанных с гемоглобином показателей биохимических анализов пациентов. Согласно отчету, количество гемоглобина и нейтрофилов у большинства пациентов снизилось, а индексные значения сывороточного ферритина, скорости оседания эритроцитов, С-реактивного белка, альбумина и лактатдегидрогеназы у многих пациентов значительно возросли. Эти изменения предполагают, что содержание гемоглобина у пациента уменьшается, а гема увеличивается, и организм будет накапливать слишком много вредных ионов железа, что вызовет воспаление в организме и увеличит уровни С-реактивного белка и альбумина. Клетки реагируют на стресс, вызванный воспалением, производя большое количество сывороточного ферритина для связывания свободных ионов железа, чтобы уменьшить повреждения. Гемоглобин состоит из четырех субъединиц, 2-α и 2-β, и каждая субъединица имеет железосодержащий гем22,23. Гем является важным компонентом гемоглобина. Это порфирин, содержащий железо. Структура без железа называется порфирином. Когда железо находится в двухвалентном состоянии, гемоглобин может отщеплять углекислый газ и связывать атомы кислорода в альвеолярных клетках, при этом железо окисляется до трехвалентного уровня. Когда гемоглобин становится доступен другим клеткам организма через кровь, он может высвобождать атомы кислорода и присоединять углекислый газ, а железо восстанавливается до двухвалентного.
Особо эффективных лекарств и вакцин для борьбы с болезнью, вызванной новым коронавирусом, не существует24. Однако в недавних поисках клинических методов лечения было обнаружено несколько старых препаратов, которые могут подавлять некоторые функции вируса, например, хлорохина фосфат оказывает определенное влияние на новую коронавирусную пневмонию25. Хлорохина фосфат — это противомалярийный препарат, который применяется в клинике уже более 70 лет. Эксперименты показывают, что эритроциты, инфицированные возбудителем малярии, могут накапливать большое количество хлорохина. Препарат приводит к потере фермента гемоглобина и смерти паразита из-за недостаточности аминокислот для его роста и развития. Предполагается, что терапевтический эффект хлорохина фосфата в отношении новой коронавирусной пневмонии может быть тесно связан с аномальным метаболизмом гемоглобина у человека. Между тем мы можем отметить, что хлорохин также широко используется для лечения порфирии26,27.
Поэтому мы предположили, что присоединение вирусных белков к порфиринам вызовет ряд патологических реакций у человека, таких как снижение уровня гемоглобина. Из-за тяжелой эпидемии и существующих условий с ограниченными экспериментальными методами тестирования функций белков большое научное значение имеет анализ функции белков нового коронавируса методами биоинформатики.
В этом исследовании для анализа функций белков, связанных с вирусом, использовались методы прогнозирования консервативных доменов, гомологического моделирования и молекулярной стыковки. Это исследование показало, что белок ORF8 и поверхностный гликопротеин способны объединяться с порфирином с образованием комплекса, в то время как белки orf1ab, ORF10, ORF3a скоординировано атакуют гем на 1-бета-цепи гемоглобина и отщепляют железо с образованием порфирина. Этот механизм вируса подавляет нормальный метаболический путь гема и приводит к проявлению у людей симптомов заболевания. Основываясь на результатах вышеупомянутых исследований, с помощью технологии молекулярной стыковки мы также проверили то, каким образом хлорохина фосфат и фавипиравир могут быть полезны в клинической практике.
2. Материалы и методы
2.1. Набор данных
Следующие последовательности белка загружали из NCBI: все белки нового коронавируса Ухань, гем-связывающий белок; гемоксидаза; для анализа консервативного домена использовали белковые последовательности.
Все белки нового коронавируса Ухань также использовали для конструирования трехмерных структур путем гомологического моделирования.
В то же время следующие файлы были загружены из базы данных PDB: кристаллическая структура MERS-CoV nsp10_nsp16 комплекс—5yn5, гем, оксигемоглобин человека 6bb5; дезоксигемоглобин человека 1a3n; 0TX; Rp. Комплекс MERS-CoV nsp10_nsp16—5yn5 использовался для гомологического моделирования. Гем, 0TX и 1RP использовались для молекулярной стыковки. Два оксигемоглобин был использован для стыковки белков.
2.2. Блок-схема биоинформационного анализа
На основе опубликованных в данном исследовании биологических белковых последовательностей была проведена серия биоинформационного анализа. Этапы показаны на рисунке 1:1. Консервативные домены вирусных белков анализируются28-30 онлайн-сервером МЕМЕ. Консервативные домены использовались для прогнозирования функциональных различий вирусных белков и белков человека. 2. Трехмерная структура вирусных белков была построена путем гомологического моделирования в средстве Swiss-model31,32. Если длина последовательности превышала 5000 нуклеотидов, использовался инструмент гомологического моделирования Discovery-Studio 2016. 3. Использование технологии молекулярной стыковки (инструмент LibDock) Discovery-Studio 201633 позволило смоделировать рецептор-лигандное соединение вирусных белков с гемом человека (или порфиринами). С учетом результатов биоинформационного анализа была построена модель жизненного цикла вируса и предложена соответствующая молекулярная картина заболевания.
Рисунок 1. Блок-схема биоинформационного анализа.
Рабочий процесс основан на эволюционных принципах. Хотя биологическая последовательность, характерная для развитых форм жизни и вируса, отличается, молекулы с аналогичными структурами всегда могут играть аналогичные биологические роли. В методе гомологического моделирования используется принцип, согласно которому аналогичная первичная структура белковых последовательностей имеет аналогичную пространственную структуру. Метод молекулярной стыковки построен на гомологическом моделировании реальных трехмерных молекул.
2.3. Анализ консервативного домена
MEME Suite — это онлайн-сайт, который объединяет множество инструментов прогнозирования и описания мотивов. Алгоритм максимального ожидания (EM) является основой для идентификации мотива на сайте MEMЕ. Мотив представляет собой консервативный домен небольшой последовательности в белке. Модели, основанные на мотивах, помогают оценить надежность филогенетического анализа. После открытия онлайн-инструмента MEME интересующие белковые последовательности объединяют в текстовый файл, при этом сохраняется формат файла .fasta. Затем выбирают нужное количество мотивов и нажимают кнопку «Перейти». В конце анализа консервативные домены отображаются после нажатия на ссылку.
2.4. Гомологическое моделирование
SWISS-MODEL — это полностью автоматический сервер гомологического моделирования структуры белка, доступ к которому можно получить через веб-сервер. Первый шаг — войти на сервер SWISS-MODEL, ввести последовательность и нажать Search Template («Поиск шаблона»), чтобы выполнить простой поиск шаблона. После завершения поиска можно выбрать шаблон для моделирования. Поиск шаблонов выполняется нажатием кнопки Build Model, и модель шаблона выбирается автоматически. Как видно, было найдено несколько шаблонов, а затем построено множество моделей. Здесь выбирается только модель. Модель в формате PDB загружается и визуализируется в VMD. SWISS-MODEL моделирует только белковые модели, соответствующие последовательностям менее 5000 нуклеотидных оснований. Для моделирования белка, соответствующего последовательности более 5000 нуклеотидов, можно использовать инструмент гомологического моделирования Discovery-Studio.
Перед использованием Discovery-Studio для гомологического моделирования неизвестного белка (такого, как orf1ab) файл структуры pdb матричного белка, такого как MERS-CoVnsp10_nsp16 комплекс 5yn5, должен быть загружен из базы данных PDB. Затем для сопоставления гомологичных последовательностей белков 5yn5 и orf1ab был применен инструмент сопоставления последовательностей Discovery-Studio. Затем был построен файл пространственной структуры orf1ab на основе матричного белка 5yn5.
2.5. Технология молекулярной стыковки
Молекулярная стыковка — это процесс нахождения наилучшего соответствия между двумя или более молекулами посредством определения геометрического и энергетического соответствия. Этапы использования молекулярной стыковки LibDock с Discovery-Studio следующие:
1. Подготовка модели лиганда. Откройте файл лиганда, например, гема, и нажмите кнопку Prepare Ligands («Подготовка лигандов») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептор-лиганд»), чтобы создать модель лиганда гема для стыковки. Сначала удалите FE (атом железа) из гема, а затем нажмите кнопку Prepare Ligands («Подготовка лигандов»), после чего будет сгенерирована модель лиганда порфирина. При открытии 0 XT снова нажмите кнопку Prepare Ligands («Подготовка лигандов»), чтобы получить модель хлорохинового лиганда.
2. Подготовьте модель белкового рецептора. Откройте файл pdb белка (сгенерированный с помощью гомологического моделирования) и нажмите Prepare protein («Подготовка белка») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом»), чтобы создать модель рецептора белка для стыковки.
3. Установите параметры стыковки для ее достижения. Выберите модель генерируемого белкового рецептора. В подменю Define and Edit Binding Site («Определение и редактирование сайта связывания») в меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом») нажмите кнопку From receptor Cavities («Из полостей рецептора»). На диаграмме модели рецептора белка появляется красная сфера. После щелчка правой кнопкой мыши по красному шару можно изменить его радиус. Затем в меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом») выберите Dock Ligands (LibDock) («Док-лиганды LibDock») в подменю Dock Ligands («Док-лиганды»). Во всплывающем окне выберите лиганд в качестве вновь созданной модели лиганда (ALL) и выберите рецептор в качестве вновь созданной модели рецептора (ALL), а для сфер сайтов задайте только что установленные координаты сфер. Наконец, нажмите RUN («Выполнить»), чтобы начать стыковку.
4. Рассчитайте энергию связывания и выберите положение с наибольшей энергией связывания. После завершения стыковки будет отображено множество местоположений лиганда. Откройте окно стыковки и нажмите кнопку Caculate Binding Energies («Рассчитать энергии связывания») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом»). Во всплывающем окне выберите рецептор в качестве значения по умолчанию, лиганд в качестве стыкуемой модели (ALL), а затем запустите вычисление энергии связывания. Наконец, сравните энергию связывания и выберите положение с наибольшей энергией связывания. Чем выше стабильность комплекса, тем больше энергия связывания.
5. Экспортируйте вид совместного сечения. Для вида в состоянии стыковки после установки стиля отображения области связывания нажмите кнопку Show 2D Map («Показать 2D-карту») в подменю View Interaction («Просмотр взаимодействия») меню Receptor-Ligand Interaction («Взаимодействие между рецептором и лигандом»), чтобы открыть вид участка связывания. Это представление может быть сохранено в виде файла изображения.
2.6. Технология стыковки белков
ZDOCK от Discovery-Studio — это еще один инструмент молекулярной стыковки для изучения взаимодействий белков. Мы использовали его для изучения атаки гемоглобина вирусными неструктурными белками. Ниже приведено описание стыковки orf1ab и гемоглобина, при изучении стыковки с другими неструктурными белками вируса применяли аналогичные методы стыковки. После открытия PBD-файлов человеческого оксигемоглобина 6bb5 и белка orf1ab нажмите кнопку Dock proteins (ZDOCK) в меню Dock and Analyze Protein Comlexes («Стыковка и анализ белковых комплексов»). Во всплывающем интерфейсе выберите человеческий оксигемоглобин 6bb5 в качестве рецептора, а orf1a в качестве лиганда, а затем нажмите кнопку Run («Выполнить»). После того как компьютер закончит вычисления, нажмите на интерфейс proteinpose («положение белка») и выберите положение и кластер с самым высоким баллом ZDOCK. Так можно получить положение белка orf1ab на человеческом оксигемоглобине 6bb5. Дезоксигемоглобин человека 1a3n имеет сходную схему стыковки с белком orf1ab.
3. РЕЗУЛЬТАТЫ
3.1. Вирусные структурные белки, связывающие порфирин
У человека гемоглобин может разлагаться на глобин и гем. Гем состоит из порфирина и иона железа, при этом ион железа находится в середине порфирина. Гем нерастворим в воде и может быть объединен с гем-связывающими белками с образованием комплекса и транспортироваться в печень. Порфирин разлагается до билирубина и выводится через желчный проток, а железо, содержащееся в молекуле, может повторно использоваться организмом. Если вирусные белки могут связываться с порфирином гема, они должны обладать связывающей способностью, аналогичной гем-связывающему белку человека, то есть вирусные белки и гем-связывающие белки должны иметь аналогичные консервативные домены. Для изучения связывания структурных белков вируса и порфирина в настоящей работе были применены следующие методы биоинформатики.
Сначала на онлайн-сервере MEME был выполнен поиск консервативных доменов в каждом структурном белке вируса и человеческом гем-связывающем белке (ID:NP_057071.2 гем-связывающий белок 1, ID: EAW47917.1 гем-связывающий белок 2). На рисунке 2 показано, что три вирусных белка (поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин) и белки связывания гема имеют консервативные домены, но мембранный гликопротеин не имеет консервативных доменов, p-значения малы, различия статистически значимы. Домены в трех вирусных белках различны, что позволяет предположить некоторое различие способностей структурных белков связывать порфирин. Мембранный гликопротеин не может связываться с порфирином.
Рисунок 2. Консервативные домены в структурных белках и гем-связывающих белках человека. A. Консервативные домены поверхностного гликопротеина. B. Консервативные домены белка оболочки. C. Консервативные домены мембранного гликопротеина. D. Консервативные домены нуклеокапсидного фосфопротеина.
Затем онлайн-сервер Swiss-model смоделировал поверхностные гликопротеины для получения трехмерной структуры, и были выбраны два вида файлов на основе шаблонов Spike и E2. 3D-структурный файл гема был загружен из базы данных PDB.
В конце концов Discovery-Studio реализовала молекулярную стыковку поверхностных гликопротеинов и порфирина. Сначала не удалось стыковать белок-шип с гемом (и порфирином). Гликопротеин Е2 (рисунок 3.A) получен из матриц 1zva.1.A. Стыковка гликопротеина Е2 и гема также была безуспешной. Когда удалили ион железа и гем стал порфирином, удалось выполнить множество видов стыковки между гликопротеином E2 и порфирином. После вычисления энергии связывания за результат была принята позиция стыковки с самой высокой энергией связывания (7 530 186 265,80 ккал/моль). Результат стыковки показан на рисунке 4.A-1, где представлена молекулярная модель связывания гликопротеина E2 с порфирином.
На рисунке 4.A-2 представлен двухмерный вид участка связывания, в котором 18 аминокислот гликопротеина Е2 взаимодействуют с порфирином.
При анализе белка оболочки использовались те же методы. Шаблон 5×29.1. A был выбран в качестве шаблона 3D-структуры белка оболочки (рисунок 3.B). Discovery-Studio обнаружила несколько видов стыковки белка оболочки и порфирина, где было выбрано положение стыковки с самой высокой энергией связывания (219 317,76 ккал/моль). На рисунке 4.B-1 показан результат стыковки, представляющий собой молекулярную модель связывания белка оболочки с порфирином. Рисунок 4.В-2 представляет двухмерный вид участка связывания, в котором 18 аминокислот белка оболочки взаимодействуют с порфирином.
Те же методы использовались для анализа нуклеокапсидного фосфопротеина. В качестве шаблона фосфопротеина нуклеокапсида использовали 1ssk.1.А (рисунок 3.С). Discovery-Studio позволила выявить вариант стыковки между нуклеокапсидным фосфопротеином и порфирином с самой высокой энергией связывания (15 532 506,53 ккал/моль). На рисунке 4.С-1 показан результат стыковки, представляющий собой молекулярную модель связывания нуклеокапсидного фосфопротеина с порфирином. На рисунке 4.C-2 представлен двухмерный вид связывающего участка, где 22 аминокислоты нуклеокапсидного фосфопротеина связаны с порфирином. Мембранный белок получен из шаблонов 1zva.1.A. Состыковать мембранный белок с гемом (и порфирином) не удалось. Полученные результаты свидетельствуют, что поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин могут связываться с порфирином с образованием комплекса.
Было обнаружено, что энергия связывания белка оболочки была самой низкой, энергия связывания гликопротеина Е2 была самой высокой, а энергия связывания нуклеокапсидного фосфопротеина была средней. Это означает, что связывание гликопротеина Е2 с порфирином является наиболее стабильным, связывание нуклеокапсидного фосфопротеина с порфирином является неустойчивым, а связывание белка оболочки с порфирином является наиболее неустойчивым.
После этого был проведен следующий анализ, чтобы выяснить, атакуют ли структурные белки гем с отщеплением атома железа и образованием порфиринов. Гем имеет оксидазу, называемую гемоксидазой, которая окисляет гем и отщепляет ион железа. Если структурные белки могут атаковать гем и отщеплять ионы железа, они должны иметь такой же консервативный домен, как гемоксидаза. Онлайн-сервер MEME был использован для поиска консервативных доменов структурных белков и белков гемоксидазы (NP_002124.1: гемоксигеназы-1; BAA04789.1: гемоксигеназы-2; AAB22110.2: гемоксигеназы-2). В результате консервативных доменов структурных белков обнаружено не было (рисунок 5). Объединяя этот результат с результатом предыдущего анализа, можно предположить, что структурные белки могут объединяться только с порфирином. Можно сделать вывод, что структурные белки не атакуют гем, вызывая диссоциацию атома железа с образованием порфирина.
Рисунок 3. Трехмерные структурные схемы новых белков коронавируса, полученные с помощью гомологического моделирования. A. Гликопротеин E2 поверхностного гликопротеина. B. Белок оболочки. C. Нуклеокапсидный фосфопротеин. D. Белок orf1ab. E. Белок ORF8. F. Белок ORF7a.
Рисунок 4. Результаты молекулярной стыковки структурных белков вируса и порфирина (красная структура). A. Результаты молекулярной стыковки гликопротеина E2 и порфирина. B. Результаты молекулярной стыковки белка оболочки и порфирина. C. Результаты молекулярной стыковки нуклеокапсидного фосфопротеина и порфирина. 1. Структурные белки вируса. 2. Вид участков связывания.
Рисунок 5. Консервативные домены структурных белков и белков гемоксигеназы человека. A. Консервативные домены поверхностного гликопротеина. B. Консервативные домены белка оболочки. C. Консервативные домены мембраны. D. Консервативные домены нуклеокапсидного фосфопротеина.
3.2. Неструктурные белки вируса, связывающие порфирин
Сначала на онлайн-сервере MEME был выполнен поиск консервативных доменов в каждом структурном белке вируса и человеческом гем-связывающем белке (ID:NP_057071.2 гем-связывающий белок 1, ID: EAW47917.1 гем-связывающий белок 2). На рисунке 2 показано, что три вирусных белка (поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин) и белки связывания гема имеют консервативные домены, но мембранный гликопротеин не имеет консервативных доменов, p-значения малы, различия статистически значимы. Домены в трех вирусных белках различны, что позволяет предположить некоторое различие способностей структурных белков связывать порфирин. Мембранный гликопротеин не может связываться с порфирином.
Рисунок 6. Консервативные домены в неструктурных белках и гем-связывающих белках человека. A. Консервативные домены orf1ab. B. Консервативные домены ORF3a. C. Консервативные домены ORF6. D. Консервативные домены ORF7a. E. Консервативные домены ORF8. F. Консервативные домены ORF10.
Гомологическое моделирование и технология молекулярной стыковки были применены для изучения способности белка orf1ab связывать гем. Поскольку Swiss-model не может моделировать 3D-структуру белковой последовательности orf1ab из-за ограничения на длину кодирующей последовательности (не более 5000 нуклеотидов), для гомологического моделирования использовалась программа Discovery-Studio. Кристаллическая структура комплекса MERS-CoV nsp10_nsp16 5yn5 и гема была загружена из базы данных PDB. В этом исследовании кристаллическая структура комплекса MERS-CoV nsp10_nsp16 5yn5 была взята в качестве матрицы для создания гомологичной структуры белка orf1ab. В качестве 3D-структуры белка orf1ab была выбрана гомологичная структура по умолчанию (рисунок 3.D). Затем в программе Discovery-Studio была проведена молекулярная стыковка белка orf1ab и порфирина. Белок orf1ab и гем не удалось состыковать, но после удаления ионов железа и превращения гема в порфирин радиус действия увеличился и несколько типов стыковки удалось довести до конца. Путем вычисления энергии связывания была выбрана модель стыковки с наибольшей энергией связывания (561 571,10 ккал/моль). Результат стыковки показан на рисунке 7.A-1, где представлена молекулярная модель связывания белка orf1ab с порфирином. Связывающая часть белка orf1ab действует как зажим. Именно этот зажим захватывает порфирин без иона железа. На рисунке 7.A-2 показан двухмерный вид участка связывания. Видно, что 18 аминокислот белка orf1ab связаны с порфирином.
Для изучения свойств связывания белка ORF8 с гемом использовались те же этапы анализа, что и для структурного белкового метода. Файл структуры был создан на основе шаблона ORF7 (рисунок 3.E). Было обнаружено несколько видов стыковки белка ORF8 и порфирина, из которых выбрано стыковочное положение, имеющее наибольшую энергию связывания (12 804 859,25 ккал/моль). Результат стыковки (рисунок 7.В-1) представляет собой молекулярную модель связывания белка ORF8 с порфирином. Рисунок 7.В-2 представляет собой двухмерный вид участка связывания, где 18 аминокислот ORF8 связаны с порфирином.
Для анализа белка ORF7a использовались те же методы, что и при анализе белка ORF8. Шаблон ORF7a — 1yo4.1.A (рис. 3.F). Белок ORF7a и порфирин имели наивысшую энергию связывания (37 123,79 ккал/моль). На рисунке 7.С-1 показана молекулярная модель связи ORF7a с порфирином. Пятнадцать аминокислот ORF7a связаны с порфирином (рис. 7.C-2). Связывающая часть белка ORF7a также действует как зажим.
Swiss-модель не может предоставить шаблон для ORF10. ORF6a и ORF3a получены из шаблонов 3h08.1.A и 2m6n.1.A соответственно, но состыковать ORF6a (ORF3a) с гемом и порфирином не удалось.
Рисунок 7. Результаты молекулярной стыковки неструктурных белков вируса и порфирина (красный). A. Результаты молекулярной стыковки белка orf1ab и порфирина. B. Результаты молекулярной стыковки для белка ORF8 и порфирина. C. Результаты молекулярной стыковки белка ORF7a и порфирина. 1. Неструктурные белки вируса. 2. Вид участков связывания.
Наконец, был проведен следующий анализ, чтобы выяснить, могли ли неструктурные белки атаковать гем и отщеплять атом железа с образованием порфиринов. Здесь для анализа консервативных доменов неструктурных белков и белков гемоксидазы использовался тот же метод, что и для предыдущего структурного белка — онлайн-сервер MEME (NP_002124.1: гемоксигеназа-1; BAA04789.1: гемоксигеназа-2; AAB22110.2: гемоксигеназа-2). Как показано на рисунке 8, ORF10, orf1ab и ORF3a имеют консервативные домены. Учитывая результаты предыдущего анализа, можно сказать, что неструктурные белки ORF10, orf1ab и ORF3a могут атаковать гем и отщеплять атом железа с образованием порфирина. Однако р-значение для orf1ab и ORF3a больше, чем 0,1 %. Поэтому ORF10 может быть основным белком, атакующим гем, тогда как orf1ab и ORF3a захватывают гем или порфирин.
Результаты показали, что orf1ab, ORF7a и ORF8 могут связываться с порфирином, в то время как ORF10, ORF3a и ORF6 не могут связываться с гемом (и порфирином). ORF10, ORF1ab и ORF3a также обладают способностью атаковать гем с образованием порфирина. Энергии связывания orf1ab, ORF7a, ORF8 и порфирина сравнивали между собой. Было обнаружено, что энергия связывания ORF7a была самой низкой, энергия связывания ORF8 была самой высокой, а энергия связывания orf1ab была средней. Это означает, что связывание ORF8 с порфирином является наиболее стабильным, связывание orf1ab с порфирином является неустойчивым, а связывание ORF7a с порфирином является наиболее неустойчивым. Последовательности ORF10 и ORF6 короткие, поэтому они должны быть короткими сигнальными пептидами. Следовательно, механизм, с помощью которого неструктурные белки атакуют гем, может быть такой: ORF10, ORF1ab и ORF3a атакуют гем и образуют порфирин; ORF6 и ORF7a отправляют порфирин в ORF8; и ORF8 и порфирин образуют стабильный комплекс.
Рисунок 8. Консервативные домены неструктурных белков и белков гемоксигеназы человека. A. Консервативные домены orf1ab. B. Консервативные домены ORF3a. C. Консервативные домены ORF6. D. Консервативные домены ORF7a. E. Консервативные домены ORF8. F. Консервативные домены ORF10.
3.3. Вирусный неструктурный белок атакует гем на бета-цепи гемоглобина
Порфирины в организме человека — это в основном железосодержащие порфирины, то есть гем. Большая часть молекул гема не свободна, а связана в составе гемоглобина. Для выживания вирусов им требуется большое количество порфиринов. Поэтому новый коронавирус нацелен на гемоглобин, атакует гем и охотится на порфирины. Результаты предыдущего анализа показали, что ORF1ab, ORF3a и ORF10 имеют домены, сходные с гемоксигеназой, но только ORF1ab может связываться с порфирином. Чтобы изучить атакующее поведение белков orf1ab, ORF3a и ORF10, мы использовали технологию молекулярной стыковки ZDOCK. Технология молекулярной стыковки ZDOCK позволяет анализировать взаимодействия белков и находить приблизительные положения этих трех белков на гемоглобине.
Сначала мы загрузили гемоксигеназу 2 (5UC8) из PDB и использовали ее в качестве шаблона, а затем использовали инструмент гомологического моделирования Discovery-Studio для создания трехмерной структуры ORF10 (рисунок 9). Поскольку гемоглобин имеет две формы: окисленную и восстановленную, в приведенном ниже анализе выполнена молекулярная стыковка белков в этих двух случаях, а в качестве результата принята позиция с наивысшей оценкой ZDOCK.
Рисунок 9. Моделирование гомологии ORF10.
На дезоксигемоглобине orf1ab располагается в нижне-среднем участке 1-альфа- и 2-альфа-цепи вблизи 2-альфа-цепи (рисунок 10.A). ORF3a располагается в нижне-среднем участке 1-альфа и 2-альфа-цепи вблизи 2-альфа цепи (рисунок 10.B). ORF10 располагается в нижне-средней части 1-бета- и 2-бета-цепи вблизи 1-бета-цепи (рисунок 10.C). Предполагается следующий механизм: orf1ab атакует 2-альфа-цепь, вызывая изменения конформации белка глобина. Связывание ORF3A с цепью 2-альфа приводит к атаке ею цепи 1-бета, открывающей гем. ORF10 быстро присоединяется к 1-бета-цепи и непосредственно воздействует на гем 1-бета-цепи. Когда атом железа отщепляется, гем превращается в порфирин, и orf1ab получает возможность захватить порфирин. Белок orf1ab играет критически важную роль на протяжении всей атаки.
Рисунок 10. Вирусный неструктурный белок атакует гемоглобин. A. orf1ab атакует дезоксигемоглобин. B. ORF3a атакует дезоксигемоглобин. C. ORF10 атакует дезоксигемоглобин. D. orf1ab атакует окисленный гемоглобин. E. ORF10 атакует окисленный гемоглобин. F. ORF3a атакует окисленный гемоглобин.
На окисленном гемоглобине orf1ab располагается в нижне-средней части альфа- и бета-цепи вблизи альфа-цепи (рисунок 10.A). ORF10 располагается в нижней части бета-цепи, ближе к внешней (рисунок 10.B). ORF3a располагается в нижне-средней части альфа- и бета-цепи и приближен к бета-цепи (рисунок 10.C). Возможный механизм состоит в том, что orf1ab связывается с альфа-цепью и атакует бета-цепь, вызывая конфигурационные изменения в альфа- и бета-цепях; ORF3 атакует бета-цепь и обнажает гем. ORF10 быстро прикрепляется к бета-цепи и непосредственно влияет на атомы железа в геме бета-цепи. Гем после отщепления железа превращается в порфирин, и orf1ab получает возможность захватить порфирин. Белок orf1ab играет ключевую роль на протяжении всей атаки.
Атака вирусных белков на оксигемоглобин приводит к прогрессирующему уменьшению количества гемоглобина, который может переносить кислород. Влияние вирусных белков на дезоксигемоглобин будет еще сильнее уменьшать количество гемоглобина, доступного для переноса диоксида углерода и глюкозы крови. Люди с диабетом могут иметь нестабильный уровень глюкозы крови. Состояние пациента дополнительно ухудшается от отравления диоксидом углерода. Клетки легких испытывают чрезвычайно сильное воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Состояние пациентов с респираторными расстройствами ухудшится.
3.4. Валидация воздействия хлорохина фосфата
Химические компоненты хлорохина фосфата конкурируют с порфирином и связываются с вирусным белком, тем самым ингибируя атаку вирусного белка на гем или связывание с порфирином. Для проверки влияния хлорохина фосфата на молекулярный механизм действия вируса была принята технология молекулярной стыковки. Структурный файл 0TX (хлорохин) был загружен из базы данных PDB. Затем была использована технология молекулярной стыковки Discovery-Studio 2016 для тестирования эффектов вирусных белков и хлорохина.
Рисунок 11.A-1 представляет собой схему связывания хлорохина с поверхностным гликопротеином вируса. На рисунке 11.A-2 показана область связывания вирусного поверхностного гликопротеина. В связывании участвуют 13 аминокислот. Энергия связывания хлорохина с гликопротеином Е2 вируса составляет 3 325 322 829,64 ккал/моль, что составляет около половины энергии связывания гликопротеина Е2 и порфирина. Согласно результатам рис. 4.А-2, дальнейший анализ показал, что некоторые аминокислоты (например, VAL A:952, ALA A:956, ALA B:956, ASN A:955 и др.) гликопротеина Е2 могут связываться не только с хлорохин-фосфатом, но и с порфиринами. Другими словами, хлорохин имеет одну треть шансов ингибировать вирусный гликопротеин E2 и уменьшить симптомы у пациента.
Вид связывания хлорохина и белка оболочки показан на рисунке 11.В-1. Энергия связывания хлорохина и белка оболочки 7852,58 ккал/моль, что эквивалентно лишь 4 % энергии связывания белка оболочки и порфирина. Участок связывания показан на рисунке 11.B-2. На рисунках 4.В-2 и 11.В-2 представлены некоторые аминокислоты (такие, как LEV E:28, PHE: D:20, VAL E:25) белка оболочки, которые связываются не только с хлорохин-фосфатом, но и с порфирином.
Рисунок 11.С-1 представляет собой схему связывания хлорохина с фосфопротеином нуклеокапсида. Энергия связывания хлорохина с нуклеокапсидным фосфопротеином составляет 198 815,22 ккал/моль, что эквивалентно лишь 1,4 % энергии связывания нуклеокапсидного фосфопротеина и порфирина. ALA A:50 и т. д. нуклеокапсида фосфопротеина участвуют в связывании (рисунок 12.C-2). Рисунки 4.C-2 и 11.C-2 свидетельствуют о том, что аминокислоты нуклеокапсидного фосфопротеина могут связывать порфирин, но не могут связывать хлорохин. Стыковка мембранного белка с хлорохином не произошла.
Рисунок 11. Результаты молекулярной стыковки структурных белков вируса и хлорохина (красный). A. Результаты молекулярной стыковки гликопротеина E2 и порфирина. B. Результаты молекулярной стыковки белка оболочки и порфирина. C. Результаты молекулярной стыковки нуклеокапсидного фосфопротеина и порфирина. 1. Структурные белки вируса. 2. Вид участков связывания.
Принципиальная схема связывания хлорохина с белком orf1ab показана на рисунке 12.A-1. Участок связывания белка orf1ab представлен на рисунке 12.A-2. Энергия связывания хлорохина и белка orf1ab составляет 4 584 302,64 ккал/моль, что в 8 раз больше энергии связывания между orf1ab и порфирином. Согласно результатам на рисунке 7.A-2, было показано, что некоторые аминокислоты, такие как MET 7045, PHE 7043, LYS 6836 белка orf1ab, могут быть связаны не только с фосфатом хлорохина, но и с порфирином.
Принципиальная схема связывания хлорохина с белком ORF8 показана на рисунке 12.B-1. На рисунке 12.B-2 показан участок связывания ORF8. Энергия связывания хлорохина с белком ORF8 составляет 4 707 657,39 ккал/моль, что эквивалентно лишь 37 % энергии связывания белка ORF8 с порфирином. Согласно результату, показанному на рисунке 7.B-2, аминокислоты, такие как ILE A: 74, ASP A:75, LYS A: 53 ORF8, могут связываться не только с фосфатом хлорохина, но и с порфирином.
Принципиальная схема связывания хлорохина с белком ORF7a показана на рисунке 12.C-1. На рисунке 12.C-2 представлен вид участка связывания. Энергия связывания хлорохина с белком ORF7a составляет 497 154,45 ккал/моль, что в 13 раз превышает энергию связи белка ORF7a с порфирином. Согласно результатам, показанным на рисунке 7.C-2, аминокислоты, такие как GLN A:94, ARG A:78 и LEU A:96 белка ORF7 могут связываться не только с фосфатом хлорохина, но и с порфирином.
Стыковка белков ORF3a, ORF6 и ORF10 с хлорохином не удалась.
Эти результаты показали, что хлорохин может в определенной степени ингибировать связывание E2 и ORF8 с порфирином с образованием комплекса. Кроме того, хлорохин может предотвратить атаку orf1ab, ORF3a и ORF10 на гем с образованием порфирина.
Рисунок 12. Результаты молекулярной стыковки вирусных неструктурных белков и хлорохина (красная структура). A. Результаты молекулярной стыковки белка orf1ab и хлорохина. B. Результаты молекулярной стыковки белка ORF8 и хлорохина. C. Результаты молекулярной стыковки белка ORF7a и хлорохина. 1. Неструктурные белки вируса. 2. Вид участков связывания.
3.5. Валидация эффекта фавипиравира
Рисунок 11.С-1 представляет собой схему связывания хлорохина с фосфопротеином нуклеокапсида. Энергия связывания хлорохина с нуклеокапсидным фосфопротеином составляет 198 815,22 ккал/моль, что эквивалентно лишь 1,4 % энергии связывания нуклеокапсидного фосфопротеина и порфирина. ALA A:50 и т. д. нуклеокапсида фосфопротеина участвуют в связывании (рисунок 12.C-2). Рисунки 4.C-2 и 11.C-2 свидетельствуют о том, что аминокислоты нуклеокапсидного фосфопротеина могут связывать порфирин, но не могут связывать хлорохин. Стыковка мембранного белка с хлорохином не произошла.
Таблица 1. Эффект фавипиравира
| Белок вируса | Порфирин (ккал/моль) |
Фавипиравир (ккал/моль) |
Имеет идентичные остатки |
Мишень | Отношение связывания с мишенью (фавипиравир/ порфирин) |
|---|---|---|---|---|---|
| Гликопротеин E2 | 7,530,186,265.80 | — | — | — | — |
| Белок оболочки | 219,317.76 | 597,814,480.55 | Да | Да | 2,725.79 |
| Нуклеокапсид | 15,532,506.53 | — | — | — | — |
| orf1ab | 561,571.10 | 1,052,489.88 | Да | Да | 1.87 |
| ORF8 | 12,804,859.25 | 348,589.80 | Да | — | — |
| ORF7a | 37,123.79 | 17,034,560.60 | Да | Да | 458.86 |
4. Обсуждение
4.1. Новый коронавирус произошел от древнего вируса
Для самых примитивных форм жизни, коими являются вирусы, не так-то просто увидеть их роль в связывании порфирина. Соединения порфирина широко распространены в фотосинтезирующих и нефотосинтезирующих организмах и связаны с критическими физиологическими процессами, такими как катализ, перенос кислорода и энергии. Порфирин также является древним соединением, широко распространенным на Земле. Порфирин впервые обнаружен в сырой нефти и асфальтовой породе в 1934 году. Порфирин обладает уникальными фотоэлектронными свойствами, отличной термостабильностью и имеет широкие перспективы применения в химии материалов, медицине, биохимии и аналитической химии. Его характеристики отлично подходят для применений, связанных с двухфотонным поглощением, флуоресценцией, передачей энергии и других. Перенос энергии флуоресцентного резонанса (FRET) — это безызлучательный процесс, при котором донор в возбужденном состоянии передает энергию реципиенту в основном состоянии посредством дипольного эффекта дальнего действия. FRET-характеристики порфирина могут быть основой способа выживания, на который опирался исходный вирус.
Существует множество теорий о происхождении вирусов, одна из которых называется теорией совместной эволюции, в которой вирусы могут эволюционировать из комплексов белка и нуклеиновой кислоты. Различные методы не объясняют, как вирус выжил независимо от не существовавших в начале жизни клеток, поэтому происхождение вирусов остается загадкой. В этой статье предполагается, что вирус может связываться с порфирином, что может объяснить проблему выживания оригинального вируса. Поскольку порфирин обладает характеристикой передачи энергии флуоресцентного резонанса, вирусы, которые связываются с порфиринами, могут получить энергию с помощью этого светоиндуцированного метода. Вирус, получивший энергию, может использовать ее для минимального перемещения, для выхода из состояния гибернации или перехода в него из активного состояния. Согласно результатам нашего исследования, новый коронавирус был формой жизни, зависящей от порфирина. Поэтому мы можем предположить, что новый коронавирус происходит от древнего вируса, который мог развиваться у летучих мышей на протяжении бесчисленных поколений.
4.2. Более высокая проницаемость порфиринов сквозь клеточные мембраны обуславливает большую инфекционность
Быстрая эволюция нового коронавируса также сопровождается некоторыми парадоксальными особенностями. Нынешняя теория предполагает, что новый коронавирус связывается с рецептором ACE2 человека через белок-шип. Он попадает в клетки человека по механизму фагоцитоза. Модели инфекционных заболеваний показали, что новая коронавирусная пневмония очень контагиозна. Следовательно, способность связывания белка-шипа и белка ACE2 человека должна быть большой, но в литературе имеются сообщения о том, что эта способность связывания является слабой. Что вызывает высокую инфекционность нового коронавируса? Мы считаем, что в дополнение к методу инвазии через взаимодействие шип-ACE2 вирус должен обладать оригинальным механизмом инвазии.
Медицинские работники обнаружили новый коронавирус в моче, слюне, кале и крови. Жизнеспособный вирус также может обнаруживаться в биологических жидкостях. В таких средах порфирин является доминирующим веществом. Порфириновые соединения относятся к классу азотсодержащих полимеров, и существующие исследования показали, что они обладают выраженной способностью обнаруживать клеточные мембраны и проникать сквозь них. В начале жизни молекулы вирусов с порфиринами непосредственно перемещались в исходную мембранную структуру за счет проницаемости порфирина. Это исследование показало, что гликопротеин E2 и белок оболочки нового коронавируса могут хорошо связываться с порфиринами. Поэтому коронавирус в связи с порфирином может также напрямую проникать через клеточную мембрану человека, что делает процесс инфицирования надежным. Наш валидационный анализ показал, что фавипиравир может предотвратить связывание только белка оболочки и порфирина. В то же время хлорохин может предотвращать связывание гликопротеина Е2 с порфирином лишь в определенной степени. Следовательно, инфекционность новой коронавирусной пневмонии не предотвращается этими препаратами полностью, так как связывание гликопротеина E2 и порфирина ингибируется не полностью.
4.3. Сложность индивидуального иммунитета
В некоторых теориях предполагается, что иммунный ответ возникает в организме после того, как у пациента разовьется заболевание. У некоторых пациентов после выздоровления вырабатываются иммунные антитела. Согласно нашему исследованию, гликопротеин E2, белок оболочки, нуклеокапсидный фосфопротеин, orf1ab, ORF7a и ORF8 вируса могут связываться с порфирином. Но из текущего исследования неясно, какие иммунные антитела возникали против вирусных белков.
Кроме того, некоторые пациенты могут погибнуть в результате цитокинового шторма. По сравнению с пациентами с атипичной пневмонией, анатомические характеристики умерших отличаются. Комплекс вирусных белков и порфирина может быть малорастворимым. Избыток слизи в тканях умерших пациентов был причиной избытка муцинового белка. Муцин может превратить слабо соединенные клетки в плотно соединенные и увеличить смазку между ними. Можно предположить, что действующее соединение приводит к уменьшению связи между клетками, в результате чего клетки начинают нуждаться в муцине для укрепления связи между собой в пределах тканей и для обеспечения смазывающего эффекта. Кроме того, когда пациент вступает в тяжелый инфекционный период, вирусные структурные белки, в основном, используются для сборки вирусов. Поэтому мы не можем обнаружить заметных вирусных включений в клетках тканей при аутопсии умерших пациентов.
4.4. Иммунные клетки заражаются и секретируют антитела и вирусные белки
Иммунные клетки, такие как плазматические клетки, также известны как эффекторные В-клетки. Плазматические клетки в основном наблюдаются в соединительной ткани слизистой оболочки как в пищеварительном тракте, так и в дыхательных путях. Это клетки, секретирующие антитела. Плазматические клетки выполняют функцию синтеза и хранения антител, а именно иммуноглобулинов, и участвуют в гуморальных иммунных ответах. В зависимости от источника выработки антител выделяют естественные антитела, такие как антитела анти-А и анти-В в системе групп крови ABO. По способности к участию в процессе агглютинации в ходе антигенной реакции антитела делят на полные антитела IgM и неполные антитела IgG. Обнаружение IgM и IgG в крови помогает определить, является ли организм человека инфицированным вирусом. В крови пациентов с подозрением на новую коронавирусную пневмонию содержится большое количество IgM. При лечении количество IgM у пациента снижается, а количество IgG повышается, указывая на то, что его организм вырабатывает резистентность и иммунитет. Имеются сообщения о том, что плазматические клетки также имеют рецептор ACE2, то есть для них существует путь инфекции шип-ACE2. Учитывая сообщения о том, что селезенка, костный мозг и лимфатические узлы тяжелых пациентов также сильно повреждены, мы предполагаем, что плазматические клетки также тесно связаны с инфекцией и выздоровлением пациентов с коронавирусом.
Плазматические клетки могут секретировать различные антитела, что также объясняет высвобождение вирусных белков в организме. Вирусные белки orf1ab, ORF3a и ORF10 синтезировались в клетках и атаковали гемоглобин и гем вне клеток. Вирусные белки могли покидать клетки через механизмы секреции белков. К числу секретируемых белков в основном относятся пищеварительные ферменты, антитела и некоторые гормоны. Исходя из вышеизложенной точки зрения, что инфицирование было связано с плазматическими клетками, мы полагали, что вирусные белки секретировались главным образом изнутри клетки наружу по механизму секреции антител. Один из возможных путей заключается в том, что после инфицирования плазматической клетки в ней запускаются процессы вирусной транскрипции и трансляции, а затем из клетки секретируются вирусные белки, такие как orf1ab, ORF3a и ORF10. Однако неясно, секретируются ли вирусные белки за пределы клетки путем связывания с антителами группы крови.
Мы планировали смоделировать этот механизм, но объем вычислений оказался слишком велик. После того, как мы ввели «антитела крови» в поисковую строку базы данных PDB, веб-страница показала почти 160 000 записей и почти 47 000 записей, связанных с человеком. Кроме того, моделирование молекулярной стыковки антител и белков, таких как orf1ab, представляет собой стыковку белков, процесс расчета которой является очень сложным. Поэтому мы не можем смоделировать этот механизм. Мы предлагаем другим лабораториям использовать суперкомпьютеры для моделирования этого механизма.
4.5. Вирусный белок атакует гемоглобин, высвобожденный за счет иммунного гемолиза эритроцитов
Эритроциты в основном содержат гемоглобин. Во время гемолиза гемоглобин выходит из клеток и растворяется в плазме. В этот момент способность гемоглобина переносить кислород теряется. Гемолиз происходит из-за разрыва мембран эритроцитов и растворения матрикса. Либо может происходить расширение пор мембраны эритроцита до степени, позволяющей гемоглобину покидать клетку, оставляя за собой двояковогнутую дискообразную клеточную мембрану — «гематоцит». Иммунный гемолиз — это специфический гемолиз, вызванный реакцией «антиген-антитело». Неспецифический гемолиз вызывается физическими, химическими или биологическими факторами. После гемолиза эритроцитов вирусные белки могут атаковать гемоглобин. Учитывая, что некоторые исследователи подсчитали, что люди с кровью типа O хуже заражаются COVID-19, мы предполагаем, что иммунный гемолиз может быть основным методом обеспечения атаки гемоглобина вирусными белками. Вирусные белки атакуют гемоглобин после заражения. Из-за ограниченных возможностей вычислительных инструментов мы не можем смоделировать, атакуют ли вирусные белки гемоглобин снаружи или внутри эритроцитов.
4.6. Более высокий уровень гемоглобина вызывает более высокую болезненность
Показано, что терапевтический эффект хлорохина фосфата в отношении новой коронавирусной пневмонии может быть тесно связан с аномальным метаболизмом гемоглобина у человека. Количество гемоглобина является основным биохимическим показателем крови, и его содержание различается в зависимости от пола. В норме у мужчин его уровень значимо выше, чем у женщин, что также может быть причиной того, почему мужчины заражаются новой коронавирусной пневмонией чаще, чем женщины. Кроме того, большинство пациентов с новой коронавирусной пневмонией составляют людей среднего и старшего возраста. Многие из этих пациентов имеют сопутствующие заболевания, такие как сахарный диабет. Пациенты с диабетом имеют более высокий уровень гликированного гемоглобина. Гликированный гемоглобин представляет собой дезоксигемоглобин. Гликированный гемоглобин представляет собой комбинацию гемоглобина и глюкозы крови, что является еще одной причиной высокого уровня инфицирования среди пожилых людей.
Это исследование подтвердило, что белки orf1ab, ORF3a и ORF10 могут скоординированно атаковать гем на бета-цепи гемоглобина. Атаке подвергаются как оксигенированный, так и дезоксигенированный гемоглобин. Во время атаки позиции orf1ab, ORF3 и ORF10 немного отличаются. Было показано, что, чем выше содержание гемоглобина, тем выше риск заболевания. Однако нет уверенности в том, что частота заболеваний, вызванных аномальным гемоглобином (структурным), относительно невелика. Гемоглобин пациентов и выздоравливающих должен быть объектом дальнейших исследований и лечения.
4.7. Ингибирование анаболического пути гема и развитие заболевания
В данной статье рассматривалось непосредственное вмешательство вируса в сборку гемоглобина человека. Основной причиной был слишком низкий уровень нормального гема. Гем участвует в критических биологических процессах, таких как регуляция экспрессии генов и трансляции белка. Порфирин является важным материалом для синтеза гема. Поскольку существующие данные показывают, что в организме оказывается слишком много свободного железа, это должно быть следствием того, что вирус-продуцирующая молекула конкурирует с железом за порфирин. Ингибирование анаболического пути гема и возникновение симптомов у человека.
Неясно, является ли пространственная молекулярная структура гема и порфирина у пациентов с порфирией такой же, как и у здоровых людей. При наличии аномальной структуры неясно, может ли такой порфирин связываться с вирусным белком с образованием комплекса, и может ли вирусный белок атаковать подобный гем. Эти вопросы должны быть рассмотрены в клинических и экспериментальных исследованиях.
5. Выводы
С момента возникновения эпидемии использование методов биоинформатики имеет большое научное значение для анализа ролей белков нового коронавируса (таких, как ORF8 и поверхностные гликопротеины). В этом исследовании методы прогнозирования доменов применялись для поиска консервативных доменов. Структуру белковых молекул, таких как ORF8 и поверхностных гликопротеинов, получали с помощью методов гомологического моделирования. Технология молекулярной стыковки использовалась для анализа взаимодействия связывающей части вирусных белков с гемом и порфирином. Результаты исследования показывают, что ORF8 и поверхностные гликопротеины могут объединяться с порфирином с образованием комплекса. В то же время белки orf1ab, ORF10 и ORF3a могут координированно атаковать гем, находящийся на 1-бета-цепи гемоглобина, что приводит к отщеплению железа с образованием порфирина. В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, уменьшается. Клетки легких испытывают чрезвычайно сильное воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Состояние пациентов с респираторными расстройствами ухудшится. Пациенты с диабетом и пожилые люди имеют более высокий уровень гликированного гемоглобина. Уровень гликированного гемоглобина снижается в результате вирусной атаки, что делает уровень глюкозы в крови пациентов нестабильным. Поскольку порфириновые комплексы вируса, продуцируемого в организме человека, ингибировали анаболический путь гема, они вызывали широкий спектр инфекций и заболеваний.
С учетом этих выводов дальнейший анализ показал, что хлорохин может предотвратить атаку orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
На основании компьютерного моделирования и дискуссионного анализа этого исследования мы выдвинули предположение об основном механизме патогенности этого вируса. Вирус может сначала инфицировать клетки с рецепторами ACE2, включая иммунные клетки. Иммунные клетки производят антитела и вирусные белки. Антитела действуют на эритроциты, вызывая иммунный гемолиз. Гемоглобин высвобождается и подвергается атаке. Вирус захватывает порфирин и ингибирует метаболизм гема. Поэтому мы считаем, что поражение организма человека вирусом носит системный характер, а не ограничивается дыхательной системой.
Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. Мы с нетерпением ожидаем сообщений от лабораторий, которые смогут доказать, является ли эта теория неправильной или правильной из следующих экспериментов: 1) используйте рентгеноструктурный анализ для определения структуры гемоглобина у тяжелобольных пациентов, чтобы выяснить, есть ли какие-либо отклонения; 2) в эксперименте с вирусами должны быть показаны следующие этапы: вирусные белки могут связывать порфирин; вирусные белки могут атаковать гем; вирусные белки могут атаковать гемоглобин в крови.
Заявления/h5>
Согласие этического комитета и согласие на участие
Согласие на публикацию
Доступность данных и материалов
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Финансирование
Эта работа финансировалась за счет гранта Фонда естественных наук для проекта по внедрению талантов Сычуанского университета науки и техники (номер награды 2018RCL20, грантополучатель WZL).
Вклад авторов
Финансирование получил WZL. Дизайн, анализ, написание: WZL. Курирование данных, проверка рукописи: HLL. Все авторы прочитали и согласились с опубликованной версией рукописи.
Благодарности
Об авторах
1 Факультет информатики и инженерии, Сычуаньский инженерно-технический университет, Цзыгун, 643002, Китай;
2 Факультет медико-биологических наук и технологии пищевых продуктов, Ибиньский университет, Ибинь, 644000, Китай.
Список литературы
- Дяо, K., Хань, P., Пан, T., Ли, И. и Ян, Ц. Характерные особенности визуализации HRCT в репрезентативных случаях завозной инфекции новой коронавирусной пневмонии 2019 г. (Diao, K., Han, P., Pang, T., Li, Y. & Yang, Z. HRCT Imaging Features in Representative Imported Cases of 2019 Novel Coronavirus Pneumonia). Precision Clinical Medicine (2020).
- Чан, Д. и др., Эпидемиологические и клинические характеристики новой коронавирусной инфекции на примере 13 пациентов за пределами Уханя. Китай (Chang, D. et al. Epidemiologic and clinical characteristics of novel coronavirus infections involving 13 patients outside Wuhan, China). JAMA (2020).
- Хуан С. и др. Клинические характеристики пациентов, инфицированных новым коронавирусом 2019 в Ухане, Китай (Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China). The Lancet (2020).
- Ли, С., Цай, Цз., Ван, С. и Ли, Ю. Возможность крупномасштабного переноса инфекции 2019 nCov от человека к человеку в первом поколении (Li, X., Zai, J., Wang, X. & Li, Y. Potential of large ‘first generation’human‐to‐human transmission of2019‐nCoV). Journal of Medical Virology (2020).
- Ван, Д. и др., Клинические характеристики 138 госпитализированных пациентов с вирусной пневмонией, вызванной новым коронавирусом 2019, Ухань, Китай (Wang, D. et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China). Jama (2020).
- Ли, Ц. и др. Ранняя динамика передачи пневмонии, вызванной новой коронавирусной инфекцией, в Ухане, Китай (Li, Q. et al. Early transmission dynamics in Wuhan, China, of novel coronavirus–infected pneumonia). New England Journal of Medicine (2020).
- Чжу, Н. и др. Новый коронавирус, выделенный у пациентов с пневмонией в Китае в 2019 г. (Zhu, N. et al. A novel coronavirus from patients with pneumonia in China, 2019). New England Journal of Medicine (2020).
- Ву, Ф. и др. Новый коронавирус, ассоциируемый с респираторными заболеваниями людей в Китае (Wu, F. et al. A novel coronavirus associated with human respiratory disease in China). Nature, 1-8 (2020).
- Лу, Х., Страттон, С. У. и Тан, И. В. Вспышка пневмонии неизвестной этиологии в Ухане, Китай: загадка и чудо (Lu, H., Stratton, C. W. & Tang, Y. W. Outbreak of Pneumonia of Unknown Etiology in Wuhan China: the Mystery and the Miracle). Journal of Medical Virology.
- Чу, Н. и др. Исследовательская группа по новому китайскому коронавирусу. Новый коронавирус, выделенный у пациентов с пневмонией в Китае (Zhu, N. et al. China Novel Coronavirus Investigating and Research Team. A novel coronavirus from patients with pneumonia in China, 2019). N Engl J Med (2020).
- Лу, Р. и др. Геномная характеристика и эпидемиология нового коронавируса 2019: заключения по поводу происхождения вируса и связывания его с рецепторами (Lu, R. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding). The Lancet (2020).
- Ван, М. и др. Прецизионно-медицинский подход в отношении лечения коронавирусной уханьской пневмонии (Wang, M. et al. A precision medicine approach to managing Wuhan Coronavirus pneumonia). Precision Clinical Medicine (2020).
- Шехер, С. Р., Пекош, А. в сборнике «Молекулярная биология коронавируса SARS» (Schaecher, S. R. & Pekosz, A. in Molecular Biology of the SARS-Coronavirus) 153-166 (Springer, 2010).
- МакБрайд, Р. и Филдинг, Б. Ч. Роль вспомогательных белков вируса тяжелого острого респираторного синдрома (ТОРС) в патогенезе вируса (McBride, R. & Fielding, B. C. The role of severe acute respiratory syndrome (SARS)-coronavirus accessory proteins in virus pathogenesis). Viruses 4, 2902-2923 (2012).
- Ву, А. и др. Состав и дивергенция генома нового коронавируса (2019-nCoV) родом из Китая (Wu, A. et al. Genome Composition and Divergence of the Novel Coronavirus (2019-nCoV) Originating in China). Cell Host & Microbe (2020).
- Параскевис, Д. и др. Полногеномный эволюционный анализ нового коронавируса (2019-nCoV) позволяет отклонить гипотезу о его появлении в результате недавнего события рекомбинации (Paraskevis, D. et al. Full-genome evolutionary analysis of the novel corona virus (2019-nCoV) rejects the hypothesis of emergence as a result of a recent recombination event). Infection, Genetics and Evolution, 104212 (2020).
- Ли, С. и др. Регуляция отклика на стресс со стороны эндоплазматического ретикулума активностью ионных каналов, образуемых белком оболочки коронавируса, вызывающего инфекционный бронхит, модуляцией выброса вирионов, влиянием на апоптоз, репликативную способность и патогенез (Li, S. et al. Regulation of the ER Stress Response by the Ion Channel Activity of the Infectious Bronchitis Coronavirus Envelope Protein Modulates Virion Release, Apoptosis, and Pathogenesis). Frontiers in Microbiology 10, 3022 (2020).
- То, К.-К. В. и др. Постоянное выявление нового коронавируса 2019 в слюне (To, K. K.-W. et al. Consistent detection of 2019 novel coronavirus in saliva). Clinical Infectious Diseases (2020).
- Дон, Н. и др. Анализ моделей генома и белковой структуры отображает происхождение и патогенность вируса 2019-nCoV, нового коронавируса, вызвавшего вспышку пневмонии в Ухане, Китай (Dong, N. Et al Genomic and protein structure modelling analysis depicts the origin and pathogenicity of 2019-nCoV, a novel coronavirus which caused a pneumonia outbreak in Wuhan, China). F1000Research 9, 121 (2020).
- Роте, К. и др. Передача инфекции 2019-nCoV при контакте с бессимптомным носителем в Германии (Rothe, C. et al. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany). New England Journal of Medicine (2020).
- Чен, Н. и др., Эпидемиологические и клинические характеристики 99 случаев пневмонии, вызванной новым коронавирусом 2019 года в Ухане, Китай: дескриптивное исследование (Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study). The Lancet (2020).
- Дас, Р. и Шарма, П., в сборнике «Клиническая молекулярная медицина» (Das, R. & Sharma, P. in Clinical Molecular Medicine) 327-339 (Elsevier, 2020).
- Казазян-мл., Х. Х. и Вудхэд, А. П. Синтез гемоглобина А в развивающемся плоде (Kazazian Jr, H. H. & Woodhead, A. P. Hemoglobin A synthesis in the developing fetus). New England Journal of Medicine 289, 58-62 (1973).
- Лю, Дж. и др. Общие и отличающиеся аспекты патологии и патогенеза новых патогенных для человека коронавирусных инфекций SARS‐CoV, MERS‐CoV и 2019‐nCoV. (Liu, J. et al. Overlapping and discrete aspects of the pathology and pathogenesis of the emerging human pathogenic coronaviruses SARS‐CoV, MERS‐CoV, and 2019‐nCoV). Journal of Medical Virology (2020).
- Ван, М. и др. Ремдесивир и хлорохин эффективно ингибируют недавно появившийся коронавирус (2019-n-CoV) in vitro (Wang, M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro). Cell Research, 1-3 (2020).
- Бернардо-Сейсдедос, Г., Джил, Д., Блуэн, Ж-М., Ришар, Э. и Милле, О. Заболевания белкового гомеостаза (Bernardo-Seisdedos, G., Gil, D., Blouin, J.-M., Richard, E. & Millet, O. in Protein Homeostasis Diseases) 389-413 (Elsevier, 2020).
- Ламеда, И. Л. и Кох, Т. Р в сборнике «Заболевания печени» (Lameda, I. L. P. & Koch, T. R. in Liver Diseases) 107-116 (Springer, 2020).
- Бэйли, Т. Л., Джонсон, Дж., Грант, К. Э., Нобл, У. С. Программа МЕМЕ SUITE (Bailey, T. L., Johnson, J., Grant, C. E. & Noble, W. S. The MEME suite). Nucleic acids research 43, W39-W49 (2015).
- Бэйли, Т. Л. и др. ПРОГРАММА МЕМЕ SUITE: средство поиска известных мотивов и открытия новых (Bailey, T. L. et al. MEME SUITE: tools for motif discovery and searching). Nucleic acids research 37, W202-W208 (2009).
- Бэйли, Т. Л., Уильямс, Н., Мислех, С. и Ли, У. У. МЕМЕ: обнаружение и анализ мотивов с последовательностях ДНК и белков (Bailey, T. L., Williams, N., Misleh, C. & Li, W. W. MEME: discovering and analyzing DNA and protein sequence motifs). Nucleic acids research 34, W369-W373 (2006).
- Шведе, Т., Копп, Й., Гуэ, Н. и Петиш, М. SWISS-MODEL: автоматизированный сервер гомологического моделирования белков (Schwede, T., Kopp, J., Guex, N. & Peitsch, M. C. SWISS-MODEL: an automated protein homology-modeling server). Nucleic acids research 31, 3381-3385 (2003).
- Бьязини, М. и др. SWISS-MODEL: моделирование третичной и четвертичной структуры белков и использованием эволюционной информации (Biasini, M. et al. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information). Nucleic acids research 42, W252-W258 (2014).
- Studio, D. Discovery Studio. Accelrys [2.1] (2008).
Повышен билирубин: причины, последствия, лечение
Билирубин — это желчный пигмент желтого цвета. Он образуется при распаде гемоглобина отживших свой срок эритроцитов. В норме билирубин обезвреживается клетками печени и выделяется с желчью в кишечник, после чего его метаболиты выводятся с калом и — в меньшей степени — мочой. Если по каким-то причинам распадается слишком много эритроцитов, нарушается процесс биотрансформации гемоглобина в печени или возникает препятствие для нормального оттока желчи, то уровень билирубина в крови может повышаться. Такое состояние называют гипербилирубинемией. Оно может быть спровоцировано множеством факторов.
Нормы билирубина4:
Нормальные показатели общего билирубина сыворотки крови составляют 3,4–20,4 мкмоль/л, непрямого биллирубина — до 6,5 мкмоль/л1, прямого — до 5,1 мкмоль/л.
Желтуху может наблюдаться при значениях билирубина на уровне 40–70 мкмоль/л.
Классификация
В организме взрослого человека идет постоянное обновление эритроцитов. «Состарившиеся» клетки разрушаются, главным образом, в селезенке и костном мозге, а также в лимфоузлах и печени. Гемоглобин красных кровяных клеток распадается на железосодержащую часть (гем) и белковую часть (глобин). После ряда биохимических реакций от гема отщепляется железо, а оставшаяся часть превращается в билирубин, который соединяется с транспортным белком для переноски в печень.
Это так называемый свободный (непрямой, неконъюгированный) билирубин плазмы крови1. Он плохо растворяется в воде, зато хорошо в жирах и довольно токсичен. За счет жирорастворимости и малого размера молекулы при повышении концентрации свободного билирубина он может попадать в центральную нервную систему и оказывать неблагоприятное влияние на ее работу. Поэтому организм в норме транспортирует вещество в печень, где связывает его с глюкуроновой кислотой. Так образуется прямой (связанный, конъюгированный) билирубин, относительно малотоксичный1.
Затем связанный билирубин выделяется в составе желчи в желчные протоки и после в кишечник, откуда его метаболиты выводятся из организма со стулом и — в меньшей степени — мочой, претерпевая ряд трансформаций и после повторного всасывания.
Основным проявлением гипербилирубинемии является желтуха. Желтушный синдром классифицируют в зависимости от того, на каком этапе утилизации билирубина произошла «поломка» в его метаболизме:
Надпеченочная желтуха — нарушение произошло на надпеченочном уровне и связано с усиленным разрушением эритроцитов. Проявляется повышенным уровнем непрямого билирубина;
Печеночная желтуха — повреждение на уровне печени, а именно на этапах захвата, связывания или выведения билирубина в желчные протоки. При этом могут быть повышен уровень обеих его фракций;
Подпеченочная желтуха — изменения на подпеченочном уровне, обусловленное нарушением желчеотделения. Характеризуется повышением уровня прежде всего прямого билирубина.
Причины повышенного билирубина
Процесс синтеза и выведения билирубина из организма включает в себя множество этапов, нарушение на любом из них может проявиться повышением концентрации вещества в крови.
Прямой билирубин
Уровень прямого билирубина может повышаться при нарушении оттока желчи и при повреждении или гибели печеночных клеток, сопровождающихся нарушением выведения билирубина в желчные канальцы и попаданием его в общий кровоток. Это бывает при острых и хронических заболеваниях печени, таких как гепатиты различного происхождения, а также патологии желчевыводящих путей, сопровождающейся обструкцией их камнем, опухолью или паразитами. Также поражение печени, влекущее за собой повышение уровня билирубина, может развиться при некоторых инфекционных болезнях, например герпетической и цитомегаловирусной инфекции, лептоспирозе.
Непрямой билирубин
Наиболее частая причина повышения уровня непрямого билирубина — чрезмерно активное разрушение эритроцитов, превышающее способность печени утилизировать образовавшийся билирубин. В норме такое состояние бывает у новорожденных, когда так называемый фетальный гемоглобин плода заменяется на нормальный, а ферментные системы печени еще недостаточно зрелые2. Физиологическая желтуха новорожденных, как правило, нормальное состояние для детей в первые дни жизни и обычно не требует вмешательства.
В остальных случаях усиленный распад эритроцитов носит патологический характер и может быть обусловлен рядом врожденных или приобретенных причин. К примеру, гемолитическая анемия может возникать при некоторых отравлениях (солями тяжелых металлов, уксусной кислотой и др.), сепсисе, обширных ожогах, протезировании клапанов сердца, малярии, аутоиммунных реакциях при различных заболеваниях (неспецифический язвенный колит, инфекционный мононуклеоз и др.)3.
Кроме того, содержание непрямого билирубина в крови может повышаться при доброкачественных гипербилирубинемиях — наследственно обусловленных состояниях, при которых нарушена активность печеночных ферментов, превращающих свободный билирубин в связанный (например, при синдроме Жильбера).
Повышение непрямого билирубина может сопровождать также и заболевания печени, если нарушены захват и связывание непрямой его фракции.
Симптомы
Основное проявление повышенного уровня билирубина в крови — желтуха, или желтое окрашивание слизистых оболочек и кожи. При относительно невысокой гипербилирубинемии первым делом, как правило, возникает желтушность склер (белой оболочки глаза), при высоком уровне билирубина кожа приобретает характерную желтушную окраску, оттенок которой может варьироваться от желто-оранжевого до оливкового.
Остальные симптомы зависят от причины основного заболевания, вызвавшего синдром. Например, желтуха при поражении печени может быть сопряжена со слабостью, изменением режима сна и бодрствования, тяжестью в правом подреберье, тошнотой, рвотой, отвращением к пище. В тяжелых случаях, при развитии цирроза печени, к этим симптомам присоединяются и другие признаки, например покраснение ладоней, варикозное расширение вен передней брюшной стенки, отеки, асцит (скопление жидкости в брюшной полости), склонность к кровотечениям.
Проблемы с печенью
Одно из самых распространенных заболеваний печени, сопровождающихся повышением уровня билирубина в крови с развитием желтухи — вирусный гепатит4. Чаще всего это вирусный гепатит А, который передается фекально-оральным путем (с загрязненной водой или пищей) и протекает остро.
Но нередко причиной появления гипербилирубинемии становятся и гепатиты В или С. Вирусы гепатита В и С передаются с кровью и другими биологическими жидкостями, что возможно, например, при недостаточной дезинфекции медицинских инструментов, инструментов для маникюра и нанесения татуировок, а также при незащищенном половом контакте.
Другая нередкая причина повышения уровня билирубина — лекарственный гепатит, представляющий собой токсическое поражение печени, вызванное приемом тех или иных медикаментов. Лекарственные поражения печени отмечаются примерно у 10–20 человек на 100 тысяч, принимающих медикаменты5. Такие нежелательные явления могут быть связаны с приемом противоопухолевых, антиретровирусных препаратов, противосудорожных и нестероидных противовоспалительных средств (в особенности парацетамола).
Довольно часто встречается и алкогольное поражение печени, развивающееся у 60–100 % лиц, злоупотребляющих алкоголем. Если на первой фазе болезни, при алкогольном стеатозе, симптомов может и не быть, то по мере прогрессирования заболевания часто наблюдается яркая клиническая картина, сопровождающаяся повышением уровня билирубина и развитием классического поражения печени.
Лечебная тактика при повышенном уровне билирубина
Поскольку повышение уровня билирубина в плазме крови не самостоятельная болезнь, а лабораторная находка, наблюдаемая при различных патологических состояниях и заболеваниях, прежде всего необходимо обратиться к врачу и пройти комплексную диагностику для выявления причины гипербилирубинемии. Дальнейшие подходы к лечению будут зависеть от выявленной проблемы и основного заболевания. В некоторых случаях потребуется лишь симптоматическая терапия, в других будут назначены противовирусные средства, препараты, нормализующие отток желчи, и другие лекарства5, 6.
В случае если повышенный уровень билирубина наблюдается на фоне патологий печени, в терапии последних могут быть использованы и гепатопротекторы, например на основе эссенциальных фосфолипидов. Они помогают восстанавливать целостность печеночных клеток, способствуют их регенерации и могут внести дополнительный вклад в ограничение формирования соединительной ткани в печени7.
Дата публикации материала: 22 апреля 2021 года
MAT-RU-2003445-1.00-11/2020
Другие статьи
Симптомы ожирения печени бывает непросто распознать. Признаки этого состояния часто неспецифичны и могут наблюдаться и при других патологических состояниях.
Жировая дистрофия печени характеризуется избыточным накоплением жира в печеночных клетках (гепатоцитах) и является самой распространённой хронической патологией печени.
Ожирение – избыточное накопление жира в организме. Одним из органов, который прежде всего страдает от повышенной массы тела, является печень…
Неалкогольная жировая болезнь печени (НАЖБП) – болезнь печени с патологическим накоплением жировых капель в клетках печени. Что вызывает и как распознать болезнь?
Читать все статьиПройдите тест
Жировой гепатоз важно диагностировать как можно раньше, чтобы он не повлиял на работу других органов. Наш тест позволит Вам больше узнать о факторах риска этого заболевания.
- Биохимия. Учебник для ВУЗов под редакцией проф. Е.С.Северина, 2-е издание, Москва, ГЭОТАР-МЕД, 2004, 784с.
- Gundermann KJ et al. Activity of essential phospholipids (EPL) from soybean in liver diseases. Pharmacological reports, 2011 (63), 643-659
- Baldwin C, Olarewaju O. Hemolytic Anemia. [Updated 2020 Aug 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK558904/
- Чернобровкина Т.Я. и др. Некоторые аспекты дифференциальной диагностики заболеваний с желтушным синдромом в практике инфекциониста. Архивъ внутренней медицины • № 1 • 2017, с. 15—22.
- Ивашкин В.Т. и др. Лекарственные поражения печени (клинические рекомендации для врачей). Рос журн гастроэнтерол гепатол колопроктол 2019; 29(1) . С. 101—131.
- Gundermann KJ et al. Activity of essential phospholipids (EPL) from soybean in liver diseases. Pharmacological reports, 2011 (63), 643-659
- Инструкция по медицинскому применению Эссенциале® форте Н
MAT-RU-2101680-1.0-04/2021
Осложнения при коронавирусе вызывает ферритин, считает израильский ученый
Фото: АГН Москва
Учёные поняли, какой биомаркер может указать на тяжёлую форму коронавирусной болезни. Это ферритин — протеин крови, играющий важную роль в переносе железа. Об этом, как заявили в Санкт-Петербургском госуниверситете 14 апреля, рассказал профессор СПбГУ, почётный профессор Тель-Авивского университета, исследователь израильского медицинского центра Шиба Иегуда Шенфельд на онлайн-конференции.
Надо победить шторм
Ферритин хранит запасы железа в организме человека. Он очень быстро доставляет этот элемент к органу, который в нём нуждается. Как правило, это связано с регулированием кислородного обмена в клетках. Но, как оказалось, если этого белка много, он становится смертельно опасен при некоторых заболеваниях, в том числе при коронавирусе. А значит, люди, у которых уровень ферритина высок, находятся в зоне повышенного риска: скорее всего, заболевание у них будет протекать в тяжёлой форме. Особенно это касается пожилых.
«Ферритин активизирует макрофаги — клетки, которые нас защищают, охватывая бактерии и вирусы, — рассказал Иегуда Шенфельд. — Но когда они активизируются, они выделяют цитокины — в небольшом количестве они нам помогают сопротивляться инфекции, но если их много, это приводит к коллапсу».
В медицине такой коллапс получил название «цитокиновый шторм» — именно он приводит к смерти половины пациентов старшего возраста: в случае коронавируса иммунная система ошибочно атакует клетки лёгких и очень быстро их полностью разрушает. Теперь же стало понятно, что этот «шторм» поднимается именно из-за высокого содержания ферритинов.«Таким образом, у нас есть диагностический параметр, — сказал Шенфельд. — И следовательно, мы понимаем, что, чтобы снизить смертность, надо как-то бороться с высоким уровнем ферритина».
Вирус поможет себя побороть
Анализ крови на содержание ферритинов в клиниках брать умеют давно — это довольно быстрое и доступное исследование, которое может сразу показать, насколько велик для пациента риск столкнуться с серьёзными осложнениями при коронавирусе. Правда, забирать кровь в приёмном отделении больницы бесполезно: это надо делать натощак. А если больной принимает препараты, содержащие железо, то не раньше чем через три дня после их последнего приёма.
Ещё одним маркером, предполагающим высокую вероятность осложнений, по мнению Шенфельда, может стать цитокин СD-143, который тоже указывает на слишком большую активность макрофагов.
«Таким образом, наша главная задача — блокировка цитокинов», — заключил профессор.
Иегуди Шенфельд. Фото: spbu.ruСейчас во всём мире учёные ищут антитела, которые могут эффективно побороть «цитокиновый шторм», причём желательно, чтобы они били точечно по определённым цитокинам, не подавляя полностью иммунную систему. В СПбГУ сообщили, что такая работа ведётся и в университетском Центре аутоиммунных заболеваний, которым как раз руководит Иегуди Шенфельд.
«Кроме того, мы намерены создать вакцину от коронавируса, — рассказал израильский профессор. — В его основу мы намерены положить части вируса — вирусные белки, которые не встречаются в организме человека и потому не способны создать нежелательный иммунный ответ».
Зато, по мнению Шенфельда, такая вакцина сможет предотвратить развитие процессов, при которых иммунные тела атакуют здоровые клетки. С точки зрения учёного, именно этот путь максимально быстро приведёт к созданию эффективного средства от коронавируса.
Читайте также:
• ТОП-10 продуктов для очищения легких по мнению медиков • Кому нельзя делать прививку от COVID-19
Кто в зоне риска
Кратковременный подъём уровня ферритина возникает как ответ организма на инфекцию. А его постоянно высокий уровень, как правило, наблюдается:
- при гемохроматозе;
- при различных эндокринных заболеваниях, например гипертиреозе;
- при гемолитических анемиях;
- при воспалении верхних дыхательных и мочевыводящих путей;
- при острых и хронических болезнях печени;
- при некоторых онкологических заболеваниях — рак костного мозга, рак молочной железы, болезнь Ходжкина;
- при приёме железосодержащих препаратов;
- у перенесших множественные переливания крови;
- при алкоголизме.
Людям, страдающим этими заболеваниями, следует максимально оградить себя от контактов, чтобы снизить вероятность заражения коронавирусом.
Как обнаружить и лечить дефицит витамина B12 у пожилых людей
Всем известно, что витамины и питание важны для здоровья, и многие пожилые люди принимают поливитамины.
Но знаете ли вы, что даже среди пожилых людей, которые так поступают, у многих все равно развивается серьезный дефицит одного конкретного витамина?
Это витамин B12.
Если есть один витамин, о котором я бы хотел, чтобы все пожилые люди и члены семьи знали больше, это был бы витамин B12.
(Вторым в моем списке будет витамин D, но гораздо сложнее развить низкий уровень витамина D, если вы ежедневно принимаете добавки, как я объясняю в этом посте. В то время как дефицит витамина B12 действительно развивается у многих пожилых людей, которые получают их рекомендуемая суточная.)
Дефицит любого витамина может иметь катастрофические последствия для здоровья. Но дефицит витамина B12 выделяется потому, что а) он очень распространен — по оценкам экспертов, до 20% пожилых людей может иметь низкий уровень этого витамина — и б) врачи часто упускают его из виду.
Гериатры также любят обращать внимание на витамин B12, потому что его дефицит может вызвать — или, как правило, усугубить — когнитивные нарушения или проблемы с ходьбой.
Но если вы знаете симптомы и факторы риска, вы можете помочь убедиться, что у вас обнаружен дефицит витамина B12. Лечение безопасно и эффективно, если вы поймаете проблему до того, как произойдет необратимое повреждение. Вот что нужно знать.
Как дефицит витамина B12 вредит здоровьюВ организме витамин B12, также известный как кобаламин, особенно важен для образования красных кровяных телец и поддержания правильного функционирования нервных клеток.Когда уровень витамина B12 низкий, у человека могут развиться проблемы со здоровьем, связанные с нарушением работы эритроцитов и нервных клеток.
Наиболее распространенные проблемы, связанные с низким уровнем витамина B12, включают :
- Анемия. Это означает, что количество эритроцитов низкое. Красные кровяные тельца переносят кислород в кровь, поэтому анемия может вызвать усталость или одышку. Распад неисправных эритроцитов также может вызвать желтуху. (Узнайте больше об анемии здесь: Анемия у пожилых людей: 10 распространенных причин и что спросить.)
- Невропатия . Это означает, что нервы в организме не работают. Это может вызвать множество симптомов, включая покалывание, онемение, жжение, нарушение равновесия и трудности при ходьбе.
- Когнитивные нарушения . Это означает, что нервные клетки в головном мозге плохо работают. Это может вызвать проблемы с памятью, раздражительность и даже слабоумие.
Возможно, вы слышали, что дефицит витамина B12 может вызвать злокачественную анемию. Но на самом деле термин «злокачественная анемия» означает специфический дефицит витамина B12, вызванный потерей способности организма вырабатывать «внутренний фактор».«Организму необходим внутренний фактор, чтобы усваивать витамин B12; без него уровень витамина B12 в конечном итоге падает. Это часто вызывает анемию, но иногда сначала возникают симптомы нервных и мозговых заболеваний.
Почему низкий уровень витамина B12 часто встречается у пожилых людейЧтобы понять, как низкий уровень витамина B12 бывает у стареющих взрослых, хорошо бы начать с изучения того, как организм обычно получает и перерабатывает этот витамин.
В природе витамин B12 доступен человеку только в мясных и молочных продуктах.Однако в наше время вы можете легко получить его с помощью добавок или поливитаминов. Рекомендуемая суточная доза витамина B12 для взрослых составляет 2,4 мкг. Эксперты подсчитали, что западная диета содержит 5-7 микрограммов витамина B12, а поливитамины часто содержат 12-25 микрограммов.
Когда вы принимаете витамин B12, он обрабатывается кислотами и ферментами в желудке и тонком кишечнике. Затем обработанный витамин всасывается в тонком кишечнике и хранится в организме, особенно в печени.
Этот тайник действительно может удовлетворить потребности организма в течение нескольких лет; хотя витамин B12 необходим, но каждый день нужно его совсем немного. Таким образом, если здоровый человек перестает принимать витамин B12, часто проходит несколько лет, прежде чем организм исчерпает его и у него появятся симптомы.
Итак, почему дефицит витамина B12 особенно влияет на пожилых людей?
По мере того, как люди становятся старше, их способность усваивать витамин B12 снижается. Это связано с тем, что у пожилых людей часто возникают проблемы с кислотами и ферментами желудка, необходимыми для переработки витамина.
Общие факторы риска низкого уровня витамина B12 у пожилых людей включают :
- Низкий уровень кислоты в желудке. Это может быть связано с ослаблением слизистой оболочки желудка или с лекарствами, снижающими кислотность желудка.
- Лекарства, такие как метформин (применяемый при диабете), нарушающий всасывание витамина B12.
- Алкоголизм, вызывающий раздражение желудка и иногда связанный с неправильным питанием.
- Операции по удалению части (или всей) желудка или тонкой кишки.
- Любая проблема, вызывающая плохое всасывание в желудке или тонком кишечнике, например болезнь Крона.
Дефицит витамина B12 часто упускают из виду, потому что симптомы — усталость, анемия, невропатия, проблемы с памятью или трудности при ходьбе — довольно распространены у пожилых людей и могут быть легко вызваны чем-то другим.
Кроме того, дефицит витамина B12, как правило, возникает очень медленно, поэтому люди часто переживают длительный период умеренного дефицита.В это время у пожилого человека могут быть едва заметные симптомы или симптомы могут быть связаны с другим хроническим заболеванием.
Тем не менее, легкий дефицит почти всегда со временем ухудшается. И даже когда у пожилого человека есть много других причин для усталости или проблем с подвижностью, полезно устранить любые отягчающие факторы, такие как дефицит витаминов.
В отличие от многих проблем, с которыми сталкиваются пожилые люди, дефицит витамина B12 поддается лечению.Обнаружение — это ключ; затем убедитесь, что план лечения повысил уровень витамина B12 и сохранил его на стабильном уровне.
Кого следует проверять на дефицит витамина B12Пожилому человеку, вероятно, следует проверить дефицит витамина B12, если он или она испытывает какие-либо проблемы со здоровьем, которые могут быть вызваны низким уровнем этого витамина.
Я особенно рекомендую проверять уровень витамина B12, если вас беспокоит память, функция мозга, невропатия, ходьба или анемия.
Чтобы убедиться, что у вас не наблюдается легкого дефицита витамина B12, вы также можете заранее проверить его на низкий уровень, если вы или ваш старший родственник страдаете от любого из общих факторов риска, связанных с этим заболеванием.
Например, вы можете запросить проверку витамина B12, если вы вегетарианец или если у вас проблемы с желудком, поджелудочной железой или кишечником. Также разумно проверить уровень, если вы долгое время принимали лекарства, снижающие кислотность желудка.
Как диагностировать и лечить дефицит витамина B12Первым шагом в проверке дефицита является анализ крови для проверки уровня витамина B12 в сыворотке крови.
Поскольку дефицит фолиевой кислоты может вызвать аналогичный тип анемии (мегалобластная анемия, что означает низкое количество эритроцитов с чрезмерно большими клетками), врачи часто проверяют кровь на содержание фолиевой кислоты и витамина B12. Однако дефицит фолиевой кислоты встречается гораздо реже.
Вы должны знать, что вполне возможно иметь клинически низкий уровень витамина B12 без анемии.Если врач отвергает запрос на проверку витамина B12, потому что у пожилого человека был недавний нормальный анализ крови, вы можете поделиться с ним этой исследовательской статьей.
Хотя MedlinePlus говорит, что «нормальные значения составляют от 160 до 950 пикограмм на миллилитр (пг / мл)», в клинической справке UptoDate говорится, что нормальный уровень витамина B12 в сыворотке превышает пг / мл.
Если уровень витамина B12 пограничный, можно заказать подтверждающий анализ крови. Он включает в себя тестирование на метилмалоновую кислоту, которая на больше, чем нормальная , когда у людей есть дефицит витамина B12.
В моей собственной практике, особенно если у пожилого человека есть факторы риска дефицита витамина B12, я считаю уровень витамина B12 200-400 пг / мл пограничным и обычно назначаю уровень метилмалоновой кислоты в качестве последующего наблюдения.
Если анализы крови подтвердят дефицит витамина B12, врачи пропишут добавки, чтобы восстановить уровень в организме. Врач также может порекомендовать дополнительные тесты или исследование, чтобы выяснить, почему у пожилого человека выработался низкий уровень витамина B12.
Типичное начальное лечение значительного дефицита витамина B12 включает внутримышечные инъекции — 1000 мкг витамина. Это позволяет избежать любых проблем с абсорбцией в желудке или кишечнике.
Высокие дозы пероральных добавок витамина B12 (1000–2000 микрограммов в день) также повышают его уровень, поскольку высокие дозы обычно могут компенсировать плохое усвоение организмом. Однако пероральные препараты, вероятно, работают дольше, чем внутримышечные инъекции. Таким образом, они не идеальны для первоначальной коррекции дефицита, хотя иногда их используют для поддержания уровня витамина B12.
Я обнаружил, что большинство пожилых пациентов предпочитают пероральные добавки обычным инъекциям витамина B12, что понятно; выстрелы — это не весело. Однако это требует от пожилого человека постоянного приема добавок каждый день. Если вы (или ваш старший родственник) испытываете трудности с регулярным приемом лекарств, то часто лучшим вариантом будут плановые прививки с витамином B12.
И хорошее в лечении витамином B12 то, что передозировка практически невозможна. В отличие от некоторых других витаминов, витамин B12 не вызывает токсичности при высоком уровне.
Итак, если вы лечитесь от дефицита витамина B12, вам не нужно беспокоиться о том, что врачи перескочат. Вам просто нужно убедиться, что последующий тест подтвердил лучший уровень витамина B12, а затем вы можете работать с врачами, чтобы найти правильную поддерживающую дозу, чтобы предотвратить будущий дефицит витамина B12.
Есть ли другие преимущества приема добавок витамина B12?Поскольку мы знаем, что витамин B12 необходим для правильного функционирования красных кровяных телец и клеток мозга, вы можете задаться вопросом, стоит ли принимать более высокие дозы витамина B12 в рамках подхода к здоровому старению.
Это, конечно, не повредит, поскольку витамин B12 не вызывает проблем при более высоких уровнях крови, как некоторые витамины.
Но когда у пожилого человека появляется хороший уровень витамина B12 в организме, неясно, снизит ли дополнительный прием витамина B12 риск таких проблем, как рак или деменция. На сегодняшний день большая часть исследований преимуществ дополнительного витамина B12 безрезультатна.
Однако исследования однозначно подтвердили, что дефицит этого необходимого витамина вреден для организма и мозга, а более серьезный дефицит, как правило, вызывает больший вред.
Итак, чтобы помочь себе или близкому человеку максимально использовать этот витамин, сосредоточьтесь на выявлении и лечении дефицита витамина B12. Помните, что на эту распространенную проблему часто не обращают внимания.
Вы можете помочь себе, попросив врача проверить уровень витамина B12, если вы заметили какие-либо сопутствующие симптомы, или попросив проактивную проверку, если у вас есть какие-либо факторы риска.
У пожилых людей часто бывает достаточно проблем со здоровьем. Обязательно отметим те, которые легко обнаруживаются и поддаются лечению.
Были ли у вас проблемы, связанные с дефицитом витамина B12? Я был бы рад услышать от вас в комментариях ниже.
Определение анемии у пожилых людей | Гематология | JAMA
Контекст Определены ли концентрации гемоглобина как анемия по оценке Всемирной организации здравоохранения (ВОЗ) связана с о повышении смертности среди пожилых людей ничего не известно.
Цель Изучить связь между гемоглобином концентрация и смертность от конкретных причин среди пожилых людей.
Дизайн Исследование на уровне сообщества, проведенное с 1986 по 1996 год (срок наблюдения 10 лет).
Установка Лейден, Нидерланды.
Участники Всего 1016 жителей общины в возрасте 85 лет и пожилые люди соответствовали критериям отбора, и 872 человека согласились взять образец крови. Концентрация гемоглобина была измерена у 755 человек (74%).
Основные показатели результатов Концентрация гемоглобина, 10-летняя выживаемость, и основная причина смерти.Согласно критериям ВОЗ анемия была определяется как концентрация гемоглобина ниже 7,5 ммоль / л (120 г / л) в женщины и ниже 8,1 ммоль / л (130 г / л) у мужчин.
Результаты По сравнению с людьми с нормальным гемоглобином концентрации риск смерти составил 1,60 (доверительный интервал 95%). [CI], 1,24–2,06; P <0,001) у женщин с анемией и 2,29 (95% ДИ, 1,60–3,26; P <0,001) у мужчин с анемией. В обоих полов, риск смертности увеличивается с более низким гемоглобином концентрации.У лиц без клинических проявлений болезни, о которых сообщалось, при исходный уровень риска смертности от анемии составлял 2,21 (95% ДИ 1,37–3,57; P = 0,002). Смертность от злокачественных и инфекционные заболевания были выше у лиц с анемией.
Выводы Анемия, определенная критериями ВОЗ, была связана с повышенный риск смертности у лиц в возрасте 85 лет и старше. В Таким образом, критерии подходят для пожилых людей. Низкий гемоглобин концентрация в старости означает болезнь.
Анемия определяется Всемирной организацией здравоохранения (ВОЗ), 1 , но для пожилых людей критерии анемии могут быть не так широко приняты, как критерии молодые люди. Концентрация гемоглобина в среднем ниже в людей старшего возраста и поэтому может потребоваться корректировка критерии. 1 С другой стороны, снижение концентрации гемоглобина во время старения невелико и может не потребовать уникальных критерии. 2
Целью данного исследования было изучить связь между концентрация гемоглобина и смертность у пожилых людей. Мы использовали данные о смертности, чтобы определить, соответствуют ли критерии гемоглобина ВОЗ концентрация и определение анемии ВОЗ подходят для лица в возрасте 85 лет и старше. Мы предположили, что низкий гемоглобин концентрация представляет собой основное заболевание и поддерживает оценку пациенту по поводу возможных причин анемии.
Испытуемые были участниками общины Лейдена. 85-плюс Этюд. Основная цель исследования состояла в том, чтобы изучить связь между фенотипами лейкоцитарного антигена человека (HLA) и старение. 3 Лица были включены, если они были жителями Лейден, Нидерланды, и в возрасте 85 лет и старше в начале исследование (1 декабря 1986 г.). Критерии исключения отсутствовали.В Исследуемая популяция составила в общей сложности 1258 человек, из которых 73% были женщины. Комитет по медицинской этике медицинского факультета Лейденского университета. Центр одобрил исследование.
Все лица посещены по месту жительства. Запрос на участие осуществлялось по телефону, с коротким домашним визитом или через родственники, если человек проживал в доме престарелых. После словесного информированное согласие, врач опросил людей по их медицинским показаниям. истории и повседневной жизни и проверяли их познавательные способности. функция краткой экспертизы психического состояния. 4 В конце интервью было запрошено разрешение на сбор венозной крови. образец. Образцы крови были взяты во время отдельного домашнего звонка.
Образцы крови собирали в стерильные пробирки с ЭДТА (Becton Dickinson Vacutainer Systems, Meylan Cedex, Франция) и переработали в течение 3 часов в центральных лабораториях Медицинского университета Лейдена Центр. Измерения проводились с помощью автоматизированной системы (Coulter счетчик, Coulter Electronics, Хайалиа, Флорида).
Анемия определялась критериями ВОЗ. 1 Референтный интервал для концентрации гемоглобина был установлен от 7,5 до 10,0 ммоль / л (120–160 г / л) у женщин и от 8,1 до 11,2 ммоль / л (130–180 г / л). г / л) у мужчин. Референтный интервал для объема эритроцитов составлял установлено от 80 до 100 фл для обоих полов.
Все участники наблюдались на летальность до 1 октября, 1996 г., общий период наблюдения — 10 лет.Места и даты проведения смерть и номера свидетельств о смерти были получены от гражданские регистры. 5 Два человека, выехавшие за границу в течение периода исследования, не были включены в анализ.
Основные причины смерти оценивались путем увязки смерти номера свидетельств о причинах смерти, закодированные врачом Центральное статистическое бюро Нидерландов. 5 Причины смерти классифицированы в соответствии с Международной классификацией Болезни, девятая редакция 90 184. 6 С 1996 г. свидетельства о смерти кодировались в соответствии с международным стандартом . Классификация болезней, 10-я редакция. 7 Для для целей исследования они были реклассифицированы согласно девятому доработка. Коды с 390 по 459 были отнесены к категории «сердечно-сосудистые. расстройства », коды с 140 по 239 как« злокачественные новообразования »и коды с 460 по 519 как «респираторные заболевания». Выбрано инфекции дыхательных путей (коды 460-466.1, 475, 480-487,8, 510.0-510.9 и 513.0-513.1) вошли в категорию «все инфекции. «В категорию» все инфекции «также вошли туберкулез (коды 010-018.9 и 137-137.4), сепсис (коды 038-038.9), инфекции почек и мочевыводящих путей (коды 590-590.9 и 599.0). Другие инфекционные заболевания не регистрировались в наше исследование. 5
Непрерывные данные представлены в виде медианы и межквартильного размаха.В риск смертности от анемии и 95% доверительный интервал (ДИ) составлял оценивается с помощью регрессионной модели пропорциональных рисков Кокса. (Линейный сплайн-модель дала очень похожие результаты; только модель Кокса представлен здесь). Риск смертности людей с анемией был оценивается по сравнению с людьми с нормальным гемоглобином концентрация. Мы использовали 4 регрессионные модели. В модели 1 корректировка была сделано для возраста и пола. В модели 2 была сделана поправка на возраст, пол и болезни, о которых сообщалось ранее, связанные с анемией: злокачественные новообразование, инфекционное заболевание, заболевание щитовидной железы, язвенная болезнь, почечная несостоятельность и ревматоидное заболевание.В модели 3 сделана поправка на возраст, пол и функциональный статус, определяемый как любая зависимость от повседневной активности и когнитивных нарушений, измеряемых Оценка краткого экзамена на психическое состояние ниже 24 баллов. 4 дюйм модель 4, риск смертности от анемии оценивался только для лиц без клинического заболевания, о котором сообщают сами, после поправки на возраст и секс.
В дополнительном анализе концентрация гемоглобина была разделена на категории из 6.От 5 до 10,0 ммоль / л с шагом 0,5 ммоль / л. Для для каждой категории гемоглобина использовалась модель пропорциональных рисков Кокса. оценить риск смертности и 95% доверительный интервал. Риск смертности для лиц с определенной категорией гемоглобина сравнивали со всеми другие категории.
Риски смертности оценивались для 2 разных периодов: от 0 до 5 лет. после даты забора крови и от 5 до 10 лет после крови отбор проб. Время выживания рассчитывалось от даты забора крови. вперед.
Различия в возрасте проверяли с помощью теста Манна-Уитни U . Различия в пропорциях проверяли с помощью теста χ 2 или, при необходимости, точного критерия Фишера. Все анализы проводились с статистический пакет SPSS для Windows, версия 6.1 (SPSS Inc, Чикаго, штат Иллинойс).
В ходе последующего наблюдения было обнаружено, что 21 человек, изначально включенный в исследование, не соответствовали возрастным критериям, и 221 человек умер до интервью.Таким образом, 1016 человек были допущены к исследованию. Из них 57 человек (6%) отказались от интервью, 2 человека не были отслежены, и 1 человек не был опрошен по ошибке. Всего 956 человек (94%), из которых 872 человека (86% от допустимого числа) одобрили образец крови, дал согласие на интервью. Если бы только небольшое количество кровь можно было взять, сначала было проведено HLA-типирование, потому что это было основная цель исследования. Концентрация гемоглобина была оценено у 755 человек (74% от допустимого числа).
Анемия была обнаружена у 17% женщин и у 28% женщин. мужчин (Таблица 1). Для обоих полов анемия была в основном нормоциты (80% всех анемичных женщин и 92% всех анемичных люди). Средний возраст (межквартильный размах) составлял 90 лет (88-93 года). у лиц с анемией и 89 лет (88-91 лет) у лиц с нормальная концентрация гемоглобина ( P = 0,003).
Исходно анемия была связана с заболеваниями, которые, как известно, вызывают снижение концентрации гемоглобина.Злокачественные новообразования обнаружены в 19 (13%) больных анемией и 28 (5%) лиц с нормальной концентрацией гемоглобина (χ 2 1 = 11,83, P <0,001). Язвенная болезнь в анамнезе присутствовала в 3 (2%) больных анемией по сравнению ни с одним из пациентов с нормальной концентрацией гемоглобина ( P = 0,03). Любая инфекция была обнаружена у 7 (5%) лиц с анемией, и у 11 (2%) лиц с анемией нормальная концентрация гемоглобина ( P =.07). Там не было различий между людьми с анемией и людьми с нормальная концентрация гемоглобина при других заболеваниях.
На исходном уровне у 29 (21%) людей с анемией не было зарегистрировано клиническое заболевание по сравнению с 148 человек (26%) с нормальным концентрация гемоглобина (χ 2 1 = 1,65, P = 0,20).
В первые 5 лет после забора крови риск летального исхода составлял увеличивается у лиц с анемией (Таблица 2).Для женщин с анемией смертность риск в этот период составлял 1,60 (95% ДИ 1,24–2,06; P <0,001) по сравнению с женщинами с нормальной концентрацией гемоглобина. Для мужчин при анемии риск смерти составил 2,29 (95% ДИ 1,60–3,26; P <0,001) по сравнению с мужчинами с нормальным гемоглобином концентрация. Не было различий в риске смертности между лица с микроцитарной, нормоцитарной или макроцитарной анемией (таблица 2).
Риск смертности, связанный с анемией, был аналогичным после корректировка была сделана для болезней на исходном уровне, связанных с анемией, а также если была сделана поправка на функциональные нарушения (таблица 2).Если анализ был ограничен людьми, не сообщившими о себе клиническое заболевание на исходном уровне, риск смертности анемия была выше (таблица 2).
Риск смертности увеличивается при более низком гемоглобине концентрации для обоих полов. У женщин риск смертности был повышается у лиц с концентрацией гемоглобина ниже 8,0 ммоль / л и был самым высоким у лиц с концентрацией гемоглобина 6,5 ммоль / л: 2,20 (95% ДИ, 1,35–3,58; P =.002) по сравнению со всеми другими концентрациями (рис. 1). У мужчин риск смертности был повышается у лиц с концентрацией гемоглобина ниже 8,5 ммоль / л а также был самым высоким у людей с концентрацией гемоглобина 6,5 ммоль / л: 2,54 (95% ДИ, 1,33–4,87; P = 0,005) по сравнению со всеми другими концентрациями (рис. 2).
В период от 5 до 10 лет после забора крови не было различия в риске смертности (таблица 2).
Во время наблюдения 133 (86%) из 151 человека с анемией имели умерли по сравнению с 390 (65%) из 599 человек с нормальным концентрация гемоглобина.Злокачественных новообразований и инфекций было больше. часто отмечается как основная причина смерти у людей с анемией, тогда как респираторные заболевания чаще отмечались в качестве основной причины смерти у лиц с нормальной концентрацией гемоглобина. В разница в распределении основных причин смерти была статистически значимый (χ 2 4 = 9,89, P = 0,04) (Таблица 3).
Концентрация гемоглобина не измерялась у 201 человека, давшего согласие на участие в исследовании.Риск смертности от этих человек составил 1,24 (95% ДИ 1,03–1,48; P = 0,02) по сравнению с исследуемой выборкой. Никаких различий по полу не было распределение, возраст или основные причины смерти.
Риск смертности у лиц с анемией, определенный по критериям ВОЗ увеличился в 2 раза по сравнению с лицам с нормальной концентрацией гемоглобина. Риск смертности увеличивается при более низких концентрациях гемоглобина.Связь между низкая концентрация гемоглобина и повышенная смертность не могут быть объясняется исходными заболеваниями или функциональными нарушениями. Более того, низкая концентрация гемоглобина также была связана с повышенный риск смертности у пожилых людей без клинических проявлений заболевания. Хотя клиническое заболевание определялось на основании самоотчета пациента, предыдущее исследование показало, что самооценка разумно точный. 8 , 9
Несмотря на то, что они выбраны произвольно, критерии ВОЗ для анемии были подтверждены нашими данными.Анемия определяется ВОЗ как концентрация гемоглобина ниже 7,5 ммоль / л (120 г / л) у женщин и ниже 8,1 ммоль / л (130 г / л) у мужчин. 1 Эти гемоглобин концентрации основаны на данных молодых людей, но также были связаны с повышенным риском смертности у лиц в возрасте 85 лет и старше. Таким образом, критерии ВОЗ для анемии также подходят для лица в возрасте 85 лет и старше, и возрастные критерии не учитываются нужно.
Причина анемии обнаруживается у большинства пожилых людей с низким гемоглобином. концентрация. 10 , 11 В нашем исследовании анемия также связано с плохим состоянием здоровья. Как и в других исследований, 10 , 11 злокачественных новообразований и инфекций больше часто встречается у пожилых людей с анемией. Этих болезней тоже было больше. часто отмечается как основная причина смерти. Таким образом, анемия в пожилом возрасте была вероятно из-за болезни. Из-за этого повышенного риска смертности, уровень гемоглобина ниже нормы является поводом для дальнейшего исследования пожилых людей в клинической практике.
Описана также более высокая распространенность анемии у мужчин. в других исследованиях. Частота анемии колеблется от 27% до 40%. у мужчин в возрасте 85 лет и старше и от 16% до 21% у женщин в возрасте 85 лет и старше. 12 , 13 Риск смертности мужчин в нашей когорта была немного выше, чем у женщин. 3 Это предполагает что более высокая частота анемии у мужчин может быть объяснена распространенность основных заболеваний. 12
Плохое состояние здоровья также может иметь значение, если гемоглобин концентрация высокая. По сравнению с наименьшим риском смертности небольшой увеличение риска смертности наблюдалось у пожилых людей с высоким концентрация гемоглобина. Вызывается более высокая концентрация гемоглобина, например, при обезвоживании или обструктивной болезни легких. В нашем исследования респираторные заболевания чаще отмечались как первичная причина смерти у лиц с нормальной концентрацией гемоглобина, чем у лица с анемией.Эти расстройства приведут как к более высокому концентрация гемоглобина и повышение риска смертности.
Таким образом, риск смерти был повышен у пожилых людей. лица с анемией, если анемия была определена ВОЗ критерии. 1 Таким образом, критерии ВОЗ подходят для пожилых людей. Анемия у пожилых людей возникает из-за болезни, а не из-за старения. Следовательно, требуется дальнейшее клиническое исследование, если концентрация гемоглобина у человека ниже нормальных значений ВОЗ — даже если у человека нет явных клинических заболеваний.
1.Всемирная организация здравоохранения. Питательный Анемии: отчет научной группы ВОЗ. Женева, Швейцария: Всемирная организация здоровья; 1968.
2. Nilsson-Ehle H, Jagenburg R, Landahl S. и другие. Отклонить гемоглобина крови у пожилых людей: продольное исследование городского Шведское население в возрасте от 70 до 81 года. Br J Haematol. 1989; 71: 437-442. Google Scholar 3. Isaks GJ, Van Houwelingen HC, Schreuder GMT, Ligthart GJ.Связь между лейкоцитарными антигенами человека (HLA) и смертность жителей общины в возрасте 85 лет и старше. J Am Geriatr Soc. 1997; 45: 56-60.Google Scholar4.Folstein MF, Folstein SE, McHugh PR. «Мини-Ментал» Состояние »: практический метод оценки когнитивного состояния пациенты для врача. J Psychiatr Res. 1975; 12: 189-198.Google Scholar 5. Weverling-Rijnsburger AWE, Blauw GJ, Lagaay AM. и другие. Общий холестерин и риск смерти в пожилом возрасте. Ланцет. 1997; 350: 1119-1123. Google Scholar6.Международная классификация болезней, девятая Редакция (МКБ-9). Женева, Швейцария: Всемирная организация здравоохранения; 1977 г.
7.Международная статистическая классификация Болезни, 10-я редакция (МКБ-10). Женева, Швейцария: Здоровье в мире Организация; 1992.
8.Lagaay AM, Van der Meij JC, Hijmans W. сбор анамнеза в рамках опроса населения по предметам в возрасте 85 лет и старше. BMJ. 1992; 304: 1091-1092.Google Scholar9.Izaks GJ, Gussekloo J, Dermout KMT, Heeren TJ, Ligthart GJ. Трехлетнее наблюдение за результатами краткого экзамена на психическое состояние в жители общины в возрасте 85 лет и старше. Psychol Med. 1995; 25: 841-848.Google Scholar 10. Йостен Э., Пелеманс В., Хиле М. и другие. Распространенность и причины анемии у госпитализированных гериатрических больных. Геронтология. 1992; 38: 111-117.Google Scholar11.Ania BJ, Suman VJ, Fairbanks VF, Rademacher DM, Melton LJ. Заболеваемость анемией у пожилых людей: эпидемиологическое исследование в четко определенная популяция. J Am Geriatr Soc. 1997; 45: 825-831. Google Scholar, 12, Salive ME, Cornoni-Huntley J, Guralnik JM. и другие. Уровень анемии и гемоглобина у пожилых людей: взаимосвязь с возрастом, пол и состояние здоровья. J Am Geriatr Soc. 1992; 40: 489-496.Google Scholar 13. Тимирас М.Л., Браунштейн Х. Распространенность анемии и корреляция гемоглобина с возрастом в гериатрической клинике Население. J Am Geriatr Soc. 1987; 35: 639-643. Google Scholar.Есть ли у этого пожилого пациента железодефицитная анемия и какова ее первопричина?
Основой правильного ведения дефицита железа является точная проверка диагноза с последующим определением первопричины, следовательно, требуется, чтобы тесты статуса железа сочетали высокую степень чувствительности с сопоставимой степенью специфичности, поскольку «дальнейшее выявление причина истощения запасов железа неизбежно приведет к утомительным клиническим и лабораторным исследованиям ».1
Определение
Дефицит железа является результатом длительного периода отрицательного баланса железа, кульминацией которого является истощение запасов железа в организме. Однако только тогда, когда концентрация гемоглобина падает ниже нижнего предела нормального диапазона (то есть <120 г / л и <130 г / л у пожилых женщин и мужчин, соответственно) 2, пациент может быть полностью обозначен как до состояния железодефицитной анемии.
Распространенность среди пожилых людей
Документально подтвержденная распространенность дефицита железа составляет 4–7% среди североамериканских мужчин и женщин в возрасте> 70 лет, при этом соответствующая распространенность анемии, вызванной этим дефицитом крови, составляет 2% в этой возрастной группе, если использовать граничные концентрации гемоглобина 118 г / л и 124 г / л для самок и самцов соответственно.4 При обследовании населения мужчин и женщин в возрасте> 70 лет железодефицитная анемия по распространенности опережала анемию хронических заболеваний 5, но было показано обратное у пациентов в возрасте> 65 лет, встречающихся в больничной практике6.
Подтверждение дефицита железа
Хотя отсутствие окрашиваемого железа в костном мозге считается окончательным маркером дефицита железа, 6 это не может быть безошибочным критерием, учитывая несоответствие в окрашиваемом железе между срезами игольчатой биопсии и одновременно аспирированными мазками, отсюда и рекомендация не только проводить аспирацию. большое количество стромы, но также для подтверждения результатов, где это возможно, с помощью биопсии костного мозга.7
Подтверждение гипоферритинемии является альтернативной стратегией 5, пороговая концентрация, рекомендованная комитетом экспертов Всемирной организации здравоохранения, составляет 12 мкг / л, 8 совпадает с концентрацией, предложенной Lipschitz и др. на основе их анализа 250 госпитализированные пациенты с анемией и / или нарушениями метаболизма железа.9 Из-за способности ферритина сыворотки также вести себя как белок острой фазы, может возникнуть сосуществование дефицита железа и различных воспалительных заболеваний (включая хроническое заболевание почек и заболевание печени, соответственно). быть ассоциированным с нормальными концентрациями ферритина в сыворотке 10, что требует использования других диагностических параметров (кроме аспирации костного мозга и / или биопсии) для подтверждения этого дефицита крови.Одним из таких параметров является отношение правдоподобия, полученное на основе истинно положительных результатов по сравнению с ложноположительными показателями дефицита железа на заданном уровне для ферритина в сыворотке, при этом одним из результатов является> 95% вероятность дефицита железа у пожилых пациентов с ферритином в сыворотке <18 мкг / 1.11 В более поздних разработках используется оценка концентраций сывороточного рецептора трансферрина (TfR), которые увеличиваются прямо пропорционально количеству TfR, экспрессируемого на предшественниках эритроидов, чтобы последние могли более успешно конкурировать за снижение концентраций железа в тканях во время эволюция железодефицитного состояния.В сочетании с логарифмическим преобразованием уровня ферритина в сыворотке (log ферритина), чтобы получить параметр, обозначенный как TfR / log ферритин (индекс TfR-F), может быть достигнуто надежное разделение между субъектами, характеризующимися сосуществованием дефицита железа и анемии. хронических расстройств по сравнению с пациентами с единственным диагнозом анемия хронических расстройств1. Наиболее убедительным косвенным доказательством железодефицитной анемии является повышение уровня гемоглобина на> 20 г / л после трех недель заместительной терапии железом.12 Документирование клинических стигматов дефицита железа также весьма наводит на размышления, с должным учетом того факта, что койлонихия также может возникать после воздействия едких агентов, в то время как атрофический глоссит и ангулярный стоматит также могут проявляться при мегалобластном дефиците и дефиците рибофлавина, соответственно.
Вставка 1: Дифференциальная диагностика микроцитарной гипохромной анемии
Гематологические проявления
Хотя дефицит железа обычно характеризуется средним корпускулярным объемом (MCV) и средней концентрацией корпускулярного гемоглобина (MCH) <80 мкг и <26 пг соответственно 13, остается спорным вопрос, какой из двух параметров имеет более высокую прогностическую ценность. .7 Сопоставимые изменения MCV и MCH возникают при анемии, связанной с сепсисом, хроническим воспалением, злокачественными новообразованиями, хроническим заболеванием почек, 10 14 15 и даже при циррозе печени 16, а также при талассемии и сидеробластной анемии соответственно (вставка 1) 7. 17 Тромбоцитоз - еще одно гематологическое проявление дефицита железа, задокументированное даже при отсутствии острого кровотечения, 18 и тот факт, что он также может возникать у субъектов с высоким содержанием железа с анемией хронических заболеваний19, добавляет диагностической путаницы между этими двумя расстройствами.В последнем контексте сосуществование тромбоцитоза и нарушения гемоглобинизации эритроцитов объясняется ролью цитокинов в тромбопоэзе и мобилизации железа из ретикулоэндотелиальных макрофагов.
Основные причины дефицита железа
Расследование железодефицитной анемии проиллюстрировано исследованием, показывающим, что в одном медицинском районе исследования желудочно-кишечного тракта для выявления основной причины этого дефицита крови были выполнены только у 63% из 109 пациентов с дефицитом железа в возрасте> 50,21, независимо от возраста. связанные с распространением желудочно-кишечных причин этого расстройства.Интуитивное ожидание того, что основная причина будет выявлена путем систематического анализа симптомов и признаков17, должно быть умерено признанием того факта, что даже при отсутствии симптомов до 44% взрослых с железодефицитной анемией будут иметь поражения желудочно-кишечного тракта, способные вызвать вызывает хроническую кровопотерю22. При наличии симптомов положительная прогностическая ценность поражения верхних отделов желудочно-кишечного тракта (диапазон 18–86%, медиана 60%) может быть почти в два раза выше, чем при патологии нижних отделов желудочно-кишечного тракта (диапазон 28). % –52%, медиана 35%).23-28 Это может быть отражением того факта, что анализ 1207 пациентов, собранных из 10 исследований, в каждом из которых участвовало> 70 пациентов с целью выявления основных причин железодефицитной анемии и / или скрытого желудочно-кишечного кровотечения, дал соотношение 491 v 283 для пациентов с поражением верхних отделов желудочно-кишечного тракта v , причем оба участка одновременно вовлечены примерно в 104 случаях. 23-32 В другом анализе участвовал 721 субъект с дефицитом железа в возрасте> 50 лет, собранный из семи исследований, верхние отделы желудочно-кишечного тракта. поражения регистрировались в два раза чаще, чем поражения нижних отделов желудочно-кишечного тракта.33 Однако ввиду более высокой распространенности злокачественных новообразований в поражениях нижнего, а не верхних отделов желудочно-кишечного тракта, железодефицитным пациентам в возрасте> 50, в том числе с доброкачественными поражениями верхних отделов желудочно-кишечного тракта, почти всегда следует предлагать колоноскопию, потому что именно в этой возрастной группе злокачественные колоректальная патология может сосуществовать с доброкачественными поражениями верхних отделов желудочно-кишечного тракта. 33 Когда эта стратегия была проверена в проспективном исследовании 89 пациентов в возрасте 65 лет, у 26 пациентов были обнаружены поражения как верхних, так и нижних отделов желудочно-кишечного тракта.Исследователи были настолько тщательными, что 14 их испытуемых также были подвергнуты исследованиям тонкой кишечной клизмы с барием.31 Принцип, согласно которому выявление патологии тонкой кишки должно быть частью общей стратегии исследования железодефицитной анемии, является одним из основных. Все чаще признаются энтероскопия 34, клизма тонкой кишки (энтероклиз) 35 и компьютерный томографический энтероклиз36, которые являются лишь тремя из расширяющегося списка методов, направленных на то, чтобы убедиться в том, что ошибка игнорирования наличия опухолей тонкой кишки (рис. 1) должна иметь место. с убывающей частотой.Также необходимо поддерживать индекс подозрительности в отношении кровопотери, происходящей из не желудочно-кишечных участков, таких как мочевыводящие пути (рис. 2) и матка.
фигура 1Гистологическое изображение веретенообразных клеток (отмечено стрелкой) злокачественной стромальной опухоли тонкой кишки (гематоксилин и эозин × 200), диагностированных только при вскрытии трупа у 88-летней женщины с трехлетней историей железодефицитной анемии, требующей частых переливаний крови при Заместительная терапия железом оказалась недостаточной для поддержания нормальной концентрации гемоглобина.
фигура 2Ультрасонографическое изображение опухоли мочевого пузыря (отмечено стрелкой) у 73-летнего мужчины с железодефицитной анемией и гематурией.
Одним из наиболее важных достижений последнего времени является признание степени этиопатогенетической роли целиакии в железодефицитной анемии, включая документальное подтверждение того факта, что с распространенностью 39% этот гематический дефицит является единственным наиболее частым заболеванием. внекишечное проявление этого расстройства, 37 и что пациенты в возрасте старше 60 лет составляют до 19% взрослого населения с глютеновой болезнью.38
Диетический дефицит, если его специально искать, может быть единственной причиной железодефицитной анемии всего лишь у 5% пожилых пациентов, соблюдающих западную диету.24 Не менее важно признание того, что гипохлоргидрия (обычно связанная с аутоиммунным гастритом) может ухудшать биодоступность пищевого железа с последующей железодефицитной анемией, как у 22 пациентов с гистаминовой быстрой ахлогидрией и антителами к париетальным клеткам, при сосуществовании мальабсорбции витамина B 12 в подгруппе из семи пациентов.39 Не менее важно осознавать тот факт, что при сосуществовании двух гематологических недостаточностей гипохромный гематологический профиль микроцитов может полностью скрыть наличие дефицита витамина B 12 40, причем единственным случайным признаком является интеркуррентная тромбоцитопения. Однако сама тромбоцитопения может быть редким проявлением железодефицитной анемии.41 Дивертикулярная болезнь толстой кишки не является признанной причиной дефицита железа, 29 32, и он может ввести в заблуждение с диагностической точки зрения, когда при бариевой клизме создается впечатление, что это единственный диагноз, а сопутствующая карцинома толстой кишки обнаруживается только при последующей колоноскопии.42 Даже после интенсивного обследования у 40% пациентов в возрасте старше 50 лет может не быть выявленной первопричины дефицита железа. 33 Последующее наблюдение, продолжавшееся в среднем 39 месяцев у 69 таких пациентов, не выявило каких-либо злокачественных образований при контрольной колоноскопии, а также анемии. сам по себе разрешился в 71% .43 У одного пациента, у которого впоследствии была обнаружена ангиодисплазия двенадцатиперстной кишки, был достаточно серьезный дефицит железа, чтобы потребовалось периодическое переливание крови, а у большинства остальных, по-видимому, была сопутствующая анемия хронических заболеваний.
Последний вопрос — это чувствительность и локальная специфичность тестов на скрытую фекальную кровь при подозрении на хроническую желудочно-кишечную кровопотерю. Чувствительность снизилась до 50–55%, 25 26 с положительными прогностическими значениями 17–43% и 16–26% для поражений верхних и нижних отделов желудочно-кишечного тракта соответственно.25 27 32 44 Положительные тесты плохо различают поражения верхних и нижних отделов желудочно-кишечного тракта, как показали два исследования с участием 119 и 134 пациентов, соответственно, 17–59,6% из которых имеют поражения верхних отделов желудочно-кишечного тракта, а колоректальная патология характерна в 16–45%.У 5-10% были поражения на обоих участках.32 45 Даже при полностью отрицательном результате колоноскопического исследования до 37% пациентов с положительным результатом на фекалии на скрытую кровь имеют источники хронической кровопотери в верхних отделах желудочно-кишечного тракта.44 В конечном счете, успех в прогнозировании локализации хронической желудочно-кишечной крови очень ограничен. потери из-за использования стандартизированных анкет и / или анализов на скрытую кровь в фекалиях, как показало проспективное исследование 80 пациентов с дефицитом железа в возрасте 70 лет (диапазон 37-91), у которых значительные поражения произошли либо в верхних, либо в нижних отделах желудочно-кишечного тракта. тракта, независимо от наличия или отсутствия симптомов или статуса скрытой крови в фекалиях.46 Даже при целиакии до 47% взрослых могут иметь положительные анализы на скрытую кровь в фекалиях.
Вопросы
- (1)
- Можно ли диагностировать железодефицитную анемию при нормальной концентрации ферритина в сыворотке?
- (2)
- Какова физиологическая основа для оценки уровней рецепторов трансферрина в сыворотке при дефиците железа и как этот параметр может повысить полезность ферритина в сыворотке у пациентов с микроцитарной гипохромной анемией?
- (3)
- Насколько надежны желудочно-кишечные симптомы при прогнозировании места кровопотери со стороны желудочно-кишечного тракта?
- (4)
- Насколько надежны анализы кала на скрытую кровь для различения кровотечений из верхних и нижних отделов желудочно-кишечного тракта?
- (5)
- Что является основанием для проведения колоноскопии у большинства железодефицитных пациентов в возрасте> 50 лет, несмотря на выявление доброкачественных причин кровотечения из верхних отделов желудочно-кишечного тракта?
- (6)
- Какие три наиболее ярких особенности целиакии вы обнаружили в этой презентации?
ответов
- (1)
- Да.Когда дефицит железа сосуществует с анемией при хронических заболеваниях, поведение сывороточного ферритина как реагента острой фазы противодействует ожидаемому падению сывороточного ферритина, что приводит к «ложной нормализации» этого параметра.
- (2)
- Во время развития состояния дефицита железа циркулирующие уровни рецептора трансферрина (TfR) и количества этого вещества, экспрессируемого на поверхности предшественников эритроидов, повышаются в ответ на снижение уровня железа в тканях.Отношение TfR / log ферритина, по-видимому, обеспечивает четкое разделение между сопутствующим дефицитом железа и анемией хронических заболеваний по сравнению с анемией хронических заболеваний в качестве единственного диагноза.
- (3)
- Симптоматология имеет низкую локальную специфичность.
- (4)
- Анализы фекалий на скрытую кровь также имеют низкую локальную специфичность.
- (5)
- Хотя поражения верхних отделов желудочно-кишечного тракта являются наиболее часто встречающимися при дефиците железа и также более вероятны доброкачественными, чем злокачественными, поражения толстой кишки, хотя и менее частые, с большей вероятностью могут быть злокачественными и могут сосуществовать. при доброкачественных поражениях верхних отделов ЖКТ.
- (6)
- Железодефицитная анемия является наиболее частым внекишечным проявлением целиакии; пациенты в возрасте старше 60 лет составляют до 19% взрослого населения с целиакией; положительные тесты на скрытую кровь в фекалиях могут встречаться у 47% взрослых с глютеновой болезнью.
Благодарности
Выражаю благодарность доктору Г. Р. Диксону MRCPath, патологоанатому-консультанту в больнице общего профиля Tameside за отчет о вскрытии и последующую микрофотографию, относящуюся к рисунку 1.Я признателен г-же А. Рассел за подготовку этой рукописи.
Анемия старости | SpringerLink
Льюис Р. Анемия — частое, но не нормальное явление, сопровождающее старение. Гериатрия 1976; 31: 53–60.
CAS PubMed Google Scholar
Beutlere E, Waalen J. Определение анемии: каков нижний предел нормальной концентрации гемоглобина в крови? Кровь 2006; 107: 1747–1750.
Артикул CAS Google Scholar
Гаскелл Х, Дерери С., Эндрю Мур Р., МакКуэй Х.Дж. Распространенность анемии у пожилых людей: систематический обзор. БМК Гериатр 2008; 8: 1.
Артикул PubMed PubMed Central Google Scholar
Халави Р., Мухаддер Х., Тахер А. Анемия у пожилых людей: следствие старения? Эксперт Рев Гематол 2017; 10: 327–335.
Артикул CAS PubMed Google Scholar
Hamer M, Molloy GJ. Поперечные и продольные ассоциации между анемией и депрессивными симптомами в английском продольном исследовании старения. J Am Geriatr Soc 28 апреля 2009 г .; 57 (5). https://doi.org/10.1111/j.1532-5415.2009.02250.x (свободный доступ)
Google Scholar
Morley JE. Анемия в домах престарелых: проблема сложная. J Am Med Dir Assoc 2012; 13: 191–194.
Артикул PubMed Google Scholar
Палмер К., Ветрано Д.Л., Маренгони А. и др. Связь между анемией и дряхлостью: систематический обзор и метаанализ обсервационных исследований. J Nutr Health, старение, 2018; 22: 965–974.
Артикул CAS PubMed Google Scholar
Палмер К., Ветрано Д.Л., Маренгони А. и др. Связь между анемией и дряхлостью: систематический обзор и метаанализ обсервационных исследований. J Nutr Health Aging 2018; 22: 965–974.
Артикул CAS PubMed Google Scholar
Пирес Корона Л., Драмонд Андраде ФК, де Оливейра Дуарте Ю.А., Лебрао М.Л. Связь между анемией, концентрацией гемоглобина и слабостью у пожилых людей Бразилии. J Nutr Health Aging 2015; 19: 935–940.
Артикул CAS PubMed Google Scholar
Morley JE. Экспресс-гериатрическая оценка: вторичная профилактика для прекращения возрастной инвалидности.Clin Geriatr Med 2017; 33: 431–440.
Артикул PubMed Google Scholar
Joosten E, Detroyer E, Milisen K. Влияние анемии на силу захвата рук, скорость ходьбы, функциональность и смертность в течение 1 года у госпитализированных пациентов старшего возраста. BMC Geriatr 2016; 16: 153. Doi: https://doi.org/10.1186/s12877-016-0326-y.
Артикул PubMed PubMed Central Google Scholar
Bosco Rde M, Assis EP, Pinheiro RR и др. Анемия и функциональные возможности у госпитализированных пожилых бразильских пациентов. Cad Saude Publica 2013; 29: 1322–1332.
Артикул PubMed Google Scholar
Hopstock LA, Utne EB, Horsch A, Skjelbakken T. Связь между анемией и падениями у женщин и мужчин в возрасте 65 лет и старше, проживающих в сообществе, из пятого исследования Тромсё 2001-02: повторное исследование. БМК Гериатр 2017; 17: 292.d doi: https://doi.org/10.1186/s12877-017-0689-8.
Артикул PubMed PubMed Central Google Scholar
Morley JE. Хрупкость, падения и переломы. J Am Med Dir Assoc, 2013; 14: 149–151.
Артикул PubMed Google Scholar
Явуз ББ, Джанкуртаран М, Хазнедароглу И. Дефицит железа может вызвать когнитивные нарушения у гериатрических пациентов.J Nutr Health Aging 2012; 16: 220–224.
Артикул CAS PubMed Google Scholar
Фаулер А.Дж., Ахмад Т., Фулл М.К. и др. Мета-анализ связи между предоперационной анемией и летальностью после операции. Br J Surg 2015; 102: 1314–1324.
Артикул CAS PubMed Google Scholar
Malaguarnera MI, Di Fazio I, Vinci E, Bentivegna P, Mangione G, Romano M.Гематологическая картина у здоровых пожилых людей. Panminerva Med. 1999 Сен; 41 (3): 227–31.
CAS PubMed Google Scholar
Fairweather-Tait SJ, Wawer AA, Gillings R, Jennings A, Myint PK. Состояние железа у пожилых людей. Mech Aging Dev 2014; 171: 136–137.
Google Scholar
Вавер А.А., Дженнингс А., Фэйрвезер-Тейт С.Дж. Статус железа у пожилых людей: обзор последних данных.Mech Aging Dev 2018; 175: 55–73.
Артикул CAS PubMed Google Scholar
Шин Д.Х., Ким Х.С., Парк М.Дж. и др. Использование растворимого рецептора трансферрина (sTfR) и индекса ферритина sTfR / log в диагностике железодефицитной анемии. Энн Клин Лаборатория Sci 2015; 45 (4): 396–402.
CAS PubMed Google Scholar
Хармс К., Кайзер Т. За пределами растворимого рецептора трансферрина: старые проблемы и новые горизонты.Лучшая практика Res Clin Endocrinol Metab 2015; 29: 799–810.
Артикул CAS PubMed Google Scholar
Bozentowicz-Wikarek M, Kocelak P, Owczarek A, et al. Концентрация фактора роста 23 фибробластов в плазме и статус железа. Существуют ли отношения в пожилом населении? Clin Biochem 2015; 48: 431–436.
Артикул CAS PubMed Google Scholar
Рот М.П., Мейнард Д., Коппин Х. Регуляторы экспрессии гепсидина. Витамины и гормоны 2019; 110: 101–111.
Артикул PubMed Google Scholar
Karlsson T. Оценка конкурентного анализа гепсидина ALISA в дифференциальной диагностике железодефицитной анемии с сопутствующим воспалением и анемией воспаления у пожилых пациентов. Карлссон Дж. Воспаление 2017; 14:21. Doi: https: //doi.org/10.1187/s12950-017-0166-3.
Артикул CAS Google Scholar
Sun CC, Vaja V, Babitt JL, Lin HY. Ориентация на ось гепсидин-ферропортин для разработки новых стратегий лечения анемии хронического заболевания и анемии воспаления. Am J Hematol 2012; 87: 392–400.
Артикул CAS PubMed PubMed Central Google Scholar
Mahlknecht U, Kaiser S. Exp Ther Med.Возрастные изменения показателей периферической крови у человека. 2010 ноя; 1 (6): 1019–1025.
Артикул PubMed PubMed Central Google Scholar
Morley JE, Baumgartner RN. Процесс старения, связанный с цитокинами. Дж. Геронтол Биол Науки Мед Науки 2004; 59: M924 – M929.
Артикул PubMed Google Scholar
Przybyszewska J, Zekanowska E, Kedziora-Kornatowska K, et al.Параметры метаболизма прогепсидина и железа у пациентов пожилого возраста с ожирением и анемией. J Nutr Health Aging 2011; 15: 259–264.
Артикул CAS PubMed Google Scholar
Stauder R, Valent P, Theurl I. Анемия в пожилом возрасте: этиология, клинические последствия и лечение. Кровь 2018; 131: 505–514.
Артикул CAS PubMed Google Scholar
Ланг Э., Ланг Ф. Триггеры, ингибиторы, механизмы и значение эриптоза: самоубийственная смерть эритроцитов. Биомед Рес Инт 2015; 2015: 513518. Doi: https://doi.org/10.1155/2015/513518. Epub 2015, 4 марта.
Статья CAS PubMed PubMed Central Google Scholar
Frangos E, Trombetti A, Graf CE, et al. Недоедание у очень старых госпитализированных пациентов: новый этиологический фактор анемии? J Nutr Health Aging 2016; 20: 705–713.
Артикул CAS PubMed Google Scholar
Morley JE. От редакции: Определение недоедания (недоедания) у пожилых людей. J Nutr Health Aging 2018; 22: 308–310.
Артикул CAS PubMed Google Scholar
Бассил Н., Морли Дж. Э. Гипогонадизм с поздним началом: обзор. Clin Geriatr Med 2010; 26: 197–222.
Артикул PubMed Google Scholar
Дхиндса С., Ганим Х., Батра М. и др. Влияние тестостерона на гепсидин, ферропортин, ферритин и способность связывать железо у пациентов с гипогонадотропным гипогонадизмом и диабетом 2 типа. Клин Эндокринол (Oxf). 2016; 85: 772–780.
Артикул CAS PubMed PubMed Central Google Scholar
Гуо В., Бахман Э., Ли М. и др. Введение тестостерона подавляет транскрипцию гепсидина и связано с повышенным включением железа в эритроциты.Старение клетки. 2013; 12: 280–291.
Артикул CAS PubMed PubMed Central Google Scholar
Анемия — причины | Американское гериатрическое общество
В Соединенных Штатах около одной трети всех анемий среди пожилых людей вызваны дефицитом железа, витамина B12 и / или фолиевой кислоты (фолиевой кислоты) с пищей. Около половины всех анемий среди пожилых людей вызваны хроническими заболеваниями, а примерно пятая часть всех анемий остается необъяснимой даже после тщательного обследования.
Ниже описаны три основные причины возникновения анемии. У пожилых людей анемия часто является результатом одновременного возникновения нескольких заболеваний. Эти условия могут включать:
- Снижение производства красных кровяных телец, вызванное:
- Проблемы с функцией костного мозга
- Хронические заболевания или воспаления, например рак или инфекции
- Гормональные проблемы
- Болезнь почек
- Недоедание и дефицит железа, витамина B12 или фолиевой кислоты (фолиевой кислоты) в пище
- Наследственные болезни
- Лекарства
- Алкогольная зависимость
- Потеря крови от:
- Раздражение желудка от лекарств, алкоголя или язвы
- полипы или опухоли в кишечнике
- Камни или опухоли в почках
- рак
- хирургия
- Повышенное разрушение эритроцитов, вызванное:
- Лекарства
- Наследственное заболевание
- Болезнь вашей иммунной системы
- Проблемы с сердечным клапаном (которые повреждают ваши эритроциты)
- Опухоль
- Инфекции
Вот наиболее частые причины анемии у пожилых людей.
Железодефицитная анемия
Распространенной причиной железодефицитной анемии является хроническая кровопотеря, обычно из желудочно-кишечного тракта. Этот вид «тихого» внутреннего кровотечения может быть вызван кровоточащими язвами или полипами, раком или хроническим раздражением слизистой оболочки желудочно-кишечного тракта. Часто эта кровопотеря невидима невооруженным глазом, и ваш лечащий врач может провести простой тест, называемый анализом кала на скрытую кровь, чтобы ее обнаружить.
Анемия при хронических заболеваниях
Анемия хронического заболевания может быть результатом хронического воспаления, вызванного текущими инфекциями, повреждением тканей, различными формами артрита, доброкачественными или злокачественными опухолями или различными хроническими заболеваниями.Эти состояния вызывают воспаление внутри вашего тела и мешают костному мозгу работать должным образом.
Анемия, вызванная дефицитом B12 и фолиевой кислоты
Витамин B12 и фолиевая кислота (фолиевая кислота) — два витамина, важные для производства красных кровяных телец. Дефицит витамина B12 чаще встречается с возрастом, особенно у женщин старше 60 лет и взрослых с аутоиммунным заболеванием щитовидной железы. Признаки и симптомы включают:
- Общая слабость тела
- Бледная кожа
- Изменения нервной системы (некоторые признаки включают неуклюжую походку или онемение и покалывание в руках и ногах)
- Поведенческие изменения или спутанность сознания
Дефицит фолиевой кислоты может быть результатом плохого питания, приема некоторых лекарств или заболеваний, влияющих на всасывание из кишечника.
Гемолитическая анемия
Анемия, вызванная разрушением эритроцитов, называется гемолитической анемией. Часто виноваты проблемы с вашей иммунной системой. Раковые заболевания, такие как неходжкинская лимфома или хронический лимфолейкоз, также разрушают эритроциты. Гемолитическая анемия также может быть вызвана лекарствами или инфекциями или заболеванием иммунной системы, таким как ревматоидный артрит или волчанка.
Последнее обновление: июль 2020 г.
Анемия — Hematology.org
Анемия является наиболее распространенным заболеванием крови, и, по данным Национального института сердца, легких и крови, от нее страдают более 3 миллионов американцев.
Роль красных кровяных телец в анемии
Красные кровяные тельца несут гемоглобин, богатый железом белок, который присоединяется к кислороду в легких и переносит его в ткани по всему телу. Анемия возникает, когда у вас недостаточно эритроцитов или когда ваши эритроциты не функционируют должным образом. Диагноз ставится, когда анализ крови показывает уровень гемоглобина менее 13,5 г / дл у мужчин или менее 12,0 г / дл у женщин. Нормальные значения для детей меняются с возрастом.
Когда у вас анемия, вашему организму не хватает кислорода, поэтому вы можете испытать один или несколько из следующих симптомов:
- Слабость
- Одышка
- Головокружение
- Быстрое или нерегулярное сердцебиение
- Стук в ушах
- Головная боль
- Холодные руки или ноги
- Бледная или желтая кожа
- Боль в груди
Могу ли я заболеть анемией?
Многие люди подвержены риску анемии из-за неправильного питания, кишечных расстройств, хронических заболеваний, инфекций и других состояний.Наибольшему риску этого заболевания подвержены женщины во время менструации, беременные и люди с хроническими заболеваниями. Риск анемии увеличивается с возрастом.
Если у вас есть одно из следующих хронических состояний, у вас может быть повышенный риск развития анемии:
- Ревматоидный артрит или другое аутоиммунное заболевание
- Болезнь почек
- Рак
- Болезнь печени
- Заболевание щитовидной железы
- Воспалительное заболевание кишечника (болезнь Крона или язвенный колит)
Признаки и симптомы анемии легко не заметить.Фактически, многие люди даже не осознают, что у них анемия, до тех пор, пока она не будет выявлена в анализе крови.
Распространенные типы анемии
Железодефицитная анемия — наиболее распространенный тип анемии. Это случается, когда в организме не хватает железа. Дефицит железа обычно возникает из-за кровопотери, но иногда может быть из-за плохого усвоения железа. Беременность и роды потребляют много железа и, таким образом, могут привести к анемии, связанной с беременностью. Люди, перенесшие операцию обходного желудочного анастомоза для похудания или по другим причинам, также могут иметь дефицит железа из-за плохой абсорбции.
Витаминно-дефицитная анемия может быть результатом низкого уровня витамина B12 или фолиевой кислоты (фолиевой кислоты), обычно из-за плохого питания. Пагубная анемия — это состояние, при котором витамин B12 не всасывается в желудочно-кишечном тракте.
Анемия и беременность y — Узнайте о факторах риска и симптомах анемии во время беременности.
Апластическая анемия — редкое заболевание, связанное с недостаточностью костного мозга, при котором костный мозг перестает вырабатывать достаточное количество кровяных телец (эритроцитов, лейкоцитов и тромбоцитов).Это происходит в результате разрушения или дефицита кроветворных стволовых клеток в костном мозге, в частности, когда собственная иммунная система организма атакует стволовые клетки. Однако те немногие клетки крови, которые производит костный мозг, являются нормальными. Вирусные инфекции, ионизирующее излучение и воздействие токсичных химикатов или лекарств также могут привести к апластической анемии.
Гемолитическая анемия возникает, когда красные кровяные тельца разрушаются в кровотоке или в селезенке. Гемолитическая анемия может быть вызвана механическими причинами (негерметичные сердечные клапаны или аневризмы), инфекциями, аутоиммунными нарушениями или врожденными аномалиями красных кровяных телец.Унаследованные аномалии могут влиять на гемоглобин или структуру или функцию эритроцитов. Примеры наследственной гемолитической анемии включают некоторые типы талассемии и низкие уровни ферментов, такие как дефицит глюкозо-6-фосфатдегидрогеназы. Лечение будет зависеть от причины.
Серповидно-клеточная анемия — это наследственная гемолитическая анемия, при которой белок гемоглобина является ненормальным, в результате чего красные кровяные тельца становятся жесткими и закупоривают кровообращение, поскольку они не могут проходить через мелкие кровеносные сосуды.
Анемия, вызванная другими заболеваниями — Некоторые заболевания могут влиять на способность организма вырабатывать красные кровяные тельца. Например, у некоторых пациентов с заболеванием почек развивается анемия из-за того, что почки не вырабатывают достаточно гормона эритропоэтина, чтобы подать сигнал костному мозгу о создании новых или большего количества красных кровяных телец. Химиотерапия, используемая для лечения различных видов рака, часто снижает способность организма вырабатывать новые эритроциты, и в результате этого лечения часто возникает анемия.
Как лечится анемия?
Лечение анемии зависит от ее причины.
Железодефицитная анемия почти всегда возникает в результате кровопотери. Если у вас железодефицитная анемия, ваш врач может назначить анализы, чтобы определить, теряете ли вы кровь из желудка или кишечника. Другие пищевые анемии, такие как дефицит фолиевой кислоты или B-12, могут быть результатом неправильного питания или неспособности усваивать витамины в желудочно-кишечном тракте. Лечение варьируется от изменения диеты до приема пищевых добавок.
Если ваша анемия возникла в результате хронического заболевания, лечение основного заболевания часто улучшает течение анемии.В некоторых случаях, например, при хроническом заболевании почек, врач может назначить лекарство, например, инъекции эритропоэтина, для стимуляции выработки костным мозгом большего количества красных кровяных телец.
Апластическая анемия возникает, если костный мозг перестает вырабатывать эритроциты. Апластическая анемия может быть следствием первичной недостаточности костного мозга, миелодисплазии (состояние, при котором костный мозг вырабатывает аномальные эритроциты, которые не созревают должным образом) или иногда как побочный эффект некоторых лекарств.Если у вас есть форма апластической анемии, ваш врач может направить вас к гематологу на биопсию костного мозга, чтобы определить причину анемии. Для лечения апластической анемии могут использоваться лекарства и переливание крови.
Гемолитическая анемия возникает, когда красные кровяные тельца разрушаются в кровотоке. Это может быть связано с механическими факторами (негерметичный клапан сердца или аневризма), инфекцией или аутоиммунным заболеванием. Причину часто можно определить с помощью специальных анализов крови и изучения эритроцитов под микроскопом.Лечение будет зависеть от причины и может включать направление к кардиологу или сосудистому специалисту, применение антибиотиков или лекарств, подавляющих иммунную систему.
Поговорите со своим врачом, если вы считаете, что у вас есть риск анемии. Ваш врач определит ваш лучший курс лечения и, в зависимости от вашего состояния, может направить вас к гематологу, врачу, который специализируется на заболеваниях крови.
Можно ли предотвратить анемию?
Хотя многие виды анемии невозможно предотвратить, употребление здоровой пищи может помочь вам избежать как железодефицитной, так и витаминной анемии.Продукты, которые следует включать в свой рацион, включают продукты с высоким уровнем железа (говядину, темно-зеленые листовые овощи, сушеные фрукты и орехи), витамин B-12 (мясо и молочные продукты) и фолиевую кислоту (соки цитрусовых, темно-зеленые листовые овощи, бобовые и обогащенные злаки). Ежедневный прием поливитаминов также поможет предотвратить алиментарную анемию; однако пожилым людям не следует принимать добавки железа при железодефицитной анемии без указания врача.
Наследственный сфероцитоз: путешествие пациента
Где я могу найти дополнительную информацию?
Если вы обнаружите, что хотите узнать больше о болезнях и расстройствах крови, вот еще несколько ресурсов, которые могут вам помочь:
Результаты клинических исследований, опубликованные в
КровьНайдите Blood , официальный журнал ASH, чтобы найти результаты последних исследований крови.В то время как для недавних статей обычно требуется вход в систему подписчика, пациенты, заинтересованные в просмотре статьи с контролируемым доступом в Blood , могут получить копию, отправив запрос по электронной почте в издательство Blood Publishing Office.
Группы пациентов
Список веб-ссылок на группы пациентов и другие организации, предоставляющие информацию.
Обзор анемии — заболевания крови
Симптомы различаются в зависимости от тяжести анемии и скорости ее развития.У некоторых людей с легкой формой анемии, особенно когда она развивается медленно, симптомы отсутствуют. Другие люди могут испытывать симптомы только при физических нагрузках. Более тяжелая анемия может вызывать симптомы даже во время отдыха. Симптомы становятся более серьезными, когда легкая или тяжелая анемия развивается быстро, например, когда кровотечение возникает при разрыве кровеносного сосуда.
Легкая анемия часто вызывает утомляемость, слабость и бледность. Помимо этих симптомов, более тяжелая анемия может вызывать обморок, головокружение, повышенную жажду, потоотделение, слабый и учащенный пульс и учащенное дыхание.Тяжелая анемия может вызвать болезненные судороги голени во время упражнений, одышку и боль в груди, особенно если у людей уже есть нарушение кровообращения в ногах или определенные типы заболеваний легких или сердца.
Некоторые симптомы также могут указывать на причину анемии. Например, черный дегтеобразный стул, кровь в моче или стуле или кашель с кровью предполагают, что анемия вызвана кровотечением. Темная моча или желтуха (желтоватый оттенок кожи или белков глаз) предполагают, что разрушение эритроцитов может быть причиной анемии.Чувство жжения или покалывания в руках или ногах может указывать на дефицит витамина B12.
Многие заболевания, вызывающие анемию, такие как рак, включая рак крови, такие как миелодисплазия и множественная миелома, чаще встречаются у пожилых людей. Таким образом, у многих пожилых людей развивается анемия. Анемия при хроническом заболевании и железодефицитная анемия, вызванная аномальным кровотечением, являются наиболее частыми причинами анемии среди пожилых людей. Анемия не является нормальным следствием старения, и при выявлении анемии всегда следует искать причину.
Симптомы анемии в основном одинаковы независимо от возраста. Кроме того, даже при легкой форме анемии у пожилых людей больше шансов впасть в замешательство, депрессию, возбуждение или апатию, чем у молодых. Они также могут стать неустойчивыми и испытывать трудности при ходьбе. Эти проблемы могут мешать самостоятельной жизни. Однако у некоторых пожилых людей с легкой формой анемии симптомы отсутствуют, особенно когда анемия развивается постепенно, как это часто бывает.
У пожилых людей анемию, вызванную дефицитом витамина B12, можно ошибочно принять за деменцию, поскольку этот тип анемии может влиять на умственную функцию.
Анемия может сократить продолжительность жизни пожилых людей. Таким образом, выявление причины и ее устранение особенно важны.
.
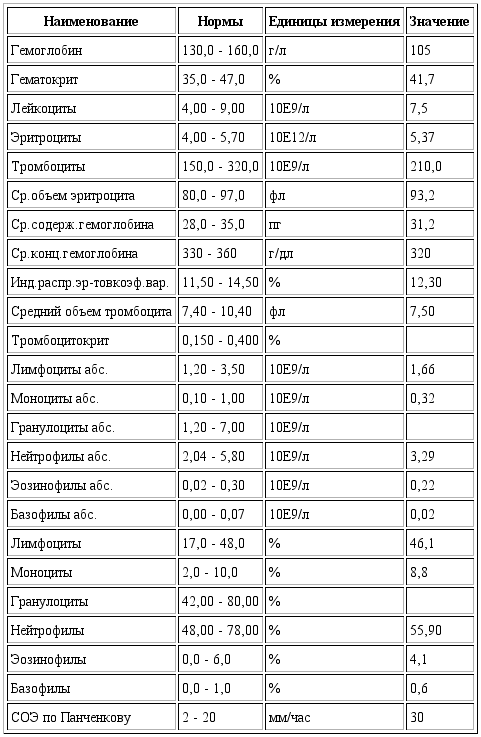
 Даже при сбалансированном питании может возникнуть анемия по той причине, что вещества не усваиваются из-за особенностей организма, заболеваний, приема определенных лекарственных препаратов.
Даже при сбалансированном питании может возникнуть анемия по той причине, что вещества не усваиваются из-за особенностей организма, заболеваний, приема определенных лекарственных препаратов.