Асфиксия виды: Ошибка 404. Запрашиваемая страница не найдена
Асфиксия в стоматологии — стоматологический алфавитный указатель French Dental Clinic
Асфиксией называют острую дыхательную недостаточность, которая угрожает жизни пациента, если не будут приняты неотложные меры. Доступ кислорода в лёгкие затрудняется и прекращается, наблюдаются судороги и расширение зрачков, нередко наблюдается двигательное возбуждение. Кожные покровы приобретают синюшный оттенок, происходят нарушения ЧСС и сердечной деятельности. Цвет крови становится тёмным. При острой асфиксии происходит быстрая потеря сознания.
Типы асфиксии
- Стентотическая асфиксия часто встречается в стоматологической практике. Возникает при отёках гортани или глотки, гематомах. Причины могут быть вызваны как аллергическим шоком или развитием воспалительных процессов, так и в результате резкого кровоизлияния.
- Обтурационная асфиксия происходит при закупорке дыхательного прохода инородными телами. Обычно это могут быть марлевые шарики или тампоны, кусочки массы для получения оттиска зубов или отколовшиеся части зубов.

- При попадании в дыхательные пути рвотных масс или крови наблюдается аспирационная асфиксия.
- В случае дислокационной асфиксии доступ воздуха в лёгкие перекрывается запавшим языком или деформированной гортанью.
- Причиной клапанной асфиксии является закупорка просвета лоскутом мягкого нёба.
Экстренная медицинская помощь при асфиксии
Врач должен мгновенно определить причину и далее выбрать наиболее эффективную схему неотложной медицинской помощи для восстановления дыхательных функций. Обычно мероприятия включают следующие этапы:
- В первую очередь нужно деблокировать дыхательные пути. Если асфиксия вызвана попаданием инородного предмета — удалить его. Больного кладут на бок или животом на колено врача и ударяют между лопаток либо выполняют приём Гемлиха. Первая задача при обтурационной асфиксии — очистить ротовую полость от сгустков крови или инородных тел. Если эффект отсутствует, производится интубация трахеи либо используется вакуум-отсос.
 Хирургическое вмешательство показано только в крайних случаях. При анафилактическом шоке требуется введение адреналина и кортикостероидов.
Хирургическое вмешательство показано только в крайних случаях. При анафилактическом шоке требуется введение адреналина и кортикостероидов. - Проводится оксигенотерапия, больной подключается к кислородному баллону или аппарату ИВЛ в особо тяжёлых случаях.
- В качестве медикаментозной терапии используются дыхательные аналептики и бронхолитики.
Для профилактики состояний асфиксии врач обязан тщательно собирать анамнез и контролировать состояние пациента во время лечения.
Памятка для родителей «Профилактика механической асфиксии у детей до 1 года»
Асфиксия — удушье, вызванное сдавлением дыхательных путей, закрытием их просвета слизью, пищей, сдавлением шеи, грудной клетки и живота, которое может привести к смерти ребенка.
У новорожденного это состояние может быть вызвано в основном следующими причинами:
Прикрытие дыхательных путей ребенка мягким предметом (подушкой, игрушкой).
Прикрытие дыхательных путей грудью матери во время кормления.
Попадание инородных тел в дыхательные пути (мелкие игрушки, пуговицы, кольца, монеты и т.д.).
Поперхивание и попадание молока не в пищевод ребенка, в гортань, иногда бронхи.
Частые срыгивания.
Сдавление области шеи цепочками с крестиками (талисманами), тесьмой с соской.
Профилактика асфиксии
- После каждого кормления ребенку следует дать возможность отрыгнуть воздух, заглоченный с пищей. Для этого его нужно подержать некоторое время вертикально и ни в коем случае не класть сразу после кормления. Некоторые дети (особенно недоношенные или ослабленные) могут срыгивать повторно, уже находясь в кроватке. Для предотвращения вдыхания содержимого поворачивайте голову младенца всегда набок. Если срыгивания частые и обильные, то это является поводом для обращения к врачу.
- Выбирая детское постельное белье и одежду, предпочтение следует отдавать товарам без всевозможных завязочек, тесемочек и т.
 п. Вместо детского одеяла можно пользоваться специальным конвертом для сна, не использовать слишком большие «взрослые» одеяла. Можно использовать специальные сетчатые одеяла для младенцев.
п. Вместо детского одеяла можно пользоваться специальным конвертом для сна, не использовать слишком большие «взрослые» одеяла. Можно использовать специальные сетчатые одеяла для младенцев. - Не следует оставлять надолго старших детей одних около новорожденного, надеясь на их взрослость и рассудительность, а также класть спать младенца в одну кровать с ними. Да и совместный сон в одной кровати с родителями с точки зрения возможной асфиксии не безопасен.
- Совместный сон также может быть фактором риска удушения малыша. Хотя многие молодые мамы кладут с собой в постель малышей

ГБУЗ «Котельниковская ЦРБ» | Государственное бюджетное учреждение здравоохранения «Котельниковская центральная районная больница»
Фонд поддержки детей, находящихся в трудной жизненной ситуации, совместно с РОО «Объединение многодетных семей города Москвы» в 2021г проводят Всероссийский спортивный фестиваль «Здоровая семья – сильная Россия!». «Берегите здоровье смолоду!» — основное условие полноценной жизни каждого человека. Здоровая активная семья — залог успеха развития страны!
Котельниковская ЦРБ НовостиУважаемые жители г. Котельниково и Котельниковского района! В связи с длительными выходными и праздничными майскими днями, устанавливается следующий режим работы ГБУЗ «Котельниковская ЦРБ»: ПОЛИКЛИНИКА по адресу: г. Котельниково, ул. Ленина, 14 В период с 04.05.2021г. по 07.05.2021г. прием амбулаторных больных будет проводиться в обычном режиме с 8. 00 до 16.18.2021г. всеми специалистами! в остальные
00 до 16.18.2021г. всеми специалистами! в остальные
С 26 апреля по 2 мая 2021 года Европейское региональное бюро ВОЗ в шестнадцатый раз проведет ежегодную Европейскую неделю иммунизации (ЕНИ), чтобы привлечь внимание общественности к той ключевой роли, которую иммунизация играет в защите здоровья людей на всех этапах жизни.
Всемирный день борьбы с туберкулезом уже более 30 лет отмечают 24 марта. Международный праздник был учрежден в 1982 году Международным союзом борьбы с туберкулезом и легочными заболеваниями совместно со Всемирной организацией здравоохранения.
Котельниковская ЦРБ НовостиЕсли Вас укусила собака или попала слюна животного на кожу, слизистые, то вы уже подвержены риску инфицирования бешенством! А это очень опасно.
Безусловно, рождение ребенка — это счастье! Но с появлением крохи прибавляются и заботы. Помимо правильного питания и ухода, крайне необходимо обеспечить безопасность малютки. Нередко причиной трагедии может стать механическая асфиксия (удушье) — острая нехватка воздуха, вызванная сдавлением дыхательных путей, закрытием их просвета слизью, пищей, мягкими
Котельниковская ЦРБ НовостиВ период с 15 по 26 марта и с 18 по 29 октября 2021 года ГУ МВД по Волгоградской области на территории региона запланировано проведение Всероссийской акции «Сообщи, где торгуют смертью». Акция направлена на привлечение общественности к участию в противодействии незаконному обороту наркотиков, а также
Асфиксия — опасное состояние
АСФИКСИЯ – общее состояние удушья, вызванное нехваткой кислорода (гипоксией) и соответственно избытком углекислого газа (гиперкапнией) в крови и тканях тела. Синоним — удушье.
Синоним — удушье.
Происхождение термина: от греч. asphyxia – отсутствие пульса.
Асфиксия может быть связана с разными факторами.
Ненасильственная А. возникает: 1) в результате патологий дыхательных путей (астма, аллергический отек), 2) спазма от действия химических и температурных раздражителей и 3) у новорожденных как результат проблем с вынашиванием и родовой деятельностью.
Насильственная А. происходит при: 1) закрытии дыхательных путей инородными предметами и жидкостями (обтурационная А.), 2) сжимании шеи через — повешение, удавление петлей, руками и т.д. (странгуляционная А.) и 3) сдавливания груди и живота чем-то массивным, как бывает в давке (компрессионная А.). К данному типу А. относят также подростковые игры с удушением.
Асфиксия плода и новорожденного в наше время является главной причиной мертворождений и ранней детской смертности. Врачи связывают её с неблагополучной беременностью, внутриутробной инфекцией, затяжными родами, полученной в родах травмой головы и т.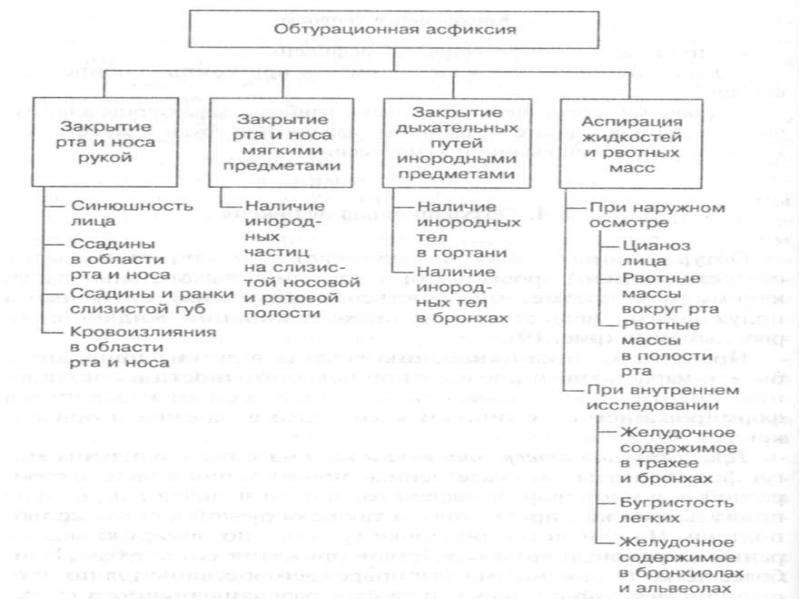 д.
д.
Асфиксия плода часто происходит при обвитии пуповиной. Считается, что это явление вызвано многоводием, стрессами и другими факторами, заставляющими ребенка суетиться в утробе.
Диагностика беременности дает возможность остановить развитие многих опасных ситуаций, таких как обвитие пуповиной, отслойка плаценты, аномалия легких или сердца младенца и т.д. Но, увы, не всех.
Асфиксия новорожденных встречается сейчас в 4-6% случаев. Отличается она от других видов А. тем, что дыхание ребенка нарушено или отсутствует, но его сердечная деятельность сохранена.
Первичная А. развивается сразу при рождении. Её проявления акушеры достаточно эффективно отслеживают по шкале Вирджинии Апгар. Более опасна вторичная А., может наступить через несколько часов/суток после рождения. Тогда ребенок может просто перестать дышать. Поэтому за таким малышом нужно постоянное наблюдение.
развивается сразу при рождении. Её проявления акушеры достаточно эффективно отслеживают по шкале Вирджинии Апгар. Более опасна вторичная А., может наступить через несколько часов/суток после рождения. Тогда ребенок может просто перестать дышать. Поэтому за таким малышом нужно постоянное наблюдение.
Частые причины вторичной А.: 1) нарушено кровообращение головного мозга, 2) ребенок срыгнул и захлебнулся, 3) врожденный порок или недоразвитие легких, сердца, головного мозга, 4) пневмония новорожденных
Существует 3 степени А. – легкая, средняя, тяжелая. У каждой из них свои признаки, но общим для всех является расстройство дыхания, как следствие – различной сложности нарушения сердечного ритма, а после работы кровеносной и нервной систем.
Лечение младенца, родившегося с удушьем, начинается тут же, в родильном зале или операционной. Ему оказывается первая необходимая помощь, направленная на восстановление дыхательной, сердечной деятельности и основных рефлексов.
Но все последствия асфиксии в роддоме не устраняются. Ребенку необходима дальнейшая реабилитация и постоянное наблюдение специалистов в течение первого года жизни, а в сложных случаях и после.
Реабилитационные мероприятия – это в первую очередь остеопатические сеансы, специальный детский массаж и гимнастика. Эти методики восстанавливают трофику тканей, улучшают кровообращение, отток лимфы и спинномозговой жидкости, крайне позитивно влияют на формирование нервной системы малыша. Также очень помогают организму после асфиксии и гипоксии занятия в бассейне.
Все типы асфиксии, при которых удается сохранить жизнь ребенку или взрослому, требуют длительного восстановления. Восстановительные процедуры ЦКП Атлант (различные виды медицинского массажа) прекрасно работают с последствиями асфиксии.
Помните, асфиксия и гипоксия опасны своими осложнениями! Пережившему асфиксию своевременный массаж может спасти жизнь.
Ждем будущих мам на диагностику позвоночника, а малышей – на массаж!
Асфиксия – советы по первой помощи и профилактике
Чувствуете затрудненное дыхание? Это серьезный повод для беспокойства. Но без паники! Узнайте, от чего бывает асфиксия, что делать при удушьи, и как от него защититься.
Но без паники! Узнайте, от чего бывает асфиксия, что делать при удушьи, и как от него защититься.
Асфиксия – это патологическое состояние, при котором возникает удушье. Сопровождается гипоксией – в крови и тканях резко падает уровень кислорода, и развивается избыток углекислого газа. Это состояние вызывает сильное кислородное голодание, которое становится угрозой жизни человека. Поэтому при асфиксии ему нужна неотложная помощь.
Навигация по странице:
Симптомы и виды асфиксии
Асфиксию классифицируют по этиологии, а ее симптоматика имеет характерные проявления.
Виды
Асфиксия может быть связана с:
- Нарушениями работы организма
- Механическими воздействиями на дыхательные пути
В первой категории выделяют следующие виды асфиксии:
- Рефлекторная – воздух перекрывается из-за спазмов голосовой щели.
- Вызванная болезнями – патология связана с нарушениями работы дыхательных путей.

- Асфиксия новорожденных – ребенок рождается с затрудненным дыханием, либо совсем не дышит. Это может быть связано с родовыми травмами, а также с кислородным голоданием в утробе, когда развивается асфиксия плода.
Механическая асфиксия подразделяется на 3 типа:
- Обтурбационная – дыхательные пути перекрывают инородные тела и предметы – например, при удушении подушкой, утоплении.
- Странгуляционная асфиксия – кровеносные сосуды и ткани шеи сдавливаются – например, при удушении руками или петлей.
- Компрессионная – грудная клетка и живот прижимаются массивными предметами или сыпучими веществами – например, при производственных травмах, землетрясениях, обвалах.
Симптомы
Распознать опасное состояние помогут такие симптомы:
- Одышка – человек чувствует нехватку кислорода и пытается дышать активнее
- Учащенное сердцебиение
- Повышенное артериальное давление
- Испуг и возбуждение
- Кашель, изменение голоса
- Синюшность кожи
- На запущенных стадиях – отсутствие пульса, потеря сознания
Причины асфиксии
Когда развивается асфиксия, причины могут быть следующими:
- Закупорка дыхательных путей инородными телами, водой, рвотными массами
- Сильный отек верхних отделов дыхательной системы из-за воспаления или аллергии
- Опухоли гортани, перекрывающие просвет
- Острый стеноз дыхательных путей при трахеите, бронхите, ларингите
- Обструкция легких при пневмонии, плеврите или бронхиальной астме
- Осложнения коронавирусной инфекции
- Ожоги слизистой оболочки дыхательных путей горячим паром или едкими химическими веществами
- Повреждения при травмах шеи
- Центральные поражения дыхательных центров – при инсультах, черепно-мозговых травмах
- Паралич дыхательных мышц
- Сильное сдавливание шеи или грудной клетки – частые причины механической асфиксии
Стадии асфиксии
Когда развивается асфиксия, стадии 4:
- Человек чувствует некоторое кислородное голодание и начинает активно компенсировать его учащенным дыханием.
 Развивается одышка, кружится голова, кожные покровы бледнеют, сердцебиение учащается.
Развивается одышка, кружится голова, кожные покровы бледнеют, сердцебиение учащается. - Одышка усиливается, кожа начинает синеть, дышать становится все тяжелее – приходится делать огромные мышечные усилия при каждом вдохе.
- Дыхание прерывается, давление падает, сердцебиение замедляется. Начинаются эпизоды потери сознания.
- Асфиксия тяжелой степени – дыхание и пульс отсутствуют, у человека начинаются судороги, приступы непроизвольного мочеиспускания и дефекации.
Асфиксия у детей и новорожденных
4-6% детей рождаются с асфиксией. Это связано с патологическим течением беременности и родовыми травмами. Очень важно быстро восстановить дыхание у новорожденных – каждая секунда на счету. Если не сделать этого оперативно, ребенок может получить тяжелые нарушения ЦНС и даже умереть.
Асфиксия у детей может возникнуть при стенозе дыхательных путей, связанном с воспалительными болезнями. Поэтому важно лечить их на ранних стадиях и не допускать осложнений.
Особенности лечения асфиксии
Человеку, у которого асфиксия, нужна грамотная первая помощь. Сделать это помогут советы врачей клиники «Беттертон»:
- Вызовите скорую
- Освободите шею от одежды и других мешающих предметов
- Уберите из дыхательных путей слизь, воду, пищевые или рвотные массы – если они есть
- Обеспечьте доступ воздуха – усадите человека рядом с открытым окном
- При необходимости – сделайте искусственное дыхание и массаж грудной клетки
Более профессиональную помощь окажут врачи.
Асфиксия – последствия
Когда развивается асфиксия, последствия могут быть плачевными:
- Обструкция легких
- Паралич дыхательных центров мозга
- Отек мозга
- Амнезия и другие нарушения ЦНС
- Смерть от удушья
Как уберечь себя и близких от асфиксии
- Вовремя лечите болезни ЛОР-органов
- Берегите шею и грудную клетку от травм
- Носите респиратор при работе с едкими химическими веществами
Врачи нашего ЛОР-центра помогут вам быстро вылечить болезни, вызывающие асфиксию. Запишитесь на консультацию, чтобы узнать больше!
Запишитесь на консультацию, чтобы узнать больше!
Записаться на прием к врачу:
Записаться на прием к врачу:
Об авторе статьи:
Отоларинголог (ЛОР)
Доктор Омельченко О.В. является прогрессивным специалистом в области отоларингологии, аудиологии и сурдологии.
Опыт работы:
8 лет
Последние публикации от автора
О диагностике асфиксии вследствии закрытия дыхательных путей рвотными массами и компактными инородными предметами Текст научной статьи по специальности «Прочие медицинские науки»
Вестник КазНМУ, №1- 2014
СУДЕБНАЯ МЕДИЦИНА FORENSIC MEDICINE
УДК 340.6(075.8)
В.В. СТОЙЛОВ, Б.К. ДЖАНБЫРШИЕВ, Г.М. ТУЛЕПБЕРГЕНОВА, Г.С. ШЕВЧЕНКО
Казахский Национальный медицинский университет им. С.Д. Асфендиярова и Алматинский филиал Центра Судебной медицины
О ДИАГНОСТИКЕ АСФИКСИИ ВСЛЕДСТВИИ ЗАКРЫТИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ РВОТНЫМИ МАССАМИ И КОМПАКТНЫМИ ИНОРОДНЫМИ ПРЕДМЕТАМИ
На архивном материале и личных экспертизах освещается возможность диагностики асфиксии от закрытия дыхательных путей рвотными массами и компактными инородными предметами, возможность провоцирования рвотного рефлекса путем сдавления шеи руками.
Ключевые слова: механическая асфиксия, сдавление шеи руками, прижизненность попадания рвотных масс и инородных предметов в дыхательные пути.
Асфиксия от закрытия дыхательных путей рвотными массами и инородными телами, предметами и веществами встречаются в судебно-медицинской практике не так часто как другие виды асфиксий. На долю ее приходится, по данным различных авторов, от 6% до 12% от числа всех видов асфиксий. Несмотря на приведенные данные диагностика от закрытия дыхательных путей не так легка, как на первый взгляд кажется. Сложности в том, что при наружном исследовании зачастую могут вообще отсутствовать какие-либо признаки насильственной смерти, а при внутреннем исследовании необходима дифференциация асфиксии от закрытия дыхательных путей с часто имеющим место посмертным попаданием инородных тел в гортань, трахею и бронхи. Особенно часто при экспертизе в этих отделах обнаруживаются рвотные массы. Пищевые комочки рвотных масс при прижизненном попадании могут плотно закрывать просвет дыхательных путей и приводить к обтурации, а при посмертном- пребывать в дыхательных путях индифферентно. По данным литературных источников (Попова М.А. и Лукаш А.А; Анохин О.Х., Чучко В.А.) смерть от асфиксии с аспирацией пищевых масс наступает вследствие рвоты, обусловленной алкогольной интоксикацией. Результаты практических наблюдений свидетельствуют о том, что высокая концентрация алкоголя приводит к коматозному состоянию, при котором резко снижается чувствительность дыхательных путей, вплоть до подавления защитных рефлексов (Чучко В.А.) Рвотный рефлекс с последующим прижизненным попаданием пищевых масс в дыхательные пути может провоцироваться каким-либо грубым воздействием на область шеи. Такое воздействие чаще всего имеет место при сдавлении шеи петлей или руками. Приводим пример из личной практики. Труп гр-ки С. 35 лет был обнаружен с наружными признаками асфиксии от сдавления шеи руками. Согласно следственным данным во время праздничной вечеринки после принятия алкогольных напитков и обильной пищи у С.
Пищевые комочки рвотных масс при прижизненном попадании могут плотно закрывать просвет дыхательных путей и приводить к обтурации, а при посмертном- пребывать в дыхательных путях индифферентно. По данным литературных источников (Попова М.А. и Лукаш А.А; Анохин О.Х., Чучко В.А.) смерть от асфиксии с аспирацией пищевых масс наступает вследствие рвоты, обусловленной алкогольной интоксикацией. Результаты практических наблюдений свидетельствуют о том, что высокая концентрация алкоголя приводит к коматозному состоянию, при котором резко снижается чувствительность дыхательных путей, вплоть до подавления защитных рефлексов (Чучко В.А.) Рвотный рефлекс с последующим прижизненным попаданием пищевых масс в дыхательные пути может провоцироваться каким-либо грубым воздействием на область шеи. Такое воздействие чаще всего имеет место при сдавлении шеи петлей или руками. Приводим пример из личной практики. Труп гр-ки С. 35 лет был обнаружен с наружными признаками асфиксии от сдавления шеи руками. Согласно следственным данным во время праздничной вечеринки после принятия алкогольных напитков и обильной пищи у С. возникла ссора с сотрудницей.
возникла ссора с сотрудницей.
Та, будучи моложе С., свалила последнюю на пол, уселась ей на живот, при этом сдавливала ей шею руками. На боковых поверхностях шеи С. было обнаружено около 8 округлой и овальной формы кровоподтеков с выраженным осаднением кожи. При внутреннем исследовании на фоне общеасфиктических признаков просматривались обширные очаги кровоизлияния в мышцах передне-боковой поверхности шеи, выраженная эмфизема легких с обилием полужидких пищевых масс в трахее и бронхах. При микроскопическом исследовании установлены признаки прижизненного их проникновения в мелкие бронхи вплоть до альвеол. При химическом исследовании крови и мочи был обнаружен этиловый алкоголь в количестве, соответствующим сильной степени алкогольного опьянения (3,8 %о). Случай интересен тем, что смерть С. наступила не от асфиксии вследствие сдавления шеи руками, а от попадания пищевых масс в дыхательные пути вследствие спровоцированной рвоты.
Посмертное проникновение пищевых масс в дыхательные пути, особенно в жидком и полужидком состоянии обычно связано с грубой транспортировкой трупов, с их резким перемещением, переворачиванием, когда содержимое желудка вначале выходит из него, а потом затекает в дыхательные пути. Анализируя архивный материал АФ ЦСМ за 2011, 2012 и частично 2013 годы мы сделали выборку случаев экспертизы с обнаружением рвотных масс в дыхательных путях. Было отобрано около 200 случаев. Кроме этого авторы данной работы проанализировали подобные личные экспертизы за тот же срок, их оказалось 38 случаев. Проанализированны секционные, лабораторные, а так же следственные данные об обстоятельствах наступления смерти. Смерть а результате закрытия дыхательных путей наступила по данным изученных экспертиз имело место в 12%, в остальных же 88% случаев было посмертное попадание рвотных масс в дыхательные пути.
Анализируя архивный материал АФ ЦСМ за 2011, 2012 и частично 2013 годы мы сделали выборку случаев экспертизы с обнаружением рвотных масс в дыхательных путях. Было отобрано около 200 случаев. Кроме этого авторы данной работы проанализировали подобные личные экспертизы за тот же срок, их оказалось 38 случаев. Проанализированны секционные, лабораторные, а так же следственные данные об обстоятельствах наступления смерти. Смерть а результате закрытия дыхательных путей наступила по данным изученных экспертиз имело место в 12%, в остальных же 88% случаев было посмертное попадание рвотных масс в дыхательные пути.
Попадание рвотных масс в дыхательные пути
I прижизненное
посмертное
Наличие алкоголя в организме
I обнаружено
не обнаружено
Важно отметить, что смерть от асфиксии наступала у лиц находившихся в состоянии алкогольного опьянения (96,5%). Во всех случаях гистологическим исследованием выявлено резкое полнокровие всех внутренних органов, в легких картина очаговой альвеолярной эмфиземы, отек и кровоизлияние. Элементы пищи в виде мелких комочков обнаруживалось в
Во всех случаях гистологическим исследованием выявлено резкое полнокровие всех внутренних органов, в легких картина очаговой альвеолярной эмфиземы, отек и кровоизлияние. Элементы пищи в виде мелких комочков обнаруживалось в
альвеолах и бронхиолах, вызывая их расширение. При прощупывании таких участков дыхательных путей определялся «четкообразный» рельеф их поверхности. Прижизненность попадания пищевых масс в дыхательные пути во всех случаях были подтверждены данными микроскопии на прижизненность — в стеках бронхов в зоне прилегания комочков пищи
Вестник КазНМУ, №1- 2014
наблюдалось выраженная сосудистая реакция в виде расстройства кровообращения и кровоизлияний. Что касается обстоятельств наступления асфиксии от аспирации инородных тел, то они по данным изученных экспертиз весьма различны. Приводим два типичных случая из нашей практике. Случай первый. Студент стоматолог Каз НМУ в перерыве между занятиями прогуливался с согрупниками по аллее. Во время оживленной беседы неожиданно закашлялся, посинел, затем упал и на фоне выраженных судорожных дыхательных движений скончался. При вскрытии просвет гортани оказался закрытым липкой массой белого цвета (жевательная резинка). При изучении микроскопической картины легких и дыхательных путей была обнаружены резкая эмфизема верхних долей обоих легких, отек мягких тканей гортани, кровоизлияния в них на участках прилегания инородного тела.
Случай первый. Студент стоматолог Каз НМУ в перерыве между занятиями прогуливался с согрупниками по аллее. Во время оживленной беседы неожиданно закашлялся, посинел, затем упал и на фоне выраженных судорожных дыхательных движений скончался. При вскрытии просвет гортани оказался закрытым липкой массой белого цвета (жевательная резинка). При изучении микроскопической картины легких и дыхательных путей была обнаружены резкая эмфизема верхних долей обоих легких, отек мягких тканей гортани, кровоизлияния в них на участках прилегания инородного тела.
Случай второй. Гр. Т. 50 лет во время приема пищи оживленно разговаривал по телефону. Со слов сотрудника неожиданно
закашлялся, в момент судорожных движений упал на пол и скончался. При наружном и внутреннем исследовании трупа Т. обнаружены признаки механической асфиксии в виде выраженного полнокровия внутренних органов, точечных кровоизлияний в эпикарде и под плеврой. Просвет гортани оказался полотно прикрыт куском мяса, провисающим в начальный отдел трахеи.
ВЫВОДЫ: Таким образом, анализ изученного секционного материала позволяет сделать вывод о том, что диагноз смерти от закрытия дыхательных путей рвотными массами и инородными телами должен ставиться на основе обнаружения признаков прижизненности и локализации инородных тел в глубоких отделах дыхательных путей — в альвеолах и бронхиолах. Определенное значение для судебно-медицинской диагностики могут иметь в подобных случаях и следственные данные.
СПИСОК ЛИТЕРАТУРЫ
1 Лукаш А.А. Редкий случай аспирации крупных камней при утоплении в воде // Судебно-медицинская экспертиза. — М.: 1959. — №1. — С. 51
2 Международная классификация болезней Том 17. Инородное тело в дыхательных путях. — С. 122-125.тыц, бегде заттыц тыныс жолдарына Tipi кезде тусук
ABOUT DIAGNOSTICS OF ASPHYXIA CAUSED BY CLOSING OF AIRWAY BY VOMITING MATTERS AND
COMPACT ENTHETIC BODIES
Resume: on the archived material and personal examinations possibility of diagnostics of asphyxia from closing of respiratory tracts the vomitive
masses and compact foreign objects, possibility of provocation of vomitive reflex by the prelum of neck by hands is illuminated.
Keywords: mechanical asphyxia, prelum of neck by hands, hits of the vomitive masses and foreign objects in respiratory tracts in the time of life.
УДК 340.6(075.8)
Г.С. ШЕВЧЕНКО, Г.М. ТУЛЕПБЕРГЕНОВА, Б.К. ДЖАНБЫРШИЕВ, В.В. СТОЙЛОВ
Казахский Национальный медицинский университет им. С.Д. Асфендиярова и Алматинский филиал Центра Судебной медицины
ОБ ЭФФЕКТИВНОСТИ СТЕРЕОМИКРОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ ПЕРЕЛОМОВ ПОДЯЗЫЧНОЙ КОСТИ.
На примерах из личной практики приводятся случаи механической асфиксии сопровождавшиеся переломами подъязычной кости и характеристики стереомикроскопической картины переломов подъязычной кости при странгуляции и внешнем ударном воздействии. Стереомикроскопический метод исследования подъязычной кости рекомендуется для использования при экспертизе гнилостноразложившихся трупов.
Ключевые слова: механическая асфиксия, механизм перелома подъязычной кости, стереомикроскопия, повешение, удавление руками, исследование костных останков.
При экспертизе костных останков трупов, а также трупов с выраженным гнилостным разложением важное значение имеет определение механизма переломов подъязычной кости и вид имевшего место внешнего воздействия. При отсутствии мягких тканей экспертные выводы полностью или в основном могут базироваться на результатах исследования только костной ткани.
В судебно-медицинской практике переломы подъязычной кости встречаются в основном при странгуляции и при различных видах механического воздействия на область шеи — ударах твердыми тупыми предметами, при транспортных происшествиях, при падениях с высоты. Практически установление механизма травмы производиться по признакам
виды, причины, признаки, симптомы и лечение
Асфиксия — состояние, при котором человек испытывает ограничение поступления воздуха в носоглотку, в результате чего наступает удушье с тотальным кислородным голоданием, приводящее к гибели клеток. Возникает по разным причинам c от насильственных, механических, патологических или психологических действий, когда нарушается газообмен в организме человека, что приводит к параличу дыхательного центра.
Не занимайтесь самолечением. При первых признаках заболевания обращайтесь к врачу.
По внешнему проявлению (состоянию кожных покровов) выделяется белая и синяя асфиксия.
По статистике, больше погибает людей от удушья, особенно летом, во время плавания. Взрослые или дети пренебрегают правилами безопасности на воде, вследствие чего тонут, нахлебавшись воды и перекрыв поступление воздуха в органы дыхания. Если не оказана неотложная помощь при асфиксии в течение определенного времени, пациент умирает. У человека отключается мозг, перестают функционировать все системы и органы.
Состояние удушья диагностируется по внешним признакам, после первичного осмотра. Когда состояние стабилизировалось, пациент пришел в сознание, врач может назначить обследование головного мозга. Прогноз зависит от стадии асфиксии: чем тяжелее состояние, тем меньше шансов на положительный результат от реанимации.
Процесс дыхания каждой клетки организма происходит по такой схеме: молекулы кислорода через легкие проникают в кровь, прикрепляясь к гемоглобину в эритроцитах, и транспортируются в клетки кровотока, углекислый газ транспортируется только в обратном направлении.
Во время удушья у человека наблюдается:
- гипоксия — резкое снижение в крови человека эритроцитов с кислородом;
- гиперкапния — резкое увеличение эритроцитов с углекислым газом.
Основные причины асфиксии:
- травмы верхних дыхательных путей;
- сдавливание гортани или перекрытие дыхания;
- инородные тела: жидкость, пища, предметы, опухоли органов дыхания;
- заболевания органов дыхания: трахеобронхит, астма, отек гортани;
- нарушение газообмена;
- проблемные роды;
- интоксикация;
- черепно-мозговая и спинномозговая травма;
- инсульт;
- паралич дыхательных мышц;
- проблемы с кровообращением;
- передозировка медикаментами;
- отравление газом.
Часто у человека наблюдается асфиксия в замкнутом пространстве, что связано с психологической травмой в детстве, полученной из-за несчастного случая: ребенок застрял в лифте, провалился в колодец или яму, провел большое количество времени в темном маленьком помещении.
Классификация асфиксии зависит от случая, который спровоцировал состояние. Классическая остановка дыхания — удушье, вызванное механическим воздействием на гортань, трахею.
Выделяют насильственное и ненасильственное удушье. К последнему относятся случаи, связанные с заболеванием человека (проблемы с легкими, сердцем, сосудами, заболевания крови и центральной нервной системы).
Основные формы насильственной остановки дыхания:
- Странгуляционная асфиксия. Тяжелая разновидность удушья, образуется в результате сдавливания шеи (руками или веревкой), грудной клетки (человек находится под завалом или тяжелым предметом).
- Аспирационная асфиксия. Перекрытие дыхательных путей из-за вдыхания различных веществ: попадание жидкости (воды, рвотных масс, крови), газа или химических испарений, твердой пищи.
- Интранатальная асфиксия образуется в процессе родовой деятельности. Причины удушья младенца разнообразны: слишком долгие роды, крупный плод, большое количество околоплодных вод, неправильное предлежание, обвитие пуповиной, патологии в развитии, слабая родовая деятельность. Диагностируется в 4–6 % случаев и может привести к смерти.
- Амфибиотропная асфиксия наблюдается у людей со стенокардией или острой сердечной недостаточностью. В медицине состояние получило название «грудная жаба». Чаще всего патология связана с перегрузкой сердца, из-за чего повышается артериальное давление, отекают легкие, нарушая кислородный обмен. Пациенты страдают одышкой при любом физическом напряжении.
- Дислокационная асфиксия возникает из-за травмы, когда смещаются челюсть, гортань или язык с мягким небом, что затрудняет процесс дыхания. Если человек находится в сознании, состояние резко ухудшается.
- Стенотическая асфиксия. Опухоль трахеи или отек с сильнейшим воспалением гортани мешают и перекрывают доступ кислорода. Состояние может возникнуть из-за тяжелой болезни пациента, которая вызвана инфекцией, вирусом, аллергической реакцией.
Остановка дыхания может быть связана с механическими, токсическими, травматическими и физиологическими причинами. Если человек хорошо ориентируется в понятии удушье и знает виды асфиксии, сможет оказать первую помощь пострадавшему до приезда бригады «Скорой помощи». Важна каждая минута.
Первичные симптомы асфиксии:
- остановка дыхания;
- изменение цвета кожных покровов.
Остальные признаки зависят от стадии удушья.
- Первая стадия. В крови человека появляется недостаток кислорода, что приводит к раздражению центра дыхания. Симптоматические проявления: затрудненность вдыхания воздуха, сильный испуг, цианоз кожных покровов, повышение давление и тахикардия. Если нарушена проходимость или сдавлены дыхательные пути, лицо пострадавшего становится багрово-синим с отеком, может наблюдаться сильный кашель с сипением.
- Вторая стадия. Снижаются реакции организма. Отмечают слабое дыхание, акроцианоз, затрудненность выдоха, сердцебиение замедляется, давление снижается.
- Третья стадия характеризуется прерывистым дыханием с угасанием рефлексов. Человек теряет сознание и впадает в состояние комы.
- Четвертая стадия. Терминальное состояние, когда кожа пострадавшего приобретает белый либо синеватый цвет, дыхание агональное, могут появляться судороги. Человек перестает контролировать тело, мышцы расслабляются — происходит непроизвольное мочеиспускание, дефекация.
У детей удушье может возникать в процессе родов. Состояние младенца измеряется шкалой Апгар, по которой оценивают мышечный тонус, рефлекторную возбудимость, окраску кожи, частоту сердцебиения и дыхание.
Степени асфиксии зависят от количества баллов, поставленные врачом после осмотра новорожденного. Выделяют:
- Легкая степень, 6–7 баллов. Ребенок сделал первый вдох в течение первой минуты после рождения, нос и губы с синеватым оттенком, дыхание ослабленное, тонус мышц понижен.
- Средняя степень, 4–5 баллов. Ребенок дышит нерегулярно, крик слабый, рефлексы снижены, синюшность кожных покровов, пуповина пульсирует.
- Тяжелая степень, 1–3 балла. Отсутствие дыхания и крика, сосуды не пульсируют, кожа бледная, функция надпочечников слабая.
- Клиническая смерть, 0 баллов.
Осложнения асфиксии у новорожденных проявляется практически сразу, на первый или второй день жизни младенца. Могут отмечаться проблемы в функционировании головного мозга из-за долгого кислородного голодания, плохое состояние легких, сердца. Не исключены патологии нервной системы.
При острых случаях удушья пациент сам может сообщить врачу признаки асфиксии — жалобы на головокружение, одышку, потемнение в глазах, затруднение вдоха или выдоха.
У новорожденного проблемы с дыханием определяются еще и по состоянию кожных покровов. Выделяется:
- Синяя асфиксия, когда кожа младенца приобретает синий цвет и отмечается затрудненность в дыхании.
- Белая асфиксия, когда кожа новорожденного становится белой, дыхание отсутствует.
После реанимационных мероприятий назначаются соответствующие исследования крови, головного мозга, центральной нервной системы, чтобы проверить самочувствие.
Травматическая асфиксия требует более тщательной проверки, чтобы знать область повреждения и какие меры стоит принять для восстановления дыхания.
Общий список обследований:
- Пульсоксиметрия. Дает возможность проверить пульс и степень насыщения гемоглобина кислородом.
- Рентгенография.
- Бронхоскопия.
Пульсоксиметрия
Не всегда удается вовремя помочь пострадавшему. Чтобы диагностировать смерть от удушья, специалисты опираются на состояние кожи (трупные пятна синевато-лилового цвета, лицо синее), глаз (конъюнктивы с кровоизлиянием).
Компрессионная асфиксия характеризуется наличием на шее борозды от петли, отмечаются переломы шейных позвонков.
Терапевтические мероприятия прописываются только после того, как состояние пострадавшего стабилизируется. Оказывается первая помощь при асфиксии — действия врачей будут зависеть от вида и фазы нарушения дыхания.
Когда у пострадавшего сдавлена шея, стоит ослабить петлю, устранить западение языка. Если после этого человек не пришел в сознание, не прощупывается сердцебиение, отсутствует дыхание, нужно провести сердечно-легочную реанимацию с искусственным дыханием и закрытым массажем сердца.
Обтурационная асфиксия требует восстановления прохождения воздуха по дыхательным путям. Осуществляется очистка от слизи, воды, крови. Если вытянуть инородное тело или вещество невозможно, применяется трахеальная аспирация. Новорожденным могут вводить специальную интубационную трубку, подключать к аппаратной вентиляции легких, при скоплении газа в желудок ребенка вводят зонд.
Тяжелая асфиксия токсической разновидности устраняется путем введения антидотов. Когда больного удалось стабилизировать, назначаются:
- коррекция кислотно-щелочного и водно-электролитного баланса;
- препараты для поддержания сердечно-сосудистой и дыхательной системы;
- дегидратационная терапия, чтобы предотвратить отек мозга или легких.
При кровопотере могут проводить переливание крови или вводить кровезамещающие растворы.
Введение адреналина при удушье — обязательное мероприятие, так как препарат усиливает сердечное сокращение, улучшает кровообращение, повышает давление и обладает отхаркивающим действием.
Асфиксия, возникшая из-за инфекционных заболеваний, патологических состояний (нервной, сердечно-сосудистой системы), имеет свою методику проведения терапевтических мероприятий.
У новорожденного на первые или вторые сутки после рождения могут проявиться осложнения:
- проблемы с рефлексами;
- угнетение нервной системы.
Смерть от асфиксии у младенцев отмечается в 4–6 % случаев. Важно подбирать хорошую клинику с современной аппаратурой и опытными врачами, тогда риск минимален.
Удушье у взрослого человека приводит к отклонениям:
- речи;
- функционирования центральной нервной системы.
Длительное кислородное голодание может привести к возникновению судорожного синдрома, спровоцировать потерю памяти, вызвать пневмонию.
Профилактические мероприятия для каждого вида удушья различны. Чтобы предотвратить последствия от удушья, стоит придерживаться основных правил:
- Вовремя лечить инфекционные и вирусные заболевания.
- Избавиться от боязни замкнутых пространств, посещать психологические тренинги.
- Следовать правилам безопасности в обращении с химическими веществами, газом.
- Не купаться в глубоких водоемах, посещать зоны отдыха со взрослыми.
Специалисты советуют пройти минимальный курс по оказанию первой помощи в непредвиденных обстоятельствах, что позволит спасти жизнь не только себе, но и окружающим.
Эволюция защиты от удушья
Андерсен, Х.Т. (1959). Угнетение обмена веществ у утки во время ныряния. Acta Physiologica Scandinavica , 46: 234–239.
Артикул Google Scholar
—— (1966). Физиологические адаптации ныряющих позвоночных. Physiological Reviews , 46: 212–243.
PubMed Google Scholar
Оги, М.Л., Элснер Р.В., Гуден Б.А. и Уилсон, П.Р. (1971). Респираторные и сердечные реакции роющего животного ехидны. Физиология дыхания , 11: 327–334.
PubMed Статья Google Scholar
Bandurski, R.S., Bradstreet, E.D. и Scholander, P.F. (1968). Метаболические изменения у прыгуна во время асфиксии или физических упражнений. Сравнительная биохимия и физиология , 24: 271–274.
PubMed Статья Google Scholar
Варфоломей, Г.А., Беннетт А.Ф. и Доусон В.Р. (1976). Плавание, ныряние и производство лактата морской игуаны. Amblyrhynchus cristatus, Копея , 4: 709–720.
Артикул Google Scholar
Берт П. (1870). Leçons Sur la Physiologie Comparée de la Respiration . Париж: Байер.
Google Scholar
Bjertnaes, L., Hauge, A., Kjekshus, J.и Soyland, E. (1984). Сердечно-сосудистые реакции на погружение в воду и апноэ во время устойчивой тренировки мышц. Acta Physiologica Scandinavica , 120: 605–612.
PubMed Статья Google Scholar
Blix, A.S., Elsner, R. и Kjekshus, J.K. (1983). Сердечный выброс и его распределение через капилляры и шунты A-V у водолазных тюленей. Acta Physiologica Scandinavica , 118: 109–116.
PubMed Статья Google Scholar
Батлер, П.Дж., Стивенсон, Р., Вукс, А.Дж. (1986). Вариабельность реакции сердечного ритма при произвольном нырянии у хохлатой утки, Aythya fuligula. Журнал физиологии, 371: 69P.
Батлер П.Дж. и Вукс А.Дж. (1987). Сердечный ответ на ныряние с задержкой дыхания в покое и во время тренировки. (Сравнение человека и ныряющих гомеотерм.) В «Психология погружений с задержкой дыхания» . Мэриленд, США: Публикация Общества подводной и гипербарической медицины No.72 (WS / BH) 15 апреля 1987 г. С. 200–211.
Эльснер Р. (1965). Реакция сердечного ритма при вынужденных и тренированных экспериментальных погружениях на ластоногих. Hvalradets Skrifter, Norske Videnskaps-Akadamie, Oslo , 48: 24–29.
Google Scholar
Элснер Р. и Гуден Б.А. (1983). Дайвинг и асфиксия — сравнительное исследование животных и человека . Кембридж: Издательство Кембриджского университета.
Забронировать Google Scholar
Эльснер, Р., Гуден, Б.А. и Робинсон, С. (1971). Изменения газов артериальной крови и реакция человека на ныряние. Австралийский журнал экспериментальной биологии и медицинских наук , 49: 435–444.
PubMed Статья Google Scholar
Элснер, Р., Миллард, Р.В., Кекшус, Дж. К., Уайт, Ф., Бликс, А.С. и Кемпер, В.С. (1985). Коронарный кровоток и размеры миокардиального сегмента при моделировании погружений в тюленях. Американский журнал физиологии , 249: h2119-h2126.
PubMed Google Scholar
Файнштейн Р., Пинскер Х., Шмале М. и Гуден Б.А. (1977). Брадикардиальный ответ у Aplysia на воздухе. Журнал сравнительной физиологии B , 122: 311–324.
Артикул Google Scholar
Fordyce, R.E. (1992). Эволюция. В Harrison, R. и Bryden, M.M. (Ред.). Киты, дельфины и морские свиньи .Сидней: Велдон Оуэн.
Google Scholar
Гарей, В.Ф. (1962). Сердечные реакции рыб в удушливых средах. Биологический бюллетень морской лаборатории, Вудс-Хоул , 122: 362–368.
Артикул Google Scholar
Гуден, Б.А. (1971). Влияние погружения лица на температуру тела и кровоток в хвосте крысы. Сравнительная биохимия и физиология , 40A: 659–668.
Google Scholar
Гуден Б.А., Стоун Х.Л. и Янг С. (1974). Сердечные реакции на погружение морды у обученных собак. Журнал физиологии , 242: 405–414.
Google Scholar
Гуден, Б.А. (1978). Строение и функция сосудистой сети брыжеечной артерии водных и наземных птиц . Кандидат наук. Тезис. Медицинская библиотека, Медицинская школа, Медицинский центр Королевы, Ноттингем, США.К.
Google Scholar
Гуден, Б.А. (1980a). Сравнение in vitro сосудосуживающих реакций сосудистой сети брыжеечной артерии курицы и утенка на нервную стимуляцию и на норадреналин. Британский журнал фармакологии , 68: 263–273.
PubMed Google Scholar
Гуден, Б.А. (1980b). Влияние гипоксии на вазоконстрикторные реакции изолированной сосудистой сети брыжеечной артерии цыпленка и утенка. Сравнительная биохимия и физиология , 67C: 219–222.
Google Scholar
Гуден, Б.А. (1990). Как морские млекопитающие выживают при глубоком погружении? Австралийский зоолог , 26, № 1: 26–33.
Google Scholar
Гуден, Б.А. и Эльснер Р. (1985). Что ныряющие животные могут рассказать нам о регуляции кровотока. Перспективы биологии и медицины , 28: 465–474.
PubMed Google Scholar
Горр Т. и Кляйншмидт Т. (1993). Эволюционные взаимоотношения латимерии. Американский ученый , 81: 72–82.
Google Scholar
Гуппи, М., Хилл, Р.Д., Шнайдер, Р.К., Квист, Дж., Лиггинс, Г.К., Запол, В.М. и Хочачка П. (1986). Метаболические исследования при добровольном нырянии тюленей Уэдделла с помощью микрокомпьютера. Американский журнал физиологии , 250: R175-R187.
PubMed Google Scholar
Hance, A.J., Robin, E.D., Halter, J.B., Lewiston, N., Robin, D.A., Cornell, L., Caligiuri, M. and Theodore, J. (1982). Гормональные изменения и вынужденное ныряние в гавани тюленя Phoca vitulina . II. Катехоламины плазмы. Американский журнал физиологии , 242: R528-R532.
PubMed Google Scholar
Харрисон, Р.Дж. И Кинг, Дж. Э. (1965). Морские млекопитающие . Лондон: Библиотека Университета Хатчинсона.
Google Scholar
Heistad, D.D. и Уиллер, Р. (1970). Имитация ныряния при гипоксии у человека. Журнал прикладной физиологии , 38: 652–656.
Google Scholar
Hong, S.K., Lin, Y.C., Lally, D.A., Lim, B.J.B., Kominami, N., Hong, P.W. и Мур Т.О., (1971). Авеолярный газообмен и сердечно-сосудистые функции при задержке дыхания воздухом. Журнал прикладной физиологии , 30: 540–547.
PubMed Google Scholar
Хорган, Дж. (1991). Тенденции эволюции «В начале …» Scientific American , 264 (2): 100–109.
Google Scholar
Hudson, D.M. и Джонс, Д. (1982).Замечательный уровень катехоламинов в крови у уток, вынужденных нырять. Журнал экспериментальной зоологии , 224: 451–456.
PubMed Статья Google Scholar
Йохансен, К., Ленфант, К. и Григг, Г.С. (1966). Респираторные свойства крови и реакция утконоса на ныряние, Ornithorhynchus anatinus (Shaw). Сравнительная биохимия и физиология , 18: 597–608.
PubMed Статья Google Scholar
Kjekshus, J.К., Бликс, А.С., Эльснер, Р., Хол, Р. и Амундсен, Э. (1982). Кровоток и метаболизм миокарда у водолазов. Американский журнал физиологии , 242: R97-R104.
PubMed Google Scholar
Кестер, Дж., Майери, Э., Либесвар, Г. и Кандел, Э. Р. (1973). Клеточная регуляция гомеостаза: нервный контроль кровообращения в Aplysia . Federation Proceedings , 32: 2179–2187.
PubMed Google Scholar
Мартин, Л.Д. и Ротшильд Б. (1989). Палеопатология и дайвинг мозазавров. Американский ученый , 77: 460–467.
Google Scholar
Пиквелл, Г.В. (1968). Энергетический обмен у уток при погружной асфиксии: оценка прямым методом. Сравнительная биохимия и физиология , 27A: 455–485.
Артикул Google Scholar
Postgate, J.(1986). Микробы в эволюции. В Микробы и Человек . Миддлсекс: Penguin Books, стр. 193–211.
Google Scholar
Рэйпер, А.Дж., Ричардсон, Д.У., Контос, Х.А. и Паттерсон, Дж. Л. (1967). Циркуляторные реакции на задержку дыхания у человека. Журнал прикладной физиологии , 22: 201–206.
PubMed Google Scholar
Рише, К. (1899). De la résistance des canards à l’asphyxie. Journal de Physiologie et de Pathologie Générale , июль, стр. 641–650.
Scholander, P.F. (1940). Экспериментальные исследования дыхательной функции ныряющих животных и птиц. Hvalradets skrifter, Norske Videnskaps-Akadamie, Oslo , 22, 1–131.
Google Scholar
Scholander, P.F., Bradstreet, E. and Garey, W. (1962). Реакция на молочную кислоту в грунионе. Сравнительная биохимия и физиология , 6: 201–203.
PubMed Статья Google Scholar
Шоландер П.Ф., Ирвинг Л. и Гриннелл С.В. (1942). О температуре и метаболизме тюленя во время ныряния. Журнал клеточной и сравнительной физиологии , 19: 67–78.
Артикул Google Scholar
Шоландер П.Ф., Ван Дам Л. и Шоландер С.И. (1955). Газообмен в корнях мангровых зарослей. Американский журнал ботаники , 42: 92–98.
Артикул Google Scholar
Strømme, S.B. и Ingjer, F. (1978). Сравнение брадикардии при нырянии и максимальной аэробной мощности. Авиация, космическая и экологическая медицина , 49: 1267–1270.
Google Scholar
Вольф, С. (1993). Мозг, разум и медицина: Шарль Рише и истоки физиологической психологии .Нью-Брансуик, Нью-Джерси: Издатели транзакций.
Google Scholar
Wolf, S., Schneider, R.A. и Groover, M.E. (1965). Дальнейшие исследования кровообращения и метаболических изменений кислородсохраняющего (ныряющего) рефлекса у человека. Труды Ассоциации американских врачей , 78: 242–254.
PubMed Google Scholar
Окислительный стресс при перинатальной асфиксии и гипоксически-ишемической энцефалопатии
ВведениеТак называемые оксирегуляторные ткани, такие как центральная нервная система (ЦНС) и миокард, требуют большого количества энергии для поддержания мембранного потенциала и, следовательно, зависят от аэробных условий. метаболизм, который генерирует энергию намного эффективнее, чем анаэробный метаболизм.1 В ЦНС передача потенциалов действия включает АТФ-зависимые ионные насосы, которые используют большое количество энергии. Кроме того, ЦНС не может накапливать энергию в формах, которые могут быть быстро мобилизованы, таких как фосфокреатин или гликоген, и поэтому зависит от непрерывного поступления глюкозы и кислорода. Как следствие, недостаток кислорода и глюкозы приводит к быстрому истощению запасов энергии и гибели клеток за считанные минуты. 2–4
Асфиксия во время родов характеризуется периодами гипоксии / ишемии во время родов, которые, в зависимости от степени тяжести, могут привести к смерть или причина гипоксически-ишемической энцефалопатии (ГИЭ).Смертность от ГИЭ составляет от 1 до 8 смертей на 1000 живорождений в развитых странах и может достигать 26 смертей на 1000 живорождений в развивающихся странах. Основная задача неонатологов заключается в снижении заболеваемости и смертности, связанных с ГИЭ, поскольку, несмотря на широкое использование гипотермии, до 45% этих пациентов все еще умирают сегодня, в то время как у большого процента выживших развивается значительная инвалидность5
Цель этой обзорной статьи — описать биохимические основы окислительного метаболизма, а также адъювантную терапию, которая может помочь контролировать производство свободных радикалов и улучшить результаты гипотермии.
Окислительный метаболизм2,6–9 Аэробный метаболизм и окислительное фосфорилирование (Рис. 1)В многоклеточных организмах кислород должен быть доступен для окислительного фосфорилирования митохондрий, чтобы производить энергию, необходимую для поддержания жизни. Субстраты, такие как глюкоза, аминокислоты и жирные кислоты, превращаются в ацетилкофермент А (ацетил-коА) в митохондриальном матриксе. Ацетил-коА метаболизируется различными компонентами цикла Кребса. Этот процесс высвобождает высокоэнергетические электроны, которые переносятся в цепь переноса электронов никотинамидадениндинуклеотидом и флавинадениндинуклеотидом.Цепь переноса электронов состоит из ряда смежных ферментных комплексов (i, iii и iv), способных перекачивать протоны (H +) в межмембранное пространство, создавая таким образом мембранный потенциал (ψm). Затем АТФ-синтаза позволяет протонам течь обратно в матрицу по электрохимическому градиенту, который высвобождает энергию, используемую для синтеза АТФ из АДФ. Кислород принимает электроны, производимые циклом Кребса, предотвращая повреждение митохондриальных структур. Энергия используется настолько эффективно, что 36 молекул АТФ получают из 1 молекулы глюкозы и 106 молекул АТФ из 1 молекулы пальмитиновой кислоты.2,6–9
Активные формы кислорода и свободные радикалы (Рис. 2)Кислород восстанавливается путем добавления 4 электронов к его внешней оболочке. Кислород имеет ограниченную реактивность, поэтому она снижается последовательно (медленное восстановление). Однако его реакционная способность экспоненциально возрастает в присутствии переходных металлов, таких как медь или железо (быстрое восстановление). Обильное присутствие железа в ЦНС, таким образом, увеличивает скорость окислительных процессов, как это происходит при ГИЭ. В последовательном процессе кислород восстанавливается одним электроном до супероксид-аниона (O2-), двумя электронами до перекиси водорода (h3O2) или тремя электронами до гидроксильного радикала (ОН).Все эти вещества, которые являются обычными продуктами окислительного фосфорилирования митохондрий, известны как активные формы кислорода. Однако некоторые из этих разновидностей, такие как супероксид-анион, гидроксильный радикал и другие, такие как оксид азота (NO) или липидные пероксирадикалы (LOO), также являются свободными радикалами, то есть разновидностями с одним неспаренным электроном в их внешней оболочке, которые поэтому они обладают высокой реакционной способностью и взаимодействуют с соседними субстратами для получения дополнительных электронов, которые им необходимы для достижения стабильности, вызывая цепную реакцию, которая может повредить клеточные структуры.Самый распространенный свободный радикал в организме человека — это супероксид-анион. Не все химически активные частицы являются свободными радикалами: например, перекись водорода (h3O2), которая действует как сигнальная молекула в нескольких физиологических путях, также может быть предшественником свободных радикалов, особенно в присутствии переходных металлов (Fe ++ / Fe +++; Cu + ) .6
Источники свободных радикаловАктивность митохондрий является основным физиологическим источником свободных радикалов. В митохондриях кислород полностью восстанавливается и дает воду, если реагирует с протонами (H +).В условиях метаболического стресса (реанимация, инфекция, парентеральное питание и т. Д.) Происходит повышенное производство свободных радикалов, которые могут повредить структуру митохондрий и препятствовать выработке энергии. Одними из наиболее частых причин окислительного стресса являются активация системы НАДФН-оксидазы (NOX) в фагоцитах в ответ на инфекцию, добавление кислорода или введение определенных лекарств.6,8,9
Биологические антиоксидантные системыОкислительный стресс отражает нарушение баланса между производством свободных радикалов и их нейтрализацией.Определенная степень окислительного стресса требуется для правильного функционирования ферментативных путей, которым требуются активные формы кислорода для передачи клеточных сигналов. Однако выраженный дисбаланс приводит к повреждению тканей и острым или хроническим заболеваниям.9
Система антиоксидантной защиты (ADS) включает как ферментативные, так и неферментативные системы. Антиоксидантные ферменты нейтрализуют активные частицы посредством химических реакций. Неферментативные антиоксидантные системы включают белки, связывающие переходные металлы (трансферрин, церулоплазмин, ферритин), витамины, блокирующие перекисное окисление липидов (A, E и C), и низкомолекулярные соединения, которые уменьшают количество реактивных частиц.Восстановленный глутатион (GSH) реагирует с другой молекулой GSH с образованием окисленного глутатиона (GSSG), процесса, при котором высвобождаются два электрона, которые могут быть захвачены свободными радикалами, способствуя их нейтрализации. Затем фермент GHS-редуктаза катализирует восстановление GSSG до GSH. Некоторыми из ключевых антиоксидантных ферментов являются супероксиддисмутазы (SOD), которые катализируют превращение супероксида в пероксид водорода, и каталазы (CAT) и глутатионпероксидазы (GPx), которые превращают пероксид водорода в воду и молекулярный кислород.Другие системы включают глутаредоксины, тиоредоксины, пероксиредоксины и гемоксигеназы, которые разрушают прооксидантный гемовый комплекс в красных кровяных тельцах, превращая его в биливердин. ADS развивается на поздних сроках беременности, чтобы подготовить плод к послеродовой оксигенации.6,9
Окислительный стресс, повреждение тканей и их оценкаСвободные радикалы вызывают изменения белков, липидов, углеводов, РНК и ДНК. Существуют биомаркеры общего окислительно-восстановительного статуса, такие как соотношение окисленного и восстановленного глутатиона (GSH / GSSG).В ситуациях окислительного стресса уровень GSSG увеличивается, а соотношение уменьшается, в то время как противоположное происходит в ситуациях, способствующих антиоксидантной активности или снижению, когда наблюдается увеличение GSH. Другой метод — измерение антиоксидантных ферментов. Таким образом, усиление окислительного стресса связано с пропорциональным увеличением активности защитных ферментов. Тем не менее, в настоящее время ведутся исследования по поиску биомаркеров, полученных в результате окисления различных компонентов клетки, которые могут быть обнаружены в образцах биологических жидкостей.В последние годы использование нескольких биомаркеров из различных биологических жидкостей для выявления окислительного стресса было подтверждено у новорожденных.10–16
Патофизиология ишемии-реперфузионного повреждения Образование свободных радикалов при реоксигенационном поврежденииГипоксия-ишемия приводит к истощению АТФ, и это вызывает повреждение, которое изначально является обратимым, но не может быть исправлено, если истощение продолжается. Оксирегуляторные ткани, ярким примером которых является ЦНС, наиболее чувствительны к недостатку кислорода.Исследования, проведенные в 1970-х годах, доказали, что первоначальное повреждение, вызванное периодом гипоксии / ишемии, значительно усиливалось во время реперфузии / реоксигенации. Повреждение, вызванное реоксигенацией, было прямо пропорционально продолжительности и интенсивности гипоксии-ишемии и концентрации кислорода, используемой во время реоксигенации / реперфузии.8 Экспериментальная модель гипоксии-ишемии у новорожденных поросят на животных показала, что повреждение нервной ткани и концентрация в моче маркеры повреждения ДНК (рис.3) были пропорциональны FiO2, используемому во время реоксигенации.17 В настоящее время проводятся исследования конкретных маркеров тканевой гипоксии. Лактат является надежным маркером интенсивности тканевой гипоксии, но не отражает ее длительности. Экспериментальная модель на новорожденных поросятах продемонстрировала, что концентрации метаболитов, возникающих в результате окисления пуринов, пиримидинов и фосфолипидов, обнаруженные с помощью масс-спектрометрии, могут использоваться для расчета «индекса метаболитов», который обеспечивает надежную и воспроизводимую меру интенсивности и продолжительности мозга. гипоксия, которую можно использовать для прогноза или для принятия решения о наиболее подходящем лечении.18–20
Источники реактивных видов в ишемии-реперфузииСуществует множество источников реактивных видов во время ишемии-реперфузии (IR), главными из которых являются комплекс митохондриальной дыхательной цепи и система ксантиноксидазы (XO). Система НАДФН-оксидазы (NOX) и разобщение NO-синтазы также вовлечены, хотя их роль менее заметна.8
В нормальных условиях производство свободных радикалов хорошо регулируется. Почти все электроны, которые текут по цепи переноса электронов, захватываются кислородом (98%), в то время как только 2% производят реактивные частицы.Однако в условиях гипоксии перенос электронов в дыхательной цепи останавливается из-за недостатка кислорода, и m падает. Деполяризация мембраны подавляет активность АТФ-синтазы, и производство АТФ прекращается, что приводит к лизису митохондрий и гибели клеток. Во время реоксигенации m восстанавливается, и возобновляется синтез АТФ. Однако резкая реактивация электронного потока приводит к чрезмерному производству реактивных частиц, которые могут усугубить повреждение нервной ткани, первоначально вызванное апоптозом.2,7,8 Рис. 4 показаны изображения срезов головного мозга, полученные с помощью электронной микроскопии экспериментальной модели гипоксии-реперфузии на мышах, которые показывают структурные нарушения, набухание, потерю крист, разрыв мембран и, наконец, вакуолизацию и разрушение митохондрий.
На стадии реоксигенации ИР кислород вступает в реакцию с гипоксантином и ХО, вызывая выброс супероксидных радикалов и перекиси водорода, которые, в свою очередь, вызывают другие реактивные частицы в цепной реакции, усиливая повреждение тканей, первоначально вызванное длительной ишемией.Активность XO также подвергается посттрансляционной регуляции парциальным давлением кислорода в ткани, причем активность XO увеличивается с понижением давления. Это могло бы объяснить, как окислительный стресс может начаться на стадии гипоксемии и усилиться во время реоксигенации. Недавние исследования показали, что XO может производить NO из нитритов. Одновременное образование супероксида и NO может привести к выработке пероксинитрита, мощного нитрующего агента.21,22
Фазы гипоксически-ишемической энцефалопатииТечение ГИЭ можно разделить на 3 фазы (рис.5), хотя на самом деле это континуум, в котором эти события могут перекрываться. Первая фаза длится 6 часов и характеризуется снижением кровотока у плода, вызывая системную гипотензию и потерю ауторегуляции мозгового кровотока. Церебральная ишемия приводит к гипоксии, ацидозу и повреждению головного мозга в результате отказа первичной энергии. Клетка прибегает к анаэробному метаболизму, чтобы компенсировать снижение поступления кислорода, что вызывает лактоацидоз, истощение АТФ, внутриклеточное накопление Na +, Ca ++ и воды и ингибирование обратного захвата нейромедиаторов с вторичной эксайтотоксичностью.Массивный приток Са ++ приводит к активации липаз и NO-синтазы, продукции свободных радикалов, митохондриальной дисфункции и выбросу апоптогенных веществ в цитоплазму. Вторая фаза (6–48 часов) характеризуется продолжающейся эксайтотоксичностью, потерей митохондриальной активности и окислительным стрессом, вторичным по отношению к изменениям мембранного потенциала с уменьшением продукции АТФ и щелочной внутриклеточной средой, несмотря на адекватную оксигенацию. Наконец, есть третья фаза, которая может длиться дни, недели или даже месяцы, характеризуясь воспалением и эпигенетическими изменениями, которые приводят к аномалиям развития аксонов, нейрогенеза и синаптогенеза.23,24
Стратегии предотвращения повреждений, вызванных активными формами кислородаПредотвращение повреждений, вызванных активными формами кислорода, требует очень раннего вмешательства, поскольку повреждение могло начаться в утробе матери и усилиться во время послеродовой реанимации. Следовательно, протокол лечения должен включать вмешательства, направленные на отказ от первичной энергии. Они могут быть реализованы у матери во время родов, если есть доказательства дистресса плода, или у новорожденных с клиническими или электрофизиологическими данными, указывающими на ГИЭ в первые минуты жизни.25,26
Мы переходим к краткому описанию вмешательств, направленных на устранение патогенных эффектов окислительного стресса.
ГипотермияГипотермия замедляет метаболическую активность тканей, таких как ЦНС, с соответствующим снижением активности ионного обмена и потребности в АТФ. Снижение митохондриальной активности в сочетании с активацией разобщающих белков (UCP) значительно снижает продукцию реактивных видов, сохраняя при этом мембранный потенциал и предотвращая высвобождение апоптогенных белков.Существует множество исследований механизма действия гипотермии и ее клинической эффективности. Однако, несмотря на доказанную эффективность гипотермии как нейропротективного вмешательства у пациентов с умеренным или тяжелым ГИЭ, до 45% леченных пациентов, особенно с тяжелым ГИЭ, имеют неблагоприятные исходы. Это может измениться в ближайшем будущем с использованием адъювантной терапии, которая в настоящее время изучается в ходе экспериментов и клинических испытаний5,23,25,27
Реанимация новорожденных с низкой концентрацией кислородаИспользование низких концентраций кислорода во время реанимации связано с со снижением окислительного стресса во время реоксигенации, смертности и частоты ГИЭ.28 В недавних рекомендациях Международного комитета по связям по реанимации, опубликованных в 2015 году, рекомендуется использовать комнатный воздух при реанимации доношенных новорожденных.29
Аллопуринол или ингибирование ксантиноксидазыАллопуринол является селективным ингибитором XO, снижает выработку NO из нитритов. и действует как хелатор свободного железа и акцептор гидроксильных радикалов. Эти свойства делают его подходящим кандидатом для нейропротекции.21,22
Пилотное исследование было проведено в 1998 году30 с введением 40 мг / кг аллопуринола новорожденным, страдающим асфиксией.Исследование показало снижение окислительного стресса и улучшение церебральной перфузии и корковой активности при отсутствии токсичности, связанной с аллопуринолом. Однако в последующем исследовании31 не было обнаружено улучшений выживаемости или исходов нервного развития при введении аллопуринола в первые 4 часа после рождения по сравнению с использованием плацебо, что авторы связывают с задержкой его приема после рождения. Эта же группа исследователей вводила аллопуринол роженицам с признаками гипоксии плода.32 Новорожденные с терапевтическими концентрациями аллопуринола в пуповинной крови имели значительно более низкие уровни в плазме белка S-100B, маркера повреждения головного мозга, и небелкового железа, маркера окислительного стресса.32 Последующее исследование умеренного новорожденные с асфиксией обнаружили, что группа, получавшая аллопуринол в первые часы после рождения (
часов) и вторую дозу через 12 часов, имела более высокий балл по шкале интеллекта Векслера для детей (WISC) по сравнению с новорожденными, получавшими плацебо.33 Недавно те же авторы опубликовали результаты рандомизированного плацебо-контролируемого многоцентрового исследования аллопуринола у рожениц с клиническими показателями гипоксии плода, побуждающими к немедленным родам, которые не подтвердили значительного снижения уровней S100B; однако апостериорный анализ выявил потенциальную пользу у новорожденных от матерей, получавших аллопуринол.34В настоящее время в Европе проводится многоцентровое исследование (исследование ALBINO; EudraCT-2016-000222-19) с участием 18 государственных больниц Испании. Это рандомизированное плацебо-контролируемое исследование III фазы аллопуринола, основным конечным результатом которого является смерть и / или тяжелые нарушения развития нервной системы. Протокол состоит из введения дозы аллопуринола новорожденным с подозрением на ГИЭ, вторичным по отношению к неонатальной асфиксии, в течение первых 30 минут жизни, а вторую дозу вводят через 12 часов после первой новорожденным, лечившимся от гипотермии.Оценка включает метаболомные, нейрофизиологические и визуализирующие тесты в дополнение к клиническому наблюдению за участниками до возраста 24 месяцев.
МелатонинМелатонин (N-ацетил-5-метокситриптамин) — эндогенный индоламин с антиоксидантными, противовоспалительными и антиапоптотическими свойствами, который показал многообещающие результаты у пациентов с ГИЭ. Его противовоспалительная активность основана на подавлении провоспалительных молекул и подавлении продукции NO в нервной ткани.Мелатонин также блокирует высвобождение проапоптотических белков митохондриями и модулирует активность рецепторов ГАМК и глутамата.35 Мелатонин, используемый в качестве адъювантной терапии гипотермии у пациентов с ГИЭ, связан со снижением окислительного стресса и улучшением выживаемости и исходов нервного развития. 36–38, хотя эти результаты ограничены небольшими размерами выборки. Для подтверждения эффективности мелатонина и ответа на дополнительные вопросы необходимы дальнейшие исследования с достаточной статистической мощностью.
Использование мелатонина для нейропротекции у новорожденных, страдающих асфиксией — Просмотр полного текста
Защита развития мозга является основной задачей отделения интенсивной терапии новорожденных. Гипоксико-ишемическая энцефалопатия (ГИЭ) встречается у 3-5 случаев на 1000 рождений. Только 47% новорожденных имеют нормальные результаты. Последствия травмы головного мозга для нервно-психического развития у доношенных новорожденных, страдающих асфиксией, включают церебральный паралич, тяжелые умственные нарушения, а также ряд незначительных поведенческих и когнитивных нарушений.Однако существует очень мало терапевтических стратегий для предотвращения или лечения повреждения головного мозга. Золотым стандартом является лечение гипотермией, но, согласно литературе, мелатонин потенциально действует в синергии с гипотермией для нейропротекции и улучшения неврологических исходов. Мелатонин, по-видимому, является хорошим кандидатом из-за его различных защитных эффектов, включая удаление активных форм кислорода, блокаду эксайтотоксического каскада, модуляцию нейровоспалительных путей.
В рамках исследования будут оцениваться нейропротекторные свойства и эффекты мелатонина в сочетании с терапевтической гипотермией при гипоксической ишемической энцефалопатии.
Это рандомизированное двойное слепое плацебо-контролируемое исследование с участием 100 новорожденных с гипоксической ишемической энцефалопатией (ГИЭ) от умеренной до умеренной или тяжелой степени. Младенцы с ГИЭ рандомизированы на две группы: группу охлаждения всего тела (N = 50 получают 72 часа гипотермии всего тела) и группу мелатонина / гипотермии (N = 50; получают гипотермию и 5 ежедневных энтеральных доз мелатонина 10 мг / кг). Уровни мелатонина в сыворотке и аутофагии измеряются при включении, ежедневно во время гипотермической терапии, на 5-й и 7-й день для двух групп ГИЭ.
аЭЭГ будет выполняться в течение 72 часов во время лечения гипотермией и повторного нагревания. МРТ и спектроскопический анализ будут проводиться между 5 и 7 днями. После выписки из больницы младенцы войдут в программу последующего наблюдения, состоящую из периодических клинических обследований и оценок развития до 2 лет с поправкой на недоношенность. Опытный психолог и неонатолог оценит исходы развития нервной системы с использованием шкалы Бейли III в скорректированном возрасте 6–12–24 месяцев.
Неонатальная энцефалопатия — лечение и питание
Лечение NE в первую очередь поддерживающее.Поддержание адекватного артериального давления и перфузии жизненно важно для поддержания мозгового кровотока и предотвращения дальнейшего ишемического повреждения. Этого можно достичь осторожным назначением целенаправленной внутривенной инфузионной терапии и, при необходимости, поддержкой инотропами или вазопрессорами, избегая при этом гипертонии. Было высказано предположение, что легкая гипотермия, использование барбитуратов и легкая гиперкапния снижают скорость церебрального метаболизма и сохраняют энергию. Поскольку у жеребят минимальные запасы энергии, может потребоваться внутривенное введение глюкозы для поддержания нормальной концентрации глюкозы в крови.Если жеребенок не может кормить грудью, питание может подаваться через постоянный назогастральный зонд. Полное парентеральное питание показано жеребятам с дисфункцией желудочно-кишечного тракта.
Маннит (0,25–1 г / кг, внутривенно, в виде 20% раствора в течение 20 минут каждые 12–24 часа) используется для уменьшения отека мозга. Противосудорожные препараты (фенобарбитал 2–10 мг / кг, внутривенно, 2 раза в день; диазепам 0,1–0,4 мг / кг, внутривенно, при необходимости; мидазолам 0,04–0,1 мг / кг, внутривенно, при необходимости, или 0,02–0,06 мг / кг / час, постоянно). скорость инфузии) применяются для лечения судорог, которые в противном случае могут увеличить потребление кислорода головным мозгом и способствовать продолжающимся травмам.Самостоятельные травмы во время припадков следует ограничивать, создавая защищенную или мягкую среду. Особенно часто случаются травмы глаза и язвы роговицы; поэтому следует внимательно следить за глазами и при необходимости проводить лечение. У лежачих жеребят можно использовать офтальмологические смазки, чтобы снизить вероятность повреждения роговицы.
Добавка сульфата магния, вводимая в виде инфузии с постоянной скоростью (0,05 мг / кг / час, внутривенно, нагрузочная доза, затем 0,025 мг / кг / час поддерживающей терапии), была предложена для блокирования высвобождения глутамата, тогда как антиоксиданты, такие как витамин E ( 5000 МЕ / день, перорально) и C (100 мг / кг / день, внутривенно или перорально) можно вводить вместе с тиамином (10 мг / кг медленно внутривенно или подкожно каждые 12–24 часа) для поддержки клеточного метаболизма.10% раствор ДМСО (0,5 г / кг, в / в) использовался в качестве поглотителя свободных радикалов. Аллопуринол (44 мг / кг, перорально, в течение первых 4 часов), ингибитор ксантиноксидазы, также можно вводить для уменьшения свободных радикалов, тогда как пентоксифиллин (10 мг / кг, перорально, два раза в день) может подавлять выработку TNF-α у жеребят. с NE.
Большинству жеребят с NE будет лучше от интраназального введения увлажненного кислорода (3–5 л / мин), тогда как механическая вентиляция может потребоваться в случаях тяжелого угнетения дыхания.Доксапрам (0,02–0,05 мг / кг / час инфузия с постоянной скоростью) и кофеин (10 мг / кг, перорально или на нагрузочную дозу в прямую кишку, затем 2,5 мг / кг при необходимости) могут использоваться в качестве центрального стимулятора дыхания. Доступность гипербарической оксигенотерапии ограничена, но она также использовалась для лечения NE у жеребят. Жеребята с NE предрасположены к сепсису. Неясно, связано ли это с основным инфекционным процессом, нарушением иммунной функции или повышенным воздействием патогенных микроорганизмов (т. Е. Неизбирательным поведением медсестер).Кроме того, жеребята с неврологическими отклонениями от нормы при рождении часто не умеют кормить грудью и обычно не имеют пассивной передачи иммунитета. По этим причинам обычно показаны противомикробные препараты широкого спектра действия, переливание плазмы и противовоспалительное лечение.
У большинства жеребят с NE прогноз от хорошего до очень хорошего. В неосложненных случаях выживаемость составляет 70–75% с полным выздоровлением в большинстве случаев. Сепсис и связанные с ним осложнения негативно влияют на прогноз.Жеребята, которые остаются в коме или их трудно разбудить, не показывают улучшения неврологической функции в течение первых 5 дней жизни или демонстрируют тяжелые, повторяющиеся припадки, имеют плохой прогноз.
Наркоз и удушье у некоторых видов и мутантов дрозофилы | Journal of Experimental Biology
1. Наркоз и асфиксию у насекомых можно исследовать, измеряя время восстановления. Определены этот и другие термины и приведены подходящие критерии восстановления.
2. Описаны простые методы этеризации и газирования партий Drosophila и показана достоверность полученных количественных результатов.
3. Время восстановления увеличивается на время притока и на концентрацию наркотика. Формы кривых, полученных в экспериментальных сериях, являются логарифмическими (удушение углекислым газом), прямолинейными (у некоторых видов эфир), вогнутыми, выпуклыми или сигмовидными (эфир). Предполагается, что разные формы кривых извлечения эфира представляют собой разные части по существу сходных кривых, что можно объяснить совместным действием двух макрофаз, одной водной и одного липоидного.
4. Физиологические факторы, определяющие время восстановления: ( a ) пол: женщины восстанавливаются после эфирного наркоза раньше, чем мужчины; ( b ) возраст: молодые мухи выздоравливают раньше, чем старшие; ( c ) недостаток пищи и влаги, что увеличивает время восстановления; и ( d ) химическая реакция: мухи, содержащиеся на кислой пище, дольше остаются наркотизированными, чем мухи, выращенные на щелочной среде.
5. Двуокись углерода продлевает восстановление после эфирного наркоза и иммобилизации синильной кислоты при применении до времени притока и сокращает его при применении во время восстановления.Если его вводить во время выздоровления, он также сокращает период восстановления после удушья.
6. Окись углерода и угольный газ, вводимые перед наркозом, могут сократить время восстановления после эфирного наркоза.
7. При определенных условиях, соответствующих тем, которые использовались во время наркоза рабочими Drosophila , можно было установить некоторые различия во времени восстановления после эфиризации из-за генетических различий. Существенные различия также существуют между некоторыми видами, расами и мутантами Drosophila в их устойчивости к углекислому газу, удушению и газу синильной кислоты.
Изменение интерстициального рН головного мозга в подострой фазе гипоксико-ишемической энцефалопатии у новорожденных свиней
Abstract
Изменения интерстициального pH головного мозга (pH головного мозга ) играют важную роль в механизмах повреждения нейронов при неонатальной гипоксически-ишемической энцефалопатии (ГИЭ), вызванной перинатальной асфиксией. Новорожденная свинья является признанной моделью крупного животного для изучения ГИЭ, однако у этого вида доступна лишь ограниченная информация об изменениях pH головного мозга , и она ограничена экспериментальной перинатальной асфиксией (ПА) и немедленной ревентиляцией.Поэтому мы стремились определить pH головного мозга в течение первых 24 часов развития ГИЭ у поросят. Новорожденных свиней (n = 16), находящихся под наркозом и на вентиляции, были приспособлены для контроля основных физиологических параметров. pH головного мозга определяли в теменной коре с использованием pH-селективного микроэлектрода. PA вызывали вентиляцией газовой смесью, содержащей 6% O 2 -20% CO 2 в течение 20 минут с последующей повторной вентиляцией воздухом в течение 24 часов, затем мозг обрабатывали для оценки гистопатологии.Внутренняя температура поддерживалась неизменной во время PA (38,4 ± 0,1 против 38,3 ± 0,1 ° C, при исходном уровне против в конце PA, соответственно; среднее значение ± SEM). В артериальной крови ПА привела к тяжелой гипоксии (P a O 2 : 65 ± 4 vs 23 ± 1 * мм рт. Ст., * P <0,05), а также к ацидозу (pH a : 7,53 ± 0,03). против 6,79 ± 0,02 *), что согласуется с наблюдаемой гиперкапнией (P a CO 2 : 37 ± 3 против 160 ± 6 * мм рт. Ст.) И лактацидемией (1.6 ± 0,3 против 10,3 ± 0,7 * ммоль / л). Между тем, pH головного мозга постепенно снижался с 7,21 ± 0,03 до 5,94 ± 0,11 *. Рекультивация восстановила pH — , газы и метаболиты крови в течение 4 часов, за исключением P a CO 2 , который оставался слегка повышенным. pH головного мозга вернулся к 7,0 через 29,4 ± 5,5 мин, а затем восстановился до исходного уровня без вторичных изменений в течение 24-часового периода наблюдения. Невропатологическая оценка также подтвердила повреждение нейронов.В заключение следует отметить, что, несмотря на тяжелый ацидоз и изменения газов крови во время экспериментальной ПА, pH головного мозга быстро восстановился и, что особенно важно, не было гипокапнии после асфиксии, которая обычно наблюдается у многих детей с ГИЭ. Таким образом, повреждение нейронов в нашей модели поросят не связано с аномальным pH головного мозга или низким P a CO 2 в течение первых 24 часов после PA.
Образец цитирования: Remzs G, Németh J, Varga V, Kovács V, Tóth-Szki V, Kaila K, et al.(2020) Изменения интерстициального pH головного мозга в подострой фазе гипоксически-ишемической энцефалопатии у новорожденных свиней. PLoS ONE 15 (5): e0233851. https://doi.org/10.1371/journal.pone.0233851
Редактор: Мария А. Дели, Венгерская академия наук, ВЕНГРИЯ
Поступила: 27 января 2020 г .; Принят в печать: 13 мая 2020 г .; Опубликовано: 29 мая 2020 г.
Авторские права: © 2020 Remzső et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все экспериментальные данные доступны в Open Science Framework (osf.io): DOI 10.17605 / OSF.IO / MUTGA.
Финансирование: ЙН, ГР, ВЦЗ, ВВ, ВК, ФД; 2,0 1,3 2017 1,2,1 НКП 2017 00002; Венгерская программа исследования мозга JN, GR, VTSZ, VV, VK, FD; ЭФОП-3.6.1-16-2016-00014; Венгерский грант EFOP JN, GR, VTSZ, VV, VK, FD, финансируемый ЕС; ГИНОП 2.3.2. 15 2016 00034; GINOP Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Перинатальная асфиксия (ПА), определяемая как депривация O 2 во время родов, является одной из основных причин неонатальной заболеваемости и смертности во всем мире, от которой ежегодно страдают около 4 миллионов новорожденных [1]. Прерывание плацентарного или легочного газообмена вызывает немедленные метаболические изменения (гипоксемия, гиперкапния и смешанный ацидоз), которые вызывают сердечно-сосудистые реакции в пользу поддержания доставки O 2 в миокард и мозг (т.е. централизованное обращение). Когда эти компенсаторные механизмы исчерпаны, произойдет критическая гипоксия / ишемия тканей, а последующий метаболический кризис приведет к гипоксически-ишемической энцефалопатии (ГИЭ) у выживших [2].
Несмотря на частичную эффективность терапевтической гипотермии для смягчения неблагоприятного исхода ПА / ГИЭ [3,4], доклинические модели на животных все еще необходимы для изучения точной патофизиологии развития ГИЭ, а также для тестирования предполагаемых нейрозащитных подходов [5].Подобно гетерогенности этиологии, тяжести и продолжительности синдрома ЛА / ГИЭ человека, существует также значительная гетерогенность доклинических моделей, как по видам, так и по пренатальному / постнатальному возрасту животных, методологии индукции ПА / ГИЭ и продолжительность периода наблюдения после асфиксии. Эти различия не позволяют легко сравнивать и переводить накопленные данные. Новорожденная свинья уже давно идентифицирована и принята в качестве общей доклинической модели для изучения термина «новорожденный человек» [6,7].Между этими двумя видами существует ряд важных сходств в структуре мозга, метаболизме, развитии [8,9] и физиологии сосудов головного мозга [10], которые делают поросят подходящими для трансляционных исследований PA / HIE. Недавно мы опубликовали модель PA / HIE новорожденного поросенка [11], которая выявила основные отличительные признаки PA / HIE человека и была способна вызвать значительное повреждение нейронов, но не включала в себя манипуляции, которые никогда или очень редко происходят у людей, такие как двусторонняя сонная артерия. окклюзия или преходящая геморрагическая гипотензия.
В настоящем исследовании мы намеревались изучить ход изменений интерстициального pH головного мозга (pH головного мозга ) во время PA и подострой фазы развития HIE на нашей модели поросят. У пациентов с ГИЭ, использующих методы магнитно-резонансной спектроскопии (MRS) в возрасте <2 недель, уровни внутриклеточного pH головного мозга (pH –) были значительно повышены [12]. Этот алкалоз сохранялся в течение месяцев и коррелировал с неблагоприятным неврологическим исходом, а описанное изменение pH может быть одним из признаков так называемого вторичного энергетического сбоя [13,14].Однако изменения pH i могут не отражать изменения pH мозга , поскольку трансмембранные градиенты pH могут изменяться во время развития HIE, и, кроме того, внутриклеточный и внеклеточный pH имеют разные цели, с помощью которых они могут изменять активность мозга и потребление энергии [ 15]. Имеются очень ограниченные данные об изменениях pH головного мозга , вызванных PA / HIE у поросят [16], и в этих исследованиях не отслеживалось изменение pH головного мозга более чем через 4 часа после завершения гипоксически-ишемического стресса.Теперь мы сообщаем количественные данные цереброкортикального pH мозга в нашей хорошо охарактеризованной модели PA / HIE у поросят как во время PA, так и в первые 24 часа развития HIE.
Материалы и методы
Все экспериментальные процедуры с участием животных были одобрены в три этапа. Во-первых, подробный план эксперимента был тщательно рассмотрен и одобрен Комитетом по институциональному уходу и использованию животных Университета Сегеда (IACUC, на венгерском языке: SZTE Munkahelyi Állatjóléti Bizottság).Во-вторых, одобрение одобренного IACUC экспериментального плана было запрошено у Национального этического комитета по экспериментам на животных (на венгерском: Állatkísérletes Tudományos Etikai Tanács, ÁTET). В-третьих, Национальное управление безопасности пищевых продуктов и здоровья животных округа Чонград, Венгрия, от имени венгерского правительства выдало разрешение на основании рекомендации ÁTET (номер разрешения: XIV./1414/2015). Все эксперименты на животных соответствовали (1) руководящим принципам Научного комитета экспериментов на животных Венгерской академии наук (обновленный Закон и постановления о защите животных: 40/2013.(II. 14.) Правительство Венгрии), (2) Директива ЕС 2010/63 / EU о защите животных, используемая для научных исследований, и (3) с руководящими принципами ARRIVE. Кроме того, мы заявляем, что все процедуры в настоящем исследовании были выполнены на анестезированных животных, а также что все животные были анестезированы и лечились анальгетиками вместе с интенсивным мониторингом показателей жизнедеятельности в течение периода наблюдения (24 часа) без ожидаемой или наблюдаемой смертности. В конце экспериментов животных умерщвляли передозировкой пентобарбитала натрия (300 мг, Release; Wirtschaftsgenossenschaft deutscher Tierärzte eG, Гарбсен, Германия).
Новорожденных (≤ 1 дня) самцов свиней Ландрас (масса тела: 1,5–2,5 кг, n = 16) были получены от местной компании (Pigmark Ltd., Co., H-6728, Rózsamajor út 13., Szeged, Венгрия). ) и доставлен в лабораторию утром в день экспериментов. Анестезию вызывали тиопенталом натрия (45 мг / кг внутрибрюшинно; Sandoz, Kundl, Австрия). Поросят интубировали с помощью трахеотомии и искусственно вентилировали респиратором для мелких животных с регулируемым давлением нагретым увлажненным медицинским воздухом (21% O 2 , баланс N 2 ), который можно было дополнительно дополнить O 2 .Параметры дыхания (фракция вдыхаемого O 2 : 0,21–0,25; частота дыхания (ЧД): 30–35 об / мин, пиковое давление на вдохе: 120–135 мм вод. Ст. 2 O) были скорректированы для поддержания значений газов крови и O 2 насыщенность в физиологическом диапазоне. Правую бедренную вену катетеризовали в асептических условиях для поддержания анестезии / обезболивания болюсной инъекцией морфина (100 мкг / кг; Teva, Петах-Тиква, Израиль) и мидазолама (250 мкг / кг; Torrex Pharma, Вена, Австрия), затем при непрерывном вливании морфина (10 мкг / кг / ч), мидазолама (250 мкг / кг / ч) и жидкостей (5% глюкозы, 0.45% NaCl 3–5 мл / кг / ч). Второй катетер был помещен в правую сонную артерию для непрерывного мониторинга среднего артериального кровяного давления (MABP) и частоты сердечных сокращений (HR). Эта артерия была выбрана, поскольку перевязка бедренной артерии могла бы привести к критической ишемии задней конечности в течение 24-часового периода ревентиляции (личные наблюдения), напротив, односторонняя окклюзия сонной артерии, как было показано, не влияет на церебральный кровоток [17]. Ректальную температуру измеряли непрерывно и поддерживали в физиологическом диапазоне (38.5 ± 0,5 ° C) с сервоуправляемыми нагревательными и охлаждающими подушками с циркуляцией воды (Blanketrol III., Cincinnati Sub-Zero, Cincinnati, Ohio, USA). O 2 , MABP и HR постоянно контролировали с помощью монитора Hewlett-Packard M1094 (Пало-Альто, Калифорния, США) и записывали в режиме онлайн (MecifView, Арлингтон, Массачусетс, США). Эти параметры регистрировались на исходном уровне, во время ПА, а затем в течение 10 минут в начале каждого часа повторной вентиляции. Образцы артериальной крови (~ 300 мкл / образец) анализировали с помощью системы анализа крови (EPOC Blood Analysis, Epocal Inc., Оттава, Канада) на исходном уровне, в конце асфиксии; затем с выбранными интервалами до 20 часов для определения pH артериальной крови, газового давления, избытка оснований, центрального насыщения кислородом, концентраций гемоглобина, бикарбоната, глюкозы и лактата. Профилактические антибиотики вводили внутривенно: пенициллин (50 мг / кг / 12 ч, Тева, Петах-Тиква, Израиль) и гентамицин (2,5 мг / кг / 12 ч, Санофи, Париж, Франция). Мочевой пузырь вскрывали надлобковой пункцией через 12 часов после асфиксии.
pH
мозг измеренийИзмерения проводились внутри самодельной клетки Фарадея с частотой дискретизации 4 Гц.pH-селективные микроэлектроды (внешний диаметр наконечника: 50 мкм) были получены от Unisense (Орхус, Дания), тогда как стеклянные контрольные микроэлектроды (внешний диаметр наконечника: ~ 20 мкм и заполнены 150 мМ NaCl; сопротивление: ~ 4-5×10 10 Ом) были изготовлены самостоятельно и использовались с проволочными электродами Ag / AgCl. Электроды устанавливали на стереотаксические манипуляторы для калибровки в 3 различных нагретых (38 ° C) буферных растворах (pH: 6,10, 7,10 и 8,10 соответственно) перед каждым экспериментом. Голову поросенка фиксировали в стереотаксической раме, и после втягивания скальпа были сделаны две небольшие круговые трепанации черепа (Ø5 мм) над лобно-теменной корой, и твердая мозговая оболочка была осторожно удалена.Кончики pH и эталонных микроэлектродов устанавливали на глубину ~ 1-2 мм в обнаженную кору, а заземляющий электрод Ag / AgCl помещали под кожу головы. Сигналы электродов регистрировались, оцифровывались и сохранялись либо с использованием специального дифференциального электрометра (входное сопротивление> 10 14 Ом; отсечка нижних частот 16 Гц), 16-разрядного аналого-цифрового преобразователя (National Instruments, Остин, Техас) и программное обеспечение WinEDR (д-р Джон Демпстер, Университет Стратклайда, Великобритания) или с помощью программного обеспечения Microsensor Multimeter и SensorTrace Logger (Unisense, Орхус, Дания).Оценка записей проводилась в автономном режиме: с помощью линейного регрессионного анализа сигналы от калибровочных растворов были подогнаны к кривой, и данные были преобразованы в значения pH с использованием линейной интерполяции [15,18,19]. Поскольку метод позволяет стабильно непрерывно измерять pH мозга только в течение 3-4 часов, у разных животных были выбраны разные временные окна для оценки (исходный уровень, PA и первые 4 часа ревентиляции (n = 6), 8 th -14 th часа (n = 8) и 20 th -24 th часа (n = 3) повторной вентиляции, как показано в результатах).
Индукция асфиксии
После операции 1-часовой период восстановления позволил стабилизировать наблюдаемые физиологические параметры до получения их исходных значений. ПА вызывали переключением вентиляции с медицинского воздуха на гипоксически-гиперкапническую газовую смесь (6% O 2 , 20% CO 2 , баланс N 2 ) в течение 20 минут с одновременным снижением ЧД до 15 л / мин. и прекращение введения жидкости / глюкозы. Поросят (n = 13) повторно вентилировали (RR: 30 л / мин) медицинским воздухом в течение оставшегося времени эксперимента.
У трех дополнительных животных, до индукции PA, влияние градуированной нормоксической гиперкапнии на pH головного мозга оценивали по 5% ступенчатому увеличению вдыхаемого CO 2 от 0% до 20% в течение 7-8 минут каждое. После градуированной гиперкапнии нормокапния восстановилась в течение 30 мин. Этих животных умерщвляли передозировкой пентобарбитала натрия (300 мг, Release; Wirtschaftsgenossenschaft deutscher Tierärzte eG, Гарбсен, Германия) через 2 часа после ПА.
Невропатология
Целью невропатологического обследования было проверить, было ли повреждение нейронов, вызванное асфиксией, сходным с тем, о чем мы сообщали ранее с использованием этой модели PA / HIE через 24 часа после асфиксии [11].Соответственно, из 13 поросят, подвергшихся воздействию ПА, были включены только те животные, которых содержали в течение 24 часов (n = 8). Мозг восьми анестезированных животных перфузировали холодным (4 ° C) физиологическим раствором через катетеризованные общие сонные артерии через 24 часа после окончания асфиксии. Мозги осторожно извлекали и фиксировали погружением в 4% раствор параформальдегида при 4 ° C перед дальнейшей обработкой. Залитые в парафин срезы размером 4 мкм окрашивали гематоксилин-эозином и оценивали невропатологию с помощью светового микроскопа (Leica Microsystems, Wetzlar, Германия).Поврежденные нейроны были идентифицированы с использованием основных признаков темного эозинофильного цитозоля, а также пикнотических или разрушенных ядер. Степень повреждения цереброкортикальных нейронов лобной, теменной, височной и затылочной коры определялась с использованием ранее опубликованной системы оценок [11,20]. Вкратце, характер повреждения нейронов (нет <рассеянный <сгруппированный <панламинарный) определяли в 20-20 неперекрывающихся полях зрения при 20-кратном увеличении в каждой оцениваемой области коры.Затем каждой области были присвоены баллы (0–9) на основе частоты (% от 20 исследованных полей) наиболее серьезной наблюдаемой картины повреждения. Повреждение нейронов в скорлупе, таламусе и областях CA1 гиппокампа оценивали с помощью подсчета клеток в неперекрывающихся областях (в 5-5-3 полях зрения соответственно; при увеличении 200x), как в [11,21]. Повреждение нейронов в этих областях выражали как процент поврежденных нейронов.
Статистический анализ
Результаты были проанализированы в автономном режиме и нанесены на график с помощью SigmaPlot (v12.0, Systat Software Inc., Сан-Хосе, Калифорния, США) или среду MATLAB (Mathworks Inc., Натик, Массачусетс, США). Баллы невропатологии выражаются в виде медианы, 25–75 и 5–95 перцентилей. Все остальные данные выражены как среднее ± SEM. Нормальность была проверена с помощью теста Шапиро-Уилка. Корреляцию между данными P и CO 2 и pH мозга рассчитывали с помощью аппроксимации полиномиальной кривой MATLAB. Параметрические данные сравнивали с помощью одностороннего повторного измерения дисперсионного анализа (RM ANOVA) с последующим апостериорным тестом Стьюдента-Ньюмана-Кеулса.Уровень значимости (p) был установлен на уровне 0,05.
Результаты
pH
головного мозга изменений при развитии ЛА и ГИЭИндукция PA вызвала снижение pH головного мозга , которое продолжалось без выравнивания в течение 20 минут воздействия, во время которого pH головного мозга упал с исходного значения 7,21 ± 0,03 до 5,94 ± 0,11 к концу асфиксии (n = 6; Рис. 1A). После повторной вентиляции pH головного мозга был восстановлен до 7,0 за 29,4 ± 5,5 минут с последующей стабилизацией на уровне, который практически не отличался от исходного исходного уровня.После этого, начиная с 2 часов, pH головного мозга оставался немного ниже исходного уровня (в среднем на 0,10 ± 0,02 единицы pH) без каких-либо заметных изменений в любой наблюдаемой временной точке в течение 24-часового периода наблюдения (рис. 1B).
Рис. 1. pH головного мозга изменяется во время ПА и в период повторной вентиляции.
(A) pH головного мозга изменений (серые линии — отдельные записи, жирная черная линия — среднее) нанесены на график за 10 минут до начала асфиксии, во время асфиксии и в первый час ревентиляции.pH головного мозга прогрессивно падал во время асфиксии, показывая тяжелый цереброкортикальный ацидоз, к концу инсульта падение pH превышало 1,0 единицы pH практически у всех животных, подвергшихся асфиксии. Ревентиляция быстро восстановила pH головного мозга до исходного уровня. (B) рН головного мозга изменений после ПА и в течение 24-часового периода после ПА: после выздоровления от тяжелого ацидоза, вызванного ПА, в выбранных временных интервалах не было обнаружено никаких значительных изменений рН головного мозга PA и от 1 до 4 часов; n = 8 от 8 до 14 часов и n = 3 от 20 до 24 часов соответственно).B: исходный уровень, A: в конце 20 минут PA. Точки данных панели B представлены как среднее ± SEM. * p <0,05 по сравнению с . базовый уровень.
https://doi.org/10.1371/journal.pone.0233851.g001
В течение 20-минутного периода асфиксии насыщение O 2 упало до менее 30%, а ЧСС увеличилась с примерно 140 л / мин до почти 200 л / мин. мин в течение первых 2 минут, после чего они не показали значительных изменений, тогда как ответ в MABP был двухфазным с кратковременным повышением примерно до 90 мм рт.ст. с последующим более медленным снижением до уровня ниже исходного (рис. 2).Быстрое восстановление насыщения O 2 до уровня более 80% наблюдалось в течение первых 2–3 минут ревентиляции, параллельно с кратковременным увеличением ЧСС и САД до более 240 об / мин и 80 мм рт. восстановились до нормальных значений.
Рис. 2. Изменения гемодинамики и оксигенации во время ПА.
На всех панелях сплошные линии обозначают среднее значение, а серая заштрихованная область — SEM. (n = 13). После получения исходных значений была инициирована ПА, что сначала привело к кратковременному повышению среднего артериального давления (MABP, верхняя панель) и частоты сердечных сокращений (ЧСС, средняя панель), сопровождающему быстрое падение насыщения крови кислородом (пульсоксиметрия, нижняя панель).В то время как насыщение крови кислородом оставалось ~ 20% на протяжении всего периода асфиксии, после начального пика МАВД постоянно падало ниже исходного уровня, тогда как падение ЧСС было более умеренным, а ЧСС оставалась повышенной. Повторная вентиляция воздухом быстро восстановила насыщение кислородом и вызвала второе кратковременное повышение как МАД, так и ЧСС.
https://doi.org/10.1371/journal.pone.0233851.g002
Долгосрочный мониторинг физиологических параметров хорошо отражал ожидаемые эффекты ПА и повторной вентиляции.Концентрация гемоглобина в крови (исходный уровень: 8,0 ± 0,3 г / дл; динамика не показана), внутренняя температура тела (контролируется нагреванием, см. Методы), насыщение O 2 , MABP и HR были в пределах нормального диапазона на исходном уровне до PA и значения существенно не отличались от исходного уровня на протяжении всей выживаемости (рис. 3A – 3D). В дополнение к данным пульсоксиметрии анализ газов артериальной крови в конце ПА также подтвердил развитие десатурации центрального гемоглобина (с 94 ± 4 до 13 ± 4%) наряду с тяжелым ацидозом, гипоксией и гиперкапнией (рис. 3E – 3H).Действительно, падение pH артериальной крови (pH a ) с 7,53 ± 0,03 до 6,79 ± 0,02 было значительным и сопровождалось повышением P a CO 2 до 160 ± 6 мм рт. Значение pH оставалось более чем на 0,8 единицы pH выше, чем значение pH мозга . Уровни глюкозы и лактата в крови также были значительно повышены (рис. 3I и 3J) [22], что указывает на метаболический ответ на ПА. Значительное снижение избытка основания на 17,4 ± 1,5 ммоль / л и снижение концентрации бикарбоната (рис. 3K и 3L) вместе с низким pH a (6.79) в конце ПА указывают на то, что асфиксия развивалась намного дальше ключевых клинических критериев тяжелой БА у новорожденных людей (pH <7,0 и дефицит оснований ≥12–16 ммоль / л [3,4]). Ревентиляция быстро восстановила нормоксию в артериальной крови, но уровни P a CO 2 оставались слегка повышенными, хотя изменение было статистически значимым только через 4 часа. Избыток щелочи уже был нормализован к этому моменту времени, и pH — вернулся к 7,39 ± 0,02, нормальному для поросят [23]. Аналогичным образом уровни глюкозы и лактата в крови также вернулись к исходному уровню через 4 часа, хотя оба они все еще были значительно повышены через 1 час после ПА.
Рис. 3. Изменения физиологических параметров и химического состава крови во время ПА и последующего 24-часового периода ревентиляции.
Внутренняя температура животных (n = 13) поддерживалась в физиологическом диапазоне (38,5 ± 0,5 ° C) в течение всего эксперимента (A). Насыщение крови кислородом по данным пульсоксиметрии (B) и среднее артериальное кровяное давление (MABP, (C)) вернулись к исходным уровням вскоре после асфиксии, однако частота сердечных сокращений оставалась умеренно повышенной (D). Анализ газов артериальной крови показал, что асфиксия приводит к тяжелому ацидозу (E), гипоксемии (F), гиперкапнии (G) и центральной (артериальной крови) десатурации (H).Уровни глюкозы в плазме (I) и лактата (J) были заметно повышены вместе с большим падением избытка оснований (K) и значительным снижением концентрации бикарбоната в крови (L). Ревентиляция восстановила большинство нарушенных параметров к 4 часам, и впоследствии они существенно не отличались от исходных уровней, за исключением pH, который был восстановлен до нормальных значений [23], а не до слегка щелочного исходного уровня. B: исходный уровень, A: в конце 20 минут PA. Полоски и усы представляют собой среднее значение ± SEM, * p <0.05 и . базовые значения.
https://doi.org/10.1371/journal.pone.0233851.g003
Анализ нейропатологии подтвердил развитие ГИЭ, выявив среднее / тяжелое повреждение нейронов во всех исследованных неокортикальных областях (рис. 4A и 4C), а также в гиппокампе. Область CA1, таламус и скорлупа (рис. 4B). Эти данные согласуются с ранее описанными повреждениями нейронов с использованием того же стресса ПА [11].
Рис. 4. Повреждение нейронов, оцененное через 24 часа после ПА.
(A) Репрезентативные микрофотографии, показывающие поврежденные красные нейроны через 24 часа после асфиксии в области гиппокампа CA1, скорлупе и таламусе (масштабная шкала: 100 мкм) (B) Подсчет клеток выявил умеренное повреждение нейронов в этих областях (n = 8, среднее ± SEM). (C) Асфиксия также вызывала умеренное / тяжелое повреждение коры головного мозга, показанное средними / высокими баллами невропатологии (линии, прямоугольники и усы представляют собой медианное значение, 25 -й -75 -й и 5 -й -95 -й процентиля соответственно).
https://doi.org/10.1371/journal.pone.0233851.g004
pH
головного мозга изменений во время градуированной нормоксической гиперкапнииЭти эксперименты были выполнены для оценки вклада респираторного компонента в изменения pH головного мозга, зарегистрированные во время ПА. Пошаговое увеличение вдыхаемого CO 2 на 5% (рис. 5A) привело к пропорциональному ступенчатому снижению pH головного мозга (рис. 5B и 5C). Анализ газов артериальной крови выявил аналогичное постепенное снижение pH a , таким образом, разница между pH головного мозга и pH a осталась неизменной во время гиперкапнии (рис. 5B).Максимальные изменения наблюдались при вдыхании 20% CO 2 , когда pH a упал с 7,52 ± 0,06 до 6,98 ± 0,02, тогда как pH головного мозга снизился с 7,32 ± 0,01 до 6,77 ± 0,02. Изменения pH головного мозга и pH a были полностью обращены восстановлением нормокапнии.
Рис. 5. Церебральный ацидоз, вызванный градуированной нормоксической гиперкапнией.
(A) pH головного мозга изменяется во время градуированной нормоксической гиперкапнии, вызванной вентиляцией с 5–20% CO. 2 с последующим восстановлением нормокапнии (серые линии — отдельные записи, жирная черная линия — среднее значение).(B) Одновременное снижение pH a и pH головного мозга во время градуированной нормоксической гиперкапнии соответствовало повышению P a CO 2 , значения были (мм рт. : 84,7 ± 9,0, 15%: 107,0 ± 6,7, 20%: 120,3 ± 8,2 (среднее ± SEM; n = 3). Соответствующие значения P a O 2 были (мм рт. Ст.) 5%: 75,5 ± 12,8, 10%: 78,2 ± 11,3, 15%: 85,5 ± 8,2, 20%: 84,5 ± 9,8, (среднее ± SEM; n = 3 ). (C) Линейная регрессия показывает тесную корреляцию между P a CO 2 и pH мозга (R 2 = 0.8546) значения, полученные при градуированной гиперкапнии (5–20% CO 2 ).
https://doi.org/10.1371/journal.pone.0233851.g005
Обсуждение
В этом исследовании мы представляем in vivo зарегистрированных в реальном времени значений pH мозга во время ПА и подострой фазы ГИЭ в модели трансляционной ПА / ГИЭ поросят. Основные результаты настоящего исследования следующие: (1) наша экспериментальная модель выявила PA, отражающую ее основные отличительные признаки, и вызвало повреждение нейронов, соответствующее умеренному / тяжелому HIE, выявленному нейропатологией; (2) цереброкортикальный pH головного мозга резко упал в ответ на PA, ацидоз превысил одну единицу pH в головном мозге по сравнению с артериальной кровью; (3) повторная вентиляция / реоксигенация позволила восстановить pH головного мозга до исходного уровня, затем pH головного мозга оставался стабильным на уровне исходного уровня без значительных сдвигов в течение 24-часового периода наблюдения.
Каждая модель PA / HIE с использованием постнатальных животных неизбежно несет ограничение, заключающееся в том, что PA индуцируется после, а не до / во время кардиореспираторной адаптации к внематочной жизни. Однако мы полагаем, что в нашем исследовании этот недостаток был сведен к минимуму за счет двух факторов. Во-первых, мы использовали истинно новорожденных поросят, поэтому их уязвимость к ПА с наименьшей вероятностью существенно изменилась в постнатальном развитии. Во-вторых, мы выявили ПА, что привело к достаточно серьезным изменениям рН артериальной крови и газов крови, которые, как известно, сигнализируют о развитии ГИЭ у человека.Это утверждение подтверждается клиническим исследованием, в котором сообщалось о значительных различиях в степени ацидоза (pH a : 6,75 ± 0,18 против 6,90 ± 0,18) и гиперкапнии (P a CO 2 : 141 ± 37 против P a. CO 2 : 94 ± 22 мм рт. В нашей модели соответствующими значениями были pH a : 6,79 ± 0,02 и P a CO 2 : 160 ± 6 мм рт. Ст., Что близко соответствовало данным из группы пациентов с HIE.Интересно, что практически идентичные значения в образцах крови из пупочной артерии (pH a : 6,69 ± 0,04 и P a CO 2 : 156 ± 4 мм рт. поросенок как модельный вид PA / HIE [25]. Мы разработали и использовали этот протокол PA / HIE для проверки предполагаемого нейрозащитного эффекта молекулярного водорода [11]. Мы сообщаем о практически идентичных повреждениях неокортикальных, гиппокампальных и подкорковых нейронов в настоящем исследовании по сравнению с таковыми в [11].Основываясь на аналогичных результатах невропатологии, мы можем предположить, что хирургические манипуляции, связанные с измерениями pH головного мозга , не повлияли на развитие HIE в этом исследовании, что подтверждает трансляционную ценность нынешних результатов pH мозга .
Значение pH головного мозга в определении неврологического исхода после гипоксически-ишемического стресса давно признано [26]. Однако количественные данные об изменениях pH головного мозга во время / после ПА в моделях PA / HIE у поросят в литературе очень скудны [16,27,28].Бендер и др. . [16] оценили pH головного мозга , используя аналогичную методику у поросят в возрасте 1-3 дней. ПА вызывали также гипоксически-гиперкапнической газовой смесью (5-8% O 2 -7% CO 2 ) в течение 30 мин. В конце PA измеренное значение pH головного мозга составило 6,26 ± 0,14, что примерно на 0,3 единицы pH выше, чем в нашем исследовании, и, вероятно, отчасти из-за гораздо более низких значений P a CO 2 (61 ± 1 против . 160 ± 6 мм рт. Ст. [16] против в настоящем исследовании, соответственно).После PA ревентиляция началась с вентиляцией 100% O 2 , кроме того, вводили бикарбонат натрия (2 мэкв / кг, внутривенно) для быстрой коррекции артериального pH. Оба эти вмешательства, вероятно, уменьшат трансляционную ценность исследования Bender et al . [16], поскольку они не включены в текущие рекомендации по уходу за новорожденными и могли повлиять на восстановление pH головного мозга , которое было завершено за 90 минут. Более того, не было значительного повреждения нейронов по сравнению с ложно прооперированными животными, за исключением экспериментов, в которых ПА была объединена с геморрагической гипотензией, что позволяет предположить, что примененная ПА как таковая была недостаточно серьезной, чтобы вызвать ГИЭ.Корбетт и др. . [27] использовали MRS у поросят в возрасте 8 ± 3 дней для определения pH – во время и после ишемии, но не истинного PA. Неполная церебральная ишемия была вызвана сочетанием двусторонней окклюзии сонной артерии и геморрагической гипотензии в течение 25 минут с последующей реперфузией в течение 90 минут [28]. Во время ишемии развился тяжелый ацидоз, который зависел от уровня глюкозы в крови во время стресса. PH мозга и упал ниже 5,6 у откормленных поросят, которые отреагировали на ишемию гипергликемией (9.4-15 ммоль / л), тогда как у голодных поросят, реагирующих на гипогликемию (1,4-2,6 ммоль / л), надир в конце ишемии составлял всего лишь pH ± ± 6,6. После реперфузии pH – снова нормализовали в течение 90-минутного периода наблюдения.
Из обсужденных выше исследований ясно, что более высокие уровни гиперкапнии, церебрального кровотока и глюкозы в крови способствуют развитию церебрального ацидоза во время ПА. Повышение P a CO 2 до 140–160 мм рт. Ст., Наблюдаемое как у человека, так и у поросят, одно только снижает pH i до 6.5–6,6 при нормоксических условиях [29]. Также в настоящем исследовании мы приводим доказательства того, что в нормоксических условиях вдыхание только 20% CO 2 (P a CO 2 : 120 мм рт. Ст.) Приводит к снижению pH головного мозга до 6,8. Используя линейную регрессию (рис. 4C), мы затем подсчитали, что развивающаяся гиперкапния (при P и CO 2 : 160 мм рт. полученные результаты. Дальнейшее подкисление во время ПА будет в основном определяться увеличением скорости анаэробного гликолиза, подпитывающего последующее производство молочной кислоты.Скорость гликолиза ограничивается доставкой глюкозы в гипоксический мозг, так как ее снижение за счет снижения мозгового кровотока [16] или уровня глюкозы в крови [28] ослабляет развитие ацидоза. Ранее мы показали, что в нашей модели PA значительная церебральная ишемия не развивается [11], так как у большинства животных падение MABP в течение 20 минут PA (рис. 4) не достигает нижнего предела ауторегуляции кровотока [30]. По общему признанию, PA в нашей модели недостаточно долго для развития гипотензии и брадикардии, обычно наблюдаемых у детей с тяжелой асфиксией, однако он может хорошо представлять фазу PA до того, как механизмы сердечно-сосудистой адаптации будут исчерпаны и, вероятно, наиболее выражен pH головного мозга переделки происходят.Таким образом, наше текущее исследование предоставляет новые убедительные экспериментальные доказательства того, что не только церебральная ишемия, но и bona fide PA, сочетающая клинически значимые уровни гипоксии, гиперкапнии и гипергликемии, достаточна для того, чтобы вызвать достаточно серьезный церебральный ацидоз (pH головного мозга <6,0). чтобы сильно повлиять на жизнеспособность нейронов [31]. Разница в 0,8 единиц pH между pH головного мозга и pH a сигнализирует о> 6-кратном градиенте H + через гематоэнцефалический барьер, что соответствует предыдущим результатам о том, что гематоэнцефалический барьер созревает в новорожденных свиней и без серьезной опасности ПА [32].
Изменения pH головного мозга могут играть важную патофизиологическую роль не только во время острой ПА, но также после повторной вентиляции / реоксигенации. Ранее сообщалось, что уровень pH мозга у поросят стабилен после восстановления после ПА, но не наблюдалось более четырех часов восстановления [16]. Напротив, наше текущее исследование продлило период наблюдения после асфиксии до 24 часов. Мы не обнаружили серьезных вторичных изменений в pH головного мозга в этой модели PA / HIE поросят в течение 24-часового периода после PA.Наши настоящие результаты согласуются с предыдущими данными о pH и , полученными с помощью MRS на модели HIE у поросят с использованием гипоксически-ишемического стресса вместо PA [33]. В этом исследовании pH i оставался на исходном уровне после восстановления от ишемического стресса в течение 48 часов, кроме того, развитие вторичного энергетического сбоя не отражалось на изменениях pH i в этот период времени. В исследовании MRS на людях pH – также был нормальным (7,13 ± 0,05) у новорожденных с нормокапническим состоянием, подвергшихся асфиксии в течение первого дня жизни [34], в соответствии с нашим настоящим исследованием.Важно отметить, что алкалоз мозга развился в течение следующих дней, а затем сохранялся в течение недель, даже месяцев [13,34]. Однако мы хотели бы отметить, что наша модель поросят PA / HIE представляет подгруппу детей с асфиксией, которым требуется интубация и респираторная поддержка, но не тех, кто дышит спонтанно. В то время как младенцы на искусственной вентиляции легких остаются нормокапническими, младенцы со спонтанным дыханием часто гипервентилируют и у них может развиться гипокапния [24]. Этот ответ может отражать относительную гипервентиляцию, вторичную по отношению к индукции гипоксического гипометаболизма, что приводит к снижению продукции CO 2 [35].Снижение P и CO 2 из-за гипервентиляции имеет тенденцию к повышению pH головного мозга , и это понятие представляет особый интерес, поскольку гипокапния была идентифицирована как независимый фактор риска неблагоприятного неврологического исхода [36,37]. У поросят умеренной гипокапнии было достаточно, чтобы вызвать снижение церебральной перфузии с одновременным увеличением pH и уровня лактата даже при отсутствии асфиксии [38]. Действительно, наши результаты косвенно предполагают, что поддержание нормокапнии / легкой гиперкапнии может предотвратить вторичные изменения pH головного мозга.В недавней работе, направленной на создание трансляционно валидной модели асфиксии при рождении на мелких животных у крыс и морских свинок, было обнаружено, что более высокие уровни P a CO 2 во время симулированной асфиксии при рождении и постепенное восстановление нормокапнии впоследствии оказывали положительное влияние на церебральный метаболический ацидоз, уровни кислорода и лактата [39]. Очевидно, что необходимы дальнейшие исследования для изучения этих эффектов на модели поросят. У нашего текущего исследования были некоторые дополнительные ограничения. Мы собрали данные о pH головного мозга из неокортекса, используя только один уровень асфиксии, оставив неизученными другие области мозга и уровни стресса.
Выводы
Наша трансляционная модель PA / HIE поросенка воспроизводит все основные признаки асфиксии при рождении и вызывает значительное повреждение нейронов без использования окклюзии сонной артерии и / или геморрагической гипотензии. В этой модели pH головного мозга опускается ниже 6,0, ± 0,8 единицы pH ниже, чем pH – во время PA, устанавливая патогенетическую роль тяжелого ацидоза в повреждении нейронов. Однако вторичные изменения pH головного мозга после восстановления исходных уровней не наблюдались в течение 24-часового подострого периода, возможно, из-за предотвращения вторичной гипокапнии с помощью контролируемой механической вентиляции.
Список литературы
- 1. Lawn JE, Manandhar A, Haws RA, Darmstadt GL. Снижение одного миллиона детских смертей от асфиксии при рождении — обзор пробелов и приоритетов систем здравоохранения. Система политики восстановления исцеления. 2007; 5: 1–10. pmid: 17506872
- 2. Volpe JJ. Неонатальная энцефалопатия: неадекватный термин для гипоксически-ишемической энцефалопатии. Энн Нейрол. 2012. 72: 156–166. pmid: 22926849
- 3. Аззопарди Д. В., Стром Б., Эдвардс А. Д., Дайет Л., Холлидей Г. Л., Ющак Е. и др.Умеренное переохлаждение для лечения перинатальной асфиксической энцефалопатии. N Engl J Med. 2009; 361: 1349–1358. pmid: 19797281
- 4. Торесен М. Кого следует охлаждать после перинатальной асфиксии? Semin Fetal Neonatal Med. 2015; 20: 66–71. pmid: 25667126
- 5. Yager JY, Ashwal S. Модели перинатального гипоксически-ишемического повреждения мозга на животных. Pediatr Neurol. 2009. 40: 156–167. pmid: 19218028
- 6. Бустад Л.К., Макклеллан Р.О. Свиньи в биомедицинских исследованиях. Наука.1966; 152: 1526–1530. pmid: 17788035
- 7. Бронировать SA, Bustad LK. Фетальные и неонатальные свиньи в биомедицинских исследованиях. Am J Anim Sci. 1974; 38: 997–1002.
- 8. Конрад М.С., Джонсон Р.В. Домашний поросенок: важная модель для исследования последствий травм в раннем возрасте для развития нервной системы. Анну Rev Anim Biosci. 2015; 3: 245–264. pmid: 25387115
- 9. Доббинг Дж., Сэндс Дж. Сравнительные аспекты всплеска роста мозга. Early Hum Dev.1979; 311: 79–83.
- 10. Busija DW. Церебральное кровообращение у плода и новорожденного. В: Беван Р.Д., Беван Дж. А., редакторы. Циркуляция человеческого мозга. Humana Press; 1994. С. 259–269.
- 11. Немет Дж., Тот-Сзуки В., Варга В., Ковач В., Ремцо Дж., Домоки Ф. Молекулярный водород обеспечивает нейрозащиту в трансляционной модели гипоксически-ишемической энцефалопатии у поросят. J. Physiol Pharmacol. 2016; 67: 677–689.
- 12. Azzopardi D, Wyatt JS, Cady EB, Delpy DT, Baudin J, Stewart AL, et al.Прогноз новорожденных с гипоксически-ишемической травмой головного мозга, оцененный с помощью фосфорной магнитно-резонансной спектроскопии. Pediatr Res. 1989; 25: 445–451. pmid: 2717259
- 13. Робертсон Нью-Джерси, Кокс И.Дж., Коуэн FM, Советник С.Дж., Аззопарди Д., Эдвардс А.Д. Церебральный внутриклеточный молочнокислый алкалоз, сохраняющийся через несколько месяцев после неонатальной энцефалопатии, измеренный с помощью магнитно-резонансной спектроскопии. Pediatr Res. 1999; 46: 287–296.
- 14. Робертсон, штат Нью-Джерси, Коуэн FM, Кокс И.Дж., Эдвардс А.Д.Щелочной внутриклеточный pH мозга после неонатальной энцефалопатии. Энн Нейрол. 2002; 52: 732–742. pmid: 12447926
- 15. Хельми М.М., Толнер Э.А., Ванхатало С., Воипио Дж., Кайла К. Алкалоз мозга вызывает приступы асфиксии при рождении, что предполагает терапевтическую стратегию. Энн Нейрол. 2011; 69: 493–500. pmid: 21337602
- 16. Бендер TM, Джонстон JA, Manepalli AN, Mink RB. Связь между pH ткани головного мозга и повреждением головного мозга при асфиксии у поросят. Реанимация. 2003. 59: 243–254.
- 17. Laptook AR, Stonestreet BS, Oh W. Влияние перевязки сонной артерии на кровоток в головном мозге новорожденных поросят. Brain Res. 1983; 276: 51–54.
- 18. Voipio J, Kaila K. Межклеточный PCO2 и pH в срезах гиппокампа крысы, измеренные с помощью нового быстрого чувствительного к CO2 / H + микроэлектрода на основе гелевой мембраны из ПВХ. Pflügers Arch Eur J Physiol. 1993; 423: 193–201. pmid: 8391679
- 19. Voipio J, Pasternack M, MacLeod K. Ионно-чувствительные микроэлектроды.2-е редактирование. Микроэлектродные методы — Справочник Плимутской мастерской. 2-е редактирование. Кембридж: Компания биологов с ограниченной; 1994. С. 275–316.
- 20. Фостер К.А., Колдиц П.Б., Лингвуд Б.Е., Берк С., Данстер К.Р., Робертс М.С. Улучшенная модель выживаемости при гипоксии / ишемии у поросят, подходящая для исследований нейрозащиты. Brain Res. 2001; 919: 122–131.
- 21. Oláh O, Tóth-Szki V, Temesvári P, Bari F, Domoki F. Отсроченная нервно-сосудистая дисфункция облегчается водородом у новорожденных свиней, подвергшихся асфиксии.Неонатология. 2013; 104: 79–86. pmid: 23859876
- 22. Randall GCB. Исследования влияния острой асфиксии на плод свиньи в утробе матери. Biol Neonate. 1979; 36: 63–69. pmid: 38863
- 23. Randall GCB. Значения pH и напряжения газов в крови у нормального поросенка в течение первых 48 часов жизни. Biol Neonate. 1972; 20: 68–73. pmid: 5063638
- 24. Энгл В. Д., Лэпток А. Р., Перлман Дж. М.. Острые изменения артериального давления углекислого газа и кислотно-основного статуса, а также ранние неврологические характеристики у доношенных детей после перинатальной асфиксии.Реанимация. 1999; 42: 11–17.
- 25. Randall GC. Взаимосвязь pH и pCO2 артериальной крови с жизнеспособностью новорожденного поросенка. Может J Comp Med. 1971; 35: 141–146.
- 26. Siesjö BK. Кислотно-основной гомеостаз в головном мозге: физиология, химия и нейрохимическая патология. Prog Brain Res. 1985. 63: 121–154.
- 27. Corbett RJT, Laptook AR, Nunnally RL, Hassan A, Jackson J. Внутриклеточный pH, лактат и энергетический метаболизм в неонатальном мозге во время частичной ишемии, измеренные in vivo с помощью спектроскопии ядерного магнитного резонанса 31P и 1H.J Neurochem. 1988; 51: 1501–1509. pmid: 3171590
- 28. Laptook AR, Corbett RJT, Nunnally RL. Влияние концентрации глюкозы в плазме на церебральный метаболизм при частичной ишемии у новорожденных поросят. Инсульт. 1990; 21: 435–440.
- 29. Corbett RJT, Laptook AR, Hassan A, Nunnally RL. Количественное определение ацидоза в ткани головного мозга новорожденных с использованием резонансного пика ЯМР 31P фосфоэтаноламина. Magn Reson Med. 1988. 6: 99–106. pmid: 3127649
- 30. Лэпток А, Стоунстрит Б.С., Оу У.Ауторегуляция мозгового кровотока у новорожденного поросенка: региональные различия в снижении кровотока при гипотонии. Early Hum Dev. 1982; 6: 99–107.
- 31. Ли П-А, Шамлу М., Кацура К., Смит М. Л., Сиешо Б.К. Критические значения глюкозы в плазме при обострении ишемического повреждения головного мозга: корреляция с внеклеточным pH. Neurobiol Dis. 1995; 2: 97–108. pmid: 8980013
- 32. Стоунстрит Б.С., Берджесс Г.Х., Серр Х.Ф. Целостность гематоэнцефалического барьера, вода и электролиты мозга при гипоксии / гиперкапнии и гипотонии у новорожденных поросят.Brain Res. 1992; 590: 263–270.
- 33. Лорек А., Такей Й., Кэди Э. Б., Вятт Дж. С., Пенрис Дж., Эдвардс А. Д. и др. Отсроченный («вторичный») сбой мозговой энергии после острой гипоксии-ишемии у новорожденного поросенка: непрерывные 48-часовые исследования с помощью фосфорной магнитно-резонансной спектроскопии. Pediatr Res. 1994; 36: 699–706. pmid: 7898977
- 34. Хоуп П.Л., Кэди Э.Б., Тофтс П.С., Гамильтон П.А., Костелло АМДЛ, Делпи Д.Т. и др. Церебральный энергетический метаболизм, изученный с помощью фосфорной ЯМР-спектроскопии у здоровых младенцев и младенцев, страдающих удушьем при рождении.Ланцет. 1984. 324: 366–370.
- 35. Mortola JP. Как новорожденные млекопитающие справляются с гипоксией. Физиология дыхания. 1999. С. 95–103.
- 36. Lingappan K, Kaiser JR, Srinivasan C, Gunn AJ. Связь между PCO2 и неблагоприятным исходом у младенцев с гипоксической ишемической энцефалопатией средней и тяжелой степени. Pediatr Res. 2016; 80: 204–208. pmid: 27049290
- 37. Паппас А., Шанкаран С., Лэпток А.Р., Лангер Дж.К., Бара Р., Эренкранц Р.А. и др. Гипокарбия и неблагоприятные исходы при неонатальной гипоксически-ишемической энцефалопатии.J Pediatr. 2011; 158: 752–758. pmid: 21146184
- 38. Рингер С.К., Клаузен Н.Г., Шпильманн Н., Вайс М. Влияние умеренной и тяжелой гипокапнии на внутримозговую перфузию и оксигенацию тканей мозга у поросят. Педиатр Анаест. 2019; 29: 1114–1121. pmid: 31472089
- 39. Поспелов А.С., Пушкаржов М., Кайла К., Войпио Дж. Эндогенные реакции сохранения мозга в отношении pH мозга и PO2 в модели асфиксии на грызунах. Acta Physiol (Oxf). 2020; e13467. pmid: 32174009
Метаболомическое профилирование при перинатальной асфиксии: многообещающая новая область
Метаболомика, новейшая «омическая» технология, определяется как всестороннее исследование всех низкомолекулярных биохимических веществ, «метаболитов», присутствующих в организме.Как подход системной биологии, метаболомика имеет огромный потенциал для улучшения нашего понимания перинатальной асфиксии и неонатальной гипоксически-ишемической энцефалопатии, уникальным образом обнаруживая быстрые изменения биохимических путей в ответ на гипоксическую среду. Изучение метаболомных биомаркеров в ближайшем неонатальном периоде — нетривиальная задача и требует ряда специфических соображений, характерных только для этого заболевания и данной популяции. Набор четко определенной когорты требует стандартизированного многоцентрового набора с широкими критериями включения и участия ряда многопрофильных сотрудников.Минимально инвазивный сбор биопрепаратов является приоритетом для открытия биомаркеров. Пуповинная кровь представляет собой идеальную среду, поскольку большие объемы могут быть легко извлечены и сохранены, а образец не зависит от прогрессирования послеродового заболевания. Безупречный биобанкинг и фенотипирование необходимы для обеспечения достоверности результатов метаболомики. В данной статье представлен обзор современного состояния в области метаболомики при перинатальной асфиксии и неонатальной гипоксически-ишемической энцефалопатии.Мы подробно описываем соображения, необходимые для обеспечения высококачественного отбора проб и анализа, чтобы поддержать научный прогресс в этой важной области.
1. Введение
За последнее десятилетие поиск полезных биомаркеров для точного прогнозирования тяжести травмы при перинатальной асфиксии и гипоксически-ишемической энцефалопатии (ГИЭ) стал предметом растущего интереса в неонатальных исследованиях. Несмотря на потенциал многих многообещающих маркеров, лишь немногие исследования прошли валидацию или смогли применить их результаты в клинической практике [1].Метаболомика представляет собой уникальный снимок метаболизма человека, отражающий фенотип тела и, в конечном итоге, его состояние здоровья в определенный момент времени. Способность метаболомики измерять быстрые изменения метаболизма имеет потенциал для новых разработок в неонатальной медицине [2].
Перинатальная асфиксия может возникать в результате ряда факторов риска до и во время родов, включая тяжелую материнскую анемию или гипертензию, травматические роды или нарушение кровообращения в пуповине во время родов, что приводит к прекращению газообмена дыхательных путей плода.Это остается постоянной проблемой во всем мире, возникающей у 20 доношенных живорождений на 1000, из которых у 2-3 на 1000 разовьется последующая энцефалопатия. В развивающихся странах этот показатель значительно выше — 5–10 на 1000 [3, 4]. HIE — это развивающийся процесс, являющийся кульминацией «двухступенчатой» травмы. Первоначальный церебральный гипоксический и / или ишемический инсульт характеризуется переключением на анаэробный метаболизм и накоплением реактивных метаболитов, что приводит к серьезному истощению энергии. В то время как нейронные клетки демонстрируют временную или «латентную» фазу восстановления после первоначального удара мозговой энергии, через 6–48 часов за этим следует вторичное повреждение из-за волны дальнейшего энергетического сбоя; образование свободных радикалов, протеаз и каспаз, которые приводят к необратимому повреждению нервных клеток через некроз и апоптоз [5].Серьезные последствия ГИЭ включают двигательные и когнитивные нарушения [6], а также потерю зрения, потерю слуха, поведенческие трудности или длительную эпилепсию у 30% младенцев [7, 8].
Появление терапевтической гипотермии впервые позволило нам вмешаться и изменить течение этого заболевания, повысив показатели выживаемости интактных животных [9]. К сожалению, для достижения эффективности гипотермия должна быть инициирована в течение первых 6 часов после рождения после «латентной» фазы [10]. Это усилило потребность как в ранней диагностике ГИЭ, так и в лучшем понимании его исходных патофизиологических механизмов.Современные маркеры, используемые для оценки тяжести травмы в рутинной клинической практике, ненадежны и не позволяют точно предсказать долгосрочный результат [11]. Срочно необходим быстрый, экономичный, воспроизводимый, неинвазивный и независимый от пользователя метод количественной оценки тяжести ГИЭ и вероятного прогноза [12].
Основные метаболические механизмы ГИЭ плохо изучены, особенно сложные взаимодействия отдельных метаболических путей. Текущее понимание травмы указывает на то, что гипоксия-ишемия запускает биохимический каскад событий [13], характеризующийся пониженным содержанием кислорода и глюкозы, который изменяет гомеостаз нейронов и глии.Поставка нейронами высокоэнергетических метаболитов, таких как аденозинтрифосфат (АТФ), уменьшается, и ионные насосы натрия / калия (Na + / K + ) перестают работать. Это приводит к деполяризации митохондриальной мембраны с последующим накоплением натрия и кальция параллельно с истощением запасов калия в клетках, что вызывает цитотоксический отек [14]. Внеклеточное накопление возбуждающих аминокислот в сочетании с внутриклеточным входом Ca 2+ ослабляет набухание нейрональных клеток [15].Более того, гипоксия-ишемия инициирует реакции окислительного стресса, поскольку уменьшение молекулярного кислорода сочетается с образованием активных форм кислорода, активных форм азота и нарушением окислительного фосфорилирования [16]. Все это способствовало переключению на анаэробный метаболизм и, как следствие, метаболическому ацидозу, который описывается нарушением удаления побочных продуктов метаболизма и дыхания, в частности, лактата и пирувата [17, 18]. Этот полный отказ митохондриальной активности головного мозга может иметь серьезные глобальные метаболические эффекты и в конечном итоге приводит к необратимой гибели клеток.
Метаболический ответ на гипоксию остается неясным, как и его роль в облегчении или ослаблении полученного повреждения. Мы больше не можем полагаться на редукционистский подход, который традиционно фокусировался на небольших количествах или отдельных метаболитах в отдельности, когда вероятно крупномасштабное нарушение нескольких путей. Интегративный подход к системной биологии необходим для понимания поведения всех биологических компонентов в системе, особенно их механистических взаимодействий.Метаболомика сочетает в себе высокопроизводительный анализ с теорией, биоинформатикой и статистикой вычислений [19, 20]. Следовательно, у него есть потенциал для выяснения механизмов заболевания при перинатальной асфиксии путем качественного или количественного описания активации и взаимодействия метаболических путей и, в конечном итоге, описания фенотипа младенца [21]. Уникальный метаболомный отпечаток гипоксии-ишемии может использоваться для определения тяжести травмы и прогнозирования ответа на лечение и потенциальных исходов для развития нервной системы.Изучение метаболомных биомаркеров в ближайшем неонатальном периоде требует ряда специфических соображений, характерных только для этого заболевания и данной популяции. В этой статье мы описываем текущие исследования в этой захватывающей области и уникальные проблемы, возникающие при изучении метаболомики при перинатальной асфиксии и ГИЭ.
2. Первые полевые работы
Huang et al. (1999) начали этот поиск с изучения раннего соотношения лактата и креатинина в моче у новорожденных, подвергшихся асфиксии, с помощью спектроскопии протонного ядерного магнитного резонанса ( 1 H-ЯМР).Они определили значение отношения лактата к креатинину 0,64 или выше в течение 6 часов после рождения, чтобы быть высокоспецифичным (100%) и чувствительным (94%) для прогнозирования развития ГИЭ (). Кроме того, среднее соотношение было значительно выше у младенцев, у которых был неблагоприятный исход в течение одного года жизни [22]. Метаболомный профиль мочи младенцев с клиническими признаками тяжелой асфиксии также был описан с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС), которая связала четыре энергетических и четыре метаболита окислительного стресса с хорошим и плохим исходом для младенца соответственно [23].Хотя эта первоначальная работа оказалась очень многообещающей, серьезность травмы, время сбора и исход новорожденных были плохо определены.
3. Модели на животных
В нескольких исследованиях использовались животные модели асфиксии / гипоксии для изучения метаболических изменений, и был предложен ряд предполагаемых метаболомных отпечатков пальцев. Накопление и отсроченное извлечение промежуточных продуктов цикла Кребса (например, фумарата, сукцината, малата и альфа-кетоглутарата) описано в ряде моделей [24–27].Эти энергетические метаболиты являются продуктом перехода к анаэробным условиям, что подтверждается накоплением лактата [22, 28, 29] и митохондриальной дисфункцией [30], ведущей к нарушению цикла Кребса. Из-за пониженной доступности АТФ эти метаболиты не могут попасть в дыхательную цепь для производства энергии и были предложены в качестве возможных кофакторов при образовании лактата [24].
Измененные аминокислотные профили были показаны в ряде исследований на животных [26, 31, 32]. Было показано, что аминокислотные отношения аланина к аминокислотам с разветвленной цепью (BCAA) и глицина к BCAA в сочетании с сукцинатом энергетических метаболитов и пропионил- L -карнитином сильно коррелируют (= 0.96) с продолжительностью гипоксии на модели поросенка [24]. BCAA действуют как альтернативные источники энергии для мозга и мышц [32, 33]. Их заметное присутствие в метаболомных исследованиях было подтверждено также у новорожденных с асфиксией [15] и может иллюстрировать их мобилизацию в условиях пониженной продукции АТФ. Однако валин, BCAA, который, как известно, увеличивается во время эксайтотоксичности, был описан как способствующий гипоксии-ишемии, способствуя возвращению азота в астроциты [34].
Нарушение клеточной мембраны, возможно, через высвобождение свободных радикалов кислорода, которые вызывают окислительную деградацию липидов и дисфункцию мембраны, было проиллюстрировано заметным повышением содержания арахидоновой кислоты, составляющей фосфолипидного бислоя [25].Метаболомическое исследование нервной ткани выявило три дифференцирующихся метаболита (ЦДФ-холин, холин и ацетилхолин), которые участвуют в метаболизме глицерофосфолипидов [35], основного компонента клеточных мембран. Наконец, метаболиты в моче, которые отражают функцию почек, показали потенциал в прогнозировании смерти новорожденных поросят [30], отражая системную органную недостаточность, вызванную тяжелой гипоксией.
В целом, модели на животных внесли важный вклад в неонатальную медицину.В частности, трансляционные исследования такого рода предоставили доказательную базу для назначения терапевтической гипотермии новорожденным с ГИЭ, что в настоящее время является стандартом лечения [36]. Клинически гипоксически-ишемический инсульт непредсказуем, обычно происходит в перинатальном периоде, но точное время и продолжительность часто трудно определить. Модели на животных дают возможность контролировать время получения травмы, позволяя своевременно обнаруживать изменение метаболитов и выяснять механизмы заболевания.Генетическая изменчивость и изменчивость окружающей среды можно жестко регулировать, гарантируя, что фенотип является репрезентативным для повреждения, в отличие от динамической меж- и внутрииндивидуальной изменчивости у людей, которая требует большого количества выборок для статистического контроля [37]. Они также преодолевают этические проблемы, например, используя контрольную группу без лечения или нормотермии.
Несмотря на эти очевидные преимущества, животные модели могут не отражать сложные взаимодействия органов и множественные сопутствующие заболевания, особенно связанные с развитием нервной системы, связанные с ГИЭ.Существует множество моделей, но нет единого мнения о том, какая из них лучше всего имитирует патофизиологическое и клиническое состояние [38]. В результате исследования на животных различались по видам, критериям исхода, методам асфиксии, взятию образцов биологических образцов и метаболомным подходам, представленным в таблице 1.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылка: ссылка; 1 H-ЯМР: спектроскопия протонного ядерного магнитного резонанса ( 1 H-ЯМР); UPLC-MS: сверхэффективная жидкостная хроматография-квадрупольная времяпролетная масс-спектрометрия; UPLC-MS / MS: сверхэффективная жидкостная хроматография-тандемная масс-спектрометрия; ГХ / МС: двумерная газовая хроматография-масс-спектрометрия; ЖХ-МС / МС: тандемная жидкостная хроматография-масс-спектрометрия; FIA-MS / MS: анализ впрыска потока — тандемная масс-спектрометрия; BCAA: аминокислоты с разветвленной цепью; ЦСЖ: спинномозговая жидкость. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Помимо Beckstrom et al. [25], животные модели в этой области обычно оценивали неонатальную, но не клинически возникающую внутриутробную или перинатальную асфиксию. Модели новорожденных поросят вызвали системную гипоксию за счет снижения доли вдыхаемого кислорода (FiO 2 ) до 0,06–0,13; однако это не вызывает клинически сопутствующей ишемии, связанной с ГИЭ. Модель грызунов, созданная Ваннуччи, сочетает одностороннюю перевязку сонной артерии с 8% кислородом для имитации перинатальной асфиксии [39].Эта модель была использована Liu et al. Для оценки метаболитов ткани мозга у мышей на 7-й день в постнатальном периоде [34], которые первоначально считались эквивалентными человеческому младенцу при беременности 32–36 недель [40]. Выбор оптимальной животной модели, мозг которой эквивалентен мозгу доношенного новорожденного, остается спорным [41].
В вышеупомянутых исследованиях животных обычно умерщвляют вскоре после выздоровления для гистологического исследования; не установлен окончательный диагноз ГИЭ и не оценивается степень травмы головного мозга.Сочетание визуализации и исследований результатов с моделями на животных становится все более важным для оценки фенотипа травмы новорожденного. Более крупные животные могут быть восстановлены после травм и оценены их физиологические и нейроповеденческие реакции; например, магнитно-резонансная томография (МРТ) и электроэнцефалограмма (ЭЭГ) могут определить тяжесть травмы и судорожную активность [42, 43]. Тем не менее, трудноуловимые долгосрочные дефициты памяти или скорости обработки данных по-прежнему трудно измерить.
Метаболиты обычно отражают генетическое расхождение между видами.Однако отчетливые различия в концентрации были очевидны, когда метаболомы префронтальной коры, первичной зрительной коры, коры мозжечка, коры почек и скелетных мышц бедер человека сравнивали с метаболомами шимпанзе, макак и мышей [44]. В этом исследовании сообщается, что метаболиты префронтальной коры головного мозга человека претерпевают 4-кратное отклонение от ожидаемой эволюционной линии. Возможно, это связано с когнитивными функциями, уникальными для людей, что указывает на то, что развитый метаболом человека не может быть напрямую сопоставим с метаболомом животных.
Наконец, этические соображения в исследованиях на животных с целью «замены, сокращения и уточнения» привели к тому, что когорты исследования были относительно небольшими, что затруднило экстраполяцию значимых результатов. Например, Murgia et al. оценили связь между изменениями метаболитов и временем восстановления после гипоксии у 10 субъектов-поросят, но прокомментировали явные базальные межиндивидуальные метаболомные различия между субъектами [31].
Хотя эксперименты на животных дают ценную информацию в этой развивающейся области, различное церебральное созревание и метаболизм видов означают, что ни одна модель не отражает состояние человека [45].Многие ранние метаболомные исследования не соответствовали минимальным стандартам отчетности для метаболомного анализа, которые направлены на обеспечение возможности опроса, репликации и сравнения данных [46]. Это мешает преобразованию результатов исследований животных в человеческий сценарий. Чтобы продвинуть эксперименты на метаболомных животных к клинической пользе, необходимы параллельные валидационные исследования в когортах человеческих новорожденных [47].
4. Перевод исследований на животных в исследования новорожденных на людях
4.1. Исследуемая популяция
Основным ограничением в исследованиях неонатальных биомаркеров является сложность набора достаточного и подходящего исследуемого населения. Распространенность ГИЭ низка (0,3%), что затрудняет сбор репрезентативных высококачественных образцов в достаточном количестве, подходящем для обнаружения метаболомных биомаркеров. Следовательно, даже в крупных родильных домах с 5–10 тысячами родов в год и при полном наборе персонала можно ожидать только 10–20 случаев ГИЭ средней и тяжелой степени и 20 случаев ГИЭ легкой степени в год.В исследовании, в котором приняли участие 256 новорожденных из трех отдельных больниц, только 11 случаев тяжелой асфиксии (8 ГИЭ и 3 перинатальные смерти) по сравнению с 216 здоровыми детьми контрольной группы (16 исключены) [23]. Исследования человеческих неонатальных биомаркеров явно требуют стандартизированного набора и четкого определения случая во многих центрах.
4.2. Определение случая и набор
Чтобы гарантировать, что биомаркер действительно обнаруживает гипоксически-ишемическое повреждение, мы должны исключить многие другие причины неврологической депрессии новорожденного при рождении.Младенцы с метаболической энцефалопатией, сепсисом, генетическими аномалиями или нарушениями миграции нейронов могут иметь низкие баллы по шкале Апгар и низкий тонус в первые дни жизни [48, 49]. Для продвижения исследований биомаркеров нам необходимо превзойти «диагноз по умолчанию» неонатальной энцефалопатии [48] и тщательно определить нашу популяцию, используя четкие критерии отбора.
Стандартизированный набор персонала создает свои собственные проблемы; во-первых, клиническая классификация ГИЭ может варьироваться в зависимости от центра. Для стандартизации степени ГИЭ, ЭЭГ и амплитуды интегрированный мониторинг ЭЭГ как можно скорее после рождения оказался очень полезным [50, 51].Окончательный диагноз ГИЭ часто недоступен в послеродовом периоде, поэтому возможность забрать ранние биопробы, возможно, уже упущена. Одним из решений является сбор образцов у всех младенцев, «подверженных риску» ГИЭ, с использованием критериев включения в исследование, охватывающих общие признаки асфиксии при рождении, например, срок беременности ≥36 недель, оценка по шкале Апгар ≤ 6 через 5 минут, pH пуповинной крови <7,1 или требующие интубации или СЛР при рождении [22]. Неизбежно будут набираться младенцы с перинатальной асфиксией, но без ГИЭ; это должно быть предпочтительнее, чем исключение младенцев, у которых в более позднем послеродовом периоде развиваются более тяжелые клинические симптомы.
4.3. Сбор образцов и данных
В высшей степени непредсказуемая природа ГИЭ требует систематизированного и мультидисциплинарного подхода для выявления участников и сбора образцов 24 часа в сутки, 365 дней в году. Острые клинические условия требуют участия медицинского, сестринского, акушерского и исследовательского персонала как из неонатальных, так и из родильных отделений. Биомаркер, подходящий для ранней диагностики ГИЭ, должен быть обнаружен вскоре после рождения; поэтому образцы, используемые на этапе обнаружения, должны быть собраны, обработаны и занесены в биобанк от каждого младенца «группы риска» в течение 3 часов после рождения.Это короткое окно может означать, что персонал родильного отделения должен определить кандидатов на исследование, взять образец и уведомить исследовательскую группу сразу после родов. Информированное согласие родителей может быть получено после родов, когда это клинически целесообразно, из-за невозможности идентифицировать случаи до рождения. Младенцы контрольной группы могут быть одновременно приняты на работу по антенатальному согласию.
Демографическая изменчивость популяции HIE сама объясняет метаболомные различия; например, гестационный возраст создает отчетливый метаболомный профиль [52], так же как и способ родоразрешения [53] и внутриутробный рост [54].Другие возможные мешающие факторы включают пол, этническую принадлежность, ИМТ матери и время, в течение которого образец крови находился в морозильной камере. Сопоставление случаев 1: 1 с контролем жизненно важно для достижения адекватной мощности с меньшими числами [55], в то время как включение демографических, физиологических факторов и факторов образа жизни в подобранную когорту поможет устранить их потенциальную дискриминационную предвзятость в метаболомической модели [37].
4.4. Биобанк образцов
Высококачественные биопробы необходимы для метаболомных исследований, чтобы гарантировать, что образец является репрезентативным снимком метаболома во время сбора [19].Как видно из обсуждаемых исследований на животных, можно анализировать множество различных типов биологических жидкостей и тканей. Каждый биопроб будет давать уникальный отпечаток биохимических изменений и сложных взаимодействий в конкретном регионе, в зависимости от физиологического или экологического возмущения. В метаболомных исследованиях матери и плода уже использовался ряд биопрепаратов, включая плазму, мочу, амниотическую жидкость, ткань плаценты, вагинальные выделения и пуповинную кровь [56]. Важно отметить, что ни один образец не отражает полное метаболическое нарушение организма; поэтому один из них должен быть тщательно выбран на основе доступности, пригодности для достижения целей исследования и уровня инвазивности.
Для младенцев с перинатальной асфиксией и ГИЭ сбор послеродовых образцов затруднен и легко может быть затруднен из-за прогрессирования заболевания, послеродовых вмешательств или сроков сбора. У среднего младенца весом 3,5 кг будет только 280 мл крови. Этические руководящие принципы ограничивают отбор проб для исследования до 1% от объема циркулирующей крови за 24 часа, что дает верхний предел в 3 мл для послеродового отбора проб или примерно 1–1,3 мл сыворотки или плазмы. Эта ограниченная доступность крови для метаболомного анализа оставляет мало места для ошибок или внутренней проверки.
По нашему мнению, метаболомный анализ пуповинной крови (UCB) предлагает уникальные возможности для определения тяжести клеточной гипоксии и связанного с ней повреждения. Он подходит для обнаружения биомаркеров, поскольку большие объемы (20 мл) могут быть извлечены из плаценты неинвазивным способом путем зажима пуповины с каждого конца, что позволяет хранить цельную кровь, сыворотку и плазму в биобанках. Смешанный образец артериального / венозного пуповины упрощает сбор и удобное для пользователя тестирование в острых условиях. В идеале, UCB будет извлекаться из плаценты в течение 20 минут после рождения и сразу же храниться при 4 ° C перед обработкой в стерильной среде для подавления ферментативной активности и обеспечения точности последующих биологических наблюдений.Морозильные камеры биобанков должны быть размещены в помещении, где есть контроль температуры, вентиляция и резервное питание генератора, и их следует контролировать 24 часа в сутки, чтобы гарантировать отсутствие метаболической деградации. Хранение образцов в биобанках в объемах микрочастиц, достаточных для одного метаболомного эксперимента, устранит циклы замораживания-оттаивания, которые изменяют метаболиты [19].
4.5. Проверка
Перспективные метаболомные биомаркеры требуют многократной проверки. Прежде чем метаболомный биомаркер сможет попасть в клинику, он должен пройти через цикл открытия биомаркеров, валидации исследований и когортной валидации [19].Обычно для обнаружения биомаркеров используется нецелевой метаболомный метод, при котором аналитические данные обнаруживаются одновременно для большого диапазона метаболитов (сотен или тысяч). Этот метод генерирует гипотезы, и a priori знаний об интересующих метаболитах не требуется. Однако при использовании высокопроизводительных и высокочувствительных нецелевых методов, таких как масс-спектрометрия, точность и достоверность снижаются, и вероятность случайного обнаружения особенно высока, даже когда применяются статистические поправки.Следовательно, необходима тщательная проверка дизайна, проведения и интерпретации исследования, чтобы гарантировать воспроизводимость результатов и возможность перехода к более дорогостоящей когортной проверке.
Подтверждение исследования требует перспективного планирования, и включение систем обеспечения качества (QA) и контроля качества (QC) необходимо для ограничения преаналитических ошибок, приводящих к ложным открытиям [57]. Меры обеспечения качества (запланированные действия процесса) могут быть встроены в стандартные рабочие процедуры (СОП), которые обеспечивают пошаговые процедуры для обработки, обработки и контроля образцов, помогая минимизировать вариативность в составе персонала и на разных площадках.Рандомизация подготовки и анализа проб внутри и между партиями проб, наряду со слепым анализом и интерпретацией, будет способствовать валидации аналитических методов и исключить результаты, основанные на систематической ошибке [46].
Для подтверждения качества данных образцы QC стали особенно важным этапом валидации в метаболомике. Разбросанные по всей аналитической партии, они облегчают оценку извлечения метаболитов после экстракции, коррекцию отклонения инструмента, вариации аналитиков и очистку данных [37].Объединение сывороток от каждого младенца в единый образец QC является оптимальным для гарантии того, что он представляет популяцию, и для обеспечения достоверности наличия сигналов дифференцирующих метаболитов.
Наконец, можно включить систему перекрестной проверки, анализируя одну микрочастицу каждой пробы младенца на независимых метаболомных платформах. Хотя чувствительность каждой платформы позволяет идентифицировать определенные классы метаболитов, некоторые из них частично совпадают и могут помочь подтвердить экспериментальные результаты.Например, при использовании одной и той же детской когорты несколько аминокислот (метионин, аланин, изолейцин, фенилаланин, валин и лейцин) были идентифицированы как значительно отличающиеся между HIE и подобранными контролями с использованием 1 H-ЯМР и масс-спектрометрии с прямой инфузией ( DIMS) отдельно [58, 59]. Статистические методы также требуют перекрестной проверки, чтобы избежать ложных открытий, поскольку мощные методы машинного обучения могут легко перемоделировать данные, которые действительно являются артефактом [43].
Когортная валидация выполняется с использованием более крупной независимой когорты новорожденных и должна быть сосредоточена на коротком списке (<20) допустимых и воспроизводимых биомаркеров-кандидатов.Здесь используется целевой метаболомный подход для специального исследования метаболитов-кандидатов с использованием различных методов экстракции, МС / МС и внутренних изотопных стандартов для абсолютной идентификации и количественной оценки. Дополнительным преимуществом количественных измерений является то, что их легче проверять в разных центрах и легче переводить в диагностический тест. К сожалению, до сих пор из-за уже описанных проблем метаболомные данные при перинатальной асфиксии и ГИЭ не были переведены на когортную валидацию.
4.6. Показатели результатов
Потенциал ранних устойчивых метаболомных биомаркеров в неонатальной ГИЭ разнообразен: (i) во время родов: позволяет идентифицировать младенцев со значительной перинатальной асфиксией, подверженных риску ГИЭ, когда требуется акушерское вмешательство; (ii) сразу после родов: выявить тех младенцев, у которых может развиться энцефалопатия средней или тяжелой степени и которые могут получить пользу от нейропротекторного вмешательства; (iii) постнатально: для оценки ответа на терапию и прогнозирования долгосрочного результата.И снова, чтобы точно оценить нашу способность прогнозировать результат, требуются стандартизированные методы. Ранний результат состоит из степени энцефалопатии и выживаемости. Осмотр при выписке полезен, но имеет низкую специфичность в отношении долгосрочного дефицита. Более тонкие трудности в обучении и запоминании могут не проявляться в течение многих лет, но несут основную социальную нагрузку после неонатального ГИЭ. Нарушения обучаемости, нейропсихологический дефицит и поведенческие трудности наблюдаются у более чем 40% выживших детей школьного возраста [60].
Следовательно, долгие годы набора персонала должны быть заменены годами тщательного наблюдения для развития этой быстро развивающейся области. Удержание участников для долгосрочных последующих исследований может быть трудным, и постоянное общение с родителями имеет важное значение [61].
5. Метаболомическое профилирование пуповинной крови
Несмотря на эти проблемы, некоторый прогресс был достигнут. Недавно появилось сообщение о биохимических нарушениях в UCB после неонатального гипоксически-ишемического повреждения.Количественный подход DIMS показал значительные изменения между группами (HIE по сравнению с подобранным контролем, перинатальная асфиксия по сравнению с подобранным контролем) в 29 сывороточных метаболитах трех различных классов: аминокислот, ацилкарнитинов и глицерофосфолипидов [59]. Производство энергии зависит от превращения аминокислот в глюкозу и кетоновые тела или их роли в качестве метаболитов-предшественников цикла Кребса [33]. Было показано, что нарушение цикла Кребса увеличивает количество его промежуточных соединений [24], что может объяснить повышенные концентрации аминокислот-предшественников.При нормальном функционировании ацилкарнитины транспортируют длинноцепочечные жирные кислоты через митохондрии с помощью карнитинового челнока. Уровни ацилкарнитина были увеличены у новорожденных как с перинатальной асфиксией, так и с ГИЭ по сравнению с подобранной контрольной группой, что свидетельствует о дефекте окисления жирных кислот, что приводит к их накоплению и выбросу в кровоток [62]. Эта модель метаболита могла различать HIE и контроль с AUC 0,93 и продемонстрировала возможность различать тяжесть травмы.
A 1D 1 Метод спектроскопии H-ЯМР был использован для специфической характеристики метаболитов первичной энергии, обнаружив значительные изменения в 18 метаболитах UCB у младенцев с перинатальной асфиксией или HIE [58]. Метаболический профиль тяжелого ГИЭ был проиллюстрирован средним кратным увеличением содержания сукцината и глицерина и снижением содержания кетонов, ацетона и 3-гидроксибутирата. Кетоны действуют как альтернативный источник энергии для мозга младенца, и при тяжелой ГИЭ истощение кетонов предполагает, что величина или продолжительность гипоксии-ишемии истощили эти запасы и снизили критическое образование АТФ [63, 64].При легкой гипоксии ранее не наблюдалось повышения уровня 3-гидроксибутирата в отличие от тяжелой гипоксии [32]. Присутствие ацетоацетата и сукцината после гипоксии было зарегистрировано на животных моделях [31]. Ацетоацетат является неотъемлемой частью кетогенеза, посредством чего он декарбоксилируется до ацетона или восстанавливается до 3-гидроксибутирата, который, в свою очередь, может быть преобразован в ацетил-КоА для производства энергии и, следовательно, высвобождения сукцината. Многие модели на животных описали изменение содержания сукцината, но не его связь с тяжестью ГИЭ.Было обнаружено, что сукцинат увеличивается в 8 раз при тяжелом ГИЭ по сравнению с 2-кратным при легком / умеренном ГИЭ, что позволяет предположить, что он играет важную роль в механизмах заболевания. Он потенциально способствует переходу к анаэробному метаболизму за счет стабилизации индуцируемого гипоксией фактора 1 α (HIF1 α ), важного компонента реакции на гипоксический стресс. Хотя эти результаты являются многообещающими и подтверждаются данными на животных, они еще не были подтверждены в дополнительной проспективной когорте новорожденных. Это следующая задача для продвижения области к клинически полезным биомаркерам.
6. Заключение
Таким образом, ряд предполагаемых «отпечатков пальцев» метаболитов сохраняется во всей обсуждаемой литературе. На данный момент метаболические данные согласуются с нарушением энергетического метаболизма и повреждением митохондрий при гипоксии-ишемии. В частности, исследования на людях и животных описали изменение метаболитов цикла Кребса [23–27, 58], аминокислот [24, 26, 31, 58, 59] и компонентов клеточной мембраны [25, 35, 59]. . Эти метаболические изменения согласуются с нынешним пониманием механизмов повреждения, что свидетельствует о сильной биологической вероятности.
Метаболомные маркеры могут использоваться в диагностических, прогностических или скрининговых тестах в перинатальных исследованиях. Ближайшая цель — создать инновационную панель метаболитов для быстрой, надежной и рентабельной диагностики степени ГИЭ прямо у детской кроватки. Новые технологии облегчают измерение метаболитов в местах оказания медицинской помощи, а программные алгоритмы позволяют объединять клинические данные с измерениями метаболитов с использованием всего нескольких микролитров крови [65].
Индивидуальные системы управления могут возникнуть в результате раннего выявления младенцев, у которых, вероятно, будут худшие результаты, что приведет к целенаправленному вмешательству или новым методам лечения для наиболее подверженных риску. В настоящее время необходимы масштабные многоцентровые исследования метаболомных биомаркеров для подтверждения этих ранних предполагаемых результатов. Системы контроля качества и контроля качества важны для обеспечения того, чтобы образцы были занесены в биобанк и точно фенотипированы в нескольких местах и подходят для трансляционных исследований.
Мы хотим побудить исследователей в этой области подтвердить свои открытия в отдельных когортах новорожденных.Срочно необходима программа исследований, ориентированная на сообщества, чтобы в конечном итоге разработать прикроватные тесты для новорожденных, которые принесут значительную и реальную пользу для здоровья этой уязвимой группы населения.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Выражение признательности
Ниам М. Денихан финансируется организацией Molecular Medicine Ireland (цикл 5 PRTLI Управления высшего образования Ирландии) в рамках Программы стипендиатов клинических и трансляционных исследований.


 Хирургическое вмешательство показано только в крайних случаях. При анафилактическом шоке требуется введение адреналина и кортикостероидов.
Хирургическое вмешательство показано только в крайних случаях. При анафилактическом шоке требуется введение адреналина и кортикостероидов. п. Вместо детского одеяла можно пользоваться специальным конвертом для сна, не использовать слишком большие «взрослые» одеяла. Можно использовать специальные сетчатые одеяла для младенцев.
п. Вместо детского одеяла можно пользоваться специальным конвертом для сна, не использовать слишком большие «взрослые» одеяла. Можно использовать специальные сетчатые одеяла для младенцев.

 Развивается одышка, кружится голова, кожные покровы бледнеют, сердцебиение учащается.
Развивается одышка, кружится голова, кожные покровы бледнеют, сердцебиение учащается.