Антитромботическая терапия: Антитромботическая терапия у пациентов с фибрилляцией предсердий, перенесших острый коронарный синдром
Антитромботическая терапия у пациентов с фибрилляцией предсердий, перенесших острый коронарный синдром
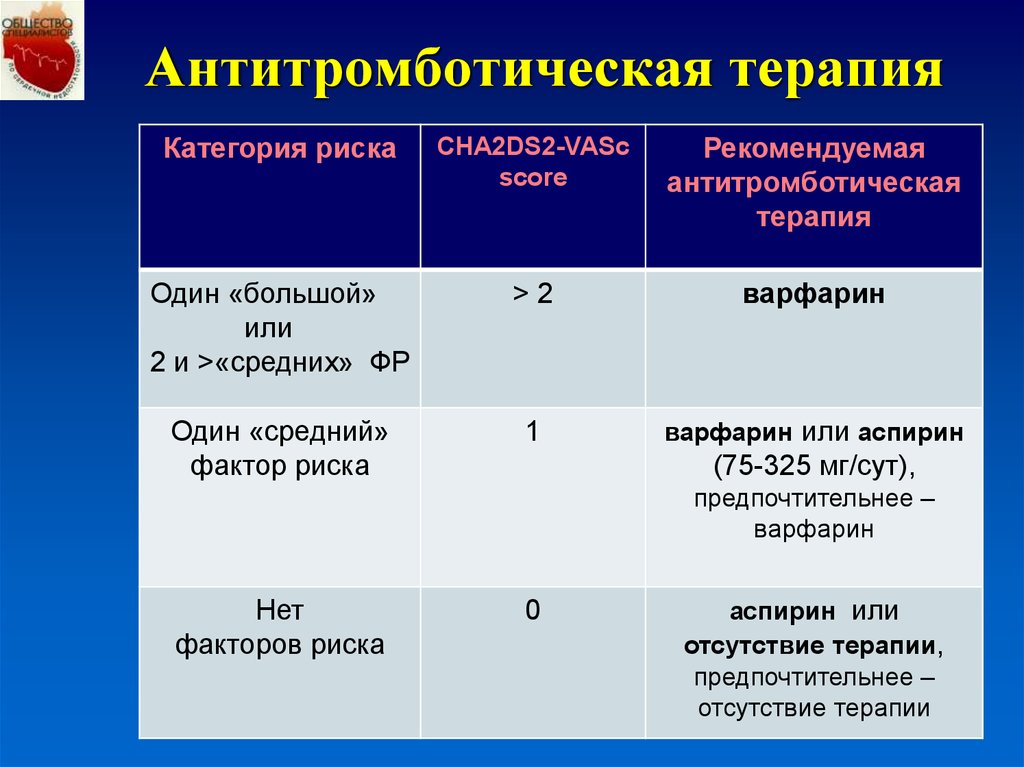
Вопросы лечения пациентов с ФП, перенесших ОКС, являются одними из наиболее актуальных на сегодняшний день, что связано с наличием определенных трудностей при назначении антитромботической терапии у данной группы больных. Согласно современным рекомендациям, таким пациентам должна быть назначена тройная антитромботическая терапия: два дезагреганта (аспирин и клопидогрель) и антикоагулянт, что ассоциируется с более высокими рисками геморрагических осложнений [1].
Очевидно, что терапия тремя антитромботическими препаратами сопровождается повышенным риском кровотечений, которые теоретически могут нивелировать благоприятный эффект профилактики тромбоэмболий. К сожалению, эффективность и безопасность антитромботической терапии у данной группы пациентов изучены недостаточно. Вопрос о месте НОАК в этой схеме также остается открытым. Рекомендации по ведению данной группы пациентов основаны на мнении экспертов (класс рекомендаций IIА, уровень В) [7, 8].
Необходимость назначения тройной антитромботической терапии пациентам с ФП и ОКС признается всеми экспертами, однако вопрос, какой из антикоагулянтов в составе этой схемы является предпочтительным, остается открытым. В современных регламентирующих документах в составе АТТ у больных с ИБС и ФП рекомендуется любой пероральный антикоагулянт: антагонисты витамина K, прямой ингибитор тромбина (дабигатран), селективные ингибиторы Xa-фактора свертывания (ривароксабан, апиксабан) [6].
На сегодняшний день доступны результаты исследований, посвященных применению НОАК в составе антитромботической терапии: в 2016 г. закончилось исследование PIONEER AF-PCI для ривароксабана [3], в сентябре 2017 г. опубликованы результаты REDUAL PCI для дабигатрана [4, 5]. Также продолжаются исследования AUGUSTUS с апиксабаном и ENTRUST-AF-PCI с эдоксабаном.
Еще до завершения указанных исследований, после появления рекомендаций 2014 г. [9], которые позволили назначать НОАК в составе антитромботической терапии, на базе РСЦ № 2 ГБУЗ, Н.
Материал и методы
В проспективное наблюдательное исследование были включены 402 пациента, проходившие лечение на базе РСЦ № 2 ГБУЗ, НО НОКБ им. Н.А. Семашко в 2014—2017 гг., с сочетанием постоянной, пароксизмальной или персистирующей ФП и ОКС как с подъемом (n=68, 16,9%), так и без подъема сегмента ST (n=334, 83,1%). 227 (56,5%) больных были мужского пола. Средний возраст пациентов 69,7±9,6 года.
Все пациенты были госпитализированы экстренно с клинической картиной ОКС. В условиях стационара осуществлялся контроль ЭКГ и лабораторных показателей в соответствии со стандартами, оценка уровня МНО проводилась не менее 2 раз в неделю с последующей коррекцией дозы варфарина при необходимости. Всем пациентам было выполнено ЭхоКГ, суточное ЭКГ-мониторирование. 357 (88,8%) пациентам была проведена СКГ.
Результаты
Из 5037 больных, госпитализированных по поводу ОКС за исследуемый период, ФП имелась у 402. Распространенность Ф.П. среди пациентов с ОКС составила 7,98%. У 161 (40%) пациента ФП была выявлена впервые, у 241 (60%) — имелась ранее. Практически в равном соотношении была зафиксирована пароксизмальная — у 195 (48,5%) пациентов и постоянная ФП — у 193 (48,0%), гораздо реже встречалась персистирующая форма ФП — у 14 (3,5%) пациентов.
Структура сопутствующей патологии представлена на рисунке. Структура сопутствующей патологии. * — ишемический инсульт — у 12 (3,0%) больных, геморрагический инсульт — у 5 (1,2%), неуточненный инсульт — у 7 (1,7%). * — ischemic stroke — in 12 (3.0%) patients, hemorrhagic stroke — in 5 (1.2%), unspecified stroke — in 7 (1.7%).
Индекс CHADS2VASc оказался высоким практически у всех пациентов и составил в среднем 5,03±1,5. Это говорит о том, что у большинства пациентов имелись показания для назначения антикоагулянтной терапии. Средний индекс HAS-BLED составил 3,1±1,1, что соответствует высокому риску кровотечений. Показатель оказался выше, чем у пациентов с ФП без ОКС, у которых, по некоторым данным, он составляет в среднем 2,9 [2]. Это связано в первую очередь с тем, что большинство пациентов с ОКС получают дезагрегантную терапию, что добавляет 1 балл при расчете индекса HAS-BLED. Таким образом, пациенты с ФП и ОКС имеют высокий риск тромбоэмболических событий и высокий риск кровотечений. Именно с этим фактом связано повышенное внимание к объему антитромботической терапии у данной группы больных.
Это говорит о том, что у большинства пациентов имелись показания для назначения антикоагулянтной терапии. Средний индекс HAS-BLED составил 3,1±1,1, что соответствует высокому риску кровотечений. Показатель оказался выше, чем у пациентов с ФП без ОКС, у которых, по некоторым данным, он составляет в среднем 2,9 [2]. Это связано в первую очередь с тем, что большинство пациентов с ОКС получают дезагрегантную терапию, что добавляет 1 балл при расчете индекса HAS-BLED. Таким образом, пациенты с ФП и ОКС имеют высокий риск тромбоэмболических событий и высокий риск кровотечений. Именно с этим фактом связано повышенное внимание к объему антитромботической терапии у данной группы больных.
Среди 241 пациента, у которых ФП имелась ранее, подавляющее большинство не получали антитромботического лечения до поступления в стационар: дезагреганты до госпитализации принимали 38 (15,7%) из 241 больного, антикоагулянты — всего 18 (7,5%) человек. Структура антитромботической терапии, назначенной в стационаре по антикоагулянтам, несколько различалась для пациентов, проходящих лечение в 2014—2015 гг. , когда появились рекомендации, разрешающие использование НОАК, и в последующем наблюдении.
, когда появились рекомендации, разрешающие использование НОАК, и в последующем наблюдении.
В 2014—2015 гг. большей части пациентов с ФП и ОКС назначалась тройная антитромботическая терапия (аспирин + клопидогрель + пероральный антикоагулянт) (n=139, 59,1%). На втором месте по частоте назначения находилась двойная дезагрегантная терапия без антикоагулянта ( n=57, 24,3%), чаще всего это было сочетание аспирина с клопидогрелем (n=49, 20,9%). Реже была назначена двойная антитромботическая терапия (1 дезагрегант + пероральный антикоагулянт) — 23 (9,8%) пациента, еще реже только 1 дезагрегант — 8 (3,4%). Только 1 пероральный антикоагулянт был назначен у 8 (3,4%) пациентов.
Среди пациентов, получающих ОАК (170 больных), в 2014—2015 гг. чаще всего был назначен варфарин (n=137, 80,6%), реже ривароксабан (n=26, 15,3%) и дабигатран (n=7, 4,1%). Доля НОАК в структуре антитромботической терапии составила 19,4%.
В последующем картина существенно изменилась.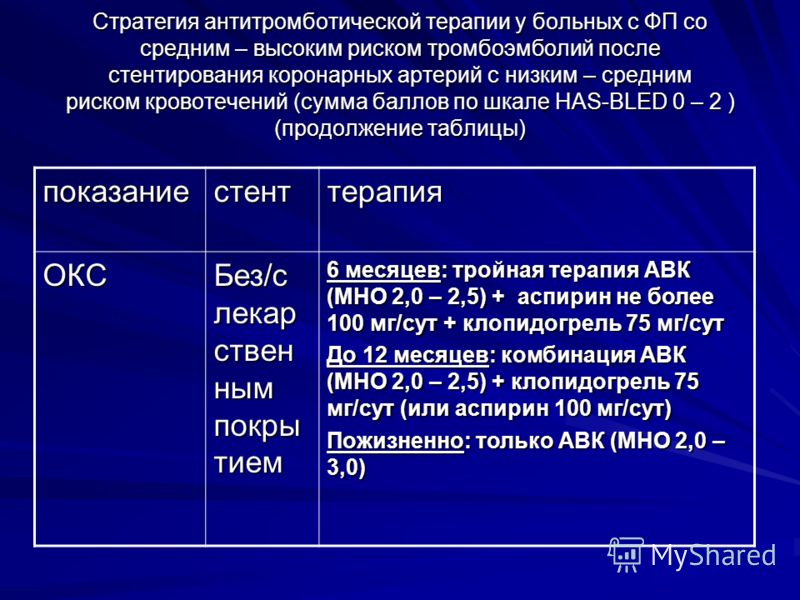 Значительно увеличилась частота назначения тройной антитромботической терапии (138 пациентов, 82,6%), на втором месте оказалась двойная антитромботическая терапия с пероральным антикоагулянтом (n=18, 10,8%). Гораздо реже назначалась двойная дезагрегантная терапия без антикоагулянта (
Значительно увеличилась частота назначения тройной антитромботической терапии (138 пациентов, 82,6%), на втором месте оказалась двойная антитромботическая терапия с пероральным антикоагулянтом (n=18, 10,8%). Гораздо реже назначалась двойная дезагрегантная терапия без антикоагулянта (
Самым распространенным пероральным антикоагулянтом остался варфарин, однако частота его назначения существенно снизилась и составила 52,9% (по сравнению с 81% в 2014—2015 гг.). Он был назначен у 83 из 157 пациентов, получающих антикоагулянтную терапию. Доля НОАК существенно возросла и достигла почти половины всех назначений — 74 (47,1%) из 157 пациентов. Среди НОАК чаще всего назначался ривароксабан (n=44, 28,0%), реже дабигатран (n=27, 17,2%) и апиксабан (n=3, 1,9%).
В составе тройной антитромботической терапии за весь период времени аспирин был назначен 277 пациентам, чаще всего его прием было рекомендовано продолжить в течение 6 мес после выписки (n=86, 31,1%), на 1 мес аспирин был назначен 181 (65,3%) пациенту, на 3 мес — 10 (3,6%).
За весь период наблюдения варфарин был назначен 216 больным, среди них к моменту выписки из стационара целевое МНО было достигнуто только у 62 (28,7%) пациентов. У большинства больных (n=99, 45,8%) МНО было менее 2. У значительной части больных (n=55, 25,5%) к моменту выписки МНО было более 3, что говорит о повышенном риске кровотечений у данной категории больных.
Обсуждение
ФП и ОКС — распространенные заболевания, которые нередко сочетаются друг с другом. Проведенное исследование позволило уточнить распространенность ФП у пациентов с ОКС. Она составила 7,98%, что является достаточно высоким показателем, особенно учитывая то, что ведение данных пациентов сопряжено с трудностями в подборе терапии. Пациенты с ФП и ОКС имеют высокий риск тромбоэмболических событий (средний показатель CHADS2VASc 5,03), но также и высокий риск кровотечений (средний индекс HAS-BLED 3,1), что ставит перед лечащим врачом трудную задачу — подобрать наиболее эффективную и по возможности максимально безопасную комбинацию антитромботических препаратов.
Помимо того, что сочетание ФП и ОКС само по себе сопряжено с трудностями в лечении, необходимо учитывать тот факт, что данные пациенты часто имеют различные сопутствующие хронические заболевания, чаще всего это гипертоническая болезнь, постинфарктный кардиосклероз, сахарный диабет и ожирение.
Несмотря на высокие риски тромбоэмболических событий, подавляющее большинство пациентов не получают антитромботического лечения до поступления в стационар. Чаще всего это связано с низкой информированностью больных о своем диагнозе и необходимостью профилактики тромбоэмболических осложнений.
Во время госпитализации по поводу ОКС всем пациентам с ФП назначается антитромботическая терапия в различном объеме. Чаще всего врачи склонны назначать тройную антитромботическую терапию, что соответствует современным рекомендациям. При этом доля тройной антитромботической терапии возросла с 59,1% в 2014—2015 гг. до 82,6% в 2016—2017 гг. Также в 2016—2017 гг. значительно уменьшилась частота назначения двойной дезагрегантной терапии без антикоагулянта, она составила всего 5,4% (по сравнению с 24,3% в 2014—2015 гг.
Достижение целевого МНО и удержание этого показателя в терапевтическом диапазоне остаются большими проблемами для пациентов, получающих варфарин. К моменту выписки из стационара целевое МНО было достигнуто только у 28,7% пациентов, что нельзя считать удовлетворительным, поскольку это означает, что большинство пациентов не получают эффекта от лечения, а у ¼ больных помимо этого возрастает риск кровотечений (МНО более 3 отмечено у 25,5% больных). Тем не менее низкая стоимость препарата приводит к тому, что варфарин продолжает занимать лидирующее положение в структуре назначенных антикоагулянтов, хотя доля его снизилась к 2017 г.
Несмотря на существующие клинические исследования, посвященные этой теме, вопросы антитромботической терапии у пациентов с ФП, перенесших ОКС, продолжают обсуждаться. Проведенное исследование позволило подробнее изучить данную категорию больных, оценить частоту назначения «двойной» и «тройной» антитромботической терапии и ее состав. Также была продемонстрирована проблема достижения целевого уровня МНО на стационарном этапе у пациентов, получающих варфарин. По результатам исследования было выявлено, что доля НОАК в структуре антикоагулянтной терапии увеличилась к 2017 г., поскольку эти препараты не требуют лабораторного контроля и могут считаться перспективной альтернативой варфарину у обсуждаемой группы пациентов.
На выполнение научно-исследовательской работы «Разработка оптимальной схемы терапии в соответствии с изучением перспектив применения новых пероральных антикоагулянтов у пациентов с фибрилляцией предсердий перед антагонистами витамина К» был предоставлен грант по программе «Умник» (Федеральное государственное бюджетное учреждение «Фонд содействия развитию малых форм предприятий в научно-технической сфере»).
Участие авторов:
Концепция и дизайн исследования — Кайдалова Н.А., Королева Л.Ю..
Сбор и обработка материала — Кайдалова Н.А., Волкова А.Т., Корязина А.М., Ковалева Г.В., Пайкова Н.Н..
Статистическая обработка — Кайдалова Н.А..
Написание текста — Кайдалова Н.А..
Редактирование — Королева Л.Ю., Носов В.П..
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Н.А. Кайдалова — e-mail: [email protected]; https://orcid.org/0000-0003-4499-2518
Л.Ю. Королева — e-mail: [email protected]; https://orcid.org/0000-0001-7843-6128
В.П. Носов — e-mail: [email protected]; https://orcid.org/0000-0003-0061-1250
А.Т. Волкова — e-mail: [email protected]; https://orcid.org/0000-0003-1684-4665
А.М. Корязина — https://orcid.org/0000-0001-9945-9134
Г. В. Ковалева — e-mail: [email protected]; https://orcid.org/0000-0002-9576-3953
В. Ковалева — e-mail: [email protected]; https://orcid.org/0000-0002-9576-3953
Н.Н. Пайкова — https://orcid.org/0000-0003-0636-3040
Антитромботическая терапия во вторичной профилактике ишемического инсульта
Нарушения мозгового кровообращения являются одной из основных причин заболеваемости и смертности. После перенесенного ишемического инсульта (ИИ) высокая частота повторных ишемических событий (инфаркта миокарда, повторного ИИ, сердечно-сосудистой смерти) диктует необходимость активной вторичной профилактики, включающей модификацию факторов риска, лечение основного заболевания, приведшего к развитию инсульта, устранение локальной причины ИИ хирургическими методами и медикаментозное воздействие на систему гемостаза [1]. В современных рекомендациях по ведению больных с ИИ и транзиторными ишемическими атаками (ТИА) [2, 3] приводятся основные направления вторичной профилактики, зарекомендовавшие себя с позиций доказательной медицины. Особое значение придается антитромботической терапии.
В патогенезе ИИ особо важную роль играет активация тромбоцитарного и/или коагуляционого звеньев гемостаза [1]. Это позволяет формировать успешное направление фармакологической профилактики сосудистых заболеваний, основанное на регуляции свойств тромбоцитов и плазменного звена гемостаза. Представленные на сегодняшний день результаты международных мультицентровых исследований позволили выработать следующие рекомендации по вторичной профилактике ИИ [2, 3].
При перенесенном кардиоэмболическом инсульте рекомендуется длительная терапия пероральными антикоагулянтами. Она показана всем пациентам после ИИ, развившегося на фоне мерцательной аритмии (рекомендации класса I, уровень доказательности А). Рекомендован длительный прием антикоагулянта непрямого действия (АНД) варфарина, при этом целевой уровень международного нормализованного отношения (MHO) составляет 2,0-3,0, а для пациентов с искусственными механическими клапанами сердца — 2,5-3,5. Длительная терапия АНД (варфарином) с целевым уровнем MHO 2,0-3,0 назначается пациентам после ИИ с доказанным кардиоэмболическим подтипом, но не связанным с мерцательной аритмией при высоком риске развития повторного инсульта. Терапия АНД не показана пациентам, перенесшим атеротромботическийинсульт, однако АНД могут быть рекомендованы больным с продолжающимися повторными ТИА или некардиоэмболическими ИИ [2, 3].Терапия АНД нежелательна у пациентов с частыми падениями, низкой приверженностью к терапии, неконтролируемой эпилепсией, тяжелой деменцией, желудочно-кишечными кровотечениями, но пожилой возраст не является противопоказанием для терапии АНД [2, 3]. Терапию АНД следует проводить длительное время, иногда пожизненно. После ТИА или малого ИИ терапию варфарином назначают немедленно.
Терапия АНД не показана пациентам, перенесшим атеротромботическийинсульт, однако АНД могут быть рекомендованы больным с продолжающимися повторными ТИА или некардиоэмболическими ИИ [2, 3].Терапия АНД нежелательна у пациентов с частыми падениями, низкой приверженностью к терапии, неконтролируемой эпилепсией, тяжелой деменцией, желудочно-кишечными кровотечениями, но пожилой возраст не является противопоказанием для терапии АНД [2, 3]. Терапию АНД следует проводить длительное время, иногда пожизненно. После ТИА или малого ИИ терапию варфарином назначают немедленно.
Дозу варфарина подбирают на фоне введения гепарина, препараты назначают одновременно, отмена гепарина производится при достижении устойчивого терапевтического уровня МНО 2,0-3,0, но не раньше, чем через 4-5 дней сочетанного лечения [4, 5]. При тяжелом инсульте терапия может быть отсрочена, вопрос о сроке начала антикоагулянтной терапии решается в каждом случае отдельно. После подбора индивидуальной дозы варфарина контроль уровня МНО должен проводиться не реже 1 раза в месяц, что позволяет уменьшить число геморрагических осложнений. Частота возникновения геморрагий на фоне приема варфарина зависит от интенсивности гипокоагуляции, которую отражает показатель МНО. Потенциально опасным для возникновения кровотечения считается уровень МНО более 4,0. Риск геморрагических осложнений зависит от интенсивности и стабильности гипокоагуляции, немодифицируемых факторов риска (возраст, пол больных, генетически детерминированная чувствительность к варфарину) и модифицируемых факторов риска (особенности питания, сопутствующие заболевания и медикаментозная терапия, функциональное состояние печени, почек, сердца). Повышенную чувствительность к варфарину следует учитывать в тех случаях, когда при приеме 2 мг варфарина регистрируются супратерапевтические (более 3,0) показатели МНО. Идентифицирован полиморфизм гена CYP2C9 и выявлены аллельные варианты — CYP2C9*2 (Arg144Cys) и CYP2C9*3 (Ile359Leu), которые снижают каталитическую активность фермента, метаболизирующего варфарин, по сравнению с обычной CYP2C9*1 (Arg144/Ile359). Необходимая ежедневная доза варфарина у носителей аллелей CYP2C9 *2 и CYP2C9*3 бывает существенно ниже, а терапевтический эффект достигается значительно быстрее по сравнению с пациентами, не несущими данных аллельных вариантов.
Частота возникновения геморрагий на фоне приема варфарина зависит от интенсивности гипокоагуляции, которую отражает показатель МНО. Потенциально опасным для возникновения кровотечения считается уровень МНО более 4,0. Риск геморрагических осложнений зависит от интенсивности и стабильности гипокоагуляции, немодифицируемых факторов риска (возраст, пол больных, генетически детерминированная чувствительность к варфарину) и модифицируемых факторов риска (особенности питания, сопутствующие заболевания и медикаментозная терапия, функциональное состояние печени, почек, сердца). Повышенную чувствительность к варфарину следует учитывать в тех случаях, когда при приеме 2 мг варфарина регистрируются супратерапевтические (более 3,0) показатели МНО. Идентифицирован полиморфизм гена CYP2C9 и выявлены аллельные варианты — CYP2C9*2 (Arg144Cys) и CYP2C9*3 (Ile359Leu), которые снижают каталитическую активность фермента, метаболизирующего варфарин, по сравнению с обычной CYP2C9*1 (Arg144/Ile359). Необходимая ежедневная доза варфарина у носителей аллелей CYP2C9 *2 и CYP2C9*3 бывает существенно ниже, а терапевтический эффект достигается значительно быстрее по сравнению с пациентами, не несущими данных аллельных вариантов.
В российской популяции полиморфизм гена CYP2C9 выявлен у 27-32% больных, получавших варфарин [4, 5]. Однако подбор индивидуальной дозы варфарина осуществляется на практике по уровню МНО, проведение предварительного генотипирования не требуется. Регулярный контроль МНО, приверженность пациентов лечению могут обеспечить эффективную и безопасную антикоагулянтную терапию варфарином, создающую искусственную (медикаментозную) гипокоагуляцию в условиях повышенного риска тромбообразования [2, 5].
Больные, которым не показаны антикоагулянты, должны получать антитромбоцитарную терапию (класс I, уровень А) [2]. Рекомендуется назначение комбинации аспирина и дипиридамола, или клопидогреля. В качестве альтернативы возможно использование аспирина или трифлюзала (класс I, уровень А) [2].
Антиагреганты — препараты, снижающие функциональную активность тромбоцитов, смертность от сосудистых заболеваний у лиц с симптомным атеросклерозом, они эффективны для предотвращения инсульта и инфаркта миокарда [3, 6-8]. Тромбоциты играют ключевую роль в регуляции системы гемостаза, обеспечивают стабильность сгустка и его ретракцию, участвуют в репарации сосудистой стенки, оказывают воздействие на фибринолитическую систему. В то же время они являются источником активного синтеза гуморальных факторов, стимулирующих одновременно процессы образования тромба и воспаление. Даже небольшие нарушения гомеостаза могут приводить к выраженной дисфункции тромбоцитов, которая способна вызывать тромбозы или кровотечения, оказывать негативное влияние на течение сердечно-сосудистых и онкологических заболеваний, на воспалительные процессы и атерогенез [1, 9].
Тромбоциты играют ключевую роль в регуляции системы гемостаза, обеспечивают стабильность сгустка и его ретракцию, участвуют в репарации сосудистой стенки, оказывают воздействие на фибринолитическую систему. В то же время они являются источником активного синтеза гуморальных факторов, стимулирующих одновременно процессы образования тромба и воспаление. Даже небольшие нарушения гомеостаза могут приводить к выраженной дисфункции тромбоцитов, которая способна вызывать тромбозы или кровотечения, оказывать негативное влияние на течение сердечно-сосудистых и онкологических заболеваний, на воспалительные процессы и атерогенез [1, 9].
Достаточно часто возникает необходимость в быстрой и адекватной оценке тромбоцитарной функции. Исторически на основании исследования агрегационной способности тромбоцитов в динамике пытались оценить функциональную активность тромбоцитов, а также эффективность антиагрегантной терапии. По данным агрегатограммы, критериями эффективности аспирина считалось снижение коллаген- и АДФ-индуцированной агрегации тромбоцитов до 20%; для тиенопиридинов — снижение АДФ-индуцированной агрегации; наиболее часто использовался метод оптической агрегации [10]. Этот метод до сих пор считается «золотым стандартом» в агрегатометрии. Он позволяет диагностировать большинство тромбоцитарных патологий и болезнь Виллебранда (включая ее типирование), измерять спонтанную агрегацию, осуществлять контроль эффективности большинства антитромбоцитарных препаратов, но ряд ограничений препятствует стандартизации в агрегатометрии. Функциональная активность тромбоцитов оценивается не в физиологическом окружении, так как в образце нет других форменных элементов крови; снижается точность измерений при работе с липемичными и иктеричными образцами; необходимо длительное предварительное центрифугирование крови, что осложняется потерей части тромбоцитов и/или их ранней активацией [10]. Эти ограничения приводят к снижению чувствительности метода, в связи с чем возможно получение недостоверной оценки и функциональной активности тромбоцитов, и действия антитромбоцитарных препаратов.
Этот метод до сих пор считается «золотым стандартом» в агрегатометрии. Он позволяет диагностировать большинство тромбоцитарных патологий и болезнь Виллебранда (включая ее типирование), измерять спонтанную агрегацию, осуществлять контроль эффективности большинства антитромбоцитарных препаратов, но ряд ограничений препятствует стандартизации в агрегатометрии. Функциональная активность тромбоцитов оценивается не в физиологическом окружении, так как в образце нет других форменных элементов крови; снижается точность измерений при работе с липемичными и иктеричными образцами; необходимо длительное предварительное центрифугирование крови, что осложняется потерей части тромбоцитов и/или их ранней активацией [10]. Эти ограничения приводят к снижению чувствительности метода, в связи с чем возможно получение недостоверной оценки и функциональной активности тромбоцитов, и действия антитромбоцитарных препаратов.
Учитывая важность гемостатических нарушений при ИИ, представляется интересным определение D-димера, свидетеля повышенного внутрисосудистого свертывания и активации фибринолитической системы, как наиболее стабильного во времени и доступного в выявлении маркера тромбинемии [11, 12]. Однако вопрос о стандартизации методов определения D-димера до сих пор не решен, поэтому результаты исследований, проведенные с использованием различных реактивов, могут не совпадать. В то же время данные, полученные в некоторых исследованиях [13], позволяют использовать этот маркер при проведении дифференциальной диагностики подтипов ИИ. Получены данные о достоверно более высоком уровне D-димера у больных с кардиоэмболическим инсультом, чем в группах с другими подтипами ИИ. При этом наиболее частой причиной кардиоэмболического инсульта была мерцательная аритмия, при которой повышение уровня D-димера хорошо известно и обусловлено гемостатическими нарушениями при внутрисердечном тромбообразовании.
Однако вопрос о стандартизации методов определения D-димера до сих пор не решен, поэтому результаты исследований, проведенные с использованием различных реактивов, могут не совпадать. В то же время данные, полученные в некоторых исследованиях [13], позволяют использовать этот маркер при проведении дифференциальной диагностики подтипов ИИ. Получены данные о достоверно более высоком уровне D-димера у больных с кардиоэмболическим инсультом, чем в группах с другими подтипами ИИ. При этом наиболее частой причиной кардиоэмболического инсульта была мерцательная аритмия, при которой повышение уровня D-димера хорошо известно и обусловлено гемостатическими нарушениями при внутрисердечном тромбообразовании.
У пациентов с лакунарным инсультом уровень D-димера находится в пределах референтных величин. С одной стороны, это может свидетельствовать о нетромботическом механизме окклюзии мелких сосудов на фоне гипертензии или сахарного диабета, с другой — тромбы при лакунарном инсульте столь малы, что их образование может не инициировать значимый подъем концентрации D-димера [11].
Наличие повышенного внутрисосудистого свертывания, диагностируемое по повышению уровня D-димера, может служить показанием к назначению терапии варфарином даже у пациентов с некардиоэмболическим инсультом, но в этом случае необходимо исключить состояния, сопровождающиеся неспецифическим повышением уровня D-димера: сепсис, злокачественные новообразования, травмы, операции, венозные тромбозы. В исследовании M. Barber и соавт. [11] выдвинута гипотеза о том, что повышение уровня D-димера является независимым предиктором прогрессирования инсульта. Одновременно повышенный уровень D-димера свидетельствует о продолжающемся тромбообразовании и острой воспалительной реакции. Однако и здесь нужно осторожно оценивать его значение, так как именно в 1-ю нед у пациентов с инсультами возникают инфекционно-воспалительные осложнения (пневмонии и др.), венозные тромбоэмболические осложнения (ВТЭО), и нередко в анамнезе у пациента имеется ряд заболеваний, сопровождающихся повышением этого маркера [11].
Исследование D-димера в клинической практике часто используется для исключения диагноза ВТЭО у больных с низкой клинической вероятностью их развития. При ИИ больные имеют множественные факторы риска развития ВТЭО. Однозначных лабораторных предвестников развития венозного тромбоза нет, но снижение уровня эндогенных антикоагулянтов (антитромбина, протеинов С и S) и повышение уровня D-димера свидетельствуют о гиперкоагуляции. В большинстве случаев локальное тромбообразование, имеющее место при ИИ, не сопровождается изменениями в системе гемостаза, поэтому значимых изменений в показателях рутинной коагулограммы нами зарегистрировано не было (протромбиновое время, активированное частичное тромбопластиновое время, концентрация фибриногена, антитромбин).
Одним из важных, в полной мере недооцененных звеньев антитромботической терапии при инсульте, является снижение риска эпизодов ВТЭО: тромбоэмболии легочных артерий (ТЭЛА) и тромбозов глубоких вен (ТГВ).
Пациентам, имеющим высокий риск тромботических осложнений инсульта (особенно в состоянии иммобилизации, с ожирением, сахарным диабетом, повторным инсультом), показана профилактика венозных тромбозов и ТЭЛА (подкожное введение низких доз гепарина или низкомолекулярных гепаринов, класс I, уровень А) [2]. У пациентов с инсультом использование низкомолекулярных гепаринов уменьшает риск ТГВ и ТЭЛА без увеличения риска интрацеребральных или экстрацеребральных геморрагий; низкие дозы нефракционированного гепарина снижают риск тромбозов, но не влияют на частоту ТЭЛА, а риск интрацеребральных геморрагий при этом статистически недостоверно увеличивается [2].
У пациентов с инсультом использование низкомолекулярных гепаринов уменьшает риск ТГВ и ТЭЛА без увеличения риска интрацеребральных или экстрацеребральных геморрагий; низкие дозы нефракционированного гепарина снижают риск тромбозов, но не влияют на частоту ТЭЛА, а риск интрацеребральных геморрагий при этом статистически недостоверно увеличивается [2].
При отсутствии эффективной профилактики ТГВ развивается примерно у 75% пациентов с гемиплегией после инсульта, ТЭЛА — у 20%. Летальный исход от ВТЭО является причиной ранней смертности после инсульта в 25% случаев. Диагностика венозных тромбозов в большинстве случаев затруднена, учитывая состояние больного [12, 14]. Есть мнение, что риск ТЭЛА сохраняется примерно в течение 4 нед после инсульта [15].
В проспективных исследованиях получены данные о благоприятном влиянии применения низких доз нефракционированного гепарина (НФГ) и низкомолекулярных гепаринов (НМГ) в снижении числа ТГВ [16], значительное снижение риска ТЭЛА связано именно с применением НМГ [17].
Во многих исследованиях оценивалась эффективность, безопасность и продолжительность различных методов профилактики ВТЭО после инсульта. Ранняя мобилизация рекомендуется для предотвращения ТГВ (рекомендации класса IV). Подкожное введение НФГ или НМГ показано пациентам с высоким риском венозных тромбозов и ТЭЛА (класс I, уровень А). Профилактическое введение подкожно низких доз НФГ (5 000 МЕ 2 раза в день) или НМГ показано пациентам с высоким риском ТГВ и ТЭЛА, а также с ВТЭО в анамнезе [17].
Применение НМГ с целью профилактики ВТЭО имеет ряд преимуществ по сравнению с НФГ — лучший профиль безопасности, высокая биодоступность, вводятся 1 раз в день, доза не зависит от массы тела больного. НМГ характеризуются более предсказуемым антикоагулянтным ответом по сравнению с НФГ и не требуют проведения строгого лабораторного мониторинга при назначении [18-20]. При применении НМГ частота развития гепарининдуцированной тромбоцитопении значительно меньше по сравнению с НФГ; кроме того, по сравнению с НФГ они ассоциируются с меньшим риском развития остеопороза [21]. Использование НМГ обычно не требует лабораторного контроля, достаточно регулярно следить за уровнем антитромбина. Но у больных с нарушением почечной функции (клиренс креатинина ниже 30 мл/мин) во избежание накопления НМГ можно определять уровень анти-Ха активности в точке, соответствующей пику абсорбции применяемого препарата. Вероятность развития гепарининдуцированной тромбоцитопении II типа при лечении НМГ ниже, чем при НФГ, но для повышения безопасности терапии необходимо периодически контролировать уровень тромбоцитов [17, 18]. НМГ имеют фармакокинетические и фармакодинамические различия, что предопределяется их химической структурой. В исследованиях было подтверждено отсутствие значимых различий в безопасности и эффективности НМГ при профилактике и лечении острых ВТЭО [22]. Срок начала лечения гепаринами и его длительность выбираются индивидуально в каждом случае, при этом учитывается степень риска развития тромбоза или кровотечения, что представляется весьма проблематичным [14, 17].
Использование НМГ обычно не требует лабораторного контроля, достаточно регулярно следить за уровнем антитромбина. Но у больных с нарушением почечной функции (клиренс креатинина ниже 30 мл/мин) во избежание накопления НМГ можно определять уровень анти-Ха активности в точке, соответствующей пику абсорбции применяемого препарата. Вероятность развития гепарининдуцированной тромбоцитопении II типа при лечении НМГ ниже, чем при НФГ, но для повышения безопасности терапии необходимо периодически контролировать уровень тромбоцитов [17, 18]. НМГ имеют фармакокинетические и фармакодинамические различия, что предопределяется их химической структурой. В исследованиях было подтверждено отсутствие значимых различий в безопасности и эффективности НМГ при профилактике и лечении острых ВТЭО [22]. Срок начала лечения гепаринами и его длительность выбираются индивидуально в каждом случае, при этом учитывается степень риска развития тромбоза или кровотечения, что представляется весьма проблематичным [14, 17].
Таким образом, на сегодняшний день имеются основанные на принципах доказательной медицины рекомендации по антитромботической терапии при вторичной профилактике ИИ и ТИА, обладающие высоким уровнем доказательности. Однако практически все они базируются на клинических данных, игнорируя лабораторный контроль (исключение составляет МНО). Это обусловлено техническими сложностями лабораторной диагностики (подвижность изменений в системе гемостаза, чувствительность тромбоцитов, отсутствие стандартизации методов). Лабораторный контроль может быть малоинформативным в том случае, когда нет системных изменений гемостаза, а локальные события (локальный тромбоз) не дают существенных сдвигов, измеряемых в образцах венозной периферической крови. Тем не менее, лабораторный контроль антитромботической терапии становится все более востребованным: резистентность к антиагрегантам [7], генетически детерминированная чувствительность к оральным антикоагулянтам [4] обусловливают целесообразность перехода в будущем к индивидуализированной профилактике ИИ. Для этого необходимо совершенствование методов лабораторной диагностики, применимых в клинической практике. Одним из перспективных методов может оказаться такой интегральный тест, как исследование генерации тромбина, отражающий в целом результат взаимодействия различных звеньев системы гемостаза.
Для этого необходимо совершенствование методов лабораторной диагностики, применимых в клинической практике. Одним из перспективных методов может оказаться такой интегральный тест, как исследование генерации тромбина, отражающий в целом результат взаимодействия различных звеньев системы гемостаза.
Важным является также совершенствование фармакологических методов воздействия на систему гемостаза — разработка и/или внедрение во вторичную профилактику ИИ более безопасных и простых в применении препаратов, например таких, как оральные прямые ингибиторы тромбина.
Работа выполнена при финансовой поддержке компании «ГлаксоСмитКляйн».
Антикоагулянтная и антитромботическая терапия: применяется во всем мире в соответствии с местными географическими критериями отбора — Favaloro
Редакция
Антитромботическая терапия применяется для профилактики или лечения тромбоза у пациентов в различных клинических условиях (1–5). В целом антитромботическая терапия включает два основных класса препаратов: антикоагулянты (которые ингибируют различные аспекты путей свертывания крови) и антитромбоцитарные агенты (которые ингибируют функцию тромбоцитов). Антикоагулянты включают как парентеральные препараты, такие как гепарин, так и пероральные препараты, такие как антагонисты витамина К (АВК) (т.е. в первую очередь варфарин) и прямые пероральные антикоагулянты (ПОАК) (которые включают дабигатран, ривароксабан, апиксабан и эдоксабан). Антитромбоцитарные средства включают широкий спектр препаратов, но в условиях сообщества в основном это аспирин и средства против рецептора P2Y12. В этой серии журнала для читателей AOB собрано множество статей, представляющих общий или специфический интерес.
В целом антитромботическая терапия включает два основных класса препаратов: антикоагулянты (которые ингибируют различные аспекты путей свертывания крови) и антитромбоцитарные агенты (которые ингибируют функцию тромбоцитов). Антикоагулянты включают как парентеральные препараты, такие как гепарин, так и пероральные препараты, такие как антагонисты витамина К (АВК) (т.е. в первую очередь варфарин) и прямые пероральные антикоагулянты (ПОАК) (которые включают дабигатран, ривароксабан, апиксабан и эдоксабан). Антитромбоцитарные средства включают широкий спектр препаратов, но в условиях сообщества в основном это аспирин и средства против рецептора P2Y12. В этой серии журнала для читателей AOB собрано множество статей, представляющих общий или специфический интерес.
Серия начинается с исследования глобальных тенденций в области антикоагулянтов, сначала специально определенных с использованием данных Google Trends (6). За период в конце 2018 г. был проведен электронный поиск одновременно с использованием поисковых терминов «варфарин» И «дабигатран» И «ривароксабан» И «апиксабан» И «эдоксабан» без каких-либо языковых или географических ограничений. Всего варфарин (55,0 %) дали наибольшее количество поисковых запросов в Google среди пяти пероральных антикоагулянтов за весь период исследования, за которыми следуют апиксабан (22,5%), ривароксабан (18,3%), эдоксабан (4,1%) и дабигатран (0,1%). Таким образом, в то время варфарин оставался преимущественно искомым антикоагулянтом во всем мире. По сравнению с другими пероральными антикоагулянтами ривароксабан был более популярен в Китае и некоторых странах Южной Америки, апиксабан был особенно популярен в некоторых странах Северной Европы и Латинской Америки, в то время как эдоксабан и дабигатран редко искали ни в одной стране мира. Согласно анализу, авторы пришли к выводу, что варфарин остается самым популярным пероральным антикоагулянтом во всем мире, ривароксабан и апиксабан занимают второе и третье места по популярности, в то время как популярность дабигатрана, оригинального ППОАК, который должен быть выпущен, в настоящее время, по-видимому, очень низкая. ограничено, и эдоксабан, являющийся последним выпущенным DOAC, начинает приобретать актуальность.
Всего варфарин (55,0 %) дали наибольшее количество поисковых запросов в Google среди пяти пероральных антикоагулянтов за весь период исследования, за которыми следуют апиксабан (22,5%), ривароксабан (18,3%), эдоксабан (4,1%) и дабигатран (0,1%). Таким образом, в то время варфарин оставался преимущественно искомым антикоагулянтом во всем мире. По сравнению с другими пероральными антикоагулянтами ривароксабан был более популярен в Китае и некоторых странах Южной Америки, апиксабан был особенно популярен в некоторых странах Северной Европы и Латинской Америки, в то время как эдоксабан и дабигатран редко искали ни в одной стране мира. Согласно анализу, авторы пришли к выводу, что варфарин остается самым популярным пероральным антикоагулянтом во всем мире, ривароксабан и апиксабан занимают второе и третье места по популярности, в то время как популярность дабигатрана, оригинального ППОАК, который должен быть выпущен, в настоящее время, по-видимому, очень низкая. ограничено, и эдоксабан, являющийся последним выпущенным DOAC, начинает приобретать актуальность. Новый современный поиск в 2020 году, охватывающий последние 3 месяца, выявил аналогичную тенденцию (9).0007 Рисунок 1 ), при этом варфарин по-прежнему сохраняет лидерство, хотя и снизилось по сравнению с 2018 годом, апиксабан все еще опережает ривароксабана, а дабигатран теперь опережает эдоксабана.
Новый современный поиск в 2020 году, охватывающий последние 3 месяца, выявил аналогичную тенденцию (9).0007 Рисунок 1 ), при этом варфарин по-прежнему сохраняет лидерство, хотя и снизилось по сравнению с 2018 годом, апиксабан все еще опережает ривароксабана, а дабигатран теперь опережает эдоксабана.
Рисунок 1 Результаты недавнего поиска в Google Trends, относящиеся к распространенным антикоагулянтам и отражающие обновление предыдущей публикации в этой серии (6). Адрес веб-сайта, по состоянию на 19 августа 2020 г.: https://trends.google.com/trends/explore?date=today%203-m&q=warfarin,dabigatran,apixaban,edoxaban,rivaroxaban
Эта передовая статья серии дополняется серией статей, посвященных антикоагулянтной терапии в конкретных регионах мира, включая Австралию (7), Италию (8), Словакию (9), Иран (10) и Францию (11). Это дополняется другими вкладами Финляндии (12) и Соединенного Королевства (13).
Для Австралии приглашенный редактор и его коллеги представляют описательный обзор, написанный в 2018 году, в котором они кратко описывают антикоагулянты, доступные в Австралии, их относительные сильные и слабые стороны, а также постоянно меняющийся местный ландшафт в отношении антикоагулянтной терапии. В частности, общемировая тенденция в поисковых запросах Google Trends (6), как правило, отражается с точки зрения употребления наркотиков в Австралии, с явным продолжающимся снижением количества назначений варфарина, контрастирующим с неуклонным увеличением количества назначений для всех НОАК, хотя в первую очередь для антидепрессантов. — агенты активированного фактора X (FXa) (ривароксабан и апиксабан). Это использование сопровождается сокращением лабораторного мониторинга варфарина и увеличением общих затрат на использование лекарств. Авторы недавно обновили эти данные в 2020 году (14).
В частности, общемировая тенденция в поисковых запросах Google Trends (6), как правило, отражается с точки зрения употребления наркотиков в Австралии, с явным продолжающимся снижением количества назначений варфарина, контрастирующим с неуклонным увеличением количества назначений для всех НОАК, хотя в первую очередь для антидепрессантов. — агенты активированного фактора X (FXa) (ривароксабан и апиксабан). Это использование сопровождается сокращением лабораторного мониторинга варфарина и увеличением общих затрат на использование лекарств. Авторы недавно обновили эти данные в 2020 году (14).
Для Италии (8) д-р Franchini резюмирует организацию антикоагулянтной терапии в этой стране, представляющей регион, где тромбоз представляет собой медицинскую проблему, имеющую большое социальное значение. Таким образом, антикоагулянтная терапия в Италии претерпела изменения за последние два десятилетия, значительно улучшив лечение пациентов с тромбозами. Однако социально-экономическая нагрузка такой организационной модели высока и требует постоянных ресурсов, направляемых на реализацию персонала центров тромбоза для удовлетворения растущего спроса, возникающего в связи со старением населения с повышенным риском тромбообразования. Постепенное привлечение адекватно подготовленных врачей общей практики, работающих в тесном сотрудничестве с центрами FCSA (Федерация центров диагностики тромбозов и эпиднадзора за антитромботической терапией), может стать способом решения этой критической проблемы, преодоления существующего дисбаланса между пациентами, нуждающимися в антикоагулянтной терапии, и лицами, осуществляющими уход. .
Постепенное привлечение адекватно подготовленных врачей общей практики, работающих в тесном сотрудничестве с центрами FCSA (Федерация центров диагностики тромбозов и эпиднадзора за антитромботической терапией), может стать способом решения этой критической проблемы, преодоления существующего дисбаланса между пациентами, нуждающимися в антикоагулянтной терапии, и лицами, осуществляющими уход. .
В Словакии д-р Станчакова и его коллеги проводят обзор состояния антикоагулянтной терапии в этой стране, уделяя особое внимание ПОАК, который также представлен Национальным центром гемостаза и тромбоза, который оказывает комплексную помощь значительной группе пациентов из Словацкая Республика. Они сообщают о характеристиках своей популяции пациентов (возраст, пол, семейный анамнез, результаты тромбофилического скрининга и показания к применению антикоагулянтной терапии), а также о своем опыте применения ПОАК в рутинной клинической практике, их показаниях с точки зрения профилактики венозных тромбоэмболий и результатов измерения их эффективности и других параметров активации гемостаза.
В Иране д-р Доргалалех и его коллеги изучают использование антикоагулянтов в этой стране, где ПОАК играют все более важную роль в лечении тромбоэмболических осложнений, хотя варфарин остается наиболее широко назначаемым антикоагулянтом в Иране. Нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ) являются другими распространенными антикоагулянтами, которые также назначают в Иране. НМГ, особенно эноксапарин, используется чаще, чем НФГ. Среди НОАК ривароксабан является наиболее часто используемым антикоагулянтом в Иране. Дабигатран в качестве прямого ингибитора тромбина (DTI) является еще одним широко используемым ПОАК в Иране.
Для Франции (11) д-р Jourdi и его коллеги отмечают, что в более поздние стратегии антикоагулянтной терапии и профилактики в этой стране произошли значительные изменения. Они советуют медицинским работникам знать о соотношении пользы и риска при приеме ПОАК, а также производных гепарина и АВК, чтобы правильно обращаться с этими препаратами и убедиться, что правильный пациент получает правильную антикоагулянтную терапию в нужное время. В этом обзоре авторы кратко рассматривают антикоагулянты, доступные во Франции в 2020 году, а затем излагают различные стратегии лечения и предложения национальных групп экспертов.
В этом обзоре авторы кратко рассматривают антикоагулянты, доступные во Франции в 2020 году, а затем излагают различные стратегии лечения и предложения национальных групп экспертов.
Для Финляндии (12) д-р Helin и его коллеги определили, что, хотя ПОАК все чаще используются при общих показаниях для антикоагулянтной терапии, включая неклапанную фибрилляцию предсердий, тромбоз глубоких вен и легочную эмболию, традиционные антикоагулянты, варфарин или гепарины, по-прежнему являются основными выбор для пациентов с заменой сердечного клапана, тяжелой тромбофилией, детей, беременных и многих больных раком. Лабораторный мониторинг варфарина и гепарина хорошо налажен, в то время как при определенных неотложных состояниях ПОАК требуют специальных анализов, доступность которых может быть ограничена. Финляндия извлекает выгоду из централизованных лабораторных сетей, предлагая унифицированные услуги по всей нашей довольно малонаселенной стране. Специфические анализы для всех DOAC доступны круглосуточно и без выходных в основной лаборатории (Южная Финляндия). Взаимодействие, сотрудничество и постоянное обучение между клиникой и лабораторией становятся все более необходимыми в эпоху быстрой смены традиций в управлении антикоагулянтами.
Взаимодействие, сотрудничество и постоянное обучение между клиникой и лабораторией становятся все более необходимыми в эпоху быстрой смены традиций в управлении антикоагулянтами.
Что касается Соединенного Королевства (13), д-р Молд и его коллеги определили, что этот регион был одним из первых, где были внедрены строгие меры тромбопрофилактики для снижения риска внутрибольничного тромбоза. Совсем недавно, с появлением ПОАК, активный скрининг мерцательной аритмии стал общенациональным приоритетом. Кроме того, лучшая осведомленность о признаках и симптомах венозной тромбоэмболии означает, что пациенты получают наилучшее лечение на ранней стадии, что предотвращает осложнения. Несмотря на все эти позитивные усилия, недавно было отмечено, что некоторые аспекты антикоагулянтной терапии представляют собой проблемные области, и они дополнительно обсуждаются в этом обзоре.
Отдельный вклад Соединенных Штатов Америки предоставлен Робертом Госселином и его коллегами (15). Созданная в 2003 году Совместная комиссия по аккредитации организаций здравоохранения (JCAHO, позже известная как просто Совместная комиссия) реализовала необходимые инициативы для аккредитованных учреждений, предоставляющих медицинские услуги, для повышения безопасности пациентов. Первые шесть Национальных целей безопасности пациентов (NPSG) требовали от этих учреждений устранения выявленных недостатков, связанных с ошибочной идентификацией пациентов, общением между лицами, осуществляющими уход, использованием высокоактивных лекарств и устройств для инфузии лекарств, сокращением хирургических ошибок и клиническими предупреждениями. В 2005 году JCAHO внедрил новую NPSG, обозначенную как Цель № 3c, предназначенную для повышения безопасности использования лекарств, а в 2008 году конкретно касающуюся антикоагулянтов. Цель этого обзора — описать роли лабораторий и аптечных отделений в отношении текущих восьми обязательных элементов NPSG, связанных с безопасностью антикоагулянтов.
Созданная в 2003 году Совместная комиссия по аккредитации организаций здравоохранения (JCAHO, позже известная как просто Совместная комиссия) реализовала необходимые инициативы для аккредитованных учреждений, предоставляющих медицинские услуги, для повышения безопасности пациентов. Первые шесть Национальных целей безопасности пациентов (NPSG) требовали от этих учреждений устранения выявленных недостатков, связанных с ошибочной идентификацией пациентов, общением между лицами, осуществляющими уход, использованием высокоактивных лекарств и устройств для инфузии лекарств, сокращением хирургических ошибок и клиническими предупреждениями. В 2005 году JCAHO внедрил новую NPSG, обозначенную как Цель № 3c, предназначенную для повышения безопасности использования лекарств, а в 2008 году конкретно касающуюся антикоагулянтов. Цель этого обзора — описать роли лабораторий и аптечных отделений в отношении текущих восьми обязательных элементов NPSG, связанных с безопасностью антикоагулянтов.
В окончательной рукописи, посвященной антикоагулянтам (16), McGlasson и Fritsma исследуют обнаружение и удаление ПОАК in vitro из образцов плазмы пациентов в случаях, когда может потребоваться лабораторное тестирование и смягчены эффекты ПОАК. Ученым медицинских лабораторий часто приходится обнаруживать и идентифицировать присутствие ПОАК в плазме пациентов, особенно в экстренных случаях. Лабораторные анализы на основе сгустка или хромогенные анализы часто требуются для выявления коагулопатий, ингибиторов фактора свертывания крови или волчаночных антикоагулянтов, но они ограничены присутствием терапевтических антикоагулянтов, которые могут сделать недействительной точность анализа из-за ложного удлинения интервалов анализа на основе сгустка и влияния на хромогенный анализ. полученные результаты. Авторы описывают тест-полоску для полуколичественного анализа мочи, DOAC-Dipstick 9.0033 ® , который можно использовать для обнаружения всех ПОАК в моче и отличия пероральных DTI от пероральных ингибиторов анти-FXa. Далее авторы описывают четыре аналогичных устройства, DOAC-Stop ® , DOAC-Remove ® , DP-Filter ® и DOAC Filter ® , предназначенных для удаления ПОАЦ из плазмы путем адсорбции, фильтрации и осаждения, в то время как по существу оставляя нетронутыми нативные прокоагулянты, пригодные для тестирования.
Ученым медицинских лабораторий часто приходится обнаруживать и идентифицировать присутствие ПОАК в плазме пациентов, особенно в экстренных случаях. Лабораторные анализы на основе сгустка или хромогенные анализы часто требуются для выявления коагулопатий, ингибиторов фактора свертывания крови или волчаночных антикоагулянтов, но они ограничены присутствием терапевтических антикоагулянтов, которые могут сделать недействительной точность анализа из-за ложного удлинения интервалов анализа на основе сгустка и влияния на хромогенный анализ. полученные результаты. Авторы описывают тест-полоску для полуколичественного анализа мочи, DOAC-Dipstick 9.0033 ® , который можно использовать для обнаружения всех ПОАК в моче и отличия пероральных DTI от пероральных ингибиторов анти-FXa. Далее авторы описывают четыре аналогичных устройства, DOAC-Stop ® , DOAC-Remove ® , DP-Filter ® и DOAC Filter ® , предназначенных для удаления ПОАЦ из плазмы путем адсорбции, фильтрации и осаждения, в то время как по существу оставляя нетронутыми нативные прокоагулянты, пригодные для тестирования. В этих устройствах для адсорбции используется активированный уголь (уголь) или аналогичные составы. Авторы приходят к выводу, что, разумно выбирая и применяя эти устройства и учитывая их ограничения, лаборатории могут с достаточной уверенностью сообщать результаты на основе сгустка и хромогенного субстрата, которые попеременно зависят от присутствия ПОАК.
В этих устройствах для адсорбции используется активированный уголь (уголь) или аналогичные составы. Авторы приходят к выводу, что, разумно выбирая и применяя эти устройства и учитывая их ограничения, лаборатории могут с достаточной уверенностью сообщать результаты на основе сгустка и хромогенного субстрата, которые попеременно зависят от присутствия ПОАК.
Наконец, для этой серии AOB д-р García-Navarrete и его коллеги оценивают всемирное антитромботическое лечение синдрома липких тромбоцитов (SPS), распространенной, но малоизученной причины тромбоза (17). Здесь лечение антитромбоцитарными препаратами приводит к низкой частоте повторного тромбоза. Цель настоящего исследования состояла в том, чтобы проанализировать лечение людей с СФС в разных частях мира. Были проанализированы данные из 43 публикаций, описывающих 1783 пациента с СФС во всем мире. Данные о лечении были доступны в 16 из этих статей с участием 332 пациентов. Все 332 пациента получали антитромбоцитарные препараты; 303 человека получали только аспирин, а 29получали комбинации с аспирином (гепарин или кумадин), тогда как два человека не получали аспирин. Частота повторного тромбоза у пациентов, получавших антитромбоцитарные препараты, составила 5/332 (1,5%), и только три пациента умерли. Таким образом, авторы заключают, что большинство пациентов с СФС во всем мире лечатся антитромбоцитарными препаратами, и при таком лечении частота повторного тромбоза очень низка.
Частота повторного тромбоза у пациентов, получавших антитромбоцитарные препараты, составила 5/332 (1,5%), и только три пациента умерли. Таким образом, авторы заключают, что большинство пациентов с СФС во всем мире лечатся антитромбоцитарными препаратами, и при таком лечении частота повторного тромбоза очень низка.
В качестве приглашенного редактора этой серии я надеюсь, что читателям AOB понравится текущая подборка и что эти инициативы приведут к улучшению ведения и клинической поддержки пациентов, страдающих тромбозом или другими неблагоприятными клиническими состояниями, управляемыми или потенциально управляемыми с помощью антитромботические препараты. Тем не менее, я также признаю некоторые ограничения и упущения в этой серии. Во-первых, в мои намерения никогда не входило создание окончательной серии, охватывающей все потенциальные антитромботические средства и все возможные условия и ситуации для использования. Это было бы невыполнимой задачей. Кроме того, основное внимание в этой серии уделяется антикоагулянтной терапии, и большинство статей посвящено ПОАК. Это уместно и своевременно, поскольку эти препараты продолжают появляться как наиболее подходящие для современной антикоагулянтной терапии. Однако даже здесь необходимо признать, что новые ПОАК постоянно появляются и, таким образом, отражают нестационарную область с точки зрения использования и показаний (18). Что еще более примечательно, мы сейчас живем в эпоху COVID-19., и это отражает растущий интерес к антитромботическим препаратам (19,20), учитывая повышенный риск тромбоза при тяжелом течении COVID-19. Естественно, антикоагулянты широко представлены в качестве областей интереса (19), но список потенциальных лекарств действительно очень велик (20). С другой стороны, использование антитромботических средств не лишено рисков (21).
Это уместно и своевременно, поскольку эти препараты продолжают появляться как наиболее подходящие для современной антикоагулянтной терапии. Однако даже здесь необходимо признать, что новые ПОАК постоянно появляются и, таким образом, отражают нестационарную область с точки зрения использования и показаний (18). Что еще более примечательно, мы сейчас живем в эпоху COVID-19., и это отражает растущий интерес к антитромботическим препаратам (19,20), учитывая повышенный риск тромбоза при тяжелом течении COVID-19. Естественно, антикоагулянты широко представлены в качестве областей интереса (19), но список потенциальных лекарств действительно очень велик (20). С другой стороны, использование антитромботических средств не лишено рисков (21).
Можно отметить и другие области интереса, в частности, опасность как ложноположительной, так и отрицательной диагностики различных протромботических маркеров в зависимости от наличия антикоагулянтной терапии (22,23), а также использование агентов для нейтрализации ПОАКС перед лабораторными исследованиями. (16), особенно на протромботические маркеры (24-26), а также на маркеры кровотечения (27).
(16), особенно на протромботические маркеры (24-26), а также на маркеры кровотечения (27).
Таким образом, эта серия отражает историю, которая еще не полностью раскрыта, и мы можем подумать об обновлении через несколько лет.
Благодарности
Финансирование: Нет.
Сноска
Происхождение и рецензирование: Эта статья была подготовлена по заказу редакции Annals of Blood для серии «Антикоагулянтная и антитромботическая терапия: глобальное применение в соответствии с местными географическими критериями отбора». Статья не проходила внешнее рецензирование.
Конфликты интересов: Автор заполнил единую форму раскрытия информации ICMJE (доступна по адресу http://dx.doi.org/10.21037/aob-2020-aat-013). Серия «Антикоагулянтная и антитромботическая терапия: глобальное применение в соответствии с локально-географическими критериями отбора» выполнена по заказу редакции без какого-либо финансирования и спонсорства. EJF был неоплачиваемым приглашенным редактором сериала. У автора нет других конфликтов интересов, о которых следует заявить.
EJF был неоплачиваемым приглашенным редактором сериала. У автора нет других конфликтов интересов, о которых следует заявить.
Этическое заявление: Автор несет ответственность за все аспекты работы, обеспечивая надлежащее расследование и решение вопросов, связанных с точностью или целостностью любой части работы. Мнения, выраженные в этом обзоре, принадлежат автору, а не обязательно мнению NSW Health Pathology.
Заявление об открытом доступе: Это статья открытого доступа, распространяемая в соответствии с международной лицензией Creative Commons Attribution-NonCommercial-NoDerivs 4.0 (CC BY-NC-ND 4.0), которая разрешает некоммерческое копирование и распространение статьи. со строгим условием, что никакие изменения или правки не вносятся, а оригинальная работа правильно цитируется (включая ссылки как на официальную публикацию через соответствующий DOI, так и на лицензию). См.: https://creativecommons.org/licenses/by-nc-nd/4.0/.
См.: https://creativecommons.org/licenses/by-nc-nd/4.0/.
Каталожные номера
- Хаттак Ф., Алам М.Б., Пол Т.К. и др. Антитромботическая терапия при неклапанной фибрилляции предсердий: консенсус и проблемы. Am J Med Sci 2018; 355: 467-76. [Перекрестная ссылка] [PubMed]
- Патроно С., Мораис Дж., Бейджент С. и др. Антиагреганты для лечения и профилактики коронарного атеротромбоза. J Am Coll Cardiol 2017; 70: 1760-76. [Перекрестная ссылка] [PubMed]
- Воукалис С., Шанцила Э., Лип Г.Ю. Клиническая профилактика инсульта при мерцательной аритмии. JR Coll Physicians Edinb 2017;47:13-23. [Перекрестная ссылка] [PubMed]
- Hu P, Jones S. Антитромботическая терапия после вмешательства на периферических сосудах. Curr Cardiol Rep 2016; 18:26. [Перекрестная ссылка] [PubMed]
- Гиббс Н.М., Весман В.М., Уоттс С.А. Новые антитромботические препараты в амбулаторных условиях.
 Curr Opin Anaesthesiol 2014; 27: 589-96. [Перекрестная ссылка] [PubMed]
Curr Opin Anaesthesiol 2014; 27: 589-96. [Перекрестная ссылка] [PubMed] - Lippi G, Mattiuzzi C, Adcock D, et al. Пероральные антикоагулянты в мире: обновленный современный анализ. Энн Блад 2018;3:49. [Перекрестная ссылка]
- Favaloro EJ, McCaughan GJ, Mohammed S, et al. Антикоагулянтная терапия в Австралии. Энн Блад 2018; 3:48. [Перекрестная ссылка]
- Franchini M. Антикоагулянтная терапия в Италии. Энн Блад 2019; 4:5. [Перекрестная ссылка]
- Станчакова Л., Добротова М., Пламенова И. и соавт. Антикоагулянтная терапия в Словакии. Энн Блад 2019; 4:22. [Перекрестная ссылка]
- Доргалале А., Бейги П., Пакджу М. и др. Антикоагулянтная терапия в Иране. Энн Блад 2019;4:26. [Перекрестная ссылка]
- Журди Г., Мансур А., Вейн С. и др. Антикоагулянтная терапия во Франции: современное состояние в 2020 г. Ann Blood 2020; 5:3. [Перекрестная ссылка]
- Хелин Т.
 , Йоутси-Корхонен Л., Лассила Р. Клиническое применение и лабораторные испытания пероральной антикоагулянтной терапии: опыт Финляндии. Энн Блад 2019; 4:17. [Перекрестная ссылка]
, Йоутси-Корхонен Л., Лассила Р. Клиническое применение и лабораторные испытания пероральной антикоагулянтной терапии: опыт Финляндии. Энн Блад 2019; 4:17. [Перекрестная ссылка] - Mold H, Ul-Haq M, Thachil J. Взлеты и падения назначения антикоагулянтов в Соединенном Королевстве. Энн Блад 2019;4:18. [Перекрестная ссылка]
- Favaloro EJ, Pasalic L, Lippi G. Пероральная антикоагулянтная терапия: обновленная информация об использовании, затратах и связанных с этим рисках. Патология 2020;52:736-41. [Перекрестная ссылка] [PubMed]
- Госселин Р.С., Робертс А.Дж., Дагер В.Е. Совместная комиссия по национальным целям безопасности пациентов (NPSG), определяющая безопасность антикоагулянтов в США. Энн Блад 2019; 4:21. [Перекрестная ссылка]
- Макглассон Д.Л., Фрицма Г.А. Обнаружение in vitro и удаление прямых пероральных антикоагулянтов из образцов плазмы пациентов. Энн Блад 2020; 5:25.
- Гарсия-Наваррете Ю.
 И., Вальехо-Вильялобос М.Ф., Оливарес-Газка Х.М. и др. Первичная тромбофилия XV: антитромботическое лечение синдрома липких тромбоцитов во всем мире. Энн Блад 2019; 4:15. [Перекрестная ссылка]
И., Вальехо-Вильялобос М.Ф., Оливарес-Газка Х.М. и др. Первичная тромбофилия XV: антитромботическое лечение синдрома липких тромбоцитов во всем мире. Энн Блад 2019; 4:15. [Перекрестная ссылка] - Липпи Г., Госселин Р., Фавалоро Э.Дж. Современные и новые прямые пероральные антикоагулянты: современное состояние. Семин Тромб Хемост 2019;45:490-501. [Перекрестная ссылка] [PubMed]
- Бикдели Б., Мадхаван М.В., Хименес Д. и др. COVID-19и тромботическая или тромбоэмболическая болезнь: последствия для профилактики, антитромботической терапии и последующего наблюдения: обзор JACC. J Am Coll Cardiol 2020; 75: 2950-73. [Перекрестная ссылка] [PubMed]
- Бикдели Б., Мадхаван М.В., Гупта А. и др. Фармакологические агенты, нацеленные на тромбовоспаление при COVID-19: обзор и значение для будущих исследований. Thromb Haemost 2020; 120:1004-24. [Перекрестная ссылка] [PubMed]
- Липпи Г., Данезе Э., Фавалоро Э.
 Дж. Вред и преимущества использования аспирина для первичной профилактики сердечно-сосудистых заболеваний: описательный обзор. Семин Тромб Хемост 2019;45:157-63. [Перекрестная ссылка] [PubMed]
Дж. Вред и преимущества использования аспирина для первичной профилактики сердечно-сосудистых заболеваний: описательный обзор. Семин Тромб Хемост 2019;45:157-63. [Перекрестная ссылка] [PubMed] - Фавалоро Э.Дж. Опасность ложноотрицательного (исключение) или ложноположительного (диагноз) «врожденной тромбофилии» в эпоху антикоагулянтов. Clin Chem Lab Med 2019;57:873-82. [Перекрестная ссылка] [PubMed]
- Favaloro EJ, Mohammed S, Curnow J, et al. Лабораторное тестирование на волчаночный антикоагулянт (ЛА) у пациентов, принимающих прямые пероральные антикоагулянты (ПОАК): вероятность ложноположительных и ложноотрицательных результатов. Патология 2019;51:292-300. [Перекрестная ссылка] [PubMed]
- Экснер Т., Ригано Дж., Фавалоро Э.Дж. Влияние ПОАЦ на лабораторные тесты и их удаление активированным углем для ограничения вмешательства в функциональные анализы. Int J Lab Hematol 2020;42:41-8. [Перекрестная ссылка] [PubMed]
- Фавалоро Э.
 Дж., Гилмор Г., Аруначалам С. и др. Нейтрализация помех, вызванных ривароксабаном, в лабораторных тестах на волчаночный антикоагулянт (ЛА): сравнительное исследование с использованием ПОАК Стоп и андексанет альфа. Тромб Рес 2019;180:10-9. [Перекрестная ссылка] [PubMed]
Дж., Гилмор Г., Аруначалам С. и др. Нейтрализация помех, вызванных ривароксабаном, в лабораторных тестах на волчаночный антикоагулянт (ЛА): сравнительное исследование с использованием ПОАК Стоп и андексанет альфа. Тромб Рес 2019;180:10-9. [Перекрестная ссылка] [PubMed] - Фавалоро Э.Дж., Гилмор Г., Бонар Р. и др. Лабораторные испытания на устойчивость к активированному протеину С: интерференция, вызванная ривароксабаном, и сравнительная оценка андексанета альфа и ПОАК Стоп для нейтрализации интерференции. Clin Chem Lab Med 2020; 58: 1322-31. [Перекрестная ссылка] [PubMed]
- Фавалоро Э.Дж., Гилмор Г., Бонар Р. и др. Уменьшение эффекта вмешательства ПОАК в лабораторных тестах на фактор VIII и фактор IX: сравнительное исследование с использованием ПОАК Стоп и андексанет альфа для нейтрализации эффектов ривароксабана. Гемофилия 2020;26:354-62. [Перекрестная ссылка] [PubMed]
Эммануэль Дж. Фавалоро
Эммануэль Дж. Фавалоро 1,2,3
Фавалоро 1,2,3
1 Отделение гематологии, Институт клинической патологии и медицинских исследований,
Патология здоровья Нового Южного Уэльса, Вестмидская больница, Вестмид, Новый Южный Уэльс, Австралия;
2 Sydney Centers for Thrombosis and Haemostasis, Westmead, NSWAАвстралия;
3 Школа биомедицинских наук Университета Чарльза Стерта, Вагга-Вагга, Новый Южный Уэльс, Австралия.
(Электронная почта: [email protected])
Получено: 20 августа 2020 г.; Принято: 30 августа 2020 г.; Опубликовано: 30 сентября 2020 г.
doi: 10.21037/aob-2020-aat-013
Антитромботическая терапия Вильямсбург | Heart Attack Virginia
Антитромботическая терапия
Термин «тромбоз» означает образование тромба, типа кровяного сгустка. Тромбы могут образовываться на стенке кровеносного сосуда или в одной из камер сердца. Когда тромб препятствует притоку крови к сердцу или голове, это может вызвать сердечный приступ или инсульт. К антитромботическим препаратам относятся антикоагулянты, препятствующие свертыванию крови, и антитромбоциты, препятствующие прилипанию крошечных дисков, циркулирующих в крови, называемых тромбоцитами, к стенкам кровеносных сосудов и друг к другу.
Когда тромб препятствует притоку крови к сердцу или голове, это может вызвать сердечный приступ или инсульт. К антитромботическим препаратам относятся антикоагулянты, препятствующие свертыванию крови, и антитромбоциты, препятствующие прилипанию крошечных дисков, циркулирующих в крови, называемых тромбоцитами, к стенкам кровеносных сосудов и друг к другу.
Целями антитромботической терапии являются блокирование образования новых тромбов, предотвращение роста существующих тромбов и снижение риска осложнений от тромбов.
Для предотвращения образования тромбов или снижения риска будущих сосудистых проблем назначают антитромботические препараты, если у пациента есть тромбы или есть риск легочной эмболии, сердечного приступа или инсульта.
Эти лекарства включают:
- Антикоагулянты, препятствующие образованию тромбов и увеличению существующих тромбов
- Антитромбоцитарные препараты, препятствующие образованию тромбов путем предотвращения слипания тромбоцитов в крови
- Гемореологические препараты, уменьшающие свертываемость и повышающие гибкость эритроцитов, разжижающие кровь и облегчающие ее ток через суженные кровеносные сосуды.

Руководство по подготовке к лечению
Из-за возможного лекарственного взаимодействия пациенты, получающие антитромботическую терапию, должны проконсультироваться со своим врачом перед приемом любых рецептурных и безрецептурных лекарств, витаминов или растительных добавок. Другие рекомендации относятся к типу антитромботической терапии.
Антикоагулянты
Люди с диабетом, тяжелой аллергией, высоким кровяным давлением, заболеваниями крови, раком, внутренними кровотечениями в анамнезе, заболеваниями печени и почек должны соблюдать осторожность при приеме антикоагулянтов. Беременным женщинам следует избегать этих препаратов. Антиагрегантные препараты. Людям с низким кровяным давлением, заболеваниями печени или язвенной болезнью в анамнезе следует соблюдать осторожность при приеме антиагрегантов. Пациенты должны избегать употребления алкоголя при приеме этого типа лекарств. Беременные или кормящие женщины должны проконсультироваться со своим врачом, прежде чем принимать антитромбоцитарные препараты.
Гемореологические препараты
Людям с заболеваниями печени, почек, недавним инсультом, язвой желудка или любым заболеванием крови следует проконсультироваться со своим врачом перед приемом гемореологических препаратов. Беременные или кормящие женщины должны проконсультироваться со своим врачом, прежде чем принимать гемореологические препараты.
Чего ожидать
Антикоагулянты. Эти лекарства обычно начинают действовать через 36-48 часов.
Общие побочные эффекты могут включать:
- Тошнота
- Кожная сыпь
- Потеря веса
- Диарея
- Судороги
Антитромбоцитарные препараты
Эти лекарства обычно действуют через 10 минут – 2 часа.
Common side effects may include:
- Indigestion
- Rash
- Headache
- Nausea
- Dizziness
- Body aches
- Ringing in the ears
Hemorheologic Agents
These medications usually take effect within 2 days to 4 недели.

 Curr Opin Anaesthesiol 2014; 27: 589-96. [Перекрестная ссылка] [PubMed]
Curr Opin Anaesthesiol 2014; 27: 589-96. [Перекрестная ссылка] [PubMed] , Йоутси-Корхонен Л., Лассила Р. Клиническое применение и лабораторные испытания пероральной антикоагулянтной терапии: опыт Финляндии. Энн Блад 2019; 4:17. [Перекрестная ссылка]
, Йоутси-Корхонен Л., Лассила Р. Клиническое применение и лабораторные испытания пероральной антикоагулянтной терапии: опыт Финляндии. Энн Блад 2019; 4:17. [Перекрестная ссылка] И., Вальехо-Вильялобос М.Ф., Оливарес-Газка Х.М. и др. Первичная тромбофилия XV: антитромботическое лечение синдрома липких тромбоцитов во всем мире. Энн Блад 2019; 4:15. [Перекрестная ссылка]
И., Вальехо-Вильялобос М.Ф., Оливарес-Газка Х.М. и др. Первичная тромбофилия XV: антитромботическое лечение синдрома липких тромбоцитов во всем мире. Энн Блад 2019; 4:15. [Перекрестная ссылка] Дж. Вред и преимущества использования аспирина для первичной профилактики сердечно-сосудистых заболеваний: описательный обзор. Семин Тромб Хемост 2019;45:157-63. [Перекрестная ссылка] [PubMed]
Дж. Вред и преимущества использования аспирина для первичной профилактики сердечно-сосудистых заболеваний: описательный обзор. Семин Тромб Хемост 2019;45:157-63. [Перекрестная ссылка] [PubMed] Дж., Гилмор Г., Аруначалам С. и др. Нейтрализация помех, вызванных ривароксабаном, в лабораторных тестах на волчаночный антикоагулянт (ЛА): сравнительное исследование с использованием ПОАК Стоп и андексанет альфа. Тромб Рес 2019;180:10-9. [Перекрестная ссылка] [PubMed]
Дж., Гилмор Г., Аруначалам С. и др. Нейтрализация помех, вызванных ривароксабаном, в лабораторных тестах на волчаночный антикоагулянт (ЛА): сравнительное исследование с использованием ПОАК Стоп и андексанет альфа. Тромб Рес 2019;180:10-9. [Перекрестная ссылка] [PubMed]