Анкилозирующего спондилоартрита: Анкилозирующий спондилит (болезнь Бехтерева) — лечение
Лабораторные биомаркеры анкилозирующего спондилита | Александрова
1. Эрдес ШФ. Развитие концепции спондилоартритов. Научно-практическая ревматология. 2014;52(5):474-6 [Erdes ShF. Spondyloarthritis: Evolution of a concept. Nauchno- Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2014;52(5):474-6 (In Russ.)]. doi: 10.14412/1995-4484-2014-474-476
2. Van der Linden SM, Valkenburg HA, de Jongh BM, Cats A. The risk of developing ankylosing spondylitis in HLA-B27 positive individuals. A comparison of relatives of spondylitis patients with the general population. Arthritis Rheum. 1984;27(3):241-9. doi: 10.1002/art.1780270301
3. Raychaudhuri SP, Deodhar A. The classification and diagnostic criteria of ankylosing spondylitis. J Autoimmun. 2014;48-49:128-33. doi: 10.1016/j.jaut.2014.01.015
4. Prajzlerova K, Grobelna K, Pavelka K, et al. An update on biomarkers in axial spondyloarthritis. Autoimmun Rev. 2016;15(6):501-9. doi: 10.1016/j.autrev.2016.02.002
5. Reveille JD. Biomarkers for diagnosis, monitoring of progression, and treatment responses in ankylosing spondylitis and axial spondyloarthritis. Clin Rheumatol. 2015;34(6):1009-18. doi: 10.1007/s10067-015-2949-3
Reveille JD. Biomarkers for diagnosis, monitoring of progression, and treatment responses in ankylosing spondylitis and axial spondyloarthritis. Clin Rheumatol. 2015;34(6):1009-18. doi: 10.1007/s10067-015-2949-3
6. Maksymowych WP. Biomarkers in axial spondiloarthritis. Curr Opin Rheumatol. 2015;27:343-8. doi: 10.1097/BOR.0000000000000180
7. Navarro-Compan V, Ramiro S, Landewe R, et al. Disease activity is longitudinally related to sacroiliac inflammation on MRI in male patients with axial spondyloarthritis: 2-years of the DESIR cohort. Ann Rheum Dis. 2016;75(5):874-8. doi: 10.1136/annrheumdis-2015- 207786
8. Эрдес ШФ, Дубинина ТВ, Абдулганиева ДЭ и др. Клиническая характеристика анкилозирующего спондилита в реальной практике в России: результаты одномоментного многоцентрового неинтервенционного исследования ЭПИКА2. Научно-практическая ревматология. 2016;54(Прил 1):10-4 [Erdes ShF, Dubinina TV, Abdulganieva DE, et al. Clinical characteristics of ankylosing spondylitis in real practice in Russia: Results of the cross-sectional non-interventional trial EPICA2. Nauchno- Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2016;54(Suppl. 1):10- 14 (In Russ.)]. doi: 10.14412/1995-4484-2016-1S-10-14
Nauchno- Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2016;54(Suppl. 1):10- 14 (In Russ.)]. doi: 10.14412/1995-4484-2016-1S-10-14
9. McGonagle D, McDermott MF. A proposed classification of the immunological diseases. PLoS Med. 2006; 3(8):e297. doi: 10.1371/journal.pmed.0030297
10. Rudwaleit M, van der Heijde D, Khan MA, et al. How to diagnose axial spondyloarthritis early. Ann Rheum Dis. 2004;63(5):535-43. doi: 10.1136/ard.2003.011247
11. Van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum. 1984;27(4):361-8. doi: 10.1002/art.1780270401
12. Rudwaleit M, Landewe R, van der Heijde D, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis. 2009;68(6):770-6. doi: 10.1136/ard.2009.108217
doi: 10.1136/ard.2009.108217
13. Rudwaleit M, van der Heijde D, Landewe R, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis. 2009;68(6):777-83. doi: 10.1136/ard.2009.108233
14. Poddubnyy D, Rudwaleit M, Haibel H, et al. Rates and predictors of radiographic sacroiliitis progression over 2 years in patients with axial spondyloarthritis. Ann Rheum Dis. 2011;70(8):1369-74. doi: 10.1136/ard.2010.145995
15. Pedersen SJ, Sorensen IJ, Lambert RG, et al. Radiographic progression is associated with resolution of systemic inflammation in patients with axial spondylarthritis treated with tumor necrosis factor α inhibitors: a study of radiographic progression, inflammation on magnetic resonance imaging, and circulating biomarkers of inflammation, angiogenesis, and cartilage and bone turnover. Arthritis Rheum. 2011;63(12):3789-800. doi: 10.1002/art.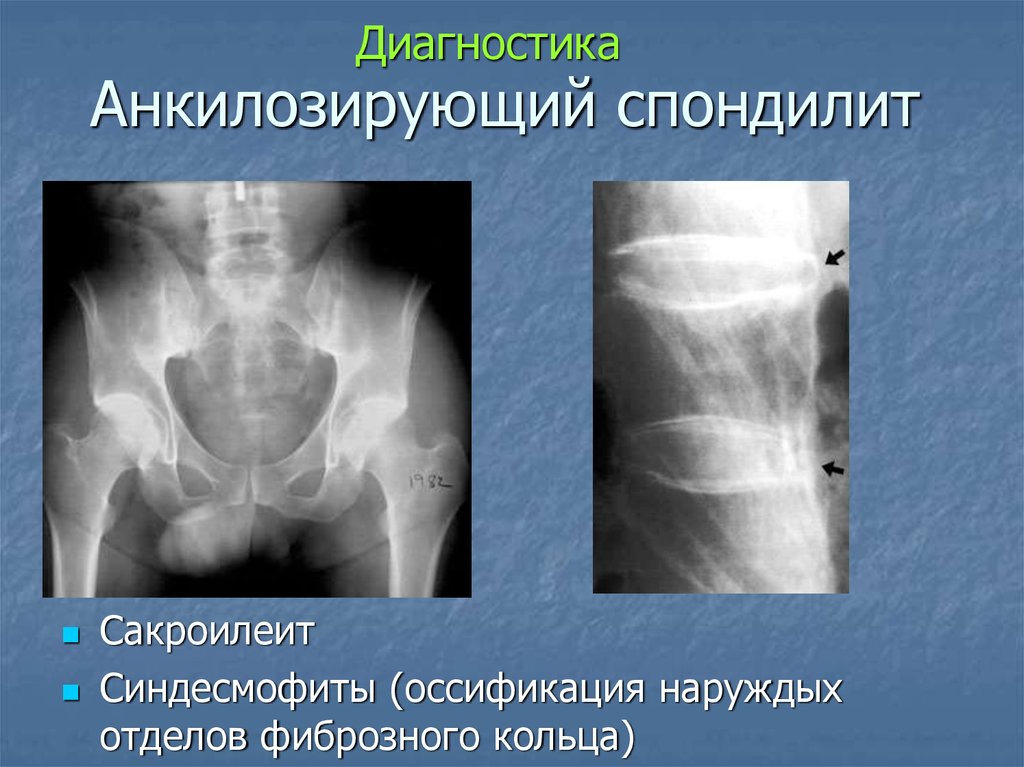 30627
30627
16. Maneiro JR, Souto A, Salgado E, et al. Predictors of response to TNF antagonists in patients with ankylosing spondylitis and psoriatic arthritis: systematic review and meta- analysis. RMD Open 2015;1:e000017. doi: 10.1136/rmdopen-2014-000017
17. Baraliakos X, Baerlecken N, Witte T, et al. High prevalence of anti-CD74 antibodies specific for the HLA class II-associated invariant chain peptide (CLIP) in patients with axial spondyloarthritis. Ann Rheum Dis. 2014;73(6):1079-82. doi: 10.1136/annrheumdis-2012-202177
18. Baerlecken NT, Nothdorft S, Stummvoll GH, et al. Autoantibodies against CD74 in spondyloarthritis. Ann Rheum Dis. 2014;73(6):1211-4. doi: 10.1136/annrheumdis-2012- 202208
19. Александрова ЕН, Новиков АА, Насонов ЕЛ. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015. Современная ревматология. 2015;9(4):25- 36 [Aleksandrova EN, Novikov AA, Nasonov EL. The 2015 guidelines for the laboratory diagnosis of rheumatic diseases by the AllRussian Public Organization «Association of Rheumatology of Russia». Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(4):25-36 (In Russ.)]. doi: 10.14412/1996-7012-2015-4-25-36
The 2015 guidelines for the laboratory diagnosis of rheumatic diseases by the AllRussian Public Organization «Association of Rheumatology of Russia». Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(4):25-36 (In Russ.)]. doi: 10.14412/1996-7012-2015-4-25-36
20. Rudwaleit M, Haibel H, Baraliakos X, et al. The early disease stage in axial spondylarthritis: results from the German Spondyloarthritis Inception Cohort. Arthritis Rheum. 2009;60(3):717-27. doi: 10.1002/art.24483
21. De Vries MK, van Eijk IC, van der Horst-Bruinsma IE, et al. Erythrocyte sedimentation rate, C-reactive protein level, and serum amyloid a protein for patient selection and monitoring of anti-tumor necrosis factor treatment in ankylosing spondylitis. Arthritis Rheum. 2009;61(11):1484-90. doi: 10.1002/art.24838
22. Spoorenberg A, van der Heijde D, de Klerk E, et al. Relative value of erythrocyte sedimentation rate and C-reactive protein in assessment of disease activity in ankylosing spondylitis. J Rheumatol. 1999;26(4):980-4.
J Rheumatol. 1999;26(4):980-4.
23. Yildirim K, Erdal A, Karatay S, et al. Relationship between some acute phase reactants and the Bath Ankylosing Spondylitis Disease Activity Index in patients with ankylosing spondylitis. South Med J. 2004;97(4):350-3. doi: 10.1097/01.SMJ.0000066946.56322.3C
24. Wallis D, Haroon N, Ayearst R, et al. Ankylosing spondylitis and nonradiographic axial spondyloarthritis: part of a common spectrum or distinct diseases? J Rheumatol. 2013;40(12):2038-41. doi: 10.3899/jrheum.130588
25. Poddubnyy D, Haibel H, Listing J, et al. Baseline radiographic damage, elevated acute- phase reactant levels, and cigarette smoking status predict spinal radiographic progression in early axial spondylarthritis. Arthritis Rheum. 2012;64(5):1388-98. doi: 10.1002/art.33465
26. Costenbader KH, Chibnik LB, Schur PH. Discordance between erythrocyte sedimentation rate and C-reactive protein measurements: clinical significance. Clin Exp Rheumatol. 2007;25:746-9.
27. Poddubnyy DA, Rudwaleit M, Listing J, et al. Comparison of a high sensitivity and standard C reactive protein measurement in patients with ankylosing spondylitis and non- radiographic axial spondyloarthritis. Ann Rheum Dis. 2010;69(7):1338-41. doi: 10.1136/ard.2009.120139
Poddubnyy DA, Rudwaleit M, Listing J, et al. Comparison of a high sensitivity and standard C reactive protein measurement in patients with ankylosing spondylitis and non- radiographic axial spondyloarthritis. Ann Rheum Dis. 2010;69(7):1338-41. doi: 10.1136/ard.2009.120139
28. Pedersen SJ, Sorensen IJ, Garnero P, et al. ASDAS, BASDAI and different treatment responses and their relation to biomarkers of inflammation, cartilage and bone turnover in patients with axial spondyloarthritis treated with TNF? inhibitors. Ann Rheum Dis. 2011;70(8):1375-81. doi: 10.1136/ard.2010.138883
29. Visvanathan S, Wagner C, Marini JC, et al. Inflammatory biomarkers, disease activity and spinal disease measures in patients with ankylosing spondylitis after treatment with infliximab. Ann Rheum Dis. 2008;67(4):511-7. doi: 10.1136/ard.2007.071605
30. Румянцева ОА, Бочкова АГ, Логинова ЕЮ и др. Влияние терапии инфликсимабом на лабораторные маркеры воспаления у больных анкилозирующим спондилитом. Эффективная фармакотерапия. 2011;(40):22-8 [Rumyantseva OA, Bochkova AG, Loginova EYu, et al. Effect of infliximab therapy on laboratory markers of inflammation in patients with ankylosing spondylitis. Effektivnaya Farmakoterapiya. 2011;(40):22-8 (In Russ.)].
Эффективная фармакотерапия. 2011;(40):22-8 [Rumyantseva OA, Bochkova AG, Loginova EYu, et al. Effect of infliximab therapy on laboratory markers of inflammation in patients with ankylosing spondylitis. Effektivnaya Farmakoterapiya. 2011;(40):22-8 (In Russ.)].
31. Sieper J, Appel H, Braun J, Rudwaleit M. Critical appraisal of assessment of structural damage in ankylosing spondylitis: implications for treatment outcomes. Arthritis Rheum. 2008;58(3):649-56. doi: 10.1002/art.23260
32. Eklund KK, Niemi K, Kovanen PT. Immune functions of serum amyloid A. Crit Rev Immunol. 2012;32(4):335-48. doi: 10.1615/CritRevImmunol.v32.i4.40
33. Lange U, Boss B, Teichmann J, et al. Serum amyloid A- an indicator of inflammation in ankylosing spondylitis. Rheumatol Int. 2000;19(4):119-22. doi: 10.1007/s002960050114
34. Jung SY, Park MC, Park YB, Lee SK. Serum amyloid a as a useful indicator of disease activity in patients with ankylosing spondylitis. Yonsei Med J. 2007;48(2):218-24. doi: 10. 3349/ymj.2007.48.2.218
3349/ymj.2007.48.2.218
35. Vogl T, Tenbrock K, Ludvig S, et al. Mrp8 and Mrp14 are endogenous activators of Toll- like receptor 4, promoting lethal, endotoxine- induced shock. Nat Med. 2007;13:1042-9. doi: 10.1038/nm1638
36. Turina MC, Yeremenko N, Paramatra JE, et al. Calprotectin (S100A8/9) as serum biomarker for clinical response in proof-ofconcept trials in axial and peripheral spondyloarthritis. Arthritis Res Ther. 2014;16:413. doi: 10.1186/s13075-014-0413-4
37. Cypers H, Varkas G, Beeckman S, et al. Elevated calprotectin levels reveal bowel inflammation in spondyloarthritis. Ann Rheum Dis. 2015;0:1-6. doi: 10.1136/annrheumdis- 2015-208025
38. Oktayoglu P, Bozkurt M, Mete N, et al. Elevated serum levels of calprotectin (myeloid- related protein 8/14) in patients with ankylosing spondylitis and its association with disease activity and quality of life. J Investig Med. 2014;62: 880-4. doi: 10.1097/JIM.0000000000000095
39. Turina MC, Sieper J, Yeremenko N, et al. Calprotectin serum level is an independent marker for radiographic spinal progression in axial spondyloarthritis. Ann Rheum Dis. 2014;73:1746-8. doi: 10.1136/annrheumdis-2014-205506
Calprotectin serum level is an independent marker for radiographic spinal progression in axial spondyloarthritis. Ann Rheum Dis. 2014;73:1746-8. doi: 10.1136/annrheumdis-2014-205506
40. Rudd CE, Taylor A, Schneider H. CD28 and CTLA-4 coreceptor expression and signal transduction. Immunol Rev. 2009;229:12-26. doi: 10.1111/j.1600-065X.2009.00770.x
41. Toussirot E, Saas P, Deschamps M, et al. Increased production of soluble CTLA-4 in patients with spondyloarthropathies correlates with diseases activity. Arthritis Res Ther. 2009;11:R101. doi: 10.1186/ar2747
42. Song IH, Heldmann F, Rudwaleit M, et al. Treatment of active ankylosing spondylitis with abatacept: an open-label, 24-week pilot study. Ann Rheum Dis. 2011;70:1108-10. doi: 10.1136/ard.2010.145946
43. Davis JC Jr. Understanding the role of tumor necrosis factor inhibition in ankylosing spondylitis. Semin Athritis Rheum. 2005;34:668-77. doi: 10.1016/j.semarthrit.2004.08.005
44. Braun J, Baraliakos X, Heldmann F, Kiltz U. Tumor necrosis factor alpha antagonists in the treatment of axial spondyloarthritis. Expert Opin Investig Drug. 2014;23:647-59. doi: 10.1517/13543784.2014.899351
Tumor necrosis factor alpha antagonists in the treatment of axial spondyloarthritis. Expert Opin Investig Drug. 2014;23:647-59. doi: 10.1517/13543784.2014.899351
45. Sherlock JP, Taylor PC, Buckley CD. The biology of IL-23 and IL-17 and their therapeutic targeting in rheumatic diseases. Curr Opin Rheumatol. 2015;27:71-5. doi: 10.1097/BOR.0000000000000132
46. Xueyi L, Lina C, Zhenbao W, et al. Levels of circulating Th27 cells and regulatory T cells in ankylosing spondylitis patients with an inadequate response to anti-TNF-alpha therapy. J Clin Immunol. 2013;33:151-61. doi: 10.1007/s10875-012-9774-0
47. Gratacos J, Collado A, Filella X, et al. Serum cytokines (IL-6, TNF-alpha, IL-1 beta and IFN- gamma) in ankylosing spondylitis: a close correlation between serum IL-6 and disease activity and severity. Br J Rheumatol. 1994;33:927-31. doi: 10.1093/rheumatology/33.10.927
48. Neumann E, Junker S, Schett G, et al. Adipokines in bone disease. Nat Rev Rheumatol. 2016;12(5):296-302. doi: 10.1038/nrrheum.2016.49
doi: 10.1038/nrrheum.2016.49
49. Syrbe U, Callhoff J, Conrad K, Poddubnyy D, et al. Serum adipokine levels in patients with ankylosing spondylitis and their relationship to clinical parameters and radiographic spinal progression. Arthritis Rheum. 2015;67(3):678-85. doi: 10.1002/art.38968
50. Park MC, Lee SW, Choi ST, et al. Serum leptin levels correlate with interleukin-6 levels and disease activity in patients with ankylosing spondylitis. Scand J Rheumatol. 2007;36(2):101-6. doi: 10.1080/03009740600991760
51. Kim KJ, Kim JY, Park SJ, et al. Serum leptin levels are associated with the presence of syndesmophytes in male patients with ankylosing spondylitis. Clin Rheumatol. 2012;31(8):1231-8. doi: 10.1007/s10067-012-1999-z
52. Pedersen SJ, Hetland ML, Sorensen IJ, et al. Circulating levels of interleukin-6, vascular endothelial growth factor, YKL-40, matrix metalloproteinase-3, and total aggrecan in spondyloarthritis patients during 3 years of treatment with TNFα inhibitors.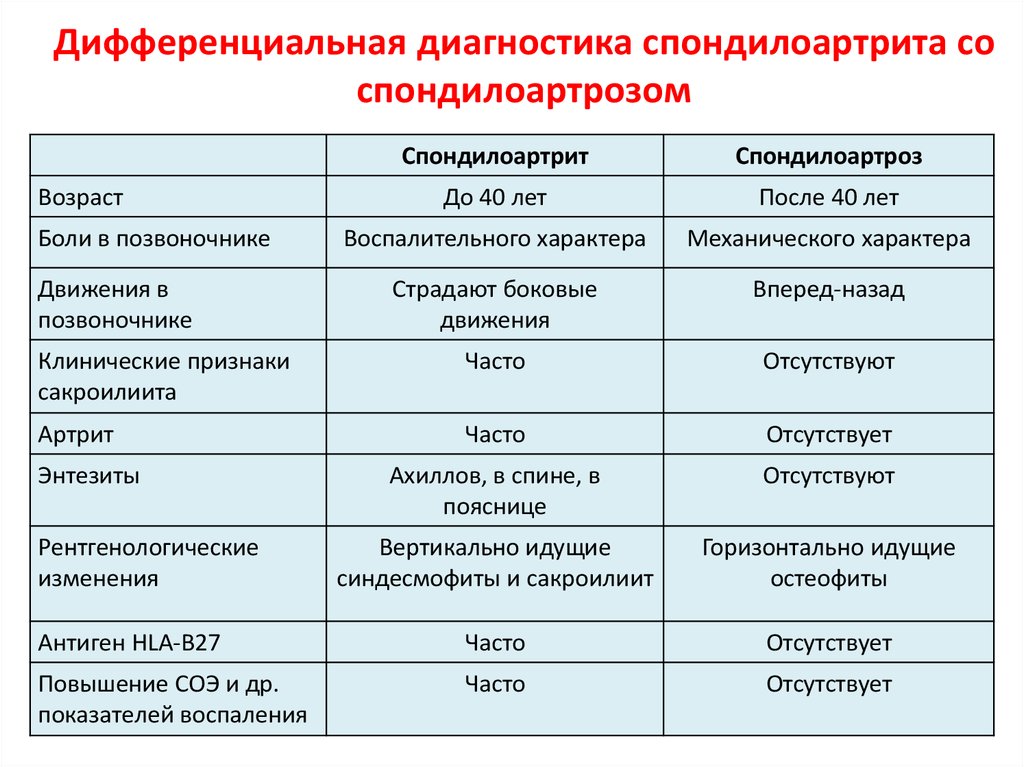 Clin Rheumatol. 2010;29(11):1301-9. doi: 10.1007/s10067-010-1528-x
Clin Rheumatol. 2010;29(11):1301-9. doi: 10.1007/s10067-010-1528-x
53. Drouart M, Saas P, Billot M, et al. High serum vascular endothelial growth factor correlates with disease activity of spondylarthropathies. Clin Exp Immunol. 2003;132(1):158-62. doi: 10.1046/j.1365-2249.2003.02101.x
54. Appel H, Janssen L, Listing J, et al. Serum levels of biomarkers of bone and cartilage destruction and new bone formation in different cohorts of patients with axial spondyloarthritis with and without tumor necrosis factor-alpha blocker treatment. Arthritis Res Ther. 2008;10(5):R125. doi: 10.1186/ar2537
55. Poddubnyy D, Conrad K, Haibel H, et al. Elevated serum level of the vascular endothelial growth factor predicts radiographic spinal progression in patients with axial spondyloarthritis. Ann Rheum Dis. 2014;73(12):2137-43. doi: 10.1136/annrheumdis-2013-203824
56. Christgau S, Garnero P, Fledelius C, et al. Collagen type II Ctelopeptide fragments as an index of cartilage degradation. Bone. 2001;29(3):209-15. doi: 10.1016/S8756-3282(01)00504-X
Bone. 2001;29(3):209-15. doi: 10.1016/S8756-3282(01)00504-X
57. Park MC, Chung SJ, Park YB, Lee SK. Bone and cartilage turnover markers, bone mineral density, and radiographic damage in men with ankylosing spondylitis. Yonsei Med J. 2008;49(2):288-94. doi: 10.3349/ymj.2008.49.2.288
58. Vosse D, Landewe R, Garnero P, et al. Association of markers of bone- and cartilage- degradation with radiological changes at baseline and after 2 years follow-up in patients with ankylosing spondylitis. Rheumatology (Oxford). 2008;47(8):1219-22. doi: 10.1093/rheumatology/ken148
59. Maksymowych WP, Rahman P, Shojania K, et al. Beneficial effects of adalimumab on biomarkers reflecting structural damage in patients with ankylosing spondylitis. J Rheumatol. 2008;35(10):2030-7.
60. Bay-Jensen AC, Wichuk S, Byrjalsen I, et al. Circulating protein fragments of cartilage and connective tissue degradation are diagnostic and prognostic markers of rheumatoid arthritis and ankylosing spondylitis. PLoS One. 2013;8(1):e54504. doi: 10.1371/journal.pone.0054504
PLoS One. 2013;8(1):e54504. doi: 10.1371/journal.pone.0054504
61. Visvanathan S, van der Heijde D, Deodhar A, et al. Effects of infliximab on markers of inflammation and bone turnover and associations with bone mineral density in patients with ankylosing spondylitis. Ann Rheum Dis. 2009;68(2):175-82. doi: 10.1136/ard.2007.084426
62. Arends S, Spoorenberg A, Efde M, et al. Higher bone turnover is related to spinal radiographic damage and low bone mineral density in ankylosing spondylitis patients with active disease: a crosssectional analysis. PLoS One. 2014;9(6):e99685. doi: 10.1371/journal.pone.0099685
63. Wendling D, Cedoz JP, Racadot E. Serum levels of MMP-3 and cathepsin K in patients with ankylosing spondylitis: effect of TNFalpha antagonist therapy. Joint Bone Spine. 2008;75(5):559-62. doi: 10.1016/j.jbspin.2008.01.026
64. Neidhart M, Baraliakos X, Seemayer C, et al. Expression of cathepsin K and matrix metalloproteinase 1 indicate persistent osteodestructive activity in long-standing ankylosing spondylitis. Ann Rheum Dis. 2009;68(8):1334-9. doi: 10.1136/ard.2008.092494
Ann Rheum Dis. 2009;68(8):1334-9. doi: 10.1136/ard.2008.092494
65. Choi ST, Kim JH, Kang EJ, et al. Osteopontin might be involved in bone remodelling rather than in inflammation in ankylosing spondylitis. Rheumatology (Oxford). 2008;47(12):1775-9. doi: 10.1093/rheumatology/ken385
66. Pinzone JJ, Hall BM, Thudi NK, et al. The role of Dickkopf-1 in bone development, homeostasis, and disease. Blood. 2009;113(3):517-25. doi: 10.1182/blood-2008-03-145169
67. Kwon SR, Lim MJ, Suh CH, et al. Dickkopf-1 level is lower in patients with ankylosing spondylitis than in healthy people and is not influenced by anti-tumor necrosis factor therapy. Rheumatol Int. 2012;32(8):2523-7. doi: 10.1007/s00296-011-1981-0
68. Daoussis D, Liossis SN, Solomou EE, et al. Evidence that Dkk-1 is dysfunctional in ankylosing spondylitis. Arthritis Rheum. 2010;62(1):150-8. doi: 10.1002/art.27231
69. Heiland GR, Appel H, Poddubnyy D, et al. High level of functional dickkopf-1 predicts protection from syndesmophyte formation in patients with ankylosing spondylitis. Ann Rheum Dis. 2012;71(4):572-4. doi: 10.1136/annrheumdis-2011-200216
Ann Rheum Dis. 2012;71(4):572-4. doi: 10.1136/annrheumdis-2011-200216
70. Poole KE, van Bezooijen RL, Loveridge N. Sclerostin is a delayed secreted product of osteocytes that inhibits bone formation. FASEB J. 2005;19(13):1842-4. doi: 10.1096/fj.05- 4221fje
71. Appel H, Ruiz-Heiland G, Listing J, et al. Altered skeletal expression of sclerostin and its link to radiographic progression in ankylosing spondylitis. Arthritis Rheum. 2009;60(11):3257-62. doi: 10.1002/art.24888
72. Saad CG, Ribeiro AC, Moraes JC, et al. Low sclerostin levels: a predictive marker of persistent inflammation in ankylosing spondylitis during anti-tumor necrosis factor therapy? Arthritis Res Ther. 2012;14(5):R216. doi: 10.1186/ar4055
73. Mattey DL, Packham JC, Nixon NB, et al. Association of cytokine and matrix metalloproteinase profiles with disease activity and function in ankylosing spondylitis. Arthritis Res Ther. 2012;14(3):R127. doi: 10.1186/ar3857
74. Maksymowych WP, Landewe R, Conner-Spady B, et al. Serum matrix metalloproteinase 3 is an independent predictor of structural damage progression in patients with ankylosing spondylitis. Arthritis Rheum. 2007;56(6):1846-53. doi: 10.1002/art.22589
Serum matrix metalloproteinase 3 is an independent predictor of structural damage progression in patients with ankylosing spondylitis. Arthritis Rheum. 2007;56(6):1846-53. doi: 10.1002/art.22589
75. Bay-Jensen AC, Karsdal MA, Vassiliadis E, et al. Circulating citrullinated vimentin fragments reflect disease burden in ankylosing spondylitis and have prognostic capacity for radiographic progression. Arthritis Rheum. 2013;65(4):972-80. doi: 10.1002/art.37843
76. Chandra PE, Sokolove J, Hipp BG, et al. Novel multiplex technology for diagnostic characterization of rheumatoid arthritis. Arthritis Res Ther. 2011;13(3):R102. doi: 10.1186/ar3383
77. Wagner C, Visvanathan S, Braun J, et al. Serum markers associated with clinical improvement in patients with ankylosing spondylitis treated with golimumab. Ann Rheum Dis. 2012;71:674-80. doi: 10.1136/ard.2010.148890
Современные принципы терапии анкилозирующего спондилоартрита | Кимова А.М.
В статье представлены современные принципы терапии анкилозирующего спондилоартрита
Для цитирования. Кимова А.М. Современные принципы терапии анкилозирующего спондилоартрита // РМЖ. 2015. No 25. С. 1499–1503.
Кимова А.М. Современные принципы терапии анкилозирующего спондилоартрита // РМЖ. 2015. No 25. С. 1499–1503.
Анкилозирующиий спондилит (АС) (болезнь Бехтерева, болезнь Штрюмпеля – Мари – Бехтерева) – это хроническое воспалительное заболевание позвоночника (спондилит), крестцово-подвздошных суставов (сакроилеит), нередко периферических суставов (артрит), энтезисов (энтезит), в ряде случаев – глаз (увеит), сердечно-сосудистой системы – корня аорты (аортит), других внутренних органов.
О данном заболевании было известно еще в Древнем Египте. Первые описания АС в зарубежной литературе сделаны А. Штрюмпелем (1884) и П. Мари (1898) и расценивались как вариант хронического суставного ревматизма [1]. В отечественной литературе приоритет отдается В.М. Бехтереву, хотя клиническая картина больных с «одеревенелостью позвоночника», описанная Бехтеревым, отличалась от классической клиники АС. Однако В.М. Бехтерев привлек большое внимание к проблеме АС, что послужило толчком к изучению АС и других спондилоартритов [2].
Классификационные модифицированные Нью-Йоркские критерии диагноза АС (1984):
1. Боль и скованность в нижней части спины – более 3-х мес., уменьшающиеся после физических упражнений и усиливающиеся в покое.
2. Ограничение движений в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях.
3. Уменьшение экскурсии грудной клетки (в сравнении с показателями нормы для пола и возраста).
4. Двусторонний сакроилеит 2–4 стадии или односторонний сакроилеит 3–4 стадии.
Диагноз определенного АС устанавливается при наличии рентгенологического и хотя бы 1 клинического критерия [3].
 Это связано с рядом причин, таких как:
Это связано с рядом причин, таких как:– разнообразие клинической картины в дебюте заболевания;
– внепозвоночные поражения, в связи с чем больные обращаются к различным специалистам;
– медленное развитие рентгенологических признаков сакроилеита, которые имеют решающее значение;
– спонтанные длительные ремиссии в первые годы болезни;
– отсутствие иммунологических маркеров;
– отсутствие достаточных знаний о дебюте АС у врачей других специальностей.
Клиническая картина АС не зависит от пола и наличия HLA-B27. Примерно в 25% случаев заболевание появляется в детском возрасте. Далеко не всегда АС начинается со спондилита или сакроилеита.
Варианты начала заболевания
Поражение позвоночника
Поражение позвоночника обычно начинается с крестцово-подвздошных суставов с постепенным переходом на вышележащие отделы.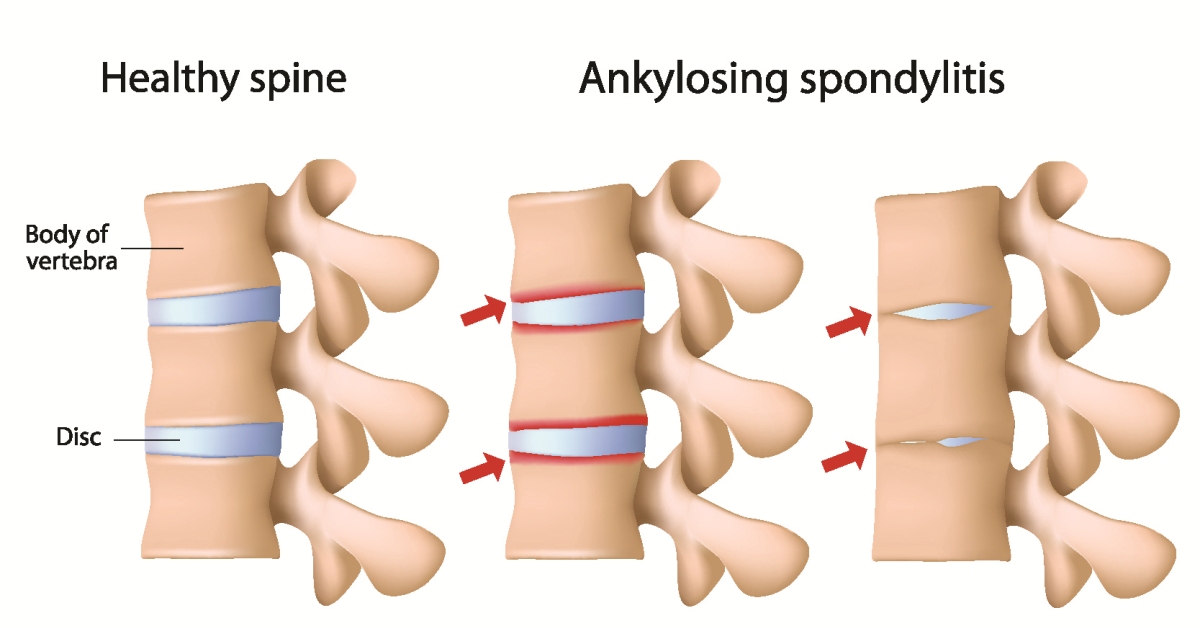 Сакроилеит проявляется перемежающейся болью в области ягодиц, иррадиирующей в ягодичные складки, по задней поверхности бедра, в паховую область. Постепенно боль нарастает, становится двухсторонней. Для ранней стадии болезни характерна также воспалительная боль в нижней части спины, для диагностики которой разработаны следующие критерии:
Сакроилеит проявляется перемежающейся болью в области ягодиц, иррадиирующей в ягодичные складки, по задней поверхности бедра, в паховую область. Постепенно боль нарастает, становится двухсторонней. Для ранней стадии болезни характерна также воспалительная боль в нижней части спины, для диагностики которой разработаны следующие критерии:
– постепенно нарастающее течение;
– уменьшение боли после физических упражнений;
– отсутствие улучшения в покое;
– ночная боль.
Боль считается воспалительной при наличии 4 из 5 признаков. При АС в процесс вовлекаются все отделы позвоночника. Заболевание часто протекает под маской пояснично-крестцового радикулита. При поражении грудного отдела позвоночника, реберно-позвоночных суставов отмечается боль в грудной клетке, иногда опоясывающего характера. Боль усиливается при кашле, глубоком вдохе, поворотах. Поражение реберно-позвоночных суставов способствует уменьшению экскурсии грудной клетки, что в дальнейшем ведет к уменьшению жизненной емкости легких.
 Поражение шейного отдела прозвоночника происходит в более поздние сроки и приводит к уменьшению объема движения головы и шеи. Спондилит шейного отдела может сопровождаться явлениями дисциркуляторной энцефалопатии. Боль в позвоночнике рефлекторно вызывает спазм мышц, что приводит к ограничению подвижности позвоночника. На ранних стадиях заболевания ограничение объема движения в позвоночнике обусловлено воспалительными явлениями и рефлекторным спазмом мускулатуры на фоне боли, на стадии развернутых клинических проявлений движения ограничены вследствие оссификации позвоночника. Со временем в результате воспалительного поражения позвоночника происходят изменения осанки, характерные для АС: поза «просителя», поза «гордеца».
Поражение шейного отдела прозвоночника происходит в более поздние сроки и приводит к уменьшению объема движения головы и шеи. Спондилит шейного отдела может сопровождаться явлениями дисциркуляторной энцефалопатии. Боль в позвоночнике рефлекторно вызывает спазм мышц, что приводит к ограничению подвижности позвоночника. На ранних стадиях заболевания ограничение объема движения в позвоночнике обусловлено воспалительными явлениями и рефлекторным спазмом мускулатуры на фоне боли, на стадии развернутых клинических проявлений движения ограничены вследствие оссификации позвоночника. Со временем в результате воспалительного поражения позвоночника происходят изменения осанки, характерные для АС: поза «просителя», поза «гордеца». Поражение периферических суставов
Периферический артрит отмечается на протяжении всей болезни более чем у половины больных и начинается преимущественно с суставов нижних конечностей. Наиболее часто поражаются тазобедренные, коленные, голеностопные суставы, реже – височно-нижнечелюстные, плюсне-фаланговые, плечевые.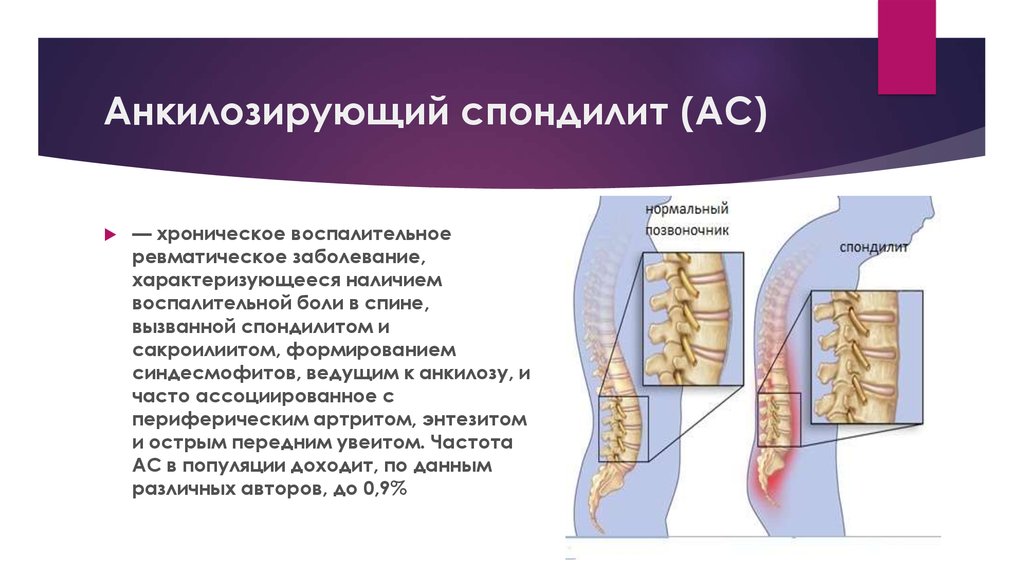
Энтезиты
Воспаление энтезисов при АС закономерно. При АС энтезиты проявляются болями при движении, в котором участвует соответствующее сухожилие, болезненностью, а иногда отечностью области энтезиса. Энтезиты обычно появляются в области пяток, локтевых, коленных, плечевых и тазобедренных суставов. В воспалительный процесс вовлекается подлежащая кость (остит), что ведет к развитию эрозий и дальнейшей оссификации и избыточному костеобразованию. Эти явления лежат в основе появления своеобразных рентгенологических изменений, характерных для АС: внесуставного эрозирования кости, субхондрального остеосклероза, костной пролиферации («шпоры») и периостита.
Увеит
Частота увеитов при системных ревматических заболеваниях составляет от 25 до 50%. Увеит является самым частым внескелетным проявлением АС, может быть манифестацией и долгое время – единственным проявлением заболевания. Увеит начинается остро и длится до 3 мес., имеет рецидивирующий характер, может поражать все отделы увеального тракта. В процесс поочередно могут вовлекаться оба глаза. У больных отмечаются боль в глазу, фотофобия, слезотечение, гиперемия конъюнктивы. Развитие осложнений приводит к снижению зрения и слепоте в молодом, трудоспособном возрасте. Слепота и слабовидение могут составить от 10 до 35% среди заболеваний глаза [9].
Поражение сердца и аорты
Поражение сердца и аорты определяет прогноз заболевания и тактику лечебных мероприятий. Известно отсутствие взаимосвязи между активностью и тяжестью поражения опорно-двигательного аппарата. Несмотря на то, что поражение сердечно-сосудистой системы зачастую протекает субклинически, на секции поражение аорты и клапанов аорты обнаруживают в 24–100% случаев [4, 11].
Несмотря на то, что поражение сердечно-сосудистой системы зачастую протекает субклинически, на секции поражение аорты и клапанов аорты обнаруживают в 24–100% случаев [4, 11].
Ранняя постановка диагноза АС позволяет избежать ненужных обследований и уберечь пациентов от неправильной терапии, в т. ч. от оперативных манипуляций, ориентировать пациента на систематический прием нестероидных противоспалительных препаратов (НПВП), а при неблагоприятном прогнозе АС – назначить ингибиторы фактора некроза опухоли (анти-ФНО-терапия) в ранние сроки. Обучение лечебной физкультуре и здоровому образу жизни способствует более благоприятному исходу АС.
Лечение АС
Должно основываться на имеющихся в момент осмотра клинических признаках болезни (позвоночные, суставные, энтезисные симптомы), их выраженности, наличии индикаторов прогноза: активности болезни/ воспаления, функциональных возможностей/трудоспособности, структурных повреждений, вовлечения тазобедренных суставов, деформации позвоночника, общеклиническом статусе (возраст, пол, сопутствующие болезни и терапия), ожиданиях и предпочтениях пациента. Ведение пациента с АС требует обязательной комбинации нефармакологических и фармакологических методов лечения.
Ведение пациента с АС требует обязательной комбинации нефармакологических и фармакологических методов лечения.
Немедикаментозные методы лечения
К немедикаментозным методам лечения относятся ежедневное выполнение комплекса физических упражнений, направленных на поддержание достаточного объема движения в позвоночнике и крупных суставах, укрепление скелетных мышц [12]; дыхательная гимнастика, массаж спины, физиотерапевтические процедуры с различными противовоспалительными мазями в виде фонофореза, бальнеолечение: радоновые и сероводородные ванны. Функциональное состояние позвоночника у лиц, регулярно занимающихся ЛФК и тренировкой мышц, лучше, чем у больных, по тем или иным причинам пренебрегающих упражнениями. Нефармакологические методы при АС могут включать образовательные программы – школы для больных. Они могут проводиться как в индивидуальном, так и в групповом режиме. Нефармакологические методы лечения при АС имеют лишь вспомогательное значение.
Фармакологические методы лечения
Фармакологические методы лечения объединяют препараты нескольких групп: НПВП, миорелаксанты, кортикостероиды, анти-ФНО-терапию.
НПВП
Несмотря на давность применения НПВП в практике ревматолога, в современных рекомендациях EULAR/ ASAS они по-прежнему являются препаратами первой линии при лечении АС, поскольку их отличает уникальное сочетание обезболивающего, противовоспалительного и жаропонижающего эффекта [5]. Длительное применение и высокая эффективность НПВП в отношении боли воспалительного характера поднимают вопрос об их способности оказывать не только симптоматическое, но и болезнь-модифицирующее действие, т. е. замедление рентгенологического прогрессирования. Недавнее наблюдение A. Wanders et al. подтвердило, что НПВП способны замедлять рентгенологическое прогрессирование (оссификацию) в позвоночнике. По данным этого исследования, оказалось, что средние величины рентгенологических изменений были достоверно меньше у пациентов, принимавших НПВП постоянно, а не по требованию.
 Порой для устранения болевого синдрома и утренней скованности необходима последовательная смена 2–3 препаратов.
Порой для устранения болевого синдрома и утренней скованности необходима последовательная смена 2–3 препаратов.Наиболее эффективными препаратами для лечения АС являются классические (стандартные) препараты: диклофенак, индометацин, кетопрофен, напроксен. Однако частота побочных реакций у этой группы препаратов, особенно при длительном приеме, который требуется при лечении АС, заставляет отдать предпочтение селективным ингибиторам ЦОГ-2. В свою очередь среди последних выделяются умеренно селективные (мелоксикам, нимесулид, набуметон, этодолак) и высокоселективные (целекоксиб, вальдекоксиб, эторикоксиб, лумирококсиб). Выбор препарата должен основываться на анализе достоинств и недостатков различных групп НПВП, причем с учетом наличия анальгетического, противовоспалительного эффектов в сочетании с хорошей переносимостью (безопасность по отношению к желудочно-кишечному тракту (ЖКТ) и сердечно-сосудистой системе). В России многие эксперты препаратом, обладающим указанными свойствами, считают нимесулид (Найз).
 Достоинства данного препарата отмечают и многие мировые эксперты. В статье, посвященной 25-летию использования нимесулида в Италии, С. Mattia et al. указали на очевидное преобладание положительных качеств этого лекарства [6]. Эти выводы подтверждены клиническими исследованиями ученых из НИИР им. В.А. Насоновой – А.Е. Каратеевым и соавт. Ретроспективный анализ частоты осложнений со стороны ЖКТ, кардиоваскулярной системы и печени у больных, поступивших в НИИР с 2007 по 2008 г. и принимавших нимесулид в дозе 200 мг не менее 12 мес. до поступления, показал, что помимо эффективных анальгетических, противовоспалительных свойств препарат Найз обладает хорошей переносимостью. Нимесулид зарекомендовал себя как эффективное средство для купирования боли. Он обладает высокой биодоступностью – уже через 30 мин после перорального приема достигается значительная концентрация препарата в крови, составляющая не менее 25% от максимальной. Полный обезболивающий и противовоспалительный эффект нимесулида наступает через 1–3 ч после приема.
Достоинства данного препарата отмечают и многие мировые эксперты. В статье, посвященной 25-летию использования нимесулида в Италии, С. Mattia et al. указали на очевидное преобладание положительных качеств этого лекарства [6]. Эти выводы подтверждены клиническими исследованиями ученых из НИИР им. В.А. Насоновой – А.Е. Каратеевым и соавт. Ретроспективный анализ частоты осложнений со стороны ЖКТ, кардиоваскулярной системы и печени у больных, поступивших в НИИР с 2007 по 2008 г. и принимавших нимесулид в дозе 200 мг не менее 12 мес. до поступления, показал, что помимо эффективных анальгетических, противовоспалительных свойств препарат Найз обладает хорошей переносимостью. Нимесулид зарекомендовал себя как эффективное средство для купирования боли. Он обладает высокой биодоступностью – уже через 30 мин после перорального приема достигается значительная концентрация препарата в крови, составляющая не менее 25% от максимальной. Полный обезболивающий и противовоспалительный эффект нимесулида наступает через 1–3 ч после приема.
Как известно, фармакологическое действие всех НПВП связано с блокадой ЦОГ-2, а ассоциированные с их приемом осложнения со стороны ЖКТ в основном определяются подавлением активности ЦОГ-1 в слизистой оболочке ЖКТ. Но ЦОГ-1 также принимает участие в развитии воспаления, и поэтому локальное снижение ее активности в области повреждения следует рассматривать как положительный фактор. Таким действием обладает нимесулид – он лишь в небольшой степени влияет на «структурную» ЦОГ-1 слизистой желудка, но существенно снижает эффекты этого фермента в области воспаления. В последнее время активно обсуждается вопрос о центральных эффектах НПВП, связанных с их способностью проникать в ткань центральной нервной системы и влиять на развитие ряда звеньев патогенеза хронической боли, связанной с активацией центральной болевой системы (феномен «центральной сенситизации»). Нимесулид, очевидно, обладает таким действием, что подтверждается данными экспериментальных и клинических исследований.
 Есть серьезное основание предполагать, что нимесулид обладает рядом фармакологических эффектов, независимых от класс-специфического воздействия на ЦОГ-2. В частности, он подавляет гиперпродукцию главных провоспалительных цитокинов (интерлейкин-6, ФНО-a), снижает активность металлопротеиназ.
Есть серьезное основание предполагать, что нимесулид обладает рядом фармакологических эффектов, независимых от класс-специфического воздействия на ЦОГ-2. В частности, он подавляет гиперпродукцию главных провоспалительных цитокинов (интерлейкин-6, ФНО-a), снижает активность металлопротеиназ.Эффективность нимесулида для купирования острой и хронической боли при ревматических заболеваниях (РЗ) подтверждается серией клинических испытаний. Так, имеются данные о его использовании при послеоперационном обезболивании. При остром ревматическом воспалении околосуставных мягких тканей – энтезитах, бурситах и тендинитах он демонстрирует хороший терапевтический эффект, сопоставимый или более выраженный, чем действие высоких доз «традиционных» НПВП – диклофенака и напроксена. В частности, W. Wober et al. провели исследование, в ходе которого 122 пациента с субакромиальным бурситом и тендинитом в течение 14 дней принимали нимесулид 200 мг/сут или диклофенак 150 мг/сут. При этом «хороший» или «отличный» ответ на лечение несколько чаще отмечался у лиц, принимавших нимесулид, – 82,3%, в сравнении с 78,0% в группе диклофенака.
 Субъективная оценка переносимости использованных лекарств демонстрировала еще более выраженное преимущество нимесулида: 96,8% больных оценили его переносимость как «хорошую» или «отличную», в то время как аналогичную оценку диклофенаку дали лишь 72,9% [14].
Субъективная оценка переносимости использованных лекарств демонстрировала еще более выраженное преимущество нимесулида: 96,8% больных оценили его переносимость как «хорошую» или «отличную», в то время как аналогичную оценку диклофенаку дали лишь 72,9% [14]. Нимесулид эффективно действует при острой боли в нижней части спины (БНЧС). По данным клинического испытания, проведенного финскими учеными, нимесулид в дозе 100 мг 2 р./сут превосходил ибупрофен в дозе 600 мг 3 р./сут как по выраженности обезболивающего эффекта, так и по восстановлению функции позвоночника. К 10-му дню терапии использование нимесулида обеспечило улучшение функциональной активности более чем в 2 раза. Это делает нимесулид (Найз) весьма привлекательным для лечения болевого синдрома при болезни Бехтерева.
Одним из наиболее ценных для клинической практики достоинств нимесулида является хорошая переносимость со стороны ЖКТ. Ведь именно развитие патологии пищеварительной системы, которая относится к числу класс-специфических осложнений НПВП, является одним из главных параметров, определяющих соотношение риска и пользы для этого класса обезболивающих средств.

Риск осложнений со стороны печени при использовании нимесулида (Найз) не выше, чем у «традиционных» НПВП. Анализ имеющихся литературных данных и клинических исследований показывает, что негативная динамика лабораторных биохимических показателей, свидетельствующая о развитии патологии печени, отмечается при применении нимесулида с такой же частотой, как и на фоне приема других НПВП. При анализе сообщений о гепатотоксических реакциях оказалось, что общее число сообщений при использовании диклофенака составило 990, ибупрофена – 590, а нимесулида – лишь 152. Самое главное, что угрожающая жизни патология – печеночная недостаточность была зафиксирована ВОЗ у 21 больного, получавшего диклофенак, и у 32 больных, получавших ибупрофен. На фоне приема нимесулида это осложнение было отмечено лишь в 4 случаях. Становится понятно, что осложнения со стороны печени при использовании нимесулида возникают крайне редко, а их абсолютное число в сравнении с другими популярными НПВП очень невелико.

В 2013 г. отсутствие особой гепатотоксичности нимесулида было подтверждено еще одним популяционным исследованием. S. Gulmez et al. изучили причины развития острой печеночной недостаточности у 9479 человек, вошедших в список нуждавшихся в экстренной трансплантации печени (Евросоюз, 2005–2007 гг.). НПВП стали этиологическим фактором потенциально этого фатального осложнения в 40 случаях, парацетамол – в 192. Относительный риск (ОР) острой печеночной недостаточности для различных препаратов разный. По результатам исследования нимесулид был менее опасен, чем парацетамол и ибупрофен, и фактически равен таким препаратам, как диклофенак и кетопрофен. В России не было описано ни одного случая тяжелых гепатотоксических реакций [7].
Важным фактором, способствующим популярности нимесулида среди других препаратов этой лекарственной группы, является низкая стоимость, делающая его доступным для подавляющего большинства жителей нашей страны. Ведь основные потребители НПВП – пациенты, страдающие хроническими заболеваниями суставов и позвоночника, люди пожилого возраста с низким доходом.

Помимо стандартных форм для перорального приема также представлен препарат для локального применения – Найз гель, содержащий 1% действующего вещества. Локальные формы НПВП являются полезным и безопасным средством, которое может быть использовано для вспомогательной терапии как при нанесении на кожу, так и в виде фонофореза с мазью на болезненную зону [13].
Глюкокортикостероиды (ГКС)
Для лечения АС не рекомендуется системное применение ГКС. Но эти препараты являются эффективными в качестве локальной терапии периферического артрита при рецидивирующем синовите. Эффективность ГК при лечении АС не вызывает сомнений, но они отличаются меньшей эффективностью в лечении энтезита (по-видимому, из-за меньшей концентрации действующего вещества в аваскулярной зоне энтезисов). В этих случаях высокоэффективны локальные инъекции ГКС в зону энтезисов.
Миорелаксанты
Известно, что болевой синдром в позвоночнике сопровождается мышечным спазмом, наличие которого в свою очередь усугубляет болевой синдром и спазм.
 Установлено, что одновременное применение НПВП и миорелаксантов уменьшает боль в спине, а также способствует сохранению подвижности позвоночника [7].
Установлено, что одновременное применение НПВП и миорелаксантов уменьшает боль в спине, а также способствует сохранению подвижности позвоночника [7].Базисные противовоспалительные препараты (БПВП)
Синтетические БПВП: сульфасалазин, метотрексат, лефлуномид не рекомендуются при лечении аксиальных форм АС в связи с неэффективностью. Но при периферическом артрите данная группа препаратов применяется с положительным эффектом, который рекомендуется оценивать не ранее чем через 3 мес. Сульфасалазин принимается в суточной дозе 2–3 г. Применение метотрексата в зависимости от эффективности, токсичности может быть в дозе от 10 до 15–20 мг в неделю и обязательно должно сопровождаться приемом фолиевой кислоты, исключая день приема метотрексата. При непереносимости метотрексата больному может быть назначен препарат арава. Последний принимается по 20 мг/сут после 3-дневного приема индукционной дозы по 100 мг/сут 3 дня.
Генно-инженерные биологические препараты (ГИБП)
За последнее время достигнут значительный прогресс в лечении заболеваний суставов и позвоночника благодаря применению ГИБП.
 Высокая эффективность данной группы препаратов подтверждена многочисленными исследованиями и долголетним использованием в лечебной практике. При АС эти препараты обеспечивают отчетливое уменьшение боли и воспаления в позвоночнике, суставах и энтезисах. К разрешенным к использованию для лечения АС относятся инфликсимаб, адалимумаб, этанерцепт, голимумаб, цертолизумаб пегол. Принципиального различия в эффективности этих препаратов в отношении влияния на основные симптомы (боль, скованность, энтезиты, периферические артриты) не установлено. Лечение ГИБП надо начинать в случае отсутствия эффекта при лечении как НПВП, так и НПВП в сочетании с БПВП (сульфасалазин в максимальной дозе 3 г/сут) в течение 3 мес. Влияние ингибиторов ФНО-a на увеит (в отличие от воздействия на позвоночник и периферические артриты) мало изучено. Группой сотрудников НИИР им. В.А. Насоновой (А.А. Годзенко, А.Г. Бочкова, Ш.Ф. Эрдес и др.) проведено исследование влияния ингибиторов ФНО-a: инфликсимаба, адалимумаба и этанерцепта на частоту атак увеита у больных с АС.
Высокая эффективность данной группы препаратов подтверждена многочисленными исследованиями и долголетним использованием в лечебной практике. При АС эти препараты обеспечивают отчетливое уменьшение боли и воспаления в позвоночнике, суставах и энтезисах. К разрешенным к использованию для лечения АС относятся инфликсимаб, адалимумаб, этанерцепт, голимумаб, цертолизумаб пегол. Принципиального различия в эффективности этих препаратов в отношении влияния на основные симптомы (боль, скованность, энтезиты, периферические артриты) не установлено. Лечение ГИБП надо начинать в случае отсутствия эффекта при лечении как НПВП, так и НПВП в сочетании с БПВП (сульфасалазин в максимальной дозе 3 г/сут) в течение 3 мес. Влияние ингибиторов ФНО-a на увеит (в отличие от воздействия на позвоночник и периферические артриты) мало изучено. Группой сотрудников НИИР им. В.А. Насоновой (А.А. Годзенко, А.Г. Бочкова, Ш.Ф. Эрдес и др.) проведено исследование влияния ингибиторов ФНО-a: инфликсимаба, адалимумаба и этанерцепта на частоту атак увеита у больных с АС. В результате исследования установлено, что ингибиторы ФНО-a эффективно воздействуют на увеит у больных с АС. Три исследованных препарата (инфликсимаб, адалимумаб, этанерцепт) достоверно уменьшили частоту обострения увеита в сравнении со стандартной противовоспалительной терапией. Критериями оценки ответа на лечение являются глобальная оценка самочувствия пациента по 100-миллиметровой визуальной аналоговой шкале (ВАШ), боль в позвоночнике по ВАШ, функциональная оценка пациента (ВАSFI), оценка воспаления по вопроснику BASDAI [1, 10].
В результате исследования установлено, что ингибиторы ФНО-a эффективно воздействуют на увеит у больных с АС. Три исследованных препарата (инфликсимаб, адалимумаб, этанерцепт) достоверно уменьшили частоту обострения увеита в сравнении со стандартной противовоспалительной терапией. Критериями оценки ответа на лечение являются глобальная оценка самочувствия пациента по 100-миллиметровой визуальной аналоговой шкале (ВАШ), боль в позвоночнике по ВАШ, функциональная оценка пациента (ВАSFI), оценка воспаления по вопроснику BASDAI [1, 10]. Хирургическое лечение
В случаях вовлечения в процесс тазобедренных суставов с развитием коксита и последующими функциональными нарушениями у больных может быть проведено эндопротезирование тазобедренного сустава. Операция на позвоночнике (корректирующая остеотомия) может проводиться при необходимости.
Несмотря на значительный прогресс в лечении АС в последнее время, остается много нерешенных проблем: мониторинг больных, иммуногенность ГИБП и их влияние на эффективность и безопасность терапии и т. д. Это оставляет тактику ведения и лечения больных АС в центре внимания ученых и врачей.
д. Это оставляет тактику ведения и лечения больных АС в центре внимания ученых и врачей.
Диагностика и лечение анкилозирующего спондилита — NYC
Записаться на прием
Наша команда специалистов по доступу поможет вам записаться на прием к нужным вам специалистам.
Анкилозирующий спондилит, форма артрита позвоночника, является одним из наиболее распространенных воспалительных заболеваний позвоночника. Анкилозирующий спондилит может вызвать сильную боль и инвалидность, особенно если его не лечить.
Анкилозирующий спондилоартрит вызывает воспаление в областях, где мягкие ткани (связки и сухожилия) прикрепляются к костям позвоночника. Анкилозирующий спондилоартрит также поражает крестцово-подвздошные (КП) суставы, которые представляют собой суставы между позвоночником и тазом. Воспаление в суставе вызывает эрозию части ткани, и когда воспаление стихает, на его месте может вырасти новая кость. В результате позвонки и суставы срастаются (срастаются), и позвоночник становится менее гибким.
Симптомы
Анкилозирующий спондилоартрит может вызывать различные боли в спине. Пациенты с анкилозирующим спондилитом обычно испытывают медленно нарастающую боль. Некоторые пациенты испытывают хроническую боль, а у некоторых боль то приходит, то уходит. Боль обычно усиливается ночью и связана с скованностью утром.
Анкилозирующий спондилоартрит приводит к тому, что позвоночник становится менее гибким, что может привести к искривлению позвоночника вперед, называемому кифозом.
Пациенты с этим заболеванием также могут испытывать боль, отек и скованность в других частях тела, поскольку болезнь прогрессирует, поражая плечи, бедра, ребра, пятки и даже мелкие суставы рук и ног.
В некоторых случаях анкилозирующий спондилоартрит может также поражать глаза (ирит или увеит). В редких случаях анкилозирующий спондилоартрит также может вызывать осложнения со стороны сердца и легких.
Диагностика
Для диагностики анкилозирующего спондилита врач часто проводит полное медицинское обследование и назначает анализы крови, которые могут выявить наличие воспаления.
Врач также может назначить рентген для визуализации изменений в позвоночнике и выявления костных разрастаний.
Поскольку существует связь между анкилозирующим спондилитом и определенным геном (HLA-B27), врач может назначить генетический тест, чтобы определить, присутствует ли этот конкретный ген.
Факторы риска
Точные причины анкилозирующего спондилита неизвестны, но, по-видимому, определенную роль играют как гены, так и окружающая среда.
Около 90% пациентов с анкилозирующим спондилитом являются носителями специфического гена HLA-B27. Однако HLA-B27 не рассказывает всей истории: оставшиеся 10% людей с анкилозирующим спондилезом не являются носителями этого гена. И многие люди в общей популяции являются носителями HLA-B27, но у большинства из них это заболевание никогда не разовьется. Таким образом, другие генетические факторы и/или факторы окружающей среды играют роль в анкилозирующем спондилезе, но сущность и точные механизмы этих других факторов еще не известны.
В отличие от других типов артрита, анкилозирующий спондилоартрит может поражать молодых людей. Обычно он поражает мужчин в возрасте от 17 до 45 лет, хотя может затронуть любого.
Лечение
Хотя нет лекарства от анкилозирующего спондилита, доступные методы лечения помогают уменьшить симптомы.
Перед обсуждением хирургического лечения пациентам с анкилозирующим спондилитом обычно назначают определенные лекарства, которые могут включать нестероидные противовоспалительные препараты (НПВП), миорелаксанты, кортикостероиды, противоревматические препараты, модифицирующие заболевание (БМАРП), и биологические препараты . Эти лекарства помогают уменьшить воспаление и, следовательно, помогают уменьшить боль.
Хирург порекомендует укрепляющие упражнения и упражнения на диапазон движений, а также здоровую диету.
Может потребоваться хирургическое вмешательство, особенно для восстановления переломов, которые могут быть вызваны анкилозирующим спондилитом. Если эти переломы начали давить на спинной мозг и окружающие нервы, может потребоваться операция по декомпрессии спинного мозга. В этих случаях хирург может выполнить ламинэктомию, чтобы удалить пластинку, которая представляет собой кость, покрывающую позвоночный канал. Удаление пластинки освобождает место для спинного мозга и позволяет спинному мозгу функционировать должным образом.
Если эти переломы начали давить на спинной мозг и окружающие нервы, может потребоваться операция по декомпрессии спинного мозга. В этих случаях хирург может выполнить ламинэктомию, чтобы удалить пластинку, которая представляет собой кость, покрывающую позвоночный канал. Удаление пластинки освобождает место для спинного мозга и позволяет спинному мозгу функционировать должным образом.
В некоторых случаях хирург может выполнить спондилодез, чтобы обеспечить стабильность позвоночника после операции. Во время спондилодеза хирург может поместить костный трансплантат в открытое пространство и позволить костям срастись (срастись). Спинальные инструменты с металлическими стержнями и винтами могут быть использованы для обеспечения немедленной стабильности позвоночника, чтобы обеспечить более быстрое заживление костного сращения. Это позволяет пациенту быть мобильным и более независимым сразу после операции.
В редких случаях хирург может выбрать выполнение остеотомии, которая выполняется для выпрямления позвоночника, сместившегося в кривизну вперед.
Детский ювенильный анкилозирующий спондилоартрит – условия и лечение
Ювенильный анкилозирующий спондилит (ЮАС) — это тип артрита, поражающий позвоночник и места прикрепления мышц, сухожилий и связок к костям. Анкилозирование означает тугоподвижность или ригидность, спондилоартрит означает позвоночник, а ит относится к воспалению. Болезнь вызывает воспаление позвоночника и крупных суставов, что приводит к скованности и боли. Заболевание может привести к эрозии сустава между позвоночником и тазовой костью (крестцово-подвздошный сустав) и образованию костных перемычек между позвонками в позвоночнике, срастанию этих костей. Кроме того, кости грудной клетки могут срастись.
ЮАС считается многофакторным заболеванием. Многофакторное наследование означает, что в возникновении проблемы со здоровьем участвует множество факторов. Факторы обычно являются как генетическими, так и экологическими, когда комбинация генов от обоих родителей в дополнение к неизвестным факторам окружающей среды вызывает признак или состояние. Часто один пол (мужской или женский) поражается чаще, чем другой, по многофакторным признакам. Многофакторные признаки повторяются в семьях, потому что они частично обусловлены генами.
Часто один пол (мужской или женский) поражается чаще, чем другой, по многофакторным признакам. Многофакторные признаки повторяются в семьях, потому что они частично обусловлены генами.
Группа генов на хромосоме 6, кодирующая антигены HLA, играет важную роль в восприимчивости и устойчивости к болезням. Специфические антигены HLA влияют на развитие многих распространенных заболеваний. Некоторые из этих расстройств, такие как JAS, связаны с аутоиммунными заболеваниями и наследуются многофакторным образом. Когда у ребенка есть определенный тип антигена HLA, связанный с заболеванием, считается, что у него или нее повышена вероятность развития заболевания. Антиген HLA, связанный с JAS, называется B27. Считается, что дети с HLA-антигеном B27 имеют повышенный шанс (или генетическую предрасположенность) к развитию JAS; однако важно понимать, что у ребенка без этого антигена также может развиться ЮАС. Это означает, что тестирование антигена HLA не является диагностическим или точным для прогнозирования состояния. Мужчины страдают ЮАС в три раза чаще, чем женщины.
Мужчины страдают ЮАС в три раза чаще, чем женщины.
ЮАС является одним из четырех заболеваний, которые классифицируются как спондилоартропатии. Другими расстройствами являются псориатический артрит, воспалительное заболевание кишечника и синдром Рейтера. Эти расстройства имеют сходные признаки, такие как:
- Воспаление позвоночника и крестцово-подвздошных суставов
- Семейный анамнез заболевания
- Сходные неартритные симптомы
- Отсутствие ревматоидного фактора (РФ) в крови (антитело, обнаруженное в крови большинство, но не все, люди, страдающие ревматоидным артритом, а также другими ревматическими заболеваниями)
JAS поражает молодых людей, как правило, в возрасте от 17 до 35 лет, но также может поражать подростков. Считается, что JAS поражает мужчин в два-три раза чаще, чем женщин.
Симптомы ЮАС имеют тенденцию появляться и исчезать с течением времени.
 Ниже приведены наиболее распространенные симптомы ЮАС. Однако каждый ребенок может испытывать симптомы по-разному. Симптомы могут включать:
Ниже приведены наиболее распространенные симптомы ЮАС. Однако каждый ребенок может испытывать симптомы по-разному. Симптомы могут включать:- Боль в спине, обычно наиболее сильная ночью во время отдыха
- Утренняя скованность
- Сутулость в ответ на боль в спине (наклон вперед уменьшает боль)
- Неспособность сделать глубокий вдох, если суставы между поражены ребра и позвоночник
- Потеря аппетита
- Потеря веса
- Усталость
- Лихорадка
- Анемия
- Боль в месте прикрепления мышц, связок и/или сухожилий к кости (энтезит)
- Боль в суставах, особенно в ногах
- Неопределенная боль, обычно в ягодицах, бедрах, пятках или около плеч
- Болезненное воспаление глаз, вызывающее покраснение и чувствительность к свету; могут иметь частые рецидивы воспаления глаз
- Поражение органов, таких как сердце, легкие и глаза
Симптомы ювенильного анкилозирующего спондилита могут напоминать другие заболевания или проблемы.
 Всегда консультируйтесь с врачом вашего ребенка для постановки диагноза.
Всегда консультируйтесь с врачом вашего ребенка для постановки диагноза.Помимо полного сбора анамнеза и медицинского осмотра, диагностические процедуры при ювенильном анкилозирующем спондилите могут включать:
- Рентгенологическое исследование . Диагностический тест, использующий невидимые лучи электромагнитной энергии для получения изображений внутренних тканей, костей и органов на пленке.
- Скорость оседания эритроцитов (СОЭ или скорость седации) . Измерение того, как быстро эритроциты падают на дно пробирки. При наличии отека и воспаления белки крови слипаются и становятся тяжелее, чем обычно. Таким образом, при измерении они быстрее падают и оседают на дно пробирки. Как правило, чем быстрее падают клетки крови, тем сильнее воспаление. (Люди с ЮАС часто имеют повышенную СОЭ.)
- Обнаружение антигена (HLA-B27) . HLA-B27 — это антиген (вещество, которое заставляет организм вырабатывать антитела для борьбы с бактериями, вирусами и другими «чужеродными» частицами для предотвращения заражения), присутствие которого может указывать на наличие какого-либо типа аутоиммунного заболевания (состояние, при котором организм собственные защитные силы начинают атаковать клетки организма).

Целью лечения ЮАС является уменьшение боли и скованности, предотвращение деформаций и помощь вашему ребенку вести как можно более нормальный и активный образ жизни.
Конкретное лечение ювенильного анкилозирующего спондилита будет определено врачом вашего ребенка на основании:
- Общего состояния здоровья вашего ребенка и истории болезни
- Степень заболевания
- Переносимость вашим ребенком определенных лекарств, процедур и методов лечения
- Ожидание течение болезни
- Ваше мнение или предпочтение
Лечение может включать:
- Нестероидные противовоспалительные препараты, НПВП (для уменьшения боли и воспаления)
- Кратковременное применение кортикостероидов (для уменьшения воспаления)
- Болезнь-модифицирующие противоревматические препараты (DMARDS), такие как метотрексат или биологические препараты, такие как инфликсимаб или этанерцепт, которые предназначены для подавления воспалительной реакции вашего организма
- Сохраняйте правильную осанку
- Регулярные физические упражнения, включая упражнения для укрепления мышц спины
- Физиотерапия
Лечение ревматологии в Детской национальной больнице
Специалисты-педиатры Детской национальной больницы в Вашингтоне, округ Колумбия, обладают опытом диагностики, лечения и лечения аутоиммунных и воспалительных заболеваний мышц, тканей и суставов растущего ребенка.
