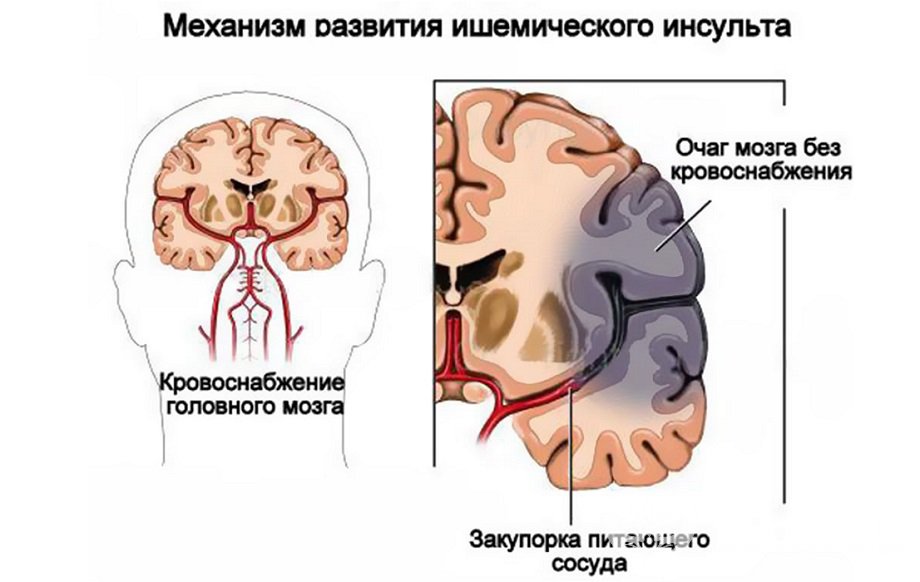
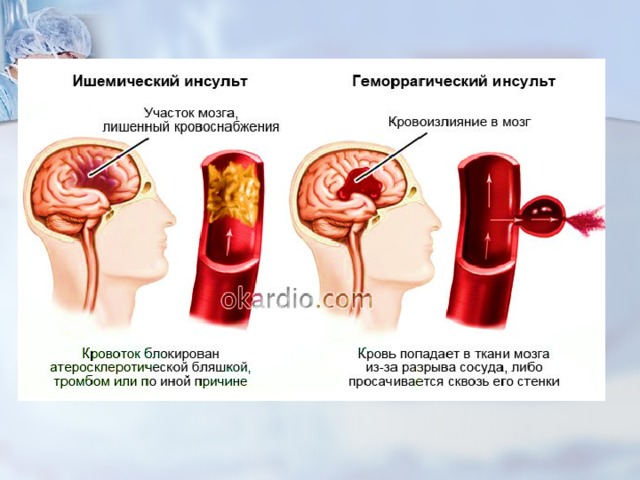
Википедия инсульт ишемический: Диагностика и лечение ишемии головного мозга (Сергиев Посад)
Применение холина альфосцерата (глиатилин) у пациентов с ишемическим инсультом
Инсульт является одной из ведущих причин смертности и инвалидизации населения [1, 2]. Рост заболеваемости инсультом связан с ведущими факторами риска — сердечно-сосудистой патологией, хроническим стрессом, нарушением питания, вредными привычками, старением населения и др. [1].
Наиболее эффективным методом лечения ишемического инсульта в первые часы заболевания является тромболитическая терапия. Однако частота ее выполнения остается низкой и не превышает 10% (в большинстве стран Европы данный показатель составляет приблизительно 3%), что во многом связано с узкими временны`ми рамками «терапевтического окна» [15]. В связи с этим актуальны исследования, направленные на изучение возможных механизмов продления жизни мозговой ткани в зоне ишемической полутени и, соответственно, увеличение терапевтического окна, а также на определение тактики лечения пациентов, по тем или иным причинам не подлежащих проведению тромболизиса.
Нейропротекторная терапия рассматривается как одно из перспективных направлений комплексного лечения пациентов с острым нарушением мозгового кровообращения (ОНМК) [14]. К настоящему времени проведено большое число исследований, посвященных применению нейропротекторных препаратов у больных с ишемическим инсультом, однако их результаты неоднозначны [5-7, 13, 16]. Можно предположить, что причиной являются недостатки дизайна проведенных клинических исследований: выбор неадекватного терапевтического окна, нецеленаправленный отбор пациентов с учетом патогенетического варианта инсульта и других особенностей заболевания, использование заведомо недостаточных дозировок препаратов и длительности их приема, выбор конечных точек с низкой чувствительностью и переоценка возможного эффекта терапии [8, 10]. В связи с этим в современных клинических рекомендациях по лечению острых неврологических заболеваний нейропротекторная терапия не рекомендуется к использованию. В то же время на основании эмпирического опыта, а также в рамках собственных протоколов, во многих лечебных учреждениях препараты с нейропротекторной активностью находят широкое применение.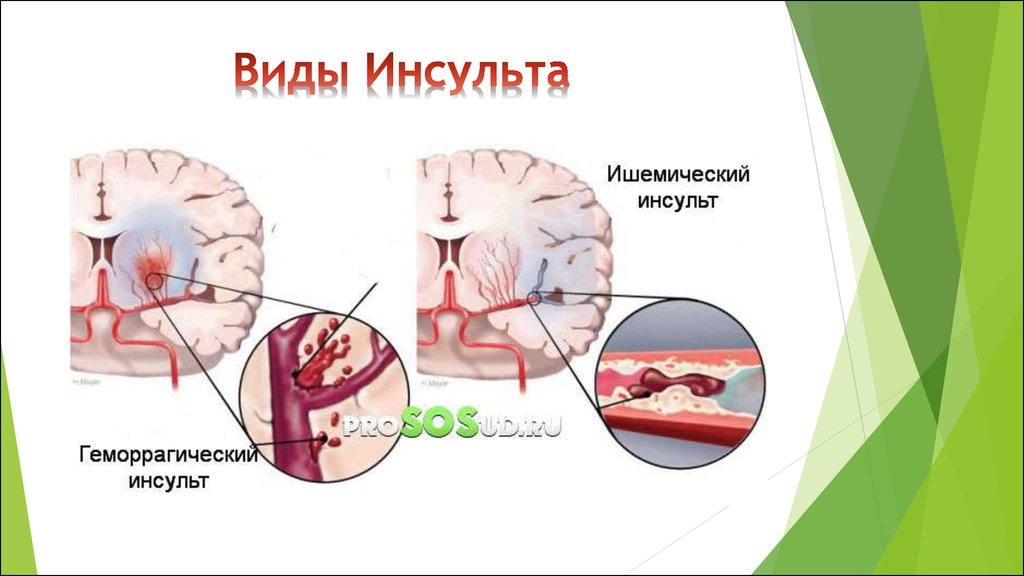
Одним из препаратов, обладающих нейропротекторным и нейротрофическим действием, является холина альфосцерат (глиатилин). При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат. Холин участвует в биосинтезе ацетилхолина — одного из основных нейромедиаторов, глицерофосфат является предшественником фосфолипидов (фосфатидилхолина) мембраны нейрона. Таким образом, глиатилин усиливает церебральную холинергическую проводимость и положительно воздействует на пластичность нейрональных мембран [11]. Накоплен определенный опыт применения холина альфосцерата у пациентов, перенесших ОНМК, однако данных о его влиянии на процесс реабилитации пациентов с инсультом пока недостаточно [3, 4, 9, 11, 12, 14].
Цель настоящего исследования — оценка влияния холина альфосцерата на динамику восстановления утраченных функций и конечные результаты нейрореабилитационных мероприятий у пациентов с полушарным ишемическим инсультом.
Материал и методы
Обследованы 60 пациентов, 37 мужчин и 23 женщины (средний возраст — 64,7±15,2 года) в острейшем периоде полушарного ишемического инсульта.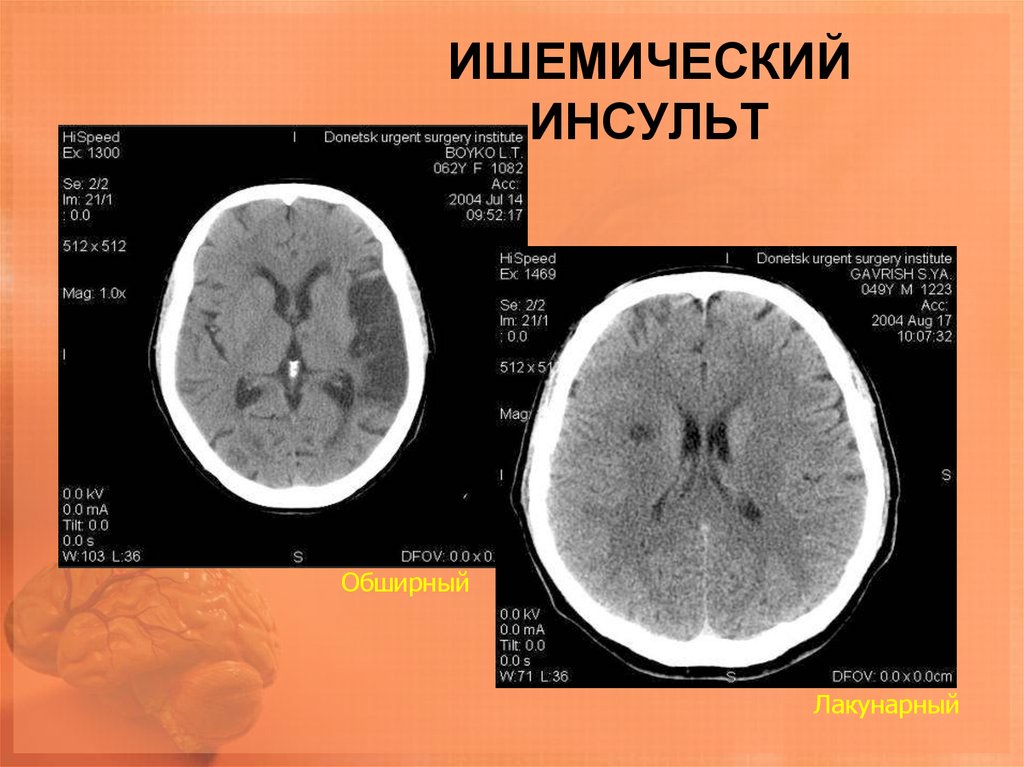
Пациенты были рандомизированы в 2 группы по 30 человек в каждой. Обе группы были сопоставимы по полу, возрасту, тяжести заболевания, сопутствующей патологии. Пациенты 1-й (основной) группы помимо унифицированной терапии инсульта получали внутривенные инъекции глиатилина по 1000 мг в сутки в течение 10 дней с последующим переходом на пероральный прием препарата в виде капсул по 400 мг 3 раза в день в течение 20 дней. Терапия глиатилином была начата не позднее 12 ч с момента развития инсульта. 2-ю группу (сравнения) составили пациенты, не получавшие глиатилин.
Унифицированная терапия инсульта включала: коррекцию респираторных нарушений, артериального давления, уровня глюкозы, водно-электролитного баланса, температуры тела, питания, вторичную профилактику (антитромботическая, гиполипидемическая, антигипертензивная терапия, коррекция других факторов риска) и комплексное восстановительное лечение (лечебная физкультура с максимально ранней вертикализацией, физиотерапия, массаж, роботизированная механотерапия, занятия с логопедом и нейропсихологом).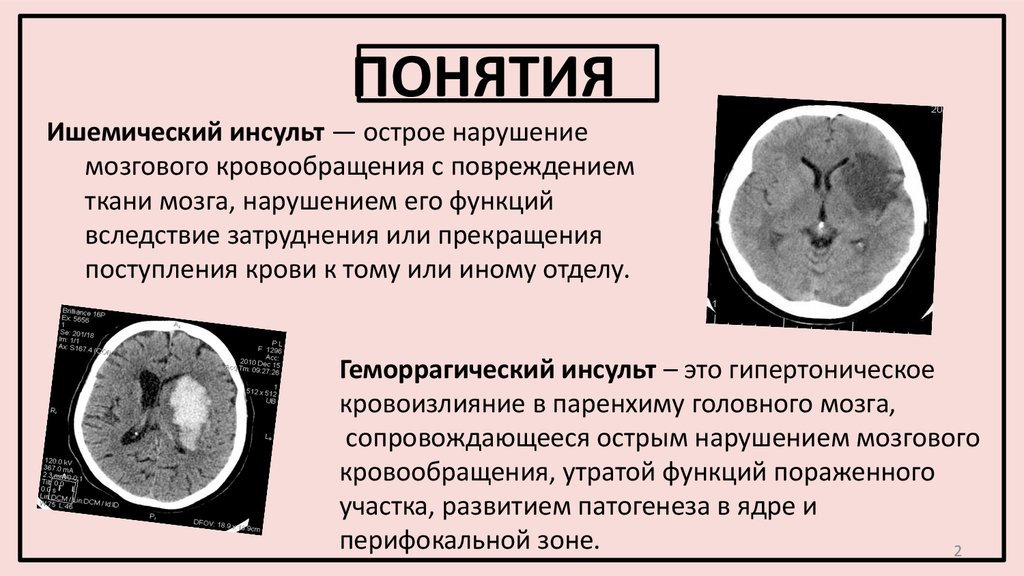
Все пациенты при поступлении были обследованы по стандартной схеме. Диагноз ишемического инсульта верифицировали данными КТ/МРТ головного мозга. Патогенетический вариант уточняли с помощью лабораторных тестов, дуплексного сканирования брахиоцефальных артерий, транскраниальной допплерографии, билатерального допплеровского мониторинга средней мозговой артерии с эмболодетекцией, ЭКГ, в том числе с холтеровским мониторированием эхокардиографии. Оценку тяжести неврологического дефицита проводили по шкале NIHSS, оценку функционального состояния — по шкале Рэнкина и данным нейрофизиологических методов исследования (ЭЭГ, соматосенсорные вызванные потенциалы — ССВП в 1, 10, 20 и 30-е сутки терапии.
Больных, которым была выполнена тромболитическая терапия, в исследование не включали.
Результаты
После 30-дневного курса терапии было проведено сравнение тяжести состояния и степени функционального восстановления у пациентов двух групп. После 30-дневного курса лечебных мероприятий тяжесть инсульта по шкале NIHSS уменьшилась на 50,8% (с 12,8±4,6 до 6,1±1,2 балла, р<0,05) у пациентов 1-й группы и на 36,8% (с 12,1±5,8 до 9,1±1,8 балла, р>0,05) у пациентов 2-й группы.
При изучении динамики функционального состояния по шкале Рэнкина на 30-е сутки отмечалось улучшение показателей на 45,4% (с 3,9±0,2 до 2,0±0,5 балла, р>0,05) у пациентов 1-й группы и на 34,5% (с 3,6±0,3 до 2,4±0,5 балла, р>0,05) у пациентов 2-й группы.
Пациенты 1-й группы статистически значимо чаще достигали поставленных реабилитационных целей (р<0,05). Так, реабилитационные задачи были достигнуты после проведенной комплексной терапии у 79% пациентов 1-й группы (33% перемещались самостоятельно, 41% перемещались с посторонней помощью или с использованием ходунков, 14% были адаптированы к инвалидной коляске, 12% оставались прикованными к кровати) и только у 38% пациентов 2-й группы (15% перемещались самостоятельно, 25% перемещались с посторонней помощью или с использованием ходунков, 39% были адаптированы к инвалидной коляске, 21% оставались прикованными к кровати).
Исследование ССВП после проведения терапевтических мероприятий у пациентов двух групп выявило увеличение амплитуды и уменьшение латентности коркового ответа N20. Данные изменения были более выражены в 1-й группе, однако различия не достигли уровня статистической значимости (табл. 1).
При проведении транскраниальной магнитной стимуляции до начала терапевтических мероприятий у всех пациентов в зоне пораженного полушария вызывался непостоянный корковый ответ со сниженной амплитудой меньше 1,5 мкВ. На 30-й день терапии у пациентов 1-й группы корковый ответ регистрировался более регулярно и амплитуда его возросла до 2-2,5мкВ. У пациентов 2-й группы амплитуда коркового ответа увеличилась незначительно (до 1,6-1,7 мкВ).
У 27 (90%) пациентов 1-й группы к 10-м суткам заболевания определялась наиболее полная нормализация паттерна ЭЭГ в виде достоверного регресса межполушарной асимметрии в α-диапазоне и минимальной выраженности медленноволновой активности в проекции очага ишемии мозга.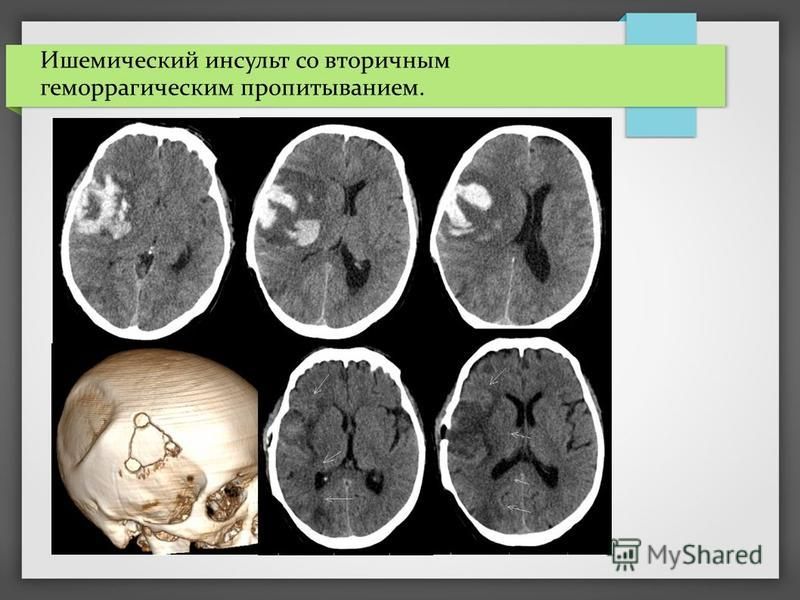 У пациентов 2-й группы даже на 20-30-е сутки были выявлены остаточные изменения в виде стойкого очага медленных волн в проекции ишемии, межполушарная асимметрия в α-1-диапазоне с преобладанием мощности в интактном полушарии.
У пациентов 2-й группы даже на 20-30-е сутки были выявлены остаточные изменения в виде стойкого очага медленных волн в проекции ишемии, межполушарная асимметрия в α-1-диапазоне с преобладанием мощности в интактном полушарии.
По данным контрольной допплерографии, у пациентов двух групп на 30-е сутки отмечалось повышение линейной скорости кровотока (ЛСК) и снижение индексов периферического сосудистого сопротивления на стороне очага поражения, что свидетельствует об усилении перфузии в аффектированном сосудистом бассейне. Несмотря на то что данные изменения не достигли уровня статистической значимости, подобная тенденция была более выражена у пациентов 1-й группы
Проведенное исследование показало, что применение холина альфосцерата (глиатилин) не позднее 12 ч с момента развития ишемического инсульта приводит к достоверному регрессу тяжести неврологической симптоматики и достижению поставленных реабилитационных целей. Более выраженное повышение церебральной перфузии в пораженном сосудистом бассейне на фоне приема холина альфосцерата может быть следствием нейрометаболической активации и усиления пластических процессов в зоне ишемии. Стабилизация нейрофизиологических показателей на фоне приема глиатилина не достигла достоверных значений, но происходила в более короткие сроки и в большем объеме.
Стабилизация нейрофизиологических показателей на фоне приема глиатилина не достигла достоверных значений, но происходила в более короткие сроки и в большем объеме.
Таким образом, в настоящем исследовании была дана оценка эффективности ранней нейропротекторной терапии препаратом глиатилин у больных с полушарным ишемическим инсультом, а также изучена динамика клинического статуса пациентов, скорость и полнота восстановления утраченных функций, успешность решения реабилитационных задач. Кроме того, была проведена оценка церебральной гемодинамики пораженного полушария, динамика нейрофизиологических показателей (ЭЭГ, ССВП, ТМС).
Инструкция по применению препарата Ксаврон (эдаварон)
Состав:
действующее вещество: эдаравон;
1 мл раствора содержит 1,5 мг эдаравона;
вспомогательные вещества: натрия метабисульфит (Е 223), натрия хлорид, натрия гидроксид, фосфорная кислота, вода для инъекций.
Лекарственная форма. Раствор для инъекций.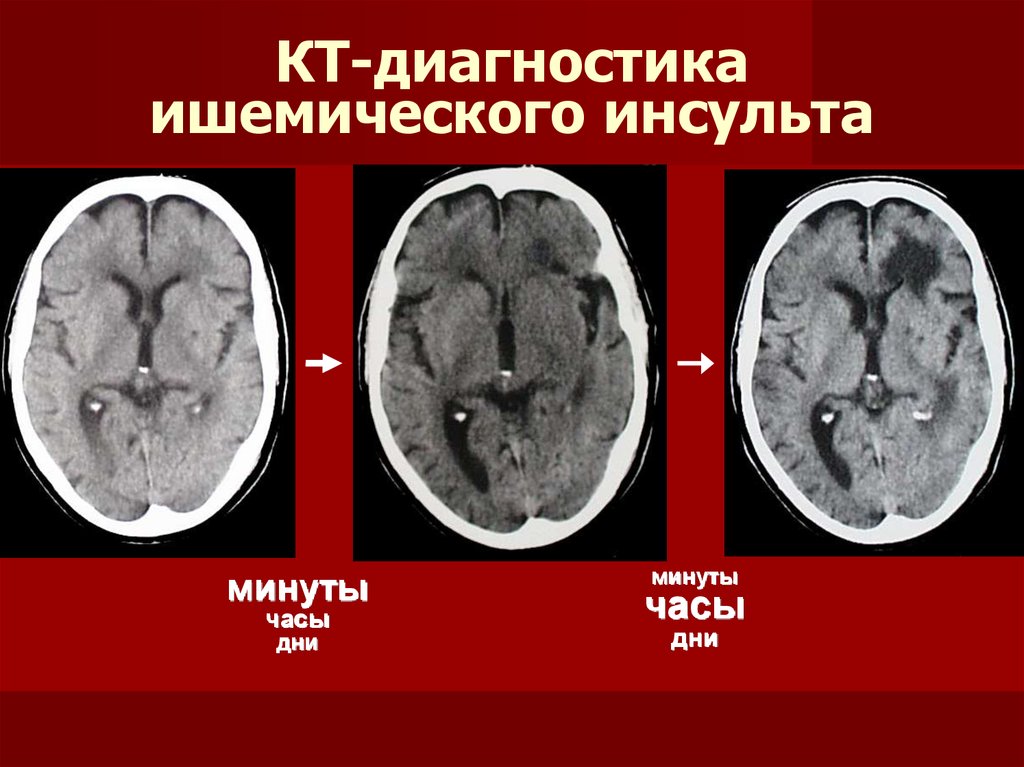
Основные физико-химические свойства: прозрачная бесцветная или слегка желтоватая жидкость.
Фармакотерапевтическая группа. Другие препараты для лечения заболеваний центральной нервной системы. АТХ N07 XX.
Фармакологические свойства.
Фармакодинамика.
Свободные радикалы, такие как гидроксильные радикалы (OH), являются одними из основных факторов сосудистых нарушений в головном мозге, связанных с ишемией; при ишемии или кровоизлиянии в момент восстановления проходимости из-за аномального увеличения продукции арахидоновой кислоты увеличивается количество продуцированных свободных радикалов. Эти свободные радикалы вызывают перекисное окисление ненасыщенных жирных кислот, входящих в состав липидов клеточных мембран, повреждая их, что приводит к нарушению функции головного мозга.
На острой стадии ишемического инфаркта мозга препарат демонстрирует защитное действие, подавляя возникновение и развитие ишемических цереброваскулярных расстройств, таких как отек головного мозга, неврологические симптомы, медленная гибель нейронов.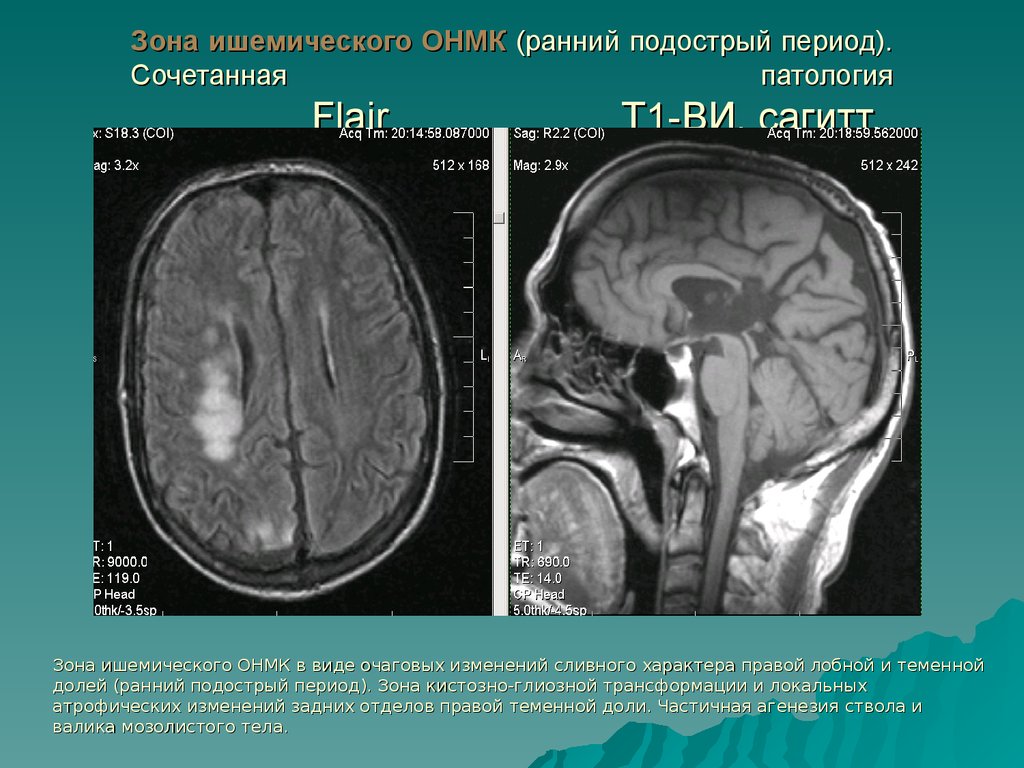
Этиология начала и развития бокового амиотрофического склероза (БАС) в настоящее время окончательно не определена. Однако было высказано предположение, что оксидативный стресс, вызванный свободными радикалами, может быть этиологическим фактором для данной патологии. Эдаравон, благодаря своему подавляющему воздействию на перекисное окисление липидов путем связывания свободных радикалов, демонстрирует торможение развития заболевания посредством уменьшения окисного повреждения клеток мозга (сосудистые эндотелиальные клетки/нервные клетки).
Фармакокинетика.
Фармакокинетику препарата исследовали на пяти здоровых мужчинах-добровольцах и пяти здоровых мужчинах-добровольцах пожилого возраста через 30 минут после многократного внутривенного
введения дозы препарата (0,5 мг/кг) два раза в сутки в течение 2 дней. Концентрация неизмененного препарата в плазме крови в обеих группах снижалась одинаково без следов накопления.
Уровень связывания эдаравона с белками сыворотки крови и сывороточным альбумином составляет 92 % и 89–91 % соответственно (in vitro).
В плазме крови главными метаболитами эдаравона выступают сульфатные конъюгаты, также были обнаружены конъюгаты с глюкуроновой кислотой. В моче по большей части были обнаружены глюкурониды и в меньшем количестве – сульфаты.
Через 12 часов после введения 0,7–0,9 % препарата выводится с мочой в неизмененном виде и 71,0–79,9 % в виде метаболитов.
Показания к применению.
Облегчение неврологических симптомов, проявлений нарушений деятельности в повседневной жизни и функциональных расстройств, связанных с острым ишемическим инсультом.
Замедление прогрессирования функциональных расстройств у больных боковым амиотрофическим склерозом.
Противопоказания.
Тяжелая форма почечной недостаточности.
Гиперчувствительность к компонентам препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
При одновременном применении с антибиотиками с почечным типом экскреции (цефазолин натрия, цефотиам гидрохлорид, пиперациллин натрия и пр. ) существует вероятность усиления дисфункции почек, в случае комбинированного применения следует тщательно вести наблюдение, регулярно осуществляя анализ функционирования почек.
) существует вероятность усиления дисфункции почек, в случае комбинированного применения следует тщательно вести наблюдение, регулярно осуществляя анализ функционирования почек.
Ксаврон перед введением нужно растворить в 100 мл физиологического раствора натрия хлорида. Смешивание препарата с другими растворами для внутривенного введения, содержащими различные сахара, может привести к снижению концентрации эдаравона.
Препарат не следует смешивать с растворами для парентерального питания и/или растворами, содержащими аминокислоты, а также вводить через те же инфузионные системы.
Препарат не смешивать с противосудорожными препаратами, включая диазепам, фенитоин натрия и пр., из-за возможности образования мути. Также не смешивать с калия канреноатом.
Способ применения и дозы.
Неврологические симптомы, связанные с острым ишемическим инсультом, проявления нарушений повседневной деятельности, облегчение разного рода дисфункций: 30 мг эдаравона (1 ампула) два раза в сутки, утром и вечером, путем внутривенной инфузии в течение 30 минут. Перед введением содержимое ампулы следует растворить в 100 мл натрия хлорида 0,9 %. Терапию необходимо начать в течение 24 часов после появления симптомов, длительность лечения — не менее 14 дней.
Перед введением содержимое ампулы следует растворить в 100 мл натрия хлорида 0,9 %. Терапию необходимо начать в течение 24 часов после появления симптомов, длительность лечения — не менее 14 дней.
Ингибирующее влияние на прогрессирование дисфункции при боковом амиотрофическом склерозе (БАС): назначать 60 мг эдаравона (2 ампулы), путем внутривенной инфузии в течение 60 минут, 1 раз в сутки. Перед введением содержимое ампулы следует растворить в достаточном объеме натрия хлорида 0,9 %. Как правило, период введения препарата и период покоя в сумме составляют 28 дней и считаются как 1 курс, такие курсы повторяются. Первый курс состоит из 14 дней приема препарата, после чего наступает 14-дневный период перерыва и покоя, второй курс и последующие состоят из 10 дней введения препарата в течение 14 дней, после чего начинается период покоя продолжительностью 14 дней.
У пациентов с острым ишемическим инсультом продолжительность терапии может быть сокращена в зависимости от клинического состояния пациента.
Пациенты пожилого возраста.
Поскольку у пациентов пожилого возраста в целом снижены физиологические функции, то в случае появления побочных эффектов следует прекратить прием препарата и принять соответствующие меры. Опубликовано много примеров того, что у пациентов пожилого возраста часто возникают летальные исходы, поэтому наблюдение должно быть особо тщательным.
Дети. Безопасность применения препарата у детей не установлена.
Недостаточно опыта применения при остром ишемическом инсульте у детей; при БАС опыт клинического применения детям отсутствует.
Побочные реакции.
Со стороны мочевыделительной системы: острая почечная недостаточность, нефротический синдром.
Со стороны кожи: сыпь, покраснение, отек, ощущение зуда, эритема.
Со стороны гепатобилиарной системы: нарушения функций печени, печеночная недостаточность, фульминантный гепатит, желтуха.
Со стороны нервной системы: бессонница, головная боль.
Со стороны сердечно-сосудистой системы: повышение артериального давления.
Со стороны крови: агранулоцитоз, ДВС-синдром, снижение количества эритроцитов, лейкоцитоз, лейкопения, уменьшение уровня гематокрита, снижение гемоглобина, тромбоцитоз, тромбоцитопения.
Со стороны дыхательной системы: синдром острого повреждения легких, сопровождающийся пирексией, кашлем, диспноэ, аномалиями рентгенографии грудной клетки.
Со стороны желудочно-кишечной системы: тошнота, рвота.
Со стороны костно-мышечной системы: рабдомиолиз.
Со стороны иммунной системы: шок, анафилактический шок (крапивница, снижение артериального давления, затрудненное дыхание и пр.).
Изменение лабораторных показателей: повышение уровней АлАТ, АсАТ, ЛДГ, ɣ-глутамилтранспептидазы, ЩФ, билирубина, креатинина, мочевой кислоты в сыворотке крови, глюкозурия, гематурия, протеинурия.
Изменения в месте введения: покраснение в месте инъекций, припухлость в месте инъекций.
Общие расстройства: гипертермия..
Срок годности. 2 года.
Условия хранения.
Хранить при температуре не выше 25 °С в оригинальной упаковке.
Хранить в недоступном для детей месте.
Несовместимость.
Не следует смешивать с другими лекарственными средствами, кроме лекарственных средств, указанных в разделе «Способ применения и дозы».
Упаковка.
По 20 мл в ампулах стеклянных;
по 2 ампулы в контурной ячейковой упаковке, по 1 ячейковой упаковке в пачке из картона;
по 5 ампул в контурной ячейковой упаковке, по 1 ячейковой упаковке в пачке из картона;
по 5 ампул в контурной ячейковой упаковке, по 2 ячейковые упаковки в пачке из картона.
Категория отпуска. По рецепту.
Производитель.
ООО «Юрия-Фарм».
Местонахождение производителя и адрес места осуществления его деятельности.
Украина, 18030, Черкасская обл., г. Черкассы, ул. Вербовецкого, 108. Тел.: (044) 281-01-01.
Дата последнего пересмотра.
Программная платформа для исследования аневризм, тромбоэмболии легочной артерии и инсульта на основе ИИ
Клинически внедрено
Клинически внедрено
RapidAI, созданная клиницистами для клиницистов, представляет собой наиболее передовую, клинически проверенную программную платформу для острых и неострых сосудистых и нейроваскулярных состояний, чтобы позволяют врачам принимать более быстрые и точные решения по диагностике и лечению. Платформа Rapid прошла клиническую валидацию в ряде исследований по всему миру, давших результаты, которые проложили путь к новому стандарту лечения пациентов с инсультом, одобренному рекомендациями Американской кардиологической ассоциации в 2015 году. Наша клиническая команда продолжает активно участвовать в исследования по всему миру, работающие с больницами, чтобы помочь сформировать будущее ухода.
Комплексная и расширяемая
Комплексная и расширяемая
Платформа Rapid была разработана на основе расширяемости, что позволяет больницам легко внедрять одну платформу для удовлетворения потребностей нескольких отделений для лечения нервно-сосудистых и сосудистых заболеваний, включая инсульт, аневризму и легочная эмболия. Благодаря бесшовной интеграции расширенной визуализации с использованием искусственного интеллекта и предоставлению результатов с помощью инструментов рабочего процесса мы обеспечиваем клиническое принятие решений и поддержку рабочего процесса, необходимые медицинским бригадам для быстрой и эффективной диагностики, сортировки и лечения пациентов. Больницы, которые стандартизируют платформу Rapid, быстро выиграют от установки и поддержки от одного поставщика, высочайшей безопасности данных и соответствия требованиям, а также от операционной и поведенческой эффективности, достигнутой благодаря использованию единой платформы.
Благодаря бесшовной интеграции расширенной визуализации с использованием искусственного интеллекта и предоставлению результатов с помощью инструментов рабочего процесса мы обеспечиваем клиническое принятие решений и поддержку рабочего процесса, необходимые медицинским бригадам для быстрой и эффективной диагностики, сортировки и лечения пациентов. Больницы, которые стандартизируют платформу Rapid, быстро выиграют от установки и поддержки от одного поставщика, высочайшей безопасности данных и соответствия требованиям, а также от операционной и поведенческой эффективности, достигнутой благодаря использованию единой платформы.
Быстрая и гибкая
Быстрая и гибкая
Платформа Rapid была разработана по принципу сокращения времени рабочего процесса пациента. Быстрое предоставление расширенных результатов Rapid на мобильных или настольных устройствах позволяет врачам принимать более быстрые и обоснованные решения по диагностике и лечению. Инструменты быстрого рабочего процесса информируют членов команды и помогают упростить и ускорить координацию ухода за пациентами.
Наша гибкая платформа работает в любой больничной среде, включая отделения неотложной помощи, травматологические центры, больницы скорой помощи, первичные инсультные центры и комплексные инсультные центры. Это идеальное решение для многоцентровых систем и справочных сетей, которые могут извлечь выгоду из обмена важной информацией о пациентах и аналитической отчетности, чтобы помочь улучшить возможности аудита между больницами, анализ рабочих процессов и экономику здравоохранения.
Безопасность данных и соответствие требованиям
Безопасность данных и соответствие требованиям
RapidAI стремится поддерживать самые строгие стандарты информационной безопасности. С этой целью мы постоянно инвестируем в людей, процессы и технологии для защиты нашей платформы и данных. Платформа Rapid была разработана с использованием структуры кибербезопасности Национального института стандартов и технологий (NIST). Он также соответствует требованиям HIPAA, GDPR, ISO 13485, ISO 27001 и ISO 27701.
- Шифрование данных ePHI в состоянии покоя и при передаче
- Настройки управления доступом к программному обеспечению
- Обратная связь в режиме реального времени об использовании и производительности системы
- Отчетность для мониторинга и аудита использования ePHI
- Стороннее тестирование на проникновение
- Встроенный процесс деидентификации данных пациента
- Глобальное облачное хранилище, локализованное для больниц
- Безопасный обмен сообщениями и вызовы в соответствии с HIPAA и GDPR в мобильном приложении Rapid
Повышение квалификации, углубленное обучение
Повышение квалификации, углубленное обучение
Rapid U предоставляет клиентам углубленное обучение, необходимое им для успешного использования продуктов RapidAI в их профессиональных ролях. Образовательный контент и ресурсы, предлагаемые через Rapid U, адаптированы для удовлетворения индивидуальных потребностей каждого члена бригады по лечению инсульта с помощью ряда ролевых путей обучения.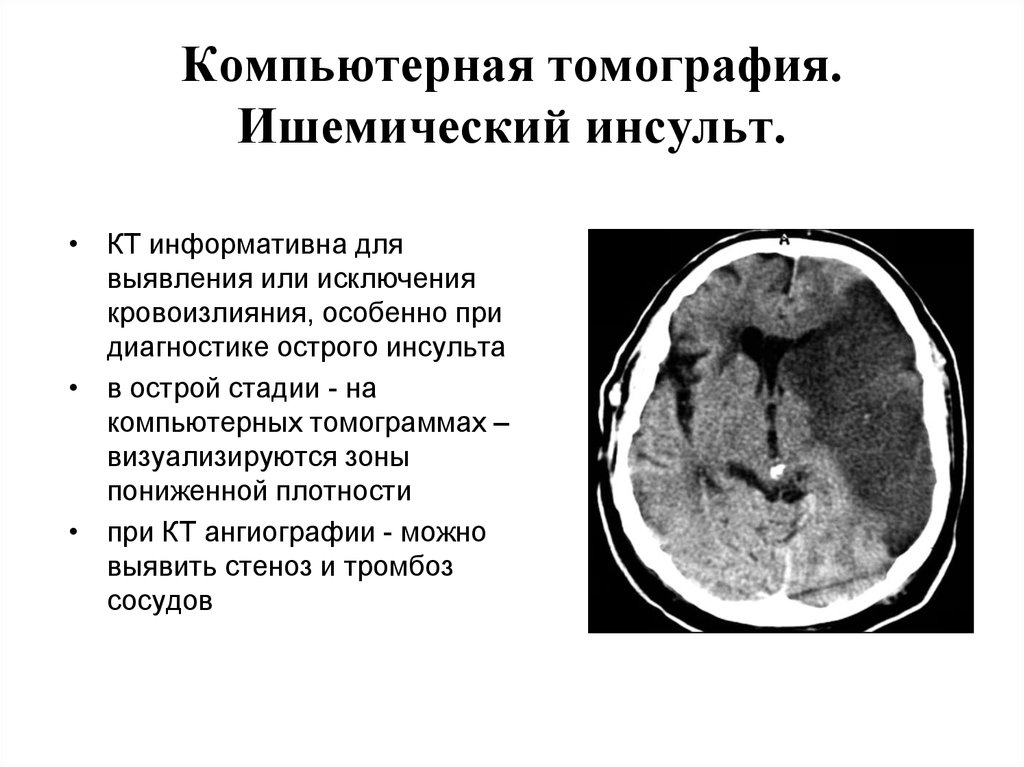 Каждая схема обучения включает:
Каждая схема обучения включает:
- Самостоятельное онлайн-обучение для повышения уверенности в использовании продуктов RapidAI; включает сертификацию RapidAI
- Виртуальные учебные занятия под руководством инструкторов врачей и других клинических экспертов; общий и специфичный для сайта для обзоров случаев
- Содержимое поддержки производительности для кредитов непрерывного образования (CE), тематических исследований, публикаций и кратких справочных руководств
Оценка криптогенного инсульта — Американский колледж кардиологии
Эпидемиология
Инсульт является пятой по значимости причиной смерти в Соединенных Штатах. Есть два основных подтипа инсульта; геморрагический, составляющий 17%, и ишемический, составляющий 83% случаев. Криптогенные инсульты составляют 15-40% всех инсультов. Ежегодно около 79У 5000 человек диагностирован новый инсульт. У женщин риск инсульта в течение жизни выше, чем у мужчин. Существуют также расовые различия в заболеваемости: у чернокожих и выходцев из Латинской Америки частота ишемических инсультов выше, чем у представителей европеоидной расы.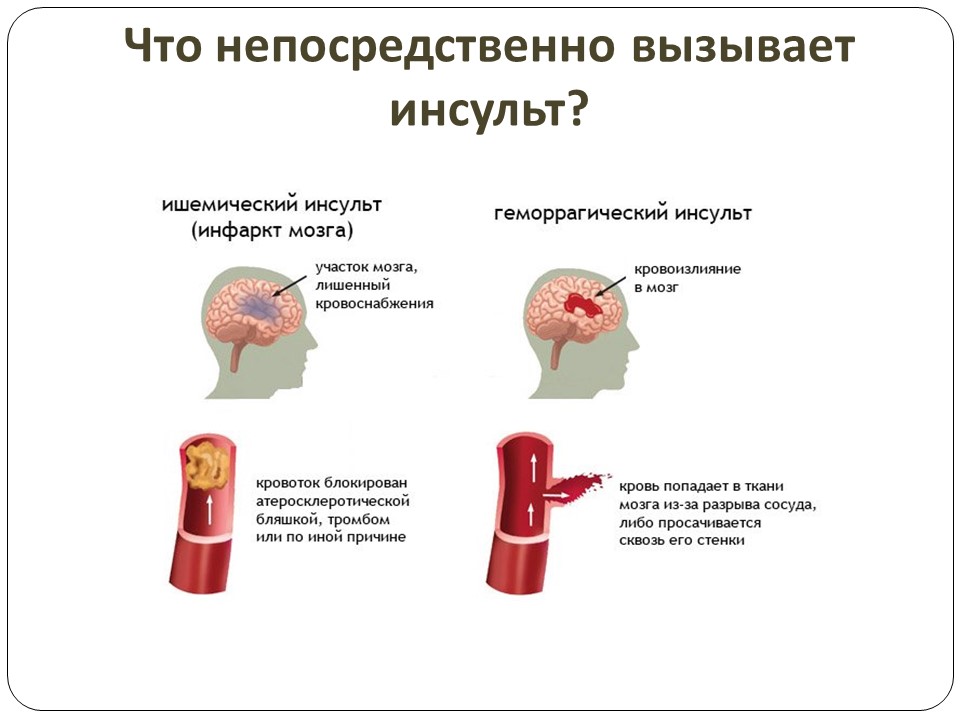 1,2 Ранее было установлено, что частота криптогенного инсульта выше у пожилых пациентов. 3 Однако совсем недавно Северо-Манхэттенское исследование инсульта (NOMASS) показало более высокую частоту криптогенного инсульта у пациентов в возрасте до 45 лет по сравнению с более старшими пациентами (55% против 42%). 2,4
1,2 Ранее было установлено, что частота криптогенного инсульта выше у пожилых пациентов. 3 Однако совсем недавно Северо-Манхэттенское исследование инсульта (NOMASS) показало более высокую частоту криптогенного инсульта у пациентов в возрасте до 45 лет по сравнению с более старшими пациентами (55% против 42%). 2,4
Определение
Общепринятого определения криптогенного инсульта не существует. Для инсульта доступны три основные системы классификации: исследование Org 10172 по острому инсульту (TOAST), система классификации причин инсульта (CCS) и атеросклероз, заболевание мелких сосудов, кардиальные причины, другие причины и диссекция (ASCOD). TOAST определяет криптогенный инсульт как инсульт, не вызванный атеросклерозом крупных артерий, кардиоэмболией и окклюзией мелких сосудов; Криптогенный инсульт также определяется как инсульт неустановленной этиологии из-за двух или более выявленных причин, отрицательной оценки или неполной оценки. Для классификации TOAST не требуется оценка. 5 С другой стороны, CCS требует как минимум электрокардиограмму в 12 отведениях, эхокардиограмму, визуализацию головного мозга (компьютерную томографию (КТ)/магнитно-резонансную томографию (МРТ) и внутрисосудистую визуализацию. Это компьютеризированный алгоритм, который определяет причинную и фенотипические подтипы инсульта.Существует пять основных категорий инсульта, включая надаортальный атеросклероз крупных артерий, сердечно-аортальную эмболию, окклюзию мелких артерий, другие необычные причины и неустановленные причины (неустановленные причины включают неполную оценку и криптогенный инсульт)9.0066 6 Наконец, ASCOD оценивает вероятность того, что болезнь была причинно связана с инсультом (1 для потенциальной причины, 2 для неопределенной причинной связи, 3 для маловероятной причины, но при наличии заболевания, 0 для отсутствия заболевания и 9 для недостаточное обследование для исключения заболевания). 7 Таким образом, криптогенный инсульт является диагнозом исключения — это ишемический инсульт с невыявленной этиологией.
Для классификации TOAST не требуется оценка. 5 С другой стороны, CCS требует как минимум электрокардиограмму в 12 отведениях, эхокардиограмму, визуализацию головного мозга (компьютерную томографию (КТ)/магнитно-резонансную томографию (МРТ) и внутрисосудистую визуализацию. Это компьютеризированный алгоритм, который определяет причинную и фенотипические подтипы инсульта.Существует пять основных категорий инсульта, включая надаортальный атеросклероз крупных артерий, сердечно-аортальную эмболию, окклюзию мелких артерий, другие необычные причины и неустановленные причины (неустановленные причины включают неполную оценку и криптогенный инсульт)9.0066 6 Наконец, ASCOD оценивает вероятность того, что болезнь была причинно связана с инсультом (1 для потенциальной причины, 2 для неопределенной причинной связи, 3 для маловероятной причины, но при наличии заболевания, 0 для отсутствия заболевания и 9 для недостаточное обследование для исключения заболевания). 7 Таким образом, криптогенный инсульт является диагнозом исключения — это ишемический инсульт с невыявленной этиологией.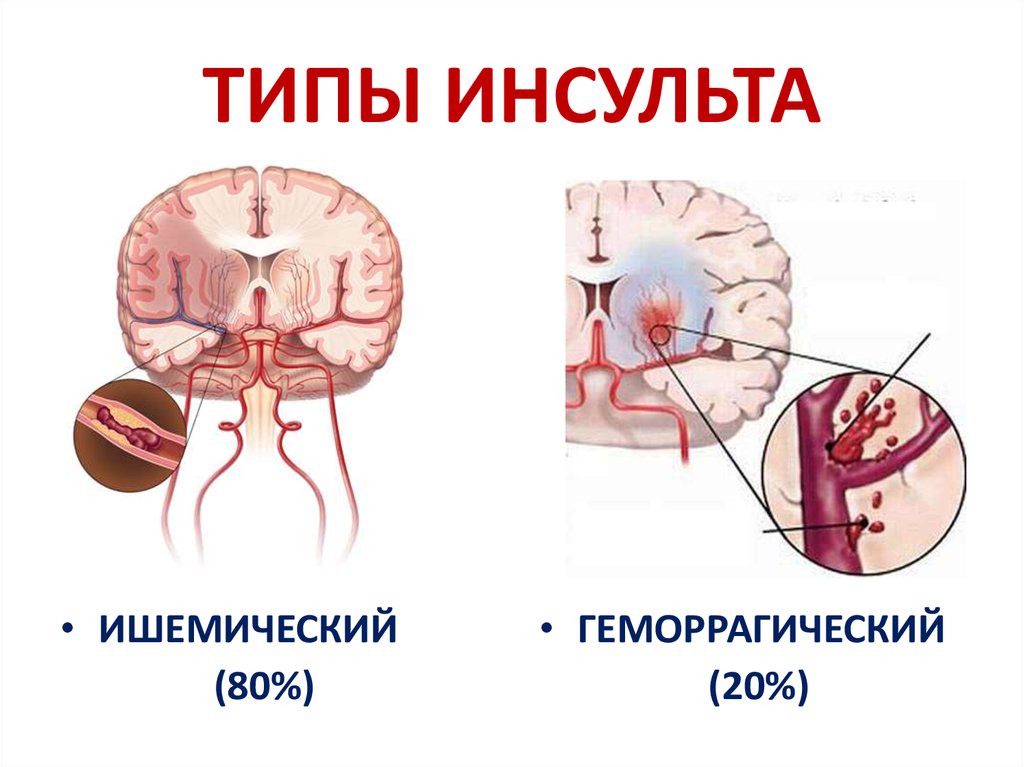
Оценка ишемического криптогенного инсульта
Анамнез и медицинский осмотр
Ниже представлена схема подхода к оценке криптогенного инсульта (рис. 1). История и медицинский осмотр служат основой для оценки криптогенного инсульта. Анамнез должен включать предшествующие события, такие как манипуляции на шее, недавняя стоматологическая или инвазивная процедура, внутривенное употребление наркотиков и недавняя беременность. Следует выявить симптомы — утомляемость и усиление хромоты могут свидетельствовать о васкулитном процессе; потеря веса и ночная потливость могут быть признаками злокачественного новообразования. Необходимо собрать соответствующий анамнез с акцентом на сердечные аритмии и факторы риска атеросклероза, включая артериальную гипертензию, дислипидемию, диабет. Семейный анамнез преждевременного атеросклеротического заболевания, инсульта или внезапной смерти также должен быть рассмотрен. 8
Рисунок 1
Подробный физикальный осмотр дополнительно определяет основную причину криптогенного инсульта.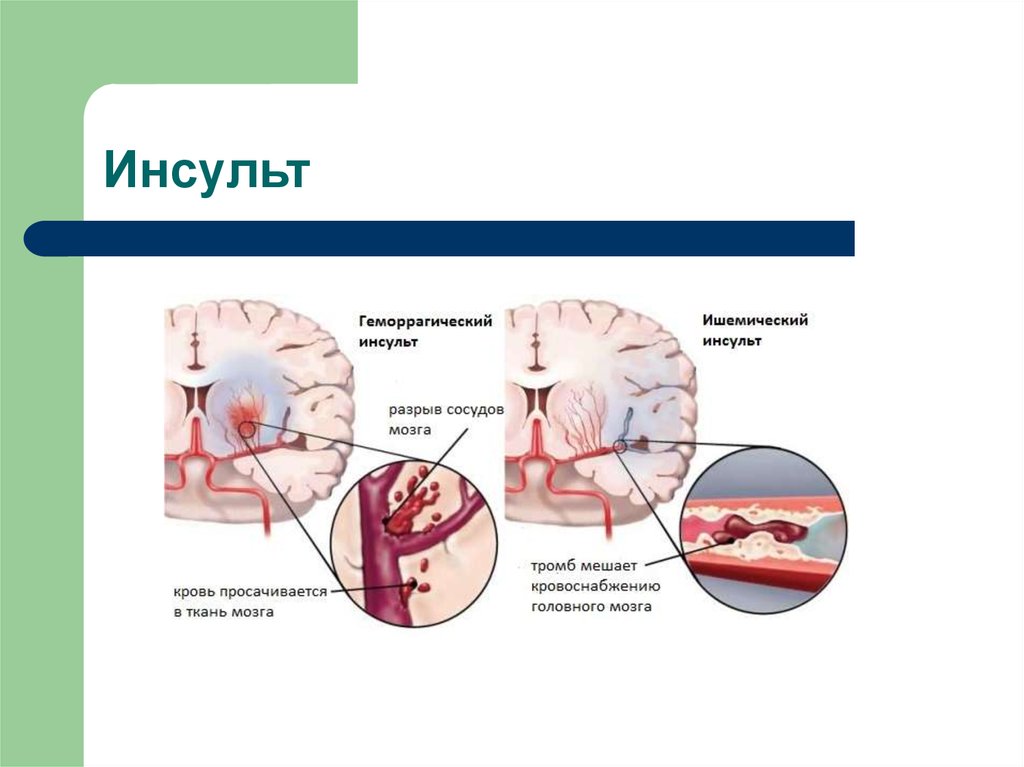 Обследование сосудов, включая двустороннее давление руками, аускультацию шумов и оценку пульса, может вызвать подозрение на расслоение аорты, артериопатии (например, фибромышечную дисплазию) или васкулитные процессы. Обследование сердца должно быть направлено на наличие аритмий, патологических шумов и признаков септической эмболии. Также необходимо провести обследование кожи для выявления признаков системной эмболии, ретикулярного ливедо, ксантомы и ксантелазмы. 8
Обследование сосудов, включая двустороннее давление руками, аускультацию шумов и оценку пульса, может вызвать подозрение на расслоение аорты, артериопатии (например, фибромышечную дисплазию) или васкулитные процессы. Обследование сердца должно быть направлено на наличие аритмий, патологических шумов и признаков септической эмболии. Также необходимо провести обследование кожи для выявления признаков системной эмболии, ретикулярного ливедо, ксантомы и ксантелазмы. 8
Нейроваскулярная визуализация
Все пациенты, госпитализированные по поводу инсульта, должны сразу же по прибытии пройти цереброваскулярную визуализацию для оценки наличия ишемического инсульта и исключения признаков кровоизлияния. Это особенно важно в отношении своевременного принятия решения о тромболитической терапии. Немедленная компьютерная томография является экономичным и быстрым средством для дифференциации инфаркта мозга, кровоизлияния и имитаторов инсульта. 9 У отдельных пациентов с признаками острого ишемического инсульта, но с отрицательным результатом КТ, МРТ оправдана; это особенно полезно в условиях заднего инфаркта и сверхострого инсульта. 10
10
Визуализация сосудов может выполняться несколькими способами. 11,12 Ультразвуковое исследование сонных артерий является портативным, широко доступным и недорогим средством для оценки заболеваний сонных артерий шеи и межкостных позвонков. Однако качество изображения во многом зависит от УЗИ. Компьютерная томографическая ангиография (КТА) и магнитно-резонансная ангиография (МРА) являются неинвазивными методами, которые можно использовать для оценки как шейных артерий, так и внутричерепных сосудов на наличие стеноза и окклюзии. КТА обычно выполняется, учитывая ее доступность и быстроту получения изображений. К сожалению, КТА требует облучения и контрастного воздействия. МРА, с другой стороны, не требует облучения, а при использовании изображений времени пролета контраст не используется. К сожалению, MRA особенно подвержена артефактам движения и отнимает много времени. 12 Ранее механическая тромбэктомия считалась потенциальным методом выбора у пациентов, поступивших в течение 6 часов после появления симптомов. Тем не менее, роль визуализации сосудов особенно важна, учитывая недавно опубликованные исследования «Клиническое несоответствие в сортировке пробуждения и поздних инсультов, подвергающихся нейровмешательству с помощью Трево» (DAWN) и эндоваскулярной терапии после оценки визуализации при ишемическом инсульте 3 (DEFUSE 3), демонстрирующие преимущества. механическая тромбэктомия в режиме «расширенного окна» на фоне окклюзии крупных сосудов. 13,14
Тем не менее, роль визуализации сосудов особенно важна, учитывая недавно опубликованные исследования «Клиническое несоответствие в сортировке пробуждения и поздних инсультов, подвергающихся нейровмешательству с помощью Трево» (DAWN) и эндоваскулярной терапии после оценки визуализации при ишемическом инсульте 3 (DEFUSE 3), демонстрирующие преимущества. механическая тромбэктомия в режиме «расширенного окна» на фоне окклюзии крупных сосудов. 13,14
Обследование сердца должно включать ЭКГ в 12 отведениях и телеметрический мониторинг как минимум в течение первых 24 часов. Рекомендации ACC/AHA по инсульту от 2017 г. включают, что расширенный кардиологический мониторинг у некоторых пациентов может предоставить дополнительную информацию, которая может побудить к профилактическому лечению; долгосрочные преимущества этого подхода неясны. 11 Доступны различные кардиомониторы (Таблица 1). Исследователи EMBRACE продемонстрировали, что фибрилляция предсердий (ФП) продолжительностью 30 секунд была обнаружена у 16,1% пациентов с использованием 30-дневного триггерного регистратора событий по сравнению с 3,2% пациентов с 24-часовым монитором, и это привело к антикоагулянтной терапии почти в два раза чаще.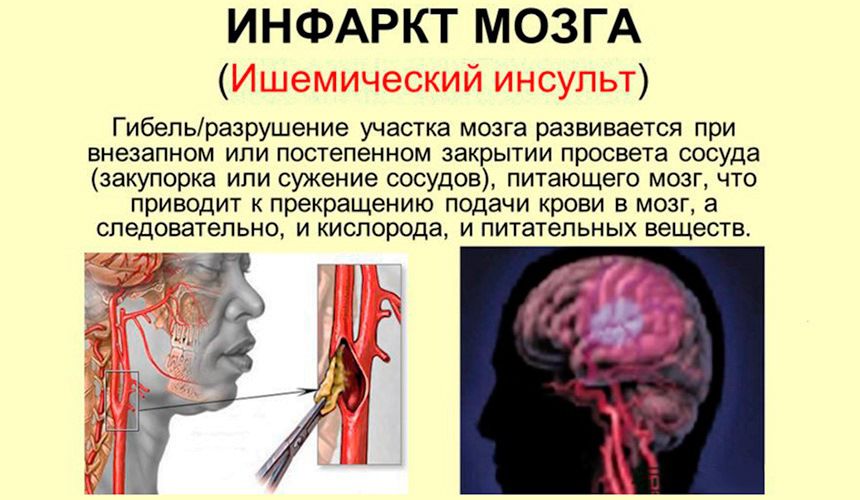 количество пациентов в группе вмешательства по сравнению с контрольной группой. 15 FIND-AF Рандомизированное исследование было сосредоточено на пациентах с острым ишемическим инсультом в возрасте старше 60 лет и аналогичным образом показало повышенную частоту выявления ФП у пациентов с криптогенным инсультом при длительном кардиомониторинге с 10-дневным мониторированием в пяти отведениях. исходно, через 3 и 6 месяцев по сравнению со стандартным мониторингом (не менее 24 часов мониторинга ритма). 16 CRYSTAL-AF показал доказательства того, что имплантированный кардиомонитор в 7,3 раза чаще выявляет ФП у пациентов с криптогенным инсультом по сравнению с обычным наблюдением с 24-часовым кардиомониторированием. Предположительно, с появлением носимых технологий, способных выявлять сердечные аритмии, ФП будет выявляться чаще. 17 Однако до настоящего времени причинно-следственная связь между постинсультной ФП и криптогенным инсультом не установлена.
количество пациентов в группе вмешательства по сравнению с контрольной группой. 15 FIND-AF Рандомизированное исследование было сосредоточено на пациентах с острым ишемическим инсультом в возрасте старше 60 лет и аналогичным образом показало повышенную частоту выявления ФП у пациентов с криптогенным инсультом при длительном кардиомониторинге с 10-дневным мониторированием в пяти отведениях. исходно, через 3 и 6 месяцев по сравнению со стандартным мониторингом (не менее 24 часов мониторинга ритма). 16 CRYSTAL-AF показал доказательства того, что имплантированный кардиомонитор в 7,3 раза чаще выявляет ФП у пациентов с криптогенным инсультом по сравнению с обычным наблюдением с 24-часовым кардиомониторированием. Предположительно, с появлением носимых технологий, способных выявлять сердечные аритмии, ФП будет выявляться чаще. 17 Однако до настоящего времени причинно-следственная связь между постинсультной ФП и криптогенным инсультом не установлена.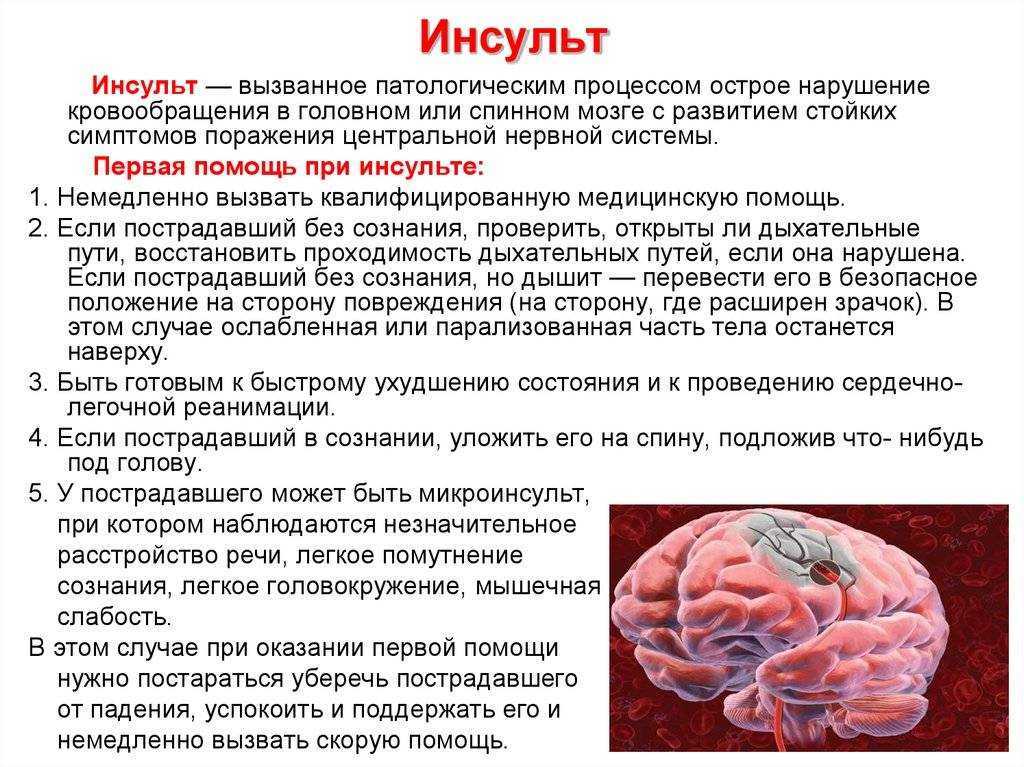
Таблица 1: Кардиомониторы 11 22 23
Трансторакальная и чреспищеводная эхокардиография может быть использована у отдельных пациентов с острым ишемическим инсультом с подозрением на сердечный источник, включая тромбы, образования в сердце (например, миксому, фиброэластому), вегетации и внутрисердечный шунт (рис. 2). 11 Трансторакальная эхокардиография (ТТЭ) является эффективной стратегией первой линии для визуализации сердца. Однако качество визуализации во многом зависит от телосложения, основного заболевания легких и размера межреберного пространства. Более низкая частота преобразователя может использоваться для визуализации структур, удаленных от поверхности кожи; однако это ставит под угрозу детали изображения. 18 ТТЭ точно оценивает функцию левого желудочка и может идентифицировать тромб левого желудочка (особенно с использованием контрастных веществ), клапанные аномалии и новообразования, а также может показать признаки внутрисердечного шунта. Чреспищеводная эхокардиограмма (ЧПЭ) более тщательно оценивает ушко левого предсердия, межпредсердную перегородку и дугу аорты. Кроме того, если отмечается открытое овальное окно (PFO), требуется ЧПЭхоКГ для надлежащего планирования закрытия, если это клинически показано. Несмотря на инвазивность, чреспищеводная эхокардиография представляет собой процедуру с относительно низким риском: перфорация пищевода происходит в период от 0,01 до 0,09.% случаев. 18 У пациентов с нормальной ТТЭ ЧПЭхоКГ определила источник криптогенного инсульта примерно у 40-50% пациентов. Более высокая распространенность ООО или дефектов межпредсердной перегородки была выявлена у пациентов моложе 55 лет с криптогенным инсультом (26,8 против 18%). Между тем, атеросклеротическое заболевание чаще встречается у пожилых пациентов. Было показано, что результаты ЧПЭхоКГ изменяют клиническое ведение не менее чем у 3% пациентов с криптогенным инсультом. 17 9Рисунок 2 Б) Спектральная импульсно-волновая допплерография, подтверждающая преимущественно сброс крови слева направо.
Чреспищеводная эхокардиограмма (ЧПЭ) более тщательно оценивает ушко левого предсердия, межпредсердную перегородку и дугу аорты. Кроме того, если отмечается открытое овальное окно (PFO), требуется ЧПЭхоКГ для надлежащего планирования закрытия, если это клинически показано. Несмотря на инвазивность, чреспищеводная эхокардиография представляет собой процедуру с относительно низким риском: перфорация пищевода происходит в период от 0,01 до 0,09.% случаев. 18 У пациентов с нормальной ТТЭ ЧПЭхоКГ определила источник криптогенного инсульта примерно у 40-50% пациентов. Более высокая распространенность ООО или дефектов межпредсердной перегородки была выявлена у пациентов моложе 55 лет с криптогенным инсультом (26,8 против 18%). Между тем, атеросклеротическое заболевание чаще встречается у пожилых пациентов. Было показано, что результаты ЧПЭхоКГ изменяют клиническое ведение не менее чем у 3% пациентов с криптогенным инсультом. 17 9Рисунок 2 Б) Спектральная импульсно-волновая допплерография, подтверждающая преимущественно сброс крови слева направо. Панели C) и D) Чреспищеводная эхокардиограмма бикавальной проекции того же пациента, выявляющая открытое овальное окно. Рисунок 2: A) Цветная допплеровская подреберная проекция на трансторакальной эхокардиограмме, выявляющая межпредсердную коммуникацию. Б) Спектральная импульсно-волновая допплерография, подтверждающая преимущественно сброс крови слева направо. Панели C) и D) Чреспищеводная эхокардиограмма бикавальной проекции того же пациента, выявляющая открытое овальное окно.
Панели C) и D) Чреспищеводная эхокардиограмма бикавальной проекции того же пациента, выявляющая открытое овальное окно. Рисунок 2: A) Цветная допплеровская подреберная проекция на трансторакальной эхокардиограмме, выявляющая межпредсердную коммуникацию. Б) Спектральная импульсно-волновая допплерография, подтверждающая преимущественно сброс крови слева направо. Панели C) и D) Чреспищеводная эхокардиограмма бикавальной проекции того же пациента, выявляющая открытое овальное окно.
Тестирование гиперкоагуляции
Состояния гиперкоагуляции, которые объясняют артериальную эмболию, в основном ограничиваются синдромом антифосфолипидных антител, дискразиями костного мозга и злокачественными новообразованиями. 19 В условиях ПФО существует риск парадоксальной эмболии и тромбофилий, связанных с венозной тромбоэмболией, включая лейденскую мутацию фактора V, мутацию гена протромбина, дефицит протеина C или S и дефицит антитромбина III. Процесс острого тромботического события и различные антикоагулянты могут изменить результаты теста на тромбофилию. На первичную тромбофилию приходится 1–4% криптогенного инсульта, хотя наследственные тромбофилии отмечаются у каждого седьмого пациента. 20,21 Кроме того, процесс острого тромбоза и антикоагулянтная терапия могут изменить результаты теста на тромбофилию. Отдельным пациентам в соответствующих клинических условиях может помочь специальное тестирование на тромбофилию. 20,21
На первичную тромбофилию приходится 1–4% криптогенного инсульта, хотя наследственные тромбофилии отмечаются у каждого седьмого пациента. 20,21 Кроме того, процесс острого тромбоза и антикоагулянтная терапия могут изменить результаты теста на тромбофилию. Отдельным пациентам в соответствующих клинических условиях может помочь специальное тестирование на тромбофилию. 20,21
Выводы
Оценка криптогенного инсульта требует обзора широкой дифференциальной и систематической оценки потенциальной этиологии инсульта. Риск повторного криптогенного инсульта высок, и, определив этиологию основного события, можно проводить соответствующее лечение и профилактику.
Ссылки
- Benjamin EJ, Muntner P, Alonso A, et al. Обновление статистики сердечных заболеваний и инсультов за 2019 год: отчет Американской кардиологической ассоциации. Тираж 2019;139:e56-e528.
- Уайт Х., Боден-Альбала Б., Ван С.
 и др. Заболеваемость подтипом ишемического инсульта среди белых, чернокожих и латиноамериканцев: исследование Северного Манхэттена. Тираж 2005; 111:1327-31.
и др. Заболеваемость подтипом ишемического инсульта среди белых, чернокожих и латиноамериканцев: исследование Северного Манхэттена. Тираж 2005; 111:1327-31. - Уильямс Л.С., Гарг Б.П., Коэн М., Флек Дж.Д., Биллер Дж. Подтипы ишемического инсульта у детей и молодых людей. Неврология 1997;49:1541.
- Джейкобс Б.С., Боден-Альбала Б., Лин И.Ф., Сакко Р.Л. Инсульт у молодых в исследовании инсульта на севере Манхэттена. Ход 2002;33:2789-93.
- Adams HP Jr, Bendixen BH, Kappelle L, et al. Классификация подтипов острого ишемического инсульта. Определения для использования в многоцелевом клиническом исследовании. ТОСТ. Испытание Org 10172 Лечение острого инсульта. Инсульт 1993;24:35-41.
- Арсава Э.М., Баллабио Э., Беннер Т. и др. Система Causative Classification of Stroke — международное исследование надежности и оптимизации. Неврология 2010;75:1277-84.
- Амаренко П., Богуславский Дж.
 , Каплан Л.Р., Доннан Г.А., Вольф М.Э., Хеннеричи М.Г. ASCOD-фенотипирование ишемического инсульта (обновленное ASCO-фенотипирование). Цереброваск дис 2013;36:1-5.
, Каплан Л.Р., Доннан Г.А., Вольф М.Э., Хеннеричи М.Г. ASCOD-фенотипирование ишемического инсульта (обновленное ASCO-фенотипирование). Цереброваск дис 2013;36:1-5. - Санна Т., Динер Х., Пассман Р.С., Руководящий комитет Crystal AF. Криптогенный инсульт и мерцательная аритмия. N Engl J Med 2014;371:1261.
- Wardlaw JM, Seymour J, Cairns J, Keir S, Lewis S, Sandercock P. Немедленная компьютерная томография при остром инсульте экономически эффективна и улучшает качество жизни. Ход 2004;35:2477-83.
- Brazzelli M, Sandercock PA, Chappell FM, et al. Магнитно-резонансная томография в сравнении с компьютерной томографией для выявления острых сосудистых поражений у пациентов с симптомами инсульта. Кокрановская база данных Syst Rev 2009:CD007424.
- Шен В.К., Шелдон Р.С., Бендитт Д.Г. и др. Руководство ACC/AHA/HRS 2017 г. по оценке и ведению пациентов с обмороками: отчет рабочей группы Американского колледжа кардиологов/Американской кардиологической ассоциации по клиническим рекомендациям и Обществу сердечного ритма.
 J Am Coll Cardiol 2017;70:e39.
J Am Coll Cardiol 2017;70:e39. - Барлинн К., Александров А.В. Визуализация сосудов при инсульте: сравнительный анализ. Нейротерапия 2011;8:340-48.
- Albers GW, Marks MP, Kemp S, et al. Тромбэктомия при инсульте в сроки от 6 до 16 часов с отбором по перфузионной визуализации. N Engl J Med 2018;378:708-18.
- Nogueira RG, Jadhav AP, Haussen DC, et al. Тромбэктомия через 6-24 часа после инсульта с несоответствием между дефицитом и инфарктом. N Engl J Med 2018;378:11-21.
- Gladstone DJ, Spring M, Dorian P и др. Мерцательная аритмия у больных с криптогенным инсультом. N Engl J Med 2014;370:2467-77.
- Wachter R, Gröschel K, Gelbrich G, et al. Холтеровское мониторирование электрокардиограммы у пациентов с острым ишемическим инсультом (Find-AFRANDOMISED): открытое рандомизированное контролируемое исследование. Ланцет Нейрол 2017;16:282-90.
- de Bruijn SF, Agema WR, Lammers GJ, et al.
 Чреспищеводная эхокардиография превосходит трансторакальную эхокардиографию при лечении пациентов любого возраста с транзиторной ишемической атакой или инсультом. Ход 2006;37:2531-34.
Чреспищеводная эхокардиография превосходит трансторакальную эхокардиографию при лечении пациентов любого возраста с транзиторной ишемической атакой или инсультом. Ход 2006;37:2531-34. - Saric M, Armor AC, Arnaout MS и др. Руководство по использованию эхокардиографии для оценки сердечного источника эмболии. J Am Soc Echocardiogr 2016;29:1-42.
- Heit JA. Тромбофилия: общие вопросы по лабораторной оценке и лечению. Гематология. Am Soc Hematol Educ Program 2007:127-35.
- Целевая группа по гемостазу и тромбозам, Британский комитет по стандартам в гематологии. Исследование и лечение наследственной тромбофилии. BrJ Haematol 2001;114:512-28.
- Мартинелли И., Маннуччи П.М., Де Стефано В. и др. Различные риски тромбоза при четырех дефектах свертывания крови, связанных с наследственной тромбофилией: исследование 150 семей. Кровь 1998;92:2353-58.
- Steinberg JS, Varma N, Cygankiewicz I, et al.


 и др. Заболеваемость подтипом ишемического инсульта среди белых, чернокожих и латиноамериканцев: исследование Северного Манхэттена. Тираж 2005; 111:1327-31.
и др. Заболеваемость подтипом ишемического инсульта среди белых, чернокожих и латиноамериканцев: исследование Северного Манхэттена. Тираж 2005; 111:1327-31.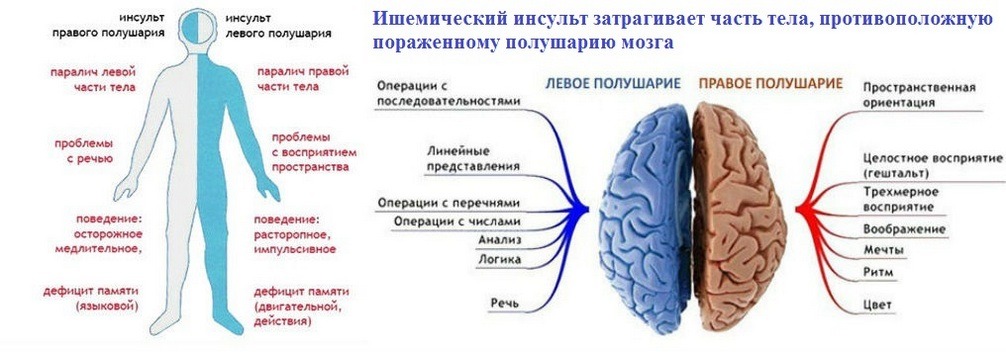 , Каплан Л.Р., Доннан Г.А., Вольф М.Э., Хеннеричи М.Г. ASCOD-фенотипирование ишемического инсульта (обновленное ASCO-фенотипирование). Цереброваск дис 2013;36:1-5.
, Каплан Л.Р., Доннан Г.А., Вольф М.Э., Хеннеричи М.Г. ASCOD-фенотипирование ишемического инсульта (обновленное ASCO-фенотипирование). Цереброваск дис 2013;36:1-5. J Am Coll Cardiol 2017;70:e39.
J Am Coll Cardiol 2017;70:e39.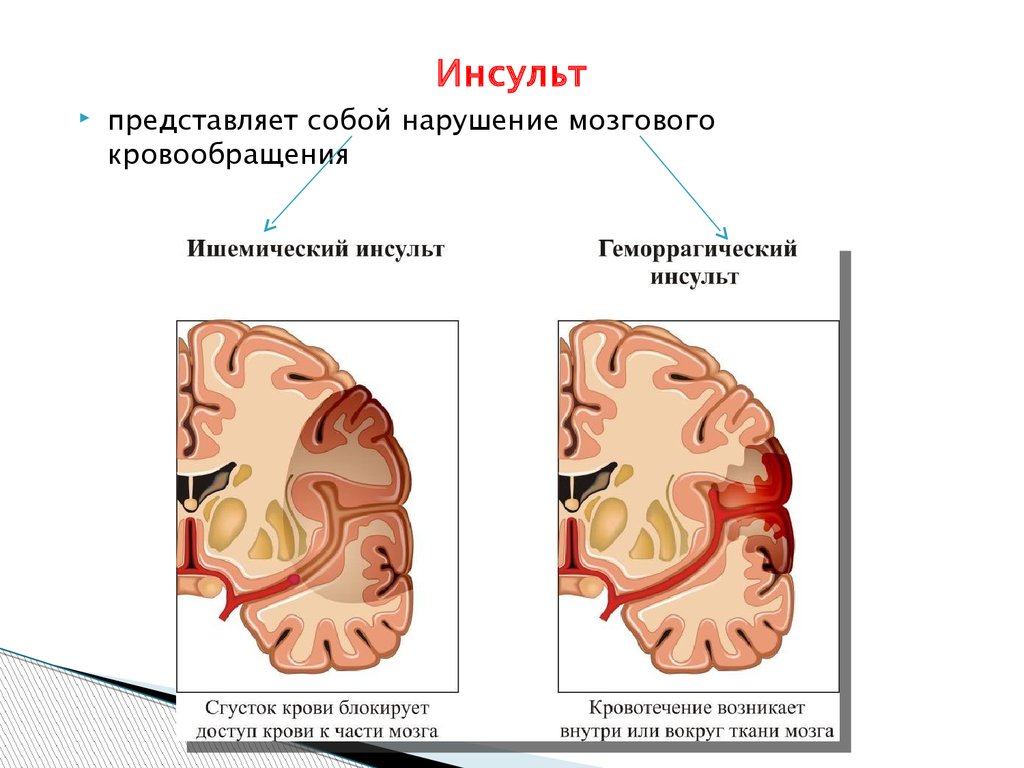 Чреспищеводная эхокардиография превосходит трансторакальную эхокардиографию при лечении пациентов любого возраста с транзиторной ишемической атакой или инсультом. Ход 2006;37:2531-34.
Чреспищеводная эхокардиография превосходит трансторакальную эхокардиографию при лечении пациентов любого возраста с транзиторной ишемической атакой или инсультом. Ход 2006;37:2531-34.