Смерть инфаркт миокарда: Что происходит с человеком при инфаркте миокарда?
Порядок кодирования причин смерти при некоторых болезнях системы кровообращения
Со времени появления официального русского издания 10-го пересмотра Международной статистической классификации болезней и проблем, связанных со здоровьем (МКБ-10) [1-4] в период до 2012 г. было внесено более 160 изменений и обновлений [5, 9]. Важнейшей задачей является обеспечение сопоставимости международной статистики заболеваемости и смертности, которая достигается использованием согласованных правил кодирования болезней [3].
Формально международные правила касаются только правил выбора и кодирования причин смерти, но не формулировки патологоанатомического диагноза. Однако рубрики патологоанатомического диагноза должны логично корреспондироваться с порядком записей о причине смерти в медицинском свидетельстве о смерти.
Патологоанатомической службой России разработаны и внедрены в практику принципы формулировки заключительного клинического и патологоанатомического диагнозов, соответствующие требованиям МКБ-10 [12]. Применение моно-, би- и мультикаузальной структуры диагноза позволяет избежать субъективизма в выборе нозологических единиц и их осложнений для записи в частях I и II медицинского свидетельства о смерти. Так, большое значение имеет формулировка комбинированного основного заболевания. Коморбизм характерен для большинства больных старших возрастных групп, и монокаузальный диагноз не позволяет объективно отразить танатогенез. Нозологическая единица, указанная первой в рубрике комбинированного основного заболевания, является первоначальной причиной смерти и вписывается в часть I свидетельства о смерти, а заболевания, записанные как конкурирующие, сочетанные или фоновые, — в часть II (наряду с важнейшими сопутствующими нозологиями) [12].
Применение моно-, би- и мультикаузальной структуры диагноза позволяет избежать субъективизма в выборе нозологических единиц и их осложнений для записи в частях I и II медицинского свидетельства о смерти. Так, большое значение имеет формулировка комбинированного основного заболевания. Коморбизм характерен для большинства больных старших возрастных групп, и монокаузальный диагноз не позволяет объективно отразить танатогенез. Нозологическая единица, указанная первой в рубрике комбинированного основного заболевания, является первоначальной причиной смерти и вписывается в часть I свидетельства о смерти, а заболевания, записанные как конкурирующие, сочетанные или фоновые, — в часть II (наряду с важнейшими сопутствующими нозологиями) [12].
Основные положения и правила, принятые Всемирной организацией здравоохранения (ВОЗ), допускают модификацию специального перечня для статистической разработки данных о заболеваемости и смертности в соответствии с национальными требованиями [3] путем разделения некоторых пунктов с диапазоном рубрик МКБ-10 в соответствии с основной классификацией, доведения до четырехзначного уровня или отбора отдельных рубрик в краткий перечень в зависимости от «эпидемиологического профиля» страны (п.
Вместе с тем как клиницисты, так и врачи-патологоанатомы нередко неверно оформляют не только диагнозы, но и медицинские свидетельства о смерти. Это ведет к дефектам статистического учета случаев смерти, снижает достоверность информации и ее международную сопоставимость. Бóльшая часть ошибок формулировки диагнозов и оформления медицинских свидетельств о смерти связана с необоснованным искусственным приоритетом острых и хронических форм ишемических болезней сердца (I20-I25) и цереброваскулярных болезней (I60-I69) при выборе первоначальной причины смерти.
Так, показатель смертности (SDR) от болезней системы кровообращения в Российской Федерации более чем в 3 раза превышает аналогичный показатель в странах Европейского Союза
Основой для формирования статистики смертности является медицинское свидетельство о смерти (учетная форма №106/у-08 «Медицинское свидетельство о смерти» или учетная форма №106-2/у-08 «Медицинское свидетельство о перинатальной смерти», которые утверждены приказом Министерства здравоохранения и социального развития Российской Федерации №782н от 26 декабря 2008 г., зарегистрированным Министерством юстиции Российской Федерации 30 декабря 2008 г., регистрационный №13055). Принятые в Российской Федерации учетные формы медицинских свидетельств о смерти основаны на международной форме медицинского свидетельства о смерти (табл. 2), рекомендованной ВОЗ. Порядок заполнения медицинского свидетельства о смерти регламентирован Минздравом России [6, 7] на основе основных положений и правил, принятых ВОЗ [3].
В соответствии с решением XX сессии ВОЗ (1967), в качестве причины смерти принимаются «все те болезни, патологические состояния или травмы, которые привели к смерти или способствовали ее наступлению, а также обстоятельства несчастного случая или акта насилия, которые вызвали любые такие травмы». Причины смерти подразделяются на первоначальные и непосредственные [3 (п. 4.1.1, с. 33), 12].
Причины смерти подразделяются на первоначальные и непосредственные [3 (п. 4.1.1, с. 33), 12].
Принятые международные правила предусматривают выбор в качестве первоначальной причины смерти только одной нозологической единицы [3, 7, 12].
Первоначальная причина смерти определена как «болезнь или травма, вызвавшая цепь болезненных процессов, непосредственно приведших к смерти», или «обстоятельства несчастного случая или акта насилия, которые вызвали смертельную травму» [3 (п. 4.1.2, с. 34), 12]. А «болезненные процессы, непосредственно приведшие к смерти», обозначаются как непосредственные причины смерти. В клиническом или патологоанатомическом диагнозе они представлены смертельными осложнениями [12]. При этом симптомы и явления, сопровождающие наступление смерти (механизм смерти), такие как сердечная или дыхательная недостаточность, в свидетельство о смерти не включаются ни в качестве первоначальной, ни в качестве непосредственной причины смерти [3 (п. 4.1.1, с. 33), 12].
Состояние, записанное на нижней заполненной строке части I свидетельства, принимается за первоначальную причину смерти, используемую для статистической разработки. Если в части I указана только одна причина смерти, то именно она используется для статистической разработки.
При определении исходной предшествовавшей причины следует пользоваться общим принципом [3 (п. 4.1.5, с. 38)] либо правилами выбора 1, 2 и 3 [3 (п. 4.1.5-4.1.6, с. 38-46)], либо правилами модификации [3 (п. 4.1.8-4.1.10, с. 46-54)].
Общий принцип заключается в соблюдении обратной патогенетической последовательности записей в пунктах а, б и в части I, так, что каждое из записанных состояний является следствием состояния, записанного строкой ниже, и причиной возникновения состояния, записанного строкой выше. Таким образом, в качестве исходной предшествовавшей причины выбирают состояние, записанное на нижней заполненной строке части I, только в том случае, если оно могло привести к возникновению всех состояний, записанных выше него [3 (п. 4.1.5, с. 38)].
4.1.5, с. 38)].
В качестве первоначальной причины смерти не могут использоваться названия блоков болезней (I20-I25 Ишемические болезни сердца, I60-I69 Цереброваскулярные болезни, I10-I15 Болезни, характеризующиеся повышенным кровяным давлением, J40-J47 Хронические болезни нижних дыхательных путей и др.), а также обобщающие термины, такие как I70.9 Генерализованный и неуточненный атеросклероз. В качестве первоначальной причины смерти должны использоваться четырехзначные коды, соответствующие конкретным рубрикам МКБ-10 (нозологическим единицам) [12].
В качестве первоначальной причины смерти не могут использоваться неуточненные состояния, кодируемые четырехзначной подрубрикой -.9 [12].
Если предварительно выбранный код наличествует с другим состоянием, для кодирования первоначальной причины смерти используются замечания и сводные таблицы связей по кодовому номеру [9 (с. 158-161)].
Так, применительно к случаям смерти, в которых в качестве первоначальной причины смерти выбираются коды из класса IX Болезни системы кровообращения (I00-I99), приняты следующие правила.
Если предварительно выбранный код G25.5 Другие виды хореи наличествует с I00-I02 Острая ревматическая лихорадка, то для кодирования первоначальной причины смерти следует использовать рубрику I02.-. Если предварительно выбранный код G25.5 Другие виды хореи наличествует с I05-I09 Хронические ревматические болезни сердца, то для кодирования первоначальной причины смерти следует использовать рубрику I02.-.
Если предварительно выбранный код I05.9 Болезнь митрального клапана, неуточненная при неустановленной причине, наличествует с упоминанием о I34. Неревматические поражения митрального клапана, то для кодирования первоначальной причины смерти следует использовать рубрику I34.-.
Если предварительно выбранный код I09.1

Болезни, характеризующиеся артериальной гипертензией (I10-I13), могут быть выбраны в качестве первоначальной причины смерти только если они являются единственным диагностированным состоянием у пациента.
Если предварительно выбранный код I10 Эссенциальная (первичная) гипертензия наличествует с упоминанием о других состояниях, то для кодирования первоначальной причины смерти следует руководствоваться правилами, изложенными в табл. 3.
Если предварительно выбранный код I10 Эссенциальная (первичная) гипертензия
наличествует в качестве исходной предшествовавшей причины других состояний, то для кодирования первоначальной причины смерти следует руководствоваться правилами, изложенными в табл. 4.Если предварительно выбранный код I11.- Гипертоническая болезнь с преимущественным поражением сердца наличествует с упоминанием о других состояниях, то для кодирования первоначальной причины смерти следует руководствоваться правилами, изложенными в табл. 5.
5.
Если предварительно выбранный код I12.- Гипертоническая болезнь с преимущественным поражением почек наличествует с упоминанием о других состояниях, то для кодирования первоначальной причины смерти следует руководствоваться правилами, изложенными в табл. 6.
Если предварительно выбранный код I13.- Гипертоническая болезнь с преимущественным поражением сердца и почек
Код I15.- Вторичная гипертензия не может быть выбран в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используется.
Если предварительно выбранный код I24.- Другие формы острой ишемической болезни сердца или I25.- Хроническая ишемическая болезнь сердца наличествует с упоминанием о I21.- Острый инфаркт миокарда, то для кодирования первоначальной причины смерти следует использовать рубрику I21. — Острый инфаркт миокарда.
— Острый инфаркт миокарда.
Если предварительно выбранный код I24.- Другие формы острой ишемической болезни сердца или I25.- Хроническая ишемическая болезнь сердца наличествует с упоминанием о I22.- Повторный инфаркт миокарда, то для кодирования первоначальной причины смерти следует использовать рубрику I22.- Повторный инфаркт миокарда.
Если предварительно выбранный код I21.- Острый инфаркт миокарда наличествует с упоминанием о I22.- Повторный инфаркт миокарда, то для кодирования первоначальной причины смерти следует использовать рубрику I22.- Повторный инфаркт миокарда.
Если предварительно выбранный код I21.- Острый инфаркт миокарда наличествует с упоминанием о I23.- Некоторые текущие осложнения острого инфаркта миокарда, то для кодирования первоначальной причины смерти следует использовать рубрики I21.- Острый инфаркт миокарда или I22.- Повторный инфаркт миокарда.
Острый инфаркт миокарда (I21. -) может быть выбран в качестве первоначальной причины смерти, если смерть наступила до 28 дней от начала заболевания, а повторный инфаркт миокарда (I22.-) — до 28 дней от начала острого [5].
-) может быть выбран в качестве первоначальной причины смерти, если смерть наступила до 28 дней от начала заболевания, а повторный инфаркт миокарда (I22.-) — до 28 дней от начала острого [5].
Коды I23.- Некоторые текущие осложнения острого инфаркта миокарда и I24.0 Коронарный тромбоз, не приведший к инфаркту миокарда, не могут быть выбраны в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используются. В таких случаях рекомендуется использовать рубрики I21.- Острый инфаркт миокарда или I22.- Повторный инфаркт миокарда.
Рубрика I25.2 Перенесенный в прошлом инфаркт миокарда обозначает перенесенный инфаркт миокарда, случайно диагностированный на ЭКГ и никак не проявлявшийся клинически, поэтому в качестве первоначальной причины смерти не применяется. Для кодирования постинфарктного кардиосклероза, сопровождавшегося синдромом хронической сердечной недостаточности, нарушениями ритма и другими осложнениями, рекомендуется использовать рубрику I25. 8 Постинфарктный кардиосклероз [5, 12]. Код I26.- Легочная эмболия не может быть выбран в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используется [12].
8 Постинфарктный кардиосклероз [5, 12]. Код I26.- Легочная эмболия не может быть выбран в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используется [12].
Если предварительно выбранный код I27.9 Легочно-сердечная недостаточность или I44.- Предсердно-желудочковая блокада и блокада левой ножки пучка Гиса, или I45.- Другие нарушения проводимости, или I46.- Остановка сердца, или I47.- Пароксизмальная тахикардия, или I48.- Фибрилляция и трепетание предсердий, или I49.- Другие нарушения сердечного ритма наличествует с упоминанием о I20-I25 Ишемические болезни сердца, то для кодирования первоначальной причины смерти следует использовать рубрики I20-I25. Это положение вытекает из общего правила, гласящего, что симптомы и явления, сопровождающие наступление смерти (механизм смерти), в свидетельство о смерти не включаются [3 (п. 4.1.1, с. 33)].
Коды I65.- Закупорка или стеноз прецеребральных артерий, не приводящие к инфаркту мозга, или I66. — Закупорка или стеноз церебральных артерий, не приводящие к инфаркту мозга, не могут быть выбраны в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используются.
— Закупорка или стеноз церебральных артерий, не приводящие к инфаркту мозга, не могут быть выбраны в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используются.
Если предварительно выбранный код I67.2 Церебральный атеросклероз наличествует с упоминанием о I60.- Субарахноидальное кровоизлияние или I61.- Внутримозговое кровоизлияние, или I62.- Другое нетравматическое внутримозговое кровоизлияние, или I63.- Инфаркт мозга, то для кодирования первоначальной причины смерти следует использовать рубрики I60-I64. Если в качестве исходной предшествовавшей причины указана F03 Деменция неуточненная, то для кодирования первоначальной причины смерти следует использовать рубрику F01.-, а если в качестве исходной предшествовавшей причины G20 Болезнь Паркинсона, то для кодирования первоначальной причины смерти следует использовать рубрику G21.4 Сосудистый паркинсонизм [9].
Хронические формы цереброваскулярных болезней (I67) могут быть выбраны в качестве первоначальной причины смерти только в случаях присоединения тяжелых осложнений, как, например, пневмонии. Не допускается запись хронической формы цереброваскулярных болезней одной строкой без указания логической последовательности состояний, приведших к смерти.
Не допускается запись хронической формы цереброваскулярных болезней одной строкой без указания логической последовательности состояний, приведших к смерти.
Если предварительно выбранный код I70.- Атеросклероз наличествует с упоминанием о других состояниях, то для кодирования первоначальной причины смерти следует руководствоваться правилами, изложенными в табл. 7.
Если предварительно выбранный код I70.- Атеросклероз наличествует в качестве исходной предшествовавшей причины других состояний, то для кодирования первоначальной причины смерти следует руководствоваться правилами, изложенными в табл. 8.
Код I97.- Нарушения системы кровообращения после медицинских процедур, не классифицированные в других рубриках, не могут быть выбраны в качестве первоначальной причины смерти и для кодирования первоначальной причины смерти не используются.
Если предварительно выбранный код N18 Хроническая болезнь почки [9] или N19 Почечная недостаточность неуточненная, или N26 Сморщенная почка неуточненная наличествует с упоминанием о I10 Эссенциальная (первичная) гипертензия или I12. — Гипертоническая болезнь с преимущественным поражением почек, то для кодирования первоначальной причины смерти следует использовать рубрику I12.- Гипертоническая болезнь с преимущественным поражением почек, если с упоминанием о I11.- Гипертоническая болезнь с преимущественным поражением сердца, то для кодирования первоначальной причины смерти следует использовать рубрику I13.- Гипертензивная (гипертоническая) болезнь с преимущественным поражением сердца и почек.
— Гипертоническая болезнь с преимущественным поражением почек, то для кодирования первоначальной причины смерти следует использовать рубрику I12.- Гипертоническая болезнь с преимущественным поражением почек, если с упоминанием о I11.- Гипертоническая болезнь с преимущественным поражением сердца, то для кодирования первоначальной причины смерти следует использовать рубрику I13.- Гипертензивная (гипертоническая) болезнь с преимущественным поражением сердца и почек.
Острые или терминальные болезни системы кровообращения, описанные как непосредственно связанные со злокачественным новообразованием (C00-C75), сахарным диабетом (Е10-Е14) или бронхиальной астмой (J45-J46), должны быть приняты как возможные последовательности в части I свидетельства (табл. 9) [5].
Следует помнить, что некроз миокарда — гетерогенная по этиологии, пато- и морфогенезу группа его тяжелых поражений, лишь часть из которых является инфарктом миокарда — нозологической единицей из группы ишемических болезней сердца и может быть выставлена в диагнозе как основное заболевание (или как компонент комбинированного основного заболевания). В других случаях некрозы миокарда (некоронарогенные метаболические или гипоксические, коронарогенные ишемические) являются проявлениями или осложнениями различных заболеваний [12].
В других случаях некрозы миокарда (некоронарогенные метаболические или гипоксические, коронарогенные ишемические) являются проявлениями или осложнениями различных заболеваний [12].
Необоснованное отождествление таких некрозов миокарда с инфарктом миокарда из группы ишемических болезней сердца является, к сожалению, нередкой ошибкой как в клинических, так и патологоанатомических диагнозах.
Наличие стенозирующего атеросклероза коронарных артерий сердца, ишемической болезни сердца и даже операций по реваскуляризации коронарных артерий сердца в анамнезе, но без обнаружения на вскрытии нестабильных атеросклеротических бляшек, окклюзии артерий тромбом или атероматозными массами не может служить доказательством принадлежности обнаруженного на вскрытии некроза миокарда к инфаркту миокарда из группы ишемических болезней сердца.
Для верификации вида некроза миокарда необходимы глубокий клинико-анатомический анализ (без учета клинических данных диагноз может быть ошибочным) и тщательное исследование коронарных артерий сердца на предмет обнаружения прежде всего нестабильных атеросклеротических бляшек. Практикуемые нередко на вскрытии поперечные разрезы коронарных артерий недостаточны для установления характера их поражения. Следует также учитывать, что в результате успешного тромболизиса на вскрытии может уже не быть диагностированных при жизни тромбов коронарных артерий сердца.
Практикуемые нередко на вскрытии поперечные разрезы коронарных артерий недостаточны для установления характера их поражения. Следует также учитывать, что в результате успешного тромболизиса на вскрытии может уже не быть диагностированных при жизни тромбов коронарных артерий сердца.
Некоронарогенные некрозы миокарда (по определению не являются инфарктом, т.е. сосудистым некрозом), обычно метаболические, достаточно широко распространены. Они могут развиваться при обменно-электролитных нарушениях, как осложнения многих тяжелых заболеваний (синдромы органной недостаточности), при интоксикациях, миокардитах, в терминальном состоянии, как элемент реанимационной болезни. Критериями их патологоанатомической диагностики являются наличие заболеваний и их осложнений, которые могут быть причиной метаболического некроза миокарда, характерная макро- и микроскопическая картина поражения миокарда, отсутствие нестабильных атеросклеротических бляшек, окклюзии, васкулита, аномалий развития и других тяжелых поражений коронарных артерий сердца. Очаги некроза миокарда обычно небольших размеров, часто множественные (мозаичные), могут быть сливными, неправильной формы, желтоватого или сероватого цвета или пропитанные кровью. Характерна жировая дистрофия миокарда, гистологически нередко выявляется чередование некротизированных и сохранных, иногда кардиомиоцитов в состоянии жировой дистрофии. При миокардитах — признаки воспалительного поражения миокарда. Наличие ишемической болезни сердца в анамнезе, клинического диагноза «инфаркт миокарда» (в том числе подтвержденного на ЭКГ и повышением кардиоспецифических биомаркеров) не является диагностическим критерием.
Очаги некроза миокарда обычно небольших размеров, часто множественные (мозаичные), могут быть сливными, неправильной формы, желтоватого или сероватого цвета или пропитанные кровью. Характерна жировая дистрофия миокарда, гистологически нередко выявляется чередование некротизированных и сохранных, иногда кардиомиоцитов в состоянии жировой дистрофии. При миокардитах — признаки воспалительного поражения миокарда. Наличие ишемической болезни сердца в анамнезе, клинического диагноза «инфаркт миокарда» (в том числе подтвержденного на ЭКГ и повышением кардиоспецифических биомаркеров) не является диагностическим критерием.
Многие заболевания и патологические процессы, осложняющиеся развитием метаболических некрозов миокарда, сопровождаются ДВС-синдромом, гипоксемией и гипоксией, поэтому ряд некоронарогенных некрозов миокарда имеет смешанный патогенез — метаболический и гипоксический (например, при шоке, сепсисе, панкреонекрозе, алкоголизме и хронической алкогольной интоксикации, реанимационной болезни и др. ).
).
Гипоксические некрозы миокарда развиваются при любых состояниях, сопровождающихся развитием гипоксемии и гипоксии (шок, коллапс, тяжелая анемия и др.), диспропорцией между потребностью миокарда в кислороде и его поступлением (аортальный стеноз, аортальная недостаточность, тиреотоксикоз и др.), при заболеваниях крови (эритремия, тромбоцитоз, синдром гиперкоагуляции, ДВС-синдром), употреблении наркотиков (например, кокаина, вызывающего спазм коронарных артерий) [12]. Вопрос о трактовке некроза миокарда как гипоксического, а не инфаркта миокарда из группы ишемических болезней сердца при наличии стенозирующего атеросклероза коронарных артерий сердца решается в каждом наблюдении индивидуально. Специфические морфологические критерии дифференциального диагноза гипоксического некроза миокарда от инфаркта миокарда из группы ишемических болезней сердца в плане изменений самого миокарда отсутствуют. Диагноз возможен на основе анализа совокупности клинических и морфологических данных.
Таким образом, коронарогенные некрозы миокарда по определению являются инфарктами миокарда (т. е. сосудистыми, ишемическими некрозами), но не всегда нозологическими единицами из группы ишемических болезней сердца, а проявлениями и осложнениями многих заболеваний, при которых поражаются коронарные артерии.
е. сосудистыми, ишемическими некрозами), но не всегда нозологическими единицами из группы ишемических болезней сердца, а проявлениями и осложнениями многих заболеваний, при которых поражаются коронарные артерии.
Критериями патологоанатомической диагностики являются наличие заболеваний и их осложнений, которые могут быть причиной ишемического некроза миокарда: (тромбо)васкулиты (коронарииты) и склероз коронарных артерий любого генеза (ревматические болезни, системные васкулиты, инфекционные и аллергические заболевания и др.), утолщение медии коронарных артерий при метаболических нарушениях, пролиферации их интимы (гомоцистеинурия, синдром Гурлера, болезнь Фабри, амилоидоз, ювенильный кальциноз артерий и др.), травматические поражения и врожденные аномалии коронарных артерий, ДВС-синдром, нарушения гемостаза (например, при паранеопластическом синдроме, эритремии и др.) с тромбозом артерий сердца, тромбоэмболия коронарных артерий (за исключением эмболии при нестабильных атеросклеротических бляшках этих артерий) и др.
При этом наличие ишемической болезни сердца в анамнезе, клинического диагноза «инфаркт миокарда» (в том числе подтвержденного на ЭКГ и повышением кардиоспецифических ферментов) не является диагностическим критерием.
Наиболее трудны для дифференциальной диагностики и кодирования причины смерти больных старших возрастных групп при сочетании анамнеза ишемической болезни сердца (в том числе перенесенного инфаркта миокарда), атеросклеротического поражения коронарных артерий сердца, артериальной гипертензии, сахарного диабета с другими заболеваниями, которые могут быть причиной некоронарогенных или коронарогенных некрозов миокарда. Диагноз возможен на основании глубокого клинико-анатомического анализа в каждом конкретном случае, иногда требуется коллегиальное решение с привлечением кардиологов и других специалистов.
В МКБ-10 предусмотрена рубрика «внезапная сердечная смерть» (код I46.1). Внезапная сердечная смерть — это групповое понятие. Спектр патологии, ее обусловливающей, весьма широк (нозологические единицы из групп ишемических болезней сердца, кардиомиопатий, миокардитов, пороков развития сердца и сосудов, синдромы Вольфа-Паркинсона-Уайта, Бругада, удлинения интервала Q-T и др. ).
).
Термин «внезапная сердечная смерть» допускается использовать при кодировании причин смерти только в крайне редких (исключительных) случаях, когда характер патологического процесса (заболевания) и соответствующего морфологического субстрата, лежащего в основе поражения сердца, не удается установить, а также при стопроцентном исключении насильственной смерти.
I51.5 Дистрофия миокарда не рекомендуется использовать при кодировании причин смерти. В этих случаях для кодирования следует выбирать I21.- Острый инфаркт миокарда, имея в виду его ишемическую стадию. При подозрении на ишемическую стадию инфаркта миокарда проведение на вскрытии макроскопической пробы миокарда на ишемию или специального гистохимического исследования обязательно [12].
На практике иногда возникает ситуация, когда клинически имелись убедительные признаки острого инфаркта миокарда (на ЭКГ, особенно при положительном тропониновом тесте и др.), и поэтому в заключительном клиническом диагнозе выставлен инфаркт миокарда, а на вскрытии диагностируется лишь очаговая ишемическая дистрофия, а не некроз миокарда, несмотря на весь спектр использованных доступных морфологических методов.
В таких случаях после исключения других причин повреждения миокарда в патологоанатомическом диагнозе рекомендуется выставлять диагноз инфаркта миокарда [12].
Статистические разработки должны проводиться не только по первоначальной, но и по множественным причинам смерти. Поэтому в медицинском свидетельстве о смерти следует кодировать все записанные состояния, включая часть II [12].
Соблюдение требований к формулировке клинического и патологоанатомического диагнозов, правил МКБ-10 по кодированию и выбору первоначальной причины смерти при болезнях системы кровообращения позволит повысить достоверность показателей смертности от этих заболеваний. Точная структура смертности послужит основанием для разработки мероприятий по снижению смертности от управляемых причин.
Конфликт интересов отсутствует.
ПРЕДИКТОРЫ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ У БОЛЬНЫХ, ПЕРЕНЕСШИХ ИНФАРКТ МИОКАРДА, ОПРЕДЕЛЯЕМЫЕ ПРИ ХОЛТЕРОВСКОМ МОНИТОРИРОВАНИИ ЭКГ | Олейников
1. National guidelines for risk identification and prevention of sudden cardiac death. Shlyahto EV, Arutyunov GP, Belenkov YN. M.: ID “MEDPRAKTIKA-M”, 2013. Russian (Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти. Шляхто Е.В., Арутюнов Г.П., Беленков Ю.Н. М.: ИД “МЕДПРАКТИКА-М”, 2013).
National guidelines for risk identification and prevention of sudden cardiac death. Shlyahto EV, Arutyunov GP, Belenkov YN. M.: ID “MEDPRAKTIKA-M”, 2013. Russian (Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти. Шляхто Е.В., Арутюнов Г.П., Беленков Ю.Н. М.: ИД “МЕДПРАКТИКА-М”, 2013).
2. Ardashev AV. Clinical arrhythmology. MEDPRAKTIKA-M; 2009. Russian (Ардашев А.В. Клиническая аритмология. МЕДПРАКТИКА-М; 2009).
3. Recourse book by Ministry of Health of the Russian Federation “The using of International Classification of Diseases -10 in the Russian medicine practice”. M.; 2002. Russian (Методическое пособие МЗ РФ “Использование МКБ-10 в практике отечественной медицины”. Москва; 2002).
4. G old MR, Ip JH, Costantini O, et al. Role of microvolt T-wave alternans in assessment of arrhythmia vulnerability among patients with heart failure and systolic dysfunction: Primaryresults from the T-wave Alternans Sudden Cardiac Death in Heart Failure Trial substudy. Circulation. 2008; 118: 2022-8.
Circulation. 2008; 118: 2022-8.
5. Bokeriya OL, Biniashvili MB. Sudden cardiac death and ischaemic heart disease. Annaly aritmologii 2013; 10(2): 69-79. Russian (Бокерия О.Л., Биниашвили М.Б. Внезапная сердечная смерть и ишемическая болезнь сердца. Анналы аритмологии 2013; 10(2): 69-79).
6. Cupples LA, Gagnon DR, Kannel WB. Long- and short-term risk of sudden coronary death. Circulation 85 (Suppl I), 1992: 11-50.
7. G afarova AV, Gafarov VV. Sudden death: Research results of myocardial infarction in terms of the WHO’s program (“Registr OIM”, “Monika”). Rossiyskiy nacional’niy kongress kardiologov, Moskva 2009; 0203: 86. Russian (Гафарова А. В., Гафаров В. В. Внезапная смерть: результаты исследования ИМ на основе программы ВОЗ (“Регистр ОИМ”, “Моника”). Российский национальный конгресс кардиологов, Москва 2009; 0203: 86).
8. D imov AS, Maksimov NI. Cardiovascular aspects of supermortality in Russia: the case analysis and capabilities of prevention. Cardiovascular therapy and prevention 2013; 12(2): 98-104. Russian ( Димов А.С., Максимов Н.И. Кардиоваскулярные аспекты сверхсмертности в России: анализ ситуации и возможности профилактики. Кардиоваскулярная терапия и профилактика 2013; 12(2): 98-104.)
Russian ( Димов А.С., Максимов Н.И. Кардиоваскулярные аспекты сверхсмертности в России: анализ ситуации и возможности профилактики. Кардиоваскулярная терапия и профилактика 2013; 12(2): 98-104.)
9. Jakushin SS, Boytsov SA, Furmenko GI, et al. Sudden cardiac death in patients with ischemic heart disease following the results of Russian multicentric epidemiologic researches of morbidity, mortality, quality of diagnostics, and treatment of acute type of CHD (REZONANS). Russ J Cardiol 2011; 2 (88): 59-64. Russian (Якушин С.С., Бойцов С.А., Фурменко Г.И. и др. Внезапная сердечная смерть у больных ишемической болезнью сердца по результатам Российского многоцентрового эпидемиологического исследования Заболеваемости, смертности, качества диагностики и лечения острых форм ИБС (РЕЗОНАНС). Российский кардиологический журнал 2011; 2 (88): 59-64.
10. Revishvili ASh. Cardioverter defibrillator for the prevention of sudden cardiac death. Vestnik aritmologii 2007; 47: 42-47. Russian (Ревишвили А.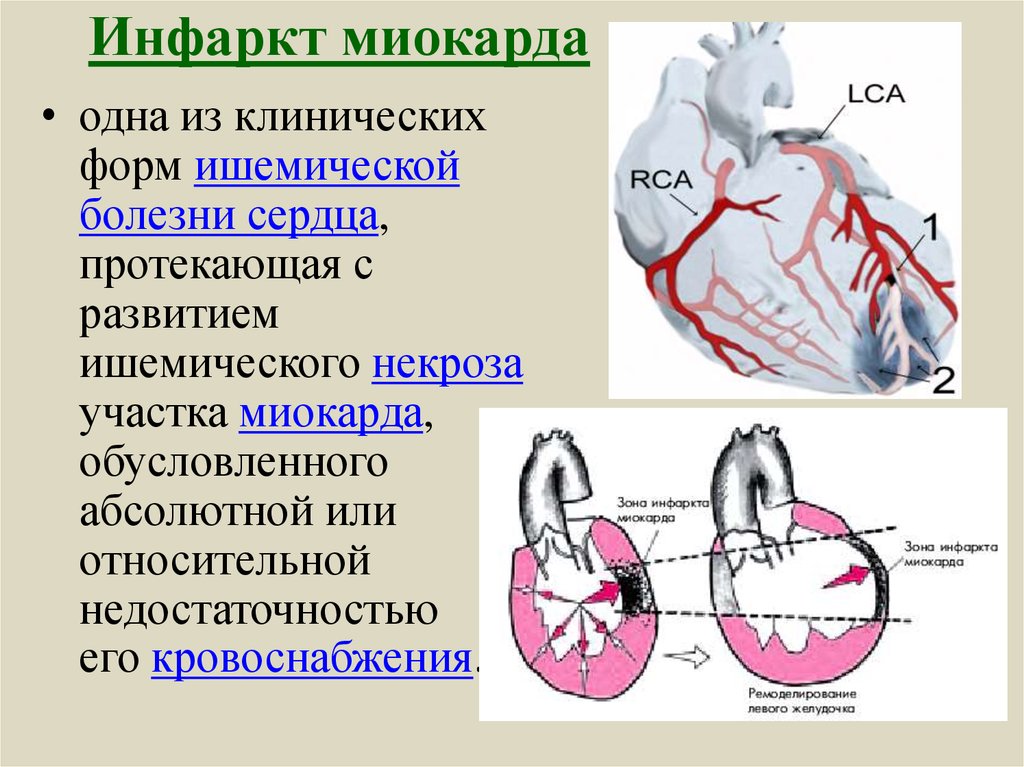 Ш. Имплантируемые кардиовертеры — дефибрилляторы в профилактике внезапной сердечной смерти. Вестник аритмологии 2007; 47: 42-47).
Ш. Имплантируемые кардиовертеры — дефибрилляторы в профилактике внезапной сердечной смерти. Вестник аритмологии 2007; 47: 42-47).
11. Clusin WT. Mechanisms of calcium transient and action potential alternans in cardiac cells and tissues. Am. J. Physiol. Heart Circ. Physiol. 2008; 294: 1-10.
12. Bokeriya OL, Ahobekov AA. The sudden cardiac death: mechanisms of the incidense and risk stratification. Annaly aritmologii 2012; 9(3): 5-13. Russian (Бокерия О. Л., Ахобеков А. А. Внезапная сердечная смерть: механизмы возникновения и стратификация риска. Анналы аритмологии 2012; 9(3): 5-13).
13. Boytsov SA, Nikulina NN, Yakushin SS, et al. The sudden cardiac death from CHD: prevalence, detectability and problems of the statistical accounting. Russ J Cardiol 2011; 2:59-64. Russian (Бойцов С.А., Никулина Н.Н., Якушин С.С. и др. Внезапная сердечная смерть у больных ИБС: распространенность, выявляемость и проблемы статистического учета. Российский кардиологический журнал 2011; 2:59-64. )
)
14. Baranceva NG. Predictors’ dynamic of the sudden death during the treatment of patients with the acute MI. Synopsis of a thesis for the degree’s competition by Candidate of Medicine. Izhevsk 2013: 191. Russian (Баранцева Н. Г. Динамика предикторов внезапной сердечной смерти в процессе лечения больных острым инфарктом миокарда. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. Ижевск 2013: 191).
15. National Russian guidelines for the application of the Holter monitoring’s approach in hospital settings. Makarov LM, Komolyatova VN, Kuprijanova OO et al. Russ J Cardiol 2014; 2 (106): 6-71. Russian (Национальные российские рекомендации по применению методики холтеровского мониторирования в клинической практике. Макаров Л. М, Комолятова В. Н., Куприянова О. О. и др. Российский кардиологический журнал 2014; 2 (106): 6-71).
16. Makarov M. L. Holter monitoring. 3 pub. . — M.: ID “Medpraktika-M”; 2008. Russian (Макаров М. Л. Холтеровское мониторирование. 3-е изд. — М.: ИД “Медпрактика-М”; 2008.)
3-е изд. — М.: ИД “Медпрактика-М”; 2008.)
17. Goldberger JJ, Cain ME, Hohnloser SH, et al. American Heart Association/American College of Cardiology Stratification Techniques for Identifying Patients at Risk for Sudden Cardiac Foundation/Heart Rhythm Society Scientific Statement on Noninvasive Risk and Council on Epidemiology and Prevention on Clinical Cardiology Committee on Electrocardiography and Arrhythmias . J Am Coll Cardiol 2008; 52: 1179-99.
18. Mozos, Serban C, Mihaescu R. Late ventricular potentials in cardiac and extracardiac diseases, in Cardiac Arrythmias-New Considerations, F. R. Breijo-Marquez, Ed., In Tech, 2012: 227-45.
19. Gomes JA, Cain ME, Buxton AE, et al. Prediction of long-term outcomes by signalaveragedelectrocardiography in patients with unsustained ventricular tachycardia, coronary artery disease, and left ventricular dysfunction. Circulation 2001; 104: 436-41.
20. Latfullin IA, Kim ZF, Teptin GM. Late potential of the ventriculus. Vestnik aritmologii 2008; 53: 44-55.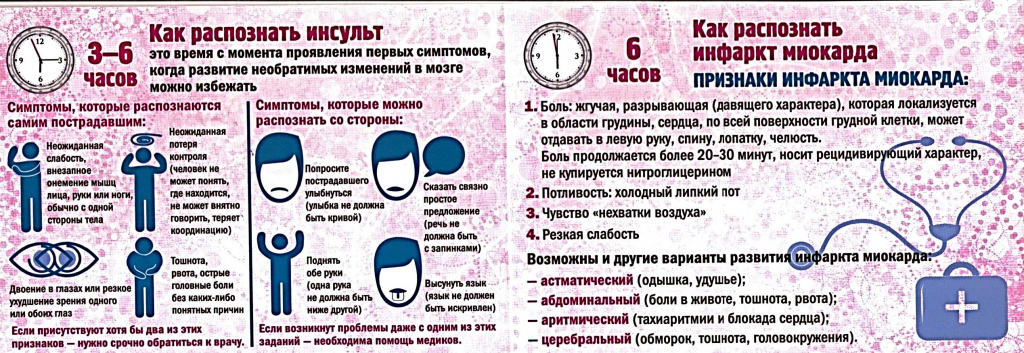 Russian (Латфуллин И.А., Ким З.Ф., Тептин Г.М. Поздние потенциалы желудочков. Вестник аритмологии 2008; 53: 44-55).
Russian (Латфуллин И.А., Ким З.Ф., Тептин Г.М. Поздние потенциалы желудочков. Вестник аритмологии 2008; 53: 44-55).
21. Bauer A, Guzik P, Barthel P, et al. Reduced prognostic power of ventricular late potentials in post-infarction patients of the reperfusion era. Eur. Heart J. 2005; Apr. 26(8): 755-61.
22. Schwarz PJ QT interval prolongation as predictor of sudden death in patients with myocardial infarction. P. J. Schwarz, S. Wolf Circulation. 1978; 57: 1074-7.
23. Chugh SS, Reinier K. Determinants of prolonged Q–T interval and their contribution to sudden death risk in coronary artery disease: the Oregon sudden unexpected death study. Circulation. 2009; 119: 663-70.
24. Chauhan VS, Tang AS. Dynamic changes of QT interval and QT dispersion in non-Q-wave and Q-wave myocardial infarction. Journal of Electrocardiology. 2001; 34: 109-17.
25. Hashimoto N, Musha H, Ozawa A, et al. Relationship between infarction location and size to QT dispersion in patients with chronic myocardial infarction. Jpn Heart J. 2002; 43, 5: 455-61.
Jpn Heart J. 2002; 43, 5: 455-61.
26. Porthan K, Virolainen J, Hiltunen TP, et al. Relationship of electrocardiographic repolarization measures to echocardiographic left ventricular mass in men with hypertension. J. H ypertens. 2007; 25, 9; 1951-7.
27. Bagadaeva EJu. Percutaneous coronary intervention by the patients with acute MI and comorbide pathology: the dynamic of the QT Interval Dispersion. Ph.D. thesis in Medicine Science. Irkutsk 2014: 121. Russian ( Багадаева Е. Ю. Чрескожное коронарное вмешательство у больных с острым инфарктом миокарда и коморбидной патологией: динамика дисперсии интервала QT. Диссертация на соискание ученой степени кандидата медицинских наук. Иркутск 2014: 121).
28. Eslami V, Safi M, Taherkhani M., et al. Evaluation of QT, QT dispersion, and T-wave peak to end time changes after primary percutaneous coronary intervention in patients presenting with acute ST-elevation myocardial infarction. J Invasive Cardiol. 2013; 25, 5: 232-4.
29. Tatarinova AA, Treshkur TV, Parmon EV. The microvolt T wave alternans as a new analysis method of the changing of the repolarization’s phase and revelation of the latent electric myocard’s instability. Kardiologiya 2011; 6: 66-82. Russian (Татаринова А.А., Трешкур Т.В., Пармон Е.В. Микровольтная альтернация зубца Т как новый метод анализа изменений фазы реполяризации и выявления латентной электрической нестабильности миокарда. Кардиология 2011; 6: 66-82).
Tatarinova AA, Treshkur TV, Parmon EV. The microvolt T wave alternans as a new analysis method of the changing of the repolarization’s phase and revelation of the latent electric myocard’s instability. Kardiologiya 2011; 6: 66-82. Russian (Татаринова А.А., Трешкур Т.В., Пармон Е.В. Микровольтная альтернация зубца Т как новый метод анализа изменений фазы реполяризации и выявления латентной электрической нестабильности миокарда. Кардиология 2011; 6: 66-82).
30. Extramiana F, Maison-Blanche P, Badilini F, et al. Circadian modulation of QT rate dependence in healthy volunteers: gender and age differences. II J: Electrocardiol. 1991: 32-43.
31. Rosenbaum DS, Jackson LE, Smith JM, et al. Electrical alternans and vulnerability to ventricular arrhythmias. N. Engl. J. Med. 1994; 330: 235-41.
32. Nieminen T, Lehtima T, Viik J, et al. T-wave alternans predicts mortality in a population undergoing a clinically indicated exercise test. Eur. Heart J.2007; 28: 2332-7.
33. Ikeda T, Yoshino H, Sugi K, et al. Predictive value of microvolt T-wave alternans for sudden cardiac death in patients with preserved cardiac function after acute myocardial infarction: results of a collaborative cohort study. J. Am. Coll. Cardiol. 2006; 48: 2268-74.
Predictive value of microvolt T-wave alternans for sudden cardiac death in patients with preserved cardiac function after acute myocardial infarction: results of a collaborative cohort study. J. Am. Coll. Cardiol. 2006; 48: 2268-74.
34. Gehi AK, Stein RH, Metz LD, et al. Microvolt T-wave alternans for the risk stratification of ventricular tachyarrhythmic events: a meta-analysis. J. Am. Coll. Cardiol. 2005; 46, 1: 75-82.
35. Tanno K, Ryu S, Watanabe N, et al. Microvolt T-wave alternans as a predictor of ventricular tachyarrhythmias. A prospective study using atrial pacing. Circulation 2004; 109: 1854-8.
36. Nieminen T, Lehtinen R, Viik J, et al. T-wave alternans predicts mortality in a population undergoing a clinically indicated exercise test (As a part of FINCAVAS). Eur Heart J 2007; 28: 2332-7.
37. Avoort CJ, Filion KB, Dendukuri N, et al. Microvolt T-wave alternans as a predictor of mortality and severe arrytmias in patients with left ventricular dysfunction: a systematic review and metaanalysis.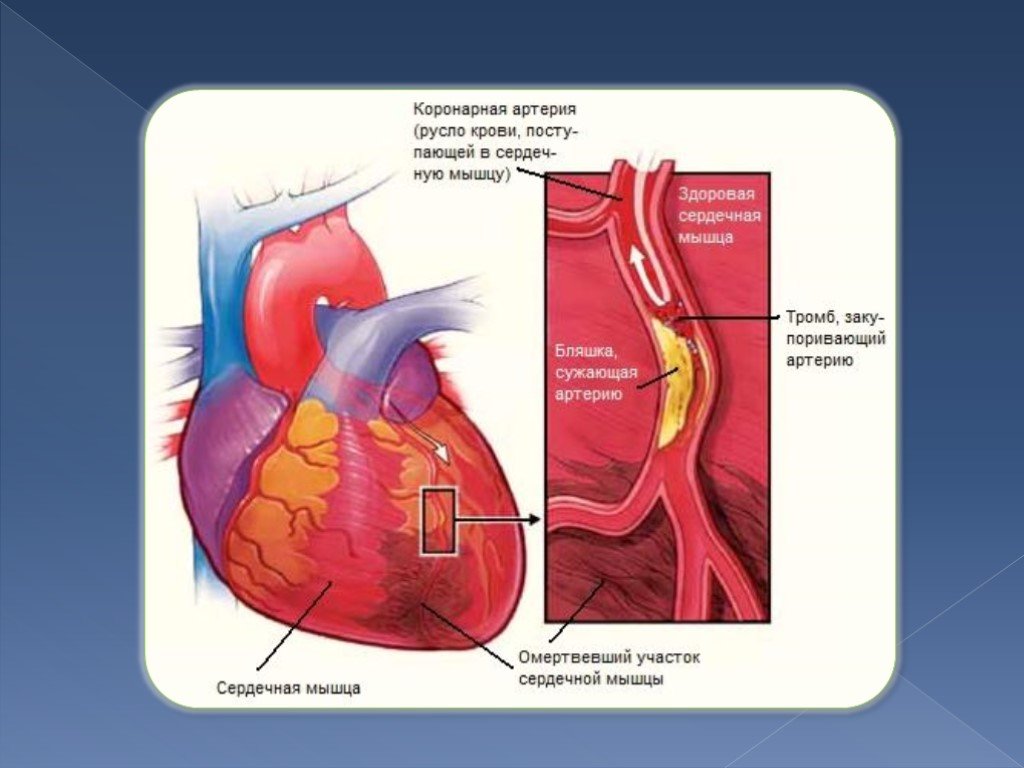 BMC Cardiovasc. Disord. 2009; 28, 9: 5.
BMC Cardiovasc. Disord. 2009; 28, 9: 5.
38. Costantini O, Hohnloser SH, Kirk MM, et al. The ABCD (Alternans Before Cardioverter Defibrillator) Trial: strategies using T-wave alternans to improve efficiency of sudden cardiac death prevention, J. Am. Coll. Cardiol. 2009; 53: 471-9.
39. Heart rate variability. Measuring standards of the physiological interpretation and clinical treatment. Writing group of the European society of Cardiology and North-American society of stimulation and electrophysiology. European Heart Journal 1996; 17: 354-81).
40. Chuhnin EV, Amirov NB, Morozova NI. Risk of the sudden death and the heart rate. Vestnik sovremennoy klinicheskoy mediciny 2010; 3(4): 558-60. Russian (Чухнин Е.В., Амиров Н.Б., Морозова Н.И. Риск внезапной смерти и частота сердечных сокращений. Вестник современной клинической медицины 2010; 3(4): 558-60).
41. Abramkin DV, Yavelov IS, Gratsianskiy NA. The comparison of the heart rate’s changes value during the reflecxive tests and heart rate variability for the prediction of the sudden death in post MI-patients. Kardiologiya 2004; 9: 34-42. Russian (Абрамкин Д. В., Явелов И. С., Грацианский Н. А. Сравнение значения изменений ЧСС во время рефлекторных тестов и вариабельности ритма сердца для прогноза внезапной сердечной смерти у больных, перенесших инфаркт миокарда. Кардиология 2004; 9: 34-42).
Kardiologiya 2004; 9: 34-42. Russian (Абрамкин Д. В., Явелов И. С., Грацианский Н. А. Сравнение значения изменений ЧСС во время рефлекторных тестов и вариабельности ритма сердца для прогноза внезапной сердечной смерти у больных, перенесших инфаркт миокарда. Кардиология 2004; 9: 34-42).
42. Farrell TG , Bashir Y, Cripps T, et al. Risk stratification for arrhythmic events in postinfarction patients based on heart rate variability, ambulatory electrocardiographic variables and the signal-averaged electrocardiogram. J Am Coll Cardiol 1991; 18: 687-97.
43. Odemuyiwa O, Malik M, Farrell T, et al. Comparison of the predictive characteristics of heart rate variability index and left ventricular ejection fraction for all-cause mortality, arrhythmic events and sudden death after acute myocardial infarction. Am J Cardiol. 1991; 68: 434-9.
44. Cripps TR, Malik M, Farrell TG , et al. Prognostic value of reduced heart rate variability after myocardial infarction: clinical evaluation of a new analysis method. Br Heart J. 1991; 65: 14-9.
Br Heart J. 1991; 65: 14-9.
45. Pedretti R, Etro MD, Laporta A, et al. Prediction of late arrhythmic events after acute myocardial infarction from combined use of noninvasive prognostic variables and inducibility of sustained monomorphic ventricular tachycardia. Am J Cardiol. 1993; 71: 1131-41.
46. Shlyahto EV, Berngardt JeR, Parmon EV, et al. Heart rate turbulence by the sudden death’s risk assessment. Vestnik aritmologii 2004; 38: 49-55. Russian (Шляхто Е. В., Бернгардт Э. Р., Пармон Е. В. и др. Турбулентность сердечного ритма в оценке риска внезапной сердечной смерти. Вестник аритмологии 2004; 38: 49-55).
47. Ghuran A, Reid F, La Rovere MT, et al. Heart rate turbulence-based predictors of fatal and nonfatal cardiac arrest (The Autonomic Tone and Reflexes After Myocardial Infarction substudy). Am. J. Cardiol. 2002; 89: 184-90.
48. Bauer A, Barthel P, Schneider R. Improved Stratification of Autonomic Regulation for risk prediction in post-infarction patients with preserved left ventricular function (ISAR-Risk). Eur. Heart J. 2009; 30: 576-83.
Eur. Heart J. 2009; 30: 576-83.
49. Huikuri H. V., Exner D. V. CARISMA and REFINE Investigators. Attenuated recovery of heart rate turbulence early after myocardial infarction identifies patients at high risk for fatal or nearfatal arrhythmic events. Heart Rhythm. 2010; 7, 2: 229-35.
50. Hoshida K, Miwa Y, Miyakoshi M, et al. Simultaneous assessment of T-wave alternans and heart rate turbulence on holter electrocardiograms as predictors for serious cardiac events in patients after myocardial infarction. Circ. J. 2013; 77 (2): 432-8.
Внезапная смерть после инфаркта миокарда
1. Huikuri HV, Castellanos A, Myerburg RJ. Внезапная смерть из-за сердечной аритмии. N Engl J Med. 2001 г., 15 ноября; 345 (20): 1473–1482. [PubMed] [Google Scholar]
2. Стратификация риска и выживаемость после инфаркта миокарда. N Engl J Med. 1983 г., 11 августа; 309 (6): 331–336. [PubMed] [Google Scholar]
3. Berger CJ, Murabito JM, Evans JC, Anderson KM, Levy D. Прогноз после первого инфаркта миокарда. Сравнение инфаркта миокарда с зубцом Q и без зубца Q в Framingham Heart Study. Джама. 1992 23–30 сентября; 268 (12): 1545–1551. [PubMed] [Google Scholar]
Сравнение инфаркта миокарда с зубцом Q и без зубца Q в Framingham Heart Study. Джама. 1992 23–30 сентября; 268 (12): 1545–1551. [PubMed] [Google Scholar]
4. Kannel WB, Sorlie P, McNamara PM. Прогноз после первоначального инфаркта миокарда: исследование Framingham. Ам Джей Кардиол. 1979 г., июль; 44 (1): 53–59. [PubMed] [Google Scholar]
5. Marcus FI, Cobb LA, Edwards JE, et al. Механизм смерти и распространенность симптомов ишемии миокарда в терминальном периоде острого инфаркта миокарда. Ам Джей Кардиол. 1988 г., 1 января; 61 (1): 8–15. [PubMed] [Google Scholar]
6. Mukharji J, Rude RE, Poole WK, et al. Факторы риска внезапной смерти после острого инфаркта миокарда: двухлетнее наблюдение. Ам Джей Кардиол. 1984 1 июля; 54(1):31–36. [PubMed] [Google Scholar]
7. Fox CS, Evans JC, Larson MG, Kannel WB, Levy D. Временные тенденции смертности от ишемической болезни сердца и внезапной сердечной смерти с 1950 по 1999 год: Framingham Heart Study. Тираж. 2004 г. , 3 августа; 110 (5): 522–527. [PubMed] [Google Scholar]
, 3 августа; 110 (5): 522–527. [PubMed] [Google Scholar]
8. Gerber Y, Jacobsen SJ, Frye RL, Weston SA, Killian JM, Roger VL. Многовековые тенденции смертности от сердечно-сосудистых заболеваний: 25-летнее исследование сообщества. Тираж. 2006 г., 16 мая; 113 (19): 2285–229.2. [PubMed] [Google Scholar]
9. Goldberg RJ, Gorak EJ, Yarzebski J, et al. Общественная перспектива половых различий и временных тенденций заболеваемости и выживаемости после острого инфаркта миокарда и внебольничной смертности, вызванной ишемической болезнью сердца. Тираж. 1993 г., июнь; 87 (6): 1947–1953. [PubMed] [Google Scholar]
10. McGovern PG, Pankow JS, Shahar E, et al. Последние тенденции в острой ишемической болезни сердца — смертность, заболеваемость, медицинская помощь и факторы риска. Исследователи сердечного исследования Миннесоты. N Engl J Med. 1996 4 апреля; 334 (14): 884–890. [PubMed] [Google Scholar]
11. Roger VL, Jacobsen SJ, Weston SA, et al. Тенденции заболеваемости и выживаемости пациентов с госпитализированным инфарктом миокарда, округ Олмстед, штат Миннесота, с 1979 по 1994 год. Ann Intern Med. 2002 г., 5 марта; 136 (5): 341–348. [PubMed] [Google Scholar]
Ann Intern Med. 2002 г., 5 марта; 136 (5): 341–348. [PubMed] [Google Scholar]
12. Abildstrom SZ, Rask-Madsen C, Ottesen MM, et al. Влияние возраста и пола на внезапную сердечно-сосудистую смерть после инфаркта миокарда. Сердце. 2002 г., декабрь; 88 (6): 573–578. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Соломон С.Д., Зеленкофске С., МакМюррей Дж.Дж. и соавт. Внезапная смерть у пациентов с инфарктом миокарда и дисфункцией левого желудочка, сердечной недостаточностью или тем и другим. N Engl J Med. 2005 г., 23 июня; 352 (25): 2581–2588. [PubMed] [Google Scholar]
14. Yap YG, Duong T, Bland M, et al. Временные тенденции риска аритмической и неаритмической смерти у пациентов с высоким риском после инфаркта миокарда: комбинированный анализ многоцентровых исследований. Eur Heart J. 26 июля 2005 г.; 26 (14): 1385–1393. [PubMed] [Академия Google]
15. Huikuri HV, Tapanainen JM, Lindgren K, et al. Прогнозирование внезапной сердечной смерти после инфаркта миокарда в эпоху бета-блокаторов. J Am Coll Кардиол. 2003 г., 20 августа; 42 (4): 652–658. [PubMed] [Google Scholar]
J Am Coll Кардиол. 2003 г., 20 августа; 42 (4): 652–658. [PubMed] [Google Scholar]
16. Jordaens L, Tavernier R. Детерминанты внезапной смерти после выписки из больницы по поводу инфаркта миокарда в эпоху тромболитиков. Eur Heart J. 22 июля 2001 г .; 22 (14): 1214–1225. [PubMed] [Google Scholar]
17. Makikallio TH, Barthel P, Schneider R, et al. Частота внезапной сердечной смерти у перенесших острый инфаркт миокарда при оптимизированной медикаментозной и реваскуляризирующей терапии. Ам Джей Кардиол. 2006 15 февраля; 97(4):480–484. [PubMed] [Google Scholar]
18. Rouleau JL, Talajic M, Sussex B, et al. Пациенты с инфарктом миокарда в 1990-х годах — их факторы риска, стратификация и выживаемость в Канаде: исследование Канадской оценки инфаркта миокарда (CAMI). J Am Coll Кардиол. 1996 апр; 27 (5): 1119–1127. [PubMed] [Google Scholar]
19. Steg PG, Lopez-Sendon J, Lopez de Sa E, et al. Внешняя валидность клинических исследований при остром инфаркте миокарда. Arch Intern Med. 2007 г., 8 января; 167 (1): 68–73. [PubMed] [Академия Google]
2007 г., 8 января; 167 (1): 68–73. [PubMed] [Академия Google]
20. Хонлозер С.Х., Герш Б.Дж. Изменение позднего прогноза острого инфаркта миокарда: влияние на лечение желудочковых аритмий в эпоху реперфузии и имплантируемого кардиовертера-дефибриллятора. Тираж. 2003 г., 25 февраля; 107 (7): 941–946. [PubMed] [Google Scholar]
21. Moss AJ, Zareba W, Hall WJ, et al. Профилактическая имплантация дефибриллятора у больных с инфарктом миокарда и сниженной фракцией выброса. N Engl J Med. 2002 г., 21 марта; 346 (12): 877–883. [PubMed] [Академия Google]
22. Hohnloser SH, Kuck KH, Dorian P, et al. Профилактическое использование имплантируемого кардиовертера-дефибриллятора после острого инфаркта миокарда. N Engl J Med. 2004 г., 9 декабря; 351 (24): 2481–2488. [PubMed] [Google Scholar]
23. Wilber DJ, Zareba W, Hall WJ, et al. Зависимость риска смертности от времени и пользы от дефибриллятора после инфаркта миокарда. Тираж. 2004 г., 9 марта; 109 (9): 1082–1084. [PubMed] [Google Scholar]
24. Myerburg RJ, Kessler KM, Castellanos A. Внезапная сердечная смерть. Структура, функция и зависимость риска от времени. Тираж. 1992 янв; 85 (1 Приложение): I2 – I10. [PubMed] [Google Scholar]
Myerburg RJ, Kessler KM, Castellanos A. Внезапная сердечная смерть. Структура, функция и зависимость риска от времени. Тираж. 1992 янв; 85 (1 Приложение): I2 – I10. [PubMed] [Google Scholar]
25. Салухе Т.В., Димопулос К., Саттон Р., Коутс А.Дж., Пьеполи М., Фрэнсис Д.П. Годы жизни, полученные в результате имплантации дефибриллятора: заметное нелинейное увеличение в течение 3 лет наблюдения и его последствия. Тираж. 2004 г., 20 апреля; 109 (15): 1848–1853. [PubMed] [Google Scholar]
26. Роджер В.Л., Киллиан Дж., Хенкель М. и соавт. Цели и методология эпиднадзора за коронарными заболеваниями в округе Олмстед. Дж. Клин Эпидемиол. 2002 июнь; 55 (6): 593–601. [PubMed] [Google Scholar]
27. White AD, Folsom AR, Chambless LE, et al. Общественный эпиднадзор за ишемической болезнью сердца в исследовании риска атеросклероза в сообществах (ARIC): методы и первые два года опыта. Дж. Клин Эпидемиол. 1996 г., февраль; 49 (2): 223–233. [PubMed] [Google Scholar]
28. Prineas R, Crow R, Blackbur H. Миннесотское руководство по электрокардиографическим данным: стандарты и процедуры измерений и классификации. Литлтон, Массачусетс: Райт-ПСЖ; 1982. [Google Scholar]
Миннесотское руководство по электрокардиографическим данным: стандарты и процедуры измерений и классификации. Литлтон, Массачусетс: Райт-ПСЖ; 1982. [Google Scholar]
29. Чарлсон М.Е., Помпеи П., Алес К.Л., Маккензи Ч.Р. Новый метод классификации прогностических сопутствующих заболеваний в лонгитюдных исследованиях: разработка и проверка. J хронический дис. 1987;40(5):373–383. [PubMed] [Google Scholar]
30. Хо К.К., Пинский Дж.Л., Каннел В.Б., Леви Д. Эпидемиология сердечной недостаточности: Фремингемское исследование. J Am Coll Кардиол. 1993 г., 22 октября (4 Приложение A): 6A–13A. [PubMed] [Google Scholar]
31. Горая Т.Ю., Якобсен С.Дж., Коттке Т.Е., Фрай Р.Л., Вестон С.А., Роджер В.Л. Смерть от ишемической болезни сердца и внезапная сердечная смерть: 20-летнее популяционное исследование. Am J Эпидемиол. 2003 1 мая; 157 (9): 763–770. [PubMed] [Google Scholar]
32. Джохадар М., Якобсен С.Дж., Ридер Г.С., Вестон С.А., Роджер В.Л. Внезапная смерть и повторные ишемические явления после инфаркта миокарда в обществе.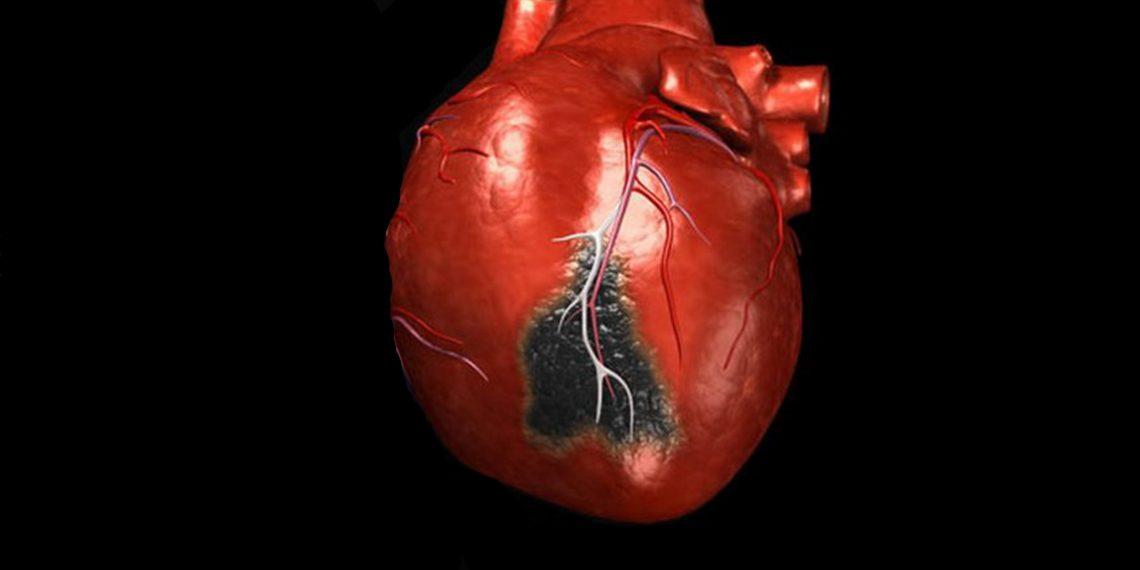 Am J Эпидемиол. 2004 г., 1 июня; 159 (11): 1040–1046. [PubMed] [Google Scholar]
Am J Эпидемиол. 2004 г., 1 июня; 159 (11): 1040–1046. [PubMed] [Google Scholar]
33. Горая Т.Ю., Якобсен С.Дж., Белау П.Г., Вестон С.А., Коттке Т.Е., Роджер В.Л. Подтверждение диагноза свидетельства о смерти внебольничной смерти от ишемической болезни сердца в округе Олмстед, Миннесота. Мэйо Клин Proc. 2000 г., июль; 75 (7): 681–687. [PubMed] [Академия Google]
34. Гули Т.А., Лейзенринг В., Кроули Дж., Сторер Б.Е. Оценка вероятностей отказов при наличии конкурирующих рисков: новые представления старых оценок. Стат мед. 1999 г., 30 марта; 18 (6): 695–706. [PubMed] [Google Scholar]
35. Bardy GH, Lee KL, Mark DB, et al. Домашнее использование автоматических наружных дефибрилляторов при внезапной остановке сердца. N Engl J Med. 2008 г., 24 апреля; 358 (17): 1793–1804. [PubMed] [Google Scholar]
36. Банч Т.Дж., Хонлозер С.Х., Герш Б.Дж. Механизмы внезапной сердечной смерти у выживших после инфаркта миокарда: результаты рандомизированных исследований имплантируемых кардиовертеров-дефибрилляторов. Тираж. 2007 г., 8 мая; 115 (18): 2451–2457. [PubMed] [Академия Google]
Тираж. 2007 г., 8 мая; 115 (18): 2451–2457. [PubMed] [Академия Google]
37. Guidry UC, Evans JC, Larson MG, Wilson PW, Murabito JM, Levy D. Временные тенденции частоты событий после инфаркта миокарда с зубцом Q: Framingham Heart Study. Тираж. 1999 г., 16 ноября; 100 (20): 2054–2059. [PubMed] [Google Scholar]
38. Hellermann JP, Goraya TY, Jacobsen SJ, et al. Частота сердечной недостаточности после инфаркта миокарда: меняется ли она во времени? Am J Эпидемиол. 2003 г., 15 июня; 157 (12): 1101–1107. [PubMed] [Google Scholar]
39. Bursi F, Weston SA, Killian JM, Gabriel SE, Jacobsen SJ, Roger VL. С-реактивный белок и сердечная недостаточность после инфаркта миокарда во внебольничном периоде. Am J Med. 2007 г., июль; 120 (7): 616–622. [PubMed] [Академия Google]
40. Spencer FA, Meyer TE, Goldberg RJ, et al. Двадцатилетние тенденции (1975–1995 гг.) заболеваемости, внутрибольничной и отдаленной смертности, связанные с сердечной недостаточностью, осложняющей острый инфаркт миокарда: перспектива в масштабах всего сообщества. J Am Coll Кардиол. 1999;34(5):1378–1387. [PubMed] [Google Scholar]
J Am Coll Кардиол. 1999;34(5):1378–1387. [PubMed] [Google Scholar]
41. Singh JP, Hall WJ, McNitt S, et al. Факторы, влияющие на надлежащее срабатывание имплантированного дефибриллятора при желудочковой тахикардии/фибрилляции: результаты многоцентрового исследования имплантации автоматического дефибриллятора II (MADIT-II) J Am Coll Cardiol. 2005 1 ноября; 46 (9)): 1712–1720. [PubMed] [Google Scholar]
42. Myerburg RJ, Mitrani R, Interian A, Jr, Castellanos A. Интерпретация результатов клинических испытаний антиаритмических препаратов: особенности дизайна и влияние на популяцию. Тираж. 1998 г., 21 апреля; 97 (15): 1514–1521. [PubMed] [Google Scholar]
43. Devlin G, Anderson FA, Heald S, et al. Ведение и исходы у пациентов с низким риском развития острого коронарного синдрома в многонациональном обсервационном регистре. Сердце. 2005 ноябрь; 91 (11): 1394–1399. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Fox KA, Anderson FA, Jr, Dabbous OH, et al.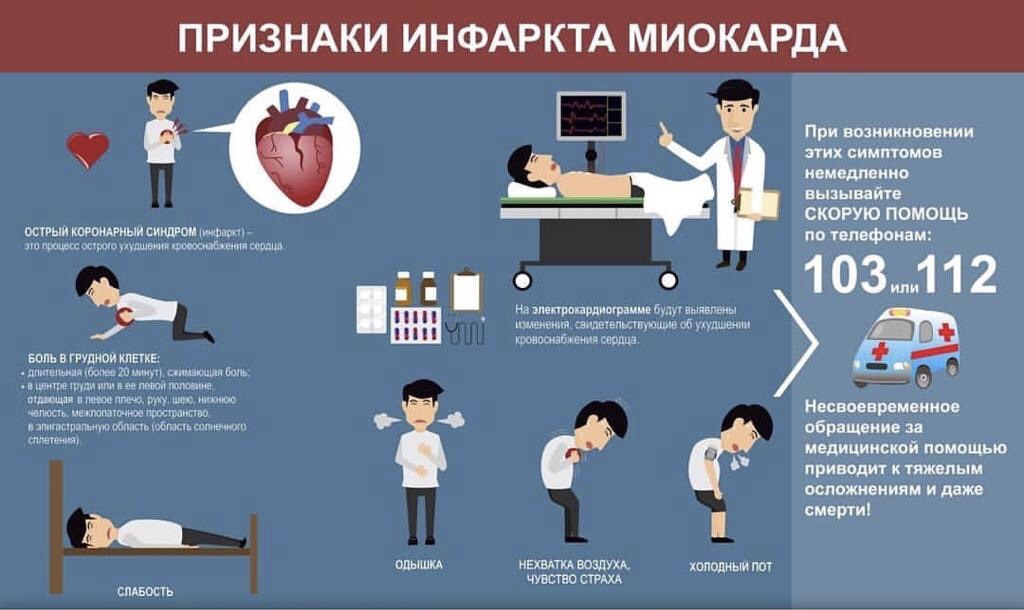 Вмешательство при острых коронарных синдромах: пациенты подвергаются вмешательству на основании их характеристик риска? Глобальный регистр острых коронарных событий (GRACE) Сердце. 2007 г., февраль; 93 (2): 177–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вмешательство при острых коронарных синдромах: пациенты подвергаются вмешательству на основании их характеристик риска? Глобальный регистр острых коронарных событий (GRACE) Сердце. 2007 г., февраль; 93 (2): 177–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Vaccarino V, Rathore SS, Wenger NK, et al. Половые и расовые различия в лечении острого инфаркта миокарда, 1994–2002 гг. N Engl J Med. 2005 г., 18 августа; 353 (7): 671–682. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Wiviott SD, Morrow DA, Frederick PD, Antman EM, Braunwald E. Применение индекса риска тромболизиса при инфаркте миокарда при инфаркте миокарда без подъема сегмента ST: оценка пациентов в Национальном реестре инфаркта миокарда. J Am Coll Кардиол. 2006 г., 18 апреля; 47 (8): 1553–1558. [PubMed] [Google Scholar]
47. Rogers WJ, Canto JG, Lambrew CT, et al. Временные тенденции в лечении более 1,5 млн пациентов с инфарктом миокарда в США с 19с 90 по 1999 год: Национальный реестр инфарктов миокарда 1, 2 и 3. J Am Coll Cardiol. 2000 г., декабрь; 36 (7): 2056–2063. [PubMed] [Google Scholar]
J Am Coll Cardiol. 2000 г., декабрь; 36 (7): 2056–2063. [PubMed] [Google Scholar]
48. Steg PG, Goldberg RJ, Gore JM, et al. Исходные характеристики, методы ведения и госпитальные исходы у пациентов, госпитализированных с острыми коронарными синдромами, в Глобальном регистре острых коронарных событий (GRACE) Am J Cardiol. 2002 г., 15 августа; 90 (4): 358–363. [PubMed] [Google Scholar]
49. Уоткинс С., Тиманн Д., Кореш Дж., Пау Н., Фолсом А.Р., Розамонд В. Четырнадцать лет (19с 87 по 2000 г.) тенденции частоты приступов, терапии и смертности от острых коронарных синдромов без подъема сегмента ST в четырех сообществах США. Ам Джей Кардиол. 2005 г., 15 ноября; 96 (10): 1349–1355. [PubMed] [Google Scholar]
50. Gandy A, Therneau TM, Aalen OO. Глобальные тесты в регрессионной модели аддитивных опасностей. Стат мед. 2008 г., 15 марта; 27 (6): 831–844. [PubMed] [Google Scholar]
51. Lloyd-Jones DM, Tian L. Прогнозирование сердечно-сосудистого риска: что нам теперь делать? Arch Intern Med. 2006 г., 10 июля; 166 (13): 1342–1344. [PubMed] [Академия Google]
2006 г., 10 июля; 166 (13): 1342–1344. [PubMed] [Академия Google]
52. Пенчина М.Дж., Д’Агостино Р.Б., старший, Д’Агостино Р.Б., младший, Васан Р.С. Оценка дополнительной прогностической способности нового маркера: от площади под ROC-кривой до реклассификации и далее. Стат мед. 2008 г., 30 января; 27 (2): 157–172. обсуждение 207–112. [PubMed] [Google Scholar]
Заболеваемость острым инфарктом миокарда, приведшим к внезапной смерти вне больницы
Текст статьи
Меню статьи
- Статья
Текст - Артикул
инфо - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
Метрика - Оповещения
Догоспитальная помощь
Заболеваемость острым инфарктом миокарда, приведшим к внезапной смерти вне стационара
- Фредерик Аднет1,
- Робин Рено2,
- Патрисия Джабре1,3,
- Эрик Кулстад4,
- Michel Galinski1,
- Frédéric Lapostolle1
- 1 SAMU 93 – EA 3409, Avicenne Hospital, Bobigny, France
- 2 SAMU 75, Necker Hospital, Paris, France
- 3 INSERM, U970, Центр сердечно-сосудистых исследований Парижа, Париж, Франция
- 4 Отделение неотложной медицины, Медицинский центр Advocate Christ, Оук-Лоун, Иллинойс, США
- Корреспонденция профессору Фредерику Адне, Саму 93 – EA 3409, Больница Ависенна, Общественная помощь – Больница Парижа, Парижский университет 13, 125 улица Сталинград, 93009 Бобиньи Седекс, Франция; frederic.
 adnet{at}avc.aphp.fr
adnet{at}avc.aphp.fr
Abstract
Цель Проспективно определить процент случаев острого инфаркта миокарда (ОИМ), приводящих к внезапной смерти вне больницы.
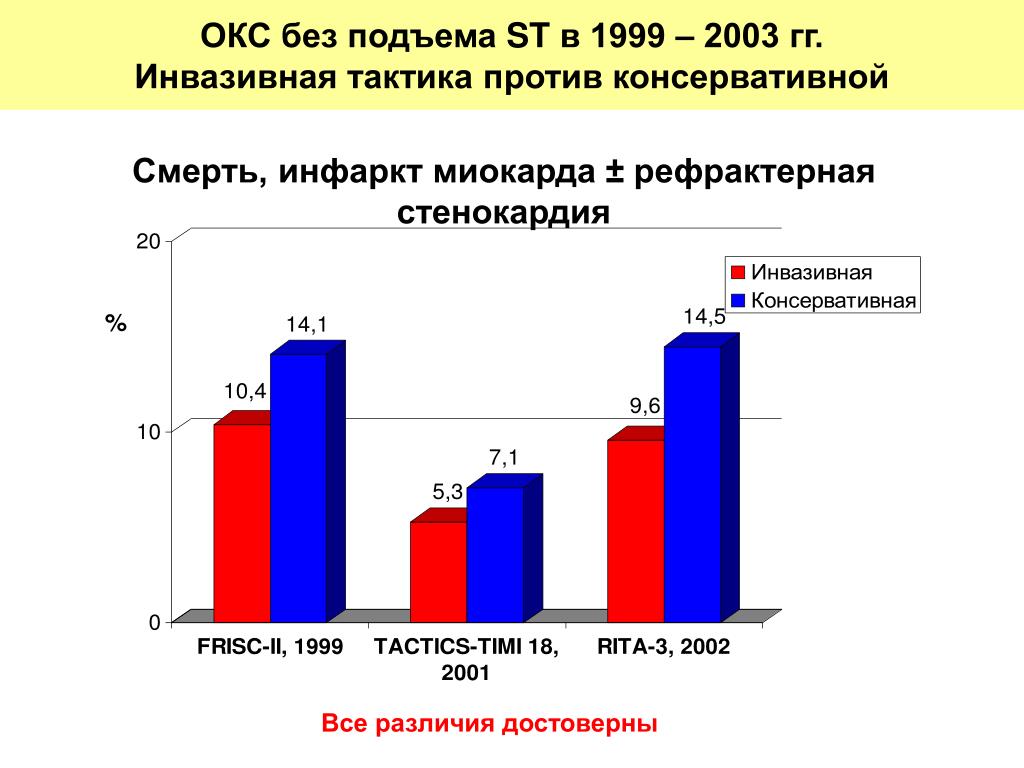
Методы Службами скорой медицинской помощи были выделены две группы пациентов. В группу А вошли все внебольничные внезапные смерти в 2004 г., отвечающие критериям возможного или вероятного ОИМ (n=39).5 место среди 1072 больных с внезапной смертью, т. е. 37%). В группу Б вошли все внутрибольничные ОИМ района за тот же год по данным госпитального учета (n=731).
Результаты Внебольничная внезапная смертность от ОИМ определялась по соотношению числа больных в группе А к общему числу больных (А+В) и составила 35% ( 95% ДИ от 32% до 38%).
Заключение По оценкам, смертность от ОИМ составляет 35% в этой популяции. Эта цифра предполагает, что значительное улучшение лечения внебольничной остановки сердца все еще необходимо.

 adnet{at}avc.aphp.fr
adnet{at}avc.aphp.fr