Шкала saps 2: Международные прогностические шкалы в анестезиологии и реаниматологии
Валидность шкал Apache II, Apache III, saps 2, saps 3 и SOFA у акушерских больных с сепсисом Текст научной статьи по специальности «Клиническая медицина»
СЕПСИС В АКУШЕРСТВЕ
© КОЛЛЕКТИВ АВТОРОВ, 2012 УДК 618.3-06:616.94]-037-07
И. Б. Заболотских, Т. С. Мусаева, Е. А. Денисова
ВАЛИДНОСТЬ ШКАЛ APACHE II, APACHE III, SAPS 2, SAPS 3 И SOFA У АКУШЕРСКИХ БОЛЬНЫХ С СЕПСИСОМ
Кафедра анестезиологии, реаниматологии и трансфузиологии ФПК и ППС ГОУ ВПО КубГМУ
Минздравсоцразвития России, Краснодар
Цель исследования — оценить эффективность шкал тяжести состояния (APACHE II, APACHE III, SAPS 2, SAPS 3, SOFA) у акушерских больных с тяжелым сепсисом. Материал и методы. Ретроспективный анализ 186 медицинских карт беременных с пульмональным сепсисом (40 женщин), уросепсисом (80 больных) и родильниц с абдоминальным сепсисом — 66. Средний возраст женщин составил 26,7 (22,4—34,5) года. Результаты. В популяции родильниц с абдоминальным сепсисом шкалы оценки тяжести APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA продемонстрировали хорошую калибровку, однако высокая разрешающая способность наблюдалась только у АРАСНЕIII, SAPS 3 и SOFA (AUROC 0,95; 0,93; 0,92 соответственно). У беременных с уросепсисом качественный прогноз обеспечивают АРАСНЕ III и SOFA; разрешающая способность этих шкал значительно превосходит APACHE II, SAPS 2 и SAPS 3 (AUROC 0,73; 0,74; 0,79 соответственно). У беременных с пульмональным сепсисом шкала APACHE II неприменима из-за недостатка калибровки (х2 = 13,1; р < 0,01), а у остальных шкал (APACHE III, SAPS 2, SAPS 3, SOFA) наблюдалась недостаточная разрешающая способность (AUROC < 0,9). Заключение. Оценка прогностической способности балльных шкал тяжести показала, что шкалы АРАСНЕ III, SAPS 3 и SOFA могут использоваться для прогноза летальности у родильниц с абдоминальным сепсисом, в популяции беременных с уросепсисом — только АРАСНЕ III и SOFA, а с пульмональным сепсисом — SAPS 3 и APACHE III только в качестве дополнительной клинической информации.
Key words: severity assessment scales, prognostic possibility, sepsis, obstetric patients
Введение. В последние два 10-летия появилось много новых шкал оценки тяжести состояния пациентов. Однако их способность точно дифференцировать умерших и выживших при различных нозологиях до сих пор ставится под сомнение [1—3]. Среди существующих современных систем количественной оценки тяжести состояния наибольшей популярностью пользуются шкалы, базирующиеся на анализе выраженности отклонений физиологических констант, характеризующих степень функциональных органосистемных расстройств (SOFA,
Информация для контакта.
Заболотских Игорь Борисович — д-р мед. наук, проф., зав. каф. анестезиологии, реаниматологии и трансфузиологии ФПК и ППС ГОУ ВПО КубГМУ Минздравсоцразвития России, Краснодар.
E-mail: [email protected]
LOD, MOD), а также шкалы, в основе которых лежит суммарный учет клинико-лабораторных параметров, пре-морбидного фона и возраста больных (SAPS 2, SAPS 3, APACHE II, APACHE III, PRISM, MPM). Внедрение методологии ROC-анализа в информационную ценность прогностических систем явилось определяющим моментом в понимании их роли для медицины критических состояний [4]. Протокол обследования и лечения больных, находящихся в реанимационном отделении, обязательно учитывает тяжесть критического состояния, без объективной оценки которой невозможно проведение эффективной целенаправленной интенсивной терапии [5].
пи
СЕПСИС В АКУШЕРСТВЕ
Таблица 1
Тяжесть состояния по различным шкалам при поступлении
Шкала Уросепсис Абдоминальный сепсис Пульмональный сепсис
APACHE III 40,2 (24,1— 54,3) 38,0 (24,0— 73,0) 39,9 (27,0— 54,8)
АРАСНЕ II 12,0 (10,5— 16,2) 13,5 (10,1— 25,0) 17,0 (12,7— 19,1)
SAPS 2 24,5 (14,7— 32,4) 25,6 (17,0— 36,4) 27,3 (22,4— 32,6)
SAPS 3 49,2 (31,0— 51,6) 35,0 (27,5— 52,0) 43,5 (35,4— 47,3)
SOFA 3,0 (1,0—6,0) 3,0 (2,0—6,0) 4,0 (3,0—7,0)
Примечание. Данные представлены в виде медианы и персентилей (p25 и p75).
дований относительно прогностических шкал (АРАСНЕ II; АРАСНЕ III и SAPS 2) наблюдался недостаток калибровки, т. е. недооценка летального исхода у пациенток с низким риском, и, наоборот, переоценка — у пациенток с высоким риском [4—6].
Был опубликован ряд исследований по оценке риска летального исхода у акушерских больных с использованием АРАСНЕ II, MPM и SAPS 2, однако полученные результаты неоднозначны [1]. Физиологические изменения при беременности ложно завышают «прогнозируемую летальность» по данным АРАСНЕ II [2], а SAPS 2, напротив, обладает хорошей способностью прогнозировать летальность [7]. Однако в современной литературе отсутствуют публикации относительно валидности шкал оценки тяжести состояния больных (APACHE III, SAPS 3, SOFA) при различных формах сепсиса (абдоминальный, пульмональный и уросепсис), что обусловлено, наверное, тем, что прогностический результат балльных шкал определяется наличием, локализацией и этиологией инфекции [8, 9].
Однако в современной литературе отсутствуют публикации относительно валидности шкал оценки тяжести состояния больных (APACHE III, SAPS 3, SOFA) при различных формах сепсиса (абдоминальный, пульмональный и уросепсис), что обусловлено, наверное, тем, что прогностический результат балльных шкал определяется наличием, локализацией и этиологией инфекции [8, 9].
Цель работы — оценить эффективность шкал оценки тяжести состояния у акушерских больных с сепсисом (APACHE II, APACHE III, SAPS 2, SAPS 3, SOFA).
Материал и методы. Мы ретроспективно провели анализ 186 историй болезней беременных: 40 с пульмональным сепсисом, 80 с уросепсисом и 66 родильниц с абдоминальным сепсисом. Из поступивших в АРО беременных: в III триместре 56/120 (46,7%), во II 61/120 (50,8%), в I триместре 3/120 (2,5%). Сроки после оперативного родоразрешения в группе с абдоминальным сепсисом 5 (3—7) дней.
Для установления диагноза сепсиса использовались критерии VII Конференции РаСХИ (ноябрь 2008 г) [13].
Все пациентки находились на лечении в МУЗ ГБ №2. Возраст пациенток составил 26,7 (22,4—34,5) года. Статистическая обработка полученных данных проводилась посредством
Таблица 3
Калибровка и разрешающая способность прогностических шкал у беременных с уросепсисомШкала Число пациенток Разрешающая способность (AUROC) Калибровка
х2 Р
АРАСНЕ III 80 0,9 4,93 0,57
АРАСНЕ II 80 0,73 6,7 0,39
SAPS 2 80 0,74 4,69 0,33
SAPS 3 79 0,79 6,0 0,34
SOFA 80 0,93 2,31 0,86
электронных таблиц Microsoft Excel (Windows XP) и программы SPSS 17. Точность прогноза (валидность) любой шкалы определялась калибровкой и разрешающей способностью. Для оценки разрешающей способности шкал вычисляли площадь под рабочей характеристической кривой (AUROC — Area Under Receiver Operator Curve), которая показывает, насколько хорошо модель дифференцирует выживших и умерших пациентов [10]. Как известно, для моделей, прогнозирующих летальный исход, надежная разрешающая способность (по данным AUROC) должна быть более 0,9. При значениях AUROC в пределах от 0,8 до 0,9 модель можно рассматривать только как дополнительную клиническую информацию; тогда как любая модель с AUROC менее 0,8 имеет малую разрешающую способность и не может быть использована в оценке прогноза летального исхода у каждого конкретного больного. Калибровка (критерий согласия — goodness of fit, GOF; С- и Н-статистика по Хосмеру—Лемешову (H-L-stat)) дает возможность модели прогнозировать летальный исход выше существующих реально значений. Чаще всего используется критерий х2 Пирсона, который предназначен для проверки гипотезы о независимости двух групп по признаку или признакам. Поэтому достоверность (р < 0,05) по критерию х2 будет свидетельствовать о том, что группы различны между собой, наоборот, недостоверный X2 (р > 0,05), что группы (прогнозируемая и наблюдаемая летальность) сопоставимы между собой. Таким образом, если наблюдаемые и ожидаемые результаты очень близки на каждом уровне диапазона модели, сумма х2 будет низкой, указывая на хорошую калибровку, и соответственно значение р будет максимальным для теста. Чем выше значение калибровки (показывает вероятность того, что данные модели и тестируемые данные не различаются), тем лучше модель соответствует реальным данным (в идеале равняется 1) [11, 12]. Калибровка и разрешающая способность взаимодополняемы, поэтому модель с AUROC 0,9 и достоверностью (р < 0,05) по критерию х2 не может быть признана хорошей.
Точность прогноза (валидность) любой шкалы определялась калибровкой и разрешающей способностью. Для оценки разрешающей способности шкал вычисляли площадь под рабочей характеристической кривой (AUROC — Area Under Receiver Operator Curve), которая показывает, насколько хорошо модель дифференцирует выживших и умерших пациентов [10]. Как известно, для моделей, прогнозирующих летальный исход, надежная разрешающая способность (по данным AUROC) должна быть более 0,9. При значениях AUROC в пределах от 0,8 до 0,9 модель можно рассматривать только как дополнительную клиническую информацию; тогда как любая модель с AUROC менее 0,8 имеет малую разрешающую способность и не может быть использована в оценке прогноза летального исхода у каждого конкретного больного. Калибровка (критерий согласия — goodness of fit, GOF; С- и Н-статистика по Хосмеру—Лемешову (H-L-stat)) дает возможность модели прогнозировать летальный исход выше существующих реально значений. Чаще всего используется критерий х2 Пирсона, который предназначен для проверки гипотезы о независимости двух групп по признаку или признакам. Поэтому достоверность (р < 0,05) по критерию х2 будет свидетельствовать о том, что группы различны между собой, наоборот, недостоверный X2 (р > 0,05), что группы (прогнозируемая и наблюдаемая летальность) сопоставимы между собой. Таким образом, если наблюдаемые и ожидаемые результаты очень близки на каждом уровне диапазона модели, сумма х2 будет низкой, указывая на хорошую калибровку, и соответственно значение р будет максимальным для теста. Чем выше значение калибровки (показывает вероятность того, что данные модели и тестируемые данные не различаются), тем лучше модель соответствует реальным данным (в идеале равняется 1) [11, 12]. Калибровка и разрешающая способность взаимодополняемы, поэтому модель с AUROC 0,9 и достоверностью (р < 0,05) по критерию х2 не может быть признана хорошей.
Результаты исследования и их обсуждение. Как известно, исходная тяжесть состояния при поступлении вносит значительный вклад в определение окончательного исхода.
Таблица 2 Таблица 4
Калибровка и разрешающая способность прогностических Калибровка и разрешающая способность прогностических шкал у родильниц с абдоминальным сепсисом шкал у беременных с пульмональным сепсисом
Шкала Число пациенток Разрешающая способность (AUROC) Калибровка Шкала Число пациенток Разрешающая способность (AUROC) Калибровка
х2 Р х2 Р
АРАСНЕ III 66 0,95 6,21 0,59 АРАСНЕ III 39 0,81 8,9 0,36
АРАСНЕ II 66 0,87 3,1 0,82 АРАСНЕ II 40 0,68 13,1 0,04
SAPS 2 66 0,89 6,4 0,49 SAPS 2 40 0,73 8,65 0,28
SAPS 3 65 0,93 6,29 0,51 SAPS 3 38 0,8 4,87 0,81
SOFA 64 0,92 2,72 0,74 SOFA 40 0,6 4,7 0,58
56
АНЕСТЕЗИОЛОГИЯ И РЕАНИМАТОЛОГИЯ № 6, 2012
жести состояния (АРАСНЕ II, APACHE III, SAPS 2, SAPS 3, SOFA). Отличий между группами по тяжести состояния при поступлении не обнаружено (табл. 1). Пороговые баллы для летальности по шкалам не отличались от представленных в литературе.
Летальный исход у родильниц с абдоминальным сепсисом наблюдался в 8 (12%) случаях, а среднее время госпитализации в ОРИТ — 30 (12—56) сут. Валидность шкал оценки тяжести у пациенток с абдоминальным сепсисом представлена в табл. 2.
Таким образом, несмотря на хорошую калибровку всех шкал только шкалы АРАСНЕ III, SAPS 3 и SOFA могут использоваться для прогноза летальности в данной популяции пациенток.
Летальный исход у беременных с уросепсисом наблюдался в 5 (6%) случаях, а среднее время госпитализации в ОРИТ составило 13 (10—24) сут.
Несмотря на хорошую калибровку всех шкал в популяции пациенток с уросепсисом, только АРАСНЕ III и SOFA продемонстрировали высокую разрешающую способность, поэтому могут быть использованы для прогноза (табл. 3).
Летальный исход у пациенток с пульмональным сепсисом наблюдался в 4 (10%) случаях, а среднее время госпитализации в ОРИТ было 11 (9—19) сут.
Как видно из табл. 4, у беременных с пульмональным сепсисом шкалы SAPS 3 и APACHE III можно использовать в качестве дополнительной клинической информации — они обладают хорошей калибровкой, но невысокой разрешающей способностью. Шкалы APACHE II, SAPS II и SOFA не обеспечивают качественный прогноз в 1-е сутки пребывания в АРО, что не позволяет использовать их для прогноза летальности.
Прогнозирование результатов лечения дает возможность объективного выбора лечебной тактики, оценки эффективности и экономического обоснования целесообразности того или иного метода терапии. Несмотря на наличие большого количества шкал оценки тяжести, проблема оценки прогноза исходов у акушерских больных остается нерешенной в силу неоднородности получаемых данных у этой популяции пациенток [3]. Данные предыдущих исследований демонстрировали низкую специфичность и чувствительность анализируемых шкал для прогноза летальности в общей выборке больных. По нашему мнению, это может быть связано с гетерогенностью исследуемой популяции вследствие разнообразия основных диагнозов: тяжелый гестоз, эклампсия, кровотечения, сепсис [1—3, 14, 15]. Следует отметить, что сепсис, как отдельная нозология, не исследовался. Поэтому логично предположить, что при условии разделения с учетом основной патологии, сопутствующих заболеваний и прочих факторов прогностическая информативность этих шкал будет выше.
В настоящем исследовании впервые оценена эффективность прогноза основных шкал оценки тяжести на популяции пациенток Краснодарского края. Не без сожаления следует отметить, что у беременных и родильниц, действительно, крайне затруднена оценка по основным шкалам оценки тяжести ввиду их низкой разрешающей способности, а для АРАСНЕ II — и калибровки в популяции с пульмональным сепсисом.
В настоящем исследовании наиболее точным прогнозом в оценке тяжести и риска летального исхода у родильниц с абдоминальным сепсисом обладают шкалы АРАС-НЕ III, SAPS 3 и SOFA; при уросепсисе — АРАСНЕ III и SOFA; в популяции беременных с пульмональным сепсисом — шкалы SAPS 3 и APACHE III можно использовать в качестве дополнительной клинической информации. По
данным зарубежных исследований [1—3, 14], у беременных и родильниц также не рекомендуется использовать шкалу APACHE II ввиду низкой прогностической способности и тенденции переоценивать летальность. Дальнейших исследований заслуживает шкала SAPS 3 — ее валидность недостаточно исследована и требует дальнейшей оценки [15].
Заключение
Оценка прогностической способности балльных шкал оценки тяжести показала, что шкалы АРАСНЕ III, SAPS 3 и SOFA могут использоваться для прогноза летальности у родильниц с абдоминальным сепсисом, в популяции беременных с уросепсисом — АРАСНЕ III и SOFA. У беременных с пульмональным сепсисом шкалы SAPS 3 и APACHE III можно использовать только в качестве дополнительной клинической информации.
ЛИТЕРАТУРА
1. El-Solh A. A., Grant B. J. A comparison of severity of illness scoring systems for critically ill obstetric patients. Chest 1996; 110: 1299— 1304.
2. Tempe A. et al. Prediction of mortality and morbidity by simplified acute physiology score II in obstetric intensive care unit admissions. Indian J. Med. Sci. 2007; 61 (4): 179—185.
3. GuptaS. et al. Obstetric critical care: A prospective analysis of clinical characteristics, predictability and fetomaternal outcome in a new dedicated obstetric intensive care unit. Indian J. Anaesth. 2011; 55 (2): 146—153.
4. Sakr Y., Krauss C., Amaral A. C. K. B. et al. Comparison of the performance of SAPS II, SAPS 3, APACHE II and their customized prognostic models in a surgical intensive care unit. Br. J. Anaesth. 2008; 101 (6): 798—803.
5. Minne L., Abu-Hanna A., de Jonge E. Evaluation of SOFA-based models for predicting mortality in the ICU: A systematic review. Crit. Care 2008; 12: 161—174.
6. Moreno R. P., Metnitz P., Almeida E. et al. SAPS 3 — from evaluation of the patient to evaluation of the intensive care unit. Part 2: Development of a prognostic model for hospital mortality at ICU admission. Intens. Care Med. 2005; 31: 1345—1355.
7. Gilbert T. T., Smulian J. C., Martin A. A. Obstetric admissions to the intensive care unit: outcomes and severity of illness. Obstetr. Gynecol. 2003; 102 (5): 897—903.
8. Fagon J.-Y., Chastre J., Novara A. et al. Characterization of intensive care unit patients using a model based on the presence or absence of organ dysfunctions and/or infection: the ODIN model. Intens. Care Med. 1993; 19: 137—144.
9. Alberti C., Brun-Buisson C., Burchardi H. et al. Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study.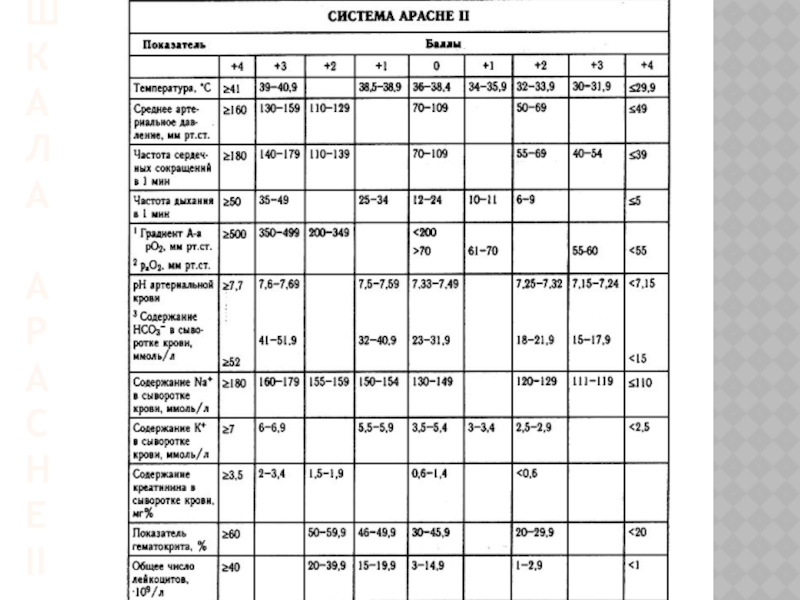 Intens. Care Med. 2002; 28: 108—121.
Intens. Care Med. 2002; 28: 108—121.
10. Hanley J. A., McNeil B. J. The meaning and use of the area under a receiver operating characteristic (ROC) curve. Radiology 1981; 143: 29—36.
11. Lemeshow S., Hosmer D. W. A review of Goodness-of-fit Statistics for Use in the development of logistic regression models. Am. J. Epidemiol. 1982; 115: 92—106.
12. Hosmer D. W., Lemeshow S. Confidence interval estimates of an index of quality performance based on logistic regression models. Statistics in Med. 1995; 14: 2161—2172.
13. Савельев В. С., Гельфанд Б. Р. (ред.). Сепсис. Классификация, клинико-диагностическая концепция и лечение. М.: Медицинское информ. агентство; 2010.
14. Saenz M. G., Das Neves A. V, Toro M. A. et al. Clinical characteristics and outcomes of obstetric patients requiring ICU admission. Chest 2007; 131: 718—724.
15. Metnitz P., Moreno R. P., Almeida E. et al. SAPS 3 — from evaluation of the patient to evaluation of the intensive care unit. Part 1: Objectives, methods and cohort description. Intens. Care Med. 2005; 31: 1336—1344.
Поступила 18.06.12
СЕПСИС В АКУШЕРСТВЕ
Оценка эффективности шкалы SAPS II и лейкоцитарного индекса интоксикации кальф-калифа при осложненной обтурационной кишечной непроходимости для определения тяжести состояния больных Текст научной статьи по специальности «Клиническая медицина»
Значения шкалы SAPS II в 1-й группе колебались от 0,04% до 15,3%, в среднем составили 3,6+3,3%, во 2-й группе от 0,46% до 41,5%, в среднем -8,5+6,8% (P<0,0001).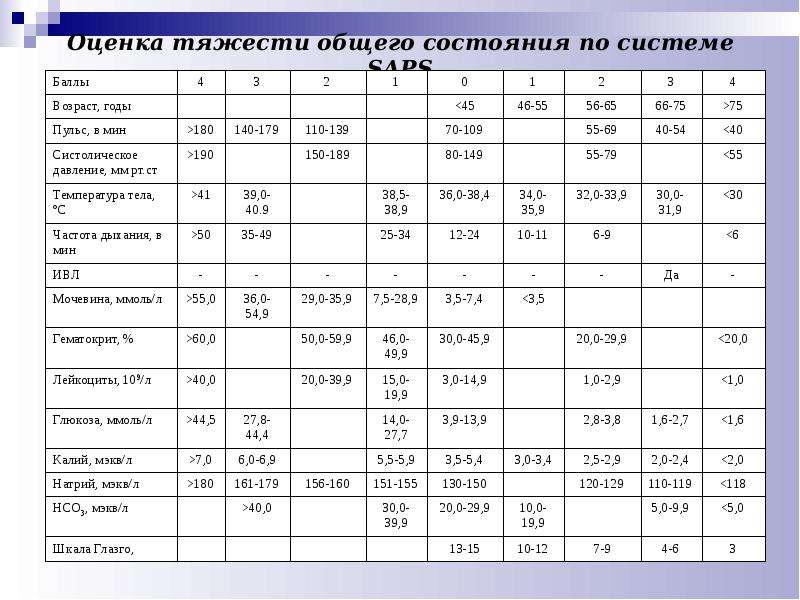 Однако у большинства больных 2-й группы (88,9%) абсолютное значение SAPS не превышало 15%, что явно недостаточно для прогнозирования летального исхода. Для сравнения отметим, что в 1-й группе только у одного пациента значение SAPS было больше 15%. Более уверенно прогнозировать возможный летальный исход можно при значениях SAPS более 15%.
Однако у большинства больных 2-й группы (88,9%) абсолютное значение SAPS не превышало 15%, что явно недостаточно для прогнозирования летального исхода. Для сравнения отметим, что в 1-й группе только у одного пациента значение SAPS было больше 15%. Более уверенно прогнозировать возможный летальный исход можно при значениях SAPS более 15%.
Значения ЛИИ по Кальф-Калифу колебались от 0,76 до 38,7 в 1-й группе (среднее 6,7+6,0) и от 0,04 до 80,2 во 2 группе (среднее 8,9+8,2), p=0,0017.
Значения ЛИИ по Островскому колебались от 0,72 до 32,0 (среднее 4,9+4,7) и от 0,04 до 32,3 (среднее 5,2+4,1) во 2 группе, p=0,4397.
Таким образом, при острой хирургической патологии выявлено существенное повышение ЛИИ, расчитанного по обеим методикам, как в 1 -й, так и во 2-й группах. Значения ЛИИ по Кальф-Калифу в группе умерших выше, чем в 1-й группе. Однако практическое значение этого вывода сомнительно, т.к. значение ЛИИ в обеих группах существенно выше нормальных. Лишь при значениях ЛИИ по Кальф-Калифу больше 40 можно констатировать уровень интоксикации, при котором летальный исход имеет высокую вероятность.
Свистунов Н.Н., Пирогов А.В., Перегудов С.И., Осипов В.А.
ОЦЕНКА ЭФФЕКТИВНОСТИ ШКАЛЫ SAPS II И ЛЕЙКОЦИТАРНОГО ИНДЕКСА ИНТОКСИКАЦИИ КАЛЬФ-КАЛИФА ПРИ ОСЛОЖНЕННОЙ ОБТУРАЦИОННОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТИ ДЛЯ ОПРЕДЕЛЕНИЯ ТЯЖЕСТИ
СОСТОЯНИЯ БОЛЬНЫХ
Больница Святого великомученика Георгия, Санкт-Петербург Санкт-Петербургский государственный университет
Колоректальный рак является распространенным заболеванием и во многих странах мира по темпам роста он переместился на второе-третье место по частоте в структуре злокачественных новообразований. Ежегодно в Европе умирают свыше 190000 больных раком этой локализации. В России в структуре летальности от злокачественных новообразований колоректальный рак занимает 3 место (10,9%) после опухолей легкого и желудка. В Санкт-Петербурге количество онкологических больных за 15 лет возросло в 2 раза, а число пациентов с колоректальным раком увеличилось за это же время в 3 раза.
Ежегодно в Европе умирают свыше 190000 больных раком этой локализации. В России в структуре летальности от злокачественных новообразований колоректальный рак занимает 3 место (10,9%) после опухолей легкого и желудка. В Санкт-Петербурге количество онкологических больных за 15 лет возросло в 2 раза, а число пациентов с колоректальным раком увеличилось за это же время в 3 раза.
Самым частым осложнением рака ободочной кишки является острая об-турационная толстокишечная непроходимость, которая встречается у 20-40% больных раком ободочной кишки.
Одним из относительно редких, но чрезвычайно тяжелых осложнений опухоли толстой кишки является перфорация. Диастатическая перфорация обо-
дочной кишки встречается гораздо реже — примерно в 26-35% случаев перфорации или в 3,4-8,9% случаев обтурационной толстокишечной непроходимости. Основными причинами летальных исходов выступают раковая интоксикация, прогрессирующий перитонит, а также септические и тромбоэмболические осложнения.
Клиническая картина диастатической перфорации крайне вариабельна. Одни авторы указывают, что клинические проявления ее развивается постепенно. Большинство авторов отмечает, что диастатическая перфорация ободочной кишки никогда не начинается у больных так остро и бурно, как, например, прободение гастродуоденальной язвы.
Тяжесть состояния у этих больных определяется не только наличием и тяжестью перитонита, но и общим состоянием организма, определяемым основным и сопутствующими заболеваниями. Для прогноза результатов лечения бывает недостаточно определить тяжесть перитонита.
Исследована возможность оценки тяжесть состояния 45 больных с супра-стенотическими перфорациями толстой кишки при опухолевой кишечной непроходимости с использованием шкалы SAPS II, которая показывает вероятность летального исхода в процентах, а также ЛИИ по Кальф-Калифу. Умерло из них 31, причиной смерти явилась интоксикация.
Умерло из них 31, причиной смерти явилась интоксикация.
Значения SAPS II, ЛИИ распределились следующим образом. Среди умерших SAPS II значения составили 1,6+2,02 среди выживших, среди умерших — 2,44+3,11 (р=0,045). Значения ЛИИ среди умерших составили 10,87+13,41, а среди выжвших — 9,28+13,27 (р=0,810).
Выявлены значимые различия значения по шкале SAPS II в группах. Однако максимальное значения вероятнотси наступления летального исхода не превышает 15%.
Таким образом, независимо от исхода заболевания выявлены признаки высокой интоксикации у больных с супрастенотическими перфорациями толстой кишки при опухолевой кишечной непроходимости, определяемые с помощью ЛИИ, и низкая эффективность шкалы SAPS II для прогноза летальности при данной патологии.
Слесаренко С.С., Горбачева Н.С., МещеряковВ.Л.
ОПТИМИЗАЦИЯ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ БОЛЬНЫХ С ТИРЕОИДНОЙ ПАТОЛОГИЕЙ
Саратовский государственный медицинский университет
Кафедрой факультетской хирургии и онкологии СГМУ проведено комплексное эпидемиологическое исследование у 1906 пациентов хирургическими заболеваниями щитовидной железы (ЩЖ), поступивших из различных регио-
Шкалы оценки тяжести состояния больных при абдоминальном сепсисе
Перитонит до настоящего времени остается чрезвычайно актуальной и до конца нерешенной проблемой абдоминальной хирургии. Несмотря на достигнутый прогресс в хирургическом лечении, летальность при распространенном гнойном перитоните (РГП) остается неизменно высокой (от 25 до 41,5%) вследствие прогрессирования эндотоксикоза и развития органносистемных дисфункций.
По данным литературы, даже после радикального устранения или отграничения источника инфекционной деструкции, полноценной санации и адекватного дренирования брюшной полости и массивной антибактериальной терапии, у 30-50% больных в различные сроки послеоперационного периода развиваются местные и системные осложнения. В настоящее время одним из ключевых аспектов проблемы РГП является прогнозирование вероятности риска возникновения этих осложнений.
В настоящее время одним из ключевых аспектов проблемы РГП является прогнозирование вероятности риска возникновения этих осложнений.
За последний 25 лет хирургия перитонита ознаменовалась внедрением новаций в его патогенетическую сущность и терминологическую трактовку, характеризующих сложных механизмов патологического процесса, развивающегося при гнойно-деструктивных процессах в брюшной полости и забрюшинном пространстве.
Появившиеся новации связаны с коренной трансформацией традиционно устоявшейся концепции, патогенетической и патофизиологической сущности генерализованной хирургической инфекции и кардинальным изменением взглядов на незыблемые базовые принципы трактовки сепсиса и связанных с ним состояний. Основу формулировки новой концепции о сепсисе составляют рекомендации, предложенные на Согласительной конференции Американского колледжа пульмонологов и Общества специалистов критической медицины (Consensus Conference Comittee – ACCP/SCCM, Чикаго, 1991).
В соответствии с новой концепцией, патологический процесс, характеризующийся синдромом системной воспалительной реакции (ССВР) организма в ответ на развитие и прогрессирование деструктивных процессов в брюшной полости и забрюшинном пространстве и сопровождающийся нарушением функций различных органов (систем) и признаками депрессии иммунной системы, принято квалифицировать и сформулировать как абдоминальный сепсис (АС).
Лидирующее место в нозологической структуре абдоминального сепсиса занимают деструктивные процессы (перфорация и некроз полых органов,) брюшной полости и забрюшинного пространства, осложненные тяжелыми формами РГП.
В развитых странах мира ежегодно регистрируется около 18 млн. случаев абдоминального сепсиса, заканчивающегося смертью 500 тысяч пациентов. Общая летальность при АС, по данным литературы, остается неизменного высокой, составляя 24-39,8%, а при развитии септического шока достигает 60- 70%. Абдоминальный сепсис с исходом в полиорганную недостаточность (ПОН) сопровождается более высокой летальностью – 83-98%.
Общепризнаным фактором, осложняющим течение и ухудшающим прогноз абдоминального сепсиса, является нарушение системы гомеостаза, способствующее прогрессированию и развитию органно-системных дисфункции (ПОН).
Одним из нерешенных вопросов проблемы абдоминального сепсиса является объективная оценка тяжести состояния больных и прогнозирование исхода заболевания. Объективизация состояния пациентов в зависимости от тяжести клинической манифестации абдоминального сепсиса позволяет прогнозировать продолжительность стационарного лечения, оценивать эффективность проводимого лечения и вероятность летального исхода.
Прогностическая оценка тяжести состояния больных и степени органно-системных дисфункций при помощи интегральных систем как необходимая составляющая концепции стратегии лечения абдоминального сепсиса рекомендована Согласительной конференцией Американского колледжа пульмонологов и Общества критической медицины (ACCP/SCCM) и решением Пленума проблемных комиссий «Неотложная хирургия» и «Гнойная хирургия» (Ростов-на-Дону, 1996). Качественная оценка результатов лечения РГП невозможна без учета концепции абдоминального сепсиса и критериев CCBP(SIRS).
В клинической практике для оценки тяжести состояния больных и прогнозирования исхода абдоминального сепсиса широкое применение нашли интегральные системы оценки степени органной дисфункции (ПОН).
Все существующие многоступенчатые балльные (шкальные) системы оценки тяжести состояния больных и степени органных дисфункций, несмотря на количество входящих в них параметров, по таким критериям, как чувствительность, специфичность, общая корректность, находятся приблизительно на одном уровне и могут быть использованы в клинической практике с одинаковой эффективностью.
В то же время между этими системами, несмотря на почти одинаковый методологический подход, существует принципиальная разница. В частности, основная цель интегральных систем оценки тяжести – прогнозирование риска летального исхода.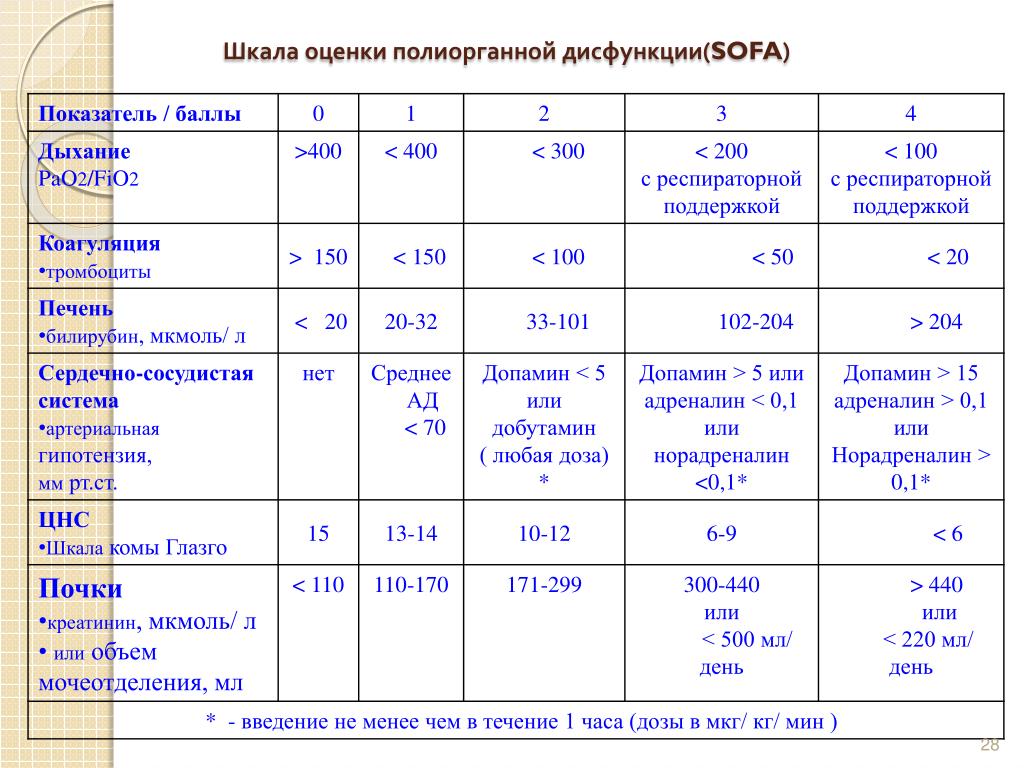
Общими недостатками существующих интегральных систем являются: плохая дискриминационная способность в отношении индивидуального прогноза при относительно точном прогнозе вероятности летального исхода для группы пациентов, низкая чувствительности шкал при недостаточно высокой специфичности.
Большую популярность получили международные шкальные (балльные) системы, основанные на числовой оценке клинических, лабораторных и биохимических параметров у больных абдоминальным сепсисом: SSS, SOFA, SAPS, APACHE II, MODS, MPI.
Исследования, проведенные Б.Р.Гельфандом и соавт. показали, что выраженность различных ССВР при интраабдоминальной инфекции может быть представлена с помощью объективных систем (шкал) оценки тяжести состояния больных (APACHE II, SAPS) и степени органно-системной дисфункции (SAPS, MODS). Авторы считают, что использование объективных критериев определения тяжести состояния больных позволяют дать клиническую стратификацию абдоминального сепсиса, оценить прогноз и оптимизировать лечебную тактику.
По сравнению с SAPS, шкала APACHE II у больных абдоминальным сепсисом отличается более высокой чувствительностью. Шкала оценки полиорганной дисфункции SOFA клинически значима и более проста для использования, чем шкала MODS.
Система SSS (Sepsis Severe Score) основана на расчете отдельных баллов при оценке дисфункции 7 основных органов или систем: дыхательной, мочевыделительной, свертывающей, сердечно-сосудистой систем, ЦНС, печени и желудочно-кишечного тракта.
Шкала SOFA (Sepsis-related Orqan Failure Assesment) принрята Европейским Обществом интенсивной терапии, которая основана на балльной (от 1 до 4 баллов) оценке функционального состояния дыхательной системы по уровню оксигенации крови; свертывающей системы по уровню тромбоцитов; печени по уровню билирубина; сердечно-сосудистой системы по величине артериального давления, ЦНС по шкале ком Глазго, мочевыделительной системы по уровню креатинина или диуреза. Суммой баллов оценивается тяжесть органно-системных дисфункций, степень которой прямо коррелирует с количеством баллов.
Суммой баллов оценивается тяжесть органно-системных дисфункций, степень которой прямо коррелирует с количеством баллов.
По данным А.А. Косовских и соавт., результаты оценки тяжести органной дисфункции у больных с распространенным гнойным перитонитом, осложненным АС по шкале SOFA 3,5 ± 0,94 балла свидетельствовали о благоприятном прогнозе заболевания. Е.В. Григорьев и соавт. считают, что шкала SOFA позволяет более объективно оценить характер органной дисфункции в динамике течения абдоминального сепсиса. Исследования Е.Б. Гельфанда и соавт. показали, что разная степень дисфункции, выраженная в интервале от 1 до 4 баллов по шкале SOFA, регистрируется практически с одинаковой частотой в отношении всех 6 критериев, включаемых в данную систему. По данным авторов, дисфункция этих систем (органов) отмечены примерно у 60% больных.
Knaus и соавт. разработана балльная оценка тяжести состояния больных и прогнозирования абдоминального сепсиса с помощью шкальной системы, учитывающая не только острые нарушения гомеостаза, но и наличие хронических заболеваний. Данная система, получившая название APACHE I (Acute Physiology and Chronic Heath Evaluation) первоначально включала 33 физиологических параметра, которым присваивали значения от 0 до 4 баллов в зависимости от того, насколько они были исключены из средних физиологических значений. Итоговая оценка тяжести определяется путем суммирования всех отклонений.
В 1985 г. эти же авторы, упростив систему APACHE I, предложили новую версию, которая включала 12 критериев, что, впрочем, не снизило ее прогностического значения. Упрощённая шкала APACHE II позволяет прогнозировать вероятность летального исхода путем использования модели логистической регрессии. Кроме баллов, система APACHE II включает вид госпитализации (экстренность) в хирургический стационар, а также количество принципиальных диагностических категорий, послуживших поводом для поступления в отделение реанимации. В США шкала APACHE II признана «золотым» стандартом и широко используется для оценки качества, организации интенсивной терапии больных перитонитом, панкреонекрозом, осложненными АС.
В США шкала APACHE II признана «золотым» стандартом и широко используется для оценки качества, организации интенсивной терапии больных перитонитом, панкреонекрозом, осложненными АС.
К.В. Костюченко и В.В. Рыбачковым проанализированы результаты хирургического лечения 290 больных с РГП, осложненным АС, с ретроспективной балльной оценкой тяжести состояния больных и прогноза заболевания с использованием шкальных систем APACHE II и МПИ. По данным авторов, при интервале дооперационного балла (ДОБ) от 0 до 10 по шкале APACHE II, летальность отсутствовала. Увеличение балла до 15 и более по шкале APACHE II обусловливает 10% летальность. При ДОБ APACHE II более 20, летальный исход был зарегистрирован более чем у 2/3 больных, при ДОБ APACHE II более 30 летальность составила 100%. По данным авторов, тяжесть течения АС по шкале МИП составляла в пределах от 20,4 до 24,2 баллов.
Авторами выявлена корреляционная связь между значениями балла по шкале APACHE II и эффективностью лечения в зависимости от применяемых методов хирургической тактики, а также исходом заболевания. Установлено, что в интервале значений ДОБ APACHE II от 11 до 15, полуоткрытый метод (программированная санационная релапаротомия) обладает наибольшей эффективностью. Применение 2-3 этапных санаций брюшной полости у этих больных не приводит к критическому ухудшению состояния, что и определяет довольно высокую его эффективность (снижение летальности до 11,5%).
При значении ДОБ APACHE II более 15, эффективность метода программированной санационной релапаротомии не имеет достоверного преимущества перед традиционным полузакрытым способом. По данным авторов при ДОБ APACHE II более 25, наблюдается 100% летальность, независимо от метода хирургической тактики.
Прогностические критерии оценки тяжести состояния больных и прогноза исхода абдоминального сепсиса при помощи интегральной шкалы APACHE II позволила авторам выявить статически значимое различие между выжившими и умершими пациентами в среднем для каждой системы органов и суммарного числа баллов. Авторы декларируют, что критерии тяжести течения абдоминального сепсиса и количественные маркеры ПОН коррелируют как с дооперационными показателями шкалы APACHE II и МИП, так и с результатами лечения.
На основании анализа собственных клинических наблюдений, авторы считают, что использование систем APACHE II и МИП для оценки тяжести состояния больных с АС при более масштабном исследовании может способствовать выработке конкретных рекомендаций и алгоритмов для определения адекватной тактики хирургического лечения и более точного прогнозирования исхода заболевания.
В дальнейшем W. Knaus и соавт. Система АРАСНЕ II была трансформирована в систему APACHE III, которая включала в себя критерии оценки состояния больных из 5 основных групп: а) возраст; б) хронические заболевания; в) физиологические показатели; г) показатели кислотно-основного состояния и газового состава крови; д) неврологический статус (ЦНС). Итоговый балл тяжести определяется из суммы баллов по 5 перечисленным выше группам.
На материале обследования 571 больного с РГП, осложненным АС, В.М. Бенсман и соавт. выявили прямую корреляцию между балльной оценкой по шкале APACHE III и исходом лечения больных. Авторами установлено, что при АС оценка тяжести общего состояния выше 118 баллов по шкале APACHE III оказалась прогностически неблагоприятной. Кроме того, у выздоровевших больных доверительный интервал составил от 96,0 до 87,2 балла. По данным авторов несовпадение доверительных интервалов балльных оценок умерших и выздоровевших пациентов (р<0,001) свидетельствует о достоверной практической значимости данной шкалы APACHE III для математического моделирования.
Однако несмотря на то, что система APACHE II является достаточно достоверной и прогностически значимой для практического использования (особенно для оценки вероятности летального исхода), из-за невозможности определения степени тяжести отдельной органно-системной дисфункции или полиорганной недостаточности, шкала имеет некоторые ограничения для ее повсеместного широкого использования. С другой стороны, по мнению ряда авторов, принципы разбивки параметров по числовым значениям (баллам) носят субъективный характер, что в значительной мере снижает информативность данной шкалы.
Le Gall и соавт. выделены из системы APACHE II наиболее достоверные критерии и разработана шкала SAPS (Simplifed Acute Physiology Score), которая построена на тех же принципах оценки параметров, что и система APACHE и позволяет прогнозировать исхода течения абдоминального сепсиса. По данным авторов, сумма максимальных значений баллов достаточно достоверно коррелирует с исходом лечения абдоминального сепсиса.
Шкала SAPS в дальнейшем была модернизирована этими же авторами и получила новое название LOG и основана на многофакторном анализе большого числа параметров, отражающих диапазоны баллов для оценки тяжести состояния больных. Количество полученных баллов менее 10 по системе SAPS указывает на легкое течение абдоминального сепсиса. Сумма баллов 10 и более соответствует тяжелому состоянию больного.
На основании клинической характеристики абдоминального сепсиса в зависимости от тяжести ССВР с использованием шкалы SAPS у 98 больных, Б.М.Белик констатировал, что тяжелый сепсис (сепсис с признаками органно-системной дисфункции) имелся у 36,7%, септический шок – у 18,4% (сепсис со стойкой гипотензией, требовавшей на фоне адекватной коррекции гиповолемии, использования катехоламинов). Автором установлено, что при наличии 3 из 4 симптомов ССВР, сепсис-SIRS констатирован у 6,1%, при присутствии 4 симптомов сепсис-SIRS отмечен у 38,8%. По данным автора, тяжесть состояния больных по шкале SAPS составила при сепсисе SIRS с наличием 3 симптомов 5,6 ± 1,3 баллов. При этом послеоперационная летальность составила 16,7%. При наличии 4 симптомов ССВР и сумме баллов по шкале SAPS 9,1 ± 1,4, послеоперационная летальность составила 31,6%.
При тяжелом сепсисе и сумме баллов 13,5 ± 1,7 по шкале SAPS, послеоперационная летальность была 38,9%. При септическом шоке и сумме баллов 17,8 ± 1,5 по шкале SAPS, послеоперационная летальность достигла 66,7%. Общая послеоперационная летальность при АС с использованием шкалы оценки тяжести течения по критериям SAPS, составила 39,8%.
На основе клинической характеристики абдоминального сепсиса в зависимости от тяжести ССВР, автором установлено, что использование шкалы SAPS в оценке тяжести состояния больных позволяет дать четкую клиническую стратификацию абдоминального сепсиса, объективно прогнозировать течение интраабдоминальнош гнойно-воспалительного процесса, а также оптимизировать лечебную тактику.
В 1993 г. J.-R. Le Gall и соавт. усовершенствовали систему SAPS, которая получила название SAPS II. Обновленная версия системы SAPS II была основана на мультифакторном анализе 37 параметров 129 997 пациентов отделения реанимации и интенсивной терапии и 137 стационарах 10 европейских и 2 североамериканских стран. По мнению ряда авторов, совокупную оценку тяжести состояния больных с АС целесообразно определять по шкале APACHE II или SAPS. Прогностический эффект использования интегральных критериев шкал APACHE II или SAPS в качестве независимых предикторов неблагоприятного прогноза исхода абдоминального сепсиса подтверждается исследованиями и других авторов.
Использование шкалы SAPS для оценки тяжести состояния больных 330 больных с РГП, осложненным АС позволило Н.Н. Хачатряну и соавт. выбрать режим рациональной антибактериальной терапии. Авторами выявлено, что при SAPS до 12 баллов клиническая эффективность антибактериальной терапии не отличается в группах, получавших карбапенемы и другие комбинации антибактериальной терапии. В группах же больных, имевших более 12 баллов по шкале SAPS, наблюдались существенные различия в продолжительности стационарного лечения, частоте послеоперационных осложнений и летальности.
Авторы считают, что назначение антибиотиков из группы карбапенемов в качестве стартовой антибиотикотерапии наиболее оправдано у больных с тяжелыми формами РГП, осложненного АС по шкале SAPS более 12 баллов. При значении баллов до 12 по шкале SAPS, использование антибиотиков из группы карбапенемов нецелесообразно в связи с высокой стоимостью лечения и риском развития мультирезистентных штаммов микроорганизмов.
Анализируя результаты лечения 690 больных с РГП, Ю.В. Стручковым и И.В. Горбачевой установлены, что состояние 86 (12,5%) больных с АС оставалось тяжелым, без положительной динамики, что по шкале SAPS соответствовало 15-20 баллам.
Использование шкальной системы APACHE II для объективизации тяжести состояния больных и прогноза абдоминального сепсиса, позволило В.М. Седову и соавт. выявить, что сумма баллов ниже 12 по APACHE II соответствует состоянию средней тяжести, выше 20 баллов – критическому состоянию.
По данным Е.В. Григорьева и соавт. показатель по шкале APACHE II21 ± 5 баллов, соответствует вероятности летального исхода 40%, значение баллов 34 ± 5 по шкале APACHE II соответствует вероятности летального исхода 70-80%.
Т.В. Семеновой и соавт. изучены диагностическая информативность показателя системного эндотоксикоза по динамике уровня молекул средней массы плазмы крови (МСМп) и прогностическая возможность интегральной системы SAPS в оценке тяжести состояния 167 больных с РГП, осложненным АС. Установлено, что более низкие значения уровня МСМп у больных с тяжестью состояния 0-4 балла по шкале SAPS, соответствовало наилучшему прогнозу заболевания. По данным авторов, у больных с показателями шкалы SAPS 5-12 баллов, большое значение для прогноза имела динамическая оценка уровня МСМп. Наиболее неблагоприятный исход заболевания при относительно невысоком уровне МСМп соответствовал группе больных с тяжестью состояния более 12 баллов по шкале SAPS. Авторы считают, что использование интегральной системы SAPS для оценки тяжести состояния больных с АС позволяет объективно оценить степень системного эндотоксикоза и прогнозировать вероятность развития гнойно-септических осложнений и исхода абдоминального сепсиса.
Проведя оценку тяжести течения абдоминального сепсиса и прогноза вероятности летального исхода у 30 больных с использованием системы SAPS, Д.В. Черданцев и соавт. отметили, что показатели шкалы SAPS, превышающие 6 баллов зарегистрированы у 60% больных, что соответствовало относительно благоприятному течению заболевания.
В 1987 г. группой немецких хирургов (г. Мангейм) во главе M. Linder разработан индекс прогнозирования исхода РГП, который первоначально включал 15 параметров. Предложенный индекс впоследствии получил название Мангеймского перитонеального индекса (МПИ) Manheimer Peritonitis Index – (MPI).
В дальнейшем данный индекс был усовершенствован и включал 8 факторов риска: возраст (старше 50 лет), пол (женский), органная недостаточность, злокачественное новообразование, продолжительность перитонита до операции 24 ч, источник перитонита (толстая кишка), распространенный характер гнойного поражения брюшины, характер экссудата (гнойный, серозный, калово-гнойный).
При ранжировании больных по степени тяжести РГП учитывается сумма баллов. Так, при значении МПИ менее 20 баллов (легкая степень тяжести) летальность составляет 0%, от 20 до 30 баллов (степень средней тяжести) – 29%, более 30 баллов (тяжелая степень тяжести) – 100%.
Сопоставление разных прогностических интегральных шкал применительно к больным с РГП, осложненным АС, проведенное в крупных хирургических клиниках ряда европейских стран (Германия, Австрия), показало, что разработанная M. Linder и соавт. МПИ, как надежная шкала, получила международное признание, благодаря высокой чувствительности и точности в оценке тяжести течения и прогноза исхода абдоминального сепсиса.
Анализируя результаты лечения РГП, осложненного АС на основании интегральной оценки тяжести течения и прогноза исхода с учетом расчетов индексов шкальных (балльных) систем SAPS и МПИ, Л.А. Лаберко и соавт. выявили, что тяжесть 0-4 балла по шкале SAPS соответствует практически абсолютный благоприятный прогноз заболевания. При тяжести состояния 16 и более баллов, прогноз заболевания наиболее неблагоприятен, т.к. летальность составляет 85%.
В свою очередь, в группах больных с исходной тяжестью состояния от 5 до 15 баллов по шкале МПИ, можно прогнозировать как благоприятный, так и неблагоприятный исход заболевания. Авторами также установлено, что при значениях шкалы МПИ менее 20 баллов, летальность составила 2,9%. В группе больных со значениями шкалы МПИ от 20 до 30 баллов летальность составила 22,4%, а при показателях шкалы МПИ более 30 баллов летальность достигла 89,5%.
Прогностический эффект МПИ в обследованной группе составил 94,8%, что относится преимущественно к группам тяжести состояния, соответствующим значениям МПИ до 20 и выше 29 баллов. Авторы считают, что основным недостатком данной шкалы интегральной оценки является отсутствие четких критериев индивидуального прогноза заболевания у больных со значениями МПИ от 20 до 30 баллов, включающей 45,5% всех анализируемых больных, у которых летальность в группе составила 29%.
По данным В.К. Гостищева и соавт., проводившим прогностической оценки тяжести состояния 37 больных РГП, осложненным АС с использованием шкалы МПИ и SAPS II, предельно высокий уровень баллов по шкале МПИ составил 25-40, по шкале SAPS II 40,8 ± 3,5, что соответствовало крайней степени тяжести состояния больных.
Б.С. Суковатых и соавт. проведя количественную характеристику показаний для выбора способа хирургического лечения РГП на основе современной интегральной системы оценки тяжести состояния больных и выраженности абдоминального сепсиса, выявили, что новая концепция о тяжелых формах РГП, сопровождающихся органно-системными дисфункциями, требует пересмотра подходов в определении хирургической тактики, основанной на количественных показателях тяжести состояния, выраженности РГП и абдоминального сепсиса.
На опыте лечения 245 больных с РГП, осложненным АС, авторами выявлено, что больным с АС без или с моноорганной дисфункцией, при ДОБ шкалы APACHE II от 12 до 15 и шкалы МПИ – от 20 до 29 баллов, показаны программированные видеолапароскопичсскис санации, которые выполнены 68 больным. Больным с тяжелым АС с ПОН при ДОБ по шкале APACHE II свыше 15 и по шкале МПИ – от 30 баллов и выше, показан полуоткрытый способ лечения с многоэтапными санациями брюшной полости (программированные релапаротомии), который применен 46 больным.
Авторы считают, что традиционный полузакрытый способ лечения целесообразно применять больным с РГП без проявления абдоминального сепсиса, с параметрами тяжести состояния по шкале APACHE II до 12 баллов, по выраженности МПИ – до 20 баллов.
На основе опыта лечения РГП, осложненного АС у 288 больных, И.С. Малковым и соавт. установлено, что использование шкалы МПИ, как наиболее доступной в клинической практике, позволяет объективно оценить тяжесть состояния больных и оптимизировать лечебную тактику. По данным авторов, при значении баллов по шкале МПИ 0-15, состояние больных соответствует легкому течению АС, при МПИ от 16 до 29 – средней тяжести, при МПИ более 29 баллов – тяжелому течению.
Авторами установлено, что при значениях МПИ от 16 до 29 баллов лапароскопическая санация брюшной полости является наиболее эффективным методом лечения РГП, осложненного АС. По данным авторов, разработанная тактика хирургического лечения РГП, осложненного АС, с учетом объективной оценки тяжести течения заболевания по шкале МПИ, позволила снизить летальность до 11,8%. По данным А.А. Андреева и соавт. при МПИ более 13 баллов, показана этапная программируемая релапаротомия.
В 1995 г. Masrshall и соавт. опубликовали систему оценки полиорганной дисфункции – MODS (Multiple Orqan disfunction Score), включавшую параметры нарушений 6 основных органов (систем): центральной нервной, сердечно-сосудистой, дыхательной систем, почек, печени и системы гемокоагуляции. Авторы подчеркнули, что система MODS разработана для оценки прогноза течения абдоминального сепсиса с ПОН. При этом каждой системе органов было присвоено значение от 0 до 40 балла.
Авторами выявлено, что и количество, и тяжесть органной дисфункции (недостаточности) в любой момент измерения параметров достоверно коррелируют с вероятностью летального исхода. Летальность составляет при значении MODS 1-4 балла – 1%, при 5-8 баллов – 3%, при 9-12 баллов – 25%, при 13-16 баллов – 50%, при 17-20 баллов – 75%. При значении шкалы MODS более 20 баллов летальность составляет 100%.
При оценке прогноза путем использования модели логистической регрессии выявлено, что увеличивающееся в динамике количество баллов по шкале MODS имеет большое прогностическое значение, чем число баллов по шкале MODS при поступлении больных в отделении реанимации и интенсивной терапии.
Проведя клиническую характеристику абдоминального сепсиса у больных РГП с использованием прогностических шкал APACHE II, SAPS, SOFA, MODS, Е.Б.Гельфанд и соавт. выявили, что при наличии 3 симптомов ССВР, тяжесть состояния больных была 9,3 ± 3,3 балла по шкале АРАСНЕ II и 5,4 ±1,5 балла по шкале SAPS. При этом выраженность ПОН составила 4,3 ± 0,4 балла по шкале MODS и 3,4 ± 0,6 балла по шкале SOFA. Авторами отмечено, что нарастание симптоматики ССВР отражается увеличением индексов тяжести состояния и органно-системных дисфункций.
Установлено, что при наличии 4 симптомов ССВР (полная клиническая манифестация сепсиса) тяжесть состояния больных по шкале APACHE II составила 13,6 ± 2,8 балла, по шкале SAPS 8,9 ±1,7 балла, с индексами ПОН более 6 баллов при оценке по шкале MODS и SOFA. На основании собственного опыта, авторы считают, что объективные интегральные системы APACHE II и SAPS позволяют оценить выраженность ССВР (SIRS) и тяжесть состояния больных с АС. Использование шкал MODS и SOFA приемлемо для определения степени тяжести ПОН.
Существенных различий в распределении больных по тяжести ПОН в зависимости от прогностических эффектов шкал MODS или SOFA авторы не выявили. По данным авторов, по сравнению с SAPS, шкала APACHE II отличается более высокой информативностью. Шкала оценки органно-системной дисфункции SOFA клинически значима и более проста для использования, чем шкала MODS.
Таким образом, проведенные данные обширной литературы свидетельствуют о методологической обоснованности и целесообразности использования шкальных систем (балльной) оценки тяжести состояния больных с АС, которые позволяют стратифицировать разнородные группы пациентов, оценить эффективность проводимого лечения, определить степень органно-системных дисфункций и прогнозировать вероятный исход заболевания.
Однако отсутствие дискриминационной способности в отношении индивидуального прогнозирования, делают шкалы неприглядными для определения прогноза исхода заболевания у отдельного больного, потому и не могут служить в качестве рутинной основы для принятия решения в конкретной клинической ситуации. Все это может быть достаточно веским аргументов и побудительным мотивом для проведения дальнейших исследований по разработке более совершенных и точных прогностических критериев для оценки тяжести течения и исхода абдоминального сепсиса.
С.А.Алиев, Э. С.Алиев, М.Г.Махмудов, А.Э.Намазов
Прогностическая ценность шкал в определении летальности у пациентов с различным уровнем постоянного потенциала при острой толстокишечной непроходимости | Стаканов
1. Moreno R., Matos R.
2. Гелъфанд Б. Р.Объективная оценка тяжести состояния и прогноза у больных с перитонитом В кн.: Гельфанд Б. Р., Руднов В. А., Ярошец-кий А. И. и соавт. Перитонит (практическое руководство). М.: Лит-тера; 2006. 60—74.
3. Knaus W. A., Wagner D. P., Draper E. A. et al.The APACHE-III prognostic system. Risk prediction of hospital mortality for critically ill hospitalized adults. Chest 1991; 100 (6): 1619—1636.
4. Le Gall J. R., Lemeshow S., Saulnier F.A new Simplified Acute Physiology Score (SAPS-II) based on a European/North American multicenter study. JAMA 1993; 270 (24): 2957—2963.
5. Lewandowski K., Lewandowski M.Scoring-Systeme auf der intensiv therapie station. Anesthesist 2003; 52 (10): 965—987.
6. Crea N., Di Fabio F., Pata G., Nascimbeni R.APACHE II, POSSUM and ASA scores and the risk of perioperative complications in patients with colorectal desease. Ann. Ital. Chir. 2009; 80 (3): 177—181.
7. Аладжалова Н. А.Медленные электрические процессы в головном мозге. М.: изд-во АН СССР; 1962. 240.
8. Бехтерева Н. П.Здоровый и больной мозг человека. Л.: Наука; 198 262.
9. Илюхина В. А.Нейрофизиология функциональных состояний человека. Л.: Наука; 1986. 171.
10. Фокин В. Ф., Пономарева Н. В., Секирина Т. П. и соавт.Взаимосвязи между деятельностью головного мозга и иммунной системой у человека. Физиология человека 1995; 21 (2): 15—23.
11. Илюхина В. А.Сверхмедленные процессы мозга человека. Физиология человека 1981; 6 (5): 512—528.
12. Илюхина В. А.Теоретические предпосылки к расширению использования сверхмедленных физиологических процессов в патофизиологии и клинике. Кубанский научн. мед. вестник 1997; 1—3: 3—
13. Mies G., Paschen W.Regional changes of blood flow, glucose, and ATP content determined on brain sections during a single passage of spreading depression in rat brain cortex. Exp. Neurol. 1984; 84 (2): 249—258.
14. Nedergaard M., Astrup J.Infarct rim: effect of hyperglycemia on direct current potential and [14C]2—deoxyglucose phosphorylation. J. Cereb. Blood Flow Metab. 1986; 6 (5): 607—615.
15. Lauritzen M., Hansen A. J., Kronborg D., Wieloch T.Cortical spreading depression is associated with arachidonic acid accumulation and preservation of energy charge. J. Cereb. Blood Flow Metab. 1990; 10 (1): 115—122.
16. Hansen A. J., Olsen C. E.Brain extracellular space during spreading depression and ischemia. Acta Physiol. Scand. 1980; 108 (4): 355—365.
17. Vanhatalo S., Tallgren P., Becker C. et al.Scalp-recorded slow EEG responses generated in response to hemodynamic changes in the human brain. Clin. Neurophysiol. 2003; 114 (9): 1744—1754.
18. De Crespigny A., Rother J., van Bruggen N. et al.Magnetic resonance imaging assessment of cerebral hemodynamics during spreading depression in rats. J. Cereb. Blood Flow Metab. 1998; 18 (9): 1008—1017.
19. Harris N. G., Zilkha E., Houseman J. et al.The relationship between the apparent diffusion coefficient measured by magnetic resonance imaging, anoxic depolarization, and glutamate efflux during experimental cerebral ischemia. J. Cereb. Blood Flow Metab. 2000; 20 (1): 28—36.
20. Голубцов В. В., Заболотских И. Б., Оноприев В. И.Оценка тяжести органной дисфункции раннего периода постгеморрагических и септических состояний. Кубанский научн. мед. вестник 2004; 4: 47—49.
21. Заболотских И. Б., Арзуманян В. М., Клевко В. А.Эффективность шкал оценки тяжести состояния и сверхмедленные биопотенциалы в прогнозе летальности у гастроэнтерологических больных. Модернизация шкал с учетом сверхмедленных биопотенциалов. Вестн. интенс. терапии. 2006; 5: 272—281.
22. Заболотских И. Б., Голубцов В. В.Развитие полиорганной дисфункции при сепсисе. Анестезиология и реаниматология 2006; 6: 20—23.
23. Ямполъский А. Ф., Еремеева Л. Ф.Гемодиафильтрация и гемофиль-трация в интенсивной терапии абдоминального сепсиса. Вестн. ин-тенс. терапии 1998; 4: 66—70.
24. Hanley J. A., McNeil B. J.The meaning and use of the area under a receiver operating characteristic (ROC) curve. Radiology. 1982; 143 (1): 29—36.
25. Белобородова Н. В., Бачинская Е. Н.Иммунологические аспекты послеоперационного сепсиса. Анестезиология и реаниматология 2000; 1: 59—66.
26. Сизов Д. Н., Костюченко А. Л., Белъских А. Н.Синдром последовательных органных повреждений у пациентов в критических состояниях. Анестезиология и реаниматология 1998; 2: 22—25.
27. Мороз В. В., Добрушина О. Р., Стрелъникова Е. П. и соавт.Предикторы кардиальных осложнений операций на органах брюшной полости и малого таза у больных пожилого и старческого возраста. Общая реаниматология 2011; VII (5): 28—33.
28. Дементъева И. И.Клинические аспекты состояния и регуляции кислотно-основного гомеостаза. М.: ЮНИМЕД-пресс; 2002. 80.
29. Любошевский П. А., Забусов А. В.Влияние регионарной анестезии на метаболические и воспалительные изменения при абдоминальных операциях. Общая реаниматология 2011; VII (2): 31—34.
30. Valenti V., Hernandez-Lizoain J. L., Baixauli J. et al.Analysis of POSSUM score and postoperative morbidity in patients with rectal cancer undergoing surgery. Langenbecks Arch. Surg. 2009; 394 (1): 55—63.
31. Заболотских И. Б., Илюхина В. А.Типология спонтанной и вызванной динамики сверхмедленных физиологических процессов, регистрируемых с поверхности головы и тела здорового и больного человека. Кубанский научн. мед. вестник 1997; 1—3: 12—26.
32. Заболотских И. Б.Интегрирующая роль сверхмедленных физиологических процессов в механизмах внутри- и межсистемных взаимоотношений в норме и патологии. Кубанский научн. мед. вестник 1997; 1—3: 26—29.
Сравнение эффективности существующих прогностических моделей для оценки тяжести состояния реанимационных больных хирургического профиля + «
Автореферат диссертации по теме «Сравнение эффективности существующих прогностических моделей для оценки тяжести состояния реанимационных больных хирургического профиля»
На правах рукописи
ПОТАНИНА ОЛЬГА КЛИМЕНТОВНА
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ СУЩЕСТВУЮЩИХ ПРОГНОСТИЧЕСКИХ МОДЕЛЕЙ ДЛЯ ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ РЕАНИМАЦИОННЫХ БОЛЬНЫХ ХИРУРГИЧЕСКОГО ПРОФИЛЯ
03.01.09 — Математическая биология, биоинформатика 14.01.20 — Анестезиология и реаниматология
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
3 МАЙ 2012
Москва — 2012
005016505
Работа выполнена в Государственном бюджетном образовательного учреждении высшего профессионального образования «Российски? национальный исследовательский медицинский университет имени Н.И Пирогова Минздравсоцразвития России» и в Государственном бюджетное учреждении здравоохранения города Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского Департаменте здравоохранения города Москвы».
Научные руководители:
доктор медицинских наук, профессор
доктор медицинских наук, профессор
Официальные оппоненты:
Доктор медицинских наук, профессор, заместитель директора ИМИСС МГУ им. М.В.Ломоносова
Зарубина Т.В. Дорфман А.Г.
Соколов Михаил Эдуардович
Доктор медицинских наук, профессор, Петриков Сергей Сергеевич
заместитель директора государственного
бюджетного учреждения здравоохранения
города Москвы «Научно-исследовательского
института скорой помощи им. Н.В. Склифосовского
Департамента здравоохранения города Москвы».
Ведущая организация:
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Юго-Западный государственный университет» (г.Курск)
Защита состоится «04» июня 2012 года в 14:00 часов на заседании диссертационного совета Д 208.072.09 при ГБОУ ВПО РНИМУ им. Н.И.Пирогова по адресу: 117997, г. Москва, ул. Островитянова, д. 1.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздравсоцразвития России по адресу: 117997, г. Москва, ул. Островитянова, д. 1
Автореферат разослан «……….» апреля 2012 года
Ученый секретарь диссертационного совета доктор медицинских наук, профессор
Л.В. Губский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность исследования
Оценка тяжести состояния пациента — принципиально важный момент в работе любого врача, особенно — анестезиологов-реаниматологов, в профессиональной деятельности которого правильная своевременная оценка состояния определяет исход заболевания пациента, находящегося в критическом состоянии.
В клинической практике для определения тяжести состояния больного используется два подхода: традиционная субъективная оценка, основанная на профессиональном опыте врача, и объективизированная оценка, полученная при помощи прогностических шкал. В настоящее время объективизированная оценка тяжести состояния пациентов прочно вошла в повседневную практику врачей отделения реанимации и интенсивной терапии (ОРИТ). Современные прогностические шкалы позволяют рассчитывать вероятность наступления летального исхода, ориентировочные сроки пребывания пациента в ОРИТ, вероятность развития различных осложнений и некоторые другие параметры. Прогностические шкалы используются для оценки эффективности работы ОРИТ, при сравнении качества лечения пациентов в ОРИТ различных стационаров, анализе эффективности и экономического обоснования целесообразности того или иного метода терапии, рандомизации групп пациентов для получения достоверных сопоставимых данных, используемых в научных исследованиях [Александрович Ю.С. соавт. 2010, Гельфанд Б.Р., соавт.2004, Светухин A.M. соавт. 2002].
В настоящее время разработано несколько десятков прогностических шкал как нозонеспецифичных, так и предназначенных для отдельных категорий реанимационных больных, которые существенно отличаются друг от друга количеством и набором клинических, инструментальных и лабораторных параметров, необходимых для расчета.
Часть существующих прогностических шкал получили широкое распространение и в течение нескольких десятилетий активно используются в
ОРИТ по всему миру. В то же время, многочисленные зарубежные исследования, посвященные сравнению эффективности прогностических шкал, демонстрируют противоречивые результаты. Это объясняется неодинаковым качеством медицинской помощи в разных странах, медицинских учреждениях и ОРИТ, изменением предсказательной мощности прогностических параметров со временем и рядом других причин. Работы отечественных авторов на эту тему немногочисленны и не позволяют обосновать правильный выбор прогностических шкал для применения в условиях ОРИТ стационаров России.
Цель исследования
Сравнение прогностической точности существующих шкал для оценки тяжести состояния реанимационных больных хирургического профиля и выбор шкал для применения в условиях стационаров Российской Федерации.
Для достижения поставленной цели необходимо было решить следующие задачи:
1. Изучить результаты совместного использования прогностических шкал оценки тяжести состояния в общемировой реанимационной клинической практике.
2. Разработать алгоритмическое и информационное обеспечение для расчета наиболее широко используемых нозонеспецифичных шкал оценки тяжести состояния реанимационных больных: APACHE II, APACHE IV, SAPS II, МРМ II О, POSSUM в информационной системе отделения реанимации и интенсивной терапии.
3. Сравнить калибрационную и дискриминационную способность прогностических шкал APACHE II, APACHE IV, SAPS II, МРМ II О, POSSUM на данных проспективно набранной группы реанимационных больных хирургического профиля и в различных нозологических группах.
4. Оценить прогностическую точность результатов прогнозирования вероятности развития послеоперационных осложнений, рассчитанную при
помощи шкалы POSSUM, и продолжительности пребывания пациента в отделении реанимации и интенсивной терапии, оцененную при помощи шкалы APACHE IV.
Научная новизна
Впервые в Российской Федерации на основе проспективно полученных данных проведено сравнение точности пяти прогностических шкал (APACHE II, APACHE IV, SAPS И, МРМ II О, POSSUM) при оценке тяжести состояния реанимационных больных хирургического профиля.
Проведен комплексный статистический анализ калибрационной и дискриминационной способности прогностических шкал с использованием критерия согласия Хосмера-Лемешоу, метода построения калибровочных кривых и анализа характеристических кривых (ROC-анализа), позволивший определить шкалы, пригодные к использованию в Российской Федерации для оценки тяжести состояния реанимационных больных хирургического профиля.
Практическая значимость
Реализация алгоритмов расчета прогностических шкал в информационной системе отделения реанимации и интенсивной терапии «ИНТЕРИС» упростила процедуру расчета и обеспечила высокое качество полученных результатов, что способствует более широкому использованию прогностических инструментов в повседневной клинической практике ОРИТ.
Результаты проведенного исследования позволяют рекомендовать к использованию в клинической практике ОРИТ стационаров Российской Федерации для оценки степени тяжести состояния больных хирургического профиля прогностические шкалы SAPS II и МРМ II 0.
Для оценки тяжести состояния больных с желудочно-кишечным кровотечением и тяжелой сочетанной травмой, кроме SAPS II и МРМ II 0, рекомендовано также использование шкалы APACHE II; для группы
пациентов с тромбозами и эмболиями различной локализации — APACHE II, APACHE IV, POSSUM.
Положения, выносимые на защиту
1. Для оценки тяжести состояния и прогноза исхода заболевания у пациентов хирургических ОРИТ в российских стационарах целесообразно использовать нозонеспецифичные прогностические шкалы SAPS II и МРМ II 0.
2. Модуль расчета прогностических шкал в информационной системе отделения реанимации и интенсивной терапии «ИНТЕРИС» позволяет объективизировать оценку тяжести состояния реанимационных больных хирургического профиля.
3. Нозонеспецифичные шкалы APACHE II, APACHE IV, SAPS II, МРМ II 0, POSSUM можно использовать для оценки тяжести состояния в различных нозологических группах больных хирургического профиля, за исключением пациентов с аневризмой аорты.
Внедрение результатов исследования
Алгоритмы расчета прогностических шкал реализованы в информационной системе отделения реанимации и интенсивной терапии «ИНТЕРИС», которая используется в повседневной практике работы отделения реанимации и интенсивной терапии для хирургических больных НИИ СП им. Н.В. Склифосовского и отделения анестезиологии и реанимации ФГБУ Российского научного центра рентгенорадиологии.
Апробация работы
Результаты диссертационного исследования доложены на научных семинаре кафедры медицинской кибернетики и информатики и ПНИЛ разработки медицинских информационных систем ГБОУ ВПО РНИМУ им. Н.И.Пирогова 22 июня 2011 г. и на совместном заседании кафедры
медицинской кибернетики и информатики ГБОУ ВПО РНИМУ им. Н.И.Пирогова и сотрудников НИИ СП им. Н.В.Склифосовского 25 января 2012 г.
Публикации
По материалам диссертации опубликовано 4 печатные работы, в том числе 3 статьи в журнале, входящем в перечень ВАК.
Объём и структура работы
Диссертационная работа состоит из введения, глав обзора литературы, описания материалов и методов исследования, результатов исследования и их обсуждения, заключения, выводов, практических рекомендаций и списка литературы. Материалы диссертации изложены на 151 странице, иллюстрированы 32 рисунками, 23 таблицами в тексте и 1 таблицей в приложении. Список литературы включает 176 источников, из них 28 работ отечественных и 148 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность темы, сформулированы цель и задачи исследования, научная новизна и практическая значимость работы.
В первой главе представлен обзор литературы. Глава содержит детальное описание широко распространенных во всем мире шкал оценки тяжести состояния реанимационных пациентов, в том числе, универсальных нозонеспецифичных моделей, разработанных для оценки тяжести состояния пациентов с любой патологией, а также специализированных нозоспецифичных систем, которые используются при определенных заболеваниях.
Значительная часть обзора литературы посвящена анализу прогностической точности шкал оценки тяжести состояния пациентов ОРИТ. Особое внимание посвящено работам, в которых проводилось сравнение
эффективности широко известных и хорошо себя зарекомендовавших шкал APACHE И, APACHE IV, SAPS П, МРМ II О, POSSUM. Детально рассмотрены статистические методы, используемые для анализа прогностической точности шкал. Описаны тест согласия Хосмера-Лемешоу для оценки калибрационной способности, метод анализа характеристических кривых (ROC-анализ) для оценки дискриминационной способности, а также различные методы поиска оптимального порога отсечения для условного разделения пациентов, поступающих в ОРИТ, на пациентов с потенциально благоприятным и потенциально неблагоприятным исходом заболевания.
Во второй главе содержится характеристика материалов и методов, использованных в работе.
Исследование носило проспективный характер и проводилось в период с июля 2009 по сентябрь 2010 года на базе отделения реанимации и интенсивной терапии для послеоперационных больных НИИ СП им Н.В. Склифосовского
В исследование было включено 300 пациентов, проходивших лечение в ОРИТ. Критерии включения в выборку: пациенты с общей хирургической патологией в возрасте старше 18 лет. Критерии исключения из выборки: пациенты с ожогами и кардиохирургические пациенты, нахождение в реанимации менее 4-х часов, повторное поступление в отделение реанимации, перевод пациента в другой стационар.
Средний возраст пациентов составил 56,3 (20,0) лет. Доля мужчин составляла 62,0% (186 человек), доля женщин — 38,0% (114 человек). Из общего числа пациентов 170 пациентов (56,7%) перенесли хирургическое вмешательство, 130 пациентам (43,3%) проводилась интенсивная консервативная терапия.
Из 300 анализируемых пациентов умерло 58 человек (19,3%). Среди пациентов, перенесших хирургическое вмешательство, скончалось 18 человек (10,6%). Среди пациентов, получавших консервативное лечение, доля умерших составила 30,8% (40 человек). Средняя длительность
пребывания в ОРИТ составила 2,9 ± 0,2 койко-дней (медиана = 2 койко-дня). В группе пациентов, перенесших хирургическое вмешательство, осложнения наблюдались у 51 пациента (30,0%), гладкое течение послеоперационного периода отмечено соответственно у 119 оперированных пациентов (70,0%).
По нозологическим группам пациенты распределились следующим образом: травмы различной локализации — 74 пациента, желудочно-кишечные кровотечения — 39 пациентов, аневризма брюшного и/или грудного отделов аорты — 36 пациентов, тромбозы или эмболии сосудов различной локализации, включая массивную тромбоэмболию легочной артерии, — 34 пациента (Таблица 1).
Таблица 1. Характеристика нозологических групп заболеваний пациентов, послуживших причинами их госпитализации в ОРИТ__
Нозологические группы Всего пациентов Летальность в группе Количество осложнений
Кол-во % Кол-во % Кол-во %
Тяжелые сочетанные травмы 74 24,7 4 5,4 22 29,7
Желудочно-кишечные кровотечения 39 13,0 8 20,5 10 25,6
Аневризмы брюшного и/или грудного отделов аорты 36 12,0 22 61,1 10 27,8
Тромбозы или эмболии артерий или вен различной локализации 34 11,3 5 14,7 6 17,7
Прочие 117 39,0 19 16,2 27 23,1
Для каждого поступившего в ОРИТ пациента, подходящего под критерии включения и исключения за время данного проспективного исследования, производился однократный расчет прогностических шкал APACHE И, APACHE IV, SAPS II, МРМ II 0. Шкала POSSUM, включающая интраоперационные данные, вычислялась у пациентов, поступивших в ОРИТ после хирургических вмешательств. Сбор клинических, лабораторных и инструментальных данных, необходимых для расчета прогностических шкал, производился из историй болезни в течение 24 часов после поступления пациента в ОРИТ в полном соответствии с требованиями разработчиков. Обязательным условием расчета всех шкал было наличие полного набора
9
входных параметров, которое было соблюдено для всех 300 пациентов. В результате расчета всех прогностических шкал вычислялась вероятность летального исхода. При расчете шкалы POSSUM дополнительно вычислялась вероятность развития послеоперационных осложнений, а при расчете шкалы APACHE IV — ориентировочная длительность пребывания пациента в ОРИТ. После завершения лечения регистрировались исход заболевания (пациент умер или выписан из стационара), длительность пребывания пациента в ОРИТ, повторные поступления пациента в ОРИТ, а также послеоперационные осложнения у пациентов, перенесших хирургическое вмешательство.
Расчет шкал проводился с использованием специализированного прогностического модуля информационной системы отделения реанимации и интенсивной терапии «ИНТЕРИС». Алгоритмы расчета моделей прогностических шкал были реализованы нами на языке Visual Basic for Application в СУБД Microsoft Access. Для статистического анализа использовалась свободная программная среда для статистического анализа и графического представления данных на основе вычислений с открытым исходным кодом R, version 2.12.1.
В третьей главе представлены результаты исследования и их обсуждение. На первом этапе исследования авторские алгоритмы разработчиков прогностических шкал APACHE II, APACHE IV, SAPS II, MPM II 0, POSSUM были реализованы в специализированном программном модуле информационной системы отделения реанимации и интенсивной терапии «ИНТЕРИС». Последующая отладка и тестирование программного обеспечения гарантировали надежность получаемых результатов. Врачи реаниматологи получили возможность осуществлять расчет прогностических шкал на своем рабочем месте на основе клинико-лабораторных данных пациентов (Рисунок 1).
Рисунок 1. Форма для расчета шкалы SAPS II в информационной системе «ИНТЕРИС». Параметры для расчета автоматически загружаются из базы данных или вводятся с клавиатуры.
Анализ прогностической точности моделей оценки тяжести состояния реанимационных больных хирургического профиля включал проверку капибрационной и дискриминационной способности. Калибрационная способность оценивалась визуально с помощью графического сопоставления прогнозируемой и наблюдаемой летальности в различных вероятностных группах, а также количественно с использованием теста Хосмера-Лемешоу.
Для графической оценки калибрационной способности шкал были построены кривые прогнозируемой (ожидаемой) и наблюдаемой летальности в разных вероятностных группах. В случае хорошей калибрационной способности шкалы кривые наблюдаемой и прогнозируемой летальности должны находиться как можно ближе друг к другу. Для построения этих кривых пациенты были разделены на группы по величине прогнозируемой вероятности летального исхода в разных вероятностных интервалах. Наблюдаемая летальность в каждой группе визуально сравнивалась со средним значением прогнозируемой летальности в интервале. Четыре из пяти шкал (APACHE II, APACHE IV, SAPS II, МРМ II 0) продемонстрировали тенденцию к недооценке тяжести состояния пациентов, т.е. прогнозировали
летальность ниже наблюдаемой во всех группах, за исключением группы с вероятностным диапазоном от 0 до 0,20. Шкала POSSUM, наоборот, давала завышенный прогноз летальности во всех вероятностных группах. Визуальный анализ графиков позволяет заключить, что результаты расчета шкалы МРМ II 0 наиболее близко расположены к линии ожидаемой летальности (наблюдаемая летальность близка к прогнозируемой) по сравнению с другими прогностическими шкалами (Рисунок 2).
Прсгможрувизя пвталвность
Пранажруеиая петальносн
Хв.
£> Oi 04 06 06
Пр0>«іинцг*иая лаіапьиоеть
Рисунок 2. Прогнозируемая летальность, полученная с помощью пяти прогностических шкал, и наблюдаемая летальность в различных вероятностных группах реанимационных больных хирургического профиля.
Анализ калибрационной способности прогностических шкал также проводился с использованием С-критерия и Н-критерия Хосмера-Лемешоу. Н-критерий включает в себя разделение пациентов на 10 групп, фиксированных по вероятностным интервалам летального исхода (0-0,10, 0,11-0,20, и.т.д.). В каждый интервал попадает различное количество человек, в зависимости от величины прогнозируемой вероятности летального исхода. Для С-критерия количество и вероятностный диапазон групп могут изменяться. Разбиение осуществляется таким образом, чтобы в каждую группу попало примерно одинаковое количество наблюдений. При этом ширина вероятностного интервала варьирует в зависимости от вероятности летального исхода у пациентов, попавших в группу.
Различие между наблюдаемой и ожидаемой летальностью в вероятностных группах для каждой шкалы оценивается с использованием у?-критерия Пирсона. Статистики по каждой группе суммируются и сравниваются с %2 распределением для степени свободы, которая принимается на две меньше, чем количество вероятностных групп. Чем ниже значение С или Н статистики, а, следовательно, больше величина р-значения, тем лучше модель соответствует реальным данным. Напротив, большее значение критерия Хосмера-Лемешоу (и меньшее р-значение) указывает на
отсутствие согласия наблюдаемых данных с моделью. При значении р < 0,05 нулевая гипотеза о сходстве распределений отвергается.
С-критерий Хосмера-Лемешоу является более мягким по сравнению с Н-критерием, так как позволяет менять ширину вероятностных интервалов. Это позволяет получить статистически значимые результаты и для сильно смещенных распределений. В то же время, Н-критерий является более строгим критерием, при котором нулевая гипотеза о сходстве распределений будет отвергаться чаше для сильно смещенных распределений в связи с жесткой фиксацией вероятностных интервалов.
Таблица 2. Результаты оценки калибрационной способности прогностических шкал с использованием С и Н-критерия Хосмера-Лемешоу
Шкала Тест Хосме ра-Лемешоу
С-критерий Н-критерий
х2 Степени свободы р-значение х2 Степени свободы р-значение
APACHE II 23,8 8 0,0025* 23,2 8 0,0031*
APACHE IV 45,6 2 0,001* 67,7 8 0,001*
SAPS II 12,7 8 0,1244 14,5 8 0,0695
МРМ II 0 9,4 8 0,3094 10,7 8 0,2185
POSSUM 27,3 8 0,0006* 27,2 8 0,0001*
* — при р < 0,05 нулевая гипотеза о сходстве распределений отвергается.
Три из пяти моделей (APACHE II, APACHE IV, POSSUM) показали неудовлетворительную калибрационную способность на данной категории пациентов. Для С и Н-критериев теста Хосмера-Лемешоу р значение было меньше 0,05. Таким образом, нулевая гипотеза о сходстве распределений прогнозируемой и наблюдаемой летальности отвергалась. Эти результаты указывают на то, что существует значительная разница между наблюдаемой и ожидаемой летальностью и, как следствие, на недостаточную калибрационную способность этих прогностических шкал. В то же время, для моделей SAPS II и МРМ II 0 тест не показал достоверных различий между распределениями прогнозируемой и наблюдаемой летальности (Таблица 2).
Таким образом, анализ калибрационной способности изученных нами прогностических шкал позволяет заключить, что только две из них (МРМ II О и SAPS И) имеют удовлетворительную калибрационную способность для данной группы пациентов ОРИТ, в то время как у других шкал она явно недостаточна.
Дискриминационная способность прогностических шкал оценивалась при помощи ROC-анализа и оценки площади под ROC-кривой. Анализ полученных нами результатов показал, что четыре шкалы APACHE II, APACHE IV, SAPS II и МРМ II 0 имеют высокую дискриминационную способность: площадь под ROC-кривой > 0,9. Шкала POSSUM продемонстрировала достаточную дискриминационную способность: AUROC 0,86 (Рисунок 3, Таблица 3).
ROC-кривы* для нескольких шкал (с площадью под кривой для группы ‘ВС«*)
\ -Специфичное п» Показам выбрэнныС порог отсечения дпя и Sp >0 8.
Рисунок 3. ROC-кpивыe для всех шкал с указанием расчетной площади под ROC-кpивoй.
Таблица 3. Оценка дискриминационной способности прогностических шкал посредством анализа площади под ГЮС-кривой (А1ЖОС)__
Шкала AUROC р-значение* 95% доверительный интервал Стандартная ошибка
APACHE II 0,941 <0,001 0,904-0,978 0,021
APACHE IV 0,964 <0,001 0,938-0,990 0,017
SAPS II 0,942 <0,001 0,903-0,980 0,022
МРМ II 0 0,910 <0,001 0,866-0,954 0,027
POSSUM 0,861 <0,001 0,754-0,968 0,057
* — при р < 0,05 нулевая гипотеза о том, что площадь под кривой равна 0,5, отвергается.
Таким образом, по совокупности калибрационной и дискриминационной способности только две из пяти прогностических шкал (SAPS II и МРМ II 0) могут быть рекомендованы для оценки вероятности летального исхода у пациентов в отделении реанимации хирургического профиля.
С практической точки зрения наиболее важной является способность прогностической шкалы с высокой степенью точности предсказывать результат лечения каждого поступившего в ОРИТ пациента или, другими словами, строить индивидуальный прогноз. Очень высокая дискриминационная способность изученных нами шкал позволяет использовать их для этой цели. Условное разделение поступающих в ОРИТ на пациентов с потенциально благоприятным и потенциально неблагоприятным результатом лечения производится по величине вероятности летального исхода. Для этого разделения используется пороговое значение вероятности — точка отсечения, при превышении которой пациент может быть условно отнесен к группе с летальным исходом, а в противном случае — к группе выздоравливающих больных. При анализе ROC-кривых существуют различные способы выбора оптимальной точки
отсечения в зависимости от задач, которые ставятся перед прогностическим тестом.
Использование прогностических шкал в ОРИТ, в первую очередь, нацелено на выявление группы риска — пациентов с летальным исходом (положительный прогноз). Чтобы не пропустить таких пациентов, необходимо минимизировать количество ложно отрицательных прогнозов за счет высокой чувствительности прогностического инструмента. В то же время, специфичность должна быть также достаточно высокой, так как большое количество пациентов, ошибочно отнесенных к группе с летальным исходом (ложно положительный прогноз), ослабляют бдительность врачей и медицинского персонала ОРИТ. Учитывая вышеуказанные особенности работы в ОРИТ, критерием выбора оптимальной точки отсечения было выбрано сочетание значений чувствительности выше 0,9 и специфичности не ниже 0,8.
Для шкалы APACHE II оптимальный уровень отсечения составил 0,15, для APACHE IV — 0,04, для шкалы SAPS II — 0,12, для шкалы МРМ II 0 — 0,15, для шкалы POSSUM — 0,18. Таким образом, точки отсечения для всех анализируемых шкал оказались смещены влево отточки отсечения 0,5.
Анализ эффективности прогностических шкал проводился не только на всей выборке, но и в различных нозологических группах пациентов. Были выбраны четыре группы пациентов: пациенты с травмами различной локализации — 74 пациента (доля летальности 5,4%), желудочно-кишечные кровотечения — 39 пациентов (доля летальности 20,5%), пациенты с аневризмой брюшного и/или грудного отделов аорты, разрывы или расслоения аневризмы — 36 пациентов (доля летальности 61,1%), пациенты с тромбозами или эмболиями сосудов различной локализации — 34 пациента (доля летальности 14,7%).
Таблица 4. Калибрационная способность (р-значение С-критерия Хосмера-Лемешоу) и дискриминационная способность прогностических шкал (АЦЯОС) для различных нозологических групп пациентов. _
Аневризма Желудочно- Тяжелые Тромбозы или
аорты кишечные сочетанные эмболии
Шкала кровотечения травмы сосудов
AU AU AU AU
Р ROC р ROC Р ROC Р ROC
APACHE 11 0,02* 0,95 0,62 0,87 0,56 0,77 0,78 0,99
APACHE IV 0,00* 0,94 0,00* 0,94 0,00* 0,97 0,13 1,00
SAPS II 0,00* 0,89 0,17 0,93 0,32 0,78 0,47 1,00
МРМ II 0 0,001* 0,89 0,64 0,80 0,55 0,80 0,76 0,99
POSSUM 0,26 0,82 0,00* — 0,03* 0,76 0,70 -
* — при р < 0,05 нулевая гипотеза о сходстве распределений отвергается.
В группе пациентов с аневризмой аорты шкалы APACHE II, APACHE IV, SAPS II, МРМ II 0, несмотря на хорошую дискриминационную способность, продемонстрировали неудовлетворительную калибрационную способность, и, следовательно, не подходят для прогнозирования летального исхода в данной нозологической группе (Таблица 4).
Наиболее высокую прогностическую точность продемонстрировали шкалы APACHE II, APACHE IV, SAPS II, МРМ II 0 для группы пациентов с тромбозами или эмболиями сосудов различной локализации. В группах пациентов с желудочно-кишечными кровотечениями и тяжелыми сочетанными травмами были получены схожие результаты: шкалы APACHE II, SAPS II, МРМ II 0 продемонстрировали удовлетворительную прогностическую точность, а шкалы APACHE IV и POSSUM, имеющие неудовлетворительную калибрационную способность, не могут быть рекомендованы для оценки тяжести состояния пациентов этих нозологических групп (таблица 4).
Дополнительно к расчету вероятности летального исхода шкала APACHE IV, по данным авторов, позволяет прогнозировать продолжительность пребывания пациента в ОРИТ. При проведении исследования мы рассчитали коэффициент ранговой корреляции Спирмена (так как распределение не подчиняется нормальному закону) между
прогнозируемой по шкале APACHE IV и наблюдаемой продолжительностью пребывания в пациентов в ОРИТ. Было установлено отсутствие корреляционной связи (г = 0.06, р = 0.265), что позволяет сделать вывод о нецелесообразности оценки длительности пребывания пациентов в ОРИТ с помощью шкалы APACHE IV у данной категории пациентов в условиях отечественных стационаров.
Шкала POSSUM вместе с вероятностью летального исхода оперированных пациентов позволяет рассчитать вероятность возникновения послеоперационных осложнений. Для графической оценки калибрационной способности шкал были построены кривые прогнозируемой и наблюдаемой частоты развития послеоперационных осложнений в разных вероятностных группах (Рисунок 4). На рисунке видно, что кривая наблюдаемых частот не соответствует прогнозируемой частоте развития осложнений по диагонали графика.
§ ® _ г о § S о ** / г
гм / У
о о _ о Z»7 /
0.0 0 2 0.4 0 6 0.8 1.0
1 — Специфичность
Рисунок 6. ROC-кривая для оценки вероятности послеоперационных осложнений с помощью шкалы POSSUM с указанием расчетной площади под кривой.
Выводы
1. В результате анализа источников литературы найдено более двух с половиной тысяч зарубежных публикаций, в которых приводятся противоречивые данные результатов сравнения эффективности различных шкал оценки тяжести состояния реанимационных больных. Единичные работы отечественных авторов не дают возможности обосновать применение международных прогностических шкал в условиях стационаров Российской Федерации.
2. Разработан и внедрен в клиническую практику специализированный модуль расчета наиболее часто применяемых в мировой практике нозонеспецифичных прогностических шкал в рамках информационной системы отделения реанимации и интенсивной терапии «ИНТЕРИС», с помощью которой осуществлен проспективный набор данных и оценка тяжести состояния реанимационных больных хирургического профиля.
3. Прогностические шкалы APACHE II, APACHE IV, SAPS II, МРМ II О продемонстрировали высокую дискриминационную способность (AUROC > 0,9), а шкала POSSUM — удовлетворительную дискриминационную способность (AUROC = 0,86). При этом удовлетворительную капибрационную способность, оцененную с использованием теста согласия Хосмера-Лемешоу и при помощи построения калибровочных кривых, показали две шкалы: SAPS II, МРМ II 0. Для прогнозирования летального исхода у реанимационных больных хирургического профиля в условиях стационаров Российской Федерации могут быть рекомендованы только шкалы SAPS II и МРМ II 0.
4. Для двух групп больных — с желудочно-кишечными кровотечениями и с тяжелыми сочетанными травмами — высокую прогностическую точность продемонстировали шкалы APACHE II, SAPS II, МРМ II 0, а для группы больных тромбозами и эмболиями сосудов раличной локализации — все пять исследуемых шкал, что позовляет рекомендовать указанные шкалы для оценки тяжести состояния данных категорий пациентов. Для группы больных
с аневризмами аорты ни одна из прогностических шкал не дала удовлетворительных результатов, следовательно, эти шкалы не могут быть рекомендованы к применению у данной категории больных. 5. Анализ результатов прогнозирования развития послеоперационных осложнений и длительности пребывания больных в отделении реанимации и интенсивной терапии с помощью шкал POSSUM и APACHE IV продемонстрировал отсутствие статистически достоверных связей между прогнозируемыми и наблюдаемыми данными (для шкалы POSSUM площадь под ROC-кривой — 0,54 и неудовлетворительная калибрационная способность, оцененная при помощи теста Хосмера-Лемешоу и калибровочных кривых; для шкалы APACHE IV — коэффициент ранговой корреляции Спирмена — 0,06), что не позволяет рекомендовать их к практическому использованию.
Практические рекомендации
1. Модуль для расчета наиболее широко используемых во всем мире нозонеспецифичных шкал, встроенный в информационную систему отделения реанимации и интенсивной терапии «ИНТЕРИС», рекомендуется для использования в клинической практике. Внутри модуля находится руководство пользователя, с которым необходимо ознакомиться перед началом использования программного средства.
2. Шкалы оценки тяжести состояния SAPS II и МРМ II 0, продемонстрировавшие высокую прогностическую точность, могут быть использованы для прогнозирования летального исхода у реанимационных больных хирургического профиля в стационарах Российской Федерации.
3. Прогностические шкалы APACHE II, SAPS II, МРМ II 0 рекомендуются для оценки тяжести состояния групп больных с желудочно-кишечными кровотечениями и тяжелой сочетанной травмой; для группы больных с тромбозами и эмболиями различной локализации рекомендуются шкалы APACHE II, APACHE IV, SAPS II, МРМ II 0, POSSUM. Использование шкал
APACHE II, APACHE IV, POSSUM для всех остальных категорий больных хирургического профиля на основе проведенного исследования рекомендовано быть не может.
4. Нецелесообразно использование шкалы POSSUM для прогнозирования вероятности развития послеоперационных осложнений и шкалы APACHE IV для прогнозирования предполагаемой длительности пребывания больных в отделении реанимации и интенсивной терапии хирургического профиля в условиях стационаров Российской Федерации.
Список работ, опубликованных по теме диссертации
1. Потанина O.K. Дорфман А.Г. Швырёв С.Л. Зарубина Т.В. Петрова М.В. Опыт использования зарубежных нозонеспецифичных прогностических шкал у больных хирургического и онкологического профиля. Вестник Российского Научного Центра рентгенорадиологии, N11. 2011. http://vestnik.rncrr.ru/vestnik/vl 1/papers/potan vi 1 .htm
2. Потанина O.K., Дорфман А.Г., Огурцова Е.В., Швырёв С.Л., Зарубина Т.В. Сравнение эффективности прогностических шкал оценки тяжести состояния реанимационных больных хирургического профиля. Врач и информационные технологии. N6. 2011. с. 50-61.
3. Потанина O.K., Дорфман А.Г., Огурцова Е.В., Швырёв С.Л., Зарубина Т.В. Сравнение эффективности прогностических шкал оценки тяжести состояния в разных диагностических группах среди реанимационных больных хирургического профиля. «Информационно-измерительные и управляющие системы», номер «Информационные технологии в медицине» №12, том 9, 2011. с.75-81.
4. Потанина O.K., Дорфман А.Г.,Швырёв С.Л. Оценка тяжести состояния реанимационных больных хирургического профиля на основе нескольких прогностических моделей//В сб. «Информационные технологии и общество -2010», Турция, Кемер, 01-08 октября 2010 г. С.113-114.
Подписано в печать: 20.04.12
Объем: 1,5усл.п.л. Тираж: 100 экз. Заказ № 761 Отпечатано в типографии «Реглет» 119526, г. Москва, ул. Бауманская д.ЗЗ (495) 979-96-99; www.reglet.ru
Шкалы общей оценки тяжести состояния у взрослых
1. Шкалы общей оценки тяжести состояния у взрослых
ШКАЛЫ ОБЩЕЙ ОЦЕНКИТЯЖЕСТИ СОСТОЯНИЯ У
ВЗРОСЛЫХ
Абидуев А.С.
Томск, СибГМУ
2015
• SAPS — упрощенная шкала оценки
физиологических расстройств).
SAPS II — упрощенная шкала оценки
физиологических расстройств II.
APACHE II — шкала оценки острых
физиологических расстройств и
хронических нарушений состояния II.
APACHE III — шкала оценки острых
физиологических расстройств и
хронических нарушений состояния III.
SOFA (Sequential Organ Failure
Assessment) — динамическая оценка
органной недостаточности.
MODS (Multiple Organ Dysfunction Score) —
шкала оценки полиорганной дисфункции.
ODIN (Organ Dysfunctions and/or Infection)
— оценка дисфункции органов и/или
инфекции.
МРМ (Mortality Probability Model) — оценка
вероятности летального исхода.
МРМ II (Mortality Probability Model) —
оценка вероятности летального исхода II.
LODS (Logistic Organ Dysfunction System)
— логистическая модель оценки
дисфункции органов.
TRIOS (Three days Recalibrated ICU
Outcome Score) — уточненный прогноз
исхода лечения в ОРИТ по состоянию на
3-й день пребывания.
TISS (Therapeutic Intervention Scoring
System) — шкала оценки эффективности
лечения.
TISS-28 (simplified TISS) — упрощенная
версия шкалы оценки эффективности
лечения.
4. Подходы к оценке степени тяжести
Физиологический• Количество и степень
витальной
дисфункции связаны
с тяжестью и
летальностью
Терапевтическая
• Уровень
инвазивности
проводимой терапии
коррелирует с
тяжестью и
летальностью
5. Подходы к оценке степени тяжести
Физиологический• Сбор данных
занимает длительное
время
• Позволяет
прогнозировать
возможные
осложенения
Терапевтическая
• Разные взгляды на
агрессивность
терапии
• Низкая ценность у
больных с
промежуточным
риском, тк зависит от
тактики лечения.
6. Клинический случай
• Пациент Ш., 57 лет• Травма 21 ноября 2015 (упал) на фоне длительной
алкоголизации, обратился ночью 22 ноября в ГБСМП,
патологии не выявлено, отправлен в МСЧ-2.
• В МСЧ-2: обнаружен перелом левой плечевой кости со
смещением отломков, выполнена иммобилизация,
транспортировка в ГБСМП
• «…ввиду наличия комбинированного повреждения
сосудисто-нервного пучка…» переведен в
травматологическое отделение ОКБ.
7. Клинический случай
• Выполнена КТ ГМ, смотрен неврологом,нейрохирургом.
Хирург: обморожение пальцев обеих кистей 2 ст.
Госпитализирован в 02:50 22 ноября 2015 г.
06:50 остановка кровообращения, дежурным
травматологом начата СЛР.
Дежурный реаниматолог – продолжена СЛР,
интубация трахеи, ИВЛ – успешные реанимационные
мероприятия, переведен в ОАР.
АД 70/40 мм рт.ст., ЧСС 130 уд/мин.
8. Клинический случай
• Восстановление сознания, в 09:50 экстубация.• Исключена ТЭЛА по КТ.
• Диагноз: Перелом плечевой кости слева.
Постреанимационная болезнь. Полиорганная
недостаточность. Синдром позиционного сдавления.
• Диурез: 600 мл
• Креатинин 385, мочевина 24
• Газы крови: pH 7.47, pO2 82 мм рт.ст.
9. TISS
• Therapeutic Intervention Scoring System — Количественнаяоценка объема терапии *
• Хорошо коррелируют со смертностью, тяжестью
патологии и стоимостью терапии.
• Модицифирована в 1983г
• 76 параметров (TISS-76)
Недостатки:
• Громозкость
• Необходимо учитывать оснащенность ЛПУ.
*Giveta J. M., 1973; Cullen D. J. et al., 1974
10. TISS-28
• Полностью замещает TISS-76• Намного проще
12. Пациент Ш. по TISS-28:
• 35 баллов• В перерасчете на TISS-76: 33 балла
• Соответствует III классу тяжести:
• Витальные функции стабильны/компенсированы,
однако требующие интенсивного ухода/инвазивных
методов контроля.
13. APACHE
• Acute Physiology and ChronicHealth Evaluation
• W. A. Knauss (1981)
• Содержала 34 параметра
• Определение
физиологического статуса в
остром периоде.
• Вероятный исход не
определялся.
14. APACHE
• Малопригодна для индивидуальногопрогнозирования
• 1985 г – пересмотр APACHE II – 12
параметров
• Исключение глюкозы крови, ЦВД,
альбумина, диуреза
• База данных – 1979-1982
15. APACHE II: три блока:
• Оценка острых физиологических изменений (AcutePhysiology Score – APS) – за первые 24 часа в ОРИТ
• Оценка возраста
• Оценка хронических заболеваний
16. APACHE II
17. APACHE II
18. APACHE II
• Итоговая оценка: баллы за APS+ баллы за возраст +баллы за сопутствующую патологию
• Высокие баллы – высокий риск летальности в ОРИТ
• Не рекомендуется у пациентов с ожогами и после АКШ
• Позволяет предсказать риск септических осложнений
19. APACHE II
Недостатки:• Не рекомендована для оценки у лиц
• Нет оценки до поступления в ОРИТ (исправлено в
APACHE III)
• Погрешности у седатированных больных (делирий,
синхронизация с ИВЛ)
20. APACHE III
• 1991г• База данных – 1988-1990/1993-1996, 17
440/37 000 пациентов
• Расширена шкала сопутствующей
патологии
• Может использоваться в течение всего
времени нахождения пациента в ЛПУ
• Причина и время поступления в ОРИТ –
важные прогностические критерии
21. APACHE IV
• База данных – 2002-2003 г, 131 000 пациентов!• Учитывает седацию и синхронизацию с ИВЛ
• По сравнению с APACHE II показала более точные
результаты у пациентов с ОНМК*
*Tulin Akarsu Ayazoglu,
ANAEST, PAIN&INTENSIVE CARE 2011
22. Пациент Ш.: APACHE
• APACHE II: 18/71 баллов• Риск смерти – 29%
• APACHE IV: 61/286 баллов
• Риск смерти 37%
• Original Simplified Acute Physiology Score
• Оригинальная упрощенная шкала оценки
физиологических расстройств
Le GallJ-R, 1984
По сути – упрощенная APACHE
14 значений
1993 – SAPS II
25. SAPS 3
• 2005 г• Позволяет довольно точно оценить состояние
витальных функций организма
• Состоит из трёх блоков: оценка данных пациента
(возраст, коморбидный фон и тд), анализ причины
перевода в ОРИТ, состояние систем органов
(оцениваются худшие значения).
26. Ш.: SAPS 3
• 80 баллов• Вероятность летального исхода 73%
• Динамическая оценка органной
недостаточности
• Sequential Organ Failure Assessment
• Vincent J. Let al., 1996
• Изначально создавалась для
оценки ПОН у пациентов с
сепсисом.
• Количество систем органов, вовлеченных в ПОН,
коррелировало со смертностью
• Больше предназначена для быстрого подсчета баллов
и описания ряда осложнений, чем для прогноза
исхода заболевания
• Scores less than 9 give predictive mortality at 33% while
above 11 can be close to or above 95% (wiki)
• Не учитывает возраст и фоновые заболевания
29. Пациент Ш.:SOFA
• Mortality Probability Model• Модель вероятности летального исхода
• 1994 г
31. Пациент Ш.: MPM II
32. Пациент Ш.:
• TISS-28: 35 баллов, III категория пациентов• APACHE II: 18/71 баллов, вероятность летального
исхода – 29%
APACHE IV: 61/286 баллов, вероятность летального
исхода 37%
SAPS 3: 80 баллов, вероятность летального исхода
73%
SOFA: 7/24 баллов
MPM II: вероятность летального исхода 38,2%
33. ВАЖНО:
• Невозможно предсказать смертность с 100% точностью≠ неизбежная гибель
• Низкая оценка ≠ невозможность развития осложнений
• Высокая оценка
• Шкалы точны именно в ОРИТ, после перевода в
профильные отделения теряют свою ценность.
• Большинство не учитывает объем и успешность
терапии
• Шкалы не тестировалась в РФ!
• прогностические шкалы SAPS II и MPM II 0, могут быть
рекомендованы для оценки вероятности летального
исхода в ОРИТ хирургического профиля*
34. Вопросы?
35. Спасибо за внимание!
(PDF) Assessment of the severity of acute destructive pancreatitis for proper treatment selection
635
Казанский медицинский журнал, 2013 г., том 94, №5
ограничено прогнозированием летальности в
стратифицированных группах пациентов без
учёта выбранного «главного» диагноза [7]. При-
нято считать, что SAPS по качеству оценки не
уступает APACHE. Другие авторы утверждают,
что данная система для оценки тяжести панкре-
онекроза менее достоверна, чем APACHE II [9].
Продолжением исследования данной про-
блемы стала шкала MODS, предложенная
Marshall и соавт. [12] в 1996 г. Авторы полагали,
что оценка тяжести состояния пациента в мо-
мент исследования имеет большее практическое
значение, чем прогнозирование вероятности ле-
тального исхода, поскольку определяет страте-
гию лечения. В связи с этим утверждением были
определены оптимальные значения переменных
для каждой из шести систем жизнедеятельно-
сти (центральной нервной системы, сердечно-
сосудистой и дыхательной систем, функций по-
чек, печени, а также системы гемокоагуляции).
Каждой из них было присвоено значение от 0 до
4 баллов. Особое внимание было уделено шкале
комы Глазго, PAR (Pressure Adjusted Heart Rate:
HR½CVP/MAP, где HR — частота сердечных
сокращений, CVP — центральное венозное дав-
ление, MAP — среднее артериальное давление),
paO2/FiO2 (соотношение парциального давления
кислорода в артериальной крови и его фракции
во вдыхаемом воздухе), содержанию креатини-
на и билирубина в крови и числу тромбоцитов.
Баллы суммируют для получения общего коли-
чества от 0 до 24. Считают, что оценка по MODS
при поступлении в отделение анестезии, реани-
мации и интенсивной терапии пациентов с тя-
жёлой формой панкреонекроза более достоверна,
чем оценка по APACHE II.
Интегральная система SOFA появилась в
1996 г. на основе системы MODS. В данной си-
стеме также используют шесть основных параме-
тров и те же переменные, за исключением сердеч-
но-сосудистой системы, недостаточность которой
была определена не критерием PAR, а необходи-
мостью использования пациентами препаратов,
влияющих на сократительную функцию мио-
карда. Также присутствовала преемственность
при подсчёте баллов, была скопирована система
счёта баллов (от 0 до 4 баллов по каждому при-
знаку). Ежедневный учёт количества баллов по
SOFA выявил статистически значимое различие
между выжившими и умершими пациентами.
Наличие инфекции увеличивало число баллов
для каждой системы органов и в итоге общую
сумму баллов. В целом же интегральная систе-
ма SOFA показала недостаточную чувствитель-
ность и высокую специфичность. Было также
установлено, что параметры сердечно-сосуди-
стой системы в SOFA имеют большее значение
в оценке полиорганной недостаточности, чем в
аналогичной системе MODS, и могут служить
показателем эффективности проводимого лече-
ния панкреонекроза [3].
По данным М.В. Лысенко и соавт. [2], шка-
лы MODS и SOFA, учитывающие степень дис-
функции сердечно-сосудистой, дыхательной
систем, печени, почек, центральной нервной
системы и системы крови, более информативны
в оценке динамики патологического процесса и
более эффективны при выборе тактики лечения.
Было также установлено, что эти шкалы
могут с высокой вероятностью прогнозировать
смертность при остром панкреатите, однако
они недостаточно результативны в прогнозиро-
вании местных и системных осложнений [10].
Одной из последних усовершенствованных
шкал оценки тяжести заболевания, демон-
стрирующих динамику изменения общего со-
стояния пациентов с острым деструктивным
панкреатитом, стала шкала Научно-исследо-
вательского института скорой помощи имени
И.И. Дженилидзе. Данная шкала позволяет
оценить тяжесть состояния пациента, а также
эффективность лечебных мероприятий. Она со-
стоит из трёх разделов: клинического, лабора-
торного и инструментального (ультразвуковые
критерии). Данную методику авторы оценивают
как достаточно простую, пригодную для исполь-
зования в стационарах скорой медицинской
помощи со средним уровнем диагностических
возможностей. Она позволяет объективно оце-
нить тяжесть состояния пациентов с острым
панкреатитом уже в первые часы с момента по-
ступления.
Таким образом, существующие системы про-
гнозирования, основанные на подсчёте баллов,
зачастую не используют в клинической практи-
ке ввиду сложности и громоздкости подсчётов.
Для клинического применения удобной и в то
же время достоверной системы прогнозирова-
ния тяжести течения заболевания на сегодняш-
ний день нет.
ВЫВОДЫ
1. Несмотря на наличие более 20 шкал инте-
гральной оценки тяжести состояния больного с
деструктивным панкреатитом, шкалы, которая
дала бы точную оценку состояния пациента на
разных стадиях развития патологического про-
цесса в поджелудочной железе, на сегодняшний
день не существует.
2. Известные шкалы оценки тяжести состо-
яния больного в своей основе используют мно-
жество клинико-лабораторных данных, опреде-
ление которых не всегда возможно в дежурных
хирургических стационарах, так как зависит
от степени их оснащённости диагностическим
оборудованием.
3. В условиях отделения неотложной хирур-
гии для определения тактики лечения больных
острым деструктивным панкреатитом целесо-
образно проводить оценку тяжести состояния
пациентов путём ежедневного контроля дина-
мики клинико-лабораторных и инструменталь-
ных показателей с использованием наиболее
простой и доступной интегральной оценки по
шкале АРАСНЕ II либо шкале Научно-исследо-
Лист расширенной системы подсчета очков SAPS II
Реферат Фон: Прогностический потенциал систем оценки, используемых в отделениях интенсивной терапии (ОИТ) для определения смертности пациентов, тщательно изучается, но практически не объединяется. Цели: Статистический анализ точности трех общих оценок ОИТ, включая оценку острой физиологии и хронического здоровья (APACHE II), упрощенную оценку острой физиологии (SAPS II) и оценку последовательной органной недостаточности (SOFA), для прогнозирования смертности.Методы: Был проведен метаанализ проспективных исследований, опубликованных в период с января 2000 г. по февраль 2019 г., для анализа эффективности APACHE II, SAPS II и SOFA для прогнозирования смертности пациентов путем объединения их дискриминационных показателей, таких как специфичность чувствительности, и области под иерархическая сводная рабочая характеристика приемника (HSROC). Индекс несогласованности (I²) использовался для оценки неоднородности по чувствительности и специфичности, в то время как мета-регрессионный анализ проводился для выявления потенциальных источников неоднородности.Графики воронки Дика использовались для оценки потенциальной систематической ошибки публикации. Полученные результаты: Всего в 37 исследованиях (7612 пациентов, 63,58% мужчин, 75,7% оценивали внутрибольничную смертность) было зарегистрировано 2170 случаев смерти. Системы оценки APACHE II, SAPS II и SOFA показали хорошие прогностические характеристики смертности, где совокупная чувствительность составляла 0,81, 0,76 и 0,80 соответственно, специфичность составляла 0,78, 0,89 и 0,79 соответственно, а объединенные HSROC составляли 0,87, 0,85 и 0.88 соответственно. Для APACHE II, SAPS II и SOFA наблюдалась значительная промежуточная неоднородность чувствительности (I² = 85.21%, 84,31% и 71,67% соответственно) и специфичности (I² = 93,74%, 92,65% и 89,41%, соответственно) при отсутствии систематической ошибки публикации (P = 0,689, 0,465 и 0,181 соответственно). Наблюдалась значительная неоднородность между исследованиями, в которых изучали APACHE II с пороговым значением> 20 (P = 0,04), и исследованиями, изучающими SAPS II в течение> 24 месяцев (P <0,001). Заключение: В рамках ограничений исследования баллы интенсивной терапии показали хорошие прогностические характеристики. Будущие исследования должны проводиться с использованием фиксированных конечных точек смертности с участием нескольких стран и с использованием комбинации общих показателей ОИТ.Ключевые слова: APACHE II, SAPS II, SOFA, критическое заболевание, смертность
Прогностическая эффективность SAPS 2 и SAPS 3 в отделении промежуточной терапии для внутренней медицины в центре трансплантологии немецкого университета; Ретроспективный анализ
Аннотация
Цель
Для анализа и сравнения показателей упрощенной оценки острой физиологии (SAPS) 2 и SAPS 3 среди пациентов промежуточного звена с внутренними расстройствами.
Материалы и методы
Мы провели ретроспективный одноцентровый анализ пациентов (n = 305), поступивших в отделение промежуточной медицинской помощи (ImCU) для внутренней медицины в Университетской клинике Эссена, Германия.Мы использовали и сравнили балльную систему SAPS 2 и SAPS 3 для оценки тяжести заболевания и прогнозирования показателей смертности среди пациентов, поступивших в ImCU в течение 18-месячного периода. Обе оценки, в которых используются параметры, записанные при поступлении в отделение интенсивной терапии (ОИТ), представляют собой наиболее широко применяемые системы оценки в европейской реанимации. Кривая площади под рабочей характеристикой приемника (AUROC) использовалась для оценки характеристик дискриминации SAPS 2 и SAPS 3.В конечном итоге были рассчитаны стандартизированные коэффициенты смертности (SMR) вместе с соответствующими 95% доверительными интервалами (95% ДИ), чтобы определить соотношение наблюдаемой и ожидаемой смертности, и были построены графики калибровочных поясов для оценки SAPS 2 и Калибровочные характеристики SAPS 3.
Результаты
Обе оценки обеспечили приемлемую дискриминацию, т. Е. AUROC составил 0,71 (95% ДИ, 0,65–0,77) для SAPS 2 и 0,77 (95% ДИ, 0,72–0,82) для SAPS 3. При наблюдаемой внутрибольничной летальности 30 .2%, SAPS 2 показал слабую эффективность с прогнозируемой смертностью 17,4% и SMR 1,74 (95% ДИ 1,38–2,09), особенно в связи с заболеваниями печени и / или сепсисом. SAPS 3 был выполнен точно, в результате чего прогнозируемая смертность составила 29,9%, а SMR — 1,01 (95% ДИ 0,8–1,21). Основываясь на графиках калибровочного ремня, SAPS 2 показал плохие характеристики калибровки, особенно у пациентов с низким риском смертности ( P <0,001), в то время как SAPS 3 продемонстрировал высокоточные калибровочные характеристики ( P = 0.906) на всех уровнях риска.
Выводы
В нашем исследовании SAPS 3 продемонстрировал высокую точность в прогнозировании смертности у пациентов с внутренними расстройствами ImCU. Напротив, SAPS 2 недооценил смертность, особенно у пациентов с заболеваниями печени и сепсисом.
Образец цитирования: Jahn M, Rekowski J, Gerken G, Kribben A, Canbay A, Katsounas A (2019) Прогностическая эффективность SAPS 2 и SAPS 3 в отделении промежуточной терапии для внутренней медицины в центре трансплантологии немецкого университета; Ретроспективный анализ.PLoS ONE 14 (9): e0222164. https://doi.org/10.1371/journal.pone.0222164
Редактор: Кьяра Лаззери, Азиенда Оспедальеро Universitaria Careggi, ИТАЛИЯ
Поступила: 24 апреля 2019 г .; Дата принятия: 16 августа 2019 г .; Опубликован: 25 сентября 2019 г.
Авторские права: © 2019 Jahn et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные содержат конфиденциальную информацию о пациентах и поэтому не могут быть общедоступными. Доступ к обезличенному минимальному набору данных для репликации / проверки полных анализов / выводов этого исследования может быть подан в местный наблюдательный совет университетской больницы Эссена, обратившись к доктору Майклу Яну (связаться по электронной почте : [email protected]). Набор данных называется «Прогнозирование SAPS2 / SAPS3 M-IMC UK Essen».
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Использование показателей внутрибольничной смертности при поступлении в отделение интенсивной терапии (ОИТ) стало эффективным методом оценки результатов лечения тяжелобольных пациентов [1]. На сегодняшний день Simplified Acute Physiology Score (SAPS) 2 и SAPS 3 являются двумя из наиболее широко проверенных оценок прогнозирования риска во всем мире и представляют собой наиболее часто применяемые системы оценки в европейской интенсивной терапии [2–7].В отличие от общих данных о смертности, такие баллы обеспечивают оценку смертности с поправкой на риск с учетом различных степеней тяжести заболевания и других предпосылок или предрасполагающих условий. Таким образом, стандартизованные коэффициенты смертности (SMR) могут быть надежно рассчитаны путем сравнения наблюдаемых и ожидаемых уровней смертности [8]. При приемлемых характеристиках калибровки SMR являются полезными инструментами, которые можно использовать для оценки вмешательств и / или качества клинического ведения в отделении интенсивной терапии или в группе отделений интенсивной терапии со сравнимыми конфигурациями с течением времени.SMR также могут выступать в качестве контрольных параметров для оценки эффективности и улучшения в отделении интенсивной терапии с развивающейся политикой сдерживания затрат и медицинской практикой или структурами, поскольку (например) уменьшающийся SMR может указывать на наличие некоторых конкретных изменений, которые благотворно влияют на смертность [9 ].
На сегодняшний день, в отличие от отделений интенсивной терапии [2–4, 6, 7, 10–17], отчетов о рутинном применении показателей прогнозирования смертности в отделениях промежуточной помощи (ImCU) мало [18–21]. Хотя такие оценки считаются важными в процессах принятия решений в отделениях интенсивной терапии, они еще не интегрированы в стандартные алгоритмы (например,g., через информационную систему больницы) в немецких ImCUs. Более того, из-за довольно неоднородных характеристик / настроек ImCU единообразная проверка этих оценок остается сложной задачей.
Между тем, сообщалось о значительном снижении внутрибольничной смертности для пациентов, госпитализированных в отделения интенсивной терапии в больницах с имплантологами, по сравнению с пациентами, госпитализированными в отделения интенсивной терапии в больницах без имплантатов [22]. Эти данные способствовали росту популярности ImCUs в Германии, особенно для пациентов, которые слишком больны для нормального отделения, но также слишком стабильны, чтобы быть помещенными в отделение интенсивной терапии [23].Все еще относительно ограниченная доступность коек в отделениях интенсивной терапии и растущая потребность в более рентабельном лечении пациентов с низким / средним риском критических состояний в первую очередь стимулировали это развитие. В больничном секторе Германии ImCU могут быть либо интегрированы и / или рядом с отделением интенсивной терапии, либо работать отдельно и независимо от отделения интенсивной терапии [24]. Фактически, ImCU могут служить в качестве «повышающих» или «понижающих» отделений между палатами общего профиля и отделениями интенсивной терапии или палатами «субинтенсивной» для пациентов, поступающих из отделений неотложной помощи или реабилитации [25].Хотя большинство ImCU лечат хирургических пациентов [24], спектр медицинской поддержки, предоставляемой в каждом ImCU, зависит от конкретной инфраструктуры и / или областей знаний принимающих клиник. Однако постоянный мониторинг, неинвазивная механическая вентиляция и применение вазоактивных препаратов по требованию представляют собой общие методы лечения среди ImCU. Таким образом, целесообразно продолжить оценку балльных систем интенсивной терапии, таких как SAPS2 и / или SAPS 3, у пациентов с ImCU [24].
В совокупности, это исследование было направлено на анализ и сравнение эффективности SAPS 2 и SAPS 3 у пациентов с внутренними расстройствами, которые были госпитализированы в ImCU при трансплантологическом центре немецкой университетской больницы, чтобы улучшить качество лечения. оценка и управление местным уходом. Кроме того, наши данные следует интерпретировать перекрестно с результатами предыдущих исследований, в которых оценивалась эффективность обоих показателей у нехирургических пациентов с ImCU [18–21].
Материалы и методы
Дизайн, установка и пациенты
Это исследование проводилось в ImCU по внутренней медицине на 22 койки при университетской клинике Эссена, Германия, академическом клиническом учреждении на почти 1300 коек.Этот ImCU возглавляет группа гастроэнтерологов / гепатологов и нефрологов и работает независимо от других отделений интенсивной терапии. Пациенты с острой или острой или хронической печеночной недостаточностью, острым повреждением почек или хроническим заболеванием почек (включая пациентов, нуждающихся в гемодиализе), пациенты, получающие иммуносупрессивную терапию после трансплантации солидных органов (SOT; особенно трансплантация почек и печени), и кандидаты на трансплантацию с различными острыми заболеваниями. условия составили большинство приемов ImCU.
Соотношение медсестер и пациентов составляет 1: 4. В медицинскую бригаду ImCU входят 9 врачей (из них 5 специалистов по реанимации), то есть 2 старших врача и 7 ординаторов, которые работают в смену от 8 до 12 часов. Все кровати стандартно оснащены непрерывной телеметрией, пульсоксиметрией, измерением температуры тела, а также неинвазивным и инвазивным мониторингом артериального давления и центрального венозного давления. Прикроватные мониторы связаны с центральным блоком, который обрабатывает все передаваемые данные и / или сигналы тревоги.
В течение 18-месячного периода, с января 2014 г. по июнь 2015 г., характеристики пациентов, история болезни, причины госпитализации, а также наихудшие клинические состояния и лабораторные показатели были записаны (независимо от медицинских вмешательств) в течение первого часа после ImCU- госпитализация по SAPS 3 [26] или в течение первых 24 часов после приема ImCU по SAPS 2 [27]. Для обеих оценок прогнозируемые коэффициенты смертности были рассчитаны с использованием уравнений, приведенных в таблице 1. Хотя в SAPS 2 используется одно общее уравнение [27], индивидуальные формулы доступны в различных основных географических регионах для SAPS 3; Настоящий анализ был проведен с использованием адаптированного уравнения SAPS 3 для Северной Европы [26].
В течение периода исследования 73 из 379 поступивших в ImCU были определены как повторные, и поэтому были исключены из дальнейшего рассмотрения. Кроме того, одного пациента пришлось исключить из-за неполных данных. Таким образом, окончательному статистическому анализу подверглись данные 305 пациентов (все в возрасте старше 18 лет). Стремясь повысить надежность данных, мы провели тесты контроля качества данных, собранных в течение одномесячного пилотного запуска, прежде чем приступить к этапу регулярного сбора данных.
SAPS 2 включает 15 переменных, т. Е. 12 физиологических переменных, возраст, тип госпитализации и одну переменную, связанную с основным заболеванием, которые должны быть записаны в 24-часовом временном окне после госпитализации [27]. SAPS 3 использует 20 переменных, то есть 5 переменных, касающихся характеристик пациента до госпитализации, 5 переменных, касающихся обстоятельств госпитализации, и 10 физиологических переменных, которые должны быть записаны в течение 1 часа до или после госпитализации [26]. В таблице 1 представлен параллельный обзор обеих систем оценки, а также подробное описание параметров, включенных в каждую оценку.Конечной точкой этого исследования была госпитальная летальность.
Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS (версия 21.0; SPSS Inc, Чикаго, Иллинойс) и SAS (версия 9.4; SAS Institute Inc., Кэри, Северная Каролина). Для описательной статистики абсолютные и относительные частоты были рассчитаны для категориальных параметров, тогда как непрерывные параметры были охарактеризованы с использованием медианы (MD), а также первого и третьего квартилей (Q1, Q3). Для SAPS 2 и SAPS 3 также были рассчитаны среднее значение и стандартное отклонение (Среднее ± SD).Статистические данные для сравнения умерших с не умершими пациентами включали точный тест Фишера для категориальных переменных и U-критерий Манна-Уитни для непрерывных переменных. Результаты считались статистически значимыми, когда P ≤0,05.
Эффективность прогностических моделей, таких как SAPS 2 и SAPS 3, включает два показателя: дискриминацию и калибровку. В то время как площадь под кривой рабочих характеристик приемника (AUROC) была рассчитана как мера дискриминации [28]), калибровка была оценена с использованием калибровочной ленты [29, 30].Обратите внимание, что высокое значение p ( P > 0,05) указывает на хорошо откалиброванную модель. Калибровочные кривые для калибровочного пояса (рис. 1 и 2) были созданы путем построения графика прогнозируемой смертности (ось x) против наблюдаемой смертности (ось y). SMR вместе с соответствующими 95% доверительными интервалами (95% доверительный интервал) были определены как для SAPS 2, так и для SAPS 3 путем деления наблюдаемого уровня смертности на среднее значение прогнозируемых показателей смертности. Таким образом, мы позволяем выявить завышение (SMR <1) или занижение (SMR> 1) показателей смертности в нашей популяции ImCU.
Рис. 1. Калибровочная лента для модели SAPS 2, сравнивающая наблюдаемую и прогнозируемую смертность ImCU.
Калибровочные кривые с 80% (внутренний пояс, светло-серый) и 95% -ным доверительным интервалом (внешний пояс, темно-серый) были созданы путем построения графика прогнозируемой смертности (ось x) против наблюдаемой смертности (ось y), таким образом, если кривая выше биссектрисы (красная линия), это соответствует занижению. Калибровочная кривая SAPS 2 плохо калибруется там, где биссектриса не входит в пояс — это имеет место у пациентов с низким риском смерти.SAPS 2 показывает плохую калибровку ( P <0,0019).
https://doi.org/10.1371/journal.pone.0222164.g001
Рис. 2. Калибровочный пояс для модели SAPS 3, сравнивающий наблюдаемую и прогнозируемую смертность от ImCU.
Калибровочные кривые с 80% (внутренний пояс, светло-серый) и 95% -ным доверительным интервалом (внешний пояс, темно-серый) были созданы путем построения графика прогнозируемой смертности (ось x) против наблюдаемой смертности (ось y), таким образом, если кривая выше биссектрисы (красная линия), это соответствует занижению.В целом SAPS 3 калибруется хорошо ( P = 0,906).
https://doi.org/10.1371/journal.pone.0222164.g002
Заявление о соблюдении этических норм
Это неинтервенционное исследование было выполнено в соответствии с этическими принципами и стандартами Хельсинкской декларации 1964 года и более поздних поправок к ней. Протокол исследования был одобрен местным наблюдательным советом университетской клиники Эссена (IRB: Ethik-Kommission am Universitätsklinikum Essen, 15-6436-BO).Из-за наблюдательного дизайна этого когортного исследования наблюдательный совет учреждения отказался от требования информированного согласия пациентов.
Результаты
Характеристики пациента
Из всех пациентов (n = 305) одна треть (n = 92; 30,2%) поступила через отделение гастроэнтерологии и гепатологии, а две трети (n = 213; 69,8%) — через отделение нефрологии. Источниками приема пациентов были обычные отделения внутренней медицины университетской клиники Эссена или другие больницы (n = 226; 74.1%), отделения неотложной помощи (n = 33; 10,8%) и интенсивной терапии (n = 45; 14,7%; таблица 2). Средний возраст пациентов составлял 60 лет, большинство пациентов составляли мужчины (n = 184; 60,3%), а средний ИМТ составлял 25,7 кг / м 2 (таблица 3). Среднее время пребывания в ImCU составляло 6 дней.
Среди всех хронических заболеваний, учитываемых SAPS 2 или SAPS 3, цирроз печени (n = 68; 22,3%) показал самую высокую частоту в нашей когорте. Другие сопутствующие заболевания, такие как рак и противоопухолевая терапия (n = 15; 4,9%), хроническая сердечная недостаточность на стадии IV по NYHA (n = 10; 3.3%), гематологический рак (n = 6; 2,0%) или СПИД (n = 4; 1,3%) были значительно реже. Кроме того, мы наблюдали высокий процент пациентов с хроническими заболеваниями почек (ХБП) на основании критериев KDIGO [31] (n = 131; 43,0% из них, n = 39 с терминальной стадией ХБП) и пациентов с системной иммуносупрессией. после трансплантации солидных органов (n = 55, 18,0%; из них n = 22 после трансплантации печени, n = 28 после трансплантации почки и n = 5 после комбинированной трансплантации поджелудочной железы-почки, таблица 3).
Что касается структуры SAPS 3, наиболее частыми острыми состояниями при поступлении были сердечные аритмии (n = 52; 17.1%), за которыми следует острая или острая или хроническая печеночная недостаточность (n = 50, 16,5%), нозокомиальные инфекции (n = 26; 8,5%), нарушения бдительности, например кома, ступор, заторможенный пациент, возбуждение, спутанность сознания, делирий (n = 26; 8,5%), септический шок (n = 15; 4,9%), неотложные состояния желудочно-кишечного тракта, например тяжелый панкреатит, острый живот (n = 11; 3,6%) и различные очаговые неврологические нарушения (n = 3; 1,0%). Мы также зарегистрировали высокие показатели острого повреждения почек по критериям KDIGO [32] (n = 97; 31,8%) или сепсиса по критериям Sepsis-2 [33] (n = 43; 14.1%) и (реже) дыхательной недостаточности, требующей неинвазивной вентиляции (n = 17; 5,6%) или желудочно-кишечного кровотечения (n = 10; 3,3%, таблица 3).
Более половины всех пациентов при поступлении получали вазоактивные препараты (норадреналин, добутамин, адреналин или гемопрессин; n = 188, 61,6%), в то время как примерно четверть всех пациентов (n = 70; 23,0%) получали заместительную почечную терапию. терапия в виде либо прерывистого гемодиализа (n = 62; 20,4%), либо непрерывного циклического или амбулаторного перитонеального диализа (n = 8; 2.6%).
Производительность SAPS 2 по сравнению с SAPS 3
Средний балл (MD [Q1; Q3]) составлял 30 [22; 39] для SAPS 2 и 55 [46; 64] для SAPS 3, в результате чего средняя прогнозируемая смертность составила 10,6% [4,7%; 23,0%] и 26,0% [12,0%; 44,0%] соответственно (табл. 3). Соответствующие средние значения и стандартные отклонения составили 31,4 ± 12,9 для SAPS 2 и 55,4 ± 12,9 для SAPS 3, что привело к средней прогнозируемой смертности 17,4% ± 17,6 и 29,9% ± 21,1 (таблица 4). Наблюдаемая внутрибольничная летальность составила 30,2% (n = 92 пациента; из них n = 56 были мужчинами и n = 36 женщинами), в результате чего SMR был равен 1.74 (95% ДИ, 1,38–2,09) для SAPS 2 и 1,01 (95% ДИ, 0,8–1,21) для SAPS 3, соответственно (таблицы 4 и 5). Следовательно, в то время как SAPS 2 сильно недооценил истинный уровень смертности, SAPS 3 обеспечил заметно точный прогноз.
При AUROC 0,71 (95% ДИ, 0,65–0,77) для SAPS 2 и 0,77 (95% ДИ, 0,72–0,82) для SAPS 3 (Таблица 4; Рис. 3) оба показателя показали приемлемые характеристики распознавания. Однако характеристики калибровки существенно различались. На основе калибровочного ремня SAPS 3 показал хорошую калибровку ( P = 0.906), тогда как SAPS 2 показал плохую калибровку, которая была выражена среди пациентов с низким риском смертности ( P <0,001, таблица 4, рисунки 1 и 2).
Рис. 3. Характеристики дискриминации SAPS 2 и SAPS 3.
SAPS 2 и SAPS 3 показали приемлемые характеристики распознавания с AUROC 0,71 (95% ДИ, 0,65–0,77) и 0,77 (95% ДИ, 0,72–0,82), соответственно, хотя между ними не было значительной разницы. оценки. Тем не менее, SAPS 3 продемонстрировал превосходную селективную способность на основе SMR по сравнению с SAPS 2.
https://doi.org/10.1371/journal.pone.0222164.g003
При раздельном рассмотрении SAPS 2 и SAPS 3 продемонстрировали одинаково стабильную эффективность как у нефрологических, так и у гастроэнтерологических / гепатологических пациентов. Однако SAPS 2 продемонстрировал плохие характеристики с точки зрения SMR в связи с печеночной недостаточностью, циррозом и сепсисом, которые представляли основные причины смертности. Фактически, наблюдаемая смертность от печеночной недостаточности, цирроза и сепсиса составила 62 человека.0%, 55,9% и 62,8% соответственно. Здесь прогнозируемые коэффициенты смертности по SAPS 2 составили 24,0% от печеночной недостаточности, 22,3% от цирроза и 17,6% от сепсиса, что привело к SMR 2,59, 2,51 и 3,57, соответственно (Таблица 5). В целом, SAPS 3 продемонстрировал более точный SMR для каждого из этих диагнозов вместе с прогнозируемой смертностью 51,8% от печеночной недостаточности, 50,0% от цирроза и 39,8% от сепсиса, что привело к SMR 1,2, 1,12 и 1,58 соответственно. (Таблица 5).
Обсуждение
У пациентов промежуточного звена предыдущие исследования выявили завышенную оценку смертности либо по шкале SAPS 2 [18–20], либо по шкале SAPS 3 [18], что в значительной степени согласуется с анализами, которые оценивали эти инструменты у пациентов с интенсивной терапией [6 , 7, 14–16].В настоящей работе мы сообщаем о значительной недооценке показателей смертности по шкале SAPS 2 у пациентов среднего звена с длительными или терминальными стадиями заболеваний печени и / или почек. На сегодняшний день SAPS 2 часто предлагается в качестве наиболее подходящего инструмента для прогнозирования смертности не только более ранними исследованиями в различных условиях интенсивной терапии [14, 16], но и недавним смешанным популяционным исследованием, проведенным на многоцелевой испанской ImCU [18] . Вопреки этим результатам, мы обнаружили несколько лучшую способность распознавания наряду с значительно более точными возможностями прогнозирования смертности для системы подсчета баллов SAPS 3.
Эти противоречивые результаты могут быть в частности связаны с уникальным сочетанием случаев в нашей исследуемой популяции. В отличие от трех ранее существовавших исследований ImCU [18–20] или оригинальных исследований, в которых были представлены системы балльной оценки SAPS 2 и SAPS 3 [26, 27], в наше исследование включались преимущественно пациенты с хроническими или терминальными заболеваниями почек и печени. Среди них кандидаты на трансплантацию или пациенты после SOT были представлены в высоком проценте. SAPS 3 включает больше переменных, связанных с желудочно-кишечными и печеночными расстройствами (GHD), т.е.е., цирроз, печеночная недостаточность, тяжелый панкреатит, острый живот, общий билирубин, тромбоциты и шкала комы Глазго (GCS) по сравнению с SAPS 2, которая учитывает только три параметра, связанные с GHD, то есть общий билирубин, GCS , и натрий. Таким образом, неудивительно, что SAPS 3 показал более высокую точность в прогнозировании смертности от печеночной недостаточности и цирроза, чем SAPS 2, в нашей когорте. Хотя Dupont et al. сообщили о противоречивых результатах у пациентов с циррозом, наши данные согласуются с недавним исследованием Alegre et al.это также свидетельствует о превосходных характеристиках теста SAPS 3 по сравнению с SAPS 2 у пациентов с циррозом печени [21, 34]. Кроме того, у пациентов с сепсисом подчеркиваются различия между результатами настоящего исследования и предыдущими исследованиями; здесь мы наблюдали наиболее выраженную недооценку риска смертности с использованием любого из этих показателей. Несмотря на то, что SAPS 3 показал лучшую производительность с точки зрения SMR по сравнению с SAPS 2, оба показателя были сочтены непригодными для адекватной оценки риска смерти среди пациентов с сепсисом в данной когорте.Однако из-за ограниченного размера выборки этой подгруппы этот результат следует рассматривать с осторожностью.
Что касается оценки качества калибровки, мы сознательно не использовали критерий согласия Хосмера-Лемешоу [35]. Несмотря на то, что этот тест часто использовался для проверки оценок прогнозируемого риска смертности [5–7, 10–12, 14, 15, 17, 18, 20, 26, 27], он также неоднократно подвергался критике за различные ограничения, связанные с его интерпретация. Например, C-тест согласия Хосмера-Лемешоу описывает только отклонения между наблюдаемой и ожидаемой смертностью, но не содержит информации об их направлении или величине и не определяет характеристики подгрупп или отдельных пациентов, которые вызывают такие отклонения [36, 37] .Более того, высокие значения P не обязательно являются свидетельством хорошей подгонки, так как многочисленные условия могут генерировать высокие значения P , включая низкую тестовую мощность [36, 38]. В отличие от C-критерия согласия Хосмера-Лемешоу, калибровочный пояс связывает логиты прогнозируемой и наблюдаемой смертности в полиномиальной функции, посредством чего доверительные интервалы могут быть вычислены и нанесены на график в виде одноименного калибровочного пояса [29, 30] . Графическая иллюстрация позволяет оценить степень соответствия без какой-либо контролируемой категоризации.Более того, направления и диапазоны плохих калибровок от идеальной подгонки модели могут быть непосредственно визуализированы. Калибровочный пояс уже был протестирован с помощью C-критерия согласия Хосмера-Лемешоу с аналогичными показателями ошибок типа I [30] и ранее использовался в аналогичном контексте исследования [16]. В целях сравнения мы по-прежнему применяли C-тест согласия Хосмера-Лемешоу и прилагали эти результаты в качестве вспомогательной информации (рис. S1 и S2) ниже. Фактически, используя этот метод, мы рассчитали приемлемые характеристики калибровки для обеих моделей прогнозирования.
Очевидно, мы согласны с Lucena et al. эти различия в комбинации гильз оказывают сильное влияние на калибровку и дискриминационные характеристики SAPS 2 и SAPS 3 [18]. Это соображение может получить дополнительную поддержку из нашей предыдущей работы, в которой была обнаружена более высокая эффективность SAPS 2 по сравнению с SAPS 3 у пациентов в отделении интенсивной терапии с интернистическими (преимущественно сердечно-сосудистыми) расстройствами в той же университетской больнице [14]. Следует отметить, что недавнее исследование, в котором анализировались данные трех отделений интенсивной терапии с более чем 2500 пациентами, пришло к выводу, что системы оценки с большим количеством переменных-предикторов (например, SAPS 3 по сравнению с SAPS 2), вероятно, позволят достичь лучших общих показателей по сравнению с теми, у кого меньше [13] .
Наконец, что важно, некоторые характеристики и ограничения настоящего исследования заслуживают особого внимания. Во-первых, как относительно небольшой размер выборки, так и уникальное сочетание случаев этого ретроспективного одноцентрового исследования могут привести к существенным различиям с точки зрения воспроизводимости оценок на основе SAPS 2 и SAPS 3 между нынешними и предыдущими когортами [18, 26, 27] . Более того, различные критерии приема и выписки, а также неоднородные модели работы персонала и / или сменной работы могут исказить или сильно конкретизировать наши выводы, что делает их, вероятно, не экстраполируемыми на другие популяции и условия ImCU.Именно в этом отношении заслуживает внимания тот факт, что у нашего ImCU было менее благоприятное соотношение медсестер и пациентов по сравнению с исследованием, проведенным Lucena et al [18], то есть 1: 4 против 1: 3, соответственно. Принимая во внимание почти равные баллы для SAPS 2 (31,4 ± 12,9 против 36,6 ± 11,9) и SAPS 3 (55,4 ± 12,9 против 58,4 ± 15,4), это состояние могло, по крайней мере, быть одной из причин более высоких показателей в стационаре. показатели смертности (30,2% против 20,1%), представленные в настоящем исследовании, по сравнению с исследованием Lucena et al [18].
Выводы
SAPS 3 (North Europe Logit) обеспечил хорошую дискриминацию и удовлетворительную калибровку и был очень точным при прогнозировании смертности в нашей когорте взрослых, госпитализированных в ImCU, из-за хронических или терминальных почечных или желудочно-кишечных / печеночных заболеваний.SAPS 2 оказался менее подходящим для оценки риска в этих условиях из-за заметной недооценки смертности по сравнению с SAPS 3. Несмотря на большое количество ранее существовавших валидационных исследований для SAPS 2 и SAPS 3 у пациентов в отделении интенсивной терапии и (в меньшей степени также) in) Пациенты ImCU, прогностическая эффективность этих инструментов остается непоследовательной и, по-видимому, сильно зависит от переменных показателей сочетания случаев и других специфических характеристик в палатах [10, 14, 18, 26, 27]. Более того, системы оценки со временем устаревают по мере изменения популяций и структур ImCU; эта судьба определяется развитием диагностических, терапевтических, технологических и экономических средств или стратегий, которые влияют на результаты лечения и смертность.Таким образом, настоящие результаты не могут быть легко распространены на другие группы населения. В частности, низкая эффективность SAPS 2 при сепсисе и острых и / или хронических заболеваниях печени, наблюдаемая в нашем анализе, подчеркивает необходимость дальнейшей и более широкой проверки этих и других прогностических показателей интенсивной терапии в различных условиях и группах ImCU во время более крупных, перспективных и хороших результатов. -проектированные этюды.
Вспомогательная информация
S1 Рис. Калибровочная кривая на основе C-теста Хосмера и Лемешоу для SAPS 2.
Калибровочные характеристики для SAPS 2 (χ2 = 3,08; P = 0,876). Обратите внимание, что высокое значение p (> 0,05) указывает на хорошо откалиброванную модель. Калибровочные кривые были построены путем нанесения прогнозируемой смертности (ось x) против наблюдаемой смертности (ось y).
https://doi.org/10.1371/journal.pone.0222164.s001
(TIF)
S2 Рис. Калибровочная кривая на основе C-теста Хосмера и Лемешоу для SAPS 3.
Калибровочные характеристики для SAPS 3 (χ2 = 11.09; P = 0,196). Обратите внимание, что высокое значение p (> 0,05) указывает на хорошо откалиброванную модель. Калибровочные кривые были построены путем нанесения прогнозируемой смертности (ось x) против наблюдаемой смертности (ось y).
https://doi.org/10.1371/journal.pone.0222164.s002
(TIF)
Благодарности
Это исследование посвящено памяти Оливера Куосдорфа (†), который не смог увидеть завершение своей докторской диссертации, но был одним из главных людей, участвовавших в начале этого исследования.
Ссылки
- 1. Арзено Н.М., Лоусон К.А., Дузински С.В., Викало Х. Разработка оптимальных показателей прогнозирования риска смертности, сохраняющих клинические знания. Дж Биомед Информ. 2015; 56: 145–56. pmid: 26056073
- 2. Метниц Б., Шаден Е., Морено Р., Ле Галл-младший, Бауэр П., Метниц П. Г.. Австрийская проверка и настройка вступительного балла SAPS 3. Intensive Care Med. 2009. 35 (4): 616–22. pmid: 18846365
- 3. Пул Д., Росси С., Ангилери А., Джардино М., Латронико Н., Радриззани Д. и др.Внешняя проверка упрощенной оценки острой физиологии (SAPS) 3 в когорте из 28 357 пациентов из 147 итальянских отделений интенсивной терапии. Intensive Care Med. 2009. 35 (11): 1916–24. pmid: 19685038
- 4.
Винсент Дж. Л., Морено Р. Клинический обзор: системы оценки в критических состояниях. Crit Care. 2010; 14 (2): 207. pmid: 203
- 5. Мартинес-Урбистондо Д., Алегре Ф., Кармона-Торре Ф., Уэрта А., Фернандес-Рос Н., Ландехо М. Ф. и др. Прогнозирование смертности у пациентов, перенесших неинвазивную вентиляцию легких в промежуточной медицинской помощи.PLoS One. 2015; 10 (10): e0139702. pmid: 26436420
- 6. Морено Р., Мораиш П. Прогнозирование исходов в отделении интенсивной терапии: результаты проспективного многоцентрового исследования в Португалии. Intensive Care Med. 1997. 23 (2): 177–86. pmid:
- 7. Strand K, Soreide E, Aardal S, Flaatten H. Сравнение SAPS II и SAPS 3 в норвежском отделении интенсивной терапии. Acta Anaesthesiol Scand. 2009. 53 (5): 595–600. pmid: 19419352
- 8. Ричардсон Д.Б., Кейл А.П., Четген Четген Э., Купер Г.Результаты отрицательного контроля и анализ стандартизированных коэффициентов смертности. Эпидемиология. 2015; 26 (5): 727–32. pmid: 26172862
- 9. Купер Л.М., Линде-Цвирбл В.Т. Использование отделения интенсивной терапии Medicare: анализ заболеваемости, стоимости и оплаты. Crit Care Med. 2004. 32 (11): 2247–53. pmid: 15640637
- 10.
Нассар А.П., Мальбуиссон Л.М., Морено Р. Оценка эффективности 3 балла по упрощенной острой физиологии: систематический обзор исследований внешней валидации. Crit Care.2014; 18 (3): R117. pmid: 24
1 - 11. Метниц П.Г., Валентин А., Веселы Х., Альберти С., Ланг Т., Ленц К. и др. Прогностическая производительность и настройка SAPS II: результаты многоцентрового австрийского исследования. Упрощенная оценка острой физиологии. Intensive Care Med. 1999. 25 (2): 192–7. pmid: 10193547
- 12. Sakr Y, Krauss C, Amaral AC, Rea-Neto A, Specht M, Reinhart K и др. Сравнение эффективности SAPS II, SAPS 3, APACHE II и их индивидуальных прогностических моделей в хирургическом отделении интенсивной терапии.Br J Anaesth. 2008. 101 (6): 798–803. pmid: 18845649
- 13. Киган М.Т., Гаджик О., Афесса Б. Сравнение APACHE III, APACHE IV, SAPS 3 и MPM0III и влияние статуса реанимации на работу модели. Грудь. 2012. 142 (4): 851–8. pmid: 22499827
- 14. Кацунас А., Камачарова И., Тычински Б., Эггебрехт Х., Эрбель Р., Канбай А. и др. Прогностическая эффективность систем оценки SAPS II и SAPS 3: ретроспективный анализ. J Crit Care. 2016; 33: 180–5.pmid: 26883275
- 15. Capuzzo M, Scaramuzza A, Vaccarini B, Gilli G, Zannoli S, Farabegoli L и др. Проверка допуска к SAPS 3 и сравнение с SAPS II. Acta Anaesthesiol Scand. 2009. 53 (5): 589–94. pmid: 19419351
- 16. Пул Д., Росси С., Латронико Н., Росси Г., Финацци С., Бертолини Г. Сравнение SAPS II и SAPS 3 при прогнозировании больничной смертности в когорте из 103 итальянских отделений интенсивной терапии. Всегда ли новое лучше? Intensive Care Med. 2012. 38 (8): 1280–8.pmid: 22584793
- 17. Метниц П.Г., Ланг Т., Веселы Х., Валентин А., Ле Галл-младший. На соотношение наблюдаемой и ожидаемой смертности влияют различия в составе случаев и качестве помощи. Intensive Care Med. 2000. 26 (10): 1466–72. pmid: 11126258
- 18. Лусена Дж. Ф., Алегре Ф., Мартинес-Урбистондо Д., Ландехо М. Ф., Уэрта А., Гарсия-Моурис А. и др. Показатели SAPS II и SAPS 3 при промежуточном уходе. PLoS One. 2013; 8 (10): e77229. pmid: 24130860
- 19. Лусена Дж. Ф., Алегре Ф., Родил Р., Ландечо М. Ф., Гарсия-Моурис А., Маркес М. и др.Результаты ретроспективного обсервационного исследования промежуточной медицинской помощи, укомплектованной госпиталистами: влияние на смертность, совместное ведение и обучение. J Hosp Med. 2012; 7 (5): 411–5. pmid: 22271454
- 20. Auriant I, Vinatier I, Thaler F, Tourneur M, Loirat P. Упрощенная оценка острой физиологии II для измерения тяжести заболевания в отделениях промежуточной медицинской помощи. Crit Care Med. 1998. 26 (8): 1368–71. pmid: 9710096
- 21. Dupont B, Delvincourt M, Kone M, du Cheyron D, Ollivier-Hourmand I, Piquet MA и др.Ретроспективная оценка прогностических показателей у пациентов с циррозом печени, поступивших в отделение промежуточной медицинской помощи. Dig Liver Dis. 2015; 47 (8): 675–81. pmid: 25937626
- 22. Capuzzo M, Volta C, Tassinati T, Moreno R, Valentin A, Guidet B и др. Больничная смертность взрослых, госпитализированных в отделения интенсивной терапии в больницах с отделениями промежуточной терапии и без них: многоцентровое европейское когортное исследование. Crit Care. 2014; 18 (5): 551. pmid: 25664865
- 23. Хамсен У., Леферинг Р., Фисан К., Шильдхауэр Т.А., Вайдхас К.Рабочая нагрузка и тяжесть заболевания пациентов в отделениях интенсивной терапии с доступными отделениями промежуточной помощи: многоцентровое когортное исследование. Минерва Анестезиол. 2018; 84 (8): 938–45. pmid: 29469547
- 24. Plate JDJ, Leenen LPH, Houwert M, Hietbrink F. Использование отделений промежуточной медицинской помощи: систематический обзор. Crit Care Res Pract. 2017; 2017: 8038460. pmid: 28775898
- 25. Армстронг Э., де Ваард М.С., де Грот Х.Дж., Хейманс М.В., Рейс Миранда Д., Гирбес А.Р. и др. Использование шкалы сестринской деятельности для оценки медсестринской нагрузки в среднем отделении.Anesth Analg. 2015; 121 (5): 1274–80. pmid: 26484461
- 26. Морено Р.П., Метниц П.Г., Алмейда Э., Джордан Б., Бауэр П., Кампос Р.А. и др. SAPS 3 — От оценки состояния пациента до оценки в отделении интенсивной терапии. Часть 2: Разработка прогностической модели госпитальной смертности при поступлении в ОИТ. Intensive Care Med. 2005. 31 (10): 1345–55. pmid: 16132892
- 27. Le Gall JR, Lemeshow S, Saulnier F. Новая упрощенная оценка острой физиологии (SAPS II), основанная на многоцентровом исследовании в Европе / Северной Америке.ДЖАМА. 1993; 270 (24): 2957–63 pmid: 8254858
- 28. Хэнли Дж. А., Макнил Б. Дж. Значение и использование площади под кривой рабочей характеристики приемника (ROC). Радиология. 1982. 143 (1): 29–36. pmid: 7063747
- 29. Finazzi S, Poole D, Luciani D, Cogo PE, Bertolini G. Калибровочный пояс для оценки качества медицинской помощи на основе дихотомических результатов. PLoS One. 2011; 6 (2): e16110. pmid: 21373178
- 30. Наттино Г., Финацци С., Бертолини Г. Новый тестовый и графический инструмент для оценки соответствия моделей логистической регрессии.Статистика в медицине. 2016; 35 (5): 709–20. pmid: 26439593
- 31. Глава 1: Определение и классификация ХБП. Международные добавки почек. 2013. 3 (1): 19–62. pmid: 25018975
- 32. Раздел 2: Определение AKI. Международные добавки почек. 2012. 2 (1): 19–36. pmid: 25018918
- 33. Леви М.М., Финк М.П., Маршалл Дж. К., Абрахам Э., Ангус Д., Кук Д. и др. 2001 SCCM / ESICM / ACCP / ATS / SIS Международная конференция по определениям сепсиса. Intensive Care Med.2003. 29 (4): 530–8. pmid: 12664219
- 34. Алегре Ф., Уэрта А., Ландечо М. Ф., Лусена Дж. Ф. Комментарий к статье Benoit Dupont et al. «Ретроспективная оценка прогностических показателей у пациентов с циррозом печени, поступивших в отделение промежуточной помощи». [Заболевания пищеварения и печени, 2015; 47: 675–81]. Dig Liver Dis. 2016; 48 (2): 209–10. pmid: 26853043
- 35. Lemeshow S, Hosmer DW Jr. Обзор качества соответствия статистики для использования при разработке моделей логистической регрессии.Am J Epidemiol. 1982; 115 (1): 92–106. pmid: 7055134
- 36. Kramer AA, Zimmerman JE. Оценка калибровки показателей смертности в отделениях интенсивной терапии: еще раз о тесте Хосмера-Лемешоу. Crit Care Med. 2007. 35 (9): 2052–6. pmid: 17568333
- 37. Бертолини Дж., Д’Амико Р., Нарди Д., Тинацци А., Аполон Г. Одна модель, несколько результатов: парадокс критерия согласия Хосмера-Лемешоу для модели логистической регрессии. J Epidemiol Biostat. 2000. 5 (4): 251–3. pmid: 11055275
- 38.Сюй В., Чжу Л. Модифицированный тест Хосмера – Лемешоу для больших наборов данных AU — Yu, Wei. Коммуникации в статистике — теория и методы. 2017; 46 (23): 11813–25.
Swiss Medical Weekly — SwissScoring — общенациональное исследование практики оценки SAPS II и ее точности
Марко Превисдомини a , Бернар Черутти b , Паоло Мерлани c , Марк Кауфманн d , Элизабет ван Гессель e , Ганс Ульрих Ротен f , Андреас Перрен a 9000 9000
Резюме
ЦЕЛЬ: Первое описание упрощенной оценки острой физиологии (SAPS) II датируется 1993 годом, но мало что известно о ее точности в повседневной практике.Нашей целью было оценить точность подсчета баллов и факторы, влияющие на нее, в общенациональном опросе.
МЕТОДЫ. Двадцать клинических сценариев, охватывающих широкий диапазон тяжести заболевания, были случайным образом распределены среди удобной выборки врачей или медсестер в швейцарских отделениях интенсивной терапии для взрослых (ОИТ), которым было предложено оценить балл SAPS II для одного сценария. Эти данные сравнивали с эталоном, составленным пятью опытными исследователями. Результаты были сопоставлены с демографическими характеристиками и данными по обучению и контролю качества для оценки, структурных и организационных свойств каждого участвующего отделения интенсивной терапии.
РЕЗУЛЬТАТЫ. В общей сложности 345 лиц, осуществляющих уход из 53 взрослых поставщиков интенсивной терапии, завершили оценку одного клинического сценария SAPS II. Средний балл по шкале SAPS II составил 42,6 ± 23,4 со смещением +5,74 (95% ДИ 2,0–9,5) по сравнению с эталонным баллом. Не было доказательств вариации систематической ошибки в зависимости от тяжести случая, размера отделения интенсивной терапии, языковой области, профессии (врач или медсестра), опыта, начального обучения SAPS II или наличия системы контроля качества.
ЗАКЛЮЧЕНИЕ. Это общенациональное исследование выявило существенные различия в результатах оценки SAPS II.В среднем оценка SAPS II была завышена более чем на 13%, независимо от профессии, опыта и структурных характеристик отделений интенсивной терапии.
Ключевые слова: SAPS II; оценка серьезности; точность; Швейцарский DRG
Список сокращений
Шкала комы GCS Глазго
G-DRG Немецкие группы, связанные с диагностикой
Коэффициент внутриклассовой корреляции ICC
Отделение интенсивной терапии ICU
Межквартильный диапазон IQR
NEMS Девять эквивалентов оценки использования сестринского персонала
Система управления данными пациента PDMS
SAPS II Упрощенная оценка острой физиологии II
SAPS III Упрощенная оценка острой физиологии III
SD Стандартное отклонение
Оценка последовательной органной недостаточности SOFA
SwissDRG Швейцарские диагностические группы
Введение
Упрощенная оценка острой физиологии II (SAPS II) в течение многих лет использовалась для клинических исследований и оценки качества в европейских отделениях интенсивной терапии (ICU) [1–3].Его первоначальная цель заключалась в оценке риска госпитальной смертности для пациентов, поступивших в отделение интенсивной терапии, на основе заданных характеристик, выбранных из большой выборки медицинских и хирургических случаев и оцененных с помощью анализа логистической регрессии [4]. Оценка присваивается через 24 часа после поступления в отделение интенсивной терапии и варьируется от 0 до 163 баллов в зависимости от возраста, типа госпитализации, наличия определенных хронических заболеваний и наихудшего наблюдаемого значения из 12 клинических пунктов, связанных с функцией органов [4 , 5].
Вероятно, что это все еще наиболее часто используемый инструмент корректировки степени тяжести для исследований в Европе, даже несмотря на то, что была разработана новая шкала оценки степени тяжести (SAPS III) [6, 7]. Более того, SAPS II используется для расчета степени возмещения больничных расходов пациентам отделений интенсивной терапии в Германии (G-DRG) и Швейцарии (SwissDRG) [8, 9]. SAPS II также является ключевым показателем процесса минимального набора данных Swiss ICU, инструмента контроля качества, который является обязательным для всех сертифицированных ICU в Швейцарии [10].
Подавляющее большинство информации о степени тяжести было получено в ходе исследования и основано на значениях, записанных специально обученным персоналом. Имеется мало данных о качестве оцененного SAPS II, поскольку он используется в отделениях интенсивной терапии [11–13]. Небольшой ретроспективный многоцентровый аудит, проведенный в Южной Швейцарии, показал, что точность баллов по шкале SAPS II, оцениваемых медсестрами интенсивной терапии, довольно низкая [14]. Однако неизвестно, могут ли такие результаты быть подтверждены на более широкой выборке поставщиков медицинских услуг ICU с различным профессиональным и культурным опытом.Более того, на процесс подсчета очков могут влиять различные организации или структуры в отделении интенсивной терапии.
Основная цель этого общенационального опроса состояла в том, чтобы изучить надежность и точность баллов по шкале SAPS II, записанных лицом, осуществляющим уход, путем оценки разницы между ними и эталонными значениями, установленными пятью авторами исследования. В качестве второстепенной цели мы исследовали потенциальную связь между предвзятостью и характеристиками как отделения интенсивной терапии, так и персонала.
Методы
Общий план исследования
Это исследование было основано на онлайн-опросах, которые самостоятельно заполняли главные врачи интенсивной терапии и прикроватный персонал интенсивной терапии.Два этапа сбора данных, описанные ниже, были выполнены в период с апреля по июнь 2012 года.
полноэкранный полноэкранный Рисунок 1 A Взаимосвязь между оценщиком, оценивающим баллы SAPS II, и эталонным значением. Точки обозначают каждое сделанное наблюдение, то есть оценку, выставленную каждым участником (значение y) по сравнению с контрольным значением (значение x). 16 значений, сгруппированных по вертикали, представляют собой эталонные значения для 20 случаев, которые были оценены участниками (в некоторых случаях был одинаковый эталонный балл SAPS II).Непрерывная линия была дополнена линейным смешанным эффектом после выбора модели. Пунктирные линии обозначают 95% доверительный интервал вокруг подобранной линии. B График Бланда-Альтмана, показывающий взаимосвязь между разницей между наблюдаемыми и контрольными значениями и средним значением контрольного и наблюдаемого значений. Пунктирные линии показывают среднюю разницу ± 1,96 стандартного отклонения.В первом опросе руководителям сертифицированных взрослых швейцарских отделений интенсивной терапии было предложено заполнить онлайн-анкету, доступную на трех национальных языках (немецком, французском и итальянском).36 пунктов в анкетах включали вопросы о социально-демографических характеристиках и профессиональной квалификации (6 пунктов), структуре и организации интенсивной терапии (7 пунктов), процедурах оценки SAPS II и обучении для оценки SAPS II (23 пункта).
На втором этапе , сотрудников, которые обычно участвуют в подсчете баллов по шкале SAPS II, были приглашены руководителями отделений интенсивной терапии к участию в онлайн-опросе по оценке показателей по шкале SAPS II. Если они соглашались, они получали ссылку для доступа к опросу с 6-значным ключевым кодом, известным только статистику, отвечающему за анализ, что позволило бы сопоставить данные с центрами.Онлайн-анкета, включающая 11 пунктов (два социально-демографических пункта, четыре пункта о квалификации и обучении по SAPS II и пять пунктов о процедурах оценки по SAPS II) сопровождалась одним (из 20) случайно выбранным клиническим сценарием, по которому участник получил оценку. SAPS II. В каждом сценарии описывался гипотетический пациент с указанием причин госпитализации в отделение интенсивной терапии (дополнительный файл 1) и включались диаграммы с жизненно важными параметрами, лабораторными значениями, деталями вентиляции и введенными лекарствами.Сценарии были разработаны для отображения клинических ситуаций и последовательностей событий, которые обычно наблюдаются в отделениях интенсивной терапии взрослых в Швейцарии, а также для охвата большого диапазона баллов по шкале SAPS II. Контрольные значения для каждого сценария были установлены пятью разными авторами исследования, которые присваивали баллы отдельно. Различия обсуждались до тех пор, пока не был достигнут консенсус по 15 пунктам и не был достигнут общий балл.
Лица, осуществляющие уход из центров, где оценка SAPS II была записана на основе значений, предоставленных системой управления данными пациентов (PDMS), также получили случайно выбранный сценарий, но он был представлен в специальной цифровой схеме с использованием Centricity Critical Care (версия 7.0 SP3, General Electric Healthcare, Баррингтон, Иллинойс, США) или MetaVision (версия 5.46.44, iMDSoft, Нидхэм, Массачусетс, США). Цель заключалась в том, чтобы предложить участникам ту же систему, которую они использовали в своей текущей клинической практике. Участникам было предложено вести свои дела в обычном режиме и без внешней поддержки.
Для каждого ОИТ следующие ключевые показатели, связанные со структурой, были получены из национального минимального набора данных ОИТ: среднее значение SAPS II, количество коек в отделении и количество пациентов в год.
Цели и дизайн этого исследования по обеспечению качества были представлены Исполнительному комитету Швейцарского общества интенсивной терапии, который одобрил проект. Анонимность участвующих лиц, осуществляющих уход, и безопасность данных были обеспечены. Кантональный комитет по этике Тичино (6500 Беллинцона, Швейцария) одобрил протокол и отказался от необходимости получения информированного согласия.
статистический анализ
Предыдущие исследования показали, что коэффициент корреляции внутри класса (ICC) равен 0.8–0,9 по сумме баллов SAPS II [11, 14, 15]. Учитывая ICC (как показатель надежности) 0,7 как самый низкий приемлемый порог и стремясь к ICC 0,85 (середина диапазона «средний — хороший»), размер выборки из 20 клинических сценариев, каждый из которых оценивался по 10 раз. считалось необходимым для обнаружения разницы между 0,7 и 0,85 с мощностью 80% и коэффициентом ошибок типа I 0,05 [16].
Взвешенные значения каппа использовались для установления надежности между показателями для пунктов SAPS II (категориальные меры) [17, 18] и коэффициентом внутриклассовой корреляции (ICC) для оценки SAPS II (непрерывный показатель) [19, 20].Доля согласия оценщика, как мера точности, была рассчитана путем сравнения каждого оценщика с эталонным значением. Модели линейных смешанных эффектов (клинические сценарии были приняты как случайные эффекты) использовались для исследования потенциальных связей между систематической ошибкой (т. Е. Разницей между наблюдаемым значением и эталонным значением) и несколькими структурными и индивидуальными ковариатами с использованием прямого выбора (log- тест отношения правдоподобия; см. список в дополнительном файле 2). График Блэнда и Альтмана использовался для визуализации систематической ошибки и пределов согласия между суммарными оценками SAPS II [21].Взвешенная госпитальная смертность рассчитывалась на основе исходного уравнения [4]. Дополнительные проверки качества результатов клинических сценариев, чтобы исключить дисбаланс из-за перевода, включали анализ дисперсии суммарных баллов SAPS между языковыми регионами.
Непрерывные переменные были выражены как среднее ± стандартное отклонение (SD), если не указано иное, или медиана с межквартильным диапазоном (IQR) для сильно асимметричных данных. Категориальные переменные были представлены с количеством наблюдений и процентным соотношением.Результат, связанный со значением p ниже 0,05, считался значимым.
Независимый статистик занимался обработкой данных и статистическим анализом. Сбор данных производился с помощью SurveyMonkey ® , Пало-Альто, Калифорния, США. Все анализы были выполнены с помощью TIBCO Spotfire S + ® 8.1 для Windows, TIBCO Software Inc., Пало-Альто, Калифорния, США.
Таблица 1: Характеристики участников исследования, получивших оценку SAPS II. Характеристика Категории Оценка участников (n = 345, 53 отделения интенсивной терапии) Возраст ≤45 лет 273 (79%) 273 (79%) –55 лет 60 (17%) ≥56 лет 11 (3%) Лингвистический регион ОИТ Немецкий 210 (61%) Французский (16%) Итальянский 79 (23%) Пол Мужской 161 (47%) Женский 183 (53%) Должность 90-389 90Консультант 81 (23%) Врач-ординатор 137 (40%) RN с сертификатом для реанимации 93 (27%) 90 394Другое 33 (10%) Опыт работы с SAPS II ≤3 месяцев 63 (18%) > 3, ≤12 месяцев 70 (20%) > 12 месяцев 207 (60%) Частота подсчета баллов SAPS II Ежедневно 144 (42%) Не реже одного раза в неделю 111 (32% ) Менее одного раза в неделю 84 (24%) Данные в n (%).RN = медсестра.
Отсутствующие значения: Возраст 1; Лингвистический регион 0; Пол 1; Позиция-квалификация 1; Опыт работы с SAPS II 5; Частота подсчета баллов SAPS II 6.Таблица 2: Достоверность авторов для отдельных пунктов оценки SAPS II. Элемент Каппаа Среднее соответствиеb Полное согласиеc Пульс 0.544 80% 45% Систолическое артериальное давление 0,683 89% 65% Температура 0,767 96% 9039 9039 9039 9039 Oxygenation 0,699 87% 65% Выделение с мочой 0,782 96% 80% Мочевина 0,812 85% 9039% Лее .836 96% 85% Калий 0,763 97% 90% Натрий 0,543 94% 75% Bicar 91% 70% Билирубин 1.000 100% 100% Шкала комы Глазго 0,583 90% 9039 9039 9039 9039 9039 9039 0900 96% 85% Хронические заболевания 0,789 96% 85% Тип госпитализации 0,877 96% 80396 Утяжеленная каппа Флейса. b Средняя доля согласия среди 5 авторов по сравнению с эталонным значением. c Процент полного согласия между 5 авторами по сравнению с эталонным значением. Полученные результаты
Общие данные ICU, практика и обеспечение качества, используемые для присвоения баллов SAPS II
В 2011 году 78 отвечающих критериям взрослых отделений интенсивной терапии, признанных Швейцарским обществом интенсивной терапии [22], имели средний балл по шкале SAPS II 30 ± 17. Среди всех опрошенных отделений 63 (81%) дали свое согласие на участие в работе руководителей отделений интенсивной терапии. опрос. Возраст участников составлял от 46 до 55 лет в 63% случаев, моложе — в 16% и старше — в 21% соответственно.Лингвистические регионы были представлены следующим образом: 45 участников (71%) из немецкой части, 14 (23%) из французского региона и 4 (6%) из итальянско-говорящей части Швейцарии. «Напоминание» для оценки SAPS II было доступно в 87% отделений интенсивной терапии, которое было активировано в 24-часовой срок (16%), на следующий день (22%) или позже (62%). Приблизительно 68% отделений интенсивной терапии имели систему контроля качества, но подавляющее большинство отделений интенсивной терапии (87%) никогда не проходили аудит качества оценки SAPS II.
Воспитатели, получившие оценку SAPS II
В общей сложности 345 участников из 53 отделений интенсивной терапии выполнили оценку SAPS II одного клинического сценария (таблица 1).В основном это были женщины, и большинство из них работали врачами (немцы: 91%; французы: 41%; итальянцы: 6%; p <0,001). Около двух третей респондентов (63%) прошли обучение у коллег, одну треть обучил их руководитель, только 5% прошли структурированное обучение и 12% узнали из руководства (разрешалось несколько ответов). Всего было 116 участников из отделений интенсивной терапии, оснащенных PDMS.
Эталонные значения SAPS II
Двадцать клинических сценариев оценивали пять авторов исследования.Средний балл по шкале SAPS II составлял 35 ± 21, а минимальный-максимальный (медиана) составлял 6–79 (27). Согласие по сумме баллов между пятью авторами было отличным (ICC = 0,941). В таблице 2 показана надежность авторов по отдельным оцениваемым пунктам.
Оценка клинических сценариев SAPS II
Каждый клинический сценарий оценивался от 10 до 26 раз (дополнительный файл 1 http://www.smw.ch/content/SMW_14090_Supplementary_file_1.pdf). Среди 345 респондентов средний балл по SAPS II составил 42,56 ± 23,38, при ICC 0,79, смещение +5,74 (95% ДИ от 2,00 до 9,48) по сравнению с контрольными значениями (дополнительный файл 3 http: //www.smw .ch / content / SMW_14090_Supplementary_file_3.pdf) и никаких свидетельств вариации в зависимости от серьезности случая ( p = 0,195; рис. 1). (Взвешенное) среднее прогнозируемое значение смертности составило 33,4 ± 33,0% против 27,1 ± 31,6% от контрольного значения ( p = 0,011, разница = 6,3% ± 20%).Не было доказательств связи между систематической ошибкой и размером ОИТ и другими структурными или организационными особенностями ОИТ (таблица 3). Аналогичные результаты были получены для демографических характеристик участников (таблица 4), типа начального обучения SAPS II ( p = 0,164) и метода, использованного для подсчета баллов ( p = 0,759).
Только 7,8% (27/345) случаев с рейтингом соответствовали справочному значению по каждому пункту. Билирубин , температура и хроническое заболевание были наиболее точно оцененными пунктами (93%, 93% и 91% соответственно), тогда как наименьшее согласие было обнаружено для выделения мочи и шкалы комы Глазго (63% и 64%).Средневзвешенная каппа составила 0,47 с лучшими значениями для возраста (0,77) и самыми низкими для диурез и натрия (0,20 и 0,28, дополнительный файл 4 http://www.smw.ch/content/SMW_14090_Supplementary_file_4.pdf ).
Таблица 3 : Взаимосвязь между систематической ошибкой оценки (оценка по сравнению с контрольной суммой) и структурными данными интенсивной терапии. Характеристика Категории Смещение p-valuea Среднее годовое значение SAPS II в 2011 году (в точках) ≤29 5.0 ± 12,9 0,431 > 29 и ≤32 5,1 ± 13,5 > 32 6,6 ± 14,6 Количество коек на блок6 5,6 ± 13,5 0,884 9–15 6,5 ± 13,9 > 15 2,9 ± 12,9 Число пациентов / год 3 ± 14,2 0,537 801–1200 6,4 ± 12,6 > 1,200 2,9 ± 14,0 Старшие врачи 7,6 ± 12,8 0,533 > 1 и ≤3 4,9 ± 13,2 > 3 5,6 ± 14,3 Количество жителей в дневную смену39 (FTE) ≤1 5.5 ± 12,5 0,233 > 1 и ≤2 6,0 ± 14,8 > 2 4,1 ± 12,9 Наличие выделенного резидента 9039 903 во время вечерней смены39 5,0 ± 13,5 0,410 Нет 5,7 ± 13,7 Наличие выделенного резидента во время ночной смены Да 5,6 ± 13.9 0,685 Нет 5,3 ± 13,4 Принадлежность к ICU независимая 6,2 ± 13,1 0,133 9039 независимая 3,38394 9039 9039 9039 9039 Метод сбора данных SAPS II полуавтоматический / автоматический с помощью PDMS 2,3 ± 18,8 0,459 ручной 5,8 ± 13,1 Наличие контроля качества Да 6393 3 ± 13,70,998 Нет 4,8 ± 14,1 Наличие механизма обратной связи Да 5,6 ± 14,3 0,360 9039 тест логарифмического отношения правдоподобия . FTE = эквивалент полной занятости; PDMS = система управления данными пациентов. Таблица 4: Взаимосвязь между систематической погрешностью при подсчете баллов (количество баллов vs.справочная сумма баллов) и личностные характеристики. Характеристика Категории Смещение p-valuea Пол Женский 6,6 ± 14,2 9039 9039 4,1639Возраст ≤ 45 лет 5,3 ± 13,8 0,652 46–55 лет 5.2 ± 12,4 ≥56 лет 8,8 ± 13,8 Профессия Старший врач 3,7 ± 10,8 0,328 RN с сертификатом для интенсивной терапии 8,0 ± 13,4 Другое 6,4 ± 13,4 Язык Немецкий 4.0 ± 13,7 0,209 Французский 7,6 ± 13,0 Итальянский 7,7 ± 13,3 Опыт работы с SAPS II 2,8 мес,7 0,758 > 3, ≤12 месяцев 5,2 ± 13,8 > 12 месяцев 6,0 ± 12,4 Частота оценки SAPS II 4 Ежедневно .4 ± 12,6 0,720 Не реже одного раза в неделю 6,0 ± 14,9 Реже одного раза в неделю 5,8 ± 12,5 .
RN = медсестра.Обсуждение
Основным выводом этого исследования была общая переоценка SAPS II персоналом интенсивной терапии.Теоретически, с точки зрения прогнозирования смертности изменение из-за систематической ошибки в 5 баллов будет зависеть от фактической оценки и от состава анализируемой выборки. В очень низком диапазоне (SAPS II ≤20) и в самом высоком диапазоне SAPS II (≥80) влияние систематической ошибки будет минимальным, тогда как в среднем диапазоне (30–60 баллов) оно будет определенно выше. Следовательно, актуальность явно зависит от спектра острого заболевания. В нашем исследовании это привело к увеличению прогнозируемой смертности на 6 человек.3%, что, на наш взгляд, малоприемлемо для сравнительного анализа, но кажется чрезмерным для клинических исследований.
С 2012 года SAPS II стала компонентом специальной кодификации ICU (система SwissDRG) для тяжелых пациентов, у которых много ресурсов. С этой целью оценка, которая оценивается в конце первых 24 часов, добавляется к совокупному результату оценки NEMS, которая является инструментом для количественной оценки медсестринской нагрузки на уровне ОИТ [23] и рассчитывается (варьируется от 0 до 56 баллов) в конце каждой восьмичасовой смены в течение всего пребывания в отделении интенсивной терапии.Этот вид кодификации актуален только для стоимостного веса выше 500 баллов [9]. Таким образом, с точки зрения текущей практики кодирования для SwissDRG, предвзятость может считаться несущественной. Тем не менее, нельзя рекомендовать более широкое использование SAPS II (например, интеграция повседневной оценки SAPS II — без GCS — как в немецкой системе G-DRG) [8].
Средневзвешенное значение каппа составляло 0,47, что на основании критериев, предложенных экспертами, оценивает надежность оценки SAPS II среди наших участников как от умеренной до умеренной [17, 18].В соответствии с существующими знаниями, менее надежными переменными были те, которые требовали вычислений ( оксигенация соотношение и диурез ), оценки или выполнения какого-либо определения со стороны оценщика (Шкала комы Глазго) [24] . Например, ошибки для диуреза были вызваны неправильным расчетом или пренебрежительной экстраполяцией общего диуреза, когда пациенты были выписаны из отделения интенсивной терапии до 24-часового срока. Шкала комы Глазго, — хорошо известный источник ошибок. , дают большую часть завышенной суммы баллов в результате неправильной оценки пациентов с седативным действием при интубации трахеи [25–27].
Интересно, что наблюдаемая предвзятость не зависела от личных характеристик участников, а также от структурных или организационных особенностей отделения интенсивной терапии. Наши результаты дополняют выводы ретроспективного многоцентрового аудита эффективности SAPS II, зарегистрированного медсестрой [14].
Некоторая вариабельность присуща подсчету, примерно 10-15%, как было показано для APACHE II при тестировании внутрииндивидуальной вариабельности [28]. Тем не менее, наши данные показывают, что есть возможности для улучшения, особенно по сравнению с исследованием, проведенным в девяти голландских отделениях интенсивной терапии, которое показало незначительную систематическую ошибку, равную 0.4 [12]. В этих отделениях интенсивной терапии применялся реестр NICE, в котором реализовано множество процедур (например, словарь данных с четкими определениями элементов, обязательное обучение, автоматическая проверка качества и автоматический выбор переменных с помощью компьютерного алгоритма), направленных на повышение качества. данных. Другое исследование показало, что вариабельность результатов оценки острой физиологии и хронического здоровья (APACHE) II у разных наблюдателей снижается при соблюдении строгих рекомендаций и программы обучения [29].
Точно так же Швейцарское общество интенсивной терапии может рассмотреть вопрос об изменении правил сертификации отделений. Они могут включать требование четкого описания местной ответственности за качество ключевых показателей процесса, например, путем назначения одного обученного представителя в каждом отделении интенсивной терапии с задачей обучения персонала отделений интенсивной терапии. Новые сотрудники должны получить обязательное конкретное введение и должны быть обеспечены официальными руководствами, содержащими все определения SAPS II.Кроме того, может быть определена частота обучения или обсуждения конкретных случаев в отделениях интенсивной терапии. Кроме того, необходимо постоянно проверять качество собранных данных, например, путем обязательных и задокументированных выборочных проверок. Автоматическое извлечение переменных из PDMS возможно и может способствовать повышению точности оценки, в зависимости от применяемых процедур проверки [12, 30]. Фактически, это уже происходит в большинстве крупных больниц. Однако по сравнению с ручным сбором данных он создает новые проблемы из-за более высокой частоты дискретизации (например,грамм. измерения артериального давления), которые, как было показано, приводят к более высоким баллам и более низкому стандартизированному коэффициенту смертности, потенциально искажая сравнение между больницами с разной практикой [31].
Это исследование имеет несколько ограничений, которые необходимо учитывать, прежде чем его результаты будут отражены в повседневной клинической практике. Во-первых, клинические сценарии были специально созданы для исследования, и их количество было ограничено до двадцати, что было основано на анализе мощности. Количество трудностей при подсчете баллов, включенных в сценарии, может отличаться от числа реальных клинических случаев, поэтому наши результаты можно рассматривать скорее как экспериментальные, чем имеющие клиническое значение.Во-вторых, их средний суммарный балл по SAPS II был на 5 пунктов выше, чем в Швейцарии в 2011 году, и они не могли воспроизвести реальную сложность швейцарской популяции пациентов интенсивной терапии. В-третьих, различные характеристики пунктов SAPS II не были равномерно распределены, что может привести к дополнительному смещению выбора. Поэтому нельзя исключать, что другие виньетки дали бы несколько иные результаты. Однако использование моделей со смешанными эффектами должно хотя бы частично учитывать это. В-четвертых, мы предположили, что каждый опрошенный обладает навыками извлечения некоторой информации из диаграмм, даже если это не указано явно в описании случая.Однако некоторые участники могли бы лучше найти необходимую информацию, если бы они лично наблюдали за последовательностью событий. В-пятых, мы не могли проверить, все ли участники регулярно участвуют в подсчете баллов SAPS II. Фактически, четверть респондентов заявили, что решают эту задачу реже одного раза в неделю, и это может вызвать более широкую вариативность между экспертами. Наконец, 15 случаев содержали карты пациентов, представленные классическим способом, тогда как 5 случаев имели «цифровой» макет. Только участникам, работающим в отделениях интенсивной терапии, оборудованных PDMS, была предоставлена «цифровая» диаграмма (точность не различалась для этой подгруппы), но мы не можем исключить, что некоторые участники боролись с незнакомыми графическими деталями.
Мы считаем, что участие 345 профессионалов (то есть около одной трети всех потенциальных респондентов) из 53 различных швейцарских отделений интенсивной терапии дает достаточно хорошее представление о национальной практике, поскольку эти результаты являются репрезентативными для значительной части швейцарских отделений интенсивной терапии. Однако довольно ограниченное участие франкоговорящего региона (только 16% участников, по сравнению с 23% населения Швейцарии) может помешать сделать надежные выводы для этой конкретной части страны.
В заключение, результаты этого общенационального опроса показывают, что точность оценок SAPS II, рассчитанных обслуживающим персоналом отделения интенсивной терапии, может быть умеренной, вызывая значительную систематическую ошибку, независимо от профессии, опыта лиц, осуществляющих уход, метода сбора данных и структурных характеристик. отделений интенсивной терапии. Этот факт может помешать достоверности оценок с точки зрения улучшения качества, сравнительного анализа и клинических исследований. Швейцарское общество интенсивной терапии должно рассмотреть возможность структурированной национальной программы, охватывающей всех участвующих профессионалов, включая учебные занятия, официальные руководства и проверки качества.
Благодарности: Авторы выражают огромную благодарность руководителям швейцарских ICU и всем остальным участникам исследований. Они также хотели бы выразить особую признательность доктору Марианне Замбрунн, Базель, за ее вклад. Одобрение и финансовая поддержка этого проекта Швейцарским обществом интенсивной терапии признаны.
Финансирование / потенциальные конкурирующие интересы: Это исследование было поддержано грантом Исследовательского фонда Швейцарского общества интенсивной терапии.
Переписка
Для корреспонденции: Марко Превисдомини, доктор медицины, отделение интенсивной терапии, Региональная больница Беллинцона и Валли, CH-6500 Беллинцона, Швейцария, marco.previsdomini [at] eoc.ch
использованная литература
1 Морено Р.П., Хохризер Х., Метниц Б., Бауэр П., Метниц ПГХ. Характеристика профилей риска отделений интенсивной терапии. Intensive Care Med. 2010. 36 (7): 1207–12.
2 Минне Л., Эслами С., де Кейзер Н., де Йонге Э, де Рой С. Е., Абу-Ханна А. Влияние изменений с течением времени в производительности индивидуализированной модели SAPS-II на качество оценки помощи. Intensive Care Med. 2011. 38 (1): 40–6.
3 Восилюс С., Сипилайте Дж., Иваскявичюс Дж. Оценка работы отделения интенсивной терапии в Литве с использованием системы SAPS II. Eur J Anaesthesiol. 2004. 21 (8): 619–24.
4 Ле Галл Дж. Р., Лемешоу С., Солнье Ф.Новая упрощенная оценка острой физиологии (SAPS II), основанная на многоцентровом исследовании в Европе / Северной Америке. ДЖАМА. 1993. 270 (24): 2957–63.
5 Калькулятор SAPS II [Интернет]. 2014. Доступно по адресу: http://clincalc.com/IcuMortality/SAPSII.aspx.
6 Метниц П.Г., Морено Р.П., Алмейда Э., Джордан Б., Бауэр П., Кампос Р.А. и др. SAPS 3 — От оценки пациента до оценки в отделении интенсивной терапии. Часть 1: Цели, методы и описание когорты.Intensive Care Med. 2005. 31 (10): 1336–44.
7 Морено Р.П., Метниц PGH, Алмейда Е., Джордан Б., Бауэр П., Кампос Р.А. и др. SAPS 3 — От оценки пациента до оценки в отделении интенсивной терапии. Часть 2: Разработка прогностической модели госпитальной смертности при поступлении в ОИТ. Intensive Care Med. 2005. 31 (10): 1345–55.
8 Deutsches Institut für Medizinische Dokumentation und Information, OPS Version 2014, Kapitel 8, Nichtoperative Therapeutische Massnahmen 8–98, 2014, Dokumentationsvorgaben zur Erfassung der Intensivmedizinischen Komplexbehandlung.Доступно по адресу: http://www.dimdi.de/static/de/klassi/faq/ops/kapitel_8/ops-anleitung-intensivmedizin-8009.pdf
9 Классификация BM. Schweizerische Operationsklassifikation (CHOP). Статистик Б.Ф., редактор. 31 июля 2013 г. Доступно по адресу: http://www.bfs.admin.ch/bfs/portal/de/index/infothek/nomenklaturen/blank/blank/chop/02/05.html
10 Rothen HU, Kaufmann M. Ein wichtiges Instrument zur Qualitäts-sicherung in der Intensivmedizin.Медицинский журнал. 2009; 2: 18–21.
11 Strand K, Strand LI, Flaatten H. Межэкспертная надежность SAPS II и SAPS 3. Intensive Care Med. 2010. 36 (5): 850–3.
12 Arts D, de Keizer N, Scheffer G-J, de Jonge E. Качество данных, собранных для оценки тяжести заболевания в Национальном реестре оценки интенсивной терапии Нидерландов (NICE). Intensive Care Med. 2002. 28 (5): 656–9.
13 Grønlykke L, Brandstrup SLR, Perner A.Данные клинической базы данных по септическому шоку действительны. Дэн Мед Дж. 2012; 59 (10): A4522.
14 Перрен А., Превисдомини М., Перрен И., Мерлани П. Медсестры интенсивной терапии неадекватно оценивают баллы SAPS II у очень больных пациентов в реальной жизни. Crit Care Res Pract. 2012; 2012:
6. 15 Strand K, Søreide E, Aardal S, Flaatten H. Сравнение SAPS II и SAPS 3 в норвежском отделении интенсивной терапии. Acta Anaesthesiol Scand.2009. 53 (5): 595–600.
16 Уолтер С.Д., Элиашив М., Доннер А. Размер выборки и оптимальные планы для исследований надежности. Stat Med. 1998. 17 (1): 101–10.
17 Ландис-младший, Кох Г.Г. Применение иерархической статистики каппа-типа для оценки согласия большинства между несколькими наблюдателями. Биометрия. 1977; 33 (2): 363–74.
18 Fleiss JL. Измерение номинальной шкалы согласованности между многими оценщиками.Психологический бюллетень. 1971: 76 (5): 378–82.
19 Shrout PE, Fleiss JL. Внутриклассовые корреляции: использование при оценке надежности оценщика. Psychol Bull. 1979. 86 (2): 420–8.
20 Макгроу КО, Вонг СП. Формирование выводов о некоторых коэффициентах внутриклассовой корреляции. Психологические методы. Американская психологическая ассоциация; 1996. 1 (1): 30–46.
21 Альтман Д.Г., Бланд Дж. М.. Измерение в медицине: анализ сравнительных исследований методов.Статистик. 1983; 32: 307–17.
22 Anerkannte Intensivstationen. 23 октября 2013 г. Доступно по адресу: http://www.sgi-ssmi.ch/index.php/liste-der-anerkannten-is.html
23 Миранда Д.Р., Морено Р., Япичино Г. Девять эквивалентов оценки использования медицинских кадров (NEMS). Intensive Care Med. 1997. 23 (7): 760–5.
24 Arts DGT, de Keizer NF, Vroom MB, de Jonge E. Надежность и точность оценки последовательной оценки органной недостаточности (SOFA).Crit Care Med. 2005. 33 (9): 1988–93.
25 Чен Л.М., Мартин С.М., Моррисон Т.Л., Сиббальд В.Дж. Различия между наблюдателями в сборе данных по шкале APACHE II в учебных и общественных больницах. Crit Care Med. 1999; 27 (9): 1999–2004.
26 Холт А.В., Бери Л.К., Берстен А.Д., Сковронски Г.А., Ведиг А.Е. Проспективная оценка ординаторов и медсестер как сборщиков данных по шкале тяжести. Crit Care Med. 1992. 20 (12): 1688–91.
27 Голдхилл Д.Р., Самнер А.APACHE II, точность данных и прогноз результатов. Анестезия. 1998. 53 (10): 937–43.
28 Полдерман К. Х., Христиан Х. М., Вестер Дж. П., Спейкстра Дж. Дж., Гирбес А. Р.. Вариабельность оценки APACHE II внутри наблюдателя. Intensive Care Med. 2001. 27 (9): 1550–2.
29 Полдерман К. Х., Йорна Е. М., Гирбес АР. Различия между наблюдателями в оценке APACHE II: эффект строгих руководств и обучения. Intensive Care Med. 2001. 27 (8): 1365–9.
30 Bosman RJ, Oudemane van Straaten HM, Zandstra DF. Использование информационных систем интенсивной терапии изменяет прогноз результатов. Intensive Care Med. 1998. 24 (9): 953–8.
31 Суйстомаа М., Кари А., Руоконен Э., Такала Дж. Частота выборки вызывает смещение в оценках APACHE II и SAPS II. Intensive Care Med. 2000. 26 (12): 1773–8.
Авторские права
Опубликовано в соответствии с лицензией об авторских правах
«Указание — Некоммерческое — Без производных 4.0 ”.
Запрещается повторное использование в коммерческих целях без разрешения.
См .: emh.ch/en/emh/rights-and-licences/Калькулятор упрощенной оценки острой физиологии (SAPS II)
Объяснение SAPS II
Это система классификации тяжести заболевания, которая используется для оценки взрослых пациентов в отделениях интенсивной терапии по всему миру.
Данные, необходимые для 15 пунктов оценки, либо легко доступны (например, возраст пациента, тип госпитализации, хронические заболевания), либо относятся к показателям жизненно важных функций, за которыми проводится регулярный мониторинг (например,грамм. частота сердечных сокращений, систолическое артериальное давление, температура) или определяется в течение 24 часов.
В следующей таблице описаны 15 пунктов оценки в зависимости от их значения при оценке состояния здоровья:
Элементы SAPS II Описание Возраст пациента Более высокий возраст означает более высокий риск тяжелого состояния здоровья. ЧСС Наихудшее значение в ударах в минуту. Систолическое артериальное давление Учитывает наивысшее или наименьшее значение, в зависимости от того, какое из них наихудшее, что означает гипертензию или гипотензию. Шкала комы Глазго Наименьшее значение при первом обследовании после госпитализации и до проведения любой седативной процедуры. Температура тела Измеряется в градусах Цельсия или Фаренгейта с отсечкой при 39 ° C / 102,2F. P a O 2 / F i O 2 передаточное отношение Если пациент находится на механической или постоянной вентиляции с положительным давлением в дыхательных путях (CPAP). Выделение мочи За последние 24 часа. Мочевина сыворотки или BUN В зависимости от того, что измеряется, а если и то, и другое, считается самый высокий Количество лейкоцитов клеток на мм 3 , наименьшее или наибольшее измерение, наиболее показательное для тяжелого состояния. Калий сыворотки Часть метаболической панели. Натрий сыворотки Предлагает информацию о гипонатриемии. Бикарбонат сыворотки Проверяет баланс электролита. Билирубин Проверяет целостность функции почек. Хронические болезни — Метастатический рак (подтвержденный хирургическим вмешательством или компьютерной томографией)
— Гематологические злокачественные новообразования (при лимфоме, остром лейкозе или множественной миеломе)
— Пациент с положительным ВИЧ-статусомМетод подсчета баллов обеспечивает получение целочисленных баллов от 0 до 163, которые затем соотносятся с показателями смертности в процентах (от 0 до 100%).
SAPS II оказался более точным, чем APACHE II, аналогичная шкала классификации интенсивной терапии, и обычно используется в исследованиях для сравнения заболеваемости и исходов между пациентами.
Показатели смертности коррелировали с SAPS II
Прогноз смертности, предлагаемый SAPS II, основан на следующих двух формулах, которые используют целочисленный результат (из оценки 15 пунктов) и определенные переменные, основанные на исследовании:
логит = −7.7631 + 0,0737 x Оценка + 0,9971 x ln (Оценка + 1)
Смертность = e logit / (1 + e logit ) x 100
В следующей таблице приведены примеры баллов по шкале SAPS II, связанных с различными уровнями смертности:
Оценка по SAPS II Смертность 29 10% 40 25% 52 50% 64 75% 77 90% ≥142 100% Аналогичный прогноз смертности для пациентов в отделениях интенсивной терапии можно получить с помощью оценки последовательной органной недостаточности (оценка SOFA).
Об исследовании
В 1993 г. Le Gall et al. проанализировали данные из 13 152 последовательных госпитализаций в 137 взрослых медицинских и / или хирургических отделений интенсивной терапии в 12 странах.
Были сформированы две группы, одна группа развития (65%) и одна для валидации (35%), и в качестве критерия исхода был установлен жизненный статус при выписке из больницы. В исследование были исключены пациенты моложе 18 лет, пациенты, находящиеся на лечении в кардиологии или перенесшие кардиохирургические операции, а также пациенты с ожогами были исключены.
Тесты согласия показали, что модель хорошо себя зарекомендовала в обоих образцах. Кривая рабочих характеристик под приемником составила 0,88 для группы разработки и 0,86 для группы проверки.
SAPS II обеспечивает точную оценку риска смерти и может служить отправной точкой для разработки стратегии лечения в отделениях интенсивной терапии.
Первоисточник
Le Gall J-R, Lemeshow S, Saulnier F. Новая упрощенная оценка острой физиологии (SAPS II) на основе многоцентрового исследования в Европе / Северной Америке.ДЖАМА. 1993; 270: 2957-2963.
Прочие ссылки
1. Деша К., Перич М., Хуседжинович И. и др. Прогностическая эффективность Simplified Acute Physiology Score II в основных хорватских больницах: проспективное многоцентровое исследование. Croat Med J. 2012; 53 (5): 442–449.
2. Ле Галл Дж. Р., Нойман А., Хемери Ф и др. Прогнозирование смертности с использованием SAPS II: обновление для французских отделений интенсивной терапии. Crit Care. 2005; 9 (6): R645 – R652.
3. Гилани М.Т., Разави М., Азад AM. (2014) Сравнение систем оценки Simplified Acute Physiology Score II, Acute Physiology and Chronic Health Evaluation II и Acute Physiology and Chronic Health Evaluation III для прогнозирования смертности и продолжительности пребывания в хирургическом отделении интенсивной терапии.Niger Med J. 2014; 55 (2): 144–147.
Система оценки и оценки
Система оценки и оценкиСписок всех зарегистрированных определений
Это вводная страница к списку баллов и систем оценивания. Это первый черновик, который отображает содержимое базы данных партитуры в HTML. Для каждой системы мы собираемся предоставить детали с особым аспектом. в назначенный код (ы) и кодовые системы.На данный момент этот список неполный и может содержать ошибки. Поэтому присылайте комментарии и дополнения на адрес электронной почты, указанный в нижнем колонтитуле.
Кроме того, пожалуйста, сообщите об улучшениях в этой презентации.
Спасибо
Оценка Описание Bezeichnung © Статус Чек APACHE II Оценка острой физиологии и хронического здоровья (II) ? в ходе выполнения APACHE III Оценка острой физиологии и хронического здоровья (III) ? в ходе выполнения АПГАР ? зарегистрированный APGAR (1 мин) нач 1 минута ? в ходе выполнения APGAR (10 мин) нач 10 минут ? в ходе выполнения APGAR (5 мин) нач 5 минут ? в ходе выполнения ASA Классификация физического статуса Американского общества анестезиологов ? зарегистрированный Бартель Индекс Бартеля Индекс Бартеля в ходе выполнения Barthel-HL7-NL Barthel-Index (голландская версия от NICTIZ) ? в ходе выполнения ИМТ Индекс массы тела Индекс массы тела ? в ходе выполнения Шкала Брадена Шкала Брейдена для прогнозирования риска пролежней © в ходе выполнения DRS Шкала оценки инвалидности ? зарегистрированный FIM Функциональная независимость ? в ходе выполнения FRB Frhreizations-Barthel-Index Фрюреабилитации-Бартель-Индекс ? зарегистрированный GCS Шкала комы Глазго Глазго Кома Скала ? в ходе выполнения GDS Шкала гериатрической депрессии Гериатрическая депрессия ? зарегистрированный GDS (Yesavage) Шкала гериатрической депрессии — после Yesavage ? в ходе выполнения Хендрих3 Шкала риска падения Хендриха 2 © в ходе выполнения MFS Шкала Морзе Падения ? в ходе выполнения БОЛЬ Оценка боли ? зарегистрированный ПОССУМ ? в ходе выполнения ППР Pflegepersonal Regelung ? в ходе выполнения QMMI ? в ходе выполнения SAPS Упрощенная оценка острой физиологии ? в ходе выполнения SAPS 2 ? в ходе выполнения SAPS 3 ? в ходе выполнения SCBA Бартель-Индекс ? в ходе выполнения SCBF Frhreha-Index ? в ходе выполнения SCSA SAPS II Интенсивная оценка ? в ходе выполнения SCTI Core-10-TISS Intensivscore ? в ходе выполнения Оценка кожи Шкала оценки кожи © зарегистрированный ДИВАН Оценка органной недостаточности, связанной с сепсисом ? в ходе выполнения СТРАТИФИКАЦИЯ Стратифицировать ? зарегистрированный TI Индекс травмы (нач Линдси?) ? в ходе выполнения ТИСС-10 Система подсчета очков терапевтического вмешательства (10) ? в ходе выполнения ТИСС-28 Система подсчета очков терапевтического вмешательства (28) ? в ходе выполнения ТИСС-76 ? в ходе выполнения ТРИОС трехдневная перекалиброванная оценка результатов интенсивной терапии ? в ходе выполнения TS Оценка травмы ? в ходе выполнения Waterlow Оценка риска возникновения пролежней при низком уровне воды ? в ходе выполнения Индекс Уилсона ? в ходе выполнения Дополнительные баллы и системы оценивания
Ниже приводится список оценок и систем оценивания. которые в настоящее время готовятся к публикации.Мы ценим любой вклад в ту или иную новую систему.
спасибоОценка Описание Bezeichnung АБСИ Сокращенный индекс тяжести ожога ADL ???? AIS Сокращенная система травм AMDP Arbeitsgemeinschaft fr Methodik und Dokumentation in der Psychiatrie AMS Hormonmangel und Wechseljahre APS Оценка острой физиологии BradenQ Шкала Брейдена для прогнозирования риска возникновения пролежней у детей BV Оценка бактериального вагиноза Индекс сердечного риска Кардиалер Risikoindex nach Goldman CASUS Оценка кардиохирургии Кормак и Лехан Euroscore FLACC Face Legs Activity Cry Consolability Score Глисон Оценка Глисона HTI Больничный индекс травм IADL IADL (Нах Лоутон и Броуди) МИЭФ Международный индекс эректильной функции IIPS Внутр.Оценка симптомов простаты IRISS МКС Оценка тяжести травмы KISS Комбинированная интенсивная система баллов kombiniertes Intensiv Scoring System LFP Lbecker Fhigkeitenprofil LIS Оценка травмы легкого LOD Оценка дисфункции логистических органов Маллампати Abschtzung des Schwierigkeitsgrades einer endotrachealen Intubation vor einer Narkose Мельба Merkmale zur Beruflichen Eingliederung von Behinderten MMSE Мини-аттестация психического состояния MNA Мини-оценка питания (nach Guigoz et.др.) МОД Оценка множественной дисфункции органов МОДЫ MOF Оценка множественной дисфункции органов (Горис и др.) MPI Индекс перитонита Маннгеймера МПМ Модель прогнозирования смертности МПМ 2 (0) МПМ 2 (24, 48, 72) МИССИС Модифицированная рейтинговая шкала NEMS Девять эквивалентов оценки использования сестринского персонала (на Рейс Миранда и др.) Norton (изменено) ODIN Нарушение функции и / или инфекция органа OHS Oxford Hip Score ОНТАРИО Парсонне Педриатический GCS Педриатический GCS PHQ Анкета личного здоровья PPP33 Fragebogen PSR Скрининг и регистрация перидонта Рамзи Шкала седации по Рамзи РАСС Весы для агитации и седации Richmond SAPS II — LODS как Aufnahmeparameter? Zwischen Tag 2 und 3 ??? SCDE Декабрьская документация ГКНП Neurologie-Pflege-Dokumentation SCNS Neugeborenenscreening TFDD Test zur Frherkennung von Demenzen mit Depressionsabgrenzung TISS Система подсчета очков терапевтического вмешательства VAS Визуальный аналог Scala визуально-аналоговая шкала Специальность / Оценка Описание Bezeichnung Скорая медицинская помощь Akutbehandlung СТРАТИФИКАЦИЯ Стратифицировать Анастезия Анстези КАК Классификация физического статуса Американского общества анестезиологов Индекс сердечного риска Кардиалер Risikoindex nach Goldman GCS Шкала комы Глазго Глазго Кома Скала Маллампати Abschtzung des Schwierigkeitsgrades einer endotrachealen Intubation vor einer Narkose Познание Познание TFDD Test zur Frherkennung von Demenzen mit Depressionsabgrenzung Гериатрия Гериатрия GDS Шкала гериатрической депрессии Гериатрическая депрессия Интенсивная терапия Интенсивмедизин ABSI Сокращенный индекс тяжести ожога АИС Сокращенная система травм APACHE II Оценка острой физиологии и хронического здоровья (II) APACHE III Оценка острой физиологии и хронического здоровья (III) КАК Классификация физического статуса Американского общества анестезиологов КАЗУС Оценка кардиохирургии GCS Шкала комы Глазго Глазго Кома Скала МКС Оценка тяжести травмы ЦЕЛОВАТЬ Комбинированная интенсивная система баллов kombiniertes Intensiv Scoring System LOD Оценка дисфункции логистических органов MPI Индекс перитонита Маннгеймера NEMS Девять эквивалентов оценки использования медсестер (нач. Рейс Миранда и др.) Рамзи Шкала седации Рамзи РАСС Шкала Ричмонда для агитации и седации SAPS Упрощенная оценка острой физиологии SAPS 2 SAPS 3 ДИВАН Оценка органной недостаточности, связанной с сепсисом TI Индекс травмы (нач Линдси?) Неврология Неврология GCS Шкала комы Глазго Глазго Кома Скала Питание Ernhrung MNA Мини-оценка питания (Nach Guigoz et.др.) Уход за пациентом Pflege Бартель Индекс Бартеля Индекс Бартеля Шкала Брейдена Шкала Брейдена для прогнозирования риска пролежней BradenQ Шкала Брейдена для прогнозирования риска возникновения пролежней у детей FIM Функциональная независимость FRB Frhreizations-Barthel-Index Frhreizations-Barthel-Index MFS Шкала Морзе Падения Минфин Оценка множественной дисфункции органов (Горис и др.) Waterlow Оценка риска возникновения пролежней при низком уровне воды Педиатрия Pdiatrie АПГАР АПГАР (1 мин.) нач 1 минута АПГАР (10 мин) нач 10 минут АПГАР (5 мин) нач 5 минут Педриатический GCS Педриатический GCS Физиология Физиология APS Оценка острой физиологии Психатрия Психиатрия AMDP Arbeitsgemeinschaft fr Methodik und Dokumentation in der Psychiatrie Мельба Merkmale zur Beruflichen Eingliederung von Behinderten MMSE Миниатюрное определение психического состояния Психология Психология AMDP Arbeitsgemeinschaft fr Methodik und Dokumentation in der Psychiatrie Травматология Травматология GCS Шкала комы Глазго Глазго Кома Скала неизвестный нет информации Глисон Оценка Глисона Урология Урология AMS Hormonmangel und Wechseljahre МИЭФ Международный индекс эректильной функции
Присылайте исправления и дополнения к hl7 (at) oemig.деСсылки на дополнительную информацию
Общее примечание
Основная цель представленной выше информации — повысить функциональную совместимость. Основное внимание уделяется присвоенным кодам.
Дата последнего изменения: 06 ноября 2008 г. (FO)
Таким образом, нельзя гарантировать, разрешено ли использование балльной системы или системы оценивания. Настоятельно рекомендуется уточнять у автора напрямую. Мы понимаем, что представленной информации может быть недостаточно для работы с ней. Авторы сделали все возможное, чтобы обеспечить соблюдение авторских прав и других юрисдикционных требований.ПРАЙМ PubMed | [Действительность шкал APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA у акушерских пациентов с сепсисом]
Цитата
Заболоцких, И. Б. и др. «[Действительность шкал APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA у акушерских пациентов с сепсисом]». Анестезиология и реаниматология, 2012, стр. 55-7.
Заболоцких И.Б., Мусаева Т.С., Денисова Е.А. [Применимость шкал APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA у акушерских пациентов с сепсисом]. Анестезиол Реаниматол . 2012.
Заболоцких И. Б., Мусаева Т. С., Денисова Е. А. (2012). [Применимость шкал APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA у акушерских пациентов с сепсисом]. Анестезиология и реаниматология , (6), 55-7.
Заболоцких И.Б., Мусаева Т.С., Денисова Е.А. [Действительность шкал APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA у акушерских пациентов с сепсисом]. Анестезиол Реаниматол. ноябрь-декабрь 2012 г .; (6) 55-7.PubMed PMID: 23662523.
TY — JOUR T1 — [Действительность шкал APACHE II, APACHE III, SAPS 2, SAPS 3 и SOFA у акушерских пациентов с сепсисом]. AU — Заболоцких, И Б, AU — Мусаева Т. С, AU — Денисова, Э А, PY — 2013/5/14 / entrez PY — 2013/5/15 / pubmed PY — 2013/6/19 / medline СП — 55 EP — 7 JF — Анестезиология и реаниматология JO — Анестезиол Реаниматол ИС — 6 N2 — ЦЕЛЬ ИССЛЕДОВАНИЯ: оценить эффективность шкал APACHE II, APACHE III, SAPS II, SAPS III, SOFA для акушерских больных с тяжелым сепсисом.Материалы и методы. Проведен ретроспективный анализ 186 медицинских карт беременных с легочным сепсисом, 40 женщин с уросепсисом и родильниц с абдоминальным сепсисом — 66. Средний возраст женщин составил 26,7 года (22,4-34,5 года). РЕЗУЛЬТАТЫ: В популяции родильниц с абдоминальным сепсисом шкалы APACHE II, APACHE III, SAPS 2, SAPS 3, SOFA показали хорошую калибровку, однако высокое разрешение наблюдали только в APACHE III, SAPS 3 и SOFA (AUROC 0,95; 0,93; 0,92). соответственно). Шкалы APACHE III и SOFA обеспечивали качественный прогноз у беременных с уросепсисом; Коэффициент разрешения этих шкал значительно превосходит APACHE II, SAPS 2 и SAPS 3 (AUROC 0.73; 0,74; 0,79 соответственно). Шкала APACHE II неприменима из-за отсутствия калибровки (X2 = 13,1; p <0,01), а на других шкалах (APACHE III, SAPS 2, SAPS 3, SOFA) наблюдалось недостаточное разрешение (AUROC <0,9) у беременных. при легочном сепсисе. ЗАКЛЮЧЕНИЕ: Оценка прогностических возможностей балльных шкал показала, что шкалы APACHE III, SAPS 3 и SOFA могут использоваться для прогноза летальности родильниц с абдоминальным сепсисом, в популяции беременных с уросепсисом - только APACHE III и SOFA, а также при легочном сепсисе. --SAPS 3 и APACHE III только в случае дополнительной клинической информации.СН - 0201-7563 UR - https://www.unboundmedicine.com/medline/citation/23662523/[validity_of_apache_ii_apache_iii_saps_2_saps_3_and_sofa_scales_in_obstetric_patients_with_sepsispting__ L2 - https://medlineplus.gov/sepsis.html БД - ПРЕМЬЕР DP - Unbound Medicine ER -
IJERPH | Бесплатный полнотекстовый | Плюсы и минусы предсказательной игры: нескончаемые дебаты о смертности в отделениях интенсивной терапии
1. Введение
Продолжаются споры о смертности в польских отделениях интенсивной терапии (ОИТ), и этот показатель кажется высоким. по сравнению со странами Западной Европы или Северной Америки [1].Это несоответствие широко обсуждалось в последние годы [1,2,3,4,5]. Балльные системы оценки тяжести заболевания в отделениях интенсивной терапии (ОИТ) стали рутинным элементом клинической оценки краткосрочного прогноза во всем мире. . Упрощенная оценка острой физиологии (SAPS) II, Оценка острой физиологии и хронического здоровья (APACHE) II и Оценка последовательной органной недостаточности (SOFA) являются наиболее полезными инструментами для этой цели [6,7,8,9,10]. Однако мало что известно об их полезности для прогнозирования долгосрочных результатов, включая смертность после ОИТ [6,9,11].Хотя этот вопрос исследовался в нескольких исследованиях, четких выводов не было сделано [12,13,14,15,16]. К сожалению, следует помнить о том, что прогноз основан не только на тяжести заболевания при поступлении, но и на различных демографических и клинических переменных [12,13,14].Настоятельно рекомендуется проверить диагностическую точность систем подсчета очков, которые могут быть специфичными для популяции, в которой они используются. Следовательно, они должны пройти валидацию перед их внедрением в конкретных отделениях интенсивной терапии.В этом исследовании мы стремились оценить диагностическую точность SAPS II, APACHE II и SOFA в прогнозировании смертности в ОИТ и после ОИТ пациентов, госпитализированных в ОИТ высшего образования.
2. Материалы и методы
Были обследованы все последующие пациенты, поступившие в смешанные отделения интенсивной терапии в период с 1 января 2015 г. по 31 декабря 2017 г. (n = 936). Из них 38 человек были госпитализированы в отделения интенсивной терапии более одного раза, что дало в общей сложности 985 госпитализаций. Исключались пациенты в возрасте n = 1), пациенты с отсутствующими данными в базе данных больницы (n = 10), пациенты с отсутствующим / неправильным национальным идентификационным номером или с неизвестной идентичностью (n = 14), а также пациенты, чьи данные были госпитализированы. только на закупку органов (n = 6).Для пациентов, госпитализированных более одного раза, учитывалась их последняя госпитализация. Наконец, в ретроспективный анализ данных были включены 905 пациентов. На рисунке 1 представлена блок-схема пациентов. Демографические, клинические и лабораторные данные были взяты из медицинских записей. Баллы по шкалам SAPS II, APACHE II и SOFA были рассчитаны на основе худших значений в первые 24 часа после госпитализации [6,9,17]. Приоритетность поступления в ОИТ оценивалась в соответствии с рекомендациями Польского общества анестезиологии и интенсивной терапии, которые основаны на рекомендациях Общества реаниматологии (SCCM) [18].Пациенты, поступившие в первую очередь, были тяжелобольными и нуждались в мониторинге, терапии и жизнеобеспечении по поводу органной недостаточности, которые могут быть предоставлены только в отделении интенсивной терапии. Пациенты, поступившие в соответствии со вторым приоритетом, были теми, кому требовалось интенсивное наблюдение, поскольку им могли потребоваться инвазивные методы лечения во время госпитализации, доступные только в отделении интенсивной терапии. Пациенты, поступившие на основании третьего приоритета, были теми, у которых критическое заболевание снижало вероятность выздоровления или выживания (например,g., пациенты с метастатическим раком или неизлечимые пациенты, которым требовалось интенсивное обезболивание). В четвертый приоритет были включены пациенты, которых не следовало госпитализировать в ОИТ (например, умирающие пациенты или пациенты в хорошем общем состоянии). Пациенты были разделены на хирургических (SP) и нехирургических (NSP) субъектов. Были рассчитаны нескорректированные коэффициенты смертности в ОИТ и после выписки из ОИТ (т. Е. Среди выживших из ОИТ). Выживаемость после выписки из ОИТ оценивалась на основе данных, полученных из национальной базы данных PESEL (Польский личный идентификационный номер).Точкой отсечения для последующего наблюдения было 10 августа 2018 г.Комитет по этике университета отказался от требования информированного согласия из-за анонимного и невмешательского характера исследования (KNW / 0022 / KB / 55/18).
Статистический анализ проводился с использованием программы StatSoft Statistica версии 13.0. Количественные переменные представлены в виде среднего и стандартного отклонения (SD) или медианы и межквартильного размаха (IQR). Качественные переменные представлены в виде абсолютного значения и / или процента.Межгрупповые различия для количественных переменных были проверены с помощью параметрических (t-критерий или ANOVA) или непараметрических тестов (U Mann-Whitney или Kruskal-Wallis) с предварительной проверкой их распределения с помощью теста Шапиро-Уилка или Смирнова-Колмогорова. . В случае качественных переменных использовался критерий хи-квадрат или точный критерий Фишера. Анализ кривой рабочих характеристик приемника (ROC) использовался для оценки диагностической точности показателей APACHE II, SAPS II и SOFA. Кривые Каплана-Майера были построены для оценки долгосрочной выживаемости, в то время как критерий лог-ранга применялся для сравнения кривых.Значение p <0,05 считалось значимым.
3. Результаты
Средний возраст пациентов составлял 62 (IQR 50–72) года, в то время как в исследуемой группе было 493 (54,5%) женщин. Было 280 нехирургических (30,9%) и 625 (69,1%) хирургических пациентов, в том числе 286 нейрохирургических, 203 желудочно-кишечных, 94 гинекологических и 42 хирургических пациента с другими состояниями. В общей сложности 765 пациентов (84,5%) были госпитализированы в отделение интенсивной терапии в соответствии с первым приоритетом SCCM, 88 (9,7%) в соответствии со вторым приоритетом и 52 (5.8%) по третьему приоритету. Ни один из пациентов не был госпитализирован по четвертому приоритету.
Исходные баллы SAPS II, APACHE II и SOFA составили 41,1 ± 20,34, 14,07 ± 8,73 и 6,33 ± 4,12 балла соответственно. Показатели значительно различались между SP и NSP, а также между субъектами, классифицированными в зависимости от приоритета госпитализации (таблица 1). Смертность в ОИТ достигла 35,4% (т. Е. 320 умерших из 905 пребывания в ОИТ) и значительно различалась между SP (n = 158, 25,3%) и NSP (n = 162, 57.9%) подгрупп (pТаблица 2) .ROC-кривые для прогнозирования смертности в ОИТ по шкалам SAPS II, APACHE II и SOFA показаны на рисунке 2. Площади под кривыми ROC (AUC) составили 0,826, 0,836 и 0,788 для SAPS II , Шкалы APACHE II и SOFA соответственно. Анализ подгрупп, включая SP и NSP, представлен в таблице 3. Хотя не было статистически значимой разницы между AUC для SAPS II и APACHE II (p> 0,05), статистически значимые различия между AUC для SOFA и двух других инструментов оценки в были обнаружены подгруппы SP и NSP (p). Медиана наблюдения за выжившими в ОИТ при последующем наблюдении составила 497 (IQR 247–848) дней.Из 585 выживших в отделении интенсивной терапии 183 (31,3%) человека умерли в ходе последующего наблюдения, что дает общий коэффициент смертности 53,5%. Из 467 выживших после ОИТ 123 (22,7%) пациентов умерли, в то время как из 118 выживших после ОИТ 60 (50,9%) пациентов умерли после выписки из ОИТ (p <0,001).
Кривые Каплана-Майера для выживаемости после выписки из ОИТ для всех пациентов, а также в подгруппах SP и NSP представлены на рисунке 3. Показатель выживаемости пациентов с SP (67,6%) был значительно лучше по сравнению с пациентами NSP (34 .2%) (p Исследуемые баллы были статистически значимо выше у выживших в ОИТ, которые умерли во время последующего наблюдения, по сравнению с теми, кто был еще жив (Таблица 4), а также в анализе подгрупп пациентов с SP и NSP. Кривые ROC для прогнозирования Смертность после выписки из ОИТ среди выживших в ОИТ по шкалам SAPS II, APACHE II и SOFA показана на рисунке 4. AUC составляли 0,708, 0,709 и 0,661 для SAPS II, APACHE II и SOFA, соответственно. Анализ подгрупп, включая пациентов SP и NSP, представлена в таблице 5.Хотя не было статистически значимой разницы между AUC для SAPS II и APACHE II AUC (p> 0,05), были обнаружены статистически значимые различия между AUC для SOFA и двумя другими инструментами оценки (APACHE II, SAPS II) в подгруппах SP и NSP. (стр.4. Обсуждение
) В этом одноцентровом наблюдательном исследовании мы стремились изучить смертность в ОИТ и после ОИТ, уделяя особое внимание способности SAPS II, APACHE II и SOFA предсказать результат. Мы обнаружили, что Смертность в отделении интенсивной терапии составила 35 лет.4%, что ниже значения, наблюдаемого в регионе Силезии (43,9%) [19], а также во всех польских отделениях интенсивной терапии (42,0%) [1]. Эти значения были намного выше, чем в других европейских странах, в том числе 6,7% в Швеции, 8,5% в Германии, 8,9% в Нидерландах, 9,2% в Австрии, 9,4% в Дании, 10,7% в Норвегии, 11,2% в Испании. , 14,9% в Англии и 17,8% в Италии [1]. Однако следует осознавать тот факт, что эти заметные различия вызваны не недостаточным уходом за пациентами, а скорее разным профилем госпитализированных пациентов, разными показаниями для госпитализации и разной организацией ухода в конце жизни [ 3].В нашем исследовании исходные баллы SAPS II, APACHE II и SOFA и прогнозируемая смертность в ОИТ были следующими: 41,1 балла (т. Е. Уровень смертности 33,6%), 14,07 балла (уровень смертности 18,4%) и 6,33 балла ( уровень смертности 29,4%), соответственно, что соответствовало уровням наблюдаемой и прогнозируемой смертности 1,05, 1,92 и 1,2 соответственно. Следует отметить тот факт, что у не выживших были получены значительно более высокие баллы по всем трем методикам по сравнению с выжившими (p6,20). Причина более высокой наблюдаемой, чем ожидаемой смертности, кажется многофакторной.Это может быть результатом разницы в профилях пациентов в нашем смешанном, гетерогенном отделении. Например, было подтверждено, что у медицинских пациентов смертность выше, чем у хирургических пациентов [21]. В нашем опросе количество пациентов, госпитализированных по нейрохирургическим причинам, составило 31,6%. В этой уникальной группе субъектов соотношение наблюдаемых и прогнозируемых было относительно высоким (то есть SAPS II: 1,32, APACHE II: 3,36, SOFA: 1,63). Объяснение этого несоответствия довольно простое: хотя неврологические субъекты (т.например, пациенты с черепно-мозговой травмой, субарахноидальным кровоизлиянием или послеоперационным отеком мозга) часто имеют низкие баллы в первые 24 часа после госпитализации, их прогноз остается неблагоприятным. Мы также провели глубокий анализ хирургических субъектов и обнаружили противоречивый эффект от режима процедуры, а именно: все три модели недооценивали смертность у пациентов неотложной помощи, особенно для APACHE II. SAPS II был более точным как для плановой, так и для неотложной хирургии, с соотношением наблюдаемых и прогнозируемых, равным 0.85 и 1.07 соответственно. Кроме того, наш анализ охватывал пациентов с сердечными заболеваниями (8,18%), которые были исключены из исходных исследований APACHE, SAPS и SOFA из-за заметной разницы между прогнозируемой и наблюдаемой смертностью [6,9,17] среди них. Более того, следует иметь в виду, что, хотя в исходном исследовании APACHE II отсутствовали 13% переменных, в анализ были включены субъекты. В нашем исследовании мы исключили всех субъектов, данные которых были неполными. Наше наблюдение высокой точности (т.е., достигая 0,8 и более) балльной системы остается в соответствии с предыдущими исследованиями, проведенными во всем мире [20,21,22,23]. Хотя наиболее эффективным инструментом был APACHE II (AUC = 0,836), SAPS II не превосходил в прогнозировании смертности в ОИТ (AUC = 0,826). Аналогичные результаты были получены Giliani et al., Которые также подтвердили, что APACHE II более надежен, чем SAPS II, у хирургических пациентов в отделении интенсивной терапии [24]. Напротив, Sungurtekin et al. сообщили о лучшей прогностической точности для SAPS II, чем для APACHE II для субъектов интенсивной терапии [25].Aminiahidashti et al. продемонстрировали сопоставимую диагностическую точность APACHE II и SAPS II при прогнозировании 30-дневного прогноза в ОИТ [16]. Следует иметь в виду, что, хотя пациенты ОИТ могут вылечиться от своего критического заболевания, они по-прежнему подвержены риску последующих умственных и физических нарушений которые вызывают ухудшение качества жизни и более высокую смертность после выписки. Таким образом, точная идентификация пациентов, которые останутся в группе риска, позволит медицинским службам провести надлежащий скрининг и адекватное лечение для уменьшения летальных осложнений после госпитализации в ОИТ.Некоторые из этих смертей можно было предотвратить, в то время как ухудшение состояния, вероятно, можно было избежать [13,26,27]. Кэмпбелл и др. и Yung-Che et al. Подчеркните, что в некоторых случаях пациенты могли быть выписаны слишком рано, что приводило к короткой выживаемости после выписки из ОИТ или повторной госпитализации в ОИТ [12,14]. Дэйли и др. сообщили, что одна треть пациентов в отделении интенсивной терапии в Великобритании имеют повышенный риск смерти после пребывания в отделении интенсивной терапии и что отсрочка их выписки на 48 часов может снизить риск смерти [28].Хотя основная цель исследования систем оценки заключалась в оценке риска краткосрочной смертности, мы также стремились проверить, можно ли использовать эти шкалы для прогнозирования выживаемости после выписки из ОИТ. Мы предоставили убедительные доказательства того, что все три системы оценки не смогли предсказать долгосрочную смертность. Эти наблюдения согласуются с данными Campbell et al. которые показали, что регулярно собираемые данные нельзя использовать для создания клинически полезных систем прогнозирования смерти или повторной госпитализации [13]. В других исследованиях, в которых изучали долгосрочную выживаемость пациентов в ОИТ, также сообщалось об отсутствии связи между оценками, рассчитанными при поступлении и смертью после выписки из ОИТ [14].Объяснение сложное, но понятное: оценка рассчитывается на основе худших результатов в течение первых 24 часов после госпитализации и отражает только острое состояние болезни. Проведенное лечение после госпитализации, внутрибольничные осложнения и лечение после выписки влияют на прогноз больше, чем базовая оценка APACHE, SAPS или SOFA. Следовательно, мы должны скорее сосредоточиться на оценках, рассчитанных среди выживших в ОИТ при их выписке, чтобы попытаться предсказать результат.Ли и др. обнаружили, что оценка по шкале APACHE II при выписке является предиктором смертности после отделения интенсивной терапии и повторной госпитализации [12]. Согласно этому наблюдению, повторная оценка состояния пациента в конце госпитализации позволит более надежно оценить шансы пациента на выживание. Более того, другие факторы, не включенные в системы оценки, в том числе поведение и образ жизни пациентов, полученные лекарства, качество последующего ухода и реабилитации, фундаментальным образом влияют на шансы пациентов на выживание.
