Шкала рэнкина интерпретация: Шкала Рэнкина / Неврологическое отделение для больных с нарушением мозгового кровообращения
особенности клинического течения у больных сахарным диабетом 2 типа
Обоснование
Острые нарушения мозгового кровообращения, определяющие высокий уровень смертности и стойкой утраты трудоспособности населения, представляют собой одну из наиболее актуальных проблем современной медицины в мире [1]. В Российской Федерации заболеваемость инсультом составляет 2,5–3,0 случая на 1000 населения в год, при этом ишемическую природу имеют до 80% мозговых инсультов [2]. Показатели смертности от цереброваскулярных заболеваний в России остаются одними из самых высоких в мире и не имеют тенденции к снижению [3].
В настоящее время среди причин, увеличивающих риск развития инсульта, тяжесть его течения и исход, особое место отводят нарушениям углеводного обмена. У больных сахарным диабетом 2 типа (СД2) риск развития ишемического инсульта (ИИ) в 2,0–2,5 раза выше, чем у лиц без диабета [4, 5]. Патогенетические компоненты СД2 (гипергликемия, гиперинсулинемия и инсулинорезистентность) рассматриваются в качестве независимых факторов риска инсульта. Среди лиц с острыми нарушениями мозгового кровообращения частота гипергликемии достигает 60% [6]. Однако до настоящего времени отсутствует единое мнение о роли повышения уровня глюкозы в развитии инсульта: имеет ли оно физиологический или патологический характер? В ряде исследований показана сопряженность между выраженностью стрессовой гипергликемии и тяжестью, а также исходом инсульта [7, 8]. С другой стороны, некоторые авторы указывают на отсутствие взаимосвязи гипергликемии и клинического исхода инсульта у пациентов с СД2 [9, 10].
Среди лиц с острыми нарушениями мозгового кровообращения частота гипергликемии достигает 60% [6]. Однако до настоящего времени отсутствует единое мнение о роли повышения уровня глюкозы в развитии инсульта: имеет ли оно физиологический или патологический характер? В ряде исследований показана сопряженность между выраженностью стрессовой гипергликемии и тяжестью, а также исходом инсульта [7, 8]. С другой стороны, некоторые авторы указывают на отсутствие взаимосвязи гипергликемии и клинического исхода инсульта у пациентов с СД2 [9, 10].
Цель исследования: изучить влияние гипергликемии в дебюте ИИ на течение и краткосрочный клинический прогноз заболевания у больных СД2.
Методы
В исследование включены 186 больных с ИИ, развившимся на фоне СД2, проходивших лечение в отделении для больных острым нарушением мозгового кровообращения ГБУЗ «Городская клиническая больница № 18» Уфы в 2015–2018 гг. Дизайн: исследование серии случаев. Все пациенты поступили в стационар в течение первых 12 часов после развития очаговой неврологической симптоматики. Диагноз заболевания устанавливали в соответствии с критериями Международной классификации болезней и проблем, связанных со здоровьем (МКБ-10). Возраст больных колебался от 42 до 80 лет (в среднем 67,8±7,72 года), из них 54 (29,0%) мужчины и 132 (71,0%) женщины. У всех больных сосудистая катастрофа развилась на фоне артериальной гипертензии 2–3-й степеней.
Диагноз заболевания устанавливали в соответствии с критериями Международной классификации болезней и проблем, связанных со здоровьем (МКБ-10). Возраст больных колебался от 42 до 80 лет (в среднем 67,8±7,72 года), из них 54 (29,0%) мужчины и 132 (71,0%) женщины. У всех больных сосудистая катастрофа развилась на фоне артериальной гипертензии 2–3-й степеней.
До развития инсульта СД2 страдали 146 (78,5%) человек. Все больные получали плановую сахароснижающую терапию, из них: 57 (39,0%) человек – препараты сульфонилмочевины и метформин, 72 (49,3%) – инсулинотерапию, 17 (11,6%) человек – диетотерапию. У 40 (21,5%) пациентов диабет был впервые выявлен в условиях стационара. Верификация диабета проведена врачами-эндокринологами в соответствии с диагностическими критериями (ВОЗ, 1999–2006) и Алгоритмами специализированной медицинской помощи больным сахарным диабетом [11].
Критерии исключения: геморрагический инсульт, соматическая патология в стадии декомпенсации.
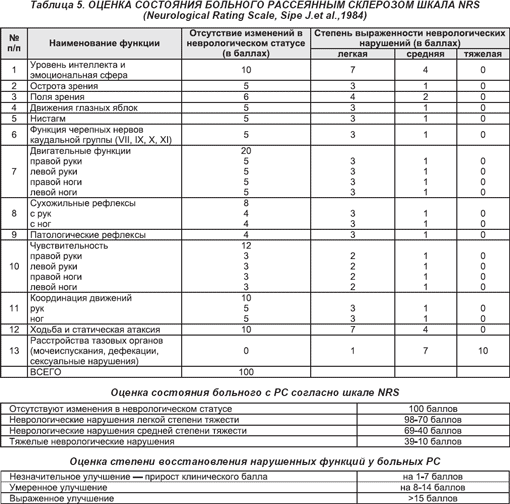
Оценка тяжести неврологической симптоматики больных проведена на основании исходного суммарного балла шкалы NIHSS. Выраженность функциональных нарушений оценивалась по модифицированной шкале Рэнкина (МшР).
Выраженность функциональных нарушений оценивалась по модифицированной шкале Рэнкина (МшР).
Анализ клинического исхода к 21-м суткам от момента развития ИИ выполнен с использованием шкалы инсульта NIHSS, согласно которой изменение состояния больных расценивалось как заметное улучшение при регрессе неврологической симптоматики на 3 и более баллов на фоне положительной динамики лабораторных показателей; незначительное улучшение – при минимальном регрессе неврологической симптоматики (1–2 балла) и неудовлетворительных лабораторных показателях; нарастание симптоматики в пределах 3 баллов – отсутствие динамики; нарастание симптоматики на 4 балла и более – отрицательная динамика.
Всем больным при поступлении проводили исследование уровня гликемии глюкозооксидантным методом. В случаях, когда было невозможно установить, принимал ли больной пищу перед развитием нарушения мозгового кровообращения, содержание сахара в крови определяли через 2 часа после дебюта заболевания.
План обследования и лечения построен в соответствии с Федеральными стандартами оказания помощи больным сосудистыми заболеваниями, утвержденными приказами Минздрава РФ. Протокол исследования (№ 22 от 16.11.2017) одобрен локальным этическим комитетом ГБУЗ «Городская клиническая больница № 18» Уфы. Каждый пациент получал подробную информацию о проводимом исследовании и давал информированное согласие на добровольное участие в исследовании.
Протокол исследования (№ 22 от 16.11.2017) одобрен локальным этическим комитетом ГБУЗ «Городская клиническая больница № 18» Уфы. Каждый пациент получал подробную информацию о проводимом исследовании и давал информированное согласие на добровольное участие в исследовании.
Статистический анализ данных выполняли с использованием пакета программ Microsoft Excell 7.0 и SPSS v. 19,0 [12]. Рассчитывали групповые показатели суммарной статистики – среднюю арифметическую величину (M) и ошибку средней (m). Сравнение двух независимых групп осуществляли с помощью критерия Хи-квадрат с поправкой Йетса. Различия считались статистически значимыми при р<0,05.
Результаты
Установлено, что в дебюте ИИ средний уровень сахара в крови составил 11,8±3,86 ммоль/л. У большинства (142 [76,3%]) больных уровень гликемии превышал 7,8 ммоль/л. Уровни гликемии 4,4–6,1 ммоль/л, соответствующие целевым показателям контроля диабета, выявлены у 14 (7,5%) пациентов, пограничные уровни гликемии 6,2–7,8 ммоль/л – у 23 (12,4%) пациентов. Содержание сахара в венозной крови менее 4,4 ммоль/л отмечено у 7 (3,8%) больных.
Содержание сахара в венозной крови менее 4,4 ммоль/л отмечено у 7 (3,8%) больных.
В зависимости от уровня гликемии больные были разделены на три группы. Первую составили 37 (19,9%) пациентов, у которых уровни сахара в крови были равны 4,4–7,8 ммоль/л. Во вторую группу был включен 51 (27,4%) пациент с гликемией 7,9–10 ммоль/л, в третью группу вошел 91 (48,9%) пациент с уровнем глюкозы крови более 10 ммоль/л. Пациенты с уровнем сахара менее 4,4 ммоль/л были исключены из исследования, поскольку их число было недостаточным для статистического анализа.
На фоне проводимой терапии у больных второй и третьей групп к третьим суткам от развития инсульта выявлено заметное улучшение показателей гликемии (табл. 1). При этом у пациентов второй группы различия с исходными величинами были статистически значимыми (на 21,5%; р=0,039), тогда как у пациентов третьей группы они носили характер тенденции (на 41,8%; р=0,100).
Не было обнаружено существенных различий возрастных и гендерных характеристик у больных СД2 с разными уровнями гликемии в дебюте инсульта. У обследованных больных в дебюте инсульта отмечены высокие уровни систолического и диастолического артериального давления. Средние уровни систолического давления были равны 180,6±21,23 мм рт.ст., диастолического – 101,5±8,30 мм рт.ст.
У обследованных больных в дебюте инсульта отмечены высокие уровни систолического и диастолического артериального давления. Средние уровни систолического давления были равны 180,6±21,23 мм рт.ст., диастолического – 101,5±8,30 мм рт.ст.
Во всех группах больных в большинстве случаев сосудистая катастрофа в головном мозге возникла впервые. Среди пациентов с сопутствующим СД2 повторный инсульт отмечен в 53 (28,5%) случаях. В первой группе повторный инсульт развился у 12 (32,4%) больных, во второй – у 17 (33,3%), в третьей группе – у 21 (23,1%).
Представленность различных подтипов инсульта в исследованных группах больных СД2 была сопоставимой. Чаще встречался атеротромботический подтип, выявленный у 21 (56,8%) больного первой группы, у 30 (58,8%) больных второй и у 64 (70,3%) больных третьей групп. Представленность кардиоэмболического подтипа в группах больных составила 12 (32,4%), 13 (25,5%) и 19 (20,9%) пациентов соответственно. ИИ неуточненной этиологии определен у 3 (8,1%) пациентов первой группы, у 5 (9,8%) второй и 6 (6,6%) пациентов третьей групп. Транзиторные ишемические атаки были диагностированы у 6 (3,6%) из 176 больных диабетом без эпизодов гипогликемии в дебюте инсульта.
Транзиторные ишемические атаки были диагностированы у 6 (3,6%) из 176 больных диабетом без эпизодов гипогликемии в дебюте инсульта.
В первой группе больных доля средней и тяжелой степеней неврологического дефицита по шкале NIНSS составила 56,8% (21 человек) и 16,2% (6), во второй группе – 43,1% (22) и 27,5% (14) соответственно, в третьей группе – 40,7% (37) и 34,1% (31) соответственно. При этом в первой группе пациентов представленность тяжелого инсульта была существенно ниже, чем в третьей группе больных, на 17,9% (χ2=4,08; р=0,044).
При оценке нарушений жизнедеятельности по шкале МшР получены следующие результаты (табл. 2). Встречаемость выраженных (4 балла) и грубых (5 баллов) функциональных нарушений при содержании сахара в крови 7,9–10,0 ммоль/л частота превысила показатели при гликемии 4,4–7,8 ммоль/л на 25,0% (χ2=5,33; р=0,021), при гликемии более 10,0 ммоль/л – на 26,0% (χ2=7,17; р=0,008).
Наиболее низкая смертность к 21-м суткам от развития ИИ установлена в первой группе – 10,8%, что на 8,6% ниже показателей во второй группе и на 3,5% ниже значений в третьей группе (табл. 3). Среди пациентов первой группы с исходной нормогликемией представленность заметного улучшения была существенно выше, чем у пациентов второй группы, – на 23,5% (χ2=5,18; р=0,023), и у пациентов третьей группы – на 30,0% (χ2=9,68; р=0,002). Незначительная положительная динамика в первой группе больных определена достоверно реже, чем в третьей группе больных, – на 20,0% (χ2=5,59; р=0,019).
3). Среди пациентов первой группы с исходной нормогликемией представленность заметного улучшения была существенно выше, чем у пациентов второй группы, – на 23,5% (χ2=5,18; р=0,023), и у пациентов третьей группы – на 30,0% (χ2=9,68; р=0,002). Незначительная положительная динамика в первой группе больных определена достоверно реже, чем в третьей группе больных, – на 20,0% (χ2=5,59; р=0,019).
Обсуждение
Существующая доказательная база свидетельствует о том, что нарушения углеводного обмена играют важную роль в развитии ишемического инсульта, способствуя усилению выраженности проявлений заболевания и большей летальности [4, 13, 14]. Однако информация о состоянии гормонально-метаболического профиля в острейшем периоде ишемического инсульта противоречива и требует уточнения. До настоящего времени отсутствует единое мнение о роли гипергликемии в развитии инсульта: носит ли она физиологический или патологический характер?
Полученные нами результаты свидетельствуют о сопряженности клинических особенностей течения ИИ у больных СД2 с выраженностью нарушений углеводного обмена в дебюте заболевания. Установлена высокая представленность (76,3%) гликемии выше 7,8 ммоль/л – значение, расцениваемое у стационарных больных как гипергликемия и определяющее высокий уровень риска возникновения сердечно-сосудистых заболеваний у пациентов с диабетом [4, 15]. Следует также отметить высокую частоту гликемии при развитии инсульта более 10 ммоль/л, усиливающем негативные эффекты гипергликемии: 48,9% [16]. При этом отклонения уровня гликемии более 10 ммоль/л носили транзиторный характер и на 3-и сутки пребывания в стационаре достигали показателей, рекомендованных для больных СД в критических состояниях [17].
Установлена высокая представленность (76,3%) гликемии выше 7,8 ммоль/л – значение, расцениваемое у стационарных больных как гипергликемия и определяющее высокий уровень риска возникновения сердечно-сосудистых заболеваний у пациентов с диабетом [4, 15]. Следует также отметить высокую частоту гликемии при развитии инсульта более 10 ммоль/л, усиливающем негативные эффекты гипергликемии: 48,9% [16]. При этом отклонения уровня гликемии более 10 ммоль/л носили транзиторный характер и на 3-и сутки пребывания в стационаре достигали показателей, рекомендованных для больных СД в критических состояниях [17].
Среди обследованных больных обращает на себя внимание высокая представленность женщин, что, возможно, обусловлено более высокой распространенностью СД среди них [18].
Результаты исследования позволяют предполагать влияние уровня гликемии на развитие и течение острого периода ИИ у больных СД2. У пациентов с гипергликемией >10 ммоль/л установлена более высокая, чем у пациентов с содержанием сахара в венозной крови 4,4–7,8 ммоль/л, соответствующим целевым показателям контроля диабета, представленность тяжелой степени неврологического дефицита по шкале NIНSS, выраженных и грубых функциональных нарушений по шкале МшР.
Особое значение имеет то, что у больных СД2 высокий уровень гликемии в дебюте инсульта оказался ассоциированным с более высокой частотой летальных исходов и меньшим регрессом очаговой неврологической симптоматики. Минимальная летальность в остром периоде инсульта установлена у пациентов с гликемией 4,4–7,8 ммоль/л (10,8%), тогда как у остальных категорий пациентов с ИИ смертность была почти в 1,5–2,0 раза выше. У пациентов с СД2 наличие гипергликемии более 7,8 ммоль/л при развитии ИИ сопровождалось более низкой частотой благоприятного клинического исхода заболевания. Полученные нами результаты согласуются с мнением других авторов о взаимосвязи гипергликемии с негативным течением и клиническим исходом ИИ в остром периоде при наличии СД2 [7, 8].
Следует особо обратить внимание на гипогликемические состояния в дебюте ИИ у больных СД2, которые, несмотря на невысокую частоту встречаемости (3,8%), сопровождаются резким возрастанием летальных исходов.
Заключение
Таким образом, результаты исследования свидетельствуют о том, что у больных, страдающих СД2, развитие ИИ сопряжено с высокими уровнями гликемии более 7,8 ммоль/л. Гипергликемия в дебюте инсульта ассоциирована с существенным возрастанием представленности тяжелой степени неврологического дефицита, выраженного и грубого нарушения жизнедеятельности и меньшей встречаемостью заметной положительной динамики.
Гипергликемия в дебюте инсульта ассоциирована с существенным возрастанием представленности тяжелой степени неврологического дефицита, выраженного и грубого нарушения жизнедеятельности и меньшей встречаемостью заметной положительной динамики.
Вклад авторов
Концепция и дизайн исследования – Г.И. Ижбульдина, Л.Б. Новикова; получение данных, анализ и интерпретация результатов, обработка данных – Г.И. Ижбульдина; утверждение рукописи для печати – Л.Б. Новикова.
1. Béjot Y., Bailly H., Durier J., Giroud M. Epidemiology of stroke in Europe and trends for the 21st century. Presse Med. 2016;45(12):391–98. Doi: 10.1016/j.lpm.2016.10.003. 2. Суслина З.А., Гулевская Т.С., Максимова М.Ю., Моргунов В.А. Нарушения мозгового кровообращения: диагностика, лечение, профилактика. М., 2016. 536 с. 3. Суслина З.А., Пирадов М.А., Домашенко М.А.Инсульт: оценка проблемы (15 лет спустя). Журнал неврологии и психиатрииим. С.С. Корсакова. 2014;11:5–13. 4. Дедов И. 5. Bruno A., Leibeskind D., Hao Q., Raychev R. Diabetes mellitus, acute hyperglycemia, and ischemic stroke. Cur. Treat. Opt. Neurol. 2010;12:492–503. Doi: 10.1007/s11940-010-0093-6. 6. Badiger Sh., Akkasaligar P.T., Narone U. Hyperglycemia and Stroke. Int. J. Stroke Res. 2013;1:1–6. 7. Clark M.E., Payton J.E., Pittiglio L.I. Acute ischemic stroke and hyperglycemia. Critical Care Nursing Quarterly. 2014;37:182–87. 8. Liang J., Liu W., Sun J., et al. Analysis of the risk factors for the short-term prognosis of acute ischemic stroke. Int J Clin Exp Med. 2015;8(11):21915–24. Doi: 10.1186/s12944-015-0080-8. 9. Антонова К.В., Танашян М.М., Романцова Т.И., Максимова М.Ю. Острые нарушения мозгового кровообращения: клиническое течение и прогноз у больных сахарным диабетом 2 типа. Ожирение и метаболизм. 10. Yao M., Ni J., Zhou L., Peng B., Zhu Y.L. SMART investigators. Elevated Fasting Blood Glucose Is Predictive of Poor Outcome in Non-Diabetic Stroke Patients: A Sub-Group Analysis of SMART. PLoS One 2016;11(8):e0160674. Doi: 10.1371/journal.pone.0160674. 11. Дедов И.И., Шестакова М.В., Майоров А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Сахарный диабет. 2017;20(1):1–112. Doi: 10.14341/DM20171S8. 12. Наследов А.Д. SPSS 19: Профессиональный статистический анализ данных. СПб., 2011. 400 с. 13. Танашян М.М., Лагода О.В., Антонова К.В., Раскуражев А.А. Основные патогенетические механизмы развития сосудистой патологии мозга при атеросклерозе и метаболическом синдроме: поиск путей коррекции. Анналы клинической и экспериментальной неврологии. 2016;10(2):5–10. 14. Brannick B., Dagogo-J.S. Prediabetes and Cardiovascular Disease: Pathophysiology and Interventions for Prevention and Risk Reduction. 15. Клыпа Т.В., Орехова М.С., Забросаева Л.И. Гипергликемия критических состояний. Сахарный диабет. 2015;18(1):33–41. Doi: 10.14341/DM2015133-41 16. Bilotta F., Rosa G. Glycemia management in critical care patients. World J. Diabetes. 2012;3(7):130–34. Doi: 10.4239/wjd.v3.i7.130. 17. Kansagara D., Fu R., Freeman M., Wolf F., Helfand M.Intensive insulin therapy in hospitalized patients: A systematic review. Ann Intern Med. 2011;154(4):268–82. Doi: 10.7326/0003-4819-1544-201102150-00008. 18. Сунцов Ю.И., Болотская Л.Л., Маслова О.В., Казаков И.В. Эпидемиология сахарного диабета и прогноз его распространенности в Российской Федерации. Сахарный диабет. 2011;14(1):15–9. И., Шестакова М.В. Сосудистые поражения головного мозга при сахарном диабете: решенные и нерешенные вопросы. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;8:79–82.
И., Шестакова М.В. Сосудистые поражения головного мозга при сахарном диабете: решенные и нерешенные вопросы. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;8:79–82. 2016;13(2):20–5. Doi: 10.14341/OMET2016220-25.
2016;13(2):20–5. Doi: 10.14341/OMET2016220-25. Endocrinol Metab Clin North Am. 2018;47(1):33–50. Doi: 10.1016/j.ecl.2017.10.001.
Endocrinol Metab Clin North Am. 2018;47(1):33–50. Doi: 10.1016/j.ecl.2017.10.001.
Автор для связи: Л.Б. Новикова, д.м.н., проф., зав. кафедрой неврологии и нейрохирургии ИДПО, Башкирский государственный медицинский университет, Уфа, Россия; e-mail: [email protected]; ORCID: https://orcid. org/0000-0001-8469-1635; Адрес: 450008, Россия, Уфа, ул. Ленина, 3
org/0000-0001-8469-1635; Адрес: 450008, Россия, Уфа, ул. Ленина, 3
Круглый стол «Перспективы развития онкореабилитации в СЗФО» состоялся 6 июля 2017 года
В ФГБУ НИИ ОНКОЛОГИИ прошел круглый стол, посвященный перспективам развития реабилитации онкологических пациентов в Северо-Западном Федеральном округе.
Круглый стол был организован ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России совместно с Союзом Реабилитологов России и ФГБОУ ВО «Первым Санкт-Петербургским государственным медицинским университетом им. акад. И.П. Павлова» Минздрава России.
Мероприятие объединило клинических онкологов, экспертов в области организации онкологической помощи, специалистов в области медицинской реабилитации, психологов.
С приветственным словом выступили Щербаков Александр Михайлович д.м.н., профессор, заместитель директора по науке ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России и Мельникова Елена Валентиновна д.м. н, профессор кафедры физических методов лечения и спортивной медицины ФПО ПСПбГМУ им. акад. И.П. Павлова, Главный внештатный специалист по медицинской реабилитации МЗ РФ в СЗФО.
н, профессор кафедры физических методов лечения и спортивной медицины ФПО ПСПбГМУ им. акад. И.П. Павлова, Главный внештатный специалист по медицинской реабилитации МЗ РФ в СЗФО.
Заседание началось с доклада профессора Мельниковой Елены Валентиновны на тему: «Новая организационная модель медицинской реабилитации для онкологических больных. Опыт реализации Пилотного проекта по реабилитации». Были обозначены основные проблемы существующей модели реабилитации в Российской Федерации, а именно: отсутствие стандартов постановки целей реабилитации, оценки реабилитационного потенциала больных, системы контроля эффективности реабилитационных мероприятий. Представлена новая модель медицинской реабилитации и опыт «Пилотного проекта по реабилитации».
В ходе конференции участники получили возможность познакомится с принципами Международной Классификации Функционирования (PRM) , формирования представления о реабилитационном потенциале, диагнозе , прогнозе, объеме реабилитационных мероприятий.
Шмонин Алексей Андреевич, к.м.н., доцент кафедры физических методов лечения и спортивной медицины ФПО ПСПбГМУ им. акад. И.П. Павлова в своем докладе «МКФ – стратегический инструмент управления мультидисциплинарной реабилитационной командой в онкореабилитации» представил концепцию МКФ, в основе которой лежат:
- пациент-центрированный принцип,
- проблемно-ориентированный принцип,
- мультидисциплинарный принцип,
- биопсихосоциальная модель (фокус на функционировании, а не на функции — осознание понятий активность и участие. Фокус и внимание на факторы окружающей среды. Люди, окружающие пациента, — ресурс для реабилитационной команды.)
Был представлен возможный формат мультидисциплинарной команды:
- врач по физической и реабилитационной медицине,
- врач-онколог,
- медицинская сестра,
- эрготерапевт,
- специалист по ЛФК,
- клинический психолог,
- логопед,
- социальный работник,
- родственники пациента.

Следующий доклад Алексея Андреевича был посвящен теме «Модифицированная шкала Рэнкина (mRS) – универсальная шкала оценки инвалидности, независимости и исходов реабилитации. Возможности использования mRS в онкореабилитации». Представлена структура данной шкалы, раскрыты принципы начисления «баллов» в ходе проведения опроса пациента и правильная их интерпретация. Приведены примеры оценки состояния пациентов по данной шкале в рамках пилотного проекта реабилитации, клинических примеров реабилитации в онкологии.
Мальцева Мария Николаевна — д.в.н, к.т.н., доцент кафедры педагогики и психологии ФПО ПСПБГМУ им. акад. Павлова, директор Сообщества Поддержки и Развития Канис-терапии России выступила перед участниками с докладом «Эрготерапия в онкореабилитации». В ходе доклада раскрыты основные принципы эрготерапии, как терапии деятельностью, цель которой — восстановление способности человека к независимой жизни. В основе эрготерапии был показан принцип междисциплинарности.
Заседание круглого стола завершилось благодарственной речью к участникам конференции Александра Михайловича Щербакова, он оценил актуальность обсуждаемых тем в рамках мероприятия и выразил мнение о необходимости работы в данном направлении в рамках реабилитационного центра НИИ онкологии им. Н.Н. Петрова.
Эволюция модифицированной шкалы Рэнкина и ее использование в будущих исследованиях инсульта
1. Куинн Т.Дж., Доусон Дж., Уолтерс М. Доктор Джон Рэнкин; его жизнь, наследие и 50-летие шкалы инсульта Рэнкина. Скотт Мед Дж. 2008; 53:44–47. [PubMed] [Google Scholar]
2. Фаррелл Б., Годвин Дж., Ричардс С., Варлоу С. Испытание аспирина при транзиторной ишемической атаке (UK-TIA) в Соединенном Королевстве: окончательные результаты. J Neurol Нейрохирург Психиатрия. 1991; 54: 1044–1054. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJ, van Gijn J. Межнаблюдательное соглашение по оценке инвалидности у пациентов с инсультом./032/032_2.jpg) Инсульт. 1988; 19: 604–607. [PubMed] [Google Scholar]
Инсульт. 1988; 19: 604–607. [PubMed] [Google Scholar]
4. Harrison JK, McArthur KS, Quinn TJ. Шкалы оценки при инсульте: клиниметрические и клинические соображения. Clin Interv Старение. 2013;8:201–211. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Quinn TJ, Dawson J, Walters MR, Lees KR. Надежность модифицированной шкалы Рэнкина: систематический обзор. Инсульт. 2009 г.;40:3393–3395. [PubMed] [Google Scholar]
6. Saver JL, Filip B, Hamilton S, Yanes A, Craig S, Cho M, et al. Исследователи FAST-MAG, координаторы. Повышение надежности оценки инвалидности после инсульта в клинических испытаниях и клинической практике: инсульт сфокусированной оценки Рэнкина (РЧА). 2010;41:992–995. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Wilson JT, Hareendran A, Hendry A, Potter J, Bone I, Muir KW. Надежность модифицированной шкалы Рэнкина для нескольких оценщиков: преимущества структурированного интервью. Инсульт. 2005; 36: 777–781. [PubMed] [Академия Google]
8. Wilson JT, Hareendran A, Grant M, Baird T, Schulz UG, Muir KW, et al. Улучшение оценки исходов инсульта: использование структурированного интервью для выставления оценок по модифицированной шкале Рэнкина. Инсульт. 2002; 33: 2243–2246. [PubMed] [Google Scholar]
Wilson JT, Hareendran A, Grant M, Baird T, Schulz UG, Muir KW, et al. Улучшение оценки исходов инсульта: использование структурированного интервью для выставления оценок по модифицированной шкале Рэнкина. Инсульт. 2002; 33: 2243–2246. [PubMed] [Google Scholar]
9. Bruno A, Close B, Switzer JA, Hess DC, Gross H, Nichols FT, 3rd, et al. Упрощенный модифицированный опросник по шкале Рэнкина коррелирует с тяжестью инсульта. Клиника реабилитации. 2013; 27: 724–727. [PubMed] [Google Scholar]
10. Бруно А., Акинвунтан А.Е., Лин С., Клоуз Б., Дэвис К., Бауте В. и др. Упрощенный модифицированный опросник по шкале Ранкина: воспроизводимость по телефону и подтверждение качества жизни. Инсульт. 2011;42:2276–2279. [PubMed] [Google Scholar]
11. Hanley DF, Lane K, McBee N, Ziai W, Tuhrim S, Lees KR, et al. CLEAR IIII следователи. Тромболитическое удаление внутрижелудочковых кровоизлияний при лечении тяжелого инсульта: результаты рандомизированного, многоцентрового, многорегионального, плацебо-контролируемого исследования CLEAR III.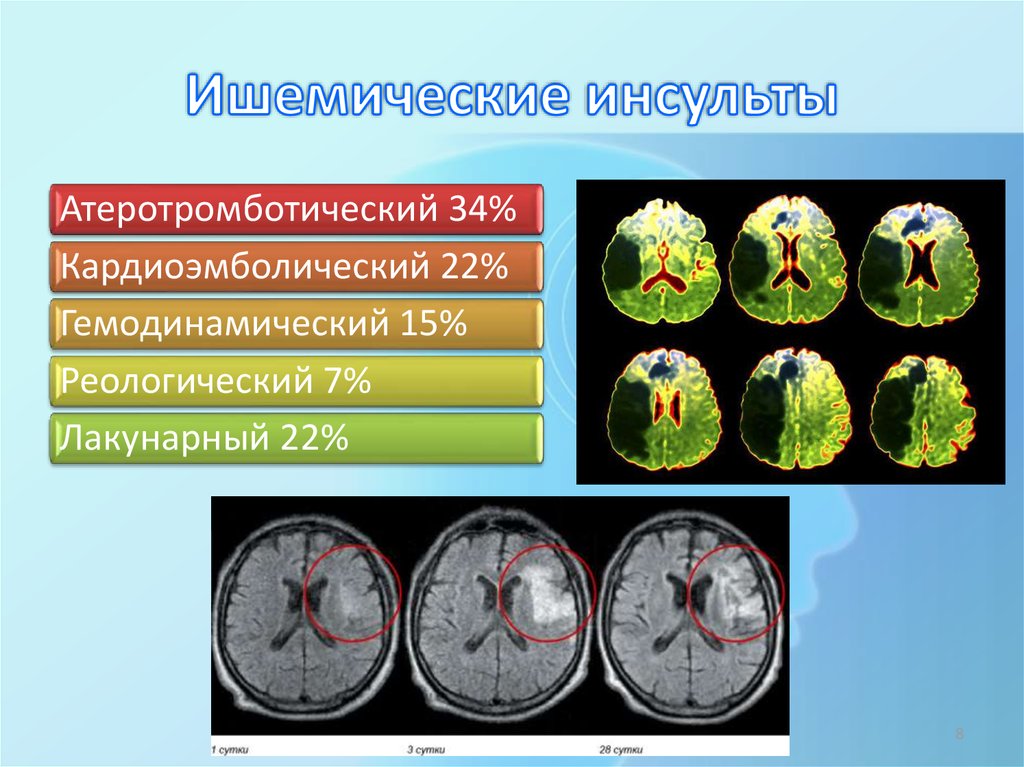 Ланцет. 2017; 389: 603–611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ланцет. 2017; 389: 603–611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Группа по изучению инсульта NINDS rt-PA. Тканевый активатор плазминогена при остром ишемическом инсульте. N Engl J Med. 1995; 333:1581–1587. [PubMed] [Академия Google]
13. Furlan A, Higashida R, Wechsler L, Gent M, Rowley H, Kase C, et al. Внутриартериальная проурокиназа при остром ишемическом инсульте. Исследование PROACT II: рандомизированная тромбоэмболия. ДЖАМА. 1999; 282:2003–2011. [PubMed] [Google Scholar]
14. Broderick JP, Palesch YY, Demchuk AM, Yeatts SD, Khatri P, Hill MD, et al. Интервенционное лечение инсульта (IMS) III Исследователи. Эндоваскулярная терапия после внутривенного введения t-PA в сравнении с монотерапией t-PA при инсульте. N Engl J Med. 2013; 368: 893–903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Менделоу А.Д., Грегсон Б.А., Роуэн Э.Н., Мюррей Г.Д., Голкар А., Митчелл П.М. Следователи STICH III. Раннее хирургическое вмешательство по сравнению с начальным консервативным лечением у пациентов со спонтанными супратенториальными долевыми внутримозговыми гематомами (STICH II): рандомизированное исследование. Ланцет. 2013; 382:397–408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ланцет. 2013; 382:397–408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Bath PM, Lees KR, Schellinger PD, Altman H, Bland M, Hogg C, et al. Рабочая группа по результатам организации инсульта. Статистический анализ первичного исхода в исследованиях острого инсульта. Инсульт. 2012;43:1171–1178. [PubMed] [Академия Google]
17. Оптимизация анализа исследований инсульта (OAST) Сотрудничество. Bath PM, Gray LJ, Collier T, Pocock S, Carpenter J. Можем ли мы улучшить статистический анализ исследований инсульта? Статистический повторный анализ функциональных результатов в исследованиях инсульта. Инсульт. 2007; 38: 1911–1915. [PubMed] [Google Scholar]
18. Howard G, Waller JL, Voeks JH, Howard VJ, Jauch EC, Lees KR, et al. Простой, свободный от предположений и клинически интерпретируемый подход к анализу модифицированных исходов Рэнкина. Инсульт. 2012; 43: 664–669.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Saver JL. Оптимальные конечные точки для испытаний терапии острого инсульта: лучшие способы измерения лечебных эффектов лекарств и устройств. Инсульт. 2011;42:2356–2362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Инсульт. 2011;42:2356–2362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Shuaib A, Lees KR, Lyden P, Grotta J, Davalos A, Davis SM, et al. SAINT II Trial Investigators NXY-059 для лечения острого ишемического инсульта. N Engl J Med. 2007; 357: 562–571. [PubMed] [Google Scholar]
21. Lees KR, Zivin JA, Ashwood T, Davalos A, Davis SM, Diener HC, et al. Лечение инсульта и острой ишемии NXY (SAINT I) Исследователи клинических испытаний NXY-059по поводу острого ишемического инсульта. N Engl J Med. 2006; 354: 588–600. [PubMed] [Google Scholar]
22. Chaisinanunkul N, Adeoye O, Lewis RJ, Grotta JC, Broderick J, Jovin TG, et al. DAWN Trial Руководящие комитеты по исследованию MOST, дополнительные участники Руководящего комитета по исследованию DAWN Принятие ориентированного на пациента подхода к анализу первичных исходов испытаний острого инсульта с использованием взвешенной по полезности модифицированной шкалы Рэнкина. Инсульт. 2015;46:2238–2243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Feeny D. Полезный подход к оценке качества жизни, связанного со здоровьем. Мед уход. 2000; 38:II151–4. [PubMed] [Академия Google]
Feeny D. Полезный подход к оценке качества жизни, связанного со здоровьем. Мед уход. 2000; 38:II151–4. [PubMed] [Академия Google]
24. Albers GW, Goldstein LB, Hess DC, Wechsler LR, Furie KL, Gorelick PB, et al. Консорциум STAIR VII. Рекомендации отраслевого круглого стола по лечению инсульта (STAIR) по максимальному использованию внутривенных тромболитиков и расширению вариантов лечения с помощью внутриартериальной и нейропротекторной терапии. Инсульт. 2011;42:2645–2650. [PubMed] [Google Scholar]
25. Rabin R, de Charro F. EQ-5D: показатель состояния здоровья от EuroQol Group. Энн Мед. 2001; 33: 337–343. [PubMed] [Академия Google]
26. Ali M, MacIsaac R, Terence J, Quinn TJ, Bath PM, Veenstra DL, Xu Y, et al. от имени сотрудников VISTA Зависимость и медицинские услуги при инсульте: данные для анализа экономической эффективности. Европейский журнал инсульта. 2017;2:70–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Rivero-Arias O, Ouellet M, Gray A, Wolstenholme J, Rothwell PM, Luengo-Fernandez R. Сопоставление измерения модифицированной шкалы Рэнкина (mRS) с общим Результаты EuroQol (EQ-5D) для здоровья. Принятие медицинских решений. 2010;30:341–354. [PubMed] [Академия Google]
Сопоставление измерения модифицированной шкалы Рэнкина (mRS) с общим Результаты EuroQol (EQ-5D) для здоровья. Принятие медицинских решений. 2010;30:341–354. [PubMed] [Академия Google]
28. Хонг К.С., Сэвер Дж.Л. Количественная оценка результатов инвалидности, вызванной инсультом: глобальное бремя болезней, прогнозируемые ВОЗ веса инвалидности для каждого уровня модифицированной шкалы Рэнкина. Инсульт. 2009;40:3828–3833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Prieto L, Sacristan JA. Проблемы и решения в подсчете лет жизни с поправкой на качество (QALY) Health Qual Life Outcomes. 2003; 1:80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Klarman HE. Путь к анализу экономической эффективности. Milbank Mem Fund Q Health Soc. 1982;60:585–603. [PubMed] [Google Scholar]
31. Гринберг Д., Плискин Дж.С. Измерения результатов на основе предпочтений в анализе полезности затрат. Обзор за 20 лет. Int J Technol оценивает здравоохранение. 2002; 18: 461–466. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
32. Torrance GW, Thomas WH, Sackett DL. Модель максимизации полезности для оценки программ здравоохранения. Health Serv Res. 1972; 7: 118–133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Torrance GW, Furlong W, Feeny D. Оценка полезности для здоровья. Эксперт Rev Pharmacoecon Outcomes Res. 2002; 2:99–108. [PubMed] [Google Scholar]
34. Kwiatkowski T, Libman R, Frankel M, Tilley B, Morganstern L, Lu M, et al. Группа по изучению инсульта NINDS rt-PA. Исследование инсульта NINDS rt-PA: устойчивая польза в течение одного года. Инсульт. 1998; 29:288. [Google Scholar]
35. Сакко Р.Л., Ши Т., Заманилло М.С., Каргман Д.Е. Предикторы смертности и рецидива после госпитализированного инфаркта мозга в городском сообществе: исследование инсульта в Северном Манхэттене. Неврология. 1994; 44: 626–634. [PubMed] [Академия Google]
36. Лис К.Р., Селим М.Х., Молина К.А., Бродерик Дж.П. Ранняя и поздняя оценка исхода инсульта. Инсульт. 2016;47:1416–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2016;47:1416–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Saver JL, Goyal M, Bonafe A, Diener HC, Levy EI, Pereira VM, et al. SWIFT PRIME Следователи. Стент-ретриверная тромбэктомия после внутривенного введения t-PA по сравнению с монотерапией t-PA при инсульте. N Engl J Med. 2015; 372: 2285–2295. [PubMed] [Google Scholar]
38. Goyal M, Demchuk AM, Menon BK, Eesa M, Rempel JL, Thornton J, et al. ESCAPE Судебные следователи. Рандомизированная оценка быстрого эндоваскулярного лечения ишемического инсульта. N Engl J Med. 2015;372:1019–1030. [PubMed] [Google Scholar]
39. Berkhemer OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ, et al. MR CLEAN Следователи. Рандомизированное исследование внутриартериального лечения острого ишемического инсульта. N Engl J Med. 2015; 372:11–20. [PubMed] [Google Scholar]
40. Jovin TG, Chamorro A, Cobo E, de Miquel MA, Molina CA, Rovira A, et al. REVASCAT Судебные следователи. Тромбэктомия в течение 8 часов после появления симптомов ишемического инсульта.2009/62/6.png) N Engl J Med. 2015; 372: 2296–2306. [PubMed] [Академия Google]
N Engl J Med. 2015; 372: 2296–2306. [PubMed] [Академия Google]
41. Bracard S, Ducrocq X, Mas JL, Soudant M, Oppenheim C, Moulin T, et al. Механическая тромбэктомия после внутривенного введения альтеплазы по сравнению с монотерапией альтеплазой после инсульта (THRACE): рандомизированное контролируемое исследование. Ланцет Нейрол. 2016;15:1138–1147. [PubMed] [Google Scholar]
42. Anderson CS, Heeley E, Huang Y, Wang J, Stapf C, Delcourt C, et al. INTERACT2 Следователи. Быстрое снижение артериального давления у больных с острым внутримозговым кровоизлиянием. N Engl J Med. 2013; 368: 2355–2365. [PubMed] [Академия Google]
43. Коллективная группа ИСТ-3. Сандеркок П., Уордлоу Дж. М., Линдли Р. И., Деннис М., Коэн Г. и др. Польза и вред внутривенного тромболизиса рекомбинантным тканевым активатором плазминогена в течение 6 ч после острого ишемического инсульта (третье международное исследование инсульта [IST-3]): рандомизированное контролируемое исследование. Ланцет. 2012; 379: 2352–2363. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Демчук А.М., Гоял М., Йейттс С.Д., Карроззелла Дж., Фостер Л.Д., Кази Э. и др. Исследователи IMS IIII Реканализация и клинический исход участков окклюзии при базовой КТ-ангиографии в исследовании Interventional Management of Stroke III. Радиология. 2014; 273:202–210. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Nogueira R, Lutsep H, Gupta R, Jovin T, Albers G, Walker G, et al. для Trevo 2 Trialists. Ретриверы Trevo и ретриверы Merci для тромбэктомической реваскуляризации окклюзии крупных сосудов при остром ишемическом инсульте (TREVO 2): рандомизированное исследование. Ланцет. 2012; 380:1231–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Hacke W, Kaste M, Bluhmki E, Brozman M, Davalos A, Guidetti D, et al. Следователи ECASS. Тромболизис альтеплазой через 3-4,5 часа после острого ишемического инсульта. N Engl J Med. 2008;359: 1317–1329. [PubMed] [Google Scholar]
47. Anderson CS, Robinson T, Lindley RI, Arima H, Lavados PM, Lee TH, et al. ЗАЧАРОВАННЫЕ Следователи, Координаторы. Низкая доза по сравнению со стандартной дозой внутривенной альтеплазы при остром ишемическом инсульте. N Engl J Med. 2016; 374: 2313–2323. [PubMed] [Google Scholar]
ЗАЧАРОВАННЫЕ Следователи, Координаторы. Низкая доза по сравнению со стандартной дозой внутривенной альтеплазы при остром ишемическом инсульте. N Engl J Med. 2016; 374: 2313–2323. [PubMed] [Google Scholar]
48. Ginsberg MD, Palesch YY, Hill MD, Martin RH, Moy CS, Barsan WG, et al. Псевдоним, Исследователи неврологических неотложных лечебных испытаний (NETT). Лечение острого ишемического инсульта высокими дозами альбумина (ALIAS). Часть 2: рандомизированное, двойное слепое, фаза 3, плацебо-контролируемое исследование. Ланцет Нейрол. 2013;12:1049–1058. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Qureshi AI, Palesch YY, Barsan WG, Hanley DF, Hsu CY, Martin RL, et al. Исследователи испытаний ATACH-2 Сеть испытаний неврологической неотложной помощи. Интенсивное снижение артериального давления у больных с острым кровоизлиянием в мозг. N Engl J Med. 2016; 375:1033–1043. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Mayer SA, Brun NC, Begtrup K, Broderick J, Davis S, Diringer MN, et al./48-1.jpg) БЫСТРЫЕ судебные следователи. Эффективность и безопасность рекомбинантного активированного фактора VII при остром внутримозговом кровоизлиянии. N Engl J Med. 2008; 358:2127–2137. [PubMed] [Академия Google]
БЫСТРЫЕ судебные следователи. Эффективность и безопасность рекомбинантного активированного фактора VII при остром внутримозговом кровоизлиянии. N Engl J Med. 2008; 358:2127–2137. [PubMed] [Академия Google]
51. Андерсон К.С., Хуанг И., Ван Дж. Г., Арима Х., Нил Б., Пэн Б. и другие. ВЗАИМОДЕЙСТВУЙТЕ Следователи. Исследование интенсивного снижения артериального давления при остром кровоизлиянии в мозг (INTERACT): рандомизированное пилотное исследование. Ланцет Нейрол. 2008; 7: 391–399. [PubMed] [Google Scholar]
52. Mendelow AD, Gregson BA, Fernandes HM, Murray GD, Teasdale GM, Hope DT, et al. Раннее хирургическое вмешательство по сравнению с начальным консервативным лечением у пациентов со спонтанными супратенториальными внутримозговыми гематомами в Международном хирургическом исследовании внутримозговых кровоизлияний (STICH): рандомизированное исследование. Ланцет. 2005; 365: 387–39.7. [PubMed] [Google Scholar]
53. Gershon RC, Lai JS, Bode R, Choi S, Moy C, Bleck T, et al.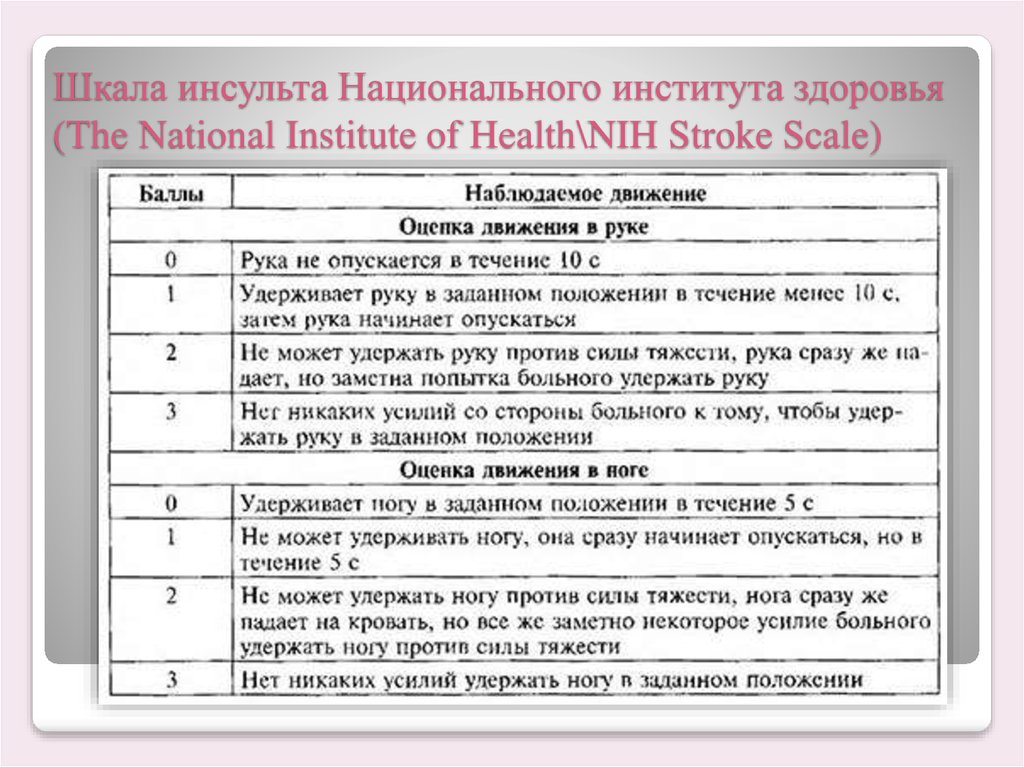 Neuro-QOL: банки тестов качества жизни для взрослых с неврологическими расстройствами: разработка и калибровка тестов на основе клинического и общего популяционного тестирования. Качество жизни Res. 2012; 21: 475–486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Neuro-QOL: банки тестов качества жизни для взрослых с неврологическими расстройствами: разработка и калибровка тестов на основе клинического и общего популяционного тестирования. Качество жизни Res. 2012; 21: 475–486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Повторные измерения баллов по модифицированной шкале Рэнкина для оценки функционального восстановления после инсульта: результаты исследования AFFINITY
%PDF-1.6 % 1 0 объект > >> эндообъект 7 0 объект /WPS-ARTICLEDOI (10.1161/JAHA.121.025425) >> эндообъект 2 0 объект > эндообъект 3 0 объект > ручей 2022-08-03T09:04:02+05:302022-08-11T02:38:30-07:002022-08-11T02:38:30-07:00Acrobat Distiller 10.1.7 (Windows)10.1161/JAHA.121.02542510.1002/(ISSN) 2047-99803VoR10.1161/JAHA.121.025425application/pdf