Saps шкала: Международные прогностические шкалы в анестезиологии и реаниматологии
The New Scale for Assessing Severity and Outcome Prediction in Зatients with Severe Sepsis and Septic Shock — Sepsis Severity Score
Статья опубликована на с. 135-138
Целью настоящего исследования является ознакомление врачей-анестезиологов со шкалой оценки тяжести состояния и прогноза исхода у пациентов с тяжелым сепсисом и септическим шоком — Sepsis Severity Score (SSS).
Предметом изучения для создания SSS стали пациенты, внесенные в базу Surviving Sepsis Campaign (SSC) начиная с 1 января 2005 года по 31 декабря 2009 года — 27 836 пациентов из 218 госпиталей, расположенных в 18 странах мира. Однако у 4408 пациентов исходно не был определен уровень лактата в крови. Так как этот показатель исходно считается маркером исхода, данные субъекты были исключены из исследования. В итоге группа пациентов, включенных в исследование для создания модели SSS, насчитывала 23 428 человек. И хотя это количество максимально приближено к SAPS (22 791), оно меньше, чем при сопоставлении с моделями APACHE IV (131 618) или MPM III (124 885).
Наиболее значимые ограничения — возраст и сопутствующие заболевания. Преимуществом этой шкалы является то, что она хорошо представлена в соответствии с калибровкой и разносторонностью подходов. SSS состоит из 34 критериев; это было установлено для избегания ошибок. Количество критериев SSS меньше, чем в APACHE IV (1492), однако больше, чем в SAPS 3 (20) и MPM III (16).
Для оценки тяжести состояния в интенсивной терапии используются, как мы уже указывали, различные шкалы, основными среди которых являются APACHE II, SOFA, SAPS II, MPM и др. M.J.Vassar et al. [1] сообщили, что ни одна из этих шкал не была приемлема при политравме без тяжелой черепно-мозговой травмы. Аналогичные данные были получены D.Y. Cho et al. [2] для APACHE II и APACHE IІІ. Y. Arabi et al. [3] сравнивали применение четырех оценочных шкал (APACHE II, SAPS II, MPM II0, MPM II24) с SAPS II и MPM II24 избирательно для септических пациентов.
Модель SSS является приемлемой исключительно для септических пациентов, тогда как другие шкалы применяются для всех групп пациентов отделений интенсивной терапии. Шкала оценки тяжести сепсиса точно оценивает возможность госпитальной смерти в случаях наличия у пациентов тяжелого сепсиса и септического шока.
 Модель прогнозирования была разработана с использованием случайной выборки 90 % субъектов (21 085) и была ратифицирована в оставшихся 10 % (2343). 90/10 метод перекрестной проверки был использован для внутренней проверки модели. Для разработанной модели и внутренне подтвержденной модели калибровка была оценена с помощью Hosmer-Lemeshow goodness-of-fit (GOF) теста; в то время как модель дискриминации была исследована с помощью ROC-кривой (receiver operating characteristic — график, позволяющий оценить качество бинарной классификации, отображает соотношение между долей объектов от общего количества носителей признака, верно классифицированных как несущие признак, и долей объектов от общего количества объектов, не несущих признака, ошибочно классифицированных как несущие признак, при варьировании порога решающего правила. Количественную интерпретацию ROC дает показатель AUC-area under ROC curve, площадь под ROC-кривой: чем выше показатель AUC, тем качественнее классификатор.
Модель прогнозирования была разработана с использованием случайной выборки 90 % субъектов (21 085) и была ратифицирована в оставшихся 10 % (2343). 90/10 метод перекрестной проверки был использован для внутренней проверки модели. Для разработанной модели и внутренне подтвержденной модели калибровка была оценена с помощью Hosmer-Lemeshow goodness-of-fit (GOF) теста; в то время как модель дискриминации была исследована с помощью ROC-кривой (receiver operating characteristic — график, позволяющий оценить качество бинарной классификации, отображает соотношение между долей объектов от общего количества носителей признака, верно классифицированных как несущие признак, и долей объектов от общего количества объектов, не несущих признака, ошибочно классифицированных как несущие признак, при варьировании порога решающего правила. Количественную интерпретацию ROC дает показатель AUC-area under ROC curve, площадь под ROC-кривой: чем выше показатель AUC, тем качественнее классификатор.В дальнейшем для создания SSS авторы присвоили пунктам целое число для оценки каждой переменной предиктора из многофакторной логистической регрессионной модели. Коэффициенты этих переменных были преобразованы путем умножения их на 10 и округления до ближайшего целого числа. Кроме того, постоянная из шести была добавлена к каждому целому коэффициенту, чтобы устранить любые отрицательные значения. Эти неотрицательные целые числа являются значениями пунктов, которые составляют SSS, когда суммируются. Прогнозируемая госпитальная летальность была затем произведена из SSS с использованием модели логистической регрессии для всех наблюдений.
SSS генерируется путем суммации значения индивидуальных пунктов, основанных на всех клинических характеристиках пациентов и оказании целевой терапии. Среднее SSS равняется 56,3, в то время как медиана составляет 55 с минимальным и максимальным значением 0 и 130 соответственно. Вероятность госпитальной летальности на основе SSS оценивали с помощью логистической регрессии.
Модель прогнозирования смертности с использованием логистической регрессии с максимальной вероятностной оценкой Sepsis Severity Score можно представить следующим образом (табл. 1).
Большой опыт работы со шкалой позволил нам несколько конкретизировать показатели, входящие в данную шкалу, путем применения четких дефиниций. Модернизированную шкалу можно представить следующим образом (табл. 2).
Использование модернизированной шкалы Sepsis Severity Score позволяет нам исходно (при поступлении) оценить тяжесть состояния и прогноз исхода у пациентов с тяжелым сепсисом и септическим шоком.
1. Vassar M.J., Lewis F.R. Jr., Chambers J.A. Prediction of outcome in intensive care unit trauma patients: A multicenter study of Acute Physiology and Chronic Health Evaluation (APACHE), Trauma and Injury Severity Score (TRISS), and a 24-hour intensive care unit (IVU) point system // Trauma. — 1999. — № 47. — Р. 324-329.
2. Cho D.Y., Wang Y.C. Comparison of the APACHE III, APACHE II and Glasgow Coma Scale in acute head injury for prediction of mortality and functional outcome // Intensive Care Med. — 1997. — № 23. — Р. 77-84.
3. Arabi Y.A., Shirawi N., Memish Z. et al. Assessment of six mortality prediction models in patients admitted with severe sepsis and septic shock to the intensive care unit: A prospective cohort study // Critical Care Medicine. — 2003. — № 7. — Р. 116-122.
4. Ho K.M. Combining Sequential Organ Failure Assessment (SOFA) score with acute physiology and chronic health evaluation (APACHE) II score to predict hospital mortality of critically ill patients // Anaesth. Intensive Care. — 2007. — № 35. — Р. 515-521.
5. Loulay E., Pochard F., Garrouste-Orgeas M. et al. Outcomerea Study Group: Decisions to forgo life-sustaining therapy in ICU patients independently predict hospital death // Intensive Care Med. — 2003. — № 29. — Р. 1895-1901.
Loulay E., Pochard F., Garrouste-Orgeas M. et al. Outcomerea Study Group: Decisions to forgo life-sustaining therapy in ICU patients independently predict hospital death // Intensive Care Med. — 2003. — № 29. — Р. 1895-1901.
6. Osborn T.M., Phillips G., Lemeshow S., Townsend S. et al. Sepsis Severity Score: An Internationally Derived Scoring System From the Surviving Sepsis Campaign Database // Critical Care Medicine. — 2014. — Vol. 42, № 9. — Р. 1969-1977.
Сравнение эффективности прогностических шкал оценки тяжести состояния реанимационных больных хирургического профиля
Ит и диагностика
Целью работы явилась оценка и сравнение эффективности прогнозирования летального исхода пяти шкал для оценки тяжести состояния (APACHE II, APACHE IV, SAPS II, MPM II 0 и POSSUM) для группы реанимационных больных хирургического профиля в условиях российского стационара. В основу анализа легло проспективное исследование, проведенное на базе отделения реанимации и интенсивной терапии (ОРИТ) для послеоперационных больных НИИ СП им Н.В. Склифосовского. Были собраны клинические и физиологические данные 300 пациентов на момент поступления и по истечению 1-х суток пребывания пациента в ОРИТ, необходимые для расчета прогностических моделей. В процессе анализа сравнивалась дискриминационная способность шкал с помощью построения ROC-кривых, а так же их калибрационная способность с использованием теста Хосмера-Лемешоу и построения калибровочных кривых. Анализ ROC кривых показал, что шкалы APACHE II, APACHE IV, SAPS II, MPM II 0 имеют хорошую дискриминационную способность (площадь под ROC-кривой > 0,9), а шкала POSSUM удовлетворительную дискриминационную способность (площадь под ROC-кривой > 0,8). Удовлетворительная калибрационная способность была выявлена только у двух из пяти прогностических шкал: SAPS II и MPM II. Таким образом, прогностические шкалы SAPS II и MPM II 0, имеющие высокую дискриминационную способность и удовлетворительную калибровку, могут быть рекомендованы для оценки вероятности летального исхода в ОРИТ хирургического профиля.
Авторы: Зарубина Т. В. [24] Швырёв С. Л. [5] Потанина О. К. [1] Дорфман А. Г. [1] Огурцова Е. В. [1]
Темы: apache ii1 apache iv1 mpm ii 01 possum1 saps ii1 прогностические шкалы1
ФГБНУ НЦПЗ. ‹‹История шизофрении››
Однако, именно основываясь на этой дофаминергической гипотезе, в течение последнего десятилетия сначала в Англии, а затем в Соединенных Штатах были предложены новые модели, направленные на то, чтобы разделить шизофрению если не на две различные болезни, то, по крайней мере, на два типа, или выделить два синдрома, которые можно противопоставить друг другу со всех точек зрения.
TJ. Crow первым в статье, опубликованной в «Британском медицинском журнале» под заголовком (как нельзя более определенным) «Молекулярная патология шизофрении: более чем один патологический процесс?» /49/, предлагает на основании «молекулярных аргументов», разделить на два типа шизофрению, которую он, таким образом, очевидно, рассматривал до сих пор как единый процесс:
— первый тип характеризовался бы внезапным началом, сохранением интеллектуальных функций, хорошей реакцией на классические нейролептики, возможным увеличением количества дофаминергических рецепторов D2 (TJ. Crow не мог предвидеть, что десятью годами позже будет открыто существование рецепторов D3 и, может быть, D4, D5…) и отсутствием так называемых дефицитарных симптомов;
Crow не мог предвидеть, что десятью годами позже будет открыто существование рецепторов D3 и, может быть, D4, D5…) и отсутствием так называемых дефицитарных симптомов;
— второй тип характеризовался бы неявным началом, интеллектуальным снижением, расширением боковых желудочков, плохой реакцией на классические нейролептики и преобладанием дефицитарных симптомов.
Это различие основывается на патогенетической гипотезе, утверждающей, что так называемые позитивные симптомы, соответствующие первому типу, выражают расстройство дофаминергических передач, тогда как так называемые негативные симптомы соответствуют утрате клеток на уровне мозговых структур. В других своих трудах TJ. Crow принадлежит к тем авторам, которые полагают, что повреждения мозговых клеток, с которыми они связывают шизофренический процесс, по крайней мере, в том, что касается второго типа, являются следствием вирусной инфекции.
Тем не менее, TJ. Crow вводит параметр прогредиентности: действительно, по его мнению, позитивные симптомы более часто встречаются при «острых шизофрениях», тогда как негативные симптомы скорее характеризуют хроническую шизофрению. Поскольку все больные шизофренией могут обнаружить позитивные симптомы, то, в конечном счете, появление или отсутствие негативных симптомов дает ключ к различению между этими двумя типами. Таким образом, если в ходе развития шизофрении первого типа констатируют тяжелые и стойкие негативные симптомы, то она должна в конце концов рассматриваться как относящаяся ко второму типу. Следовательно, эта концепция, о которой TJ. Crow сам будет говорить через несколько лет как о «понятии двух синдромов» /50/, не разделяет шизофрению полностью на две различные болезни. Хотя концепция различает два типа, полагая, что они соответствуют двум патогенезам, она допускает переход одного типа в другой, по крайней мере, от первого ко второму. Предполагается, что соответствующие патогенные механизмы также могут трансформироваться из одного в другой.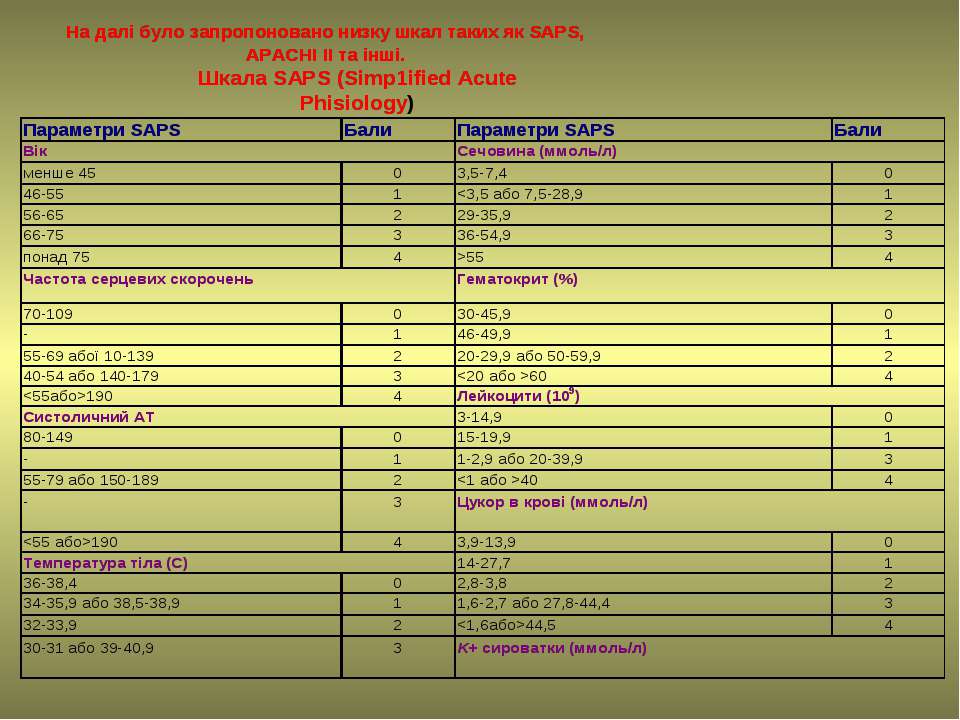 Сохранение критерия прогредиентности заставляет вспомнить о том критерии, который принял E. Kraepelin, — терминальное интеллектуальное снижение, чтобы дать определение «dementia praecox» и сгруппировать в ней различные синдромы.
Сохранение критерия прогредиентности заставляет вспомнить о том критерии, который принял E. Kraepelin, — терминальное интеллектуальное снижение, чтобы дать определение «dementia praecox» и сгруппировать в ней различные синдромы.
Франкоязычная школа с трудом может принять концепцию, включающую в шизофрению разновидность, которую англоязычные авторы именуют «острые шизофрении», т. е. острые бредовые психозы. Еще Georget /1795-1828/, ученик J. Esquirol, отделил острые помешательства от хронических, и в 1886 г. острые психозы были выделены Magnan под наименованием бредовых приступов дегенерантов из «dementia praecox», описанной BA. Morel за четверть столетия до этого. Мы говорим сейчас о XIX в., потому что когда госпожа N. Andreasen, о трудах которой мы теперь будем говорить, пишет: «Последняя четверть этого века будет театром знаменитой эволюции, которая приведет сначала в Великобритании, а затем в Соединенных Штатах к ограничению понятия шизофрении и ослаблению значимости основных и дефицитарных симптомов», то, конечно, она говорит о нашем XX веке. Ограничение и смещение центра понятия, ставшее необходимым в англоязычных странах вследствие чрезмерного расширения понятия шизофрении, которое оно претерпело, действительно произойдет, удаляясь от первоначальной психопатологической концепции E. Bleuler.
Во Франции в то же время, что и TJ. Crow, и базируясь также на дофаминергической гипотезе Snyders, Lecrubier и его сотрудники предложили единую, но биполярную концепцию шизофрении, согласно которой позитивные симптомы соответствовали гиперфункционированию, а негативные — гипофункционированию дофаминергической системы.
N. Andreasen из университета штата Айова, исходя из представления, что симптомы, которые E. Bleuler описал как основные, фактически суть негативные или дефицитарные симптомы, а те, которые он квалифицировал как дополнительные, — это позитивные или продуктивные симптомы, углубит эту концептуальную противоположность и попытается связать ее с нейропатогенными механизмами. Поступая так, эта школа по-видимому забыла, что блейлеровское различие между основными и дополнительными симптомами основывается исключительно на психопатологических соображениях, которые закладывают фундамент самого понятия шизофрении. Было бы эпистемологической ошибкой перемещать его в другую плоскость, например, биохимии клеток головного мозга или в другую область.
Поступая так, эта школа по-видимому забыла, что блейлеровское различие между основными и дополнительными симптомами основывается исключительно на психопатологических соображениях, которые закладывают фундамент самого понятия шизофрении. Было бы эпистемологической ошибкой перемещать его в другую плоскость, например, биохимии клеток головного мозга или в другую область.
Nancy C. Andreasen определяет позитивные или продуктивные симптомы как искажение или преувеличение психических функций, которые существуют в нормальном состоянии (так галлюцинации рассматриваются как необычные восприятия и ничего больше). Негативные или дефицитарные симптомы соответствуют утрате этих функций, присутствующих в нормальном состоянии. Таким образом, в их числе, рядом с классической ангедонией (утрата способности ощущать радость и удовольствие) можно встретить другие симптомы, отмеченные отрицательной приставкой аналогия (утрата или обеднение хода мыслей и речи) и абулия (уменьшение или утрата способности начинать или доводить до конца любые дела). Айовская школа разработала оценочные шкалы как для негативных, так и для позитивных симптомов: SANS (шкала оценки негативных симптомов) и SAPS (шкала оценки позитивных симптомов). Эти шкалы имели неоспоримый международный успех, поскольку они были переведены на немецкий, китайский, корейский, испанский, французский, итальянский, японский и нидерландский языки. Это прекрасный пример современной скорости распространения по всему миру работ, касающихся шизофрении, а также развития того, что называют «количественной психопатологией», совершенно отличающейся от того, что понимали под психопатологией до сих пор. Потому что больше речь не идет о том, чтобы понять психологический смысл симптомов и что с этим связано, с риском субъективности, а о том, чтобы оценить их с помощью допускающих подсчет результатов шкал, претендующих на объективность. Цель исследований состоит в том, чтобы установить прямую причинную связь между синдромом и конкретным органическим поражением. Как пишет N. Andreasen, «идеалом была бы способность определять симптомы таким образом, чтобы иметь возможность идентифицировать лежащие в их основе нейрологические механизмы». Приверженцы этой унитарной, но биполярной концепции для негативных симптомов, которые оцениваются по шкале SANS, считают источником их церебральные структурные аномалии или лобную дисфункцию. Эта школа даже полагает, что установила связь между этими негативными синдромами и расширением желудочков, констатируемым у некоторых шизофреников. Сама N. Andreasen признает, что значительность, придаваемая этим негативным симптомам, особенно если бы подтвердилась корреляция с мозговыми поражениями, могла бы привести к терапевтическому нигилизму. К счастью, в большом количестве случаев — это фактически ложно-негативные симптомы, если можно так сказать: «Подобные дефицитарные симптомы в действительности являются следствием продуктивных симптомов и отступают, когда отступают продуктивные симптомы. В других случаях клиническая картина, сравнимая с картиной дефицитарной симптоматики, может быть создана самими нейролептиками, которые имеют тенденцию вызывать вторичные явления паркинсоновского типа». В этих условиях не удивляет, что N. Andreasen выбирает в качестве модели своей концепции шизофренического психоза с негативными симптомами концепцию, которая более неврологическая, чем психиатрическая. Это концепция неврологической болезни: «Модель болезни Паркинсона показывает нам, что даже при наличии структурных аномалий, вследствие утраты нейронов, тяжелые симптомы могут быть смягчены, благодаря применению медикаментов» /7/. Конечно, речь идет о болезни Паркинсона, какой ее можно представить себе после принятия во внимание особенностей дофаминергической системы нигростриарной субстанции. Чтобы еще больше осложнить вопрос, нужно заметить, что если эти негативные симптомы не реагируют на классические нейролептики, используемые в обычных дозах, то другие нейролептики, именуемые по этой причине атипичными или анти-дефицитарными, в слабых дозах оказывают стимулирующее действие, приводящее к улучшению, — эффект, описанный в 1970 г.
Как пишет N. Andreasen, «идеалом была бы способность определять симптомы таким образом, чтобы иметь возможность идентифицировать лежащие в их основе нейрологические механизмы». Приверженцы этой унитарной, но биполярной концепции для негативных симптомов, которые оцениваются по шкале SANS, считают источником их церебральные структурные аномалии или лобную дисфункцию. Эта школа даже полагает, что установила связь между этими негативными синдромами и расширением желудочков, констатируемым у некоторых шизофреников. Сама N. Andreasen признает, что значительность, придаваемая этим негативным симптомам, особенно если бы подтвердилась корреляция с мозговыми поражениями, могла бы привести к терапевтическому нигилизму. К счастью, в большом количестве случаев — это фактически ложно-негативные симптомы, если можно так сказать: «Подобные дефицитарные симптомы в действительности являются следствием продуктивных симптомов и отступают, когда отступают продуктивные симптомы. В других случаях клиническая картина, сравнимая с картиной дефицитарной симптоматики, может быть создана самими нейролептиками, которые имеют тенденцию вызывать вторичные явления паркинсоновского типа». В этих условиях не удивляет, что N. Andreasen выбирает в качестве модели своей концепции шизофренического психоза с негативными симптомами концепцию, которая более неврологическая, чем психиатрическая. Это концепция неврологической болезни: «Модель болезни Паркинсона показывает нам, что даже при наличии структурных аномалий, вследствие утраты нейронов, тяжелые симптомы могут быть смягчены, благодаря применению медикаментов» /7/. Конечно, речь идет о болезни Паркинсона, какой ее можно представить себе после принятия во внимание особенностей дофаминергической системы нигростриарной субстанции. Чтобы еще больше осложнить вопрос, нужно заметить, что если эти негативные симптомы не реагируют на классические нейролептики, используемые в обычных дозах, то другие нейролептики, именуемые по этой причине атипичными или анти-дефицитарными, в слабых дозах оказывают стимулирующее действие, приводящее к улучшению, — эффект, описанный в 1970 г./_118/118.jpg) Deniker и Ginestet /59/. Поэтому более логично было бы рассматривать негативные симптомы как результат торможения, а не дефицита. Один свежий обзор Trimble показывает путаницу, царящую среди английских психиатров по вопросу значения терминов «негативный» и «позитивный» для оценки шизофренической симптоматики, которая, по его мнению, происходит от того, что «их текущее употребление представляется как чисто описательное и лишенное всякой попытки ввести понятие механизма»/214/.
Deniker и Ginestet /59/. Поэтому более логично было бы рассматривать негативные симптомы как результат торможения, а не дефицита. Один свежий обзор Trimble показывает путаницу, царящую среди английских психиатров по вопросу значения терминов «негативный» и «позитивный» для оценки шизофренической симптоматики, которая, по его мнению, происходит от того, что «их текущее употребление представляется как чисто описательное и лишенное всякой попытки ввести понятие механизма»/214/.
По нашему мнению, дело скорее касается отсутствия определенной точной теоретической ссылки, хотя N. Andreasen и пишет: «Концептуальное понятие, на котором построена работа шкал SANS и SAPS…, основывается на идеях Hughlings Jackson /1931/», прибавляя, правда, «хотя они не вполне согласуются» и действительно, они нам также кажутся имеющими низкую конкордантность.
В своем недавнем обзоре Stanley Kay /115/ из Медицинского колледжа имени Альберта Эйнштейна в Нью-Йорке, где была разработана шкала PANSS (Шкала позитивных и негативных симптомов), конкурирующая со шкалами SANS и SAPS, поскольку она оценивает одновременно позитивные и негативные симптомы, — показал, что чисто негативные или позитивные проявления представляют только очень незначительную часть шизофрении, а между тем, со временем эти две размерности, негативная и позитивная, независимые вначале, оказываются связанными взаимной корреляцией.
Информационная значимость шкалы qSOFA для современной клинической медицины (обзор литературы)
В.А. Руднов1,2, М.Н. Астафьева2
¹ ФГБОУ ВО «Уральский государственный медицинский университет» МЗ РФ, Екатеринбург
2 МАУ «Городская клиническая больница № 40», Екатеринбург
Для корреспонденции: Руднов Владимир Александрович — д-р мед. наук, профессор, заведующий кафедрой анестезиологии, реаниматологии и токсикологии ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, заместитель главного врача по анестезиологии и реаниматологии МАУ «Городская клиническая больница № 40», Екатеринбург; e-mail: vrudnov@mail.2007/ST62/Untitled-3.gif) ru
ru
Для цитирования: Руднов В.А., Астафьева М.Н. Информационная значимость шкалы qSOFA для современной клинической медицины (обзор литературы). Вестник интенсивной терапии имени А.И. Салтанова. 2018;4:30–37.
DOI: 10.21320/1818-474X-2018-4-30-37
Активное развитие анестезиологии и реаниматологии, создание самостоятельных отделений и сложившаяся клиническая практика привели к пониманию крайней разнородности пациентов в критических состояниях. Одним из инструментов, позволяющих снизить число ошибок, принять обоснованное решение в отношении места оказания медицинской помощи, ее объема, являются количественные системы оценки тяжести общего состояния или органной дисфункции. Существенным недостатком перечисленных скоринговых систем является их относительная громоздкость, необходимость обязательного выполнения определенных лабораторных исследований, что требует дополнительного оснащения и времени. Поэтому стали предприниматься попытки создания шкал, основанных на клинических критериях или минимуме доступных параметров без потерь информационной ценности. К таковым принадлежит шкала ранней тревоги quick SOFA (qSOFA).
Цель настоящей публикации — оценка информационной значимости шкалы qSOFA и определение ее роли для неотложных и критических состояний посредством анализа литературных данных.
Заключение. Шкала qSOFA предназначена для определения риска развития органно-системной дисфункции, прогноза исхода критического состояния и определения места оказания лечебной помощи; не уступая синдрому системной воспалительной реакции (СВР) по чувствительности в отношении прогноза исхода сепсиса у пациентов с подозрением на инфекцию, заметно превосходит его по специфичности.
Ключевые слова: шкала qSOFA, прогноз исхода неотложных состояний, лактат, прокальцитонин
Поступила: 19.10.2018
Читать статью в PDF
Литература
- Saklad M. Grading of patients for surgical procedures.
 Anesthesiology. 1941; 2(3): 281–284. DOI: 10.1097/00000542-194105000-00004.
Anesthesiology. 1941; 2(3): 281–284. DOI: 10.1097/00000542-194105000-00004. - New classification of physical status. Anesthesiology. 1963; 24(1): 111.
- Apgar V. A proposal for a new method of evaluation of the newborn infant. Anesthesia and Analgesia. 1953; 32: 260–267. DOI: 10.1213/00000539-195301000-00041.
- Knaus W., Zimmerman J., Wagner D., et al. APACHE-acute physiology and chronic health evaluation: a physiologically based classification system. Critical Care Medicine. 1981; 9(8): 591–597. DOI: 10.1097/00003246-198108000-00008.
- Knaus W.A., Draper E.A., Wagner D.P., Zimmerman J.E. APACHE II: A severity of disease classification system. Critical Care Medicine. 1985; 13(10): 818–829. DOI: 10.1097/00003246-198510000-00009.
- Le Gall J.R., Lemeshow S., Saulnier F. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter study. The Journal of the American Medical Association. 1993; 270(24): 2957–2963. DOI: 10.1001/jama.1993.03510240069035.
- Fine M.J., Auble T.E., Yealy D.M., et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. New England Journal of Medicine. 1997; 336(4): 243–250. DOI: 10.1056/nejm199701233360402.
- Vincent J.L, Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. Intensive Care Medicine. 1996; 22(7): 707–710. DOI: 10.1007/s001340050156.
- Cullen D., Civetta J., Biggs B., Ferrara L.C. Therapeutic intervention scoring system: a method for quantitative comparison of patient care. Critical Care Medicine. 1974; 2(2): 57–60. DOI: 10.1097/00003246-197403000-00001.

- Leteurtre S., Duhamel A., Grandbastien B., et al. Paediatric logistic organ dysfunction (PELOD) score. The Lancet. 2006; 367(9514): 897. DOI: 10.1016/s0140-6736(06)68371-2.
- Lim W., Van der Eerden M., Laing R., et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax. 2003; 58(5): 377–382. DOI: 10.1136/thorax.58.5.377.
- Aujesky D., Auble T.E., Yealy D.M., et al. Prospective comparison of three validated prediction rules for prognosis in community-acquired pneumonia. The American Journal of Medicine. 2005; 118(4): 384–392. DOI: 10.1016/j.amjmed.2005.01.006.
- Seymour C.W., Liu V.X., Iwashyna T.J., et al. Assessment of clinical criteria for sepsis for the third International consensus definition for sepsis and septic shock (Sepsis-3). The Journal of the American Medical Association. 2016; 315(8): 762–774. DOI: 10.1001/jama.2016.0288.
- Churpek M.M., Snyder A., Han X., et al. Quick sepsis-related organ failure assessment, systemic inflammatory response syndrome, and early warning scores for detecting clinical deterioration in infected patients outside the intensive care unit. American Journal of Respiratory and Critical Care Medicine. 2017; 195(7): 906–911. DOI: 10.1164/rccm.201604–0854oc.
- Fernando S.M., Reardon P.M., Rochwerg B., et al. Sepsis-3 Septic Shock Criteria and Associated Mortality Among Infected Hospitalized Patients Assessed by a Rapid Response Team. Chest. 2018; 154(2): 309–316. DOI: 10.1016/j.chest.2018.05.004.
- Poutsiaka D.D., Porto M., Perry W., et al. Comparison of the Sepsis-2 and Sepsis-3 Definitions of Sepsis and Their Ability to Predict Mortality in a Prospective Intensive Care Unit Cohort.
 Open Forum Infectious Disease. 2017; 4(Suppl. 1): 602. DOI: 1093/ofid/ofx163.1579.
Open Forum Infectious Disease. 2017; 4(Suppl. 1): 602. DOI: 1093/ofid/ofx163.1579. - Park H.K., Kim W.Y., Kim M.C., et al. Quick sequential organ failure assessment compared to systemic inflammatory response syndrome for predicting sepsis in emergency department. Journal of Critical Care. 2017; 42: 12–17. DOI: 10.1016/j.jcrc.2017.06.020.
- Battle S.E., Augustine M.R., Bookstaver P.B., et al. A Simplified Pitt Bacteremia Score (qPitt) to Predict Mortality in Patients with Gram-negative Bloodstream Infection. Open Forum Infectious Diseases. 2017; 4(S1): 555–556. DOI: 10.1093/ofid/ofx163.1445.
- Burnham J.P., Kollef M.H. qSOFA score: Predictive validity in Enterobacteriaceae bloodstream infections. Journal of critical care. 2018; 43: 143–147. DOI: 10.1016/j.jcrc.2017.09.011.
- АстафьеваМ.Н., Руднов В.А., Кулабухов В.В. и др. Использование шкалы qSOFA в прогнозе исхода у пациентов с сепсисом в ОРИТ. Результаты Российского многоцентрового исследования РИСЭС. Вестник анестезиологии и реаниматологии. 2018; 15(5): 26–35. [Astafeva M., Rudnov V., Kulabukhov V., et al. Use of the qSOFA scale in prognosis of outcome of patients with sepsis in ICU. Results of russian national study RISES. Messenger of Anesthesiology and Resuscitation. 2018; 15(5): 26–35. (In Russ)]
- Vincent J.L., Rello J., Marshal J., et al. International study of prevalence and outcomes of infection in ICU. The Journal of the American Medical Association. 2009; 302(21): 2323–2329. DOI: 10.1001/jama.2009.1754.
- Welte T., Torres A., Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe.
 Thorax. 2012; 67(1): 71–79. DOI: 10.1136/thx.2009.129502.
Thorax. 2012; 67(1): 71–79. DOI: 10.1136/thx.2009.129502. - Chen Y.X., Wang J.W., Guo S.B. Use of CRB-65 and quick Sepsis-related Organ Failure Assessment to predict site of care and mortality in pneumonia patients in the emergency department: a retrospective study. Critical Care. 2016; 20(1): 167. DOI: 10.1186/s13054-016-1351-0.
- Ranzani O., Prina E., Menenez R. New Sepsis Definition (Sepsis-3) and Community-acquired Pneumonia Mortality. A Validation and Clinical Decision-Making Study. American Journal of Respiratory and Critical Care Medicine. 2017; 196(10): 1287–1297. DOI: 10.1164/rccm.201611–2262oc.
- Kolditz M., Scherag A., Rohde G., et al. Comparison of the qSOFA and CRB-65 for risk prediction in patients with community-acquired pneumonia. Intensive Care Medicine. 2016; 42(12): 2108–2110. DOI: 10.1007/s00134-016-4517-y.
- Bhattachajee P., Edelson D., Churpek M. Identifying patients with sepsis on the hospital wards. Chest. 2017; 151(4): 898–907. DOI: 10.1016/j.chest.2016.06.020.
- Forward E., Konecny P., Burston J., et al. Predictive validity of the qSOFA criteria for sepsis in non-ICU inpatients. Intensive Care Medicine. 2017; 43: 945–946. DOI: 10.1007/s00134-017-4776-2.
- Serafim R., Gomes J.A., Salluh J., Póvoa P. A comparison of the Quick-SOFA and systemic inflammatory response syndrome criteria for the diagnosis of sepsis and prediction of mortality. A systematic review and meta-anallysis. Chest. 2017; 153(3): 646–655. DOI: 10.1016/j.chest.2017.12.015.
- Churpek M.M., Snyder A., Sokol S., et al. Investigating the Impact of Different Suspicion of Infection Criteria on the Accuracy of Quick Sepsis-Related Organ Failure Assessment, Systemic Inflammatory Response Syndrome, and Early Warning Scores.
 Critical Care Medicine. 2017; 45(11): 1805–1812. DOI: 10.1097/ccm.0000000000002648.
Critical Care Medicine. 2017; 45(11): 1805–1812. DOI: 10.1097/ccm.0000000000002648. - Kievlan D., Zhang L.A., Kahn J., et al. Serial evaluation of qSOFA among patients with suspected infection. Critical Care Medicine. 2016; 44(1): 412. DOI: 10.1097/01.ccm.0000510019.33158.70.
- Na H.J., Lee K., Jeong E.S., et al. Clinical application of the qSOFA in ICU patients with bacteremia: A single center study in Korea. Critical Care Medicine. 2016; 44(12): 410. DOI: 10.1097/01.ccm.0000510011.79792.02.
- Nishiwaki H., Hasegawa T., Sasaki S., et al. External validation study of the qSOFA for Japanese patients undergoing hemodialysis. Nephrology Dialysis Transplantation. 2017; 32(Suppl. 3): 482. DOI: 10.1093/ndt/gfx164.mp148.
- АстафьеваМ.Н., Руднов В.А., Кулабухов В.В. и др. Использование шкалы qSOFA в диагностике сепсиса. Вестник анестезиологии и реаниматологии. 2018; 15(4): 14–22. [Astafeva M., Rudnov V., Kulabukhov V., et al. Use of the qSOFA scale in diagnosis of sepsis. Results of russian national study RISES. Messenger of Anesthesiology and Resuscitation. 2018; 15(4): 14–22. (In Russ)]
- Kyo M., Ohshimo S., Kida Y., Shime N. The validation qSOFA criteria for sepsis. Critical Care Medicine. 2016; 44(12): 448. DOI: 10.1097/01.ccm.0000510166.80446.5f.
- Holdstock V., Shaw M., Puxty A., et al. Ability of qSOFA, SIRS, NEWS, SOFA predict sepsis in patients admitted to ICU. Critical Care Medicine. 2018; 46(1): 740. DOI: 10.1097/01.ccm.0000529515.19526.73.
- Schlapbach L.J., Straney L., Bellomo R., et al. Prognostic accurancy of age-adapted SOFA, SIRS, PELOD-2 and qSOFA for in-hospital mortality among children with suspected infection admitted to the intensive care unit.
 Intensive Care Medicine. 2018; 44(2): 179–188. DOI: 10.1007/s00134-017-5021-8.
Intensive Care Medicine. 2018; 44(2): 179–188. DOI: 10.1007/s00134-017-5021-8. - Sprung C., Schein R., Balk R. The new consensus definitions: the good, the bad and the ugly. Intensive Care Medicine 2016; 42(12): 2024–2026. DOI: 10.1007/s00134-016-4604-0.
- Fantom N., Serajuddin U. The World Bankʼs Classification of Countries by Income, Policy Research Working Paper Series, no. 7528, Washington, DC: World Bank. 2016. [Internet] Available from http://documents.worldbank.org/curated/en/408581467988942234/pdf/WPS7528.pdf (accessed 01.07.2018).
- Mills A. Health Care systems in low- and middle-income countries. New England Journal of Medicine. 2014; 370(6): 552–557. DOI: 10.1056/nejmra1110897.
- Rudd K.E., Seymour C.W., Aluisio A.R., et al. Association of the Quick Sequential (Sepsis-Related) Organ Failure Assessment (qSOFA) Score With Excess Hospital Mortality in Adults With Suspected Infection in Low- and Middle-Income Countries. The Journal of the American Medical Association. 2018; 319(21): 2202–2211. DOI: 10.1001/jama.2018.6229.
- Khwannimit B., Bhurayanontachai R., Vattanavanit V. Comparison of the performance of SOFA, qSOFA and SIRS for predicting mortality and organ failure among sepsis patients admitted to the intensive care unit in a middle-income country. Journal of Critical Care. 2018; 44: 156–160. DOI: 10.1016/j.jcrc.2017.10.023.
- Ho K.M., Lan N.S.H. Combining quick Sequential Organ Failure Assessment with plasma lactate concentration is comparable to standard Sequential Organ Failure Assessment score in predicting mortality of patients with and without suspected infection. Journal of Critical Care. 2017; 38: 1–5. DOI: 10.1016/j.jcrc.2016.10.005.
- Jung Y.T., Lee J.G., Lee S.H.
 , et al. Combination of QSOFA score with hyperlactatemia improves mortality prediction for surgical patients. Critical Care Medicine. 2018; 46(1): 715. DOI: 10.1097/01.ccm.0000529464.06958.86.
, et al. Combination of QSOFA score with hyperlactatemia improves mortality prediction for surgical patients. Critical Care Medicine. 2018; 46(1): 715. DOI: 10.1097/01.ccm.0000529464.06958.86. - Song J.U., Sin C.K., Park H.K., et al. Performance of the quick Sequential (sepsis-related) Organ Failure Assessment score as a prognostic tool in infected patients outside the intensive care unit: a systematic review and meta-analysis. Critical Care. 2018; 22(1): 28. DOI: 10.1186/s13054-018-1952-x.
- Maitra S., Som A., Bhattacharjee S. Accuracy of quick Sequential Organ Failure Assessment (qSOFA) score and systemic inflammatory response syndrome (SIRS) criteria for predicting mortality in hospitalized patients with suspected infection: A meta-analysis of observational studies. Clinical Microbiology and Infection. 2018; 24(11): 1123–1129. DOI: 10.1016/j.cmi.2018.03.032.
- Barreto B., Luz M., Gusmao-Flores D. Prognostic accurancy of quick sequential organ failure assessment (qSOFA) score for mortality: systematic review and meta-analysis. Critical Care. 2018; 22(S1): 34. DOI: 10.1186/s13054-018-1973-5.
- Fernando S.M., Tran A., Taljaard M., et al. Prognostic accuracy of the quick sequential organ failure assessment for mortality in patients with suspected infection. Annals of Internal Medicine. 2018; 168(4): 266–275. DOI:10.7326/M17–2820.
Вероятность развития тяжелого сепсиса у больных некротической рожей в пожилом и старческом возрасте
Резюме:Цель: на основании комплексной оценки (клиническое обследование с применением систем-шкал и определение уровня маркеров синдрома системной воспалительной реакции) определить вероятность развития тяжелого сепсиса у больных некротической рожей в пожилом и старческом возрасте. Материал и методы. Проведен анализ особенностей клинического течения некротической рожи у 59 больных. В первую группу вошли 17 пациентов с тяжелым сепсисом, во вторую — 18 больных с сепсисом без полиорганной недостаточности, в группу сравнения —22 пациента с локальной инфекцией. Определяли альбумин, мочевину, креатинин, прокаль-цитонин плазмы крови. Для количественного выражения ССВР использовали шкалу SAPS III, для определения степени повреждения органов и систем — шкалу SOFA. Результаты. Наиболее чувствительным маркером развивающегося сепсиса у больных некротической рожей оказался прокальцитонин. Вторым важным индикатором тяжести ССВР при некротической роже явился альбумин крови. Шкала SAPS III также позволяет выделить группу больных с высокой вероятностью развития тяжелого сепсиса. Использование для прогнозирования шкалы SOFA оказалось менее значимо. Заключение. Для прогнозирования вероятности развития тяжелого сепсиса у больных некротической рожей в пожилом и старческом возрасте целесообразно применять комплексную оценку тяжести состояния с использованием шкалы SAPS III в сочетании с определением уровней прокальцитонина и альбумина плазмы. Для последнего показателя важна как оценка абсолютных значений, так и динамика снижения его концентрации.
В первую группу вошли 17 пациентов с тяжелым сепсисом, во вторую — 18 больных с сепсисом без полиорганной недостаточности, в группу сравнения —22 пациента с локальной инфекцией. Определяли альбумин, мочевину, креатинин, прокаль-цитонин плазмы крови. Для количественного выражения ССВР использовали шкалу SAPS III, для определения степени повреждения органов и систем — шкалу SOFA. Результаты. Наиболее чувствительным маркером развивающегося сепсиса у больных некротической рожей оказался прокальцитонин. Вторым важным индикатором тяжести ССВР при некротической роже явился альбумин крови. Шкала SAPS III также позволяет выделить группу больных с высокой вероятностью развития тяжелого сепсиса. Использование для прогнозирования шкалы SOFA оказалось менее значимо. Заключение. Для прогнозирования вероятности развития тяжелого сепсиса у больных некротической рожей в пожилом и старческом возрасте целесообразно применять комплексную оценку тяжести состояния с использованием шкалы SAPS III в сочетании с определением уровней прокальцитонина и альбумина плазмы. Для последнего показателя важна как оценка абсолютных значений, так и динамика снижения его концентрации.
Литература:
1. Eriksson В, Andersson G, Holm S, et al. Epidemiological clinical aspects of invasive group A streptococcus infections and the streptococcal toxic shock syndrome. Clin Inf Dis 1998; (27): 1428-1436
2. Данилова Т.А. Инвазивная инфекция, вызываемая стрептококками группы А, и синдром стрептококкового токсического шока. Микробиология 2001; (3): 99-105)
3. Olivier С. Severe Streptococcus pyogenes cutaneous infections. Arch Pediatr 2001; (4): 757-761
4. Гельфанд Б.Р, Яковлев С.В., Ярошецкий А.И. и др. Применение активированного протеина С в лечении больных тяжелым сепсисом. Хирургия 2004; (1): 19-24
5. Аджамов Б.М., Шляпников С.А., Насер H.P. Принципы индивидуальной пациент-ориентированной антимикробной терапии при лечении больных с септическими осложнениями. Инфекции в хирургии 2011; (1): 26-30
6. Гельфанд Б.Р, Филимонов М.И., Бражник Т.Б. и др. Прокальцитонин: новый лабораторный диагностический маркер сепсиса и гнойно-септических осложнений в хирургии (ч. 1). Вестник интенсивной терапии 2003; (1): 9-12
Гельфанд Б.Р, Филимонов М.И., Бражник Т.Б. и др. Прокальцитонин: новый лабораторный диагностический маркер сепсиса и гнойно-септических осложнений в хирургии (ч. 1). Вестник интенсивной терапии 2003; (1): 9-12
7. Meisner М, Tschaikowsky К, Palmaers Т, et al. Comparison of procalcitonin (PCT) and C-reactive protein (CRP) plasma concentrations at different SOFA scores during the course of sepsis and MODS. Critcal Care 1999; 3 (1): 45-50
8. Meisner M, Tschaikowsky K, Palmaers T, et al. Comparison of procalcitonin (PCT) and C-reactive protein (CRP) plasma concentrations at different APACHE II scores during the course of sepsis and MODS. Anaesthesiology (Abstract) 1997; (87): 243
9. Родоман Г.В., Шалаева Т.И., Дынжинова Т.В. Сывороточный альбумин при синдроме системной воспалительной реакции и полиорганной недостаточности. Инфекции в хирургии 2004; (3): 12-16.
Интегральная оценка состояния больных и прогноза при тяжелой политравме
1. Картавснко В.И., Бармнка А.А. Современные подходы к классификации сочетанных повреждений н определению тяжести состояния пострадавших// М,, 1997.- 21 с.
2. Журавлев С.М. Пугннцев А,Н. и др. Оценка эффективности оказания медицинской помощи пострадавший с тяжелыми механическими повреждениями. Метод. Рекомендации. М., 1999, 22 с.
3. Гельфанд Е.Б. Абдоминальный сепсис при перитоните; клиническая характеристика и эффективность антибактериальной терапии t Автореферат дне,. канд. мед-наук, -М., 1999,- 43 с.
4. Светухии A.M., Звягин А.А., Слепнев С.Ю. Системы объективной оценки тяжести состояния больных. Часть I // Хирургия.- 2002.- № 9-С.61-57.
5. Светухин А-М., Звягин А.А. Слепнев С.Ю. Системы объективной оценки тяжести состояния бальных. Масть II // Хирургия.- 2002 10 -С.60-69.
6. Богомазов В.В. Разработка табличного метода прогнозирования исходов травматического шока // Актуальные вопросы космической биологии к медншшы.-М., 1975.-8ыл.2.-С.ЗЗ-35,
7. Бурпука В.В. Клинико-потофизнологнческая оценка синдрома взаимного отягощения у пострадавших с сочстанной закрытой травмой грудн и Юншчна xipypm.-l996,’№lO.-C. 10-12.
Бурпука В.В. Клинико-потофизнологнческая оценка синдрома взаимного отягощения у пострадавших с сочстанной закрытой травмой грудн и Юншчна xipypm.-l996,’№lO.-C. 10-12.
8. Вишневский Л А., Брайнес С.Н-, Харнас С.Ш., и др- Табличный метод прогнозирования исхода множественных травм, осложненных травматическим шоком// Экспериментальная хирургия и анестезиология.- . 976.-Ж.-С.6-9,
9. Голобородько ПК., Булата В.В., Мануйлова А.М., Марченко З.П, Разработка количественных методов оценки степени повреждений живота при иолнтравме и шоке // Общая и неотложная хирургия ,-t 980.-Вып.10.-С.93-96.
10. Гуманен ко EJC, Бояринцев В.В., Ващснко В.В., Супрун ТЛО. Объективная оценка тяжести травм// Воен-мед. Жури,- 1996,- №10.-С,25-34.
11. Клнменко Н.Б., Касумов Р.Д., Григорьев С.Г, Прогнозирование ранних исходов тяжелой черепно-мозговой травмы в зависимости от длительности неврологических синдромов и наличия осложнений// Вести.хир.- 2001.- С.46-49.
12. Лисенко Б, П., Шейко В. Д., Оценка тяжести полнтравмы с прогнозированием исходов травмтической болезни// Ортопед.травматол’2000,- №1С.36-40.
13. Мамадалиев A.M., Шахновнч А.Р., Абакумова Л.Я, и соавт, Хирургическое лечение болььных с черепно-мозговой травмой н роль неврологической симптоматики для прогнозирования исходов/ Вест.хнр.- 1989.- №5.- С.68-72.
14. Мещеряков Г-Н., Радасв С.М., Закс И.О. и соавт. Системы оценки тяжести состояния компонент методологии лечебной работы (Обзор литературы)// Реаниматология и интенсивная терапия,-1999,- №t.-С Л 9-28.
15. Шпаченко НИ. Прогнозирование исходов тяжелых механических травм у шахтеров в остром периоде травматической болезни// Травма.-2003-Т.4,-№2.-С16Мб7.34, www. WHO-orn
16. Охотский ВП Состояние и перспективы научных исследований по проблеме сочетанной травмы// Сб.кауч.тр, «Оказание помощи при сочстанной травме» НИИ СП им.Н.В.Склифосовского, ТЛ08, 1997, с.5-9.
17. De Haven Н. The site, frequency and dangerousness of injury sustained in 800 survivors of light plane accidents. NY, 1952.
NY, 1952.
18. Committee on Medical Aspects of Automotive Safety: rating the severity of tissue damage, the abbreviated scale// JAMA. 1971, V.215 p. 277-280.
19. Baker S.P. et al. The Injury Severity Score: a method for describing patients with multiple injuries and evaluation emergency care// J. Trauma. 1974, 14: 187-96.
20. Kirkpatrick J.R., Youmans R.L. Trauma Index: an aid of evaluation of injury victims// J.Trauma, 11: 711-14.
21. Oestem H I. et al. Hefte zur Unfallhetkunde. 1983. 156: 171-6.41 .Champion H.R. et al (1980). An anatomic index of injury severity. J Trauma 20:197.
22. Champion H.R- et a. (1981). Trauma Score. Crit Care Med 9: 672-6.
23. Champion H.R. et al (1989). A revision of Trauma Score. 29; 623-7
24. Boyd C.R. et al (1987). Evaluating trauma care: the TRISS method, J Trauma. 27: 370-7.
25. Pillgram-Larsen J. (1989) Assessment of probability of survival in penetrating injuries using the TRISS methodology. Injury. 20: 10-12.
26. Champion H.R. et al (1990) A new characterization of injury severity. J Trauma. 30: 1356-65.
27. Champion H.R. et al (J996) Improved predictions from A Severity Characterization Of Trauma (ASCOT) over TRISS: Results of independent evaluation. J Trauma. 40: 42-47,
28. Osier T. Rutledge R. et al. (1996) ICISS; An International Classification of Diseases-9 based Injury Severity Score. J Trauma. 41:380-8.
29. Lasch С (1979) The Culture of Narcissism: American Life in an Age of Diminishing Expectations, WW Norton, New York
30. Cullen DJ, Civet la JM, Briggs В A, Ferrara LC (1974) Therapeutic intervention scoring system: a method for quantitative comparison of patient care, Crit Care Med 2:57-60
31. Keene AR, Cullen DJ (1983) Therapeutic Intervention Scoring System; update 1983. Crit Care Med 11:1-3
32. Cullen DJ, Nemeskal AR, Zaslavsky AM (1994) Intermediate TISS: a new Therapeutic Intervention Scoring System for non-ICU patients. Crit Care Med 22:1406-1411
33. Miranda DR, de Rijk A, Schaufeli W (1996) Simplified Therapeutic Intervention Scoring System: the TISS-28 items results from a mult i center study. Crit Care Med 24:64-73
Miranda DR, de Rijk A, Schaufeli W (1996) Simplified Therapeutic Intervention Scoring System: the TISS-28 items results from a mult i center study. Crit Care Med 24:64-73
34. Knaus WA, Zimmerman JE, Wagner DP. Draper EA, Lawrence DE (1981) APACHE-acute physiology and chronic health evaluation: a physiologically based classification system. Crit Care Med 9:591-597
35. Ridley S (1998) Severity of illness scoring systems and performance appraisal. Anaesthesia 53:1185-1194
36. Harrelt FE, CalifFRM, Pryor DP (19B4) Regression models for prognosticprediction: advantages, problems and suggested solutions. Stat Med 3:143152
37. Le Gall JR, Loiral P, Alpcroviteh A, et a! (1984) A simplified acute physiology score for ICU patients. Crit Care Med 12:975-977
38. Le Gall JR. Lolrat P. Nicolas F. et al (1983) Use of a severity index in 8 multidi.seiplinary resuscitation centers. Press Med 12:1757-1761
39. Youden WJ (1950) Index for rating diagnostic tests. Cancer 3:32
40. Knaus WA, Draper EA, Wagner DP, Zimmerman JE (1985) APACHE II: aseverity of disease classification system. Crit Care Med 13:818-829
41. Gustafson DH, Flyback D, Rose J, et al (1981) A decision theoretic methodology for severity index development. Med Decis Making 6:27-35
42. Kenney RA (1982) Physiology of Aging: A Synopsis. Year Book Medical Publishers Inc. Chicago
43. Wagner DP, Knaus WA, Draper EA (1983) Statistical validation of a severity of illness measure. Am J Public Health 73:878-884
44. Horst HM, Obeid FN, Sorensen VJ, Bivins В A (1986) Factors influencing survival of elderly trauma patients, Crit Care Med (4:681-684
45. Cerra FB, Negro F, Abrams J (1990) APACHE II score does not predict multiple organ failure or mortality in postoperative surgical patients. Arch Surg 125:519-522
46. Moreau R, Soupison Tr Vauquelin P, Derrida S, Bcaucour H, Sicot С (1989) Comparison of two simplified severity scores (SAPS and APACHE II) for patients with acute myocardial infarction. Crit Care Med 17:409-413
Crit Care Med 17:409-413
47. Fcdullo AJ, Swinburne AJ, Wahl GW, Bixby KR (1988) APACHE II score and mortality in respiratory failure due to cardiogenic pulmonary edema.
48. Crit Care Med 16:1218-1221
49. Wehler M, Kokoska J, Reulbach U, Hahn EG. Strauss R (2001) Short-term prognosis in critically ill patients with cirrhosis assessed by prognostic scoring systems. Hepatology 34:255-261
50. Hazelgrove JF. Price C. Pappachan VJ, Smith GB (2001) Multicenter study of obstetric admissions to 14 intensive care units in southern England. Crit Care Med 29:770-775
51. Schwilk B, Wicdeck H, Stein B, Reinelt H, Treiber H, Bothner U (1997) Epidemiology’ of acute renal failure and outcome of haemodiafiltration in intensive care. Intensive Care Med 23:1204-1211
52. Hopefl AW, Taafle CL, Herrmann VM (1989) Failure of APACHE II alone as a predictor of mortality in patients receiving total parenteral nutrition. Crit Care Med 17:414-417
53. Chu DY (1993) Predicting survival in AIDS patients with respiratory failure. Application of the APACHE II scoring system. Crit Care Clin 9:89105
54. Eapcn CE, Thomas K, Cherian AM, Jeyaseelan L, Mathai D, John G (1997) Predictors of mortality in a medical intensive care unit. Natl Med J India 10:270-272
55. Lemeshow S. Teres D, Pastides H, Avrunin JS, Steingrub JS (1985) A method for predicting survival and mortality of ICU patients using objectively derived weights. Crit Care Med 13:519-525
56. SI.Chang RW, Jacobs S, Lee В (1988) Predicting outcome among intensive care unit patients using computerised trend analysis of daily Apache II scores corrected for organ system failure. Intensive Care Med 14:558-566
57. С hang RW, Jacobs S, Lee B, Pace N (1988) Predicting deaths among intensive care unit patients. Grit Care Med 16:34-42
58. Atkinson S, Bihari D, Smithies M, Daly K, Mason R, McColl I (1994) Identification of futility in intensive care. Lancet 344:1203-1206
59. Rogers J, Fuller HD (1994) Use of daily Acute Physiology and Chronic Health Evaluation (APACHE) II scores to predict individual patient survival rate. Crit Care Med 22:1402-1405
Crit Care Med 22:1402-1405
60. Knaus WA, Wagner DP. Draper EA, et at (1991) The APACHE Ш prognostic system. Risk prediction of hospital mortality for critically ill hospitalized adults. Chest 100:1619-1636
61. Becker RB, Zimmerman JE. Knaus WA, et aJ (1995) The use of APACHE III to evaluate ICU length of stay, resource use, and mortality after coronary artery by-pass surgery, J Cardiovasc Surg (Torino) 36:1-11
62. Durrieman S, Simon R (1989) Flexible regression models with cubic splines. Stat Med 8:551-561
63. Lcmcshow S, Teres D, Klar J, Avninin JS, Gchlbach SH. Rapoport J (1993) Mortality Probability Models (MPM II) based on an international cohort of intensive care unit patients. JAMA 270:2478-2486
64. Daley J (1994) Validity of risk-adjustment methods. In: lezzoni LI (ed) Risk Adjustment for Measuring Health Care Outcomes. Health Administration Press, Ann Arbor, pp 239-262
65. Kruse JA, Thill-Baharozian MC, Carlson RW (1988) Comparison of clinical assessment with APACHE II for predicting mortality risk in patients admitted to a medical intensive care unit, JAMA 260:1739-1742
66. Brannen AL, 2nd, Godfrey LJ, Goettcr WE (1989) Prediction of outcome from critical illness. A comparison of clinical judgment with a prediction rule. Arch Intern Med 149:1083-1086
67. McClish DK, Powell SH (1989) How well can physicians estimate mortality Ln a medical intensive care unit? Med Decis Making 9:125-132
68. Poses RM, Bekes C, Winkler RL, Scott WE, Copare FJ (1990) Are two (inexperienced) heads better than one (experienced) head? Averaging house officers’ prognostic judgments for critically ill patients. Arch Intern Med 150:1874-1878
69. Pappachan JV, Millar B, Bennett ED, Smith GB (1999) Comparison of outcome from intensive care admission after adjustment for case mix by the APACHE III prognostic system. Chest 115:802-810
70. Livingston BM, MacKirdy FN, Howie JC, Jones R, Norrie JD (2000) Assessment of the performance of five intensive care scoring models within a large Scottish database. uez-Mata G, Bravo M, et al (1998) The Apache III prognostic system: customized mortality predictions for Spanish ICU patients. Intensive Care Med 24:574-581
uez-Mata G, Bravo M, et al (1998) The Apache III prognostic system: customized mortality predictions for Spanish ICU patients. Intensive Care Med 24:574-581
72. Bastos PG, Sun X, Wagner DP, Knaus WA, Zimmerman JE (1996) Application of the APACHE III prognostic system in Brazilian intensive care units: a prospective multicentre study. Intensive Care Med 22:564-570
73. Zimmerman JE, Wagner DP, Draper EA, Wright L, Alzola C, Knaus WA (1998) Evaluation of acute physiology and chronic health evaluation III predictions of hospital mortality in an independent database. Crit Care Med 26:1317-1326
74. Sirio CA, Shepardson LB, Rotondi AJ, et al (1999) Community-wide assessment of intensive care outcomes using a physiologically based prognostic measure: implications for critical care delivery from
75. Cleveland Health Quality Choice. Chest 115:793-801
76. Le Gall JR, Lemeshow S, Saulnicr F (1993) A new Simplified Acute Physiology’ Score (SAPS I!) based on a European/North American multicenter study, JAMA 270:2957-2963
77. Cleveland WS (1979) Robust locally weighted regression and smoothing scauerplots. J Am Stat Assoc 74:829-836
78. Bahloul F. Le Gall JR. Loirat P, Alperovitch A, Patois E (1988) Prognostic factors in resuscitation. Presse Med 17:1741-1744
79. Auriant I, Vinatier I, Thaler F, Toumcur M, Loirat P (1998) Simplified acute physiology score II for measuring severity of illness in intermediate care units, Crit Care Med 26:1368-1371
80. Capuzzo M, Valpondi V, Sgarbi A, et al (2000) Validation of severity scoring systems SAPS II and APACHE II in a single-center population. Intensive Care Med 26:1779-1785
81. Moreno R, Morais P (1997) Outcome prediction in intensive care: results of a prospective, multicentre, Portuguese study, Intensive Care Med 23:177-186
82. Metnitz PG, Valentin A, Vesely H, el al (1999) Prognostic performance and customization of the SAPS II: results of a multicenter Austrian study. Simplified Acute Physiology Score. Intensive Care Med 25:192-197
Intensive Care Med 25:192-197
83. Leraeshow S, Klar J, Teres D, et a I (1994) Mortality probabi I ity models for patients in the intensive care unit for 48 or 72 hours; a prospective, multicenter study. Crit Care Med 22:1351-1358
84. Wagner DP, Knaus WA, НаттеИ FE, Zimmerman JE, Watts С (1994) Daily prognostic estimates for critically ill adults in intensive care units: results from a prospective, multicenter, inception cohort analysis. Crit Care Med 22:1359-1372
85. Miller RG (1974) The jackknife A review. Biometrika 61:1-15
86. Fry DE, Pearlstein L, Fulton RL, Polk HC, h (1980) Multiple system organ failure. The role of uncontrolled infection, Arch Surg115:136-140
87. Stevens LE (1983) Gauging the severity of surgical sepsis. Arch Surg 118:1190-1192
88. Marshall JC. Christou NV, Нот R, Meakins JL (1988) The microbiology of multiple organ failure. The proximal gastrointestinal tract as an occult reservoir of pathogens. Arch Surg 123:309-315
89. Knaus WA, Draper EA, WagneT DP, Zimmerman JE (1985) Prognosis in acute organ-system failure. Ann Surg 202:685-693
90. Fagon JY, Chastre J, Novara A. Mcdioni P, Gibert С (1993) Characterization of intensive care unit patients using a model based on the presence or absence of organ dysfunctions and/or infection: the ODIN model. Intensive Care Med 19:137-144
91. Hebert PC, Drummond AJ, Singer J, Bernard GR, Russell JA (1993) A simple multiple system organ failure scoring system predicts mortality of patients who have sepsis syndrome. Chest 104:230-235
92. Marshall JCf Cook DJ, Christou NV, Bernard GR, Sprung CL, Sibbald WJ (1995) Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome. Crit Care Med 23:1638-1652
93. Jacobs S, Zulcika M. Mphansa T (1999) The Multiple Organ Dysfunction Score as a de scriptor of patient outcome in septic shock compared with two other scoring systems, Crit Care Med 27:741-744
94. Cook R, Cook D, Til ley J, Lee K, Marshall J (2001) Multiple organ dysfunction: baseline and serial component scores. Crit Care Med 29:2046-2050
Crit Care Med 29:2046-2050
95. Le Gall JR, Klar J, Lcmeshow S, et al (1996) The Logistic Organ Dysfunction system. A new way to assess organ dysfunction in the intensive care unit. ICU Scoring Group. JAMA 276:802-810
96. Metnitz PG, Lang T, Valentin A, Steltzer H, Krenn CG, Le Gall JR (2001) Evaluation of the logistic organ dysfunction system for theassessment of organ dysfunction and mortality in critically ill patients. Intensive Care Med 27:992-998
97. Amonelli M, Moreno R, Vinccm JL, et al (1999) Application of SOFA score to trauma patients. Sequential Organ Failure Asscssmeni. Intensive Care Med 25:389-394
98. Hantke M, Hotzer K, Thone S, Schmandra T, Hanlsch E (2000) The SOFA score in evaluating septic illnesses. Correlations with the MOD and APACHE It scorej. Chirurg 71:1270- 1276
99. FcTTcira FL. Bota DP, Bross A. Melot C, Vincent JL (2001) Serial evaluation of the SOFA score to predict outcome in critically ill patients. JAMA 286:1754-1758
100. Moreno R, Miranda DR, Matos R, Fcvereiro T (2001) Mortality after discharge from intensive care: the impact of organ system failure and nursing workload use at discharge. Intensive Care Med 27:999-1004
101. Timsit JF, Fosse JP, Troche G, et al (2001) Accuracy of a composite score using daily SAPS II and LOD scores for predicting hospital mortality in ICU patients hospitalized for more than 72 h. Intensive Care Med 27;! 012-102!
102. Sivak ED, Rogers MA (1999) Assessing quality of care using in-hospital mortality: docs it yield informed choices? Chest 115:613-614
103. Burton TM (1999) Examining table: Operation that rated hospitals was success, but the patience died. Cleveland Clinic found fault with program of CEOs, whose ardor faded, too. Low grades spurred reforms. Wall Street Journal, New York, Al
104. Hosmcr DW, Lcmcshow S (1989) Applied Logistic regression, Wiley and Sons, New York, pp 140-145
105. Hanley JA, McNeil В J (1982) The meaning and use of the area under a receiver operating characteristic (ROC) curve. Radiology 143:29-36
Radiology 143:29-36
106. Hanley J A, McNeil В J (1983) A method of comparing the areas under receiver operating characteristic curves derived from the same cases. Radiology 148:839-843
107. Angus DC, Pinsky MR (1997) Risk prediction: judging the judges. Intensive Care Med 23:363-365
108. Brazier JE, Harper R, Jones NM, ct a. (1992) Validating the SF-36 health survey questionnaire: new outcome measure for primary care. Br Med J 305:160-164
109. Knaus WA, Draper EA, Wagner DP, Zim merman J E (1986) An evaluation of outcome from intensive care in major medical centers. Ann Intern Med 104:410-41S
110. Boyd 0, Grounds RM (1993) Physiological scoring systems and audit Lancet 341:1573- 1574
111. Zimmerman JE, Shoriell SM. Knaus WA, et al (1993) Value and cost of teaching hospitals; a prospective, mu I tic enter, inception cohort study. Crit Care Med 21:1432-1442
112. Zimmerman JE, Shortetl SM, Rousseau DM, et al (1993) Improving intensive care: observations based on organizational case studies in nine intensive care units: a prospective, multicenter study. Crit Care Med 21:1443-1451
113. Boyd O, Grounds M (1994) Can standardized mortality ratio be used to compare quality of intensive care unit performance? Crit Care Med 22:1706-1709
114. Goldhitl DR, Withington PS (1996) Mortality predicted by APACHE II. The effect of changes in physiological values and post-1CU hospital mortality. Anaesthesia 51:719-723
115. Bosnian RJ, Oudemane van Straatcn HM, Zandstra DP (1998) The use of intensive care information systems alters outcome prediction. Intensive Care Med 24:953-958
116. Suistomaa M, Kari A, Ruokonen E, Takala J (2000) Sampling rate causes bias in APACHE II and SAPS II scores. Intensive Care Med 26:1773-1778
117. Teasdale G, Jennett В (1974) Assessment of coma and impaired consciousness. A practical scale. Lancet 2:81-84
118. Chen LM, Martin CM, Morrison TL, Sibbald WJ (1999)1.terobserver variability in data collection of the APACHE II score in teaching and community hospitals, Crit Care Med 27:1999-2004
119. Cho DY, Wang YC (1997) Comparison of the APACHE III, APACHE II and Glasgow Coma Scale in acute head injury for prediction of mortality and functional outcome. Intensive Care Med 23:77-84
Cho DY, Wang YC (1997) Comparison of the APACHE III, APACHE II and Glasgow Coma Scale in acute head injury for prediction of mortality and functional outcome. Intensive Care Med 23:77-84
120. Grntcc S, Gasparovic V (2001) Comparison of APACHE II, MEES and Glasgow Coma Scale in patients with nontraumatic coma for prediction of mortality. Acute Physiologyand Chronic Health Evaluation, Mainz Emergency Evaluation System. Crit Care 5:19-23
121. Bion JF, Edlin SA. Ramsay G, McCabc S, Ledingham 1M (1985) Validation of a prognostic score in critically ill patients undergoing transport. Br Med J 291:432-434
122. Dragsted L, Jorgensen J, Jensen NH, et at (1989) tnterhospilal comparisons of patient outcome from intensive care: importance of lead-time bias. Crit Care Med 17:418-422
123. Tunnel I RD, Mil tar В W, Smith GB (1998) The effect of lead time bias on severity of illness scoring, mortality prediction and standardised mortality ratio in intensive care a pilot study. Anaesthesia 53:1045-1053
124. Angus DC (2000) Scoring system fatigue.and the search for a way forward. Crit Care Med 28:2145-2146
125. Moreno R, Matos R (2001) Outcome prediction in intensive care. Solving the paradox. Intensive Care Med 27:962-964
126. Zuleika M. et al. Is MMQDS belter than SOFA? Critical Care 2003 7(Supp. 2): P 227,
127. Antonelli M, et al. (1999) Aplication of SOFA score to trauma patients. Intensive Care Med 25: 389-94,
128. Napolitano L.M„ Ferrer Т., et al. SIRS at admission independentlypredicts mortality and length of stay in trauma patients. J Trauma. 2000; 49:647-653.
129. W.Ertel, M.Keel et al. The significance of SIRS in 1278 trauma patients. Der Unfallchiruig. 101(7): 520-526.
130. Cho DJ, Wang YC, Lee MJ Comparison of APACHE III. II and Glasgow Coma Scale for prediction of mortality in neurosurgical ICU, Clin Intensive Care. 1995; 6; 9-14.
131. Wong D.T. et al (1996) A comparison of APACHE II score and TRISS for outcome assessment in ICU trauma patients. Crit Care Med 24(10): 1642-8.
Crit Care Med 24(10): 1642-8.
132. Vassar M.J,( Lewis F.R., Chambers J.A et al. Prediction Of Outcome In Intensive Care Unit Trauma Patients. J Trauma 1999» 47(2): 324-329.
133. Lefering R. et al (1997) Der APACHE II score bci Traumapatientcn -cine Systematische Unterschaizung der Prognose Intensivemedizin and Notfallmcdizm 34:426-31.
134. Hannan EJ~ ct al. (1999) A Gsmparision of TRISS and ICISS, J Trauma. 47:8-14.
135. Rownalds В J. (1994) Scoring systems in management of Surgical Sepsis. Surg Ress Comm. 15:153-65.
136. Marshall J.C. (1997’jOutcomc Measures for Clinical Trials In Sepsis. Sepsis. 1:11-12.
137. De La Torre M.V. et al. Score systems and cardiovascular Junction in a series of consecutive patients with acute severe pancreatitis. Crit Care Med 21. Suppl 1): P 152.
%PDF-1.4 % 6 0 obj > endobj 5 0 obj > >> endobj 9 0 obj > endobj 8 0 obj > >> endobj 4 0 obj [5 0 R 8 0 R] endobj 10 0 obj > stream application/pdf
 yandex.disk/18264273/Yandex.Disk.localized/Desktop/CM02-18/20171016_120432.jpg
yandex.disk/18264273/Yandex.Disk.localized/Desktop/CM02-18/20171016_120432.jpg 000000100.0000000.0000000.000000
000000100.0000000.0000000.000000Оценка из пяти (PANSS, SAPS, SANS, NSA-16, CGI-SCH) часто используемых шкал оценки симптомов при шизофрении и сравнение с более новыми шкалами (CAINS, BNSS)
Abstract
Шкалы измерения положительных и отрицательных симптомов при шизофрении остаются основным методом. Весы, измеряющие положительные и отрицательные симптомы шизофрении, остаются основным методом оценки и диагностики шизофрении клиницистами и исследователями. Шкалы в основном используются для отслеживания тяжести положительных и отрицательных симптомов и отслеживания реакции на лечение у шизофреников.Хотя эти шкалы широко используются, качество, а также общая полезность каждой шкалы различаются. Качество определяется достоверностью и надежностью весов. Полезность шкалы определяется временем введения и настройками, при которых шкалы могут применяться в исследовательских или клинических условиях. Относительно меньше статей о полезности новых шкал, таких как CAINS (Интервью для клинической оценки отрицательных симптомов) и BNSS (Краткая шкала отрицательных симптомов), которые сравнивают их со старыми шкалами PANSS (шкала положительных и отрицательных симптомов), SAPS (шкала для оценки отрицательных симптомов). Оценка положительных симптомов) SANS (Шкала оценки отрицательных симптомов), NSA-16 (Оценка отрицательных симптомов-16) и CGI-SCH (Шизофрения общего клинического впечатления).
Старые весы были разработаны более 30 лет назад. С тех пор наше понимание негативных симптомов эволюционировало, и в настоящее время существуют новые рейтинговые шкалы, оценивающие достоверность негативных симптомов. Старые шкалы не включают результаты последних исследований негативных симптомов. CAINS и BNSS привлекательны как своей надежностью, так и кратким доступным форматом, однако более простая, доступная, удобная для пользователя шкала, которая включает многомерную модель шизофрении и учитывает психосоциальный и когнитивный компоненты, еще предстоит разработать.
Ключевые слова: Шизофрения, Психопатология, Психическое здоровье, Клиническая практика
Введение
С тех пор, как Ойген Блейлер ввел термин «шизофрения» в 1908 году как название того, что первоначально было известно как «раннее слабоумие», шизофрения продолжает оставаться расстройство, которое по-прежнему сложно определить. Как и следовало ожидать, для врачей и исследователей были предложены и разработаны различные шкалы и инструменты для скрининга шизофрении, и эти различные инструменты отражают различное понимание того, как шизофрению лучше всего определять и классифицировать с точки зрения ее симптомов.Вплоть до 1980-х годов большинство исследователей сосредотачивались на симптомах, которые можно было описать как «позитивные», таких как галлюцинации, бред и расстройства мышления, при этом игнорируя апатию, алогию, аволицию и другие так называемые «негативные» симптомы. Однако в 1980 году новаторская модель шизофрении как болезни, состоящей из «двух синдромов», разработанная Т. Дж. Кроу, ввела концепцию дихотомического набора положительных и отрицательных симптомов и во многом изменила то, как исследователи позже поймут и скрининг на шизофрению [1].
С тех пор шкалы, разработанные для скрининга шизофрении, были в первую очередь ориентированы на оценку пациентов с использованием положительных и отрицательных симптомов. PANSS, SAPS и SANS — это хорошо зарекомендовавшие себя шкалы, которые использовались для объективной оценки симптомов шизофрении. Тот факт, что он чувствителен к изменениям, делает его «золотым стандартом» в исследованиях лечения. При долгосрочном использовании психофармакологические исследования подтверждают конструкцию PANSS, ее дискриминационную, конвергентную и прогностическую валидность, а также ее чувствительность.PANSS не предназначен исключительно для оценки негативных симптомов; скорее, это комплексная шкала для оценки психопатологии. Более того, первоначально прогресс в разработке нового фармакологического лечения негативных симптомов шизофрении ограничен ограничениями доступных инструментов оценки. Многостороннее сотрудничество по продвижению оценки негативных симптомов было создано для разработки и проверки новой шкалы клинических оценок CAINS (Интервью для клинической оценки негативных симптомов) для устранения ограничений существующих мер.Насколько известно автору, еще не было обзорной статьи, в которой оценивались бы старые шкалы (PANSS, SAPS, SANS) и сравнивали бы их с более новыми шкалами (CAINS и BNSS).
Цель
Основная цель данной статьи — рассмотреть и оценить полезность хорошо зарекомендовавших себя шкал: шкалы оценки положительных симптомов (SAPS), шкалы оценки отрицательных симптомов (SANS), шкалы положительных и отрицательных симптомов. Шкала негативных симптомов (PANSS), Оценка негативных симптомов (NSA-16) и Шизофрения общего клинического впечатления (CGI-SCH) и сравнение этих шкал с более новыми инструментами скрининга: интервью для клинической оценки негативных симптомов (CAINS) и Краткая шкала отрицательных симптомов (BNSS).
Методы
Обзор литературы за 1980–2016 годы был выполнен с использованием следующих поисковых систем: PubMed, First Search, Cochran, Google Scholar Online, EBSCO host и Psychiatryonline.org. Логические поисковые запросы включали «шкалу положительных симптомов при шизофрении», «шкалу отрицательных симптомов при шизофрении», «шкалу положительных и отрицательных синдромов при шизофрении», «скрининг на шизофрению» и «шкалы полезности при шизофрении». Исследовательские статьи, созданные с использованием вышеупомянутых поисковых запросов, соответствовали нашим критериям включения, если в заголовке была упомянута хотя бы одна из шкал отрицательных или положительных симптомов (PANSS, SANS, SAPS, NAS-16 и CGI-SCH CAINS, BNSS). / или аннотация.Мы исключили редакционные статьи.
Шкала оценки негативных симптомов и шкала оценки позитивных симптомов (SANS и SAPS)
(SANS) и (SAPS) были разработаны в 1980 году, чтобы заполнить заметный пробел в инструментах, которые могли эффективно измерять выраженность негативных и позитивных симптомов [2]. Стандартизированной шкалы для измерения положительных или отрицательных симптомов в то время не существовало, а отрицательные симптомы часто игнорировались как в клинических, так и в исследовательских условиях, тогда как положительные симптомы иногда преувеличивались.Благодаря работе Кроу о важности негативных симптомов возник новый интерес к скринингу пациентов с негативными симптомами, а также к взаимной корреляции негативных симптомов [3]. Частично в ответ на этот сдвиг парадигмы была разработана Шкала оценки негативных симптомов (SANS) [4]. Год спустя были выпущены SAPS, что позволило клиницистам оценивать положительные симптомы, используя структуру и формат, аналогичные SANS [5]. Конкретные симптомы в обеих шкалах были выбраны на основе как клинического опыта, так и эмпирической статистической оценки взаимосвязей и корреляций данных [6].
SANS и SAPS часто используются в клинических и исследовательских целях. Вопрос надежности и валидности поднимался с момента его создания, и были проведены различные исследования валидности шкал. Более ранние исследования в основном были сосредоточены на межэкспертной надежности, которая, как было показано, стабильна даже в различных межкультурных условиях [2]. Другие исследования были сосредоточены на временной стабильности двух шкал, особенно в отношении эффекта лечения [7].Одно исследование, проведенное Malia et al. продемонстрировали, что в то время как SAPS и SANS демонстрируют умеренную временную стабильность в течение 12-месячного периода времени, показатели апатии и странного поведения по субшкалам не показали значительной стабильности [8].
Характер оценки
SANS измеряет негативные симптомы по 25 пунктам, 6-балльной шкале. Пункты перечислены в пяти областях: аффективное притупление, алогия, аволия / апатия, ангедония / асоциальность и внимание. В то время как SAPS измеряет положительные симптомы по 34-балльной 6-балльной шкале.Пункты перечислены под галлюцинациями, бредом, странным поведением и положительным формальным расстройством мышления. Пункты обеих шкал четко определены.
Критика
В то время как SAPS и SANS обычно используются в исследованиях для оценки симптомов шизофрении, одна уместная критика этих двух шкал наносит удар по модели положительных / отрицательных симптомов шизофрении, которая была популярна с 1980-х годов — некоторые авторы предположили, что Двумерная взаимосвязь между SAPS и SANS может затруднять способность тех, кто использует шкалы, выходить за рамки дуалистической модели негативных и позитивных симптомов, что само по себе может быть конструкцией, которая не обязательно является полезной.Выступая за переосмысление структуры шизофрении, Климидис и др. и Минас и др. предложили многомерную структуру, состоящую как минимум из трех категорий, включая галлюцинации / бред, расстройство позитивного мышления и негативные симптомы, вместо простого разделения шизофренических симптомов на позитивные и негативные [9,10]. В отдельном исследовании, посвященном взаимосвязи между симптомами с использованием SAPS и SANS, была получена трехмерная модель, состоящая из психотических, дезорганизованных и негативных факторов [11].Сторонники более сложной парадигмы шизофренической симптоматологии утверждают, что шизофрению нельзя разделить или разделить так же четко, как SAPS и SANS. На основе «двух синдромов» Кроу, возможно, потребуется разработать новые модели, которые расширяют масштабы и включают в свои структуры различные элементы шизофренических симптомов.
Шкала положительных и отрицательных симптомов (PANSS)
PANSS обеспечивает объективное измерение клинического ответа на фармакологическое лечение и невероятно полезна в клинических исследованиях, причем некоторые считают ее «золотым стандартом измерения эффективности лечения».«Продольные данные для отдельных пациентов можно объединить вместе, чтобы изучить влияние ковариат на группу лечения по сравнению с контрольной группой плацебо в исследованиях, посвященных терапии, поэтому PANSS является надежным средством оценки пациентов в хронологическом порядке на протяжении их болезни. В исследовании пациенты были разделены на четыре взаимоисключающие группы на основе результатов PANSS. Эти результаты показали, что в группе лечения, которая в основном наблюдалась в амбулаторных условиях, «19% людей были классифицированы как имеющие выраженные отрицательные симптомы, 20% — как имеющие выраженные положительные симптомы и 21% — как имеющие выраженные положительные и заметные отрицательные симптомы» [ 12].Это исследование подтвердило, что у людей с отрицательными симптомами общие результаты хуже, если судить по показателям ремиссии, и что у пациентов с как положительными, так и отрицательными симптомами результаты еще хуже, что дополнительно демонстрирует, что отрицательные симптомы напрямую влияют на тяжесть и хронизацию шизофрении.
Характер оценки
PANSS состоит из 30 отдельных пунктов, организованных в три независимых подшкалы с оценкой от 30 до 210 баллов [13]. Ранее было продемонстрировано, что подшкалы положительной, отрицательной и общей психопатологии показывают нормальное распределение и независимость друг от друга.Подшкала негативных симптомов оценивает притупление аффекта, эмоциональную замкнутость, плохую раппорт, пассивную / апатическую социальную изоляцию, трудности с абстрактным мышлением, отсутствие спонтанности и потока разговора, а также стереотипное мышление. Положительная подшкала касается заблуждений, концептуальной дезорганизации, галлюцинаторного поведения, возбуждения, грандиозности, подозрительности и враждебности. Подшкала общей психопатологии касается соматического беспокойства, беспокойства, чувства вины, напряжения, манер поведения и позирования, депрессии, двигательной отсталости, отказа от сотрудничества, необычного содержания мыслей, дезориентации, плохого внимания, отсутствия суждения и понимания, нарушения воли, плохого контроля над импульсами, озабоченность и активное социальное избегание.
Критика
В разгар литературы с подтверждающими данными о валидности и полезности PANSS, некоторые все еще сомневаются в способности шкалы служить «автономным» экраном для шизофрении, бросая вызов ее репутации как золотой стандартная шкала. Существует некоторая степень двусмысленности и избыточности в оценке когнитивных элементов, оцениваемых по его подшкалам. Самая большая ошибка PANSS — это отсутствие чувствительности и специфичности в прогнозировании глобального когнитивного функционирования.Кроме того, подшкала депрессии не позволяет провести различие между «депрессией, негативными симптомами и экстрапирамидными побочными эффектами», что является важной проблемой, учитывая различные методы лечения и неблагоприятные последующие последствия при неправильной диагностике [13]. Всесторонняя оценка факторов, измеряемых PANSS по отдельности, часто приводит к созданию более длинных шкал с избыточными запросами. И наоборот, сокращение шкалы до минимума запросов столь же проблематично и может привести к получению неполных данных, более слабой корреляции и менее надежных результатов [13].Кроме того, исследования, в которых используется PANSS для оценки эффективности психотропной фармакотерапии, могут быть предвзятыми, когда сообщаются средние результаты, что служит систематическим потоком, который вряд ли обнаружит коварианты, влияющие на ответ на плацебо [13].
Действительно, одним из самых распространенных недостатков PANSS является его сложность. Помимо длины, PANSS, который использует шкалу интервалов от 1 до 7 для каждого из 30 пунктов, требует преобразования PANSS в шкалу соотношений, чтобы оценивать пациентов и правильно отслеживать реакцию на лечение.Недавний систематический обзор показал, что до 62% авторов, использующих PANSS, возможно, использовали неверные вычисления в своих исследованиях, и что очень немногие статьи даже включали методы расчета [14].
PANSS сравнивали с Краткими психиатрическими рейтинговыми шкалами (BPRS) / более ранним аналогом, и он показал неизменно лучший результат, чем (BPRS). В исследовании психиатрической реабилитации оба инструмента продемонстрировали высокую надежность между экспертами; однако результат показал, что PANSS превосходит BPRS по клинической прогностической способности [14].
Оценка негативных симптомов 16 (NSA-16)
Первоначальная шкала NSA-16 была разработана Alphs et al. в 1989 г. [15]. Более новая усеченная версия, Оценка негативных симптомов-4 (NSA 4), была адаптирована из прототипа в 1993 году в качестве валидированного инструмента для оценки негативных симптомов шизофрении [16]. NSA-16 исследует наличие, тяжесть и диапазон негативных симптомов, связанных с шизофренией. Он задумывался как краткий и простой в использовании инструмент с сильными психометрическими характеристиками с точки зрения валидности, надежности, чувствительности к изменениям и хорошей клинической применимости.
NSA-16 — это полуструктурированное интервью, содержащее 16 вопросов, которые всесторонне оценивают негативный синдром шизофрении и включают следующие факторы: общение, эмоции / аффекты, социальную вовлеченность, мотивацию и отсталость [15]. Эти факторы оцениваются с помощью структурированного интервью, они обширны и четко определены, чтобы помочь стандартизировать оценку [16].
Axelrod BN и др. [16] оценили достоверность этой шкалы на выборке из 223 стационарных больных шизофренией, не принимавших лекарства.В этом исследовании было обнаружено, что пятифакторная модель наилучшим образом характеризует структуру этой рейтинговой шкалы. Исследование предоставило поддержку многомерной модели негативных симптомов при шизофрении и предложило полезную меру оценки негативных симптомов. Стандартизованное измерение негативных симптомов было также достигнуто в международных испытаниях, что еще раз подтвердило достоверность NSA-16. Доун Веллиган и др. Исследовали, были ли изменения негативных симптомов (NSA 16) связаны с изменениями функционального результата.Результаты показали, что взаимосвязь между изменениями негативных симптомов и изменениями функционального результата является сложной, и что негативные симптомы привели к изменениям в социальной и профессиональной функциональной шкале (SOFAS), а не наоборот [15,17]
Характер оценки
It представляет собой полуструктурированное интервью из 16 пунктов, в котором используются пять факторов: 1. Общение, 2. Эмоции / аффекты, 3. Социальная вовлеченность, 4. Мотивация, 5. Отсталость (18). Пункты оцениваются по 6-балльной шкале Лайкерта, где более высокие баллы отражают большее ухудшение.В шкале представлены подробные критерии привязки для рейтинговых баллов, а также общий балл, сумма баллов по 16-балльной шкале и общий рейтинг негативных симптомов, основанный на общем клиническом впечатлении от негативных симптомов пациента [19].
Критика
Основным ограничением NSA-16 является его высокая зависимость от функционирования или поведения, даже в отношении симптомов переживания, таких как снижение социального влечения, серьезность которого измеряется типом и частотой социальных взаимодействий [19].И SANS, и NSA-16 обеспечивают целенаправленную оценку негативных симптомов, но они должны использоваться вместе со шкалой оценки позитивных симптомов [18]
Оценка негативных симптомов 4 (NSA-4)
Исследование, опубликованное в Int. Journal of Psychiatry о подтверждении оценки отрицательных симптомов с 4 пунктами (SA-4) [20]. Это исследование показало, что NSA-4 представляет собой краткий практический клинический инструмент для оценки негативных симптомов шизофрении. Психометрические свойства и предсказательная сила версии с четырьмя пунктами (NSA-4) сравнивались с NSA-16, чтобы определить прогностическую валидность и конструктивную валидность.Обе шкалы показали приемлемую внутреннюю согласованность (альфа Кронбаха 0,85 и 0,64 соответственно) и надежность повторного тестирования (коэффициент корреляции внутри класса 0,87 и 0,82). Это исследование демонстрирует, что NSA-4 имеет точность, сопоставимую с NSA-16, в оценке негативных симптомов у пациентов с шизофренией [20].
Шкала CGI-SCH (Шкала общего клинического впечатления-шизофрении)
Шкала CGI-SCH оценивает положительные, отрицательные, депрессивные, когнитивные симптомы и общую тяжесть шизофрении [21].Шкала (CGI-SCH) — это инструмент для краткой оценки, который первоначально был адаптирован из шкалы общего клинического впечатления (CGI) и шкалы CGI-биполярных пациентов (CGI-BP) [22,23]. Он был разработан для изучения результатов лечения антипсихотиками при шизофрении в рамках обсервационного исследования (Schizophrenia Outpatient Health Outcomes (SOHO) Study [24]
). CGI-SCH продемонстрировал сильную валидность и несколько более высокую межэкспериментальную надежность, чем PANSS. [25]. Исследование 114 пациентов, измеряющее разнообразие симптомов, присутствующих при шизофрении, показало высокие коэффициенты корреляции между шкалами CGI-SCH, Global Assessment of Function (GAF) и PANSS, а также значительную надежность по всем параметрам, кроме депрессивного.В этом исследовании сделан вывод, что шкала CGI-SCH является действенным и надежным инструментом для оценки степени тяжести и ответа на лечение при шизофрении. Использование инструмента является простым, кратким и быстрым, что делает его подходящим масштабом для использования в обсервационных исследованиях и в повседневной клинической практике [21].
Характер оценки
CGI-SCH — это более простая шкала, поскольку она состоит только из двух категорий: тяжесть заболевания и степень изменения. Категория серьезности заболевания оценивает ситуацию в течение недели, предшествующей оценке, а категория степени изменения оценивает изменение по сравнению с предыдущей оценкой.Каждая категория содержит пять различных оценок (положительный, отрицательный, депрессивный, когнитивный и общий), которые оцениваются с использованием семибалльной порядковой шкалы.
Критика
CGI-SCH не хватает хорошей межэкспертной надежности, чувствительности к изменениям и низкого коэффициента корреляции для оценки депрессии [21].
CAINS и BNSS (Интервью для клинической оценки негативных симптомов и краткая шкала негативных симптомов)
В 2005 году Национальный институт психического здоровья провел конференцию по выработке консенсуса по негативным симптомам.В результате этой встречи возникли две шкалы негативных симптомов следующего поколения: BNSS и CAINS. Обе меры получают широкое распространение, и различные исследования продемонстрировали хорошие психометрические свойства каждой шкалы. Исследование, опубликованное в бюллетене по шизофрении, представляет собой первое прямое психометрическое сравнение этих шкал [26]. В этом исследовании 65 амбулаторных пациентов с диагнозом шизофрения или шизоаффективное расстройство прошли клинические интервью, анкеты и нейропсихологические тесты.Отдельные оценщики заполнили BNSS и CAINS в течение одной недели. Результаты показали, что обе меры обладают хорошей внутренней согласованностью, конвергентной достоверностью и дискриминирующей достоверностью. Наблюдалась высокая степень соответствия между пунктами CAINS и BNSS с притупленным аффектом и алогией. Умеренная конвергенция произошла по предметам аволиции и асоциальности, а низкая конвергенция наблюдалась по предметам ангедонии. Результаты этого исследования показывают, что обе шкалы обладают хорошими психометрическими свойствами [26].
CAINS — это эффективный и проверенный инструмент для измерения негативных симптомов шизофрении.Используя разнообразную выборку из 162 амбулаторных пациентов с шизофренией или шизоаффективным расстройством, исследователи оценили структуру, согласие переводчика, надежность повторного тестирования, а также конвергентную и дискриминантную валидность инструмента из 13 пунктов. Результаты были многообещающими. Шкалы продемонстрировали хорошую внутреннюю согласованность, стабильность результатов повторных тестов и согласованность между экспертами. CAINS также продемонстрировал сильную конвергентную валидность, которая определялась связями с другими показателями негативных симптомов. CAINS, хотя и краток, также является всеобъемлющим и может применяться в широком диапазоне исследований и клинических контекстов [27].
Исследование, опубликованное в Schizophrenia Research, подчеркнуло тот факт, что пациенты с шизофренией, особенно те, у которых есть стойкие и клинически значимые негативные симптомы (ПНС), имеют самые низкие функциональные результаты и качество жизни [28]. Наличие негативных симптомов представляет собой неудовлетворенную терапевтическую потребность большого числа пациентов с шизофренией. Не существует единой модели психосоциального лечения, которая могла бы охватить всю совокупность PNS.В этом исследовании 51 пациент с ПНС был рандомизирован в одну из двух групп на период 9 месяцев: 1) лечение и вовлечение (MOVE) или 2) обычное лечение. MOVE был мультимодальным лечением на дому, в котором использовался ряд когнитивных и поведенческих принципов для устранения широкого спектра факторов, способствующих возникновению ПНС, и их функциональных последствий. Пациенты оценивались на исходном уровне и каждые три месяца с множественными оценками негативных симптомов. Результаты этого исследования выявили повторный анализ дисперсии для смешанных моделей и указали на значительные групповые по времени эффекты для оценки негативных симптомов (NSA; p <0.02) и интервью для клинической оценки негативных симптомов (CAINS p <0,04). Различия между группами не были значительными до девяти месяцев лечения и не были значимыми для шкалы кратких отрицательных симптомов (BNSS) [28].
Согласно согласованному заявлению NIMH – MATRICS 2005 г., CAINS и BNSS обращаются к пяти признанным в настоящее время областям негативных симптомов, дифференцируют аппетитные аспекты ангедонии от консумматорных аспектов и обращаются к желанию социальных отношений. К настоящему времени оба показали многообещающие психометрические свойства [29].
CAINS — это эмпирически разработанный и оцененный показатель негативных симптомов. Результаты предыдущих исследований показывают, что CAINS является кратким, но всеобъемлющим и применимым в широком диапазоне исследований и клинических контекстов. Отрицательные симптомы не поддаются лечению и препятствуют функциональному восстановлению при шизофрении. Признавая клиническую важность негативных симптомов, главной рекомендацией была Конференция по развитию консенсуса по негативным симптомам (созываемая Национальным институтом психического здоровья (NIMH) и Исследованиями по измерению и лечению для улучшения когнитивных функций при шизофрении (инициатива MATRICS) для стимулирования новых методов лечения). развитие [27].
Характер оценки
CAINS и BNSS — это две шкалы, которые исследуют психометрические области, включая негативные симптомы, различные аспекты ангедонии и интерес к социальным отношениям с другими людьми. Обе шкалы используют 13 пунктов для оценки негативных симптомов [27]. Ожидается, что проспективные клинические испытания с участием пациентов с негативными симптомами продемонстрируют относительную чувствительность к изменениям и глобальную пригодность BNSS и CAINS по сравнению друг с другом и шкалами более раннего поколения [30].Многочисленные исследования показали, что независимо от шкалы, используемой для оценки негативных симптомов, существует сильная корреляция между более высокими показателями негативных симптомов и более низким социальным функционированием [27,28,30]. В целом CAINS и BNSS привлекательны как своей надежностью, так и их кратким доступным форматом.
Критика
CAINS и BNSS продолжают оценивать первичный диагноз пациентов на основе негативных симптомов без интеграции других аспектов социального и когнитивного функционирования пациентов.Общая критика SAPS и SANS за то, что они слишком ограничительны, также может быть применена как к CAINS, так и к BNSS, а многомерные шкалы еще предстоит разработать. Кроме того, шкалы CAINS не сильно связаны с депрессией, возбуждением или положительными симптомами [27].
Оценка пяти (PANSS, SAPS, SANS, NSA-16, CGI-SCH) часто используемых шкал оценки симптомов при шизофрении и сравнение с более новыми шкалами (CAINS, BNSS)
Abstract
Шкалы измерения положительных и отрицательных симптомов в шизофрения остается основным методом. Шкалы измерения положительных и отрицательных симптомов шизофрении остаются основным методом оценки и диагностики шизофрении клиницистами и исследователями.Шкалы в основном используются для отслеживания тяжести положительных и отрицательных симптомов и отслеживания реакции на лечение у шизофреников. Хотя эти шкалы широко используются, качество, а также общая полезность каждой шкалы различаются. Качество определяется достоверностью и надежностью весов. Полезность шкалы определяется временем введения и настройками, при которых шкалы могут применяться в исследовательских или клинических условиях. Относительно меньше статей о полезности новых шкал, таких как CAINS (Интервью для клинической оценки отрицательных симптомов) и BNSS (Краткая шкала отрицательных симптомов), которые сравнивают их со старыми шкалами PANSS (шкала положительных и отрицательных симптомов), SAPS (шкала для оценки отрицательных симптомов). Оценка положительных симптомов) SANS (Шкала оценки отрицательных симптомов), NSA-16 (Оценка отрицательных симптомов-16) и CGI-SCH (Шизофрения общего клинического впечатления).
Старые весы были разработаны более 30 лет назад. С тех пор наше понимание негативных симптомов эволюционировало, и в настоящее время существуют новые рейтинговые шкалы, оценивающие достоверность негативных симптомов. Старые шкалы не включают результаты последних исследований негативных симптомов. CAINS и BNSS привлекательны как своей надежностью, так и кратким доступным форматом, однако более простая, доступная, удобная для пользователя шкала, которая включает многомерную модель шизофрении и учитывает психосоциальный и когнитивный компоненты, еще предстоит разработать.
Ключевые слова: Шизофрения, Психопатология, Психическое здоровье, Клиническая практика
Введение
С тех пор, как Ойген Блейлер ввел термин «шизофрения» в 1908 году как название того, что первоначально было известно как «раннее слабоумие», шизофрения продолжает оставаться расстройство, которое по-прежнему сложно определить. Как и следовало ожидать, для врачей и исследователей были предложены и разработаны различные шкалы и инструменты для скрининга шизофрении, и эти различные инструменты отражают различное понимание того, как шизофрению лучше всего определять и классифицировать с точки зрения ее симптомов.Вплоть до 1980-х годов большинство исследователей сосредотачивались на симптомах, которые можно было описать как «позитивные», таких как галлюцинации, бред и расстройства мышления, при этом игнорируя апатию, алогию, аволицию и другие так называемые «негативные» симптомы. Однако в 1980 году новаторская модель шизофрении как болезни, состоящей из «двух синдромов», разработанная Т. Дж. Кроу, ввела концепцию дихотомического набора положительных и отрицательных симптомов и во многом изменила то, как исследователи позже поймут и скрининг на шизофрению [1].
С тех пор шкалы, разработанные для скрининга шизофрении, были в первую очередь ориентированы на оценку пациентов с использованием положительных и отрицательных симптомов. PANSS, SAPS и SANS — это хорошо зарекомендовавшие себя шкалы, которые использовались для объективной оценки симптомов шизофрении. Тот факт, что он чувствителен к изменениям, делает его «золотым стандартом» в исследованиях лечения. При долгосрочном использовании психофармакологические исследования подтверждают конструкцию PANSS, ее дискриминационную, конвергентную и прогностическую валидность, а также ее чувствительность.PANSS не предназначен исключительно для оценки негативных симптомов; скорее, это комплексная шкала для оценки психопатологии. Более того, первоначально прогресс в разработке нового фармакологического лечения негативных симптомов шизофрении ограничен ограничениями доступных инструментов оценки. Многостороннее сотрудничество по продвижению оценки негативных симптомов было создано для разработки и проверки новой шкалы клинических оценок CAINS (Интервью для клинической оценки негативных симптомов) для устранения ограничений существующих мер.Насколько известно автору, еще не было обзорной статьи, в которой оценивались бы старые шкалы (PANSS, SAPS, SANS) и сравнивали бы их с более новыми шкалами (CAINS и BNSS).
Цель
Основная цель данной статьи — рассмотреть и оценить полезность хорошо зарекомендовавших себя шкал: шкалы оценки положительных симптомов (SAPS), шкалы оценки отрицательных симптомов (SANS), шкалы положительных и отрицательных симптомов. Шкала негативных симптомов (PANSS), Оценка негативных симптомов (NSA-16) и Шизофрения общего клинического впечатления (CGI-SCH) и сравнение этих шкал с более новыми инструментами скрининга: интервью для клинической оценки негативных симптомов (CAINS) и Краткая шкала отрицательных симптомов (BNSS).
Методы
Обзор литературы за 1980–2016 годы был выполнен с использованием следующих поисковых систем: PubMed, First Search, Cochran, Google Scholar Online, EBSCO host и Psychiatryonline.org. Логические поисковые запросы включали «шкалу положительных симптомов при шизофрении», «шкалу отрицательных симптомов при шизофрении», «шкалу положительных и отрицательных синдромов при шизофрении», «скрининг на шизофрению» и «шкалы полезности при шизофрении». Исследовательские статьи, созданные с использованием вышеупомянутых поисковых запросов, соответствовали нашим критериям включения, если в заголовке была упомянута хотя бы одна из шкал отрицательных или положительных симптомов (PANSS, SANS, SAPS, NAS-16 и CGI-SCH CAINS, BNSS). / или аннотация.Мы исключили редакционные статьи.
Шкала оценки негативных симптомов и шкала оценки позитивных симптомов (SANS и SAPS)
(SANS) и (SAPS) были разработаны в 1980 году, чтобы заполнить заметный пробел в инструментах, которые могли эффективно измерять выраженность негативных и позитивных симптомов [2]. Стандартизированной шкалы для измерения положительных или отрицательных симптомов в то время не существовало, а отрицательные симптомы часто игнорировались как в клинических, так и в исследовательских условиях, тогда как положительные симптомы иногда преувеличивались.Благодаря работе Кроу о важности негативных симптомов возник новый интерес к скринингу пациентов с негативными симптомами, а также к взаимной корреляции негативных симптомов [3]. Частично в ответ на этот сдвиг парадигмы была разработана Шкала оценки негативных симптомов (SANS) [4]. Год спустя были выпущены SAPS, что позволило клиницистам оценивать положительные симптомы, используя структуру и формат, аналогичные SANS [5]. Конкретные симптомы в обеих шкалах были выбраны на основе как клинического опыта, так и эмпирической статистической оценки взаимосвязей и корреляций данных [6].
SANS и SAPS часто используются в клинических и исследовательских целях. Вопрос надежности и валидности поднимался с момента его создания, и были проведены различные исследования валидности шкал. Более ранние исследования в основном были сосредоточены на межэкспертной надежности, которая, как было показано, стабильна даже в различных межкультурных условиях [2]. Другие исследования были сосредоточены на временной стабильности двух шкал, особенно в отношении эффекта лечения [7].Одно исследование, проведенное Malia et al. продемонстрировали, что в то время как SAPS и SANS демонстрируют умеренную временную стабильность в течение 12-месячного периода времени, показатели апатии и странного поведения по субшкалам не показали значительной стабильности [8].
Характер оценки
SANS измеряет негативные симптомы по 25 пунктам, 6-балльной шкале. Пункты перечислены в пяти областях: аффективное притупление, алогия, аволия / апатия, ангедония / асоциальность и внимание. В то время как SAPS измеряет положительные симптомы по 34-балльной 6-балльной шкале.Пункты перечислены под галлюцинациями, бредом, странным поведением и положительным формальным расстройством мышления. Пункты обеих шкал четко определены.
Критика
В то время как SAPS и SANS обычно используются в исследованиях для оценки симптомов шизофрении, одна уместная критика этих двух шкал наносит удар по модели положительных / отрицательных симптомов шизофрении, которая была популярна с 1980-х годов — некоторые авторы предположили, что Двумерная взаимосвязь между SAPS и SANS может затруднять способность тех, кто использует шкалы, выходить за рамки дуалистической модели негативных и позитивных симптомов, что само по себе может быть конструкцией, которая не обязательно является полезной.Выступая за переосмысление структуры шизофрении, Климидис и др. и Минас и др. предложили многомерную структуру, состоящую как минимум из трех категорий, включая галлюцинации / бред, расстройство позитивного мышления и негативные симптомы, вместо простого разделения шизофренических симптомов на позитивные и негативные [9,10]. В отдельном исследовании, посвященном взаимосвязи между симптомами с использованием SAPS и SANS, была получена трехмерная модель, состоящая из психотических, дезорганизованных и негативных факторов [11].Сторонники более сложной парадигмы шизофренической симптоматологии утверждают, что шизофрению нельзя разделить или разделить так же четко, как SAPS и SANS. На основе «двух синдромов» Кроу, возможно, потребуется разработать новые модели, которые расширяют масштабы и включают в свои структуры различные элементы шизофренических симптомов.
Шкала положительных и отрицательных симптомов (PANSS)
PANSS обеспечивает объективное измерение клинического ответа на фармакологическое лечение и невероятно полезна в клинических исследованиях, причем некоторые считают ее «золотым стандартом измерения эффективности лечения».«Продольные данные для отдельных пациентов можно объединить вместе, чтобы изучить влияние ковариат на группу лечения по сравнению с контрольной группой плацебо в исследованиях, посвященных терапии, поэтому PANSS является надежным средством оценки пациентов в хронологическом порядке на протяжении их болезни. В исследовании пациенты были разделены на четыре взаимоисключающие группы на основе результатов PANSS. Эти результаты показали, что в группе лечения, которая в основном наблюдалась в амбулаторных условиях, «19% людей были классифицированы как имеющие выраженные отрицательные симптомы, 20% — как имеющие выраженные положительные симптомы и 21% — как имеющие выраженные положительные и заметные отрицательные симптомы» [ 12].Это исследование подтвердило, что у людей с отрицательными симптомами общие результаты хуже, если судить по показателям ремиссии, и что у пациентов с как положительными, так и отрицательными симптомами результаты еще хуже, что дополнительно демонстрирует, что отрицательные симптомы напрямую влияют на тяжесть и хронизацию шизофрении.
Характер оценки
PANSS состоит из 30 отдельных пунктов, организованных в три независимых подшкалы с оценкой от 30 до 210 баллов [13]. Ранее было продемонстрировано, что подшкалы положительной, отрицательной и общей психопатологии показывают нормальное распределение и независимость друг от друга.Подшкала негативных симптомов оценивает притупление аффекта, эмоциональную замкнутость, плохую раппорт, пассивную / апатическую социальную изоляцию, трудности с абстрактным мышлением, отсутствие спонтанности и потока разговора, а также стереотипное мышление. Положительная подшкала касается заблуждений, концептуальной дезорганизации, галлюцинаторного поведения, возбуждения, грандиозности, подозрительности и враждебности. Подшкала общей психопатологии касается соматического беспокойства, беспокойства, чувства вины, напряжения, манер поведения и позирования, депрессии, двигательной отсталости, отказа от сотрудничества, необычного содержания мыслей, дезориентации, плохого внимания, отсутствия суждения и понимания, нарушения воли, плохого контроля над импульсами, озабоченность и активное социальное избегание.
Критика
В разгар литературы с подтверждающими данными о валидности и полезности PANSS, некоторые все еще сомневаются в способности шкалы служить «автономным» экраном для шизофрении, бросая вызов ее репутации как золотой стандартная шкала. Существует некоторая степень двусмысленности и избыточности в оценке когнитивных элементов, оцениваемых по его подшкалам. Самая большая ошибка PANSS — это отсутствие чувствительности и специфичности в прогнозировании глобального когнитивного функционирования.Кроме того, подшкала депрессии не позволяет провести различие между «депрессией, негативными симптомами и экстрапирамидными побочными эффектами», что является важной проблемой, учитывая различные методы лечения и неблагоприятные последующие последствия при неправильной диагностике [13]. Всесторонняя оценка факторов, измеряемых PANSS по отдельности, часто приводит к созданию более длинных шкал с избыточными запросами. И наоборот, сокращение шкалы до минимума запросов столь же проблематично и может привести к получению неполных данных, более слабой корреляции и менее надежных результатов [13].Кроме того, исследования, в которых используется PANSS для оценки эффективности психотропной фармакотерапии, могут быть предвзятыми, когда сообщаются средние результаты, что служит систематическим потоком, который вряд ли обнаружит коварианты, влияющие на ответ на плацебо [13].
Действительно, одним из самых распространенных недостатков PANSS является его сложность. Помимо длины, PANSS, который использует шкалу интервалов от 1 до 7 для каждого из 30 пунктов, требует преобразования PANSS в шкалу соотношений, чтобы оценивать пациентов и правильно отслеживать реакцию на лечение.Недавний систематический обзор показал, что до 62% авторов, использующих PANSS, возможно, использовали неверные вычисления в своих исследованиях, и что очень немногие статьи даже включали методы расчета [14].
PANSS сравнивали с Краткими психиатрическими рейтинговыми шкалами (BPRS) / более ранним аналогом, и он показал неизменно лучший результат, чем (BPRS). В исследовании психиатрической реабилитации оба инструмента продемонстрировали высокую надежность между экспертами; однако результат показал, что PANSS превосходит BPRS по клинической прогностической способности [14].
Оценка негативных симптомов 16 (NSA-16)
Первоначальная шкала NSA-16 была разработана Alphs et al. в 1989 г. [15]. Более новая усеченная версия, Оценка негативных симптомов-4 (NSA 4), была адаптирована из прототипа в 1993 году в качестве валидированного инструмента для оценки негативных симптомов шизофрении [16]. NSA-16 исследует наличие, тяжесть и диапазон негативных симптомов, связанных с шизофренией. Он задумывался как краткий и простой в использовании инструмент с сильными психометрическими характеристиками с точки зрения валидности, надежности, чувствительности к изменениям и хорошей клинической применимости.
NSA-16 — это полуструктурированное интервью, содержащее 16 вопросов, которые всесторонне оценивают негативный синдром шизофрении и включают следующие факторы: общение, эмоции / аффекты, социальную вовлеченность, мотивацию и отсталость [15]. Эти факторы оцениваются с помощью структурированного интервью, они обширны и четко определены, чтобы помочь стандартизировать оценку [16].
Axelrod BN и др. [16] оценили достоверность этой шкалы на выборке из 223 стационарных больных шизофренией, не принимавших лекарства.В этом исследовании было обнаружено, что пятифакторная модель наилучшим образом характеризует структуру этой рейтинговой шкалы. Исследование предоставило поддержку многомерной модели негативных симптомов при шизофрении и предложило полезную меру оценки негативных симптомов. Стандартизованное измерение негативных симптомов было также достигнуто в международных испытаниях, что еще раз подтвердило достоверность NSA-16. Доун Веллиган и др. Исследовали, были ли изменения негативных симптомов (NSA 16) связаны с изменениями функционального результата.Результаты показали, что взаимосвязь между изменениями негативных симптомов и изменениями функционального результата является сложной, и что негативные симптомы привели к изменениям в социальной и профессиональной функциональной шкале (SOFAS), а не наоборот [15,17]
Характер оценки
It представляет собой полуструктурированное интервью из 16 пунктов, в котором используются пять факторов: 1. Общение, 2. Эмоции / аффекты, 3. Социальная вовлеченность, 4. Мотивация, 5. Отсталость (18). Пункты оцениваются по 6-балльной шкале Лайкерта, где более высокие баллы отражают большее ухудшение.В шкале представлены подробные критерии привязки для рейтинговых баллов, а также общий балл, сумма баллов по 16-балльной шкале и общий рейтинг негативных симптомов, основанный на общем клиническом впечатлении от негативных симптомов пациента [19].
Критика
Основным ограничением NSA-16 является его высокая зависимость от функционирования или поведения, даже в отношении симптомов переживания, таких как снижение социального влечения, серьезность которого измеряется типом и частотой социальных взаимодействий [19].И SANS, и NSA-16 обеспечивают целенаправленную оценку негативных симптомов, но они должны использоваться вместе со шкалой оценки позитивных симптомов [18]
Оценка негативных симптомов 4 (NSA-4)
Исследование, опубликованное в Int. Journal of Psychiatry о подтверждении оценки отрицательных симптомов с 4 пунктами (SA-4) [20]. Это исследование показало, что NSA-4 представляет собой краткий практический клинический инструмент для оценки негативных симптомов шизофрении. Психометрические свойства и предсказательная сила версии с четырьмя пунктами (NSA-4) сравнивались с NSA-16, чтобы определить прогностическую валидность и конструктивную валидность.Обе шкалы показали приемлемую внутреннюю согласованность (альфа Кронбаха 0,85 и 0,64 соответственно) и надежность повторного тестирования (коэффициент корреляции внутри класса 0,87 и 0,82). Это исследование демонстрирует, что NSA-4 имеет точность, сопоставимую с NSA-16, в оценке негативных симптомов у пациентов с шизофренией [20].
Шкала CGI-SCH (Шкала общего клинического впечатления-шизофрении)
Шкала CGI-SCH оценивает положительные, отрицательные, депрессивные, когнитивные симптомы и общую тяжесть шизофрении [21].Шкала (CGI-SCH) — это инструмент для краткой оценки, который первоначально был адаптирован из шкалы общего клинического впечатления (CGI) и шкалы CGI-биполярных пациентов (CGI-BP) [22,23]. Он был разработан для изучения результатов лечения антипсихотиками при шизофрении в рамках обсервационного исследования (Schizophrenia Outpatient Health Outcomes (SOHO) Study [24]
). CGI-SCH продемонстрировал сильную валидность и несколько более высокую межэкспериментальную надежность, чем PANSS. [25]. Исследование 114 пациентов, измеряющее разнообразие симптомов, присутствующих при шизофрении, показало высокие коэффициенты корреляции между шкалами CGI-SCH, Global Assessment of Function (GAF) и PANSS, а также значительную надежность по всем параметрам, кроме депрессивного.В этом исследовании сделан вывод, что шкала CGI-SCH является действенным и надежным инструментом для оценки степени тяжести и ответа на лечение при шизофрении. Использование инструмента является простым, кратким и быстрым, что делает его подходящим масштабом для использования в обсервационных исследованиях и в повседневной клинической практике [21].
Характер оценки
CGI-SCH — это более простая шкала, поскольку она состоит только из двух категорий: тяжесть заболевания и степень изменения. Категория серьезности заболевания оценивает ситуацию в течение недели, предшествующей оценке, а категория степени изменения оценивает изменение по сравнению с предыдущей оценкой.Каждая категория содержит пять различных оценок (положительный, отрицательный, депрессивный, когнитивный и общий), которые оцениваются с использованием семибалльной порядковой шкалы.
Критика
CGI-SCH не хватает хорошей межэкспертной надежности, чувствительности к изменениям и низкого коэффициента корреляции для оценки депрессии [21].
CAINS и BNSS (Интервью для клинической оценки негативных симптомов и краткая шкала негативных симптомов)
В 2005 году Национальный институт психического здоровья провел конференцию по выработке консенсуса по негативным симптомам.В результате этой встречи возникли две шкалы негативных симптомов следующего поколения: BNSS и CAINS. Обе меры получают широкое распространение, и различные исследования продемонстрировали хорошие психометрические свойства каждой шкалы. Исследование, опубликованное в бюллетене по шизофрении, представляет собой первое прямое психометрическое сравнение этих шкал [26]. В этом исследовании 65 амбулаторных пациентов с диагнозом шизофрения или шизоаффективное расстройство прошли клинические интервью, анкеты и нейропсихологические тесты.Отдельные оценщики заполнили BNSS и CAINS в течение одной недели. Результаты показали, что обе меры обладают хорошей внутренней согласованностью, конвергентной достоверностью и дискриминирующей достоверностью. Наблюдалась высокая степень соответствия между пунктами CAINS и BNSS с притупленным аффектом и алогией. Умеренная конвергенция произошла по предметам аволиции и асоциальности, а низкая конвергенция наблюдалась по предметам ангедонии. Результаты этого исследования показывают, что обе шкалы обладают хорошими психометрическими свойствами [26].
CAINS — это эффективный и проверенный инструмент для измерения негативных симптомов шизофрении.Используя разнообразную выборку из 162 амбулаторных пациентов с шизофренией или шизоаффективным расстройством, исследователи оценили структуру, согласие переводчика, надежность повторного тестирования, а также конвергентную и дискриминантную валидность инструмента из 13 пунктов. Результаты были многообещающими. Шкалы продемонстрировали хорошую внутреннюю согласованность, стабильность результатов повторных тестов и согласованность между экспертами. CAINS также продемонстрировал сильную конвергентную валидность, которая определялась связями с другими показателями негативных симптомов. CAINS, хотя и краток, также является всеобъемлющим и может применяться в широком диапазоне исследований и клинических контекстов [27].
Исследование, опубликованное в Schizophrenia Research, подчеркнуло тот факт, что пациенты с шизофренией, особенно те, у которых есть стойкие и клинически значимые негативные симптомы (ПНС), имеют самые низкие функциональные результаты и качество жизни [28]. Наличие негативных симптомов представляет собой неудовлетворенную терапевтическую потребность большого числа пациентов с шизофренией. Не существует единой модели психосоциального лечения, которая могла бы охватить всю совокупность PNS.В этом исследовании 51 пациент с ПНС был рандомизирован в одну из двух групп на период 9 месяцев: 1) лечение и вовлечение (MOVE) или 2) обычное лечение. MOVE был мультимодальным лечением на дому, в котором использовался ряд когнитивных и поведенческих принципов для устранения широкого спектра факторов, способствующих возникновению ПНС, и их функциональных последствий. Пациенты оценивались на исходном уровне и каждые три месяца с множественными оценками негативных симптомов. Результаты этого исследования выявили повторный анализ дисперсии для смешанных моделей и указали на значительные групповые по времени эффекты для оценки негативных симптомов (NSA; p <0.02) и интервью для клинической оценки негативных симптомов (CAINS p <0,04). Различия между группами не были значительными до девяти месяцев лечения и не были значимыми для шкалы кратких отрицательных симптомов (BNSS) [28].
Согласно согласованному заявлению NIMH – MATRICS 2005 г., CAINS и BNSS обращаются к пяти признанным в настоящее время областям негативных симптомов, дифференцируют аппетитные аспекты ангедонии от консумматорных аспектов и обращаются к желанию социальных отношений. К настоящему времени оба показали многообещающие психометрические свойства [29].
CAINS — это эмпирически разработанный и оцененный показатель негативных симптомов. Результаты предыдущих исследований показывают, что CAINS является кратким, но всеобъемлющим и применимым в широком диапазоне исследований и клинических контекстов. Отрицательные симптомы не поддаются лечению и препятствуют функциональному восстановлению при шизофрении. Признавая клиническую важность негативных симптомов, главной рекомендацией была Конференция по развитию консенсуса по негативным симптомам (созываемая Национальным институтом психического здоровья (NIMH) и Исследованиями по измерению и лечению для улучшения когнитивных функций при шизофрении (инициатива MATRICS) для стимулирования новых методов лечения). развитие [27].
Характер оценки
CAINS и BNSS — это две шкалы, которые исследуют психометрические области, включая негативные симптомы, различные аспекты ангедонии и интерес к социальным отношениям с другими людьми. Обе шкалы используют 13 пунктов для оценки негативных симптомов [27]. Ожидается, что проспективные клинические испытания с участием пациентов с негативными симптомами продемонстрируют относительную чувствительность к изменениям и глобальную пригодность BNSS и CAINS по сравнению друг с другом и шкалами более раннего поколения [30].Многочисленные исследования показали, что независимо от шкалы, используемой для оценки негативных симптомов, существует сильная корреляция между более высокими показателями негативных симптомов и более низким социальным функционированием [27,28,30]. В целом CAINS и BNSS привлекательны как своей надежностью, так и их кратким доступным форматом.
Критика
CAINS и BNSS продолжают оценивать первичный диагноз пациентов на основе негативных симптомов без интеграции других аспектов социального и когнитивного функционирования пациентов.Общая критика SAPS и SANS за то, что они слишком ограничительны, также может быть применена как к CAINS, так и к BNSS, а многомерные шкалы еще предстоит разработать. Кроме того, шкалы CAINS не сильно связаны с депрессией, возбуждением или положительными симптомами [27].
Компонентная структура шкал для оценки положительных и отрицательных симптомов при первом эпизоде психоза и ее зависимость от вариантов аналитических методов
Основные моменты
- •
Психотические симптомы представляют собой сложную иерархическую структуру симптомов.
- •
Десять + факторов первого порядка были извлечены с использованием методов сокращения данных.
- •
Три фактора второго порядка были извлечены с использованием методов сокращения данных.
- •
Некоторые зарегистрированные различия в структуре симптомов связаны с используемыми аналитическими методами.
РЕФЕРАТ
Был проведен вторичный анализ данных по шкалам для оценки положительных и отрицательных симптомов (SAPS / SANS) у 345 пациентов с первым эпизодом психоза (FEP), собранных в исследовании West London FEP.Целью этого исследования было определить: (i) компонентную структуру этих показателей в FEP (первичный анализ) и (ii) зависимость любых результатов этих первичных анализов от вариаций в аналитических методах. Оценки симптомов были подвергнуты методам обработки данных, и было установлено влияние следующих манипуляций: (i) уровень анализа (индивидуальный симптом против общей оценки тяжести симптомов), (ii) метод извлечения (анализ основных компонентов и исследовательских факторов) и ( iii) метод удерживания (тест осыпи vs.Критерий Кайзера). В то время как глобальный анализ уровня оценок представил классическую триаду психотических синдромов (позитивный, негативный и дезорганизованный), анализ уровня симптомов выявил иерархическую структуру с 11 компонентами первого порядка, объединенными тремя компонентами второго порядка, которые также отображены в этой синдромной триаде. . Эти результаты были устойчивыми при сокращении данных, но , а не методов удержания компонентов, предполагая, что расхождения в литературе относительно структуры компонентов SAPS / SANS частично отражают уровень анализа и используемый метод удержания компонентов.Кроме того, они поддерживают иерархическую модель симптомов, последствия которой обсуждаются.
Ключевые слова
Психоз
Позитивные симптомы
Отрицательные симптомы
Симптомы дезорганизации
Факторный анализ
Факторная структура
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию© 2018 Авторы. Опубликовано Elsevier BV
Рекомендуемые статьи
Цитирующие статьи
Оценка пяти (PANSS, SAPS, SANS, NSA-16, CGI-SCH) широко используемых шкал оценки симптомов при шизофрении и сравнения с более новыми шкалами (CAINS, BNSS)
6.Андресен NC, Flaum M, Arndt S, Alliger R, Swayze VW (1992) Положительный
и отрицательные симптомы: оценка и валидность. Отрицательный против положительного
шизофрения, стр: 28-51.
7. Johnstone EC, Owens DGC, Firth CD, Crow TJ (1986) относительная
стабильность положительных и отрицательных характеристик при хронической шизофрении. Br J
Psychiatry 150: 60-64
8. Малиа А.К., Норман Р.М., Уильямсон П. (1993) Стабильность положительных и
отрицательных симптомов при шизофрении.Может J Psychiatry 38: 617-621.
9. Климидис С., Стюарт Г.В., Минас И.Х., Кополов Д.Л., Сингх Б.С. (1993) Положительный
и отрицательные симптомы при психозах. Повторный анализ опубликованных глобальных рейтингов SAPS
и SANS. Schizophr Res 9: 11-18.
10. Минас И. Х., Стюарт Г. В., Климидис С., Джексон Х. Дж., Сингх Б. С. и др. (1992)
Положительные и отрицательные симптомы психозов: многомерная шкала
пунктов SAPS и SANS. Schizophr Res 8: 143-156.
11. Андреасен NC, Арндт С., Миллер Д., Флаум М., Нопулос П. (1995)
Корреляционные исследования шкалы оценки негативных симптомов
и шкалы оценки позитивных симптомов: обзор и
обновление. Психопатология 28: 7-17.
12. Rabinowitz J, Harvey PD, Eerdekens M, Davidson M (2006) Premorbid
функционирование и реакция на лечение при недавно начавшейся шизофрении. Br J
Психиатрия 189: 31-35.
13. Mortimer AM (2007) Шкала оценки симптомов и исход при шизофрении
. Br J Psychiatry Suppl 50: S7-S14.
14. Обермайер М., Шеннах-Воло Р., Мейер С., Мёллер Х. Дж., Ридель М. и др.
(2011) Правильно ли используется PANSS? Систематический обзор. BMC Psychiatry
11: 113.
15. Альфс Л.Д., Саммерфельт А., Ланн Х., Мюллер Р.Дж. (1989) — отрицательный результат
Оценка симптомов: новый инструмент для оценки негативных симптомов
шизофрении.Psychopharmacol Bull 25: 159-163
16. Аксельрод Б.Н., Голдман Р.С., Альфс Л.Д. (1993) Подтверждение оценки негативных симптомов из 16 пунктов
. J. Psychiatr Res 27: 253-258.
17. Веллиган Д.И., Альфс Л., Ланкастер С., Морлок Р., Минц Дж. (2009) Ассоциация
между изменениями шкалы оценки негативных симптомов (NSA-16)
и мерами функционального результата при шизофрении. Psychiatry Res
169: 97-100.
18.Kane JM (2013) Инструменты для оценки негативных симптомов шизофрении.
19. Portilla MPG, Альварес Л.Г., Саиз П.А. (2015) Психометрическая оценка негативного синдрома шизофрении
. Eur Arch Psychiatry Clin Neurosci
265: 559-566.
20. Альфис Л., Морлок Р., Кун С., Касорл П., Сегеди А. и др. (2011) Проверка
оценки негативных симптомов из 4 пунктов (NSA-4): краткий практический клинический инструмент
для оценки негативных симптомов при шизофрении.
Int J Methods Psychiatr Res.
21. Харо Дж. М., Камат С. А., Очоа С. (2003) Глобальное клиническое впечатление —
шкала шизофрении: простой инструмент для измерения разнообразия
симптомов, присутствующих при шизофрении. Acta Psychiatr Scand Suppl, стр:
16-23.
22. Гай В. (1976) Общее клиническое впечатление. В: Руководство ECDEU по оценке
для психофармакологии (пересмотренное). Роквилл, Мэриленд: Национальный институт психического здоровья
: 217-221.
23. Spearing MK, Post RM, Leverich GS, Brandt D, Nolen W (1997)
Модификация шкалы клинических глобальных впечатлений (CGI) для использования при
биполярном заболевании (BP): e CGI- BP. Psychiatry Res 73: 159-171.
24. Haro JM, Edgell ET, Jones PB, Alonso J, Gavart S (2003) — Европейское исследование
амбулаторных исходов здоровья (SOHO) шизофрении: обоснование,
методов и набор. Acta Psychiatr Scand 107: 222-232.
25. Кей С.Р., Абрахам Ф., Оплер Л.А. (1987) — позитивный и негативный синдром по шкале
(PANSS) для шизофрении. Бюллетень по шизофрении 13: 261-276.
26. Strauss GP, Gold JM (2016) Психометрическое сравнение клинического оценочного интервью
для выявления негативных симптомов и краткой шкалы негативных симптомов
. Шизофр Булл 42: 1384-1394.
27. Кринг А.М., Ракель, Стивен П. (2013) — интервью для клинической оценки
негативных симптомов (CAINS): окончательная разработка и проверка.Am J
Психиатрия: 165-172.
28. Веллиган Д.И., Робертт Д., Браун М. (2015) Рандомизированное пилотное исследование
мотивации и повышения квалификации (MOVE) для негативных симптомов.
Schizophr Res 165: 175-180.
29. Дэниел Д.Г., Альфс Л., Касорла П. (2011) Тренинг по оценке отрицательных
симптомов шизофрении в разных языках и культурах: Сравнение
NSA-16 с отрицательной подшкалой PANSS и фактором отрицательного симптома
.Clin Schizophr Relat Psychoses 5: 87-94.
30. Дэниел Д.Г. (2013) Проблемы при выборе инструментов для измерения отрицательных
симптомов. Schizophr Res 150: 343-345.
31. Кей С.Р., Абрахам Ф., Оплер Л.А. (1987) — положительный и отрицательный синдром
по шкале(PANSS) для шизофрении. Шизофр Булл 13: 261-276.
32. Андреасен NC (1984) Шкала для оценки положительных симптомов
(SAPS). Айова-Сити, Университет Айовы.
33.Андреасен NC (2013) Департамент психиатрии Университета Айовы
медицинский колледж 52242.
34. Андреасен NC (1984) Шкала оценки негативных симптомов
(SANS) Айова-Сити, Университет Айовы.
35. Kring AM, Gur RE, Blanchard JJ, Horan WP, Reise SP (2013) Клиническое
оценочное интервью для выявления негативных симптомов (CAINS): окончательная разработка
и проверка. Am J Psychiatry 170: 165-172.
36.Киркпатрик Б., Штраус Г.П., Нгуен Л., Фишер Б.А., Даниэль Д.Г. и др. (2011)
Краткая шкала негативных симптомов: Психометрические свойства. Schizophr
Bull 37: 300-305.
37. Аксельрод Б.Н., Гольдман Р.С., Альфс Л.Д. (1993) Валидация оценки негативных симптомов из 16 пунктов
. J. Psychiatr Res 27: 253-258.
38. Веллиган Д.И., Альфс Л., Ланкастер С., Морлок Р., Минц Дж. (2009) Ассоциация
между изменениями шкалы оценки негативных симптомов (NSA-16)
и мерами функционального результата при шизофрении.Psychiatry Res
169: 97-100.
39. Portilla MPG, Alvarez LG, Saiz PA, Al Halabi S., Bascaran, et al. (2015)
Психометрическая оценка негативного синдрома шизофрении. Eur
Arch Psychiatry Clin Neurosci 265: 559-566.
40. Альфс Л., Морлок Р., Кун С., ван Виллигенбург А., Панагидес Дж. (2010) e
Инструмент для оценки негативных симптомов из 4 пунктов (NSA-4): простой инструмент
для оценки негативных симптомов при шизофрении после краткого обучения
.Психиатрия (Эджмонт) 7: 26-32.
41. Альфс Л., Морлок Р., Кун С., Касорла П., Сегеди А. (2011) Валидация оценки отрицательных симптомов из 4 пунктов
(NSA-4): краткий практический клинический инструмент
для оценки негативные симптомы при шизофрении.
Международный журнал методов психиатрических исследований.
42. Guy W (1976) Общий клинический слепок. В: ECDEU Assessment
Руководство по психофармакологии (отредактированное).Роквилл, Мэриленд: Национальный
Институт психического здоровья: 217-221.
43. Спиринг М.К., Пост Р.М., Леверих Г.С., Брандт Д., Нолен В. (1997)
Модификация шкалы общего клинического впечатления (CGI) для использования при биполярном заболевании
: e CGI-BP. Psychiatry Res 73: 159-171.
44. Харо Дж. М., Камат С. А., Очоа С. (2003) Глобальное клиническое впечатление —
Шкала шизофрении: простой инструмент для измерения разнообразия
симптомов шизофрении.Acta Psychiatr Scand 107: 16-23.
45. Kay SRF, Opler LA (1987) — позитивный и негативный синдром по шкале Абрахама
по шкале(PANSS) для шизофрении. Бюллетень по шизофрении 13: 261-276.
Образец цитирования: Kumari S, Malik M, Florival C, Manalai P, Sonje S (2017) Оценка пяти (PANSS, SAPS, SANS, NSA-16, CGI-SCH) обычно
использовала шкалы оценки симптомов при шизофрении и Сравнение с более новыми весами (CAINS, BNSS). J Addict Res Ther 8: 324. DOI:
10.4172 / 2155-6105.1000324
Страница 7 из 7
J Addict Res er, журнал с открытым доступом
ISSN: 2155-6105
Том 8 • Выпуск 3 • 1000324
Около
19 января 2021 г.
Εκπαιδευτικό Πρόγραμμα Επείγουσας και Εντατικής Νοσηλευτικής …
02 февраля 2021 года
ΑΝΑΚΟΙΝΩΣΗ Σας γνωρίζουμε ότι σύμφωνα με τις διατάξεις του άρθρου 62 του Ν.4764 / 23-12 …
01 февраля 2021 года
ΑΝ ΔΙΑΠΙΣΤΩΣΑΤΕ ΑΝΕΠΙΘΥΜΗΤΗ ΔΡΑΣΗ ΦΑΡΜΑΚΟΥ ΔΗΛΩΣΤΕ ΤΟ ΣΤΟΝ ΕΟΦ ΚΑΙ ΣΤΗΝ ΕΠΙΤΡΟΠ…
22 декабря 2020 г.
ΑΝΑΚΟΙΝΩΘΕΝ: ξέλιξη πορείας υγείας κ. Ι. Πλακιωτάκη, Υπουργού Ναυτιλίας …
30 месяцев 2020
ΔΕΛΤΙΟ ΤΥΠΟΥ- ΕΞΙΤΗΡΙΟ ΜΑΚΑΡΙΩΤΑΤΟΥ ΑΡΧΙΕΠΙΣΚΟΠΟΥ ΑΘΗΝΩΝ ΚΑΙ ΠΑΣΗΣ ΕΛΛΑΔΟΣ κ.κ …
26 месяцев 2020
Εξέλιξη πορείας υγείας Μακαριωτάτου Αρχιεπισκόπου κ.κ. Ιερωνύμου 26/11/2020 …
25 месяцев 2020
Εξέλιξη πορείας υγείας Μακαριωτάτου Αρχιεπισκόπου κ.κ. Ιερωνύμου …
23 месяца 2020
Η αίθουσα αιμοδοτών του Τμήματος Αιμοδοσίας του Νοσοκομείου μας παραμένει ασφ …
23 месяца 2020
ΔΕΛΤΙΟ ΤΥΠΟΥ Πορεία Νοσηλείας Αρχιεπισκόπου Τιράνων, Δυρραχίου και πάσης Αλβ…
23 месяца 2020
ΙΑΤΡΙΚΟ ΑΝΑΚΟΙΝΩΘΕΝ ΘΕΜΑ: ξέλιξη πορείας υγείας Μακαριωτάτου Αρχιεπισκόπο …
Преобразование положительных и отрицательных оценок симптомов между PANSS и SAPS / SANS.
Преобразование положительных и отрицательных оценок симптомов между PANSS и SAPS / SANS.Форма поиска- Обзор
- Исследования
- Личность
- Дополнительная информация о документе
- Смотреть все
Обзор
абстракция
- Шкала оценки позитивных симптомов (SAPS), Шкала оценки негативных симптомов (SANS) и Шкала позитивных и негативных синдромов шизофрении (PANSS) являются наиболее широко используемыми шкалами оценки симптомов шизофрении, но, несмотря на то, что они -существование в течение 25 лет не существует легко используемого механизма межмасштабной конверсии.Целью этого исследования было предоставить уравнения для преобразования оценок симптомов между шкалами. Двести пять пациентов с шизофренией [средний возраст ± SD = 39,5 ± 11,6, 156 мужчин] были обследованы с помощью SANS, SAPS и PANSS. Были вычислены корреляции Пирсона между оценками симптомов по каждой шкале. Анализ линейной регрессии на данных 176 случайно выбранных пациентов был проведен для вывода уравнений для преобразования оценок между шкалами. Внутриклассовые корреляции по данным оставшихся 29 пациентов, не являющиеся частью регрессионного анализа, были выполнены для определения точности преобразования рейтинга.Положительные и отрицательные оценки симптомов по шкале сильно коррелировали. Внутриклассовые корреляции между исходными положительными и отрицательными оценками симптомов и оценками, полученными путем преобразования альтернативных оценок с использованием уравнений преобразования, были от умеренных до высоких (ICC = 0,65–0,91). Уравнения на основе регрессии могут быть полезны для преобразования между тяжестью симптомов шизофрении, измеренной с помощью SANS / SAPS и PANSS, хотя требуется дополнительная проверка. Уравнения преобразования этого исследования, реализованные на http: / converteasy.org, может помочь в сравнении исследований эффективности лекарств, в мета- и мега-анализах, изучающих симптомы как модераторные переменные, и в ретроспективном сочетании данных симптомов в проектах обмена данными между несколькими центрами, которым необходимо объединить данные рейтингов симптомов, когда такие данные полученные с использованием различных шкал. Авторское право © 2013 Elsevier BV Все права защищены.
авторов
дата публикации
опубликовано в
Исследования
ключевых слов
- Подростковый
- Взрослый
- женский
- Люди
- Мужчина
- Средних лет
- Прогностическая ценность тестов
- Шкалы оценки психиатрического статуса
- Психометрия
- Анкеты
- Регрессионный анализ
- Воспроизводимость результатов
- Шизофрения
- Шизофреническая психология
- Молодой взрослый
Идентификационный номер
Цифровой идентификатор объекта (DOI)
PubMed ID
Дополнительная информация о документе
стартовая страница
конечная страница
том
номер
© 2021 Проект VIVO | Условия использования | Работает на VIVO
Данные об эффективности| НУПЛАЗИД® (пимавансерин)
НУПЛАЗИД значительно снизил частоту и / или тяжесть галлюцинаций и бредовых идей, связанных с психозом на 6-й неделе, по сравнению с плацебо (первичная конечная точка) 1
НУПЛАЗИД показал признаки улучшения по сравнению с исходным уровнем уже на 2-й неделе, со значительным снижением на 4-й и 6-й неделях 1,3
Результаты фазы 3 рандомизированного двойного слепого плацебо-контролируемого исследования в параллельных группах пациентов с галлюцинациями и бредом, связанными с психозом на БП (N = 199).Первичная эффективность оценивалась на основании изменения общего балла SAPS-PD из 9 пунктов по сравнению с исходным уровнем до 6 недели. 1 Средний возраст пациентов, включенных в клиническое исследование с НУПЛАЗИДом, составлял 72 года. 3
Средний исходный балл (SD) SAPS-PD составлял 15,9 (6,12) для NUPLAZID и 14,7 (5,55) для плацебо. Изменение LSM от исходного уровня (SE) для NUPLAZID составило -5,79 (0,66) и -2,73 (0,67) для плацебо; Разница за вычетом плацебо (препарат минус плацебо) для NUPLAZID составила -3,06 (95% ДИ: -4.91, -1,20). 1
В то время как первичная конечная точка была разработана для измерения изменения от исходного уровня до 6-й недели, статистически значимая разница между NUPLAZID и плацебо наблюдалась на 4-й неделе ( P = 0,0369) и снова на 6-й неделе ( P = 0,0014). 1,3
LSM = среднее значение наименьших квадратов; SAPS-PD = Шкала оценки положительного Симптомы адаптированы к болезни Паркинсона; SD = стандартное отклонение; SE = стандартная ошибка.
Важная информация по технике безопасности
Противопоказание: НУПЛАЗИД противопоказан пациентам с реакцией гиперчувствительности на пимавансерин или любой из его компонентов в анамнезе.Сообщалось о появлении сыпи, крапивницы и реакций, связанных с ангионевротическим отеком (например, отек языка, околоральный отек, стеснение в горле и одышка).
Подтверждающие анализы
Уменьшение галлюцинаций и иллюзий — домены SAPS-PD
НУПЛАЗИД улучшил как галлюцинации, так и бред по сравнению с плацебо на 6 неделе 1
Важная информация по технике безопасности
Предупреждения и меры предосторожности: Продление интервала QT
НУПЛАЗИД удлиняет интервал QT.Следует избегать применения НУПЛАЗИД у пациентов с известным удлинением интервала QT или в комбинации с другими препаратами, которые, как известно, удлиняют интервал QT, включая антиаритмики класса 1A или антиаритмики класса 3, некоторые антипсихотические препараты и определенные антибиотики.
НУПЛАЗИД также следует избегать пациентам с сердечной аритмией в анамнезе, а также при других обстоятельствах, которые могут увеличить риск возникновения пуантах деформации и / или внезапной смерти, включая симптоматическую брадикардию, гипокалиемию или гипомагниемию и наличие врожденных удлинение интервала QT.
SAPS-PD: Измерение эффективности NUPLAZID в базовом исследовании 4
SAPS-PD был адаптирован с использованием субдоменов галлюцинаций и иллюзий SAPS, которые наиболее актуальны для оценки PDP.SAPS-PD сохраняет надежность, чувствительность к изменениям и размер эффекта более крупной шкалы, улучшая при этом специфичность для PDP, уменьшая вариабельность оценок и сокращая время введения.
Типы измеренных галлюцинаций 4 | Виды измеренных заблуждений 4 |
|---|---|
| Слуховой | Преследование |
| Голоса разговаривают | Ревность |
| Соматический или тактильный | Номер ссылки |
| Визуальный | Глобальный рейтинг серьезности |
| Глобальный рейтинг серьезности |
Пример объекта SAPS: Глобальные галлюцинации
5| Масштаб | Уровень серьезности | Ответ пациента |
|---|---|---|
| 0 | Нет | |
| 1 | Сомнительно | |
| 2 | мягкий | Галлюцинации определенно присутствуют, но случаются нечасто: иногда пациент может сомневаться в их существовании |
| 3 | Умеренный | Галлюцинации яркие и иногда возникают; они могут до некоторой степени беспокоить пациента |
| 4 | Отмечено | Галлюцинации довольно яркие, возникают часто и пронизывают жизнь пациента |
| 5 | Тяжелая | Галлюцинации случаются почти ежедневно и иногда бывают необычными или причудливыми; они очень яркие и необычайно тревожный |
Каждый пункт оценивается по шкале от 0 (нет) до 5 (серьезный), чтобы получить максимальное количество баллов. 45.¹ Это представление одного элемента полной шкалы SAPS-PD.
Изменение на 2,33 балла в SAPS-PD связано с клинически значимым улучшением — эквивалентно изменению на 1 балл в CGI-I. 6
Важная информация по технике безопасности
Побочные реакции: Обычными побочными реакциями (≥2% для НУПЛАЗИДа и больше, чем плацебо) были периферические отеки (7% против 2%), тошнота (7% против 4%), состояние спутанности сознания (6% против 3%). , галлюцинации (5% против 3%), запор (4% против 3%) и нарушение походки (2% против <1%).
Анализ респондеров на НУПЛАЗИД: реальное улучшение для большинства ваших пациентов с психозом на парентеральном дыхании.
Около 65% пациентов, получавших НУПЛАЗИД, испытали клинически значимый ответ на ≥3 балла по сравнению с 42,2% для плацебо 1§
Примечание. Полный ответ = оценка SAPS-PD снижена до 0 по сравнению с исходным значением.Пациенты с пропущенными значениями считались не ответившими. 1
§ На основании регрессионного анализа клинически значимое изменение на 1 единицу в шкале CGI-I было связано с изменением на 2,33 балла в SAPS-PD. 4
13,7% пациентов, получавших НУПЛАЗИД, испытали полное исчезновение симптомов (оценка SAPS-PD снижена до 0 по сравнению с исходным уровнем) по сравнению с 1.

 Anesthesiology. 1941; 2(3): 281–284. DOI: 10.1097/00000542-194105000-00004.
Anesthesiology. 1941; 2(3): 281–284. DOI: 10.1097/00000542-194105000-00004.
 Open Forum Infectious Disease. 2017; 4(Suppl. 1): 602. DOI: 1093/ofid/ofx163.1579.
Open Forum Infectious Disease. 2017; 4(Suppl. 1): 602. DOI: 1093/ofid/ofx163.1579. Thorax. 2012; 67(1): 71–79. DOI: 10.1136/thx.2009.129502.
Thorax. 2012; 67(1): 71–79. DOI: 10.1136/thx.2009.129502. Critical Care Medicine. 2017; 45(11): 1805–1812. DOI: 10.1097/ccm.0000000000002648.
Critical Care Medicine. 2017; 45(11): 1805–1812. DOI: 10.1097/ccm.0000000000002648. Intensive Care Medicine. 2018; 44(2): 179–188. DOI: 10.1007/s00134-017-5021-8.
Intensive Care Medicine. 2018; 44(2): 179–188. DOI: 10.1007/s00134-017-5021-8. , et al. Combination of QSOFA score with hyperlactatemia improves mortality prediction for surgical patients. Critical Care Medicine. 2018; 46(1): 715. DOI: 10.1097/01.ccm.0000529464.06958.86.
, et al. Combination of QSOFA score with hyperlactatemia improves mortality prediction for surgical patients. Critical Care Medicine. 2018; 46(1): 715. DOI: 10.1097/01.ccm.0000529464.06958.86.