Ренкина шкала: Шкала Рэнкина — Ишемический инсульт/Профилактика сердечно-сосудистых заболеваний — Калькуляторы — Общество доказательной неврологии
Шкала Рэнкина | Habilect
Шкала Рэнкина позволяет оценить степень инвалидизации после инсульта и включает пять степеней инвалидизации после инсульта
Наши системы применимы до четвертой степени включительно:
0. Нет симптомов.
1. Отсутствие существенных нарушений жизнедеятельности, несмотря на наличие некоторых симптомов: способен выполнять все повседневные обязанности.
2. Легкое нарушение жизнедеятельности: неспособен выполнять некоторые прежние обязанности, однако справляется с собственными делами без посторонней помощи.
3. Умеренное нарушение жизнедеятельности: требуется некоторая помощь, однако способен ходить без посторонней помощи.
4. Выраженное нарушение жизнедеятельности: неспособен ходить без посторонней помощи, неспособен справляться со своими физическими потребностями без посторонней помощи.
5. Тяжелое нарушение жизнедеятельности: прикован к постели, недержание мочи и кала, требует постоянной помощи и присмотра персонала.
Первая степень предполагает отсутствие признаков инвалидности, больной в состоянии выполнять без посторонней помощи все действия по уходу за собой. Однако это не исключает у больного наличия мышечной слабости, расстройств чувствительности, нарушений речи или других неврологических функций. Эти нарушения выражены в незначительной степени и не ведут к ограничению активности.
Вторая степень инвалидизации по Рэнкину предполагает наличие легких признаков инвалидности, но больной в состоянии ухаживать за собой без посторонней помощи. Например, не может вернуться к прежней работе, но способен обслуживать себя без постороннего присмотра.
Третья степень умеренно выраженные признаки инвалидности, больной нуждается в некоторой посторонней помощи при одевании, гигиеническом уходе за собой; больной не в состоянии внятно читать или свободно общаться с окружающими. Больной может пользоваться ортопедическими приспособлениями или тростью.
Четвертая степень предполагает наличие выраженных признаков инвалидности. Больной не в состоянии ходить и ухаживать за собой без посторонней помощи, он нуждается в круглосуточном присмотре и в ежедневной посторонней помощи. При этом он в состоянии самостоятельно или при минимальной помощи со стороны выполнять какую-то часть мероприятий по уходу за собой.
Больной не в состоянии ходить и ухаживать за собой без посторонней помощи, он нуждается в круглосуточном присмотре и в ежедневной посторонней помощи. При этом он в состоянии самостоятельно или при минимальной помощи со стороны выполнять какую-то часть мероприятий по уходу за собой.
Пятая степень сильно выраженные признаки инвалидности. Больной прикован к постели, неопрятен и нуждается в постоянном уходе и наблюдении.
Материалы любезно предоставлены: http://www.cardioneurology.ru/
Шкала Рэнкина | CardioNeurology.ru
Шкала Рэнкина позволяет оценить степень инвалидизации после инсульта и включает пять степеней инвалидизации после инсульта
| 0 | Нет симптомов |
| 1 | Отсутствие существенных нарушений жизнедеятельности, несмотря на наличие некоторых симптомов: способен выполнять все повседневные обязанности. |
| 2 | Легкое нарушение жизнедеятельности: неспособен выполнять некоторые прежние обязанности, однако справляется с собственными делами без посторонней помощи. |
| 3 | Умеренное нарушение жизнедеятельности: требуется некоторая помощь, однако способен ходить без посторонней помощи. |
| 4 | Выраженное нарушение жизнедеятельности: неспособен ходить без посторонней помощи, неспособен справляться со своими физическими потребностями без посторонней помощи. |
| 5 | Тяжелое нарушение жизнедеятельности: прикован к постели, недержание мочи и кала, требует постоянной помощи и присмотра персонала. |
- Первая степень предполагает отсутствие признаков инвалидности, больной в состоянии выполнять без посторонней помощи все действия по уходу за собой. Однако это не исключает у больного наличия мышечной слабости, расстройств чувствительности, нарушений речи или других неврологических функций. Эти нарушения выражены в незначительной степени и не ведут к ограничению активности.
- Вторая степень инвалидизации по Рэнкину предполагает наличие легких признаков инвалидности, но больной в состоянии ухаживать за собой без посторонней помощи.
 Например, не может вернуться к прежней работе, но способен обслуживать себя без постороннего присмотра.
Например, не может вернуться к прежней работе, но способен обслуживать себя без постороннего присмотра. - Третья степень умеренно выраженные признаки инвалидности, больной нуждается в некоторой посторонней помощи при одевании, гигиеническом уходе за собой; больной не в состоянии внятно читать или свободно общаться с окружающими. Больной может пользоваться ортопедическими приспособлениями или тростью.
- Четвертая степень предполагает наличие выраженных признаков инвалидности. Больной не в состоянии ходить и ухаживать за собой без посторонней помощи, он нуждается в круглосуточном присмотре и в ежедневной посторонней помощи. При этом он в состоянии самостоятельно или при минимальной помощи со стороны выполнять какую-то часть мероприятий по уходу за собой.
- Пятая степень сильно выраженные признаки инвалидности. Больной прикован к постели, неопрятен и нуждается в постоянном уходе и наблюдении.
Вконтакте
Одноклассники
Шкала Ренкина — gaz.
 wiki
wikiШкала Ренкина ( ) является абсолютной шкалой от термодинамической температуры имени университета Глазго инженера и физика Macquorn Ренкина , который предложил его в 1859.
| Ренкин | |
|---|---|
| Единица | Температура |
| Символ | ° R, ° Ra |
| Названный в честь | Маккорн Ренкин |
Шкала Ренкина до сих пор используется в инженерных системах, где тепловые вычисления выполняются в градусах Фаренгейта. [ необходима цитата ]
Обозначение для градусов Ренкина — ° R [2] (или ° Ra, если необходимо, чтобы отличить его от шкал Ремера и Реомюра ).
Некоторые важные температуры, связывающие шкалу Ренкина с другими шкалами температур, показаны в таблице ниже.
| Температура | Кельвин | Цельсия | По Фаренгейту | Ренкин |
|---|---|---|---|---|
| Абсолютный ноль | 0 К | -273,15 ° С | -459,67 ° F | 0 ° R |
| Температура замерзания рассола [a] | 255,37 К | -17,78 ° С | 0 ° F | 459,67 ° R |
| Температура замерзания воды [b] | 273,15 К | 0 ° C | 32 ° F | 491,67 ° R |
| Температура кипения воды | 373,1339 К | 99,9839 ° С | 211,97 · 102 ° F | 671,64 · 102 ° R |
- ^ Точка замерзания рассола — это нулевая точка шкалы Фаренгейта, старое определение.
 Для Венской стандартной средней океанической воды при одной стандартной атмосфере (101,325 кПа) при калибровке исключительно в соответствии с двухточечным определением термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Для получения дополнительной информации о фактической температуре кипения воды см. VSMOW при измерении температуры .
Для Венской стандартной средней океанической воды при одной стандартной атмосфере (101,325 кПа) при калибровке исключительно в соответствии с двухточечным определением термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Для получения дополнительной информации о фактической температуре кипения воды см. VSMOW при измерении температуры .
Маккорн Рэнкин — gaz.wiki
Navigation
- Main page
Languages
- Deutsch
- Français
- Nederlands
- Русский
- Italiano
- Español
- Polski
- Português
- Norsk
- Suomen kieli
- Magyar
- Čeština
- Türkçe
- Dansk
- Română
- Svenska
Шкала Ренкина
Абсолютная шкала температуры в градусах Фаренгейта
В Шкала Ренкина () является абсолютная шкала из термодинамическая температура названный в честь Университет Глазго инженер и физик Маккорн Ренкин, который предложил его в 1859 году. [1] Как и Кельвин шкала, которая была впервые предложена в 1848 году,[1] Ноль на шкале Ренкина — это абсолютный ноль, но разница температур в один градус Ренкина определяется как равная одному Фаренгейт степень, а не Цельсия градус по шкале Кельвина. Таким образом, температура 0 K (-273,15 ° C; -459,67 ° F) равна 0 ° R, а температура -458,67 ° F равна 1 ° R. Таким образом, шкала Ренкина используется в инженерных системах, где тепловые вычисления выполняются в градусах Фаренгейта.
[1] Как и Кельвин шкала, которая была впервые предложена в 1848 году,[1] Ноль на шкале Ренкина — это абсолютный ноль, но разница температур в один градус Ренкина определяется как равная одному Фаренгейт степень, а не Цельсия градус по шкале Кельвина. Таким образом, температура 0 K (-273,15 ° C; -459,67 ° F) равна 0 ° R, а температура -458,67 ° F равна 1 ° R. Таким образом, шкала Ренкина используется в инженерных системах, где тепловые вычисления выполняются в градусах Фаренгейта.
Символ для градусы Ренкина это ° R[2] (или ° Ra, если необходимо отличить его от Рёмер и Реомюр напольные весы). По аналогии с единицей СИ, кельвином, некоторые авторы называют единицей измерения Ранкин, опуская символ градуса.[3][4]
Некоторые важные температуры, связывающие шкалу Ренкина с другими шкалами температур, показаны в таблице ниже.
| Температура | Кельвин | Цельсия | Фаренгейт | Ренкин |
|---|---|---|---|---|
| Абсолютный ноль | 0 К | -273,15 ° С | -459,67 ° F | 0 ° R |
| Точка замерзания рассол[а] | 255,37 К | -17,78 ° С | 0 ° F | 459,67 ° R |
| Температура замерзания воды[b] | 273,15 К | 0 ° C | 32 ° F | 491,67 ° R |
| Точка кипения воды[c] | 373,1339 К | 99,9839 ° С | 211,97 · 102 ° F | 671,64 · 102 ° R |
Смотрите также
Примечания
- ^ Точка замерзания рассол это нулевая точка шкалы Фаренгейта, старое определение
- ^ Температура льда в очищенной воде составляет 0,000089 (10) градусов Цельсия — см.
 За Венская стандартная средняя океанская вода за один стандартная атмосфера (101,325 кПа) при калибровке исключительно по двухточечному определению термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Подробнее о фактической температуре кипения воды см. VSMOW в измерении температуры.
За Венская стандартная средняя океанская вода за один стандартная атмосфера (101,325 кПа) при калибровке исключительно по двухточечному определению термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Подробнее о фактической температуре кипения воды см. VSMOW в измерении температуры.
Рекомендации
Источники
Острые нарушения мозгового кровообращения: клиническое течение и прогноз у больных сахарным диабетом 2 типа | Антонова
Введение
Сосудистые заболевания головного мозга относятся к ведущим причинам потери трудоспособности и смерти населения как в нашей стране, так и во всем мире. Острое нарушение мозгового кровообращения (ОНМК) характеризуется высокой летальностью, инвалидизацией и социальной дезадаптацией пациентов, занимая во всем мире второе место среди причин смерти [1], и является наиболее частой причиной стойкой утраты трудоспособности.
Несмотря на то, что стандартизированные по возрасту показатели смертности в результате инсульта за последние двадцать лет снизились во всем мире, абсолютные показатели ежегодного числа инсультов, числа пациентов, выживших после инсульта, связанных с инсультом смертельных случаев, а также общий показатель глобального бремени инсульта остаются очень высокими и продолжают увеличиваться. Инсульт по-прежнему является важнейшей медико-социальной проблемой как в мире, так и в Российской Федерации. Показатели летальности от инсульта являются одними из самых высоких в мире: в экономически развитых странах смертность от инсульта оценивается в 11–12%, при этом смертность населения от цереброваскулярных заболеваний (ЦВЗ) в РФ в 4 раза выше, чем в Канаде и США [2].
В России проживают свыше 1 млн человек, перенесших инсульт, при этом треть из них составляют люди трудоспособного возраста, к труду возвращаются только четверть из них [3]. У 80% лиц, перенесших инсульт, развивается частичная, а у 10% – полная нетрудоспособность. Высокий процент не только смертности, но и инвалидизации определяет чрезвычайную актуальность изучения различных аспектов ЦВЗ и поиска факторов, влияющих на возможности восстановления неврологических функций.
Высокий процент не только смертности, но и инвалидизации определяет чрезвычайную актуальность изучения различных аспектов ЦВЗ и поиска факторов, влияющих на возможности восстановления неврологических функций.
Важнейшей причиной всех сосудистых заболеваний, в том числе цереброваскулярной патологии, является атеросклероз – универсальный прогрессирующий процесс поражения сосудов. Многокомпонентность атеросклеротического процесса включает взаимнопотенцирующий эффект многих коморбидных состояний. Важнейшими из них на сегодняшний день признаются метаболический синдром и сахарный диабет (СД) [4]. Гипергликемия и СД у пациентов с инсультом встречаются часто. Так, повышение гликемии, в том числе транзиторное, определяется у большого числа больных, а СД отмечается у 30% пациентов с ОНМК. У части таких больных может быть впервые диагностирован СД2, в том числе и без повышения уровня HbA1c [5]. При этом инсульт относится к основным причинам смерти больных СД2, вызывая гибель около 20% из них [6].
Во всем мире регистрируется стремительный рост заболеваемости СД, подавляющее большинство пациентов – больные с СД2. Реальная распространенность СД среди наиболее трудоспособной части населения (в возрасте от 30 до 50 лет) в 3–4 раза превышает регистрируемую по обращаемости и составляет 5,5% всего населения России [7]. Поздняя диагностика, длительный период неконтролируемой гипергликемии способствуют развитию осложнений. Учитывая значительные патобиохимические и патоморфологические изменения сосудов при СД2, меры, направленные на их коррекцию, могут рассматриваться как методы первичной и вторичной профилактики ОНМК [8, 9].
Выраженность и продолжительность нарушений углеводного обмена играют роль в развитии сосудистых поражений. Гликированный гемоглобин (HbA1c) – показатель контроля углеводного обмена, рассматривается как маркер кардиоваскулярного риска в целом. Риск развития инсульта резко возрастает с повышением значения HbA1c≥7% [10]. Продолжительность заболевания СД также рассматривается как независимый фактор риска ишемического инсульта [11].
Наличие компонентов метаболического синдрома ухудшает течение ОНМК [12]. Гипергликемия, инсулинорезистентность и гиперинсулинизм способствуют прогрессированию атеросклероза, атерогенезу, изменениям в системе гемореологии и гемостаза, вызывая повреждение сосудистого русла и развитие макро- и микрососудистых осложнений СД. У пациентов с ишемическим инсультом (ИИ) и СД2 изменяются основные гемореологические и гемостатические показатели в сторону повышения протромботического звена, способствуя продолжению ишемии в веществе мозга и ухудшению клинической картины ОНМК [13].
При оказании медицинской помощи больным с ИИ по унифицированным схемам у пациентов с СД2 отмечен худший исход заболевания [14].
Современные возможности терапии ОНМК и сохранения жизни больным с инсультом ставят вопрос клинического исхода и качества восстановления функциональных нарушений, возможностей самообслуживания и возвращения к привычной деятельности. Стремительный рост числа больных СД и большая доля таких пациентов в общем количестве пациентов с ОНМК требуют выявления факторов, влияющих не только на риски его развития, но и на течение и исход, а также функциональные возможности пациента, перенесшего инсульт.
Целью работы было изучение влияния СД2 на клинические особенности, динамику течения и функциональный исход ОНМК.
Материалы и методы
В исследование были включены 98 пациентов с ОНМК в первые сутки от развития неврологической симптоматики, из них 1-я группа – 52 больных с ОНМК и СД2, средний возраст 63±10 лет, и 2-я группа – 46 больных с ОНМК без СД, средний возраст 58±13 лет. Всем пациентам проводились общесоматический и неврологический осмотр, общеклинические и биохимические исследования. Диагноз ОНМК был верифицирован на основании клинической картины и данных магнитно-резонансной томографии (МРТ). При проведении МРТ (Magnetom Symphony, SIEMENS, 1,5 T) уточнялся характер инсульта (ишемический или геморрагический), величина и распространенность очаговых изменений мозга. Для выявления и оценки степени атеросклероза магистральных артерий головы (МАГ) проводилось дуплексное сканирование.
Исходя из основной цели исследования, всем больным проводилось определение уровня гликемии при поступлении, а при выявлении гипергликемии – в динамике. Следует отметить, что исследование HbA1c – показателя, отражающего средние значения гликемии за последние несколько месяцев, проводилось всем больным с ОНМК (первые сутки) при гликемии от 6,1 ммоль/л при поступлении, поскольку зачастую затруднительно установить, принимал ли пищу больной перед развитием ОНМК. При этом у пациентов с СД2 проводился также контроль гликемии не менее 4 раз в первые сутки, далее – по мере необходимости. Диагноз СД устанавливался в соответствии с критериями ВОЗ (1999–2006) и Российскими алгоритмами специализированной медицинской помощи больным сахарным диабетом 2013 г. Принимая во внимание, что развитие ОНМК часто сопровождается стрессовым изменением многих биохимических показателей, в частности, гипергликемией, у пациентов со значениями гликемии, соответствующими критериям СД при отсутствии повышения HbA1c≥6,5%, СД был диагностирован в конце острого периода ОНМК.
Следует отметить, что исследование HbA1c – показателя, отражающего средние значения гликемии за последние несколько месяцев, проводилось всем больным с ОНМК (первые сутки) при гликемии от 6,1 ммоль/л при поступлении, поскольку зачастую затруднительно установить, принимал ли пищу больной перед развитием ОНМК. При этом у пациентов с СД2 проводился также контроль гликемии не менее 4 раз в первые сутки, далее – по мере необходимости. Диагноз СД устанавливался в соответствии с критериями ВОЗ (1999–2006) и Российскими алгоритмами специализированной медицинской помощи больным сахарным диабетом 2013 г. Принимая во внимание, что развитие ОНМК часто сопровождается стрессовым изменением многих биохимических показателей, в частности, гипергликемией, у пациентов со значениями гликемии, соответствующими критериям СД при отсутствии повышения HbA1c≥6,5%, СД был диагностирован в конце острого периода ОНМК.
Всем включенным в исследование пациентам проводилась в полном объеме терапия, назначаемая при остром инсульте в соответствии с действующими медико-экономическими стандартами. Сахароснижающая терапия осуществлялась под контролем гликемии.
Сахароснижающая терапия осуществлялась под контролем гликемии.
Степень неврологических нарушений и эффективность проведенного лечения у пациентов с ОНМК определялись в баллах Скандинавской шкалы инсульта [15] при поступлении и на 21-е сутки от момента развития ОНМК. Минимальная оценка – 0 баллов, что соответствует полному отсутствию определяемой функции, а максимальная – 60 баллов означает отсутствие изменений в неврологическом статусе. Оценивалась также выраженность функциональных нарушений по модифицированной шкале Рэнкина [16], где 0 баллов соответствует отсутствию, а 5 и 6 баллов свидетельствуют о тяжелом нарушении жизнедеятельности: прикованности к постели, недержании мочи и кала, потребности в постоянной помощи и присмотре персонала; и смерти, соответственно.
Оценка клинического состояния больных на протяжении острого периода заболевания (21 день) определялась по динамике степени неврологического дефицита как значительная, умеренная, незначительная и отрицательная. Значительное улучшение состояния больных отмечалось при регрессе неврологической симптоматики по Скандинавской шкале на 10 и более баллов, а также положительной динамики лабораторных показателей; умеренное улучшение – при уменьшении неврологического дефицита менее чем на 10 баллов от исходного состояния и улучшении некоторых лабораторных показателей; незначительное улучшение – при минимальном изменении неврологической симптоматики (на 1–2 балла) на фоне стабильно неудовлетворительных лабораторных показателей.
Статистический анализ проводился с использованием программы MS Excel (Microsoft), а математическая обработка – при помощи пакета программ STATISTICA 8.0. Рассчитывали групповые показатели суммарной статистики – среднюю арифметическую величину (M) и ошибку средней (m), а также проводили визуализацию распределения значений с помощью частотных гистограмм. Для показателей, характеризующих качественные признаки, указывалось абсолютное число и относительная величина в процентах (%). Исследование взаимосвязи между количественными показателями осуществлялось при помощи непараметрического коэффициента ранговой корреляции Спирмена, а для оценки различий между группами при оценке качественных параметров использовался критерий Хи-квадрат. Различия считались статистически значимыми при р<0,05.
Результаты
При отсутствии статистически значимой разницы в возрасте, пациенты с СД2 были в равной степени представлены мужчинами и женщинами (51,9%, и 48,1% соответственно), а во 2-й группе большинство составили мужчины (69,6% и 30,4% соответственно), р<0,05 (табл. 1).
1).
Таблица 1 | ||
Характеристика обследованных пациентов | ||
Показатель | 1-я группа (ОНМК и СД), n (%) | 2-я группа (ОНМК), n (%) |
Возраст, лет | 63±10 | 58±13, р=0,1 |
Пол: мужчины женщины | 27 (52) 25 (48) | 32 (69,6) 14 (30,4), р<0,05 |
Атеросклероз МАГ, в т.ч. атеростеноз более 60% | 46 (88) 17 (32,7) | 32 (70), р=0,015 8 (17,4), р= 0,036 |
Ишемический инсульт | 47 (90) | 42 (91,3) |
Геморрагический инсульт | 5 (10) | 4 (8,7). |
Количество очаговых изменений мозга (МРТ-визуализация) один очаг поражения два и более | 42 (80,8) | 38 (82,6) 8 (17,4) |
Атеросклеротическое поражение магистральных артерий головы превалировало у пациентов с СД2: 88% и 70% соответственно, р<0,015. При этом у них также чаще выявлялись гемодинамически значимые стенозы (≥60%): 32,69% и 17,39%, р<0,05.
При этом у них также чаще выявлялись гемодинамически значимые стенозы (≥60%): 32,69% и 17,39%, р<0,05.
По характеру острых НМК у всех обследованных пациентов преимущественно диагностирован ишемический инсульт. Так, в 1-й группе ИИ был диагностирован у 90,4% пациентов, геморрагический инсульт – у 9,6%. Во 2-й группе ИИ выявлен у 91,3% пациентов, геморрагический – у 8,7%.
Количество очагов поражения вещества мозга и их размеры, выявленные при нейровизуализации, в группах также достоверно не отличалось. В 1-й группе с СД2 в превалирующем числе наблюдений (81%) был выявлен один очаг, два и более – у 19%. В группе без СД: один очаг – 83%, два и более – у 17,4%, р=0,81, оценка методом Пирсона Хи-квадрат. По размерам очага у пациентов с СД малые глубинные инфаркты встречались у 46% больных, средние – у 29%, большие – у 21%, а обширные инфаркты были выявлены у 4% пациентов. У больных без СД малые глубинные инфаркты отмечены у 46%, средние – у 24%, большие – у 17%, обширные – у 13% больных (р=0,4).
Уровень гликемии при поступлении в среднем по группе СД2 составил 9,3±2,9 ммоль/л, при этом гликемия ≤6,5 ммоль/л была выявлена у 14% больных, в интервале >6,5 и ≤7,5 ммоль/л – у 17% больных, а >7,5 ммоль/л – у 69% больных.
Определение уровня HbA1c выявило повышенные значения и составило в среднем по группе СД2 7,8±2,0%. Уровень HbA1c<6,5% определялся у 22% пациентов, ≥6,5 и ≤6,9% – у 20%, ≥7,0 и ≤7,9% – у 24%, ≥8 % – у 34% пациентов. Таким образом, повышение уровня HbA1c≥7% было выявлено у 58% пациентов, что подтверждает предшествовавшую развитию ОНМК гипергликемию. СД2 был впервые выявлен у 29 (55,8%) больных с уровнем гликемии при поступлении 9,4±3,4 ммоль/л. Ранее диагностированный СД2 длительностью менее 5 лет отмечался у 12 (23%) больных, сроком от 5 до 10 лет – у 9 (17%) больных, более 10 лет – у 2 больных (3,9%). У 15,4% больных диагностирован впервые выявленный СД2 без повышения HbA1c.
Выраженность неврологической симптоматики у пациентов при поступлении была сопоставима в группах. Средний балл (по Скандинавской шкале): в 1-й группе (с СД) – 41,4±15,1, во 2-й группе (без СД) – 36,32±18, р=0,137. При сравнении неврологической симптоматики на 21-е сутки заболевания отмечены худшие результаты при наличии СД (учитывались данные выживших пациентов). Так, отсутствие улучшения или нарастание неврологического дефицита чаще встречалось у больных СД в 21,6% случаев, в то время как в группе без СД только у 7% пациентов (р=0,02). Незначительная положительная динамика отмечалась также чаще в группе больных с СД – у 13,7% пациентов против 4,7% у больных без СД, р =0,004, рис. 1.
Средний балл (по Скандинавской шкале): в 1-й группе (с СД) – 41,4±15,1, во 2-й группе (без СД) – 36,32±18, р=0,137. При сравнении неврологической симптоматики на 21-е сутки заболевания отмечены худшие результаты при наличии СД (учитывались данные выживших пациентов). Так, отсутствие улучшения или нарастание неврологического дефицита чаще встречалось у больных СД в 21,6% случаев, в то время как в группе без СД только у 7% пациентов (р=0,02). Незначительная положительная динамика отмечалась также чаще в группе больных с СД – у 13,7% пациентов против 4,7% у больных без СД, р =0,004, рис. 1.
Нами не было получено отличий между мужчинами и женщинами по динамике неврологических нарушений и частоте нарастания неврологического дефицита как у пациентов 1-й группы (с СД) (р=0,2), так и без СД (р=0,7).
Учитывая то, что в 2-й группе больных встречалось повышение гликемии в первые сутки ОНМК, был проведен анализ влияния гликемии на исходный уровень и динамику неврологических нарушений по Скандинавской шкале. У лиц без СД не установлено существенной взаимосвязи между начальной клинической симптоматикой и восстановлением неврологических функций при наличии исходной гликемии до 6,5 и от 6,5 ммоль/л.
У лиц без СД не установлено существенной взаимосвязи между начальной клинической симптоматикой и восстановлением неврологических функций при наличии исходной гликемии до 6,5 и от 6,5 ммоль/л.
Важнейшей характеристикой течения ОНМК является функциональный исход. При оценке по модифицированной шкале Рэнкина на 21-е сутки также обнаружено, что лучшие результаты отмечаются в группе пациентов без СД (критерий Пирсона «Хи-квадрат», р=0,013). Учитывались как выжившие, так и умершие пациенты. Результаты отражены в таблице 2.
Таблица 2 | |||||||
Распределение пациентов по модифицированной шкале Рэнкина | |||||||
Оценка по шкале Рэнкина, баллы | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
Группа 1. | 7 (13,46) | 13 (25,0) | 11 (21,15) | 8 (15,38) | 7 (13,46) | 5 (9,62) | 1 (1,92) |
Группа 2. ОНМК без СД, n (%) | 19 (41,30) | 5 (10,87) | 3 (6,52) | 9 (19,57) | 3 (6,52) | 4 (8,70) | 3 (6,52) |
В ходе лечения пациенты с СД2 получали сахароснижающую терапию. Отмечено 8 эпизодов гипогликемии, из них лишь один случай сопровождался «классическими» симптомами с наличием дрожи, потливости и возбуждения. В качестве гипогликемии расценивался уровень глюкозы плазмы до 3,9 ммоль/л. У одного пациента (согласно приложенной документации бригады скорой медицинской помощи) ОНМК развилось на фоне гипогликемии 2,0 ммоль/л. При оценке корреляции между наличием эпизодов гипогликемии в течение острого периода и отсутствием улучшения (по Скандинавской шкале) выявлена тенденция к такой взаимосвязи, р=0,05.
Обсуждение
Рост заболеваемости СД в мировом масштабе приобрел эпидемические пропорции и, согласно обновленным данным Международной диабетической федерации за 2014 г., составляет 387 млн человек. При этом в последние годы отмечается значительное повышение риска инсульта для больных с СД во всех возрастных категориях, что связывают с эпидемией СД во всем мире [17]. Изучение особенностей не только развития, течения, но и прогноза восстановления после инсульта у больных СД приобретает все большее значение.
В обследованных нами группах больных обращает на себя внимание различие в соотношении мужчин и женщин. Среди больных без СД большинство составляли мужчины. В группе больных СД2 подобной связи ОНМК с мужским полом не выявлено, что соответствует результатам мета-анализа, показавшего увеличение риска инсульта у женщин при наличии СД [18], поскольку в целом в популяции инсульт чаще развивается у мужчин. С другой стороны, возможно, это обусловлено тем, что распространенность СД2 среди женщин в 2,5 раза выше [19].
Нами не было получено достоверных отличий по частоте ишемических и геморрагических ОНМК в группах. Кроме того, подтверждены литературные данные о преобладании ИИ над геморрагическим у больных с СД [20].
Прогрессирование атеросклеротического процесса с развитием выраженного сужения просвета артерии играет важную роль в развитии ОНМК. Наличие СД способствует ускорению сосудистого повреждения и реализации клинических эпизодов острого коронарного синдрома, ОНМК, критической ишемии нижних конечностей. Нами также обнаружено более выраженное изменение сосудистой системы головного мозга в виде распространенного и гемодинамически значимого нарушения мозгового русла у больных СД2.
Чрезвычайно важным для своевременной дифференциальной диагностики стрессовой гипергликемии и верификации СД у больных с ОНМК является определение HbA1c вскоре после поступления в стационар. Этот ретроспективный показатель, отражающий уровень гликемии за последние несколько месяцев, имеет достоверную связь с развитием диабетических осложнений. Для большинства пациентов с СД современные международные рекомендации определяют целевой уровень HbA1c менее 7% с целью уменьшения риска развития и прогрессирования диабетических осложнений [21]. В нашем исследовании установлено, что увеличение HbA1c≥7% отмечалось у 58% больных с ОНМК. Такие результаты свидетельствуют о том, что у большинства больных СД2 выявленная гипергликемия не развивается остро в виде стрессовой реакции организма, а предшествует инсульту, что подтверждается повышенным уровнем HbA1c – 7,8±2%.
Для большинства пациентов с СД современные международные рекомендации определяют целевой уровень HbA1c менее 7% с целью уменьшения риска развития и прогрессирования диабетических осложнений [21]. В нашем исследовании установлено, что увеличение HbA1c≥7% отмечалось у 58% больных с ОНМК. Такие результаты свидетельствуют о том, что у большинства больных СД2 выявленная гипергликемия не развивается остро в виде стрессовой реакции организма, а предшествует инсульту, что подтверждается повышенным уровнем HbA1c – 7,8±2%.
Проведенное исследование не обнаружило в группах больных с ОНМК, в сочетании с СД2 и без такового, различий в характере повреждения мозга. Тип инсульта, количество и размеры очагов, выраженность неврологических нарушений ис
1. Mozaffarian D, Benjamin EJ, Go AS, et al. Heart Disease and Stroke Statistics—2015 Update. Circulation. 2015;131(4):e29-e322. doi:10.1161/cir.0000000000000152
doi:10.1161/cir.0000000000000152
3. Инсульт: диагностика, лечение, профилактика. / Под. Ред. Суслиной З.А., Пирадова М.А. М.: МЕДпресс-информ; – 2009. [Insul’t: diagnostika, lechenie, profilaktika. Ed. By Suslina ZA, Piradov MA. Moscow: MEDpress-inform; 2009. (In Russ).]
4. Суслина З.А., Танашян М.М., Лагода О.В. Атеросклероз и ишемические нарушения мозгового кровообращения. // Атеротромбоз. – 2009.
5. Танашян M.M., Антонова К.В., Лагода О.В., и др. Острые нарушения мозгового кровообращения и сахарный диабет 2 типа. Анналы клинической и экспериментальной неврологии. – 2014. – Т. 8. – № 3. – С. 4-8. [Tanashyan MM, Antonova KV, Lagoda OV, et al. Ostrye narusheniya mozgovogo krovoobrashcheniya i sakharnyy diabet 2 tipa. Annaly klinicheskoy i eksperimental’noy nevrologii. 2014;8(3):4-8. (In Russ).]
6. Phipps MS, Jastreboff AM, Furie K, Kernan WN. The Diagnosis and Management of Cerebrovascular Disease in Diabetes. Curr Diab Rep. 2012;12(3):314-23. doi:10.1007/s11892-012-0271-x
 Дедов И.И. Сахарный диабет — опаснейший вызов мировому сообществу. Вестник РАМН. – 2012. – T.1. – C. 7–13. [Dedov II. Sakharnyy diabet — opasneyshiy vyzov mirovomu soobshchestvu. Annals of the Russian Academy of Medical Sciences. 2012;67(1):7-13. (In Russ).] doi:10.15690/vramn.v67i1.103
Дедов И.И. Сахарный диабет — опаснейший вызов мировому сообществу. Вестник РАМН. – 2012. – T.1. – C. 7–13. [Dedov II. Sakharnyy diabet — opasneyshiy vyzov mirovomu soobshchestvu. Annals of the Russian Academy of Medical Sciences. 2012;67(1):7-13. (In Russ).] doi:10.15690/vramn.v67i1.1038. Meschia JF, Bushnell C, Boden-Albala B, et al. Guidelines for the Primary Prevention of Stroke. Stroke. 2014;45(12):3754-832. doi:10.1161/str.0000000000000046
9. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2014;45(7):2160-2236. doi:10.1161/str.0000000000000024
10. Myint PK, Sinha S, Wareham NJ, et al. Glycated Hemoglobin and Risk of Stroke in People Without Known Diabetes in the European Prospective Investigation Into Cancer (EPIC)-Norfolk Prospective Population Study: A Threshold Relationship? Stroke. 2007;38(2):271-275. doi:10.1161/01.STR.0000254549.75763.5f
Myint PK, Sinha S, Wareham NJ, et al. Glycated Hemoglobin and Risk of Stroke in People Without Known Diabetes in the European Prospective Investigation Into Cancer (EPIC)-Norfolk Prospective Population Study: A Threshold Relationship? Stroke. 2007;38(2):271-275. doi:10.1161/01.STR.0000254549.75763.5f
11. Banerjee C, Moon YP, Paik MC, et al. Duration of Diabetes and Risk of Ischemic Stroke: The Northern Manhattan Study. Stroke. 2012;43(5):1212-7. doi:10.1161/strokeaha.111.641381
12. Танашян М.М., Орлов С.В., Домашенко М.А., Ионова В.Г. Метаболический синдром и ишемический инсульт // Анналы неврологии. – 2007. – Т. 1. – С. 5-11. [Tanashyan MM, Orlov SV, Domashenko MA, Ionova VG. Metabolicheskiy sindrom i ishemicheskiy insul’t. Annaly klinicheskoy i eksperimental’noy nevrologii. 2007;1(3):5-11. (In Russ).]
13. Танашян М.М., Щепанкевич Л.А., Орлов С.В., и др. Гемореология и гемостаз у больных с ишемическим инсультом на фоне сахарного диабета 2-го типа и метаболического синдрома //Анналы клинической и экспериментальной неврологии. – 2014. – Т. 3. – С. 14-20.[Tanashyan MM, Shchepankevich LA, Orlov SV, et al. Gemoreologiya i gemostaz u bol’nykh s ishemicheskim insul’tom na fone sakharnogo diabeta tipa 2 i metabolicheskogo sindroma. Annaly klinicheskoy i eksperimental’noy nevrologii. 2014;8(3):14-19. (In Russ).]
Танашян М.М., Щепанкевич Л.А., Орлов С.В., и др. Гемореология и гемостаз у больных с ишемическим инсультом на фоне сахарного диабета 2-го типа и метаболического синдрома //Анналы клинической и экспериментальной неврологии. – 2014. – Т. 3. – С. 14-20.[Tanashyan MM, Shchepankevich LA, Orlov SV, et al. Gemoreologiya i gemostaz u bol’nykh s ishemicheskim insul’tom na fone sakharnogo diabeta tipa 2 i metabolicheskogo sindroma. Annaly klinicheskoy i eksperimental’noy nevrologii. 2014;8(3):14-19. (In Russ).]
14. Щепанкевич Л.А., Вострикова Е.В., Пилипенко П.И. Клинические особенности ишемического инсульта, развившегося на фоне сахарного диабета 2 типа. Медицина и образование в Сибири. 2012; 3. Электронный ресурс. Доступен по http://ngmu.ru/cozo/mos/article/text_full.php?id=737.
15. Multicenter trial of hemodilution in ischemic stroke—background and study protocol. Scandinavian Stroke Study Group. Stroke. 1985;16(5):885-90. doi:10.1161/01.str.16.5.885
Scandinavian Stroke Study Group. Stroke. 1985;16(5):885-90. doi:10.1161/01.str.16.5.885
16. van Swieten JC, Koudstaal PJ, Visser MC, et al. Interobserver agreement for the assessment of handicap in stroke patients. Stroke. 1988;19(5):604-7. doi:10.1161/01.str.19.5.604
17. Khoury JC, Kleindorfer D, Alwell K, et al. Diabetes Mellitus: A Risk Factor for Ischemic Stroke in a Large Biracial Population. Stroke. 2013;44(6):1500-4. doi:10.1161/strokeaha.113.001318
18. Peters SAE, Huxley RR, Woodward M. Diabetes as a risk factor for stroke in women compared with men: a systematic review and meta-analysis of 64 cohorts, including 775 385 individuals and 12 539 strokes. The Lancet. 2014;383(9933):1973-80. doi:10.1016/s0140-6736(14)60040-4
19. Сунцов Ю.И., Болотская Л.Л., Маслова О.В., Казаков И.В. Эпидемиология сахарного диабета и прогноз его распространенности в Российской Федерации // Сахарный диабет. – 2011. – Т. 14. – №1 – C. 15-19. [Suntsov YI, Bolotskaya LL, Maslova OV, Kazakov IV. Epidemiology of diabetes mellitus and prognosis of its prevalence in the Russian Federation. Diabetes mellitus. 2011;14(1):15-19. (In Russ).] doi: 10.14341/2072-0351-6245
Сунцов Ю.И., Болотская Л.Л., Маслова О.В., Казаков И.В. Эпидемиология сахарного диабета и прогноз его распространенности в Российской Федерации // Сахарный диабет. – 2011. – Т. 14. – №1 – C. 15-19. [Suntsov YI, Bolotskaya LL, Maslova OV, Kazakov IV. Epidemiology of diabetes mellitus and prognosis of its prevalence in the Russian Federation. Diabetes mellitus. 2011;14(1):15-19. (In Russ).] doi: 10.14341/2072-0351-6245
20. Hyvarinen M, Tuomilehto J, Mahonen M, et al. Hyperglycemia and Incidence of Ischemic and Hemorrhagic Stroke-Comparison Between Fasting and 2-Hour Glucose Criteria. Stroke. 2009;40(5):1633-7. doi:10.1161/strokeaha.108.539650
21. American Diabetes Association. American Diabetes Association. Standards of Medical Care in Diabetes – 2015. Diabetes Care. 2015, 38 (1): 1-93. doi:10.2337/dc15-S001
%d1%80%d0%b5%d0%bd%d0%ba%d0%b8%d0%bd%d0%b0 — с русского на все языки
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиАнглийскийНемецкийНорвежскийКитайскийИвритФранцузскийУкраинскийИтальянскийПортугальскийВенгерскийТурецкийПольскийДатскийЛатинскийИспанскийСловенскийГреческийЛатышскийФинскийПерсидскийНидерландскийШведскийЯпонскийЭстонскийТаджикскийАрабскийКазахскийТатарскийЧеченскийКарачаевскийСловацкийБелорусскийЧешскийАрмянскийАзербайджанскийУзбекскийШорскийРусскийЭсперантоКрымскотатарскийСуахилиЛитовскийТайскийОсетинскийАдыгейскийЯкутскийАйнский языкЦерковнославянский (Старославянский)ИсландскийИндонезийскийАварскийМонгольскийИдишИнгушскийЭрзянскийКорейскийИжорскийМарийскийМокшанскийУдмурдскийВодскийВепсскийАлтайскийЧувашскийКумыкскийТуркменскийУйгурскийУрумскийЭвенкийскийБашкирскийБаскский
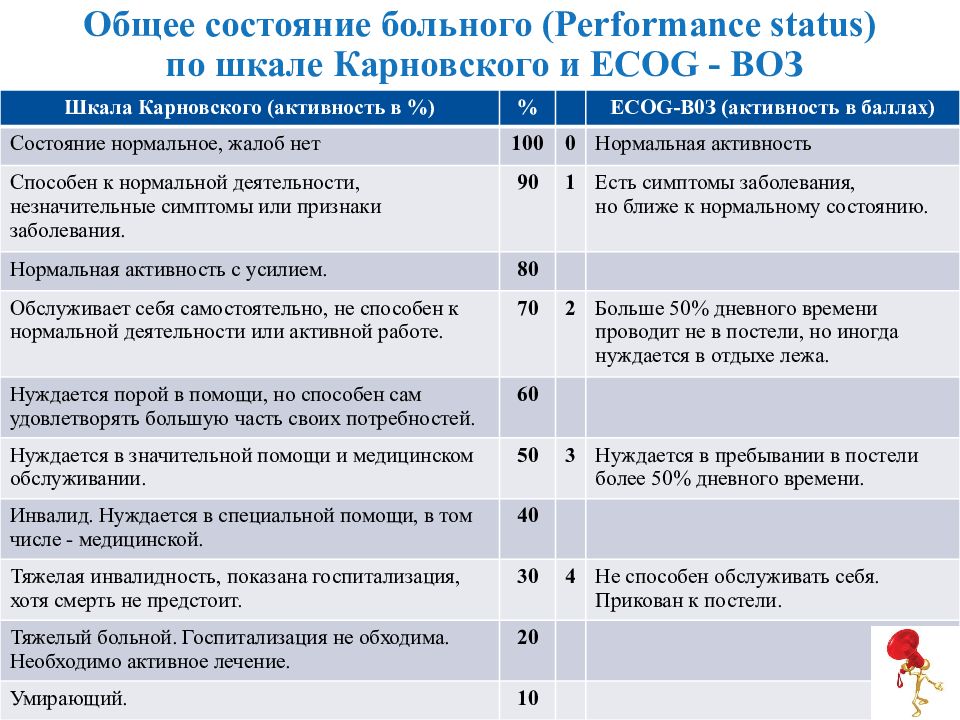
Использование индекса Бартеля и модифицированной шкалы Ренкина в исследованиях острого инсульта
Предпосылки и цель: Индекс Бартеля (BI) и модифицированная шкала Ренкина (MRS) — это обычно используемые шкалы, которые измеряют инвалидность или зависимость в повседневной жизни у жертв инсульта..gif) Целью этого исследования было изучить, как эти шкалы использовались и интерпретировались в испытаниях острого инсульта.
Целью этого исследования было изучить, как эти шкалы использовались и интерпретировались в испытаниях острого инсульта.
Методы: Мы определили из MEDLINE основные испытания эффективности нейропротекторных препаратов, тромболитических препаратов и антикоагулянтов при остром ишемическом инсульте, опубликованные в период с января 1995 г. по декабрь 1998 г. Мы выбрали те испытания, в которых в качестве параметров результатов использовались BI и / или MRS.
Полученные результаты: Было найдено пятнадцать испытаний, соответствующих критериям включения.BI использовался в 13, а MRS — в 8. В 4 испытаниях использовались средние и медианные баллы BI, а в 1 испытании сравнивались медианные баллы MRS. Первичные конечные точки включали BI в 7, MRS в 6 и как BI, так и MRS в 3. Что касается BI, то для определения благоприятного результата использовались различные суммы баллов от 50 до 95 в качестве пороговых значений. Благоприятный исход по MRS был определен как
Что касается BI, то для определения благоприятного результата использовались различные суммы баллов от 50 до 95 в качестве пороговых значений. Благоприятный исход по MRS был определен как
Выводы: Среди испытаний эффективности при остром инсульте мы обнаружили заметные различия в выборе первичных конечных точек и в определении благоприятного исхода как по BI, так и по MRS.Отсутствие консенсуса сильно затрудняет разработку, интерпретацию и сравнение исследований острого инсульта. В общем, может быть легче определить плохой исход, чем благоприятный. Плохой исход можно определить, если будет достигнута любая из следующих конечных точек: смерть, госпитализация из-за инсульта, MRS> 3 или BI <60.
Модифицированная шкала гандикапа Ранкина | База данных RehabMeasures
Библиография
Али, М. , и другие. (2013).» Насколько хорошо стандартные показатели исхода инсульта отражают качество жизни? Ретроспективный анализ данных клинических испытаний ». Ход 44: 3161-3165. Найдите на PubMed
, и другие. (2013).» Насколько хорошо стандартные показатели исхода инсульта отражают качество жизни? Ретроспективный анализ данных клинических испытаний ». Ход 44: 3161-3165. Найдите на PubMed
Batcho, C.S., et al. (2014) «Измерение функционального восстановления у пациентов с инсультом: реакция на ACTIVLIM-инсульт». J Neurol Neurosurg Psychiatry 85 (12): стр. 1337-42. Найдите на PubMed
Берзина Г. и др. (2015) «Анализ модифицированной шкалы ранкина с использованием концепций международной классификации функционирования, инвалидности и здоровья.”Eur J Phys Rehabil Med. Найдите на PubMed
Бруно, А. и др., (2010) «Улучшение оценки по модифицированной шкале Рэнкина с помощью упрощенной анкеты». Инсульт, 41 (5): п. 1048-50. Найдите на PubMed
Bruno, A., et al. (2011) «Упрощенная анкета с модифицированной шкалой ранжирования: воспроизводимость по телефону и подтверждение качества жизни». Ход 42 (8): п. 2276-9. Найдите на PubMed
2276-9. Найдите на PubMed
Bruno, A., et al., (2013) «Размер инсульта коррелирует с функциональным результатом по упрощенной модифицированной анкете по шкале Рэнкина.”J Stroke Cerebrovasc Dis 22 (6): стр. 781-3. Найдите на PubMed
Bruno, A., et al. (2013) «Упрощенная модифицированная анкета по шкале Рэнкина коррелирует с тяжестью инсульта». Clin Rehabil 27 (8): стр. 724-7 Найдите на PubMed
Бруно А. и Дж. А. Свитцер (2013) Письмо Бруно и Свитцера относительно статьи «Модифицированная шкала Рэнкина до перестройки имеет умеренную надежность и валидность среди наблюдателей при остром инсульте». Инсульт. 44 (5): п.e43. Найдите на Pubmed
Cincura C, Pontes-Neto OM, Neville IS, Mendes HF, Menezes DF, Mariano DC, Pereira IF, Teixeira LA Jesus PA, de Wueiroz DC, Pereira DF, Pinto E, Leite JP, Lopes AA, Oliveira = Filho J. (2009) «Валидация шкалы инсульта национальных институтов здоровья, модифицированной шкалы Рэнкина и индекса Бартеля в Бразилии: роль культурной адаптации и структурированного интервьюирования». Цереброваск Дис 27: 119-122 Найти на Pubmed
Цереброваск Дис 27: 119-122 Найти на Pubmed
Cup, E. H., Scholte op Reimer, W. J., et al.(2003). «Надежность и валидность канадских критериев оценки профессиональной деятельности у пациентов с инсультом». Clin Rehabil 17 (4): 402-409. Найдите на PubMed
Де Хаан Р., Хорн Дж. И др. (1993). «Сравнение пяти шкал инсульта с показателями инвалидности, инвалидности и качества жизни». Ход 24: 1178-1181.
де Хаан Р., Лимбург М. и др. (1995). «Клиническое значение« инвалидности »Ранкина после инсульта». Инсульт 26: 2027-2030.
Dennis, M. et al. (2012).«Определение модифицированной оценки Рэнкина после инсульта с помощью почтовых и телефонных анкет». Ход 43: 851-853. Найдите на PubMed
Дромерик А. В., Эдвардс Д. Ф. и др. (2003). «Чувствительность к изменениям инвалидности после инсульта: сравнение четырех шкал, используемых в клинических испытаниях». J Rehabil Res Dev 40: 1-8.
Fearon, P., et al. {2012) «Модифицированная шкала ранкинского инсульта до перестройки имеет умеренную надежность и валидность между наблюдателями в условиях острого инсульта». Ход 43 (12): п.3184-8 Найдите на PubMed
Ход 43 (12): п.3184-8 Найдите на PubMed
Ghandehari, K., et al. (2012) «Сравнительная межэкспертная надежность Азиатской шкалы инсульта, модифицированной шкалы Рэнкина и индекса Бартеля у пациентов с инфарктом головного мозга». ARYA Atheroscler 8 (3): стр. 153-7. Найдите на PubMed
Goldie, F.C., et al. (2014). «Взаимозависимость шкал результатов инсульта: надежные оценки из Виртуального международного архива исследований инсульта (VISTA)». Int J Stroke 9 (3): 328-332. Найдите на PubMed
Голицки, Д.и др. (2015). «Срок действия EQ-5D-5L в ходу». Qual Life Res 24 (4): 845-50. Найдите на PubMed
Горелик, П. Б., (2012). «Как исходная тяжесть влияет на эффективность и безопасность результатов исследований по вмешательству в острый ишемический инсульт». Ann N Y Acad Sci, 1268 : стр. 85-94. Найдите на PubMed
Харрисон, Дж. К. и др., (2013) «Шкалы оценки инсульта: клинические и клинические аспекты». Clin Interv Aging 8: 8-12. Найдите на PubMed
Clin Interv Aging 8: 8-12. Найдите на PubMed
Janssen, P.M., et al., (2010) «Сравнение телефонной и личной оценки модифицированной шкалы ранжирования». Цереброваск Дис 29: 137-139. Найдите на PubMed
Kerr, D.M., et al., (2012) «Семидневный NIHSS — чувствительный критерий результатов для поисковых клинических испытаний при остром инсульте: данные из Виртуального международного архива испытаний инсульта». Ход 43 (5): п. 1401-3. Найдите его на PubMed.
Квон С., Хартзема А. Г. и др. (2004). «Показатели инвалидности при инсульте: взаимосвязь между индексом Бартеля, показателем функциональной независимости и модифицированной шкалой Рэнкина.»Инсульт 35: 918-923.
Liotta, E.M., et al (2013) «Предикторы 30-дневной повторной госпитализации после внутримозгового кровоизлияния: одноцентровый подход для выявления потенциально изменяемых ассоциаций с повторной госпитализацией». Crit Care Med 41 (12): стр. 2762-9. Найдите на PubMed
Оволаби, М. О. (2010). «Что больше подходит для пациентов с инсультом: общие или специфические для инсульта показатели качества жизни?» Нейроэпидемиология 34 (1): 8-12. Найдите на PubMed
О. (2010). «Что больше подходит для пациентов с инсультом: общие или специфические для инсульта показатели качества жизни?» Нейроэпидемиология 34 (1): 8-12. Найдите на PubMed
Куинн Т.Дж., Доусон Дж., Уолтерс М.Р., Лис КР.(2009) «Функциональные критерии результатов в современных исследованиях инсульта». Int J Stroke. 4 : 200 –205. Найдите на PubMed
Куинн, Т.Дж. и др. (2010) «Надежность структурированной модифицированной оценки по шкале Рэнкина». Ход 41 (12): п. e602; ответ автора e603.Найдите его на PubMed
Риверо-Ариас, О. и др. (2010) «Сопоставление измерения модифицированной шкалы Рэнкина (mRS) с общим результатом для здоровья EuroQol (EZ-5D)». Принятие решений в медицине 30: 341-354.Найдите на PubMed
Saver, J.L. и др. (2010) «Повышение надежности классификации инвалидности при инсульте в клинических исследованиях и клинической практике: оценка, сфокусированная на Рэнкине (RFA)». Ход 41 (5): 992-5. Найдите на PubMed
Ход 41 (5): 992-5. Найдите на PubMed
Savio, K., et al. (2013) «Надежность модифицированной шкалы Рэнкина, применяемой по телефону». Neurol Int 5 (1): стр. e2. Найдите на PubMed
Quinn, T. J., Ray, G., et al. (2008). «Получение модифицированных оценок Рэнкина из медицинских историй болезни.»Инсульт 39: 3421-3423.
Schaefer, P. W., Huisman, T. A., et al. (2004). «Диффузионно-взвешенная МРТ при закрытой черепно-мозговой травме: высокая корреляция с исходной оценкой по шкале комы Глазго и оценкой по модифицированной шкале Рэнкина при выписке». Радиология 233 (1): 58-66.
Шинохара Ю., Минемацу К. и др. (2006). «Модифицированная шкала Рэнкина с расширенной схемой руководства и анкетой для собеседования: согласие между экспертами и воспроизводимость оценки». Цереброваск Дис 21: 271-278.
Тилли, Б.C., Marler, J., et al. (1996). «Использование глобального теста на множественные исходы в исследованиях инсульта с применением в Национальном институте неврологических расстройств и инсульта t-PA Stroke Trial». Ход 27: 2136-2142.
Ход 27: 2136-2142.
van Swieten, J. C., Koudstaal, P. J., et al. (1988). «Соглашение между наблюдателями по оценке инвалидности у пациентов с инсультом». Ход 19: 604-607. Найдите на PubMed
Weimar, C., Kurth, T., et al. (2002). «Оценка работоспособности и инвалидности после ишемического инсульта.»Ход 33 (8): 2053-2059.
Wilson, J. T., Hareendran, A., et al. (2002). «Улучшение оценки результатов при инсульте: использование структурированного интервью для выставления оценок по модифицированной шкале Рэнкина». Ход 33 (9): 2243-2246.
Wolfe, C.D., Taub, N.A., et al. (1991). «Оценка шкал инвалидности и инвалидности для больных, перенесших инсульт». Ход 22: 1242-1244.
Zhao, H., et al., «Модифицированная шкала Рэнкина при остром инсульте имеет хорошую межэкспертную надежность, но сомнительную валидность.”Цереброваскский дис., 2010. 29 (2): с. 188-93. Найдите на PubMed
Шкала Рэнкина— обзор
Шкалы для оценки исходов (глобальных или инвалидных) после инсульта
Доступны несколько шкал для оценки глобальных (гандикапных) результатов после инсульта. Эти шкалы относительно короткие и включают несколько четко определенных клинических степеней. Наиболее часто используемые шкалы — это mRS и шкала результатов Глазго (GOS). 5,6,202 Это действенные и действенные способы оценки результатов клинических испытаний и эпидемиологических исследований. 183,203 Шкалы показали высокую степень достоверности, а воспроизводимость внутри эксперта высока. 204
Эти шкалы относительно короткие и включают несколько четко определенных клинических степеней. Наиболее часто используемые шкалы — это mRS и шкала результатов Глазго (GOS). 5,6,202 Это действенные и действенные способы оценки результатов клинических испытаний и эпидемиологических исследований. 183,203 Шкалы показали высокую степень достоверности, а воспроизводимость внутри эксперта высока. 204
MRS считается лучшей в настоящее время доступной шкалой для оценки результатов после инсульта. 17 Ее следует рассматривать не только как шкалу гандикапа, а скорее как глобальный показатель результатов. У него есть ограничения. Определения несколько произвольны. Оценка 0 по шкале mRS может быть труднодостижимой, поскольку у пациента не должно быть никаких остаточных симптомов, связанных с инсультом (таблица 21-12).Это строгое определение проблематично, потому что пациент, возможно, полностью выздоровел, но если минимальные проблемы сохраняются, ему необходимо присвоить 1 балл. В результате оценка 1 охватывает широкий спектр пациентов. Как правило, в клинических испытаниях использовалось дихотомическое или трихотомическое разделение оценок, при этом оценка 0–1 считалась очень благоприятным исходом, 2–3 — благоприятным и 4–6 — неблагоприятным. В некоторых случаях оценка 2 считается положительным ответом, а в других — отрицательным.Согласие между экспертами в дифференциации смежных баллов, особенно среди пациентов с легким поражением, может быть затруднено. 205 MRS продемонстрировала умеренную межэкспертную надежность, которая улучшается с помощью структурированных интервью. 204 Обучение использованию весов, ведущее к сертификации, также повышает их надежность. 206 Использование централизованного вынесения решения по результатам посредством передачи видеокассет — еще одна стратегия, повышающая надежность шкал. 16,207,208 Конструктивная валидность mRS демонстрируется ее тесной взаимосвязью с другими показателями тяжести инсульта, включая баллы NIHSS и изображения головного мозга.
В результате оценка 1 охватывает широкий спектр пациентов. Как правило, в клинических испытаниях использовалось дихотомическое или трихотомическое разделение оценок, при этом оценка 0–1 считалась очень благоприятным исходом, 2–3 — благоприятным и 4–6 — неблагоприятным. В некоторых случаях оценка 2 считается положительным ответом, а в других — отрицательным.Согласие между экспертами в дифференциации смежных баллов, особенно среди пациентов с легким поражением, может быть затруднено. 205 MRS продемонстрировала умеренную межэкспертную надежность, которая улучшается с помощью структурированных интервью. 204 Обучение использованию весов, ведущее к сертификации, также повышает их надежность. 206 Использование централизованного вынесения решения по результатам посредством передачи видеокассет — еще одна стратегия, повышающая надежность шкал. 16,207,208 Конструктивная валидность mRS демонстрируется ее тесной взаимосвязью с другими показателями тяжести инсульта, включая баллы NIHSS и изображения головного мозга. 204 Адамс и др. 126 предложили скорректировать определения благоприятных исходов по mRS исходя из исходной тяжести неврологических нарушений, оцененных по шкале NIHSS. Saver 209 выступал за то, чтобы изменение распределения баллов по шкале mRS использовалось как способ оценки успешности лечения.Последний подход подвергался критике. 210 Mandava et al. 211 обнаружили, что использование дихотомизации конечных точек было более надежным, чем использование стратегии распределения.
204 Адамс и др. 126 предложили скорректировать определения благоприятных исходов по mRS исходя из исходной тяжести неврологических нарушений, оцененных по шкале NIHSS. Saver 209 выступал за то, чтобы изменение распределения баллов по шкале mRS использовалось как способ оценки успешности лечения.Последний подход подвергался критике. 210 Mandava et al. 211 обнаружили, что использование дихотомизации конечных точек было более надежным, чем использование стратегии распределения.
GOS был разработан для оценки исходов у пациентов с травмами головы, но теперь он используется для оценки исходов у пациентов с инсультом, в частности с кровотечениями. 202 212 213 Состоит из пяти ступеней с подразделениями в рамках трех высших категорий (таблица 21-13).Разделение баллов на 2 (умеренная инвалидность) и 3 (тяжелая инвалидность) может быть трудным. Тем не менее, GOS имеет хорошее согласие между экспертами и воспроизводимость результатов внутри эксперта. Использование GOS, по-видимому, лучше всего подходит для пациентов с субарахноидальным кровоизлиянием из-за связи GCS со шкалой WFNS. Спектр оценок по шкале GOS может отражать серьезное диффузное или многоочаговое повреждение головного мозга, которое может возникнуть при субарахноидальном кровоизлиянии. GOS включает степень постоянного вегетативного состояния, которое не очень часто встречается у выживших после ишемического инсульта.Кроме того, GOS не делает различий между пациентами с более легкой степенью поражения. Таким образом, использование GOS снизилось в исследованиях ишемического инсульта, поскольку mRS стала более широко использоваться.
Использование GOS, по-видимому, лучше всего подходит для пациентов с субарахноидальным кровоизлиянием из-за связи GCS со шкалой WFNS. Спектр оценок по шкале GOS может отражать серьезное диффузное или многоочаговое повреждение головного мозга, которое может возникнуть при субарахноидальном кровоизлиянии. GOS включает степень постоянного вегетативного состояния, которое не очень часто встречается у выживших после ишемического инсульта.Кроме того, GOS не делает различий между пациентами с более легкой степенью поражения. Таким образом, использование GOS снизилось в исследованиях ишемического инсульта, поскольку mRS стала более широко использоваться.
Все глобальные критерии оценки исходов включают некоторое объединение групп пациентов с широким спектром неврологических последствий; они могут не дать адекватного определения многих тонких или разнообразных, но важных неврологических последствий инсульта. Однако весы относительно просты в использовании, доступны образовательные и сертификационные программы для повышения их достоверности и надежности, и они успешно использовались в многочисленных клинических испытаниях. Весы используются клиницистами и все чаще группами, которые сертифицируют или контролируют качество помощи в медицинских центрах. Врачи, работающие с пациентами с инсультом, знакомы с этими инструментами, и они широко используются. Были предложены другие шкалы результатов, но они широко не используются. 214 Шкалы исходов инсульта у детей также были оценены. 215 До тех пор, пока не появятся более качественные рейтинговые инструменты, следует продолжать использовать mRS или GOS. 17
Весы используются клиницистами и все чаще группами, которые сертифицируют или контролируют качество помощи в медицинских центрах. Врачи, работающие с пациентами с инсультом, знакомы с этими инструментами, и они широко используются. Были предложены другие шкалы результатов, но они широко не используются. 214 Шкалы исходов инсульта у детей также были оценены. 215 До тех пор, пока не появятся более качественные рейтинговые инструменты, следует продолжать использовать mRS или GOS. 17
Шкала Ренкина — обзор
ПРАВИЛА ВЫИГРЫША — НЕТ ВЫИГРЫША
Оценка новых лекарств в группах пациентов, нуждающихся в неотложных нейроэкстракциях, осложняется возможностью патологического исхода.Например, нежелательны препараты, которые улучшают смертность или «хорошее восстановление» только для одновременного увеличения доли вегетативных исходов или тяжелых последствий. Общее статистическое решение этой проблемы состоит в том, чтобы проверить гипотезу о том, что вмешательство или лекарство улучшает благоприятные исходы, одновременно проверяя отсутствие сопутствующего повышения патологических исходов в пользу группы, не получавшей лечения или плацебо. Практическим следствием введения беспроигрышных правил для текущих клинических испытаний нейроэкстренной медицинской помощи является сложность успешной демонстрации эффективности и отсутствие неблагоприятных тенденций в той же популяции пациентов (т.е., мы проверяем гипотезы на обоих концах распределения результатов). В общем, демонстрация строгой эквивалентности при отсутствии различий в патологических исходах между группами лечения не требуется. Скорее, нам нужно только показать, что мы не превышаем клинически приемлемый, а предопределенный порог для наблюдаемой разницы (например, не более 10%). К сожалению, этот метод проверяет только подмножество исследуемой совокупности на любом конце шкалы, тем самым снижая полезность полной выборки и связанную с ней мощность.В некоторых исследованиях начали анализировать клинические исходы с использованием подходов кумулятивного отношения шансов, которые могут сначала предусмотреть некоторые заранее заданные комбинации порядковых уровней выбранной шкалы (например, в случае mRS, коллапс смерти и тяжелая инвалидность).
Практическим следствием введения беспроигрышных правил для текущих клинических испытаний нейроэкстренной медицинской помощи является сложность успешной демонстрации эффективности и отсутствие неблагоприятных тенденций в той же популяции пациентов (т.е., мы проверяем гипотезы на обоих концах распределения результатов). В общем, демонстрация строгой эквивалентности при отсутствии различий в патологических исходах между группами лечения не требуется. Скорее, нам нужно только показать, что мы не превышаем клинически приемлемый, а предопределенный порог для наблюдаемой разницы (например, не более 10%). К сожалению, этот метод проверяет только подмножество исследуемой совокупности на любом конце шкалы, тем самым снижая полезность полной выборки и связанную с ней мощность.В некоторых исследованиях начали анализировать клинические исходы с использованием подходов кумулятивного отношения шансов, которые могут сначала предусмотреть некоторые заранее заданные комбинации порядковых уровней выбранной шкалы (например, в случае mRS, коллапс смерти и тяжелая инвалидность). Такой подход оценивает полный спектр результатов по выбранным шкалам результатов, обеспечивая более чувствительный и мощный аналитический подход.
Такой подход оценивает полный спектр результатов по выбранным шкалам результатов, обеспечивая более чувствительный и мощный аналитический подход.
В качестве примера, хотя несколько категорий доступны в традиционных шкалах результатов (например,g., Шкала результатов Глазго [23], Расширенная шкала результатов Глазго или mRS [24]), формальный статистический анализ исторически сгруппировал эти шкалы результатов в две категории, выбрав оценку, которая отличает благоприятный исход от неблагоприятного. У использования этого подхода к дихотомии упорядоченной порядковой шкалы результатов есть два основных недостатка.
Во-первых, разделение конечной точки на несколько категорий не согласуется с современной клинической практикой. Например, исход после серьезного инсульта не является бинарным исходом, но в основном существует в континууме, причем сдвиги в этом континууме весьма актуальны для отдельного пациента, даже если сдвиг не такой, что он пересекает произвольную границу, разделяющую предположительно плохой исход от якобы хорошего исхода (25). Обсуждение этой концепции обсуждается в документе Пункты рассмотрения об остром инсульте, подготовленном Комитетом по патентованным лекарственным препаратам (CPMP) (26), в котором говорится следующее: «В качестве альтернативы можно показать, что агент эффективно перемещает пациентов из тяжелый исход для группы умеренной инвалидности и от умеренной инвалидности до выздоровевшей группы, т. е. эффект препарата распространяется на все степени тяжести инсульта, перемещая пациентов к более высокой степени независимости в их повседневной деятельности.Опять же, для такого рода анализа клинически значимые сдвиги должны быть определены и обоснованы в протоколе исследования. В этом случае категориальный анализ дает больше информации о действии препарата, чем дихотомический анализ ». Проблема игнорирования информации в конечных точках нескольких категорий путем придания им дихотомии, хотя и выявляется с помощью CPMP, десятилетиями преследовала острые нейроэкстренные исследования (27).
Обсуждение этой концепции обсуждается в документе Пункты рассмотрения об остром инсульте, подготовленном Комитетом по патентованным лекарственным препаратам (CPMP) (26), в котором говорится следующее: «В качестве альтернативы можно показать, что агент эффективно перемещает пациентов из тяжелый исход для группы умеренной инвалидности и от умеренной инвалидности до выздоровевшей группы, т. е. эффект препарата распространяется на все степени тяжести инсульта, перемещая пациентов к более высокой степени независимости в их повседневной деятельности.Опять же, для такого рода анализа клинически значимые сдвиги должны быть определены и обоснованы в протоколе исследования. В этом случае категориальный анализ дает больше информации о действии препарата, чем дихотомический анализ ». Проблема игнорирования информации в конечных точках нескольких категорий путем придания им дихотомии, хотя и выявляется с помощью CPMP, десятилетиями преследовала острые нейроэкстренные исследования (27). С появлением современных статистических методов, которые могут надлежащим образом исследовать эту дополнительную информацию в конечных точках нескольких категорий, следует пересмотреть постоянную зависимость от таких неэффективных методов.
С появлением современных статистических методов, которые могут надлежащим образом исследовать эту дополнительную информацию в конечных точках нескольких категорий, следует пересмотреть постоянную зависимость от таких неэффективных методов.
Во-вторых, использование подхода, который имеет меньшую (возможно, намного меньшую) статистическую чувствительность при обнаружении клинически значимой пользы или вреда от вмешательства, подвергает большее количество пациентов экспериментальному процессу клинического испытания без компенсации пользы. Это ограничение на использование информации, предоставляемой каждым участвующим субъектом, противоречит принципу проведения максимально эффективного исследования, что является требованием большинства этических руководств для исследований на людях.
В исследованиях острого инсульта mRS рассматривается как наиболее подходящий показатель клинического исхода. Во многих продолжающихся исследованиях острого инсульта было запланировано изменение пропорций остаточной нетрудоспособности по всему диапазону исходов mRS, чтобы обеспечить более надежный и клинически приемлемый анализ, чем простой дихотомический подход к хорошим и плохим исходам. Таким образом, этот анализ с использованием подхода пропорциональных шансов отражает не только вероятность хорошего выздоровления, но также может отражать другой важный лечебный эффект, а именно переход к повышенной вероятности умеренной остаточной нетрудоспособности по сравнению с тяжелой.Это особенно актуально для тех исследований, где прогнозируемый результат является плохим и где важное преимущество лечения не может быть обнаружено с помощью подхода простой дихотомии.
Таким образом, этот анализ с использованием подхода пропорциональных шансов отражает не только вероятность хорошего выздоровления, но также может отражать другой важный лечебный эффект, а именно переход к повышенной вероятности умеренной остаточной нетрудоспособности по сравнению с тяжелой.Это особенно актуально для тех исследований, где прогнозируемый результат является плохим и где важное преимущество лечения не может быть обнаружено с помощью подхода простой дихотомии.
В качестве конкретного примера, mRS имеет семь категорий (см. Ниже), цель которых — предоставить средства оценки как индивидуального уровня инвалидности пациента, так и, в контексте клинического исследования, доли пациентов, которые меняют категории в любом исследовании. терапевтического вмешательства. MRS является важным и универсальным средством измерения клинических результатов в большинстве исследований инсульта.MRS представляет собой комбинированную шкалу результатов, которая измеряет неврологическую функцию и инвалидность, разделяя семь категорий, включая смерть в виде mRS 6 (28,29):
| mRS | Неврологические симптомы | Инвалидность | |
|---|---|---|---|
| 0 | Нет | Нет | |
| 1 | Да | Нет | |
| 2 | Да | Мягкий | |
| 3 | 902 9017 Да | 9017 Да | 9017 Да | Умеренно тяжелая
| 5 | Да | Тяжелая, прикованная к постели | |
| 6 | — | Смерть |
Модель пропорциональных шансов с семью упорядоченными категориями ответов может использоваться в конечном анализе первичной точки анализа . Преимущества использования этого подхода (7) по сравнению с моделью бинарного исхода («плохой» или «неплохой» исход) следующие: (а) модель пропорциональных шансов с семью порядковыми категориями использует гораздо больше информации из mRS. оценка, чем бинарная модель; (b) этот подход может снизить вероятность утверждения превосходства из-за положительного воздействия на плохой конец шкалы mRS и в то же время имеет отрицательный эффект на хороший конец; и (c) анализ пропорциональных шансов будет более чувствителен к изменениям в любой части шкалы mRS, чем бинарная модель.Следовательно, для метода пропорциональных шансов требуется меньший размер выборки, чем для простого критерия хи-квадрат. Это гарантирует выполнение общего принципа проведения эффективного испытания, тем самым придерживаясь этических принципов исследования на людях.
Преимущества использования этого подхода (7) по сравнению с моделью бинарного исхода («плохой» или «неплохой» исход) следующие: (а) модель пропорциональных шансов с семью порядковыми категориями использует гораздо больше информации из mRS. оценка, чем бинарная модель; (b) этот подход может снизить вероятность утверждения превосходства из-за положительного воздействия на плохой конец шкалы mRS и в то же время имеет отрицательный эффект на хороший конец; и (c) анализ пропорциональных шансов будет более чувствителен к изменениям в любой части шкалы mRS, чем бинарная модель.Следовательно, для метода пропорциональных шансов требуется меньший размер выборки, чем для простого критерия хи-квадрат. Это гарантирует выполнение общего принципа проведения эффективного испытания, тем самым придерживаясь этических принципов исследования на людях.
Таким образом, по клиническим и статистическим причинам, запланированный анализ первичной конечной точки шкал, таких как mRS, должен быть выполнен с сохранением упорядоченных категориальных данных (категория за категорией, потенциально объединяющей тяжелую инвалидность и смерть), которые обеспечат полную картина потенциальной эффективности любого терапевтического вмешательства в условиях неотложной нейрохирургии.
Преобразование результатов самооценки из регистра инсультов в модифицированную шкалу Рэнкина: перекрестное исследовательское исследование
Выборка исследования и процедура
Это перекрестное, исследовательское исследование на основе регистров, часть Физического Активность до инсульта в Гётеборге, проект 11 . Использовались два регистра качества: Väststroke, местный регистр инсульта в Гетеборге, Швеция, и Riksstroke, шведский национальный регистр инсульта. Были извлечены данные об оказании неотложной помощи и трехмесячном последующем наблюдении, зарегистрированные с 1 января 2015 г. по 31 августа 2018 г.Данные по неотложной помощи регистрировались персоналом больницы. Данные трехмесячного последующего наблюдения были собраны с использованием почтовых анкет, заполняемых самостоятельно, а также телефонных интервью с обученными медсестрами. Регистры Väststroke и Riksstroke были связаны статистиком Riksstroke с использованием уникальных личных идентификационных номеров пациентов.
Критерии включения, применявшиеся в этом исследовании, были следующими: пациенты с первым в истории инсультом, диагностированным в соответствии с кодами Международной классификации болезней (МКБ-10), пациенты в возрасте> 18 лет, полные данные о пациентах с mRS. данные, зарегистрированные в регистре Väststroke, и ответы на вопросы Riksstroke, которые должны были использоваться в алгоритме, как показано в дополнительной таблице S1.
Этика и информированное согласие
Файл данных, который использовался в исследовании, был анонимным, и отдельные пациенты не могли быть идентифицированы. Исследование было одобрено региональным советом по этике в Гетеборге (№ 346-16) и Шведским органом по этике (поправка № 2019-01251 / 346-16). Была соблюдена Хельсинкская декларация. Информированное согласие : согласно Управлению по защите данных Швеции, обработка данных, созданных в рамках регистров качества, представляет собой исключение из общего правила, требующего письменного информированного согласия пациентов. Кроме того, Закон о персональных данных (шведский закон № 1998: 204 от 29 апреля 1998 г.) позволяет собирать данные из медицинских карт для клинических целей и контроля качества без письменного информированного согласия.
Кроме того, Закон о персональных данных (шведский закон № 1998: 204 от 29 апреля 1998 г.) позволяет собирать данные из медицинских карт для клинических целей и контроля качества без письменного информированного согласия.
Переменные
Переменные, использованные для разработки модифицированного алгоритма шкалы Рэнкина-Риксстрока (mRS-RS)
Контрольная переменная mRS была получена из трехмесячных данных наблюдения Вестстрока. Данные mRS были собраны опытными врачами или медсестрами. Рекомендации по телефонному интервью, описанные Bruno et al. 8,12 отслеживались. MRS используется для определения уровня функциональной инвалидности пациента после инсульта; в нем используется 7-уровневая порядковая шкала, где 0 = «нет симптомов» и 6 = «смерть» 5 .
Переменные индекса были получены из данных трехмесячного наблюдения Riksstroke . Семь вопросов были выбраны профессионалами здравоохранения на основе клинических соображений для процедуры картирования. Были заданы следующие вопросы: 1. «Зависимы ли вы сегодня от помощи / поддержки члена семьи / ближайшего родственника?» 2.»Где ты сейчас остановился?» 3. «Как ваша подвижность сейчас?» 4. «Получают ли вы помощь от кого-нибудь, чтобы сходить в туалет?» 5. «Вам нужна помощь, чтобы одеться и раздеться?» 6. «У вас все еще есть проблемы после инсульта?» 7. «Смогли ли вы вернуться к жизни и занятиям, которые у вас были до инсульта?» (Дополнительная таблица S1).
Были заданы следующие вопросы: 1. «Зависимы ли вы сегодня от помощи / поддержки члена семьи / ближайшего родственника?» 2.»Где ты сейчас остановился?» 3. «Как ваша подвижность сейчас?» 4. «Получают ли вы помощь от кого-нибудь, чтобы сходить в туалет?» 5. «Вам нужна помощь, чтобы одеться и раздеться?» 6. «У вас все еще есть проблемы после инсульта?» 7. «Смогли ли вы вернуться к жизни и занятиям, которые у вас были до инсульта?» (Дополнительная таблица S1).
Переменные, использованные для описания образца исследования
Из Väststroke: тяжесть инсульта при поступлении в больницу оценивалась по шкале инсульта Национального института здравоохранения (NIHSS) 13 .Когнитивные функции во время пребывания в больнице оценивались с помощью Монреальского когнитивного теста (MoCA) 14 .
Из Riksstroke: были получены пол пациентов, возраст, факторы риска инсульта, статус активности до инсульта, реперфузионное лечение, продолжительность пребывания в больнице и место выписки. Тип инсульта классифицировался согласно кодам МКБ-10: отсутствие травматического внутримозгового кровоизлияния (I61), инфаркт мозга (I63) и неуточненный инсульт (I64). Уровень сознания по прибытии в больницу оценивался по шкале уровня реакции (RLS).Оценки RLS варьировались от 1 до 8, где «1» означало полное бодрствование / бдительность 15 .
Тип инсульта классифицировался согласно кодам МКБ-10: отсутствие травматического внутримозгового кровоизлияния (I61), инфаркт мозга (I63) и неуточненный инсульт (I64). Уровень сознания по прибытии в больницу оценивался по шкале уровня реакции (RLS).Оценки RLS варьировались от 1 до 8, где «1» означало полное бодрствование / бдительность 15 .
Статистический анализ
Характеристики исследуемой выборки описаны как средние (SD), медианы (диапазон), количество (%) и квартили (Q 1 –Q 3 ). Анализ исключения был выполнен с помощью критерия Пирсона χ 2 для номинальных переменных и критерия Манна – Уитни U для порядковых и непрерывных переменных с искаженными распределениями.
Разработка модифицированного алгоритма шкалы Ренкина-Риксстроука (mRS-RS)
Предварительная работа и картирование
Многопрофильная группа специалистов в области здравоохранения (три автора: Т.A., M.R., K.S.S.) с 8–30-летним опытом реабилитации после инсульта (исследования, а также клиническая работа) выполнили ручное сопоставление вопросов Riksstroke с оценками mRS. Семь вопросов от Riksstroke были определены как возможные кандидаты для алгоритма mRS-RS. Кроме того, категории ответов на вопросы Riksstroke были сопоставлены с оценками mRS, индивидуально каждым специалистом в области здравоохранения. Варианты ответа «Не знаю» и «Не имею родственников / друзей или не контактирую с родственниками / друзьями» были исключены из анализа.
Семь вопросов от Riksstroke были определены как возможные кандидаты для алгоритма mRS-RS. Кроме того, категории ответов на вопросы Riksstroke были сопоставлены с оценками mRS, индивидуально каждым специалистом в области здравоохранения. Варианты ответа «Не знаю» и «Не имею родственников / друзей или не контактирую с родственниками / друзьями» были исключены из анализа.
Результаты ручного картирования были обобщены в SPSS. Общее согласие между mRS-RS и mRS, а также согласие по отдельным классам оценивалось с помощью каппа Коэна. Поскольку mRS является порядковой шкалой, был рассчитан квадратичный вес типа Флейсса-Коэна (K w ). Уровень согласия интерпретировался как слабый (K w ≤ 0,20), удовлетворительный (K w = 0,21–0,40), умеренный (K w = 0,41–0,60), существенный (K w = 0,61– 0.80) и почти идеальный (≥ 0,81) 16 . Результаты описываются перекрестной таблицей, значениями K и , значениями p и 95% доверительным интервалом.
Деревья принятия решений
Справочная переменная mRS (Väststroke) была порядковой. Существовали как порядковые, так и номинальные индексные переменные — это семь вопросов от Riksstroke. Таким образом, для построения деревьев решений был использован непараметрический метод. Набор данных был разделен на обучающий (80%) и тестовый (20%) наборы. Несколько измерений были использованы для оценки производительности деревьев решений.Точность классификации использовалась для определения общего числа правильно классифицированных пациентов. Точность классификации дополнительно сравнивалась со скоростью отсутствия информации, чтобы определить удобство использования модели. Квадратичный K w использовался для изучения соответствия между истинными и предсказанными значениями mRS. Для каждого дерева классификации были созданы матрицы неточностей.
Были построены три отдельных дерева решений:
Дерево 1. Для проверки алгоритма mRS-RS, который был разработан на основе ручного сопоставления, мы использовали mRS с оценками 0–2, 3, 4 и 5 в качестве целевой переменной.

Дерево 2. Чтобы отличить оценки mRS 0, 1 и 2 друг от друга, в качестве целевой переменной использовалась полномасштабная оценка mRS.
Дерево 3. Из-за клинических соображений и проблем с ручным картированием целевой переменной была mRS с оценками 0–1, 2–3 и 4–5, что указывало на отсутствие инвалидности, умеренную инвалидность и тяжелую инвалидность, соответственно.
Описательный статистический анализ исследуемой выборки и анализ согласованности выполнялись в SPSS Statistics 26.0 (IBM SPSS Statistics для Windows, Армонк, Нью-Йорк: IBM Corp). Деревья решений были построены с использованием подхода условных деревьев вывода (ctree) из набора инструментов для рекурсивного разбиения (partykit) из пакета 17,18 (R, версия 3.6.2). Все тесты были двусторонними и проводились с уровнем значимости 5%.
Ig Governance — Неврологические весы
Общая сумма баллов по инвалидности (ODSS) была первой шкалой, разработанной для оценки ограничений пациентов с
иммуноопосредованные периферические невропатии. ODSS фокусируется на функциях верхних и нижних конечностей и состоит из
контрольный список для интервьюирования пациентов. ODSS продемонстрировал надежность, оперативность и конструктивную валидность в
люди с синдромом Гийена-Барре, хронической воспалительной демиелинизирующей полинейропатией и парапротеин-ассоциированной
демиелинизирующая невропатия. Чтобы уменьшить возможный эффект потолка, ODSS был немного изменен, чтобы включить лазание.
лестница и бег. Эта новая мера называется Шкалой общих ограничений невропатии (ONLS).Критерий требует, чтобы эта шкала была заполнена путем сложения общей суммы баллов по шкале рук (0-5) и баллов по шкале ног (0-7), что дает общий балл от 0 до 12.
ODSS фокусируется на функциях верхних и нижних конечностей и состоит из
контрольный список для интервьюирования пациентов. ODSS продемонстрировал надежность, оперативность и конструктивную валидность в
люди с синдромом Гийена-Барре, хронической воспалительной демиелинизирующей полинейропатией и парапротеин-ассоциированной
демиелинизирующая невропатия. Чтобы уменьшить возможный эффект потолка, ODSS был немного изменен, чтобы включить лазание.
лестница и бег. Эта новая мера называется Шкалой общих ограничений невропатии (ONLS).Критерий требует, чтобы эта шкала была заполнена путем сложения общей суммы баллов по шкале рук (0-5) и баллов по шкале ног (0-7), что дает общий балл от 0 до 12.
Чтобы оценить изменение инвалидности в обзоре пациента, записывается скорректированный ONLS.
Скорректированная оценка идентична оценке инвалидности ONLS, за исключением исключения.
изменений функции верхних конечностей от 0 до 1 или от 1 до 0, потому что эти изменения
не были признаны клинически значимыми для всех пациентов. Все остальные 1-балльные ступени шкалы для рук или ног представляют клинически значимые изменения инвалидности.
Все остальные 1-балльные ступени шкалы для рук или ног представляют клинически значимые изменения инвалидности.
Шкала общих ограничений невропатии
Инструкции: Экзаменатор должен задавать вопросы и наблюдать за пациентом, чтобы определить ответы на следующие вопросы.Следует отметить любое другое заболевание, кроме периферическая невропатия, ограничивающая функцию.
Весы для рук
| Есть ли у пациента какие-либо симптомы в руках или руках, например покалывание, онемение или слабость? (если нет, перейдите в раздел ножек) | Да | Нет |
|---|
| Влияет ли на пациента способность: | Не влияет | Затрагивается, но не предотвращается | Предотвращено |
|---|---|---|---|
| Мыть и расчесывать волосы | |||
| Используйте вместе нож и вилку (или ложку, если нож и вилка не используются) | |||
| Застегивайте или расстегивайте пуговицы или молнии | |||
| Оденьте верхнюю часть их корпус без кнопок или молний |
| Если все эти функции заблокированы, может ли пациент совершать целенаправленные движения руками или руками? | Да | Нет | Не применимо |
|---|
Оценка по оружию
- 0 = Нормальный
- 1 = Незначительные симптомы в одной или обеих руках, но не влияющие ни на одну из перечисленных функций
- 2 = инвалидность в одной или обеих руках, влияющая, но не препятствующая ни одной из перечисленных функций
- 3 = инвалидность в одной или обеих руках, препятствующая хотя бы одной, но не всем перечисленным функциям
- 4 = инвалидность обеих рук, препятствующая выполнению всех перечисленных функций, но целенаправленное движение все еще возможно
- 5 = инвалидность обеих рук, препятствующая любым целенаправленным движениям
Весы для ног
| Да | Нет | Неприменимо | |
|---|---|---|---|
| Есть ли у пациента трудности при беге или подъеме по лестнице? | |||
| Есть ли у пациента трудности с ходьбой? | |||
| Не выглядит ли их походка ненормальной? | |||
Как они мобилизуются примерно на 10 метров (т. е.е. 33 фута)? е.е. 33 фута)? | |||
| Без посторонней помощи | |||
| С одной палкой или костылем, или держась за чью-то руку | |||
| С двумя палками или костылями, одной палкой или рамой костыля | , держась за чью-то руку|||
| С инвалидной коляской | |||
| Если они используют инвалидную коляску, могут ли они встать и пройти 1 метр с помощью одного человека? | |||
Если они не могут ходить, как указано выше, могут ли они сделать некоторые целенаправленные движения ногами, например. грамм. переставить ноги в постели? грамм. переставить ноги в постели? | |||
| Использует ли пациент ортезы / скобы для голеностопного сустава? (Если да, укажите, пожалуйста, справа или слева) |
Оценка за ноги
- 0 = ходьба / подъем по лестнице / бег не влияет
- 1 = Ходьба / подъем по лестнице / бег затруднены, но походка не выглядит ненормальной
- 2 = Самостоятельная ходит, но походка выглядит ненормальной
- 3 = Требуется односторонняя поддержка, чтобы пройти 10 метров (палка, костыль, одна рука)
- 4 = Требуется двусторонняя поддержка, чтобы пройти 10 метров (палки, костыли, костыль и рука, рама)
- 5 = Требуется инвалидная коляска, чтобы проехать 10 метров, но возможность стоять и проходить 1 метр с помощью одного человека
- 6 = Только для инвалидных колясок, не может стоять и ходить 1 метр с помощью одного человека, но может совершать целенаправленные движения ногами
- 7 = Прикован к инвалидной коляске или в постели большую часть дня, неспособен делать какие-либо целенаправленные движения ногами
Есть ли какое-либо заболевание, кроме периферической невропатии, которое влияет на вышеуказанные функции? Если да, опишите, пожалуйста, в разделе комментариев в BloodSTAR. | Да | Нет |
|---|
Общая шкала ограничения невропатии
Оценка по шкале рук (от 0 до 5) 5+
Оценка по шкале ног (от 0 до 7) 7
Диапазон: от 0 (нет инвалидности) до 12 (максимальная инвалидность).
Общий балл ONLS (введите в BloodSTAR): 12
| DCU.musc.edu Главная | |
| Независимое обучение в рамках проекта | |
| Модифицированная шкала Ренкина (mRS) | любезно предоставлено Сетью испытаний неотложной неврологической помощи (NETT) |
| Шкала инсульта NIH (NIHSS) | |
| Обучение WebDCU ™ CTMS | |
| Специальное обучение для проекта | |
| Проект ARCADIA | |
| Проект ARCADIA-CSI | |
| Проект ASPIRE | |
| САМЫЙ БЫСТРЫЙ проект | |
| Проект I-ACQUIRE | |
| Проект MiSLE | |
| МОСТ проект |
|
| САТУРН проект | |
| Проект SHARP | |
| Сон SMART Project | |
| Проект TRANSPORT2 | |


 Например, не может вернуться к прежней работе, но способен обслуживать себя без постороннего присмотра.
Например, не может вернуться к прежней работе, но способен обслуживать себя без постороннего присмотра. Для Венской стандартной средней океанической воды при одной стандартной атмосфере (101,325 кПа) при калибровке исключительно в соответствии с двухточечным определением термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Для получения дополнительной информации о фактической температуре кипения воды см. VSMOW при измерении температуры .
Для Венской стандартной средней океанической воды при одной стандартной атмосфере (101,325 кПа) при калибровке исключительно в соответствии с двухточечным определением термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Для получения дополнительной информации о фактической температуре кипения воды см. VSMOW при измерении температуры . За Венская стандартная средняя океанская вода за один стандартная атмосфера (101,325 кПа) при калибровке исключительно по двухточечному определению термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Подробнее о фактической температуре кипения воды см. VSMOW в измерении температуры.
За Венская стандартная средняя океанская вода за один стандартная атмосфера (101,325 кПа) при калибровке исключительно по двухточечному определению термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Подробнее о фактической температуре кипения воды см. VSMOW в измерении температуры. ОНМК и СД, n (%)
ОНМК и СД, n (%)