Микроинсульт симптомы первые признаки у мужчин последствия: Как распознать инсульт? Признаки и симптомы
Диагностика и лечение инсульта › МРТ КТ Хмельницкий Медицинский центр «Ультрадиагностика»
|
МРТ головного мозга |
1250 грн. |
|
МРТ ангиография сосудов головы |
1000 грн. |
| КТ головного мозга | 700 грн. |
| КТ ангиография сосудов головы с контрастом | 1900 грн. |
| Прием (осмотр, консультация, назначение лечения) — Степанюк Людмила Владимировна — врач — невролог высшей категории. Ведущий в Украине врач по инсульту. | 300 грн. |
ВСЕ ЦЕНЫ
Своевременная и правильная диагностика инсульта позволяет эффективно бороться с возможными последствиями и осложнениями, а также снижает риск повторных острых нарушений мозгового кровообращения, что, увы, не редкость.
Корректная диагностика инсульта головного мозга позволяет быстро определить истинную причину недомогания.
Современной аппаратуре под силу диагностика ишемического инсульта. Существуют также методы, которые быстро определяют наступление геморрагического поражения сосудов головного мозга. Важно суметь правильно и быстро определить, о каком инсульте идёт речь. От правильной диагностики инсульта головного мозга зависит оперативность выбора нужной схемы лечения, что крайне важно при таком серьёзном заболевании.
Информативными методами диагностики являются магнитно-резонансная томография (МРТ) и компьютерная томография (КТ). Каждый из них поможет определить очаги распространения инсульта и дать чёткую характеристику поражения.
Диагностика и лечение инсультов при помощи МРТ и КТ
Диагностика, проведенная на аппаратах КТ и МРТ при инсульте, позволяют разграничить ишемические, геморрагические и субарахноидальные поражения. В зависимости от причин, предшествующих нарушению мозгового кровообращения, различают:
В зависимости от причин, предшествующих нарушению мозгового кровообращения, различают:
- Ишемический инсульт (повреждение ткани мозга).
При отсутствии полноценного насыщения тканей мозга кислородом наступает гипоксия того или иного отдела. Мозговая ткань размягчается, что ведет к инфаркту мозга.
При ишемическом типе инсульта применение МРТ в 80 — 90% случаев точно определяет участки гиперинтенсивности уже через 4-6 часов от момента начала мозговой катастрофы. В следующие часы, до двух суток область гиперинтенсивности расширяется ещё бльше. При МР-ангиографии уже в первые часы на томограммах видны признаки обескровливания вокруг ишемической зоны, что подтверждает факт инсульта.
В отличие от МРТ, при КТ признаки инфаркта в виде зон пониженной плотности определяются в половине случаев только через 12 часов от начала развития ишемического инсульта. Причем очаги в стволе головного мозга и лакунарные инфаркты определяются только посредством КТ с введением контрастирующих препаратов.
Таким образом, МРТ представляет собой метод, который более эффективным на ранних стадиях диагностики лакунарного инфаркта, чем КТ.
- Геморрагический инсульт (нетравматическое внутримозговое кровоизлияние).
При остро возникшем нетравматическом поражении мозга врачом должно быть быстро и последовательно решено, относиться ли данное нарушение к инсульту и если да, то к какому виду инсульта. Найти правильный ответ и поставить верный диагноз поможет КТ исследование.
Уже спустя шесть, максимум десять часов с момента геморрагического инсульта на КТ визуализируется очаг повышенной плотности, где и находится кровоизлияние. А менее чем через полсуток после случившегося геморрагического инсульта, вокруг больших очагов кровоизлияний может распознать признаки отёка, которые видно, как овал пониженной плотности.
Данные МРТ в первые часы после геморрагического инсульта не позволяют выявить его, так как МРТ не улавливает сигналы от крови так хорошо, как от белого вещества. На более поздних сроках магнитно-резонансная томография при геморрагическом инфаркте обнаруживает месторасположение очага и объём сосудистых аномалий, что позволяет отказаться от классической ангиографии с использованием контрастных веществ.
На более поздних сроках магнитно-резонансная томография при геморрагическом инфаркте обнаруживает месторасположение очага и объём сосудистых аномалий, что позволяет отказаться от классической ангиографии с использованием контрастных веществ.
Данные КТ и МРТ в сочетании с показателями степени тяжести состояния больных, являются факторами, определяющими необходимость хирургических вмешательств после геморрагического инсульта.
- Субарахноидальное кровоизлияние (острое нарушение кровообращения мозга).
Субарахноидальное кровоизлияние в очаге поражения диагностируются посредством компьютерной и магнитно-резонансной томографии, в особенности КТ с контрастным усилением и МР-ангиографией, у 95% пациентов в течение ближайшей половины суток. Такие исследования позволяют установить месторасположение и объём кровоизлияния, а также проникновение крови в вещество головного мозга.
В поздние сроки МРТ информативнее, чем КТ. Повторные исследования на МРТ позволяют судить о динамике сужения сосудов, осложнений, а также о сроках формирования ишемических очагов и их объеме. Результаты МРТ являются одним из двух определяющих ориентиров для решения вопроса о возможном оперативном (хирургическом) лечении субарахноидальных кровоизлияний, обусловленных разрывом артериальных аневризм и артериовенозных мальформаций. Вторым ориентиром является тяжесть состояния больного.
Результаты МРТ являются одним из двух определяющих ориентиров для решения вопроса о возможном оперативном (хирургическом) лечении субарахноидальных кровоизлияний, обусловленных разрывом артериальных аневризм и артериовенозных мальформаций. Вторым ориентиром является тяжесть состояния больного.
- Острое нарушение мозгового кровообращения, которое вы даже не заметите (Микроинсульт)
Микроинсульт, обладающий менее выраженной симптоматикой, так же опасен для жизни человека, как и лакунарный. По сути, это тот же инсульт, но затронувший менее значительные сосуды в очаге и протёк без видимых пациенту последствий. Микроинсульт — тревожный звонок к тому, что сосудистая система в будущем может дать такой сбой, который уже не пройдет незамеченным.
Единственными признаками случившегося микроинсульта бывают асимметрия лица, нарушения зрения. Человек может внезапно начать бессвязно говорить, заикаться, не реагировать на вопросы окружающих.
МРТ является единственным действенным диагностическим инструментом в поиске микроинсультов.
Помимо диагностики типа инсульта, классические методы КТ и МРТ дают возможность отличить острое нарушение кровообращения головного мозга (инсульт) от опухолей, абсцессов головного мозга, посттравматических эпидуральных и субдуральных гематом.
симптомы, первые признаки у женщин и мужчин
Микроинсульт — это сильный недостаток снабжения головного мозга кровью, который происходит из-за сужений в микрососудах или их закупорке.
Микроинсульт отличается от полноценного инсульта тем, что поражается только небольшая площадь мозговых тканей, а их восстановительные функции снова начинают работать уже через сутки. Микроинсульт отличается довольно слабыми симптомами, которые часто похожи на признаки других недугов.
Многие мужчины переносят такую неприятность, не прекращая своей повседневной деятельности и не обращаясь за помощью врачей.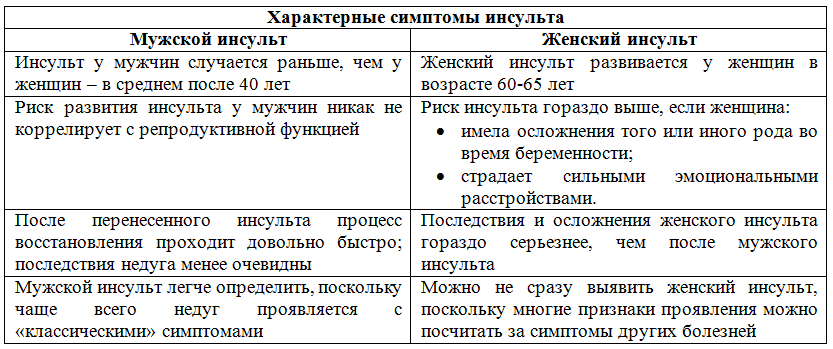
Что является причиной микроинсульта
Существует множество негативных факторов, которые значительно увеличивают риски на развитие рассматриваемого недуга. Вот основные из них:
- Слишком тяжелый физический труд и работа с тяжестями, которые непомерно нагружают организм;
- Зависимость от вредных веществ: никотина, наркотиков или алкоголя;
- Чрезмерный лишний вес тела;
- Постоянные недосыпания, влияние стресса, депрессии, постоянных волнений и переживаний;
- Прием в пищу вредной еды, нарушение основ правильного питания;
- Работа в условиях вредности;
- Отравления организма веществами, который могут провоцировать спазмы сосудов.
Также вероятность микроинсульта значительно повышается при таких заболеваниях, как:
- Повышенный уровень вязкости крови;
- Проблемы с сосудами: их воспаление, какие-либо врожденные аномалии;
- Сердечные болезни;
- Тромбоз
- Диабет.

Важную роль может играть фактор наследственности. Даже при отсутствии упомянутых заболеваний, риск столкнуться с микроинсультом значительно повышается у каждого мужчины возрастом 45 и больше лет.
Симптомы и главные признаки
Все возможные симптомы микроинсульта принято делать на две большие категории: очаговые и общемозговые. В первом случае нарушается нормальное кровообращение только отдельных участков мозга, поэтому по тому, какие функции страдают, можно понять, какая область головного мозга подверглась приступу. Здесь возможны такие симптомы:
- Онемение и паралич различных конечностей;
- Внезапные проблемы со зрением, локализованные чаще всего в той стороне, где случился приступ;
- Проблемы с передвижением, потеря мышцами их нормального тонуса;
- Нарушение памяти и мыслительных процессов;
- Проблемы с речью;
- Проблемы с глотанием и т.п.
Что касается симптомов общемозговых, то они выглядят так:
- Внезапное возникновение головных болей, головокружение;
- Проблемы с координацией;
- Слабость в руках, ногах;
- Обмороки и помутнение сознания;
- Дышать становится трудно, больной жалуется на «ком» в горле;
- Приступы тошноты и рвоты;
- Болезненная восприимчивость света, шума.

При возникновении подобных явлений необходимо обязательно вызывать скорую помощь.
Микроинсульт «на ногах»
Так как симптомы микроинсульта могут действовать довольно ограниченное время, то некоторые стойкие мужчины могут перенести их, даже не прекращая своей повседневной деятельности. Им кажется, что ничего страшного не происходит – просто легкое недомогание, которое через час уходит в никуда. Соответственно, ни посещения врача, ни адекватного лечения здесь не происходит.
Это очень опасно, ведь проигнорированный приступ часто становится причиной скорого его повторения или вообще главным фактором развития ишемии мозга. Если это случится, то последствия будут очень серьезными, вплоть до инвалидности, а лечение будет занимать несколько месяцев или даже лет.
Первая помощь при микроинсульте
Если у человека приключился микроинсульт, то требуется незамедлительно позвонить в скорую помощь, а пока она в пути, провести следующие меры:
- Положить больного на ровную плоскость, голову немного поднять выше тела и повернуть в сторону;
- Ослабить ремни, расстегнуть пуговицы;
- Открыть окна в помещении;
- По возможности исключить шумы и другие раздражители;
- Нельзя давать человеку впасть в панику, поэтому с ним необходимо проводить успокоительные беседы;
- При необходимости проводится массаж сердца и искусственное дыхание.

Нельзя давать человеку с приступом лекарства, влияющие на состояние сосудов, давление, тормошить его, позволять вставать.
Лечение мужского микроинсульта
Самая первая мера при лечении – восстановление нормального кровотока к мозгу. Делается это с помощью специальных медикаментов:
- Средства для нормализации давления;
- Сердечных гликозидов, помогающих нормальной работе сердца;
- Вазоактивных препаратов, помогающих улучшить обращение крови в мозговых тканях;
- Препаратов, способствующих снижению свертываемости крови;
- Ноотропов, позволяющих стимулировать работу мозга, мыслительных процессов, питания клеток мозга.
- Помимо медикаментов больной проходит дополнительные реабилитационные меры:
- Массажи;
- Специальную гимнастику для дыхания;
- Физиотерапия;
- При необходимости встречи с психологом или логопедом.
youtube.com/embed/zmH9Fq9CKqg?rel=0″>
Возможные последствия
Микроинсульт – это серьезное явление, которое чаще всего оставляет после себя временные или постоянные последствия такого плана:
- Головные боли и легкое головокружение;
- Повышенная утомляемость;
- Рассеянность и неспособность сфокусировать внимание;
- Сонливость и всеобщая слабость;
- Резкие перепады настроения.
Если не лечить проблему вовремя, то возможно появление очень опасны последствий в виде:
- Паралич;
- Проблемы с координацией, памятью, речью, зрением;
- Развитие психических расстройств;
- Проблемы с нормальным мочеиспусканием, глотанием.
Чтобы не допустить таких проблем, необходимо своевременно оказывать больному помощь и вызывать скорую.
Профилактика
Чтобы не допустить микроинсульта, необходимо выполнять такие довольно простые рекомендации специалистов:
- Отказаться от вредных привычек: спиртного, курения и тем более наркотиков;
- Избегать стрессов и перевозбуждения, не ссориться по возможности и не поддаваться депрессии;
- Заниматься спортом с умеренными физическими нагрузками;
- Нормально высыпаться;
- Не допускать ожирения, правильно и умеренно питаться;
- Периодически проходить обследование и профилактическое лечение.

Достаточно придерживаться этих несложных правил, и вероятность появления микроинсульта можно свести к минимуму.
симптомы у женщин, первые признаки, возможные последствия
Микроинсульт все чаще поражает людей любых возрастов, и его последствия не такие маленькие, как можно заключить из названия. Чтобы вовремя предпринять необходимые действия, нужно точно знать симптомы микроинсульта — они одинаковые и у женщин, и у мужчин.
Микроинсульт: симптомы у женщин всегда являются поводом для проведения детальной диагностики и комплексного лечения у невролога.
Описание
Микроинсульт еще называют транзиторной ишемической атакой: ситуацией, когда закупориваются микроскопические капилляры в мозгу. Симптомы ТИА напрямую связаны с тем, в каком именно участке мозга произошла закупорка, но обычно они не сильно отличаются.
В отличие от инсульта, при ТИА кровообращение восстанавливается самостоятельно, ткани не погибают, а симптомы проходят в течение суток.
Но это не значит, что к атаке можно относиться легкомысленно: она часто является предвестником более обширной закупорки. Если вовремя не предпринять необходимые меры, последствия могут остаться на всю жизнь.
Именно поэтому ТИА – всегда повод для обращения к врачу! Только рекомендации специалиста помогут избежать нежелательных последствий и станут отличной мерой профилактики угрожающего инсульта!
Факторы риска
Есть группа людей, которым особенно нужно следить за своим самочувствием и уметь отличать симптомы приближающегося микроинсульта.
К этой категории относятся люди со следующими заболеваниями:
- Гипертония. Из-за высокого давления капилляры изнашиваются быстрее и риск их закупорки возрастает.
- Нарушения сердечного ритма. Из-за аритмии в сердце образуются кровяные сгустки, которые могут плотно закупорить мелкий капилляр.
- Сахарный диабет. От этого заболевания сосуды становятся слабыми, а уровень холестерина — нестабильным.
 Все это может привести к микроинсульту.
Все это может привести к микроинсульту. - Ожирение. Этот фактор провоцирует сразу несколько: сбой в работе сердца из-за повышенной нагрузки, низкую физическую активность и нарушения обмена жиров.
- Вредные привычки. Алкоголь и курение негативно сказываются на состоянии сосудов и обменных процессов в организме.
- Люди пожилого возраста. Часто с возрастом появляются сопутствующие болезни, негативно влияющие на состояние сосудов, а снижать нагрузку на организм многие пожилые не хотят.
- Генетическая предрасположенность. Если ишемические атаки были у кого-то из близких родственников.
- Стрессы и агрессия. Статистика показывает, что люди, подверженные беспокойству и склонные выплескивать гнев, чаще становятся жертвами нарушений кровообращения в сосудах головного мозга.
Как распознать микроинсульт? Всем, кто входит в группу риска, и их близким необходимо знать, каковы первые признаки микроинсульта и что делать, если он произойдет.
Раньше предполагалось, что транзиторная атака может случиться только после 50 лет. Но это распространенное заблуждение: из-за распространенности вредных привычек, неправильного питания и тяжелого ритма современной жизни микроинсульты все чаще встречаются у людей молодого возраста.
Симптомы
Хотя часто микроинсульт становится полной неожиданностью, организм дает сигналы за несколько часов. Главное — знать, как распознать их.
Микроинсульт обычно происходит на фоне высокого артериального давления. Хотя сам этот фактор не является прямым симптомом ишемической атаки, он требует пристального внимания.
Первые признаки микроинсульта нередко становятся следствием скачка АД.
Затем у женщины появляется головная боль, которая не проходит даже после приема анальгетиков. Яркий свет и резкие звуки, даже не слишком громкие, усиливают боль и вызывают раздражение. В целом симптомы начинают напоминать мигрень, но через некоторое время добавляется еще один — ноющая боль в области сердца. Это — первые признаки, дальше события развиваются стремительнее:
В целом симптомы начинают напоминать мигрень, но через некоторое время добавляется еще один — ноющая боль в области сердца. Это — первые признаки, дальше события развиваются стремительнее:
- Почти всегда нарушается координация. Походка становится неровной и неустойчивой, женщина может упасть, сама не понимая из-за чего.
- Резко появляется слабость в руках и ногах.
- Часто женщины чувствуют оглушенность, они плохо слышат, становится невозможным быстро на что-то среагировать. Речь замедляется, человек не способен быстро отвечать даже на простые вопросы.
- Из-за скачков давления появляются нарушения зрения, чаще всего на один глаз — все становится расплывчатым.
- Появляется онемение одной стороны лица, мышцы перестают слушаться.
- Начинается тошнота и рвота. Облегчение наступает лишь на несколько минут.
- Нередко атака сопровождается нарушением сознания или обмороками.
Близким полезно помнить простой способ диагностики:
- Попросить улыбнуться.
 При поражении мозговых капилляров улыбка будет «свисать» с одной стороны из-за повреждения лицевого нерва.
При поражении мозговых капилляров улыбка будет «свисать» с одной стороны из-за повреждения лицевого нерва. - Попросить поднять обе руки. Одна рука будет поднята значительно меньше или останется неподвижной.
- Задать простой вопрос или попросить повторить какую-то фразу. Женщине в момент ТИА тяжело будет услышать вопрос, речь будет невнятной, неразборчивой.
Если проявляются все эти симптомы нужно немедленно вызывать бригаду скорой помощи.
Симптомы микроинсульта и их количество у разных женщин могут отличаться в зависимости от области поражения мозга.
Симптомы ТИА часто проходят быстро, иногда — в течение минуты, поэтому часто женщины переносят его на ногах, думая, что это обычное недомогание. Но даже если кажется, что состояние нормализовалось, необходимо обратиться к врачу.
Первая помощь и лечение
Если приступ удалось определить в самом его начале, необходимо уложить пациента, подложив под голову подушку или валик из одежды. Нужно обеспечить доступ кислорода: открыть окно, расслабить шарф, воротник или пояс. Если атака сопровождается рвотой, нужно положить голову на бок. Насколько это возможно, нужно успокоить женщину и позаботиться о том, чтобы вокруг не было толпы. Сразу же вызвать скорую помощь.
По завершению приступа необходимо обратиться к врачу. Он проведет необходимые диагностические процедуры и назначит лечение. Врач будет преследовать две цели:
- Восстановить нормальное мозговое кровообращение.
- Устранить причину, из-за которой произошла атака.
Это поможет избежать возможных последствий сбоя в кровоснабжении мозга.
Лечение должно проводиться всегда, так как последствия микроинсульта не так безобидны, как кажется на первый взгляд
Для улучшения мозгового кровотока обычно назначают препараты, которые мешают тромбоцитам склеиваться и контролируют уровень белка, отвечающего за свертываемость крови: антитромбоцитарные средства и антикоагулянты. Так достигается сразу две цели: улучшается кровоснабжение и снижается риск закупорки сосуда тромбом. Это необходимо, так как часто после ТИА инсульт становится более вероятным.
В некоторых случаях врачи назначают операцию: это происходит, если медикаментозного лечения недостаточно или риск закупорки крупных артерий слишком высок. Одна из процедур представляет собой операцию с минимальным повреждением тканей. Через бедренную артерию хирург вводит катетер, который очищает артерии с помощью стента в месте сужения артерии. Благодаря минимальной инвазивности операция проходит достаточно легко для пациента и не требует много времени на восстановление.
Диагностические процедуры и терапию медикаментами необходимо проходить даже после микроинсульта, благополучно перенесенного на ногах, когда кажется, что худшее позади и общее самочувствие удовлетворительное.
Атака — это не самостоятельное заболевание, у нее всегда есть причины. Если их не устранить, приступы будут повторяться снова, каждый раз усугубляясь.
Медикаментозного лечения и операции будет недостаточно, если не изменить образ жизни. Это самая важная часть как борьбы, так и профилактики. Она включает в себя:
- отказ от негативных привычек,
- сбалансированное питание,
- умеренные физические нагрузки,
- достаточный сон,
- снижение количества стрессовых ситуаций в жизни,
- контроль хронических заболеваний.
Профилактические меры под силу всем, а их важность сложно переоценить.
Коварство симптомов микроинсульта у женщин кроется в том, что это состояние нередко оказывается перенесенным на ногах. Знание симптомов ТИА позволит вовремя взять под контроль ситуацию и позаботиться о собственном благополучии и здоровье близких. Помните, их появление всегда является поводом для проведения комплексной диагностики и лечения. Пренебрегать советами врача ни в коем случае нельзя! Опасными для здоровья состояниями могут становиться такие осложнения, как микроинфаркт или инфаркт, еще более угрожающее дальнейшей трудоспособности и жизни больного.
Читайте также: признаки инсульта у женщины
Микроинсульт: первые признаки и симптомы у пожилых людей
Миркоинсульт это предвестник настоящего инсульта и это тревожный звоночек того, что необходимо обратить внимание на свое здоровье. Увы, но многие относятся к нему слишком спокойно, что и приводит к росту показателей смертности от инсульта.
Как определить микроинсульт у женщин — первые признаки, симптомы и лечение
Как показывает статистка, с каждым годом все больше и больше людей страдают от микроинсульта.
Факторами, которые располагают к микроинсульту, являются:
- лишний вес;
- повышенное артериальное давление;
- неправильное питание;
- вредные привычки;
- частые стрессы;
- переутомляемость;
- повышенный уровень сахара в крови.
Зачастую микроинсульт является наследственным заболеванием и в группу риска попадают те, чьим родственникам приходилось столкнуться с данным заболеванием.
Первые признаки микроинсульта среди женщин определяются по таким симптомам как:- Человек начинает теряться в пространстве. Начинает появляться ощущение «ватных» ног, раздвоение картинки перед глазами, предобморочное состояние, человек перестает понимать, где он находится.
- Начинает появляться такой признак как звукобоязнь. При этом даже небольшой звук начинает сильно раздражать.
- Частые головные боли.
- Ухудшение слуха и восприятия информации.
- Озноб чередуется с учащенным потоотделением.
Если вы начали у себя или у близкого вам человека наблюдать такие признаки, это говорит о том, что необходимо срочно вызывать доктора. Можно конечно переждать это состояние, но нет никакой гарантии, что после это никак не отразится на общем самочувствие.
Первые признаки и симптомы у мужчин
Повреждение сосудов происходит за считанные минуты, поэтому необходимо знать, как действовать, если у мужчины начался микроинсульт.
Есть несколько признаков, по которым можно беспроигрышно определить, что у человека начался микроинсульт, а именно:
- По улыбки человека можно увидеть, что она в одну сторону перекошена.
- Язык во время микроинсульта будет отведен в одну строну.
- Речь во время микроинсульта будет невнятной.
Если есть хоть один признак — это говорит о том, что человеку требуется срочная госпитализация. Особенностью микроинсульта является то, что в первые минуты его практически невозможно отличить от инсульта.
У мужчины при микроинсульте резко начинает кружиться голова, нарушается восприятие происходящего. При этом человек может себя чувствовать все хуже и хуже.
Может возникать:
- онемение рук или ног;
- слабость в конечностях;
- нарушение координации;
- проблемы с речью;
- ровные позывы;
- головокружения;
- потеря сознания на короткий промежуток времени.
Во время микроинсульта может проявляться как один симптом, так и несколько. Своевременное лечение и реабилитация человека может гарантировать полное восстановление без рецидивов.
Последствия и осложнения
У многих престарелых людей после микроинсульта ухудшается память, появляются первые признаки слабоумия, ухудшается характер.
Во второй раз у человека может быть так называемый «молчащий инсульт», когда нет никаких симптомов, но при этом клетки получают серьезный ущерб.
Особенности лечения микроинсульта и прогноз
Для полного выздоровления престарелому человеку требуется покой. При комплексной программе реабилитации старику будет гораздо проще вернуться к своей привычной жизни.
Провести полноценное лечение в домашних условиях практически невозможно, ведь у вас нет возможности оборудовать квартиру всем необходимым. Именно поэтому мы предлагаем вашему близкому человеку пройти курс реабилитации после микроинсульта в частном доме престарелых «Милена». Наши специалисты разработают программу лечения для вашего родственника в индивидуальном порядке.
Реабилитация и уход за пожилыми после микроинсульта
Мы поможем вашему родному человеку пройти максимально безболезненно курс лечения и вернуться к привычной жизни. Комплексная терапия поможет добиться значительного улучшения пациента.
Человек после микроинсульа требует внимания и квалифицированного ухода, что очень сложно предоставить в условиях квартиры, особенно когда все родственники работают и сидеть с престарелым человеком некому. Далеко не каждый решиться на то, чтобы оставить роботу и днями просиживать у койки мамы или бабушки. В доме для престарелых «Милена» же вашему родственнику будет предоставлен уход 24 часа в сутки.
Если у вас возникли вопросы, вы всегда можете получить на них ответы, набрав указанный номер телефона.
Как определить микроинсульт у человека?
Сосудистые заболевания мозга представляют собой невероятно острую проблему. Ежегодно от инсульта умирает более 4 миллионов людей. Кроме того, именно он занимает первое место среди всех существующих причин инвалидности. Это связано с тем, что большинство людей, столкнувшихся со сбоем в работе собственного организма и переживших его, просто не могут жить без посторонней помощи.
Учитывая все это, становится вполне очевидной необходимость понимание того, какие именно симптомы указывают на инсульт. Ведь эти знания позволяют максимально быстро определить микроинсульт у человека, обратиться за помощью и исключить тяжелые последствия.
Тест на выявление симптомов
Самое правильное и простое решение, позволяющее увидеть признаки и симптомы инсульта и микроинсульта у женщин и мужчин любого возраста – проведение небольшого теста. Для этого достаточно попросить больного выполнить несколько действий.
Определить наличие нарушений можно при помощи улыбки. Если человек будет улыбаться перекошено – это симптом микроинсульта головного мозга. Одна половина лица просто перестанет ему подчиняться, и соответствующий уголок губ останется опущенным. При этом будет наблюдаться неправильное расположение языка во рту и некоторое изменение его формы.
Также стоит отметить, что при инсульте человеку очень сложно говорить. Его речь становится крайне невнятной. Таким образом, разобрать слова просто невозможно или же крайне тяжело.
Чтобы распознать инсульт или микроинсульт, можно попросить больного поднять обе руки. В случае если какая-то из них окажется ниже, то можно сделать однозначный вывод о необходимости срочной госпитализации.
Признаки развития инсульта у женщин
С инсультом могут столкнуться представители женского пола, возраст которых составляет 18 лет и более. При этом предрасполагающими факторами является курение, длительный прием оральных контрацептивов, а также повышенный уровень холестерина в крови.
Первые симптомы инсульта головного мозга у женщин представлены следующим списком:
- сильные головные боли, сопровождающиеся головокружением;
- шум в голове;
- сложности с нормальным воспроизведением слов;
- резкое онемение, которое ощущается не только в конечностях, но и в области лица;
- отсутствие нормальной координации.
Таким образом, заметить очевидные симптомы микроинсульта и инсульта и приложить усилия для ликвидации последствий не составляет никакого труда. Важно помнить, что квалифицированная помощь должна быть оказана как можно скорее и желательно в течение 2-3 часов после того, как начался приступ. Оперативное обращение к специалистам позволит свести отрицательные последствия к минимуму.
Отдельного внимания заслуживает микроинсульт, симптомы которого очень схожи с перечисленными, но при этом данная форма заболевания несколько опаснее и требует грамотного лечения.
Основные симптомы инсульта у мужчины
Распространенные симптомы инсульта головного мозга у мужчин мало чем отличаются от признаков заболевания у женщин. Однако при этом еще могут наблюдаться:
- нарушения в работе речевого аппарата, органов зрения и слуха;
- резкий приступ слабости, дополненный головной болью;
- отсутствие устойчивости в процессе передвижения, сложность при ходьбе;
- обильное слюноотделение и частичное отсутствие глотательного рефлекса.
Случившееся кровоизлияние в мозг, симптомы которого описаны выше, может стать причиной глубокой комы, паралича конечностей, нарушений психики и потери чувствительности в одной половине тела. Именно поэтому крайне важно организовать своевременное оказание медицинской помощи.
Если симптомы неврологического инсульта останутся незамеченными, это может привести к необратимым последствиям. Соответственно, необходимо не просто знать о признаках данного нарушения, но и понимать, какие действия можно предпринимать для минимизации существующих рисков.
Чтобы лучше понимать, как происходит микроинсульт и инсульт, чем они отличаются друг от друга, обратитесь в клинику инсульта в вашем городе за полными консультациями специалистов.
Смотрите также
Болезнь Альцгеймера | Nature Reviews Disease Primers
Jessen, F. et al. Концептуальная основа для исследования субъективного когнитивного снижения при доклинической болезни Альцгеймера. Демент Альцгеймера. 10 , 844–852 (2014).
PubMed PubMed Central Google Scholar
Петерсен, Р. С. Легкие когнитивные нарушения как диагностическая сущность. J. Intern. Med. 256 , 183–194 (2004).
CAS Google Scholar
McKhann, G.M. et al. Диагноз деменции вследствие болезни Альцгеймера: рекомендации Национального института старения и рабочей группы Ассоциации Альцгеймера. Демент Альцгеймера. 7 , 263–269 (2011).
PubMed PubMed Central Google Scholar
Петерсен, Р. К. Насколько рано мы можем диагностировать болезнь Альцгеймера (и достаточно ли этого)? Лекция Вартенберга 2017 года. Неврология 91 , 395–402 (2018).
PubMed PubMed Central Google Scholar
Nelson, P. T. et al. Болезнь Альцгеймера — это не «старение мозга»: нейропатологические, генетические и эпидемиологические исследования на людях. Acta Neuropathol. 121 , 571–587 (2011).
PubMed PubMed Central Google Scholar
Boyle, P.A. et al. Индивидуальный вклад невропатологий в когнитивную потерю в пожилом возрасте. Ann. Neurol. 83 , 74–83 (2018). Клинико-невропатологический анализ> 1000 человек, демонстрирующий, как различные этиологии связаны с познанием в позднем возрасте.
CAS PubMed PubMed Central Google Scholar
Шнайдер Дж. А., Арванитакис З., Леурганс С. Э. и Беннетт Д.A. Невропатология вероятной болезни Альцгеймера и легких когнитивных нарушений. Ann. Neurol. 66 , 200–208 (2009).
PubMed PubMed Central Google Scholar
Капаси А., ДеКарли К. и Шнайдер Дж. А. Влияние множественных патологий на порог клинически явной деменции. Acta Neuropathol. 134 , 171–186 (2017).
PubMed PubMed Central Google Scholar
Karanth, S. et al. Распространенность и клинический фенотип четырехкратно неправильно свернутых белков у пожилых людей. JAMA Neurol. 77 , 1299–1307 (2020).
Google Scholar
Brodaty, H. et al. Мир деменции после 2020 года. J. Am. Гериатр. Soc. 59 , 923–927 (2011).
Google Scholar
Wu, Y. T. et al.Изменение распространенности и заболеваемости деменцией с течением времени — современные данные. Nat. Rev. Neurol. 13 , 327–339 (2017).
Google Scholar
Satizabal, C. L. et al. Заболеваемость деменцией за три десятилетия в исследовании сердца Фрамингема. N. Engl. J. Med. 374 , 523–532 (2016).
CAS PubMed PubMed Central Google Scholar
Стерн, Ю. Когнитивный резерв при старении и болезни Альцгеймера. Ланцет нейрол. 11 , 1006–1012 (2012).
PubMed PubMed Central Google Scholar
Tom, S. E. et al. Тенденции развития деменции и социально-экономического статуса в раннем возрасте в разбивке по возрастным когортам в исследовании изменений мышления взрослых. JAMA Open 3 , e2011094 (2020).
Google Scholar
Ковари, Э., Херрманн, Ф. Р., Бурас, К. и Голд, Г. Отложение амилоидов уменьшается в стареющем мозге: исследование вскрытия 1599 пожилых людей. Неврология 82 , 326–331 (2014).
Google Scholar
Ниу, Х., Альварес-Альварес, И., Гильен-Грима, Ф. и Агуинага-Онтосо, И. Распространенность и заболеваемость болезнью Альцгеймера в Европе: метаанализ. Neurologia 32 , 523–532 (2017).
CAS Google Scholar
Хай, Л. X. и Келлер, Д. М. Распространенность БА среди белых: сводка по уровням серьезности. Неврология 55 , 198–204 (2000).
CAS Google Scholar
Гиллис, К., Мирзаи, Ф., Поташман, М., Икрам, М. А. и Масереджян, Н. Частота легких когнитивных нарушений: систематический обзор и синтез данных. Демент Альцгеймера. 11 , 248–256 (2019).
Google Scholar
Petersen, R.C. et al. Легкие когнитивные нарушения из-за болезни Альцгеймера: критерии в обществе. Ann. Neurol. 74 , 199–208 (2013).
PubMed PubMed Central Google Scholar
Дегенхардт, Э. К. и др. Флорбетапир F18 ПЭТ-нейровизуализация амилоида и характеристики у пациентов с легкой и умеренной деменцией Альцгеймера. Психосоматика 57 , 208–216 (2016).
Google Scholar
Робинсон, Дж. Л. и др. Сопутствующие протеинопатии нейродегенеративного заболевания распространены, связаны с возрастом и связаны с APOE4. Мозг 141 , 2181–2193 (2018).
PubMed PubMed Central Google Scholar
Prince, M. et al. Последние глобальные тенденции в распространенности и заболеваемости деменцией и выживаемости с деменцией. Alzheimers Res. Ther. 8 , 23 (2016).
PubMed PubMed Central Google Scholar
Röhr, S. et al. Оценка распространенности субъективного когнитивного снижения в международных когортных исследованиях старения: исследование COSMIC. Alzheimers Res. Ther. 12 , 167 (2020).
PubMed PubMed Central Google Scholar
Petersen, R.C. et al. Краткое изложение обновления практических рекомендаций: легкие когнитивные нарушения: отчет подкомитета по разработке, распространению и внедрению рекомендаций Американской академии неврологии. Неврология 90 , 126–135 (2018).
PubMed PubMed Central Google Scholar
Petersen, R.C. et al. Распространенность легких когнитивных нарушений у мужчин выше, чем у женщин. Исследование старения в клинике Мэйо. Неврология 75 , 889–897 (2010).
CAS PubMed PubMed Central Google Scholar
Мильке М. М., Вемури П. и Рокка В. А. Клиническая эпидемиология болезни Альцгеймера: оценка пола и гендерных различий. Clin. Эпидемиол. 6 , 37–48 (2014).
PubMed PubMed Central Google Scholar
Thambisetty, M., An, Y. & Tanaka, T. Гены риска болезни Альцгеймера и возрастной фенотип. Neurobiol. Старение 34 , 2696.e1–5 (2013).
CAS Google Scholar
Хаасс К., Кетер К., Тинакаран Г. и Сисодиа С. Торговля и протеолитическая обработка АРР. Колд Спринг Харб. Перспектива. Med. 2 , а006270 (2012).
PubMed PubMed Central Google Scholar
Jonsson, T. et al. Мутация APP защищает от болезни Альцгеймера и возрастного когнитивного снижения. Природа 488 , 96–99 (2012).
CAS Google Scholar
van der Lee, S.J. et al. Влияние APOE и других распространенных генетических вариантов на начало болезни Альцгеймера и деменции: когортное исследование на уровне сообщества. Ланцет нейрол. 17 , 434–444 (2018).
Google Scholar
Bellenguez, C. et al. Вклад в риск болезни Альцгеймера редких вариантов TREM2, SORL1 и ABCA7 в 1779 случаях и 1273 контрольной группе. Neurobiol. Старение 59 , 220.e1–220.e9 (2017).
CAS Google Scholar
Леоненко Г. и др. Полигенные оценки риска и опасности для прогнозирования болезни Альцгеймера. Ann. Clin. Пер. Neurol. 6 , 456–465 (2019).
PubMed PubMed Central Google Scholar
Карч, К. М., Кручага, С. и Козел, А. М. Генетика болезни Альцгеймера: от стенда к клинике. Neuron 83 , 11–26 (2014).
CAS PubMed PubMed Central Google Scholar
Kunkle, B. W. et al. Генетический метаанализ диагностированной болезни Альцгеймера определяет новые локусы риска и затрагивает Aβ, тау-белок, иммунитет и процессинг липидов. Nat. Genet. 51 , 414–430 (2019).
CAS PubMed PubMed Central Google Scholar
Ливингстон Г. и др. Профилактика, вмешательство и лечение деменции: отчет комиссии Lancet за 2020 год. Ланцет 396 , 413–446 (2020).
PubMed PubMed Central Google Scholar
Singh-Manoux, A. et al. Траектории депрессивных симптомов до постановки диагноза деменции: последующее 28-летнее исследование. JAMA Psychiatry 74 , 712–718 (2017).
PubMed PubMed Central Google Scholar
Gottesman, R.F. et al. Связь между факторами риска сосудов среднего возраста и 25-летней деменцией в группе риска атеросклероза в сообществах (ARIC). JAMA Neurol. 74 , 1246–1254 (2017).
PubMed PubMed Central Google Scholar
Samieri, C. et al. Связь уровня здоровья сердечно-сосудистой системы в пожилом возрасте с когнитивным снижением и случайной деменцией. JAMA 320 , 657–664 (2018).
PubMed PubMed Central Google Scholar
Gottesman, R.F. et al. Связь между факторами риска сердечно-сосудистых заболеваний в среднем возрасте и предполагаемым отложением амилоида в головном мозге. JAMA 317 , 1443–1450 (2017).
CAS PubMed PubMed Central Google Scholar
Vemuri, P. et al. Сосудистые и амилоидные патологии являются независимыми предикторами снижения когнитивных функций у здоровых пожилых людей. Мозг 138 , 761–771 (2015).
PubMed PubMed Central Google Scholar
Голде Т. Э., ДеКоски С. Т. и Галаско Д. Болезнь Альцгеймера: правильное лекарство, правильное время. Наука 362 , 1250–1251 (2018).
CAS Google Scholar
Херруп, К. Аргументы в пользу отказа от гипотезы амилоидного каскада. Nat. Neurosci. 18 , 794–799 (2015).
CAS Google Scholar
Злокович Б.В. и др. Вклад сосудов в когнитивные нарушения и деменцию (VCID): отчет Национального института сердца, легких и крови 2018 г. и Национального института неврологических расстройств и инсульта. Демент Альцгеймера. 16 , 1714–1733 (2020).
Google Scholar
Арнольд, С.Э., Хайман, Б.Т., Флори, Дж., Дамасио, А.Р. и Ван Хусен, Г.В. Топографическое и нейроанатомическое распределение нейрофибриллярных клубков и нейритных бляшек в коре головного мозга пациентов с болезнью Альцгеймера. Cereb. Cortex 1 , 103–116 (1991). Графическая демонстрация различного регионального распределения Aβ и тау при вскрытии.
CAS Google Scholar
Montine, T. J. et al. Руководство Национального института старения и ассоциации Альцгеймера по невропатологической оценке болезни Альцгеймера: практический подход. Acta Neuropathol. 123 , 1–11 (2012).
CAS Google Scholar
Хаасс К. и Селко Д. Дж. Растворимые белковые олигомеры в нейродегенерации: уроки из амилоидного β-пептида Альцгеймера. Nat. Rev. Mol. Cell Biol. 8 , 101–112 (2007).
CAS Google Scholar
Хольцман, Д. М., Моррис, Дж. К. и Гоут, А. М. Болезнь Альцгеймера: вызов второго века. Sci. Пер. Med. 3 , 77ср71 (2011).
Google Scholar
Thinakaran, G. & Koo, E. H. Транспортировка, процессинг и функция белка-предшественника амилоида. J. Biol. Chem. 283 , 29615–29619 (2008).
CAS PubMed PubMed Central Google Scholar
Хаасс, К. и Виллем, М. Секретный АРР модулирует синаптическую активность: новая мишень для терапевтического вмешательства? Neuron 101 , 557–559 (2019).
CAS Google Scholar
Cirrito, J. R. et al.Синаптическая активность регулирует уровни амилоида-β в интерстициальной жидкости in vivo. Neuron 48 , 913–922 (2005).
CAS Google Scholar
Kang, J. E. et al. Динамика амилоида-β регулируется орексином и циклом сна-бодрствования. Наука 326 , 1005–1007 (2009).
CAS PubMed PubMed Central Google Scholar
Boespflug, E. L. и Iliff, J. J. Возникающая взаимосвязь между обменом межклеточной жидкости и спинномозговой жидкости, амилоидом-β и сном. Biol. Психиатрия 83 , 328–336 (2018).
Google Scholar
Спирс-Джонс, Т. Л. и Хайман, Б. Т. Пересечение амилоида β и тау в синапсах при болезни Альцгеймера. Нейрон 82 , 756–771 (2014).
CAS PubMed PubMed Central Google Scholar
Benarroch, E. E. Глутаматергическая синаптическая пластичность и дисфункция при болезни Альцгеймера: новые механизмы. Неврология 91 , 125–132 (2018).
Google Scholar
Rice, H.C. et al. Секретируемый белок-предшественник амилоида-β действует как лиганд GABA (B) R1a, модулируя синаптическую передачу. Наука 363 , eaao4827 (2019).
CAS PubMed PubMed Central Google Scholar
Мюллер, У. С., Деллер, Т. и Корте, М. Не только амилоид: физиологические функции семейства белков-предшественников амилоида. Nat. Rev. Neurosci. 18 , 281–298 (2017).
Google Scholar
Смолл, С. А. и Пецко, Г. А. Переработка эндосом позволяет примирить парадокс болезни Альцгеймера. Sci. Пер. Med. 12 , eabb1717 (2020).
PubMed PubMed Central Google Scholar
Gallardo, G. & Holtzman, D. M. Амилоид-β и тау на перекрестке болезни Альцгеймера. Adv. Exp. Med. Биол. 1184 , 187–203 (2019).
CAS Google Scholar
Пулер А. М., Нобл В. и Хэнгер Д. П. Роль тау-белка в синапсах в патогенезе болезни Альцгеймера. Нейрофармакология 76 (Pt A), 1–8 (2014).
CAS Google Scholar
Eftekharzadeh, B. et al. Белок тау нарушает ядерно-цитоплазматический транспорт при болезни Альцгеймера. Neuron 99 , 925–940.e7 (2018).
CAS PubMed PubMed Central Google Scholar
Кент, С. А., Спирс-Джонс, Т. Л. и Даррант, С. С. Физиологические роли тау-белка и Aβ: значение для патологии болезни Альцгеймера и лечения. Acta Neuropathol. 140 , 417–447 (2020).
CAS PubMed PubMed Central Google Scholar
Yamada, K. et al. Активность нейронов регулирует внеклеточный тау in vivo. J. Exp. Med. 211 , 387–393 (2014).
CAS PubMed PubMed Central Google Scholar
Wu, J. W. et al. Активность нейронов усиливает распространение тау-белка и патологию тау-белка in vivo. Nat.Neurosci. 19 , 1085–1092 (2016).
CAS PubMed PubMed Central Google Scholar
de Calignon, A. et al. Распространение тау-патологии на модели ранней болезни Альцгеймера. Нейрон 73 , 685–697 (2012).
PubMed PubMed Central Google Scholar
Dujardin, S. et al. Молекулярное разнообразие тау способствует клинической неоднородности болезни Альцгеймера. Nat. Med. 26 , 1256–1263 (2020). Клинико-невропатологическая и молекулярная демонстрация того, как посттрансляционные модификации тау-белка могут играть роль в скорости клинического прогрессирования.
CAS Google Scholar
Shi, Y. et al. ApoE4 заметно усугубляет тау-опосредованную нейродегенерацию на мышиной модели таупатии. Природа 549 , 523–527 (2017).
PubMed PubMed Central Google Scholar
Gratuze, M. et al. Влияние варианта TREM2R47H на глиоз и нейродегенерацию, вызванные тау-патологией. J. Clin. Вкладывать деньги. 130 , 4954–4968 (2020).
CAS PubMed PubMed Central Google Scholar
Shi, Y. et al. Микроглия управляет APOE-зависимой нейродегенерацией в мышиной модели таупатии. J. Exp. Med. 216 , 2546–2561 (2019).
CAS PubMed PubMed Central Google Scholar
Браак, Х., Тал, Д. Р., Гебремедин, Э. и Дель Тредичи, К. Стадии патологического процесса при болезни Альцгеймера: возрастные категории от 1 до 100 лет. J. Neuropathol. Exp. Neurol. 70 , 960–969 (2011).
CAS Google Scholar
Браак Х. и Браак Е. Невропатологическая стадия изменений, связанных с болезнью Альцгеймера. Acta Neuropathol. 82 , 239–259 (1991).
CAS Google Scholar
Delacourte, A. et al. Биохимический путь нейрофибриллярной дегенерации при старении и болезни Альцгеймера. Неврология 52 , 1158–1165 (1999).
CAS Google Scholar
Прайс, Дж. Л. и Моррис, Дж. С. Клубки и бляшки при недемлементном старении и «доклинической» болезни Альцгеймера. Ann. Neurol. 45 , 358–368 (1999).
CAS Google Scholar
Delacourte, A. et al. Агрегация тау в образовании гиппокампа: старение или патологический процесс? Exp. Геронтол. 37 , 1291–1296 (2002).
CAS Google Scholar
Crary, J. F. et al. Первичная возрастная таупатия (ЧАСТЬ): распространенная патология, связанная со старением человека. Acta Neuropathol. 128 , 755–766 (2014).
CAS PubMed PubMed Central Google Scholar
Джек, С. Р. и др. Двумерное распределение амилоида-β и тау: взаимосвязь с установленными нейрокогнитивными клиническими синдромами. Мозг 142 , 3230–3242 (2019).
PubMed PubMed Central Google Scholar
Hanseeuw, B.J. et al. Связь амилоида и тау-белка с познанием в доклинической болезни Альцгеймера: продольное исследование. JAMA Neurol. 76 , 915–924 (2019).
PubMed PubMed Central Google Scholar
Ossenkoppele, R. et al. Паттерны тау-ПЭТ отражают клиническую и нейроанатомическую изменчивость при болезни Альцгеймера. Мозг 139 , 1551–1567 (2016).
PubMed PubMed Central Google Scholar
Graff-Radford, J. et al. Новые взгляды на атипичную болезнь Альцгеймера в эпоху биомаркеров. Ланцет нейрол. 20 , 222–234 (2021).
Google Scholar
Ким, Дж., Басак, Дж. М. и Хольцман, Д. М. Роль аполипопротеина Е в болезни Альцгеймера. Neuron 63 , 287–303 (2009).
CAS PubMed PubMed Central Google Scholar
Huynh, T. V., Davis, A. A., Ulrich, J. D., Holtzman, D.M. & Apolipoprotein, E. и болезнь Альцгеймера: влияние аполипопротеина E на амилоид-β и другие амилоидогенные белки. J. Lipid Res. 58 , 824–836 (2017).
CAS PubMed PubMed Central Google Scholar
Reiman, E. M. et al. Бремя фибриллярного амилоида-β у когнитивно нормальных людей на 3 уровнях генетического риска болезни Альцгеймера. Proc. Natl Acad. Sci. США 106 , 6820–6825 (2009).
CAS Google Scholar
Jack, C.R. Jr. et al. Возраст, пол и влияние APOE e4 на память, структуру мозга и β-амилоид на протяжении всей взрослой жизни. JAMA Neurol. 72 , 511–519 (2015).
PubMed PubMed Central Google Scholar
van der Kant, R., Goldstein, L. S. B. & Ossenkoppele, R. Амилоид-β-независимые регуляторы тау-патологии при болезни Альцгеймера. Nat. Rev. Neurosci. 21 , 21–35 (2020).
Google Scholar
Смолл, С. А. и Дафф, К. Связывание Aβ и тау при болезни Альцгеймера с поздним началом: гипотеза двойного пути. Нейрон 60 , 534–542 (2008).
CAS PubMed PubMed Central Google Scholar
Буше, М. А. и Хайман, Б. Т. Синергия между амилоидом-β и тау при болезни Альцгеймера. Nat. Neurosci. 23 , 1183–1193 (2020).
CAS Google Scholar
Курт, М.А., Дэвис, Д.К., Кидд, М., Дафф, К. и Хоулетт, Д.Р. Гиперфосфорилированный тау-белок и парные спиральные нити-подобные структуры в мозге мышей, несущих мутантный белок-предшественник амилоида и мутантный пресенилин- 1 трансген. Neurobiol. Дис. 14 , 89–97 (2003).
CAS Google Scholar
Le, R. et al. Вызванные бляшками аномалии геометрии нейритов в трансгенных моделях болезни Альцгеймера: последствия для нарушения нервной системы. J. Neuropathol. Exp. Neurol. 60 , 753–758 (2001).
CAS Google Scholar
Leyns, C.E.G. et al. Функция TREM2 препятствует посеву тау в нейритных бляшках. Nat. Neurosci. 22 , 1217–1222 (2019).
CAS PubMed PubMed Central Google Scholar
Смолл, С. А., Симоэс-Спасов, С., Майё, Р. и Петско, Г. А. Эндосомные пробки на дорогах представляют собой патогенный центр и терапевтическую мишень при болезни Альцгеймера. Trends Neurosci. 40 , 592–602 (2017).
CAS PubMed PubMed Central Google Scholar
Никсон, Р. А. и Янг, Д. С. Нарушение аутофагии при болезни Альцгеймера — определение первичного дефекта. Neurobiol. Дис. 43 , 38–45 (2011).
CAS PubMed PubMed Central Google Scholar
Палоп, Дж. Дж. И Маке, Л. Сетевые аномалии и дисфункция интернейронов при болезни Альцгеймера. Nat. Rev. Neurosci. 17 , 777–792 (2016).
CAS Google Scholar
Terry, R.D. et al. Физическая основа когнитивных изменений при болезни Альцгеймера: потеря синапсов является основным коррелятом когнитивных нарушений. Ann. Neurol. 30 , 572–580 (1991).
CAS Google Scholar
ДеКоски, С. Т. и Шефф, С. В. Потеря синапсов в биоптатах лобной коры при болезни Альцгеймера: корреляция с когнитивной тяжестью. Ann. Neurol. 27 , 457–464 (1990). Демонстрация в реальном времени тесного соответствия между потерей синапсов и степенью когнитивных нарушений в биопсиях головного мозга пациентов с БА.
CAS Google Scholar
Spiers, T. L. et al. Аномалии дендритного позвоночника у трансгенных мышей с белками-предшественниками амилоида, продемонстрированные с помощью переноса генов и прижизненной многофотонной микроскопии. J. Neurosci. 25 , 7278–7287 (2005).
CAS PubMed PubMed Central Google Scholar
Arbel-Ornath, M. et al.Растворимый олигомерный амилоид-β вызывает дисомеостаз кальция, который предшествует потере синапсов в мозге живой мыши. Мол. Neurodegener. 12 , 27 (2017).
PubMed PubMed Central Google Scholar
Zhou, L. et al. Связь тау-белка с синаптическими пузырьками вызывает пресинаптическую дисфункцию. Nat. Commun. 8 , 15295 (2017).
PubMed PubMed Central Google Scholar
Masliah, E., Hansen, L., Albright, T., Mallory, M. & Terry, R. D. Иммуноэлектронно-микроскопическое исследование синаптической патологии при болезни Альцгеймера. Acta Neuropathol. 81 , 428–433 (1991).
CAS Google Scholar
Henstridge, C. M. et al. Посмертный анализ мозга когорты Лотиана, родившейся в 1936 году: расширение когнитивных функций и фенотипирования мозга на протяжении всей жизни до уровня синапсов. Acta Neuropathol.Commun. 3 , 53 (2015).
PubMed PubMed Central Google Scholar
Lleo, A. et al. Изменения синаптических белков предшествуют маркерам нейродегенерации в спинномозговой жидкости доклинической стадии болезни Альцгеймера. Мол. Cell Proteom. 18 , 546–560 (2019).
CAS Google Scholar
DeVos, S. L. et al.Посев синаптического тау предшествует патологии тау в мозге человека при болезни Альцгеймера. Фронт. Neurosci. 12 , 267 (2018).
PubMed PubMed Central Google Scholar
Yoshiyama, Y. et al. Потеря синапсов и активация микроглии предшествуют спутыванию в модели мыши с таупатией P301S. Neuron 53 , 337–351 (2007).
CAS Google Scholar
Кескин А.Д. и соавт. Зависимое от ингибирования BACE восстановление патофизиологии болезни Альцгеймера. Proc. Natl Acad. Sci. США 114 , 8631–8636 (2017).
CAS Google Scholar
Busche, M. A. et al. Кластеры гиперактивных нейронов возле амилоидных бляшек на мышиной модели болезни Альцгеймера. Наука 321 , 1686–1689 (2008).
CAS Google Scholar
Kuchibhotla, K. V. et al. Бляшки Aβ приводят к аберрантной регуляции гомеостаза кальция in vivo, что приводит к структурным и функциональным нарушениям нейронных сетей. Neuron 59 , 214–225 (2008).
CAS PubMed PubMed Central Google Scholar
Menkes-Caspi, N. et al. Патологический тау нарушает текущую сетевую активность. Нейрон 85 , 959–966 (2015).
CAS Google Scholar
Busche, M.A. et al. Тау нарушает нервные цепи, доминируя над эффектами амилоида-β в моделях болезни Альцгеймера in vivo. Nat. Neurosci. 22 , 57–64 (2019).
CAS Google Scholar
Андерсон, К. Дж., Шефф, С. В. и ДеКоски, С. Т. Реактивный синаптогенез в области СА1 гиппокампа взрослых взрослых и старых крыс. J. Comp. Neurol. 252 , 374–384 (1986).
CAS Google Scholar
Геддес, Дж. У. и Котман, К. У. Пластичность возбуждающих аминокислотных рецепторов гиппокампа при болезни Альцгеймера. Neurosci. Res. 3 , 672–678 (1986).
CAS Google Scholar
Хайман, Б. Т., Кромер, Л. Дж. И Ван Хусен, Г. В. Реиннервация зоны перфорантного пути гиппокампа при болезни Альцгеймера. Ann. Neurol. 21 , 259–267 (1987).
CAS Google Scholar
Liu, L. et al. Транссинаптическое распространение тау-патологии in vivo. PLoS ONE 7 , e31302 (2012).
CAS PubMed PubMed Central Google Scholar
Rauch, J. N. et al. LRP1 — главный регулятор поглощения и распространения тау. Природа 580 , 381–385 (2020).
CAS PubMed PubMed Central Google Scholar
Kounnas, M. Z. et al. Белок, связанный с рецептором ЛПНП, многофункциональный рецептор ApoE, связывает секретируемый белок-предшественник β-амилоида и опосредует его деградацию. Cell 82 , 331–340 (1995).
CAS Google Scholar
Ребек, Г. В., Рейтер, Дж. С., Стрикленд, Д. К. и Хайман, Б. Т. Аполипопротеин Е при спорадической болезни Альцгеймера: аллельные вариации и взаимодействия рецепторов. Neuron 11 , 575–580 (1993).
CAS Google Scholar
Уилтон, Д. К., Диссинг-Олесен, Л. и Стивенс, Б. Передача сигналов нейрон-глии при элиминации синапсов. Annu. Rev. Neurosci. 42 , 107–127 (2019).
CAS Google Scholar
Никсон Р. А. Роль аутофагии в нейродегенеративных заболеваниях. Nat. Med. 19 , 983–997 (2013).
CAS Google Scholar
Menzies, F. M. et al. Аутофагия и нейродегенерация: патогенетические механизмы и терапевтические возможности. Neuron 93 , 1015–1034 (2017).
CAS Google Scholar
Никсон, Р.А. Белок-предшественник амилоида и эндосомно-лизосомная дисфункция при болезни Альцгеймера: неразлучные партнеры в многофакторном заболевании. FASEB J. 31 , 2729–2743 (2017).
CAS PubMed PubMed Central Google Scholar
Shehata, M. et al. Аутофагия усиливает стирание памяти за счет дестабилизации синапсов. J. Neurosci. 38 , 3809–3822 (2018).
CAS PubMed PubMed Central Google Scholar
Glatigny, M. et al.Аутофагия необходима для формирования памяти и обращает вспять ухудшение памяти, связанное с возрастом. Curr. Биол. 29 , 435–448.e8 (2019).
CAS Google Scholar
Cataldo, A. M. et al. Нарушения эндоцитарного пути предшествуют отложению β-амилоида при спорадической болезни Альцгеймера и синдроме Дауна: дифференциальные эффекты генотипа APOE и мутаций пресенилина. г. J. Pathol. 157 , 277–286 (2000).
CAS PubMed PubMed Central Google Scholar
Ван Акер, З. П., Брету, М. и Аннаерт, В. Эндолизосомная дисрегуляция и болезнь Альцгеймера с поздним началом: влияние генетических факторов риска. Мол. Neurodegener. 14 , 20 (2019).
PubMed PubMed Central Google Scholar
Suire, C. N. et al. Катепсин D регулирует церебральные отношения Aβ42 / 40 посредством дифференциальной деградации Aβ42 и Aβ40. Alzheimers Res. Ther. 12 , 80 (2020).
CAS PubMed PubMed Central Google Scholar
Kwart, D. et al. Большая панель изогенных нейронов ИПСК человека с мутантными APP и PSEN1 выявляет общие эндосомные аномалии, опосредованные APP β-CTF, а не Aβ. Neuron 104 , 256–270.e5 (2019). Данные индуцированных плюрипотентных стволовых клеток о критической роли эндосомной дисрегуляции в патогенезе Aβ и тау-индуцированных заболеваний.
CAS Google Scholar
Pensalfini, A. et al. Эндосомная дисфункция, вызванная чрезмерной активацией Rab5, повторяет продромальные и нейродегенеративные особенности болезни Альцгеймера. Cell Rep. 33 , 108420 (2020).
CAS PubMed PubMed Central Google Scholar
Lauritzen, I. et al. Внутринейрональная агрегация фрагмента β-CTF APP (C99) вызывает Aβ-независимую лизосомно-аутофагическую патологию. Acta Neuropathol. 132 , 257–276 (2016).
CAS PubMed PubMed Central Google Scholar
Lee, J. H. et al. Пресенилин 1 поддерживает лизосомный гомеостаз Ca 2+ через TRPML1, регулируя опосредованное vATPase закисление лизосом. Cell Rep. 12 , 1430–1444 (2015).
CAS PubMed PubMed Central Google Scholar
Ли, Дж. Х. и др. β2-адренергические агонисты восстанавливают закисление лизосом и функционируют при дефиците PSEN1, обращая обратную доставку ClC-7 из ER в лизосомы. J. Mol. Биол. 432 , 2633–2650 (2020).
CAS PubMed PubMed Central Google Scholar
Морел Н. и Поэ-Гайон С. Мембранный домен вакуолярной H + АТФазы: решающий игрок в высвобождении экзоцитоза нейромедиатора. Ячейка. Мол. Life Sci. 72 , 2561–2573 (2015).
CAS Google Scholar
Хигасида, Х., Йокояма, С., Цуджи, С. и Мурамацу, С. I. Высвобождение нейротрансмиттера: c-субъединицы вакуолярной АТФазы V0 в возможных генных или клеточных методах лечения болезней Паркинсона, Альцгеймера и психических заболеваний. J. Physiol. Sci. 67 , 11–17 (2017).
CAS Google Scholar
Эль Фар, О. и Сигар, М. Роль субъединиц V-АТФазы в слиянии синаптических пузырьков? J. Neurochem. 117 , 603–612 (2011).
CAS Google Scholar
Peng, K. Y. et al. Генотип аполипопротеина E4 нарушает производство экзосом мозга. Мозг 142 , 163–175 (2019).
Google Scholar
Лю Р.Q. et al. Мембранная локализация β-амилоида 1-42 в лизосомах: возможный механизм лабилизации лизосом. J. Biol. Chem. 285 , 19986–19996 (2010).
CAS PubMed PubMed Central Google Scholar
Моришита Х. и Мидзусима Н. Разнообразные клеточные роли аутофагии. Annu. Rev. Cell Dev. Биол. 35 , 453–475 (2019).
CAS Google Scholar
Левин Б. и Кремер Г. Биологические функции генов аутофагии: перспектива болезни. Cell 176 , 11–42 (2019).
CAS PubMed PubMed Central Google Scholar
Bordi, M. et al. Поток аутофагии в нейронах CA1 гиппокампа при болезни Альцгеймера: повышенная индукция перегружает неэффективные лизосомы, что приводит к нейритной дистрофии. Аутофагия 12 , 2467–2483 (2016).
CAS PubMed PubMed Central Google Scholar
Морейра П. И., Карвалью К., Чжу X., Смит М. А. и Перри Г. Дисфункция митохондрий является пусковым механизмом патофизиологии болезни Альцгеймера. Биохим. Биофиз. Acta 1802 , 2–10 (2010).
CAS Google Scholar
Никсон, Р. А. Старение лизосомы: важный катализатор поздних нейродегенеративных заболеваний. Биохим. Биофиз. Acta Proteins Proteom. 1868 , 140443 (2020).
CAS Google Scholar
Уайт, Л. С., Лау, А. А., Хемсли, К. М., Хопвуд, Дж. Дж. И Сарджант, Т. Дж. Эндолизосомная и аутофагическая дисфункция: движущий фактор болезни Альцгеймера? J. Neurochem. 140 , 703–717 (2017).
CAS Google Scholar
Pensalfini, A. et al. Внутриклеточный амилоид и нейронное происхождение нейритных бляшек болезни Альцгеймера. Neurobiol. Дис. 71 , 53–61 (2014).
CAS Google Scholar
Adalbert, R. et al. Сильнодистрофические аксоны в амилоидных бляшках остаются непрерывными и связаны с жизнеспособными клеточными телами. Мозг 132 , 402–416 (2009).
Google Scholar
Никсон Р. А. и Янг Д. С. Аутофагия и гибель нейрональных клеток при неврологических расстройствах. Колд Спринг Харб. Перспектива. Биол. 4 , a008839 (2012).
PubMed PubMed Central Google Scholar
Наканиши, Х. Микроглиальный катепсин B как ключевой фактор воспалительных заболеваний головного мозга и старения мозга. Neural Regenerat. Res. 15 , 25–29 (2020).
Google Scholar
Лоури, Дж. Р. и Клегерис, А. Новые роли катепсинов микроглии в нейродегенеративных заболеваниях. Brain Res. Бык. 139 , 144–156 (2018).
CAS Google Scholar
Сарлус, Х. и Хенека, М. Т. Микроглия при болезни Альцгеймера. J. Clin. Вкладывать деньги. 127 , 3240–3249 (2017).
PubMed PubMed Central Google Scholar
Деретич В., Сайто Т. и Акира С. Аутофагия при инфекции, воспалении и иммунитете. Nat. Rev. Immunol. 13 , 722–737 (2013).
CAS PubMed PubMed Central Google Scholar
Cho, M. H. et al. Аутофагия в микроглии разрушает внеклеточные β-амилоидные фибриллы и регулирует инфламмасому NLRP3. Аутофагия 10 , 1761–1775 (2014).
CAS PubMed PubMed Central Google Scholar
Джей Т. Р. и др. Зависящие от прогрессирования заболевания эффекты дефицита TREM2 на мышиной модели болезни Альцгеймера. J. Neurosci. 37 , 637–647 (2017).
CAS PubMed PubMed Central Google Scholar
Lewcock, J. W. et al. Новая биология микроглии определяет новые терапевтические подходы к болезни Альцгеймера. Neuron 108 , 801–821 (2020).
CAS Google Scholar
Kim, H. J. et al. Недостаточная аутофагия в микроглии нарушает синаптическую обрезку и вызывает социальные поведенческие дефекты. Мол. Психиатрия 22 , 1576–1584 (2017).
CAS PubMed PubMed Central Google Scholar
Сайдо Т. и Лейссринг М.А. Протеолитическая деградация амилоидного β-белка. Колд Спринг Харб. Перспектива. Med. 2 , а006379 (2012).
PubMed PubMed Central Google Scholar
Расмуссен, М. К., Местре, Х. и Недергаард, М. Глимфатический путь при неврологических расстройствах. Ланцет нейрол. 17 , 1016–1024 (2018).
CAS PubMed PubMed Central Google Scholar
Бакнер, Р. Л., Эндрюс-Ханна, Дж. Р. и Шактер, Д. Л. Сеть мозга по умолчанию: анатомия, функции и отношение к болезни. Ann. Акад. Sci. 1124 , 1–38 (2008). Демонстрация взаимосвязи между сетью режима по умолчанию и накоплением амилоида.
Google Scholar
Грейциус, М. Д., Шривастава, Г., Рейсс, А. Л. и Менон, В. Сетевая активность в режиме по умолчанию отличает болезнь Альцгеймера от здорового старения: данные функциональной МРТ. Proc. Natl Acad. Sci. США 101 , 4637–4642 (2004).
CAS PubMed PubMed Central Google Scholar
Buckner, R. L. et al. Корковые узлы, выявленные внутренней функциональной связностью: картирование, оценка стабильности и связь с болезнью Альцгеймера. J. Neurosci. 29 , 1860–1873 (2009).
CAS PubMed PubMed Central Google Scholar
Agosta, F. et al. ФМРТ в состоянии покоя при болезни Альцгеймера: за пределами сети режима по умолчанию. Neurobiol. Старение 33 , 1564–1578 (2012).
PubMed PubMed Central Google Scholar
Whitwell, J. L. et al. Дисфункции рабочей памяти и языковой сети при логопенической афазии: беззадачное сравнение фМРТ с деменцией Альцгеймера. Neurobiol. Старение 36 , 1245–1252 (2015).
PubMed PubMed Central Google Scholar
Townley, R.A. et al. Прогрессирующий дизэкспективный синдром вследствие болезни Альцгеймера: описание 55 случаев и сравнение с другими фенотипами. Brain Commun. 2 , fcaa068 (2020).
PubMed PubMed Central Google Scholar
Franzmeier, N. et al. Функциональная архитектура мозга связана со скоростью накопления тау при болезни Альцгеймера. Nat. Commun. 11 , 347 (2020).
CAS PubMed PubMed Central Google Scholar
Sintini, I. et al. Тау и амилоидные отношения с функциональной связностью в состоянии покоя при атипичной болезни Альцгеймера. Cereb. Cortex https://doi.org/10.1093/cercor/bhaa319 (2020).
Артикул Google Scholar
Jones, D. T. et al. Тау, амилоид и каскадный отказ сети по всему спектру болезни Альцгеймера. Cortex 97 , 143–159 (2017).
PubMed PubMed Central Google Scholar
Sepulcre, J. et al. Иерархическая организация тау- и амилоидных отложений в коре головного мозга. JAMA Neurol. 74 , 813–820 (2017).
PubMed PubMed Central Google Scholar
Jack, C.R. Jr. et al. Профили «первый амилоид» и «сначала нейродегенерация» характеризуют случайную положительную реакцию на амилоид при ПЭТ. Неврология 81 , 1732–1740 (2013).
CAS PubMed PubMed Central Google Scholar
Protas, H. D. et al. Метаболизм глюкозы в задней поясной извилине, метаболизм глюкозы в гиппокампе и объем гиппокампа у когнитивно нормальных людей позднего среднего возраста на 3 уровнях генетического риска болезни Альцгеймера. JAMA Neurol. 70 , 320–325 (2013).
PubMed PubMed Central Google Scholar
Franzmeier, N. et al. Ориентированное на пациента прогнозирование распространения тау-патологии при болезни Альцгеймера на основе возможности установления связи. Sci. Adv. 6 , eabd1327 (2020). Анализ, показывающий, как региональная экспансия тау следует моделям связности.
CAS PubMed PubMed Central Google Scholar
D’Onofrio, G. et al. Психоневрологические симптомы и функциональный статус у пациентов с болезнью Альцгеймера и сосудистой деменцией. Curr. Alzheimer Res. 9 , 759–771 (2012).
Google Scholar
Lehmann, M. et al. Различные модели отложения амилоида и гипометаболизма в клинических вариантах вероятной болезни Альцгеймера. Мозг 136 , 844–858 (2013).
PubMed PubMed Central Google Scholar
Костыль, С. Дж. И др. Консенсусная классификация задней корковой атрофии. Демент Альцгеймера. 13 , 870–884 (2017).
PubMed PubMed Central Google Scholar
Gorno-Tempini, M. L. et al. Логопенический / фонологический вариант первично прогрессирующей афазии. Неврология 71 , 1227–1234 (2008).
CAS PubMed PubMed Central Google Scholar
Bergeron, D. et al. Распространенность патологии амилоида-β при различных вариантах первично-прогрессирующей афазии. Ann. Neurol. 84 , 729–740 (2018).
CAS PubMed PubMed Central Google Scholar
Ossenkoppele, R. et al. Поведенческий / дизэкспективный вариант болезни Альцгеймера: клинические, нейровизуализационные и патологические особенности. Мозг 138 , 2732–2749 (2015).
PubMed PubMed Central Google Scholar
Murray, M. E. et al. Невропатологически определенные подтипы болезни Альцгеймера с отчетливыми клиническими характеристиками: ретроспективное исследование. Ланцет нейрол. 10 , 785–796 (2011).
PubMed PubMed Central Google Scholar
Кларфилд А. М. Снижение распространенности обратимых деменций: обновленный метаанализ. Arch. Междунар. Med. 163 , 2219–2229 (2003).
Google Scholar
Бич, Т. Г., Монселл, С. Э., Филлипс, Л. Э. и Кукулл, В. Точность клинического диагноза болезни Альцгеймера в Национальном институте старения в центрах болезни Альцгеймера, 2005-2010 гг. J. Neuropathol. Exp. Neurol. 71 , 266–273 (2012).
PubMed PubMed Central Google Scholar
McKeith, I.G. et al. Диагностика и лечение деменции с тельцами Леви: четвертый консенсусный отчет Консорциума DLB. Неврология 89 , 88–100 (2017).
PubMed PubMed Central Google Scholar
Rascovsky, K. et al. Чувствительность пересмотренных диагностических критериев для поведенческого варианта лобно-височной деменции. Мозг 134 , 2456–2477 (2011).
PubMed PubMed Central Google Scholar
Gorno-Tempini, M. L. et al. Классификация первично-прогрессирующей афазии и ее вариантов. Неврология 76 , 1006–1014 (2011).
PubMed PubMed Central Google Scholar
Botha, H. et al. ФДГ-ПЭТ при тау-отрицательной амнестической деменции напоминает таковой при склерозе гиппокампа, подтвержденном вскрытием. Мозг 141 , 1201–1217 (2018).
PubMed PubMed Central Google Scholar
Петерсен, Р. К. и Яффе, К. Проблемы и вопросы, связанные со скринингом когнитивных нарушений у пожилых пациентов. JAMA 323 , 722–724 (2020).
PubMed PubMed Central Google Scholar
Patnode, C. D. et al. Скрининг когнитивных нарушений у пожилых людей: обновленный отчет о доказательствах и систематический обзор Целевой группы профилактических служб США. JAMA 323 , 764–785 (2020).
Google Scholar
Jack, C.R. Jr. et al. Рамки исследования NIA-AA: к биологическому определению болезни Альцгеймера. Демент Альцгеймера. 14 , 535–562 (2018).
PubMed PubMed Central Google Scholar
Chetelat, G. et al. Амилоид-ПЭТ и 18 F-ФДГ-ПЭТ в диагностическом исследовании болезни Альцгеймера и других деменций. Ланцет нейрол. 19 , 951–962 (2020).
CAS Google Scholar
Klunk, W. E. et al. Визуализация амилоида мозга при болезни Альцгеймера с помощью Питтсбургского соединения-B. Ann. Neurol. 55 , 306–319 (2004).
CAS Google Scholar
Джек, К. Р. Дж. И др. Введение в пересмотренные критерии диагностики болезни Альцгеймера: Национальный институт старения и рабочие группы Ассоциации Альцгеймера. Демент Альцгеймера. 7 , 257–262 (2011).
Google Scholar
Knopman, D. S. et al. Эволюция нейродегенеративных биомаркеров визуализации от клинически нормальных к деменции в спектре болезни Альцгеймера. Neurobiol. Старение 46 , 32–42 (2016).
PubMed PubMed Central Google Scholar
Schröder, J. & Pantel, J. Нейровизуализация атрофии гиппокампа в раннем распознавании болезни Альцгеймера — критическая оценка после двух десятилетий исследований. Psychiatry Res. Нейровизуализация 247 , 71–78 (2016).
Google Scholar
Petersen, C. et al. Клинические варианты болезни Альцгеймера демонстрируют отчетливые региональные паттерны накопления нейрофибриллярных клубков. Acta Neuropathol. 138 , 597–612 (2019).
CAS PubMed PubMed Central Google Scholar
Ridha, B.H. et al. Отслеживание прогрессирования атрофии при семейной болезни Альцгеймера: серийное исследование МРТ. Ланцет нейрол. 5 , 828–834 (2006).
Google Scholar
Greenberg, S. M. et al. Церебральная амилоидная ангиопатия и болезнь Альцгеймера — один пептид, два пути. Nat. Rev. Neurol. 16 , 30–42 (2020).
CAS Google Scholar
Graff-Radford, J. et al. Церебральные микрокровоизлияния: распространенность и связь с амилоидной нагрузкой. Неврология 92 , e253 – e262 (2019).
PubMed PubMed Central Google Scholar
Li, X. et al. Значительное влияние церебральных микрокровоизлияний на когнитивную дисфункцию: обновленный метаанализ. PLoS ONE 12 , e0185145 (2017).
PubMed PubMed Central Google Scholar
Laforce, R. Jr. et al. Параллельная ICA FDG-PET и PiB-PET в трех состояниях с основной патологией Альцгеймера. Neuroimage Clin. 4 , 508–516 (2014).
PubMed PubMed Central Google Scholar
Кароли А.и другие. Легкие когнитивные нарушения с подозрением на неамилоидную патологию (SNAP): прогнозирование прогрессирования. Неврология 84 , 508–515 (2015).
CAS PubMed PubMed Central Google Scholar
Иаккарино, Л., Сала, А. и Перани, Д. Прогнозирование долгосрочной клинической стабильности у амилоид-положительных субъектов с помощью FDG-PET. Ann. Clin. Пер. Neurol. 6 , 1113–1120 (2019).
CAS PubMed PubMed Central Google Scholar
Villemagne, V. L., Doré, V., Burnham, S. C., Masters, C. L. и Rowe, C. C. Визуализация протеинопатий тау- и амилоид-β при болезни Альцгеймера и других состояниях. Nat. Rev. Neurol. 14 , 225–236 (2018).
CAS Google Scholar
Clark, C.M. et al. Церебральная ПЭТ с флорбетапиром в сравнении с невропатологией при аутопсии для выявления невритных бляшек амилоида-β: проспективное когортное исследование. Ланцет нейрол. 11 , 669–678 (2012).
CAS Google Scholar
Murray, M. E. et al. Клинико-патологические последствия и влияние соединения B 11C-Pittsburgh на фазу Thal-амилоида в спектре болезни Альцгеймера. Мозг 138 , 1370–1381 (2015).
PubMed PubMed Central Google Scholar
Klunk, W.E. et al. Центилоидный проект: стандартизация количественной оценки амилоидных бляшек с помощью ПЭТ. Демент Альцгеймера. 11 , 1–15.e1–4 (2015).
Google Scholar
Landau, S.M. et al. Сравнение изображений с помощью позитронно-эмиссионной томографии и измерений β-амилоида в спинномозговой жидкости. Ann. Neurol. 74 , 826–836 (2013).
CAS PubMed PubMed Central Google Scholar
Leuzy, A. et al. Питтсбургское исследование соединения B и амилоида-β спинномозговой жидкости в многоцентровом европейском клиническом исследовании памяти. Мозг 139 , 2540–2553 (2016).
PubMed PubMed Central Google Scholar
Grothe, M. J. et al. Определение стадии регионального отложения амилоида in vivo. Неврология 89 , 2031–2038 (2017).
CAS PubMed PubMed Central Google Scholar
Джагуст, У. Дж. И Ландау, С. М. Временная динамика накопления β-амилоида при старении и болезни Альцгеймера. Неврология 96 , e1347 – e1357 (2021).
Google Scholar
Jack, C.R. Jr. et al. Распространенность биологически и клинически определенных структур спектра болезни Альцгеймера с использованием исследовательских рамок ассоциации Национального института старения и болезни Альцгеймера. JAMA Neurol. 76 , 1174–1183 (2019).
PubMed PubMed Central Google Scholar
Johnson, K. A. et al. Соответствующие критерии использования амилоидного ПЭТ: отчет целевой группы по амилоидной визуализации, общества ядерной медицины и молекулярной визуализации и ассоциации Альцгеймера. J. Nucl. Med. 54 , 476–490 (2013).
CAS Google Scholar
Рабинович, Г.D. et al. Связь амилоидной позитронно-эмиссионной томографии с последующим изменением клинического ведения пациентов с легкими когнитивными нарушениями или деменцией. JAMA 321 , 1286–1294 (2019). Очень крупное прагматическое исследование значения визуализации Aβ в клинической практике деменции.
PubMed PubMed Central Google Scholar
de Wilde, A. et al. Связь амилоидной позитронно-эмиссионной томографии с изменениями диагноза и лечением пациентов в когорте неотобранных клиник памяти: проект ABIDE. JAMA Neurol. 75 , 1062–1070 (2018).
PubMed PubMed Central Google Scholar
Jeong, H.J. et al. [ 18 F] THK5351 ПЭТ-визуализация у пациентов с легкими когнитивными нарушениями. J. Clin. Neurol. 16 , 202–214 (2020).
Google Scholar
Pascoal, T. A. et al. 18 F-MK-6240 ПЭТ для раннего и позднего обнаружения нейрофибриллярных клубков. Мозг 143 , 2818–2830 (2020).
Google Scholar
Leuzy, A. et al. Диагностическая эффективность позитронно-эмиссионной томографии RO948 F 18 tau в дифференциации болезни Альцгеймера от других нейродегенеративных заболеваний. JAMA Neurol. 77 , 955–965 (2020).
Google Scholar
Ossenkoppele, R.и другие. Дискриминационная точность позитронно-эмиссионной томографии [ 18 F] флортауципира при болезни Альцгеймера по сравнению с другими нейродегенеративными расстройствами. JAMA 320 , 1151–1162 (2018). Демонстрация замечательной специфичности повышенного сигнала ПЭТ тау за пределами медиальной височной доли для людей с повышенным уровнем Aβ.
CAS PubMed PubMed Central Google Scholar
Ашенбреннер, А.Дж., Гордон, Б. А., Бензингер, Т. Л. С., Моррис, Дж. К. и Хассенстаб, Дж. Дж. Влияние тау-ПЭТ, амилоидного ПЭТ и объема гиппокампа на познание при болезни Альцгеймера. Неврология 91 , e859 – e866 (2018).
CAS PubMed PubMed Central Google Scholar
Brier, M. R. et al. Визуализация тау и Aβ, показатели спинномозговой жидкости и когнитивные функции при болезни Альцгеймера. Sci. Пер. Med. 8 , 338ra366 (2016).
Google Scholar
Harrison, T. M. et al. Продольное накопление и атрофия тау-белка при старении и болезни Альцгеймера. Ann. Neurol. 85 , 229–240 (2019).
CAS PubMed PubMed Central Google Scholar
Lu, M. et al. Совокупный тау-белок, измеренный путем визуальной интерпретации позитронно-эмиссионной томографии флортауципира, и связанный с этим риск клинического прогрессирования легких когнитивных нарушений и болезни Альцгеймера: результаты 2 клинических испытаний фазы III. JAMA Neurol. 78 , 445–453 (2021).
PubMed PubMed Central Google Scholar
Lowe, V.J. et al. Широко распространенный мозговой тау-белок и его связь со старением, стадией Браака и деменцией Альцгеймера. Мозг 141 , 271–287 (2018).
Google Scholar
Pontecorvo, M. J. et al. Связь между связыванием тау-белка ПЭТ флортауципира и амилоидной нагрузкой, клинический диагноз, возраст и когнитивные способности. Мозг 140 , 748–763 (2017).
PubMed PubMed Central Google Scholar
Шоу, Л. М. и др. Соответствующие критерии использования люмбальной пункции и анализа спинномозговой жидкости при диагностике болезни Альцгеймера. Демент Альцгеймера. 14 , 1505–1521 (2018).
Google Scholar
Молинуево, Дж.L. et al. Текущее состояние биомаркеров жидкости Альцгеймера. Acta Neuropathol. 136 , 821–853 (2018).
CAS PubMed PubMed Central Google Scholar
Hansson, O. et al. Биомаркеры CSF болезни Альцгеймера согласуются с амилоид-β ПЭТ и предсказывают клиническое прогрессирование: исследование полностью автоматизированных иммуноанализов в когортах BioFINDER и ADNI. Демент Альцгеймера. 1 , 30029–30023 (2018).
Google Scholar
Hansson, O. et al. Прогнозирование болезни Альцгеймера с использованием соотношения Aβ42 / Aβ40 в спинномозговой жидкости у пациентов с легкими когнитивными нарушениями. Демент. Гериатр. Cogn. Disord. 23 , 316–320 (2007).
CAS Google Scholar
Wiltfang, J. et al. Соотношение амилоидного β-пептида 42/40, но не Aβ42, коррелирует с фосфо-тау у пациентов с низкой и высокой нагрузкой CSF Aβ40. J. Neurochem. 101 , 1053–1059 (2007).
CAS Google Scholar
Mattsson, N. et al. Биомаркеры спинномозговой жидкости и зарождающаяся болезнь Альцгеймера у пациентов с легкими когнитивными нарушениями. JAMA 302 , 385–393 (2009).
CAS Google Scholar
Skillbäck, T. et al. Тау-белок и амилоид-β1-42 в спинномозговой жидкости у пациентов с деменцией. Мозг 138 , 2716–2731 (2015).
Google Scholar
Buerger, K. et al. Отсутствует корреляция между тау-белком ЦСЖ, фосфорилированным по треонину 181, с нейрофибриллярной патологией неокортекса при болезни Альцгеймера. Мозг 130 , e82 (2007).
Google Scholar
Seppälä, T. T. et al. Биомаркеры спинномозговой жидкости для болезни Альцгеймера коррелируют с результатами кортикальной биопсии головного мозга. Неврология 78 , 1568–1575 (2012).
Google Scholar
Бартелеми, Н. Р. и др. Сигнатура растворимого фосфорилированного тау связывает тау, амилоид и эволюцию стадий доминантно наследуемой болезни Альцгеймера. Nat. Med. 26 , 398–407 (2020).
PubMed PubMed Central Google Scholar
Джанелидзе, С.и другие. Спинномозговая жидкость p-tau217 работает лучше, чем p-tau181, как биомаркер болезни Альцгеймера. Nat. Commun. 11 , 1683 (2020).
CAS PubMed PubMed Central Google Scholar
Kern, S. et al. Связь легкого белка нейрофиламентов спинномозговой жидкости с риском умеренных когнитивных нарушений у лиц без когнитивных нарушений. JAMA Neurol. 76 , 187–193 (2019).
Google Scholar
Зеттерберг, Х. и Бендлин, Б. Б. Биомаркеры болезни Альцгеймера — подготовка к новой эре методов лечения, изменяющих болезнь. Мол. Психиатрия 26 , 296–308 (2020).
Google Scholar
Tarawneh, R. et al. Диагностическая и прогностическая ценность синаптического маркера нейрогранина при болезни Альцгеймера. JAMA Neurol. 73 , 561–571 (2016).
PubMed PubMed Central Google Scholar
Schindler, S. E. et al. Высокоточный плазменный β-амилоид 42/40 позволяет прогнозировать текущий и будущий амилоидоз мозга. Неврология 93 , e1647 – e1659 (2019).
CAS PubMed PubMed Central Google Scholar
Karikari, T. K. et al.Фосфорилирование тау-181 в крови в качестве биомаркера болезни Альцгеймера: исследование диагностической эффективности и прогнозирования с использованием данных четырех предполагаемых когорт. Ланцет нейрол. 19 , 422–433 (2020).
CAS Google Scholar
Palmqvist, S. et al. Различительная точность плазменного фосфо-тау-217 при болезни Альцгеймера по сравнению с другими нейродегенеративными расстройствами. JAMA 324 , 772–781 (2020).
CAS Google Scholar
de Wolf, F. et al. Уровни тау-белка в плазме, легкой цепи нейрофиламентов и β-амилоида и риск деменции; популяционное когортное исследование. Мозг 143 , 1220–1232 (2020).
PubMed PubMed Central Google Scholar
Ashton, N.J. et al. Обновленная информация о биомаркерах крови для нейродегенеративных расстройств, не связанных с болезнью Альцгеймера. Nat. Rev. Neurol. 16 , 265–284 (2020).
Google Scholar
Ваттмо, К. и Валлин А., К. Раннее и позднее начало болезни Альцгеймера в клинической практике: когнитивные и глобальные результаты за 3 года. Alzheimers Res. Ther. 9 , 70 (2017).
PubMed PubMed Central Google Scholar
Уилсон, Р.S. et al. Снижение когнитивных функций при возникновении болезни Альцгеймера среди местного населения. Неврология 74 , 951–955 (2010).
CAS PubMed PubMed Central Google Scholar
van Harten, A.C. et al. Субъективное снижение когнитивных функций и риск MCI: исследование старения Mayo Clinic. Неврология 91 , e300 – e312 (2018).
PubMed PubMed Central Google Scholar
Kryscio, R.J. et al. Жалобы на память, сообщаемые самими пациентами: выводы из продольной когорты с аутопсией. Неврология 83 , 1359–1365 (2014).
PubMed PubMed Central Google Scholar
Stewart, R. et al. Продольная нейровизуализация коррелятов нарушения субъективной памяти: 4-летнее проспективное исследование сообщества. руб. J. Psychiatry 198 , 199–205 (2011).
Google Scholar
Amariglio, R.E. et al. Субъективные когнитивные жалобы и амилоидная нагрузка у когнитивно нормальных пожилых людей. Neuropsychologia 50 , 2880–2886 (2012).
PubMed PubMed Central Google Scholar
Petersen, R.C. et al. Рандомизированные контролируемые испытания при легких когнитивных нарушениях: источники вариабельности. Неврология 88 , 1751–1758 (2017).
PubMed PubMed Central Google Scholar
Roberts, R.O. et al. Распространенность и исходы положительного амилоида среди лиц без деменции в продольных, популяционных условиях. JAMA Neurol. 75 , 970–979 (2018).
PubMed PubMed Central Google Scholar
Vos, S.J. et al. Распространенность и прогноз болезни Альцгеймера на стадии легких когнитивных нарушений. Мозг 138 , 1327–1338 (2015).
PubMed PubMed Central Google Scholar
Jack, C.R. Jr. et al. Связь профилей амилоида, тау-белка и биомаркеров нейродегенерации со скоростью снижения памяти у лиц без деменции. JAMA 321 , 2316–2325 (2019).
CAS PubMed PubMed Central Google Scholar
Knopman, D. S. et al.Тау энторинальной коры, амилоид-β, толщина коры и производительность памяти у субъектов без деменции. Мозг 142 , 1148–1160 (2019).
PubMed PubMed Central Google Scholar
Vos, S.J. et al. Доклиническая болезнь Альцгеймера и ее исход: продольное когортное исследование. Ланцет нейрол. 12 , 957–965 (2013).
PubMed PubMed Central Google Scholar
Серрано-Позо, А., Цян, Дж., Монселл, С. Е., Бетенски, Р. А. и Хайман, Б. Т. APOEε2 ассоциирован с более легкой клинической и патологической болезнью Альцгеймера. Ann. Neurol. 77 , 917–929 (2015).
CAS PubMed PubMed Central Google Scholar
Craft, S. et al. Ускоренное снижение числа гомозигот аполипопротеина E-epsilon4 с болезнью Альцгеймера. Неврология 51 , 149–153 (1998).
CAS Google Scholar
Butler, M. et al. Вмешательства, отпускаемые без рецепта, для предотвращения снижения когнитивных функций, легких когнитивных нарушений и клинической деменции альцгеймеровского типа: систематический обзор. Ann. Междунар. Med. 168 , 52–62 (2018).
Google Scholar
Fink, H.A. et al. Фармакологические вмешательства для предотвращения снижения когнитивных функций, легких когнитивных нарушений и клинической деменции типа Альцгеймера: систематический обзор. Ann. Междунар. Med. 168 , 39–51 (2018).
Google Scholar
Brasure, M. et al. Вмешательства при физической активности для предотвращения снижения когнитивных функций и деменции альцгеймеровского типа: систематический обзор. Ann. Междунар. Med. 168 , 30–38 (2018).
Google Scholar
Kane, R. L. et al. в Вмешательствах по предотвращению возрастного когнитивного спада, легких когнитивных нарушений и клинической деменции типа Альцгеймера (Агентство медицинских исследований и качества, 2017).
Ngandu, T. et al. Двухлетнее мультидоменное вмешательство в виде диеты, физических упражнений, когнитивных тренировок и мониторинга сосудистого риска по сравнению с контролем для предотвращения снижения когнитивных функций у пожилых людей из группы риска (FINGER): рандомизированное контролируемое исследование. Ланцет 385 , 2255–2263 (2015). Первая демонстрация немедикаментозных средств замедления когнитивного снижения у пожилых людей с риском деменции.
PubMed Google Scholar
Debette, S. et al. Воздействие факторов риска сосудов среднего возраста ускоряет структурное старение мозга и снижение когнитивных функций. Неврология 77 , 461–468 (2011).
CAS PubMed PubMed Central Google Scholar
Williamson, J. D. et al. Влияние интенсивного и стандартного контроля артериального давления на вероятную деменцию: рандомизированное клиническое исследование. JAMA 321 , 553–561 (2019).
PubMed PubMed Central Google Scholar
Reuben, D. B. et al. D-CARE: исследование помощи при деменции: дизайн прагматического исследования эффективности и рентабельности лечения деменции на базе системы здравоохранения в сравнении с лечением деменции на уровне сообщества по сравнению с обычным лечением деменции. J. Am. Гериатр. Soc. 68 , 2492–2499 (2020).
Google Scholar
Фиск, Дж. Д., Битти, Б. Л., Доннелли, М., Бышевски, А. и Мольнар, Ф. Дж. Раскрытие диагноза деменции. Демент Альцгеймера. 3 , 404–410 (2007).
Google Scholar
Alpinar-Sencan, Z. & Schicktanz, S. Решение этических проблем раскрытия информации при прогнозировании деменции: ограничения действующих руководств и предложения, которые необходимо продолжить. BMC Med. Этика 21 , 33 (2020).
PubMed PubMed Central Google Scholar
Amieva, H. et al. Групповая и индивидуальная когнитивная терапия при болезни Альцгеймера: рандомизированное исследование ETNA3. Внутр. Психогериатр. 28 , 707–717 (2016).
Google Scholar
Tricco, A.C. et al. Сравнение вмешательств по профилактике падений у пожилых людей: систематический обзор и метаанализ. JAMA 318 , 1687–1699 (2017).
PubMed PubMed Central Google Scholar
Mohs, R.C. et al. 1-летнее плацебо-контролируемое исследование сохранения функции выживания донепезила у пациентов с БА. Неврология 57 , 481–488 (2001).
CAS Google Scholar
Панза, Ф., Лозупоне, М., Логрошино, Г.& Имбимбо, Б. П. Критическая оценка терапии, направленной на амилоид-β, при болезни Альцгеймера. Nat. Rev. Neurol. 15 , 73–88 (2019).
Google Scholar
Роджерс М. Б. https://www.alzforum.org/news/research-news/aducanumab-still-needs-prove-itself-researchers-say (2020).
Mintun, M. A. et al. Донанемаб при ранней болезни Альцгеймера. N. Engl. J. Med .https://doi.org/10.1056/NEJMoa2100708 (2021 г.).
Шугарт, Дж. Https://www.alzforum.org/news/conference-coverage/banish-av-ban2401-antibody-makes-its-move-phase-3-program (2020).
ВандеВреде, Л., Боксер, А. Л. и Полидоро, М. Ориентация на тау: клинические испытания и новые терапевтические подходы. Neurosci. Lett. 731 , 134919 (2020).
CAS Google Scholar
Риос-Роменец, С. и др. Исходные демографические, клинические и когнитивные характеристики исследования аутосомно-доминантной болезни Альцгеймера в Колумбийском исследовании инициативы по профилактике Альцгеймера (API). Демент Альцгеймера 16 , 1023–1030 (2020).
PubMed PubMed Central Google Scholar
Insel, P. S., Donohue, M. C., Sperling, R., Hansson, O. & Mattsson-Carlgren, N. Исследование A4: β-амилоид и когнитивные способности у 4432 взрослых с когнитивными нарушениями. Ann. Clin. Пер. Neurol. 7 , 776–785 (2020).
CAS PubMed PubMed Central Google Scholar
Ballard, C. et al. Оценка безопасности, переносимости и эффективности пимавансерина по сравнению с плацебо у пациентов с психозом, вызванным болезнью Альцгеймера: рандомизированное плацебо-контролируемое двойное слепое исследование фазы 2. Ланцет нейрол. 17 , 213–222 (2018).
CAS Google Scholar
Jennings, L.A. et al. Цели пациентов и лиц, осуществляющих уход, при лечении деменции. Qual. Life Res. 26 , 685–693 (2017).
Google Scholar
Bannon, S. et al. В нем вместе: качественный мета-синтез общих и уникальных психосоциальных стрессоров и адаптивных стратегий выживания людей с деменцией с ранним началом и их опекунов. Геронтолог https://doi.org/10.1093/geront/gnaa169 (2020).
Артикул Google Scholar
Мун, Х. и Адамс, К. Б. Эффективность диадических вмешательств для людей с деменцией и лиц, ухаживающих за ними. Деменция 12 , 821–839 (2013).
Google Scholar
van Charante, E. P. et al. Эффективность 6-летнего мультидоменного вмешательства по лечению сосудов для предотвращения деменции (preDIVA): кластерное рандомизированное контролируемое исследование. Ланцет 388 , 797–805 (2016).
Google Scholar
Andrieu, S. et al. Влияние длительного приема полиненасыщенных жирных кислот омега-3 с мультидоменным вмешательством или без него на когнитивные функции у пожилых людей с жалобами на память (MAPT): рандомизированное плацебо-контролируемое исследование. Ланцет нейрол. 16 , 377–389 (2017).
CAS Google Scholar
Раковина, К. М. и др. Влияние 24-месячного вмешательства в отношении физической активности в сравнении с санитарным просвещением на когнитивные исходы у пожилых людей, ведущих малоподвижный образ жизни: рандомизированное исследование жизни. JAMA 314 , 781–790 (2015).
CAS PubMed PubMed Central Google Scholar
Де Ягер, П. Л., Янг, Х. С. и Беннетт, Д. А. Деконструкция и нацеливание на геномную архитектуру нейродегенерации человека. Nat.Neurosci. 21 , 1310–1317 (2018).
PubMed PubMed Central Google Scholar
Rehiman, S.H. et al. Протеомика как надежный подход к открытию биомаркеров болезни Альцгеймера в крови: систематический обзор и метаанализ. Aging Res. Ред. 60 , 101066 (2020).
CAS PubMed PubMed Central Google Scholar
Mahajan, U. V. et al. Нарушение регуляции множественных метаболических сетей, связанных с трансметилированием мозга и путями полиаминов при болезни Альцгеймера: целевое метаболомное и транскриптомное исследование. PLoS Med. 17 , e1003012 (2020).
CAS PubMed PubMed Central Google Scholar
Доусон, Т. М., Голд, Т. Э. и Лагье-Туренн, С. Модели нейродегенеративных заболеваний на животных. Nat.Neurosci. 21 , 1370–1379 (2018).
CAS PubMed PubMed Central Google Scholar
van der Kant, R. et al. Метаболизм холестерина — это лекарственная ось, которая независимо регулирует тау и амилоид-β в нейронах болезни Альцгеймера, происходящих от ИПСК. Cell Stem Cell 24 , 363–375.e9 (2019).
PubMed PubMed Central Google Scholar
Американская психиатрическая ассоциация. DSM-5: Диагностическое и статистическое руководство по психическим расстройствам 5-е изд. (Американская психиатрическая ассоциация, 2013 г.).
Albert, M. et al. Диагноз легкого когнитивного нарушения, вызванного болезнью Альцгеймера: рекомендации рабочих групп Национального института старения — Ассоциации Альцгеймера по диагностическим руководствам по болезни Альцгеймера. Демент Альцгеймера. 7 , 270–279 (2011).
Google Scholar
Dubois, B. et al. Совершенствование исследовательских диагностических критериев болезни Альцгеймера: критерии IWG-2. Ланцет нейрол. 13 , 614–629 (2014).
PubMed PubMed Central Google Scholar
Тал, Д. Р., Руб, У., Орантес, М. и Браак, Х. Фазы отложения Aβ в мозге человека и его значение для развития БА. Неврология 58 , 1791–1800 (2002).
PubMed Google Scholar
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
% PDF-1.4 % 1 0 объект > эндобдж 5 0 obj > эндобдж 2 0 obj > поток 2012-05-23T20: 53: 15-05: 00AH Formatter V5.0 MR2a (5,0,2009,0623) для Linux2013-09-25T16: 41: 42 + 01: 002013-09-25T16: 41: 42+ 01: 00Antenna House PDF Output Library 2.6.0 (Linux) Falseapplication / pdfuuid: 5a86967f-8eaf-4bd5-a275-dea31420cadauuid: db4aabb0-6f3e-45ef-ae39-a37dfd7cb32b конечный поток эндобдж 3 0 obj > эндобдж 4 0 объект > эндобдж 6 0 obj > эндобдж 7 0 объект > эндобдж 8 0 объект > эндобдж 9 0 объект > / XObject> >> / Аннотации [38 0 R 39 0 R 40 0 R] / Родитель 7 0 R / MediaBox [0 0 595 842] >> эндобдж 10 0 obj > / ProcSet [/ PDF / Text / ImageC] / XObject> >> / Повернуть 0 / Тип / Страница >> эндобдж 11 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 12 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 13 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 14 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 15 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 16 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 17 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 18 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 19 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 20 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 21 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 22 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 23 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 24 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 25 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 26 0 объект > / Шрифт> / ProcSet [/ PDF / Text / ImageC] / XObject> >> / Повернуть 0 / Тип / Страница >> эндобдж 27 0 объект > / Шрифт> / ProcSet [/ PDF / Text / ImageC] / XObject> >> / Повернуть 0 / Тип / Страница >> эндобдж 28 0 объект > / Шрифт> / ProcSet [/ PDF / Text / ImageC] / XObject> >> / Повернуть 0 / Тип / Страница >> эндобдж 29 0 объект > / Шрифт> / ProcSet [/ PDF / Text / ImageC] / XObject> >> / Повернуть 0 / Тип / Страница >> эндобдж 30 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 31 0 объект > / ProcSet [/ PDF / Text / ImageC] >> / Повернуть 0 / Тип / Страница >> эндобдж 32 0 объект > эндобдж 33 0 объект > поток xUMsH + d0> nL \ N | n \ FR # M, 3 # ~ {o * EA ׯ_ {O ‘$ `pss dai: -n \ w / 0bC ս lE / l 蝽 F23Z0WJʴBJ.





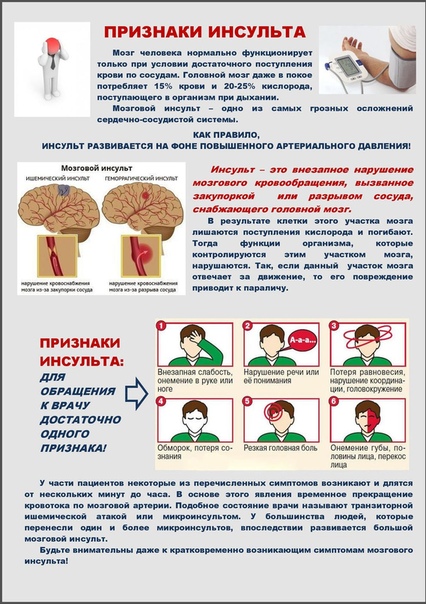 Но это не значит, что к атаке можно относиться легкомысленно: она часто является предвестником более обширной закупорки. Если вовремя не предпринять необходимые меры, последствия могут остаться на всю жизнь.
Но это не значит, что к атаке можно относиться легкомысленно: она часто является предвестником более обширной закупорки. Если вовремя не предпринять необходимые меры, последствия могут остаться на всю жизнь. Все это может привести к микроинсульту.
Все это может привести к микроинсульту. При поражении мозговых капилляров улыбка будет «свисать» с одной стороны из-за повреждения лицевого нерва.
При поражении мозговых капилляров улыбка будет «свисать» с одной стороны из-за повреждения лицевого нерва.