Микроинсульт ишемический: симптомы, лечение ~ 【Диагностика в Киеве】
Что такое микроинсульт?
Содержание:
- Что такое микроинсульт?
- Что происходит после микроинсульта?
- Серьезны ли ТИА?
- Как называются микроинсульты в головном мозге?
- Выявляются ли микроинсульты на МРТ?
- Как остановить дальнейшие ТИА?
- Как определить, что у меня микроинсульт?
- Можете ли вы определить, была ли у кого-то ТИА?
- Какова наиболее частая причина ТИА?
- Чувствуете кровоизлияние в мозг?
- Могут ли врачи определить, был ли у вас микроинсульт?
- Почему жертвы инсульта такие злые?
Что такое микроинсульт?
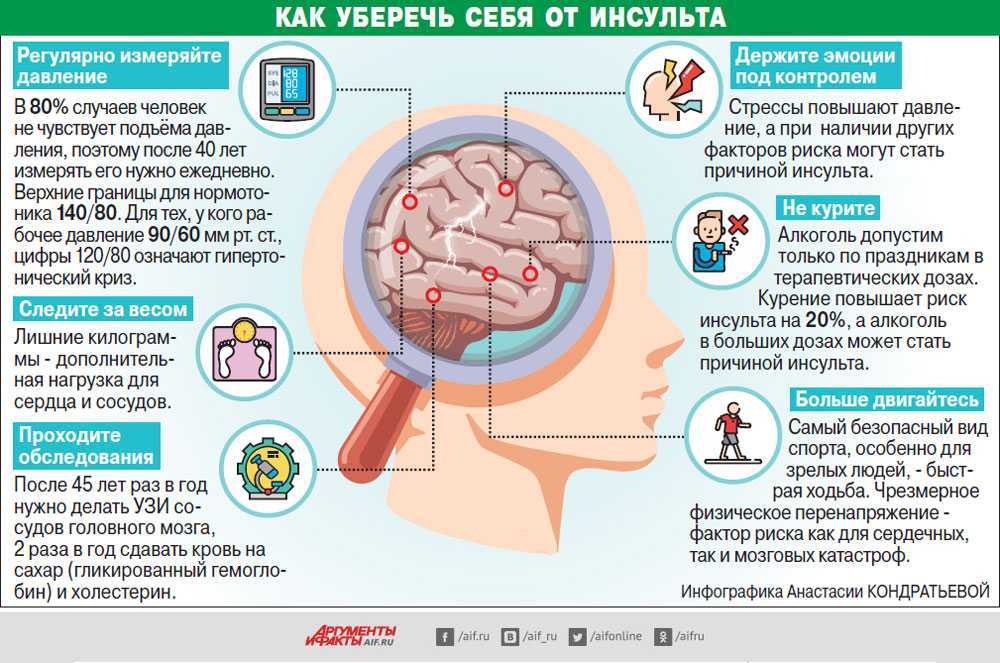
Микроэмболия — это небольшая частица, часто сгусток крови, которая захватывается во время движения по кровотоку и может вызвать закупорку кровеносного сосуда . Когда многие из них возникают в кровеносных сосудах головного мозга, они известны как церебральные микроэмболы.
Что происходит после микроинсульта?
Серьезны ли ТИА?
ТИА выглядят как инсульты с точки зрения признаков и симптомов, но они носят временный характер. Другими словами, они не оставляют длительного повреждения головного мозга или остаточных симптомов. Однако они служат предупреждающим знаком, что человек подвержен повышенному риску большого инсульта и должен немедленно обратиться за медицинской помощью.
Как называются мини-инсульты в головном мозге?
Транзиторную ишемическую атаку (ТИА) иногда называют «мини-инсультом». Он отличается от основных типов инсульта тем, что приток крови к мозгу блокируется лишь на короткое время — обычно не более 5 минут.
Выявляются ли микроинсульты на МРТ?
Его часто называют «мини-инсультом». После ТИА проводится КТ или МРТ, чтобы исключить инсульт или другие причины ваших симптомов. ТИА нельзя увидеть на КТ или МРТ , в отличие от инсульта, при котором изменения могут быть видны на этих снимках.
Как остановить дальнейшие ТИА?
Профилактика
- Не курите. Отказ от курения снижает риск ТИА или инсульта.
- Ограничьте уровень холестерина и жиров. …
- Ешьте много фруктов и овощей. …
- Ограничение содержания натрия. …
- Регулярно занимайтесь спортом. …
- Ограничьте потребление алкоголя. …
- Поддерживайте здоровый вес. …
- Не употребляйте запрещенные наркотики.
Как определить, что у меня микроинсульт?
Наиболее распространенными симптомами легкого инсульта являются:
- дисфазия, нарушение речи.

- дизартрия или физические трудности при разговоре.
- изменения зрения.
- путаница.
- проблемы с балансом.
- покалывание.
- измененный уровень сознания.
- головокружение.
Можете ли вы определить, была ли у кого-то ТИА?
Признаки и симптомы ТИА напоминают те, которые обнаруживаются на ранних стадиях инсульта, и могут включать внезапное начало: Слабости, онемения или паралича лица , руки или ноги, как правило, на одной стороне тела. Невнятная или искаженная речь или трудности с пониманием других. Слепота на один или оба глаза или двоение в глазах.
Какова наиболее частая причина ТИА?
Закупорка кровеносных сосудов, ответственная за большинство ТИА, обычно вызывается

Чувствуете кровоизлияние в мозг?
В целом симптомы кровоизлияния в мозг могут включать: Внезапное покалывание, слабость, онемение или паралич лица, руки или ноги , особенно на одной стороне тела. Головная боль. (При субарахноидальном кровоизлиянии возникает внезапная сильная головная боль типа «раскат грома».)
Могут ли врачи определить, был ли у вас микроинсульт?
Единственный способ определить разницу между микроинсультом и инсультом — попросить врача просмотреть изображение вашего мозга с помощью КТ или МРТ . Если у вас был инсульт, вполне вероятно, что он не будет виден на компьютерной томографии вашего мозга в течение 24–48 часов. МРТ обычно показывает инсульт раньше.
Почему жертвы инсульта такие злые?
» Гнев и агрессия , по-видимому, является поведенческим симптомом, вызванным растормаживанием импульсного контроля, который является вторичным по отношению к поражениям головного мозга, хотя он может быть вызван поведением других людей или физическими недостатками.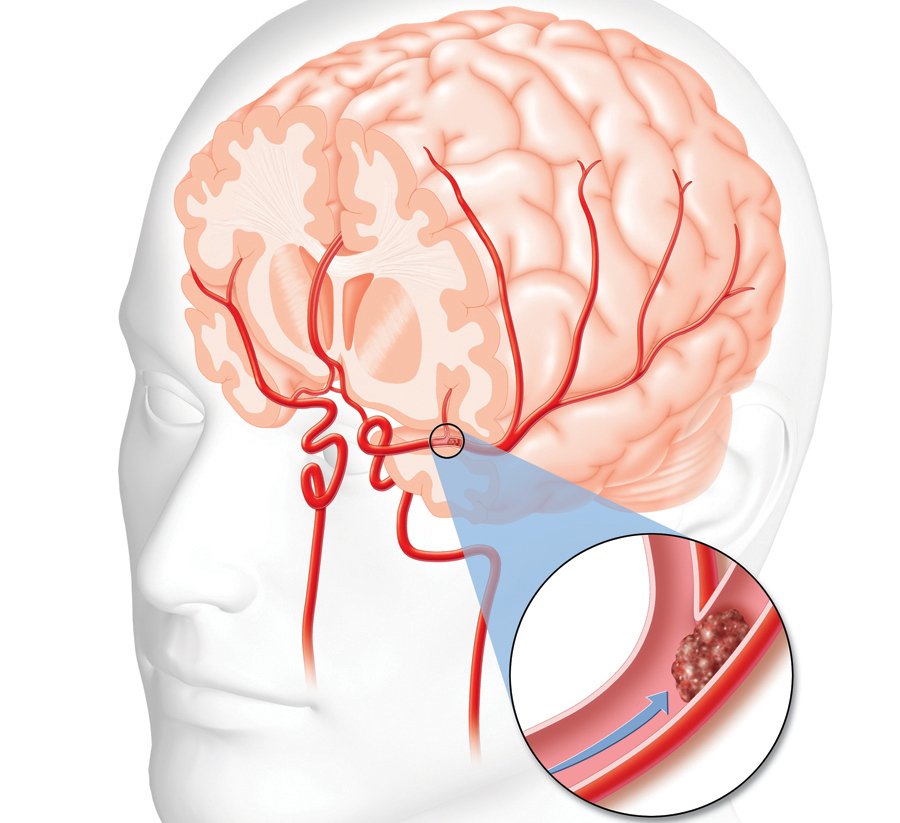 » Ким сказал, что гнев и агрессия, а также другие симптомы, характерные для выздоравливающих пациентов после инсульта, — это «…
» Ким сказал, что гнев и агрессия, а также другие симптомы, характерные для выздоравливающих пациентов после инсульта, — это «…
Ранний риск инсульта после транзиторной ишемической атаки у больных с поражением внутренней сонной артерии
СМАЖ. 2004 г., 30 марта; 170 (7): 1105–1109.
doi: 10.1503/cmaj.1030460
Майкл Элиазив, Джеймс Кеннеди, Майкл Д. Хилл, Аластер М. Бьюкен, Генри Дж. М. Барнетт и для Североамериканской группы исследований симптоматической каротидной эндартерэктомии (NASCET)
Информация об авторе Авторские права и Информация о лицензии Отказ от ответственности
Исходная информация
Транзиторные ишемические атаки (ТИА) часто предвещают инсульт, но мало что известно об остром естественном течении ТИА. Нашей целью было количественно оценить ранний риск инсульта после ТИА у пациентов с поражением внутренней сонной артерии.
Методы
Используя данные пациентов из медицинской части Североамериканского исследования симптоматической каротидной эндартерэктомии, мы рассчитали риск ипсилатерального инсульта в области симптоматической внутренней сонной артерии в течение 2 и 90 дней после первой зарегистрированной полушарной ТИА. Мы также изучили аналогичные исходы среди пациентов в исследовании, у которых впервые был зарегистрирован завершенный полушарный инсульт.
Мы также изучили аналогичные исходы среди пациентов в исследовании, у которых впервые был зарегистрирован завершенный полушарный инсульт.
Результаты
Для пациентов с впервые зарегистрированной ТИА полушария ( n = 603), 90-дневный риск ипсилатерального инсульта составил 20,1% (95% доверительный интервал [ДИ] 17,0–23,2%), выше, чем риск 2,3% (95% ДИ 1,0%–3,6%) для больных с полушарным инсультом ( n = 526). 2-дневные риски составили 5,5% и 0,0% соответственно. Пациенты с более тяжелым стенозом внутренней сонной артерии (> 70%) не подвергались большему риску инсульта, чем пациенты с меньшей степенью стеноза (скорректированное отношение рисков 1,1, 95% ДИ 0,7–1,7). Инфаркт при визуализации головного мозга (скорректированный коэффициент риска 2,1, 95% ДИ 1,5–3,0) и наличие внутричерепного поражения крупных артерий (скорректированный коэффициент риска 1,9, 95% ДИ 1,3–2,7) удвоили ранний риск инсульта у пациентов с полушарной ТИА.
Интерпретация
Пациенты с полушарной ТИА, связанной с поражением внутренней сонной артерии, имели высокий риск инсульта в первые несколько дней после ТИА. Ранний риск инсульта не зависел от степени стеноза внутренней сонной артерии.
Ранний риск инсульта не зависел от степени стеноза внутренней сонной артерии.
Транзиторная ишемическая атака (ТИА) — это распространенное неврологическое состояние, которое наблюдается у всех групп врачей, включая семейных врачей и врачей скорой помощи, терапевтов, сосудистых хирургов и неврологов. В Канаде полмиллиона взрослых в возрасте 18 лет и старше были диагностированы с ТИА.
Атеросклеротическое поражение сонных артерий вне полости черепа уже давно признано наиболее частым источником эмболов, которые затем попадают в мозг, вызывая инсульт. 2 , 3 , 4 ТИА часто являются ранними предвестниками атеросклеротического заболевания. Около 10% пациентов с ТИА, поступивших в отделения неотложной помощи Калифорнии, вернулись в отделение неотложной помощи с инсультом в течение 9 лет.
Несмотря на несколько крупных исследований по профилактике инсульта среди пациентов с ТИА 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 представили некоторые данные о риске инсульта от ранее существовавшего атеросклеротического заболевания сонных артерий, они ограничены, поскольку включение в испытания было задержано на 1 или более месяцев после ТИА.
На примере пациентов из медицинской части Североамериканского исследования симптоматической каротидной эндартерэктомии (NASCET) мы описываем ранний риск инсульта у большого числа пациентов с ТИА, у которых заболевание внутренней сонной артерии было единственной предполагаемой причиной .
NASCET — это рандомизированное многоцентровое клиническое исследование, предназначенное для определения эффективности каротидной эндартерэктомии у пациентов с ишемическими симптомами, связанными с поражением внутренней сонной артерии. Пациенты включались в исследование, если у них была ТИА сетчатки или полушария или завершенный ишемический инсульт сетчатки или полушария в течение 180 дней до рандомизации.
С декабря 1987 г. по декабрь 1996 г. пациенты были рандомизированы в группу наилучшей современной медицинской помощи ( Пациенты с инвалидизирующим инсультом до рандомизации также были исключены.
Пациенты с инвалидизирующим инсультом до рандомизации также были исключены.
Все пациенты прошли детальное медицинское обследование в начале исследования, включая эхокардиографию и рентгенографию органов грудной клетки. Перед рандомизацией выполняли КТ или МРТ головного мозга, чтобы определить наличие инфарктов и исключить структурные поражения, которые могли вызвать симптомы, подобные инсульту. Степень стеноза внутренней сонной артерии измеряли по стандартной каротидной ангиограмме с использованием строгих критериев. 24 Наблюдение за пациентами состояло из клинических осмотров через 30 дней, через 3, 6, 9 дней.и 12 месяцев, а затем каждые 4 месяца.
Сбор данных для этого исследования включал личное интервью с пациентом, в ходе которого регистрировались все ишемические события, произошедшие в течение 180 дней до рандомизации. Клинические данные об ишемических событиях, включая тип, продолжительность и количество, были собраны участвующим неврологом в рамках протокола исследования. Письменный рассказ истории болезни пациента был включен в форму отчета о болезни. После сбора данных все события были тщательно изучены менеджерами медицинских данных испытания и специалистами по инсульту и согласованы с письменным описанием.
Письменный рассказ истории болезни пациента был включен в форму отчета о болезни. После сбора данных все события были тщательно изучены менеджерами медицинских данных испытания и специалистами по инсульту и согласованы с письменным описанием.
Территория и тип инсульта (ишемический или геморрагический), возникшие во время наблюдения, были централизованно рассмотрены. Предполагаемую причину каждого ишемического инсульта обозначали как крупноартериальный, лакунарный или кардиоэмболический. Определение лакунарных инсультов основывалось на соответствии 5 классическим лакунарным синдромам с наличием или отсутствием глубоких очагов не более 1 см в диаметре, видимых при КТ головного мозга. 25 Кардиоэмболические инсульты определяли с использованием комбинации клинических и эхокардиографических критериев. 26 Ишемические инсульты, которые не были лакунарными или кардиоэмболическими, классифицировались как инсульты крупных артерий.
Это исследование отличается от предыдущих отчетов NASCET тем, что мы решили измерять время и подсчитывать события с даты первого зарегистрированного ишемического события, а не с даты рандомизации, и мы исключили пациентов с первым зарегистрированным ишемическим поражением сетчатки. событие, потому что мы сосредоточены на церебральной ишемии. О прогнозе у пациентов с ишемией сетчатки сообщалось в другом месте. 27
событие, потому что мы сосредоточены на церебральной ишемии. О прогнозе у пациентов с ишемией сетчатки сообщалось в другом месте. 27
Первичным результатом исследования было возникновение ипсилатерального инсульта в области симптоматической внутренней сонной артерии в течение 90 дней после первого зарегистрированного события. Риск ипсилатерального инсульта оценивали по кривым бессобытийной выживаемости Каплана-Мейера. Различия в безинсультной выживаемости между группами оценивали на статистическую значимость с помощью логрангового теста. Регрессионное моделирование пропорциональных рисков Кокса использовалось для выявления характеристик пациентов, повышающих риск ипсилатерального инсульта среди пациентов с полушарной ТИА. Различия между пропорциями оценивали на статистическую значимость с использованием критерия χ 2 тест. Также изучалась связь между продолжительностью симптомов полушарной ТИА и риском ипсилатерального инсульта.
Из 1449 пациентов, рандомизированных в медицинскую группу исследования, у 320 впервые было зарегистрировано поражение сетчатки (ТИА 252, инсульт 68), и они были исключены из дальнейшего анализа. Из оставшихся 1129 пациентов у 603 (53,4%) была полушарная ТИА, а у 526 (46,6%) был полушарный инсульт в качестве первого зарегистрированного события (1). Средний возраст составил 66,4 года (стандартное отклонение [SD] 8,6), сосудистые факторы риска были общими для обеих групп. Медиана продолжительности полушарной ТИА составила 15 минут (межквартильный размах 5–60 минут; у 72,1% продолжительность составила менее 1 часа, у 7,6% — ≥ 6 часов).
Из оставшихся 1129 пациентов у 603 (53,4%) была полушарная ТИА, а у 526 (46,6%) был полушарный инсульт в качестве первого зарегистрированного события (1). Средний возраст составил 66,4 года (стандартное отклонение [SD] 8,6), сосудистые факторы риска были общими для обеих групп. Медиана продолжительности полушарной ТИА составила 15 минут (межквартильный размах 5–60 минут; у 72,1% продолжительность составила менее 1 часа, у 7,6% — ≥ 6 часов).
Таблица 1
Открыть в отдельном окне
Всего у 133 пациентов был ипсилатеральный инсульт в течение 90 дней после первого зарегистрированного события. 90-дневный риск ипсилатерального инсульта был выше среди пациентов, перенесших полушарную ТИА, чем среди пациентов, перенесших полушарный инсульт (20,1%, 95% доверительный интервал [ДИ] 17,0–23,2% против 2,3%, 95% ДИ 1,0–3,6%, логарифмический критерий 90–159, р < 0,001) (90–160). Около четверти 90-дневного риска инсульта (т.е. 5,5% из 20,1%) приходится на 48 часов после полушарной ТИА.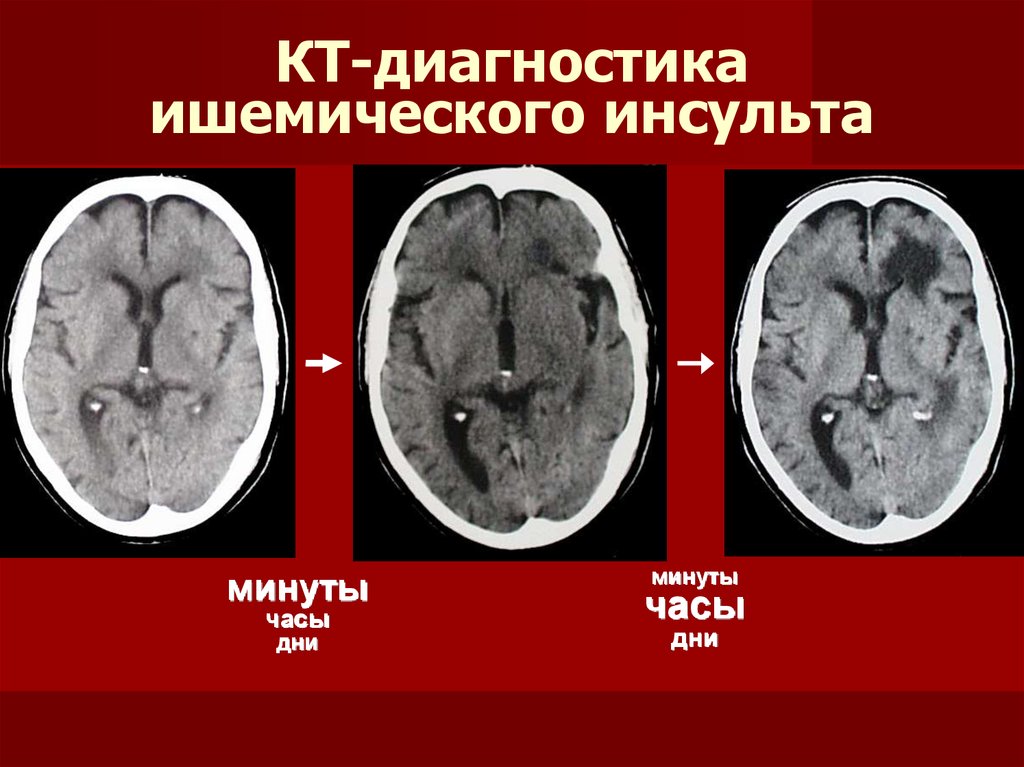 Кривые бессобытийной выживаемости стали параллельными примерно через 60 дней. Геморрагических явлений не было.
Кривые бессобытийной выживаемости стали параллельными примерно через 60 дней. Геморрагических явлений не было.
Открыть в отдельном окне
Рис. 1: Ипсилатеральные кривые Каплана-Мейера без инсульта с даты первой зарегистрированной полушарной транзиторной ишемической атаки (ТИА) или полушарного инсульта.
Хотя в большинстве случаев инсульт был крупноартериального происхождения, у большего числа пациентов в группе полушарной ТИА, чем в группе полушарного инсульта, был лакунарный инсульт (37,2% против 8,3%; χ 2 тест p = 0,043 ). Частота кардиоэмболических инсультов была низкой (0,8% и 0,0% соответственно).
Когда пациенты с полушарной ТИА были стратифицированы по степени стеноза, кривые бессобытийной выживаемости для ипсилатерального инсульта были практически неразличимы (логранговый критерий p = 0,93, ). Ранний риск ипсилатерального инсульта не увеличивался при тяжелом (70-99%) стенозе внутренней сонной артерии (скорректированное отношение рисков 1,1, 95% ДИ 0,7-1,7, ). За исключением инфаркта, видимого при визуализации головного мозга (скорректированный коэффициент риска 2,1, 95% ДИ 1,5–3,0) и наличия внутричерепного поражения крупных артерий (скорректированный коэффициент риска 1,9)., 95% ДИ 1,3–2,7), отношения рисков, связанные с другими характеристиками, были близки к 1. 90-дневный риск ипсилатерального инсульта увеличивался с увеличением продолжительности симптомов у пациентов с полушарной ТИА, но не был статистически значимым (логранговый критерий p = 0,58, тест на тренд p = 0,34, ).
За исключением инфаркта, видимого при визуализации головного мозга (скорректированный коэффициент риска 2,1, 95% ДИ 1,5–3,0) и наличия внутричерепного поражения крупных артерий (скорректированный коэффициент риска 1,9)., 95% ДИ 1,3–2,7), отношения рисков, связанные с другими характеристиками, были близки к 1. 90-дневный риск ипсилатерального инсульта увеличивался с увеличением продолжительности симптомов у пациентов с полушарной ТИА, но не был статистически значимым (логранговый критерий p = 0,58, тест на тренд p = 0,34, ).
Таблица 2
Открыть в отдельном окне
Открыть в отдельном окне
Рис. 3: 90-дневный риск ипсилатерального инсульта в зависимости от длительности ТИА первого полушария. Столбики ошибок = 95% доверительные интервалы.
Открыть в отдельном окне
Рис. 2: Ипсилатеральные кривые Каплана-Мейера без инсульта от даты первой зарегистрированной полушарной ТИА в зависимости от степени стеноза внутренней сонной артерии.
Это исследование показало, что риск ипсилатерального инсульта среди пациентов с симптоматическим поражением внутренней сонной артерии составлял 5,5% в течение первых 2 дней после впервые зарегистрированной полушарной ТИА и 20,1% в первые 90 дней. На 90-дневный риск не влияла степень стеноза. Риск был ниже среди пациентов с впервые зарегистрированным полушарным инсультом, чем среди пациентов с впервые зарегистрированной полушарной ТИА. Примерно у двух третей пациентов, перенесших ипсилатеральный инсульт, инсульт был крупного генеза, в который вовлекалась внутренняя сонная артерия с впервые выявленными симптомами. Причиной была кардиоэмболия в нескольких случаях инсульта, поскольку пациенты с вероятным кардиогенным инсультом были исключены из исследования.
В предыдущем исследовании 5 сообщалось, что пожилой возраст, сахарный диабет и продолжительность симптомов были предикторами раннего инсульта у пациентов с диагнозом ТИА. В нашем исследовании повышенный риск инсульта был в значительной степени связан только с инфарктом, видимым при визуализации головного мозга, и наличием внутричерепного поражения крупных артерий. Риск инсульта действительно увеличивался с увеличением продолжительности симптомов, но результат не достигал статистической значимости. Разница в факторах риска в первую очередь связана с разным составом пациентов в этих исследованиях; в наше исследование были включены только пациенты с симптоматическим поражением внутренней сонной артерии.
Риск инсульта действительно увеличивался с увеличением продолжительности симптомов, но результат не достигал статистической значимости. Разница в факторах риска в первую очередь связана с разным составом пациентов в этих исследованиях; в наше исследование были включены только пациенты с симптоматическим поражением внутренней сонной артерии.
Крупные рандомизированные исследования 23 , 28 , демонстрирующие эффективность каротидной эндартерэктомии при симптоматическом стенозе внутренней сонной артерии, показали положительную связь между степенью стеноза и долгосрочным риском инсульта. В нашем исследовании степень стеноза не влияла на ранний риск инсульта. Таким образом, высокий ранний риск инсульта может быть результатом разрыва бляшки в стенозированной сонной артерии. Однако, если бы это был единственный механизм возникновения инсульта, то риск инсульта был бы таким же для пациентов с завершенным инсультом, как и для пациентов с полушарной ТИА.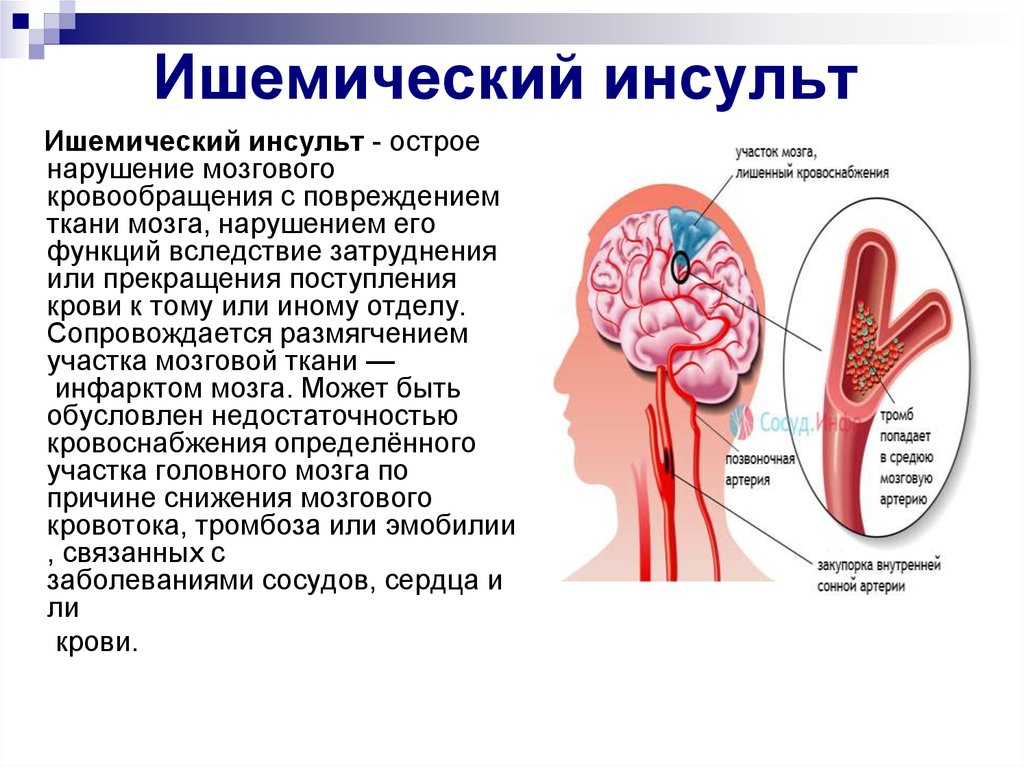 Поразительное несоответствие между двумя группами, наблюдаемое в нашем исследовании, предполагает другие механизмы, которые в настоящее время неясны. Новые методы визуализации могут пролить некоторый свет, сделав возможной точную визуализацию каротидной бляшки и позволив охарактеризовать влияние нестабильности бляшки на риск инсульта. 29 , 30
Поразительное несоответствие между двумя группами, наблюдаемое в нашем исследовании, предполагает другие механизмы, которые в настоящее время неясны. Новые методы визуализации могут пролить некоторый свет, сделав возможной точную визуализацию каротидной бляшки и позволив охарактеризовать влияние нестабильности бляшки на риск инсульта. 29 , 30
Почти у 75% пациентов с полушарной ТИА симптомы длились менее 1 часа. Количество пациентов, у которых симптомы полушарной ТИА сохранялись более 1 часа, уменьшалось со временем, что согласуется с предложенным новым определением ТИА, а именно, чем дольше сохраняются симптомы, тем меньше вероятность их разрешения. 31
Поскольку ТИА является историческим клиническим диагнозом, 32 результаты этого исследования ограничены способностью пациентов вспомнить свои симптомы. Эту трудность разделяют все исследования ТИА. Однако, поскольку неврологи, занимающиеся инсультом, участвовавшие в этом исследовании, специально собирали подробную информацию об ишемических событиях, произошедших за 180 дней до рандомизации, были предприняты все усилия, чтобы свести к минимуму последствия плохой памяти.
В заключение следует отметить, что полушарная ТИА в сочетании с поражением внутренней сонной артерии повышает риск инсульта сразу после появления симптомов поражения артерии. Теперь необходимы согласованные усилия по проведению рандомизированных исследований, посвященных исключительно острой фазе, для определения оптимальных стратегий вмешательства для профилактики инсульта.
β См. соответствующие статьи на стр. 1099, 1113, 1123 и 1134
Это исследование было поддержано грантом R01-NS-24456 Национального института неврологических расстройств и инсульта. Авторы признают поддержку всех участников NASCET. Майкла Элиазива поддержали Национальный институт неврологических расстройств и инсульта, Совет по естественным наукам и инженерным исследованиям Канады и Фонд медицинских исследований Alberta Heritage Foundation. Джеймс Кеннеди получил премию от Canadian Stroke Network, Канадского фонда Heart and Stroke Foundation, Канадских институтов исследований в области здравоохранения и AstraZeneca. Майкл Хилл был поддержан Фондом сердца и инсульта Альберты / Северо-Западных территорий и Канадскими институтами исследований в области здравоохранения. Аластер Бьюкен был поддержан Фондом сердца и инсульта Альберты / Северо-Западных территорий, Фондом медицинских исследований Альберты и Канадскими институтами исследований в области здравоохранения.
Майкл Хилл был поддержан Фондом сердца и инсульта Альберты / Северо-Западных территорий и Канадскими институтами исследований в области здравоохранения. Аластер Бьюкен был поддержан Фондом сердца и инсульта Альберты / Северо-Западных территорий, Фондом медицинских исследований Альберты и Канадскими институтами исследований в области здравоохранения.
Эта статья прошла рецензирование.
Авторы: Майкл Элиасзив разработал исследование, составил рукопись и провел статистический анализ. Джеймс Кеннеди участвовал в разработке исследования, провел обзор литературы и участвовал в написании рукописи. Майкл Хилл участвовал в статистическом анализе, способе представления данных и написании рукописи. Аластер Бьюкен внес свой вклад в написание рукописи, особенно в ее организацию. Генри Барнетт, главный исследователь NASCET, участвовал в разработке и написании рукописи. Все авторы одобрили окончательный вариант рукописи.
Конкурирующие интересы: Не заявлено.
Адрес для корреспонденции: Доктор Аластер М. Бьюкен, отделение клинической неврологии, Университет Калгари, больница Футхиллз, 1403 29-я улица, северо-запад, Калгари, AB T2N 2T9; факс 403 944-1602; ac.yraglacu@nahcuba
1. ТИА/мини-инсульты: общедоступная информация и опыт (исследование Roper Starch Worldwide). Энглвуд (Колорадо): Национальная ассоциация инсульта; 2000.
2. Грейвс Р.Дж. Клинические лекции по практической медицине . Лондон: Общество Нью-Сиденхэма; 1884.
3. Chiari H. Ueber das Verhalten des Teilungswinkels der Carotis communis bei der Endarteriitis Chronic deformans. Verh Dtsch Ges Pathol 1905;9:326-30.
4. Фишер СМ. Окклюзия внутренних сонных артерий. Arch Neurol Psychiatry 1951; 65:346-77. [PubMed]
5. Johnston SC, Gress DR, Browner WS, Sidney S. Краткосрочный прогноз после диагностики ТИА в отделении неотложной помощи. ЯМА 2000;284(22):2901-6. [PubMed]
[PubMed]
6. Whisnant JP, Matsumoto N, Elveback LR. Транзиторные церебральные ишемические атаки в обществе. Mayo Clin Proc 1973;48(3):194-8. [PubMed]
7. Whisnant JP, Wiebers DO, O’Fallon WM, Sicks JD, Frye RL. Влияние времени с момента появления факторов риска на возникновение ишемического инсульта. Неврология 2002; 58(5):787-94. [PubMed]
8. Dennis MS, Bamford JM, Sandercock PA, Warlow CP. Сравнение факторов риска и прогноза транзиторных ишемических атак и малых ишемических инсультов. Инсульт 1989;20(11):1494-9. [PubMed]
9. Bousser MG, Eschwege E, Haguenau M, Lefaucconnier JM, Thibult N, Touboul D, et al. Контролируемое исследование AICLA по применению аспирина и дипиридамола для вторичной профилактики атеротромботической ишемии головного мозга. Инсульт 1983;14(1):5-14. [PubMed]
10. Канадская совместная исследовательская группа. Рандомизированное исследование аспирина и сульфинпиразона при угрозе инсульта. N Engl J Med 1978;299(2):53-9. [PubMed]
[PubMed]
11. Филдс В.С., Лемак Н.А., Франковски Р.Ф., Харди Р.Дж. Контролируемое исследование аспирина при церебральной ишемии. Инсульт 1977;8(3):301-14. [PubMed]
12. Sorensen PS, Pedersen H, Marquardsen J, Petersson H, Heltberg A, Simonsen N, et al. Ацетилсалициловая кислота в профилактике инсульта у пациентов с обратимыми церебральными ишемическими атаками: датское совместное исследование. Ход 1983; 14(1):15-22. [PubMed]
13. Совместная группа SALT. Шведское исследование низких доз аспирина (SALT) 75 мг аспирина в качестве вторичной профилактики после цереброваскулярных ишемических событий. Ланцет 1991;338(8779): 1345-9. [PubMed]
14. Фаррелл Б., Годвин Дж., Ричардс С., Варлоу С. Испытание аспирина при транзиторной ишемической атаке (UK-TIA) в Соединенном Королевстве: окончательные результаты. J Neurol Neurosurge Psychiatry 1991;54(12):1044-54. [Бесплатная статья PMC] [PubMed]
15. Голландская исследовательская группа TIA. Сравнение двух доз аспирина (30 мг против 283 мг в день) у пациентов после транзиторной ишемической атаки или малого ишемического инсульта. N Engl J Med 1991;325(18):1261-6. [ПубМед]
Сравнение двух доз аспирина (30 мг против 283 мг в день) у пациентов после транзиторной ишемической атаки или малого ишемического инсульта. N Engl J Med 1991;325(18):1261-6. [ПубМед]
16. Hass WK, Easton JD, Adams HP Jr., Pryse-Phillips W, Molony BA, Anderson S, et al. Рандомизированное исследование, сравнивающее тиклопидина гидрохлорид с аспирином для профилактики инсульта у пациентов с высоким риском. N Engl J Med 1989; 321 (8): 501-7. [PubMed]
17. Diener H, Cunha L, Forbes C, Sivenius J, Smets P, Lowenthal A. Европейское исследование профилактики инсульта 2. Дипиридамол и ацетилсалициловая кислота для вторичной профилактики инсульта. J Neurol Sci 1996;143(1-2):1-13. [ПубМед]
18. Американо-канадская совместная исследовательская группа. Испытание персантина аспирином при церебральной ишемии. Часть II: Конечные результаты. Ход 1985;16(3):406-15. [PubMed]
19. Барнетт HJM. Транзиторная ишемия головного мозга. Банка Physic Surg Ann R Coll 1974; 7: 154-73.
20. Пессин М.С., Дункан Г.В., Мор Дж.П., Посканцер Д.К. Клинико-ангиографические особенности каротидных транзиторных ишемических атак. N Engl J Med 1977;296(7):358-62. [ПубМед]
21. Мор Дж. П., Готье Дж. К., Пессин М. С. Заболевание внутренней сонной артерии. В: Barnett HJM, Mohr JP, Stein BM, Yatsu FM, редакторы. Инсульт: патофизиология, диагностика и лечение . Нью-Йорк: Черчилль-Ливингстон; 1998. с. 355-400.
22. Руководящий комитет НАСКЕТ. Североамериканское исследование симптоматической каротидной эндартерэктомии: методы, пациенты, характеристики и прогресс. Ход 1991;22(6):711-20. [PubMed]
23. Barnett HJM, Taylor DW, Eliasziw M, Fox AJ, Ferguson GG, Haynes RB, et al. Преимущество каротидной эндартерэктомии у пациентов с симптоматическим умеренным или тяжелым стенозом. Североамериканские участники исследования симптоматической каротидной эндартерэктомии N Engl J Med 1998;339(20):1415-25. [PubMed]
24. Фокс А.Дж. Как измерить стеноз сонной артерии. Радиология 1993;186(2):316-8. [PubMed]
Фокс А.Дж. Как измерить стеноз сонной артерии. Радиология 1993;186(2):316-8. [PubMed]
25. Inzitari D, Eliasziw M, Sharpe BL, Fox AJ, Barnett HJ. Факторы риска и исходы у больных со стенозом сонных артерий с лакунарным инсультом. Неврология 2000;54(3):660-6. [PubMed]
26. Barnett HJM, Gunton RW, Eliasziw M, Fleming L, Sharpe B, Gates P, et al. Причины и тяжесть ишемического инсульта у больных со стенозом внутренней сонной артерии. JAMA 2000;283(11):1429-36. [PubMed]
27. Benavente O, Eliasziw M, Streifler JY, Fox AJ, Barnett HJ, Meldrum H, et al. Прогноз после транзиторной монокулярной слепоты, связанной со стенозом сонных артерий. N Engl J Med 2001;345(15):1084-90. [PubMed]
28. Рандомизированное исследование эндартерэктомии при недавно появившемся стенозе сонных артерий: окончательные результаты Европейского исследования хирургии сонных артерий MRC (ECST). Ланцет 1998; 351 (9113): 1379-87. [ПубМед]
29.