Микроинсульт головного мозга: симптомы, лечение ~ 【Диагностика в Киеве】
Микроинсульт: Предвестник аварии головного мозга
Как же распознать опасность и вовремя спастись? О микроинсультах расскажет заместитель директора НЦН (научный центр неврологии), доктор и профессор в области медицины, госпожа Маринэ Танашян.
Инсульт принято называть не иначе как удар. Ведь он приходит мгновенно, словно «молния», ниоткуда. Но часто перед приходом он посылает сигналы нашему организму, пытается предупредить о катастрофе. В народе подобные сигналы именуются как микроинсульт, а медработники приняли для себя другое название – малые инсульты. Как же распознать смертельную хворь и спастись?
Принято считать, что обширный инсульт более опасен, несет больший удар на здоровье человека. Но недооценивать приступ микроинсульта не стоит. Не закрывайте на него глаза.
Приступ микроинсульта происходит мгновенно, но след от него остается заметный
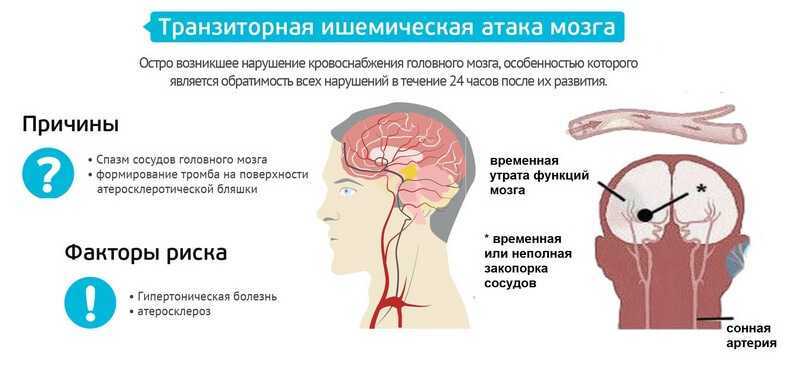
Если поискать в медицинских справочниках значение микроинсульта, то найти вам ничего не удастся, так как это не официальное название болезни. Докторам удобно говорить, что заболевание включает в себя переходящее нарушение кровотока в мозгу или же транзиторные ишемические атаки. Возникают они вследствие спазмов кровеносных сосудов головы или их закупорки тромбами. В результате получается частичная закупорка кровеносных сосудов.
Докторам удобно говорить, что заболевание включает в себя переходящее нарушение кровотока в мозгу или же транзиторные ишемические атаки. Возникают они вследствие спазмов кровеносных сосудов головы или их закупорки тромбами. В результате получается частичная закупорка кровеносных сосудов.
Подписывайтесь на наш youtube канал!
При малом инсульте наблюдаются те же признаки, что и при приступе обширного инсульта. Вы будете ощущать кружение головы, речь будет не сложенной, отсутствие силы в руках и ногах, а также их затекание. Но разница между этими симптомами в том, что они длятся, небольшое количество времени (несколько минут или пару часов). И как нам кажется, по их окончанию мы не видим никаких изменений в нашем общем состоянии.
Но отпечаток на здоровье от микроинсультов все-таки остается. И это доказано при помощи нейровизуализаций. По результатам проведенных исследований на магнитно-резонасной томографии (МРТ) или на компьютерной томографии (КТ) было обнаружено изменения веществ головного мозга, которые возникли в результате кратковременных сосудистых нарушений. Выходя из этого, лечить малый инсульт нужно теми же средствами, что и обширный инсульт.
Выходя из этого, лечить малый инсульт нужно теми же средствами, что и обширный инсульт.
Симптомы микроинсульта
-
Мгновенная утрата чутья, затекание участков тела (рука, нога).
-
Возникновение проблем с координацией движений.
-
Трудности во время ходьбы.
-
Нарушение выговора слов.
-
Проблемы с памятью.
-
Завышенная реакция на звуки и яркий свет.
-
Резкая боль в области головы, которая возникает, без каких-либо на то причин.
Как избежать последствий микроинсульта
При первых появлениях симптомов заболевания нужно обратиться за помощью в больницу. Не тратьте свое время на самолечение, если не хотите осложнений — у вас есть в запасе четыре с половиной часа. Это то время, при котором можно избавиться от малого инсульта, не нанеся ущерб здоровью. Доктора называют этот период – терапевтическим окном.
Доктора называют этот период – терапевтическим окном.
Во время обследования в больнице вам должны сделать магнитно-резонансную томографию, ультразвуковую диагностику головы, и необходимые анализы, а также исследовать работу сердца. По этим фактам можно будет говорить, рискует ли пациент получить обширный инсульт. А процент риска очень велик — где-то в районе шестидесяти процентов от числа всех больных, которые перенесли малый инсульт.
И эти цифры соответствуют учету данных, которые проводились по всей стране. После этих процедур доктор назначит вам медикаментозное лечение, которое нормализует кровоток головы. Последним этапом будет установление причины возникновения заболевания.
Факторы, которые провоцируют микроинсульт
Существует большое количество причин, которые провоцируют появление инсульта. Но больше всего на его появление влияет повышенная температура воздуха. Это происходит от недостатка влаги в организме, что повышает на густоту крови.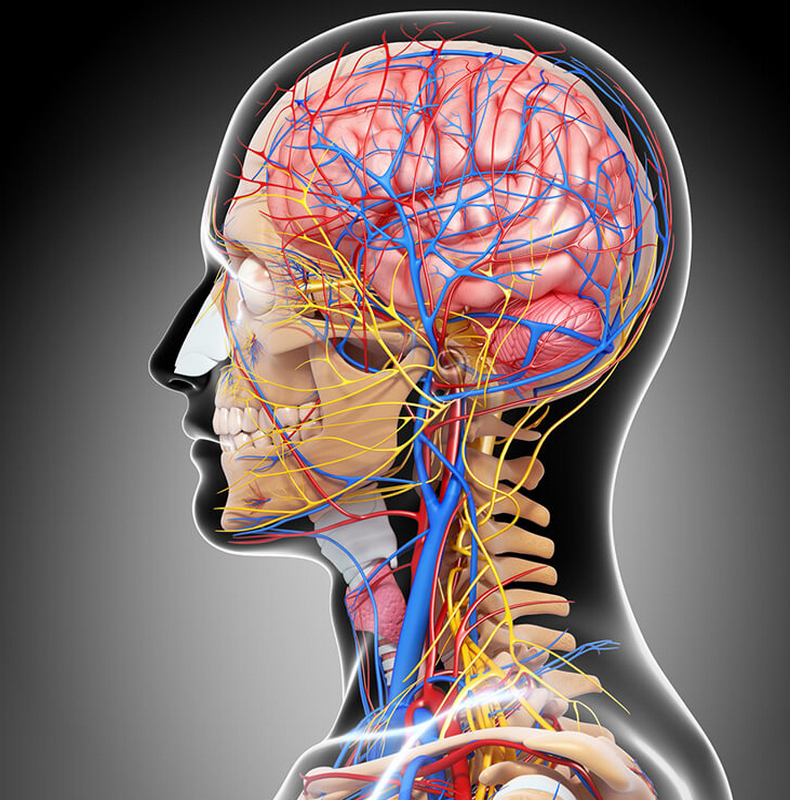 Как следствие – образование тромбов и нарушение кровотока в сосудах головного мозга.
Как следствие – образование тромбов и нарушение кровотока в сосудах головного мозга.
Избегайте прямых попаданий солнечных лучей. Если вы работаете в поле, то лучше дождаться снижения температуры. Переждите пик жары в тени, а затем смело приступайте к работе. Таким образом вы сможете избежать приступа микроинсульта.
Второй важной причиной является положение головы по отношению к телу. Если ваша голова находится в опущенном положении, а хребет при этом согнут, то есть риск заработать инсульт. А все потому, что такая поза вредит работе сердечно-сосудистой системе, идет излишняя нагрузка на нее. Это может стать причиной разрыва кровеносных сосудов.
Вероятность повышается, если человек имеет аневризму (выпирание) сосудов. Провоцируют нарушение кровотока плохие привычки (курение и употребление алкоголя), постоянные стрессовые ситуации, излишние физические нагрузки, и душевные расстройства.
Врожденные патологии, провоцирующие приступы
Грозит инсульт людям, которые болеют сахарным диабетом и имеют проблемы с сердечно-сосудистой системой (гипертонию, а также стенокардию). Таким людям нужно регулярно посещать докторов и употреблять медпрепараты.
Таким людям нужно регулярно посещать докторов и употреблять медпрепараты.
Людям, которые имеют искривленные сонные артерии и атеросклероз сосудов головы, будет очень трудно избежать приступа малого инсульта. Они находятся в повышенной зоне риска. Для выявления такой патологии обратитесь за помощью в медучреждение, где специалисты сканируют сосуды вашей головы.
Если обнаружатся какие-либо отклонения (сужение) сосудов, то вам порекомендуют сделать процедуру стентирования сонной артерии. С помощью этого метода лечения можно будет убрать дефекты, которые препятствуют нормальному кровотоку.
Большое количество болезней несет угрозу появления инсульта, изменяют состав кровь. Именно поэтому по истечению некоторого времени нужно делать анализы. Если у вас часто кружится голова, вы падаете в обморочное состояние или вас укачивает при езде в транспортных средствах – тогда вам нужно быть очень бдительными.
Все эти симптомы дают сигнализируют о проблемах кровеносной системы.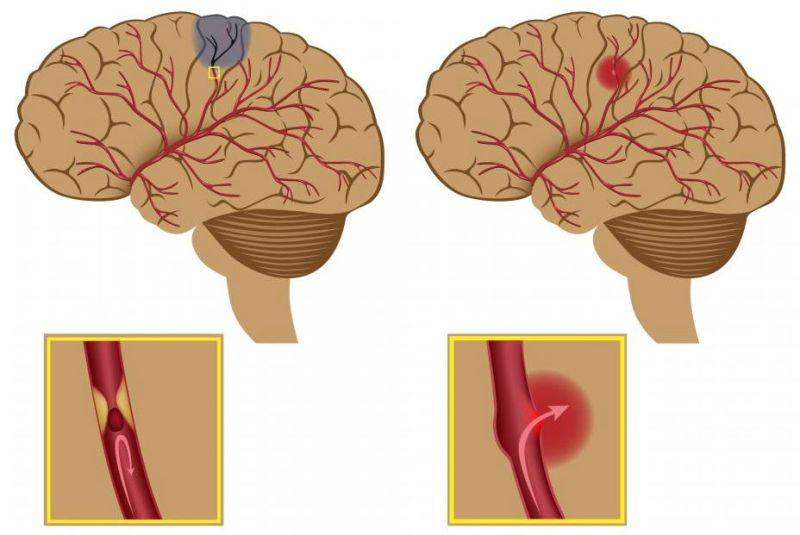 Не исключено, что эти недостатки могут быть врожденными. Поэтому вам необходимо регулярно обращаться к доктору за диагностикой своего состояния.
Не исключено, что эти недостатки могут быть врожденными. Поэтому вам необходимо регулярно обращаться к доктору за диагностикой своего состояния.
Научитесь понимать свой организм, когда он посылает вам сигналы о приближающейся катастрофе. Распознайте микроинсульт, и не тратя время на самолечение, своевременно обратитесь за помощью к врачу. Не болейте и будьте здоровы. опубликовано econet.ru.
Автор Маринэ Танашян
Лучшие публикации в Telegram-канале Econet.ru. Подписывайтесь!
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! © econet
Глубинный внутрикортикальный микроинсульт с помощью двухфотонного фототромбоза в головном мозге грызунов
Новые результаты
Masahiro Fukuda, Takayoshi Matsumura, View Orcid ProfileToShio Suda, View Orcid Profilehajime Hirase
DOI: https://doi. org/10.1101/2021.11.10.46928
org/10.1101/2021.11.10.46928
- .1101111.11.10.466928
- 009
- 099009
- .1101111.11.10.466928
- .1011111.11.10.466928
- .10111111.11.10.466928
- .
- Дополнительный материал
- Предварительный просмотр PDF
Abstract
Значение Фототромбоз является широко используемой моделью ишемического инсульта в экспериментах на грызунах. В модели фототромбориса фотосенсибилизатор Бенгальский розовый систематически вводится в кровоток и активируется зеленым светом, чтобы вызвать агрегацию тромбоцитов, что в конечном итоге вызывает окклюзию сосудов. Поскольку активация бенгальской розы является однофотонным явлением, а молекулы в освещенной области (световой путь) подвержены возбуждению, нацеливание на тромбоз неспецифично, особенно в глубинном измерении. Мы разработали протокол фототромбоза, который может нацеливаться на один сосуд в паренхиме коры путем двухфотонного возбуждения.

Цель Мы стремимся вызвать тромботический инсульт в кортикальной паренхиме путем двухфотонной активации бенгальского розового, чтобы ограничить фототромбоз сосудом заданной глубины.
Подход FITC-декстран вводят в кровоток для визуализации мозгового кровотока у взрослых мышей под наркозом с помощью краниального окна. После выбора целевого сосуда с помощью двухфотонной визуализации (950 нм) в кровоток вводят бенгальскую розу. Длину волны сканирования изменили на 720 нм и индуцировали фототромбоз путем сканирования целевого сосуда.
Результаты Двухфотонный направленный по глубине фототромбоз одного сосуда был достигнут с вероятностью успеха 84,9±1,7% в течение 80 с. Попытки без бенгальской розы (т.е. только с ФИТЦ) не приводили к фототромбозу при длине волны возбуждения 720 нм.
Выводы Мы описали протокол, который обеспечивает направленный по глубине фототромбоз одного сосуда с помощью двухфотонного возбуждения.
 Одновременная визуализация кровотока в целевом сосуде с использованием декстрана FITC позволила подтвердить окклюзию сосуда и предотвратить избыточное облучение, которое может вызвать непреднамеренное фотоповреждение.
Одновременная визуализация кровотока в целевом сосуде с использованием декстрана FITC позволила подтвердить окклюзию сосуда и предотвратить избыточное облучение, которое может вызвать непреднамеренное фотоповреждение.1 Введение
Ишемические инсульты возникают на различных уровнях мозгового кровообращения, начиная от массивной окклюзии средней мозговой артерии и заканчивая преходящими микроинсультами, возникающими в одиночных артериолах. Ишемия в местах удара вызывает гибель нейронов или необратимое повреждение с образованием инфаркта из-за недостатка энергетических субстратов. Тихие инсульты обычно возникают в мелких артериолах и вызывают небольшие инфаркты, приводящие к маловыраженным симптомам. Эти так называемые микроинсульты возникают в паренхиме головного мозга и остаются незамеченными до тех пор, пока множественные случаи микроинсультов в течение периода не объединятся и не разовьются в моторные и/или когнитивные нарушения 1 .
Было предложено несколько моделей локального эмболического или тромботического инсульта у экспериментальных животных 2–4 .
 Например, сотни микросфер диаметром 20-50 мкм были перфузированы в верхние отделы мозгового кровообращения 5 , например, во внутреннюю сонную артерию, чтобы вызвать эмболический ишемический инсульт в нижних артериолах. Инфузия микросфер создает значительную хирургическую нагрузку и по своей природе формирует инфаркты в нескольких местах. Поскольку локализация инфарктов несколько произвольна и иногда эктопична, этот метод не является оптимальным для наблюдения влияния однососудистой окклюзии микроскопическим визуализация in vivo .
Например, сотни микросфер диаметром 20-50 мкм были перфузированы в верхние отделы мозгового кровообращения 5 , например, во внутреннюю сонную артерию, чтобы вызвать эмболический ишемический инсульт в нижних артериолах. Инфузия микросфер создает значительную хирургическую нагрузку и по своей природе формирует инфаркты в нескольких местах. Поскольку локализация инфарктов несколько произвольна и иногда эктопична, этот метод не является оптимальным для наблюдения влияния однососудистой окклюзии микроскопическим визуализация in vivo .Индукция тромбоза оптическими средствами, фототромбоз 6 , широко используется сообществом исследователей инсульта благодаря воспроизводимости метода и гибкому выбору целевой области. Фототромбоз осуществляют путем введения в кровь фотосенсибилизатора бенгальской розы и возбуждения ее зеленым светом в целевом участке поверхности головного мозга. Возбуждение бенгальского розового продуцирует активные формы кислорода (АФК), которые повреждают эпителиальные клетки и способствуют агрегации тромбоцитов на стенке сосуда, что в конечном итоге закупоривает сосуд.
 Фототромбоз имеет преимущество выбора целевой области по сравнению с другими методами, поскольку целевая область может быть указана с помощью освещения возбуждающим светом. Однако из-за природы однофотонной реакции фототромбоз не подходит для нацеливания на определенные сосуды внутри ткани головного мозга, поскольку поверхностные сосуды, включая капилляры, также подвергаются фототромбозу при еще более интенсивном свете. Кроме того, избыточное воздействие высокоинтенсивного возбуждающего света на кору головного мозга мыши может проникать в более глубокие структуры, такие как гиппокамп и полосатое тело, и закупоривать нецелевые области, делая неясной интерпретацию последующего результата. Кроме того, при точечном освещении области тромбоза не различаются артерии и вены.
Фототромбоз имеет преимущество выбора целевой области по сравнению с другими методами, поскольку целевая область может быть указана с помощью освещения возбуждающим светом. Однако из-за природы однофотонной реакции фототромбоз не подходит для нацеливания на определенные сосуды внутри ткани головного мозга, поскольку поверхностные сосуды, включая капилляры, также подвергаются фототромбозу при еще более интенсивном свете. Кроме того, избыточное воздействие высокоинтенсивного возбуждающего света на кору головного мозга мыши может проникать в более глубокие структуры, такие как гиппокамп и полосатое тело, и закупоривать нецелевые области, делая неясной интерпретацию последующего результата. Кроме того, при точечном освещении области тромбоза не различаются артерии и вены.Двухфотонная микроскопия широко используется в биовизуализации из-за ее превосходного проникновения вглубь ткани и фокус-специфического возбуждения флуоресценции 7 . Воспользовавшись этой особенностью, группа, использовавшая облучение в фиксированной точке, совсем недавно сообщила о многофотонном фототромбозе 8 .
 Здесь мы представляем альтернативный метод для направленного по глубине фототромбоза (DTPT), который можно легко использовать на стандартном двухфотонном микроскопе, оснащенном резонансным сканером. Используя этот метод, мы демонстрируем фототромбоз в одном сосуде или группе сосудов на заданной глубине до 300 мкм. Примечательно, что мы показываем, что фототромбоз индуцируется в течение 40 секунд лазерного освещения на глубине коры 300 мкм без нежелательных окклюзий выше и ниже цели. Эти особенности благоприятны для проспективных исследований микроинсультов, поскольку считается, что окклюзия отдельных целевых сосудов в паренхиме головного мозга имитирует тихий инсульт.
Здесь мы представляем альтернативный метод для направленного по глубине фототромбоза (DTPT), который можно легко использовать на стандартном двухфотонном микроскопе, оснащенном резонансным сканером. Используя этот метод, мы демонстрируем фототромбоз в одном сосуде или группе сосудов на заданной глубине до 300 мкм. Примечательно, что мы показываем, что фототромбоз индуцируется в течение 40 секунд лазерного освещения на глубине коры 300 мкм без нежелательных окклюзий выше и ниже цели. Эти особенности благоприятны для проспективных исследований микроинсультов, поскольку считается, что окклюзия отдельных целевых сосудов в паренхиме головного мозга имитирует тихий инсульт.2 Материалы и методы
Испытуемые и операция
Использовали взрослых мышей C57BL/6 (возраст 2–6 месяцев, 20–30 г) обоего пола. Мышей глубоко анестезировали изофлураном (5% для индукции, 1,5% для поддержания). Выполнена трепанация черепа диаметром ~3 мм над соматосенсорной корой, при этом твердая мозговая оболочка остается интактной.
 После этого накладывали покровное стекло и фиксировали его стоматологическим цементом. Металлический каркас головы, который подходит к держателю для головы MAG-3 (Narishige, Япония), был прикреплен к черепу, а оставшийся открытый череп был покрыт стоматологическим цементом.
После этого накладывали покровное стекло и фиксировали его стоматологическим цементом. Металлический каркас головы, который подходит к держателю для головы MAG-3 (Narishige, Япония), был прикреплен к черепу, а оставшийся открытый череп был покрыт стоматологическим цементом.Процедуры, включающие уход за животными, операции и подготовку образцов, были одобрены Датской инспекцией по экспериментам на животных и комитетом по уходу и использованию животных Университета Кумамото, Кумамото, Япония. Исследование на животных проходило под контролем Институционального комитета по уходу и использованию животных Копенгагенского университета.
Двухфотонный фототромбоз по глубине (DTPT) in vivo
Двухфотонную визуализацию и фототромбоз по глубине (DTPT) проводили у мышей под наркозом с использованием микроскопа Bergamo (Thorlabs), оснащенного резонансным сканером (8 кГц) , пьезоэлектрический привод Z, иммерсионный объектив с числовой апертурой 25× 1,1 (Nikon, CFI75 Apochrom 25XC W 1300) и лазер Mai Tai eHP DeepSee (Spectra-Physics).
 Свет излучения разделялся дихроичным зеркалом (562 нм, Chroma) с полосовыми фильтрами 525/50 нм и 607/70 нм (оба от Chroma) для зеленого и красного каналов соответственно. Микроскоп работал с использованием программного обеспечения ThorImage LS версии 4.0.
Свет излучения разделялся дихроичным зеркалом (562 нм, Chroma) с полосовыми фильтрами 525/50 нм и 607/70 нм (оба от Chroma) для зеленого и красного каналов соответственно. Микроскоп работал с использованием программного обеспечения ThorImage LS версии 4.0.DTPT проводили следующим образом. Во-первых, чтобы максимизировать эффективность возбуждения, мы отрегулировали угол крепления головного столика так, чтобы плоскость краниотомии стала параллельной плоскости объектива, используя гониометр, встроенный в держатель головного столика MAG-3 9 . Во-вторых, 300 мкл 20 мг/мл декстрана FITC-150k (Sigma-Aldrich, Миссури, США) вводили внутривенно (в/в) ретроорбитальным путем для маркировки кровеносных сосудов. После идентификации целевого кровеносного сосуда с помощью возбуждающего света с длиной волны 950 нм вводили 100 мкл фотосенсибилизатора Бенгальская роза (Sigma-Aldrich, Миссури, США) (в/в, концентрация бенгальской розы: 20 мг/мл в фосфатно-солевом буфере) 10 и вводят каждые 20 мин для поддержания концентрации РБ в крови (до трех раз).
 Затем длина волны возбуждающего света была изменена на 720 нм, а глубина фокуса была отрегулирована в соответствии с просветом целевого сосуда с использованием минимально возможной мощности лазера (2,9 мВт). Затем область сканирования была ограничена путем увеличения цифрового увеличения, чтобы включить только целевой сосуд. Для запуска фототромбоза на выходе из линзы объектива устанавливали мощность лазера 31 мВт и сканировали выбранную область с высокой частотой кадров (30–60 Гц, в зависимости от сканируемой области) при мониторинге полученных изображений в режиме реального времени. . Если имеется, дальний красный канал обнаружения должен быть отключен для защиты ФЭУ. Сканирование прекращали при образовании тромбов.
Затем длина волны возбуждающего света была изменена на 720 нм, а глубина фокуса была отрегулирована в соответствии с просветом целевого сосуда с использованием минимально возможной мощности лазера (2,9 мВт). Затем область сканирования была ограничена путем увеличения цифрового увеличения, чтобы включить только целевой сосуд. Для запуска фототромбоза на выходе из линзы объектива устанавливали мощность лазера 31 мВт и сканировали выбранную область с высокой частотой кадров (30–60 Гц, в зависимости от сканируемой области) при мониторинге полученных изображений в режиме реального времени. . Если имеется, дальний красный канал обнаружения должен быть отключен для защиты ФЭУ. Сканирование прекращали при образовании тромбов.Статистические данные
Сравнение средних значений двух выборок оценивали с помощью t-критерия. Столбики погрешностей гистограмм представляют собой стандартную ошибку среднего значения. Коробчатые диаграммы показывают медианы и 25-й и 75-й процентили выборочных данных.
 Усы на блочной диаграмме представляют более короткий диапазон данных или предел выбросов. Пределы выбросов определяются как q3 + 1 . 5 × (q3 – q1) и q1 – 1 . 5 × (q3 – q1) , где q1 и q3 — это 25-й и 75-й процентили выборочных данных.
Усы на блочной диаграмме представляют более короткий диапазон данных или предел выбросов. Пределы выбросов определяются как q3 + 1 . 5 × (q3 – q1) и q1 – 1 . 5 × (q3 – q1) , где q1 и q3 — это 25-й и 75-й процентили выборочных данных.3 Результаты
Повторяющиеся быстрые сканирования в просвете индуцируют 2-фотонный фототромбоз
< 750 нм 11 . Во-первых, мы визуализировали сосуды головного мозга, пометив сыворотку FITC-декстраном внутривенно. инъекция и визуализация через черепную вдову с помощью двухфотонного микроскопа у анестезированной мыши (рис. 1 (а)). Длина волны 950 нм использовали для возбуждения FITC. Церебральные артериолы идентифицировали путем отслеживания нисходящего потока крови в проникающих артериях. В качестве мишени выбирали сосуд диаметром 4–20 мкм и помещали в середину поля зрения, регулируя предметный столик микроскопа. Сканируемая область была ограничена целевым сосудом путем увеличения сосуда (рис. 1 (б)). После внутривенного введения бенгальского розового длина волны была изменена на 720 нм, а глубина сканирования (фокус по оси Z) была перенастроена для сканирования внутри просвета с минимальной интенсивностью лазера с частотой кадров 30 или 60 Гц. После установки мишени мощность лазера устанавливалась на 31 мВт (на выходе из линзы объектива). Напряжение ФЭУ и усиление усилителя были установлены на низкие значения, чтобы обеспечить одновременный мониторинг фототромбоза и кровотока в сосудах.
1 (б)). После внутривенного введения бенгальского розового длина волны была изменена на 720 нм, а глубина сканирования (фокус по оси Z) была перенастроена для сканирования внутри просвета с минимальной интенсивностью лазера с частотой кадров 30 или 60 Гц. После установки мишени мощность лазера устанавливалась на 31 мВт (на выходе из линзы объектива). Напряжение ФЭУ и усиление усилителя были установлены на низкие значения, чтобы обеспечить одновременный мониторинг фототромбоза и кровотока в сосудах.Рис. 1
In vivo двухфотонный направленный по глубине фототромбоз (DTPT): (a) Схематическая иллюстрация DTPT. После визуализации кровеносных сосудов с помощью FITC-декстрана кровеносный сосуд, содержащий бенгальскую розу, подвергается двухфотонному возбуждению. ( б ) Кровеносные сосуды, на которые нужно нацелиться, были выбраны с использованием флуоресценции FITC-декстрана. (c) После инъекции бенгальской розы длина волны возбуждения была переключена на 720 нм.
 Визуализацию целевого кровеносного сосуда с длиной волны 720 нм проводили до образования коагуляции. (d) Завершение окклюзии можно определить по фотообесцвечиванию бенгальской розы и FITC. (e) В небольшом числе случаев наблюдались разрывы кровеносных сосудов или ожоги тканей. (f) Вероятность успеха DTPT составила 84,9.±1,7%, в то время как в 6,1±2,5% случаев не было окклюзии (без изменений) и в 9,0±2,1% случаев наблюдалось жжение/разрыв ткани (окклюзия: 84/99, без изменений: 6/99, жжение/разрыв ткани сосуды 9/99, 4 мыши). (g) Контрольные образцы с одним декстраном FITC-150k не показали окклюзии или ожога/разрыва ткани через 150 секунд (103 кровеносных сосуда, 3 мыши). Шкала баров: (а) 200 мкм; (б), (в), (г), (д): 10 мкм.
Визуализацию целевого кровеносного сосуда с длиной волны 720 нм проводили до образования коагуляции. (d) Завершение окклюзии можно определить по фотообесцвечиванию бенгальской розы и FITC. (e) В небольшом числе случаев наблюдались разрывы кровеносных сосудов или ожоги тканей. (f) Вероятность успеха DTPT составила 84,9.±1,7%, в то время как в 6,1±2,5% случаев не было окклюзии (без изменений) и в 9,0±2,1% случаев наблюдалось жжение/разрыв ткани (окклюзия: 84/99, без изменений: 6/99, жжение/разрыв ткани сосуды 9/99, 4 мыши). (g) Контрольные образцы с одним декстраном FITC-150k не показали окклюзии или ожога/разрыва ткани через 150 секунд (103 кровеносных сосуда, 3 мыши). Шкала баров: (а) 200 мкм; (б), (в), (г), (д): 10 мкм.Видео 1
Окклюзия одиночного кортикального сосуда методом DTPT. Масштабная линейка 10 мкм. (MP4, 7MB)
Кровоток в пораженном сосуде определяли по субоптимальной флуоресценции бенгальской розы и FITC по мере обновления полученных изображений на экране (рис.
 1(c), слева). Первоначально к стенке кровеносного сосуда начали прикрепляться тромбоциты и эритроциты (рис. 1(в), середина). После этого красные кровяные тельца (эритроциты) образовали сгусток, и кровоток постепенно нарушился (рис. 1(с), справа; видео 1). Окклюзия сосуда наблюдалась по появлению на изображении застойных эритроцитов. Кроме того, красители, содержащие кровь, быстро обесцвечивались и после полной окклюзии, что можно использовать как признак окклюзии (рис. 1(г)). В большинстве случаев окклюзия индуцировалась в течение 80 с облучения 720 нм (рис. 1(f), 84/9).9 сосудов, 4 мыши), хотя мы наблюдали несостоятельность окклюзии или разрыв/прижигание ткани при небольшом количестве попыток (рис. 1(f)). Напротив, в FITC-контроле не было обнаружено ни окклюзии, ни прикрепления тромбоцитов к стенкам сосудов даже при облучении до 150 с (рис. 1(g)).
1(c), слева). Первоначально к стенке кровеносного сосуда начали прикрепляться тромбоциты и эритроциты (рис. 1(в), середина). После этого красные кровяные тельца (эритроциты) образовали сгусток, и кровоток постепенно нарушился (рис. 1(с), справа; видео 1). Окклюзия сосуда наблюдалась по появлению на изображении застойных эритроцитов. Кроме того, красители, содержащие кровь, быстро обесцвечивались и после полной окклюзии, что можно использовать как признак окклюзии (рис. 1(г)). В большинстве случаев окклюзия индуцировалась в течение 80 с облучения 720 нм (рис. 1(f), 84/9).9 сосудов, 4 мыши), хотя мы наблюдали несостоятельность окклюзии или разрыв/прижигание ткани при небольшом количестве попыток (рис. 1(f)). Напротив, в FITC-контроле не было обнаружено ни окклюзии, ни прикрепления тромбоцитов к стенкам сосудов даже при облучении до 150 с (рис. 1(g)).Мы не обнаружили, что диаметр кровеносных сосудов влияет на успешность формирования окклюзии (окклюзия: 11,58 ± 0,43 мкм (n = 84), без изменений: 8,27 ± 1,57 мкм (n = 6), P = 0,069) (рис.
 2(а)). Мы обнаружили, что на успешность формирования окклюзии с помощью DTPT влияет время, прошедшее после инъекции бенгальской розы. Неудачные попытки произошли, когда после инъекции бенгальской розы прошло значительно больше времени, чем типичные успешные попытки (успешная окклюзия: 90,0 ± 0,6 минуты (n = 84), отсутствие окклюзии: 13,8 ± 1,6 минуты (n = 6) после инъекции бенгальского розового. Р=0,019) (рис. 2(б)). Эти результаты вместе с контролем только FITC (рис. 1 (g)) показали, что концентрация бенгальской розы внутри кровеносного сосуда имеет решающее значение для DTPT, а лазер возбуждения 720 нм надежно возбуждает бенгальскую розу.
2(а)). Мы обнаружили, что на успешность формирования окклюзии с помощью DTPT влияет время, прошедшее после инъекции бенгальской розы. Неудачные попытки произошли, когда после инъекции бенгальской розы прошло значительно больше времени, чем типичные успешные попытки (успешная окклюзия: 90,0 ± 0,6 минуты (n = 84), отсутствие окклюзии: 13,8 ± 1,6 минуты (n = 6) после инъекции бенгальского розового. Р=0,019) (рис. 2(б)). Эти результаты вместе с контролем только FITC (рис. 1 (g)) показали, что концентрация бенгальской розы внутри кровеносного сосуда имеет решающее значение для DTPT, а лазер возбуждения 720 нм надежно возбуждает бенгальскую розу.Рис. 2
Параметры для успешной DTPT: (a) Распределение диаметра сосудов для успешно окклюзированных сосудов по сравнению с не окклюзированными сосудами. (b) Распределение времени после инъекции бенгальского розового (RB) для успешно окклюзированных сосудов по сравнению с неокклюзированными сосудами. * Р < 0,05.

Окклюзия DTPT ограничена целевыми сосудами
В то время как попытки DTPT, которые мы описали до сих пор, были выполнены в целевых плоскостях на расстоянии 30–50 мкм от поверхности пиала, мы затем выполнили DTPT, нацеленную на кровеносный сосуд (φ = 6,5 мкм), расположенный на глубине 300 мкм. В этом случае мы использовали мощность лазера ~300 мВт для излучения 720 нм.
Соответственно и тромб образовался в течение 40 сек (рис. 3(а) и (б), видео 2). Образовавшийся сгусток был хорошо виден при возбуждении на длине волны 950 нм (рис. 3(в), стрелка). Полезность DTPT становится мощной, когда сосуды вне фокуса не закупорены. Чтобы убедиться, что фототромбоз ограничен целевым сосудом, мы сделали объемные изображения и проверили, есть ли сгустки крови в капиллярах на 100, 200 и 300 мкм выше и на 100 мкм ниже плоскости-мишени вскоре после ДТТВ (в течение 5 мин) при длина волны 950 нм. Как показано на репрезентативном изображении в результате, мы не увидели очевидных сгустков в нецелевых плоскостях (рис.
 3 (d) и видео 3). Чтобы изучить эффект селективной окклюзии, мы наблюдали эту область через 3 дня. Мы обнаружили, что периферические кровеносные сосуды целевой плоскости также были окклюзированы, и была заметна экстравазация FITC вокруг оккулированных кровеносных сосудов (рис. 3 (e)).
3 (d) и видео 3). Чтобы изучить эффект селективной окклюзии, мы наблюдали эту область через 3 дня. Мы обнаружили, что периферические кровеносные сосуды целевой плоскости также были окклюзированы, и была заметна экстравазация FITC вокруг оккулированных кровеносных сосудов (рис. 3 (e)).Рис. 3
Нецелевой эффект DTPT незначителен: (а) Целью был кровеносный сосуд, расположенный на расстоянии 300 мкм от мягкой мозговой оболочки. (b) Окклюзия была сформирована за 40 секунд с использованием возбуждающего лазера мощностью 300 мВт с длиной волны 720 нм. (c) После DTPT возбуждение было установлено на 950 нм, визуализировали коагуляцию. (d) Даже при возбуждении мощностью 300 мВт для DTPT не было окклюзии/коагуляции в областях на 300, 200, 100 мкм выше и на 100 мкм ниже мишени. (e) Экстравазация декстрана FITC-150k и окклюзия периферических кровеносных сосудов наблюдались через три дня после DTPT. Масштабные линейки: (а), (в), (г) 50 мкм; (б), (д) 10 мкм.

Видео 2
Окклюзия сосуда согласно рис. 3(б). Масштабная линейка 10 мкм. (MP4, 5 МБ)
Видео 3
Глубинный стек сосудистой сети коры вокруг целевого участка DTPT. Масштабная линейка 10 мкм. (MP4, 12 МБ)
4 Обсуждение
Фототромбоз используется уже более трех десятилетий 6 и по-прежнему широко используется для целенаправленной индукции ишемического инсульта благодаря его превосходной воспроизводимости. Несмотря на широкое применение, фототромбоз до недавнего времени не использовался для индукции микроинсультов, направленных конкретно на глубину коры головного мозга. Это связано с тем, что обычный фототромбоз основан на однофотонном возбуждении бенгальского розового: АФК вырабатываются везде, где зеленый фотон попадает на бенгальский розовый, поэтому образование тромбоза смещено в сторону поверхностных сосудов. С другой стороны, многофотонное возбуждение происходит только в фокальном пятне, что позволяет избежать продукции АФК за пределами фокальной плоскости и, таким образом, позволяет нацеливаться на конкретную глубину.
 Действительно, Делафонтен-Мартель и его коллеги продемонстрировали, что многофотонная окклюзия возможна при двухфотонном или трехфотонном возбуждении. В их исследовании двухфотонный фототромбоз достигался на глубине до 200 мкм от поверхности пиала, и требовалось значительно большее время облучения (до 300 секунд) при длине волны возбуждения 1000 нм 9 .0048 8 .
Действительно, Делафонтен-Мартель и его коллеги продемонстрировали, что многофотонная окклюзия возможна при двухфотонном или трехфотонном возбуждении. В их исследовании двухфотонный фототромбоз достигался на глубине до 200 мкм от поверхности пиала, и требовалось значительно большее время облучения (до 300 секунд) при длине волны возбуждения 1000 нм 9 .0048 8 .В текущей работе мы еще раз подтверждаем, что двухфотонный фототромбоз возможен в мозгу мыши. Примечательно, что мы обнаружили, что менее 80-секундного облучения достаточно, чтобы вызвать окклюзию микрососудов с вероятностью успеха> 80%. Этот ускоренный двухфотонный фототромбоз был возможен при значительно более короткой длине волны 720 нм. Спектр однофотонного поглощения бенгальской розы имеет широкий пик около 560 нм, а зеленый свет в диапазоне 530–580 нм обычно используется для активации бенгальской розы. Недавно Campaign и Knox измерили спектр двухфотонного возбуждения Rose Bengal 9.0048 11 . Согласно этому исследованию, двухфотонно-возбуждаемая флуоресценция увеличивается примерно в три раза при изменении длины волны возбуждения от 780 нм до 720 нм.
 Хотя эмиссия флуоресценции не обязательно коррелирует с продукцией АФК, демонстрация повышенной возбудимости молекул при 720 нм побуждает к будущим исследованиям, чтобы охарактеризовать продукцию АФК на этой длине волны. Еще один методологический момент, который мы считаем важным для индукции эффективного фототромбоза, заключается в том, что мы сканируем просвет целевого сосуда и максимально избегаем облучения стенок сосуда (эндотелиальных клеток). Эта процедура в сочетании с одновременным облучением и визуализацией предназначена для обеспечения возбуждения бенгальского розового без нарушения целостности сосуда. В этом отношении необходимо провести DTPT вскоре после введения бенгальского розового, чтобы в плазме сохранялись достаточные уровни бенгальского розового.
Хотя эмиссия флуоресценции не обязательно коррелирует с продукцией АФК, демонстрация повышенной возбудимости молекул при 720 нм побуждает к будущим исследованиям, чтобы охарактеризовать продукцию АФК на этой длине волны. Еще один методологический момент, который мы считаем важным для индукции эффективного фототромбоза, заключается в том, что мы сканируем просвет целевого сосуда и максимально избегаем облучения стенок сосуда (эндотелиальных клеток). Эта процедура в сочетании с одновременным облучением и визуализацией предназначена для обеспечения возбуждения бенгальского розового без нарушения целостности сосуда. В этом отношении необходимо провести DTPT вскоре после введения бенгальского розового, чтобы в плазме сохранялись достаточные уровни бенгальского розового.Хотя это и не было предпринято в этом исследовании, сокращенное время индукции фототромбоза делает вероятным, что этот метод применим к бодрствующим мышам, что устраняет смешанные факторы, связанные с анестетиками 12 , и, следовательно, более точно имитирует человеческие инсульты.
 Предыдущее исследование зафиксировало образование однососудистого сгустка с использованием килогерцового импульсного лазера с энергией импульса на несколько порядков больше, чем у обычного лазера, используемого для двухфотонной визуализации 13 Однако этот метод требует сложной дополнительной оптики для получения импульсов высокой энергии. Наш метод работает на стандартном двухфотонном микроскопе без каких-либо аппаратных модификаций, поэтому привлекает простотой и универсальностью.
Предыдущее исследование зафиксировало образование однососудистого сгустка с использованием килогерцового импульсного лазера с энергией импульса на несколько порядков больше, чем у обычного лазера, используемого для двухфотонной визуализации 13 Однако этот метод требует сложной дополнительной оптики для получения импульсов высокой энергии. Наш метод работает на стандартном двухфотонном микроскопе без каких-либо аппаратных модификаций, поэтому привлекает простотой и универсальностью.Фототромбоз одного сосуда был выполнен на поверхностных сосудах 14–18 , но предполагаемые нецелевые эффекты на более глубокие паренхиматозные сосуды тщательно не изучались. Умное применение однофотонного фототромбоза нацелено на проникающие сосуды 19 , тем самым частично решая проблему активации Бенгальской розы по всей оси глубины. DTPT предлагает явное преимущество перед обычным фототромбозом, вызванным зеленым светом, за счет использования инфракрасного света, который проникает глубже в паренхиму.
 Следовательно, DTPT должен быть эффективным средством для оценки теоретического прогнозирования исходов микроинсульта в различных конфигурациях микроциркуляции 20 . Будущие приложения DTPT включают окклюзию подкорковых областей, таких как гиппокамп, где возможна двухфотонная или трехфотонная визуализация с поверхности коры 9,21–23 . Наши предварительные попытки предполагают, что это осуществимо, хотя необходимо провести тщательное гистологическое исследование областей коры при прохождении инфракрасного луча, чтобы подтвердить целенаправленную индукцию тромботического инсульта.
Следовательно, DTPT должен быть эффективным средством для оценки теоретического прогнозирования исходов микроинсульта в различных конфигурациях микроциркуляции 20 . Будущие приложения DTPT включают окклюзию подкорковых областей, таких как гиппокамп, где возможна двухфотонная или трехфотонная визуализация с поверхности коры 9,21–23 . Наши предварительные попытки предполагают, что это осуществимо, хотя необходимо провести тщательное гистологическое исследование областей коры при прохождении инфракрасного луча, чтобы подтвердить целенаправленную индукцию тромботического инсульта.Еще одним будущим применением DTPT является исследование влияния окклюзии одиночного микрососуда на активность и воспаление окружающего нейропиля. Сообщалось, что астроциты, основной подтип глии, вызывают аберрантную активность после широкопольного фототромбоза 24,25 . Хроническая визуализация активности или морфологии Ca 2+ будет отличным ресурсом для понимания того, как нейропили нормализуются после легкого ишемического инсульта или как, возможно, происходит ангиогенез.
 Следует отметить, что мы недавно описали, что антагонизм к адренергическим рецепторам ускоряет восстановление активности нейронов после широкопольного фототромботического инсульта , 25, или распространения депрессии/деполяризации коры , 26, . Было бы интересно изучить, как антагонизм к адренергическим рецепторам влияет на гомеостаз внеклеточной среды вокруг одиночно закупоренного сосуда в свете зависимой от адренергических рецепторов глимфатической системы 27,28 .
Следует отметить, что мы недавно описали, что антагонизм к адренергическим рецепторам ускоряет восстановление активности нейронов после широкопольного фототромботического инсульта , 25, или распространения депрессии/деполяризации коры , 26, . Было бы интересно изучить, как антагонизм к адренергическим рецепторам влияет на гомеостаз внеклеточной среды вокруг одиночно закупоренного сосуда в свете зависимой от адренергических рецепторов глимфатической системы 27,28 .Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Доступность кодов, данных и материалов
Все материалы, используемые в данной процедуре, имеются в продаже. ThorImage LS — это запатентованное программное обеспечение для получения изображений для многофотонных микроскопов Thorlab.
Благодарности
MF поддерживается грантом JSPS для научных исследований (S) (JP18H05284 для Т. Суда) и грантом JSPS для сложных исследований (исследовательский) (JP21K19514 к Т.
 Мацумуре). HH поддерживается Фондом Ново Нордиск (NNFOC0058058), Danmarks Frie Forskningsfond (0134-00107B), Фондом Лундбек.
Мацумуре). HH поддерживается Фондом Ново Нордиск (NNFOC0058058), Danmarks Frie Forskningsfond (0134-00107B), Фондом Лундбек.Ссылки
- 1.↵
S. E. Vermeer, W. T. Longstreth и P. J. Koudstaal, «Безмолвные инфаркты головного мозга: систематический обзор», Lancet. Нейрол. 6(7), 611–619, Lancet Neurol (2007) [doi:10.1016/S1474-4422(07)70170-9].
- 2.↵
А. Дурукан и Т. Татлисумак, «Острый ишемический инсульт: обзор основных экспериментальных моделей на грызунах, патофизиология и терапия очаговой церебральной ишемии». Pharmacol. Биохим. Поведение 87(1), 179–197, Pharmacol Biochem Behav (2007) [doi:10.1016/j.pbb.2007.04.015].
- 3.
F. Fluri, M. K. Schuhmann и C. Kleinschnitz, «Животные модели ишемического инсульта и их применение в клинических исследованиях», Drug Des. Девел. тер. 9, 3445–3454, Dove Medical Press Ltd. (2015) [doi:10.2147/DDDT.S56071].
- 4.↵
CJ Sommer, «Ишемический инсульт: экспериментальные модели и реальность», Acta Neuropathol.
 133(2), 245–261, Acta Neuropathol (2017) [doi:10.1007/s00401-017-1667-0].
133(2), 245–261, Acta Neuropathol (2017) [doi:10.1007/s00401-017-1667-0]. - 5.↵
М. Кудо и др., «Животная модель инфаркта головного мозга. Гомологичные эмболы кровяных сгустков у крыс», Stroke 13(4), 505–508, Stroke (1982) [doi:10.1161/01.str.13.4.505].
- 6.↵
B.D. Watson et al., «Индукция воспроизводимого инфаркта головного мозга с помощью фотохимически инициированного тромбоза», Ann. Нейрол. 17(5), 497–504, Энн Нейрол (1985) [doi:10.1002/ana.410170513].
- 7.↵
В. Денк, Дж. Х. Стриклер и В. В. Уэбб, «Двухфотонная лазерная сканирующая флуоресцентная микроскопия», Наука (80-.) . 248 (4951), 73–76 (1990).
- 8. Применение
- V. X. D. Yang и
P. Delafontaine-Martel et al., «Мультихотонное возбуждение розовой бенгалии для индуцирования капилляра», в сфере SPIE 1166. D. D.
 D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. Yang and JM Kainerstorfer, Eds., стр. 116290G1–6, SPIE (2021) [doi: 10.1117/12.2577868].
D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. D. Yang and JM Kainerstorfer, Eds., стр. 116290G1–6, SPIE (2021) [doi: 10.1117/12.2577868]. - 9.↵
- Vivo M.M. Barroso и
- X. Intes
М. Фукуда, К. Озава и Х. Хирасе, «Визуализация живых организмов», в книге «Визуализация от клеток к животным» In Vivo М. М. Баррозу и X. Интес, ред., стр. 295–306, CRC Press ( 2020) [doi:10.1201/9781315174662-22].
- 10.↵
T. Yardeni et al., «Ретроорбитальные инъекции мышам», Lab Anim. (Нью-Йорк). 40(5), 155, NIH Public Access (2011) [doi:10.1038/LABAN0511-155].
- 11.↵
С. М. Г. Кампания и У. Х. Нокс, «Повышение эффективности фемтосекундной микрообработки в ближнем инфракрасном диапазоне в офтальмологических гидрогелях с добавлением флуоресцеина натрия, бенгальской розы и рибофлавина», Appl. Опц. 58(32), 8959, Оптическое общество (2019) [doi:10.
 1364/ao.58.008959].
1364/ao.58.008959]. - 12.↵
Seto et al., «Индукция ишемического инсульта у бодрствующих свободно движущихся мышей показывает, что анестезия изофлураном может маскировать преимущества нейропротекторной терапии». Front. Нейроэнергетика 6(APR), 1, Front Neuroenergetics (2014) [doi:10.3389/fnene.2014.00001].
- 13.↵
N. Nishimura et al., «Целенаправленное повреждение подповерхностных кортикальных кровеносных сосудов с использованием ультракоротких лазерных импульсов: три модели инсульта». Nat. Методы 3(2), 99–108, Nat Methods (2006) [doi:10.1038/nmeth844].
- 14.↵
T. A. Clark et al., «Фототромбоз артерий расширяет сосудистую полутень, вызывает периинфарктную неоваскуляризацию и моделирует нарушения передних конечностей». Sci. Отчет 9(1), 2323, Nature Publishing Group (2019) [doi:10.1038/s41598-019-39092-7].
- 15.
S. Sunil et al., «Модель хронической мышиной пробуждения целевой окклюзии пиальных сосудов посредством фототромбоза», Neurophotonics 7 (01), 1, SPIE-Intl Soc Optical Eng (2020) [doi: 10.
 1117 /1.нф.7.1.015005].
1117 /1.нф.7.1.015005]. - 16.
З. Дж. Тейлор и А. Ю. Ши, «Целенаправленная окклюзия отдельных пиальных сосудов коры мышей», Биопротокол 3 (17), NIH Public Access (2013) [doi: 10.21769/bioprotoc.897] .
- 17.
Сиглер, А. Горошков и Т. Х. Мерфи, «Оборудование и методология нацеливания на отдельные артериолы головного мозга для фототромботического инсульта на вертикальном микроскопе». J. Neurosci. Methods 170(1), 35–44, J Neurosci Methods (2008) [doi:10.1016/j.jneumeth.2007.12.015].
- 18.↵
S.M.S. Kazmi et al., «Трехмерное картирование напряжения кислорода в кортикальных артериолах до и после окклюзии», Biomed. Опц. Express 4(7), 1061–1073, Biomed Opt Express (2013) [doi:10.1364/BOE.4.001061].
- 19.↵
Y. Shih et al., «Самый маленький инсульт: окклюзия одного проникающего сосуда приводит к инфаркту и когнитивному дефициту». Nat. Неврологи. 16(1), 55–63, Nat Neurosci (2013) [doi:10.
 1038/nn.3278].
1038/nn.3278]. - 20.↵
F. Schmid et al., «Тяжесть микроинсультов зависит от топологии сосудов и исходной перфузии», Elife 10, Elife (2021) [doi:10.7554/eLife.60208].
- 21.↵
N.G. Horton et al., «Трехфотонная микроскопия in vivo подкорковых структур в неповрежденном мозге мыши». Nat. Photonics 7(3), 205–209, Nat Photonics (2013) [doi:10.1038/nphoton.2012.336].
- 22.
R. Kawakami et al., «Визуализация нейронов гиппокампа с помощью двухфотонной микроскопии in vivo с использованием пикосекундного импульсного лазера с длиной волны 1030 нм»,
- 23.↵
- M. M. Barroso и
- X. Intes
L. Streich et al., «Структурная и функциональная визуализация глубокого мозга с высоким разрешением с использованием адаптивной оптики, трехфотонная микроскопия Nat. Methods 18(10), MM Barroso and X.
 Intes, Eds., 1253–1258, CRC Press (2021) [doi:10.1038/s41592-021-01257-6].
Intes, Eds., 1253–1258, CRC Press (2021) [doi:10.1038/s41592-021-01257-6]. - 24.↵
S. Ding et al., «Фототромбозная ишемия стимулирует устойчивую передачу сигналов Ca2+ астроцитами in vivo», Glia 57(7), 767–776 (2009) [doi:10.1002/glia.20804].
- 25.↵
H. Monai et al., «Антагонизм адренергических рецепторов вызывает нейропротекцию и облегчает восстановление после острого ишемического инсульта», Proc. Натл. акад. науч. США 166(22), 11010–11019, Национальная академия наук (2019) [doi:10.1073/pnas.1817347116].
- 26.↵
H. Monai et al., «Адренергическое ингибирование способствует нормализации внеклеточного калия после распространяющейся деполяризации коры», Sci. Представитель 11 (1), 8150, научный представитель (2021) [doi: 10.1038 / s41598-021-87609-ж].
- 27.↵
J. J. Iliff et al., «Парасосудистый путь облегчает поток спинномозговой жидкости через паренхиму головного мозга и клиренс интерстициальных растворенных веществ, включая амилоид β;.
 », Sci. Перевод Мед. 4(147), 147ra111 (2012) [doi:10.1126/scitranslmed.3003748].
», Sci. Перевод Мед. 4(147), 147ra111 (2012) [doi:10.1126/scitranslmed.3003748]. - 28.↵
L. Xie et al., «Сон способствует выведению метаболитов из мозга взрослого человека», Science 342(6156), 373–377 (2013) [doi:10.1126/science.4241222 ].
Наверх
Magnetresonanztomographie Der Gehirnsklerose Mikrostroke Weiße Flecken Im Gehirn Stock Video und mehr Clips von Anatomie
Videos
- Bilder
- Fotos
- Grafiken
- Vektoren
- Videos
Beschreibung
Магнитно-резонансная томография Gehirnsklerose Mikrostroke weiße Flecken im Gehirn
Essentials Kollektion
HD Web
HD
HD
45,00 € € Free Diesen Videoclip
9000 2 9000 29000 2
9000 2
9000 2
9000 2
9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000.
 Abonnement
Abonnement(10 лучших изображений, видео или музыкальное сопровождение за 128,00 €)
Optionen und Preise ansehenUmfasst unsere Standardlizenz.
Erweiterte Lizenz hinzufügen.
Изображение:maxximmm
Stock-Video-ID:601788530
Дата публикации:
Категория:Видео | Anatomie
Suchbegriffe
- Anatomie Videos,
- Bildkomposition und Technik Videos,
- Computertomogramm Videos,
- Film — Filmtechnik Videos,
- Gehirn Videos,
- Gesundheitswesen und Medizin Videos,
- HD-Format Videos,
- Горизонтальные видео,
- Inneres Organ eines Menschen Videos,
- Krankenhaus Videos,
- Krankheit Videos,
- Magnet Videos,
- Menschen Videos,
- Sclerosis Videos,
- Technologie Videos,
- Tomografie Videos,
- Ärztliche Untersuchung Videos,
Alle anzeigen
Kategorien
- Gesundheitswesen und Medizin
Häufig gestellte Fragen
- Lizenist e frezine
9051
- Bei lizenzfreien Lizenzen bezahlen Sie einmalig und können urheberrechtlich geschützte Bilder und Videoclips fortlaufend in privaten und kommerziellen Projekten nutzen, ohne bei jeder Verwendung zusätzlich bezahlen zu müssen.

- .1011111.11.10.466928
- .1101111.11.10.466928


 Одновременная визуализация кровотока в целевом сосуде с использованием декстрана FITC позволила подтвердить окклюзию сосуда и предотвратить избыточное облучение, которое может вызвать непреднамеренное фотоповреждение.
Одновременная визуализация кровотока в целевом сосуде с использованием декстрана FITC позволила подтвердить окклюзию сосуда и предотвратить избыточное облучение, которое может вызвать непреднамеренное фотоповреждение. Например, сотни микросфер диаметром 20-50 мкм были перфузированы в верхние отделы мозгового кровообращения 5 , например, во внутреннюю сонную артерию, чтобы вызвать эмболический ишемический инсульт в нижних артериолах. Инфузия микросфер создает значительную хирургическую нагрузку и по своей природе формирует инфаркты в нескольких местах. Поскольку локализация инфарктов несколько произвольна и иногда эктопична, этот метод не является оптимальным для наблюдения влияния однососудистой окклюзии микроскопическим визуализация in vivo .
Например, сотни микросфер диаметром 20-50 мкм были перфузированы в верхние отделы мозгового кровообращения 5 , например, во внутреннюю сонную артерию, чтобы вызвать эмболический ишемический инсульт в нижних артериолах. Инфузия микросфер создает значительную хирургическую нагрузку и по своей природе формирует инфаркты в нескольких местах. Поскольку локализация инфарктов несколько произвольна и иногда эктопична, этот метод не является оптимальным для наблюдения влияния однососудистой окклюзии микроскопическим визуализация in vivo . Фототромбоз имеет преимущество выбора целевой области по сравнению с другими методами, поскольку целевая область может быть указана с помощью освещения возбуждающим светом. Однако из-за природы однофотонной реакции фототромбоз не подходит для нацеливания на определенные сосуды внутри ткани головного мозга, поскольку поверхностные сосуды, включая капилляры, также подвергаются фототромбозу при еще более интенсивном свете. Кроме того, избыточное воздействие высокоинтенсивного возбуждающего света на кору головного мозга мыши может проникать в более глубокие структуры, такие как гиппокамп и полосатое тело, и закупоривать нецелевые области, делая неясной интерпретацию последующего результата. Кроме того, при точечном освещении области тромбоза не различаются артерии и вены.
Фототромбоз имеет преимущество выбора целевой области по сравнению с другими методами, поскольку целевая область может быть указана с помощью освещения возбуждающим светом. Однако из-за природы однофотонной реакции фототромбоз не подходит для нацеливания на определенные сосуды внутри ткани головного мозга, поскольку поверхностные сосуды, включая капилляры, также подвергаются фототромбозу при еще более интенсивном свете. Кроме того, избыточное воздействие высокоинтенсивного возбуждающего света на кору головного мозга мыши может проникать в более глубокие структуры, такие как гиппокамп и полосатое тело, и закупоривать нецелевые области, делая неясной интерпретацию последующего результата. Кроме того, при точечном освещении области тромбоза не различаются артерии и вены.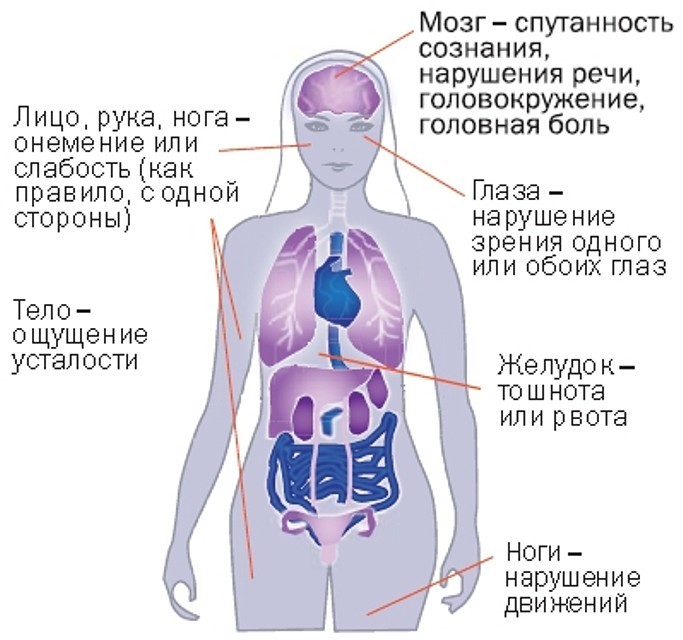 Здесь мы представляем альтернативный метод для направленного по глубине фототромбоза (DTPT), который можно легко использовать на стандартном двухфотонном микроскопе, оснащенном резонансным сканером. Используя этот метод, мы демонстрируем фототромбоз в одном сосуде или группе сосудов на заданной глубине до 300 мкм. Примечательно, что мы показываем, что фототромбоз индуцируется в течение 40 секунд лазерного освещения на глубине коры 300 мкм без нежелательных окклюзий выше и ниже цели. Эти особенности благоприятны для проспективных исследований микроинсультов, поскольку считается, что окклюзия отдельных целевых сосудов в паренхиме головного мозга имитирует тихий инсульт.
Здесь мы представляем альтернативный метод для направленного по глубине фототромбоза (DTPT), который можно легко использовать на стандартном двухфотонном микроскопе, оснащенном резонансным сканером. Используя этот метод, мы демонстрируем фототромбоз в одном сосуде или группе сосудов на заданной глубине до 300 мкм. Примечательно, что мы показываем, что фототромбоз индуцируется в течение 40 секунд лазерного освещения на глубине коры 300 мкм без нежелательных окклюзий выше и ниже цели. Эти особенности благоприятны для проспективных исследований микроинсультов, поскольку считается, что окклюзия отдельных целевых сосудов в паренхиме головного мозга имитирует тихий инсульт. После этого накладывали покровное стекло и фиксировали его стоматологическим цементом. Металлический каркас головы, который подходит к держателю для головы MAG-3 (Narishige, Япония), был прикреплен к черепу, а оставшийся открытый череп был покрыт стоматологическим цементом.
После этого накладывали покровное стекло и фиксировали его стоматологическим цементом. Металлический каркас головы, который подходит к держателю для головы MAG-3 (Narishige, Япония), был прикреплен к черепу, а оставшийся открытый череп был покрыт стоматологическим цементом. Свет излучения разделялся дихроичным зеркалом (562 нм, Chroma) с полосовыми фильтрами 525/50 нм и 607/70 нм (оба от Chroma) для зеленого и красного каналов соответственно. Микроскоп работал с использованием программного обеспечения ThorImage LS версии 4.0.
Свет излучения разделялся дихроичным зеркалом (562 нм, Chroma) с полосовыми фильтрами 525/50 нм и 607/70 нм (оба от Chroma) для зеленого и красного каналов соответственно. Микроскоп работал с использованием программного обеспечения ThorImage LS версии 4.0. Затем длина волны возбуждающего света была изменена на 720 нм, а глубина фокуса была отрегулирована в соответствии с просветом целевого сосуда с использованием минимально возможной мощности лазера (2,9 мВт). Затем область сканирования была ограничена путем увеличения цифрового увеличения, чтобы включить только целевой сосуд. Для запуска фототромбоза на выходе из линзы объектива устанавливали мощность лазера 31 мВт и сканировали выбранную область с высокой частотой кадров (30–60 Гц, в зависимости от сканируемой области) при мониторинге полученных изображений в режиме реального времени. . Если имеется, дальний красный канал обнаружения должен быть отключен для защиты ФЭУ. Сканирование прекращали при образовании тромбов.
Затем длина волны возбуждающего света была изменена на 720 нм, а глубина фокуса была отрегулирована в соответствии с просветом целевого сосуда с использованием минимально возможной мощности лазера (2,9 мВт). Затем область сканирования была ограничена путем увеличения цифрового увеличения, чтобы включить только целевой сосуд. Для запуска фототромбоза на выходе из линзы объектива устанавливали мощность лазера 31 мВт и сканировали выбранную область с высокой частотой кадров (30–60 Гц, в зависимости от сканируемой области) при мониторинге полученных изображений в режиме реального времени. . Если имеется, дальний красный канал обнаружения должен быть отключен для защиты ФЭУ. Сканирование прекращали при образовании тромбов. Усы на блочной диаграмме представляют более короткий диапазон данных или предел выбросов. Пределы выбросов определяются как q3 + 1 . 5 × (q3 – q1) и q1 – 1 . 5 × (q3 – q1) , где q1 и q3 — это 25-й и 75-й процентили выборочных данных.
Усы на блочной диаграмме представляют более короткий диапазон данных или предел выбросов. Пределы выбросов определяются как q3 + 1 . 5 × (q3 – q1) и q1 – 1 . 5 × (q3 – q1) , где q1 и q3 — это 25-й и 75-й процентили выборочных данных. 1 (б)). После внутривенного введения бенгальского розового длина волны была изменена на 720 нм, а глубина сканирования (фокус по оси Z) была перенастроена для сканирования внутри просвета с минимальной интенсивностью лазера с частотой кадров 30 или 60 Гц. После установки мишени мощность лазера устанавливалась на 31 мВт (на выходе из линзы объектива). Напряжение ФЭУ и усиление усилителя были установлены на низкие значения, чтобы обеспечить одновременный мониторинг фототромбоза и кровотока в сосудах.
1 (б)). После внутривенного введения бенгальского розового длина волны была изменена на 720 нм, а глубина сканирования (фокус по оси Z) была перенастроена для сканирования внутри просвета с минимальной интенсивностью лазера с частотой кадров 30 или 60 Гц. После установки мишени мощность лазера устанавливалась на 31 мВт (на выходе из линзы объектива). Напряжение ФЭУ и усиление усилителя были установлены на низкие значения, чтобы обеспечить одновременный мониторинг фототромбоза и кровотока в сосудах. Визуализацию целевого кровеносного сосуда с длиной волны 720 нм проводили до образования коагуляции. (d) Завершение окклюзии можно определить по фотообесцвечиванию бенгальской розы и FITC. (e) В небольшом числе случаев наблюдались разрывы кровеносных сосудов или ожоги тканей. (f) Вероятность успеха DTPT составила 84,9.±1,7%, в то время как в 6,1±2,5% случаев не было окклюзии (без изменений) и в 9,0±2,1% случаев наблюдалось жжение/разрыв ткани (окклюзия: 84/99, без изменений: 6/99, жжение/разрыв ткани сосуды 9/99, 4 мыши). (g) Контрольные образцы с одним декстраном FITC-150k не показали окклюзии или ожога/разрыва ткани через 150 секунд (103 кровеносных сосуда, 3 мыши). Шкала баров: (а) 200 мкм; (б), (в), (г), (д): 10 мкм.
Визуализацию целевого кровеносного сосуда с длиной волны 720 нм проводили до образования коагуляции. (d) Завершение окклюзии можно определить по фотообесцвечиванию бенгальской розы и FITC. (e) В небольшом числе случаев наблюдались разрывы кровеносных сосудов или ожоги тканей. (f) Вероятность успеха DTPT составила 84,9.±1,7%, в то время как в 6,1±2,5% случаев не было окклюзии (без изменений) и в 9,0±2,1% случаев наблюдалось жжение/разрыв ткани (окклюзия: 84/99, без изменений: 6/99, жжение/разрыв ткани сосуды 9/99, 4 мыши). (g) Контрольные образцы с одним декстраном FITC-150k не показали окклюзии или ожога/разрыва ткани через 150 секунд (103 кровеносных сосуда, 3 мыши). Шкала баров: (а) 200 мкм; (б), (в), (г), (д): 10 мкм. 1(c), слева). Первоначально к стенке кровеносного сосуда начали прикрепляться тромбоциты и эритроциты (рис. 1(в), середина). После этого красные кровяные тельца (эритроциты) образовали сгусток, и кровоток постепенно нарушился (рис. 1(с), справа; видео 1). Окклюзия сосуда наблюдалась по появлению на изображении застойных эритроцитов. Кроме того, красители, содержащие кровь, быстро обесцвечивались и после полной окклюзии, что можно использовать как признак окклюзии (рис. 1(г)). В большинстве случаев окклюзия индуцировалась в течение 80 с облучения 720 нм (рис. 1(f), 84/9).9 сосудов, 4 мыши), хотя мы наблюдали несостоятельность окклюзии или разрыв/прижигание ткани при небольшом количестве попыток (рис. 1(f)). Напротив, в FITC-контроле не было обнаружено ни окклюзии, ни прикрепления тромбоцитов к стенкам сосудов даже при облучении до 150 с (рис. 1(g)).
1(c), слева). Первоначально к стенке кровеносного сосуда начали прикрепляться тромбоциты и эритроциты (рис. 1(в), середина). После этого красные кровяные тельца (эритроциты) образовали сгусток, и кровоток постепенно нарушился (рис. 1(с), справа; видео 1). Окклюзия сосуда наблюдалась по появлению на изображении застойных эритроцитов. Кроме того, красители, содержащие кровь, быстро обесцвечивались и после полной окклюзии, что можно использовать как признак окклюзии (рис. 1(г)). В большинстве случаев окклюзия индуцировалась в течение 80 с облучения 720 нм (рис. 1(f), 84/9).9 сосудов, 4 мыши), хотя мы наблюдали несостоятельность окклюзии или разрыв/прижигание ткани при небольшом количестве попыток (рис. 1(f)). Напротив, в FITC-контроле не было обнаружено ни окклюзии, ни прикрепления тромбоцитов к стенкам сосудов даже при облучении до 150 с (рис. 1(g)). 2(а)). Мы обнаружили, что на успешность формирования окклюзии с помощью DTPT влияет время, прошедшее после инъекции бенгальской розы. Неудачные попытки произошли, когда после инъекции бенгальской розы прошло значительно больше времени, чем типичные успешные попытки (успешная окклюзия: 90,0 ± 0,6 минуты (n = 84), отсутствие окклюзии: 13,8 ± 1,6 минуты (n = 6) после инъекции бенгальского розового. Р=0,019) (рис. 2(б)). Эти результаты вместе с контролем только FITC (рис. 1 (g)) показали, что концентрация бенгальской розы внутри кровеносного сосуда имеет решающее значение для DTPT, а лазер возбуждения 720 нм надежно возбуждает бенгальскую розу.
2(а)). Мы обнаружили, что на успешность формирования окклюзии с помощью DTPT влияет время, прошедшее после инъекции бенгальской розы. Неудачные попытки произошли, когда после инъекции бенгальской розы прошло значительно больше времени, чем типичные успешные попытки (успешная окклюзия: 90,0 ± 0,6 минуты (n = 84), отсутствие окклюзии: 13,8 ± 1,6 минуты (n = 6) после инъекции бенгальского розового. Р=0,019) (рис. 2(б)). Эти результаты вместе с контролем только FITC (рис. 1 (g)) показали, что концентрация бенгальской розы внутри кровеносного сосуда имеет решающее значение для DTPT, а лазер возбуждения 720 нм надежно возбуждает бенгальскую розу.
 3 (d) и видео 3). Чтобы изучить эффект селективной окклюзии, мы наблюдали эту область через 3 дня. Мы обнаружили, что периферические кровеносные сосуды целевой плоскости также были окклюзированы, и была заметна экстравазация FITC вокруг оккулированных кровеносных сосудов (рис. 3 (e)).
3 (d) и видео 3). Чтобы изучить эффект селективной окклюзии, мы наблюдали эту область через 3 дня. Мы обнаружили, что периферические кровеносные сосуды целевой плоскости также были окклюзированы, и была заметна экстравазация FITC вокруг оккулированных кровеносных сосудов (рис. 3 (e)).
 Действительно, Делафонтен-Мартель и его коллеги продемонстрировали, что многофотонная окклюзия возможна при двухфотонном или трехфотонном возбуждении. В их исследовании двухфотонный фототромбоз достигался на глубине до 200 мкм от поверхности пиала, и требовалось значительно большее время облучения (до 300 секунд) при длине волны возбуждения 1000 нм 9 .0048 8 .
Действительно, Делафонтен-Мартель и его коллеги продемонстрировали, что многофотонная окклюзия возможна при двухфотонном или трехфотонном возбуждении. В их исследовании двухфотонный фототромбоз достигался на глубине до 200 мкм от поверхности пиала, и требовалось значительно большее время облучения (до 300 секунд) при длине волны возбуждения 1000 нм 9 .0048 8 . Хотя эмиссия флуоресценции не обязательно коррелирует с продукцией АФК, демонстрация повышенной возбудимости молекул при 720 нм побуждает к будущим исследованиям, чтобы охарактеризовать продукцию АФК на этой длине волны. Еще один методологический момент, который мы считаем важным для индукции эффективного фототромбоза, заключается в том, что мы сканируем просвет целевого сосуда и максимально избегаем облучения стенок сосуда (эндотелиальных клеток). Эта процедура в сочетании с одновременным облучением и визуализацией предназначена для обеспечения возбуждения бенгальского розового без нарушения целостности сосуда. В этом отношении необходимо провести DTPT вскоре после введения бенгальского розового, чтобы в плазме сохранялись достаточные уровни бенгальского розового.
Хотя эмиссия флуоресценции не обязательно коррелирует с продукцией АФК, демонстрация повышенной возбудимости молекул при 720 нм побуждает к будущим исследованиям, чтобы охарактеризовать продукцию АФК на этой длине волны. Еще один методологический момент, который мы считаем важным для индукции эффективного фототромбоза, заключается в том, что мы сканируем просвет целевого сосуда и максимально избегаем облучения стенок сосуда (эндотелиальных клеток). Эта процедура в сочетании с одновременным облучением и визуализацией предназначена для обеспечения возбуждения бенгальского розового без нарушения целостности сосуда. В этом отношении необходимо провести DTPT вскоре после введения бенгальского розового, чтобы в плазме сохранялись достаточные уровни бенгальского розового.