Малый ишемический инсульт: причины, симптомы и лечение всех видов заболеваний в ФНКЦ ФМБА
Малый инсульт может привести к серьезным последствиям
EnglishУкр/Рус
Безшейко В.Г.
- Издательство «МОРИОН»
Резюме. Выявлены факторы риска потери трудоспособности после малого инсульта и транзиторной ишемической атаки
Согласно результатам исследования, опубликованного в сентябре 2012 г. в журнале «Stroke», у большей части пациентов, перенесших транзиторную ишемическую атаку (ТИА) или малый инсульт, впоследствии наблюдается потеря трудоспособности. Доктор медицины Шелаг Каутс (Shelagh Coutts) из университета Калгари (University of Calgary) и соавторы получили эти данные, взяв за основу предыдущую работу, в которой выявлено, что у пациентов с легким ишемическим инсультом, не имевших показаний к проведению тромболизиса, не настолько хороший прогноз, как предполагали ранее. Главный автор также добавила, что у пациентов с закупоркой или сужением сосудов отмечен наибольший риск потери трудоспособности. Таким лицам необходимо в срочном порядке проводить инструментальную визуализацию мозга и сосудов для быстрого принятия решения о дальнейших профилактических мероприятиях.
В указанном исследовании приняли участие 499 пациентов с малым инсультом (<4 баллов по Шкале тяжести инсульта Национальных институтов здравоохранения США (National Institutes of Health Stroke Scale)) или ТИА. Всем участникам провели компьютерную томографию (КТ-)/КТ-ангиографию на протяжении первых 24 ч после появления симптомов.
На 90-е сутки после инсульта у 74 (15%) пациентов наблюдали потерю трудоспособности и снижение повседневной активности (>2 баллов по модифицированной шкале Ранкина). Ни один из этих случаев не был связан с осложнениями после каротидной реваскуляризации или антикоагулянтной терапии. Результаты анализа свидетельствуют, что факторами риска потери трудоспособности на 90-й день были сахарный диабет, женский пол, продолжение симптоматики вплоть до первого медицинского обследования в экстренном отделении и выявление патологических изменений при КТ/КТ-ангиографии (таблица).
Таблица Предикторы потери трудоспособности в мультивариантном анализе
| Фактор | Относительный риск (95% доверительный интервал) | р |
|---|---|---|
| Симптоматика во время первого медицинского осмотра | 2,4 (1,3–4,4) | 0,004 |
| Сахарный диабет | 2,3 (1,2–4,3) | 0,009 |
| Женский пол | 1,8 (1,1–3) | 0,025 |
| Изменения по результатам КТ/КТ-ангиографии | 2,4 (1,4–4) | 0,001 |
У 19 пациентов из 74 с потерей трудоспособности в последующем развилось рекуррентное событие (у 9 — прогрессирование симптомов и у 10 — повторный инсульт).
По мнению авторов, наличие у пациента продолжающейся симптоматики во время первого медицинского осмотра и патологических изменений по результатам КТ/КТ-ангиографии должно рассматриваться как показание к проведению тромболизиса даже в случае малого инсульта или ТИА, поскольку именно эта группа пациентов находится в группе высокого риска по потере трудоспособности.
Brooks M. (2012) Minor stroke can cause major disability. Medscape, September 20 (http://www.medscape.com/viewarticle/771263).
Coutts S.B., Modi J., Patel S.K. et al. (2012) What causes disability after Ischemic attack and minor stroke? Results from the CT and MRI in the triage of TIA and minor cerebrovascular events to identify high risk patients (CATCH) study. Stroke, September 13 [Epub ahead of print].
Виталий Безшейко
Якщо ви помітили помилку, виділіть текст з помилкою і натисніть Ctrl + Enter, щоб повідомити про це.
Транзиторные ишемические атаки и малые инсульты: современные терапевтические стратегии | #05/20
Ишемический инсульт (ИИ) и инфаркт миокарда (ИМ) — сосудистые катастрофы, которые в последние десятилетия занимают лидирующее положение среди причин преждевременной смерти. Известно, что транзиторные ишемические атаки (ТИА) являются сильным предиктором не только острых нарушений мозгового кровообращения (ОНМК), но и других сосудистых событий, в том числе острого коронарного синдрома (ОКС) и артериальных тромбозов другой локализации [1, 2]. Активное ведение больных с ТИА предполагает агрессивную терапию антитромботическими, гиполипидемическими и антигипертензивными средствами и может существенно уменьшить количество фатальных сосудистых событий и инсультов с грубым неврологическим дефицитом.ТИА — предиктор сосудистой катастрофы
Распределение риска сосудистых событий после ТИА происходит неравномерно: на первый год приходится более 50% случаев [1]. В первые 90 дней после ТИА риск инсульта приближается к 30% [3].
Кратковременная обратимая дисфункция головного мозга, связанная с сосудистыми причинами, — наиболее удачный для пациента дебют ОНМК. Ведь около 80% всех инсультов — это впервые возникшее сосудистое событие, которое без всякого предупреждения лишает жизни около 40% больных и оставляет инвалидами почти всех, переживших сосудистую катастрофу [5, 6].
По современным представлениям ТИА — это гетерогенный клинический синдром острой церебральной ишемии с внезапным появлением очаговых неврологических симптомов, которые сохраняются короткое время (в среднем 12–15 минут) [3].
Развитие у больного ТИА — это всегда клиническая манифестация опасной сердечно-сосудистой патологии и основание для детального обследования с целью уточнения причин и механизмов декомпенсации мозгового кровообращения в соответствии с современными представлениями о прецизионной медицине [7–9]. Комплекс такого обследования может включать в себя широкий сердечно-сосудистый скрининг (дуплексное сканирование экстра- и интракраниальных артерий головного мозга, ЭКГ, ЭхоКГ, лабораторные тесты и др.). Однако ключевым моментом диагностики является нейровизуализация (компьютерная томография — КТ, магнитно-резонансная томография — МРТ). Результаты КТ (МРТ) могут оказать существенное влияние на выбор лечебной тактики. Выраженные признаки атрофии, перивентрикулярный лейкоареоз, увеличение периваскулярных пространств, следы мелких субкортикальных кровоизлияний и лакунарных инфарктов — биомаркеры болезни мелких артерий (SVD), которые указывают на высокий риск внутричерепных кровоизлияний (ВЧК). Возможность развития ВЧК — главное препятствие агрессивного ведения больных с признаками острой церебральной ишемии. Тенденция роста ВЧК стала особенно заметной в последние годы и может быть связана с более активным применением антитромботической терапии в клинической практике [3, 10].
Комплекс такого обследования может включать в себя широкий сердечно-сосудистый скрининг (дуплексное сканирование экстра- и интракраниальных артерий головного мозга, ЭКГ, ЭхоКГ, лабораторные тесты и др.). Однако ключевым моментом диагностики является нейровизуализация (компьютерная томография — КТ, магнитно-резонансная томография — МРТ). Результаты КТ (МРТ) могут оказать существенное влияние на выбор лечебной тактики. Выраженные признаки атрофии, перивентрикулярный лейкоареоз, увеличение периваскулярных пространств, следы мелких субкортикальных кровоизлияний и лакунарных инфарктов — биомаркеры болезни мелких артерий (SVD), которые указывают на высокий риск внутричерепных кровоизлияний (ВЧК). Возможность развития ВЧК — главное препятствие агрессивного ведения больных с признаками острой церебральной ишемии. Тенденция роста ВЧК стала особенно заметной в последние годы и может быть связана с более активным применением антитромботической терапии в клинической практике [3, 10].
Ключевая проблема выбора лечебной стратегии
Агрессивная терапия получила обоснование и развитие в коронарной кардиологии, где сложившаяся фармакоинвазивная стратегия ведения больных с ОКС продемонстрировала высокую эффективность и привела к значительному снижению случаев ИМ [11, 12]. Хотя клиническое, этиологическое и патогенетическое сходство ОКС без подъема ST и ТИА представляется очевидным, существуют и значительные различия, обусловленные высокой гетерогенностью цереброваскулярной патологии [7, 13]. Суть этих различий касается как патогенеза, так и клинических проявлений кратковременного эпизода острой ишемии сердца или мозга. ОКС в 95% случаев обусловлен коронарным атеросклерозом, в развитии синдрома ТИА непосредственное участие атеросклероза экстра- или интракраниальных артерий обнаруживается только у одного больного из трех. Микроангиопатии, в том числе амилоидная, часто становятся причинами локальных нарушений церебральной гемодинамики, создавая условия для возникновения мелких субкортикальных инфарктов мозга, клиническая картина которых характеризуется парциальными инсультами с быстрым регрессом очаговых неврологических симптомов (малый ИИ). Церебральная микроангиопатия увеличивает риск внутричерепных кровоизлияний, и это существенно отличает ТИА от ОКС [12–15].
Хотя клиническое, этиологическое и патогенетическое сходство ОКС без подъема ST и ТИА представляется очевидным, существуют и значительные различия, обусловленные высокой гетерогенностью цереброваскулярной патологии [7, 13]. Суть этих различий касается как патогенеза, так и клинических проявлений кратковременного эпизода острой ишемии сердца или мозга. ОКС в 95% случаев обусловлен коронарным атеросклерозом, в развитии синдрома ТИА непосредственное участие атеросклероза экстра- или интракраниальных артерий обнаруживается только у одного больного из трех. Микроангиопатии, в том числе амилоидная, часто становятся причинами локальных нарушений церебральной гемодинамики, создавая условия для возникновения мелких субкортикальных инфарктов мозга, клиническая картина которых характеризуется парциальными инсультами с быстрым регрессом очаговых неврологических симптомов (малый ИИ). Церебральная микроангиопатия увеличивает риск внутричерепных кровоизлияний, и это существенно отличает ТИА от ОКС [12–15].
Клинические различия в свою очередь во многом определяют выбор лечебной стратегии. Боль является демонстративным признаком ОКС и способствует сокращению времени от появления первых признаков болезни до контакта с врачом. Что касается ТИА, то кратковременные очаговые симптомы не всегда приводят больного к решению о необходимости госпитализации. Для уточнения диагноза в распоряжении кардиолога или врача первого контакта есть надежный метод диагностики (ЭКГ), а для уточнения характера повреждений мозга такого метода диагностики нет.
Однако эти различия не могут служить оправданием практики наблюдения и пассивного ведения больных с ТИА. Около 40% пациентов с симптомами ТИА получают медицинскую помощь лишь через 24 часа, а время (медиана) от появления первых симптомов ОНМК до контакта с врачом составляет 4,5 часа (у больных с ОКС — 2,2 часа) [14].
Принципиально новой представляется современная тенденция распространения «кардиологического» подхода к ведению больных с ОКС на пациентов с ТИА [15]. Агрессивная терапия в первые минуты и часы ТИА основана на применении ДАТ в виде комбинации двух препаратов — ацетилсалициловой кислоты (АСК) и клопидогрела (К). Нагрузочные дозы (300–325 мг для АСК и до 300 мг для К) были использованы в клинических исследованиях, результаты которых показали снижение вероятности инсульта в течение 90 дней после ТИА на 32% [16, 17]. Легализация ДАТ в неотложной сосудистой неврологии не закончена и еще находится в стадии накопления и анализа результатов клинической практики. Российские рекомендации национальной ассоциации по борьбе с инсультом 2015 г. по лечению ТИА и ишемического инсульта у взрослых оставляют возможность ДАТ только для коморбидных пациентов с кардиологическими показаниями. Клинические рекомендации Американской ассоциации кардиологов 2018 г. разрешают ДАТ при ТИА и малых инсультах, допуская возможность продления такой терапии до 3 месяцев [18]. Последние европейские руководства демонстрируют осторожный подход к агрессивной антитромботической терапии, ограничивая продолжительность ДАТ 10–21 днями [19]. Существенные ограничения ДАТ для больных с цереброваскулярной патологией обусловлены возможностью ВЧК, вероятность которых зависит от возраста больных и патологических изменений тканей головного мозга, среди которых основное значение имеют метаболические, амилоидные и наследственные ангиопатии [13, 20, 21]. Для выбора эффективной и безопасной антитромботической терапии у больных с клинической картиной ТИА необходимо использовать визуализацию мозга, без которой агрессивная ДАТ невозможна.
по лечению ТИА и ишемического инсульта у взрослых оставляют возможность ДАТ только для коморбидных пациентов с кардиологическими показаниями. Клинические рекомендации Американской ассоциации кардиологов 2018 г. разрешают ДАТ при ТИА и малых инсультах, допуская возможность продления такой терапии до 3 месяцев [18]. Последние европейские руководства демонстрируют осторожный подход к агрессивной антитромботической терапии, ограничивая продолжительность ДАТ 10–21 днями [19]. Существенные ограничения ДАТ для больных с цереброваскулярной патологией обусловлены возможностью ВЧК, вероятность которых зависит от возраста больных и патологических изменений тканей головного мозга, среди которых основное значение имеют метаболические, амилоидные и наследственные ангиопатии [13, 20, 21]. Для выбора эффективной и безопасной антитромботической терапии у больных с клинической картиной ТИА необходимо использовать визуализацию мозга, без которой агрессивная ДАТ невозможна.
Предлагаемый алгоритм (рис. ) сочетает в себе возможность неотложного применения антитромботической терапии у больного с клиническими признаками ТИА с безопасностью. Единственное несоответствие предлагаемого алгоритма действующим клиническим рекомендациям по ведению больных с ТИА и ишемическим инсультом касается применения АСК (Аспирина) в качестве средства неотложной помощи, которое применяется в первые минуты и часы ОНМК в нагрузочной дозе 300–325 мг. Клинические рекомендации в качестве единственного эффективного метода лечения ИИ определяют внутривенную тромболитическую терапию (класс I, уровень А), оставляя тромбоцитарным антиагрегантам роль вторичной профилактики ИИ с началом терапии через 24 часа после тромболизиса.
) сочетает в себе возможность неотложного применения антитромботической терапии у больного с клиническими признаками ТИА с безопасностью. Единственное несоответствие предлагаемого алгоритма действующим клиническим рекомендациям по ведению больных с ТИА и ишемическим инсультом касается применения АСК (Аспирина) в качестве средства неотложной помощи, которое применяется в первые минуты и часы ОНМК в нагрузочной дозе 300–325 мг. Клинические рекомендации в качестве единственного эффективного метода лечения ИИ определяют внутривенную тромболитическую терапию (класс I, уровень А), оставляя тромбоцитарным антиагрегантам роль вторичной профилактики ИИ с началом терапии через 24 часа после тромболизиса.
Опасение негативного влияния предварительного приема Аспирина на результаты тромболизиса послужили основанием для отказа от антиагрегантов как средства неотложной помощи. Однако клиническая практика показала, что тромболизис доступен менее 10% больных с ОНМК, а предварительный прием Аспирина не является противопоказанием для применения активаторов плазминогена и не оказывает существенного влияния на результаты тромболизиса [18]. В соответствии с алгоритмом (рис.) решение о проведении ДАТ может быть принято только после визуализации мозга, которая позволяет исключить высокую вероятность ВЧК. Дальнейшее кардионеврологическое обследование открывает возможности дифференцированной антитромботической терапии в зависимости от механизмов преходящей ишемии миокарда. Для пациентов с болезнью мелких артерий, например, это может быть цилостазол, а для пациентов с вероятным кардиогенным механизмом ТИА — антикоагулянты.
В соответствии с алгоритмом (рис.) решение о проведении ДАТ может быть принято только после визуализации мозга, которая позволяет исключить высокую вероятность ВЧК. Дальнейшее кардионеврологическое обследование открывает возможности дифференцированной антитромботической терапии в зависимости от механизмов преходящей ишемии миокарда. Для пациентов с болезнью мелких артерий, например, это может быть цилостазол, а для пациентов с вероятным кардиогенным механизмом ТИА — антикоагулянты.
Таким образом, антитромботическая терапия является ключевой стратегией ведения больных с ТИА. Кратковременная церебральная ишемия с нестойкими очаговыми неврологическими симптомами требует неотложного лечения. Больные с ТИА не являются кандидатами для тромболизиса, и ранняя терапия антиагрегантами не может ограничить возможности дальнейшего лечения таких пациентов.
Контроль артериального давления и гиполипидемическая терапия
Артериальная гипертония (АГ) — важнейший фактор риска ИИ и частый спутник острого периода сосудистой катастрофы. Причины АГ в остром периоде ИИ связывают с активацией нейроэндокринных и нейрогенных механизмов регуляции АД, ишемией стволовых структур мозга, госпитальным стрессом, срывом ауторегуляции мозгового кровообращения [22, 23]. Оптимальные значения систолического и диастолического АД в острой фазе ИИ не установлены, и у клиницистов нет на этот счет единого мнения. Крупное исследование, которое должно ответить на этот вопрос, в настоящее время выполняется [22]. Однако действующие клинические рекомендации содержат конкретные параметры АД, которых следует придерживаться в первые часы и дни после появления симптомов ОНМК [18, 24]. Значения систолического АД в первые сутки ИИ ниже 180, а диастолического — ниже 110 мм рт. ст. считаются оправданными. Другими словами, артериальная гипертония в первые часы острой церебральной ишемии трактуется как один из механизмов компенсации нарушенного мозгового кровообращения.
Причины АГ в остром периоде ИИ связывают с активацией нейроэндокринных и нейрогенных механизмов регуляции АД, ишемией стволовых структур мозга, госпитальным стрессом, срывом ауторегуляции мозгового кровообращения [22, 23]. Оптимальные значения систолического и диастолического АД в острой фазе ИИ не установлены, и у клиницистов нет на этот счет единого мнения. Крупное исследование, которое должно ответить на этот вопрос, в настоящее время выполняется [22]. Однако действующие клинические рекомендации содержат конкретные параметры АД, которых следует придерживаться в первые часы и дни после появления симптомов ОНМК [18, 24]. Значения систолического АД в первые сутки ИИ ниже 180, а диастолического — ниже 110 мм рт. ст. считаются оправданными. Другими словами, артериальная гипертония в первые часы острой церебральной ишемии трактуется как один из механизмов компенсации нарушенного мозгового кровообращения.
Единственный аргумент, который поддерживает тактику сохранения относительного высокого уровня АД в остром периоде ИИ, заключается в предположении о лучшей перфузии ткани мозга в области ишемии при высоком системном давлении в условиях срыва ауторегуляции [24, 25]. Однако результаты последних исследований не подтверждают это предположение. В исследовании ENCHANTED (2019) больные с ИИ (n = 2227) в первые сутки были разделены на две группы: группа с уровнем АД меньше 180 мм рт. ст. (в соответствии с действующими рекомендациями) и группа интенсивного снижения АД (130–140 мм рт. ст.). Не было обнаружено существенных различий по исходам лечения (шкала Рэнкина), но в группе высокого АД было больше внутримозговых кровоизлияний [26].
Однако результаты последних исследований не подтверждают это предположение. В исследовании ENCHANTED (2019) больные с ИИ (n = 2227) в первые сутки были разделены на две группы: группа с уровнем АД меньше 180 мм рт. ст. (в соответствии с действующими рекомендациями) и группа интенсивного снижения АД (130–140 мм рт. ст.). Не было обнаружено существенных различий по исходам лечения (шкала Рэнкина), но в группе высокого АД было больше внутримозговых кровоизлияний [26].
Предположение о благоприятном влиянии высокого систолического АД на поврежденный мозг представляется неубедительным и в отношении периваскулярного отека — у больных с высокими значениями АД и формирующимся инфарктом мозга отек в зоне повреждения более выражен [27]. Еще менее обоснованным выглядит сохранение «лечебной» артериальной гипертонии у больных с ТИА. Преходящая фокальная церебральная ишемия очень часто ассоциируется с гипертоническим кризом, церебральным вазоспазмом и тромбоэмболией. Во всех случаях ТИА очаг повреждения или очень маленький, или не формируется вовсе.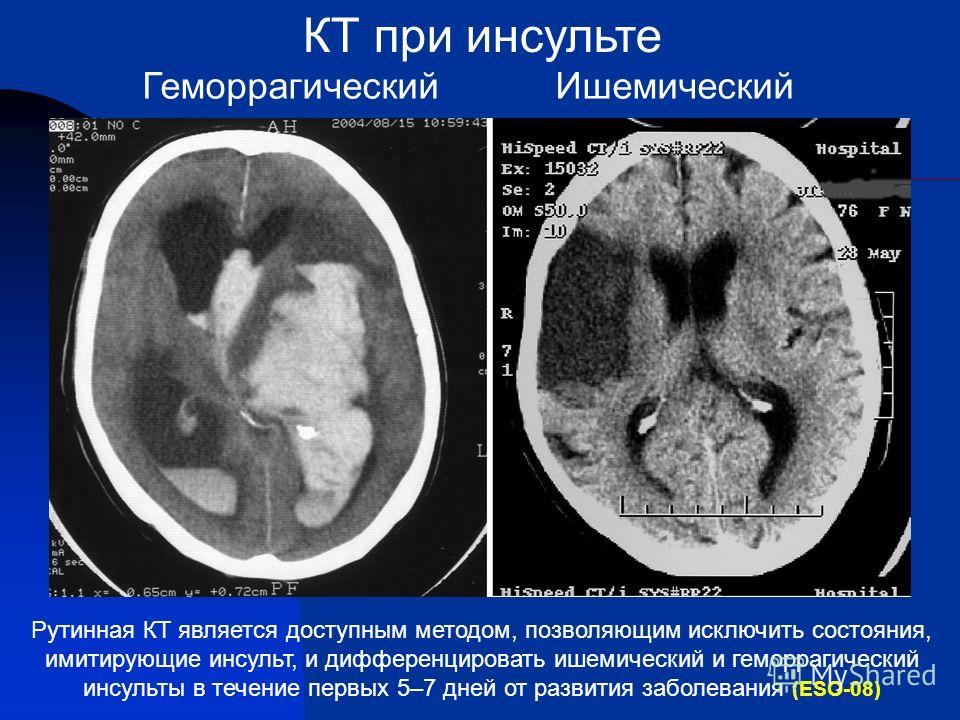 При всем сходстве этиологии, патогенез ИИ и ТИА существенно отличается. Основное отличие заключается в отсутствии инфаркта мозга при ТИА. Этот факт существенно уменьшает вероятность ВЧК и позволяет проводить более агрессивное лечение с применением антигипертензивных и антитромботических средств. Это касается и гиполипидемической терапии статинами, которая не упоминается в руководствах по ведению больных в остром периоде инсульта, но активно используется при ТИА [3, 28].
При всем сходстве этиологии, патогенез ИИ и ТИА существенно отличается. Основное отличие заключается в отсутствии инфаркта мозга при ТИА. Этот факт существенно уменьшает вероятность ВЧК и позволяет проводить более агрессивное лечение с применением антигипертензивных и антитромботических средств. Это касается и гиполипидемической терапии статинами, которая не упоминается в руководствах по ведению больных в остром периоде инсульта, но активно используется при ТИА [3, 28].
Обсуждение
Транзиторные ишемические атаки часто предшествуют развитию более тяжелых форм ОНМК, артериальных тромбозов другой локализации и требуют детальной диагностики причин и механизмов преходящей церебральной ишемии. С внедрением в клиническую практику современных методов визуализации мозга, ультразвуковых исследований сердца и сосудов, чувствительных лабораторных тестов изменились и представления о природе ТИА. Время сохранения очаговых неврологических симптомов как критерий диагностики ТИА уже не является ключевым признаком, который определяет диагноз. Совершенно очевидно, что 24 часа — это слишком большой диагностический период, который ограничивает выбор лечебной стратегии. Результаты тайм-анализа демонстрируют, что только 5 минут клинических проявлений очаговых неврологических симптомов более или менее надежно гарантируют от развития инфаркта мозга. Если очаговые симптомы сохраняются 6–30 минут, то МРТ показывает повреждения мозга в 33% случаев, более 12 часов — в 71% [1, 15]. Средняя продолжительность клинических проявлений ТИА — 12–14 мин. Таким образом, сохранение очаговых неврологических симптомов в течение суток — это всегда инфаркт мозга, но не всегда инсульт как клинический синдром.
Совершенно очевидно, что 24 часа — это слишком большой диагностический период, который ограничивает выбор лечебной стратегии. Результаты тайм-анализа демонстрируют, что только 5 минут клинических проявлений очаговых неврологических симптомов более или менее надежно гарантируют от развития инфаркта мозга. Если очаговые симптомы сохраняются 6–30 минут, то МРТ показывает повреждения мозга в 33% случаев, более 12 часов — в 71% [1, 15]. Средняя продолжительность клинических проявлений ТИА — 12–14 мин. Таким образом, сохранение очаговых неврологических симптомов в течение суток — это всегда инфаркт мозга, но не всегда инсульт как клинический синдром.
Возникает вопрос, где находится граница между ТИА и ИИ? Лежит ли в основе этих различий клиническая симптоматика или результат визуализации мозга? Вероятно, ТИА как гетерогенный клинический синдром имеет право на существование только до получения результатов МРТ или КТ. Этот диагноз будет окончательным, если визуализация не показывает очаговых повреждений мозга, соответствующих клиническим проявлениям ОНМК. Однако если повреждения мозга верифицированы, а клиническая картина регрессировала, это так называемый «малый» ИИ.
Однако если повреждения мозга верифицированы, а клиническая картина регрессировала, это так называемый «малый» ИИ.
Необходимость разделения этих двух фенотипов ОНМК представляется очевидной, поскольку существующие различия требуют разных лечебных стратегий. Если использовать сложившиеся в кардиологии диагностические критерии, то ТИА — это острое неотложное состояние, близкое по своей сущности к ОКС без подъема ST, тогда как малый ИИ — по клиническим проявлениям и патогенезу ближе к ОКС с подъемом ST. Верификация кардиологического диагноза возможна в кратчайшие сроки и базируется на результатах ЭКГ и определении уровня тропонина. В сосудистой неврологии, к сожалению, нет надежных лабораторных и электрофизиологических биомаркеров повреждения мозга, и только визуализация может служить надежным критерием дифференциальной диагностики.
Это приводит к необходимости сосуществования двух понятий: «ТИА-синдром» и «ТИА-диагноз». ТИА как гетерогенный клинический синдром не требует верификации с помощью КТ или МРТ, но служит достаточным основанием для неотложной терапии. Как минимум такие больные должны получить нагрузочную дозу Аспирина (300–325 мг) в желудочно-растворимой форме (не энтерик) — как это принято для больных с ОКС без подъема ST.
Как минимум такие больные должны получить нагрузочную дозу Аспирина (300–325 мг) в желудочно-растворимой форме (не энтерик) — как это принято для больных с ОКС без подъема ST.
Нагрузочные дозы статинов и антигипертензивная терапия с целевыми значениями 130/80 мм рт. ст. безопасны для больных с кратковременной дисфункцией мозга. Основной аргумент сторонников относительно высокого АД в острой фазе ИИ (необходимость высокого перфузионного давления в зоне ишемического повреждения) не состоятелен, если нет признаков формирования ишемического очага.
Агрессивная терапия больных с ТИА приводит к снижению вероятности ИИ в ближайшие дни после ТИА до 80% при крайне низкой опасности кровотечений [1, 15]. Однако агрессивные методы лечения неприемлемы для больных с так называемыми малыми ИИ. Клинический критерий «малый инсульт» не раскрывает гетерогенной природы болезни мелких артерий, в основе которой лежат церебральные ангиопатии (наследственная, амилоидная, гипертоническая, метаболическая). Повреждение мелких артерий увеличивает риск внутримозговых кровоизлияний и делает риск агрессивной антитромботической терапии неоправданно высоким [13, 29].
Повреждение мелких артерий увеличивает риск внутримозговых кровоизлияний и делает риск агрессивной антитромботической терапии неоправданно высоким [13, 29].
Заключение
Транзиторные ишемические атаки как клинический вариант ОНМК должны восприниматься в качестве биомаркера неблагоприятного течения заболевания сердечно-сосудистой системы и предиктора фатального сосудистого события. Такие больные требуют неотложной госпитализации и агрессивного лечения в той же степени, что и больные с ОКС. Сложившееся в клинической практике и получившее отражение в действующих клинических рекомендациях представление о сходстве ТИА и малого ИИ требует переоценки в связи с новыми данными о гетерогенности малых инсультов и различий в лечебной стратегии. Лакунарные ИИ, которые часто протекают с негрубым неврологическим дефицитом, могут быть обусловлены церебральными ангиопатиями, требующими осторожного применения антитромботических средств. Агрессивная антитромботическая терапия тромбоцитарными антиагрегантами у больных с ТИА имеет высокий превентивный потенциал, поскольку оказывает существенное влияние на развитие всех патогенетических подтипов ИИ и других сосудистых событий. Антигипертензивная терапия, направленная на достижение целевых значений АД, безопасна для больных без признаков формирования крупноочагового инфаркта мозга. Антигипертензивная терапия статинами и ингибиторами ангиотензинпревращающего фермента вместе с нагрузочными дозами статинов обеспечивают ангиопротективный эффект, что вполне обосновано и безопасно для больных с ТИА и малыми ИИ. Само понятие «агрессивная терапия» содержит высокий превентивный потенциал, отражая степень воздействия на опасное развитие агрессивного патологического процесса.
Антигипертензивная терапия, направленная на достижение целевых значений АД, безопасна для больных без признаков формирования крупноочагового инфаркта мозга. Антигипертензивная терапия статинами и ингибиторами ангиотензинпревращающего фермента вместе с нагрузочными дозами статинов обеспечивают ангиопротективный эффект, что вполне обосновано и безопасно для больных с ТИА и малыми ИИ. Само понятие «агрессивная терапия» содержит высокий превентивный потенциал, отражая степень воздействия на опасное развитие агрессивного патологического процесса.
Литература
- Amarenco P., Lavallée C., Monteiro Tavares L. Five-Year Risk of Stroke after TIA or Minor Ischemic Stroke // New Eng Journal of medicine. Published on May 16, 2018, at NEJM.org. DOI: 10.1056/NEJMoa1802712.
- Giles M. F., Albers G. W., Amarenco P. et al. Early stroke risk and ABCD2 score performance in tissue — vs time defined TIA // Neurology. 2011; 77: 1222–1228.
- Uchiyama S.
 , Amarenco P., Minematsu K. et al. TIA as Acute Cerebrovascular Syndrome // Front Neurol Neurosci. 2014, vol. 33, p. 135–146. DOI: 10.1159/000351914.
, Amarenco P., Minematsu K. et al. TIA as Acute Cerebrovascular Syndrome // Front Neurol Neurosci. 2014, vol. 33, p. 135–146. DOI: 10.1159/000351914. - Симоненко В. Б., Широков Е. А., Фролов В. М. Клиническая кризология в кардионеврологии. М.: Издательство КВОРУМ, 2013. 293 с.
- Kernan W. N., Ovbiagele B., Black H. R. et al. Guidelines for the Primary Prevention of Stroke: A Statement for Healthcare Professionals from the American Heart Association/American Stroke Association // Stroke. 2014; 45: 2160–2236.
- Парфенов В. А., Хасанова Д. Р. Ишемический инсульт. М.: Издательство «Медицинское информационное агентство», 2012.
- Bae H. J., Yoon B. W., Kang D. W., Koo J. S., Lee S. H., Kim K. B. et al. Correlation of coronary and cerebral atherosclerosis: difference between extracranial and intracranial arteries // Cerebrovasc Dis. 2006; 21: 112–119.
- Agusti A., Bel E., Thomas M. et al. Treatable traits: toward precision medicine of chronic airway diseases // Eur Respir J.
 2016; 47: 410–419. DOI: 10.1183/13993003.01359-2015.
2016; 47: 410–419. DOI: 10.1183/13993003.01359-2015. - Jameson J. L., Longo D. L. Precision medicine — personalized, problematic, and promising // N Engl J Med. 2015; 372: 2229–2234.
- Mozaffarian D., Benjamin E., Go A. et al. Heart Disease and Stroke Statistics — 2016 Update // Circulation. 2016; 133 (4): e38-e360.
- Roffi M., Patrono C., Collet J. P., Mueller C. et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC) // Eur Heart J. 2016; 37 (3): 267–315.
- Widimsky P., Coram R., Abou-Cheb A. Reperfusion therapy of acute ischaemic stroke and acute myocardial infarction: similarities and differences // European Heart Journal. 2014; 35: 147–155.
- Mok V., Kim J.
 Prevention and Management of Cerebral Small Vessel Disease // Journal of Stroke. 2015; 17 (2): 111–122.
Prevention and Management of Cerebral Small Vessel Disease // Journal of Stroke. 2015; 17 (2): 111–122. - Dolmans L. S., Hoes A., Bartelink E. et al. Patient delay in TIA: a systematic review // Jornal of Neurology. 2018. DOI: 10.1007/s00415-018-8977-6.
- Lavallée P., Amarenco P. Stroke Subtypes and Interventional Studies for Transient Ischemic Attack. TIA as Acute Cerebrovascular Syndrome // Front Neurol Neurosci. 2014; 33: 135–146. DOI: 10.1159/000351914.
- Chen Z. M., Sandercoch P., Pan H. C. et al. Indication for early aspirin use in acute ischemic stroke. A combined analysis of 40 000 randomized patients from the Chines Acute Stroke Trial and the International Stroke Trial // Stroke. 2000; 31: 1240–1249.
- Kennedy J., Ryckborst K. et al. For the FASTER investigators: Fast Assessment of Stroke and Transient Ischemic Attack to prevent Early Recurrence (FASTER): a randomized controlled pilot trial // Lancet Neurol.
 2007; 6: 961–969.
2007; 6: 961–969. - Powers W., Rabinstein A., Ackerson T. et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association // Stroke. 2018; 49: eXXX–eXXX. DOI: 10.1161/STR.0000000000000158.
- Prasad K., Siemieniuk R., Hao Q. Dual antiplatelet therapy with aspirin and clopidogrel for acute high risk transient ischaemic attack and minor ischaemic stroke: a clinical practice guideline // BMJ. 2018; 363: k5130. DOI: 10.1136/bmj.k5130 (published 18 December 2018).
- Sandercock P., Counsell C., Tseng M. C., Cecconi E. Oral antiplatelet therapy for acute ischemic stroke // Cochrane Database of Systematic Reviews. 2014, Issue 3. Art. №: CD000029. DOI: 10.1002/14651858.CD000029.pub3.
- Li Z., Wang Y., Zhao X. et al. Treatment effect of clopidogrel plus aspirin within 12 hours of acute minor stroke or transient ischemic attack // J Am Heart Assoc.
 2016; 5: e003038. DOI: 10/1161/JAHA.115.003038.
2016; 5: e003038. DOI: 10/1161/JAHA.115.003038. - Sharma V. K., Tan B. Y., Ying Sim M. Y. Rationale and design of a randomized trial of early intensive blood pressure lowering on cerebral perfusion parameters in thrombolysed acute ischemic stroke patients // Medicine. 2018, 97: 40 (e12721). doi.org/10.1097/MD.0000000000012721.
- Симоненко В. Б., Широков Е. А., Овчинников Ю. В. Клинические особенности течения артериальной гипертонии, осложненной перенесенным ишемическим инсультом // Клиническая медицина. 2007; 85 (9): 45–49.
- Powers W. J. Acute hypertension after acute stroke: the scienti?c basis for treatment decisions // Neurology. 1993; 43: 461–467.
- Fischberg G. M., Lozano E., Rajamani K. et al. Stroke precipitated by moderate blood pressure reduction // J Emerg Med. 2000; 19: 339–346.
- Anderson C. S., Huang Y., Lindley R. I. et al. Intensive blood pressure reduction with intravenous thrombolysis therapy for acute ischaemic stroke (ENCHANTED): an international, randomised, open-label, blinded-endpoint, phase 3 trial.
 Published Online February 7, 2019. http://dx.doi.org/10.1016/ S0140-6736(19)30038-8.
Published Online February 7, 2019. http://dx.doi.org/10.1016/ S0140-6736(19)30038-8. - Skalidi S. J., Manios E. D., Stamatelopoulos K. S. et al. Brain edema formation is associated with the time rate of blood pressure variation in acute stroke patients // Blood Press Monit. 2013; 18 (4): 203–207.
- Фонякин А. В., Гераскина Л. А. Профилактика ишемического инсульта. Рекомендации по гиполипидемической терапии. М.: ИМАПРЕСС, 2015. 60 с.
- Pan Y. Outcomes Associated With Clopidogrel-Aspirin Use in Minor Stroke or Transient Ischemic Attack. Published online August 19, 2019. DOI: 10.1001/jamaneurol.2019.2531.
Е. А. Широков1, доктор медицинских наук, профессор
В. Б. Симоненко, доктор медицинских наук, профессор, член-корреспондент РАН
Ю. В. Овчинников, доктор медицинских наук
ФГБВОУ ВО ВМА им. С. М. Кирова, московский филиал, Москва
1 Контактная информация: Evg-747747@yandex.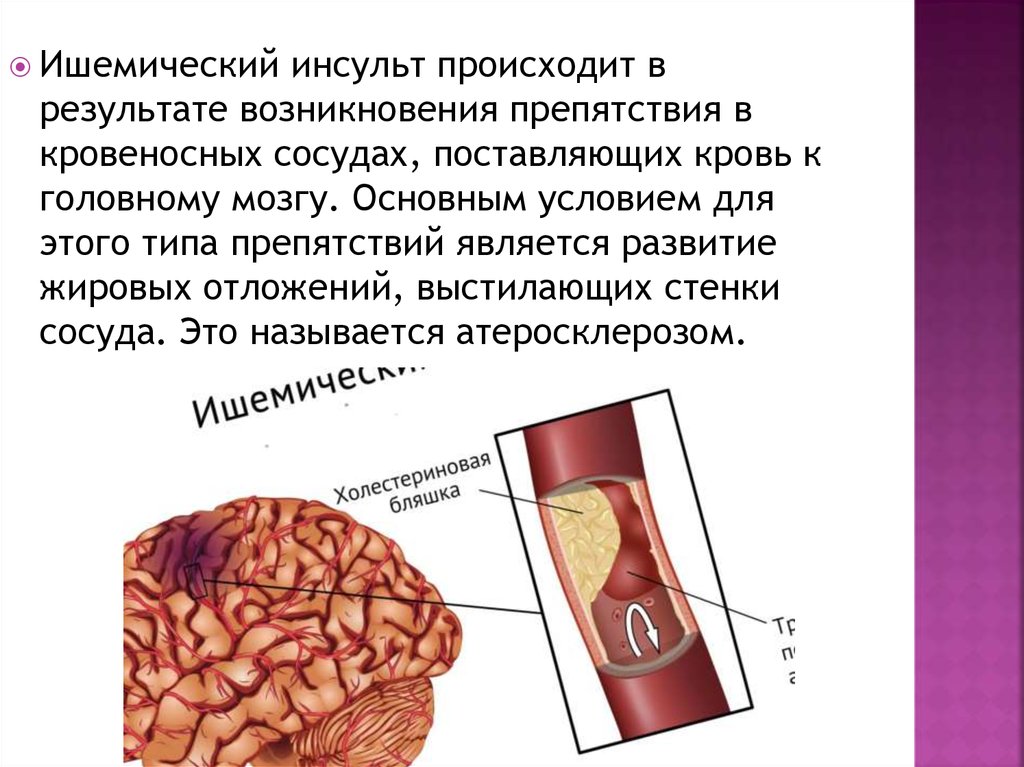 ru
ru
DOI: 10.26295/OS.2020.56.70.001
Транзиторные ишемические атаки и малые инсульты: современные терапевтические стратегии/ Е. А. Широков, В. Б. Симоненко, Ю. В. Овчинников
Для цитирования: Лечащий врач № 5/2020; Номера страниц в выпуске: 7-11
Теги: сосудистые события, антиагреганты, статины, антигипертензивная терапия
Транзиторная ишемическая атака | Национальный институт неврологических расстройств и инсульта
ПОДЕЛИТЬСЯ:
Какие исследования проводятся?
NINDS является ведущим сторонником исследований инсульта и ТИА в США и спонсирует исследования, начиная от клинических испытаний и заканчивая изучением основных биологических механизмов, а также исследованиями на животных.
Определение
Определение
ЛечениеЛечение
ПрогнозПрогноз
Клинические испытанияКлинические испытания
ОрганизацииОрганизации
ПубликацииПубликации
ОпределениеОпределение
Транзиторная ишемическая атака (ТИА) представляет собой транзиторный инсульт, который длится всего несколько минут. Это происходит, когда кровоснабжение части мозга кратковременно прерывается. Симптомы ТИА, которые обычно возникают внезапно, аналогичны симптомам инсульта, но длятся не так долго. Большинство симптомов ТИА исчезают в течение часа, хотя могут сохраняться до 24 часов. Симптомы могут включать: онемение или слабость в лице, руке или ноге, особенно на одной стороне тела; спутанность сознания или трудности в разговоре или понимании речи; проблемы со зрением в одном или обоих глазах; трудности с ходьбой, головокружение или потеря равновесия и координации.
Это происходит, когда кровоснабжение части мозга кратковременно прерывается. Симптомы ТИА, которые обычно возникают внезапно, аналогичны симптомам инсульта, но длятся не так долго. Большинство симптомов ТИА исчезают в течение часа, хотя могут сохраняться до 24 часов. Симптомы могут включать: онемение или слабость в лице, руке или ноге, особенно на одной стороне тела; спутанность сознания или трудности в разговоре или понимании речи; проблемы со зрением в одном или обоих глазах; трудности с ходьбой, головокружение или потеря равновесия и координации.
Прочитайте больше Читать меньше
Лечение. Лечение. Для выявления причины ТИА и определения соответствующей терапии необходима своевременная оценка (в течение 60 минут). В зависимости от анамнеза пациента и результатов медицинского обследования врач может порекомендовать медикаментозную терапию или хирургическое вмешательство для снижения риска инсульта у людей, перенесших ТИА. Использование антиагрегантов, особенно аспирина, является стандартным лечением пациентов с риском инсульта. Людям с мерцательной аритмией (нерегулярным сердцебиением) могут быть назначены антикоагулянты.
Использование антиагрегантов, особенно аспирина, является стандартным лечением пациентов с риском инсульта. Людям с мерцательной аритмией (нерегулярным сердцебиением) могут быть назначены антикоагулянты.
Прочитайте больше Читать меньше
PrognosisPrognosis
ТИА часто являются предупредительными признаками того, что человек подвергается риску более серьезного и изнурительного инсульта. Примерно у трети пациентов с ТИА когда-нибудь в будущем произойдет острый инсульт. Многие инсульты можно предотвратить, обращая внимание на настораживающие признаки ТИА и устраняя основные факторы риска. Наиболее важными излечимыми факторами, связанными с ТИА и инсультом, являются высокое кровяное давление, курение сигарет, болезни сердца, заболевания сонных артерий, диабет и злоупотребление алкоголем. Медицинская помощь доступна для уменьшения и устранения этих факторов. Изменения в образе жизни, такие как сбалансированное питание, поддержание здорового веса, физические упражнения и участие в программах по отказу от курения и алкоголя, также могут уменьшить эти факторы.
Прочитайте больше Читать меньше
Клинические испытанияКлинические испытания
Клинические испытания NINDS в США и во всем мире
Транзиторная ишемическая атака | UF Health, University of Florida Health
Основные вкладки
- Обзор (активная вкладка)
- Места
- Провайдеры
- Научные исследования
Транзиторные ишемические атаки возникают, когда приток крови к частям мозга ограничивается на короткие периоды времени. Поскольку кровоснабжение восстанавливается быстро, мозговая ткань не отмирает, как при инсульте. Эти приступы часто являются ранними признаками инсульта.
Причины
Транзиторные ишемические атаки могут быть вызваны различными факторами, в том числе:
- Небольшие кусочки жирового материала или кальция, которые накапливаются на стенке артерии, а затем отрываются и застревают в мелких кровеносных сосудах мозг
- Спазмы стенок артерий
- Высокое кровяное давление
- Условия, при которых кровь течет, но не имеет достаточного количества кислорода для питания мозга.
 Это может произойти, когда у человека тяжелая анемия, отравление угарным газом или состояние, при котором вырабатываются аномальные клетки крови или функция свертывания крови, например лейкемия или полицитемия.
Это может произойти, когда у человека тяжелая анемия, отравление угарным газом или состояние, при котором вырабатываются аномальные клетки крови или функция свертывания крови, например лейкемия или полицитемия.
Симптомы
Транзиторная ишемическая атака начинается внезапно и обычно длится от 2 до 30 минут. Редкие случаи могут длиться более двух часов. Его эффекты различаются в зависимости от того, какая часть мозга лишена крови и кислорода.
Может проявляться множество различных симптомов, в том числе:
- Слабость или паралич руки или ноги или одной стороны тела
- Потеря (или ненормальная) чувствительность в руке, ноге или на одной стороне тела
- Частичная потеря зрения или слуха
- Двойное зрение
- Головокружение
- Невнятная речь
- Проблемы с мыслью или произношением правильного слова
- Неспособность узнавать части тела
- Необычные движения
- Потеря контроля над мочевым пузырем
- Дисбаланс и падение
- Обморок
Симптомы транзиторной ишемической атаки аналогичны симптомам инсульта, но носят временный и обратимый характер. Однако такие приступы имеют тенденцию повторяться. У человека их может быть несколько за один день или только два-три за несколько лет. Примерно в трети случаев за транзиторной ишемической атакой следует инсульт. Примерно половина таких инсультов возникает в течение года после транзиторной ишемической атаки.
Однако такие приступы имеют тенденцию повторяться. У человека их может быть несколько за один день или только два-три за несколько лет. Примерно в трети случаев за транзиторной ишемической атакой следует инсульт. Примерно половина таких инсультов возникает в течение года после транзиторной ишемической атаки.
Диагностика
Многие расстройства имеют симптомы, сходные с симптомами транзиторных ишемических атак, такие как судороги, опухоли, мигрени или аномальные уровни сахара в крови. В то время как внезапные неврологические симптомы позволяют предположить, какая область мозга поражена, необходима тщательная оценка. Такие инструменты, как компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), которые полезны для диагностики инсульта при наличии повреждения головного мозга, бесполезны для диагностики транзиторных ишемических атак при отсутствии необратимого повреждения головного мозга.
Если закупорка происходит в одной или обеих сонных артериях, для подтверждения транзиторных ишемических атак можно использовать несколько методов. (При поражении этих артерий общие симптомы включают слепоту на один глаз, слабость или нарушения чувствительности.) Диагностические методы включают:
(При поражении этих артерий общие симптомы включают слепоту на один глаз, слабость или нарушения чувствительности.) Диагностические методы включают:
- Прослушивание звука кровотока в сонных артериях с помощью стетоскопа. Неравномерный поток создает звуки (шум). Тем не менее, шумы могут присутствовать без какой-либо значительной блокировки.
- Ультразвуковое сканирование и допплеровское исследование кровотока проводятся одновременно, чтобы определить размер закупорки и количество крови, которое может обходить ее.
- МРТ или церебральную ангиографию можно выполнить, если имеется сильное сужение артерии. При церебральной ангиографии в артерию вводят жидкость и одновременно делают рентгеновские снимки головы и шеи.
Лечение
Лечение транзиторных ишемических атак направлено на профилактику инсульта. Основными факторами риска инсульта являются:
- Высокое кровяное давление
- Высокий уровень холестерина
- Курение
- Диабет
Устранение или снижение этих факторов риска является первым шагом в предотвращении инсульта.

 , Amarenco P., Minematsu K. et al. TIA as Acute Cerebrovascular Syndrome // Front Neurol Neurosci. 2014, vol. 33, p. 135–146. DOI: 10.1159/000351914.
, Amarenco P., Minematsu K. et al. TIA as Acute Cerebrovascular Syndrome // Front Neurol Neurosci. 2014, vol. 33, p. 135–146. DOI: 10.1159/000351914. 2016; 47: 410–419. DOI: 10.1183/13993003.01359-2015.
2016; 47: 410–419. DOI: 10.1183/13993003.01359-2015. Prevention and Management of Cerebral Small Vessel Disease // Journal of Stroke. 2015; 17 (2): 111–122.
Prevention and Management of Cerebral Small Vessel Disease // Journal of Stroke. 2015; 17 (2): 111–122.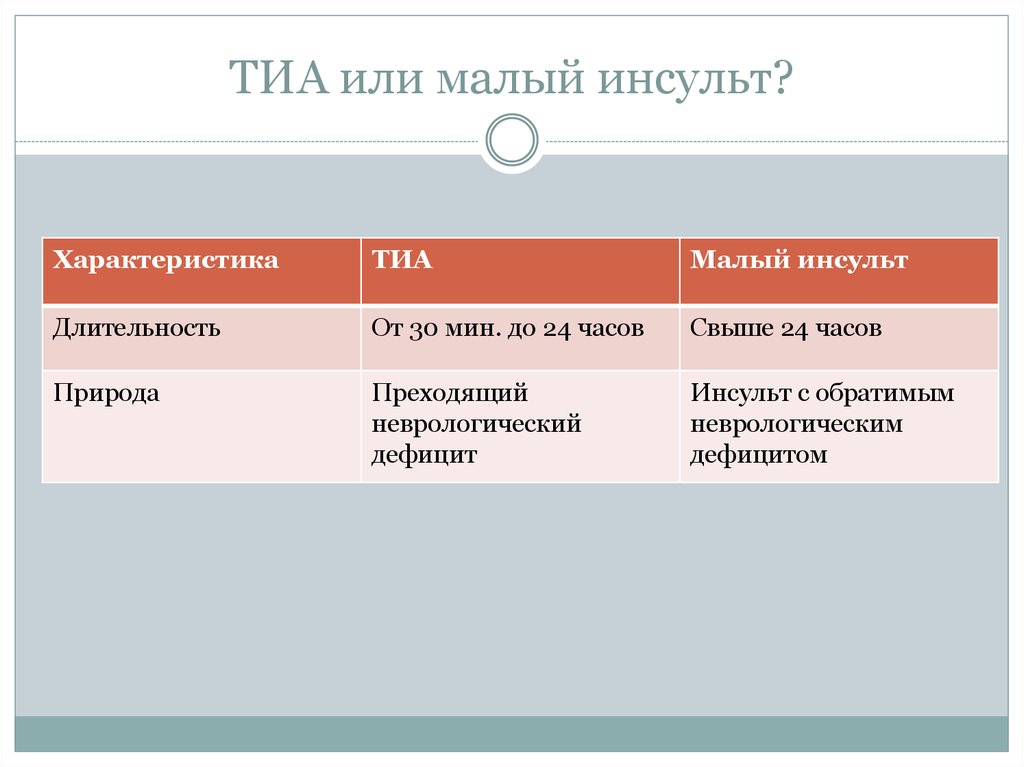 2007; 6: 961–969.
2007; 6: 961–969. 2016; 5: e003038. DOI: 10/1161/JAHA.115.003038.
2016; 5: e003038. DOI: 10/1161/JAHA.115.003038.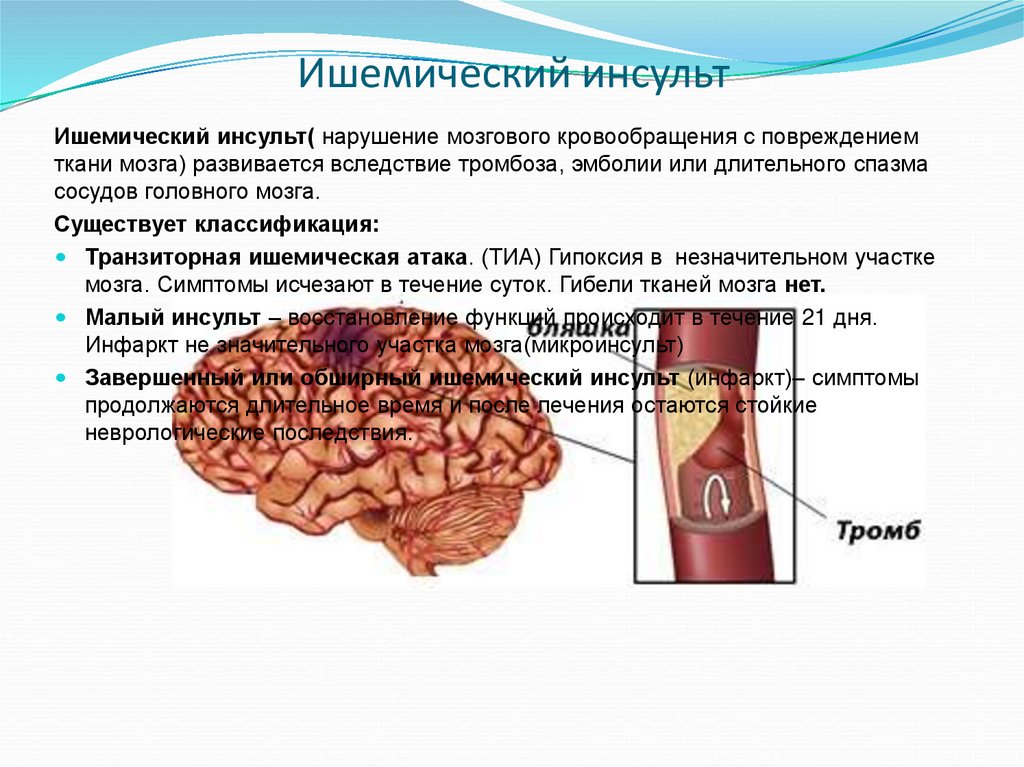 Published Online February 7, 2019. http://dx.doi.org/10.1016/ S0140-6736(19)30038-8.
Published Online February 7, 2019. http://dx.doi.org/10.1016/ S0140-6736(19)30038-8. Это может произойти, когда у человека тяжелая анемия, отравление угарным газом или состояние, при котором вырабатываются аномальные клетки крови или функция свертывания крови, например лейкемия или полицитемия.
Это может произойти, когда у человека тяжелая анемия, отравление угарным газом или состояние, при котором вырабатываются аномальные клетки крови или функция свертывания крови, например лейкемия или полицитемия.