Лекарство при деменции для подавления агрессии: Как успокоить больного деменцией при обострении
Постинсультные психоэмоциональные расстройства: современная медикаментозная терапия
Резюме. Представлен обзор литературы о некоторых наиболее распространенных психоэмоциональных расстройствах, отмечаемых после перенесенного инсульта, феноменология настроения и эмоциональных расстройств. Приведена распространенность психоэмоциональных расстройств, их негативное влияние на восстановление неврологических расстройств и когнитивные функции. Обоснована необходимость своевременной диагностики и коррекции эмоциональных расстройств у пациентов, перенесших острое нарушение мозгового кровообращения, и эффективность комплексного подхода при лечении. Описаны общие патогенетические звенья развития постинсультных психоэмоциональных расстройств — депрессии, тревожных состояний, их связь с процессом реабилитации и социальной реадаптации пациентов, а также возможность фармакотерапии препаратами группы селективных ингибиторов обратного захвата серотонина, в частности эсциталопрамом.
DOI 10. 32471/umj.1680-3051.125.127041
32471/umj.1680-3051.125.127041
УДК 616.8-005/009
Актуальность проблемы
Инсульт по-прежнему занимает лидирующие позиции среди причин смертности и стойкой инвалидизации населения индустриально развитых стран (Pandya R.S. et al., 2011). По данным Европейской организации по изучению инсульта (European Stroke Organisation), после перенесенного нарушения мозгового кровообращения выраженная инвалидность развивается у 15–30% больных и около 40% сохраняют умеренную инвалидность (European Stroke Organisation (ESO) Executive Committee, 2008). Украина не является исключением, причем занимает по этому показателю лидирующие позиции. Ежегодно около 100–110 тыс. жителей нашей страны впервые заболевают инсультом. Заболеваемость составляет 282,3 случая на 100 тыс. населения, что значительно превосходит средний показатель заболеваемости для стран Европейского Союза — 200 на 100 тыс. населения, сопровождаясь повышением летальности в 2 раза. Ежегодно в Украине умирают около 40 тыс. пациентов с впервые выявленным инсультом. Если учесть, что треть заболевших — лица трудоспособного возраста, а из 10–20% возвратившихся к труду прежнюю профессиональную пригодность сохраняют менее 8% — статистика более чем удручающая (Мищенко Т.C., 2011).
Если учесть, что треть заболевших — лица трудоспособного возраста, а из 10–20% возвратившихся к труду прежнюю профессиональную пригодность сохраняют менее 8% — статистика более чем удручающая (Мищенко Т.C., 2011).
Наряду с двигательными, речевыми и когнитивными нарушениями у больных, перенесших инсульт, часто развиваются различного рода психоэмоциональные расстройства, такие как депрессия, тревожность, астения, апатия и аспонтанность, негативизм, реже — эйфория и благодушие (Kim J.S. et al., 2000; Кадыков А.С. и соавт., 2009). Из многих постинсультных нарушений психоэмоциональные расстройства, прежде всего тревожно-депрессивные состояния, являются одними из ведущих, приводя к снижению эффективности лечения, отдаляя перспективу пациентов возвратиться в привычную социальную среду (Gaete J.M., Bogousslavsky J., 2008). Более того, формирование психоэмоциональных расстройств угнетающе действует на пациентов и их опекунов, снижает приверженность лечению и качество жизни (Kim J.S., 2016).
Коморбидность инсульта и тревожно-депрессивных состояний взаимно отягощают клиническую картину каждого из состояний, способствуя прогрессированию развившегося патологического процесса. К сожалению, описанная M.L.C. Labi и соавторами (1980) постинсультная депрессия как редко распознаваемое осложнение инсульта, остается таковой и в наши дни (Kim J.S., 2016), часто являясь незамеченной неврологами.
В настоящем обзоре описаны некоторые из наиболее распространенных психоэмоциональных расстройств, отмечаемых после перенесенного инсульта, феноменология настроения и эмоциональных расстройств, а также возможности фармакотерапевтического лечения препаратами группы селективных ингибиторов обратного захвата серотонина (СИОЗС).
Общие вопросы патогенеза и терапии психоэмоциональных расстройств
Психоэмоциональные расстройства после перенесенного инсульта развиваются у большинства пациентов — в 30–67% случаев. При этом тревожно-депрессивные состояния отмечают у 18–43% заболевших (Verdelho A. et al., 2004). В целом постинсультная депрессия ассоциируется с повышенным риском цереброваскулярных осложнений и смертности. Так, смертность на протяжении 10 лет повышается в три раза (Townend B.S. et al., 2007), и многократно увеличивается риск развития цереброваскулярных осложнений: инфаркта миокарда — в 4,5, инсульта — в 2,7, осложненного течения сахарного диабета 2-го типа — в 2,2 (Скворцова В.И. и соавт., 2009).
et al., 2004). В целом постинсультная депрессия ассоциируется с повышенным риском цереброваскулярных осложнений и смертности. Так, смертность на протяжении 10 лет повышается в три раза (Townend B.S. et al., 2007), и многократно увеличивается риск развития цереброваскулярных осложнений: инфаркта миокарда — в 4,5, инсульта — в 2,7, осложненного течения сахарного диабета 2-го типа — в 2,2 (Скворцова В.И. и соавт., 2009).
Кроме явной угрозы развития фатальных осложнений в случае депрессии другие психоэмоциональные расстройства создают не меньшие проблемы, особенно там, где речь идет о социальной реадаптации пациентов (Gillen R. et al., 2011), снижается качество жизни (Liman T.G. et al., 2012). Кроме того, своевременно нераспознанные психоэмоциональные расстройства резко снижают эффективность реабилитационных усилий (Gillen R. et al., 2011).
Неоспорим также фактор места и объема поражения головного мозга при инсульте. В связи с этим тема взаимосвязи локализации и размеров очага инсульта и их влияния на развитие постинсультной депрессии весьма актуальна. Предложена теория «левой лобной доли» (Robinson R.G. et al., 1984), доказывающая высокую частоту тяжелой депрессии в острый период инсульта при локализации очага в левом полушарии, захватывающем дорсолатеральную корковую область и базальные ядра слева. Особая роль в этой связи отводится вовлечению лобно-базальных ганглиозных путей мозга при постинсультной депрессии и изменениям в нейротрансмиттерных системах при повреждении передней лобной доли: серотонинергической, адренергической и дофаминергической систем. Важным открытием последних лет стало доказательство снижения уровня нейротрофического фактора головного мозга (brain-derived neurotrophic factor — BDNF) и подавления нейрогенеза под влиянием гиперкортизолемии при длительно существующей депрессии, приводящих к атрофии мозга и развитию когнитивной дисфункции, которая может быть обратимой при лечении антидепрессантами (Martinowich K., Lu B., 2007). Таким образом, обоснована общая стратегия лечения пациентов с постинсультными психоэмоциональными расстройствами и роль препаратов, влияющих на модуляцию нейромедиаторных систем и повышающих уровень BDNF, в частности антидепрессантов (Jorge R.
Предложена теория «левой лобной доли» (Robinson R.G. et al., 1984), доказывающая высокую частоту тяжелой депрессии в острый период инсульта при локализации очага в левом полушарии, захватывающем дорсолатеральную корковую область и базальные ядра слева. Особая роль в этой связи отводится вовлечению лобно-базальных ганглиозных путей мозга при постинсультной депрессии и изменениям в нейротрансмиттерных системах при повреждении передней лобной доли: серотонинергической, адренергической и дофаминергической систем. Важным открытием последних лет стало доказательство снижения уровня нейротрофического фактора головного мозга (brain-derived neurotrophic factor — BDNF) и подавления нейрогенеза под влиянием гиперкортизолемии при длительно существующей депрессии, приводящих к атрофии мозга и развитию когнитивной дисфункции, которая может быть обратимой при лечении антидепрессантами (Martinowich K., Lu B., 2007). Таким образом, обоснована общая стратегия лечения пациентов с постинсультными психоэмоциональными расстройствами и роль препаратов, влияющих на модуляцию нейромедиаторных систем и повышающих уровень BDNF, в частности антидепрессантов (Jorge R. E. et al., 2010).
E. et al., 2010).
Постинсультная депрессия
Клинически постинсультная депрессия характеризуется паттерном симптомов, схожим с проявлениями депрессии позднего возраста. Общими симптомами являются тревога, иногда маскирующая сниженный фон настроения, выраженное чувство вины, лабильность настроения и социальная изоляция. По данным метаанализа, включившего 25 488 наблюдений, постинсультная депрессия развилась у 31% пациентов на протяжении пяти лет (Hackett M.L., Pickles K., 2014).
Постинсультная депрессия значимо снижает качество жизни пациентов, создает дополнительный психоэмоциональный очаг напряженности для родственников и негативно влияет на прогноз восстановления неврологических расстройств, степень функционального ограничения и когнитивные функции. Именно это является основным требованием для рекомендации исследовать всех пациентов после инсульта на наличие эмоциональных нарушений и при их выявлении незамедлительно начинать соответствующее лечение.
Развитие депрессивных состояний — процесс сложный и до конца не изученный. Тесная связь между постинсультной депрессией и выраженностью неврологического дефицита (Kim J.S. et al., 2000), а также возможным его уменьшением, определенным по шкале Монтгомери — Асберга (Kim J.S. et al., 2017), указывают на обратимость психологического реактивного состояния с внезапным функциональным дефицитом.
Тесная связь между постинсультной депрессией и выраженностью неврологического дефицита (Kim J.S. et al., 2000), а также возможным его уменьшением, определенным по шкале Монтгомери — Асберга (Kim J.S. et al., 2017), указывают на обратимость психологического реактивного состояния с внезапным функциональным дефицитом.
Проведенные исследования с помощью однофотонной эмиссионной компьютерной томографии подтвердили нарушения церебральной перфузии при депрессии за счет редукции вазомоторной реактивности сосудов головного мозга. При этом процесс был обратим и восстанавливался после исчезновения симптомов депрессии (Navarro V. et al., 2002). В то же время наиболее высокая обратимость процесса наблюдалась в первые 3 нед от перенесенного инсульта и была тем выше, чем меньше развившийся неврологический дефицит (Robinson R.G., Jorge R.E., 2016).
Моноаминовая теория депрессии послужила основанием для применения ингибиторов обратного захвата моноаминов в фармакотерапии у пациентов с депрессией. При этом наиболее важной мишенью фармакологического воздействия является обмен серотонина (Каплан Г.И., Сэдок Б.Дж., 1994). Показана корреляционная зависимость между выраженностью депрессии и уровнем серотонина. При этом его коррекция ведет к регрессу выраженности эмоциональных расстройств (Вейн А.М. и соавт., 2007).
При этом наиболее важной мишенью фармакологического воздействия является обмен серотонина (Каплан Г.И., Сэдок Б.Дж., 1994). Показана корреляционная зависимость между выраженностью депрессии и уровнем серотонина. При этом его коррекция ведет к регрессу выраженности эмоциональных расстройств (Вейн А.М. и соавт., 2007).
Кроме того, серотонин играет роль в нейропластических изменениях, связанных с развитием мозга (Gaspar P. et al., 2003), а СИОЗС увеличивают нейрогенез гиппокампа, вероятно, через эффекты, опосредованные 5-НТ1А-рецепторами (Radley J.J., Jacobs B.L., 2002). В целом нейротрофические эффекты антидепрессантов и тот факт, что они являются широко применяемыми препаратами с доказанной безопасностью, делают их превосходными кандидатами для использования в качестве восстановителей в подострую фазу инсульта и при других формах повреждения головного мозга (Cramer S.C., 2008).
Лечение
Первоначальные данные на основании Кокрановского обзора по предупреждению и медикаментозному лечению пациентов с постинсультной депрессией не подтвердили положительного результата применения антидепрессантов (Hackett M. L. et al., 2008). Однако спустя непродолжительный период времени после правильно спланированного исследования на основании того же Кокрановского обзора доказана умеренно положительная эффективность применения антидепрессантов (СИОЗС) для лечения пациентов с депрессивными состояниями после перенесенного инсульта (Robinson R.G. et al., 2008; Tsai C.S. et al., 2011). При оценке тяжести развития нежелательных явлений по шкале UKU (Udvalg for Kliniske Undersogelser Scale) также отмечена их безопасность (Jorge R.E. et al., 2010; Khasanova D.R., Zhitkova Yu.V., 2013). Среди антидепрессантов СИОЗС обладают наиболее благоприятным спектром переносимости, легко дозируются и не влияют на эффективность антигипертензивной терапии, что является неоспоримым достоинством (Cattaneo A. et al., 2010).
L. et al., 2008). Однако спустя непродолжительный период времени после правильно спланированного исследования на основании того же Кокрановского обзора доказана умеренно положительная эффективность применения антидепрессантов (СИОЗС) для лечения пациентов с депрессивными состояниями после перенесенного инсульта (Robinson R.G. et al., 2008; Tsai C.S. et al., 2011). При оценке тяжести развития нежелательных явлений по шкале UKU (Udvalg for Kliniske Undersogelser Scale) также отмечена их безопасность (Jorge R.E. et al., 2010; Khasanova D.R., Zhitkova Yu.V., 2013). Среди антидепрессантов СИОЗС обладают наиболее благоприятным спектром переносимости, легко дозируются и не влияют на эффективность антигипертензивной терапии, что является неоспоримым достоинством (Cattaneo A. et al., 2010).
В ряду препаратов СИОЗС наилучшим соотношением эффективность/безопасность обладает эсциталопрам. С учетом высокой степени селективности он воздействует исключительно на серотониновую систему при минимальных терапевтических дозах. Применение эсциталопрама в начальной дозе 5 мг/сут с повышением до 10 мг/сут со 2-й недели терапии является эффективным и безопасным (Cipriani A. et al., 2009). К важным достоинствам препарата необходимо отнести возможность коррекции как при депрессивных состояниях, так и при когнитивных нарушениях (Воробьева О.В., 2011). Это позволяет рациональнее проводить превентивную терапию в случае депрессивных постинсультных состояний. Так, в рандомизированном исследовании две группы пациентов, перенесших инсульт, в течение года получали плацебо и эсциталопрам. Депрессия развилась у 22,4% больных группы плацебо и только у 8,5% пациентов, получавших эсциталопрам (p<0,001) (Robinson R.G. et al., 2008).
Применение эсциталопрама в начальной дозе 5 мг/сут с повышением до 10 мг/сут со 2-й недели терапии является эффективным и безопасным (Cipriani A. et al., 2009). К важным достоинствам препарата необходимо отнести возможность коррекции как при депрессивных состояниях, так и при когнитивных нарушениях (Воробьева О.В., 2011). Это позволяет рациональнее проводить превентивную терапию в случае депрессивных постинсультных состояний. Так, в рандомизированном исследовании две группы пациентов, перенесших инсульт, в течение года получали плацебо и эсциталопрам. Депрессия развилась у 22,4% больных группы плацебо и только у 8,5% пациентов, получавших эсциталопрам (p<0,001) (Robinson R.G. et al., 2008).
Таким образом, сегодня СИОЗС считаются эффективными препаратами для лечения пациентов с постинсультной депрессией, внесены в перечень препаратов первой линии в рекомендациях по фармакотерапии постинсультной депрессии Европейской организации по изучению инсульта (European Stroke Organisation) и Американской кардиологической ассоциации (American Heart Association) (Quinn T. J. et al., 2009; Miller E.L. et al., 2010) .
J. et al., 2009; Miller E.L. et al., 2010) .
Постинсультные тревожные состояния
Постинсультная тревога, по разным оценкам, отмечается с частотой 3–13% (Ferro J.M. et al., 2009), а по некоторым данным может достигать 33% (Morrison V. et al., 2005). При этом, как установлено в систематическом обзоре с участием 4706 пациентов, ощущение тревоги испытывали 24% пациентов с инсультом, при том, что тревожные генерализованные расстройства развились у 18% пациентов и сохранялись на протяжении 5 лет после инсульта (Campbell Burton C.A. et al., 2013).
Как сообщается, постинсультная тревога тесно связана с депрессивными состояниями, хотя четкой взаимосвязи с объемом поражения и зоной коры не выявлено (Starkstein S.E. et al., 1990; Campbell Burton C.A. et al., 2013). Сама по себе постинсультная тревога не влияет на процесс реабилитации и когнитивные функции, но связана с ухудшением социальной адаптации пациентов, перенесших инсульт, и значительно снижает качество жизни. Однако единой точки зрения на лечение при постинсультной тревоге нет ввиду отсутствия достаточного количества рандомизированных плацебо-контролируемых исследований (Campbell Burton C. A. et al., 2011).
A. et al., 2011).
Тем не менее основным, наиболее эффективным, методом лечения пациентов с генерализованным тревожным расстройством, после перенесенного инсульта в том числе, остается комплексная терапия, которая должна включать одновременно несколько обязательных составляющих: лекарственную терапию и психотерапию (National Institute for Health and Care Excellence, 2011). В этой ситуации препаратами выбора остаются СИОЗС. Данные систематических обзоров и рандомизированных плацебо-контролируемых исследований подтверждают эффективность многих антидепрессантов: СИОЗС, ингибиторов обратного захвата серотонина и норадреналина (Baldwin D.S., 2012). В ряду препаратов СИОЗС наилучшим соотношением эффективность/безопасность обладает эсциталопрам. Одним из достоинств препарата является возможность коррекции не только депрессивных симптомов, но и когнитивных нарушений у постинсультных больных благодаря способности повышать уровень BDNF (Cattaneo A. et al., 2010).
Постинсультная агрессия и ярость
В фазу острого инсульта у пациентов довольно часто развиваются симптомы агрессии, проявляющиеся агрессивно-насильственным поведением. Такого рода симптомы рассматривают как постинсультную ярость (Choi-Kwon S. et al., 2006). Частота данного вида расстройства психики в зависимости от стадии заболевания различна и колеблется от 15–35% в острый период (Greenop K.R. et al., 2009) до 32% — в подострую фазу заболевания (Kim J.S. et al., 2002). В патогенезе постинсультной ярости есть много общего с развитием психоэмоциональной неуравновешенности. Зачастую затрагивается область фронтально-лентикулокапсулярно-понтийской области — зона Вернике (Kim J.S. et al., 2002). Она ассоциируется с тяжелой неврологической дисфункцией, предшествующим инсультом, а также может сочетаться с депрессивными состояниями. Таким образом, постинсультная агрессия может иметь многофакторный генез, обусловленный функциональным дефицитом или повторными инсультами, серотонинергической дисфункцией из-за повреждения головного мозга либо генетическим полиморфизмом моноаминоксидазы A (Kim J.S. et al. 2002).
Такого рода симптомы рассматривают как постинсультную ярость (Choi-Kwon S. et al., 2006). Частота данного вида расстройства психики в зависимости от стадии заболевания различна и колеблется от 15–35% в острый период (Greenop K.R. et al., 2009) до 32% — в подострую фазу заболевания (Kim J.S. et al., 2002). В патогенезе постинсультной ярости есть много общего с развитием психоэмоциональной неуравновешенности. Зачастую затрагивается область фронтально-лентикулокапсулярно-понтийской области — зона Вернике (Kim J.S. et al., 2002). Она ассоциируется с тяжелой неврологической дисфункцией, предшествующим инсультом, а также может сочетаться с депрессивными состояниями. Таким образом, постинсультная агрессия может иметь многофакторный генез, обусловленный функциональным дефицитом или повторными инсультами, серотонинергической дисфункцией из-за повреждения головного мозга либо генетическим полиморфизмом моноаминоксидазы A (Kim J.S. et al. 2002).
Лечение
С учетом особенности патогенеза развития постинсультной агрессии для ее лечения как наиболее подходящие рассматриваются препараты группы СИОЗС, в частности эсциталопрам (Pollock B. G. et al., 2007), которые оказались весьма эффективны при агрессивном поведении пациентов с расстройством личности или деменцией. Хотя в отдельных ситуациях β-адренергические антагонисты (Fleminger S. et al., 2006) и препараты лития (Glenn M.B. et al., 1989) необходимо рассматривать при лечении агрессии на фоне черепно-мозговой травмы, в повседневной практике агрессивного поведения чаще применим эсциталопрам. Так, по данным исследования с участием 478 пациентов с постинсультной агрессией, эсциталопрам был высокоэффективен в ее предотвращении в острый период после перенесенного инсульта (Kim J.S. et al., 2017).
G. et al., 2007), которые оказались весьма эффективны при агрессивном поведении пациентов с расстройством личности или деменцией. Хотя в отдельных ситуациях β-адренергические антагонисты (Fleminger S. et al., 2006) и препараты лития (Glenn M.B. et al., 1989) необходимо рассматривать при лечении агрессии на фоне черепно-мозговой травмы, в повседневной практике агрессивного поведения чаще применим эсциталопрам. Так, по данным исследования с участием 478 пациентов с постинсультной агрессией, эсциталопрам был высокоэффективен в ее предотвращении в острый период после перенесенного инсульта (Kim J.S. et al., 2017).
Заключение
В приведенном обзоре показана значимость изменения психоэмоциональных расстройств у пациентов с церебральным инсультом. Рассмотрены наиболее общие патофизиологические механизмы формирования аффективных нарушений в острый период инсульта. Обоснован выбор психофармакологических препаратов при лечении пациентов с психоэмоциональными постинсультными расстройствами.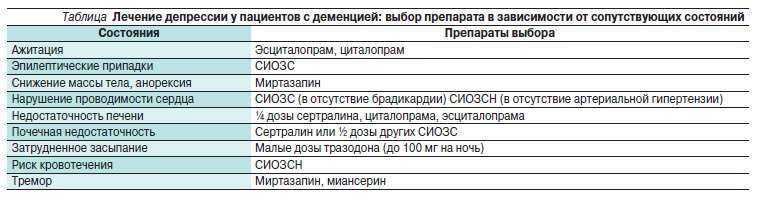 Дана общая характеристика антидепрессивных препаратов и их клиническая значимость в зависимости от развившихся психоэмоциональных расстройств. С учетом высокой распространенности депрессии после инсульта и ее значения для прогноза, функционального восстановления и когнитивных функций, обоснована ранняя тактика применения антидепрессивных препаратов группы СИОЗС. В связи с высокой клинической эффективностью и безопасностью обосновывается терапия пациентов с тревожно-депрессивными состояниями с применением эсциталопрама.
Дана общая характеристика антидепрессивных препаратов и их клиническая значимость в зависимости от развившихся психоэмоциональных расстройств. С учетом высокой распространенности депрессии после инсульта и ее значения для прогноза, функционального восстановления и когнитивных функций, обоснована ранняя тактика применения антидепрессивных препаратов группы СИОЗС. В связи с высокой клинической эффективностью и безопасностью обосновывается терапия пациентов с тревожно-депрессивными состояниями с применением эсциталопрама.
Список использованной литературы
О.І. Осадчий
Резюме. Представлено огляд літератури деяких найпоширеніших психоемоційних розладів, які відзначають після перенесеного інсульту, феноменології настрою та емоційних розладів. Наведено поширеність психоемоційних розладів, їх негативний вплив на відновлення неврологічних розладів і когнітивні функції. Обґрунтована необхідність своєчасної діагностики та корекції емоційних розладів у пацієнтів, які перенесли гостре порушення мозкового кровообігу, та ефективність комплексного підходу до лікування. Описано загальні патогенетичні ланки розвитку постінсультних психоемоційних розладів — депресії, тривожних станів, їх зв’язок із процесом реабілітації та соціальної реадаптації пацієнтів, а також можливість фармакотерапії препаратами групи селективних інгібіторів зворотного захоплення серотоніну, зокрема есциталопрамом.
Описано загальні патогенетичні ланки розвитку постінсультних психоемоційних розладів — депресії, тривожних станів, їх зв’язок із процесом реабілітації та соціальної реадаптації пацієнтів, а також можливість фармакотерапії препаратами групи селективних інгібіторів зворотного захоплення серотоніну, зокрема есциталопрамом.
Ключові слова: постінсультна депресія, антидепресанти, есциталопрам, селективні інгібітори зворотного захоплення серотоніну, СІЗЗС, психоемоційні розлади.
UA-ESCI-PUB-072018-004
демократические СМИ намекают на сумасшествие Трампа
13 октября 2020 00:19
В статье американской New York Times президента Дональда Трампа обвинили в приеме лекарств, вызывающих побочные эффекты, чреватые психическим расстройством.
«Если он отдаст приказ посреди ночи, а его никто не остановит, всё будет зависеть только от военного советника». Цитата из свежей статьи «Нью-Йорк Таймс». Чьи авторы проводят весьма экзотичную параллель между доступом Дональда Трампа к так называемой ядерной кнопке и недавним коронавирусным диагнозом президента США.
Цитата из свежей статьи «Нью-Йорк Таймс». Чьи авторы проводят весьма экзотичную параллель между доступом Дональда Трампа к так называемой ядерной кнопке и недавним коронавирусным диагнозом президента США.
Казалось бы, одно с другим никоим образом не связано. Однако акцент здесь – на препаратах, которые хозяин Белого Дома принимал и продолжает принимать для борьбы с инфекцией. В первую очередь – речь о дексаметазоне: он, как утверждают журналисты со ссылкой на экспертов, сначала «вызывает эйфорию», а потом «превращает человека в одержимого параноика».
И таким образом, якобы, может спровоцировать катастрофические последствия. Включая внезапное использование оружия массового уничтожения. Звучит довольно жутко. И в то же время не стоит забывать: сама газета однозначно поддерживает оппозиционную Демократическую партию. Никогда не упускает случая выставить нынешнего главу государства в невыгодном свете.
Поэтому есть смысл разобраться, насколько публикация правдива – и не продиктована ли она сугубо политическими соображениями.
Американские журналисты ведут опасную политическую игру. Они пытаются подорвать репутацию Трампа. Но пострадает в итоге репутация лекарства. Во время пандемии такого лучше не допускать.
Итак, Дональд Трамп заставил медиков прописать себе дексаметазон. Такое предположение делают авторы из «Нью-Йорк-Таймс». Мол, на самом деле препарат ему и не нужен, но лидер нации слишком торопится выздороветь. И тут же – обязательная пугалка: это его самодурство еще всем нам аукнется. Как всегда в подобных случаях, в статье – лишь часть правды.
Дексаметазон – это лекарство, используемое еще с середины прошлого века. Оно входит в группу кортикостероидов и применяется крайне широко: при аутоимунных заболеваниях, бронхиальной астме. Его назначают людям, перенесшим пересадку органов и борющимся с раком.
Но во время пандемии выяснилось, что от коронавируса он тоже хорошо помогает. Ссылаясь на исследователей из Оксфорда, ВОЗ приводит статистику: при использовании дексаметазона смертность среди пациентов на аппаратах ИВЛ снижается на треть! А среди всех, у кого отмечается пониженный уровень кислорода в крови – на одну пятую. Ранее такой же эффект от кортикостероидов заметили и российские специалисты.
Ранее такой же эффект от кортикостероидов заметили и российские специалисты.
«Дексаметазон не может влиять непосредственно на вирус, на его репликацию, на возможность проникновения в клетки. Дексаметазон в данном конкретном случае применяется для подавления иммунной системы, чтобы избежать осложнений при КОВИД-19. Которые связаны не с вирусом, а именно с излившей активностью иммунной системы», – считает Симон Мацкеплишвили, заместитель директора Медицинского центра МГУ имени М.В.Ломоносова, доктор медицинских наук, член-корреспондент РАН.
Но можно ли от такого лекарства сойти с ума? На самом деле, в теории – да. Кортикостероиды, как и любые стероидные препараты, могут нанести удар по психике человека.
Побочные эффекты разнятся: от вспышек агрессии, раздражительности и галлюцинаций до развития маний, депрессии, суицидальных наклонностей и даже деменции! Известны случаи убийств и самоубийств под воздействием дексаметазона. Но есть одна небольшая тонкость, о которой «Нью Йорк Таймс» как бы случайно забыли.
Для развития всех этих патологий стероидные гормоны нужно применять очень долго. Многие месяцы и даже годы. Трампу же дексаметазон прописали всего 10 дней назад, в минувшую субботу.
Ну и конечно же, даже если у американского президента и случится некое гипотетическое помутнение, серьезно наломать дров ему никто не позволит.
Врачи называют дексаметазон одним из самых безопасных кортикостероидов. Конечно, и он может нанести вред, если принимать бездумно. Но под контролем врачей от него уж точно ничего плохого не случится.
Но как это теперь объяснить читателям «Нью Йорк Таймс»? Ведь из их статьи следует, что лекарство, спасшее уже столько жизней, может сводить людей с ума! А ведь в Штатах и так ситуация с заболеваемостью – катастрофическая. Что если заболевшие, начитавшись вот таких статей, станут отказываться от приема дексаметазона? В общем, странная безответственность от коллег.
в мире президент СМИ США/Америка Дональд Трамп коронавирус общество новости
Ранее по теме
Рейтинг Байдена снова упал до 40%
«Безграничная» готовность США помогать Украине иссякает
Президент США опозорился, поздравляя британского премьера
Байден снова пообщался с пустотой
Байден четверть срока провел в своей семейной резиденции
Представлен фильм, основанный на данных с ноутбука Хантера Байдена
Лечение ажитации при болезни Альцгеймера
Авторы: Редакторы WebMD
В этой статье
- Советы по уходу
- Лекарства
Люди с болезнью Альцгеймера могут легко впасть в тревогу или расстроиться. Они могут быть беспокойными, неспособными спать или ходить взад-вперед. Эти проблемы, называемые ажитацией, могут мешать им вести обычный дневной и ночной распорядок и могут нанести вред вашему близкому человеку или его опекунам.
Они могут быть беспокойными, неспособными спать или ходить взад-вперед. Эти проблемы, называемые ажитацией, могут мешать им вести обычный дневной и ночной распорядок и могут нанести вред вашему близкому человеку или его опекунам.
Часто самым большим поводом для беспокойства являются перемены. Это может быть разница в их распорядке дня, окружении или опекунах, которых они видят. Иногда это происходит из-за страха или усталости, что характерно для болезни Альцгеймера. В некоторых случаях возбуждение может быть вызвано инфекцией или другой медицинской проблемой.
Если ваш близкий взволнован, и вы не можете понять причину, отведите его к врачу, чтобы узнать, сможет ли он найти причину.
Советы по уходу
Вы можете уменьшить волнение, упростив их распорядок дня или отвлекшись от стресса, вызвавшего проблему. Несколько вещей, которые можно попробовать:
- Создайте для них спокойное место. Избавьтесь от фонового шума телевизора или радио, избавьтесь от беспорядка и максимально упростите свои повседневные задачи.

- Проверьте физические причины, по которым они могут быть возбуждены, такие как голод, жажда, потребность в туалете, слишком жарко или холодно.
- Упражнения могут уменьшить тревогу и стресс. Возьмите их на прогулку, займитесь садоводством или включите их любимую музыку и потанцуйте.
- Используйте слабое освещение или ночники, чтобы помочь им меньше смущаться и бояться ночью.
- Держите свои эмоции под контролем. Вы можете чувствовать разочарование, но старайтесь говорить спокойно и ровно, избегайте споров или критики.
Лекарства
Если вы не можете самостоятельно остановить их возбуждение или проблема очень серьезная, врач может порекомендовать лекарства, которые могут помочь.
Лекарства, которые они пропишут, будут зависеть от симптомов вашего близкого. Но распространенные препараты, которые могут ослабить возбуждение, включают:
- Лекарства для лечения паранойи и спутанности сознания, называемые нейролептиками или нейролептиками.
 Примерами таких препаратов являются арипипразол (абилифай), галоперидол (галдол), оланзапин (зипрекса), кветиапин (сероквель), рисперидон (риспердал) и зипразидон (геодон). Эти препараты могут вызывать побочные эффекты, такие как сонливость, ригидность и необычные движения. Исследования связывают некоторые из них с более высоким риском смерти для людей с деменцией. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) поместило предупреждение в «черный ящик» для этих препаратов с описанием рисков. Спросите у врача, подходят ли они вашему близкому человеку.
Примерами таких препаратов являются арипипразол (абилифай), галоперидол (галдол), оланзапин (зипрекса), кветиапин (сероквель), рисперидон (риспердал) и зипразидон (геодон). Эти препараты могут вызывать побочные эффекты, такие как сонливость, ригидность и необычные движения. Исследования связывают некоторые из них с более высоким риском смерти для людей с деменцией. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) поместило предупреждение в «черный ящик» для этих препаратов с описанием рисков. Спросите у врача, подходят ли они вашему близкому человеку.
- Антидепрессанты могут помочь, если ваш близкий находится в депрессии и раздражителен. Варианты включают циталопрам (Celexa), флуоксетин (Prozac), нортриптилин (Pamelor), пароксетин (Paxil) и сертралин (Zoloft). Побочные эффекты этих лекарств могут включать сонливость, сухость во рту, запор и беспокойство.
- Противотревожные препараты , , которые включают алпразолам (ксанакс), буспирон (BuSpar), лоразепам (ативан) и оксазепам (серакс), часто вызывают сонливость.
 (Парадоксально, но они также могут усугубить спутанность сознания и возбуждение.)
(Парадоксально, но они также могут усугубить спутанность сознания и возбуждение.)
Лучший способ помочь своему близкому человеку, страдающему ажитацией, — обратиться к его врачу. Они могут порекомендовать правильное сочетание лекарств и советов по уходу, чтобы успокоить их и облегчить вам жизнь.
Руководство по болезни Альцгеймера
- Обзор и факты
- Симптомы и причины
- Диагностика и лечение
- Жизнь и уход
- Долгосрочное планирование и ресурсы
- 70008
Алгоритм последовательного медикаментозного лечения ажитации и агрессии при болезни Альцгеймера и смешанной деменции
Американская психиатрическая ассоциация (2016 г.) Практическое руководство по применению нейролептиков для лечения ажитации или психоза у пациентов с деменцией. Доступно по адресу: http://psychiatryonline.org/doi/pdf/10.1176/appi.books.9780890426807 (по состоянию на 25 сентября 2017 г.
Azermaia M, Petrovica M, Elseviersa MM, et al. (2012) Систематическая оценка руководств по лечению деменции при поведенческих и психологических симптомах. Старение Res Rev 11: 78–86. [PubMed] [Академия Google]
Болдуин Д.С., Эйчисон К., Бейтсон А. и др. (2013) Бензодиазепины: риски и преимущества. Пересмотр. Дж. Психофармакол 27: 967–971. [PubMed] [Google Scholar]
Baldwin DS, Anderson IM, Nutt DJ и др. (2014) Фармакологическое лечение тревожных расстройств, посттравматического стрессового расстройства и обсессивно-компульсивного расстройства, основанное на фактических данных: пересмотр рекомендаций 2005 года Британской ассоциации психофармакологии. Дж. Психофармакол 28: 403–439. [PubMed] [Академия Google]
Bolea-Alamanac BM, Davies SJC, Christmas DM и др. (2011) Ципротерон для лечения агрессивности при деменции: клинический случай и систематический обзор. Дж. Психофармакол 77: 96–101. [PubMed] [Google Scholar]
Алгоритм BPSD Британской Колумбии (2014 г. ) Доступно по адресу: www.bcbpsd.ca (по состоянию на 18 июня 2017 г.).
) Доступно по адресу: www.bcbpsd.ca (по состоянию на 18 июня 2017 г.).
Бродати Х., Эймс Д., Сноудон Дж. и др. (2003) Рандомизированное плацебо-контролируемое исследование рисперидона для лечения агрессии, возбуждения и психоза при деменции. Джей Клин Психиатрия 64: 134–143. [PubMed] [Академия Google]
Carlyle W, Killick L, Ancill R. (1991) ЭСТ: Эффективное лечение кричащего слабоумного пациента. J Am Geriatr Soc 39: 637. [PubMed] [Google Scholar]
Cheung G, Stapelberg J. (2011) Кветиапин для лечения поведенческих и психологических симптомов деменции (ППСР): метаанализ рандомизированных плацебо-контролируемых исследований. N Z Med J 124: 39–50. [PubMed] [Google Scholar]
Chew ML, Mulsant BH, Pollock BG и др. (2008) Антихолинергическая активность 107 препаратов, обычно используемых пожилыми людьми. J Am Geriatr Soc 56: 1333–1341. [PubMed] [Академия Google]
Chibnall JT, Tait RC, Harman B и др. (2005) Влияние ацетаминофена на поведение, самочувствие и использование психотропных препаратов у обитателей домов престарелых с деменцией от умеренной до тяжелой степени. J Am Geriatr Soc
53: 1921–1929. [PubMed] [Google Scholar]
J Am Geriatr Soc
53: 1921–1929. [PubMed] [Google Scholar]
Coccaro EF, Kramer E, Zemishlany Z, et al. (1990) Фармакологическое лечение некогнитивных поведенческих нарушений у пожилых пациентов с деменцией. Эм Джей Психиатрия 147: 1640–1645. [PubMed] [Google Scholar]
Cooney C, Murphy S, Tessema H, et al. (2013)Использование низких доз габапентина при агрессивном поведении при сосудистой и смешанной сосудистой/альцгеймеровской деменции. J нейропсихиатрия Clin Neurosci 25: 120–125. [PubMed] [Академия Google]
Камминг Р.Г., Клайнберг Р.Дж. (1994) Частота и характеристики падений и риск переломов бедра. J Am Geriatr Soc 42: 774–778. [PubMed] [Google Scholar]
Камминг Р.Г., Le Couteur DG. (2003)Бензодиазепины и риск переломов бедра у пожилых людей: обзор доказательств. Препараты ЦНС 17: 825–837. [PubMed] [Google Scholar]
Каммингс Дж. Л., Мега М., Грей К. и др. (1994) Нейропсихиатрическая инвентаризация: комплексная оценка психопатологии при деменции. неврология
44: 2308–2314. [PubMed] [Академия Google]
неврология
44: 2308–2314. [PubMed] [Академия Google]
Davies SJC, Eayrs S, Pratt P, et al. (2004)Возможность лекарственного взаимодействия с участием цитохромов P450 2D6 и 3A4 в общих психиатрических отделениях для взрослых и функциональных психиатрических отделениях для пожилых людей. Бр Дж Клин Фармакол 57: 464–472. [Бесплатная статья PMC] [PubMed] [Google Scholar]
De Berardis D, Marini S, Serroni N, et al. (2015) Ориентация на норадренергическую систему при посттравматическом стрессовом расстройстве: систематический обзор и метаанализ испытаний празозина. Текущие цели по наркотикам 16: 1094–1106. [PubMed] [Академия Google]
Де Дейн П.П., Рабхеру К., Расмуссен А. и др. (1999) Рандомизированное исследование рисперидона, плацебо и галоперидола при поведенческих симптомах деменции. неврология 53: 946–955. [PubMed] [Google Scholar]
Durán JC, Greenspan A, Diago JI, et al. (2005) Оценка рисперидона при лечении поведенческих и психологических симптомов и нарушений сна, связанных с деменцией.
Ferri CP, Prince M, Brayne C, et al. (2005) Глобальная распространенность деменции: консенсусное исследование Delphi. Ланцет 366: 2112–2117. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фой А., О’Коннелл Д., Генри Д. и др. (1995)Применение бензодиазепинов как причина когнитивных нарушений у пожилых стационарных пациентов. J Gerontol A Biol Sci Med Sci 50: М99–М106. [PubMed] [Google Scholar]
Gaber S, Ronzoli S, Bruno A, et al. (2001) Сертралин в сравнении с малыми дозами галоперидола при лечении ажитированного поведения у пациентов с деменцией. Arch Gerontol Geriatr Suppl 7: 159–162. [PubMed] [Google Scholar]
Grant JE, Mohan SN. (2001) Лечение возбуждения и агрессии у четырех пациентов с деменцией с помощью ЭСТ. J ECT 17: 205–209. [PubMed] [Google Scholar]
Grossberg GT, Pejović V, Miller ML, et al. (2009)Мемантиновая терапия поведенческих симптомов у пациентов, проживающих по месту жительства, с болезнью Альцгеймера от умеренной до тяжелой. Дементное гериатрическое когнитивное расстройство
27: 164–172. [PubMed] [Google Scholar]
Дементное гериатрическое когнитивное расстройство
27: 164–172. [PubMed] [Google Scholar]
Холл К.А., Кекс Н.А., О’Коннор Д.В. (2005)Трансдермальные пластыри с эстрогеном при агрессивном поведении у пациентов мужского пола с деменцией: рандомизированное контролируемое исследование. Int Psychogeriatr 17: 165–178. [PubMed] [Академия Google]
Health Canada (2012) Celexa (циталопрам) — Связь с аномальными сердечными ритмами — Для медицинских работников. Доступно по адресу: http://www.healthycanadians.gc.ca/recall-alert-rappel-avis/hc-sc/2012/14672a-eng.php (по состоянию на 18 июня 2017 г.).
Министерство здравоохранения Канады (2015 г.) Рисперидон. Ограничение показаний к слабоумию. Доступно по адресу: http://healthycanadians.gc.ca/recall-alert-rappel-avis/hc-sc/2015/43797a-eng.php (по состоянию на 18 июня 2017 г.).
Health Quality Ontario (2016) Стандарты качества: поведенческие симптомы деменции Уход за пациентами в больницах и проживающими в домах длительного ухода. Доступно по адресу: http://www.hqontario.ca/portals/0/documents/evidence/quality-standards/qs-dementia-clinical-guide-1609.-en.pdf (по состоянию на 18 июня 2017 г.).
Доступно по адресу: http://www.hqontario.ca/portals/0/documents/evidence/quality-standards/qs-dementia-clinical-guide-1609.-en.pdf (по состоянию на 18 июня 2017 г.).
Herrmann N, Lanctôt KL. (2005) Вызывают ли атипичные нейролептики инсульт? Препараты ЦНС 19: 91–103. [PubMed] [Google Scholar]
Hogan DB, Bailey P, Black S, et al. (2008) Диагностика и лечение деменции: 4. Подход к лечению деменции легкой и средней степени тяжести. CMAJ 179: 787–793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Houlihan DJ, Mulsant BH, Sweet RA и др. (1994)Натуральное исследование тразодона при лечении поведенческих осложнений деменции. Am J Гериатр Психиатрия 2: 78–85. [PubMed] [Академия Google]
Ховард Р., Макшейн Р., Линдесей Дж. и др. (2012)Донепезил и мемантин при болезни Альцгеймера средней и тяжелой степени. N Engl J Med 366: 893–903. [PubMed] [Google Scholar]
Уэртас Д., Лопес-Ибор Алино Дж. Дж., Молина Дж. Д. и др. (2007) Антиагрессивный эффект ципротерона по сравнению с галоперидолом при болезни Альцгеймера: рандомизированное двойное слепое пилотное исследование. Джей Клин Психиатрия
68: 439–444. [PubMed] [Google Scholar]
Джей Клин Психиатрия
68: 439–444. [PubMed] [Google Scholar]
Husebo BS, Ballard C, Cohen-Mansfield J, et al. (2014) Реакция возбужденного поведения на обезболивание у людей с деменцией. Am J Гериатр Психиатрия 22: 708–717. [PubMed] [Академия Google]
Huybrechts KF, Rothman KJ, Silliman RA, et al. (2011) Риск смерти и госпитализации в связи с крупными медицинскими событиями после начала приема психотропных препаратов у пожилых людей, поступивших в дома престарелых. CMAJ 183: Е411–Е419. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Isserles M, Daskalakis ZJ, Kumar S, et al. (2017) Клиническая эффективность и переносимость электросудорожной терапии у пациентов с психоневрологическими симптомами деменции. Дж. Альцгеймерс Дис 57: 45–51. [PubMed] [Академия Google]
Катон В., Фон Корф М., Лин Э. и др. (1995) Совместное управление для достижения рекомендаций по лечению: влияние на депрессию в первичной медико-санитарной помощи. ДЖАМА 273: 1026–1031. [PubMed] [Google Scholar]
Kim Y, Wilkins KM, Tampi RR. (2008) Использование габапентина при лечении поведенческих и психологических симптомов деменции: обзор доказательств. Наркотики Старение
25: 187–196. [PubMed] [Google Scholar]
(2008) Использование габапентина при лечении поведенческих и психологических симптомов деменции: обзор доказательств. Наркотики Старение
25: 187–196. [PubMed] [Google Scholar]
Коновалов С., Мурали С., Тампи Р.Р. (2008) Противосудорожные препараты для лечения поведенческих и психологических симптомов деменции: обзор литературы. Int Psychogeriatr 20:293–308. [PubMed] [Google Scholar]
Kyomen HH, Satlin A, Hennen J, et al. (1999) Терапия эстрогенами и агрессивное поведение у пожилых пациентов с умеренной и тяжелой деменцией: результаты краткосрочного рандомизированного двойного слепого исследования. Am J Гериатр Психиатрия 7: 339–348. [PubMed] [Google Scholar]
Lewin J, Sumners D. (1992) Успешное лечение эпизодического нарушения контроля с помощью карбамазепина. Бр Дж Психиатрия 161: 261–262. [PubMed] [Google Scholar]
Lim HK, Pae CU, Lee C, et al. (2006) Лечение амисульпридом и рисперидоном поведенческих и психологических симптомов у пациентов с деменцией типа Альцгеймера: рандомизированное открытое проспективное исследование. нейропсихобиология
54: 247–251. [PubMed] [Академия Google]
нейропсихобиология
54: 247–251. [PubMed] [Академия Google]
Липероти Р., Ондер Г., Ланди Ф. и др. (2009) Смертность от всех причин, связанная с атипичными и обычными нейролептиками, среди обитателей домов престарелых с деменцией: ретроспективное когортное исследование. Джей Клин Психиатрия 70: 1340–1347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Lonergan E, Luxenberg J, Colford J. (2002) Галоперидол при возбуждении при деменции. Системная версия базы данных Cochrane 2: CD002852. [PubMed] [Google Scholar]
Лопес-Пуса С., Гарре-Олмо Дж., Вилалта-Франч Дж. и др. (2008) Тразодон при болезни Альцгеймера: последующее естественное исследование. Арх Геронтол Гериатр 47: 207–215. [PubMed] [Академия Google]
Lyketsos G, Lopez O, Jones B, et al. (2002) Распространенность психоневрологических симптомов при деменции и легких когнитивных нарушениях: результаты исследования сердечно-сосудистых заболеваний. ДЖАМА 288: 1475–1483. [PubMed] [Google Scholar]
Madhusoodanan S, Ting MB. (2014) Управление психозом у пациентов с болезнью Альцгеймера. Психиатрические времена. Доступно по адресу: http://www.psychiatrictimes.com/geriatric-psychiatry/managing-psychosis-patients-alzheimer-disease (по состоянию на 18 июня 2017 г.).
(2014) Управление психозом у пациентов с болезнью Альцгеймера. Психиатрические времена. Доступно по адресу: http://www.psychiatrictimes.com/geriatric-psychiatry/managing-psychosis-patients-alzheimer-disease (по состоянию на 18 июня 2017 г.).
Мартинон-Торрес Г., Фиораванти М., Гримли Эванс Дж. (2004) Тразодон для возбуждения при деменции. Системная версия базы данных Cochrane 3: CD004990. [PubMed] [Google Scholar]
Mauri M, Mancioli A, Rebecchi V, et al. (2006)Амисульприд в лечении поведенческих нарушений у пациентов с болезнью Альцгеймера средней и тяжелой степени. Акта Нейрол Сканд 114: 97–101. [PubMed] [Google Scholar]
Maust DT, Kim HM, Seyfried LS, et al. (2015) Нейролептики, другие психотропные средства и риск смерти у пациентов с деменцией: число, необходимое для причинения вреда. ДЖАМА Психиатрия 72: 438–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mintzer JE, Tune LE, Breder CD и др. (2007) Арипипразол для лечения психозов у стационарных пациентов с деменцией Альцгеймера: многоцентровая, рандомизированная, двойная слепая, плацебо-контролируемая оценка трех фиксированных доз. Am J Гериатр Психиатрия
15: 918–931. [PubMed] [Google Scholar]
Am J Гериатр Психиатрия
15: 918–931. [PubMed] [Google Scholar]
Mulsant BH, Alexopoulos GS, Reynolds CF, 3rd, et al.; Исследовательская группа PROSPECT (2001) Фармакологическое лечение депрессии у пожилых пациентов первичного звена: алгоритм PROSPECT. Int J Гериатр Психиатрия 16: 585–592. [PubMed] [Google Scholar]
Mulsant BH, Blumberger DM, Ismail Z, et al. (2014) Систематический подход к фармакотерапии гериатрической большой депрессии. Клин Гериатр Мед 30: 517–534. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mulsant BH, Gharabawi GM, Bossie CA, et al. (2004) Корреляты антихолинергической активности у пациентов с деменцией и психозом, получавших рисперидон или оланзапин. Джей Клин Психиатрия 65: 1708–1714. [PubMed] [Google Scholar]
Nutt DJ, Blier P. (2016) Номенклатура на основе нейробиологии (NbN) для журнала Psychopharmacology. Дж. Психофармакол 30: 413–415. [PubMed] [Академия Google]
Олин Дж.Т., Фокс Л.С., Павлучик С. и др. (2001) Пилотное рандомизированное исследование карбамазепина при поведенческих симптомах у резистентных к лечению амбулаторных пациентов с болезнью Альцгеймера. Am J Гериатр Психиатрия
9: 400–405. [PubMed] [Google Scholar]
Am J Гериатр Психиатрия
9: 400–405. [PubMed] [Google Scholar]
Oudman E. (2012) Является ли электросудорожная терапия (ЭСТ) эффективной и безопасной для лечения депрессии при деменции? Краткий обзор. J ECT 28: 34–38. [PubMed] [Google Scholar]
Peskind ER, Tsuang DW, Bonner LT, et al. (2005) Пропранолол для деструктивного поведения у обитателей домов престарелых с вероятной или возможной болезнью Альцгеймера: плацебо-контролируемое исследование. Ассоциированный синдром болезни Альцгеймера 19: 23–28. [PubMed] [Google Scholar]
Pollock BG, Mulsant BH, Rosen J, et al. (2002) Сравнение циталопрама, перфеназина и плацебо для экстренного лечения психозов и поведенческих нарушений у госпитализированных пациентов с деменцией. Эм Джей Психиатрия 159: 460–465. [PubMed] [Google Scholar]
Pollock BG, Mulsant BH, Rosen J, et al. (2007) Двойное слепое сравнение циталопрама и рисперидона для лечения поведенческих и психотических симптомов, связанных с деменцией. Am J Гериатр Психиатрия
15:942–952. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
Pollock BG, Mulsant BH, Sweet R и др. (1997)Открытое пилотное исследование циталопрама при поведенческих расстройствах при деменции. Am J Гериатр Психиатрия 5: 70–78. [PubMed] [Google Scholar]
Porsteinsson AP, Drye LT, Pollock BG и др.; Исследовательская группа CitAD (2014) Влияние циталопрама на возбуждение при болезни Альцгеймера: рандомизированное клиническое исследование CitAD. ДЖАМА 311: 682–691. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Prince M, Bryce R, Albanese E, et al. (2013) Глобальная распространенность деменции: систематический обзор и метаанализ. Демент Альцгеймера 9: 63–75. [PubMed] [Google Scholar]
Salzman C, Jeste D, Meyer R, et al. (2008) Пожилые пациенты с симптомами тяжелой ажитации и агрессии, связанными с деменцией: консенсусное заявление о вариантах лечения, методологии клинических испытаний и политике. Джей Клин Психиатрия 69: 889–898. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Schneider LS, Dagerman KS, Insel P. (2005) Риск смерти при лечении деменции атипичными нейролептиками: метаанализ рандомизированных плацебо-контролируемых исследований. ДЖАМА
294: 1934–1943. [PubMed] [Google Scholar]
(2005) Риск смерти при лечении деменции атипичными нейролептиками: метаанализ рандомизированных плацебо-контролируемых исследований. ДЖАМА
294: 1934–1943. [PubMed] [Google Scholar]
Schneider LS, Dagerman K, Insel PS. (2006)Эффективность и побочные эффекты атипичных нейролептиков при деменции: метаанализ рандомизированных плацебо-контролируемых исследований. Am J Гериатр Психиатрия 14: 191–210. [PubMed] [Google Scholar]
Seitz DP, Gill SS, Herrmann N, et al. (2013) Фармакологическое лечение нейропсихиатрических симптомов деменции при длительном уходе: систематический обзор. Int Psychogeriatr 25: 185–203. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Зейтц Д., Пурандаре Н., Конн Д. (2010)Распространенность психических расстройств среди пожилых людей в домах престарелых: систематический обзор. Int Psychogeriatr 22: 1025–1039. [PubMed] [Google Scholar]
Sinclair LI, Christmas DM, Hood SD, et al. (2009) Синдром нервозности/тревожности, вызванный антидепрессантами: систематический обзор. Бр Дж Психиатрия
194: 483–490. [PubMed] [Google Scholar]
Бр Дж Психиатрия
194: 483–490. [PubMed] [Google Scholar]
Sommer OH, Aga O, Cvancarova M, et al. (2009)Влияние окскарбазепина на лечение ажитации и агрессии при тяжелой деменции. Дементное гериатрическое когнитивное расстройство 27: 155–163. [PubMed] [Академия Google]
Steenen SA, van Wijk AJ, van der Heijden GJ, et al. (2016) Пропранолол для лечения тревожных расстройств: систематический обзор и метаанализ. Дж. Психофармакол 30: 128–139. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Street JS, Clark WS, Gannon KS, et al. (2000) Лечение оланзапином психотических и поведенческих симптомов у пациентов с болезнью Альцгеймера в учреждениях по уходу: двойное слепое рандомизированное плацебо-контролируемое исследование. Исследовательская группа HGEU. Arch Gen Психиатрия 57: 968–976. [PubMed] [Google Scholar]
Suh GH, Greenspan AJ, Choi SK. (2006) Сравнительная эффективность рисперидона и галоперидола в отношении поведенческих и психологических симптомов деменции. Int J Гериатр Психиатрия
21: 654–660. [PubMed] [Google Scholar]
Int J Гериатр Психиатрия
21: 654–660. [PubMed] [Google Scholar]
Tannenbaum C, Paquette A, Hilmer S, et al. (2012) Систематический обзор амнестических и неамнестических легких когнитивных нарушений, вызванных антихолинергическими, антигистаминными, ГАМКергическими и опиоидными препаратами. Наркотики Старение 29: 639–658. [PubMed] [Академия Google]
Trivedi MH, Rush AJ, Crismon ML, et al. (2004)Клинические результаты для пациентов с большим депрессивным расстройством в Техасском проекте алгоритма лечения. Arch Gen Психиатрия 61: 669–680. [PubMed] [Google Scholar]
Ujkaj M, Davidoff DA, Seiner SJ, et al. (2012)Безопасность и эффективность электросудорожной терапии для лечения возбуждения и агрессии у пациентов с деменцией. Am J Гериатр Психиатрия 20: 61–72. [PubMed] [Google Scholar]
van den Elsen GA, Ahmed AI, Verkes RJ, et al. (2015) Тетрагидроканнабинол при нейропсихиатрических симптомах при деменции: рандомизированное контролируемое исследование. неврология
84: 2338–2346. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Васудев А., Шариф С.З., Лю К. и др. (2015) Тенденции выдачи психотропных препаратов среди пожилых людей с деменцией, проживающих в учреждениях длительного ухода: 2004–2013 гг. Am J Гериатр Психиатрия 23: 1259–1269. [PubMed] [Google Scholar]
Verhey FR, Verkaaik M, Lousberg R; Оланзапин-галоперидол при лечении деменции Исследовательская группа (2006 г.) Оланзапин по сравнению с галоперидолом при лечении ажитации у пожилых пациентов с деменцией: результаты рандомизированного контролируемого двойного слепого исследования. Дементное гериатрическое когнитивное расстройство 21: 1–8. [PubMed] [Академия Google]
Ван Л.И., Шофер Дж.Б., Роде К. и др. (2009)Празосин для лечения поведенческих симптомов у пациентов с болезнью Альцгеймера с возбуждением и агрессией. Am J Гериатр Психиатрия 17: 744–751. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Weintraub D, Drye LT, Porsteinsson AP, et al. (2015)Время ответа на лечение циталопрамом возбуждения при болезни Альцгеймера.

 Примерами таких препаратов являются арипипразол (абилифай), галоперидол (галдол), оланзапин (зипрекса), кветиапин (сероквель), рисперидон (риспердал) и зипразидон (геодон). Эти препараты могут вызывать побочные эффекты, такие как сонливость, ригидность и необычные движения. Исследования связывают некоторые из них с более высоким риском смерти для людей с деменцией. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) поместило предупреждение в «черный ящик» для этих препаратов с описанием рисков. Спросите у врача, подходят ли они вашему близкому человеку.
Примерами таких препаратов являются арипипразол (абилифай), галоперидол (галдол), оланзапин (зипрекса), кветиапин (сероквель), рисперидон (риспердал) и зипразидон (геодон). Эти препараты могут вызывать побочные эффекты, такие как сонливость, ригидность и необычные движения. Исследования связывают некоторые из них с более высоким риском смерти для людей с деменцией. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) поместило предупреждение в «черный ящик» для этих препаратов с описанием рисков. Спросите у врача, подходят ли они вашему близкому человеку. (Парадоксально, но они также могут усугубить спутанность сознания и возбуждение.)
(Парадоксально, но они также могут усугубить спутанность сознания и возбуждение.)